Азетидиноновые соединения и медицинское применение указанных соединений
Номер патента: 21484
Опубликовано: 30.06.2015
Авторы: Чжан Юн, Чжао Сюйян, Бай Хуа, Сюй Сяоцзе, Лю Сяу, Ло Хайжун, Чжу Цюфен, Чжэн Сяохе, Гу Маоцзян, Чен Ин, Чжан Юнкай
Формула / Реферат
1. Соединение, представленное формулой I
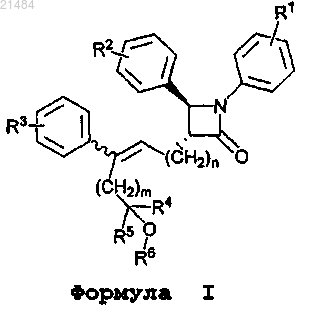
или его фармацевтически приемлемая соль, где
R1 означает 1-3 заместителя, независимо выбранных из группы, состоящей из галогена;
R2 означает 1-3 заместителя, независимо выбранных из группы, состоящей из гидроксила, C1-C6-алкокси, C6-C10-арилокси, (C6-C10-арил)метокси и -OCOR7;
R3 означает 1-3 заместителя, независимо выбранных из группы, состоящей из галогена;
R4 выбирают из группы, состоящей из водорода и C1-C6-алкила;
R5 выбирают из группы, состоящей из водорода и C1-C6-алкила;
R6 означает водород или -COR7;
R7 означает C1-C10-алкил, фенил или фенил, замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из галогена, C1-C6-алкила и C3-C6-циклоалкила;
m равно 0, 1, 2 или 3;
n равно 1, 2 или 3;
где углерод-углеродная двойная связь имеет Z-конфигурацию или Е-конфигурацию.
2. Соединение по п.1, где R1 означает 1-3 заместителя, независимо выбранных из группы, состоящей из фтора и хлора.
3. Соединение по п.2, где R1 означает 1-3 заместителя, представляющих собой фтор.
4. Соединение по любому из предшествующих пунктов, где R2 означает 1-3 заместителя, независимо выбранных из группы, состоящей из гидроксила, C1-C6-алкокси и -OCOR7, где R7 выбирают из группы, состоящей из C1-C10-алкила, фенила или фенила, замещенного по меньшей мере одним заместителем, выбранным из группы, состоящей из галогена, C1-C6-алкила и C3-C6-циклоалкила.
5. Соединение по любому из пп.1-3, где R2 означает 1-3 заместителя, независимо выбранных из группы, состоящей из гидроксила, метокси, фенилокси и -OCOR7.
6. Соединение по п.1, где R3 означает 1-3 заместителя, независимо выбранных из группы, состоящей из фтора и хлора.
7. Соединение по п.6, где R3 означает 1-3 заместителя, представляющих собой атом фтора.
8. Соединение по п.1, где R4 означает водород или метил.
9. Соединение по п.1, где R5 означает водород или метил.
10. Соединение по любому из предшествующих пунктов, где R6 означает водород.
11. Соединение по любому из пп.1-9, где R6 означает -COR7, где R7 означает C1-C10-алкил, фенил или фенил, замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из галогена, C1-C6-алкила и C3-C6-циклоалкила.
12. Соединение по любому из предшествующих пунктов, где R7 означает C1-C10-алкил.
13. Соединение по п.12, где R7 означает метил.
14. Соединение по любому из предшествующих пунктов, где m равно 0 или 1.
15. Соединение по любому из предшествующих пунктов, где n равно 1.
16. Соединение по п.1, выбранное из группы, состоящей из
(3R,4S)-1-(4-фторфенил)-3-[(Z)-3-(4-фторфенил)-4-гидроксибут-2-енил]-4-(4-гидроксифенил)азетидин-2-она (I-1 Z-конфигурации);
(3R,4S)-1-(4-фторфенил)-3-[(Е)-3-(4-фторфенил)-4-гидроксибут-2-енил]-4-(4-гидроксифенил)азетидин-2-она (I-1 Е-конфигурации);
(3R,4S)-1-(4-фторфенил)-3-[(Z)-3-(4-фторфенил)-4-гидроксибут-2-енил]-4-(4-метоксифенил)азетидин-2-она (I-2 Z-конфигурации);
(3R,4S)-1-(4-фторфенил)-3-[(Е)-3-(4-фторфенил)-4-гидроксибут-2-енил]-4-(4-метоксифенил)азетидин-2-она (I-2 Е-конфигурации);
(3R,4S)-1-(4-фторфенил)-3-[(Z)-3-(4-фторфенил)-4-гидроксибут-2-енил]-4-(4-феноксифенил)азетидин-2-она (I-3 Z-конфигурации);
(3R,4S)-1-(4-фторфенил)-3-[(Е)-3-(4-фторфенил)-4-гидроксибут-2-енил]-4-(4-феноксифенил)азетидин-2-она (I-3 Е-конфигурации);
(3R,4S)-4-(4-бензилоксифенил)-1-(4-фторфенил)-3-[(Z)-3-(4-фторфенил)-4-гидроксибут-2-енил]азетидин-2-она (I-4 Z-конфигурации);
(3R,4S)-4-(4-бензилоксифенил)-1-(4-фторфенил)-3-[(Е)-3-(4-фторфенил)-4-гидроксибут-2-енил]азетидин-2-она (I-4 Е-конфигурации);
(3R,4S)-4-(4-бензоилоксифенил)-1-(4-фторфенил)-3-[(Z)-3-(4-фторфенил)-4-гидроксибут-2-енил]азетидин-2-она (I-5 Z-конфигурации);
(3R,4S)-4-(4-ацетоксифенил)-1-(4-фторфенил)-3-[(Z)-3-(4-фторфенил)-4-гидроксибут-2-енил]азетидин-2-она (I-6 Z-конфигурации);
(3R,4S)-4-(4-бензоилоксифенил)-1-(4-фторфенил)-3-[(Z)-3-(4-фторфенил)-4-гидроксипент-2-енил]азетидин-2-она (I-7 Z-конфигурации);
(3R,4S)-1-(4-фторфенил)-3-[(Z)-3-(4-фторфенил)-4-гидроксипент-2-енил]-4-(4-гидроксифенил)азетидин-2-она (I-8 Z-конфигурации);
(3R,4S)-1-(4-фторфенил)-3-[(Е)-3-(4-фторфенил)-4-гидроксипент-2-енил]-4-(4-гидроксифенил)азетидин-2-она (I-8 Е-конфигурации);
(3R,4S)-4-(4-бензоилоксифенил)-1-(4-фторфенил)-3-[(Z)-3-(4-фторфенил)-4-гидрокси-4-метилпент-2-енил]азетидин-2-она (I-9 Z-конфигурации);
(3R,4S)-1-(4-фторфенил)-3-[(Z)-3-(4-фторфенил)-4-гидрокси-4-метилпент-2-енил]-4-(4-гидроксифенил)азетидин-2-она (I-10 Z-конфигурации);
(3R,4S)-3-[(Z)-4-ацетокси-3-(4-фторфенил)бут-2-енил]-4-(4-ацетоксифенил)-1-(4-фторфенил)азетидин-2-она (I-11 Z-конфигурации);
(3R,4S)-3-[(Z)-4-ацетокси-3-(4-фторфенил)бут-2-енил]-1-(4-фторфенил)-4-(4-гидроксифенил)азетидин-2-она (I-12 Z-конфигурации);
(3R,4S)-3-[(Z)-4-бензоилокси-3-(4-фторфенил)бут-2-енил]-1-(4-фторфенил)-4-(4-гидроксифенил)азетидин-2-она (I-13 Z-конфигурации);
(3R,4S)-3-[(Z)-4-(4-фторбензоилокси)-3-(4-фторфенил)бут-2-енил]-1-(4-фторфенил)-4-(4-гидроксифенил)азетидин-2-она (I-14 Z-конфигурации);
(3R,4S)-1-(4-фторфенил)-3-[(Z)-3-(4-фторфенил)-4-(4-метилбензоилокси)бут-2-енил]-4-(4-гидроксифенил)азетидин-2-она (I-15 Z-конфигурации);
(3R,4S)-3-[(Z)-4-ацетокси-3-(4-фторфенил)бут-2-енил]-4-(4-бензоилоксифенил)-1-(4-фторфенил)азетидин-2-она (I-16 Z-конфигурации);
(3R,4S)-3-[(Z)-4-ацетокси-3-(4-фторфенил)бут-2-енил]-1-(4-фторфенил)-4-(4-метоксифенил)азетидин-2-она (I-17 Z-конфигурации);
(3R,4S)-3-[(Е)-4-ацетокси-3-(4-фторфенил)бут-2-енил]-1-(4-фторфенил)-4-(4-метоксифенил)азетидин-2-она (I-17 Е-конфигурации).
17. Способ получения соединения, представленного формулой I, по п.1, включающий снятие защиты соединения, представленного формулой V, в щелочных условиях
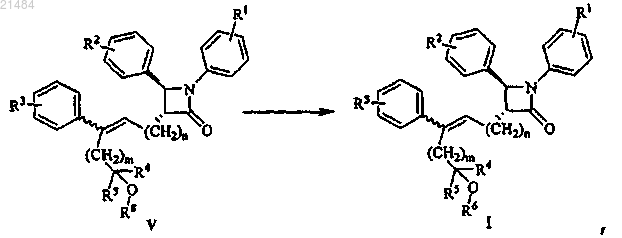
где R1, R2, R3, R4, R5, R6, m и n являются такими, как определено в п.1;
R8 означает гидроксилзащитную группу, такую как ацетил, трет-бутилдиметилсилил (TBDMS), триметилсилил (TMS), трет-бутилдифенилсилил (TBDPS) или т.п.
18. Фармацевтическая композиция для снижения уровней холестерина в плазме или для лечения или предотвращения атеросклероза, содержащая эффективное количество соединения, представленного формулой I, или его фармацевтически приемлемой соли по любому из пп.1-16.
19. Применение соединения по любому из пп.1-16 для получения лекарственного средства для снижения уровней холестерина в плазме или для лечения или предотвращения атеросклероза.
20. Способ получения соединения формулы V, как определено в п.17, включающий обработку соединения, представленного формулой IV, N,О-бис-(триметилсилил)ацетамидом и последующую циклизацию полученного силилированного продукта
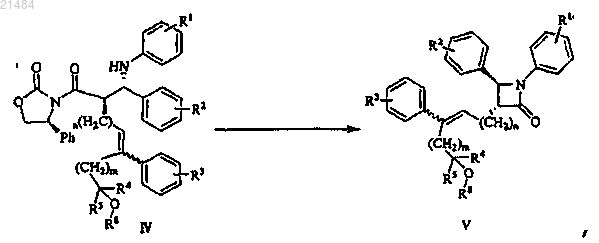
где R1, R2, R3, R4, R5, R8, m и n являются такими, как определено в п.17.
21. Соединение, представленное формулой V
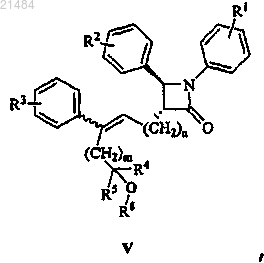
где R1, R2, R3, R4, R5, R8, m и n являются такими, как определено в п.20.
22. Соединение, представленное формулой IV
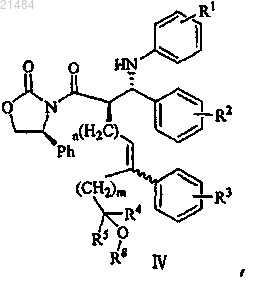
где R1, R2, R3, R4, R5, R8, m и n являются такими, как определено в п.20.
Текст
АЗЕТИДИНОНОВЫЕ СОЕДИНЕНИЯ И МЕДИЦИНСКОЕ ПРИМЕНЕНИЕ УКАЗАННЫХ СОЕДИНЕНИЙ Настоящим изобретением предложено получение азетидиноновых соединений и медицинское применение указанных соединений. Более конкретно, в описании предложены азетидиноновые соединения, представленные формулой I, где R1, R2, R3, R4, R5 и R6 определены в описании,и способы получения таких соединений. Соединения по настоящему изобретению могут снижать уровни общего холестерина (ТС) и холестерина липопротеинов низкой плотности(LDL-C) в плазме и могут быть использованы для лечения или профилактики атеросклероза,какергазии кровеносных сосудов, сердечной недостаточности, болезни коронарных артерий,ангиокардиопатии, инфаркта миокарда, стенокардии, гиперлипидемии, гиперхолестеринемии и подобного. Настоящим изобретением также предложен способ получения соединений формулы I и промежуточных соединений(71)(73) Заявитель и патентовладелец: ЧЖЭЦЗЯН ХИСУН ФАРМАСЬЮТИКАЛ КО., ЛТД. (CN) Область техники, к которой относится изобретение Настоящее изобретение относится к новым азетидиноновым соединениям, в качестве средства,снижающего сывороточный холестерин, и лечения заболеваний путем введения азетидиноновых соединений. Настоящее изобретение также относится к способам получения азетидиноновых соединений. Уровень техники изобретения Атеросклеротическое заболевание коронарных артерий является основной причиной смерти и заболеваемости, а также значительного расхода ресурсов здравоохранения в западном мире. Хорошо известно, что холестериновые эфиры являются основным фактором риска атеросклеротических поражений, а также основной формой откладывания холестерина в клетках стенок артерий. Регуляции гомеостаза холестерина в организмах людей и животных включают регуляции пищевого холестерина и регуляции биосинтеза холестерина, биосинтеза желчной кислоты и метаболизма липопротеина плазмы, содержащего холестерин. Холестерин пищевого и желчного происхождения поглощается из кишечника и поступает в кровоток в виде компонента хиломикронов. В другом аспекте холестерин биосинтезируется и метаболизируется печенью и, следовательно, является основным детерминантом уровней холестерина плазмы. Печень является участком синтеза и секреции липопротеина очень низкой плотности (VLDL), и затем VLDL метаболизирует до липопротеина низкой плотности (LDL) в кровотоке. LDL является основной формой холестерина с липопротеином в плазме, и повышение концентрацииLDL связано с возрастанием атеросклероза. Независимо от того, что именно подразумевается, если кишечная абсорбция холестерина снижается, меньше холестерина будет поставляться в печень, что приводит к снижению продуцирования печеночного липопротеина (VLDL), равно как к возрастанию печеночного клиренса холестерина плазмы. В настоящее время многочисленные клинические исследования наглядно продемонстрировали, что возрастание общего уровня сывороточного холестерина является одним из основных факторов риска заболевания коронарных артерий. Чем выше уровень общего сывороточного холестерина, тем выше риск и раньше наступает атеросклероз. При снижении общего сывороточного холестерина на 1% риск наступления заболевания коронарных артерий может быть снижен на 2%. Таким образом, ингибирование образования холестериновых эфиров и снижение сывороточного холестерина может подавлять развитие формирования атеросклеротических поражений, снижать аккумуляцию холестериновых эфиров в артериальных стенках и предотвращать кишечную абсорбцию пищевого холестерина. Даже при существующем широком диапазоне терапевтических средств, таких как статины, например симвастатин и флувастатин, вещество, связывающее желчные кислоты, фибраты, аналоги никотиновой кислоты, значительная часть гиперхолестеринемических пациентов не способна достичь заданных уровней холестерина, либо взаимодействия лекарственных средств между собой, либо ненадежность препарата делают невозможным длительное применение, необходимое для достижения заданных уровней. Поэтому все еще сохраняется потребность в разработке дополнительных средств, более эффективных и лучше переносимых. Были описаны соединения, обладающие такой ингибирующей активностью в отношении абсорбции холестерина, см., например, соединения, описанные в WO 93/02048, WO 94/17038, WO 95/08532, WO 95/26334, WO 95/35277, WO 96/16037, WO 96/19450, WO 97/16455, WO 02/50027, WO 02/50060, WO 02/50068, WO 02/50090, WO 02/66464, WO 04/000803, WO 04/000804, WO 04/000805, США 5756470,США 5767115 и США RE37721. Большей частью представлены азетидиноновые соединения для снижения холестерина и/или ингибирования формирования поражений стенок артерий у млекопитающих. Настоящее изобретение основано на приведенном выше открытии неожиданного ингибирования абсорбции холестерина производными 2-азетидинона. Согласно настоящему изобретению синтезированы и структурно модифицированы такие азетидиноновые соединения, чтобы найти азетидиноновые соединения с более эффективным ингибирующим эффектом в отношении холестерина. Соединения настоящего изобретения не описаны ни в одной из приведенных выше заявок. Настоящее изобретение дополнительно относится к применению азетидиноновых соединений настоящего изобретения для снижения уровней сывороточного холестерина. Краткое описание изобретения Одной из задач настоящего изобретения является разработка новых средств, снижающих сывороточный холестерин, т.е. азетидиноновых соединений или их фармацевтически приемлемых солей. Другой задачей настоящего изобретения является раскрытие способов получения указанных азетидиноновых соединений. Соединениями настоящего изобретения являются соединения, представленные формулой или их фармацевтически приемлемые соли, гдеR1 означает 1-3 заместителя, независимо выбранных из группы, состоящей из галогена;R2 означает 1-3 заместителя, независимо выбранных из группы, состоящей из гидроксила, C1-C6 алкокси, C6-C10-арилокси, (C6-C10-арил)метокси и -OCOR7;R3 означает 1-3 заместителя, независимо выбранных из группы, состоящей из галогена;R4 выбирают из группы, состоящей из водорода и C1-C6-алкила;R5 выбирают из группы, состоящей из водорода и C1-C6-алкила;R6 означает водород или -COR7;R7 означает C1-C10-алкил, фенил или фенил, замещенный по меньшей мере одним заместителем,выбранным из группы, состоящей из галогена, C1-C6-алкила и C3-C6-циклоалкила;n равно 1, 2 или 3; где углерод-углеродная двойная связь имеет Z-конфигурацию или Е-конфигурацию. В указанном выше варианте осуществления настоящего изобретения "галоген" включает фтор,хлор, бром и йод; "C1-C6-алкил" включает метил, этил, н-пропил, изопропил, н-бутил, изобутил, третбутил, н-пентил, изопентил, неопентил, н-гексил, изогексил, неогексил; "C3-C6-циклоалкил" включает циклопропил, циклобутил, циклопентил, циклогексил; "C1-C6-алкокси" включает метокси, этокси, нпропокси, изопропокси, н-бутокси, изобутокси, трет-бутокси, н-пентокси, изопентокси, неопентокси, нгексокси, изогексокси, неогексокси. Другой аспект настоящего изобретения относится к промежуточным соединениям для получения соединения формулы I соединению, представленному формулой V где R1, R2, R3, R4, R5, R8, m и n являются такими, как определено выше. Кроме того, в указанных выше промежуточных соединениях с углерод-углеродной двойной связью углерод-углеродная двойная связь имеет Z-конфигурацию или Е-конфигурацию. В еще одном аспекте настоящее изобретение относится к фармацевтической композиции, содержащей эффективное количество соединения, представленного формулой I, и его фармацевтически прием-2 021484 лемой соли. Фармацевтическая композиция настоящего изобретения дополнительно содержит фармацевтически приемлемые носители, совместимые с соединением формулы I. Соединение формулы I может быть введено в обычных дозированных формах, предпочтительно пероральных дозированных формах, таких как капсулы, таблетки, порошки, плоские капсулы, суспензии или растворы. Дозированная форма и фармацевтическая композиция могут быть получены с использованием традиционных фармацевтически приемлемых эксципиентов и добавок и применением традиционных технологий. Фармацевтически приемлемые эксципиенты и добавки включают нетоксичные совместимые наполнители, связующие вещества,дезинтегрирующие агенты, буферы, консерванты, антиоксиданты, лубриканты, корригенты, загустители,красители, эмульгаторы и т.п. В другом аспекте настоящее изобретение относится к применению соединения формулы I в получении лекарственного средства для снижения уровней сывороточного холестерина. Соединение настоящего изобретения может снижать уровни общего холестерина (ТС) и холестерина липопротеинов низкой плотности (LDL-C) в плазме и может быть использовано в качестве лекарственного средства для снижения холестерина в крови. Таким образом, соединение настоящего изобретения может быть использовано для лечения или профилактики атеросклероза, сосудистого нарушения,сердечной недостаточности, болезни коронарных артерий, сердечно-сосудистого заболевания, инфаркта миокарда, стенокардии и гиперлипидемии, гиперхолестеринемии и подобного. Как использовано в данном описании, ряд терминов определяется следующим образом."Алкил", когда используется в качестве заместителя или части заместителя, означает линейный или разветвленный алифатический углеводородный заместитель. Наиболее предпочтительным алкилом является C1-C6-алкил, если не указано иное. Примеры линейного или разветвленного C1-C6-алкила включают,но не в порядке ограничения, метил, этил, н-пропил, 2-пропил, н-бутил, изобутил, трет-бутил, гексил и т.п."Циклоалкил" означает насыщенное или частично насыщенное отдельное, конденсированное или спиро-углеродное кольцо. Предпочтительно циклоалкил представляет собой кольцо с 3-6 атомами углерода. Примеры включают, но не в порядке ограничения, циклопропил, циклобутил, циклопентил, циклогексил и т.п."Алкокси" означает заместитель (алкил-О-), в котором алкил соответствует указанному выше определению. Предпочтительно алкокси означает C1-C6-алкокси. Примеры включают, но не в порядке ограничения, метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, трет-бутокси и т.п. Термин "арил", когда используется отдельно или в комбинации, означает ароматическую углеродно-кольцевую систему с одним или двумя кольцами, в которой указанные кольца конденсационно связаны. Термин "арил" включает ароматические группы, такие как фенил, нафтил и тетрагидронафтил. Предпочтительным арилом является C6-C10-арил, более предпочтительным арилом является фенил. Настоящее изобретение включает соединение формулы I и его различные возможные изомеры, которые включают незеркальные изомеры, зеркальные изомеры и геометрические изомеры, такие как "Z-" или"Е-" конфигурационные изомеры. Кроме того, термин "фармацевтически приемлемая соль" означает соль соединения, обладающую исходной биологической активностью и пригодную для медицинского применения. Фармацевтически приемлемая соль соединения формулы I является солью, образованной со щелочным металлом. Щелочной металл, который может образовывать фармацевтически приемлемую соль с соединением формулы I,включает литий, натрий, калий, магний, кальций, алюминий, цинк и т.п. Соединение формулы I предпочтительно вводят перорально. Авторы обнаружили, что соединение настоящего изобретения может снижать уровни сывороточного холестерина. Получение азетидиноновых соединений. Другой аспект настоящего изобретения дополнительно относится к способу получения соединения формулы I, включающему снятие защиты соединения, представленного формулой V, в щелочных условиях:-3 021484 где R1, R2, R3, R4, R5, R6, m и n являются такими, как определено выше, R8 означает гидроксилзащитную группу, такую как ацетил, трет-бутилдиметилсилил (TBDMS), триметилсилил (TMS), третбутилдифенилсилил (TBDPS) или т.п.; когда R2 означает гидроксил, указанный заместитель является необязательно замещенным, и, после гидролиза соединения формулы V, удаление защитной группы наR2, альтернативно, при необходимости, гидроксил дополнительно преобразовывают в другой заместитель, указанный выше для R2. Соединение формулы V может быть получено следующим способом, включающим обработку соединения, представленного формулой IV, N,О-бис-(триметилсилил)ацетамидом и последующую циклизацию полученного силилированного продукта: где R1, R2, R3, R4, R5, R8, m и n являются такими, как определено выше. Соединение формулы IV, использованное выше, может быть получено следующим способом, по которому соединение, представленное формулой III, растворяют в подходящем безводном растворителе(таком как безводный метиленхлорид), затем конденсируют с имином, представленным формулой II, в условиях защиты в атмосфере сухого инертного газа (такого как азот), в присутствии кислоты Льюиса Соединение формулы III, использованное выше, может быть получено следующим способом, по которому в безводном инертном растворителе (таком как CH2Cl2 или ТГФ) кислота, представленная формулой L, и изобутилхлорформиат образуют смешанный ангидрид, и затем осуществляют конденсацию с (S)-4-фенил-2-оксазолидиноном в присутствии подходящего катализатора, такого как натрий-бис(триметилсилил)амид или 4-диметиламинопиридин (DMAP), предпочтительно натрий-бис(триметилсилил)амид, при температуре от -60 до -25 С: Соединение формулы L, использованное выше, может быть получено следующим способом, по которому соединение, представленное формулой K, гидролизуют в щелочных условиях и затем подкисляют, с получением соединения формулы L: где R9 означает метил или этил. Соединение формулы K, использованное выше, может быть получено следующим способом, по которому соединение, представленное формулой J, декарбоксилируют нагреванием, с получением соединения с одной сложноэфирной группой, т.е. соединения формулы K: Соединение формулы J, использованное выше, может быть получено следующим способом, по которому соединение, представленное формулой H, гидролизуют по одной сложноэфирной группе, регулируя подходящие реакционные условия, что дает соединение формулы J: Соединение формулы Н, использованное выше, может быть получено следующим способом, по которому соединение, представленное формулой G, подвергают взаимодействию с диэфиром малоновой кислоты, с получением сложнодиэфирного соединения формулы Н: где X означает галоген, т.е. фтор, хлор, бром или йод. Соединение формулы G, использованное выше, может быть получено следующим способом, по которому гидроксил соединения, представленного формулой F, галогенируют, обрабаткой галогенирующим агентом, что дает соединение формулы G: Соединение формулы F, использованное выше, может быть получено следующим способом, по которому сложноэфирную группу соединения, представленного формулой D, восстанавливают подходящим восстанавливающим агентом (таким как диизобутилалюмогидрид (DIBAH, с получением соединения формулы F: Соединение формулы D, использованное выше, может быть получено следующим способом, по которому соединение, представленное формулой С, подвергают реакции Виттига-Хорнера, с получением соединения формулы D, которое дополнительно разделяют, с получением Z-конфигурации и Еконфигурации: Соединение формулы С, использованное выше, может быть получено следующим способом, по которому в подходящем растворителе, гидроксил соединения, представленного формулой В, защищают в присутствии подходящих катализаторов (таких как 4-диметиламинопиридин (DMAP, с получением соединения формулы С: Соединение формулы В, использованное выше, может быть получено следующим способом, по которому сложноэфирную группу соединения, представленного формулой А, гидролизуют в щелочных условиях, с получением соответствующего спирта, т.е. соединения формулы В: Соединение формулы А, использованное выше, может быть получено следующим способом, по которому галогенид подвергают взаимодействию с ацетатом натрия, с получением соединения формулы А: Настоящее изобретение дополнительно иллюстрируется следующими примерами. Примеры охватывают получение конкретных соединений, представленных формулой I, и соответствующие данные по структурной идентификации. Следует отметить, что следующие примеры являются исключительно иллюстративными, и никоим образом не могут рассматриваться, как ограничивающие настоящее изобретение. В следующих примерах, если не указано иное, все температуры даны в градусах по Цельсию и; если не указано особо, все исходные вещества и реагенты являются коммерчески доступными. Коммерчески доступные исходные вещества и реагенты используют непосредственно, без дополнительной очистки,если не указано иное. Лабораторную стеклянную посуду сушат в сушильном шкафу и/или при нагревании. Реакции отслеживают на пластинах из кварцевого стекла-60 F254 (0,25 мм) (ТСХ), которые анализируют методом тонкослойной хроматографии и проявляют при соответствующем соотношении (V/V) растворителей. Окончание реакции определяют по исчезновению исходных вещества ТСХ. Спектр 1 Н-ЯМР снимают, используя прибор Bruker (400 МГц). Химический сдвиг приведен в м.д. Тетраметилсилан используют в качестве внутреннего стандарта (0,00 м.д.). 1 Н ЯМР представлен следующим образом: с = синглет, д = дублет, т = триплет, м = мультиплет, ушир. = уширенный, дд = двой-6 021484 ной дублет, дт = двойной триплет. Когда приводится константа связи, единицей является Гц. Масс-спектр определяют на приборе ЖХ/МС с ионизацией ESI или APCI. Температуры плавления были некорректированными. Следующие примеры являются только иллюстрирующими способ синтеза специфических соединений настоящего изобретения. Однако не существует ограничений для способа синтеза. Соединения, не перечисленные в данном описании выше, также могут быть получены путем аналогичного синтеза при выборе соответствующих исходных веществ и при необходимом регулировании ряда реакционных условий, которые могут быть общеизвестны в данной области. Синтез. Как для соединения формулы I, когда R1=R3 означает F, R2 означает ОН, R4=R5=R6 означает Н, R8 означает TBDMS, R9 означает Me, X означает Cl, m равно 0, n равно 1, соответствующее соединение может быть синтезировано с использованием способа, представленного следующей схемой синтеза. Соединение II-1 может быть синтезировано следующим способом: Подробное описание вариантов осуществления Пример 1. Получение [2-(4-фторфенил)-2-оксоэтил]ацетата (соединение А-1) В 3-литровую колбу добавляют 400 г (2,32 моль) 2-хлор-1-(4-фторфенил)этанона, 1 л N,Nдиметилформамида и 265 г (3,23 моль) безводного ацетата натрия. Смесь перемешивают и нагревают до 90 С, взаимодействие продолжается 10 ч. После завершения взаимодействия нагревание прекращают. Реакционный раствор охлаждают до комнатной температуры и экстрагируют этилацетатом (600 мл 6). Органические фазы объединяют, промывают трижды насыщенным раствором соли, сушат над безводным сульфатом натрия и концентрируют досуха. Остаток кристаллизуют из смешанного растворителя толуол/петролейный эфир и сушат с получением 357 г (1,82 моль) соединения А-1 с выходом 78,5%. 1 В 2-литровую колбу добавляют 321,3 г (1,64 моль) соединения А-1, 1 л метанола, 18 г (0,13 моль) карбоната калия. Смесь перемешивают при комнатной температуре, и взаимодействие продолжается 2 ч. Смесь экстрагируют 5 раз этилацетатом (800 мл 5). Органические фазы объединяют, сушат над безводным сульфатом натрия и концентрируют досуха, с получением 211,0 г (1,37 моль) соединения В-1 с выходом 83,5%. 1 В 5-литровую колбу добавляют 187,8 г (1,22 моль) соединения В-1, 1,2 л ацетонитрила, 1,8 л дихлорметана, 17,6 г (0,14 моль) 4-диметиламинопиридина (DMAP), 200 мл (1,44 моль) триэтиламина и 258,4 г (1,72 моль) трет-бутилдиметилсиланхлорида (TBDMSCl). Смесь перемешивают при комнатной температуре, и взаимодействие продолжается 10 ч. Затем 136 мл (1 моль/л) хлористо-водородной кислоты добавляют по каплям в реакционный раствор. После добавления реакционный раствор дополнительно перемешивают 20 мин и затем экстрагируют 3 раза дихлорметаном (400 мл 3). Органические фазы объединяют и промывают 5 раз насыщенным раствором соли, сушат над безводным сульфатом натрия и концентрируют досуха. Остаток очищают колоночной хроматографией (смесь петролейный эфир/дихлорметан=1,5/1), с получением 219,5 г (0,82 моль) соединения С-1 с выходом 67,2%. 1 В 5-литровую колбу добавляют 27,0 г (1,19 моль) триэтилфосфоноацетата и 1,3 л тетрагидрофурана. Смесь перемешивают и добавляют по каплям 0,82 л (2 моль/л) натрий-бис-(триметилсилил)амида приблизительно при -30 С. После добавления смесь нагревают до комнатной температуры, и взаимодействие продолжается 1 ч. Затем добавляют по каплям 192,1 г (0,72 моль) соединения С-1 (растворенного в 450 мл тетрагидрофурана) при температуре около -60 С. После добавления температуру поднимают до комнатной температуры, и взаимодействие продолжается 1 ч. Полученную смесь экстрагируют 3 раза этилацетатом (250 мл 3), сушат над безводным сульфатом натрия и концентрируют досуха. Продукт очищают колоночной хроматографией (петролейный эфир) с получением 125 г (0,37 моль, выход 51,4%) В 5-литровую колбу добавляют 120 г (0,36 моль) соединения D-1 (Z-конфигурации) и 1,0 л дихлорметана. Затем добавляют по каплям 0,8 л (1,125 моль/л) раствора диизобутилалюмогидрида (DIBAH) в нгексане, приблизительно при -60 С. Температуру поднимают до комнатной температуры, и взаимодействие продолжается 30 мин. К реакционному раствору добавляют 500 мл дихлорметана. Полученную смесь последовательно промывают насыщенным раствором хлорида аммония, затем насыщенным раствором соли 3 раза, сушат над безводным сульфатом натрия и концентрируют досуха, с получением 103,6 г (0,35 моль) соединения F-1 (Z-конфигурации) с выходом 97,2%. 1 Указанное соединение получают из этил-(Е)-4-трет-бутилдиметилсилилокси-3-(4-фторфенил)бут-2 еноата (соединение D-1, Е-конфигурации) способом, аналогично описанному в примере 5. 1 В 5-литровую колбу добавляют 100,6 г (0,34 моль) соединения F-1 (Z-конфигурацию), 1,6 л дихлорметана, 10,5 г (0,085 моль) 4-диметиламинопиридина и 182 мл диизопропилэтиламина. Смесь перемешивают в защитной атмосфере азота, добавляют по каплям 74,3 г (0,39 моль) 4 толуолсульфонилхлорида (TsCl) (растворенного в 800 мл дихлорметана), приблизительно при -20 С. Раствор нагревают до комнатной температуры, и взаимодействие продолжается 12 ч. Затем реакционный раствор подкисляют до рН 4 2 моль/л хлористо-водородной кислоты. Реакционный раствор перемешивают 30 мин, затем дают расслоиться. Водную фазу экстрагируют 2 раза дихлорметаном (100 мл 2). Полученные органические фазы объединяют, промывают 3 раза насыщенным раствором соли, сушат над безводным сульфатом натрия и концентрируют досуха, с получением 77,5 г (0,25 моль) соединения G-1 Указанное в заголовке соединение получают из (Е)-4-трет-бутилдиметилсилилокси-3-(4 фторфенил)бут-2-ен-1-ола (соединение F-1, Е-конфигурации) способом, аналогично описанному в примере 7. 1 В 3-литровую колбу добавляют 57,2 г (0,43 моль) диметилмалоната и 1 л N,N-диметилформамида. Смесь перемешивают в защитной атмосфере азота, добавляют 73,0 г (0,55 моль) карбоната цезия при комнатной температуре. После взаимодействия в течение 2 ч при комнатной температуре добавляют по каплям 75,5 г (0,24 моль) соединения G-1 (Z-конфигурации) (растворенного в 300 мл N,Nдиметилформамида). После взаимодействия в течение 1 ч к реакционному раствору добавляют 400 мл этилацетата и 100 мл воды. Раствору дают расслоиться. Водный слой экстрагируют 3 раза этилацетатом(100 мл 3). Органические фазы объединяют, промывают 3 раза насыщенным раствором соли, сушат над безводным сульфатом натрия и концентрируют досуха, с получением 96,5 г (0,235 моль) соединения Н-1 Указанное в заголовке соединение получают из трет-бутил[(Е)-4-хлор-2-(4-фторфенил)бут-2 енокси]диметилсилана (соединение G-1 Е-конфигурации) способом, аналогично описанному в примере 9. 1 В 2-литровую колбу добавляют 94,0 г (с содержанием 75%, 0,23 моль) соединения Н-1 (Zконфигурации) и 0,62 л этанола. Затем добавляют по каплям при комнатной температуре 85 мл 3 моль/л водного раствора гидроксида калия. После взаимодействия в течение 1 ч реакционный раствор подкисляют до рН 4 2 моль/л хлористо-водородной кислотой. Смесь перемешивают 30 мин и экстрагируют 3 раза этилацетатом (150 мл 3). Органические фазы объединяют, промывают 3 раза насыщенным раство- 10021484 ром соли, сушат над безводным сульфатом натрия и концентрируют досуха, с получением 76,1 г (0,19 моль) соединения J-1 (Z-конфигурации) с выходом 83,8%. 1 Указанное в заголовке соединение получают из диметил-2-[(Е)-4-трет-бутилдиметилсилилокси-3(4-фторфенил)бут-2-енил]пропандиоата (соединение Н-1, Е-конфигурации) способом, аналогично описанному в примере 11. 1 В 2-литровую колбу добавляют 73,66 г (0,186 моль) соединения J-1 (Z-конфигурации), 0,6 л толуола и 3,8 мл триэтиламина. Смесь нагревают до температуры кипения с обратным холодильником и взаимодействие осуществляют в течение 5 ч. Полученную смесь экстрагируют этилацетатом, промывают насыщенным раствором соли, сушат над безводным натрия сульфатом и концентрируют досуха, с получением 57,02 г (0,162 моль) соединения K-1 (Z-конфигурации) с выходом 87,1%. 1 Указанное в заголовке соединение получают из 6-трет-бутилдиметилсилилокси-5-(4-фторфенил)-2 метоксикарбонил-4(Е)-гексеновой кислоты (соединение J-1, Е-конфигурации) способом, аналогично описанному в примере 13. 1 В 1-литровую колбу добавляют 56,07 г (0,159 моль) соединение K-1 (Z-конфигурации) и 180 мл этанола. Затем добавляют по каплям при комнатной температуре 54,28 мл (3 моль/л) водного раствора гидроксида калия. После взаимодействия в течение 1 ч реакционный раствор подкисляют до рН 4 2 моль/л хлористо-водородной кислотой. Продолжают перемешивание раствора в течение 30 мин. Остаток экстрагируют 3 раза этилацетатом (60 мл 3). Органические фазы объединяют, промывают 3 раза насыщенным раствором соли, сушат над безводный сульфатом натрия и концентрируют досуха, с получением 39,88 г (0,118 моль) соединения L-1 (Z-конфигурации) с выходом 74,1%. 1 Указанное в заголовке соединение получают из метил-(Е)-6-трет-бутилдиметилсилилокси-5-(4 фторфенил)гекс-4-еноата (соединение К-1, Е-конфигурации) способом, аналогично описанному в примере 15. 1 Стадия 1. В 1-литровую колбу добавляют 39,21 г (0,116 моль) соединения L-1 (Z-конфигурации),300 мл тетрагидрофурана и 19,0 мл (0,14 моль) изобутилхлорформиата. Затем добавляют по каплям 19,3 мл (0,14 моль) триэтиламина при температуре около -60 С. После добавления смесь нагревают до комнатной температуры, и взаимодействие продолжается 30 мин. Остаток фильтруют с получением смешанного ангидрида в растворе тетрагидрофурана для дальнейшего использования. Стадия 2. В 3-литровую колбу добавляют 22,69 г (0,14 моль) (S)-4-фенил-2-оксазолидона и 0,6 л тетрагидрофурана. Затем добавляют по каплям 69,6 мл (2 моль/л) натрий-бис-(триметилсилил)амида примерно при -25 С. Взаимодействие продолжается 30 мин. Затем добавляют по каплям тетрагидрофурановый раствор смешанного ангидрида, полученный на стадии 1. После добавления смесь нагревают до комнатной температуры, и взаимодействие продолжается 1 ч. Остаток экстрагируют 3 раза этилацетатом(150 мл 3). Органические фазы объединяют, промывают 3 раза насыщенным раствором соли, сушат над безводным сульфатом натрия и концентрируют досуха, с получением 47,62 г (0,10 моль) соединения III-1 Указанное в заголовке соединение получают из (Е)-6-трет-бутилдиметилсилилокси-5-(4 фторфенил)гекс-4-еновой кислоты (соединение L-1, Е-конфигурации) способом, аналогично описанному(0,187 моль) карбоната калия. Затем медленно добавляют по каплям, при температуре около 0 С, 52,1 мл(0,449 моль) бензоилхлорида (BzCl). После добавления смесь нагревают до комнатной температуры и взаимодействие продолжается 2 ч. Остаток экстрагируют 3 раза этилацетатом (150 мл 3). Органические фазы объединяют, сушат над безводным сульфатом натрия и концентрируют досуха, с получением 76,08 г (0,336 моль) 4-бензоилоксибензальдегида. Затем 35,7 мл (0,37 моль) 4-фторанилина добавляют по каплям к раствору полученного 4-бензоилоксибензальдегида в 300 мл этилацетата. Взаимодействие продолжается 1 ч. Реакционную смесь фильтруют. Образовавшийся твердый продукт перекристаллизовывают из безводного этанола, с получением 60,3 г (0,189 моль) белого твердого вещества, а именно соединения В 1-литровую колбу добавляют 350 мл дихлорметана и 20 г порошка молекулярных сит в защитной атмосфере азота и затем добавляют 10,6 мл (95,7 ммоль) тетрахлорида титана и 9,6 мл (0,032 моль) тетраизопропилата титана при температуре около 0 С. После взаимодействия в течение 15 мин добавляют 47,62 г (98,6 ммоль) соединения III-1 (Z-конфигурации) (растворенного в 60 мл дихлорметана). После взаимодействия в течение 5 мин добавляют 37,8 мл (0,21 моль) диизопропилэтиламина (DIPEA) примерно при 0 С. После взаимодействия в течение 1 ч, реакционный раствор охлаждают примерно до -20 С,добавляют 34,97 г (98,6 ммоль) соединения II-1 (растворенного в 0,87 л дихлорметана). После взаимодействия в течение 4 ч добавляют по каплям 29 мл уксусной кислоты и 58 мл (2 моль/л) серной кислоты. Смесь перемешивают при комнатной температуре 30 мин и затем экстрагируют 3 раза дихлорметаном(120 мл 3). Органические фазы объединяют, сушат над безводным сульфатом натрия и концентрируют досуха. Остаток очищают колоночной хроматографией с получением 43,3 ммоль соединения IV-1 (Zконфигурации) с выходом 43,9%. 1 Указанное в заголовке соединение получают из (4S)-3-[(E)-6-трет-бутилдиметилсилилокси-5-(4 фторфенил)гекс-4-еноил]-4-фенилоксазолидин-2-она (соединение III-1, Е-конфигурации) способом, аналогично описанному в примере 20. 1 В 1-литровую колбу добавляют 42,5 ммоль соединения IV-1 (Z-конфигурации), 350 мл толуола и 22,93 г (112,7 ммоль) N,О-бис-(триметилсилил)ацетамида. Взаимодействие продолжается 1 ч примерно при 50 С. Затем добавляют 1,36 г (4,3 ммоль) тетрабутиламмонийфторида (TBAF). Взаимодействие продолжается 3 ч при той же температуре. После завершения взаимодействия нагревание прекращают. После охлаждения реакционной системы до комнатной температуры, рН доводят примерно до 7,0 2 моль/л хлористо-водородной кислотой. Полученную смесь экстрагируют 300 мл этилацетата, промывают 3 раза насыщенным раствором соли, сушат над безводным сульфатом натрия и концентрируют досуха. Остаток очищают колоночной хроматографией с получением 33,1 ммоль соединения V-1 (Z конфигурации) с выходом 77,9%. 1 Указанное в заголовке соединение получают из [4-[(Е,1S,2R)-6-трет-бутилдиметилсилилокси-1-(4 фторанилино)-5-(4-фторфенил)-2-[(4S)-2-оксо-4-фенилоксазолидин-3-карбонил]гекс-4 енил]фенил]бензоата (соединение IV-1, Е-конфигурации) способом, аналогично описанному в примере 22. 1 Стадия 1. В колбу на 500 мл добавляют 32,5 ммоль соединения V-1 (Z-конфигурации), 250 мл метанола и 4,89 г (35,8 ммоль) карбоната калия. Смесь перемешивают при комнатной температуре, и взаимодействие продолжается 30 мин. После завершения взаимодействия остаток экстрагируют 3 раза этилацетатом (300 мл 3). Органические фазы объединяют, промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и концентрируют досуха для дальнейшего использования. Стадия 2. Продукт стадии 1 растворяют в 200 мл тетрагидрофурана. рН доводят примерно до 1 6 моль/л хлористо-водородной кислотой. Смесь перемешивают при комнатной температуре, и взаимодействие продолжается 30 мин. Остаток экстрагируют 3 раза этилацетатом (250 мл 3). Органические фазы объединяют, промывают насыщенным раствором соли, сушат над безводным сульфатом натрия, концентрируют досуха и очищают колоночной хроматографией с получением 8,14 г (19,3 ммоль) соединения I1 (Z-конфигурации) с выходом 59,4%. Указанное в заголовке соединение получают из (3R,4S)-4-(4-бензоилоксифенил)-1-(4-фторфенил)-3[(Е)-3-(4-фторфенил)-4-трет-бутилдиметилсилилоксибут-2-енил]азетидин-2-она (соединение V-1, Еконфигурации) способом, аналогично описанному в примере 24. 1 В колбу на 250 мл добавляют 19,0 ммоль соединения I-1 (Z-конфигурации), 100 мл дихлорметана,4,72 г (20,9 ммоль) бензойного ангидрида и 3,3 мл триэтиламина. Смесь перемешивают при комнатной температуре, и взаимодействие продолжается 2 ч. После завершения взаимодействия остаток экстрагируют 3 раза этилацетатом (300 мл 3). Органические фазы объединяют, промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и концентрируют досуха. Остаток очищают колоночной хроматографией, с получением 8,04 г (15,3 ммоль) соединения 1-5 (Z конфигурации) с выходом 80,6%. 1 Соединение I-1 (Z-конфигурации) используют в качестве исходного вещества и соединение I-6 (Zконфигурации) получают согласно способу примера 32. 1 Стадия 1. В колбу на 100 мл добавляют 15.0 ммоль соединения I-5 (Z-конфигурации), 20 мл дихлорметана и 7,63 г (18,0 ммоль) периодинана Десс-Мартина. Смесь перемешивают при комнатной температуры, и взаимодействие продолжается 2 ч. После завершения взаимодействия полученную смесь промывают диэтиловым эфиром. Фильтрат концентрируют досуха и непосредственно используют на следующей стадии без дополнительной очистки. Стадия 2. В колбу на 100 мл добавляют 18,0 ммоль метилмагнийхлорида и 30 мл безводного тетрагидрофурана. Смесь охлаждают до -10 С, медленно по каплям добавляют тетрагидрофурановый раствор продукта стадии 1. После добавления смесь нагревают до 0 С, и взаимодействие продолжается 2 ч. После завершения взаимодействия остаток нейтрализуют насыщенным раствором NH4Cl и экстрагируют 3 раза дихлорметаном (80 мл 3). Органические фазы объединяют, промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и концентрируют досуха. Остаток очищают колоночной хроматографией, с получением 2,29 г (4,25 ммоль) соединения I-7 (Z-конфигурации) с выходом 52,6%. 1 Н ЯМР (400 МГц, CDCl3):1,26 (д, 3 Н, -СН 3), 2,80-2,98 (м, 2 Н, -СН 2-), 3,32-3,35 (м, 1 Н, -СН-), 4,80 Соединение I-7 (Z-конфигурации) используют в качестве исходного вещества, и, согласно стадии 1 примера 24 удаляют бензоильную защитную группу, с получением соединения I-8 (Z-конфигурации). 1 Н ЯМР (400 МГц, ДМСО-d6):1,11 (д, 3 Н, -СН 3), 2,76-2,83 (м, 2 Н, -СН 2-), 3,20-3,24 (м, 1 Н, -СН-),4,91-4,93 (м, 2 Н, 2-СН-), 4,93 (с, 1 Н, -ОН), 5,45 (т, 1 Н, J=7,2 Гц, -СН-), 6,74-6,78 (м, 2 Н, Cpr-Н), 7,07-7,19 Соединение I-1 (Е-конфигурации) используют в качестве исходного вещества и соединение I-8 (Еконфигурации) получают согласно способам примера 32, примера 34 и примера 35, последовательно. 1 Соединение I-7 (Z-конфигурации) используют в качестве исходного вещества и соединение I-9 (Zконфигурации) получают согласно способам стадии 1 и стадии 2 примера 34. 1 Соединение I-9 (Z-конфигурации) используют в качестве исходного вещества и согласно способу стадии 1 примера 24 удаляют бензоильную защитную группу с получением соединения I-10 (Zконфигурации). 1 В колбу на 250 мл добавляют 19,0 ммоль соединения I-1 (Z-конфигурации), 100 мл дихлорметана,4,84 г (47,5 ммоль) уксусного ангидрида и 7,5 мл триэтиламина. Смесь перемешивают при комнатной температуре, и взаимодействие продолжается 2 ч. После завершения взаимодействия остаток экстрагируют 3 раза этилацетатом (100 мл 3). Органические фазы объединяют, промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и концентрируют досуха. Остаток очищают колоночной хроматографией с получением 8,16 г (16,2 ммоль) соединения I-11 (Z-конфигурации) с выходом 85,0%. 1 Соединение I-11, (Z-конфигурации) используют в качестве исходного вещества и согласно способу стадии 1 примера 24 ацетильную защитную группу удаляют с фенольного гидроксила с получением соединения I-12 (Z-конфигурации). 1MC (m/z): 464 [М+Н]. Следующие соединения получают, используя соответствующие исходные вещества, согласно способам примера 39 и примера 40. В колбу на 250 мл добавляют 16,0 ммоль соединение I-5 (Z-конфигурации), 100 мл дихлорметана,1,96 г (19,2 ммоль) уксусного ангидрида и 2,8 мл триэтиламина. Смесь перемешивают при комнатной температуре и взаимодействие продолжается 2 ч. После завершения взаимодействия остаток экстрагируют 3 раза этилацетатом (100 мл 3). Органические фазы объединяют, промывают насыщенным раствором соли, сушат над безводным сульфатом натрия и концентрируют досуха. Остаток очищают колоночной хроматографией, с получением 7,94 г (14,0 ммоль) соединения I-16 (Z-конфигурации) с выходом 87,5%. 1 Н ЯМР (400 МГц, CDCl3):2,90-2,94 (м, 2 Н, -СН 2-), 3,27-3,31 (м, 1 Н, -CH-), 4,80 (д, 1 Н, J=2,3 Гц,-CH-), 5,06 (кв, 2 Н, -СН 2-), 5,97 (т, 1 Н, J=8,0 Гц, -СН-), 6,95-7,03 (м, 4 Н, Cpr-Н), 7,23-7,32 (м, 6 Н, Cpr-Н),7,38-7,40 (м, 2 Н, Cpr-Н), 7,50-7,54 (м, 2 Н, Cpr-Н), 7,63-7,67 (м, 1 Н, Cpr-Н), 8,18-8,20 (м, 2 Н, Cpr-H); Соединение I-17 (Z-конфигурации) получают согласно способу примера 44, используя соединение Соединение I-17 (Е-конфигурации) получают согласно способу примера 44, используя соединениеMC (m/z): 500 [M+Na]. Фармакодинамический скрининг in vivo. Фармакодинамический скрининг соединения настоящего изобретения in vivo выполняют следующим способом. 1. Создание модели гиперхолестеринемии у золотистых хомячков. Проводят акклиматизацию животных, обеспечивая кормление в течение 1 недели со свободным доступом к корму и воде, в условиях освещения 10 ч/14 ч. На 8 день животные получают корм с высоким содержанием жира (содержащий 0,5% холестерина, 20% пальмового масла, 79,5% основного корма) в течение 1 недели. Затем каждое животное анестезируют эфиром. После взвешивания отбирают 0,5 мл крови из глазничной вены, антикоагулируют гепарином и центрифугируют при 5000 об/мин в течение 10 мин. Собирают плазму и уровни ТС (общего холестерина) и LDL-C (холестерина липопротеинов низкой плотности) в плазме определяют с помощью автоматического биохимического анализатора. Животных с ТС плазмы 9-15 ммоль/л отбирают в качестве модельных животных (см. следующую ссылку на метод моделирования на животных: Burrier, R.E., Smith, A.A., Mcgregor, D.G., Hoos, L.M., Zilli, D.L., Davis, H.R.The effect of acyl CoA: cholesterol acyltransferase inhibition on the uptake, esterification and secretion of cholesterol by the hamster small intestine. J. Pharm. Exp. Ther., 1995, 272, 156-163). 2. Скрининг соединения. Животных группируют по ТС и LDL-C и взвешивают, по 6 животных на группу. Эзетимиб используют в качестве положительного контроля. Животным вводят внутрижелудочно объем 5 мл/кг в течение 1 недели. Каждое животное анестезируют эфиром. После взвешивания отбирают 0,5 мл крови из глазничной вены, антикоагулируют гепарином и центрифугируют при 5 000 об/мин в течение 10 мин. Собирают плазму и уровни ТС (общего холестерина) и LDL-C (холестерина липопротеинов низкой плотности) в плазме определяют с помощью автоматического биохимического анализатора для оценки эффективности данных соединений. 3. Результаты скрининга. Согласно фармакодинамическому скрининговому тесту, в котором в качестве положительного контроля используют эзетимиб, результаты показывают, что соединения I-1 (Z), I-2 (Z), I-3 (Z), I-4 (Z), I-5(Z), I-6 (Z), I-11 (Z), I-12 (Z), I-13 (Z), I-14 (Z), I-15 (Z), I-16 (Z) и I-17 (Z) обладают действием по снижению холестерина. В частность, эффективности соединений I-1 (Z), I-2 (Z), I-3 (Z), I-4 (Z), I-6 (Z), I-15 (Z) и I-17 (Z) более похожа на положительный контроль, и I-1 (Е) также обладает некоторым холестеринснижающим действием. Результаты скрининга приведены в табл. 1-12. Поскольку I-1 (Z) обладает значительной эффективностью, проводили дополнительные эксперименты по определению снижающего холестерин эффекта указанного соединения (см. табл. 13).(1) Влияние соединений на уровень липидов крови на модели гиперхолестеринемии у золотистых хомячков. Таблица 1 Влияние соединения I-1 на уровень липидов крови на модели гиперхолестеринемии у золотистых хомячков (xs) Примечание: сопоставление данных до введения с данными после введения, Р 0,05, Р 0,01,Р 0,001 (Р 0,05 указывает на наличие значимого статистического различия между обработанными группами и контрольной группой; Р 0,01, наличие высокозначимого статистического различия между обработанными группами и контрольной группой; Р 0,001 указывает на наличие в высшей степени значимого статистического различия между обработанными группами и контрольной группой. Те же смысловые значения используются и в дальнейшем). Таблица 2 Влияние соединения I-1 на снижение уровней ТС и LDL-C Таблица 3 Влияние соединения I-1 (Z) на уровень липидов крови на модели гиперхолестеринемии у золотистых хомячков (xs) Примечание: сопоставление данных до введения с данными после введения, Р 0,05,Р 0,01, Р 0,001. Таблица 4 Влияние соединения I-1 на снижение уровней ТС и LDL-C Таблица 5 Влияние соединения I на уровень липидов крови на модели гиперхолестеринемии у золотистых хомячков (xs) Примечание: сопоставление данных до введения с данными после введения,Р 0,001. Таблица 6 Влияние соединения I на снижение уровней ТС и LDL-C Таблица 7 Влияние соединения I на уровень липидов крови на модели гиперхолестеринемии у золотистых хомячков (xs) Примечание: сопоставление данных до введения с данными после введения, Р 0,05,Р 0,01, Р 0,001. Таблица 8 Влияние соединения I на снижение уровней ТС и LDL-C Таблица 9 Влияние соединения I на уровень липидов крови на модели гиперхолестеринемии у золотистых хомячков (xs) Примечание: сопоставление данных до введения с данными после введения,Р 0,01, Р 0,001. Таблица 10 Влияние соединения I на снижение уровней ТС и LDL-C Таблица 11 Влияние соединения I на уровень липидов крови на модели гиперхолестеринемии у золотистых хомячков (xs) Примечание: сопоставление данных до введения с данными после введения, Р 0,001. Таблица 12 Влияние соединения I на снижение уровней ТС и LDL-C(2) Влияние соединений на уровень липидов в крови у нормальных морских свинок. Таблица 13 Влияние соединения I-1(Z) на уровень липидов крови у нормальных морских свинок (xs) Примечание: сопоставление данных для рассматриваемых соединении с данными для модельной группы, Р 0,05.(Z), I-6 (Z), I-11 (Z), I-12 (Z), I-13 (Z), I-14 (Z), I-15 (Z), I-16 (Z) и I-17 (Z) могут значительно снижать уровни ТС и LDL-C плазмы в модели гиперхолестеринемии у золотистых хомячков, которые все имеют значимое статистическое различие. В частности, действия соединений I-2 (Z), I-3 (Z), I-4 (Z), I-6 (Z), I-15(Z), I-17 (Z) аналогичны действию положительного контроля, т.е. эзетимиба, при той же дозе, и действие соединения I-1 (Z) является таким же, как действие положительного контроля, при той же дозе. Соединение I-1 (Е) может также снижать уровни ТС и LDL-C плазмы животных, но указанное соединение снижает менее 50% от количества, снижаемого эзетимибом и соединением I-1 (Z). Кроме того, соединение I-1 (Z) может значительно снижать уровни ТС и LDL-C плазмы у нормальных морских свинок, и действие является таким же, как действие положительного контроля, т.е. эзетимиба, при той же дозе. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, представленное формулой I или его фармацевтически приемлемая соль, гдеR1 означает 1-3 заместителя, независимо выбранных из группы, состоящей из галогена;R2 означает 1-3 заместителя, независимо выбранных из группы, состоящей из гидроксила, C1-C6 алкокси, C6-C10-арилокси, (C6-C10-арил)метокси и -OCOR7;R3 означает 1-3 заместителя, независимо выбранных из группы, состоящей из галогена;R4 выбирают из группы, состоящей из водорода и C1-C6-алкила;R5 выбирают из группы, состоящей из водорода и C1-C6-алкила;R6 означает водород или -COR7;R7 означает C1-C10-алкил, фенил или фенил, замещенный по меньшей мере одним заместителем,выбранным из группы, состоящей из галогена, C1-C6-алкила и C3-C6-циклоалкила;n равно 1, 2 или 3; где углерод-углеродная двойная связь имеет Z-конфигурацию или Е-конфигурацию. 2. Соединение по п.1, где R1 означает 1-3 заместителя, независимо выбранных из группы, состоящей из фтора и хлора. 3. Соединение по п.2, где R1 означает 1-3 заместителя, представляющих собой фтор. 4. Соединение по любому из предшествующих пунктов, где R2 означает 1-3 заместителя, независимо выбранных из группы, состоящей из гидроксила, C1-C6-алкокси и -OCOR7, где R7 выбирают из группы, состоящей из C1-C10-алкила, фенила или фенила, замещенного по меньшей мере одним заместителем,выбранным из группы, состоящей из галогена, C1-C6-алкила и C3-C6-циклоалкила. 5. Соединение по любому из пп.1-3, где R2 означает 1-3 заместителя, независимо выбранных из группы, состоящей из гидроксила, метокси, фенилокси и -OCOR7. 6. Соединение по п.1, где R3 означает 1-3 заместителя, независимо выбранных из группы, состоящей из фтора и хлора. 7. Соединение по п.6, где R3 означает 1-3 заместителя, представляющих собой атом фтора. 8. Соединение по п.1, где R4 означает водород или метил. 9. Соединение по п.1, где R5 означает водород или метил. 10. Соединение по любому из предшествующих пунктов, где R6 означает водород. 11. Соединение по любому из пп.1-9, где R6 означает -COR7, где R7 означает C1-C10-алкил, фенил или фенил, замещенный по меньшей мере одним заместителем, выбранным из группы, состоящей из галогена, C1-C6-алкила и C3-C6-циклоалкила. 12. Соединение по любому из предшествующих пунктов, где R7 означает C1-C10-алкил. 13. Соединение по п.12, где R7 означает метил. 14. Соединение по любому из предшествующих пунктов, где m равно 0 или 1. 15. Соединение по любому из предшествующих пунктов, где n равно 1. 16. Соединение по п.1, выбранное из группы, состоящей из(3R,4S)-3-[(Е)-4-ацетокси-3-(4-фторфенил)бут-2-енил]-1-(4-фторфенил)-4-(4 метоксифенил)азетидин-2-она (I-17 Е-конфигурации). 17. Способ получения соединения, представленного формулой I, по п.1, включающий снятие защиты соединения, представленного формулой V, в щелочных условияхR8 означает гидроксилзащитную группу, такую как ацетил, трет-бутилдиметилсилил (TBDMS),триметилсилил (TMS), трет-бутилдифенилсилил (TBDPS) или т.п. 18. Фармацевтическая композиция для снижения уровней холестерина в плазме или для лечения или предотвращения атеросклероза, содержащая эффективное количество соединения, представленного формулой I, или его фармацевтически приемлемой соли по любому из пп.1-16. 19. Применение соединения по любому из пп.1-16 для получения лекарственного средства для снижения уровней холестерина в плазме или для лечения или предотвращения атеросклероза. 20. Способ получения соединения формулы V, как определено в п.17, включающий обработку соединения, представленного формулой IV, N,О-бис-(триметилсилил)ацетамидом и последующую циклизацию полученного силилированного продукта
МПК / Метки
МПК: A61K 31/397, A61P 9/00, C07D 263/26, C07D 205/08, A61P 9/04, A61P 3/06, A61P 9/10
Метки: применение, медицинское, соединений, соединения, азетидиноновые, указанных
Код ссылки
<a href="https://eas.patents.su/28-21484-azetidinonovye-soedineniya-i-medicinskoe-primenenie-ukazannyh-soedinenijj.html" rel="bookmark" title="База патентов Евразийского Союза">Азетидиноновые соединения и медицинское применение указанных соединений</a>
Предыдущий патент: Счетчик доз ингалятора отмеренных доз
Следующий патент: Фармацевтическая композиция для лечения связанных с мср-1 воспалительных заболеваний
Случайный патент: Производное триазола в качестве ингибитора hsp90












