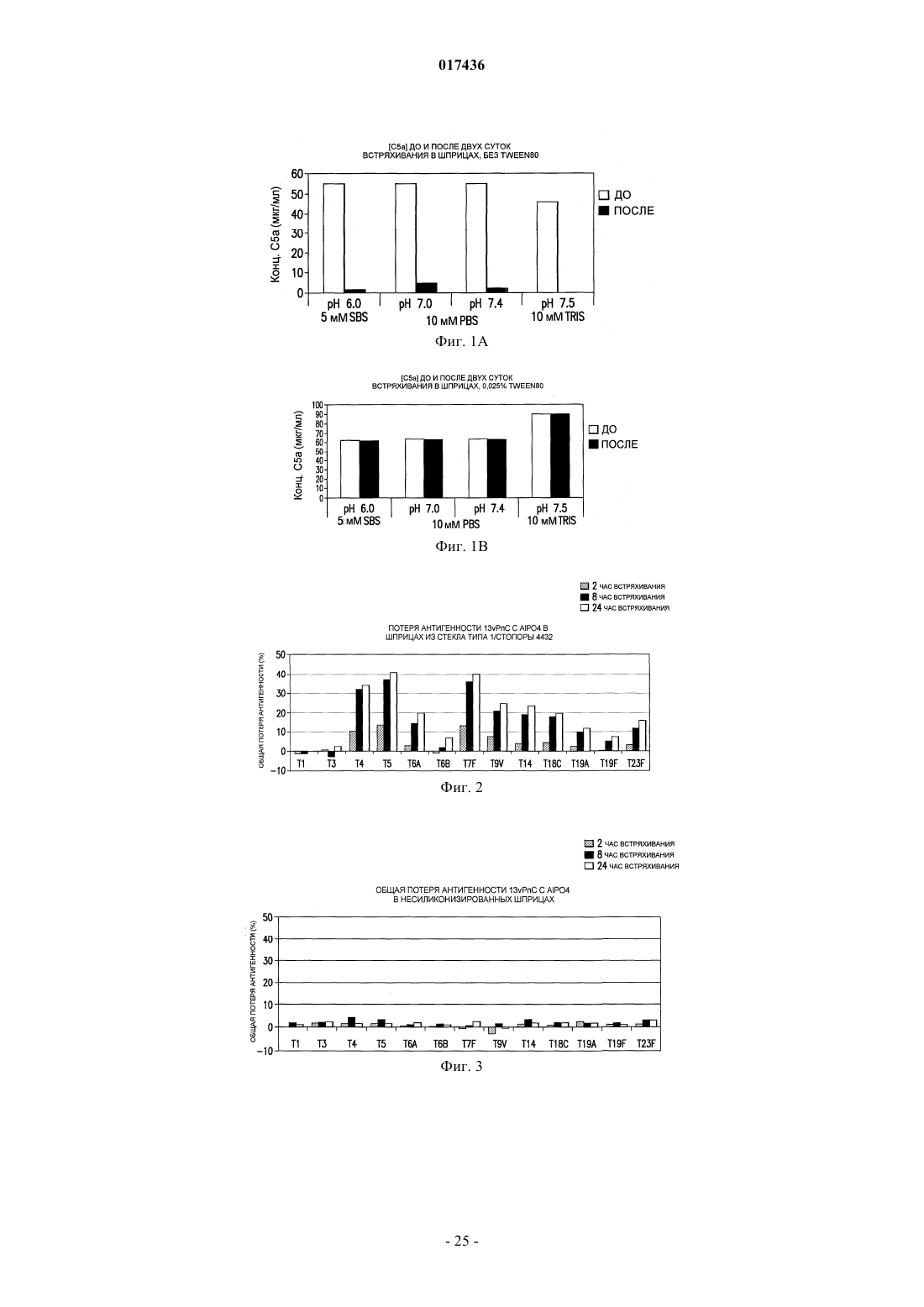
Новые составы, стабилизирующие иммуногенные композиции и ингибирующие их осаждение
Номер патента: 17436
Опубликовано: 28.12.2012
Авторы: Кхандке Лакшми, Сид Роберт Чэнси, Хан Ханиоунг, Лоок Дзее Лоон, Ян Сюйдун, Чен Ин, Мэлон Рональд, Цзинь Чжаовэй
Формула / Реферат
1. Состав, стабилизирующий конъюгат полисахарид-белок, содержащий (i) рН-забуференный солевой раствор, где буфер имеет значение pKa, равное приблизительно от 3,5 до приблизительно 7,5, (ii) полисорбат 80 в конечной концентрации от 0,001 до 0,05% вес./об. состава и (iii) один или несколько конъюгатов полисахарид-белок, содержащий один или несколько полисахаридов пневмококка.
2. Состав по п.1, где рН-забуференный солевой раствор содержит хлорид натрия.
3. Состав по любому из пп.1 или 2, где рН-забуференный солевой раствор имеет значение рН, равное 5,5-7,5.
4. Состав по любому из пп.1-3, где буфер является фосфатным, сукцинатным, гистидиновым или цитратным.
5. Состав по п.4, где буфером является сукцинатный буфер.
6. Состав по п.5, где сукцинатный буфер находится в конечной концентрации 1-10 мМ, а значение рН равно 5,8-6,0.
7. Состав по п.6, где сукцинатный буфер имеет конечную концентрацию, равную 5 мМ.
8. Состав по п.7, где буфер имеет значение рН, равное 5,8.
9. Состав по любому из пп.1-8, дополнительно содержащий один или несколько полисахаридов менингококка, один или несколько антигенных белков менингококка или их сочетание.
10. Состав по любому из пп.1-8, дополнительно содержащий один или несколько полисахаридов стрептококка, один или несколько антигенных белков стрептококка или их сочетание.
11. Состав по любому из пп.1-10, где состав конъюгата полисахарид-белок представляет собой состав 7-валентного конъюгата пневмококка (7vPnC), содержащий
полисахарид S.pneumoniae серотипа 4, конъюгированный с полипептидом CRM197,
полисахарид S.pneumoniae серотипа 6В, конъюгированный с полипептидом CRM197,
полисахарид S.pneumoniae серотипа 9V, конъюгированный с полипептидом CRM197,
полисахарид S.pneumoniae серотипа 14, конъюгированный с полипептидом CRM197,
полисахарид S.pneumoniae серотипа 18С, конъюгированный с полипептидом CRM197,
полисахарид S.pneumoniae серотипа 19F, конъюгированный с полипептидом CRM197, и
полисахарид S.pneumoniae серотипа 23F, конъюгированный с полипептидом CRM197.
12. Состав по любому из пп.1-10, где состав конъюгата полисахарид-белок представляет собой состав 13-валентного конъюгата пневмококка (13vPnC), содержащий
полисахарид S.pneumoniae серотипа 4, конъюгированный с полипептидом CRM197,
полисахарид S.pneumoniae серотипа 6В, конъюгированный с полипептидом CRM197,
полисахарид S.pneumoniae серотипа 9V, конъюгированный с полипептидом CRM197,
полисахарид S.pneumoniae серотипа 14, конъюгированный с полипептидом CRM197,
полисахарид S.pneumoniae серотипа 18С, конъюгированный с полипептидом CRM197,
полисахарид S.pneumoniae серотипа 19F, конъюгированный с полипептидом CRM197,
полисахарид S.pneumoniae серотипа 23F, конъюгированный с полипептидом CRM197,
полисахарид S.pneumoniae серотипа 1, конъюгированный с полипептидом CRM197,
полисахарид S.pneumoniae серотипа 3, конъюгированный с полипептидом CRM197,
полисахарид S.pneumoniae серотипа 5, конъюгированный с полипептидом CRM197,
полисахарид S.pneumoniae серотипа 6А, конъюгированный с полипептидом CRM197,
полисахарид S.pneumoniae серотипа 7F, конъюгированный с полипептидом CRM197, и
полисахарид S.pneumoniae серотипа 19А, конъюгированный с полипептидом CRM197.
13. Состав по любому из пп.1-12, дополнительно содержащий один или несколько адъювантов.
14. Состав по п.13, в котором адъювант представляет собой фосфат алюминия.
15. Состав по п.11, где состав дополнительно содержит один или несколько адъювантов.
16. Состав по п.15, где адъювантом является фосфат алюминия.
17. Состав по п.13, где фосфат алюминия присутствует в конечной концентрации, равной около 0,25 мг/мл.
18. Состав по п.1, который стабилизирует конъюгат полисахарид-белок, содержащий:
(i) рН-забуференный солевой раствор, где буфер является сукцинатным и имеет конечную концентрацию, равную около 1-10 мМ, и имеет значение рН, равное 5,8-6,0;
(ii) полисорбат 80 с конечной концентрацией от 0,01 до 0,05% полисорбата 80 по мас./об. состава;
(iii) состав 13-валентного конъюгата пневмококка (13vPnC), содержащий полисахарид S.pneumoniae серотипа 4, конъюгированный с полипептидом CRM197, полисахарид S.pneumoniae серотипа 6В, конъюгированный с полипептидом CRM197, полисахарид S.pneumoniae серотипа 9V, конъюгированный с полипептидом CRM197, полисахарид S.pneumoniae серотипа 14, конъюгированный с полипептидом CRM197, полисахарид S.pneumoniae серотипа 18С, конъюгированный с полипептидом CRM197, полисахарид S.pneumoniae серотипа 19F, конъюгированный с полипептидом CRM197, и полисахарид S.pneumoniae серотипа 23F, конъюгированный с полипептидом CRM197, полисахарид S.pneumoniae серотипа 1, конъюгированный с полипептидом CRM197, полисахарид S.pneumoniae серотипа 3, конъюгированный с полипептидом CRM197, полисахарид S.pneumoniae серотипа 5, конъюгированный с полипептидом CRM197, полисахарид S.pneumoniae серотипа 6А, конъюгированный с полипептидом CRM197, полисахарид S.pneumoniae серотипа 7F, конъюгированный с полипептидом CRM197, и полисахарид S.pneumoniae серотипа 19А, конъюгированный с полипептидом CRM197.
19. Состав по п.18, где конечная концентрация сукцинатного буфера равна 5 мМ.
20. Состав по п.18, где рН-забуференный солевой раствор содержит хлорид натрия.
21. Состав по п.20, где хлорид натрия присутствует в конечной концентрации 150 мМ.
22. Состав по любому из пп.18-21, где состав дополнительно содержит адъювант, и адъювантом является фосфат алюминия.
23. Состав п.1, который стабилизирует конъюгат полисахарид-белок, где состав содержит:
(i) рН-забуференный солевой раствор, содержащий хлорид натрия, где буфер является сукцинированным и имеет конечную концентрацию, равную около 5 мМ, и значение рН, равное 5,8;
(ii) полисорбат 80 с конечной концентрацией 0,01-0,05% полисорбата 80 по мас./об. состава;
(iii) состав 13-валентного конъюгата пневмококка (13vPnC), содержащий полисахарид S.pneumoniae серотипа 4, конъюгированный с полипептидом CRM197, полисахарид S.pneumoniae серотипа 6В, конъюгированный с полипептидом CRM197, полисахарид S.pneumoniae серотипа 9V, конъюгированный с полипептидом CRM197, полисахарид S.pneumoniae серотипа 14, конъюгированный с полипептидом CRM197, полисахарид S.pneumoniae серотипа 18С, конъюгированный с полипептидом CRM197, полисахарид S.pneumoniae серотипа 19F, конъюгированный с полипептидом CRM197, и полисахарид S.pneumoniae серотипа 23F, конъюгированный с полипептидом CRM197, полисахарид S.pneumoniae серотипа 1, конъюгированный с полипептидом CRM197, полисахарид S.pneumoniae серотипа 3, конъюгированный с полипептидом CRM197, полисахарид S.pneumoniae серотипа 5, конъюгированный с полипептидом CRM197, полисахарид S.pneumoniae серотипа 6А, конъюгированный с полипептидом CRM197, полисахарид S.pneumoniae серотипа 7F, конъюгированный с полипептидом CRM197, и полисахарид S.pneumoniae серотипа 19А, конъюгированный с полипептидом CRM197;
(iv) адъювант, содержащий фосфат алюминия в конечной концентрации около 0,25 мг/мл.
24. Контейнерное устройство, выбранное из группы, состоящей из флакона, шприца, бутылки, ферментера, биореактора, пробирки, трубки, пакета, банки, ампулы, картриджа и одноразовой ручки, наполненных составом по любому из пп.1-23.
25. Контейнерное устройство по п.24, которое дополнительно необязательно содержит одно или несколько из пробки, крышки, стеклянной крышки, резиновой крышки, пластиковой крышки, стопора шприца, поршня шприца, мензурки, мерного цилиндра.
26. Контейнерное устройство по любому из пп.24-25, где контейнерные устройства закрыты силиконом.
Текст
НОВЫЕ СОСТАВЫ, СТАБИЛИЗИРУЮЩИЕ ИММУНОГЕННЫЕ КОМПОЗИЦИИ И ИНГИБИРУЮЩИЕ ИХ ОСАЖДЕНИЕ Настоящее изобретение направлено на постоянную необходимость в данной области в составах,улучшающих стабильность иммуногенных композиций, таких как конъюгаты полисахаридбелок и белковые иммуногены. Изобретение в широком смысле относится к новым составам,стабилизирующим иммуногенные композиции и ингибирующим их осаждение. Более конкретно,изобретение, описанное в настоящем описании, направлено на необходимость в данной области в составах, стабилизирующих иммуногенные композиции и ингибирующих формирование твердых частиц (например, агрегацию, осаждение) в иммуногенных композициях, перерабатываемых,разрабатываемых, составленных, изготовленных и/или сохраняемых в контейнерных устройствах,таких как ферментеры, биореакторы, флаконы, бутылки, пакеты, шприцы, резиновые пробки,пробирки и т.п. 017436 Область изобретения Настоящее изобретение в целом относится к области иммунологии, бактериологии, составам вакцин, стабильности белка и усовершенствования процесса. Более конкретно, изобретение относится к новым составам, ингибирующим осаждение иммуногенных композиций. Предпосылки изобретения В биофармацевтической области общепризнанным является тот факт, что улучшение стабильности иммуногенной композиции (например, белкового иммуногена, конъюгата полисахарид-белок) является необходимой и очень желательной целью. Например, иммуногенная композиция при введении пациенту должна оставаться свежей, ясной и соответствующей профессиональным требованиям. Любые изменения стабильности и/или физических свойств иммуногенной композиции, такие как изменение цвета, образование осадка или помутнение, может вызывать у пациента или потребителя потерю доверия к продукту. Более того, поскольку многие иммуногенные составы отпускают в контейнерах для множественной дозировки, необходимо обеспечить однородность содержания дозы активного ингредиента (например, конъюгата полисахарид-белок) в течение времени (например, замутненный раствор может приводить к неравномерному характеру дозирования). Кроме того, иммуногенная композиция должна быть активной в течение ее ожидаемого срока хранения, когда любой распад иммуногенной композиции до неактивной или иным образом нежелательной формы (например, агрегата) снижает общую концентрацию продукта. В нескольких публикациях в литературе было сделано предположение, что стабильность конкретной иммуногенной композиции (например, белкового иммуногена, конъюгата полисахарид-белок), по меньшей мере, частично зависит от конкретного белка или белка-носителя (Но et al., 2001; Но et al., 2002;Bolgiano et al., 2001). Например, анализ стабильности полисахаридов менингококка С (MenC) и полисахаридов Haemophilus influenzae типа b (Hib), конъюгированных либо с токсоидом столбняка (ТТ), либо с белком-носителем CRM197, выявил различные профили стабильности в зависимости от белка-носителя(Но et al., 2002). В другом исследовании (Но et al., 2001) анализировали конъюгаты МепС-CRM197 от двух различных производителей (Но et al., 2001), в которых конъюгаты MenC-CRM197 отличаются по химии их конъюгации и длине конъюгированного полисахарида (оба обладают одним и тем же белкомносителем, CRM197). Кроме того, данные этого исследования показывают, что такие факторы, как химия конъюгации (например, восстановительное аминирование либо напрямую, либо через химическую спейсерную группу), число участков конъюгации, длина полисахаридной цепи, рН, буфер для хранения, температура(ы) хранения и циклы замораживания/оттаивания также влияют на стабильность иммуногенной композиции. Таким образом, при разработке состава для иммуногенной композиции необходимо учитывать множество факторов для обеспечения получения безопасного, стабильного, активного и экономически эффективного продукта. Такие факторы включают в качестве неограничивающих примеров химическую стабильность иммуногенной композиции (например, гидролиз сахаридов, деполимеризацию полисахаридов, протеолиз или фрагментацию белков), физическую/термическую стабильность иммуногенной композиции (например, агрегацию, осаждение, адсорбцию), совместимость иммуногенной композиции с системой контейнера/крышки, взаимодействия между иммуногенной композицией и неактивными ингредиентами (например, буферами, солями, наполнителями, криопротекторами), способ получения, лекарственную форму (например, лиофилизированную, жидкую), условия внешней среды, встречающиеся во время перевозки, хранения и манипуляций (например, температура, влажность, усилия сдвига), и промежуток времени между изготовлением и использованием. В данной области было сделано предположение, что силиконовое масло, которое индуцирует вторичные и третичные конформационные изменения белка, может быть ответственным за агрегацию/осаждение, наблюдаемые в конкретных белковых фармацевтических препаратах (Jones et al., 2005). Например, в нескольких публикациях в 1980 гг. было показано высвобождение силиконового масла из одноразовых пластиковых шприцев в качестве причинного фактора агрегации инсулина человекаDawson, 1985). Chantelau et al. (1986) наблюдали, что после трех или более отборов из десятидозового препарата инсулина (с использованием силиконизированного одноразового шприца), во флаконе начинается помутнение из-за загрязнения силиконовым маслом, таким образом, приводя в результате к агрегации и дезактивации инсулина (Chantelau et al., 1986). Парадоксально, но силиконовое масло является необходимым компонентом пластиковых шприцев, так как оно служит для смазки резинового поршня и облегчения движения поршня вниз цилиндра шприца (т.е., силиконовое масло улучшает проходимость состава через шприц). Более того, использование силиконового масла не ограничено шприцами, так как его используют для покрытия стеклянных флаконов, чтобы минимизировать адсорбцию белка, в качестве смазывающего вещества для предупреждения прилипания резиновых пробок во время процедур наполнения, в качестве смазывающего вещества, критического для технологичности/механической обрабатываемости стеклянных и эластомерных крышек, и в качестве смазывающего вещества для облегчения протыкания иглой резиновых пробок флаконов. Кроме того, силиконизация шприцев, стеклянных флаконов, резиновых-1 017436 пробок и т.п. не является ни хорошо контролируемым, ни стандартизованным процессом, и по этой причине существует высокая вариабельность содержания силиконового масла от одной партии к другой. Таким образом, в данной области существует постоянная необходимость в составах, которые увеличивают стабильность и ингибируют осаждение иммуногенных композиций. Сущность изобретения Настоящее изобретение в широком смысле относится к новым составам, стабилизирующим иммуногенные композиции и ингибирующим их осаждение. Более конкретно, в конкретных вариантах осуществления настоящее изобретение относится к новым составам, ингибирующим осаждение иммуногенных композиций, содержащихся в контейнерных устройствах. В одном из конкретных вариантов осуществления изобретение относится к новым составам, стабилизирующим иммуногенные композиции против взаимодействий с силиконовым маслом, усилий сдвига, встряхивания при перевозке и т.п. Таким образом, в конкретных вариантах осуществления изобретение относится к составам, стабилизирующим конъюгат полисахарид-белок, содержащим (i) рН-забуференный солевой раствор, где буфер обладает рКа приблизительно от 3,5 приблизительно до 7,5, (ii) поверхностно-активное вещество и(iii) один или несколько конъюгатов полисахарид-белок. В одном из конкретных вариантов осуществления состава конъюгата полисахарид-белок содержится в контейнерных устройствах. В конкретных вариантах осуществления контейнерные устройства выбраны из одного или нескольких из группы, состоящей из флакона, пробки флакона, крышки флакона, стеклянной крышки, резиновой крышки, пластиковой крышки, шприца, стопора шприца, поршня шприца, бутылки, мензурки, мерного цилиндра, ферментера, биореактора, пробирки, трубки, пакета, банки, ампулы, картриджа и одноразовой ручки. В конкретных вариантах осуществления контейнерные устройства закрывают силиконом. В конкретных вариантах осуществления рН-забуференный солевой раствор составов обладает рН 5,5-7,5. В других вариантах осуществления буфер представляет собой фосфат, сукцинат, гистидин или цитрат. В конкретных вариантах осуществления буфер представляет собой сукцинат с конечной концентрацией 1-10 мМ и рН 5,8-6,0. В одном конкретном варианте осуществления конечная концентрация сукцинатного буфера составляет 5 мМ. В других вариантах осуществления соль в рН-забуференном солевом растворе содержит хлорид магния, хлорид калия, хлорид натрия или их сочетание. В одном из конкретных вариантов осуществления соль в рН-забуференном солевом растворе представляет собой хлорид натрия. В другом варианте осуществления поверхностно-активное вещество из составов выбрано из группы, состоящей из полисорбата 20 (Tween20), полисорбата 40 (Tween40), полисорбата 60 (Tween60),полисорбата 65 (Tween65), полисорбата 80 (Tween80), полисорбата 85 (Tween85), Triton N-101,Triton X-100, октоксинола 40, ноноксинола-9, триэтаноламина, олеата триэтаноламина полипептида,гидроксистеарата полиоксиэтилена-660 (PEG-15, Solutol H15), рицинолеата полиоксиэтилена-35 (Cremophor EL), соевого лецитина и полоксамера. В одном конкретном варианте осуществления поверхностно-активное вещество представляет собой полисорбат 80. В другом варианте осуществления конечная концентрация полисорбата 80 в составе составляет по меньшей мере 0,01-10% полисорбата 80 по мас./об. состава. В других вариантах осуществления конечная концентрация полисорбата 80 в составе составляет 0,01% полисорбата 80 по мас./об. состава. В других вариантах осуществления конечная концентрация полисорбата 80 в составе составляет 0,05% полисорбата 80 по мас./об. состава. В другом варианте осуществления конечная концентрация полисорбата 80 в составе составляет 0,1% полисорбата 80 по мас./об. состава. В других конкретных вариантах осуществления конечная концентрация полисорбата 80 в составе составляет 1,0% полисорбата 80 по мас./об. состава. В других вариантах осуществления конечная концентрация полисорбата 80 в составе составляет 10,0% полисорбата 80 по мас./об. состава. В другом варианте осуществления конъюгат полисахарид-белок содержит один или несколько полисахаридов пневмококка. В конкретных вариантах осуществления один или несколько полисахаридов пневмококка представляют собой полисахарид S. pneumoniae серотипа 4, полисахарид 5. pneumoniae серотипа 6 В, полисахарид S. pneumoniae серотипа 9V, полисахарид S. pneumoniae серотипа 14, полисахарид S. pneumoniae серотипа 18 С, полисахарид S. pneumoniae серотипа 19F, полисахарид S. pneumoniae серотипа 23F, полисахарид S. pneumoniae серотипа 1, полисахарид S. pneumoniae серотипа 3, полисахарид S. pneumoniae серотипа 5, полисахарид S. pneumoniae серотипа 6A, полисахарид S. pneumoniae серотипа 7F и полисахарид S. pneumoniae серотипа 19 А. В конкретных вариантах осуществления белок из состава конъюгата полисахарид-белок выбран из группы, состоящей из CRM197, токсоида столбняка, токсоида холеры, токсоида коклюша, термолабильного токсоида Е. coli (LT), токсоида пневмолизина, поверхностного белка А пневмококка (PspA), белка адгезина А пневмококка (PsaA), пептидазы С 5 а изStreptococcus, белка D Haemophilus influenzae, овальбумина, гемоцианина морского блюдечка (KLH),бычьего сывороточного альбумина (BSA) и очищенного белкового производного туберкулина (PPD). В одном конкретном варианте осуществления состав конъюгата полисахарид-белок представляет собой состав 7-валентного конъюгата пневмококка (7vPnC), содержащий полисахарид S. pneumoniae серотипа 4, конъюгированный с полипептидом CRM197, полисахарид S. pneumoniae серотипа 6 В, конъюгированный с полипептидом CRM197, полисахарид S. pneumoniae серотипа 9V, конъюгированный с поли-2 017436 пептидом CRM197, полисахарид S. pneumoniae серотипа 14, конъюгированный с полипептидом CRM197,полисахарид S. pneumoniae серотипа 18 С, конъюгированный с полипептидом CRM197, полисахарид S.pneumoniae серотипа 19F, конъюгированный с полипептидом CRM197, и полисахарид S. pneumoniae серотипа 23F, конъюгированный с полипептидом CRM197. В другом конкретном варианте осуществления состав конъюгата полисахарид-белок представляет собой состав 13-валентного конъюгата пневмококка (13vPnC), содержащий полисахарид S. pneumoniae серотипа 4, конъюгированный с полипептидом CRM197, полисахарид S. pneumoniae серотипа 6 В, конъюгированный с полипептидом CRM197, полисахарид S. pneumoniae серотипа 9V, конъюгированный с полипептидом CRM197, полисахарид S. pneumoniae серотипа 14, конъюгированный с полипептидомpneumoniae серотипа 7F, конъюгированный с полипептидом CRM197, и полисахарид S. pneumoniae серотипа 19 А, конъюгированный с полипептидом CRM197. В других вариантах осуществления состав дополнительно содержит один или несколько полисахаридов менингококка, один или несколько антигенных белков менингококка, или их сочетание. В других вариантах осуществления состав дополнительно содержит один или несколько полисахаридов стрептококка, один или несколько антигенных белков стрептококка, или их сочетание. В других конкретных вариантах осуществления состав дополнительно содержит один или несколько адъювантов. Примеры подходящих адъювантов описаны далее. В других вариантах осуществления изобретение относится к составам, стабилизирующим композицию пептидазы С 5 а стрептококка (SCP), содержащим (i) рН-забуференный солевой раствор, где буфер обладает рКа приблизительно от 3,5 до приблизительно 6,5, (ii) поверхностно-активное вещество и (iii) пептидазу С 5 а стрептококка. В одном конкретном варианте осуществления состав SCP содержится в контейнерных устройствах. В конкретных вариантах осуществления контейнерные устройства выбраны из одного или нескольких из группы, состоящей из флакона, пробки флакона, крышки флакона, стеклянной крышки, резиновой крышки, пластиковой крышки, шприца, стопора шприца, поршня шприца, бутылки, мензурки, мерного цилиндра, ферментера, биореактора, пробирки, трубки, пакета, банки, ампулы,картриджа и одноразовой ручки. В других вариантах осуществления рН-забуференный солевой раствор состава обладает рН 5,5-7,5. В других вариантах осуществления буфер представляет собой сукцинат, гистидин, фосфат или цитрат. В одном конкретном варианте осуществления буфер представляет собой сукцинат при конечной концентрации 1-10 мМ и рН 5,8-6,0. В другом конкретном варианте осуществления конечная концентрация сукцинатного буфера составляет 5 мМ. В других вариантах осуществления соль в рН-забуференном солевом растворе содержит хлорид магния, хлорид калия, хлорид натрия или их сочетание. В конкретных вариантах осуществления поверхностно-активное вещество в составах выбрано из группы, состоящей из полисорбата 20 (Tween20), полисорбата 40 (Tween40), полисорбата 60(Tween60), полисорбата 65 (Tween65), полисорбата 80 (Tween80), полисорбата 85 (Tween85),Triton N-101, Triton X-100, октоксинола 40, ноноксинола-9, триэтаноламина, олеата триэтаноламина полипептида, гидроксистеарата полиоксиэтилена-660 (PEG-15, Solutol H15), рицинолеата полиоксиэтилена-35 (Cremophor EL), соевого лецитина и полоксамера. В одном конкретном варианте осуществления поверхностно-активное вещество представляет собой полисорбат 80. В конкретных вариантах осуществления конечная концентрация полисорбата 80 в составе составляет 0,01-10% полисорбата 80 по мас./об. состава. В других вариантах осуществления конечная концентрация полисорбата 80 в составе составляет 0,01% полисорбата 80 по мас./об. состава. В других вариантах осуществления конечная концентрация полисорбата 80 в составе составляет 0,05% полисорбата 80 по мас./об. состава. В других вариантах осуществления конечная концентрация полисорбата 80 в составе составляет 0,1% полисорбата 80 по мас./об. состава. В другом варианте осуществления конечная концентрация полисорбата 80 в составе составляет 1,0% полисорбата 80 по мас./об. состава. В другом варианте осуществления конечная концентрация полисорбата 80 в составе составляет 10,0% полисорбата 80 по мас./об.состава. В других конкретных вариантах осуществления композиция SCP дополнительно содержит один или несколько полипептидов, выбранных из группы, состоящей из полипептида стрептококка, полипептида пневмококка, полипептида менингококка и полипептида стафилококка. В других вариантах осуществления композиция SCP дополнительно содержит один или несколько полисахаридов, выбранных из группы, состоящей из полисахарида стрептококка, полисахарида пневмококка, полисахарида менингококка и полисахарида стафилококка. В другом варианте осуществления состав дополнительно содержит один или несколько адъювантов. Примеры подходящих адъювантов описаны далее.-3 017436 В другом варианте осуществления изобретение относится к составам, ингибирующим индуцированное силиконом осаждение конъюгата полисахарид-белок, содержащегося в силиконизированных контейнерных устройствах, содержащим (i) рН-забуференный солевой раствор, где буфер обладает рКа приблизительно от 3,5 до приблизительно 7,5, (ii) соль алюминия и (iii) один или несколько конъюгатов полисахарид-белок. В конкретных вариантах осуществления силиконизированные контейнерные устройства выбраны из одного или нескольких из группы, состоящей из флакона, пробки флакона, крышки флакона, стеклянной крышки, резиновой крышки, пластиковой крышки, шприца, стопора шприца, поршня шприца, бутылки, мензурки, мерного цилиндра, ферментера, биореактора, пробирки, трубки, пакета,банки, ампулы, картриджа и одноразовой ручки. В конкретных вариантах осуществления рН-забуференный солевой раствор в составах обладает рН 5,5-7,5. В других вариантах осуществления буфер в составах представляет собой фосфат, сукцинат, гистидин или цитрат. В других вариантах осуществления буфер представляет собой сукцинат при конечной концентрации 1-10 мМ и рН 5,8-6,0. В одном из конкретных вариантов осуществления конечная концентрация сукцинатного буфера составляет 5 мМ. В других вариантах осуществления соль в рНзабуференном солевом растворе содержит хлорид магния, хлорид калия, хлорид натрия или их сочетание. В одном конкретном варианте осуществления соль в рН-забуференном солевом растворе представляет собой хлорид натрия. В других вариантах осуществления соль алюминия представляет собой гидроксид алюминия, фосфат алюминия или сульфат алюминия. В одном из конкретных вариантов осуществления соль алюминия представляет собой фосфат алюминия. В других конкретных вариантах осуществления состав дополнительно содержит полисорбат 80(Tween80). В одном конкретном варианте осуществления конечная концентрация полисорбата 80 в составе составляет по меньшей мере 0,01%-10% полисорбата 80 по мас./об. состава. В другом варианте осуществления конъюгат полисахарид-белок содержит один или несколько полисахаридов пневмококка. В конкретных вариантах осуществления один или несколько полисахаридов пневмококка представляют собой полисахарид S. pneumoniae серотипа 4, полисахарид S. pneumoniae серотипа 6 В, полисахарид S. pneumoniae серотипа 9V, полисахарид S. pneumoniae серотипа 14, полисахарид S. pneumoniae серотипа 18 С, полисахарид S. pneumoniae серотипа 19F, полисахарид S. pneumoniae серотипа 23F, полисахарид S. pneumoniae серотипа 1, полисахарид S. pneumoniae серотипа 3, полисахарид S. pneumoniae серотипа 5, полисахарид S. pneumoniae серотипа 6 А, полисахарид S. pneumoniae серотипа 7F и полисахарид 5. pneumoniae серотипа 19 А. В других конкретных вариантах осуществления белок из состава конъюгата полисахарид-белок выбран из группы, состоящей из CRM197, токсоида столбняка, токсоида холеры, токсоида коклюша, термолабильного токсоида Е. coli (LT), токсоида пневмолизина, поверхностного белка А пневмококка (PspA) ,белка адгезина А пневмококка (PsaA), пептидазы С 5 а из Streptococcus, белка D Haemophilus influenzae,овальбумина, гемоцианина морского блюдечка (KLH), бычьего сывороточного альбумина (BSA) и очищенного белкового производного туберкулина (PPD). В одном из конкретных вариантов осуществления состав конъюгата полисахарид-белок представляет собой состав 7-валентного конъюгата пневмококка (7vPnC), содержащий полисахарид S. pneumoniae серотипа 4, конъюгированный с полипептидом CRM197, полисахарид S. pneumoniae серотипа 6 В,конъюгированный с полипептидом CRM197, полисахарид S. Pneumoniae серотипа 9V, конъюгированный с полипептидом CRM197, полисахарид S. pneumoniae серотипа 14, конъюгированный с полипептидомCRM197, полисахарид S. pneumoniae серотипа 18 С, конъюгированный с полипептидом CRM197, полисахарид S. pneumoniae серотипа 19F, конъюгированный с полипептидом CRM197, и полисахарид S. pneumoniae серотипа 23F, конъюгированный с полипептидом CRM197. В другом конкретном варианте осуществления состав конъюгата полисахарид-белок представляет собой состав 13-валентного конъюгата пневмококка (13vPnC), содержащий полисахарид S. pneumoniae серотипа 4, конъюгированный с полипептидом CRM197, полисахарид S. pneumoniae серотипа 6 В, конъюгированный с полипептидом CRM197, полисахарид S. pneumoniae серотипа 9V, конъюгированный с полипептидом CRM197, полисахарид S. pneumoniae серотипа 14, конъюгированный с полипептидомpneumoniae серотипа 7F, конъюгированный с полипептидом CRM197 и полисахарид S. pneumoniae серотипа 19 А, конъюгированный с полипептидом CRM197. В других вариантах осуществления состав дополнительно содержит один или несколько полисахаридов менингококка, один или несколько антигенных белков менингококка или их сочетание. В другом варианте осуществления состав дополнительно содержит один или несколько полисахаридов стрептококка, один или несколько антигенных белков стрептококка или их сочетание.-4 017436 В других конкретных вариантах осуществления состав дополнительно содержит один или несколько адъювантов. Примеры подходящих адъювантов описаны далее. В других вариантах осуществления настоящее изобретение относится к составам, ингибирующим индуцированное силиконом осаждение композиции пептидазы С 5 а стрептококка (SCP), содержащейся в силиконизированных контейнерных устройствах, содержащим (i) рН-забуференный солевой раствор, где буфер обладает рКа приблизительно от 3,5 до приблизительно 6,5, (ii) соль алюминия и (iii) пептидазу С 5 а стрептококка. В конкретных вариантах осуществления контейнерные устройства выбраны из одного или нескольких из группы, состоящей из флакона, пробки флакона, крышки флакона, стеклянной крышки, резиновой крышки, пластиковой крышки, шприца, стопора шприца, поршня шприца, бутылки, мензурки, мерного цилиндра, ферментера, биореактора, пробирки, трубки, пакета, банки, ампулы, картриджа и одноразовой ручки. В другом варианте осуществления рН-забуференный солевой раствор из состава обладает рН 5,57,5. В других вариантах осуществления буфер представляет собой сукцинат, гистидин, фосфат или цитрат. В конкретных вариантах осуществления буфер представляет собой сукцинат при конечной концентрации 1-10 мМ и рН 5,8-6,0. В другом варианте осуществления соль в рН-забуференном солевом растворе содержит хлорид магния, хлорид калия, хлорид натрия или их сочетание. В других конкретных вариантах осуществления состав дополнительно содержит полисорбат 80(Tween80). В одном конкретном варианте осуществления конечная концентрация полисорбата 80 в составе составляет 0,01-10% полисорбата 80 по мас./об. состава. В других вариантах осуществления композиция SCP дополнительно содержит один или несколько полипептидов, выбранных из группы, состоящей из полипептида стрептококка, полипептида пневмококка, полипептида менингококка и полипептида стафилококка. В других конкретных вариантах осуществления композиция SCP дополнительно содержит один или несколько полисахаридов, выбранных из группы, состоящей из полисахарида стрептококка, полисахарида пневмококка, полисахарида менингококка и полисахарида стафилококка. В другом варианте осуществления состав дополнительно содержит один или несколько адъювантов. Примеры подходящих адъювантов описаны далее. В других вариантах осуществления изобретение относится к составам, стабилизирующим композицию белка 2086 N. meningitidis, содержащим (i) рН-забуференный солевой раствор, где буфер обладает рКа приблизительно от 3,5 до приблизительно 6,5, (ii) поверхностно-активное вещество и (iii) белок 2086N. meningitidis. Примерные белки 2086 N. meningitidis описаны далее. В одном из конкретных вариантов осуществления состав белка 2086 N. meningitidis содержится в контейнерных устройствах. В конкретных вариантах осуществления контейнерные устройства выбраны из одного или нескольких из группы, состоящей из флакона, пробки флакона, крышки флакона, стеклянной крышки, резиновой крышки, пластиковой крышки, шприца, стопора шприца, поршня шприца, бутылки, мензурки, мерного цилиндра, ферментера, биореактора, пробирки, трубки, пакета, банки, ампулы, картриджа и одноразовой ручки. В других вариантах осуществления рН-забуференный солевой раствор в составе обладает рН 5,57,5. В других вариантах осуществления буфер представляет собой сукцинат, гистидин, фосфат или цитрат. В одном конкретном варианте осуществления буфер представляет собой сукцинат при конечной концентрации 1-10 мМ и рН 5,8-6,0. В другом конкретном варианте осуществления конечная концентрация сукцинатного буфера составляет 5 мМ. В других вариантах осуществления соль в рН-забуференном солевом растворе содержит хлорид магния, хлорид калия, хлорид натрия или их сочетание. В конкретных вариантах осуществления поверхностно-активное вещество в составах выбрано из группы, состоящей из полисорбата 20 (Tween20), полисорбата 40 (Tween40), полисорбата 60(Tween60), полисорбата 65 (Tween65), полисорбата 80 (Tween80), полисорбата 85 (Tween85),Triton N-101, Triton X-100, октоксинола 40, ноноксинола-9, триэтаноламина, олеата триэтаноламина полипептида, гидроксистеарата полиоксиэтилена-660 (PEG-15, Solutol H15), рицинолеата полиоксиэтилена-35 (Cremophor EL), соевого лецитина и полоксамера. В одном конкретном варианте осуществления поверхностно-активное вещество представляет собой полисорбат 80. В конкретных вариантах осуществления конечная концентрация полисорбата 80 в составе составляет 0,01-10% полисорбата 80 по мас./об. состава. В других вариантах осуществления конечная концентрация полисорбата 80 в составе составляет 0,01% полисорбата 80 по мас./об. состава. В других вариантах осуществления конечная концентрация полисорбата 80 в составе составляет 0,05% полисорбата 80 по мас./об. состава. В других вариантах осуществления конечная концентрация полисорбата 80 в составе составляет 0,1% полисорбата 80 по мас./об. состава. В другом варианте осуществления конечная концентрация полисорбата 80 в составе составляет 1,0% полисорбата 80 по мас./об. состава. В другом варианте осуществления конечная концентрация полисорбата 80 в составе составляет 10,0% полисорбата 80 по мас./об. состава. В других конкретных вариантах осуществления композиция белка 2086 N. meningitidis дополнительно содержит один или несколько полипептидов, выбранных из группы, состоящей из полипептида стрептококка, полипептида пневмококка, полипептида менингококка и полипептида стафилококка. В других вариантах осуществления композиция белка 2086 N. Meningitidis дополнительно содержит один-5 017436 или несколько полисахаридов, выбранных из группы, состоящей из полисахарида стрептококка, полисахарида пневмококка, полисахарида менингококка и полисахарида стафилококка. В другом варианте осуществления состав дополнительно содержит один или несколько адъювантов. Примеры подходящих адъювантов описаны далее. В других вариантах осуществления настоящее изобретение относится к составам, ингибирующим индуцированное силиконом осаждение композиции белка 2086 N. meningitidis, содержащейся в силиконизированных контейнерных устройствах, содержащим (i) pH-забуференный солевой раствор, где буфер обладает рКа приблизительно от 3,5 до приблизительно 6,5, (ii) соль алюминия и (iii) белок N. meningitidis 2086. В конкретных вариантах осуществления контейнерные устройства выбраны из одного или нескольких из группы, состоящей из флакона, пробки флакона, крышки флакона, стеклянной крышки, резиновой крышки, пластиковой крышки, шприца, стопора шприца, поршня шприца, бутылки, мензурки,мерного цилиндра, ферментера, биореактора, пробирки, трубки, пакета, банки, ампулы, картриджа и одноразовой ручки. В другом варианте осуществления рН-забуференный солевой раствор в составах обладает рН 5,57,5. В других вариантах осуществления буфер представляет собой сукцинат, гистидин, фосфат или цитрат. В конкретных вариантах осуществления буфер представляет собой сукцинат при конечной концентрации 1 мМ - 10 мМ и рН 5,8-6,0. В другом варианте осуществления соль в рН-забуференном солевом растворе содержит хлорид магния, хлорид калия, хлорид натрия или их сочетание. В других конкретных вариантах осуществления состав дополнительно содержит полисорбат 80(Tween80). В одном конкретном варианте осуществления конечная концентрация полисорбата 80 в составе составляет 0,01-10% полисорбата 80 по мас./об. состава. В других вариантах осуществления композиция белка 2086 N. meningitidis дополнительно содержит один или несколько полипептидов, выбранных из группы, состоящей из полипептида стрептококка, полипептида пневмококка, полипептида менингококка и полипептида стафилококка. В других конкретных вариантах осуществления композиция белка 2086 N. meningitidis дополнительно содержит один или несколько полисахаридов, выбранных из группы, состоящей из полисахарида стрептококка, полисахарида пневмококка, полисахарида менингококка и полисахарида стафилококка. В другом варианте осуществления состав дополнительно содержит один или несколько адъювантов. Примеры подходящих адъювантов описаны далее. Другие признаки и преимущества изобретения будут очевидны из следующего подробного описания, из вариантов его осуществления и из формулы изобретения. Краткое описание чертежей На фиг. 1 показана стабильность составов пептидазы С 5 а стрептококка (SCP) (заполняющих шприцы) до и после двух суток осторожного встряхивания (60 cpm) на горизонтальном орбитальном встряхивателе. Данные, представленные на фиг. 1 А, представляют собой стабильность в течение двух суток SCP,составленной без Tween80 (т.е. 0%), в то время как данные на фиг. 1 В представляют собой стабильность в течение двух суток SCP, составленной с 0,025% Tween80. Буферы, применяемые в составах,показанных на фиг. 1 А и 1 В, представляют собой забуференный сукцинатом солевой раствор (SBS),фосфатно-солевой буфер (PBS) и трис(гидроксиметил)аминометан (TRIS). На фиг. 2 показана общая потеря антигенности 13vPnC, составленного с AlPO4 (0,25 мг/мл) и заполняющего шприц BD Hypak, после 2, 8 и 24 ч встряхивания при 500 об./мин и 2-8 С. На фиг. 3 показана общая потеря антигенности 13vPnC, составленного с AlPO4 (0,25 мг/мл) и заполняющего несиликонизированный шприц, после 2, 8 и 24 ч встряхивания при 500 об./мин и 2-8 С. На фиг. 4 показана общая потеря антигенности 13vPnC, составленного с AlPO4 (0,25 мг/мл) и заполняющего шприц Vetter, после 2, 8 и 24 ч встряхивания при 500 об./мин и 2-8 С. На фиг. 5 показана общая потеря антигенности 13vPnC, составленного с AlPO4 (0,25 мг/мл) и заполняющего шприц Schott ТорРас, после 2, 8 и 24 ч встряхивания при 500 об./мин и 2-8 С. На фиг. 6 показана общая потеря антигенности 13vPnC, составленного с (фиг. 6 А) и без (фиг. 6 В)AlPO4 (0,25 мг/мл) и заполняющего шприц BD после термической обработки, после 2, 8 и 24 ч встряхивания при 500 об./мин и 2-8 С. На фиг. 7 показана общая потеря антигенности 13vPnC, составленного с (фиг. 7 А) и без (фиг. 7 В)AlPO4 (0,25 мг/мл) и заполняющего шприц BunderGlas PS2, после 2, 8 и 24 ч встряхивания при 500 об./мин и 2-8 С. Подробное описание изобретения Настоящее изобретение направлено на существующую в данной области необходимость улучшения стабильности иммуногенных композиций, таких как конъюгаты полисахарид-белок и белковые иммуногены. Таким образом, настоящее изобретение в широком смысле относится к новым составам поверхностно-активных веществ и/или новым составам солей алюминия, стабилизирующим иммуногенные композиции и ингибирующим их осаждение. Более конкретно, изобретение, описанное далее, направлено на существующую в данной области необходимость составов, стабилизирующих иммуногенные композиции и ингибирующих формирование твердых частиц (например, агрегацию, осаждение) в иммуногенных-6 017436 композициях, перерабатываемых, разрабатываемых, составленных, изготовленных и/или сохраняемых в контейнерных устройствах, таких как ферментеры, биореакторы, флаконы, бутылки, пакеты, шприцы,резиновые пробки, пробирки и т.п. Как указано выше в разделе Предпосылки изобретения, различные факторы влияют на стабильность иммуногенных композиций, включая, в качестве неограничивающих примеров, химическую стабильность иммуногенной композиции, физическую/термическую стабильность иммуногенной композиции, совместимость иммуногенной композиции с системой контейнера/крышки, взаимодействия между иммуногенной композицией и неактивными ингредиентами (например, буферами, солями, наполнителями, криопротекторами), способ изготовления, лекарственную форму, условия внешней среды, встречающиеся во время перевозки, хранения и манипуляций (например, температура, влажность, усилия сдвига), и промежуток времени между изготовлением и использованием. Стабильность иммуногенной композиции по изобретению легко определить с использованием стандартных способов, которые являются хорошо известными и общепринятыми для специалистов в данной области. Например, для иммуногенной композиции исследуют стабильность, агрегацию, иммуногенность, формирование твердых частиц, потерю белка (концентрации) и т.п., способами, включающими в себя, в качестве неограничивающих примеров, рассеяние света, оптическую плотность, скорость седиментации при центрифугировании, равновесие седиментации при центрифугировании, круговой дихроизм (CD), анализ по Лоури, анализ с бицинхониновой кислотой (ВСА), связывание антитела и т.п. Как подробно описано здесь, настоящее изобретение относится к неожиданным и удивительным результатам, что составление иммуногенной композиции с поверхностно-активным веществом, таким как Tween80, значительно усиливает стабильность и ингибирует осаждение иммуногенной композиции. Например, наблюдали, что по настоящему изобретению (например, см. пример 2) тринадцативалентный конъюгат пневмококка (13vPnC), составленный в забуференном солевом растворе и заполняющий шприц для однократной дозы, будет начинать осаждаться из раствора в течение 10 мин при 2-8 С при осторожном встряхивании на горизонтальном орбитальном встряхивателе. (Горизонтальный орбитальный встряхиватель использовали для имитации типичных условий получения, перевозки и хранения иммуногенной композиции 13vPnC). Однако неожиданно обнаружили, что 13vPnC, составленный в забуференном солевом растворе и 0,001% Tween80, заполняющий шприц для однократной дозы и осторожно встряхиваемый при 2-8 С, являлся стабильным в течение двадцати пяти суток без видимых признаков осаждения (данные не представлены). Таким образом, эти данные показывают, что добавление поверхностно-активного вещества (например, Tween80) к составу иммуногенной композиции увеличивает стабильность иммуногенной композиции. Второе исследование стабильности 13vPnC дополнительно подтвердило, что добавление поверхностно-активного вещества к составу значительно увеличивает стабильность 13vPnC. Например, стабильность (т.е. анализируемую измерением изменения антигенности 13vPnC) состава 13vPnC с 0,05%Tween80 (табл. 1) и без Tween80 (0,0%, табл.1) оценивали в течение периода времени 2 ч. Как показано в табл. 1, присутствовало значительное снижение антигенности полисахаридов тринадцати серотипов (составленных без Tween80) во время анализа в течение 2 ч. Однако достаточно ясно для состава 13vPnC, содержащего 0,05% Tween80 (табл. 1), была показана сильная стабильность во время анализа антигенности в течение 2 ч. Наблюдали также, что 13vPnC, составленный в 250 мл стеклянных бутылках либо с 0,01% Tween80, либо с 0,05% Tween80, может выдерживать значительные усилия сдвига, индуцированные встряхиванием составов в течение 30 мин при 2-8 С, с малой потерей антигенности или без потери антигенности (например, см. пример 2, табл. 2). В других экспериментах (пример 3) , было показано, что стабильность иммуногенной композиции пептидазы С 5 а стрептококка (SCP) сильно увеличивается при составлении с поверхностно-активным веществом, таким как Tween80. Например, как показано на фиг. 1 А, после двух суток встряхиванияSCP (55 мкг/мл), составленной либо в 5 мМ сукцинатном буфере (рН 6,0), либо в 10 мМ фосфатном буфере (рН 7,0 и 7,4), либо в 10 мМ Tris буфере (рН 7,5), присутствовало значительное снижение (например, более чем на 90%) концентрации SCP. Однако, как показано на фиг. 1 В, добавление 0,025%Tween80 к составам SCP с сукцинатом, SCP с фосфатом и SCP с Tris перед встряхиванием в течение двух суток, полностью ингибирует потерю SCP, которую наблюдали на фиг. 1 А. Иммуногенную композицию 13vPnC по изобретению можно также составлять с адъювантом или без адъюванта, такого как фосфат алюминия (AlPO4). Таким образом, в отдельной серии экспериментов(пример 4) иммуногенные композиции 13vPnC составляли в 5 мМ сукцинатном буфере (рН 5,8), 0,85%NaCl и AlPO4 (0,25 мг алюминия/мл) без добавления поверхностно-активного вещества (например, в состав не включали Tween80). В этих экспериментах иммуногенной композицией 13vPnC (составленной в присутствии AlPO4) наполняли различные силиконизированные и несиликонизированные контейнерные устройства (например,см. табл. 3) и подвергали имитации условий перевозки и манипуляций посредством встряхивания при 28 С. В этих экспериментах наблюдали (пример 4), что для контейнерных устройств с более высоким содержанием силикона характерна более высокая степень формирования твердых частиц 13vPnC и более-7 017436 высокий процент потери антигенности 13vPnC. Анализ FTIR твердых частиц показал, что твердые частицы состоят из белка и силикона (данные не представлены) и что приблизительно 85% 13vPnC связано сAlPO4, где оставшиеся 15% представляли собой свободный (не связанный с AlPO4) 13vPnC в растворе. В другом эксперименте, сравнивающем иммуногенные композиции 13vPnC, составленные с и безAlPO4, которыми затем наполняли одинаковые шприцы, наблюдали, что 13vPnC, составленный безAlPO4, теряет значительно больше антигенности, чем 13vPnC с AlPO4, в тестированных шприцах (например, см. фиг. 6 и фиг. 7). Таким образом, изобретение, как описано здесь, относится к новым составам, стабилизирующим иммуногенные композиции и ингибирующим агрегацию или осаждение иммуногенных композиций, таких как конъюгаты полисахарид-белок (например, 13vPnC) и белковые иммуногены (например, пептидаза С 5 а стрептококка, белок ORF 2086 N. meningitidis) , в зависимости от различных факторов, влияющих на стабильность иммуногенных композиций (например, усилия сдвига, встряхивание при перевозке,взаимодействия с силиконовым маслом, адсорбция, способ изготовления, температура, влажность, промежуток времени между изготовлением и использованием и т.д.). В конкретных вариантах осуществления изобретение относится к составу, стабилизирующему конъюгат полисахарид-белок, где состав содержит рН-забуференный солевой раствор, где буфер обладает рКа приблизительно от 3,5 до приблизительно 7,5, поверхностно-активное вещество и один или несколько конъюгатов полисахарид-белок. В других вариантах осуществления состав конъюгата полисахарид-белок содержится в контейнерных устройствах. В другом варианте осуществления изобретение относится к составу, стабилизирующему композицию пептидазы С 5 а стрептококка (SCP), где состав содержит рН-забуференный солевой раствор, где буфер обладает рКа приблизительно от 3,5 до приблизительно 6,5, поверхностно-активное вещество и пептидазу С 5 а стрептококка. В конкретных вариантах осуществления состав SCP содержится в контейнерных устройствах. В другом варианте осуществления изобретение относится к составу, стабилизирующему композицию белка 2086 N. meningitidis, где состав содержит рН-забуференный солевой раствор, где буфер обладает рКа приблизительно от 3,5 до приблизительно 7,5, поверхностно-активное вещество и белок N. meningitidis 2086. В конкретных вариантах осуществления состав 2086 менингококка содержится в контейнерных устройствах. В других конкретных вариантах осуществления изобретение относится к составу, ингибирующему индуцируемое силиконом осаждение конъюгата полисахарид-белок, содержащегося в силиконизированных контейнерных устройствах, где состав содержит рН-забуференный солевой раствор, где буфер обладает рКа приблизительно от 3,5 до приблизительно 7,5, соль алюминия и один или несколько конъюгатов полисахарид-белок. В другом варианте осуществления изобретение относится к составу, ингибирующему индуцированное силиконом осаждение композиции пептидазы С 5 а стрептококка (SCP), содержащейся в силиконизированных контейнерных устройствах, где состав содержит рН-забуференный солевой раствор, где буфер обладает рКа приблизительно от 3,5 до приблизительно 6,5, соль алюминия и пептидазу С 5 а стрептококка. В других конкретных вариантах осуществления изобретение относится к составу,ингибирующему индуцируемое силиконом осаждение композиции белка 2086 N. meningitidis, содержащейся в силиконизированных контейнерных устройствах, где состав содержит рН-забуференный солевой раствор, где буфер обладает рКа приблизительно от 3,5 до приблизительно 7,5, соль алюминия и белок 2086 N. meningitidis. В других вариантах осуществления изобретение относится к составам, оптимизирующим антигенную стабильность и процент связывания с адъювантом - солью алюминия (например, AlPO4) белка 2086N. meningitidis, где состав содержит рН-забуференный солевой раствор, где буфер обладает рКа приблизительно от 3,5 до приблизительно 7,5, поверхностно-активное вещество, соль алюминия и белок 2086 N.meningitidis. В конкретных вариантах осуществления состав содержится в контейнерных устройствах. Как определено далее, термины осаждение, осадок формирование твердых частиц, помутнение и агрегация можно использовать взаимозаменяемо, и они предназначены для обозначения любого физического взаимодействия или химической реакции, которые приводят к агрегации конъюгата полисахарид-белок или белкового (или полипептидного) иммуногена. Процесс агрегации (например, агрегации белка) является хорошо известным (но не хорошо понятным) и описанным в данной области, и на него часто влияют многочисленные физико-химические воздействия, включая тепло, давление, рН,встряхивание, усилия сдвига, замораживание-оттаивание, дегидратацию, тяжелые металлы, фенольные соединения, силиконовое масло, денатурирующие средства и т.п. Как определено далее, конъюгат полисахарид-белок, конъюгат пневмококка, 7-валентный конъюгат пневмококка (7vPnC), 13-валентный конъюгат пневмококка (13vPnC), иммуногенная композиция пептидазы С 5 а стрептококка (SCP) и иммуногенная композиция белка 2086 N. meningitidis по изобретению включают в себя жидкие составы, замороженные жидкие составы и твердые (например,высушенные сублимацией или лиофилизированные) составы. А. Поверхностно-активные вещества Как указано выше, изобретение относится к составам, стабилизирующим иммуногенные композиции и ингибирующим агрегацию иммуногенных композиций в зависимости от различных факторов,-8 017436 влияющих на стабильность иммуногенных композиций (например, усилий сдвига, встряхивания при перевозке, взаимодействий с силиконовым маслом, адсорбции, способов изготовления, температуры,влажности, промежутка времени между изготовлением и использованием и т.д.). В конкретных вариантах осуществления изобретение относится к составам, содержащим поверхностно-активное вещество. Поверхностно-активное вещество (или поверхностно-активное средство) в общем определяют как(а) молекулу или соединение, содержащие гидрофильную группу или часть и липофильную (гидрофобную) группу или часть, и/или (b) молекулу, вещество или соединение, которое понижает или уменьшает поверхностное натяжение раствора. Как определяют здесь, поверхностно-активное вещество по настоящему изобретению представляет собой любую молекулу или соединение, снижающие поверхностное натяжение состава иммуногенной композиции. Поверхностно-активное вещество, применяемое в составе по настоящему изобретению, содержит любое поверхностно-активное вещество или любое сочетание поверхностно-активных веществ, стабилизирующих иммуногенную композицию и ингибирующих агрегацию иммуногенной композиции, описанной здесь. Таким образом, поверхностно-активное вещество по изобретению включает в себя, в качестве неограничивающих примеров, полисорбат 20 (Tween20), полисорбат 40 (Tween40), полисорбат 60(Tween60), полисорбат 65 (Tween65), полисорбат 80 (Tween80), полисорбат 85 (Tween85),Triton N-101, Triton X-100, октоксинол 40, ноноксинол-9, триэтаноламин, олеат триэтаноламина полипептида, гидроксистеарат полиоксиэтилена-660 (PEG-15, Solutol H15), рицинолеат полиоксиэтилена 35 (Cremophor EL), соевый лецитин, полоксамер, гексадециламин, октадециламин, сложные эфиры октадецила и аминокислоты, лизолецитин, бромид диметилдиоктадециламмония, метоксигексадецилглицерин, плюроновые полиолы, полиамины (например, пиран, декстрансульфат, поли IC, карбопол),пептиды (например, мурамилпептид и дипептид, диметилглицин, тафцин), масляные эмульсии, минеральные гели (например, фосфат алюминия) и иммуностимулирующие комплексы (ISCOMS). Специалист в данной области может легко определить подходящее поверхностно-активное вещество или сочетание поверхностно-активных веществ посредством измерения поверхностного натяжения конкретного состава иммуногенной композиции в присутствии и в отсутствие поверхностно-активного вещества(веществ). Альтернативно, поверхностно-активное вещество оценивают качественно (например,визуальный контроль формирования частиц) или количественно (например, рассеяние света, скорость седиментации при центрифугировании, оптическая плотность, антигенность) по их способности уменьшать, ингибировать или предупреждать агрегацию иммуногенной композиции. В. Контейнерные устройства В конкретных вариантах осуществления изобретение относится к составам иммуногенных композиций, содержащимся в контейнерных устройствах. Как определяют здесь, контейнерные устройства по настоящему изобретению включают в себя любое изделие, которое используют, чтобы вмещать,содержать, смешивать, перемешивать, размельчать, инъецировать, переносить, распылять и т.д. иммуногенную композицию во время исследования, переработки, разработки, составления, изготовления, хранения и/или введения. Например, контейнерные устройства по настоящему изобретению включают в себя в качестве неограничивающих примеров обычную лабораторную стеклянную посуду,бутылки, мензурки, мерные цилиндры, ферментеры, биореакторы, пробирки, трубки, пакеты, банки,флаконы, крышки флаконов (например, резиновая пробка, навинчивающийся колпачок), ампулы, шприцы, стопоры шприцев, поршни шприцев, резиновые крышки, пластиковые крышки, стеклянные крышки и т.п. Контейнерные устройства по настоящему изобретению не являются ограниченными по материалу для изготовления, и материалы включают в себя такие материалы, как стекло, металлы (например, сталь,нержавеющая сталь, алюминий и т.д.) и полимеры (например, термопластики, эластомеры, термопластики-эластомеры). Опытному специалисту в данной области будет понятно, что контейнерные устройства, описанные выше, совсем не представляют собой исчерпывающий список, но просто служат руководством для специалиста в данной области по отношению к множеству контейнерных устройств, которые используют,чтобы вмещать, содержать, смешивать, перемешивать, размельчать, инъецировать, переносить, распылять и т.д. иммуноген или иммуногенную композицию во время исследования, переработки, разработки,составления, изготовления, хранения и/или введения композиции. Дополнительные контейнерные устройства, предусмотренные для использования по настоящему изобретению, можно найти в опубликованных каталогах от поставщиков и производителей лабораторного оборудования, таких как UnitedStates Plastic Corp. (Lima, OH), VWR (West Chester, PA), BD Biosciences (Franklin Lakes, NJ) , Fisher Scientific International Inc. (Hampton, NH) и Sigma-Aldrich (St. Louis, MO). Таким образом, новые составы по настоящему изобретению являются особенно преимущественными в том, что они стабилизируют иммуногенные составы и ингибируют осаждение иммуногенных составов, содержащихся в контейнерных устройствах, во время различных стадий исследования, переработки,разработки, составления, изготовления, хранения и/или введения композиции. Новые составы по изобретению не только стабилизируют иммуногенные композиции против физических/термических воздействий (например, температура, влажность, усилия сдвига и т.д.), они также увеличивают стабильность им-9 017436 муногенных композиций и ингибируют осаждение иммуногенных композиций в зависимости от отрицательных факторов или влияний, таких как несовместимость иммуногенной композиции с системой контейнера/крышки (например, с силиконизированными контейнерными устройствами). Таким образом, новые составы по настоящему изобретению являются, в частности, применимыми для стабилизации иммуногена (т.е. конъюгата полисахарид-белок, белкового или полипептидного антигена) против осаждения, индуцированного силиконовым маслом, и осаждения, описанного выше. Например, в одновременно рассматриваемой патентной заявке США 60/795098, поданной 26 апреля 2006 г., конкретно приведенной в данном описании в качестве ссылки, описана агрегация иммуногенных композиций в присутствии силиконового масла, обнаруженная в контейнерных устройствах, таких как шприцы, стеклянные флаконы, резиновые пробки и т.п., где добавление поверхностно-активного вещества в контейнерные устройства предупреждает индуцированную силиконовым маслом агрегацию этих иммуногенных композиций. С. Адъюванты и фармацевтические носители/наполнители В конкретных вариантах осуществления иммуногенные композиции по изобретению дополнительно составляют с адъювантом. Адъювант представляет собой вещество, которое усиливает иммунный ответ при введении вместе с иммуногеном или антигеном. Показано, что ряд цитокинов или лимфокинов обладают иммуномодулирующей активностью, и, таким образом, их можно использовать в качестве адъювантов, включая, в качестве неограничивающих примеров, интерлейкины 1-, 1-, 2, 4, 5, 6, 7, 8, 10,12 (см., например, патент США 5723127), 13, 14, 15, 16, 17 и 18 (и их мутантные формы), интерфероны-,и , гранулоцитарно-макрофагальный колониестимулирующий фактор (GMCSF, см., например,патент США 5078996 и инвентарный номер в АТСС 39900), макрофагальный колониестимулирующий фактор (MCSF), гранулоцитарный колониестимулирующий фактор (GCSF) и факторы некроза опухолии(TNF). Другие адъюванты, применимые по этому изобретению, включают в себя хемокины, включая,без ограничения, МСР-1, MIP-1, MIP-1 и RANTES. В конкретных вариантах осуществления адъюванты, применимые для усиления иммунного ответа в составах иммуногенных композиций, включают в себя, без ограничения, MPL (3-O-деацилированный монофосфориллипид A; Corixa, Hamilton, MT), описанный в патенте США 4912094, содержание которого таким образом приведено в качестве ссылки. Также пригодными для применения в качестве адъювантов являются синтетические аналоги липида А или соединения аминоалкилглюкозаминфосфата(AGP), или их производные или аналоги, доступные из Corixa (Hamilton, MT) и описанные в патенте Соединенных Штатов 6113918, содержание которого, таким образом, приведено в качестве ссылки. Один такой AGP представляет собой 2-[(R)-3-тетрадеканоилокситетрадеканоиламино]этил-2-дезокси-4O-фосфоно-3-O-[(R)-3-тетрадеканоилокситетрадеканоил]-2-[(R)-3-тетрадеканоилокситетрадеканоиламино]-b-D-глюкопиранозид, известный также как 529 (ранее известный как RC529). Этот адъювант 529 составляют в виде водной формы или в виде стабильной эмульсии (RC529-SE). Другие адъюванты включают в себя эмульсии минерального масла и воды, соли алюминия (квасцы), такие как гидроксид алюминия, фосфат алюминия, сульфат алюминия и т.д., амфиген, авридин,L121/сквален, D-лактид-полилактид/гликозид, плюроновые полиолы, мурамилдипептид, убитую Bordetella, сапонины, такие как Stimulon QS-21 (Antigenics, Framingham, MA.), описанные в патенте США 5057540, содержание которого, таким образом, приведено в данном описании в качестве ссылки, и полученные из них частицы, такие как ISCOMS (иммуностимулирующие комплексы), ISCOMATRIX (CSLCpG-мотив (патент США 6207 64 6, содержание которого, таким образом, приведено в качестве ссылки), IC-31 (Intercell AG, Vienna, Austria), описанный в европейских патентах 12 96713 и 132 6634, токсин коклюша (РТ) или термолабильный токсин Е. coli (LT), в частности LT-K63, LT-R72, PT-K9/G129; см., например, международные патентные публикацииWO 93/13302 и WO 92/19265, содержание которых приведено в данном описании в качестве ссылки. Также применимыми в качестве адъювантов (и белков-носителей) являются токсины холеры и их мутанты, включая токсины, описанные в опубликованной международной патентной заявке номер WO 00/18434 (где глутаминовую кислоту в положении аминокислоты 29 заменяют другой аминокислотой(отличной от аспарагиновой кислоты), предпочтительно гистидином). Подобные СТ токсины или мутанты описаны в опубликованной международной патентной заявке номер WO 02/098368 (где изолейцин в положении аминокислоты 16 заменяют другой аминокислотой, либо отдельно, либо в сочетании с заменой серина в положении аминокислоты 68 другой аминокислотой; и/или где валин в положении аминокислоты 72 заменяют другой аминокислотой). Другие СТ токсины описаны в опубликованной международной патентной заявке номер WO 02/098369 (где аргинин в положении аминокислоты 25 заменяют другой аминокислотой; и/или вставляют аминокислоту в положении аминокислоты 49; и/или вставляют две аминокислоты в положениях аминокислот 35 и 36). В конкретных вариантах осуществления составы иммуногенных композиций содержат фармацевтически приемлемый разбавитель, наполнитель или фармацевтически приемлемый носитель. В одном- 10017436 варианте осуществления фармацевтически приемлемый разбавитель представляет собой стерильную воду, воду для инъекций, стерильный изотонический солевой раствор или биологический буфер. Конъюгаты полисахарид-белок и/или белковые иммуногены смешивают с такими разбавителями или носителями общепринятым образом. Как применяют в настоящем: описании, выражение фармацевтически приемлемый носитель предназначено, чтобы включать в себя все и любые растворители, диспергенты, покрытия, антибактериальные и противогрибковые средства, изотонические и замедляющие всасывание средства и т.п., подходящие для введения хозяевам - людям или другим позвоночным. Подходящий носитель является очевидным для специалистов в данной области и будет зависеть в значительной степени от способа введения. Например, наполнители, которые могут присутствовать в составе иммуногенной композиции, представляют собой консерванты, химические стабилизаторы и суспендирующие или диспергирующие средства. Как правило, стабилизаторы, консерванты и т.п. оптимизируют для определения лучшего состава для эффективности для намеченного реципиента (например, человека). Примеры консервантов включают в себя хлорбутанол, сорбат калия, сорбиновую кислоту, диоксид серы, пропилгаллат, парабены, этилванилин, глицерин, фенол и парахлорфенол. Примеры стабилизирующих ингредиентов включают в себя казаминокислоты, сахарозу, желатин, феноловый красный, N-Z амин, дифосфат монокалия, лактозу, гидролизат лактальбумина и сухое молоко. В конкретных вариантах осуществления состав иммуногенной композиции получают для введения людям, например, в форме жидкостей, порошков, аэрозолей, таблеток, капсул, таблеток или капсул с энтеросолюбильным покрытием, или суппозиториев. Таким образом, составы иммуногенной композиции могут также включать в себя в качестве неограничивающих примеров суспензии, растворы, эмульсии в масляных или водных носителях, пасты и имплантируемые составы с замедленным высвобождением или биологически разлагаемые составы. Иммуногенные композиции по настоящему изобретению не являются ограниченными посредством выбора общепринятых, физиологически приемлемых носителей, разбавителей и наполнителей, таких как растворители, буферы, адъюванты или другие ингредиенты, применимых в фармацевтических препаратах описанных выше типов. Получение этих фармацевтически приемлемых композиций из вышеописанных компонентов, обладающих подходящими рН, изотоничностью, стабильностью и другими общепринятыми характеристиками, находится в компетенции специалистов в данной области.D. Иммуногены В конкретных вариантах осуществления состав конъюгата полисахарид-белок по изобретению содержит один или несколько полисахаридов пневмококка. В других вариантах осуществления состав конъюгата полисахарид-белок по изобретению содержит один или несколько полисахаридов стрептококка. В других вариантах осуществления состав конъюгата полисахарид-белок по изобретению содержит один или несколько полисахаридов менингококка. В других вариантах осуществления состав конъюгата полисахарид-белок по изобретению содержит сочетание одного или нескольких полисахаридов пневмококка, одного или нескольких полипептидов пневмококка, одного или нескольких полисахаридов стрептококка, одного или нескольких полипептидов стрептококка, одного или нескольких полисахаридов менингококка и/или одного или нескольких полипептидов менингококка. Как определено далее, термин полисахарид предназначен, чтобы включать в себя любой антигенный сахаридный элемент (или антигенную единицу), общепринятый в области иммунологических и бактериальных вакцин, включая, в качестве неограничивающих примеров, сахарид, олигосахарид, полисахарид, липосахарид, липоолигосахарид (LOS), липополисахарид (LPS), гликозилат, гликоконъюгат и т.п. В одном конкретном варианте осуществления изобретения один или несколько полисахаридов пневмококка представляют собой полисахарид S. pneumoniae серотипа 4, полисахарид S. pneumoniae серотипа 6 В, полисахарид S. pneumoniae серотипа 9V, полисахарид S. pneumoniae серотипа 14, полисахарид S. pneumoniae серотипа 18 С, полисахарид S. pneumoniae серотипа 19F, полисахарид S. pneumoniae серотипа 23F, полисахарид S. pneumoniae серотипа 1, полисахарид S. pneumoniae серотипа 3, полисахарид S. pneumoniae серотипа 5, полисахарид S. pneumoniae серотипа 6 А, полисахарид S. pneumoniae серотипа 7F и полисахарид S. pneumoniae серотипа 19 А. В конкретных вариантах осуществления состав конъюгата полисахарид-белок представляет собой состав 7-валентного конъюгата пневмококка (7vPnC), содержащий полисахарид S. pneumoniae серотипа 4, конъюгированный с полипептидом CRM197, полисахарид S. pneumoniae серотипа 6 В, конъюгированный с полипептидом CRM197, полисахарид S. pneumoniae серотипа 9V, конъюгированный с полипептидом CRM197, полисахарид S. pneumoniae серотипа 14, конъюгированный с полипептидом CRM197, полисахарид S. pneumoniae серотипа 18 С, конъюгированный с полипептидом CRM197, полисахарид S. pneumoniae серотипа 19F, конъюгированный с полипептидом CRM197, и полисахарид S. pneumoniae серотипа 23F, конъюгированный с полипептидом CRM197. В других конкретных вариантах осуществления состав конъюгата полисахарид-белок представляет собой состав 13-валентного конъюгата пневмококка (13vPnC), содержащий полисахарид S. pneumoniaepneumoniae серотипа 7F, конъюгированный с полипептидом CRM197, и полисахарид S. pneumoniae серотипа 19 А, конъюгированный с полипептидом CRM197. Полисахариды получают посредством общепринятых способов, известных специалистам в данной области. Например, капсульные полисахариды, описанные в настоящем изобретении, получают из серотипов 1, 3, 4, 5, 6 А, 6 В, 7F, 9V, 14, 18 С, 19 А, 19F и 23F Streptococcus pneumoniae, где каждый серотип выращивают на среде на основе сои, и затем отдельные полисахариды очищают центрифугированием,осаждением, ультрафильтрацией и колоночной хроматографией. Подобным образом, полисахариды стрептококка (например, один или несколько полисахаридов (или олигосахаридов) из -гемолитическогоStreptococcus, такого как Streptococcus группы A, Streptococcus группы В, Streptococcus группы С и Streptococcus группы G) и сахариды менингококка (например, липоолигосахарид N. meningitidis (LOS) или липополисахарид (LPS получают из имеющих клиническое значение серотипов или серогрупп с использованием обычных способов и методов, известных специалисту в данной области. Затем очищенные полисахариды химически активируют (например, посредством восстановительного аминирования) для получения сахаридов, способных реагировать с белком-носителем. После активации каждый капсульный полисахарид отдельно конъюгируют с белком-носителем (например, CRM197) для получения гликоконъюгата (или, альтернативно, каждый капсульный полисахарид конъюгируют с одним и тем же белкомносителем) и составляют в состав для однократного дозирования. Химическую активацию полисахаридов и последующую конъюгацию с белком-носителем (т.е. конъюгат полисахарид-белок) получают общепринятыми способами. См., например, патенты США 4673574 и 4902506. Белки-носители предпочтительно представляют собой белки, которые являются нетоксичными и не реакционноспособными и которые можно получить с достаточным количеством и чистотой. Белкиносители должны являться поддающимися общепринятым способам конъюгации. В конкретном варианте осуществления настоящего изобретения CRM197 используют в качестве белка-носителя.CRM197 (Wyeth, Sanford, NC) представляет собой нетоксичный вариант (т.е. токсоид) дифтерийного токсина, выделенного из культур Corynebacterium diphtheria штамма С 7 (197), выращиваемых в среде на основе казаминокислот и дрожжевого экстракта. CRM197 очищают посредством ультрафильтрации,осаждения сульфатом аммония и ионообменной хроматографии. Альтернативно, CRM197 получают рекомбинантным способом согласно патенту США 5614382, который, таким образом, приведен в качестве ссылки. Другие дифтерийные токсоиды также являются подходящими для использования в качестве белков-носителей. В других вариантах осуществления белок-носитель по изобретению представляет собой ферментативно неактивную пептидазу С 5 а стрептококка (SCP) (например, один или несколько вариантов SCP,описанных в патенте США 6951653, патенте США 6355255 и патенте США 6270775). Другие подходящие белки-носители включают в себя инактивированные бактериальные токсины,такие как токсоид столбняка, токсоид коклюша, токсоид холеры (например, СТ Е 29 Н, описанный в международной патентной заявке WO 2004/083251), LT Е. coli, ST Е. coli, и экзотоксин А из Pseudomonasaeruginosa. Можно использовать также белки внешней мембраны бактерий, такие как комплекс внешней мембраны с (ОМРС), порины, связывающие трансферрин белки, пневмолизин, поверхностный белок А пневмококка (PspA), белок адгезии пневмококка (PsaA) или белок D Haemophilus influenzae. Другие белки, такие как овальбумин, гемоцианин морского блюдечка (KLH), бычий сывороточный альбумин (BSA) или очищенное белковое производное туберкулина (PPD), также можно использовать в качестве белковносителей. После конъюгации капсульного полисахарида с белком-носителем, конъюгаты полисахарид-белок очищают (обогащают по отношению к количеству конъюгата полисахарид-белок) множеством способов. Эти способы включают в себя способы концентрирования/диафильтрации, осаждения/элюции, колоночной хроматографии и глубокой фильтрации. После очистки отдельных гликоконъюгатов их смешивают для получения иммуногенной композиции по настоящему изобретению. Состав конъюгатов полисахарид-белок по настоящему изобретению можно получать с использованием известных в данной области способов. Например, 13 отдельных конъюгатов пневмококка можно составлять с физиологически пригодным носителем для получения композиции. Такие носители включают в себя в качестве неограничивающих примеров воду, забуферен- 12017436 ный солевой раствор, полиолы (например, глицерин, пропиленгликоль, жидкий полиэтиленгликоль) и растворы декстрозы. В других вариантах осуществления изобретение относится к составам, стабилизирующим иммуногенную композицию пептидазы стрептококка С 5 а (SCP), где составы содержат рН-забуференный солевой раствор, где буфер обладает рКа приблизительно от 3,5 до приблизительно 6,5, поверхностноактивное вещество и пептидазу С 5 а стрептококка. Пептидаза С 5 а представляет собой высоко консервативную сериновую протеазу и экспрессируется у всех -гемолитических стрептококков (например,стрептококков групп А, В, С и G). Например, нуклеотидная последовательность, кодирующая пептидазу С 5 а стрептококков группы В (GBS), на 98% идентична нуклеотидной последовательности, кодирующей пептидазу С 5 а стрептококков группы A (GAS). Таким образом, в конкретных вариантах осуществления изобретения иммуногенная композиция против инфекции, вызванной -гемолитическими стрептококками, содержит иммуноген (или антиген) пептидазу С 5 а. В одном конкретном варианте осуществления пептидаза С 5 а по изобретению представляет собой ферментативно неактивную пептидазу С 5 а стрептококка (например, один или более из вариантов SCP,описанных в патенте США 6951653, патенте США 6355255 и патенте США 6270775, содержание каждого из которых конкретно приведено в данном описании в качестве ссылки). В другом конкретном варианте осуществления SCP, используемые в новых составах иммуногенной композиции по изобретению,клонируют из стрептококков группы В. В другом варианте осуществления в последовательность SCP стрептококков группы В вводят генетические мутации, чтобы привести ее в протеолитически неактивное состояние (например, см. патенты США 6951653; 6355255 и 6270775), и экспрессируют в качестве рекомбинантного белка в Е. coli. В другом из вариантов осуществления изобретение относится к составам, стабилизирующим иммуногенную композицию белка 2086 N. meningitidis, где составы содержат рН-забуференный солевой раствор, где буфер обладает рКа приблизительно от 3,5 до приблизительно 7,5, поверхностно-активное вещество и белок 2086 N. meningitidis. Белки 2086 N. meningitidis кодированы последовательностью нуклеиновой кислоты открытой рамки считывания (ORF), идентифицированной как ORF 2086 (например,см. международную публикациюWO 03/063766 А 2 (международная заявкаPCT/US02/32369), Международную публикациюWO 04/094596 А 2 (международная заявкаPCT/US04/011901) и Международную публикациюWO 04/065603 А 2 (международная заявкаPCT/US04/000800) , содержание каждой из которых конкретно приведено в данном описании в качестве ссылки). В следующем варианте осуществления изобретение относится к составам, оптимизирующим антигенную стабильность и процент связывания с адъювантом - солью алюминия (например, AlPO4) белка 2086 N. meningitidis, где составы содержат рН-забуференный солевой раствор, где буфер обладает рКа приблизительно от 3,5 до приблизительно 7,5, поверхностно-активное вещество, соль алюминия и белок 2086 N. meningitidis. Содержание всех патентов и публикаций, процитированных в данном описании, таким образом,приведено в качестве ссылки. Е. Примеры Следующие примеры осуществляли с использованием общепринятых способов, которые являются хорошо известными и общепринятыми для специалистов в данной области, за исключением тех, которыеподробно описаны иным образом. Следующие примеры представлены для иллюстративной цели, и их никаким образом не следует рассматривать как ограничивающие объем настоящего изобретения. Пример 1. Иммуногенные составы, содержащие 0,001-0,05% TWEEN80, стабилизируют иммуноген и предупреждают его агрегацию Конъюгат полисахарид-белок, применяемый в этом примере, представлял собой тринадцативалентный конъюгат полисахарида пневмококка (13vPnC), содержащий капсульные полисахариды из 5. pneumoniae серотипов 4, 6 В, 9V, 18 С, 19F, 14, 23F, 1, 3, 5, 6 А, 7F и 19 А, каждый из которых конъюгировали сCRM197. Капсульные полисахариды получены посредством общепринятых способов, известных специалистам в данной области. Кратко, каждый серотип полисахарида выращивали в среде на основе сои, затем отдельные полисахариды очищали посредством центрифугирования, осаждения, ультрафильтрации и колоночной хроматографии. Очищенные полисахариды химически активировали для конъюгации, и каждый полисахарид отдельно конъюгировали с белком-носителем CRM197 для получения гликоконъюгата и составляли в состав для однократной дозы. Химическую активацию полисахаридов и последующую конъюгацию с белком-носителем осуществляли посредством общепринятых способов (например, см. патент США 4673574 и 4902506).CRM197 (Wyeth, Sanford, NC) представляет собой нетоксичный вариант (т.е. токсоид) дифтерийного токсина, выделенного из Corynebacterium diphtheria штамма С 7 (197), выращенного в среде на основе казаминокислот и дрожжевого экстракта. CRM197 очищали посредством ультрафильтрации, осаждения сульфатом аммония и ионообменной хроматографии. Эксперименты по антигенности, описанные ниже, выполняли посредством смешивания образцов 13vPnC с одной из тринадцати антисывороток (Ab), специфических к каждому из серотипов полисахарида, и детекции иммунных комплексов посредством измерений рассеяния света на системе Array 360(Beckman Coulter, Inc.; Fullerton, CA). Детектированные измерения рассеяния света для каждого из тринадцати серотипов затем сравнивали со стандартной кривой и записывали как антигенность (мкг/мл). Шприцы (BD Hypak SCF) и стопоры шприцев (BD Hypak SCF) закупали в BD Biosciences(Franklin Lakes, NJ). Прозрачные боросиликатные флаконы (VWR TraceClean, 40 мл) с покрытыми Teflon крышками закупали в VWR (West Chester, PA). Полисорбат 80 (Tween80) закупали в J.T. Baker(Mallinckrodt Baker, Inc.; Phillipsburg, NJ). Забуференный солевой раствор представлял собой сукцинат (5 мМ) и NaCl (0,85%) при рН 5,8. 13vPnC составляли (500 мл общего объема) при различных концентрациях поверхностно-активного вещества (Tween80; 0,001, 0,005, 0,01 и 0,05%, мас./об.) следующим образом: в стеклянную литровую мензурку Pyrex добавляли 0,85% солевой раствор (150 мМ NaCl), затем 50 мМ сукцинатный буфер(конечная концентрация 5 мМ) и 13vPnC. Конечная концентрация конъюгата каждого серотипа составляла 4,4 мкг/мл (за исключением серотипа 6 В, для которого она составляла 8,8 мкг/мл). Затем состав 13vPnC разделяли на пять отдельных стеклянных флаконов (50 мл на флакон), где 0,0, 0,001, 0,005, 0,01 или 0,05% Tween 80 (мас./об.) добавляли в один из пяти флаконов и каждый раствор фильтровали через 0,22 мкм фильтр Durapore (Millipore; Billerica, MA). Затем 0,65 мл каждого раствора заполняли в отдельный стеклянный шприц 3 мл BD HYPAK SCF с неокрашенными стопорами w4432 (BD Medical Pharmaceutical Systems; Franklin Lakes, NJ) и помещали шприцы в горизонтальный орбитальный встряхиватель (60 cpm) на 100 ч при 2-8 С. Посредством визуального контроля наблюдали (данные не представлены), что 13vPnC, составленный в отсутствие Tween 80 (т.е. 0,0%), начинает осаждаться из раствора в течение 10 мин при 2-8 С при осторожном встряхивании посредством горизонтального орбитального встряхивателя. В отличие от этого, 13vPnC, составленный в 0,001, 0,005, 0,01 или 0,05% Tween 80 и осторожно встряхиваемый при 2-8 С, являлся стабильным в течение вплоть до двадцати пяти суток без видимых признаков осаждения(данные не представлены). Таким образом, эти данные показывают, что добавление поверхностноактивного вещества (например, Tween80) к составу иммуногенной композиции увеличивает стабильность иммуногенной композиции. Второй эксперимент по стабильности 13vPnC дополнительно подтвердил, что добавление поверхностно-активного вещества к составу значительно увеличивает стабильность 13vPnC. В этом эксперименте 13vPnC составляли с и без 0,05% Tween 80. 13vPnC, составленный без Tween80 (т.е. 0,0%),получали следующим образом: в литровую стеклянную мензурку Pyrex добавляли 0,85% солевой раствор (150 мМ NaCl), затем 50 мМ сукцинатный буфер (конечная концентрация 5 мМ) и 13vPnC, в общем объеме 500 мл. 13vPnC, составленный с 0,05% Tween 80 получали следующим образом: в литровую стеклянную мензурку Pyrex добавляли 0,85% солевой раствор (150 мМ NaCl), затем 50 мМ сукцинатный буфер (конечная концентрация 5 мМ), 0,05% Tween80 и 13vPnC, в общем объеме 500 мл. Конечная концентрация конъюгата каждого серотипа в 500 мл составов составляла 4,4 мкг/мл (за исключением серотипа 6 В, для которого она составляла 8,8 мкг/мл). 500 мл составов гомогенизировали посредством роторного/статорного гомогенизатора при 6000 об./мин (2-8 С) в течение 120 мин. Процесс гомогенизации создавал поверхность раздела воздух-жидкость (с пузырьками воздуха). Стабильность состава 13vPnC с (табл. 1) и без (табл. 1) 0,05% Tween 80 оценивали в течение периода времени два часа следующим образом: Образцы (20-30 мл) отбирали через 0, 30 и 120 мин из составов с 0,0 и 0,05% Tween 80, образцы разводили 1:2 в разбавителе для белка (Array 360 разбавитель для белка (Cat.663630); Beckman Coulter Inc.; Fullerton, CA), и оценивали антигенность всех тринадцати серотипов 13vPnC (см. табл. 1) в системе Array 360. Как показано в табл. 1, присутствовало значительное уменьшение антигенности полисахаридов тринадцати серотипов (составленных без Tween80) в течение двухчасового анализа. Однако достаточно значительно для состава 13vPnC, содержащего 0,05% Tween 80 (табл. 1), была показана сильная стабильность без уменьшения антигенности в течение двухчасового анализа антигенности. Состав 13vPnC/Tween80 далее тестировали по стабильности против усилий сдвига. В этом эксперименте 10 0 мл композиции 13vPnC (4,4 мкг/мл серотипов 1, 3, 4, 5, 6 А, 7F, 9V, 14, 18 С, 19 А, 19F, 23F и 8,8 мкг/мл серотипа 6 В, 5 мМ сукцинатный буфер, 150 мМ NaCl и 0,25 мг/мл AlPO4) добавляли в три 250 мл стеклянные бутылки, содержащие 0,0, 0,01 или 0,05% Tween80. Затем три бутылки встряхивали в течение 30 мин (2-8 С) на встряхивателе (Vortex-Genie 2; Scientific Industries, Inc.; Bohemia, NY) и создавали поверхность раздела воздух-жидкость при установке максимальной скорости. Спустя 30 мин образцы по 10-30 мл отбирали из каждой бутылки, разводили 1:2 в разбавителе для белка Array 360, и анализировали антигенность тринадцати серотипов в системе Array 360. Как видно в табл. 2 ниже, 13vPnC, составленный без Tween80 (0,0%), обладал в среднем 20% уменьшением антигенности после встряхивания. 13vPnC, составленный с 0,01% Tween80, обладал уменьшением антигенности в диапазоне 2-10% (в среднем 8%), a 13vPnC, составленный с 0,05%Tween80, обладал уменьшением антигенности в диапазоне 0-8% (в среднем 3%). Таким образом, данные, представленные в таблице 2, показывают, что 13vPnC, составленные либо с 0,01%, либо с 0,05%Tween80, являлись значительно стабилизированными против усилий сдвига по сравнению с 13vPnC,составленным в отсутствие Tween80. Пример 2. Составы, содержащие поверхностно-активное вещество, стабилизируют пептидазу С 5 а стрептококка и предупреждают ее агрегацию Пептидазу С 5 а стрептококка (SCP), применяемую в этом примере, экспрессировали и очищали следующим образом. SCP экспрессировали рекомбинантным способом в Е. coli с использованием индуцируемой системы арабинозы. Следовали общепринятым протоколам ферментации в Е. coli с использованием среды определенного состава, свободной от веществ животного происхождения, и последующего лизиса клеток. Рекомбинантный SCP очищали из растворимой фракции лизата клеток посредством насыщения до 60% (приблизительно ЗМ) сульфата аммония при перемешивании в течение 12-24 ч. Насыщенный лизат центрифугировали, супернатант сохраняли и наносили на колонку для гидрофобного взаимодействия с фенилсефарозой. Затем связавшийся материал элюировали с помощью 1 М сульфата аммония, 20 мМ Tris-Cl, pH 7,5, концентрировали и подвергали диафильтрации против PBS, рН 7,4. Очищенный рекомбинантный SCP (rSCP) разводили до 10 мг/мл PBS, рН 7,4, пропускали через фильтрPosidyne для удаления эндотоксина с последующей окончательной фильтрацией (0,2 мМ) для стерильности и хранили замороженным (-25 С). Затем очищенный SCP (55 мкг/мл) составляли с 0,025% Tween80 или без Tween80 (0,0%) в следующих буферах: 5 мМ сукцинатный буфер при рН 6,0, 10 мМ фосфатный буфер при рН 7,0, 10 мМ фосфатный буфер при рН 7,4 или 10 мМ Tris-буфер при рН 7,5, и наполняли им отдельные шприцы BDHypak SCF. Затем шприцы помещали в горизонтальный орбитальный встряхиватель при 2-8 С, встряхивали при 180 cpm в течение двух суток и определяли концентрацию белка SCP посредством модифицированного анализа по Лоури. Как показано на фиг. 1, стабильность SCP сильно увеличивается при составлении с Tween80. Например, после двух суток на орбитальном шейкере, для SCP, составленного без Tween80 (фиг. 1 А) было показано значительное уменьшение (например, более 90%) концентрации SCP в каждом из тестированных буферов. Однако, как показано на фиг. 1 В, добавление 0,025% Tween80 в составы буферов дляSCP перед помещением в орбитальный шейкер на двое суток, полностью ингибирует потерю SCP, наблюдаемую на фиг. 1 А. Стабильность при хранении состава SCP/Tween80 (0,025%) оценивали также при 25 и 37 С в течение восьми недель и шести недель, соответственно (данные не представлены). Кратко, SCP (200 мкг) составляли либо в сукцинатном буфере, либо в фосфатном буфере следующим образом: сукцинатный буфер (5 мМ, рН 6,0) или фосфатный буфер (15 мМ, рН 7,4), 0,9% NaCl и 0,025% Tween80. Стабильность составов SCP/Tween80 анализировали эксклюзионной HPLC, модифицированным анализом общего белка по Лоури и визуальным контролем осаждения. В этом исследовании наблюдали, что составыSCP/Tween80 (в любом буфере) являлись полностью стабильными при 25 и 37 С в течение всего исследования стабильности (т.е. вплоть до восьми недель и шести недель, соответственно). Пример 3. Влияние силиконизированных контейнерных устройств на стабильность 13vPnC Предварительные эксперименты показали (данные не представлены), что иммуногенные композиции 13vPnC осаждались и/или агрегировали при наполнении готовых для использования (для однократной дозы) шприцев Becton Dickinson (BD) Hypak типа 1 из боросиликатного стекла, обработанных чистым для медицины силиконом Dow Corning DC 360 и закрытых свободными от латекса стопорами West 4432/50 (хлорбутил), и крышкой для наконечника EZ West 7025/65 (смесь синтетических изопрена и бромбутила; West Pharmaceutical, Lionville, PA). В этих экспериментах 13vPnC составляли в 5 мМ сукцинатном буфере, содержащем 0,85% NaCl и 4,4 мкг/мл S. pneumoniae серотипов 1, 3, 4, 5, 6 А, 7F, 9V, 14,18 С, 19 А, 19F и 23F и 8,8 мкг/мл S. pneumoniae серотипа 6 В, в присутствии и в отсутствие 0,25 мг/мл фосфата алюминия в качестве адъюванта. Обнаружили, что в отсутствие AlPO4 можно было легко наблюдать твердые частицы 13vPnC, тогда как в присутствии AlPO4 твердых частиц 13vPnC было значительно меньше и их было труднее детектировать. В настоящем примере исследовали серии компонентов контейнеров и крышек (т.е. контейнерные устройства), чтобы идентифицировать, какие компоненты индуцируют формирование твердых частиц 13vPnC или вносят в него вклад. Тестируемые контейнерные устройства включают в себя шприцы, стопоры и флаконы и перечислены ниже в табл. 3. Стопоры BD и West, перечисленные в табл. 3, силиконизировали с использованием способа либо Huber, либо Jar. Способ силиконизации Huber является более контролируемым и дает выход 30-60 мкг/см 2 силикона на поверхности стопора, тогда как способом силиконизации Jar получают 150-300 мкг/см 2 силикона на поверхности стопора. На основании теоретических вычислений приблизительно 15% площади поверхности стопора подвергаются воздействию продукта в шприце, позволяя предполагать, что для способов Huber и Jar между 4,5-9 и 22,5-45 мкг силикона может быть экстрагировано из стопоров, соответственно. Материалы Силикон представлял собой Dow Corning 360 Medical Fluid 1000 сантистоксов (партия 0001846266). 7vPnC составляли в 5 мМ сукцинатном буфере, содержащем 0,85% NaCl и 4,4 мкг/мл S.pneumoniae серотипов 4, 9, 14, 18 С, 19F и 23F, и 8,8 мкг/мл S. pneumoniae серотипа 6 В, в присутствии и в отсутствие 0,25 мг/мл фосфата алюминия. 13vPnC составляли в 5 мМ сукцинатном буфере, содержащем 0,85% NaCl и 4,4 мкг/мл S. pneumoniae серотипов 1, 3, 4, 5, 6 А, 7F, 9V, 14, 18 С, 19 А, 19F и 23F, и 8,8 мкг/мл S. pneumoniae серотипа 6 В, в присутствии и в отсутствие 0,25 мг/мл фосфата алюминия. Моновалентный S. pneumoniae серотипа 6 В составляли (в 5 мМ сукцинатном буфере, содержащем 0,85% NaCl,без фосфата алюминия) в концентрации 61 мкг/мл для имитации общей концентрации сахарида составов 13vPnC. Методы 7vPnC и 13vPnC составляли, как описано выше, и 35 мл данного состава добавляли в прозрачную бутылку 250 мл Nalgene. В каждую бутылку Nalgene добавляли компоненты контейнерных устройств, перечисленных в табл. 3. Затем бутылки Nalgene помещали в орбитальный шейкер Labline и вращали в течение ночи при 50 об./мин. Результаты суммированы в табл. 3. Визуальный контроль Бутылки Nalgene, содержащие каждый из компонентов контейнерных устройств, удерживали под флуоресцентным освещением в лаборатории. Путь пучка света (эффект Тиндаля), проходящего через образцы, позволяет детекцию твердых частиц. Анализ белка Общий белок и белок, связавшийся с алюминием, определяли измерением концентрации общего белка в составленной иммуногенной композиции и белка, связанного с осадком алюминия, соответственно (аликвоту иммуногенной композиции центрифугировали, и осадок ресуспендировали в солевом растворе). Анализы проводили с использованием модифицированного анализа белка по Лоури Pierce(каталожный 23240) с бычьим сывороточным альбумином в качестве стандарта. Результаты В первой серии экспериментов иммуногенные композиции 13vPnC составляли без AlPO4 и подвергали воздействию серий контейнерных устройств, перечисленных ниже в табл. 3. Из данных ясно было очевидно (табл. 3), что компоненты контейнерных устройств, которые обрабатывали силиконовым маслом, индуцировали формирование белых частиц. В отличие от этого, не детектировали твердых частиц в присутствии несиликонизированных стопоров Daikyo (Daikyo Seiko, Ltd., Japan) и флаконов Schott- 17017436 Таблица 3. Эффект различных компонентов контейнерных устройств на 13vPnC, составленный без AlPO4 Моновалентный S. pneumoniae серотипа 6 В выбрали в качестве модели для 13vPnC и составляли при 61,6 мкг/мл (без AlPO4) для имитации общей концентрации сахарида в составе 13vPnC. Силикон(Dow Corning 360 Medical Fluid) добавляли к аликвотам составленного моновалентного 6 В в диапазоне от 2 до 100 ч/млн. Смеси помещали в орбитальный шейкер Labline на 2 ч при 50 об./мин. Как указано ниже в табл. 4, подобные волокнам белые твердые частицы наблюдали при всех концентрациях силикона(Si). Таблица 4. Эффект концентрации силикона на формирование твердых частиц Исследовали также количество силикона в составах 13vPnC (без AlPO4). Концентрацию силикона определяли эмиссионной спектроскопией с плазмой DC (данные не представлены). По этому способу содержимое 25 шприцов объединяли и экстрагировали двумя 50 мл порциями смеси циклогексан/изопропиловый спирт. Экстракты объединяли и упаривали. Осадок солюбилизировали и тестировали согласно существующим способам для определения силикона на резиновых пробках. Результаты показали, что из каждого шприца можно экстрагировать между 15,8 и 19,0 мкг силикона. Это количество соот- 18017436 ветствует 2,7-3,3% силикона. В отдельных сериях экспериментов, в которых 13vPnC составляли в присутствии AlPO4 и подвергали воздействию тех же самых контейнерных устройств, описанных в табл. 3, выявили, что силикон и свободный белок (13vPnC) в растворе являлись ответственными за формирование твердых частиц(данные не представлены). Анализ FTIR твердых частиц также показал, что твердые частицы состояли из белка и силикона (данные не представлены). В этих экспериментах определили, что приблизительно 85% из 13vPnC являлись связанными с AlPO4, где оставшиеся 15% являлись свободным (не связанным сAlPO4) 13vPnC в растворе. В отличие от этого наблюдали, что 7vPnC, составленный с AlPO4, являлся на 100% связанным с AlPO4 (данные не представлены). Для выявления эффекта свободного белка-полисахарида на формирование твердых частиц по 25 мл как 7vPnC, так и 13vPnC разделяли на аликвоты и переносили в 50 мл пробирку для центрифугирования. Образцы центрифугировали в течение 10 мин при 3000 об./мин, супернатант осторожно экстрагировали и переносили в бутылку Nalgene. Десять силиконизированных стопоров (стопоры 4432) добавляли в каждую бутылку и помещали на орбитальный встряхиватель при 50 об./мин. После тщательного визуального контроля обнаружили, что для супернатанта 7vPnC не наблюдали формирования твердых частиц, таким образом, он оставался прозрачным и бесцветным. Однако для супернатанта 13vPnC начинали наблюдать низкие уровни твердых частиц, начиная с четвертого часа наблюдения (данные не представлены). Этот результат позволяет предполагать, что свободный белок-полисахарид в растворе, в сочетании с силиконом, является ответственным за формирование твердых частиц. Для дальнейшего выявления вклада свободного белка-полисахарида в растворе в формирование твердых частиц выбрали моновалентные S. pneumoniae серотипов 4 и 6 В за их высокое и низкое связывание с алюминием, соответственно. Эти два моновалентных серотипа составляли при концентрации белка в диапазоне от 25 до 200 мкг/мл в отсутствие и в присутствии AlPO4. Десять силиконизированных стопоров (стопоры 4432) помещали в каждый из составов, которые затем помещали в орбитальный встряхиватель при 50 об./мин. Как показано ниже в табл. 5, подобные волокнам белые твердые частицы наблюдали для обоих моновалентных серотипов при всех концентрациях белка в отсутствие AlPO4. Однако в присутствии AlPO4 твердые частицы детектировали при более низких концентрациях для серотипа 4 (100 мкг/мл) по сравнению с серотипом 6 В (200 мкг/мл), данные не представлены. Таблица 5. Эффект концентрации белка на формирование твердых частиц Пример 4. Алюминиевые адъюванты ингибируют формирование твердых частиц 13vPnC в присутсвии силиконизированных контейнерных устройств Как указано выше в примере 3, иммуногенная композиция 13vPnC представляет собой жидкий состав, содержащий 4,4 мкг/мл S. pneumoniae серотипов 1, 3, 4, 5, 6 А, 7F, 9V, 14, 18 С, 19 А, 19F, 23F и 8,8 мкг/мл типа 6 В в 5 мМ сукцинатном буфере (рН 5,8) и 0,85% NaCl, который можно также составлять в присутствии или в отсутствие адъюванта (например, алюминиевого адъюванта). 13vPnC можно также составлять в присутствии или в отсутствие адъюванта, такого как 0,25 мг алюминия/мл фосфата алюминия (AlPO4). В примере 3 наблюдали, что 13vPnC, составленный без AlPO4 и заполняющий шприцы BDHypak SCF (закрытые поршнями Нурак), не удовлетворял визуальному контролю из-за обнаружения твердых частиц, где дополнительные исследования выявили, что твердые частицы частично являлись результатом взаимодействий белка-полисахарида с силиконом. В следующем примере шприцы (и поршни) от различных поставщиков оценивали с составами 13vPnC, где условия перевозки и манипуляцийS. pneumoniae серотипов 1, 3, 4, 5, 6 А, 7F, 9V, 14, 18 С, 19 А, 19F и 23F и 8,8 мкг/мл S. pneumoniae серотипа 6 В, в присутствии и в отсутствие 0,25 мг/мл фосфата алюминия. Тестированные контейнерные устройства перечислены ниже в табл. 6. Таблица 6. Контейнерные устройства Методы Способ составления и заполнения Ниже в табл. 7 перечислена рецептура для 2 л состава 13vPnC. Кратко, в стеклянную мензурку сначала добавляли 0,85% солевой раствор, затем 5 мМ сукцинатный буфер (рН 5,8) и затем последовательно конъюгаты каждого из серотипов S. pneumoniae. Затем состав осторожно перемешивали на смесителе и фильтровали через фильтрующий элемент Millipore 0,22 мкм. Для состава, содержащего AlPO4, затем добавляли AlPO4 (конечная концентрация 0,25 мг/мл) и состав осторожно перемешивали. Затем заполняли тестируемые шприцы (0,58 мл/шприц) и закрывали поршнями. Имитация перевозки посредством встряхивания Встряхиватель VWr signature Digital Multitube (каталожный 14005-826) использовали для встряхивания образцов. Шприцы, заполненные 13vPnC, размещали горизонтально и фиксировали двумя поддерживающими пластинами встряхивателя. Образцы удерживали в горизонтальном положении и встряхивали при 500 об./мин в режиме выдержки при 2-8 С в течение 24 ч. Нефелометрия Специфические для серотипов антигенности определяли анализом кинетической нефелометрии с использованием типоспецифических антител. В случае 13vPnC с AlPO4 фосфат алюминия солюбилизировали добавлением 1 н NaOH. Раствор немедленно нейтрализовали добавлением 1 М лимонной кислоты. В случае 13vPnC без AlPO4 не проводили процедур солюбилизации и нейтрализации. Анализ измеряет скорость изменения интенсивности рассеяния света, происходящего из-за комплекса антитело-антиген,сформированного в образце, с использованием нефелометра Beckman Array 360. Результаты В этом исследовании шприцы от различных поставщиков, обладающие различными уровнями силикона (табл. 6), подвергали условиям контролируемого встряхивания. Общую антигенность каждого серотипа измеряли анализом нефелометрии для образцов как до встряхивания, так и после встряхивания. Рассчитывали потерю антигенности после встряхивания (процент), и она показана на фиг. 2-7. Перед исследованием условия встряхивания оптимизировали на основании потери антигенности двух контролей: (1) контроля для наихудшего случая (положительный контроль, высокий уровень силикона; фиг. 2) и (2) контроля для наилучшего случая (отрицательный контроль, без силикона; фиг. 3). Затем условия оптимизировали, так что потеря антигенности являлась низкой в положительном контроле,однако поддающейся детекции в отрицательном контроле. Это выполняли, чтобы убедиться, что встряхивание не являлось ни слишком слабым, чтобы вызывать осаждение в шприцах; ни слишком сильным,так что осаждение могут вызывать факторы, отличные от взаимодействия с силиконом (например, усилия сдвига). Таким образом, встряхивание при 500 об./мин (в режиме выдержки) в течение 24 ч выбрали в качестве наиболее подходящего условия встряхивания, в то время как температуру 2-8 С и горизонтальное положение использовали для имитации условий перевозки продукта и манипуляций с ним в реальном масштабе времени. Результаты исследования обобщены следующим образом: Наибольшие потери антигенности 13vPnC, составленного с AlPO4, присутствовали в шприцах с более высокими уровнями силикона (данные не представлены). Например, из шприцев, перечисленных в табл. 6, каждый из шприца BD Hypak(контроль 1), шприца BD после термической обработки (шприц 3; 0,1 мг силикона), шприца BD для высокой вязкости (шприц 5) и шприца BunderGlas PS4 (шприц 8, 0,14 мг силикона) обладал одним или несколькими из серотипов 13vPnC с потерей антигенности более 10%. Наименьшие потери антигенности 13vPnC, составленного с AlPO4, присутствовали в шприцах с более низкими уровнями силикона. Например, шприцы Vetter (фиг. 4) и пластиковые шприцы Schott ТорРас (фиг. 5) наиболее сходны с несиликонизированными шприцами (фиг. 2), для тех и других была показана незначительная потеря антигенности для 13vPnC, составленного с AlPO4. Влияние фосфата алюминия на стабилизацию 13vPnC и ингибирование формирования твердых частиц в присутствии силиконизированных шприцев анализировали в экспериментах с использованием 13vPnC, составленного с и без 0,25 мг/мл AlPO4, где использованные шприцы представляли собой шприцы BD после термической обработки с низким уровнем силикона (шприц 4 в табл. 6) и шприцы BunderGlas с низким уровнем силикона PS2 (шприц 7 в табл. 6). Шприцы BD после термической обработки с низким уровнем силикона (0,04 мг силикона/баррель), как правило, обладали потерей антигенности ме- 21017436 нее 10% для серотипов 13vPnC, составленных с AlPO4 (фиг. 6 А), где потеря антигенности для серотипов 13vPnC, составленных без AlPO4 (фиг. 6 В), составляла потери антигенности в диапазоне от 5% (серотип 1) вплоть до приблизительно 50% (серотип 23F). Шприцы BunderGlas с низким уровнем силикона PS2(0,056 мг силикона/баррель) обладали потерей антигенности менее 5-8% (в зависимости от серотипа) для 13vPnC, составленного с AlPO4 (фиг. 7 А), где потеря антигенности для серотипов 13vPnC, составленных без AlPO4 (фиг. 7 В) составляла потери антигенности в диапазоне приблизительно от 5 до приблизительно 30% (в зависимости от серотипа). Таким образом, взятые вместе, эти данные показывают, что (1) потеря антигенности 13vPnC являлась более высокой в шприцах с более высокими уровнями силикона, и (2) 13vPnC, составленный безAlPO4, сохранял более высокие потери антигенности, чем 13vPnC с AlPO4, во всех тестированных шприцах. Пример 5. Составы, содержащие поверхностно-активное вещество, оптимизируют связывание антигенных белков менингококка с адъювантами - солями алюминия Рекомбинантный липидированный белок 2086 N. meningitidis (rLP2086), используемый в этом примере, экспрессировали и очищали следующим образом. rLP2086 экспрессировали рекомбинантным способом в Е. coli, используя природную лидерную последовательность. Следовали общепринятым способам для Е. coli с использованием среды с определенным составом, свободной от продуктов животного происхождения, а затем клетки лизировали. Рекомбинантный липидированный белок 208 6 N. meningitidis очищали от осадка мембраны с помощью 50 мМ Tris-HCl/5 мМ ЭДТА/1% саркозила рН 8. Этот саркозиловый экстракт доводили до 1% цвиттергента 3-14 (Z3-14) и дважды подвергали диализу против 30 кратного избытка 50 мМ Tris-HCl/5 мМ ЭДТА/1% Z3-14. Диализованный экстракт rLP2086 осаждали с помощью 90% этанола для удаления оставшегося саркозила, и солюбилизировали с помощью 50 мМTris-HCl/5 мМ ЭДТА/1% Z3-14 рН 8. Нерастворимый материал удаляли центрифугированием, супернатант пропускали через колонку для анионообменной хроматографии, и rLP208 6 собирали в несвязавшейся фракции. Затем несвязавшийся материал подвергали диализу дважды против 30-кратного избытка 25 мМ NaAc/1% Z3-14 рН 4,5, и пропускали через колонку для катионообменной хроматографии.rLP2086 элюировали с помощью градиента 0-0,3 М NaCl и хранили замороженным (-25 С). Затем очищенный rLP2086 составляли с 150 мМ NaCl, 0,020% Tween80, 0,2 5 мг Al/мл AlPO4 и в следующих буферах: 10 мМ фосфатный буфер при рН 7,0 и 5 мМ сукцинатный буфер при рН 6,0. В табл. 8 сравнивают процент связывания белка с адъювантом AlPO4. Таблица 8. Связывание rLP2086 с адъювантомSun et al., "Protein Denaturation Induced by Cyclic Silicone", Biomaterials 18:1593-1597, 1998. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Состав, стабилизирующий конъюгат полисахарид-белок, содержащий (i) рН-забуференный солевой раствор, где буфер имеет значение pKa, равное приблизительно от 3,5 до приблизительно 7,5, (ii) полисорбат 80 в конечной концентрации от 0,001 до 0,05% вес./об. состава и (iii) один или несколько конъюгатов полисахарид-белок, содержащий один или несколько полисахаридов пневмококка. 2. Состав по п.1, где рН-забуференный солевой раствор содержит хлорид натрия. 3. Состав по любому из пп.1 или 2, где рН-забуференный солевой раствор имеет значение рН, равное 5,5-7,5. 4. Состав по любому из пп.1-3, где буфер является фосфатным, сукцинатным, гистидиновым или цитратным. 5. Состав по п.4, где буфером является сукцинатный буфер. 6. Состав по п.5, где сукцинатный буфер находится в конечной концентрации 1-10 мМ, а значение рН равно 5,8-6,0. 7. Состав по п.6, где сукцинатный буфер имеет конечную концентрацию, равную 5 мМ. 8. Состав по п.7, где буфер имеет значение рН, равное 5,8. 9. Состав по любому из пп.1-8, дополнительно содержащий один или несколько полисахаридов менингококка, один или несколько антигенных белков менингококка или их сочетание. 10. Состав по любому из пп.1-8, дополнительно содержащий один или несколько полисахаридов стрептококка, один или несколько антигенных белков стрептококка или их сочетание. 11. Состав по любому из пп.1-10, где состав конъюгата полисахарид-белок представляет собой состав 7-валентного конъюгата пневмококка (7vPnC), содержащий полисахарид S.pneumoniae серотипа 4, конъюгированный с полипептидом CRM197,полисахарид S.pneumoniae серотипа 6 В, конъюгированный с полипептидом CRM197,полисахарид S.pneumoniae серотипа 9V, конъюгированный с полипептидом CRM197,полисахарид S.pneumoniae серотипа 14, конъюгированный с полипептидом CRM197,полисахарид S.pneumoniae серотипа 18 С, конъюгированный с полипептидом CRM197,полисахарид S.pneumoniae серотипа 19F, конъюгированный с полипептидом CRM197, и полисахарид S.pneumoniae серотипа 23F, конъюгированный с полипептидом CRM197. 12. Состав по любому из пп.1-10, где состав конъюгата полисахарид-белок представляет собой состав 13-валентного конъюгата пневмококка (13vPnC), содержащий полисахарид S.pneumoniae серотипа 4, конъюгированный с полипептидом CRM197,полисахарид S.pneumoniae серотипа 6 В, конъюгированный с полипептидом CRM197,полисахарид S.pneumoniae серотипа 9V, конъюгированный с полипептидом CRM197,полисахарид S.pneumoniae серотипа 14, конъюгированный с полипептидом CRM197,полисахарид S.pneumoniae серотипа 18 С, конъюгированный с полипептидом CRM197,полисахарид S.pneumoniae серотипа 19F, конъюгированный с полипептидом CRM197,полисахарид S.pneumoniae серотипа 23F, конъюгированный с полипептидом CRM197,полисахарид S.pneumoniae серотипа 1, конъюгированный с полипептидом CRM197,полисахарид S.pneumoniae серотипа 3, конъюгированный с полипептидом CRM197,полисахарид S.pneumoniae серотипа 5, конъюгированный с полипептидом CRM197,полисахарид S.pneumoniae серотипа 6 А, конъюгированный с полипептидом CRM197,полисахарид S.pneumoniae серотипа 7F, конъюгированный с полипептидом CRM197, и полисахарид S.pneumoniae серотипа 19 А, конъюгированный с полипептидом CRM197. 13. Состав по любому из пп.1-12, дополнительно содержащий один или несколько адъювантов. 14. Состав по п.13, в котором адъювант представляет собой фосфат алюминия. 15. Состав по п.11, где состав дополнительно содержит один или несколько адъювантов. 16. Состав по п.15, где адъювантом является фосфат алюминия.- 23017436 17. Состав по п.13, где фосфат алюминия присутствует в конечной концентрации, равной около 0,25 мг/мл. 18. Состав по п.1, который стабилизирует конъюгат полисахарид-белок, содержащий:(i) рН-забуференный солевой раствор, где буфер является сукцинатным и имеет конечную концентрацию, равную около 1-10 мМ, и имеет значение рН, равное 5,8-6,0;(ii) полисорбат 80 с конечной концентрацией от 0,01 до 0,05% полисорбата 80 по мас./об. состава;S.pneumoniae серотипа 7F, конъюгированный с полипептидом CRM197, и полисахарид S.pneumoniae серотипа 19 А, конъюгированный с полипептидом CRM197. 19. Состав по п.18, где конечная концентрация сукцинатного буфера равна 5 мМ. 20. Состав по п.18, где рН-забуференный солевой раствор содержит хлорид натрия. 21. Состав по п.20, где хлорид натрия присутствует в конечной концентрации 150 мМ. 22. Состав по любому из пп.18-21, где состав дополнительно содержит адъювант, и адъювантом является фосфат алюминия. 23. Состав п.1, который стабилизирует конъюгат полисахарид-белок, где состав содержит:(i) рН-забуференный солевой раствор, содержащий хлорид натрия, где буфер является сукцинированным и имеет конечную концентрацию, равную около 5 мМ, и значение рН, равное 5,8;(iv) адъювант, содержащий фосфат алюминия в конечной концентрации около 0,25 мг/мл. 24. Контейнерное устройство, выбранное из группы, состоящей из флакона, шприца, бутылки, ферментера, биореактора, пробирки, трубки, пакета, банки, ампулы, картриджа и одноразовой ручки, наполненных составом по любому из пп.1-23. 25. Контейнерное устройство по п.24, которое дополнительно необязательно содержит одно или несколько из пробки, крышки, стеклянной крышки, резиновой крышки, пластиковой крышки, стопора шприца, поршня шприца, мензурки, мерного цилиндра. 26. Контейнерное устройство по любому из пп.24-25, где контейнерные устройства закрыты силиконом.
МПК / Метки
МПК: A61K 47/48, A61K 47/12
Метки: новые, осаждение, иммуногенные, ингибирующие, составы, композиции, стабилизирующие
Код ссылки
<a href="https://eas.patents.su/28-17436-novye-sostavy-stabiliziruyushhie-immunogennye-kompozicii-i-ingibiruyushhie-ih-osazhdenie.html" rel="bookmark" title="База патентов Евразийского Союза">Новые составы, стабилизирующие иммуногенные композиции и ингибирующие их осаждение</a>
Предыдущий патент: Мультичастицы, способ получения мультичастиц и их применения
Следующий патент: 3-замещенное-[1,2,3]-бензотриазиноновое соединение для увеличения глутаматергических синаптических ответов
Случайный патент: Элемент отопительного радиатора с полной антикоррозионной защитой и способ антикоррозионной обработки отопительного радиатора