13-членные азалиды и их применение в качестве антибиотических агентов
Номер патента: 5156
Опубликовано: 30.12.2004
Авторы: Рафка Роберт Джон, Зиглер Карл Бернард, Мортон Барри Джеймс, Бертинейто Питер, Дерлам Джон Филип, Блайз Алан Элвуд, Рейган Коулман Брендан
Формула / Реферат
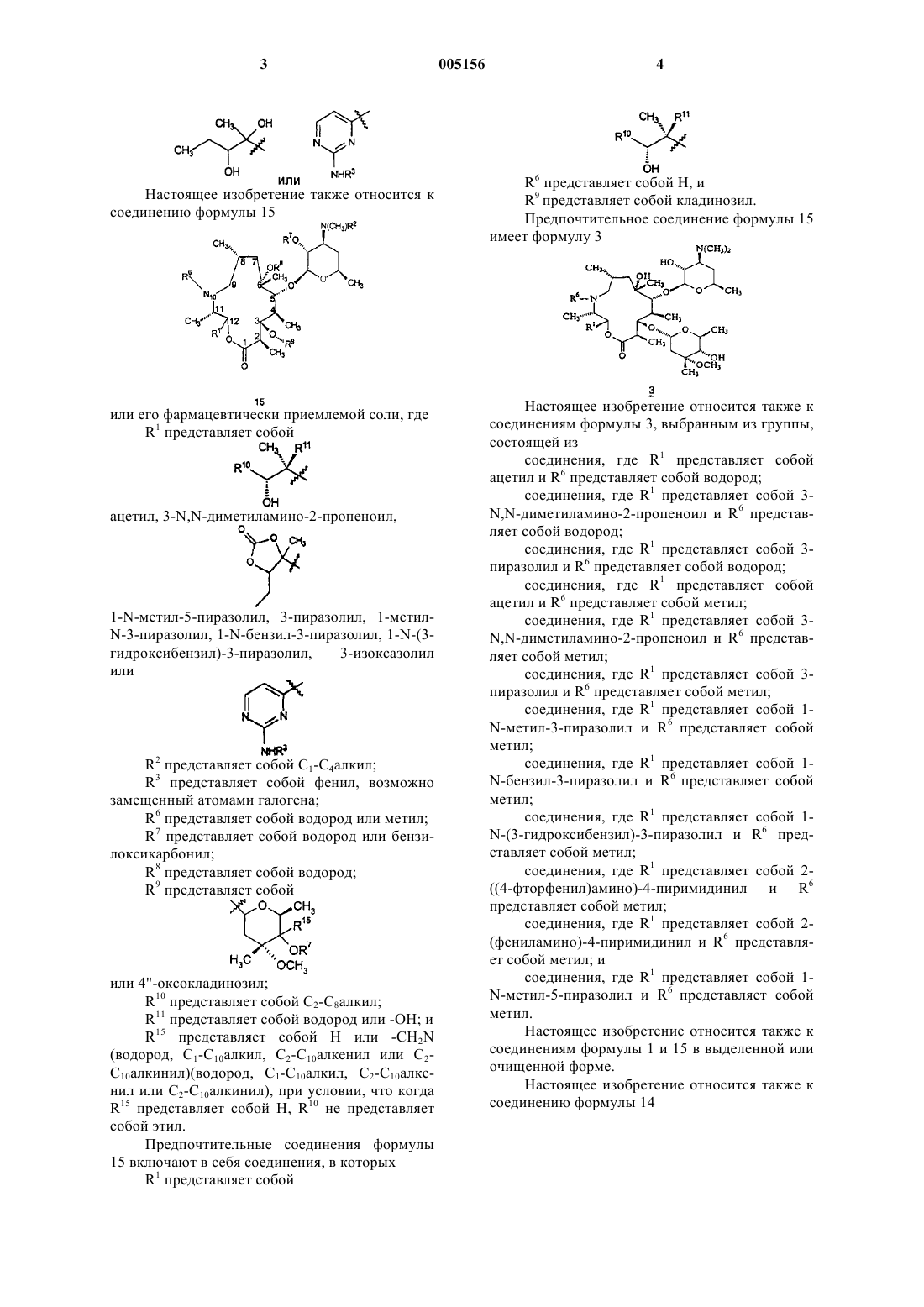
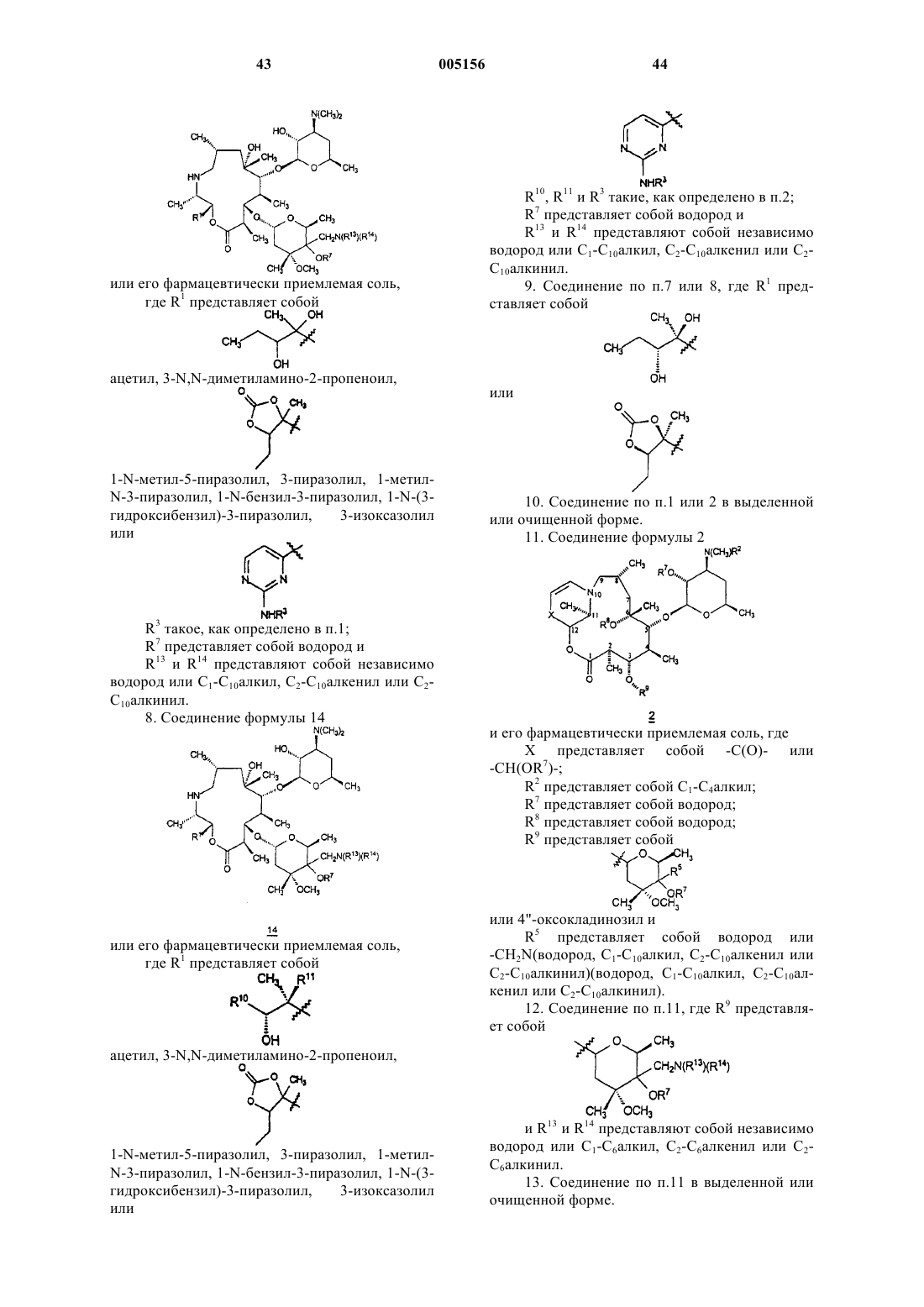
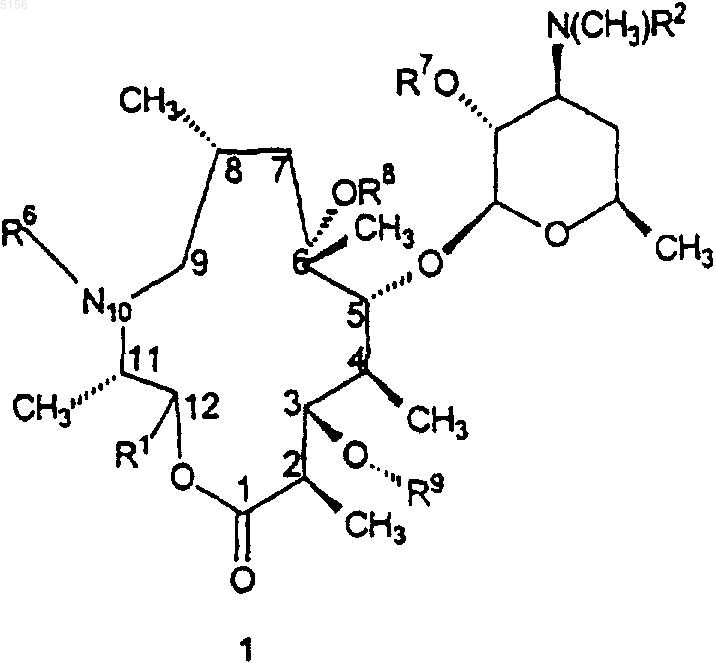
1. Соединение формулы 1
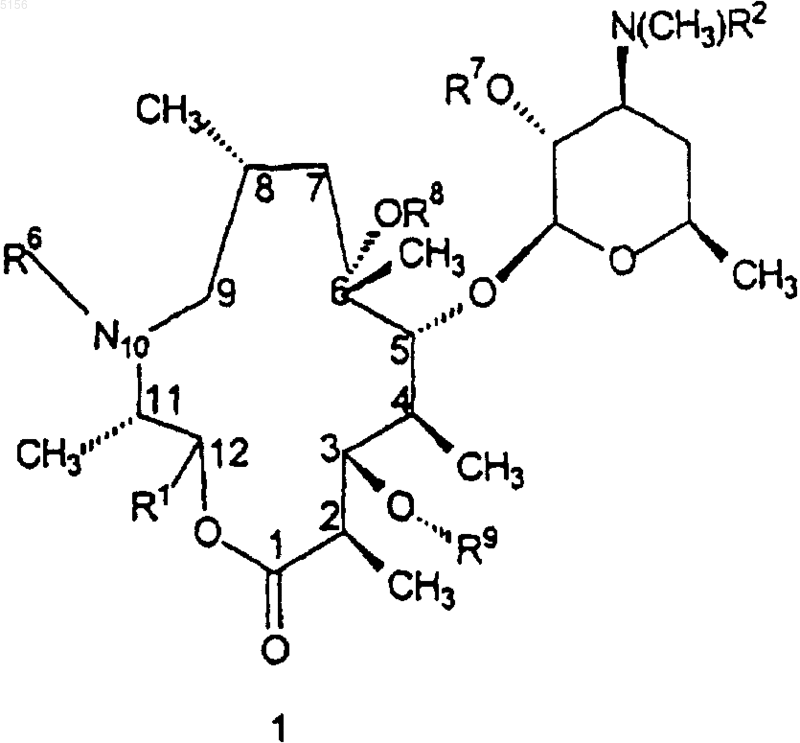
или его фармацевтически приемлемая соль,
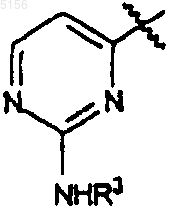
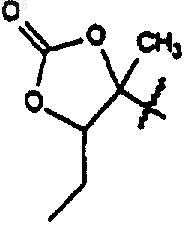
где R1 представляет собой
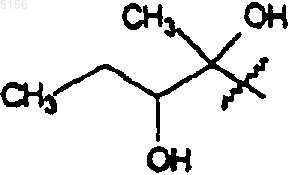 ,
,
ацетил, 3-N,N-диметиламино-2-пропеноил,

1-N-метил-5-пиразолил, 3-пиразолил, 1-метил-N-3-пиразолил, 1-N-бензил-3-пиразолил, 1-N-(3-гидроксибензил)-3-пиразолил, 3-изоксазолил или
R2 представляет собой C1-C4алкил;
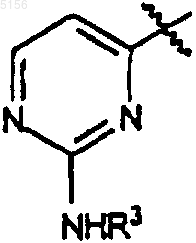
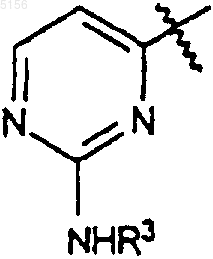
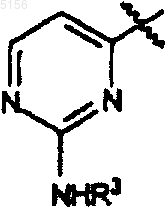
R3 представляет собой фенил, возможно замещенный атомами галогена;
R6 представляет собой водород или метил;
R7 представляет собой водород или бензилоксикарбонил;
R8 представляет собой водород;
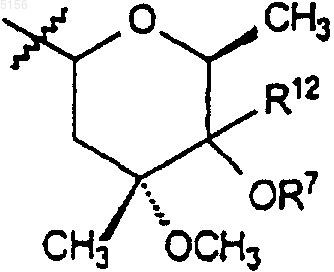
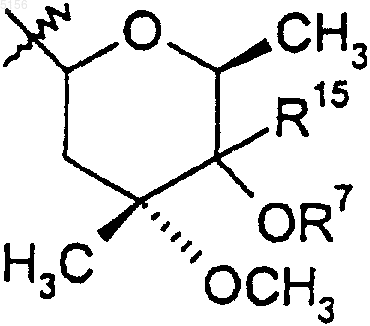
R9 представляет собой
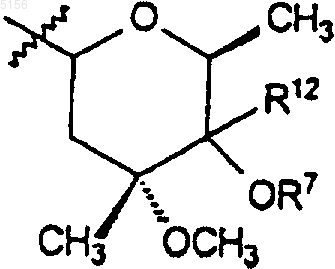
или 4"-оксокладинозил и
R12 представляет собой -CH2N(водород, C1-C10алкил, C2-C10алкенил или C2-C10алкинил)(водород, C1-C10алкил, C2-C10алкенил или C2-C10алкинил).
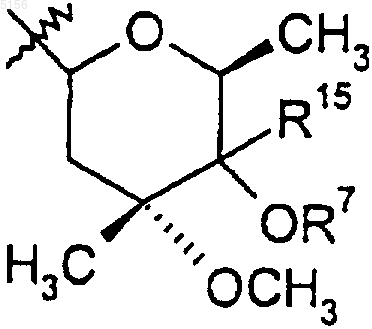
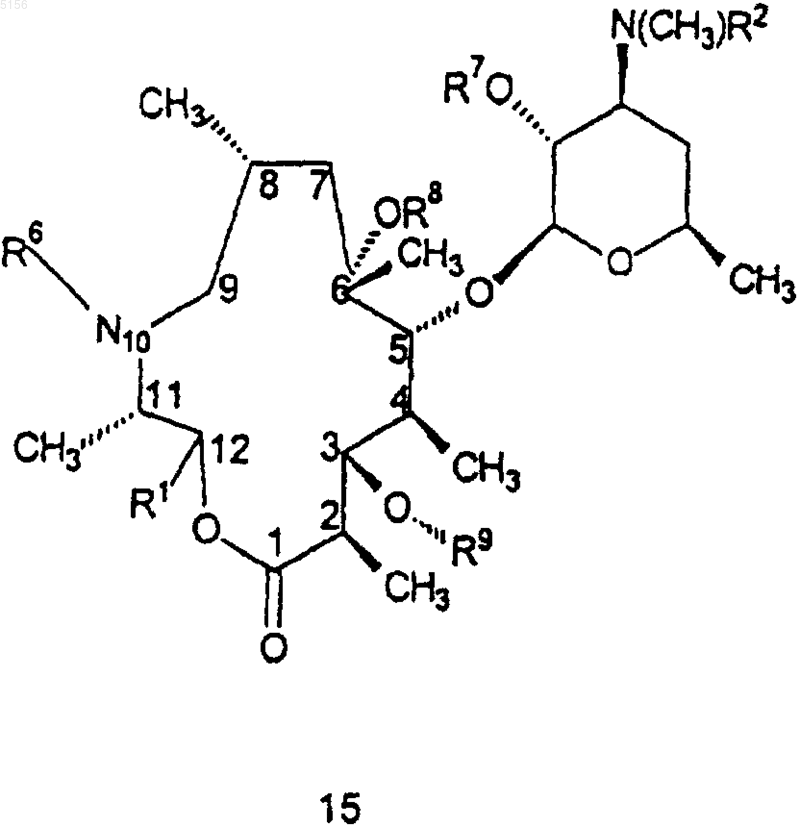
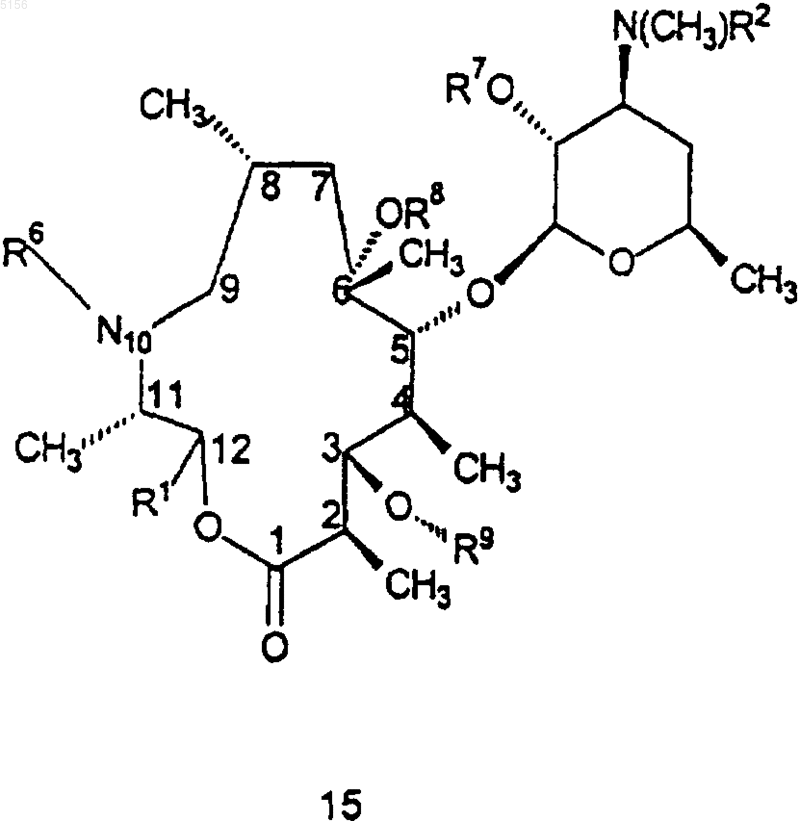
2. Соединение формулы 15
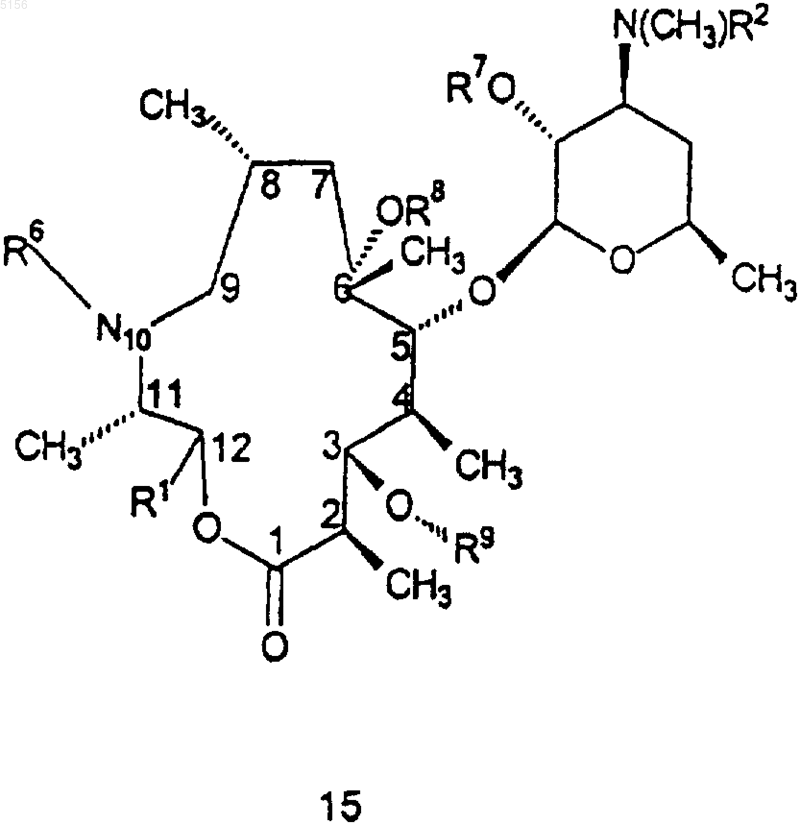
или его фармацевтически приемлемая соль,
где R1 представляет собой
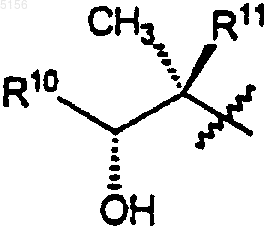 ,
,
ацетил, 3-N,N-диметиламино-2-пропеноил,
1-N-метил-5-пиразолил, 3-пиразолил, 1-метил-N-3-пиразолил, 1-N-бензил-3-пиразолил, 1-N-(3-гидроксибензил)-3-пиразолил, 3-изоксазолил или
R2 представляет собой C1-C4алкил;
R3 представляет собой фенил, возможно замещенный атомами галогена;
R6 представляет собой водород или метил;
R7 представляет собой водород или бензилоксикарбонил;
R8 представляет собой водород;
R9 представляет собой
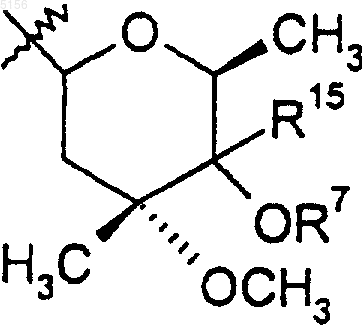
или 4"-оксокладинозил;
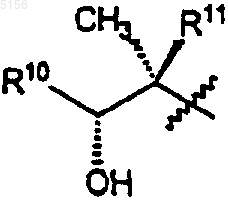
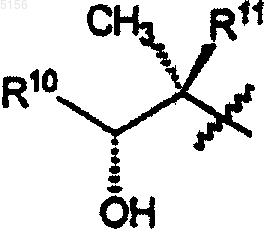
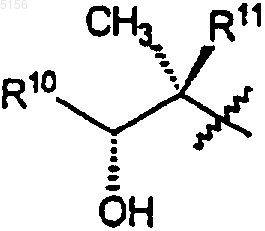
R10 представляет собой C2-C8алкил;
R11 представляет собой водород или -OH и
R15 представляет собой H или -CH2N(водород, C1-C10алкил, C2-C10алкенил или C2-C10алкинил)(водород, C1-C10алкил, C2-C10алкенил или C2-C10алкинил), при условии, что когда R15 представляет собой H, R10 не представляет собой этил.
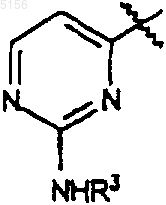
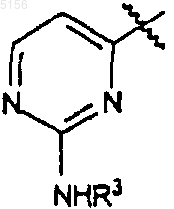
3. Соединение по п.2, где R1 представляет собой
 ,
,
R6 представляет собой H и
R9 представляет собой кладинозил.
4. Соединение по п.1, где R1 представляет собой
или
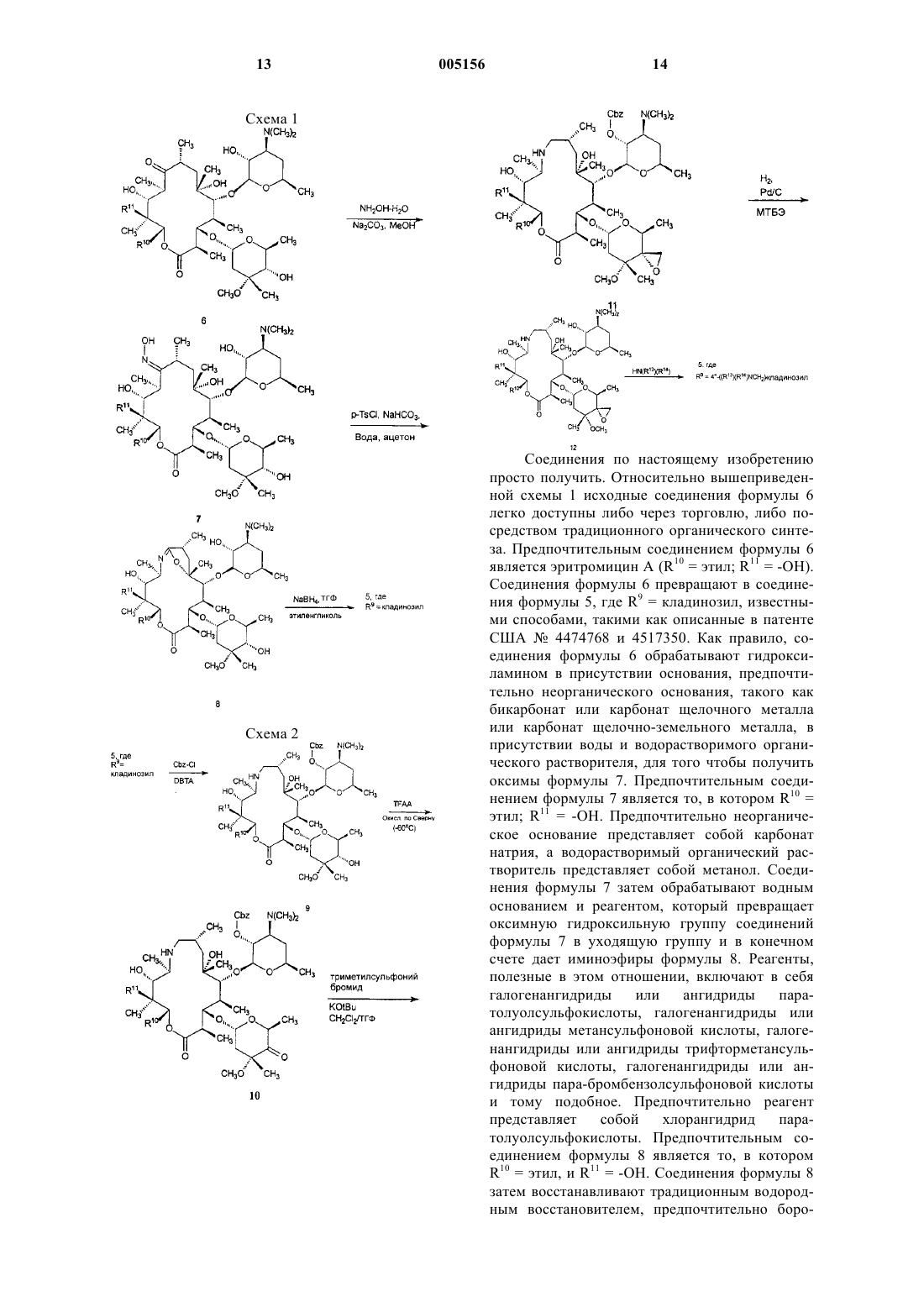
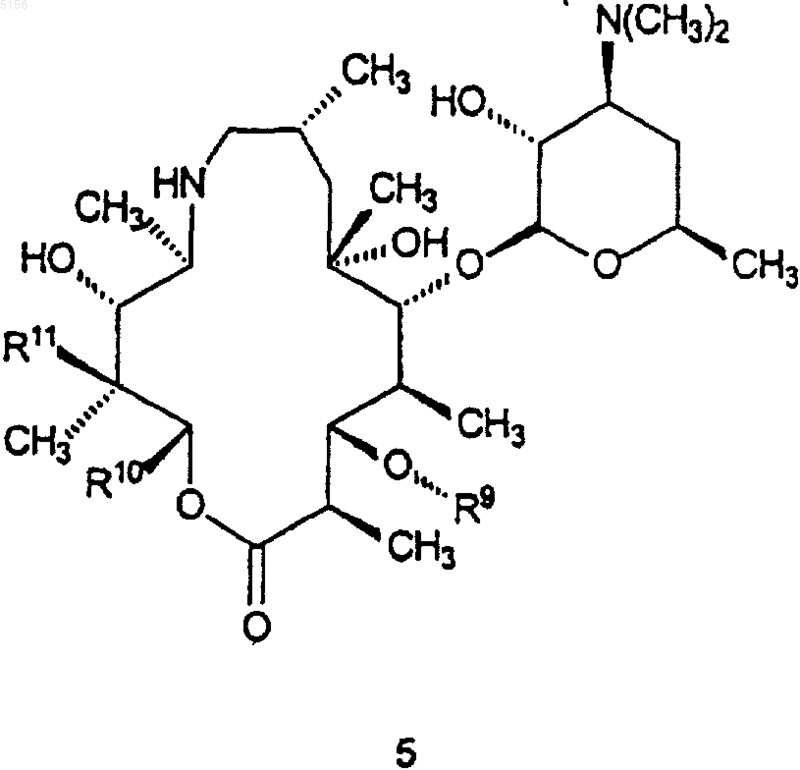
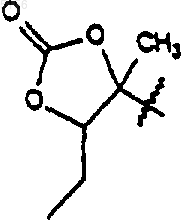
5. Соединение по п.2, имеющее формулу 3
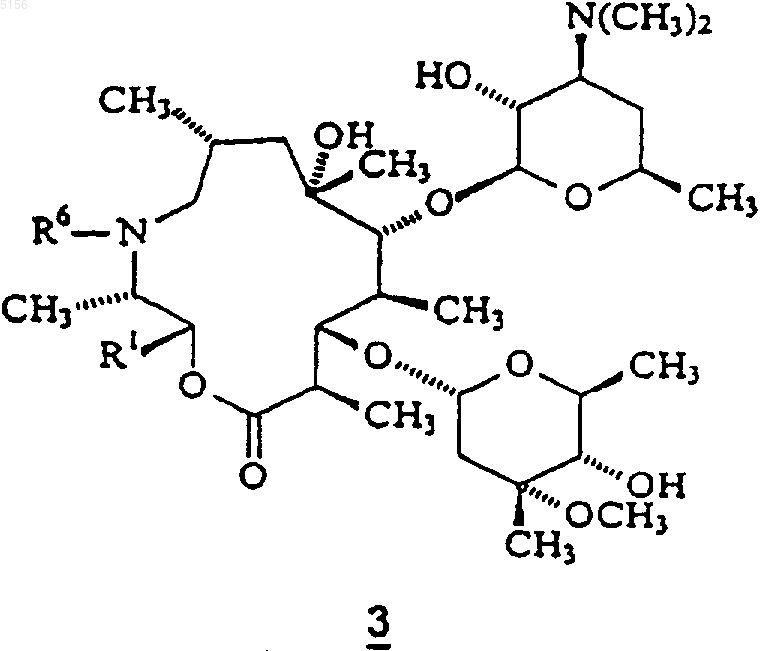
6. Соединение, имеющее формулу 3
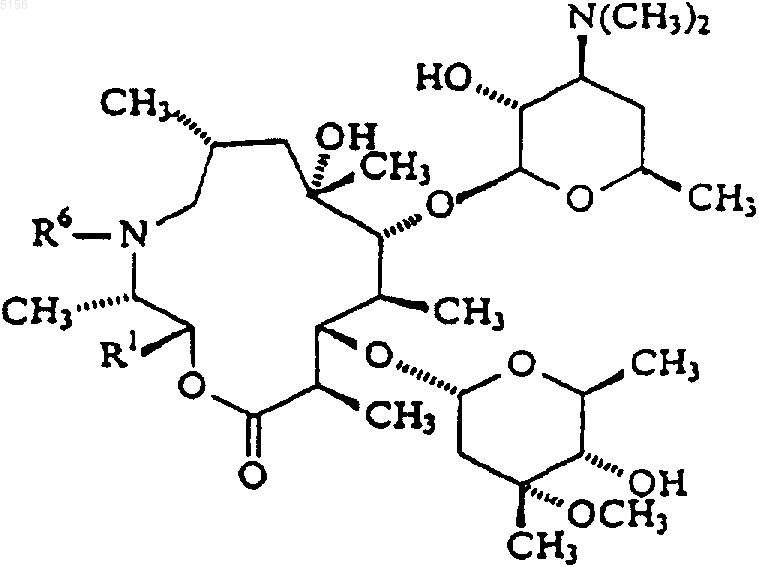
выбранное из группы, состоящей из
соединения, где R1 представляет собой ацетил и R6 представляет собой водород;
соединения, где R1 представляет собой 3-N,N-диметиламино-2-пропеноил и R6 представляет собой водород;
соединения, где R1 представляет собой 3-пиразолил и R6 представляет собой водород;
соединения, где R1 представляет собой ацетил и R6 представляет собой метил;
соединения, где R1 представляет собой 3-N,N-диметиламино-2-пропеноил и R6 представляет собой метил;
соединения, где R1 представляет собой 3-пиразолил и R6 представляет собой метил;
соединения, где R1 представляет собой 1-N-метил-3-пиразолил и R6 представляет собой метил;
соединения, где R1 представляет собой 1-N-бензил-3-пиразолил и R6 представляет собой метил;
соединения, где R1 представляет собой 1-N-(3-гидроксибензил)-3-пиразолил и R6 представляет собой метил;
соединения, где R1 представляет собой 2-((4-фторфенил)амино)-4-пиримидинил и R6 представляет собой метил;
соединения, где R1 представляет собой 2-(фениламино)-4-пиримидинил и R6 представляет собой метил; и
соединения, где R1 представляет собой 1-N-метил-5-пиразолил и R6 представляет собой метил.
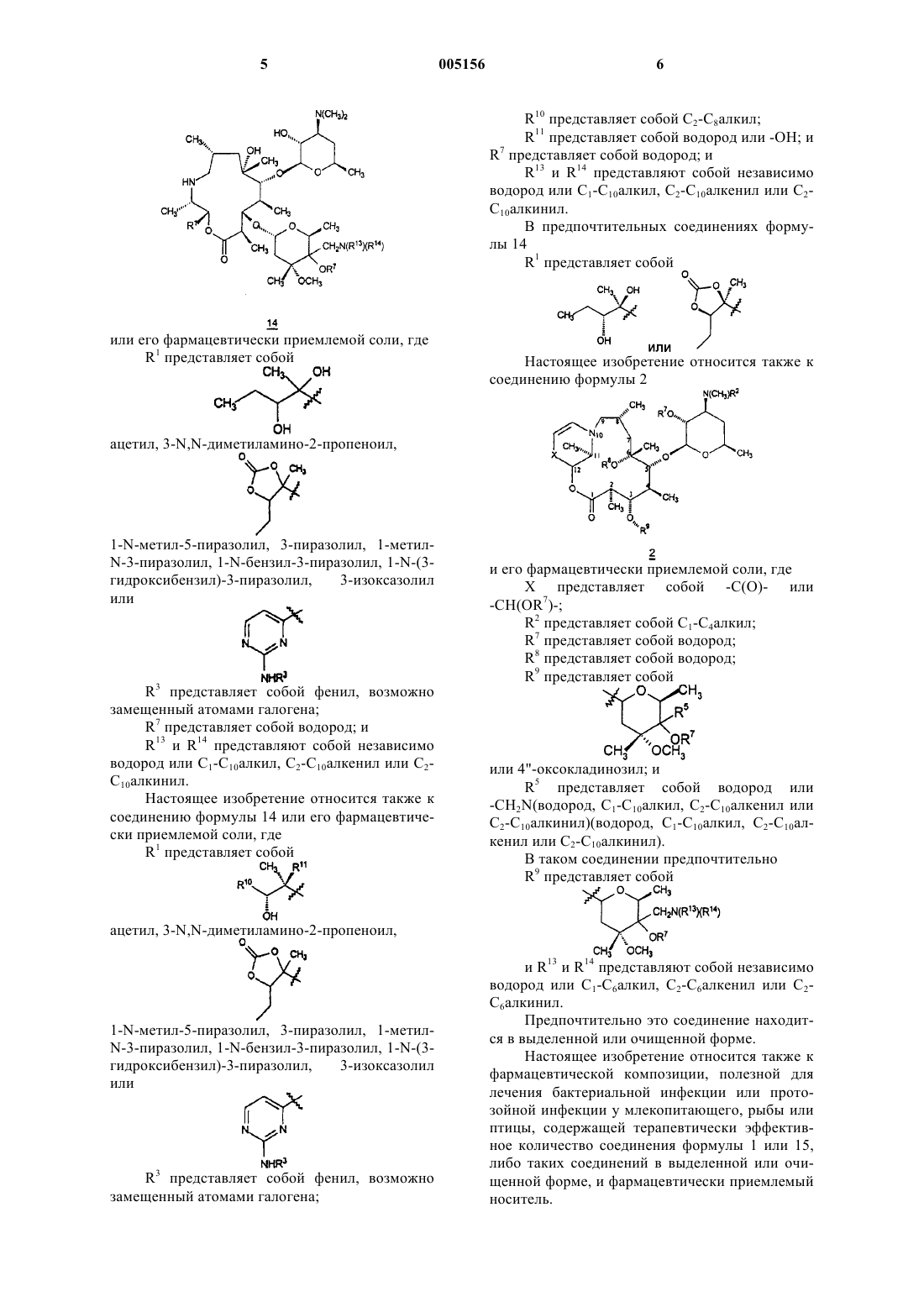
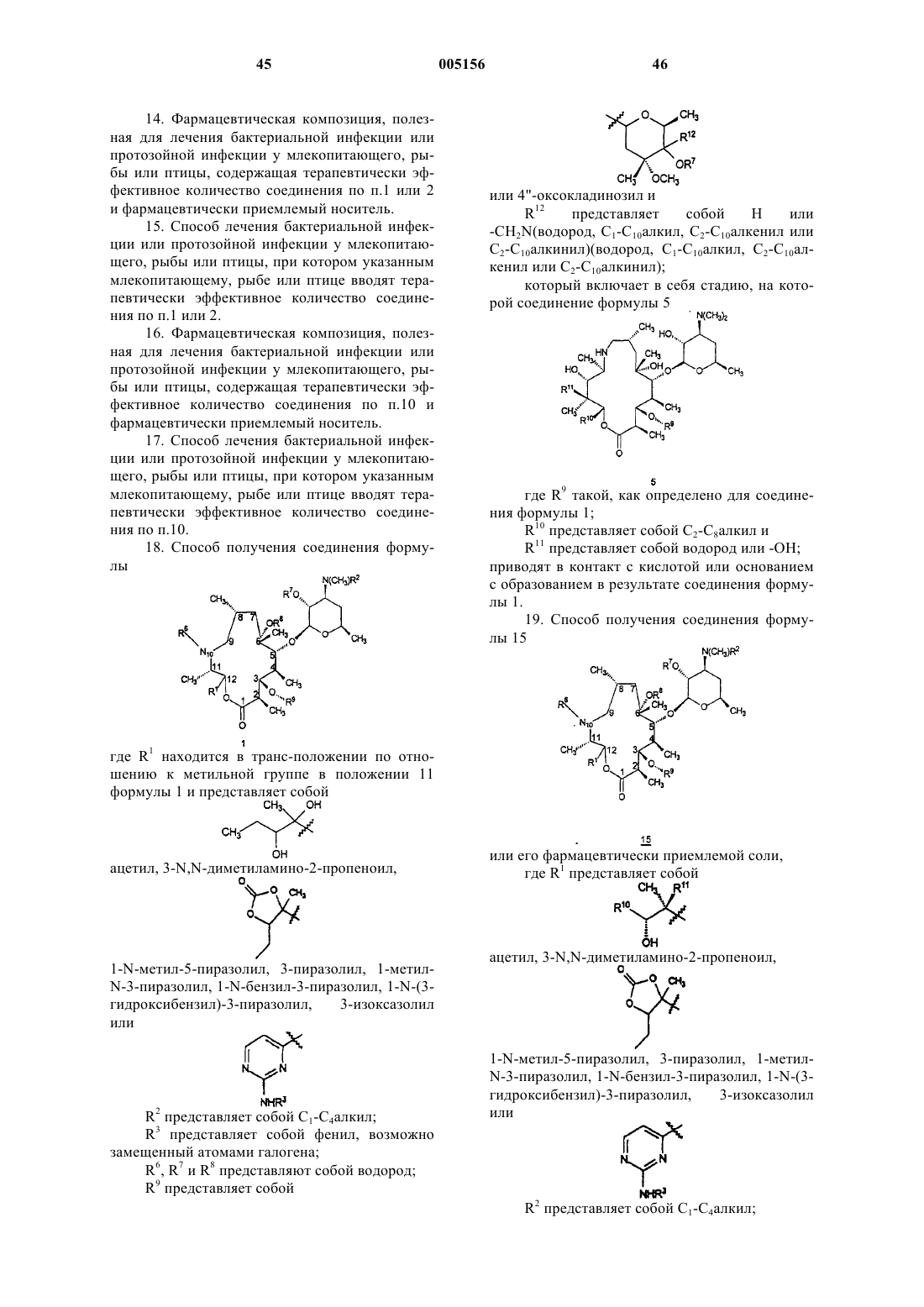
7. Соединение формулы 14
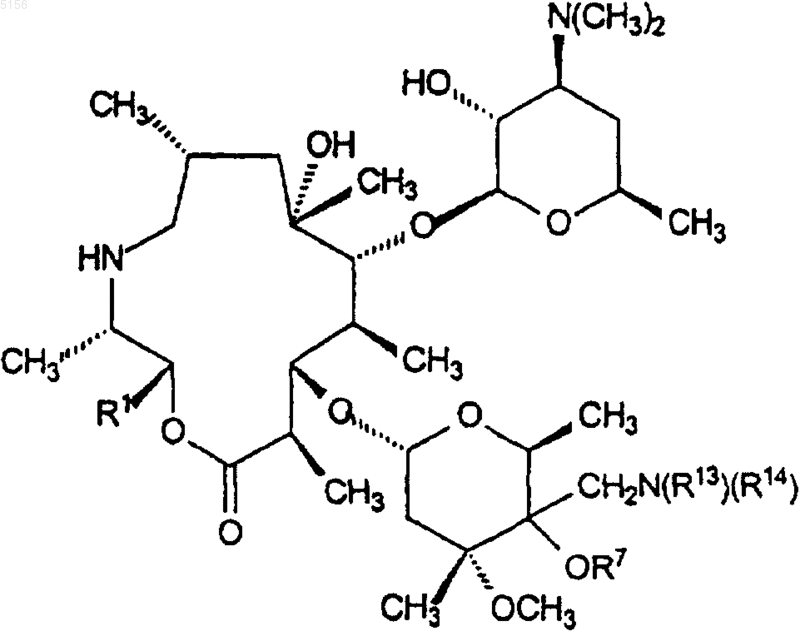
или его фармацевтически приемлемая соль,
где R1 представляет собой
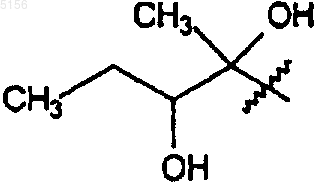 ,
,
ацетил, 3-N,N-диметиламино-2-пропеноил,
 ,
,
1-N-метил-5-пиразолил, 3-пиразолил, 1-метил-N-3-пиразолил, 1-N-бензил-3-пиразолил, 1-N-(3-гидроксибензил)-3-пиразолил, 3-изоксазолил или
R3 такое, как определено в п.1;
R7 представляет собой водород и
R13 и R14 представляют собой независимо водород или C1-C10алкил, C2-C10алкенил или C2-C10алкинил.
8. Соединение формулы 14

или его фармацевтически приемлемая соль,
где R1 представляет собой
 ,
,
ацетил, 3-N,N-диметиламино-2-пропеноил,
 ,
,
1-N-метил-5-пиразолил, 3-пиразолил, 1-метил-N-3-пиразолил, 1-N-бензил-3-пиразолил, 1-N-(3-гидроксибензил)-3-пиразолил, 3-изоксазолил или
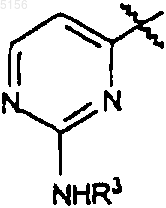
R10, R11 и R3 такие, как определено в п.2;
R7 представляет собой водород и
R13 и R14 представляют собой независимо водород или C1-C10алкил, C2-C10алкенил или C2-C10алкинил.
9. Соединение по п.7 или 8, где R1 представляет собой
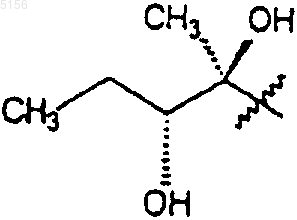
или
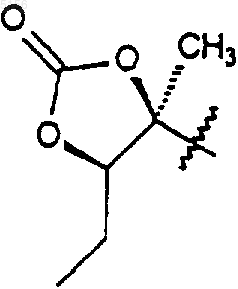
10. Соединение по п.1 или 2 в выделенной или очищенной форме.
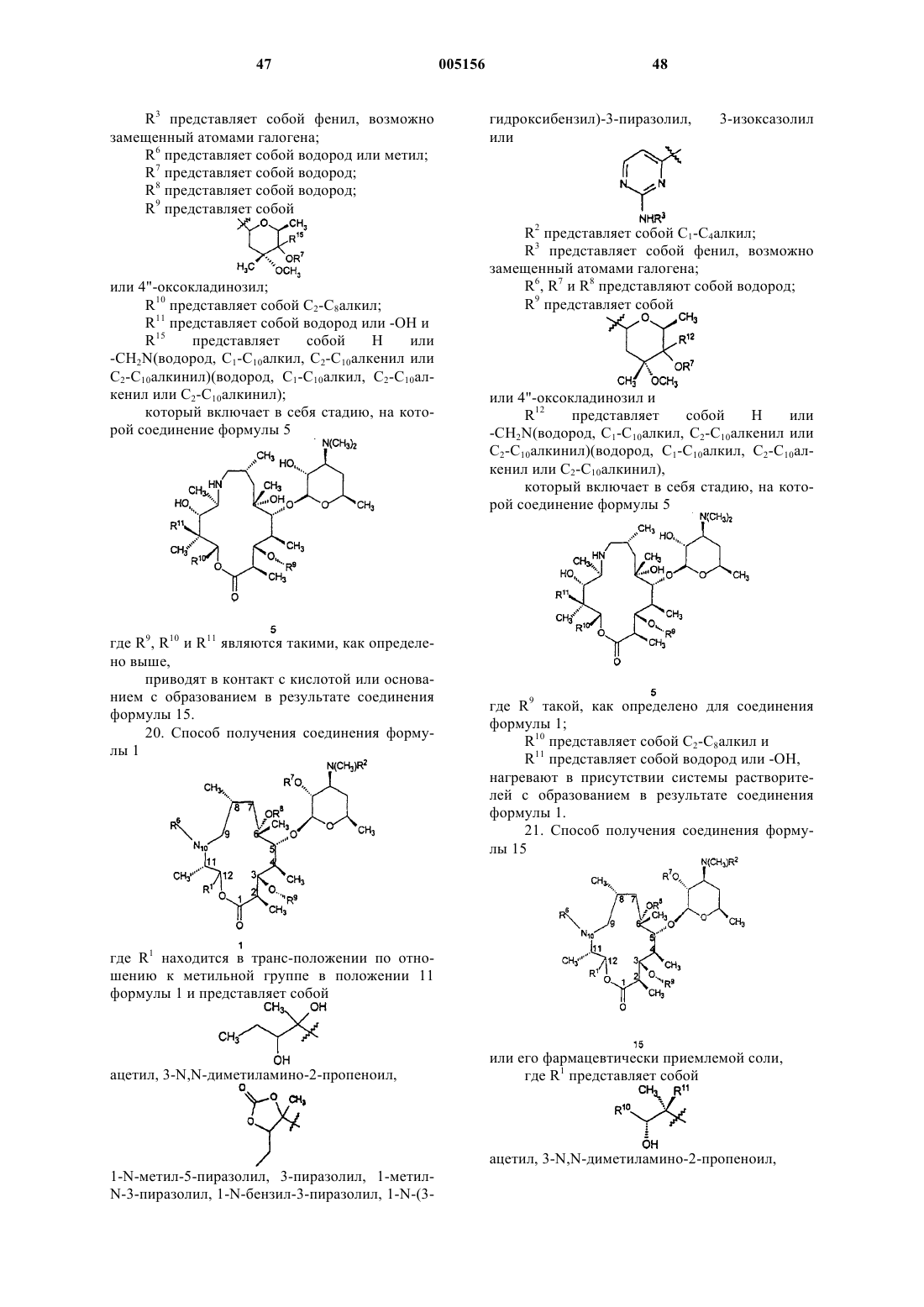
11. Соединение формулы 2
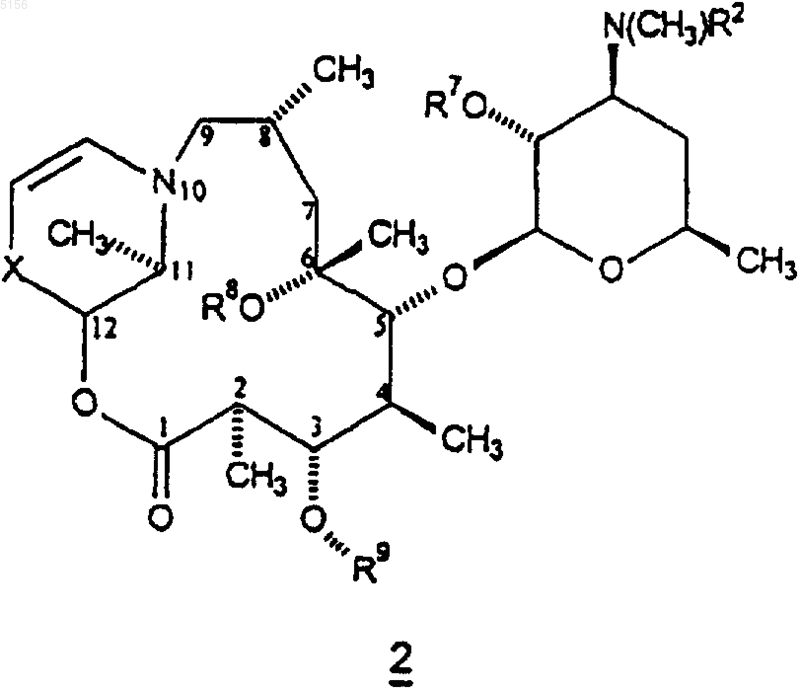
и его фармацевтически приемлемая соль,
где X представляет собой -C(O)- или -CH(OR7)-;
R2 представляет собой C1-C4алкил;
R7 представляет собой водород;
R8 представляет собой водород;
R9 представляет собой
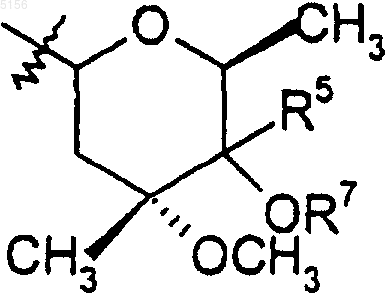
или 4"-оксокладинозил и
R5 представляет собой водород шыш -CH2N(водород, C1-C10алкил, C2-C10алкенил или C2-C10алкинил)(водород, C1-C10алкил, C2-C10алкенил или C2-C10алкинил).
12. Соединение по п.11, где R9 представляет собой
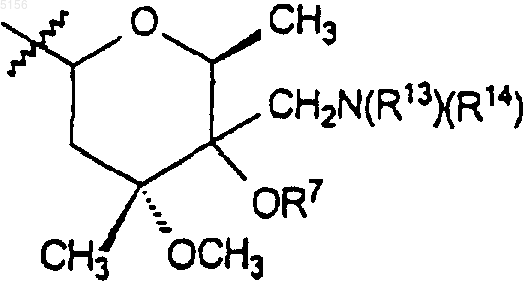
и R13 и R14 представляют собой независимо водород или C1-C6алкил, C2-C6алкенил или C2-C6алкинил.
13. Соединение по п.11 в выделенной или очищенной форме.
14. Фармацевтическая композиция, полезная для лечения бактериальной инфекции или протозойной инфекции у млекопитающего, рыбы или птицы, содержащая терапевтически эффективное количество соединения по п.1 или 2 и фармацевтически приемлемый носитель.
15. Способ лечения бактериальной инфекции или протозойной инфекции у млекопитающего, рыбы или птицы, при котором указанным млекопитающему, рыбе или птице вводят терапевтически эффективное количество соединения по п.1 или 2.
16. Фармацевтическая композиция, полезная для лечения бактериальной инфекции или протозойной инфекции у млекопитающего, рыбы или птицы, содержащая терапевтически эффективное количество соединения по п.10 и фармацевтически приемлемый носитель.
17. Способ лечения бактериальной инфекции или протозойной инфекции у млекопитающего, рыбы или птицы, при котором указанным млекопитающему, рыбе или птице вводят терапевтически эффективное количество соединения по п.10.
18. Способ получения соединения формулы
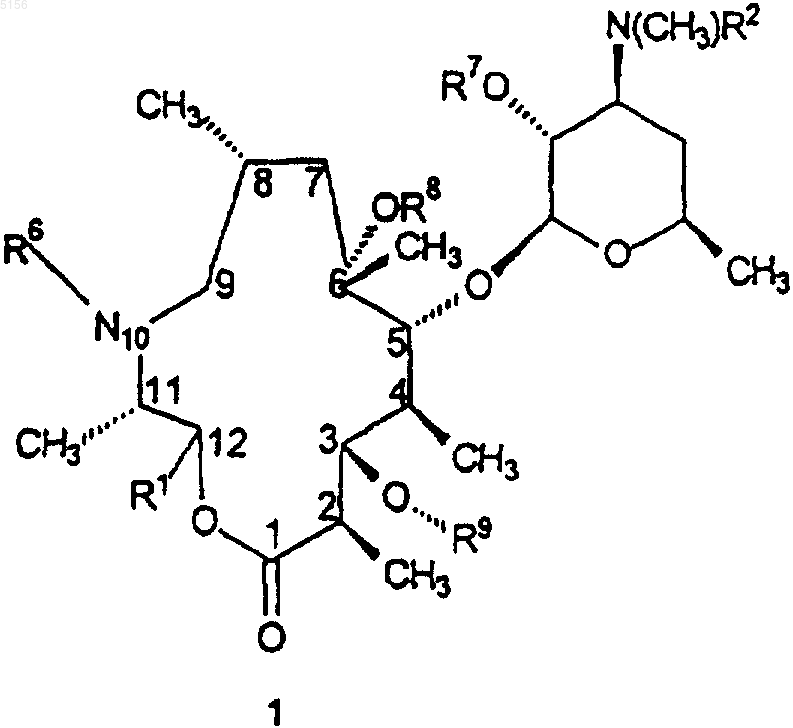
где R1 находится в транс-положении по отношению к метильной группе в положении 11 формулы 1 и представляет собой
ацетил, 3-N,N-диметиламино-2-пропеноил,
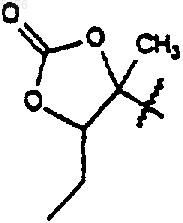
1-N-метил-5-пиразолил, 3-пиразолил, 1-метил-N-3-пиразолил, 1-N-бензил-3-пиразолил, 1-N-(3-гидроксибензил)-3-пиразолил, 3-изоксазолил или
R2 представляет собой C1-C4алкил;
R3 представляет собой фенил, возможно замещенный атомами галогена;
R6, R7 и R8 представляют собой водород;
R9 представляет собой
или 4"-оксокладинозил и
R12 представляет собой H или -CH2N(водород, C1-C10алкил, C2-C10алкенил или C2-C10алкинил)(водород, C1-C10алкил, C2-C10алкенил или C2-C10алкинил);
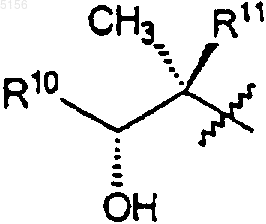
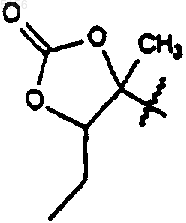
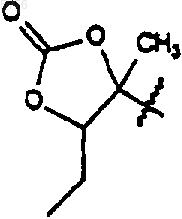
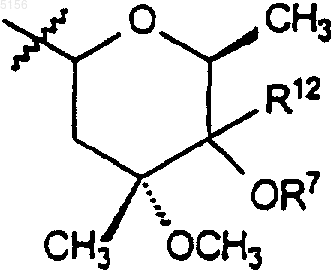
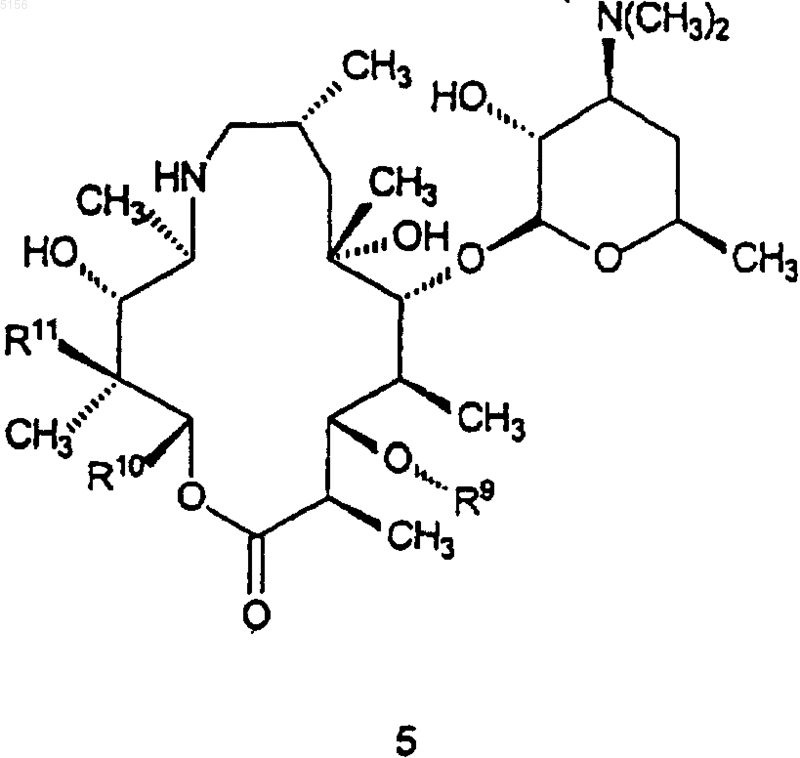
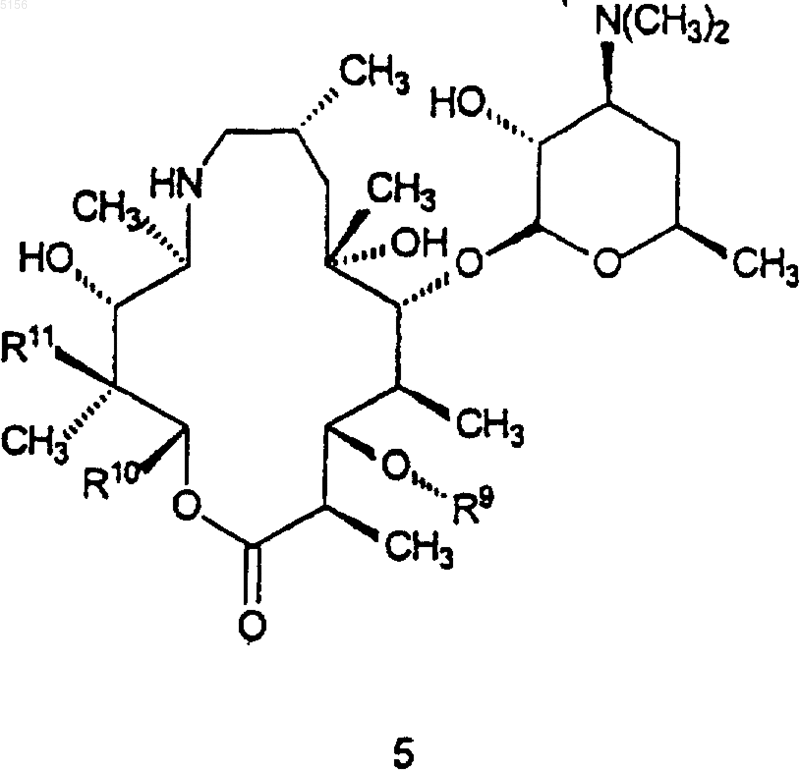
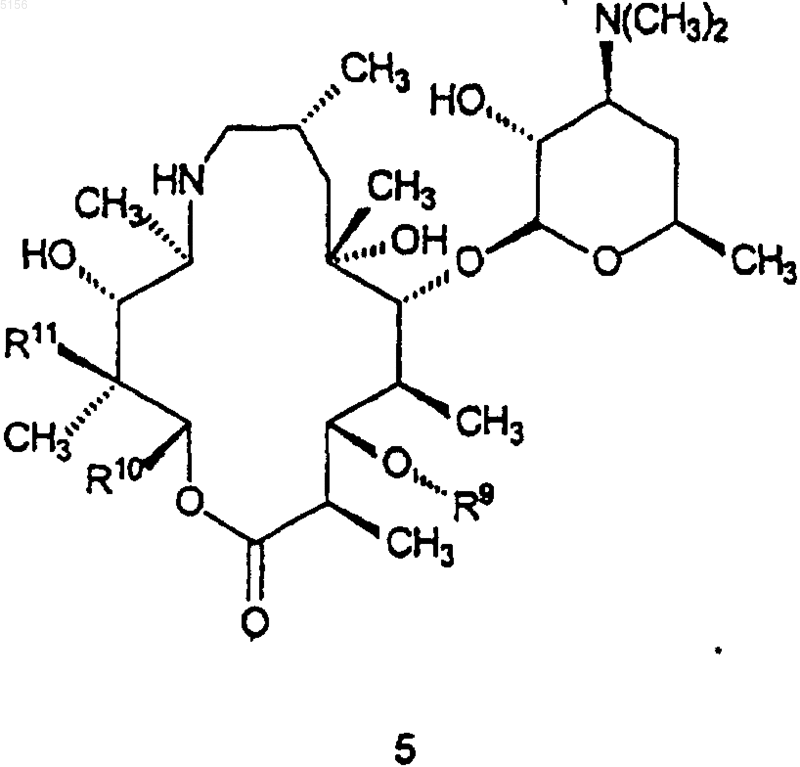
который включает в себя стадию, на которой соединение формулы 5
где R9 такой, как определено для соединения формулы 1;
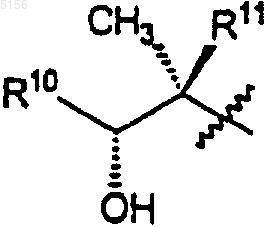
R10 представляет собой C2-C8алкил и
R11 представляет собой водород или -OH;
приводят в контакт с кислотой или основанием с образованием в результате соединения формулы 1.
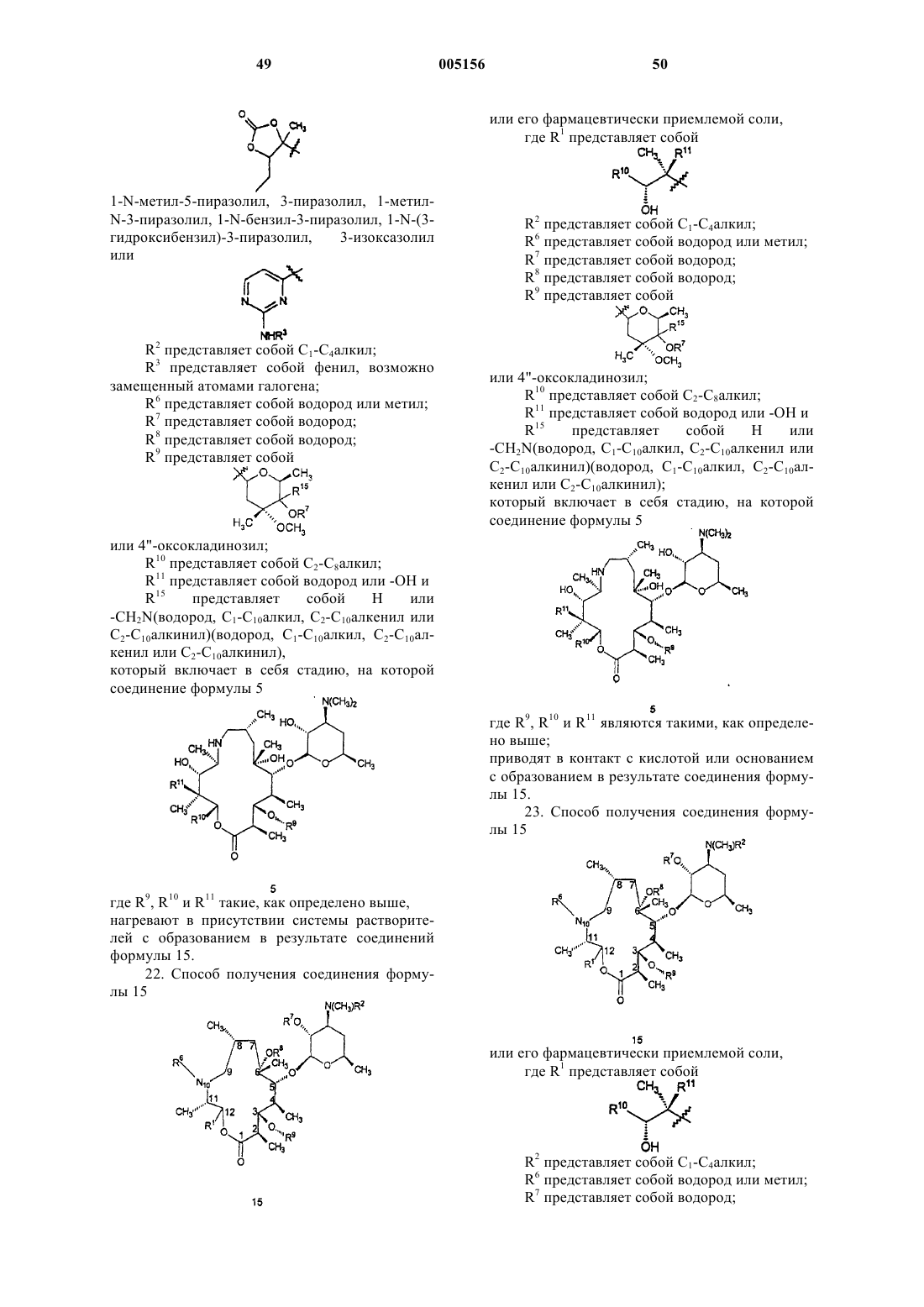
19. Способ получения соединения формулы 15
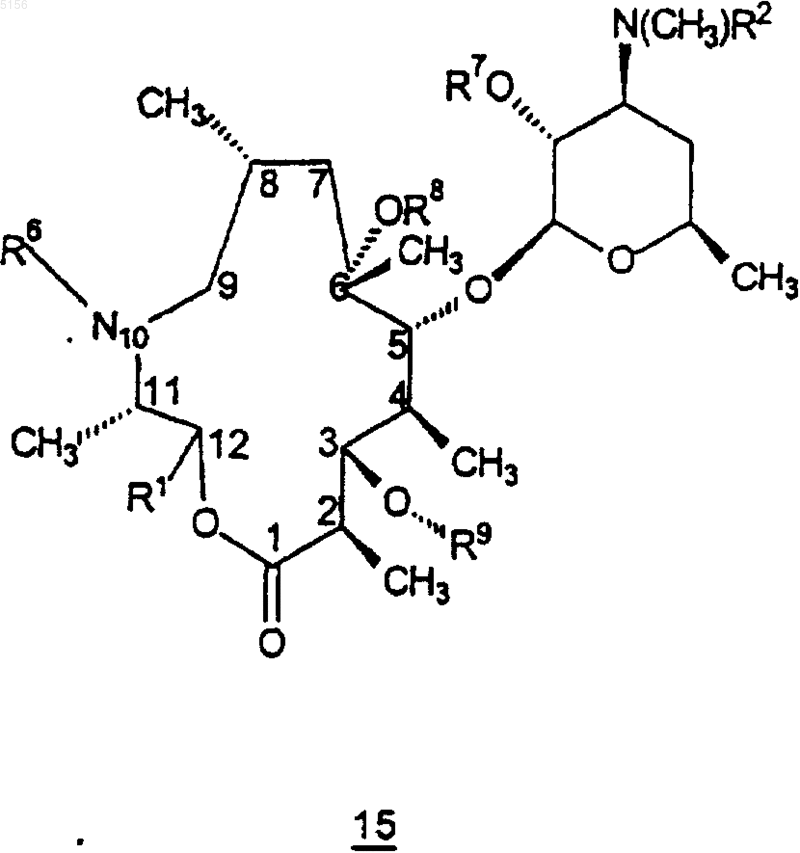
или его фармацевтически приемлемой соли,
где R1 представляет собой
ацетил, 3-N,N-диметиламино-2-пропеноил,
1-N-метил-5-пиразолил, 3-пиразолил, 1-метил-N-3-пиразолил, 1-N-бензил-3-пиразолил, 1-N-(3-гидроксибензил)-3-пиразолил, 3-изоксазолил или
R2 представляет собой C1-C4алкил;
R3 представляет собой фенил, возможно замещенный атомами галогена;
R6 представляет собой водород или метил;
R7 представляет собой водород;
R8 представляет собой водород;
R9 представляет собой
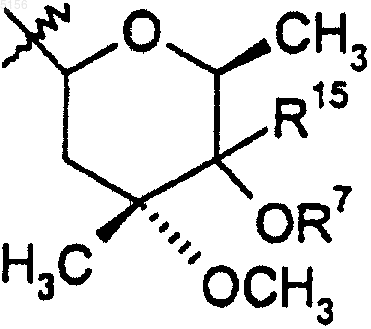
или 4"-оксокладинозил;
R10 представляет собой C2-C8алкил;
R11 представляет собой водород или -OH и
R15 представляет собой H или -CH2N(водород, C1-C10алкил, C2-C10алкенил или C2-C10алкинил)(водород, C1-C10алкил, C2-C10алкенил или C2-C10алкинил);
который включает в себя стадию, на которой соединение формулы 5
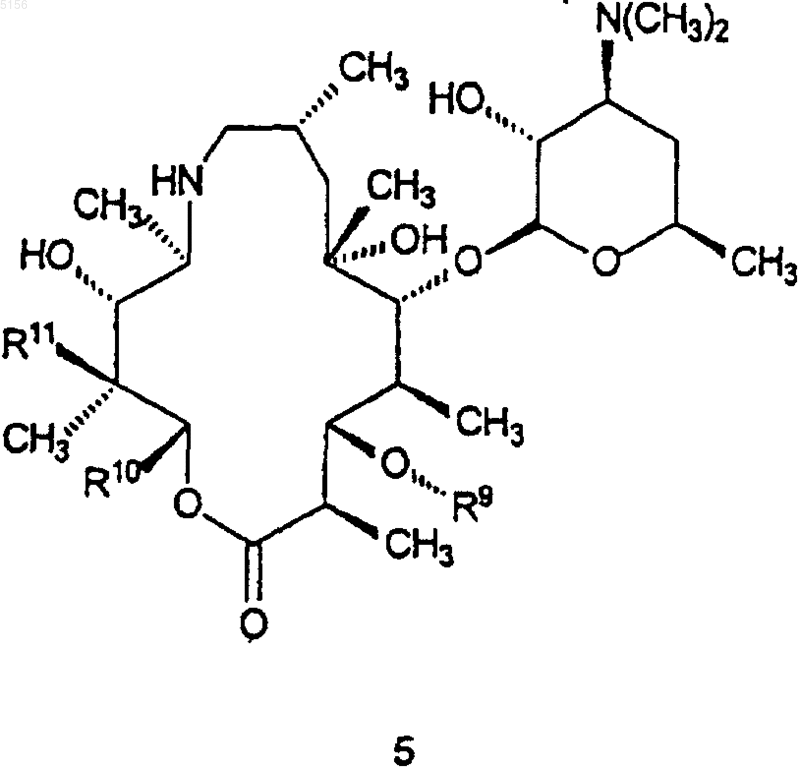
где R9, R10 и R11 являются такими, как определено выше,
приводят в контакт с кислотой или основанием с образованием в результате соединения формулы 15.
20. Способ получения соединения формулы 1
где R1 находится в транс-положении по отношению к метильной группе в положении 11 формулы 1 и представляет собой
ацетил, 3-N,N-диметиламино-2-пропеноил,
1-N-метил-5-пиразолил, 3- пиразолил, 1-метил-N-3-пиразолил, 1-N-бензил-3-пиразолил, 1-N-(3-гидроксибензил)-3-пиразолил, 3-изоксазолил или
R2 представляет собой C1-C4алкил;
R3 представляет собой фенил, возможно замещенный атомами галогена;
R6, R7 и R8 представляют собой водород;
R9 представляет собой
или 4"-оксокладинозил и
R12 представляет собой H или -CH2N(водород, C1-C10алкил, C2-C10алкенил или C2-C10алкинил)(водород, C1-C10алкил, C2-C10алкенил или C2-C10алкинил),
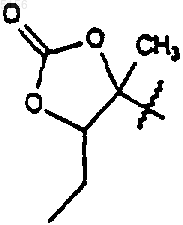
который включает в себя стадию, на которой соединение формулы 5
где R9 такой, как определено для соединения формулы 1;
R10 представляет собой C2-C8алкил и
R11 представляет собой водород или -OH,
нагревают в присутствии системы растворителей с образованием в результате соединения формулы 1.
21. Способ получения соединения формулы 15

или его фармацевтически приемлемой соли,
где R1 представляет собой
ацетил, 3-N,N-диметиламино-2-пропеноил,
1-N-метил-5-пиразолил, 3-пиразолил, 1-метил-N-3-пиразолил, 1-N-бензил-3-пиразолил, 1-N-(3-гидроксибензил)-3-пиразолил, 3-изоксазолил или
R2 представляет собой C1-C4алкил;
R3 представляет собой фенил, возможно замещенный атомами галогена;
R6 представляет собой водород или метил;
R7 представляет собой водород;
R8 представляет собой водород;
R9 представляет собой
или 4"-оксокладинозил;
R10 представляет собой C2-C8алкил;
R11 представляет собой водород или -OH и
R15 представляет собой H или -CH2N(водород, C1-C10алкил, C2-C10алкенил или C2-C10алкинил)(водород, C1-C10алкил, C2-C10алкенил или C2-C10алкинил),
который включает в себя стадию, на которой соединение формулы 5
где R9, R10 и R11 такие, как определено выше,
нагревают в присутствии системы растворителей с образованием в результате соединений формулы 15.
22. Способ получения соединения формулы 15
или его фармацевтически приемлемой соли,
где R1 представляет собой
R2 представляет собой C1-C4алкил;
R6 представляет собой водород или метил;
R7 представляет собой водород;
R8 представляет собой водород;
R9 представляет собой
или 4"-оксокладинозил;
R10 представляет собой C2-C8алкил;
R11 представляет собой водород или -OH и
R15 представляет собой H или -CH2N(водород, C1-C10алкил, C2-C10алкенил или C2-C10алкинил)(водород, C1-C10алкил, C2-C10алкенил или C2-C10алкинил);
который включает в себя стадию, на которой соединение формулы 5
где R9, R10 и R11 являются такими, как определено выше;
приводят в контакт с кислотой или основанием с образованием в результате соединения формулы 15.
23. Способ получения соединения формулы 15
или его фармацевтически приемлемой соли,
где R1 представляет собой
R2 представляет собой C1-C4алкил;
R6 представляет собой водород или метил;
R7 представляет собой водород;
R8 представляет собой водород;
R9 представляет собой
или 4"-оксокладинозил;
R10 представляет собой C2-C8алкил;
R11 представляет собой водород или -OH и
R15 представляет собой H или -CH2N(водород, C1-C10алкил, C2-C10алкенил или C2-C10алкинил)(водород, C1-C10алкил, C2-C10алкенил или C2-C10алкинил),
который включает в себя стадию, на которой соединение формулы 5
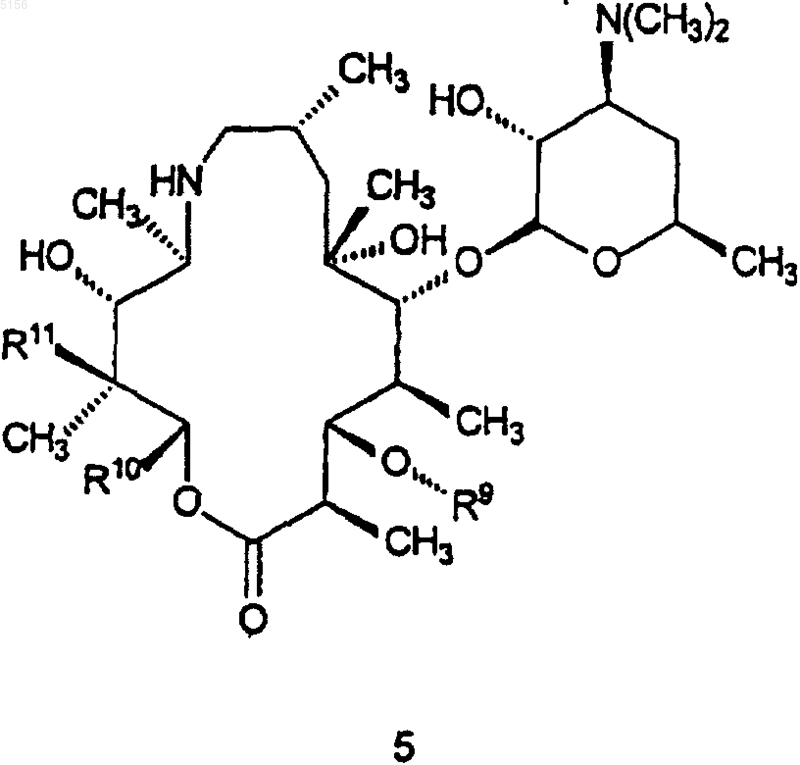
где R9, R10 и R11 являются такими, как определено выше;
нагревают в присутствии системы растворителей с образованием в результате соединения формулы 15.
24. Способ по любому из пп.20, 21 или 23, где система растворителей содержит растворитель, выбранный из группы, состоящей из низших спиртов, диэтилового эфира, ацетона, ацетонитрила, тетрагидрофурана, этилацетата, бензола, толуола, хлороформа, метиленхлорида, диметилформамида, диметилсульфоксида, N-метилпирролидинона и их смесей.
25. Способ по любому из пп.20, 21 или 23, где система растворителей дополнительно содержит протонный растворитель.
26. Способ по п.25, где протонный растворитель выбран из группы, состоящей из метанола, этанола, н-пропанола, изопропанола, н-бутанола, изобутанола, втор-бутанола, фенола, галогенофенолов, нафтолов, воды и их смесей.
Текст
1 Предпосылки изобретения Данное изобретение относится к новым 13 членным азалидам, которые полезны в качестве антибактериальных и антипротозойных агентов для млекопитающих, включая человека, а также для рыбы и птиц. Данное изобретение также относится к фармацевтическим композициям,содержащим эти новые соединения, и к способам лечения бактериальных инфекций и протозойных инфекций у млекопитающих, рыбы и птиц, при которых новые соединения вводят млекопитающим, рыбе и птицам, которым требуется такое лечение. Известно, что макролидные антибиотики полезны при лечении широкого спектра бактериальных инфекций и протозойных инфекций у млекопитающих, рыбы и птиц. Такие антибиотики включают различные производные эритромицина А, такие как азитромицин. Азитромицин имеется в продаже и на него ссылаются в патентах США 4474768 и 4517359, которые полностью включены в данное описание изобретения посредством ссылки. Дополнительные макролиды упоминаются в заявке на патент США с серийным номером 60/063676, поданной 29 октября 1997 г. (YongJin Wu), в заявке США с порядковым номером 60/063161, поданной 29 октября 1997 г. (YongJin Wu), в заявке США с порядковым номером 60/054866, поданной 6 августа 1997 г. (HirokoLeadlay, James Stauton and Jesus Cortes), в заявке США с порядковым номером 60/070358, поданной 2 января 1998 г. (Yong-Jin Wu), заявке США с порядковым номером 60/070343, поданной 2 января 1998 г. (Dirlam) и заявке США с порядковым номером 60/097075, поданной 19 августа 1998 г. (Hengmiao Cheng, Michael A. Letavic,Carl В. Ziegler, Jason K. Dutra, Brian S. Bronk),все из которых полностью включены в данное описание изобретения посредством ссылки. Поскольку вышеуказанные патенты и заявки на патенты не признаются уровнем техники в отношении настоящей заявки, остается необходимость в уровне техники в отношении легкодоступных, 13-членных азалидных анти 005156 2 биотических соединениях, которые обладают сильной активностью против широкого спектра бактерий и простейших. Подобно азитромицину и другим макролидным антибиотикам, новые макролидные соединения по настоящему изобретению обладают сильной активностью против различных бактериальных и протозойных инфекций, таких как описанные ниже. Краткое изложение сущности изобретения Настоящее изобретение относится к соединению формулы 1 или его фармацевтически приемлемой соли, гдеR3 представляет собой фенил, возможно замещенный атомами галогена;R6 представляет собой водород или метил;R7 представляет собой водород или бензилоксикарбонил;(водород, C1-С 10 алкил, С 2-С 10 алкенил или С 2 С 10 алкинил). Предпочтительные соединения формулы 1 включают в себя соединения, в которых Настоящее изобретение также относится к соединению формулы 15 или его фармацевтически приемлемой соли, гдеR3 представляет собой фенил, возможно замещенный атомами галогена;R6 представляет собой водород или метил;R7 представляет собой водород или бензилоксикарбонил;R11 представляет собой водород или -ОН; иR15 представляет собой Н, R10 не представляет собой этил. Предпочтительные соединения формулы 15 включают в себя соединения, в которыхR9 представляет собой кладинозил. Предпочтительное соединение формулы 15 имеет формулу 3 Настоящее изобретение относится также к соединениям формулы 3, выбранным из группы,состоящей из соединения, где R1 представляет собой ацетил и R6 представляет собой водород; соединения, где R1 представляет собой 3N,N-диметиламино-2-пропеноил и R6 представляет собой водород; соединения, где R1 представляет собой 3 пиразолил и R6 представляет собой водород; соединения, где R1 представляет собой ацетил и R6 представляет собой метил; соединения, где R1 представляет собой 3N,N-диметиламино-2-пропеноил и R6 представляет собой метил; соединения, где R1 представляет собой 3 пиразолил и R6 представляет собой метил; соединения, где R1 представляет собой 1N-метил-3-пиразолил и R6 представляет собой метил; соединения, где R1 представляет собой 1N-бензил-3-пиразолил и R6 представляет собой метил; соединения, где R1 представляет собой 1N-(3-гидроксибензил)-3-пиразолил и R6 представляет собой метил; соединения, где R1 представляет собой 24-фторфенил)амино)-4-пиримидинил и R6 представляет собой метил; соединения, где R1 представляет собой 2(фениламино)-4-пиримидинил и R6 представляет собой метил; и соединения, где R1 представляет собой 1N-метил-5-пиразолил и R6 представляет собой метил. Настоящее изобретение относится также к соединениям формулы 1 и 15 в выделенной или очищенной форме. Настоящее изобретение относится также к соединению формулы 14R11 представляет собой водород или -ОН; и 7R13 и R14 представляют собой независимо водород или C1-С 10 алкил, С 2-С 10 алкенил или С 2 С 10 алкинил. В предпочтительных соединениях формулы 14 или его фармацевтически приемлемой соли, где Настоящее изобретение относится также к соединению формулы 2R3 представляет собой фенил, возможно замещенный атомами галогена;R13 и R14 представляют собой независимо водород или C1-С 10 алкил, С 2-С 10 алкенил или C2 С 10 алкинил. Настоящее изобретение относится также к соединению формулы 14 или его фармацевтически приемлемой соли, где и его фармацевтически приемлемой соли, где Х представляет собой -С(O)- илиR5 представляет собой водород илиR3 представляет собой фенил, возможно замещенный атомами галогена; и R13 и R14 представляют собой независимо водород или C1-С 6 алкил, С 2-С 6 алкенил или С 2 С 6 алкинил. Предпочтительно это соединение находится в выделенной или очищенной форме. Настоящее изобретение относится также к фармацевтической композиции, полезной для лечения бактериальной инфекции или протозойной инфекции у млекопитающего, рыбы или птицы, содержащей терапевтически эффективное количество соединения формулы 1 или 15,либо таких соединений в выделенной или очищенной форме, и фармацевтически приемлемый носитель. 7 Настоящее изобретение относится также к способу лечения бактериальной инфекции или протозойной инфекции у млекопитающего, рыбы или птицы, при котором указанным млекопитающему, рыбе или птице вводят терапевтически эффективное количество соединения формулы 1 или 15, либо таких соединений в выделенной или очищенной форме. Настоящее изобретение относится также к способу получения соединения формулы 1, где(водород, С 1-С 10 алкил, С 2-С 10 алкенил или C2 С 10 алкинил); который включает в себя стадию,на которой соединение формулы 5 где R9 такой, как определено для соединения формулы 1;R11 представляет собой водород или -ОН;(а) приводят в контакт с кислотой или основанием с образованием в результате соединения формулы 1; либо(б) нагревают в присутствии системы растворителей с образованием в результате соединения формулы 1. Также настоящее изобретение относится к способу получения соединения формулы 15 или его фармацевтически приемлемой соли, гдеR7 представляет собой водород; который включает в себя стадию, на которой соединение формулы 5(а) приводят в контакт с кислотой или основанием с образованием в результате соединения формулы 15,(б) нагревают в присутствии системы растворителей с образованием в результате соединений формулы 15. Также настоящее изобретение относится к способу получения соединения формулы 15 или его фармацевтически приемлемой соли, где 8 который включает в себя стадию, на которой соединение формулы 5(а) приводят в контакт с кислотой или основанием с образованием в результате соединения формулы 15; либо(б) нагревают в присутствии системы растворителей с образованием в результате соединения формулы 15. Предпочтительно в тех способах, где используют систему растворителей, эта система растворителей содержит растворитель, выбранный из группы, состоящей из низших спиртов,диэтилового эфира, ацетона, ацетонитрила, тетрагидрофурана, этилацетата, бензола, толуола,хлороформа, метиленхлорида, диметилформамида, диметилсульфоксида, N-метилпирролидинона и их смесей. Более предпочтительно, когда система растворителей дополнительно содержит протонный растворитель. Такой протонный растворитель целесообразно выбирать из группы, состоящей из метанола, этанола, н-пропанола,изопропанола, н-бутанола, изобутанола, вторбутанола, фенола, галогенофенолов, нафтолов,воды и их смесей. Термин "лечение" при использовании здесь, если не указано иного, включает в себя лечение или предупреждение бактериальной инфекции или протозойной инфекции как предложено в способе по настоящему изобретению. При использовании здесь, если не указано иного, выражения "бактериальная(ые) инфекция(и)" и "протозойная(ые) инфекция(и)" включают в себя бактериальные инфекции и протозойные инфекции, которые встречаются у млекопитающих, рыбы и птиц, а также расстройства, связанные с бактериальными инфекциями или протозойными инфекциями, которые можно лечить или предупреждать путем введения таких антибиотиков, как соединения по настоящему изобретению. Такие бактериальные инфекции и протозойные инфекции и расстройства, связанные с такими инфекциями, включают в себя следующие: пневмонию, средний отит, синусит, бронхит, тонзиллит и мастоидит,связанные с инфекцией Streptococcus pneumoniae, Haemophilus influenzae, Moraxella catarrhalis, Staphylococcus aureus или Peptostreptococcuspneumophila, Streptococcus pneumoniae, Haemophilus influenzae или Chlamydia pneumoniae; неосложненные инфекции кожи и мягких тканей, абсцессы, и остеомиелит, и послеродовая лихорадка, связанные с инфекцией Staphylococcus aureus, коагулазоположительными стафилококками (то есть S. epidermidis, S. hemolyticus и так далее), Streptococcus pyogenes, Strepto 9henselae; неосложненные острые инфекции мочевых путей, связанные с инфекцией Staphylococcus saprophyticus или Enterococcus spp; уретрит и цервицит; и венерические заболевания, связанные с инфекцией Chlamydia trachomatis, Haemophilus ducreyi, Treponema pallidum, Ureaplasma urealyticum или Neiserria gonorrheae; токсинные заболевания, связанные с инфекцией S. aureus (пищевая интоксикация и токсический шок) или стрептококками групп А, В и С; язвы, связанные с инфекцией HelicobacterHelicobacter pylori или Chlamydia pneumoniae. Бактериальные инфекции и протозойные инфекции и расстройства, связанные с такими инфекциями, которые можно лечить или предупредить у животных, включают в себя следующие: респираторное заболевание коров, связанное с инфекцией Р. haem., P. multocida, Mycoplasma bovis или Bordetella spp.; кишечное заболевание коров, связанное с инфекцией Е. coli или простейшими (то есть кокцидиями, криптоспоридиями и так далее); мастит молочных коров, связанный с инфекцией Staph. aureus,Strep. uberis, Strep. agalactiae, Strep. dysgalactiae,Klebsiella spp., Corynebacterium или Enterococcus 10 с инфекцией Moraxella bovis; преждевременный выкидыш у коров, связанный с инфекцией простейшими (то есть неоспорами); инфекцию мочевых путей у собак и кошек, связанную с инфекцией Е. соli; инфекции кожи и мягких тканей у собак и кошек, связанные с инфекциейStaph. epidermidis, Staph. intermedius, коагулазоотр. Staph. или Р. multocida; и зубные или ротовые инфекции у собак и кошек, связанные с инфекцией Alcaligenes spp., Bacterioides spp., Clostridium spp., Enterobacter spp., Eubacterium, Peptostreptococcus, Porphyromonas или Prevotella. Другие бактериальные инфекции и протозойные инфекции и расстройства, связанные с такими инфекциями, которые можно лечить или предупреждать согласно способу по настоящему изобретению, упоминаются в J. P. Sanford et al.,"The Sanford Guide To Antimicrobial Therapy",26th Edition, (Antimicrobial Therapy, Inc., 1996). Выражение "защитная группа гидроксила" при использовании здесь, если не указано иного,включает в себя ацетил, бензилоксикарбонил, к тому же различные защитные группы гидроксила, известные специалистам в данной области техники, включают группы, упоминаемые в Т.Organic Synthesis", (J. WileySons, 1991). Термин "галогено" при использовании здесь, если не указано иного, включает в себя фторо, хлоро, бромо или йодо. Предпочтительными галогеногруппами являются фторо, хлоро и бромо. Термин "алкил" при использовании здесь,если не указано иного, включает в себя насыщенные одновалентные углеводородные радикалы, имеющие прямые, циклические или разветвленные группировки. Такие циклические группировки включают циклопропил, циклобутил или циклопентил. Алкильная группа может содержать одну или две двойные или тройные связи. Следует понимать, что там, где подразумеваются циклические группировки, должны присутствовать по меньшей мере три атома углерода в указанном алкиле, и для того, чтобы алкильная группа содержала двойную или тройную связь углерод-углерод, требуются по меньшей мере два атома углерода в алкильной группе. Там, где алкильная группировка определена как C1-С 10 алкил, эта группа включает в себя С 6-С 10 бициклогруппы, такие как группу бицикло[3.1.1]гептилметил. Термин "дезозаминил" при использовании здесь, если не указано иного, относится к группе Термин "кладинозил" при использовании здесь, если не указано иного, относится к группе Термин "4"-R13)(R14)NCH2)кладинозил",при использовании здесь, если не указано иного,относится к группе Термин "4"-оксокладинозил", при использовании здесь, если не указано иного, относится к группе Выражение "выделенная или очищенная форма" при использовании здесь, если не указано иного, обозначает выделенный или очищенный из реакционной смеси, например реакционной смеси, содержащей 15-членный азалид исходный материал, который затем очищают до содержания соединения формулы 1 по меньшей мере приблизительно 95%; из бактериальной культуры или бульона; или из природного, например растительного или животного, источника, с применением традиционных методик очистки, таких как хроматография, перекристаллизация и другие, известные специалистам в данной области техники, а также методик, раскрытых в материалах заявки. Выражение "фармацевтически приемлемая(ые) соль(и)" при использовании здесь, если не указано иного, включает в себя соли кислотных или основных групп, которые могут присутствовать в соединениях по настоящему изобретению. Соединения по настоящему изобретению, основные по природе, могут образовывать большое разнообразие солей с различными неорганическими и органическими кислотами. Кислоты, которые можно использовать для получения фармацевтически приемлемых солей присоединения кислот таких основных соединений по настоящему изобретению, являются кислотами, которые образуют нетоксичные соли присоединения кислот, то есть соли, содержащие фармакологически приемлемые анионы,такие как соли гидрохлорид, гидробромид, гидроиодид, нитрат, сульфат, бисульфат, фосфат,кислый фосфат, изоникотинат, ацетат, лактат,салицилат, цитрат, кислый цитрат, тартрат, пантотенат, битартрат, аскорбат, сукцинат, малеат,гентизинат, фумарат, глюконат, глюкаронат,сахарат, формиат, бензоат, глутамат, метансульфонат, этансульфонат, бензолсульфонат,пара-толуолсульфонат и памоат [т.е. 1,1'метилен-бис-(2-гидрокси-3-нафтоат)]. Соедине 005156 12 ния по настоящему изобретению, которые содержат аминогруппировку, в дополнение к кислотам, упомянутым выше, могут образовывать фармацевтически приемлемые соли с различными аминокислотами. Предпочтительно соединения формулы 1 можно использовать в качестве антибактериальных и антипротозойных агентов, когда они находятся в смеси с соединениями формулы 5. В этом случае соотношение соединения формулы 1 к соединению формулы 5 находится в пределах от приблизительно 2:98 до приблизительно 40:60. Те соединения по настоящему изобретению, которые являются кислыми по природе,могут образовывать основные соли с разными фармакологически приемлемыми катионами. Примеры таких солей включают в себя соли щелочных металлов и щелочно-земельных металлов и, в частности, соли кальциевые, магниевые, натриевые и калиевые соли соединений по настоящему изобретению. Некоторые соединения по настоящему изобретению могут иметь асимметрические центры и, следовательно, существовать в разных энантиомерных и диастереоизомерных формах. Данное изобретение относится к применению всех оптических изомеров и стереоизомеров соединений по настоящему изобретению и их смесей и ко всем фармацевтическим композициям и способам лечения, в которых они могут использоваться или содержаться. Настоящее изобретение включает соединения по настоящему изобретению и их фармацевтически приемлемые соли, в которых один или более чем один водородный, углеродный или другой атом замещен своим изотопом. Такие соединения могут быть полезны в качестве научно-исследовательских или диагностических инструментов в исследованиях фармакокинетики метаболизма и в анализах связывания. Настоящее изобретение можно понять более полно при помощи ссылки на подробное описание изобретения и иллюстративные примеры, которые предназначены для того, чтобы проиллюстрировать неограничивающие воплощения данного изобретения. Подробное описание изобретения Соединения по настоящему изобретению могут быть получены согласно нижеприведенным схемам 1 и 2 и последующему описанию. В следующих схемах, если не указано иного, заместители R1, R2, R3, R4, R5, R6, R7, R8, R9, R10,R11, R12, R13, R14 и R15 являются такими, как определено выше. Соединения по настоящему изобретению просто получить. Относительно вышеприведенной схемы 1 исходные соединения формулы 6 легко доступны либо через торговлю, либо посредством традиционного органического синтеза. Предпочтительным соединением формулы 6 является эритромицин A (R10 = этил; R11 = -ОН). Соединения формулы 6 превращают в соединения формулы 5, где R9 = кладинозил, известными способами, такими как описанные в патенте США 4474768 и 4517350. Как правило, соединения формулы 6 обрабатывают гидроксиламином в присутствии основания, предпочтительно неорганического основания, такого как бикарбонат или карбонат щелочного металла или карбонат щелочно-земельного металла, в присутствии воды и водорастворимого органического растворителя, для того чтобы получить оксимы формулы 7. Предпочтительным соединением формулы 7 является то, в котором R10 = этил; R11 = -ОН. Предпочтительно неорганическое основание представляет собой карбонат натрия, а водорастворимый органический растворитель представляет собой метанол. Соединения формулы 7 затем обрабатывают водным основанием и реагентом, который превращает оксимную гидроксильную группу соединений формулы 7 в уходящую группу и в конечном счете дает иминоэфиры формулы 8. Реагенты,полезные в этом отношении, включают в себя галогенангидриды или ангидриды паратолуолсульфокислоты, галогенангидриды или ангидриды метансульфоновой кислоты, галогенангидриды или ангидриды трифторметансульфоновой кислоты, галогенангидриды или ангидриды пара-бромбензолсульфоновой кислоты и тому подобное. Предпочтительно реагент представляет собой хлорангидрид паратолуолсульфокислоты. Предпочтительным соединением формулы 8 является то, в которомR10 = этил, и R11 = -ОН. Соединения формулы 8 затем восстанавливают традиционным водородным восстановителем, предпочтительно боро 15 гидридом натрия, для того чтобы получить соединения формулы 5, где R9 представляет собой кладинозил. В предпочтительном воплощении соединение формулы 5 представляет собой дезметилазитромицин. Соединения формулы 5 превращают в соединения формулы 1 способами, описанными в материалах заявки. Специалистам в данной области техники понятно, что соединения формулы 5 превращаются в соединения формулы 1,где R1 находится в транс-положении по отношению к метильной группе в положении 11 формулы 1 и представляет собойR9 = кладинозил, можно затем превратить в другие соединения формулы 1 и в соединения формулы 2 посредством традиционного органического синтеза и посредством способов, описанных в материалах данной заявки. Соединения формулы 5 превращают в соединения формулы 15 способами, описанными в материалах данной заявки. Специалистам в данной области техники понятно, что соединения формулы 5 превращаются в соединения формулы 15, гдеR9 = кладинозил, можно затем превратить в другие соединения формулы 15 и в соединения формулы 2 посредством традиционного 16 органического синтеза и посредством способов,описанных в материалах данной заявки. Специалистам в данной области техники понятно, что в дополнение к соединениям формулы 6 другие 14-членные макролиды, склонные к расширению кольца по бекмановскому типу, такие как, например, эритромицин В,эритромицин С и кларитромицин, можно превратить в предшественников 13-членных азалидов, предусмотренных настоящим изобретением. Когда желательно, чтобы соединения формулы 1 представляли собой те, в которых R9 = 4"-R13)(R14)NCH2)клaдинoзил, можно применять способы, обобщенные в схеме 2. Например, 2'-гидроксильную группу дезозаминильной группы соединений формулы 5 можно сначала защитить подходящей защитной группой, предпочтительно бензилоксикарбонильной ("Сbz"(С-бензил группой, используяCbz-Cl, для того чтобы получить соединения формулы 9. Такую реакцию можно провести при температуре от приблизительно -78 С до приблизительно комнатной температуры, предпочтительно приблизительно при 0 С. Предпочтительным соединением формулы 9 является то,в котором R10 = этил; R11 = -ОН. 4"-Гидроксильную группу кладинозильной группы соединений формулы 9 можно затем окислить,используя окислительные стандартные условия,с получением соединений формулы 10, которые несут 4"-оксокладинозильную группу. Предпочтительным соединением формулы 10 является то, в котором R10 = этил; R11 = -ОН. Такие окислительные условия можно найти, например, вJournal of Antibiotics, 1988, pages 1029-1047. Типичные условия реакции окисления включают в себя: (а) окисление по Моффетту, при котором используется N-этил-N'-(N,N- диметиламинопропил)карбодиимид и ДМСО (диметилсульфоксид) в присутствии пиридинийтрифторацетата; или (б) окисление по Сверну (Swern), при котором за оксалилхлоридом и ДМСО в СН 2 Сl2 следует добавление триэтиламина или, альтернативно, за трифторуксусным ангидридом и ДМСО в СН 2 Сl2 следует добавление триэтиламина. Предпочтительно окисление представляет собой окисление по Сверну, которое проводят в присутствии трифторуксусного ангидрида при температуре от приблизительно -78 С до приблизительно 0 С. Более предпочтительно окисление по Сверну проводят при температуре приблизительно -60 С. Карбонильную группу 4"-оксокладинозильной группы соединений формулы 10 затем превращают в эпоксид с получением соединений формулы 11. Предпочтительным соединением формулы 11 является то, в котором R10 = этил; R11 = -ОН. Соединения формулы 10 можно превратить в соединения формулы 11 по меньшей мере двумя способами. В одном способе(Способ А), соединение формулы 10 обрабаты 17 вают (СН 3)3S(O)Х 2, где X2 представляет собой галогено, -BF4 или -PF6, предпочтительно иодо,в присутствии основания, такого как третбутилат калия, трет-бутилат натрия, этилат натрия, гидрид натрия, 1,1,3,3-тетраметилгуанидин,1,8-диазабицикло[5.4.0]ундек-7-ен,1,5-диазабицикло[4.3.0]нон-5-ен, этилат калия или метилат натрия, предпочтительно натрийсодержащее основание, такое как гидрид натрия, в растворителе, таком как ТГФ (тетрагидрофуран), растворитель-простой эфир, диметилформамид (ДМФ) или диметилсульфоксид(ДМСО), или в смеси двух или более вышеуказанных растворителей, при температуре в пределах от приблизительно 0 С до приблизительно 60 С; альтернативно триметилсульфонийбромидом и сильным основанием, таким как трет-бутилат калия, в присутствии СН 2 Сl2/ТГФ. Во втором способе (способ Б), соединения формулы 10 обрабатывают (СН 3)3SХ 2, где X2 представляет собой галогено, -BF4 или -PF6,предпочтительно -BF4, в присутствии основания, такого как трет-бутилат калия, этилат натрия, трет-бутилат натрия, гидрид натрия,1,1,3,3-тетраметилгуанидин, 1,8-диазабицикло(КГМДС) или метилат натрия, предпочтительно КГМДС, в растворителе, таком как ТГФ, в растворителе-простом эфире, ДМФ или ДМСО,или в смеси двух или более вышеперечисленных растворителей, при температуре в пределах от приблизительно -78 С до приблизительно 60 С. Предпочтительно применяют способ Б, в котором используют триметилсульфонийбромид и трет-бутилат калия. Защитную, предпочтительно Cbz, группу дезозаминильной группы соединений формулы 11 подвергают гидрогенолизу в присутствии Н 2,Pd/C и любого подходящего органического растворителя,предпочтительно метил-третбутилового эфира ("МТБЭ"), с получением соединений формулы 12. Предпочтительным соединением формулы 12 является то, в которомR10 = этил и R11 = -ОН. Наконец, в эпоксидной группе в положении 4" сахара кладинозы соединений формулы 12 разрывают кольцо, используя HN(R13)(R14), предпочтительно в присутствии иодида калия, с получением соединений формулы 5, в которых R9 = 4"-R13)(R14)NCH2) клaдинoзил. Соединения формулы HN(R13)(R14) включают первичные и вторичные алкил-, алкенил- и алкиниламины и являются легко получаемыми для специалистов в данной области техники. Такая реакция предпочтительно протекает при температуре от приблизительно комнатной температуры до приблизительно 80 С,предпочтительно от приблизительно 30 С до приблизительно 60 С. Соединения формулы 5,где R9 = 4"-R13)(R14)NCH2)клaдинoзил, можно 18 превратить в соединения формул 1 и 15, применяя способы, раскрытые здесь. Следует указать на то, что превращение соединений формулы 11 в соединения формулы 5, где R9 = 4"-R13)(R14)NCH2)клaдинoзил, можно осуществить в одну стадию путем обработки соединений формулы 10 HN(R13)(R14) в присутствии метанола, что удаляет защитную группу с дезозаминильной группы соединений формулы 10. Предпочтительно такую реакцию проводят в присутствии иодида калия. Для того чтобы получить соединения формулы 5, где R9 = 4"-оксокладиноза, защитную,предпочтительно Cbz, группу, которая находится на 2'-гидроксильной группе дезозаминильной группы соединений формулы 10, просто удаляют. Методики удаления таких защитных групп можно найти, например, в Green et al., см. выше. К удивлению неожиданно авторы настоящего изобретения обнаружили, что соединения формулы 5, которые представляет собой 15 членные азалиды, можно превратить в соединения формул 1 и 15, которые представляют собой 13-членные азалиды. Авторы настоящего изобретения обнаружили, что превращение соединений формулы 5 в соединения формул 1 и 15, предпочтительно,где R6, R7 и R8 представляют собой водород, и предпочтительно, где R1 находится в трансположении по отношению к метильной группе в положении 11 формул 1 и 15, может быть осуществлено путем приведения в контакт соединения формулы 5 с кислотой или основанием. Кислоты, полезные в этой связи, включают неорганические кислоты, такие как соляная,бромисто-водородная,иодисто-водородная,фтористо-водородная, серная и азотная кислоты; и органические кислоты, такие как муравьиная, уксусная, трифторуксусная, метансульфоновая, трифторметансульфоновая, бензолсульфоновая и пара-толуолсульфоновая кислоты. Неорганические кислоты предпочтительно используют в форме их водных растворов; более предпочтительно неорганические кислоты используют в форме их разбавленных, т.е. 2 М,водных растворов. Органические кислоты можно использовать в форме разбавленных водных или органических растворов, где органический раствор содержит растворитель, который достаточно сольватирует как органическую кислоту,так и соединение формулы 5. Основания, подходящие в этом отношении, включают неорганические основания, такие как гидроксиды натрия, лития, калия, магния или кальция; карбонаты и бикарбонаты натрия, лития или калия; и карбонаты магния или кальция бикарбонат или карбонат. Также подходящими являются органические основания,такие как триэтиламин, этилдиизопропиламин,пиридин, 4-диметиламинопиридин, коллидин,лутидин и их смеси. Предпочтительно неорганические основания используют в форме раз 19 бавленных водных растворов. Предпочтительно органические основания используют в форме разбавленных органических растворов. Неорганические или органические основания являются предпочтительными по сравнению с неорганическими или органическими кислотами. Соединения формулы 5 можно добавлять к кислоте или основанию или наоборот. В любом случае реакцию соединений формулы 5 с кислотой или основанием облетают путем нагревания смеси соединения формулы 5 и кислоты или основания при температуре от приблизительно комнатной температуры до приблизительно 100 С, предпочтительно при температуре от приблизительно комнатной температуры до приблизительно 60 С и более предпочтительно при температуре от приблизительно 30 С до приблизительно 40 С. Такое нагревание может происходить в течение периода времени от приблизительно 20 мин до приблизительно 48 ч,предпочтительно в течение периода времени от приблизительно 1 до приблизительно 36 ч. Настоящее изобретение также касается способа получения соединения формул 1 и 15 или их фармацевтически приемлемой соли,включающего в себя стадию, на которой соединение формулы 5 нагревают в присутствии растворителя. Такое нагревание осуществляют при температуре от приблизительно комнатной температуры до приблизительно 100 С, предпочтительно при температуре от приблизительно комнатной температуры до приблизительно 60 С и более предпочтительно при температуре от приблизительно 30 С до приблизительно 40 С. Нагревание может происходить в течение периода времени от приблизительно 20 мин до приблизительно 48 ч, предпочтительно в течение периода времени от приблизительно 1 до приблизительно 36 ч. Подходящими растворителями являются те, которые достаточно сольватируют соединения формулы 5 и включают в себя, но не ограничены ими, низшие спирты, диэтиловый эфир,ацетон, ацетонитрил, тетрагидрофуран, этилацетат, бензол, толуол, хлороформ, метиленхлорид,диметилформамид, диметилсульфоксид, Nметилпирролидинон и тому подобное, и их смеси. Однако авторы настоящего изобретения обнаружили, что неожиданно и к удивлению превращение соединений формулы 5 в соединения формул 1 и 15 происходит более быстро в системе растворителей, которая содержит протонный растворитель. Пригодные протонные растворители включают в себя, но не ограничены ими, низшие спирты, такие как метанол, этанол, н-пропанол, изопропанол, н-бутанол, изобутанол и втор-бутанол; фенольные соединения,такие как фенол, галогенофенолы, нафтолы и тому подобное; воду и их смеси. Однако следу 005156 20 ет указать на то, что протонный растворитель не представляет собой карбоновую кислоту. Когда система растворителей содержит протонный растворитель, этот протонный растворитель присутствует в количестве от приблизительно 10 до приблизительно 75% по объему предпочтительно в количестве от приблизительно 25 до приблизительно 60% по объему. Специалистам в данной области техники понятно, что протонный растворитель является смешиваемым с растворителем, в котором нагревают соединение формулы 5, когда нагрет при температуре нагревания. Предпочтительно система растворителей содержит ацетонитрил. Более предпочтительно система растворителей дополнительно содержит низший спирт или воду. Когда система растворителей содержит низший спирт, этот низший спирт предпочтительно представляет собой метанол. Соединения формул 1 и 15 можно выделить или очистить стандартными способами,например перекристаллизацией; хроматографией с использованием колонки, препаративной пластинки или устройства CHROMATOTRON; или другими способами, известными специалистам в данной области техники. Авторы настоящего изобретения обнаружили, что когда для выделения или очистки соединений формул 1 и 15 применяют хроматографию,элюирующая система, которая включает в себя углеводородный растворитель и органический амин, обеспечивает улучшенные результаты разделения по сравнению с другими элюирующими системами. Углеводородные растворители, пригодные в этом отношении, включают, но не ограничены ими, пентан, гексан или гексаны,гептан, петролейный эфир, бензол, толуол, ксилолы и тому подобное. Предпочтительно углеводородный растворитель представляет собой гексан или гексаны. Подходящие органические амины включают в себя, но не ограничены ими,диэтиламин, триэтиламин, этилдиизопропиламин, пиридин, 4-диметиламинопиридин, коллидин, лутидин и их смеси. Предпочтительно органический амин представляет собой диэтиламин. Преимущественно элюирующая система,которая содержит углеводородный растворитель и органический амин, дополнительно содержит полярный органический растворитель. Авторы данного изобретения обнаружили то, что добавление полярного органического растворителя к элюирующей системе обеспечивает лучшее отделение соединений формул 1 и 15 от других соединений по сравнению с элюирующей системой, которая не содержит полярный органический растворитель. Подходящие полярные растворители включают в себя низшие спирты,ацетонитрил, диметилформамид, диметилсульфоксид, N-метилпирролидинон, 1,4-диоксан,тетрагидрофуран, диэтиловый эфир, этилацетат 21 и тому подобное, но не ограничены ими. Предпочтительно полярный органический растворитель представляет собой ацетонитрил. Более предпочтительно элюирующая система содержит гексаны, диэтиламин и ацетонитрил. Соотношения углеводородного растворителя, органического амина и, возможно, полярного органического растворителя могут варьировать, но, как правило, соотношение углеводородного растворителя и органического амина находится в пределах от приблизительно 10:1 до приблизительно 1:1, предпочтительно от приблизительно 7:1 до приблизительно 2:1. Когда элюирующая система дополнительно содержит полярный органический растворитель, эта элюирующая система содержит от приблизительно 1 до приблизительно 15% по объему,предпочтительно от приблизительно 1,5 до приблизительно 10% по объему, полярного органического растворителя. В другом воплощении данного изобретения предпочтительными соединениями формул 1 и 15 являются те, где R1 представляет собой ацетил. Особенно предпочтительными являются соединения формулы 1, где R1 представляет собой ацетил, R6, R7 и R8 представляют собой водород; и R9 = кладинозил ("соединение 1 Б",табл. 1); и в которых R1 = ацетил, R6 = метил, R7 и R8 представляют собой водород; и R9 представляет собой кладинозил ("соединение 1 Д",табл. 1). Кроме того, что они полезны в качестве антибактериальных и антипротозойных агентов,соединения формул 1 и 15, где R1 представляет собой ацетил, полезны в качестве промежуточных соединений для получения других соединений формул 1 и 15, как описано ниже. В общем плане соединения формул 1 и 15,где R1 представляет собой ацетил, получают окислением соединений формул 1 и 15, где которые можно получить способами, обсуждаемыми в материалах заявки. Реакция окисления протекает в присутствии тетраацетата свинца,периодата натрия или любых других окислителей, которые превращают 1-метил-1,2-диолы в метилкетоны. Условия реакции, пригодные для окисления 1-метил-1,2-диола в метилкетон известны специалистам в данной области техники. Предпочтительно реакция окисления протекает в присутствии от приблизительно 1,0 до приблизительно 1,5 экв. тетраацетата свинца на эквивалент соединения формул 1 и 15 и при температуре от приблизительно -78 С до комнатной температуры, предпочтительно от приблизительно -10 до приблизительно 10 С, и в течение промежутка времени от приблизительно 10 мин до приблизительно 6 ч. 22 Соединения формул 1 и 15, где R1 представляет собой ацетил, можно превратить в соединения формул 1 и 15, где R1 = 3-N,Nдиметиламино-2-пропеноил. Такая реакция преимущественно происходит в присутствии избытка диметилацеталя диметилформамида. Предпочтительно эту реакцию проводят в отсутствие дополнительного растворителя. Соединения формул 1 и 15, где R1 = 3-N,Nдиметиламино-2-пропеноил, можно превратить в соединения формул 1 и 15, где R1 = 1-Nзамещенный-3-пиразолил, путем обработки соединений формулы 1, где R1 = 3-N,N-диметиламино-2-пропеноил, 1-замещенным гидразином или его кислой солью в количестве от приблизительно 1 до приблизительно 10 экв. Если применяют кислую соль 1-замещенного гидразина, тогда реакционная смесь, содержащая кислую соль и соединение формул 1 и 15, также содержит слабое органическое основание или щелочь для забуферивания реакционной смеси. Предпочтительные органические основания включают диизопропилэтиламин, пиридин, 4 диметиламинопиридин, лутидин, коллидин и тому подобное и их смеси. Предпочтительно органическое основание представляет собой диизопропилэтиламин. Реакция между соединениями формул 1 и 15, где R1 = 3-N,N-диметиламино-2-пропеноил, и 1-замещенным гидразином или его солью происходит в протонном растворителе, таком как растворитель, описанный выше, при температуре в пределах от приблизительно 50 до приблизительно 115 С, в течение промежутка времени от приблизительно 1 ч до приблизительно 5 суток. Предпочтительно протонный растворитель представляет собой 2 метоксиэтанол или 2-пропанол. Соединения формул 1 и 15, где R1 = 3-N,Nдиметиламино-2-пропеноил, можно превратить в соединения формул 1 и 15, где согласно методике, применяемой для получения соединений формул 1 и 15, где R1 = 1-Nзамещеный-3-пиразолил, за исключением того,что R3N(H)C(=NH)NH2 используют вместо 1 замещенного гидразина. Способы получения 23 путем осуществления взаимодействия соединения формул 1 и 15, где в апротонном растворителе при температуре в пределах от приблизительно 50 до приблизительно 110 С, в течение промежутка времени от приблизительно 1 ч до приблизительно 5 суток. Способы получения известны специалистам в данной области техники. Подходящие апротонные растворители включают в себя пентан, гексаны, гептан, толуол, бензол, ксилолы, петролейный эфир, тетрагидрофуран, 1,4-диоксан и тому подобное, но не ограничены ими. Предпочтительно апротонный растворитель представляет собой толуол. Соединения формул 1 и 15, где R1 = 3-N,Nдиметиламино-2-пропеноил, можно превратить в соединения формул 1 и 15, где R1 = 3 изоксазолил, путем осуществления взаимодействия соединения формул 1 и 15, где R1 = 3-N,Nдиметил-2-пропеноил, с гидроксиламином или его кислой солью в количестве от приблизительно 1 до приблизительно 10 экв. Реакцию,используемую для получения соединений формул 1 и 15, где R1 = 3-изоксазолил, предпочтительно проводят в апротонном растворителе,таком как растворитель, описанный выше, при температуре равной или приблизительно равной комнатной температуре в течение промежутка времени от приблизительно одного до приблизительно пяти суток. Более предпочтительно,апротонный растворитель представляет собой 1,4-диоксан. Соединения формул 1 и 15, где R1 = ацетил, можно превратить в соединения формулы 2, где Х = -С(O)-, путем взаимодействия соединения формул 1 и 15, где R1 = ацетил, с избытком диметилацеталя диметилформамида с получением соединений формул 1 и 15, где R1 = 3N,N-диметиламино-2-пропеноил,описанных выше. Соединения формул 1 и 15, где R1 = 3N,N-диметиламино-2-пропеноил подвергаются внутримолекулярной циклизации с образованием соединений формулы 2, где Х= -С(O)-. Такая внутримолекулярная циклизация преимущественно происходит при высокой температуре,например при приблизительно 110 С или выше. Соответственно, внутримолекулярную циклизацию осуществляют путем нагревания смеси высококипящего растворителя и соединения формул 1 и 15, где R1 представляет собой 3-N,Nдиметиламино-2-пропеноил, до температуры приблизительно 110 С или выше в течение промежутка времени от приблизительно 6 до приблизительно 48 ч, предпочтительно в течение промежутка времени от приблизительно 12 до 24 приблизительно 24 ч. Подходящие высококипящие растворители включают в себя толуол,ксилолы, хлорбензол, диметилформамид, 2 метоксиэтанол, диметилсульфоксид и тому подобное, но не ограничены ими. Предпочтительно высококипящий растворитель представляет собой 2-метоксиэтанол. Соединения формулы 2, где Х = -С(O)-,превращают в соединения формулы 2, где Х = СН(ОН)-, путем обработки соединений формулы 2, где X = -С(O)-, восстановителем гидридом, таким как NaBH4, LiAlH4, NaAlH4, восстановителем SELECTIDE или другим реагентом-гидридом, известным специалистам в данной области техники. Соединения по настоящему изобретению могут иметь асимметрические атомы углерода и, следовательно, существовать в разных энантиомерных и диастереомерных формах. Диастереомерные смеси можно разделить на их отдельные диастереомеры на основе их физикохимических различий способами, известными специалистам в данной области техники, например хроматографией или фракционной кристаллизацией. Энантиомеры можно разделить путем превращения энантиомерных смесей в диастереомерную смесь путем осуществления взаимодействия с соответствующим оптически активным соединением (например спиртом),разделения диастереомеров и превращения (например гидролиза) отдельных диастереомеров в соответствующие чистые энантиомеры. Применение всех таких изомеров, включая смеси диастериомеров и чистые энантиомеры, считается частью настоящего изобретения. Соединения по настоящему изобретению,являющиеся основными по природе, способны к образованию широкого ряда различных солей с различными неорганическими и органическими кислотами. Хотя такие соли должны быть фармацевтически приемлемыми для введения млекопитающим, на практике часто желательно сначала выделить соединение по настоящему изобретению из реакционной смеси в виде фармацевтически неприемлемой соли и затем просто превратить последнюю обратно в свободное основание обработкой щелочным реагентом, и затем превратить последнее свободное основание в фармацевтически приемлемую соль присоединения кислоты. Соли присоединения кислот основных соединений по изобретению легко получить путем приведения в контакт основного соединения с по существу эквивалентным количеством выбранной минеральной или органической кислоты в среде водного растворителя или в подходящем органическом растворителе,таком как метанол или этанол. Желаемую твердую соль легко получают после осторожного выпаривания растворителя. Желаемую соль также можно осадить из раствора свободного основания в органическом растворителе путем 25 добавления к раствору подходящей минеральной или органической кислоты. Те соединения по настоящему изобретению, которые являются кислыми по природе,способны к образованию основных солей с различными катионами. Для соединений, которые нужно вводить млекопитающим, рыбе или птицам, такие соли должны быть фармацевтически приемлемыми. Когда требуется фармацевтически приемлемая соль, может быть желательно сначала выделить соединение по настоящему изобретению из реакционной смеси в виде фармацевтически неприемлемой соли и затем просто превратить последнюю в фармацевтически приемлемую соль способом, аналогичным тому, что описан выше в отношении превращения фармацевтически неприемлемых солей присоединения кислот в фармацевтически приемлемые соли. Примеры основных солей включают соли щелочных металлов или щелочноземельных металлов, и в частности соли натрия, амина и калия. Все эти соли получают по традиционным методикам. Химические основания, которые используют в качестве реагентов для получения фармацевтически приемлемых основных солей по данному изобретению, представляют собой основания,которые образуют нетоксичные основные соли с кислыми соединениями по настоящему изобретению. Такие нетоксичные основные соли включают производные от таких фармакологически приемлемых катионов как натрий, калий,кальций, магний, различные катионы аминов и так далее. Эти соли можно легко получить путем приведения в контакт соответствующих кислотных соединений с водным раствором,содержащим желаемые фармакологически приемлемые основания с катионами, такими как натрий, калий, кальций, магний, различные катионы аминов, и так далее, и последующего выпаривания полученного в результате раствора до сухости, предпочтительно при пониженном давлении. Альтернативно, их также можно получить путем смешения вместе растворов кислотных соединений в низших спиртах и алкоголятов желаемых щелочных металлов и последующего выпаривания полученного в результате раствора до сухости тем же способом, что и ранее. В обоих случаях предпочтительно использовать стехиометрические количества реагентов, чтобы обеспечить полноту реакции и максимальные выходы желаемого конечного продукта. Антибактериальная и антипротозойная активность соединений по настоящему изобретению против бактерий- и простейших-патогенов продемонстрирована способностью соединений ингибировать рост определенных штаммов человеческих или животных патогенов. Анализ I. Анализ I, описанный ниже, использует традиционные методику и критерии интерпретации и имеет целью предложить на 005156 26 правление химических модификаций, которые могут привести к соединениям, которые обходят определенные механизмы резистентности к макролидам. В анализе I набор бактериальных штаммов составляют таким образом, чтобы включить ряд целевых патогенных видов, включая представителей механизмов резистентности к макролидам, которые были охарактеризованы. Использование этого набора позволяет установить связь химическая структура/активность в отношении эффективности, спектра активности и структурных элементов или модификаций,которые могут быть необходимы, чтобы устранить механизмы резистентности. Бактериальные патогены, которые составляют набор для скрининга, представлены в таблице ниже. Во многих случаях, как чувствительный к макролидам родительский штамм, так и резистентный к макролидам штамм, полученный из него, полезны для обеспечения более точной оценки способности соединений обойти механизм резистентности. Штаммы, которые содержат ген с обозначением еrmА/еrmВ/еrmС, резистентны к антибиотикам макролидам, линкозамидам и стрептограмину В благодаря модификациям(метилированию) молекул 23S р-РНК (рибосомальная рибонуклеиновая кислота) Erm метилазой, тем самым обычно препятствуют связыванию всех трех структурных классов. Описаны два типа оттока макролидов; msrA кодирует компонент системы оттока у стафилококков,который препятствует проникновению макролидов и стрептограминов, в то время как mefA/E кодирует трансмембранный белок, который, повидимому, выводит только макролиды. Может происходить инактивация макролидных антибиотиков, и она может быть опосредована либо фосфорилированием 2'-гидроксила (mph), либо расщеплением макроциклического лактона (эстераза). Штаммы можно охарактеризовать, используя традиционную методику полимеразной цепной реакции (PCR) и/или путем секвентирования детерминанты резистентности. Использование методики PCR для этого применения описано в J. Sutcliffe et al., "Detection Of Erythromycin-Resistant determinants By PCR", Antimicrobial(1996). Анализ выполняют в микротитрационных планшетах и интерпретируют согласно Performance Standards for Antimicrobial Disk Susceptibility Tests -Sixth Edition: Approved Standard,опубликованным по директивам Национального Комитета Клинических Лабораторных Стандартов (NCCLS); для сравнения штаммов используют минимальную ингибирующую концентрацию (МIС). Соединения первоначально растворяют в диметилсульфоксиде (ДМСО) с образованием 40 мг/мл исходных растворов. Анализ II используют для тестирования на активность против Pasteurella multocida и анализIII используют для тестирования на активность против Pasteurella haemolytica. Анализ II. Анализ основан на методе разведений в жидкости в микролитровом масштабе. Единичную колонию Р. multocida (штамм 59 А 067) инокулируют в 5 мл бульона с сердечно-мозговым экстрактом (ВНI). Тестируемые соединения готовят, растворяя 1 мг соединения в 125 мкл диметилсульфоксида (ДМСО). Разведения испытуемого соединения готовят, используя неинокулированный BHI-бульон. Используемые концентрации испытуемого соединения варьируют от 200 до 0,098 мкг/мл в результате двухкратных серийных разведений. BHI, инокулированный Р. multocida, разводят неинокулированным BHI-бульоном с получением суспензии 104 клеток на 200 мкл. ВHI-клеточные суспензии смешивают с соответствующими серийными разведениями тестируемого соединения и инкубируют при 37 С в течение 18 ч. Минимальная ингибирующая концентрация (MIC) равна концентрации соединения, проявляющей 100% ингибирование роста Р. multocida при определении в сравнении с неинокулированным контролем. Анализ III. Этот анализ основан на способе разведения в агаре с использованием репликатора Steers Replicator. От двух до пяти колоний,выделенных с чашки с агаром, инокулируют вBHI-бульон и инкубируют в течение ночи при 37 С при перемешивании (200 об./мин). На следующее утро 300 мкл полностью выросшей предкультуры Р. haemolytica инокулируют в 3 мл свежего BHI-бульона и инкубируют при 37 С при перемешивании (200 об./мин). Соответствующие количества тестируемых соединений растворяют в этаноле и готовят серии двухкратных серийных разведений. Два мл соответствующего серийного разведения смешивают с 18 мл расплавленного BHI-агара и дают застыть. 28 Когда инокулированная культура Р. haemolytica достигает 0,5 McFarland стандарта плотности,около 5 мкл этой культуры Р. haemolytica инокулируют на чашки с BHI-агаром, содержащие различные концентрации тестируемого соединения, используя Steers Replicator, и инкубируют в течение 18 ч при 37 С. Исходные концентрации тестируемого соединения варьируют в пределах 100-200 мкг/мл. MIC равна концентрации тестируемого соединения, показывающей 100% ингибирование роста Р. haemolytica при определении в сравнении с неинокулированным контролем. Анализ IV. In vivo активность соединений по настоящему изобретению можно определить путем традиционных исследований иммунитета животных, хорошо известных специалистам в данной области техники, обычно проводимых на мышах. Мышей по прибытии распределяют по клеткам (10 на клетку) и оставляют акклиматизироваться в течение минимум 48 ч перед использованием. Животных инокулируют 0,5 мл 3 х 103 CFU/мл (колониеобразующих единиц(КОЕ) на мл) бактериальной суспензии (Р. Multocida, штамм 59 А 006) внутрибрюшинно. В каждом эксперименте имеются по меньшей мере 3 не лечимые лекарством контрольные группы,включающие одну, инфицированную 0,1Xпровокационной дозой, и две, инфицированные 1Xпровокационной дозой; группу с 10Xпровокационной дозой также можно использовать. Как правило, всем мышам в данном исследовании можно сделать провокационную пробу в пределах 30-90 мин, особенно если для введения провокационной пробы используют автоматический шприц для непрерывного введения (такой как шприц Cornwall). Через 30 мин после начала осуществления провокационной пробы проводят первое лечение соединением. Может оказаться необходимым, чтобы второй человек начал дозирование соединения, если всем животные не была сделана провокационная проба к концу 30 мин. Путями введения являются подкожные или пероральные дозы. Подкожные дозы вводят под оттянутую кожу на задней части шеи, тогда как пероральные дозы дают при помощи иглы для кормления. В обоих случаях используют объем 0,2 мл на мышь. Соединения вводят через 30 мин, 4 и 24 ч после провокационной пробы. Контрольное соединение с известной эффективностью, вводимое тем же путем, включают в каждый тест. Животных обследуют ежедневно и записывают количество выживших в каждой группе. Мониторинг на модели с Р. multocida продолжается в течение 96 ч(четырех суток) после провокационной пробы. РD50 (50% защитная доза) представляет собой рассчитанную дозу, при которой тестируемое соединение защищает 50% группы мышей от смерти вследствие бактериальной инфекции, 29 которая была бы летальной в отсутствие лечения лекарственным средством. Соединения по настоящему изобретению показывают антибактериальную активность в одном из вышеописанных анализов, в частности в анализе IV. Соединения по настоящему изобретению и их фармацевтически приемлемые соли (ниже:"активные соединения") можно вводить пероральным, парентеральным, местным или ректальным путями при лечении бактериальных и протозойных инфекций. Вообще, эти соединения наиболее желательно вводить в дозировках в пределах от приблизительно 0,2 мг на кг массы тела в сутки (мг/кг/сутки) до приблизительно 200 мг/кг/сутки в однократных или разделенных общих дозах (т.е. от 1 до 4 доз в сутки), хотя отклонения обязательно будут иметь место в зависимости от вида, массы и состояния субъекта, которого лечат, и конкретного выбранного пути введения. Однако наиболее желательно применять уровень дозировок в пределах от приблизительно 4 мг/кг/сутки до приблизительно 50 мг/кг/сутки. Тем не менее, могут иметь место отклонения в зависимости от вида млекопитающего, рыбы или птицы, которых лечат, и их индивидуального ответа на указанное лекарство, также как от типа выбранного фармацевтического препарата и промежутка времени и интервала, с которыми такое введение проводят. В некоторых случаях, уровни дозировки ниже нижней границы вышеуказанного интервала могут быть более чем достаточными, в то время как в других случаях еще большие дозы можно применять, не вызывая каких-либо вредных побочных эффектов, при условии, что такие большие дозы сначала разделяют на несколько маленьких доз для введения в течение суток. Активные соединения можно вводить сами по себе или в комбинации с фармацевтически приемлемым носителями или разбавителями путями, указанными ранее, и такое введение можно осуществлять однократными или множественными дозами. Более конкретно, активные соединения можно вводить в большом множестве разных лекарственных форм, т.е. они могут быть объединены с различными фармацевтически приемлемыми инертными носителями в форме таблеток, капсул, лепешек, пастилок,твердых леденцов, порошков, спреев, кремов,мазей, суппозиториев, желе, гелей, паст, лосьонов, мазей, водных суспензий, инъекционных растворов, эликсиров, сиропов и тому подобного. Такие носители включают в себя твердые разбавители или наполнители, стерильную водную среду и различные нетоксичные органические растворители и тому подобное. Более того,пероральные фармацевтические композиции можно надлежащим образом подсластить и/или корригировать их вкус и запах. Вообще, активные соединения присутствуют в таких лекарственных формах с уровнями концентрации в 30 пределах от приблизительно 5,0 до приблизительно 99 мас.%. Для перорального введения можно применять таблетки, содержащие различные эксципиенты, такие как микрокристаллическая целлюлоза, цитрат натрия, карбонат кальция, гидроортофосфат кальция и глицин, вместе с различными разрыхлителями, такими как крахмал (и предпочтительно кукурузный, картофельный или маниоковый крахмал), альгиновая кислота и определенные сложные силикаты, вместе со связывающими веществами для грануляции,такими как поливинилпирролидон, сахароза,желатин и аравийская камедь. Дополнительно,часто для целей таблетирования очень полезны смазывающие агенты, такие как стеарат магния,лаурилсульфат натрия и тальк. Твердые композиции подобного типа можно также применять в качестве наполнителей в желатиновых капсулах; предпочтительные вещества в этой связи также включают лактозу, или молочный сахар,также как высокомолекулярные полиэтиленгликоли. Когда для перорального введения желательны водные суспензии и/или эликсиры, активное соединение можно объединять с различными подслащивающими или корригирующими агентами, красящим веществом или красителями, и, если желательно, с эмульгирующими и/или суспендирующими агентами, а также вместе с такими разбавителями, как вода, этанол,пропиленгликоль, глицерин и различные подобные их комбинации. Для парентерального введения можно применять растворы активного соединения либо в кунжутном или арахисовом масле, либо в водном пропиленгликоле. Водные растворы должны быть подходящим образом забуферены(предпочтительно рН более 8), если необходимо, а жидкий разбавитель сначала доведен до изотоничности. Такие водные растворы подходят для целей внутривенных инъекций. Масляные растворы подходят для целей внутрисуставных, внутримышечных и подкожных инъекций. Приготовление всех этих растворов в стерильных условиях легко осуществляется стандартными фармацевтическими способами, хорошо известными специалистам в данной области техники. Кроме того, также возможно вводить активные соединения по настоящему изобретению местно и это можно сделать с помощью кремов,желе, гелей, паст, пластырей, мазей и тому подобного, в соответствии с общепринятой фармацевтической практикой. Для введения животным, отличным от человека, таким как крупный рогатый скот или домашние животные, активные соединения можно вводить в корме животных или перорально в виде композиции для вливания в ротовую полость. Активные соединения можно также вводить в форме липосомальных систем доставки, 31 таких как маленькие однослойные пузырьки,большие однослойные пузырьки и многослойные пузырьки. Липосомы могут быть сформированы из множества фосфолипидов, таких как холестерин, стеариламин или фосфатидилхолины. Активные соединения также можно связывать с растворимыми полимерами в качестве носителей нацеливаемого лекарственного средства. Такие полимеры могут включать в себя поливинилпирролидон, сополимер пирана, полигидроксипропилметакриламид фенила, полигидроксиэтиласпартамидфенол или полиэтиленоксидполилизин, замещенный пальмитоильными остатками. Кроме того, активные соединения могут быть связаны с классом биоразрушаемых полимеров, подходящих для достижения контролируемого высвобождения лекарственного средства, например с полимером молочной кислоты, полигликолевой кислотой, сополимерами полимеров молочной кислоты и полигликолевой кислоты, полиэпсилонкапролактоном, полигидроксимасляной кислотой, полиортоэфирами,полиацеталями, полигидропиранами, полицианоакрилатами и поперечно-сшитыми или амфифильными блок-сополимерами гидрогелей. Следующие примеры далее иллюстрируют способ и промежуточные соединения по настоящему изобретению. Следует понимать, что настоящее изобретение не ограничено конкретными деталями примеров, предложенных ниже. Соединения примеров 1-12 имеют нижеприведенную общую формулу 3, где заместители R1 и R6 указаны в табл. 1 ниже. Соединения были получены, как описано в примерах 1-12. Пример 1. Соединение 1 А. Дезметилазитромицин (30 г, 41 ммоль) добавляли в деионизированную воду (2 л), и затем добавляли ацетонитрил для осуществления полного растворения (общий объем составлял приблизительно 4,5 л). Полученную в результате смесь оставляли перемешиваться при температуре окружающей среды в течение 2 суток, в это время ВЭЖХ (высокоэффективная жидкостная хроматография) показывала наличие нового пика (приблизительно 22% площади пиков). Ацетонитрил удаляли под вакуумом. К полученному в результате остатку добавляли карбонат калия (30 г), затем метиленхлорид (0,3 л). Смесь встряхивали и нижнюю органическую фазу удаляли. Проводили повторное экстрагирование водной фазы метиленхлоридом (2 х 0,3 л). Объединенные органические фазы сушили над сульфатом натрия и затем концентрировали под вакуумом с получением сухой пены (30 г), которую очищали на колонке, заполненной суспензией силикагеля,используя 5/1/0,5(об./об./об.) гексаныдиэтиламин-ацетонитрил. В ходе разделения систему растворителей меняли на 4/1/0,1, и, наконец, на 3/1,5/0,5 гексаны-диэтиламинацетонитрил. Концентрирование соответствующих, поздно выходящих фракций давало соединение 1 А в виде сухой пены. Пример 2. Соединение 1 Б. К раствору соединения 1 А(7,63 г, 10,41 ммоль) в метиленхлориде (100 мл) при 0 С добавляли одной порцией ацетат свинца(IV) (5,54 г, 12,40 ммоль). Полученную в результате смесь перемешивали в течение 30 минут при 0 С и затем гасили насыщенным раствором бикарбоната натрия (100 мл). Смесь переносили в делительную воронку и удаляли метиленхлоридный слой. Водный слой экстрагировали метиленхлоридом (2 х 50 мл). Объединенные метиленхлоридные фракции промывали рассолом (50 мл), сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении. Остаток очищали флэшхроматографией на силикагеле, элюируя смесью 0,2% гидроксид аммония (10% водный)/5% метанол/94,8% метиленхлорид с получением соединения 1 Б (5,64 г, 8,43 ммоль) в виде белого твердого вещества. Пример 3. Соединение 1 В. Соединение 1 Б (100 мг,0,15 ммоль) растворяли в диметилацетале диметилформамида (2 мл) и нагревали до температуры дефлегмации в атмосфере азота в течение 8 ч. Смесь оставляли охлаждаться до комнатной температуры и затем разбавляли этилацетатом(25 мл). Смесь промывали водой (10 мл) и рассолом (10 мл). Этилацетатный раствор сушили над сульфатом магния, фильтровали и затем концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на си 33 ликагеле, элюируя смесью 0,2% гидроксид аммония (10% водный)/10% метанол/метиленхлорид с получением соединения 1 В (выход: 65 мг, 60%). Пример 4. Соединение 1 Г. Соединение 1 В (100 мг,0,14 ммоль) и гидразина моногидрат (5 мл, 0,15 ммоль) растворяли в 2-метоксиэтаноле (1,5 мл) и нагревали до 105 С в атмосфере азота. Через 2 ч смесь оставляли охлаждаться до комнатной температуры и затем концентрировали при пониженном давлении. Остаток очищали флэшхроматографией на силикагеле, элюируя смесью 0,2% гидроксид аммония (10% водный)/10% метанол/метиленхлорид с получением соединения 1 Г (выход: 58 мг, 60%). Пример 5. Соединение 1 Д. К раствору соединения 1 Б(3,9 г, 5,8 ммоль) в хлороформе (58 мл) добавляли муравьиную кислоту (330 мл, 869 ммоль) и формальдегид (37%-ный водный, 1,3 мл, 17,33 ммоль). Смесь нагревали до 60 С в течение 7 ч. После охлаждения до комнатной температуры смесь переносили в делительную воронку и промывали водным раствором бикарбоната натрия (20 мл). Хлороформную фракцию сушили над сульфатом магния, фильтровали и концентрировали с получением соединения 1 Д (выход: 3,9 г, 98%), которое использовали без дальнейшей очистки. Пример 6. Соединение 1 Е. Соединение 1 Д растворяли в диметилацетале диметилформамида (25 мл) и нагревали до температуры дефлегмации в атмосфере азота в течение 36 ч. Смесь оставляли охлаждаться до комнатной температуры и затем концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на силикагеле, элюируя смесью 0,2% гидроксид аммония (10% водный)/8% метанол/метиленхлорид с получением соединения 1 Е (выход: 1,36 г, 80%). Пример 7. Соединение 1 Ж. Соединение 1 Е (250 мг,0,34 ммоль) и гидразина моногидрат (16 мл, 0,5 ммоль) растворяли в 2-метоксиэтаноле (3,4 мл) и нагревали до 105 С в атмосфере азота. Через 4 ч смесь оставляли охлаждаться до комнатной температуры и затем концентрировали при пониженном давлении. Остаток очищали флэшхроматографией на силикагеле, элюируя смесью 0,2% гидроксид аммония (10% водный)/10% метанол/метиленхлорид с получением соединения 1 Ж в виде белого твердого вещества. Пример 8. Соединение 1 И. Соединение 1 Е (250 мг,0,34 ммоль), бензилгидразина дигидрохлорид(180 мкл, 1,02 ммоль) растворяли в 2 метоксиэтаноле (3,5 мл) и нагревали до 105 С в атмосфере азота. Через 48 ч смесь оставляли охлаждаться до комнатной температуры и затем 34 концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на силикагеле, элюируя смесью 0,2% гидроксид аммония (10% водный)/10% метанол/метиленхлорид с получением соединения 1 И в виде белого твердого вещества (выход: 137 мг, 50%). Пример 9. Соединение 1 К. Соединение 1 Е (250 мг,0,34 ммоль), 3-гидроксибензилгидразина дигидрохлорид (142 мл, 0,68 ммоль) и диизопропилэтиламин (148 мкл, 0,85 ммоль) растворяли в 2 пропаноле (3,5 мл) и нагревали до температуры дефлегмации в атмосфере азота. Через 5 ч смесь оставляли охлаждаться до комнатной температуры и затем концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на силикагеле, элюируя смесью 0,2% гидроксид аммония (10% водный)/10% метанол/метиленхлорид с получением соединения 1 К в виде белого твердого вещества (выход: 147 мг, 53%). Пример 10. Соединение 1 Л. Соединение 1 Е (250 мг,0,34 ммоль), 4-фторфенилгуанидина карбонат(3,5 мл) и нагревали до температуры дефлегмации в атмосфере азота. Через 24 ч смесь оставляли охлаждаться до комнатной температуры и затем концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на силикагеле, элюируя смесью 0,2% ацетонитрил/20% диэтиламин/гексаны с получением соединения 1 Л в виде белого твердого вещества(выход: 120 мг, 42%). Пример 11. Соединение 1 М. Соединение 1 Е (125 мг,0,168 ммоль), фенилгуанидина карбонат (84 мг,0,252 ммоль) и карбонат калия (70 мг, 0,5 ммоль) растворяли в 2-пропаноле (1,5 мл) и нагревали до температуры дефлегмации в атмосфере азота. Через 48 ч смесь оставляли охлаждаться до комнатной температуры и затем разбавляли метиленхлоридом (25 мл). Смесь затем промывали водой (10 мл), сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на силикагеле, элюируя смесью 0,2% гидроксид аммония (10% водный)/10% метанол/метиленхлорид с получением соединения 1 М (54 мг, 40%) в виде белого твердого вещества. Пример 12. Соединения 1 З и 1 Н. Соединение 1 Е (260 мг, 0,35 ммоль) и метилгидразина моногидрат(56 мкл, 1,05 ммоль) растворяли в 2 метоксиэтаноле (3,5 мл) и нагревали до 115 С в атмосфере азота. Через 6 ч смесь оставляли охлаждаться до комнатной температуры и затем концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на силикагеле, элюируя смесью 1% ацетонитрил/20% диэтиламин/гексаны с получением соединения 1 З (выход: 42 мг, 17%) и соединения 1 Н (выход: 21 мг, 8%) в виде белых твердых веществ. Соединения из примеров 13-14 имеют нижеприведенную общую формулу 4, с заместителями X, указанными в табл. 2 ниже. Соединения получали как описано в примерах 13-14. 36 Соединения примеров 15-17 имеют нижеприведенную общую формулу 14, с заместителями R1, указанными в табл. 3 ниже. Соединения были получены как описано в примерах 1517. Пример 13. Соединения 2 А и 1 В. Соединение 1 Б (1,5 г,2,23 ммоль) растворяли в диметилацетале диметилформамида (15 мл) и нагревали до 105 С в течение 16 ч. После охлаждения до комнатной температуры смесь концентрировали при пониженном давлении. Остаток растворяли в 2 метоксиэтаноле (25 мл) и нагревали до 125 С в течение 16 ч. Смесь оставляли охлаждаться до комнатной температуры и затем разбавляли этилацетатом (100 мл). Смесь промывали водой(2 х 20 мл) и рассолом (20 мл), сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении. Остаток очищали флэш-хроматографией на силикагеле,элюируя смесью 0,2% гидроксид аммония (10% водный)/10% метанол/метиленхлорид с получением соединений 2 А (выход: 221 мг, 15%) и 1 В(150 мг, 0,21 ммоль) в этаноле (2 мл) при 0 С добавляли одной порцией борогидрид натрия(33 мг, 0,84 ммоль). Смесь перемешивали при 0 С в течение 2 ч и затем медленно вливали в воду (25 мл). Смесь переносили в делительную воронку и экстрагировали метиленхлоридом (3 х 20 мл). Объединенные метиленхлоридные фракции сушили над сульфатом магния, фильтровали и концентрировали. Остаток очищали флэш-хроматографией на силикагеле, элюируя смесью 0,2% гидроксид аммония (10% водный)/5% метанол/метиленхлорид с получением соединения 2 Б (выход: 103 г, 71%) в виде белого твердого вещества. Пример 15. Соединение 1 О (Способ А). В 2-литровую колбу Эрленмейера добавляли дезметилазитромицин (190,5 г, 259,2 ммоль), метиленхлорид(572 мл) и сульфат магния (38 г). Смесь перемешивали в течение 10 мин, затем фильтровали в 5-литровую круглодонную колбу. Добавляли дополнительное количество метиленхлорида(2285 мл) и раствор охлаждали до 0-5 С. Затем добавляли CBZ-Cl (58,4 мл) за 10 мин. Реакционную смесь перемешивали при 0 С в течение 6 ч, затем при температуре окружающей среды в течение ночи. Анализ с помощью ВЭЖХ показал присутствие остаточного исходного вещества, так что реакционную смесь повторно охлаждали до 0 С и добавляли дополнительное количество CBZ-Cl (19,5 мл) одной порцией. Реакционную смесь перемешивали в течение 5,5 ч при 0 С, затем в течение 2,5 ч при температуре окружающей среды. ТСХ (тонкослойная хроматография) показала завершенную реакцию. Реакцию останавливали насыщенным водным бикарбонатом натрия (953 мл) и фазы разделяли. Органическую фазу сушили над сульфатом магния, затем фильтровали и концентрировали с получением соединения формулы 9,где R10 = этил и R11 = -ОН. В 5-литровую круглодонную колбу, содержащую соединение формулы 9, где R10 = этил и R11 = -ОН, (225,3 г) в метиленхлориде(901 мл) и ДМСО (450 мл) при -65 С добавляли трифторуксусный ангидрид (82,4 мл). Температуру поддерживали на уровне -60 С в течение 37 добавления, которое было завершено через 9 мин. Реакционную смесь перемешивали при температуре от -65 до -70 С в течение 20 мин. Реакцию останавливали триэтиламином (145 мл), затем перемешивали при температуре от-60 до -65 С в течение 20 мин. В реакционную смесь затем добавляли воду (1127 мл) за 3 мин,в этот момент температура поднималась до-2 С. Реакционную смесь перемешивали в течение 10 мин и оставляли для разделения фаз. Органическую фазу промывали водой (675 мл),затем насыщенным водным хлоридом натрия(675 мл). Органическую фазу сушили над сульфатом магния, затем фильтровали и органические растворители удаляли перегонкой. Добавляли МТБЭ (метил-трет-бутиловый эфир) и перегоняли с удалением всех следов метиленхлорида и ДМСО. Добавляли дополнительное количество МТБЭ до суммарного объема 3380 мл. Добавляли дибензоил-D-винной кислоты моногидрат (87,8 г) в МТБЭ (1126 мл) с образованием густой суспензии. Смесь нагревали до температуры дефлегмации и перемешивали в течение ночи. После охлаждения до температуры окружающей среды твердые вещества собирали на воронке Бюхнера и промывали МТБЭ. Твердые вещества сушили в сушильном шкафу при 40 С с получением 258,3 г дибензоилтартрата соединения формулы 10, где R10 = этил и R11 =-ОН. В 3-литровую круглодонную колбу добавляли метиленхлорид (800 мл) и соль дибензоилтартрат соединения формулы 10, где R10 = этил и R11 = -ОН (188 г). Добавляли воду (400 мл) и карбонат калия (45,5 г) и смесь перемешивали при температуре окружающей среды в течение 5 мин. Органическую фазу отделяли, затем промывали водой (250 мл) и сушили над сульфатом магния. Осушающий агент удаляли фильтрацией и полученный в результате раствор упаривали в потоке азота до конечного объема 623 мл с получением кетона свободного основания. В 5-литровую круглодонную колбу добавляли ТГФ (623 мл) и триметилсульфонийбромид (74,7 г). Полученную в результате суспензию охлаждали до -10 С и добавляли третбутилат калия (54,4 г). Реакционную смесь перемешивали в течение 10 мин при -10 С, затем охлаждали до -70 С за 5 мин. Через 11 мин добавляли раствор кетона свободного основания,поддерживая температуру между -60 и -65 С. ВЭЖХ показала, что реакция полностью завершилась через 90 мин. Реакцию гасили при-60 С, используя раствор хлорида аммония (315 г) в воде (1800 мл). Температура поднималась до -5 С во время гашения. Реакционную смесь нагревали до 5-10 С и разделяли фазы. Органическую фазу сушили над сульфатом натрия, затем фильтровали и концентрировали с получением соединения формулы 11, где R10 = этил иR11 = -ОН, (117,4 г) в виде желтой пены. ВЭЖХ показала чистоту 61,4% по площади пика. 38 К раствору соединения формулы 11, гдеR10 = этил и R11 = -ОН, (275 г, 312 ммоль) в безводном метаноле (2,75 л) добавляли иодид калия (518 г, 3,12 моль) и н-пропиламин (250 мл,3,04 моль). Смесь перемешивали в течение ночи при 45 С. ТСХ показала завершение реакции. Реакционную смесь концентрировали на роторном испарителе и остаток распределяли между водой (2,5 л) и метиленхлоридом (2,5 л). рН водной фазы доводили до 6,7 с помощью 3 н. водной НСl. Экстракцию повторяли дополнительно один раз. Объединенные водные фазы объединяли со свежим метиленхлоридом (1,5 л) и рН водной фазы доводили до 8,5 с помощью твердого карбоната калия. Фазы разделяли и водную фазу повторно экстрагировали дважды дополнительным количеством метиленхлорида. Объединенные органические фазы сушили над сульфатом натрия, затем фильтровали. Фильтрат концентрировали на роторном испарителе с получением бежевой пены (230 г). Очистку пены осуществляли колонке, заполненной суспензией силикагеля, используя смесь 19/3 (об./об.) гексаны-диэтиламин в качестве подвижной фазы. Таким образом, из 125 г неочищенного продукта получали 72 г соединения формулы 5, гдеR11 = -ОН (10 г, 12,4 ммоль), растворяли в ацетонитриле (0,5 л) при температуре окружающей среды. Затем добавляли деионизированную воду, что вызывало осаждение. Затем добавляли дополнительное количество ацетонитрила (0,5 л) с получением гомогенного раствора, который перемешивали при температуре окружающей среды в течение 30 ч. Анализ с помощью ВЭЖХ показал образование нового компонента, который составлял 20% общей площади пиков. Органический растворитель удаляли на роторном испарителе. К водному остатку добавляли карбонат калия (30 г), а затем метиленхлорид(0,3 л). Смесь покачивали и нижнюю органическую фазу удаляли. Были также проведены две дополнительные экстракции (2 х 0,3 л). Объединенные органические фазы сушили над сульфатом натрия, затем фильтровали и полученный в результате раствор концентрировали до сухой пены (10 г). Полученную в результате смесь соединения формулы 5, где R9 = 4"-(пропиламинометил)кладинозил, R10 = этил и R11 = -ОН, и соединения 10, растворяли в смеси метиленхлорида со смесью 19/3 (об./об.) гексаны-диэтиламин,и наносили на колонку, заполненную суспензией силикагеля, а затем элюировали этой системой 19/3. Элюент изменяли на 19/6 гексаныдиэтиламин во фракции 56. Фракции 9-17 объединяли и концентрировали до безводной пены,которая содержала только непрореагировавший исходный материал. Фракции 52-72 объединяли 39 и концентрировали, и они содержали соединение 10 (79% чистоты по ВЭЖХ). Пример 16. Соединение 1O (Способ Б). Соединение формулы 5, где R9 = 4"-(пропиламинометил) кладинозил, R10 = этил и R11 = -ОН, отвешивали в 6 сосудов (25 мг/сосуд). Растворители (по 0,5 мл) добавляли как указано ниже Все сосуды затем нагревали до 50 С на масляной бане в течение 5 ч. ТСХ анализ с использованием системы 6/1/0,1 (об./об./об.) (гексаны-диэтиламин-ацетонитрил) показал присутствие соединения 1O во всех сосудах. Самая большая доля, однако, была в сосудах В и Д,которые содержали протонные растворители. Пример 17. Соединение 1 П. Смесь соединения формулы 5, где R9 = 4"-(пропиламинометил) кладинозил, R10 = этил и R11 = -ОН, и соединения 10 (15%) (0,8 г, 0,1 ммоль) растворяли в этилацетате (30 мл). Затем добавляли карбонат калия (0,14 г, 1 ммоль) и этиленкарбонат (0,5 г,5,67 ммоль) и смесь нагревали до температуры дефлегмации в атмосфере азота в течение ночи. Анализ ТСХ с использованием смеси 19/3(об./об.) гексаны-диэтиламин показал отсутствие обоих исходных веществ. Реакционную смесь затем фильтровали и фильтрат концентрировали с получением темного масла, которое очищали в атмосфере азота на пластинке 4 мм CHROMATOTRON(ядерный магнитный резонанс) показал, что этот продукт соответствует 11,12-циклическому карбонату исходного вещества. Фракции 18-39 содержали менее подвижный компонент, который был повторно очищен на пластинке 2 мм с использованием смеси 3/1 (об./об.) гексаныдиэтиламин. Обогащенные фракции (16-23) объединяли и повторно пропускали по 1 мм пластине в вышеуказанной системе с получением соединения 1 П во фракции 20 (30 мг). ТСХ и ВЭЖХ показали, что это вещество имело высокую степень чистоты. Настоящее изобретение не ограничено в объеме конкретными воплощениями, раскрытыми в данных примерах, которые предназначены для иллюстрации некоторых аспектов данного изобретения, и любые воплощения, которые функционально эквивалентны, входят в объем данного изобретения. Действительно,различные модификации данного изобретения в 40 дополнение к тем, что показаны и описаны в материалах заявки, становятся очевидными специалистам и подразумевается, что они охвачены прилагаемой формулой изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы 1 или его фармацевтически приемлемая соль, гдеR3 представляет собой фенил, возможно замещенный атомами галогена;R6 представляет собой водород или метил;R7 представляет собой водород или бензилоксикарбонил; 5. Соединение по п.2, имеющее формулу 3 или его фармацевтически приемлемая соль,где R1 представляет собойR3 представляет собой фенил, возможно замещенный атомами галогена;R6 представляет собой водород или метил;R7 представляет собой водород или бензилоксикарбонил;R11 представляет собой водород или -ОН иR15 представляет собой Н, R10 не представляет собой этил. 3. Соединение по п.2, где R1 представляет собой выбранное из группы, состоящей из соединения, где R1 представляет собой ацетил и R6 представляет собой водород; соединения, где R1 представляет собой 3N,N-диметиламино-2-пропеноил и R6 представляет собой водород; соединения, где R1 представляет собой 3 пиразолил и R6 представляет собой водород; соединения, где R1 представляет собой ацетил и R6 представляет собой метил; соединения, где R1 представляет собой 3N,N-диметиламино-2-пропеноил и R6 представляет собой метил; соединения, где R1 представляет собой 3 пиразолил и R6 представляет собой метил; соединения, где R1 представляет собой 1N-метил-3-пиразолил и R6 представляет собой метил; соединения, где R1 представляет собой 1N-бензил-3-пиразолил и R6 представляет собой метил; соединения, где R1 представляет собой 1N-(3-гидроксибензил)-3-пиразолил и R6 представляет собой метил; соединения, где R1 представляет собой 24-фторфенил)амино)-4-пиримидинил и R6 представляет собой метил; соединения, где R1 представляет собой 2(фениламино)-4-пиримидинил и R6 представляет собой метил; и соединения, где R1 представляет собой 1N-метил-5-пиразолил и R6 представляет собой метил. 7. Соединение формулы 14 или его фармацевтически приемлемая соль,где R1 представляет собойR7 представляет собой водород иR13 и R14 представляют собой независимо водород или C1-С 10 алкил, С 2-С 10 алкенил или С 2 С 10 алкинил. 8. Соединение формулы 14 или его фармацевтически приемлемая соль,где R1 представляет собойR7 представляет собой водород иR13 и R14 представляют собой независимо водород или C1-С 10 алкил, С 2-С 10 алкенил или С 2 С 10 алкинил. 9. Соединение по п.7 или 8, где R1 представляет собой 10. Соединение по п.1 или 2 в выделенной или очищенной форме. 11. Соединение формулы 2 и его фармацевтически приемлемая соль, где Х представляет собой -С(O)- илиR5 представляет собой водород или и R13 и R14 представляют собой независимо водород или C1-С 6 алкил, С 2-С 6 алкенил или С 2 С 6 алкинил. 13. Соединение по п.11 в выделенной или очищенной форме. 45 14. Фармацевтическая композиция, полезная для лечения бактериальной инфекции или протозойной инфекции у млекопитающего, рыбы или птицы, содержащая терапевтически эффективное количество соединения по п.1 или 2 и фармацевтически приемлемый носитель. 15. Способ лечения бактериальной инфекции или протозойной инфекции у млекопитающего, рыбы или птицы, при котором указанным млекопитающему, рыбе или птице вводят терапевтически эффективное количество соединения по п.1 или 2. 16. Фармацевтическая композиция, полезная для лечения бактериальной инфекции или протозойной инфекции у млекопитающего, рыбы или птицы, содержащая терапевтически эффективное количество соединения по п.10 и фармацевтически приемлемый носитель. 17. Способ лечения бактериальной инфекции или протозойной инфекции у млекопитающего, рыбы или птицы, при котором указанным млекопитающему, рыбе или птице вводят терапевтически эффективное количество соединения по п.10. 18. Способ получения соединения формулы-СН 2N(водород, C1-C10 алкил, C2-С 10 алкенил или С 2-С 10 алкинил)(водород, C1-С 10 алкил, С 2-С 10 алкенил или C2-С 10 алкинил); который включает в себя стадию, на которой соединение формулы 5 где R9 такой, как определено для соединения формулы 1;R11 представляет собой водород или -ОН; приводят в контакт с кислотой или основанием с образованием в результате соединения формулы 1. 19. Способ получения соединения формулы 15R3 представляет собой фенил, возможно замещенный атомами галогена; или его фармацевтически приемлемой соли,где R1 представляет собойR3 представляет собой фенил, возможно замещенный атомами галогена;R6 представляет собой водород или метил;R11 представляет собой водород или -ОН и-СН 2N(водород, C1-С 10 алкил, C2-С 10 алкенил или С 2-С 10 алкинил)(водород, C1-С 10 алкил, С 2-С 10 алкенил или С 2-С 10 алкинил); который включает в себя стадию, на которой соединение формулы 5 где R9, R10 и R11 являются такими, как определено выше,приводят в контакт с кислотой или основанием с образованием в результате соединения формулы 15. 20. Способ получения соединения формулы 1R3 представляет собой фенил, возможно замещенный атомами галогена;-СН 2N(водород, C1-С 10 алкил, С 2-С 10 алкенил или С 2-С 10 алкинил)(водород, C1-С 10 алкил, С 2-С 10 алкенил или С 2-С 10 алкинил),который включает в себя стадию, на которой соединение формулы 5 где R9 такой, как определено для соединения формулы 1;R11 представляет собой водород или -ОН,нагревают в присутствии системы растворителей с образованием в результате соединения формулы 1. 21. Способ получения соединения формулы 15 ацетил, 3-N,N-диметиламино-2-пропеноил, или его фармацевтически приемлемой соли,где R1 представляет собой 50 или его фармацевтически приемлемой соли,где R1 представляет собойR3 представляет собой фенил, возможно замещенный атомами галогена;R6 представляет собой водород или метил;R6 представляет собой водород или метил;R11 представляет собой водород или -ОН и-СН 2N(водород, C1-С 10 алкил, С 2-С 10 алкенил или С 2-С 10 алкинил)(водород, C1-C10 алкил, С 2-С 10 алкенил или С 2-С 10 алкинил); который включает в себя стадию, на которой соединение формулы 5R11 представляет собой водород или -ОН и-СН 2N(водород, С 1-С 10 алкил, С 2-С 10 алкенил или С 2-С 10 алкинил)(водород, C1-С 10 алкил, С 2-С 10 алкенил или С 2-С 10 алкинил),который включает в себя стадию, на которой соединение формулы 5 где R9, R10 и R11 являются такими, как определено выше; приводят в контакт с кислотой или основанием с образованием в результате соединения формулы 15. 23. Способ получения соединения формулы 15 где R9, R10 и R11 такие, как определено выше,нагревают в присутствии системы растворителей с образованием в результате соединений формулы 15. 22. Способ получения соединения формулы 15 или его фармацевтически приемлемой соли,где R1 представляет собойR6 представляет собой водород или метил;R11 представляет собой водород или -ОН и-СН 2N(водород, С 1-С 10 алкил, С 2-С 10 алкенил или С 2-С 10 алкинил)(водород, C1-С 10 алкил, С 2-С 10 алкенил или С 2-С 10 алкинил),который включает в себя стадию, на которой соединение формулы 5 52 где R9, R10 и R11 являются такими, как определено выше; нагревают в присутствии системы растворителей с образованием в результате соединения формулы 15. 24. Способ по любому из пп.20, 21 или 23,где система растворителей содержит растворитель, выбранный из группы, состоящей из низших спиртов, диэтилового эфира, ацетона, ацетонитрила, тетрагидрофурана, этилацетата, бензола, толуола, хлороформа, метиленхлорида,диметилформамида, диметилсульфоксида, Nметилпирролидинона и их смесей. 25. Способ по любому из пп.20, 21 или 23,где система растворителей дополнительно содержит протонный растворитель. 26. Способ по п.25, где протонный растворитель выбран из группы, состоящей из метанола, этанола, н-пропанола, изопропанола, нбутанола, изобутанола, втop-бутанола, фенола,галогенофенолов, нафтолов, воды и их смесей.
МПК / Метки
МПК: A61K 31/70, C07H 17/08
Метки: агентов, качестве, азалиды, 13-членные, применение, антибиотических
Код ссылки
<a href="https://eas.patents.su/27-5156-13-chlennye-azalidy-i-ih-primenenie-v-kachestve-antibioticheskih-agentov.html" rel="bookmark" title="База патентов Евразийского Союза">13-членные азалиды и их применение в качестве антибиотических агентов</a>
Предыдущий патент: Бициклические соединения, проявляющие антагонизм к рецептору витронектина, способ их получения и содержащие их фармацевтические композиции
Следующий патент: Методы и составы для лечения сердечной недостаточности и вентрикулярной коррекции путем доставки in vivo ангиогенных трансгенов
Случайный патент: Способ интенсификации самоочищения почвы от нефтяных и фенольных загрязнений с помощью комплекса минеральных солей