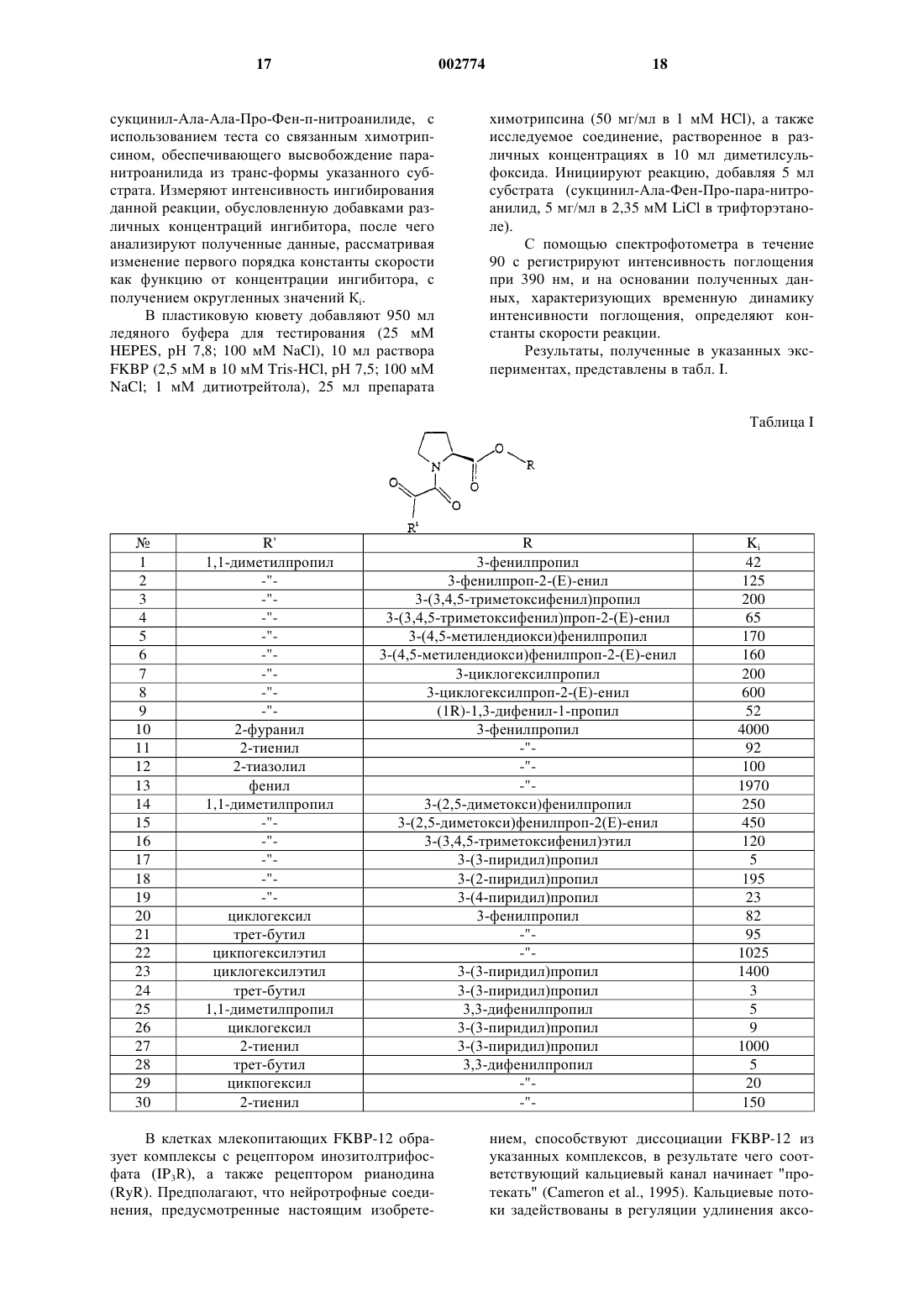
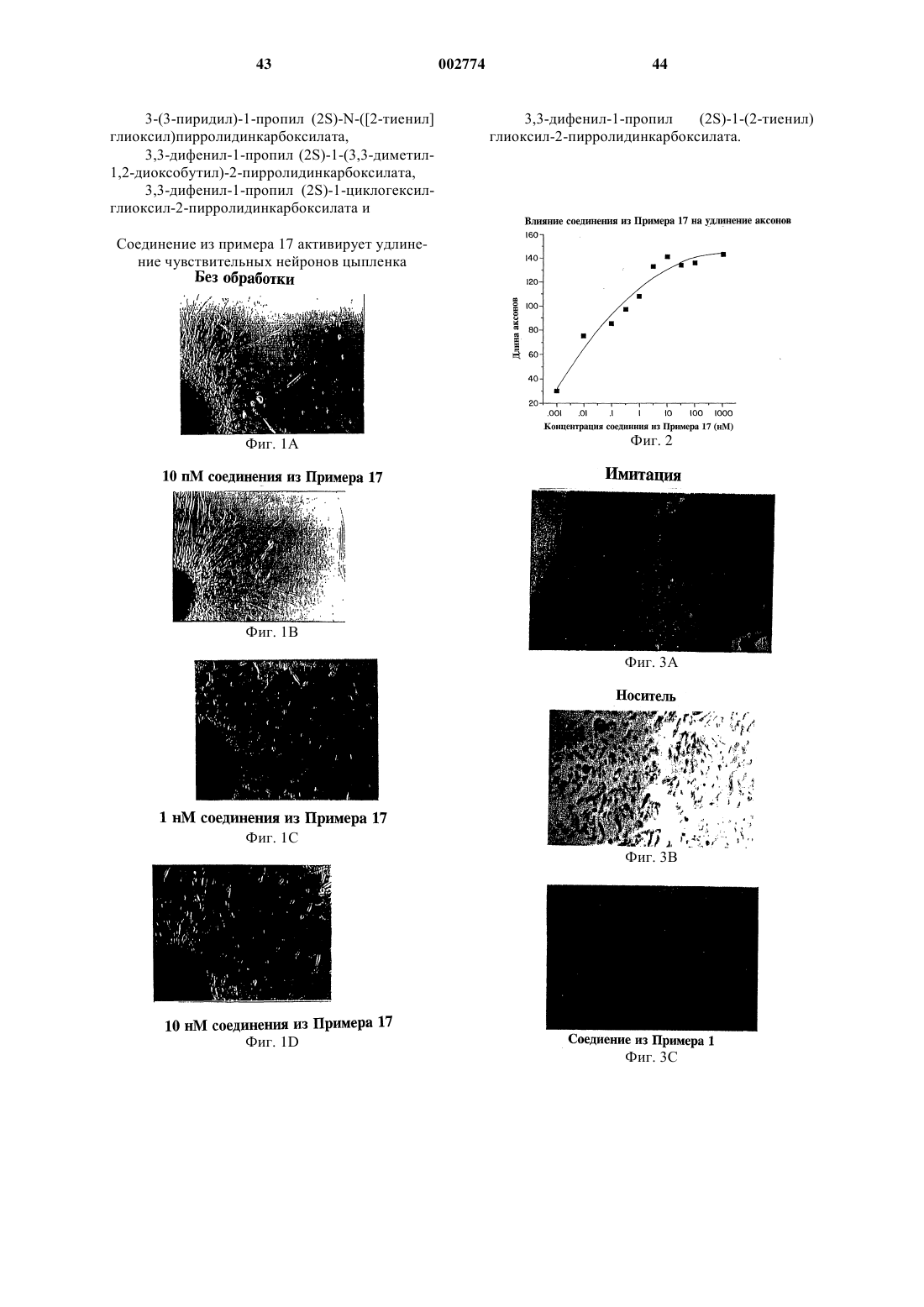
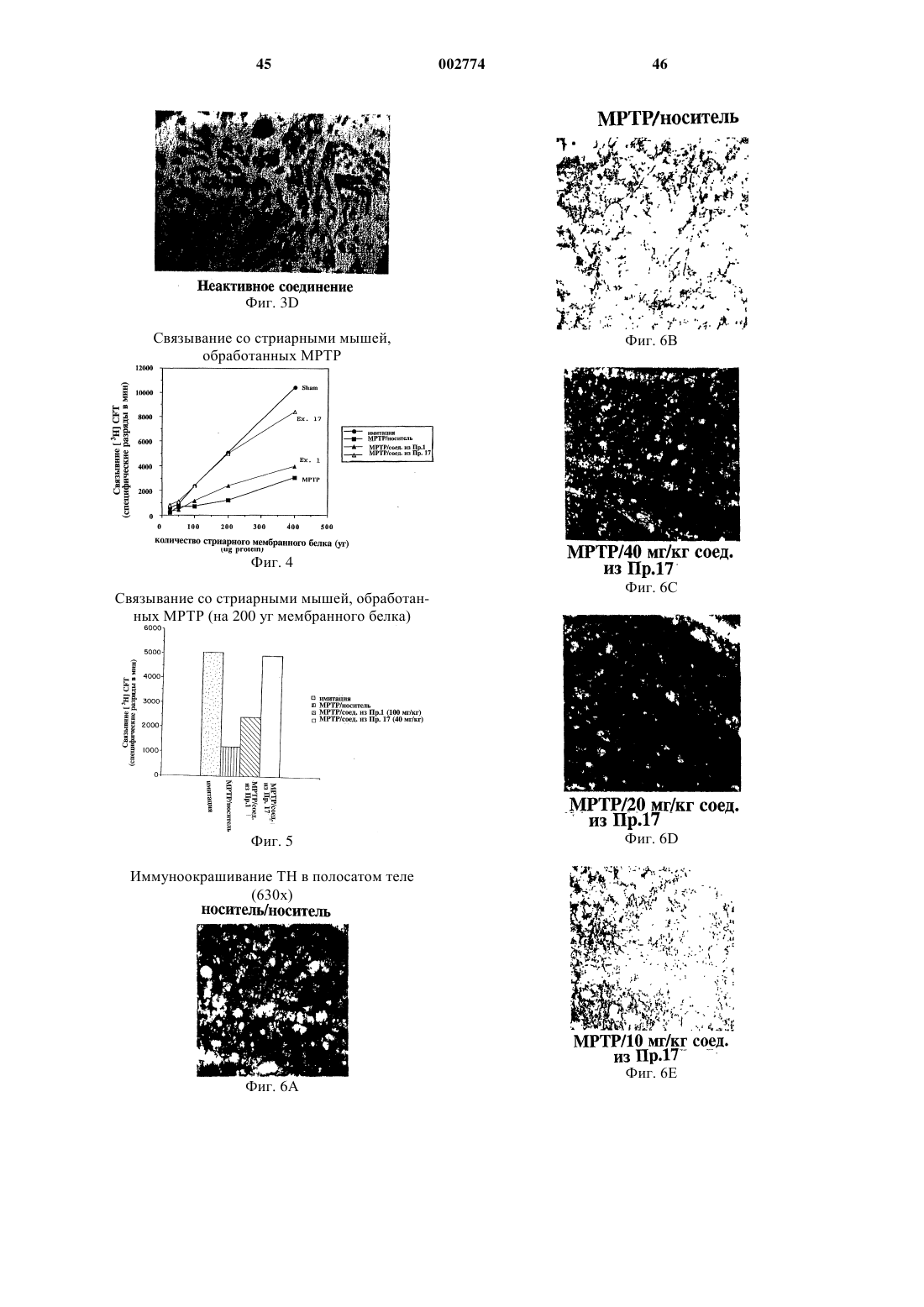
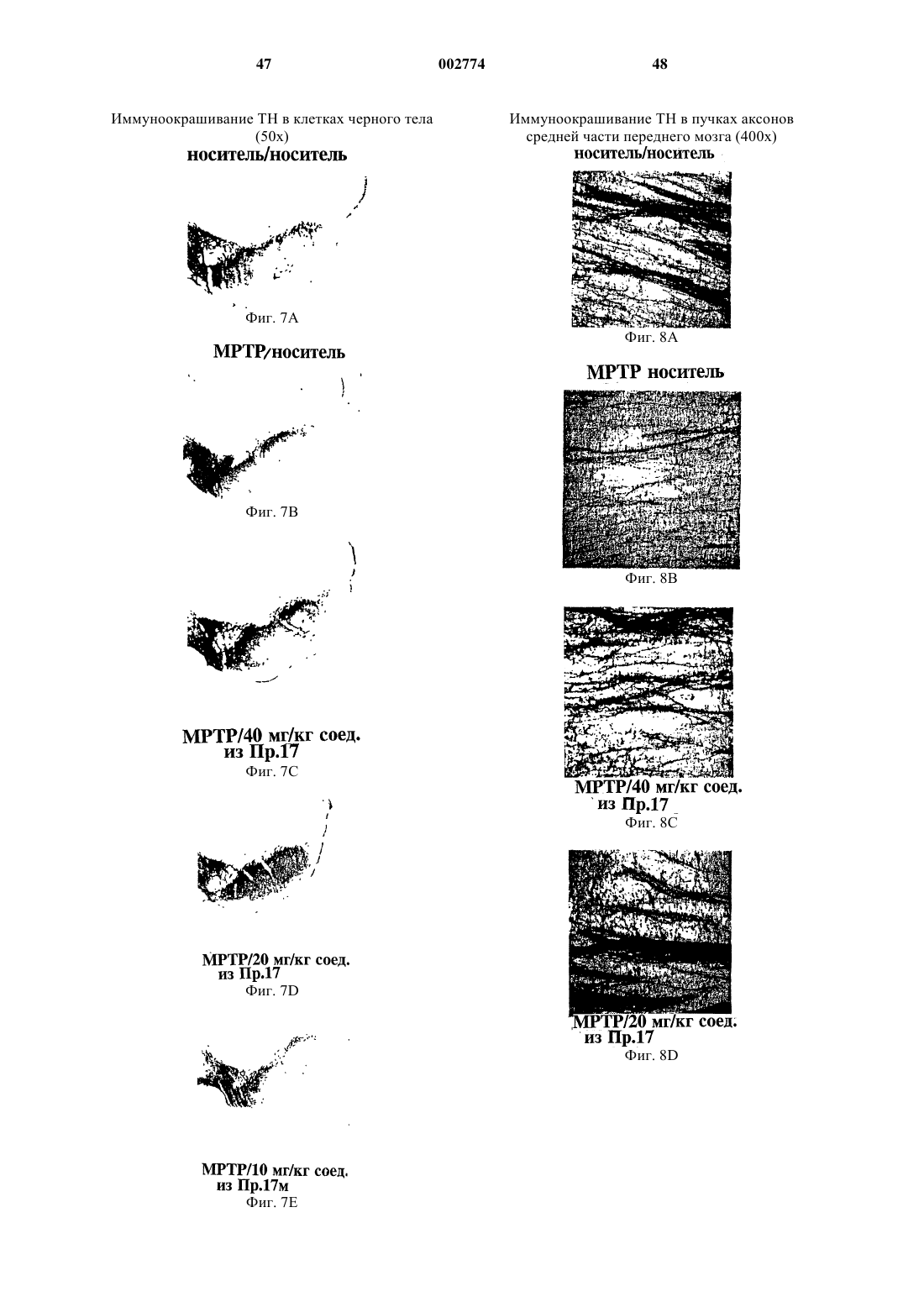
Применение новых нейротрофных соединений для стимулирования роста и регенерации нейронов, для лечения неврологического расстройства и для предупреждения нейродегенерации и в приготовлении лекарственного средства
Формула / Реферат
1. Применение нейротрофного соединения формулы
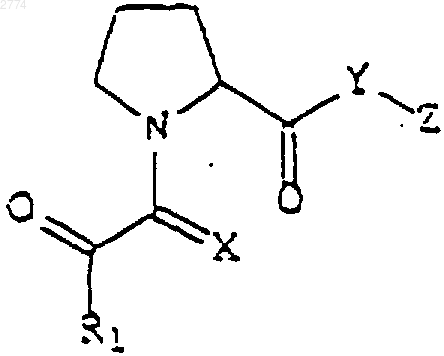
или его фармацевтически приемлемой соли или гидрата,
где R1 представляет собой
С1-С9алкильную или С2-С9алкенильную группу с прямой или разветвленной цепью, возможно замещенную С3-С8циклоалкилом,
С3 или С5циклоалкил,
С5-С7циклоалкенил,
где указанные алкильная, алкенильная, циклоалкильная или циклоалкенильная группы могут быть возможно замещены С1-С4алкилом, С2-С4алкенилом или гидроксилом,
или Ar1, где Ar1 выбран из группы, состоящей из 1-нафтила, 2-нафтила, 2-индолила, 3-индолила, 2-фурила, 3-фурила, 2-тиазолила, 2-тиенила, 3-тиенила, 2-, 3- или 4-пиридила и фенила, имеющих от одного до трех заместителей, которые независимо выбраны из группы, состоящей из водорода, галогена, гидроксила, нитрогруппы, трифторметила, прямого или разветвленного C1-С6алкила или С2-С6алкенила, С1-C4алкоксила или С2-С4алкенилоксила, феноксигруппы, бензилоксигруппы и аминогруппы;
Х является кислородом или серой;
Y является кислородом или NR2, где R2 является водородом или C1-С6алкилом; и
Z представляет собой
С2-С6алкил или алкенил с прямой или разветвленной цепью;
причем алкильная или алкенильная цепь замещена по одному или более чем одному положению Ar1, как он определен выше,
С3-С8циклоалкил,
циклоалкил, соединенный посредством C1-С6алкильной или С2-С6алкенильной прямой или разветвленной цепи; или
Аr2, где Аr2 выбран из группы, состоящей из 2-индолила, 3-индолила, 2-фурила, 3-фурила, 2-тиазолила, 2-тиенила, 3-тиенила, 2-, 3- или 4-пиридила и фенила, имеющих от одного до трех заместителей, которые независимо выбраны из группы, состоящей из водорода, галогена, гидроксила, нитрогруппы, трифторметила, прямого или разветвленного C1-С6алкила или С2-С9алкенила, С1-С4алкоксила или С2-С4алкенилоксила, феноксигруппы, бензилоксигруппы и аминогруппы;
фрагмент
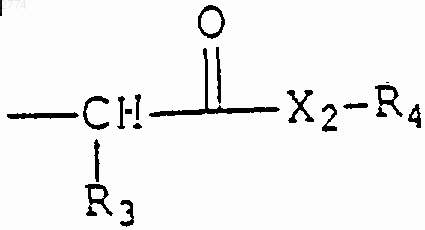
где R3 выбран из прямого или разветвленного С1-С8алкила, возможно замещенного С3-С8циклоалкилом или Ar1, как он определен выше, и незамещенного Ar1;
Х2 представляет собой О или NR5, где R5 выбран из водорода, прямого или разветвленного C1-С6алкила и С2-С6алкенила;
R4 выбран из группы, состоящей из фенила, бензила, прямого или разветвленного С1-C5алкила или С2-С5алкенила и прямого или разветвленного С1-С5алкила или С2-С5алкенила, замещенного фенилом;
для стимулирования роста и регенерации нейронов, для лечения неврологического расстройства или для предупреждения нейродегенерации.
2. Применение по п.1, для стимулирования роста поврежденных периферических нервов.
3. Применение по п.1, где неврологическое расстройство выбрано из группы, состоящей из периферических невропатий и неврологических патологий, связанных с нейродегенерацией.
4. Применение по п.3, где неврологическим расстройством, связанным с нейродегенерацией, является болезнь Альцгеймера.
5. Применение по п.3, где неврологическим расстройством, связанным с нейродегенерацией, является болезнь Паркинсона.
6. Применение по п.3, где неврологическим расстройством, связанным с нейродегенерацией, является боковой амиотрофический склероз.
7. Применение по п.1, где Z и R1 являются липофильными группами.
8. Применение по п.1, где соединение выбрано из
3-фенил-1-пропил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,
3-(3-пиридил)-1-пропил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,
3-фенил-1-проп-2-(Е)-енил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,
3-(3,4,5-триметоксифенил)-1-пропил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,
3-(3,4,5-триметоксифенил)-1-проп-2-(Е)-енил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,
3-(4,5-дихлорфенил)-1-пропил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,
3-(4,5-дихлорофенил)-1-проп-2-(Е)-енил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,
3-(4,5-метилендиоксифенил)-1-пропил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,
3-(4,5-метилендиоксифенил)-1-проп-2-(Е)-енил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,
3-циклогексил-1-пропил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,
3-циклогексил-1-проп-2-(Е)-енил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,
(1R)-1,3-дифенил-1-пропил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,
(1R)-1,3-дифенил-1-проп-2-(Е)-енил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,
(1R)-1-циклогексил-3-фенил-1-пропил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,
(1R)-1-циклогексил-3-фенил-1-проп-2-(Е)-енил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,
(1R)-1-(4,5-дихлорофенил)-3-фенил-1-пропил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,
3-фенил-1-пропил (2S)-1-(1,2-диоксо-2-циклогексил)этил-2-пирролидинкарбоксилата,
3-фенил-1-пропил (2S)-1-(1,2-диоксо-4-циклогексил)бутил-2-пирролидинкарбоксилата,
3-фенил-1-пропил (2S)-1-(1,2-диоксо-2-[2-фуранил])этил-2-пирролидинкарбоксилата,
3-фенил-1-пропил (2S)-1-(1,2-диоксо-2-[2-тиенил])этил-2-пирролидинкарбоксилата,
3-фенил-1-пропил (2S)-1-(1,2-диоксо-2-[2-тиазолил])этил-2-пирролидинкарбоксилата,
3-фенил-1-пропил (2S)-1-(1,2-диоксо-2-фенил)этил-2-пирролидинкарбоксилата,
1,7-дифенил-4-гептил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,
3-фенил-1-пропил (2S)-1-(3,3-диметил-1,2-диоксо-4-гидроксибутил)-2-пирролидинкарбоксилата,
3-фенил-1-пропил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,
этилового эфира 1-[1-(3,3-диметил-1,2-диоксопентил)-L-пролин]-L-фенилаланина,
этилового эфира 1-[1-(3,3-диметил-1,2-диоксопентил)-L-пролин]-L-лейцина,
этилового эфира 1-[1-(3,3-диметил-1,2-диоксопентил)-L-пролин]-L-фенилглицина,
фенилового эфира 1-[1-(3,3-диметил-1,2-диоксопентил)-L-пролин]-L-фенилаланина,
бензилового эфира 1-[1-(3,3-диметил-1,2-диоксопентил)-L-пролин]-L-фенилаланина и
этилового эфира 1-[1-(3,3-диметил-1,2-диоксопентил)-L-пролин]-L-изолейцина.
9. Применение нейротрофного соединения формулы
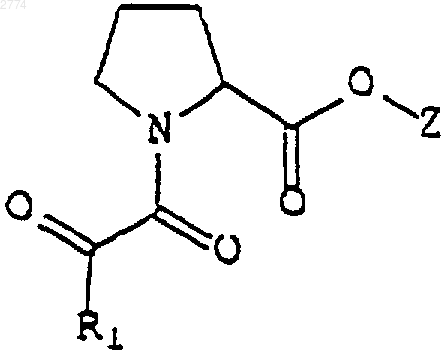
или его фармацевтически приемлемой соли или гидрата,
где R1 представляет собой
C1-C9алкильную или C2-C9алкенильную группу с прямой или разветвленной цепью, возможно замещенную C3-C8циклоалкилом,
C3 или C5циклоалкил,
C5-C7циклоалкенил,
где указанные алкильная, алкенильная, циклоалкильная или циклоалкенильная группы возможно могут быть замещены C1-C4алкилом, C2-C4алкенилом или гидроксилом,
или Ar1, где Ar1 выбран из группы, состоящей из 1-нафтила, 2-нафтила, 2-индолила, 3-индолила, 2-фурила, 3-фурила, 2-тиазолила, 2-тиенила, 3-тиенила, 2-, 3- шыш 4-пиридила и фенила, имеющих от одного до трех заместителей, которые независимо выбраны из группы, состоящей из водорода, галогена, гидроксила, нитрогруппы, трифторметила, прямого или разветвленного C1-C6алкила или C2-C6алкенила, C1-C4алкоксила или C2-C4алкенилоксила, феноксигруппы, бензилоксигруппы и аминогруппы;
Z представляет собой
C2-C6алкил или алкенил с прямой или разветвленной цепью;
причем алкильная или алкенильная цепь замещена по одному или более чем одному положению Ar1, как он определен выше,
С3-С8циклоалкил,
циклоалкил, соединенный посредством прямой или неразветвленной С1-С6алкильной или С2-С6алкенильной цепи; или
Аr2, где Аr2 выбран из группы, состоящей из 2-индолила, 3-индолила, 2-фурила, 3-фурила, 2-тиазолила, 2-тиенила, 3-тиенила, 2-, 3- или 4-пиридила и фенила, имеющих от одного до трех заместителей, которые независимо выбраны из группы, состоящей из водорода, галогена, гидроксила, нитрогруппы, трифторметила, прямого или разветвленного C1-С6алкила или С2-С6алкенила, С1-C4алкоксила или С2-С4алкенилоксила, феноксигруппы, бензилоксигруппы и аминогруппы;
для стимулирования роста и регенерации нейронов, для лечения неврологического расстройства или для предупреждения нейродегенерации.
10. Применение по п.9, где R1 выбран из группы, состоящей из С1-С9алкила с прямой или разветвленной цепью, 2-циклогексила, 4-циклогексила, 2-фуранила, 2-тиенила, 2-тиазолила и 4-гидроксибутила.
11. Применение по п.9 для стимулирования роста поврежденных периферических нервов.
12. Применение по п.9, где неврологическое расстройство выбрано из группы, состоящей из периферических невропатий и неврологических патологий, связанных с нейродегенерацией.
13. Применение по п.9, где неврологическим расстройством, связанным с нейродегенерацией, является болезнь Альцгеймера.
14. Применение по п.9, где неврологическим расстройством, связанным с нейродегенерацией, является болезнь Паркинсона.
15. Применение по п.9, где неврологическим расстройством, связанным с нейродегенерацией, является боковой амиотрофический склероз.
16. Применение по п.9, где Z и R1 являются липофильными группами.
17. Применение нейротрофного соединения формулы

или его фармацевтически приемлемых солей или гидратов,
где Z представляет собой фрагмент

где R3 выбран из группы, состоящей из прямого или разветвленного C1-С8алкила, возможно замещенного С3-С8циклоалкилом или Ar1, как он определен выше, и незамещенного Аr1;
Х2 представляет собой О или NR5, где R5 выбран из группы, состоящей из водорода, прямого или разветвленного C1-С6алкила и С2-С6алкенила; и
R4 выбран из группы, состоящей из фенила, бензила, прямого или разветвленного С1-С5алкила или С2-С5алкенила и прямого или разветвленного С1-С5алкила или С2-С5алкенила, замещенного фенилом;
для стимулирования роста и регенерации нейронов, для лечения неврологического расстройства или для предупреждения нейродегенерации.
18. Применение по п.17 для стимулирования роста поврежденных периферических нервов.
19. Применение по п.17, где неврологическое расстройство выбрано из группы, состоящей из периферических невропатий и неврологических патологий, связанных с нейродегенерацией.
20. Применение по п.17, где неврологическим расстройством, связанным с нейродегенерацией, является болезнь Альцгеймера.
21. Применение по п.17, где неврологическим расстройством, связанным с нейродегенерацией, является болезнь Паркинсона.
22. Применение по п.17, где неврологическим расстройством, связанным с нейродегенерацией, является боковой амиотрофический склероз.
23. Применение по п.17, где Z и R1 являются липофильными группами.
24. Применение нейротрофного N-глиоксилпролилэфирного соединения формулы
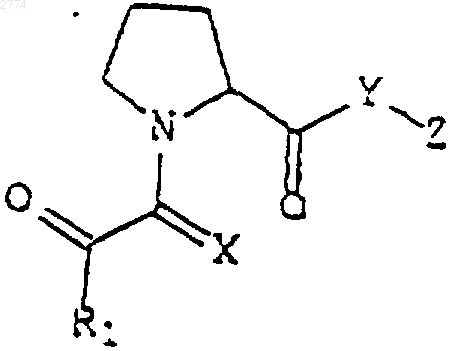
или его фармацевтически приемлемой соли или гидрата,
где R1 представляет собой
С1-С5алкильную или С2-С5алкенильную группу с прямой или разветвленной цепью, возможно замещенную С3-С6циклоалкилом, или
Аr1, где Ar1 выбран из группы, состоящей из 2-фурила, 2-тиенила и фенила; и
Х выбран из группы, состоящей из кислорода и серы;
Y является кислородом; и
Z представляет собой
С2-C6алкил или алкенил с прямой или разветвленной цепью;
причем алкильная или алкенильная цепь замещена по одному или более чем одному положению Ar1, как он определен выше,
С3-С6циклоалкил; или
Аr2, где Аr2 выбран из 2-, 3- или 4-пиридила или фенила, имеющих от одного до трех заместителей, которые независимо выбраны из группы, состоящей из водорода и С1-С4алкокси;
для стимулирования роста и регенерации нейронов, для лечения неврологического расстройства или для предупреждения нейродегенерации.
25. Применение по п.24 для стимулирования роста поврежденных периферических нервов.
26. Применение по п.24, где неврологическое расстройство выбрано из группы, состоящей из периферических невропатий и неврологических патологий, связанных с нейродегенерацией.
27. Применение по п.24, где неврологическим расстройством, связанным с нейродегенерацией, является болезнь Альцгеймера.
28. Применение по п.24, где неврологическим расстройством, связанным с нейродегенерацией, является болезнь Паркинсона.
29. Применение по п.24, где неврологическим расстройством, связанным с нейродегенерацией, является боковой амиотрофический склероз.
30. Применение по п.24, где Z и R1 являются липофильными группами.
31. Применение по п.24, где соединение выбрано из
3-(2,5-диметоксифенил)-1-пропил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,
3-(2,5-диметоксифенил)-1-проп-2-(Е)-енил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,
3-(3,4,5-триметоксифенил)-1-этил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,
3-фенил-1-пропил (2S)-1-(2-трет-бутил-1,2-диоксоэтил)-2-пирролидинкарбоксилата,
3-фенил-1-пропил (2S)-1-(2-циклогексилэтил-1,2-диоксоэтил)-2-пирролидинкарбоксилата,
3-(3-пиридил)-1-пропил (2S)-1-(2-циклогексилэтил-1,2-диоксоэтил)-2-пирролидинкарбоксилата,
3-(3-пиридил)-1-пропил (2S)-1-(2-трет-бутил-1,2-диоксоэтил)-2-пирролидинкарбоксилата,
3,3-дифенил-1-пропил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,
3-(3-пиридил)-1-пропил (2S)-1-(2-циклогексил-1,2-диоксоэтил)-2-пирролидинкарбоксилата,
3-(3-пиридил)-1-пропил (2S)-N-([2-тиенил]глиоксил)пирролидинкарбоксилата,
3,3-дифенил-1-пропил (2S)-1-(3,3-диметил-1,2-диоксобутил)-2-пирролидинкарбоксилата,
3,3-дифенил-1-пропил (2S)-1-циклогексилглиоксил-2-пирролидинкарбоксилата и
3,3-дифенил-1-пропил (2S)-1-(2-тиенил)глиоксил-2-пирролидинкарбоксилата.
32. Применение нейротрофного соединения формулы
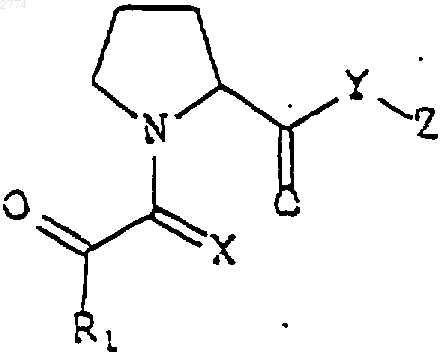
или его фармацевтически приемлемой соли или гидрата,
где R1 представляет собой
С1-С9алкильную шыш С2-С9алкенильную группу с прямой или разветвленной цепью, возможно замещенную С3-С8циклоалкилом,
С3 или С5циклоалкил,
С5-С7циклоалкенил,
где указанные алкильная, алкенильная, циклоалкильная или циклоалкенильная группы могут быть возможно замещены С1-С4алкилом, С2-С4алкенилом или гидроксилом, или
Аr1, где Ar1 выбран из группы, состоящей из 1-нафтила, 2-нафтила, 2-индолила, 3-индолила, 2-фурила, 3-фурила, 2-тиазолила, 2-тиенила, 3-тиенила, 2-, 3- или 4-пиридила и фенила, имеющих от одного до трех заместителей, которые независимо выбраны из группы, состоящей из водорода, галогена, гидроксила, нитрогруппы, трифторметила, прямого или разветвленного C1-С6алкила или С2-С6алкенила, С1-С4алкоксила или С2-С4алкенилоксила, феноксигруппы, бензилоксигруппы и аминогруппы;
Х является кислородом или серой;
Y является кислородом или NR2, где R2 является водородом или C1-С6алкилом; и
Z представляет собой
С2-С6алкил или алкенил с прямой или разветвленной цепью;
причем алкильная или алкенильная цепь замещена по одному или более чем одному положению Аr1, как он определен выше,
С3-С8циклоалкил,
циклоалкил, соединенный посредством C1-С6алкильной или С2-С6алкенильной прямой или неразветвленной цепи; или
Аr2, где Аr2 выбран из группы, состоящей из 2-индолила, 3-индолила, 2-фурила, 3-фурила, 2-тиазолила, 2-тиенила, 3-тиенила, 2-, 3- или 4-пиридила и фенила, имеющих от одного до трех заместителей, которые независимо выбраны из группы, состоящей из водорода, галогена, гидроксила, нитрогруппы, трифторметила, прямого или разветвленного С1-С6алкила или С2-С6алкенила, С1-С4алкоксила или С2-С4алкенилоксила, феноксигруппы, бензилоксигруппы и аминогруппы;
фрагмент

где R3 выбран из прямого или разветвленного С1-С8алкила, возможно замещенного С3-С8циклоалкилом или Аr1, как он определен выше, и незамещенного Аr1;
Х2 представляет собой О или NR5, где R5 выбран из водорода, прямого или разветвленного С1-С6алкила и С2-С6алкенила;
R4 выбран из группы, состоящей из фенила, бензила, прямого или разветвленного С1-С5алкила или С2-С5алкенила и прямого или разветвленного С1-С5алкила или С2-С5алкенила, замещенного фенилом;
в приготовлении лекарственного средства для стимулирования роста и регенерации нейронов, для лечения неврологического расстройства или для предупреждения нейродегенерации.
33. Применение по п.32, для стимулирования роста поврежденных периферических нервов.
34. Применение по п.32, где неврологическое расстройство выбрано из группы, состоящей из периферических невропатий и неврологических патологий, связанных с нейродегенерацией.
35. Применение по п.34, где неврологическим расстройством, связанным с нейродегенерацией, является болезнь Альцгеймера.
36. Применение по п.34, где неврологическим расстройством, связанным с нейродегенерацией, является болезнь Паркинсона.
37. Применение по п.34, где неврологическим расстройством, связанным с нейродегенерацией, является боковой амиотрофический склероз.
38. Применение по п.32, где Z и R1 являются липофильными группами.
39. Применение по п.32, где соединение выбрано из
3-фенил-1-пропил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,
3-(3-пиридил)-1-пропил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,
3-фенил-1-проп-2-(Е)-енил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,
3-(3,4,5-триметоксифенил)-1-пропил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,
3-(3,4,5-триметоксифенил)-1-проп-2-(Е)-енил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,
3-(4,5-дихлорфенил)-1-пропил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,
3-(4,5-дихлорофенил)-1-проп-2-(Е)-енил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,
3-(4,5-метилендиоксифенил)-1-пропил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,
3-(4,5-метилендиоксифенил)-1-проп-2-(Е)-енил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,
3-циклогексил-1-пропил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,
3-циклогексил-1-проп-2-(Е)-енил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,
(1R)-1,3-дифенил-1-пропил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,
(1R)-1,3-дифенил-1-проп-2-(Е)-енил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,
(1R)-1-циклогексил-3-фенил-1-пропил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,
(1R)-1-циклогексил-3-фенил-1-проп-2-(Е)-енил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,
(1R)-1-(4,5-дихлорофенил)-3-фенил-1-пропил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,
3-фенил-1-пропил (2S)-1-(1,2-диоксо-2-циклогексил)этил-2-пирролидинкарбоксилата,
3-фенил-1-пропил (2S)-1-(1,2-диоксо-4-циклогексил)бутил-2-пирролидинкарбоксилата,
3-фенил-1-пропил (2S)-1-(1,2-диоксо-2-[2-фуранил])этил-2-пирролидинкарбоксилата,
3-фенил-1-пропил (2S)-1-(1,2-диоксо-2-[2-тиенил])этил-2-пирролидинкарбоксилата,
3-фенил-1-пропил (2S)-1-(1,2-диоксо-2-[2-тиазолил])этил-2-пирролидинкарбоксилата,
3-фенил-1-пропил (2S)-1-(1,2-диоксо-2-фенил)этил-2-пирролидинкарбоксилата,
1,7-дифенил-4-гептил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,
3-фенил-1-пропил (2S)-1-(3,3-диметил-1,2-диоксо-4-гидроксибутил)-2-пирролидинкарбоксилата,
3-фенил-1-пропил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,
этилового эфира 1-[1-(3,3-диметил-1,2-диоксопентил)-L-пролин]-L-фенилаланина,
этилового эфира 1-[1-(3,3-диметил-1,2-диоксопентил)-L-пролин]-L-лейцина,
этилового эфира 1-[1-(3,3-диметил-1,2-диоксопентил)-L-пролин]-L-фенилглицина,
фенилового эфира 1-[1-(3,3-диметил-1,2-диоксопентил)-L-пролин]-L-фенилаланина,
бензилового эфира 1-[1-(3,3-диметил-1,2-диоксопентил)-L-пролин]-L-фенилаланина, и
этилового эфира 1-[1-(3,3-диметил-1,2-диоксопентил)-L-пролин]-L-изолейцина.
40. Применение нейротрофного соединения формулы
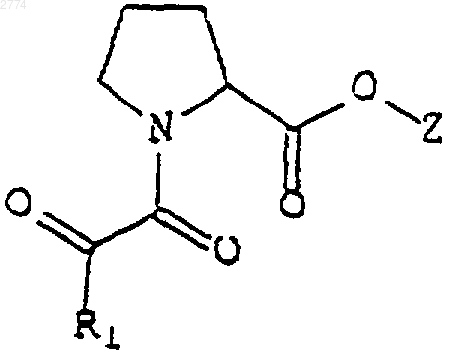
или его фармацевтически приемлемой соли или гидрата,
где R1 представляет собой
С1-С9алкильную или С2-С9алкенильную группу с прямой или разветвленной цепью, возможно замещенную С3-С8циклоалкилом,
С3 или С5циклоалкил,
С5-С7циклоалкенил,
где указанные алкильная, алкенильная, циклоалкильная или циклоалкенильная группы возможно могут быть замещены С1-C4алкилом, С2-C4алкенилом или гидроксилом, или
Аr1, где Аr1 выбран из группы, состоящей из 1-нафтила, 2-нафтила, 2-индолила, 3-индолила, 2-фурила, 3-фурила, 2-тиазолила, 2-тиенила, 3-тиенила, 2-, 3- или 4-пиридила и фенила, имеющих от одного до трех заместителей, которые независимо выбраны из группы, состоящей из водорода, галогена, гидроксила, нитрогруппы, трифторметила, прямого или разветвленного С1-С6алкшыр или С2-С6алкенила, С1-С4алкоксила или С2-С4алкенилоксила, феноксигруппы, бензилоксигруппы и аминогруппы;
Z представляет собой
С2-С6алкил или алкенил с прямой или разветвленной цепью;
причем алкильная или алкенильная цепь замещена по одному или более чем одному положению Ar1, как он определен выше,
С3-С8циклоалкил,
циклоалкил, соединенный посредством прямой или неразветвленной C1-С6алкильной или С2-С6алкенильной цепи; или
Аr2, где Аr2 выбран из группы, состоящей из 2-индолила, 3-индолила, 2-фурила, 3-фурила, 2-тиазолила, 2-тиенила, 3-тиенила, 2-, 3- или 4-пиридила и фенила, имеющих от одного до трех заместителей, которые независимо выбраны из группы, состоящей из водорода, галогена, гидроксила, нитрогруппы, трифторметила, прямого или разветвленного C1-С6алкила или С2-С6алкенила, С1-C4алкоксила или С2-С4алкенилоксила, феноксигруппы, бензилоксигруппы и аминогруппы;
в приготовлении лекарственного средства для стимулирования роста и регенерации нейронов, для лечения неврологического расстройства или для предупреждения нейродегенерации.
41. Применение по п.40, где R1 выбран из группы, состоящей из С1-С9алкила с прямой или разветвленной цепью, 2-циклогексила, 4-циклогексила, 2-фуранила, 2-тиенила, 2-тиазолила и 4-гидроксибутила.
42. Применение по п.40 для стимулирования роста поврежденных периферических нервов.
43. Применение по п.40, где неврологическое расстройство выбрано из группы, состоящей из периферических невропатий и неврологических патологий, связанных с нейродегенерацией.
44. Применение по п.40, где неврологическим расстройством, связанным с нейродегенерацией, является болезнь Альцгеймера.
45. Применение по п.40, где неврологическим расстройством, связанным с нейродегенерацией, является болезнь Паркинсона.
46. Применение по п.40, где неврологическим расстройством, связанным с нейродегенерацией, является боковой амиотрофический склероз.
47. Применение по п.40, где Z и R1 являются липофильными группами.
48. Применение нейротрофного соединения формулы
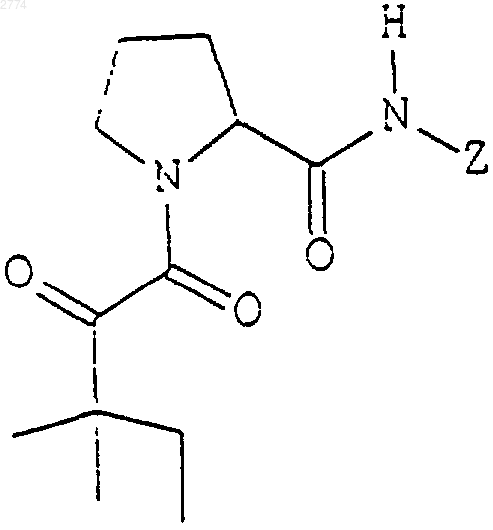
или его фармацевтически приемлемых солей или гидратов, где
Z представляет собой фрагмент

где R3 выбран из группы, состоящей из прямого или разветвленного С1-С8алкила, возможно замещенного С3-С8циклоалкилом или Аr1, как он определен выше, и незамещенного Ar1;
Х2 представляет собой О или NR5, где R5 выбран из группы, состоящей из водорода, прямого или разветвленного С1-С6алкила и С2-С6алкенила; и
R4 выбран из группы, состоящей из фенила, бензила, прямого или разветвленного С1-С5алкила или С2-С5алкенила и прямого или разветвленного С1-С5алкила или С2-С5алкенила, замещенного фенилом;
в приготовлении лекарственного средства для стимулирования роста и регенерации нейронов, для лечения неврологического расстройства или для предупреждения нейродегенерации.
49. Применение по п.48 для стимулирования роста поврежденных периферических нервов.
50. Применение по п.48, где неврологическое расстройство выбрано из группы, состоящей из периферических невропатий и неврологических патологий, связанных с нейродегенерацией.
51. Применение по п.48, где неврологическим расстройством, связанным с нейродегенерацией, является болезнь Альцгеймера.
52. Применение по п.48, где неврологическим расстройством, связанным с нейродегенерацией, является болезнь Паркинсона.
53. Применение по п.48, где неврологическим расстройством, связанным с нейродегенерацией, является боковой амиотрофический склероз.
54. Применение по п.48, где Z и R1 являются липофильными группами.
55. Применение нейротрофного N-глиоксилпролилэфирного соединения формулы
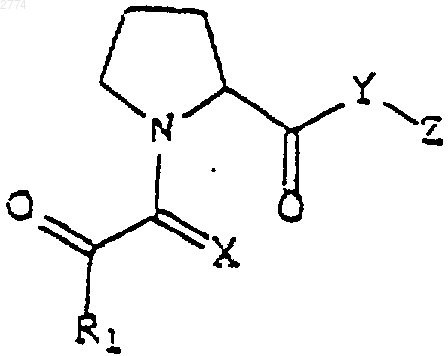
или его фармацевтически приемлемой соли или гидрата,
где R1 представляет собой
С1-С5алкильную или С2-С5алкенильную группу с прямой или разветвленной цепью, возможно замещенную С3-С6циклоалкилом, или
Ar1, где Ar1 выбран из группы, состоящей из 2-фурила, 2-тиенила и фенила; и
Х выбран из группы, состоящей из кислорода и серы;
Y является кислородом; и
Z представляет собой
С2-С6 алкил или алкенил с прямой или разветвленной цепью;
причем алкильная или алкенильная цепь замещена по одному или более чем одному положению Ar1, как он определен выше,
С3-С6циклоалкил; или
Аr2, где Аr2 выбран из 2-, 3- или 4-пиридила или фенила, имеющих от одного до трех заместителей, которые независимо выбраны из группы, состоящей из водорода и С1-C4алкокси;
в приготовлении лекарственного средства для стимулирования роста и регенерации нейронов, для лечения неврологического расстройства или для предупреждения нейродегенерации.
56. Применение по п.55 для стимулирования роста поврежденных периферических нервов.
57. Применение по п.55, где неврологическое расстройство выбрано из группы, состоящей из периферических невропатий и неврологических патологий, связанных с нейродегенерацией.
58. Применение по п.55, где неврологическим расстройством, связанным с нейродегенерацией, является болезнь Альцгеймера.
59. Применение по п.55, где неврологическим расстройством, связанным с нейродегенерацией, является болезнь Паркинсона.
60. Применение по п.55, где неврологическим расстройством, связанным с нейродегенерацией, является боковой амиотрофический склероз.
61. Применение по п.55, где Z и R1 являются липофильными группами.
62. Применение по п.55, где соединение выбрано из
3-(2,5-диметоксифенил)-1-пропил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,
3-(2,5-диметоксифенил)-1-проп-2-(Е)-енил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,
3-(3,4,5-триметоксифенил)-1-этил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,
3-фенил-1-пропил (2S)-1-(2-трет-бутил-1,2-диоксоэтил)-2-пирролидинкарбоксилата,
3-фенил-1-пропил (2S)-1-(2-циклогексилэтил-1,2-диоксоэтил)-2-пирролидинкарбоксилата,
3-(3-пиридил)-1-пропил (2S)-1-(2-циклогексилэтил-1,2-диоксоэтил)-2-пирролидинкарбоксилата,
3-(3-пиридил)-1-пропил (2S)-1-(2-трет-бутил-1,2-диоксоэтил)-2-пирролидинкарбоксилата,
3,3-дифенил-1-пропил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,
3-(3-пиридил)-1-пропил (2S)-1-(2-циклогексил-1,2-диоксоэтил)-2-пирролидинкарбоксилата,
3-(3-пиридил)-1-пропил (2S)-N-([2-тиeнил]глиoкcил)пиppoлидинкарбоксилата,
3,3-дифенил-1-пропил (2S)-1-(3,3-диметил-1,2-диоксобутил)-2-пирролидинкарбоксилата,
3,3-дифенил-1-пропил (2S)-1-циклогексилглиoксил-2-пирролидинкарбоксилата и
3,3-дифенил-1-пропил (2S)-1-(2-тиенил)глиоксил-2-пирролидинкарбоксилата.
Текст
1 Уровень техники Область изобретения. Настоящее изобретение относится к применению нейротрофных соединений для стимулирования роста и регенерации нейронов, для лечения неврологического расстройства и для предупреждения нейродегенерации и к их применению в приготовлении лекарственного средства для стимулирования роста и регенерации нейронов, для лечения неврологического расстройства и для предупреждения нейродегенерации. Предпосылки изобретения. Термин "иммунофилин" относится к ряду белков, служащих рецепторами основных иммунодепрессорных лекарственных средств, таких как циклоспорин A (CsA), FK506 и рапамицин. Известными классами иммунофилинов являются циклофилины и FК 506-связывающие белки, такие как FKBP. В то время как циклоспорин А связывается с циклофилином, FK506 и рапамицин связываются с FKBP. Указанные комплексы, образованные иммунофилином и лекарственным средством, задействованы в целом ряде внутриклеточных систем сигнальной трансдукции, в особенности в иммунной и нервной системах. Известно, что иммунофилины обладают пептидил-пролил-изомеразной (РРI) или ротамазной ферментативной активностью. Показано, что ротамазная активность задействована в катализе взаимного превращения цис- и трансизомеров иммунофилиновых белков. Иммунофилины были впервые открыты и изучены в иммунной ткани. Первоначально специалисты предполагали, что ингибирование ротамазной активности иммунофилинов приводит к подавлению пролиферации Т-клеток, что в свою очередь вызывает иммунодепрессорный эффект, свойственный иммунодепрессорным лекарственным препаратам, таким как циклоспорин А, FKBP и рапамицин. Как показали дальнейшие исследования, само по себе ингибирование ротамазной активности недостаточно для осуществления иммунодепрессорной активности (Schreiber et al., Science, 1990, vol. 250, pp. 556-559). Было продемонстрировано, что способ действия вышеупомянутых комплексов иммунофилина и лекарственного средства обусловлен их взаимодействием с тройными белкамимишенями (Schreiber et al., Cell, 1991, vol. 66, pp. 807-815). Комплексы, образованные лекарственным средством и иммунофилином (такие какFKBP-FK506 и FKBP-CsA), связываются с ферментом кальцинейрином, ингибируя передачу сигнала рецепторов Т-клеток, приводящую к пролиферации Т-клеток. Комплекс, образованный рапамицином и FKBP, взаимодействует аналогичным образом с белком RAFT1/FRAP и подавляет передачу сигнала от рецептора IL-2. Обнаружено, что иммунофилины присутствуют в высоких концентрациях в центральной 2 нервной системе, где их количество в 10-50 раз больше, нежели в иммунной системе. Как оказалось, в нервных тканях иммунофилины оказывают влияние на процесс роста нейрона, синтез оксида азота, а также выделение нейротрансмиттеров. Пикомолярные концентрации иммунодепрессантов, таких как FK506 и рапамицин, стимулируют внешний рост аксонов у клеток РС 12 и сенсорного нерва, в частности у клеток спинномозговых узлов (DRGs) (Lyons et al., Proc. ofNatl. Acad. Sci, 1994, vol. 91, pp. 3191-3195). В экспериментах, проведенных на целых животных, было установлено, что FK506 стимулирует регенерацию нервов после лицевой хирургии и вызывает восстановление функций у животных с повреждениями седалищного нерва. Удивительным оказался тот факт, что лекарственные препараты, обладающие высоким сродством к FKBP, являются мощными ингибиторами ротамазы, обладающими нейротрофным действием (Lyons et al.). На основе этих открытий было предложено использовать иммунодепрессанты при лечении различных периферических невропатий, а также для стимулирования процесса восстановления нервов в центральной нервной системе (CNS). Как показали проведенные исследования, причиной нейродегенеративных расстройств, таких как болезнь Альцгеймера, болезнь Паркинсона и боковой амиотрофический склероз (ALS), может служить потеря или снижение доступности нейротрофного вещества, специфичного для конкретной популяции нейронов, пораженных указанным заболеванием. Выявлено несколько нейротрофных факторов, воздействующих на определенные популяции нейронов в центральной нервной системе. В частности, было высказано предположение,что болезнь Альцгеймера возникает в результате уменьшения содержания или исчезновения нервного ростового фактора (NGF). В связи с этим было высказано предположение, что болезнь Альцгеймера можно лечить экзогенным нервным ростовым фактором или другими нейротрофными белками, такими как мозговой нервный фактор (BDNF), глиальный нервный фактор, цилиарный нейротрофный фактор, а также нейротропин-3, в результате чего будет наблюдаться повышение выживаемости дегенерирующей популяции нейронов. Клиническое применение указанных белков для лечения различных неврологических заболеваний затруднено сложностями введения и биологической доступности крупных белков по отношению к мишеням нервной системы. Напротив, иммунодепрессорным лекарственным средствам, обладающим нейротрофной активностью, свойственны относительно небольшие размеры, а также великолепные биологическая доступность и специфичность. Вместе с тем, при постоянном применении иммуноде 3 прессантов наблюдается ряд потенциально серьезных побочных эффектов, в том числе нейротоксичность (например нарушение клубочковой фильтрации и необратимый интерстициальный фиброз (Корр et al., 1991, J.Am. Soc.(например непроизвольные треморы) или неспецифическая церебральная стенокардия (например нелокализованные головные боли (DeGroen et al., 1987, Engl. J. Med. 317: 861; а также сосудистая гипертензия с проистекающими от нее осложнениями (Kahan et al., 1989, N.Engl. J. Med. 321: 1725). Задача настоящего изобретения заключается в том, чтобы предложить применение нейротрофных соединений, при котором исключены указанные выше побочные эффекты, ассоциированные с применением иммунодепрессорных соединений. Для решения поставленной задачи согласно настоящему изобретению предложено применение нового класса нейротрофных соединений, которые не являются иммунодепрессантами и являются ингибиторами ротамазы FKBP с молекулами небольшого размера, для стимуляции роста и регенерации нейронов при различных невропатологических состояниях, когда может быть облегчено восстановление нервов, в частности, при повреждении периферических нервов в результате физической травмы или болезненного состояния, таких как диабет, физическое повреждение центральной нервной системы (спинного или головного мозга), повреждение мозга при сотрясении, а также для лечения неврологических заболеваний, сопровождающихся нейродегенерацией, в том числе болезни Паркинсона, болезни Альцгеймера и бокового амиотрофического склероза. Краткое описание изобретения Настоящее изобретение относится к применению нейротрофных соединений нового класса, обладающих сродством к иммунофилинам FKBP-типа. Связанные с указанными белками, рассматриваемые нейротрофные соединения являются мощными ингибиторами ферментативной активности, ассоциированной с иммунофилиновыми белками, конкретно - ферментативной активности ротамазы, в результате чего происходит стимуляция регенерации и удлинения нейронов. Ключевой отличительной особенностью соединений, предусмотренных настоящим изобретением, является отсутствие у них сколь бы то ни было существенной иммуносупрессорной активности в дополнение к их нейротрофной активности. В одном варианте воплощения настоящего изобретения предложено применение нейротрофного соединения формулы или его фармацевтически приемлемой соли или гидрата,где R1 представляет собой С 1-C9 алкильную или С 2-С 9 алкенильную группу с прямой или разветвленной цепью, возможно замещенную С 3-С 8 циклоалкилом,С 3 или С 5 циклоалкил,С 5-С 7 циклоалкенил,где указанные алкильная, алкенильная, циклоалкильная или циклоалкенильная группы могут быть возможно замещены С 1-C4 алкилом, С 2 С 4 алкенилом или гидроксилом,или Аr1, где Ar1 выбран из группы, состоящей из 1-нафтила, 2-нафтила, 2-индолила,3-индолила, 2-фурила, 3-фурила, 2-тиазолила, 2 тиенила, 3-тиенила, 2-, 3- или 4-пиридила и фенила, имеющих от одного до трех заместителей,которые независимо выбраны из группы, состоящей из водорода, галогена, гидроксила,нитрогруппы, трифторметила, прямого или разветвленного С 1-С 6 алкила или С 2-С 6 алкенила, С 1 С 4 алкоксила или С 2-С 4 алкенилоксила, феноксигруппы, бензилоксигруппы и аминогруппы; Х является кислородом или серой;Y является кислородом или NR2, где R2 является водородом или С 1-С 6 алкилом; иZ представляет собой С 2-С 6 алкил или алкенил с прямой или разветвленной цепью; причем алкильная или алкенильная цепь замещена по одному или более чем одному положению Аr1, как он определен выше,С 3-С 8 циклоалкил,циклоалкил, соединенный посредством С 1-С 6 алкильной или С 2-С 6 алкенильной прямой или неразветвленной цепи; или Аr2, где Аr2 выбран из группы, состоящей из 2-индолила, 3-индолила, 2-фурила, 3-фурила,2-тиазолила, 2-тиенила, 3-тиенила, 2-, 3- или 4 пиридила и фенила, имеющих от одного до трех заместителей, которые независимо выбраны из группы, состоящей из водорода, галогена, гидроксила, нитрогруппы, трифторметила, прямого или разветвленного C1-С 6 алкила или С 2 С 9 алкенила, С 1-С 4 алкоксила или С 2-С 4 алкенилоксила, феноксигруппы, бензилоксигруппы и аминогруппы; фрагмент где R3 выбран из прямого или разветвленногоC1-С 8 алкила, возможно замещенного С 3 С 8 циклоалкилом или Ar1, как он определен выше, и незамещенного Ar1; 5 Х 2 представляет собой О или NR5, где R5 выбран из водорода, прямого или разветвленного C1-С 6 алкила и С 2-С 6 алкенила;R4 выбран из группы, состоящей из фенила, бензила, прямого или разветвленного С 1 С 5 алкила или С 2-С 5 алкенила, и прямого или разветвленного С 1-С 5 алкила или С 2-С 5 алкенила,замещенного фенилом; для стимулирования роста и регенерации нейронов, для лечения неврологического расстройства или для предупреждения нейродегенерации. К числу предпочтительных соединений,применяемых согласно настоящему изобретению, относятся следующие соединения: 3-фенил-1-пропил (2S)-1-(3,3-диметил-1,2 диоксопентил)-2-пирролидинкарбоксилат,3-(3-пиридил)-1-пропил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилат,3-фенил-1-проп-2-(Е)-енил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилат,3-(3,4,5-триметоксифенил)-1-пропил (2S)1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилат,3-(3,4,5-триметоксифенил)-1-проп-2-(Е)енил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2 пирролидинкарбоксилат,3-(4,5-дихлорфенил)-1-пропил (2S)-1-(3,3 диметил-1,2-диоксопентил)-2-пирролидинкарбоксилат,3-(4,5-дихлорофенил)-1-проп-2-(Е)-енил(2S)-1-(1,2-диоксо-2 фенил)этил-2-пирролидинкарбоксилат,1,7-дифенил-4-гептил (2S)-1-(3,3-диметил 1,2-диоксопентил)-2-пирролидинкарбоксилат,3-фенил-1-пропил (2S)-1-(3,3-диметил-1,2 диоксо-4-гидроксибутил)-2-пирролидинкарбоксилат,3-фенил-1-пропил (2S)-1-(3,3-диметил-1,2 диоксопентил)-2-пирролидинкарбоксилат,этилового эфира 1-[1-(3,3-диметил-1,2 диоксопентил)-1-пролин]-L-фенилаланин,этилового эфира 1-[1-(3,3-диметил-1,2 диоксопентил)-1-пролин]-L-лейцин,этилового эфира 1-[1-(3,3-диметил-1,2 диоксопентил)-L-пролин]-L-фенилглицин,фенилового эфира 1-[1-(3,3-диметил-1,2 диоксопентил)-L-пролин]-L-фенилаланин,бензилового эфира 1-[1-(3,3-диметил-1,2 диоксопентил)-L-пролин]-L-фенилаланин и этилового эфира 1-[1-(3,3-диметил-1,2 диоксопентил)-L-пролин]-L-изолейцин. В еще одном варианте воплощения настоящего изобретения предложено применение нейротрофного соединения формулы или его фармацевтически приемлемой соли или гидрата,где R1 представляет собой С 1-С 9 алкильную или С 2-С 9 алкенильную группу с прямой или разветвленной цепью, возможно замещенную С 3-С 8 циклоалкилом,С 3 или С 5 циклоалкил,С 5-С 7 циклоалкенил,где указанные алкильная, алкенильная, циклоалкильная или циклоалкенильная группы возможно могут быть замещены С 1-C4 алкилом, С 2 С 4 алкенилом или гидроксилом,или Аr1, где Аr1 выбран из группы, состоящей из 1-нафтила, 2-нафтила, 2-индолила,3-индолила, 2-фурила, 3-фурила, 2-тиазолила, 2 тиенила, 3-тиенила, 2-, 3- или 4-пиридила и фенила, имеющих от одного до трех заместителей,которые независимо выбраны из группы, состоящей из водорода, галогена, гидроксила,нитрогруппы, трифторметила, прямого или разветвленного С 1-С 6 алкила или С 2-С 6 алкенила, С 1 7 С 4 алкоксила или С 2-С 4 алкенилоксила, феноксигруппы, бензилоксигруппы и аминогруппы;Z представляет собой С 2-С 6 алкил или алкенил с прямой или разветвленной цепью; причем алкильная или алкенильная цепь замещена по одному или более чем одному положению Аr1, как он определен выше,С 3-С 8 циклоалкил,циклоалкил, соединенный посредством прямой или неразветвленной C1-С 6 алкильной или С 2-С 6 алкенильной цепи; или Аr2, где Аr2 выбран из группы, состоящей из 2-индолила, 3-индолила, 2-фурила, 3-фурила,2-тиазолила, 2-тиенила, 3-тиенила, 2-, 3- или 4 пиридила и фенила, имеющих от одного до трех заместителей, которые независимо выбраны из группы, состоящей из водорода, галогена, гидроксила, нитрогруппы, трифторметила, прямого или разветвленного С 1-С 6 алкила или С 2 С 6 алкенила, С 1-С 4 алкоксила или С 2-С 4 алкенилоксила, феноксигруппы, бензилоксигруппы и аминогруппы; для стимулирования роста и регенерации нейронов, для лечения неврологического расстройства или для предупреждения нейродегенерации. В еще одном варианте воплощения настоящего изобретения предложено применение нейротрофного соединения формулы или его фармацевтически приемлемых солей или гидратов,где Z представляет собой фрагмент где R3 выбран из группы, состоящей из прямого или разветвленного С 1-С 8 алкила, возможно замещенного С 3-С 8 циклоалкилом или Аr1, как он определен выше, и незамещенного Ar1; Х 2 представляет собой О или NR5, где R5 выбран из группы, состоящей из водорода, прямого или разветвленного С 1-С 6 алкила и С 2 С 6 алкенила; иR4 выбран из группы, состоящей из фенила, бензила, прямого или разветвленного С 1 С 5 алкила или С 2-С 5 алкенила, и прямого или разветвленного С 1-С 5 алкила или С 2-С 5 алкенила,замещенного фенилом; для стимулирования роста и регенерации нейронов, для лечения неврологического расстройства или для предупреждения нейродегенерации. 8 В другом варианте воплощения настоящего изобретения предложено применение нейротрофного N-глиоксилпролилэфирного соединения формулы или его фармацевтически приемлемой соли или гидрата,где R1 представляет собой С 1-C5 алкильную или С 2-С 5 алкенильную группу с прямой или разветвленной цепью, возможно замещенную С 3-С 6 циклоалкилом,или Ar1, где Ar1 выбран из группы, состоящей из 2-фурила, 2-тиенила и фенила; и Х выбран из группы, состоящей из кислорода и серы;Z представляет собой С 2-С 6 алкил или алкенил с прямой или разветвленной цепью; причем алкильная или алкенильная цепь замещена по одному или более чем одному положению Ar1, как он определен выше,С 3-С 6 циклоалкил; или Аr2, где Аr2 выбран из 2-, 3- или 4 пиридила или фенила, имеющих от одного до трех заместителей, которые независимо выбраны из группы, состоящей из водорода и С 1C4 алкокси; для стимулирования роста и регенерации нейронов, для лечения неврологического расстройства или для предупреждения нейродегенерации. Наиболее предпочтительными нейротрофными N-глиоксилпролилэфирными соединениями приведенной выше формулы являются следующие соединения: 3-(2,5-диметоксифенил)-1-пропил (2S)-1(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилат,3-(2,5-диметоксифенил)-1-проп-2-(Е)-енил(2S)-1-(2-тиенил) глиоксил-2-пирролидинкарбоксилат. Другим предпочтительным вариантом воплощения изобретения является применение указанных выше нейротрофных соединений в приготовлении лекарственного средства для стимулирования роста и регенерации нейронов,для лечения неврологического расстройства или для предупреждения нейродегенерации. Краткое описание графических материалов На фиг. 1 приведена микрофотография спинно-мозгового узла цыпленка, обработанного соединением, описанным в примере 17, взятым в различных концентрациях. Как следует из фиг. 1, соединение, соответствующее примеру 17 настоящего изобретения, оказывает мощное активирующее действие на удлинение аксонов в культурах сенсорных нейронов. Культуры эксплантов, выделенных на 9-10 день эмбрионального развития цыпленка из спинно-мозгового узла, обрабатывали различными концентрациями соединения из примера 17. Через 48 ч подсчитывали количество аксонов, длина которых превышала соответствующий показатель для исходного экспланта DRG. Из указанной величины вычитали количество аналогичных аксонов в эксплантах, не обработанных соединением из примера 17, в результате чего получали показатель, характеризующий стимуляцию удлинения аксонов под действием соединения из примера 17. Представлены микрофотографииDRG's, обработанных соединением из примера 17, а также количественное дозо-зависимое удлинение аксонов, вызванное соединением из примера 17. На фиг. 2 графически представлены количественные показатели удлинения аксонов в спинно-мозговых узлах цыпленка, обработанных различными концентрациями соединения из примера 17. Как следует из фиг. 2, соединение, соответствующее примеру 17 настоящего изобретения, оказывает мощное активирующее действие на удлинение аксонов в культурах чувствительных нейронов. Культуры эксплантов, выделенных на 9-10 день эмбрионального развития цыпленка из спинно-мозговых узлов,обрабатывали различными концентрациями соединения из примера 17. Через 48 ч подсчитывали количество аксонов, длина которых превышала соответствующий показатель для исходного экспланта DRG. Из указанной величины вычитали количество аналогичных аксонов в эксплантах, не обработанных соединением из 10 примера 17, в результате чего получали показатель, характеризующий стимуляцию удлинения аксонов под действием соединения из примера 17. Представлены количественные зависимости"доза-эффект" удлинения аксонов под действием соединения из примера 17. Фиг. 3 представляет собой микрофотографию срезов седалищного нерва крысы. Как следует из фиг. 3, соединение, описанное в примере 1 настоящего изобретения, активирует регенерацию нейронов после повреждения седалищного нерва. У самцов крыс линии SpragueDawley, весящих 150 г, сдавливали седалищные нервы на уровне бедер. В течение последующего 21-го дня указанным крысам ежедневно проводили однократное подкожное введение соединения из примера 1 (30 мг/кг), неактивного соединения (30 мг/кг), либо липидного носителя. Затем животных умерщвляли, выделяли седалищные нервы, получали срезы нервов на участке 2 мм дистальнее повреждения и окрашивали их серебряным красителем Хольмса(увеличение 630 х) представлены срезы седалищного нерва у только что прооперированных крыс, а также животных, обработанных носителем, соединением из примера 1, либо неактивным соединением; по 4 животных на группу. На фиг. 4 графически представлено [3H]CFT связывание на мкг стриарного мембранного белка. Как видно из фиг. 4, нейроиммунофилиновые лиганды, предусмотренные настоящим изобретением, активируют восстановление дофаминовых нейронов мыши после обработки МРТР. Мышам линии CD1, весящим 25 г, ежедневно в течение 5 дней внутрибрюшинно вводили 30 мг/кг МРТР. Кроме того, указанным животным ежедневно в течение всего срока применения МРТР, а также последующих 5 дней проводили подкожное введение липидного носителя, соединения из примера 1 (100 мг/кг),либо соединения из примера 17 (40, 20 или 10 мг/кг). Через еще 18 дней мышей умерщвляли,полосатые тела, выделенные из 5 животных каждой группы, объединяли, а затем использовали их для получения препаратов отмытых мембран. Для того чтобы определить количество транспортеров дофамина на живых нервных окончаниях, оценивали интенсивность связывания[3H]-CFT с препаратами стриарных мембран,полученными из различных групп животных. Интенсивность связывания в присутствии 10 мкМ немеченного CFT служила показателем неспецифического связывания; данную величину вычитали из показателя общей интенсивности связывания, в результате чего получали характеристику специфического [3H]-CFT связывания. Интенсивность связывания служила показателем количества соответствующего белка в стриарных мембранах каждой из эксперимен 11 тальных групп. Для того чтобы получить данные о количестве тирозин-гидролазы (ТН) в полосатом теле, в пучках аксонов средней части переднего мозга, а также о нигральном уровне фермента (что является характеристикой функциональных дофаминергических нейронов),венечные и саггитальные срезы головного мозга животных, обработанных либо МРТР, либо лекарственным препаратом, окрашивали антитирозингидролазным Ig. На фиг. 5 приведена гистограмма для [3H]CFT, построенная для 200 мкг мембранного белка. Как видно из фиг. 5, нейроиммунофилиновые лиганды, предусмотренные настоящим изобретением, активируют восстановление дофаминовых нейронов после обработки мышей МРТР в соответствии с методикой, описанной для фиг. 4. Фиг. 6 представляет собой микрофотографию (увеличение 630 х) венечных и саггитальных срезов головного мозга. На Фиг. 6 показаны срезы головного мозга, окрашенные антитирозин-гидроксилазным Ig; при этом подопытные животные были обработаны либо МРТР,либо лекарственным средством; указанная обработка позволяет оценить количество ТН в полосатом теле, что является характеристикой функциональных дофаминергических нейронов. Фиг. 7 представляет собой микрофотографию (увеличение 50 х) венечных и саггитальных срезов головного мозга. На фиг. 7 показаны срезы головного мозга, окрашенные антитирозингидроксилазным Ig; при этом подопытные животные были обработаны либо МРТР, либо лекарственным средством; указанная обработка позволяет оценить нигральные уровни ТН, что является характеристикой функциональных дофаминергических нейронов. Фиг. 8 представляет собой микрофотографию (увеличение 400 х) венечных и саггитальных срезов головного мозга. На фиг. 8 показаны срезы головного мозга, окрашенные антитирозин-гидроксилазным Ig; при этом подопытные животные были обработаны либо МРТР,либо лекарственным средством; указанная обработка позволяет оценить количество ТН в пучках аксонов средней части переднего мозга,что является характеристикой функциональных дофаминергических нейронов. Детальное описание изобретения Предусмотренные настоящим изобретением нейротрофные соединения характеризуются относительно небольшим размером молекул по сравнению с другими известными соединениями, такими как рапамицин, FK506 и циклоспорин, способными связываться с иммунофилинами типа FKBP. Предусмотренные настоящим изобретением нейротрофные соединения обладают сродством к белкам, связывающим FK-506, таким какFKBP-12. Неожиданно оказалось, что при связывании с FKBP предусмотренные настоящим 12 изобретением нейротрофные соединения ингибируют пролилпептидил цис-транс-изомеразную или ротамазную активности связывающего белка и стимулируют рост аксонов при отсутствии иммуносупрессорного эффекта. Предусмотренные настоящим изобретением соединения существуют в форме стереоизомеров либо энантиомеров, либо диастереоизомеров. Стереохимия в положении 1 (см. формулу 1) - R или S, однако S-конфигурация является предпочтительной. Настоящее изобретение охватывает применение энантиомеров, рацемической формы, а также смесей диастереоизомеров. Разделение энантиомеров и диастереоизомеров можно проводить методами, хорошо известными специалистам. Известно, что иммунофилины, такие какFKBP, предпочтительно распознают пептидные субстраты, содержащие мотивы Xaa-Pro-Yaa,где Хаа и Yaa обозначают липофильные аминокислотные остатки (Schreiber et al., 1990, J. Org.Chem. 55, 4984-4986; Harrison and Stein, 1990,Biochemistry, 29, 3813-3816). Модифицированные таким образом соединения, являющиеся пролилсодержащими псевдосимметричными пептидами, несущими липофильные заместители, должны с высокой эффективностью связываться с гидрофобным остовом активного сайтаFKBP и ингибировать его ротамазную активность. В структуру предпочтительных соединений, предусмотренных настоящим изобретением, входят группы R1, не являющиеся стереохимически объемными по сравнению с известными формой и размером гидрофобного остова в активном сайте молекулы FKBP. В соответствии с этим очень крупные и/или в высокой степени замещенные группы R1 должны связываться с активным сайтом FKBP с меньшей эффективностью. Предусмотренные настоящим изобретением соединения можно применять в форме солей,образованных неорганическими или органическими кислотами и основаниями. К числу указанных солей, образованных кислотами, принадлежат следующие: ацетат, адипат, альгинат,аспартат, бензоат, бензолсульфонат, бисульфат,бутират, цитрат, камфорат, камфорсульфонат,циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, фумарат, глюкогептаноат, глицерофосфат, гемисульфат, гептаноат,гексаноат, гидрохлорид, гидробромид, гидроиодид, 2-гидроксиэтансульфонат, лактат, малеат,метансульфонат, 2-нафтилсульфонат, никотинат, оксалат, памоат, пектинат, пропионат, сукцинат, тартрат, тиоционат, тозилат, а также ундеканоат. К числу солей, образованных основаниями, относятся соли аммония, соли щелочных металлов (такие как натриевые и калиевые соли), соли щелочно-земельных металлов (такие как кальциевые и магниевые соли), соли, образованные органическими основаниями (такие 13 как соли дициклогексиламина и N-метил-Dглюкамина), а также соли, образованные аминокислотами (такими как аргинин, лизин и т.п.). Кроме того, основные азотсодержащие группы могут быть кватернизированы с помощью таких агентов, как галогениды низших алкилов (например метил-, этил-, пропил- и пентил- хлориды, бромиды или иодиды), диалкилсульфаты(например диметил-, диэтил-, дибутил- и диамилсульфаты), галогениды длинноцепочечных углеводородов (например децил-, лаурил-, миристил- и стеарилхлориды, бромиды или иодиды), аралкилгалогениды (например бензил- и фенилэтилбромиды), а также другие соединения. При этом получают продукты, растворимые или диспергируемые в воде или масле. Предусмотренными настоящим изобретением нейротрофными соединениями можно периодически воздействовать на пациента, проходящего лечение по поводу неврологических расстройств, либо в других целях, когда желательно стимулировать регенерацию и рост нервов, например при различных периферических невропатических и неврологических расстройствах, сопровождающихся нейродегенерацией. Кроме того, предусмотренные настоящим изобретением соединения можно применять для животных, отличных от человека, при лечении разнообразных неврологических расстройств млекопитающих. Предусмотренные настоящим изобретением новые соединения являются мощными ингибиторами ротамазной активности и оказывают великолепный неврологический эффект. Указанный эффект может быть использован для стимуляции поврежденных нейронов, активации регенерации нейронов, предотвращения нейродеградации, а также при лечении некоторых неврологических расстройств, которые, как известно, сопровождаются деградацией нейронов и периферическими невропатиями. К числу указанных неврологических расстройств, для лечения которых можно применять вышеописанные соединения, относятся, в частности, невралгия тройничного нерва, невралгия языко-глоточного нерва, тяжелая псевдопаралитическая миастения, паралич Белла, мускульная дистрофия, боковой амиотрофический склероз, прогрессирующая мышечная атрофия, прогрессирующая бульбарная наследственная мышечная атрофия,синдромы, обусловленные выпячиваниями, разрывами или опущениями межпозвонковых дисков, шейный спондилез, заболевания сплетений,синдромы сквозных повреждений грудной клетки, периферическая невропатия (вызываемая, в частности, отравлениями свинцом, дапсоном,укусами клещей), порфирия, или синдром Гийена-Барре-Штроля, болезнь Альцгеймера, болезнь Паркинсона, а также другие заболевания. В указанных целях предусмотренные настоящим изобретением соединения можно вводить перорально, парентерально, посредством 14 ингаляции, местно, ректально, назально, буккально, вагинально или с помощью имплантируемой емкости, с использованием дозированных составов, содержащих традиционные нетоксичные фармацевтически приемлемые носители, адъюванты и наполнители. В настоящей заявке понятие "парентеральное введение" включает в себя подкожное, внутривенное,внутримышечное, внутрибрюшинное, внутрикапсульное, внутрижелудочковое, внутригрудинное или внутричерепное введение посредством инъекции или вливания. Для того чтобы комплекс, образованный иммунофилином и лекарственным соединением,оказался терапевтически эффективным по отношению к мишеням центральной нервной системы, он должен успешно преодолевать гематоэнцефалический барьер в случае периферического введения. Предусмотренные настоящим изобретением соединения, не способные преодолевать гематоэнцефалический барьер, можно успешно применять путем внутрижелудочкового введения. Фармацевтические составы могут находиться в форме стерильного препарата, предназначенного для инъекции, например в виде стерильной водной или масляной суспензии, предназначенной для инъекции. Указанная суспензия может быть получена в соответствии с хорошо известными из уровня техники способами с использованием приемлемых диспергирующих или смачивающих агентов, а также суспендирующих агентов. Кроме того, инъецируемый стерильный препарат может представлять собой предназначенный для инъекции стерильный раствор или суспензию в нетоксичном разбавителе или растворителе, пригодном для парентерального введения (например, раствор в 1,3 бутандиоле). К числу приемлемых носителей и растворителей, пригодных для такого рода применения, относятся вода, раствор Рингера, а также изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или суспензионной среды традиционно используют стерильные стабильные масла. Для этих целей может быть использовано любое стабильное мягкое масло, в том числе искусственные моноили диглицериды. Жирные кислоты, такие как масляная кислота и ее глицеридные производные, а также оливковое и касторовое масла(особенно в своих полиоксиэтилированных формах), находят применение при производстве инъецируемых препаратов. Кроме того, указанные масляные растворы или суспензии могут содержать в качестве разбавителей или диспергирующих агентов спирты с длинными углеводородными цепями. Указанные соединения можно вводить перорально, например в форме капсул или таблеток, либо в виде водной суспензии или раствора. При получении таблеток, предназначенных для перорального введения, традиционно исполь 15 зуемыми носителями являются лактоза и кукурузный крахмал. Кроме того, обычно добавляют смазывающие, скользящие агенты, такие как стеарат магния. К числу удобных разбавителей,используемых при получении капсул для перорального введения, относятся лактоза и сухой кукурузный крахмал. В том случае, если для перорального введения используют водные суспензии, активный ингредиент комбинируют с эмульгирующими и суспендирующими агентами. При желании можно добавлять определенные подсластители, ароматизаторы и/или красители. Предусмотренные настоящим изобретением соединения также можно применять в форме суппозиториев, предназначенных для ректального введения соответствующего лекарственного средства. Подобные составы могут быть получены при смешивании указанного лекарственного средства с приемлемым не раздражающим эксципиентом, для которого характерно твердое состояние при комнатной температуре,но жидкое состояние при температуре прямой кишки, в результате чего рассматриваемый эксципиент должен таять в прямой кишке и высвобождать указанное лекарственное средство. К числу такого рода веществ относятся масло какао, пчелиный воск, а также полиэтиленгликоли. Предусмотренные настоящим изобретением соединения также можно вводить местно,особенно в том случае, если требующие лечения симптомы затрагивают участки или органы,полностью доступные для местной обработки; к числу подобных заболеваний относятся неврологические болезни глаз, кожи или нижних отделов кишечного тракта. Соответствующие составы, предназначенные для местного применения, могут быть приготовлены для каждой из указанных частей тела. В случае введения через слизистую глаза указанные соединения можно применять в форме микроскопически тонких суспензий в изотоническом стерильном солевом растворе с установленным рН, либо, в предпочтительном случае, в виде растворов в изотонических стерильных солевых растворах с установленным рН,возможно содержащих консерванты, такие как хлорид бензилалкония. В альтернативном случае введения через слизистую глаза рассматриваемые соединения можно применять в составе мази, например на вазелиновой основе. При местном нанесении на кожу указанные соединения можно применять в форме приемлемой мази, включающей в себя соответствующее соединение, суспендированное или растворенное например в смеси, содержащей одно или несколько следующих веществ: минеральное масло, жидкий вазелин, белый вазелин,пропиленгликоль, полиоксиэтиленовое или полиоксипропиленовое соединение, эмульгирующий воск, а также воду. В альтернативном слу 002774 16 чае рассматриваемое соединение можно применять в форме приемлемого лосьона или крема,включающего в себя соответствующее активное соединение, суспендированное или растворенное в смеси, содержащей, например, одно или несколько следующих веществ: минеральное масло, моностеарат сорбитана, полисорбат 60,цетилэфирный воск, цетеариловый спирт, 2 октилдодеканол, бензиловый спирт, а также воду. Местное введение через нижние отделы кишечного тракта может быть достигнуто с использованием препарата, представляющего собой ректальный суппозиторий (см. выше), либо с помощью приемлемого состава, вводимого посредством клизмы. Для лечения вышеупомянутых симптомов указанные соединения, представляющие собой активный ингредиент, можно использовать в дозах в пределах от 0,1 до 10000 мг; предпочтительные дозы находятся в пределах от 0,1 до 1000 мг. Конкретное количество активного ингредиента, смешиваемого с соответствующими веществами-носителями при получении разовой дозовой формы, зависит от особенностей конкретного пациента, а также способа введения. Вместе с тем, хорошо известно, что конкретный уровень дозы для каждого конкретного пациента зависит от целого ряда факторов,включая активность используемого конкретного соединения, возраст, вес тела, общее состояние здоровья, пол, тип диеты, длительность применения, интенсивность выведения, комбинацию активных ингредиентов, степень тяжести конкретного заболевания, лечение которого проводят указанным соединением, а также способ введения. Рассматриваемые соединения могут быть введены совместно с другими нейротрофными агентами, такими как нейротрофный фактор роста (NGF), глиальный фактор роста, мозговой фактор роста, цилиарный нейротрофный фактор, а также нейротропин-3. Дозовое количество подобных активных ингредиентов, обладающих нейротрофной активностью, должно зависеть от вышеописанных параметров, а также от эффективности используемой комбинации активных ингредиентов. Способ определения Кi Способность применяемых согласно настоящему изобретению соединений ингибировать указанную пептидилпролилизомеразную(ротамазную) активность можно оценить с помощью хорошо известных методов, описанных в литературе (Harding, M.W. et al. Nature 341: 758-760 (1989); Holt et al. J. Am. Chem. Soc. 115: 9923-9938). Соответствующие значения, выраженные в виде констант ингибирования (Кi),представлены в табл. 1. Интенсивность цистранс-изомеризации связи, образованной между остатками аланина и пролина, спектроскопически оценивают на модельном субстрате, N 17 сукцинил-Ала-Ала-Про-Фен-п-нитроанилиде, с использованием теста со связанным химотрипсином, обеспечивающего высвобождение паранитроанилида из транс-формы указанного субстрата. Измеряют интенсивность ингибирования данной реакции, обусловленную добавками различных концентраций ингибитора, после чего анализируют полученные данные, рассматривая изменение первого порядка константы скорости как функцию от концентрации ингибитора, с получением округленных значений Кi. В пластиковую кювету добавляют 950 мл ледяного буфера для тестирования (25 мМ 18 химотрипсина (50 мг/мл в 1 мМ HCl), а также исследуемое соединение, растворенное в различных концентрациях в 10 мл диметилсульфоксида. Инициируют реакцию, добавляя 5 мл субстрата (сукцинил-Ала-Фен-Про-пара-нитроанилид, 5 мг/мл в 2,35 мМ LiCl в трифторэтаноле). С помощью спектрофотометра в течение 90 с регистрируют интенсивность поглощения при 390 нм, и на основании полученных данных, характеризующих временную динамику интенсивности поглощения, определяют константы скорости реакции. Результаты, полученные в указанных экспериментах, представлены в табл. I. Таблица I нием, способствуют диссоциации FKBP-12 из указанных комплексов, в результате чего соответствующий кальциевый канал начинает "протекать" (Cameron et al., 1995). Кальциевые потоки задействованы в регуляции удлинения аксо 19 нов, поэтому рецепторы инозитолтрифосфата и рианодина могут принимать участие в реализации нейротрофных эффектов, свойственных рассматриваемым лекарственным средствам. Поскольку указанные лекарственные средства связываются с тем же самым сайтом молекулыFKBP-12, что и рецептор IP3R, можно предположить, что рассматриваемые лекарства вытесняют каналы из FKBP-12. Культуры спинно-мозговых узлов цыпленка и удлинение аксонов Выделение спинно-мозговых узлов из зародышей цыпленка проводили на десятый день после оплодотворения. Целые экспланты ганглиев культивировали при температуре 37 С в атмосфере с 5%-м содержанием СO2; культивирование проводили в 12-луночных планшетах,покрытых тонким слоем Matrigel, на среде Либовица L15 плюс глюкозная среда с добавками 2 мМ глутамина и 10%-й фетальной сыворотки теленка, а также 10 мкМ цитозинD арабинофуранозида (Аrа С). Через 24 ч указанныеDRG's обрабатывали различными концентрациями нервного ростового фактора, иммунофилиновыми лигандами, либо комбинациями NGF плюс исследуемые лекарственные средства. Через 48 ч после вышеописанной обработки лекарственным средством проводили визуальное исследование тестируемых ганглиев под инвертированным микроскопом Zeiss Axiovert с использованием фазового контраста, либо контраста Hoffman Modulation. Получали микрофотографии исследуемых эксплантов и измеряли удлинение аксонов. Аксоны, длина которых превышала диаметр DRG, рассматривали в качестве позитивных. Кроме того, проводили учет общего количества аксонов в каждом из вариантов эксперимента. В одной лунке культивировали от 3 до 4 DRG's, каждый вариант обработки повторяли два раза. Данные, полученные в вышеописанных экспериментах, представлены в табл. II. Репрезентативные микрофотографии, полученные при использовании соединения примера 17, представлены на фиг. 1; кривая зависимости "дозаответ" для этого соединения приведена на фиг. 2. Таблица II Удлинение аксонов в DRG цыпленка ПримерЭД 50, удлинения аксонов, нм 1 53 2 105 3 149 4 190 5 10 6 75 10 0,46 11 0,015 14 2 15 0,8 16 0,015 Аксотомия седалищного нерва У анестезированных шестинедельных самцов крыс линии Sprague-Dawley на уровне бедра обнажали седалищный нерв и сдавливали его с помощью пинцета. Непосредственно перед нанесением указанного повреждения крысам подкожно вводили исследуемые соединения или носитель, после чего ежедневно повторяли данное введение в течение еще 18 дней. Получали срезы поврежденного седалищного нерва, окрашивали их серебряным красителем Хольмса(для определения количества аксонов), а также красителем Luxol быстрым синим (для количественного определения интенсивности миелинизации). У животных, обработанных носителем, через 18 дней после нанесения исходного повреждения наблюдали достоверное снижение количества аксонов (50%-е снижение по отношению к неповрежденному контролю), а также интенсивности миелинизации (90%-е снижение по отношению к неповрежденному контролю). По сравнению с животными, обработанными носителем, у подопытных крыс, которым непосредственно перед нанесением повреждения, а также ежедневно в течение 18 дней после нанесения указанного повреждения осуществляли подкожное введение соединения из примера 1 (30 мг/кг), наблюдали достоверную регенерацию как количества аксонов (5%-е снижение по отношению к неповрежденному контролю),так и интенсивности миелинизации (50%-е снижение по отношению к контролю). Значительная эффективность соединения из примера 1 хорошо согласуется с его мощной способностью ингибировать ротамазную активность и стимулировать удлинение аксонов в DRG цыпленка. Указанные результаты представлены на фиг. 3. Обозначение "имитация" соответствует контрольным животным, получавшим носитель в отсутствие повреждения. Обозначение "носитель" соответствует животным, которым наносили повреждение и вводили лишь веществоноситель без лекарственного средства. Животные, обработанные соединением из примера 1,оказались очень сходными по исследованным параметрам с контрольными животными, пре 21 терпевшими имитацию повреждения, что свидетельствует о мощных нейрорегенерационных эффектах, оказываемых данным соединением invivo. В качестве неактивного соединения использовали вещество, не проявляющее ингибиторной активности по отношению к FKBP-12. Животные, обработанные неактивным соединением, напоминали поврежденных животных,которым вводили вещество-носитель; полученные данные хорошо согласуются с представлениями о том, что нейрорегенеративные свойства соединения примера 1 непосредственно обусловлены его ингибиторным действием по отношению к FKBP-12. Полученные численные значения представлены в табл. III. Таблица III Вид обработки Имитация Повреждение Моделирование болезни Паркинсона у мышей с помощью МРТР Для моделирования болезни Паркинсона у мышей использовали повреждение дофаминергических нейронов с помощью МРТР. Четырехнедельным белым мышам линии CD1 в течение 5 дней внутрибрюшинно вводили МРТР в дозе 30 мг/кг. В течение этих 5 дней подопытным мышам дополнительно подкожно вводили либо соединение из примера 17 (в концентрации 1040 мг/кг), либо носитель, после чего продолжали введение соответствующего соединения в течение еще 5 дней. Через 18 дней после обработки МРТР подопытных животных умерщвляли, выделяли полосатое тело и гомогенизировали его. Для того чтобы оценить влияние исходного повреждения и обработки лекарственным средством на количество переносчиков дофамина (DAT), исследовали связывание [3H]CFT (радиоактивного лиганда для переносчика дофамина) со стриарными мембранами. Для того чтобы провести количественную оценку выживаемости и восстановления дофаминергических нейронов, на саггитальных и венечных срезах головного мозга проводили иммуноокрашивание с использованием антитирозингидроксилазных(ТН) Ig. У животных, совместно обработанных МРТР и носителем, наблюдали достоверное снижение количества функциональных дофаминергических окончаний по сравнению с неповрежденными животными. У поврежденных животных, получавших соединение из примера 17, наблюдали практически полное восстановление количества дофаминергических нейронов,окрашиваемых ТН. 22 На фиг. 4 и 5 приведены количественные данные о содержании DAT; фиг. 6-8 представляют собой микрофотографии, иллюстрирующие регенерационные эффекты, оказываемые в этой модели соединением из примера 17. Как следует из фиг. 4, предусмотренные настоящим изобретением соединения вызывают существенное восстановление функциональных дофаминергических окончаний, выявляемых с помощью связывания [3H]CFT, по сравнению с обработкой МРТР в отсутствие соединений фирмы Guilford. На фиг. 5 эти же данные представлены в виде гистограммы. Показано, что для животных, обработанных МРТР и соединением примера 17 (40 мг/кг), характерно более чем 90%-е восстановление контрольного уровня связывания [3H]CFT. Как следует из фиг. 6-8,иммуноокрашивание на тирозингидроксилазу(маркера жизнеспособных дофаминергических нейронов) в полосатом теле, черном теле, а также в пучке средней части переднего мозга свидетельствует о четком и значительном восстановлении функциональных нейронов у животных, получавших соединение примера 17, по сравнению с животными, обработанными повреждающим агентом в отсутствие активного соединения (МРТР + носитель). Приведенные ниже примеры призваны проиллюстрировать предпочтительные варианты воплощения настоящего изобретения и не должны рассматриваться как ограничивающие настоящее изобретение. Все предпочтительные варианты воплощения настоящего изобретения не должны рассматриваться как ограничивающие настоящее изобретение. Под молекулярной массой всех полимеров подразумевается средняя молекулярная масса. Во всех случаях, кроме особо оговоренных, процентные содержания рассчитаны как массовые процентные содержания по отношению к конечной массе вводимых системы или приготовленного состава; общая масса во всех случаях равна 100%. Примеры Предусмотренные настоящим изобретением соединения могут быть получены с помощью различных вариантов синтеза с использованием хорошо известных химических превращений. Основной способ получения соединений, предусмотренных настоящим изобретением, представлен на схеме 1. Производные N-глиоксилпролина можно получить, приводя метиловый эфир L-пролина во взаимодействие с метилоксалилхлоридом как показано на схеме 1. Образующиеся при этом оксаматы могут быть приведены во взаимодействие с различными углеродными нуклеофилами с получением промежуточных соединений. Затем указанные промежуточные соединения приводят во взаимодействие с различными спиртами, амидами, либо защищенными остатками аминокислот с получением предусмотренных настоящим изобретением пропиловых эфиров или амидов. Пример 1. Синтез 3-фенил-1-пропил (2S)1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата. а. Синтез метил (2S)-1-(1,2-диоксо-2 метоксиэтил)-2-пирролидинкарбоксилата. Раствор гидрохлорида метилового эфираL-пролина (3,08 г; 18,60 ммоль) в сухом метиленхлориде охлаждали до температуры 0 С и обрабатывали триэтиламином (3,92 г; 38,74 ммоль; 2,1 эквивалента). Полученную при этом суспензию перемешивали в атмосфере азота в течение 15 мин, после чего по каплям добавляли раствор метилоксалилхлорида (3,20 г; 26,12 ммоль) в метиленхлориде (45 мл). Образовавшуюся смесь перемешивали при температуре 0 С в течение 1,5 ч. Удалив твердое вещество с помощью фильтрования, органическую фазу промывали водой, высушивали над МgSO4 и концентрировали. Полученный сырой остаток очищали на силикагелевой колонке, элюируя 50%-ным этилацетатом в гексане, с выходом 3,52 г (88%) продукта в виде красноватого масла; смесь цис-транс-ротамеров амида; приведены данные для транс-ротамера. 1H ЯМР (CDCl3): d 1,93 (dm, 2H); 2,17 (m,2 Н); 3,62 (m, 2H); 3,71 (s, 3 Н); 3,79; 3,84 (s, 3 Н общее); 4,86 (dd, 1H, J=8,4; 3,3). б. Синтез метил (2S)-1-(1,2-диоксо-3,3 диметилфенилпентил)-2-пирролидинкарбоксилата. Раствор метил (2S)-1-(1,2-диоксо-2-метоксиэтил)-2-пирролидинкарбоксилата (2,35 г; 10,90 ммоль) в 30 мл тетрагидрофуране (ТГФ) охлаждали до температуры -78 С и обрабатывали 14,2 мл раствора 1,1-диметилпропилмагнийхлорида (1,0 M) в ТГФ. Образовавшуюся при этом гомогенную смесь перемешивали при температуре -78 С в течение 3 ч, после чего выливали указанную смесь в насыщенный раствор хлорида аммония (100 мл) и экстрагировали этилацетатом. Полученную органическую фазу промывали водой, высушивали и концентрировали, а сырой остаток, образовавшийся в результате удаления вышеупомянутого растворителя, очищали на силикагелевой колонке, элюируя 25%-м этилацетатом в гексане, с выходом 2,10 г (75%) оксамата в виде бесцветного масла.(2,10 г; 8,23 ммоль), 1 н. LiOH (15 мл) и метанола (50 мл) перемешивали при температуре 0 С в течение 30 мин, а затем в течение ночи при комнатной температуре. Указанную смесь подкисляли 1 н. HCl до рН 1, разбавляли водой и экстрагировали 100 мл метиленхлорида. Полученный органический экстракт промывали солевым раствором и концентрировали с выходом 1,73 г (87%) белоснежного твердого вещества,не требующего дальнейшей очистки. 1(822 мг; 3,98 ммоль), камфорсульфоновой кислоты (190 мг; 0,8 ммоль) и 4-диметиламинопиридина (100 мг; 0,8 ммоль) в метиленхлориде (20 мл) перемешивали в течение ночи в атмосфере азота. Из образовавшейся реакционной смеси с помощью фильтрования через броунмиллерит удаляли твердый осадок, полученный фильтрат концентрировали в вакууме, и выделенное сырое вещество очищали с помощью флэш-хроматографии на колонке (элюирование 25%-ным этилацетатом в гексане) с выходом 720 мг (80%) указанного в заголовке соединения в виде бесцветного масла. 1H ЯМР (CDCl3): d 0,84 (t, 3H); 1,19 (s, 3 Н); 1,23 (s, 3H); 1,70 (dm, 2H); 1,98 (m, 5H); 2,22 (m,1H); 2,64 (m, 2H); 3,47 (m, 2H); 4,14 (m, 2H); 4,51 (d, 1 Н); 7,16 (m, 3H); 7,26 (m, 2H). Способ, описанный выше в примере 1, использовали для получения следующих соединений, служащих иллюстрациями настоящего изобретения: Пример 2. 3-Фенил-1-проп-2-(Е)-енил (2S)1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилат. 80%; 1H ЯМР (360 МГц, CDCl3): d 0,86 (t,3H); 1,21 (s, 3H); 1,25 (s, 3 Н); 1,54-2,10 (m, 5H); 2,10-2,37 (m, 1H); 3,52-3,55 (m, 2H); 4,56 (dd, 1H,J=3,8; 8,9) 4,78-4,83 (m, 2H); 6,27 (d, 1H); 6,67 28 Пример 29. 3,3-Дифенил-1-пропил (2S)-1 циклогексилглиоксил-2-пирролидинкарбоксилат. 91%; 1H ЯМР (300 МГц, CDCl3): d 1,32 (m,6H); 1,54-2,41 (m, 10 Н); 3,20 (dm, 1H); 3,69 (m,2H); 4,12 (m, 4H); 4,52 (d, 1H); 7,28 (m, 10 Н). Пример 30. 3,3-Дифенил-1-пропил (2S)-1(2-тиенил)глиоксил-2-пирролидинкарбоксилат. 75%; 1H ЯМР (300 МГц, CDCl3): d 2,04 (m,3 Н); 2,26 (m, 2H); 2,48 (m, 1H); 3,70 (m, 2H); 3,82-4,18 (m, 3 Н общее); 4,64 (m, 1H); 7,25 (m,11H); 7,76 (dd, 1H); 8,03 (m, 1H). Необходимые замещенные спирты можно получить с помощью целого ряда методов, хорошо известных специалистам в области органического синтеза. Как показано на схеме 2,алкильные или арильные альдегиды могут быть гомологенизированы до фенилпропанолов за счет взаимодействия с метил(трифенилфосфоранилиден)ацетатом с получением различных транс-циннаматов; затем указанные циннаматы можно восстанавливать до насыщенных спиртов, либо приводя их во взаимодействие с избытком гидрида лития и алюминия, либо осуществляя их поэтапное восстановление: сначала восстановление двойной связи (посредством каталитического гидрирования), а затем восстановление полученного насыщенного эфира (с использованием соответствующих восстанавливающих агентов). В альтернативном случае рассматриваемые транс-циннаматы можно восстанавливать до (Е)-аллильных спиртов, используя гидрид диизобутилалюминия. Схема 2 Спирты с длинной углеводородной цепью можно получить в результате гомологенизации бензиловых и высших альдегидов. В альтернативном случае указанные альдегиды можно получить из соответствующих фенилуксусных и высших кислот, а также из фенилэтиловых и высших спиртов. Основной способ синтеза акриловых эфиров, в частности метил (3,3,5-триметокси)транс-циннамата, состоит в следующем. Раствор 3,4,5-триметоксибензальдегида(5,0 г; 25,48 ммоль) и метил(трифенилфосфоранилиден)ацетата (10,0 г; 29,91 ммоль) в тетрагидрофуране (250 мл) подвергали дефлегмации в течение ночи. Затем охлаждали указанную реакционную смесь, разбавляли ее 200 мл этилацетата, промывали водой (2200 мл), высушивали и концентрировали в вакууме. Образовавшийся сырой остаток очищали с помощью хроматографии на силикагелевой колонке, элюируя 25%-ным этилацетатом в гексане, с получением 29 5,63 г (88%) вышеназванного циннамата в виде кристаллического твердого вещества. 1(d, 1H; J=16). Основной способ синтеза насыщенных спиртов на примере (3,4,5-триметокси)фенилпропанола заключается в следующем. К раствору гидрида лития и алюминия (14 мМ) в ТГФ (35 мл), перемешиваемому в атмосфере аргона, по каплям добавляли раствор метил(3,3,5-триметокси)-транс-циннамата (1,81 г; 7,17 ммоль) в тетрагидрофуране (30 мл). По завершении указанного добавления образовавшуюся смесь выдерживали при температуре 75 С в течение 4 ч, охлаждали, после чего останавливали реакцию, осторожно добавляя 15 мл 2 н. NaOH, а затем 50 мл воды. Полученную при этом смесь фильтровали через броунмиллерит для удаления твердого осадка, а использованный фильтр промывали этилацетатом. Объединяли полученные органические фракции, промывали их водой, высушивали, концентрировали в вакууме и очищали с помощью хроматографии на силикагелевой колонке, элюируя этилацетатом, с выходом 0,86 г (53%) вышеназванного спирта в виде прозрачного масла. 1(s, 3 Н); 3,83 (s, 6H); 6,40 (s, 2H). Основной способ синтеза транс-аллиловых спиртов на примере (3,4,5-триметокси)фенилпроп-2-(Е)-енола из акриловых эфиров состоит в следующем. Раствор (3,3,5-триметокси)-транс-циннамата (1,35 г; 5,35 ммоль) в толуоле (25 мл) охлаждали до температуры -10 С, после чего обрабатывали раствором гидрида диизобутилалюминия (11,25 ммоль) в толуоле (11,25 мл 1,0 М раствора, 11,25 ммоль). Образовавшуюся реакционную смесь перемешивали при температуре 0 С в течение 3 ч, после чего останавливали реакцию, добавляя 3 мл метанола, а затем 1 н.HCl до рН 1. Экстрагировали указанную реакционную смесь этилацетатом, полученную органическую фракцию промывали водой, высушивали и концентрировали. В результате очистки с помощью хроматографии на силикагелевой колонке (элюирование 25%-м этилацетатом в гексане) получили 0,96 г (80%) вышеназванного соединения в виде густого масла. 1J=15,8; 5,7); 6,54 (d, 1H; J=15,8); 6,61 (s, 2H). Очевидно, что описанный в настоящем описании изобретения синтез может быть осуществлен с большим количеством разнообразных вариаций. Все подобные вариации не должны восприниматься в отрыве от настоящего изобретения, а, напротив, должны рассматриваться в качестве составной части приведенной ниже формулы изобретения. 30 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение нейротрофного соединения формулы или его фармацевтически приемлемой соли или гидрата,где R1 представляет собой С 1-С 9 алкильную или С 2-С 9 алкенильную группу с прямой или разветвленной цепью, возможно замещенную С 3-С 8 циклоалкилом,С 3 или С 5 циклоалкил,С 5-С 7 циклоалкенил,где указанные алкильная, алкенильная, циклоалкильная или циклоалкенильная группы могут быть возможно замещены С 1-С 4 алкилом, С 2 С 4 алкенилом или гидроксилом,или Ar1, где Ar1 выбран из группы, состоящей из 1-нафтила, 2-нафтила, 2-индолила,3-индолила, 2-фурила, 3-фурила, 2-тиазолила, 2 тиенила, 3-тиенила, 2-, 3- или 4-пиридила и фенила, имеющих от одного до трех заместителей,которые независимо выбраны из группы, состоящей из водорода, галогена, гидроксила,нитрогруппы, трифторметила, прямого или разветвленного C1-С 6 алкила или С 2-С 6 алкенила, С 1C4 алкоксила или С 2-С 4 алкенилоксила, феноксигруппы, бензилоксигруппы и аминогруппы; Х является кислородом или серой;Y является кислородом или NR2, где R2 является водородом или C1-С 6 алкилом; иZ представляет собой С 2-С 6 алкил или алкенил с прямой или разветвленной цепью; причем алкильная или алкенильная цепь замещена по одному или более чем одному положению Ar1, как он определен выше,С 3-С 8 циклоалкил,циклоалкил, соединенный посредством C1 С 6 алкильной или С 2-С 6 алкенильной прямой или разветвленной цепи; или Аr2, где Аr2 выбран из группы, состоящей из 2-индолила, 3-индолила, 2-фурила, 3-фурила,2-тиазолила, 2-тиенила, 3-тиенила, 2-, 3- или 4 пиридила и фенила, имеющих от одного до трех заместителей, которые независимо выбраны из группы, состоящей из водорода, галогена, гидроксила, нитрогруппы, трифторметила, прямого или разветвленного C1-С 6 алкила или С 2 С 9 алкенила,С 1-С 4 алкоксила или С 2 С 4 алкенилоксила, феноксигруппы, бензилоксигруппы и аминогруппы; фрагмент 31 где R3 выбран из прямого или разветвленного С 1-С 8 алкила, возможно замещенного С 3 С 8 циклоалкилом или Ar1, как он определен выше, и незамещенного Ar1; Х 2 представляет собой О или NR5, где R5 выбран из водорода, прямого или разветвленного C1-С 6 алкила и С 2-С 6 алкенила;R4 выбран из группы, состоящей из фенила, бензила, прямого или разветвленного С 1C5 алкила или С 2-С 5 алкенила и прямого или разветвленного С 1-С 5 алкила или С 2-С 5 алкенила,замещенного фенилом; для стимулирования роста и регенерации нейронов, для лечения неврологического расстройства или для предупреждения нейродегенерации. 2. Применение по п.1, для стимулирования роста поврежденных периферических нервов. 3. Применение по п.1, где неврологическое расстройство выбрано из группы, состоящей из периферических невропатий и неврологических патологий, связанных с нейродегенерацией. 4. Применение по п.3, где неврологическим расстройством, связанным с нейродегенерацией, является болезнь Альцгеймера. 5. Применение по п.3, где неврологическим расстройством, связанным с нейродегенерацией, является болезнь Паркинсона. 6. Применение по п.3, где неврологическим расстройством, связанным с нейродегенерацией, является боковой амиотрофический склероз. 7. Применение по п.1, где Z и R1 являются липофильными группами. 8. Применение по п.1, где соединение выбрано из 3-фенил-1-пропил (2S)-1-(3,3-диметил-1,2 диоксопентил)-2-пирролидинкарбоксилата,3-(3-пиридил)-1-пропил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,3-фенил-1-проп-2-(Е)-енил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,3-(3,4,5-триметоксифенил)-1-пропил (2S)1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,3-(3,4,5-триметоксифенил)-1-проп-2-(Е)енил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2 пирролидинкарбоксилата,3-(4,5-дихлорфенил)-1-пропил (2S)-1-(3,3 диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,3-(4,5-дихлорофенил)-1-проп-2-(Е)-енил(2S)-1-(1,2-диоксо-2 фенил)этил-2-пирролидинкарбоксилата,1,7-дифенил-4-гептил (2S)-1-(3,3-диметил 1,2-диоксопентил)-2-пирролидинкарбоксилата,3-фенил-1-пропил (2S)-1-(3,3-диметил-1,2 диоксо-4-гидроксибутил)-2-пирролидинкарбоксилата,3-фенил-1-пропил (2S)-1-(3,3-диметил-1,2 диоксопентил)-2-пирролидинкарбоксилата,этилового эфира 1-[1-(3,3-диметил-1,2 диоксопентил)-L-пролин]-L-фенилаланина,этилового эфира 1-[1-(3,3-диметил-1,2 диоксопентил)-L-пролин]-L-лейцина,этилового эфира 1-[1-(3,3-диметил-1,2 диоксопентил)-L-пролин]-L-фенилглицина,фенилового эфира 1-[1-(3,3-диметил-1,2 диоксопентил)-L-пролин]-L-фенилаланина,бензилового эфира 1-[1-(3,3-диметил-1,2 диоксопентил)-L-пролин]-L-фенилаланина и этилового эфира 1-[1-(3,3-диметил-1,2 диоксопентил)-L-пролин]-L-изолейцина. 9. Применение нейротрофного соединения формулы 33 или его фармацевтически приемлемой соли или гидрата,где R1 представляет собойC1-C9 алкильную или C2-C9 алкенильную группу с прямой или разветвленной цепью,возможно замещенную C3-C8 циклоалкилом,C3 или C5 циклоалкил,C5-C7 циклоалкенил,где указанные алкильная,алкенильная,циклоалкильная или циклоалкенильная группы возможно могут быть замещены C1-C4 алкилом,C2-C4 алкенилом или гидроксилом,или Ar1, где Ar1 выбран из группы, состоящей из 1-нафтила, 2-нафтила, 2-индолила,3-индолила, 2-фурила, 3-фурила, 2-тиазолила, 2 тиенила, 3-тиенила, 2-, 3- или 4-пиридила и фенила, имеющих от одного до трех заместителей,которые независимо выбраны из группы, состоящей из водорода, галогена, гидроксила,нитрогруппы, трифторметила, прямого или разветвленного C1-C6 алкила или C2-C6 алкенила, C1C4 алкоксила или C2-C4 алкенилоксила, феноксигруппы, бензилоксигруппы и аминогруппы;C2-C6 алкил или алкенил с прямой или разветвленной цепью; причем алкильная или алкенильная цепь замещена по одному или более чем одному положению Ar1, как он определен выше,С 3-С 8 циклоалкил,циклоалкил, соединенный посредством прямой или неразветвленной С 1-С 6 алкильной или С 2-С 6 алкенильной цепи; или Аr2, где Аr2 выбран из группы, состоящей из 2-индолила, 3-индолила, 2-фурила, 3-фурила,2-тиазолила, 2-тиенила, 3-тиенила, 2-, 3- или 4 пиридила и фенила, имеющих от одного до трех заместителей, которые независимо выбраны из группы, состоящей из водорода, галогена, гидроксила, нитрогруппы, трифторметила, прямого или разветвленного C1-С 6 алкила или С 2 С 6 алкенила, С 1-C4 алкоксила или С 2-С 4 алкенилоксила, феноксигруппы, бензилоксигруппы и аминогруппы; для стимулирования роста и регенерации нейронов, для лечения неврологического расстройства или для предупреждения нейродегенерации. 10. Применение по п.9, где R1 выбран из группы, состоящей из С 1-С 9 алкила с прямой или разветвленной цепью, 2-циклогексила, 4 циклогексила, 2-фуранила, 2-тиенила, 2 тиазолила и 4-гидроксибутила. 11. Применение по п.9 для стимулирования роста поврежденных периферических нервов. 12. Применение по п.9, где неврологическое расстройство выбрано из группы, состоящей из периферических невропатий и неврологических патологий, связанных с нейродегенерацией. 34 13. Применение по п.9, где неврологическим расстройством, связанным с нейродегенерацией, является болезнь Альцгеймера. 14. Применение по п.9, где неврологическим расстройством, связанным с нейродегенерацией, является болезнь Паркинсона. 15. Применение по п.9, где неврологическим расстройством, связанным с нейродегенерацией, является боковой амиотрофический склероз. 16. Применение по п.9, где Z и R1 являются липофильными группами. 17. Применение нейротрофного соединения формулы или его фармацевтически приемлемых солей или гидратов,где Z представляет собой фрагмент где R3 выбран из группы, состоящей из прямого или разветвленного C1-С 8 алкила, возможно замещенного С 3-С 8 циклоалкилом или Ar1, как он определен выше, и незамещенного Аr1; Х 2 представляет собой О или NR5, где R5 выбран из группы, состоящей из водорода, прямого или разветвленного C1-С 6 алкила и С 2 С 6 алкенила; иR4 выбран из группы, состоящей из фенила, бензила, прямого или разветвленного С 1 С 5 алкила или С 2-С 5 алкенила и прямого или разветвленного С 1-С 5 алкила или С 2-С 5 алкенила,замещенного фенилом; для стимулирования роста и регенерации нейронов, для лечения неврологического расстройства или для предупреждения нейродегенерации. 18. Применение по п.17 для стимулирования роста поврежденных периферических нервов. 19. Применение по п.17, где неврологическое расстройство выбрано из группы, состоящей из периферических невропатий и неврологических патологий, связанных с нейродегенерацией. 20. Применение по п.17, где неврологическим расстройством, связанным с нейродегенерацией, является болезнь Альцгеймера. 21. Применение по п.17, где неврологическим расстройством, связанным с нейродегенерацией, является болезнь Паркинсона. 22. Применение по п.17, где неврологическим расстройством, связанным с нейродегене 35 рацией, является боковой амиотрофический склероз. 23. Применение по п.17, где Z и R1 являются липофильными группами. 24. Применение нейротрофного Nглиоксилпролилэфирного соединения формулы или его фармацевтически приемлемой соли или гидрата,где R1 представляет собой С 1-С 5 алкильную или С 2-С 5 алкенильную группу с прямой или разветвленной цепью, возможно замещенную С 3-С 6 циклоалкилом, или Аr1, где Ar1 выбран из группы, состоящей из 2-фурила, 2-тиенила и фенила; и Х выбран из группы, состоящей из кислорода и серы;Z представляет собой С 2-C6 алкил или алкенил с прямой или разветвленной цепью; причем алкильная или алкенильная цепь замещена по одному или более чем одному положению Ar1, как он определен выше,С 3-С 6 циклоалкил; или Аr2, где Аr2 выбран из 2-, 3- или 4 пиридила или фенила, имеющих от одного до трех заместителей, которые независимо выбраны из группы, состоящей из водорода и С 1 С 4 алкокси; для стимулирования роста и регенерации нейронов, для лечения неврологического расстройства или для предупреждения нейродегенерации. 25. Применение по п.24 для стимулирования роста поврежденных периферических нервов. 26. Применение по п.24, где неврологическое расстройство выбрано из группы, состоящей из периферических невропатий и неврологических патологий, связанных с нейродегенерацией. 27. Применение по п.24, где неврологическим расстройством, связанным с нейродегенерацией, является болезнь Альцгеймера. 28. Применение по п.24, где неврологическим расстройством, связанным с нейродегенерацией, является болезнь Паркинсона. 29. Применение по п.24, где неврологическим расстройством, связанным с нейродегенерацией, является боковой амиотрофический склероз. 30. Применение по п.24, где Z и R1 являются липофильными группами. 31. Применение по п.24, где соединение выбрано из(2S)-1-(2-тиенил) глиоксил-2-пирролидинкарбоксилата. 32. Применение нейротрофного соединения формулы или его фармацевтически приемлемой соли или гидрата,где R1 представляет собой С 1-С 9 алкильную или С 2-С 9 алкенильную группу с прямой или разветвленной цепью, возможно замещенную С 3-С 8 циклоалкилом,С 3 или С 5 циклоалкил,С 5-С 7 циклоалкенил,где указанные алкильная, алкенильная, циклоалкильная или циклоалкенильная группы могут быть возможно замещены С 1-С 4 алкилом, С 2 С 4 алкенилом или гидроксилом, или Аr1, где Ar1 выбран из группы, состоящей из 1-нафтила, 2-нафтила, 2-индолила, 3 индолила, 2-фурила, 3-фурила, 2-тиазолила, 2 тиенила, 3-тиенила, 2-, 3- или 4-пиридила и фенила, имеющих от одного до трех заместителей,которые независимо выбраны из группы, состоящей из водорода, галогена, гидроксила,нитрогруппы, трифторметила, прямого или разветвленного C1-С 6 алкила или С 2-С 6 алкенила, С 1 37 С 4 алкоксила или С 2-С 4 алкенилоксила, феноксигруппы, бензилоксигруппы и аминогруппы; Х является кислородом или серой;Y является кислородом или NR2, где R2 является водородом или C1-С 6 алкилом; иZ представляет собой С 2-С 6 алкил или алкенил с прямой или разветвленной цепью; причем алкильная или алкенильная цепь замещена по одному или более чем одному положению Аr1, как он определен выше,С 3-С 8 циклоалкил,циклоалкил, соединенный посредством C1 С 6 алкильной или С 2-С 6 алкенильной прямой или неразветвленной цепи; или Аr2, где Аr2 выбран из группы, состоящей из 2-индолила, 3-индолила, 2-фурила, 3-фурила,2-тиазолила, 2-тиенила, 3-тиенила, 2-, 3- или 4 пиридила и фенила, имеющих от одного до трех заместителей, которые независимо выбраны из группы, состоящей из водорода, галогена, гидроксила, нитрогруппы, трифторметила, прямого или разветвленного С 1-С 6 алкила или С 2 С 6 алкенила,С 1-С 4 алкоксила или С 2 С 4 алкенилоксила, феноксигруппы, бензилоксигруппы и аминогруппы; фрагмент где R3 выбран из прямого или разветвленного С 1-С 8 алкила, возможно замещенного С 3 С 8 циклоалкилом или Аr1, как он определен выше, и незамещенного Аr1; Х 2 представляет собой О или NR5, где R5 выбран из водорода, прямого или разветвленного С 1-С 6 алкила и С 2-С 6 алкенила;R4 выбран из группы, состоящей из фенила, бензила, прямого или разветвленного С 1 С 5 алкила или С 2-С 5 алкенила и прямого или разветвленного С 1-С 5 алкила или С 2-С 5 алкенила,замещенного фенилом; в приготовлении лекарственного средства для стимулирования роста и регенерации нейронов, для лечения неврологического расстройства или для предупреждения нейродегенерации. 33. Применение по п.32, для стимулирования роста поврежденных периферических нервов. 34. Применение по п.32, где неврологическое расстройство выбрано из группы, состоящей из периферических невропатий и неврологических патологий, связанных с нейродегенерацией. 35. Применение по п.34, где неврологическим расстройством, связанным с нейродегенерацией, является болезнь Альцгеймера. 36. Применение по п.34, где неврологическим расстройством, связанным с нейродегенерацией, является болезнь Паркинсона. 38 37. Применение по п.34, где неврологическим расстройством, связанным с нейродегенерацией, является боковой амиотрофический склероз. 38. Применение по п.32, где Z и R1 являются липофильными группами. 39. Применение по п.32, где соединение выбрано из 3-фенил-1-пропил (2S)-1-(3,3-диметил-1,2 диоксопентил)-2-пирролидинкарбоксилата,3-(3-пиридил)-1-пропил (2S)-1-(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,3-фенил-1-проп-2-(Е)-енил(2S)-1-(1,2-диоксо-2 фенил)этил-2-пирролидинкарбоксилата,1,7-дифенил-4-гептил (2S)-1-(3,3-диметил 1,2-диоксопентил)-2-пирролидинкарбоксилата,3-фенил-1-пропил (2S)-1-(3,3-диметил-1,2 диоксо-4-гидроксибутил)-2-пирролидинкарбоксилата,3-фенил-1-пропил (2S)-1-(3,3-диметил-1,2 диоксопентил)-2-пирролидинкарбоксилата,этилового эфира 1-[1-(3,3-диметил-1,2 диоксопентил)-L-пролин]-L-фенилаланина,этилового эфира 1-[1-(3,3-диметил-1,2 диоксопентил)-L-пролин]-L-лейцина,этилового эфира 1-[1-(3,3-диметил-1,2 диоксопентил)-L-пролин]-L-фенилглицина,фенилового эфира 1-[1-(3,3-диметил-1,2 диоксопентил)-L-пролин]-L-фенилаланина,бензилового эфира 1-[1-(3,3-диметил-1,2 диоксопентил)-L-пролин]-L-фенилаланина, и этилового эфира 1-[1-(3,3-диметил-1,2 диоксопентил)-L-пролин]-L-изолейцина. 40. Применение нейротрофного соединения формулы или его фармацевтически приемлемой соли или гидрата,где R1 представляет собой С 1-С 9 алкильную или С 2-С 9 алкенильную группу с прямой или разветвленной цепью, возможно замещенную С 3-С 8 циклоалкилом,С 3 или С 5 циклоалкил,С 5-С 7 циклоалкенил,где указанные алкильная, алкенильная, циклоалкильная или циклоалкенильная группы возможно могут быть замещены С 1-C4 алкилом, С 2C4 алкенилом или гидроксилом, или Аr1, где Аr1 выбран из группы, состоящей из 1-нафтила, 2-нафтила, 2-индолила, 3 индолила, 2-фурила, 3-фурила, 2-тиазолила, 2 тиенила, 3-тиенила, 2-, 3- или 4-пиридила и фенила, имеющих от одного до трех заместителей,которые независимо выбраны из группы, состоящей из водорода, галогена, гидроксила,нитрогруппы, трифторметила, прямого или разветвленного С 1-С 6 алкила или С 2-С 6 алкенила, С 1 С 4 алкоксила или С 2-С 4 алкенилоксила, феноксигруппы, бензилоксигруппы и аминогруппы;Z представляет собой С 2-С 6 алкил или алкенил с прямой или разветвленной цепью; причем алкильная или алкенильная цепь замещена по одному или более чем одному положению Ar1, как он определен выше, 002774 40 С 3-С 8 циклоалкил,циклоалкил, соединенный посредством прямой или неразветвленной C1-С 6 алкильной или С 2-С 6 алкенильной цепи; или Аr2, где Аr2 выбран из группы, состоящей из 2-индолила, 3-индолила, 2-фурила, 3-фурила,2-тиазолила, 2-тиенила, 3-тиенила, 2-, 3- или 4 пиридила и фенила, имеющих от одного до трех заместителей, которые независимо выбраны из группы, состоящей из водорода, галогена, гидроксила, нитрогруппы, трифторметила, прямого или разветвленного C1-С 6 алкила или С 2 С 6 алкенила,С 1-C4 алкоксила или С 2 С 4 алкенилоксила, феноксигруппы, бензилоксигруппы и аминогруппы; в приготовлении лекарственного средства для стимулирования роста и регенерации нейронов, для лечения неврологического расстройства или для предупреждения нейродегенерации. 41. Применение по п.40, где R1 выбран из группы, состоящей из С 1-С 9 алкила с прямой или разветвленной цепью, 2-циклогексила, 4 циклогексила, 2-фуранила, 2-тиенила, 2 тиазолила и 4-гидроксибутила. 42. Применение по п.40 для стимулирования роста поврежденных периферических нервов. 43. Применение по п.40, где неврологическое расстройство выбрано из группы, состоящей из периферических невропатий и неврологических патологий, связанных с нейродегенерацией. 44. Применение по п.40, где неврологическим расстройством, связанным с нейродегенерацией, является болезнь Альцгеймера. 45. Применение по п.40, где неврологическим расстройством, связанным с нейродегенерацией, является болезнь Паркинсона. 46. Применение по п.40, где неврологическим расстройством, связанным с нейродегенерацией, является боковой амиотрофический склероз. 47. Применение по п.40, где Z и R1 являются липофильными группами. 48. Применение нейротрофного соединения формулы или его фармацевтически приемлемых солей или гидратов, где 41 где R3 выбран из группы, состоящей из прямого или разветвленного С 1-С 8 алкила, возможно замещенного С 3-С 8 циклоалкилом или Аr1, как он определен выше, и незамещенного Ar1; Х 2 представляет собой О или NR5, где R5 выбран из группы, состоящей из водорода, прямого или разветвленного С 1-С 6 алкила и С 2 С 6 алкенила; иR4 выбран из группы, состоящей из фенила, бензила, прямого или разветвленного С 1 С 5 алкила или С 2-С 5 алкенила и прямого или разветвленного С 1-С 5 алкила или С 2-С 5 алкенила,замещенного фенилом; в приготовлении лекарственного средства для стимулирования роста и регенерации нейронов, для лечения неврологического расстройства или для предупреждения нейродегенерации. 49. Применение по п.48 для стимулирования роста поврежденных периферических нервов. 50. Применение по п.48, где неврологическое расстройство выбрано из группы, состоящей из периферических невропатий и неврологических патологий, связанных с нейродегенерацией. 51. Применение по п.48, где неврологическим расстройством, связанным с нейродегенерацией, является болезнь Альцгеймера. 52. Применение по п.48, где неврологическим расстройством, связанным с нейродегенерацией, является болезнь Паркинсона. 53. Применение по п.48, где неврологическим расстройством, связанным с нейродегенерацией, является боковой амиотрофический склероз. 54. Применение по п.48, где Z и R1 являются липофильными группами. 55. Применение нейротрофного Nглиоксилпролилэфирного соединения формулы или его фармацевтически приемлемой соли или гидрата,где R1 представляет собой С 1-С 5 алкильную или С 2-С 5 алкенильную группу с прямой или разветвленной цепью, возможно замещенную С 3-С 6 циклоалкилом, илиAr1, где Ar1 выбран из группы, состоящей из 2-фурила, 2-тиенила и фенила; и Х выбран из группы, состоящей из кислорода и серы;Z представляет собой С 2-С 6 алкил или алкенил с прямой или разветвленной цепью; 42 причем алкильная или алкенильная цепь замещена по одному или более чем одному положению Ar1, как он определен выше,С 3-С 6 циклоалкил; или Аr2, где Аr2 выбран из 2-, 3- или 4 пиридила или фенила, имеющих от одного до трех заместителей, которые независимо выбраны из группы, состоящей из водорода и С 1C4 алкокси; в приготовлении лекарственного средства для стимулирования роста и регенерации нейронов, для лечения неврологического расстройства или для предупреждения нейродегенерации. 56. Применение по п.55 для стимулирования роста поврежденных периферических нервов. 57. Применение по п.55, где неврологическое расстройство выбрано из группы, состоящей из периферических невропатий и неврологических патологий, связанных с нейродегенерацией. 58. Применение по п.55, где неврологическим расстройством, связанным с нейродегенерацией, является болезнь Альцгеймера. 59. Применение по п.55, где неврологическим расстройством, связанным с нейродегенерацией, является болезнь Паркинсона. 60. Применение по п.55, где неврологическим расстройством, связанным с нейродегенерацией, является боковой амиотрофический склероз. 61. Применение по п.55, где Z и R1 являются липофильными группами. 62. Применение по п.55, где соединение выбрано из 3-(2,5-диметоксифенил)-1-пропил (2S)-1(3,3-диметил-1,2-диоксопентил)-2-пирролидинкарбоксилата,3-(2,5-диметоксифенил)-1-проп-2-(Е)-енил Соединение из примера 17 активирует удлинение чувствительных нейронов цыпленка Фиг. 3D Связывание со стриарными мышей,обработанных МРТР Фиг. 4 Связывание со стриарными мышей, обработанных МРТР (на 200 уг мембранного белка) 48 Иммуноокрашивание ТН в пучках аксонов средней части переднего мозга (400 х)
МПК / Метки
МПК: A61K 31/40, C07D 207/16, A61P 25/00
Метки: соединений, новых, расстройства, лекарственного, нейронов, нейротрофных, регенерации, предупреждения, нейродегенерации, средства, стимулирования, приготовлении, применение, лечения, роста, неврологического
Код ссылки
<a href="https://eas.patents.su/26-2774-primenenie-novyh-nejjrotrofnyh-soedinenijj-dlya-stimulirovaniya-rosta-i-regeneracii-nejjronov-dlya-lecheniya-nevrologicheskogo-rasstrojjstva-i-dlya-preduprezhdeniya-nejjrodegenerac.html" rel="bookmark" title="База патентов Евразийского Союза">Применение новых нейротрофных соединений для стимулирования роста и регенерации нейронов, для лечения неврологического расстройства и для предупреждения нейродегенерации и в приготовлении лекарственного средства</a>
Предыдущий патент: Производные азетидинилпропилпиперидина, промежуточные соединения и применение в качестве антагонистов тахикинина
Следующий патент: Производные 2,3-диарил-пиразоло[1,5-b]пиридазинов, их получение и их применение в качестве ингибиторов циклооксигеназы 2 (цог-2)
Случайный патент: Усовершенствованная конструкция гидравлической опоры для опалубки