Новые соединения, фармацевтические композиции, содержащие их, и способы их использования
Номер патента: 10484
Опубликовано: 30.10.2008
Авторы: Макфэдден Джилл М., Тхупари Джаган Н., Кухаджа Фрэнсис П., Медгалчи Сьюзен М., Таунсенд Крэйг А.
Формула / Реферат
1. Соединения формулы I
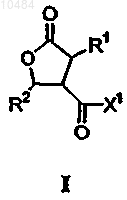
в которой R1 означает C1-С20алкил или группу =СН2;
R2 означает C1-С20алкил;
X1 означает NHR4, где R4 представляет собой C1-С20алкил, С3алкенил и необязательно содержит карбоксильную группу, спиртовую группу, или когда R1 означает группу =СН2, и R2 означает С8алкил, X1 означает группу -NHCH2COOMe или группу -NHCH2COOtrBu.
2. Соединения по п.1, в которых R1 представляет C1-С10алкил или группу =СН2.
3. Соединения по п.2, в которых R1 представляет -СН3 или =СН2.
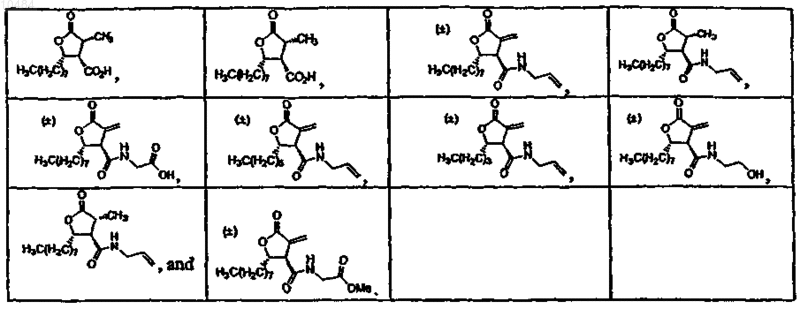
4. Соединения по п.3, в которых соединение выбрано из группы, состоящей из
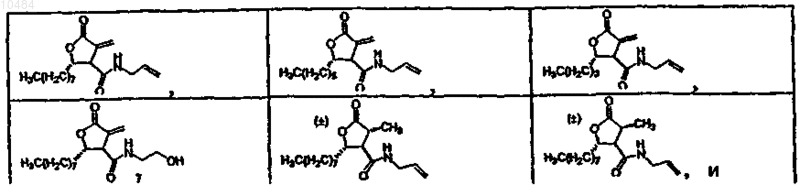
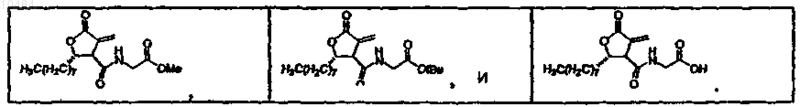
5. Соединения по п.1, в которых соединение выбрано из группы, состоящей из
6. Соединения формулы II
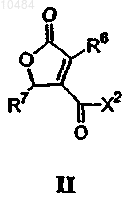
в которой R6 означает C1-С20алкил;
R7 означает C1-С20алкил;
X2 означает NHR9, где R9 представляет собой С3алкенил.
7. Соединения по п.6, в которых R1 представляет собой C1-С10алкил.
8. Соединения по п.7, в которых R6 представляет -СН3.
9. Соединения формулы VII

в которой R27 означает С6-С10алкил.
10. Соединения по п.9, выбранные из группы, состоящей из
11. Фармацевтическая композиция, включающая фармацевтический разбавитель и соединение формулы IX
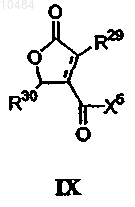
в которой R29 означает C1-С20алкил или группу =СН2;
R30 означает C1-С20алкил;
X5 означает группу ОН или -NHR32, где R32 представляет собой C1-С20алкил, С3алкенил и необязательно содержит карбоксильную группу или спиртовую группу, или когда R1 означает группу =СН2, и R2 означает С8алкил, X5 означает группу -NHCH2COOMe.
12. Фармацевтическая композиция по п.11, в которой R29 представляет собой C1-С10алкил или группу =СН2.
13. Фармацевтическая композиция по п.12, в которой R29 представляет -СН3 или =СН2.
14. Фармацевтическая композиция по п.11, в которой R29 представляет -С6Н13 или -C8H17.
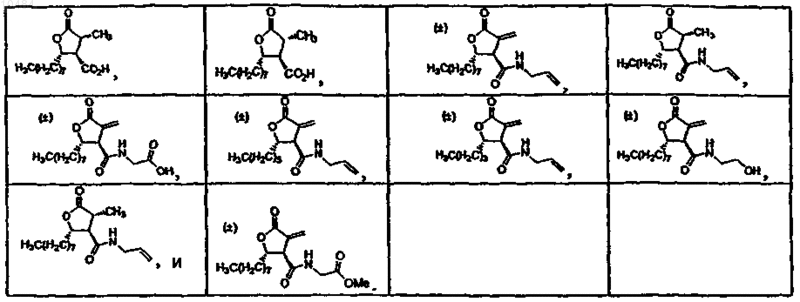
15. Фармацевтическая композиция по п.11, в которой соединение выбрано из группы, состоящей из
16. Фармацевтическая композиция, включающая фармацевтический разбавитель и соединение по п.1.
17. Фармацевтическая композиция, включающая фармацевтический разбавитель и соединение по п.6.
18. Фармацевтическая композиция, включающая фармацевтический разбавитель и соединение по п.9.
19. Способ индуцирования потери веса у животного или человека, предусматривающий введение указанному субъекту эффективного количества фармацевтической композиции по п.11.
20. Способ по п.19, в котором субъектом является человек.
21. Способ по п.19, в котором субъектом является животное.
22. Способ по п.20, в котором фармацевтическая композиция включает соединение, выбранное из группы, состоящей из
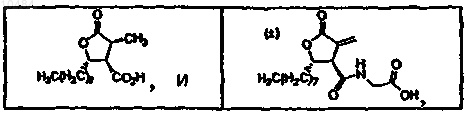
23. Способ по п.21, в котором фармацевтическая композиция включает соединение, выбранное из группы, состоящей из
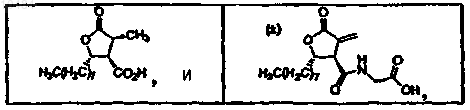
24. Способ ингибирования роста раковых клеток у животного или человека, предусматривающий введение указанному субъекту эффективного количества фармацевтической композиции по п.11.
25. Способ по п.24, в котором субъектом является человек.
26. Способ по п.24, в котором субъектом является животное.
27. Способ по п.25, в котором фармацевтическая композиция включает соединение, выбранное из группы, состоящей из
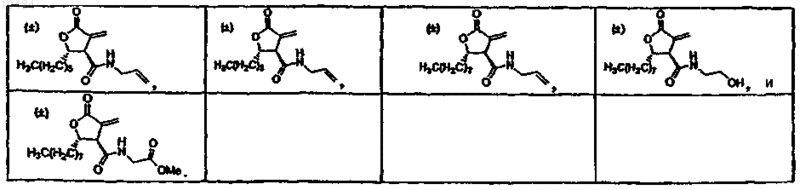
28. Способ по п.26, в котором фармацевтическая композиция включает соединение, выбранное из группы, состоящей из
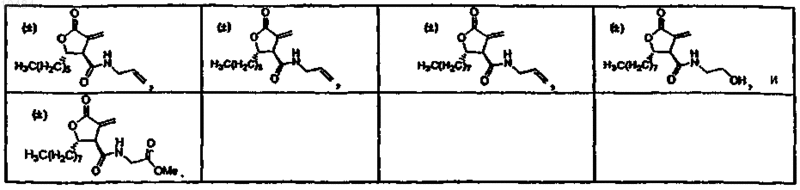
29. Способ стимулирования активностиСРТ-1 у животного или человека, предусматривающий введение указанному субъекту эффективного количества фармацевтической композиции по п.11.
30. Способ по п.29, в котором субъектом является человек.
31. Способ по п.29, в котором субъектом является животное.
32. Способ по п.30, в котором соединение представляет
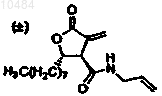
33. Способ по п.31, в котором соединение представляет
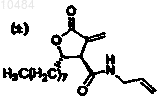
34. Способ ингибирования активности нейропептида-Y у животного или человека, предусматривающий введение указанному субъекту эффективного количества фармацевтической композиции по п.11.
35. Способ по п.34, в котором субъектом является человек.
36. Способ по п.34, в котором субъектом является животное.
37. Способ ингибирования активности синтазы жирной кислоты у животного или человека, предусматривающий введение указанному субъекту эффективного количества фармацевтической композиции по п.11.
38. Способ по п.37, в котором субъектом является человек.
39. Способ по п.37, в котором субъектом является животное.
40. Способ по п.38, в котором соединение, выбрано из группы, состоящей из
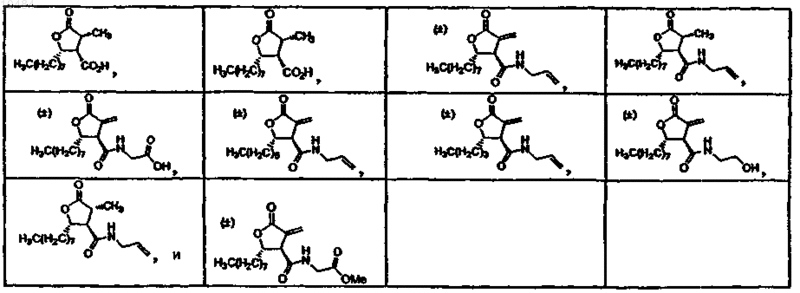
41. Способ по п.39, в котором соединение выбрано из группы, состоящей из
42. Способ ингибирования роста инвазивных микробных клеток у животного или человека, предусматривающий введение указанному субъекту эффективного количества фармацевтической композиции по п.11.
43. Способ по п.42, в котором субъектом является человек.
44. Способ по п.42, в котором субъектом является животное.
45. Способ по п.43, в котором соединение выбрано из группы, состоящей из
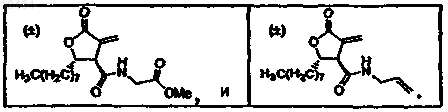
46. Способ по п.44, в котором соединение выбрано из группы, состоящей из
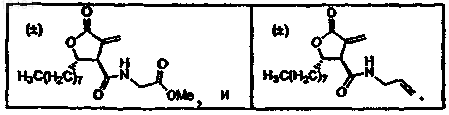
Текст
010484 Предпосылки изобретения Синтаза жирной кислоты Жирные кислоты играют три первостепенные роли в физиологии клеток. Во-первых, они являются строительными блоками биологических мембран. Во-вторых, производные жирных кислот служат в качестве гормонов и внутриклеточных переносчиков. В-третьих, особую важность для настоящего изобретения представляет то, что жирные кислоты являются топливными молекулами, которые могут храниться в адипозной ткани в виде триацилглицеринов, которые также известны как нейтральные жиры. Имеются четыре первостепенных фермента, включенных в синтетический путь жирной кислоты,синтаза жирной кислоты (FAS), ацетил СоА карбоксилаза (АСС), яблочный фермент и лимонная лиаза. Главный фермент FAS катализирует NADPH-зависимую конденсацию предшественников малонил-СоА и ацетил-СоА для продуцирования жирных кислот. NADPH (никотинамид-адениндинуклеотид фосфат НАДФ) является восстанавливающим агентом, который обычно служит как донор неотъемлемых электронов в двух точках реакционного цикла FAS. Другие три фермента (т.е. АСС, яблочный фермент и лимонная лиаза) продуцируют необходимые предшественники. Другие ферменты, например, которые продуцируют NADPH, также включены в синтез жирных кислот.FAS имеет номер Ферментной Комиссии (Е.С.)2.3.1.85 и также известен как синтетаза жирных кислот, лигаза жирных кислот, также как его систематическое наименование ацил-СоА: малонил-СоА Сацилтрансфераза (декарбоксилирующий, оксоацил- и эноилвосстанавливающий и тиоэфиргидролизующий). Имеются семь отчетливых ферментов или каталитических доменов, включенных вFAS катализируемый синтез жирных кислот: ацетилтрансацилазы, малонил-трансацилазы, бетакетоацилсинтетазы (конденсирующего фермента), бета-кетоацилредуктазы, бета-гидроксиацилдегидразы, эноилредуктазы и тиоэстеразы. (Wakil, S.J., Biochemistiry, 28: 4523-4530, 1989). Все семь этих ферментов вместе образуют FAS. Хотя FAS катализируемый синтез жирных кислот сходен в низших организмах, таких как, например, бактерии, и в более высших организмах, таких как, например, микобактерии, дрожжи и люди, имеет несколько важных отличий. В бактериях семь ферментных реакций осуществляются с помощью семи отдельных полипептидов, которые являются неассоциированными. Это классифицируется как тип IIFAS. В противоположность этому, ферментные реакции в микобактериях, дрожжах и человеческих организмах осуществляются с помощью многофункциональных полипептидов. Например, дрожжи имеют комплекс, составленный из двух отдельных полипептидов, тогда как в микобактериях и человеческих организмах все семь реакций осуществляются с помощью единственного полипептида. Они классифицируются как тип I FAS.FAS ингибиторы Различные соединения были показаны для ингибирования синтазы жирных кислот (FAS). FAS ингибиторы могут идентифицироваться по способности соединений ингибировать ферментную активность очищенной FAS. FAS активность может оцениваться с помощью измерения включения радиомеченного предшественника (например, ацетил-СоА или малонил-СоА) в жирных кислотах или с помощью спектрофотометрического измерения окисления NADPH. (Dils, и др. Methods Enzymol, 35:74-83). В таблице, представленной ниже, перечислены несколько FAS ингибиторов. Представители ингибиторов ферментов путей синтеза жирных кислот-2 010484 Из четырех ферментов в пути синтеза жирных кислот FAS является предпочтительной целью для ингибирования, потому что данный фермент действует только в пути получения жирных кислот, в то время как другие три фермента вовлечены в другие клеточные функции. Следовательно, более вероятно,что ингибирование одного из трех других ферментов воздействует на нормальные клетки. Из семи ферментных стадий, осуществляемых с помощью FAS, стадия, катализируемая конденсирующим ферментом, (т.е. бета-кетоацилсинтетазой) и эноилредуктаза оказались наиболее обычными кандидатами для ингибирования, которые уменьшают или останавливают синтез жирных кислот. Конденсирующий фермент FAS комплекса хорошо охарактеризован с точки зрения структуры и функции. Активный сайт или участок конденсирующего фермента содержит крайне важный цистеинтиол, который является целью антилипидемических реагентов, таких как, например, ингибитор церуленин. Предпочтительные ингибиторы конденсирующего фермента включают широкий ряд химических соединений, включающих алкилирущие агенты, оксиданты и реагенты, способные к подвержению дисульфидного обмена. Связующая группа фермента предпочитает длинную цепь, Е,Е, диены. В принципе, реагент, содержащий в боковой цепи диен и группу, которая проявляет реакционноспособность с тиолатными анионами, мог бы быть хорошим ингибитором конденсирующего фермента. Примером является церуленин [(2S,3R)-2,3-эпокси-4-оксо-7,10-додекадиеноиламид] Церуленин ковалентно связывается с существенной цистеинтиольной группой в активном сайте конденсирующего фермента синтазы жирной кислоты, инактивирующей данную ключевую ферментную стадию (Fimabashi, et al, J. Biochem., 105:751-755, 1989). Хотя отмечалось, что церуленин обладает другими активностями, они или имеют место в микроорганизмах, которые могут быть нерелевантными моделями человеческих клеток (например, ингибирование синтеза холестерина в грибках, Omura (1976),Bacteriol. Rev., 40:681-697; или синтеза уменьшенной РНК в вирусах, Perez, et al. (1991), FEBS, 280: 129133), имеют место при существенно более высоких концентрациях лекарства (ингибирование вируснойHIV протеазы при 5 мг/мл, Moelling, et al. (1990), FEBS, 261:373-377) или могут быть непосредственным результатом ингибирования синтеза эндогенной жирной кислоты (ингибирование переработки антигена в В лимфоцитах и макрофагах, Falo, et al. (1987), J. Immunol., 139:3918-3923). По некоторым данным предполагают, что церуленин не ингибирует специфически миристоилирование белков (Simon, et al., J.Biol. Chem., 267:3922-3931, 1992). Еще несколько FAS ингибиторов описываются в патентной заявке США 08/096908 и ее частичном продолжении, поданных 24 января 1994 г., содержание которых приводится здесь для сведения. Они включают ингибиторы синтазы жирной кислоты, цитратлиазу, СоА-карбоксилазу и яблочный фермент. Томода с коллегами (Tomoda et al., Biochem. Biophys. Act 921:595-598 1987; Omura et al., J. Antibiotics 39:1211-1218 1986) описывают триаксин С (называемый иногда термином WS-1228 А), встречающийся в природе ингибитор ацил-СоА-синтетазы, который является продуктом Streptomyces sp. SK-1894. Химическая структура Триаксина С представляет 1-гидрокси-3-(Е,Е,Е-2',4',7'-ундекатриенилиден)триазин. Триаксин С вызывает 50% ингирование ацил-СоА-синтетазы печени крыс при 8,7 мкМ; родственное соединение, Триаксин А, ингибирует ацил-СоА-синтетазу с помощью механизма, который является конкурентным с длинноцепочечными жирными кислотами. Ингибирование ацил-СоА-синтетазы является токсичным для животных клеток. Томода и др. (Tomoda et al., J. Biol. Chem. 266:4214-4219, 1991) сообщают, что Триаксин С вызывает ингибирование роста в Raji клетках при 1,0 мкМ, и было также показано, что он ингибирует рост Vero и Hela клеток. Томода и др. далее сообщают, что ацил-СоА-синтетаза является существенной в животных клетках и что ингибирование данного фермента вызывает летальные эффекты. В патенте США 5981575 (содержание которого приводится здесь для сведения) было показано,что семейство соединений (гамма-замещенных-альфа-метилен-бета-карбокси-гамма-бутиролактонов) ингибирует синтез жирных кислот, ингибирует рост опухолевых клеток и вызывает потерю веса. Соединения, описанные в патенте '575, имеют несколько преимуществ над природным продуктом церуленином вследствие терапевтических применений: [1] они не содержат высокореактивную эпоксидную группу церуленина, [2] они являтся стабильными и растворимыми в водном растворе, [3] они могут получаться с помощью двухстадийной реакции синтеза и таким образом получаться в больших количествах,и [4] они легко тритируются до высокой специфической активности для биохимических и фармакологических анализов. Синтез данного семейства соединений, которые являются ингибиторами синтазы жирных кислот, описывается в патенте '575, как и их использование в качестве средств для лечения экспрессирования FAS в опухолевых клетках, и их использование в качестве средств для снижения веса тела. Патент '575 раскрывает также использование любых ингибиторов синтазы жирных кислот для системного снижения адипоцитной массы (числа или размера адипоцитных клеток) как средства снижения веса тела. Первичными областями для синтеза жирных кислот у мышей и людей являются печень (см. Ron-3 010484cari, Can. J. Biochem., 52:221-230, 1974; Triscari et al., 1985, Metabolism, 34:580-7; Barakat et al., 1991, Metabolism, 40:280-5), лактирующие молочные железы (см. Thompson et al., Pediatr. Res., 19:139-143, 1985) и адипозная ткань (Goldrick et al., 1974, Clin. Sci. Mol. Med., 46:469-79). Ингибиторы синтеза жирных кислот как противомикробные агенты Церуленин был первоначально выделен в качестве потенциального противогрибкового антибиотика из культурального бульона Cephalosporium caerulens. В структурном отношении церуленин был охарактеризован как амид (2R,3S)-эпокси-4-оксо-7,10-транс,транс-додекановой кислоты. Было показано, что его механизмом действия является ингибирование, через необратимое связывание, бета-кетоацил-АСР синтазы, конденсирующего фермента, требуемого для биосинтеза жирных кислот. Церуленин был охарактеризован как противогрибковый агент, прежде всего против Candida и Saccharomyces sp. Кроме того,некоторая in vitro активность была показана против некоторых бактерий, актиномицетов и микобактерий, хотя не было найдено никакой активности против Mycobacterium tuberculosis. Активность ингибиторов синтеза жирных кислот и, в частности, церуленина оценивалась против простейших, таких какToxoplasma gondii, или других инфекционных эукариотных патогенов, таких как Pneumocystis carinii,Giardia lamblia, Plasmodium sp., Trichomonas vaginalis, Cryptosporidium, Trypanosoma, Leishmania, Schistosoma. Инфекционными заболеваниями, которые особенно восприимчивы к лечению, являются заболевания, которые вызывают повреждения на внешне доступных поверхностях зараженного животного. Внешне доступные поверхности включают все поверхности, которые можно достичь неинвазивными средствами (без пореза или пунктирования кожи), включая кожную поверхность саму по себе, слизистые мембраны, такие как мембраны, покрывающие носовую, ротовую, желудочно-кишечную или урогенитальную поверхности, и легочные поверхности, такие как альвеолярные мешочки. Восприимчивые заболевания включают: (1) кожные микозы или грибковые инфекционные заболевания волос, особенно вызываемые грибками Microsporium, Trichophyton, Epidermophyton или Mucocutaneous candidiasis; (2) мукотический кератит, особенно вызываемый Aspergillus, Fusarium или Candida; (3) амебный кератит, особенно вызываемый Acanthamoeba; (4) желудочно-кишечное заболевание, особенно вызываемое Giardialamblia, Entamoeba, Cryptosporidium, Microsporidium или Candida (наиболее обычное у иммунологически скомпрометированных животных); (5) урогенитальную инфекцию, особенно вызываемую Candida albicans или Trichomonas vaginalis; и (6) легочное заболевание, особенно вызываемое Mycobacterium tuberculosis, Aspergillus или Pneumocystis carinii. Инфекционные организмы, которые являются восприимчивыми к лечению ингибиторами синтеза жирных кислот, включают Mycobacterium tuberculosis, особенно штаммы, резистентные к множеству лекарств, и простейшие, такие как Toxoplasma. Любое соединение, которое ингибирует синтез жирных кислот, может применяться для ингибирования роста микробных клеток. Однако соединения, даваемые пациенту, не должны быть в равной степени токсичными по отношению и к пациенту, и к целевым микробным клеткам. Соответственно, благоприятным является выбор ингибиторов, которые поражают только или преимущественно целевые микробные клетки. Эукариотные микробные клетки, которые являются зависимыми от их собственных эндогенно синтезированных жирных кислот, экспрессируют Тип I FAS. Это показано как тем фактом, что FAS ингибиторы являются ингибиторными к росту, так и тем фактом, что экзогенно добавляемые жирные кислоты могут защищать нормальные клетки пациента, но не микробные клетки, от FAS ингибиторов. Следовательно, агенты, которые предотвращают синтез жирных кислот с помощью клеток, могут применяться для лечения инфекций. В эукариотах жирные кислоты синтезируются с помощью типа I FAS с использованием субстратов ацетил-СоА, малонил-СоА и NADPH. Таким образом, другие ферменты, которые могут быть подходящими для субстратов в данном пути синтеза, могут также воздействовать на степень синтеза жирных кислот и таким образом быть важными в микробах, которые зависят от эндогенно синтезируемых жирных кислот. Ингибирование экспрессии или активности любых из этих ферментов будет воздействовать на рост микробных клеток, которые являются зависимыми от эндогенно синтезируемой жирной кислоты. Продукт типа I FAS отличается в различных организмах. Например, у грибка S. cerevisiae продуктами являются преимущественно пальмитат и стерат, стерифицированный по отношению к коферменту А. У Mycobacterium smegmatis продуктами являются СоА сложные эфиры насыщенных жирных кислот с длиной, варьирующейся от 16 до 24 атомов углерода. Данные липиды часто далее перерабатываются для удовлетворения потребности в клетках для различных липидных компонентов. Можно ожидать, что ингибирование ключевых стадий при переработке в нисходящем потоке или утилизация жирных кислот будет ингибировать клеточную функцию, зависит ли клетка от эндогенной жирной кислоты или утилизирует жирную кислоту, поставляемую извне клетки, и поэтому ингибиторы данных стадий в нисходящем потоке могут не быть достаточно селективными для микробных клеток,которые зависят от эндогенной жирной кислоты. Однако было обнаружено, что введение ингибитора синтеза жирной кислоты типа I таким микробам делает их более чувствительными к ингибированию ингибиторами переработки в нисходящем потоке и/или утилизации. Из-за данного синергизма введение ингибитора синтеза жирных кислот в сочетании с одним или более ингибиторами стадий, проходящих в-4 010484 нисходящем потоке в биосинтезе липидов, и/или утилизации будет селективно воздействовать на микробные клетки, которые зависят от эндогенно синтезируемой жирной кислоты. Предпочтительные сочетания включают ингибитор FAS и ацетил-СоА-карбоксилазу, или FAS и ингибитор MAS. Когда было найдено, что млекопитающие инфицируются клетками организма, который экспрессирует FAS типа I, или, если FAS найден в биологической жидкости, взятой у пациента, млекопитающее или пациента можно лечить введением ингибитора синтеза жирных кислот (патент 5614551). Ингибирование нейропептида-Y для подавления аппетита и стимулирования потери веса описывается в международной патентной заявкеPCT/US 01/05316, содержание которой приводится здесь для сведения. В данной заявке, однако, не описываются и не раскрываются какие-либо из соединений, раскрытых в настоящей заявке. Стимулирование карнитин-пальмитоил-трансферазы-1 (СРТ-1) для стимуляции потери веса описано в патентной заявке США 60/354480, содержание которой приводится здесь для сведения. Указанная заявка также не раскрывает и не описывает какие-либо из соединений, описанных в настоящей заявке. Использование ингибиторов FAS для ингибирования роста раковых клеток описывается в патенте США 5759837, содержание которого включено в настоящую заявку для сведения. Указанная заявка не описывает и не раскрывает какое-либо из соединений, раскрытых в данном описании. Краткое содержание изобретения Обнаружены новые классы соединений, которые обладают большим разнообразием терапевтически ценных свойств, например, проявляют FAS-ингибирование, NPY-ингибирование, СРТ-1 стимулирование, способность вызывать потерю веса и противораковые и противомикробные свойства. Еще одной целью данного изобретения является предоставление способа вызывания потери веса у животных и людей путем введения фармацевтических композиций, включающих фармацевтический разбавитель и соединение формулы I, II, III, IV, V, VI, VII, VIII или IX, которые подробно описаны ниже. Следующей целью изобретения является предоставление способа стимулирования активности СРТ 1 путем введения людям или животным фармацевтических композиций, включающих фармацевтический разбавитель и соединение формулы I, II, III, IV, V, VI, VII, VIII или IX. Еще одной целью данного изобретения является предоставление способа ингибирования синтеза нейропептида-Y у людей или животных путем введения фармацевтических композиций, включающих фармацевтический разбавитель и соединение формулы I, II, III, IV, V, VI, VII, VIII или IX. Еще одной целью данного изобретения является предоставление способа ингибирования синтазы жирной кислоты у людей или животных путем введения фармацевтических композиций, включающих фармацевтический разбавитель и соединение формулы I, II, III, IV, V, VI, VII, VIII или IX. Еще одной целью данного изобретения является предоставление способа лечения рака у людей и животных путем введения фармацевтических композиций, включающих фармацевтический разбавитель и соединение формулы I, II, III, IV, V, VI, VII, VIII или IX. Дальнейшей целью данного изобретения является предоставления способа предотвращения роста раковых клеток у животных и людей с помощью введения фармацевтических композиций, включающих фармацевтический разбавитель и соединение формулы I, II, III, IV, V, VI, VII, VIII или IX. Еще одной целью данного изобретения является предоставление способа ингибирования роста инвазивных клеток микробов путем введения фармацевтической композиции, включающей фармацевтический разбавитель и соединение формулы I, II, III, IV, V, VI, VII, VIII или IX. Краткое описание чертежей Фиг. 1 показывает синтетическую схему получения некоторых соединений согласно изобретению; фиг. 2 - схему синтеза для получения некоторых соединений согласно изобретению; фиг. 3 - результаты испытания in vivo противоопухолевых свойств некоторых соединений согласно изобретению; фиг. 4 - результаты испытания in vitro противоопухолевых свойств различных соединений согласно изобретению; фиг. 5 - результаты испытания in vivo на потерю веса с помощью некоторых соединений согласно изобретению. Подробное описание изобретения Соединения изобретения могут быть получены с помощью общепринятых средств. Синтез ряда соединений описывается в примерах. Соединения могут быть полезными для лечения ожирения, рака или основанных на микробных организмах инфекций. Одним из воплощений изобретения являются соединения формулы IX1 = NHR4, где R4 представляет Н, C1-С 20 алкил, циклоалкил, алкенил, арил, арилалкил или алкиларил, причем, R4 группа дополнительно содержит карбонильную группу, карбоксильную группу, карбоксамидную группу, спиртовую группу или простую эфирную группу, далее R4 группа необязательно содержит один или более атомов галогена. Согласно предпочтительному воплощению R1 представляет C1-С 10 алкил, циклоалкил, алкенил,арил, арилалкил или алкиларил; или =СН 2. В еще более предпочтительно воплощении R1 представляет -СН 3 или =СН 2. Согласно еще одному предпочтительному воплощению R4 представляет -CH2C(O)OR5 или-СН 2 С(О)NHR5, где R5 представляет C1-С 20 алкил, циклоалкил, алкенил, арил, арилалкил или алкиларил. Еще одним из воплощений изобретения являются соединения формулы IIX2 = NHR9, где R9 представляет Н, C1-С 20 алкил, циклоалкил, алкенил, арил, арилалкил или алкиларил, причем R9 группа дополнительно содержит карбонильную группу, карбоксильную группу, карбоксамидную группу, спиртовую группу или простую эфирную группу, далее R9 группа дополнительно содержит один или более атомов галогена; при условии, что когда R6 представляет -СН 3, и R7 представляет н-С 13 Н 27, X2 не является группой-NHC2H5. Согласно предпочтительному воплощению R6 представляет C1-С 10 алкил, циклоалкил, алкенил,арил, арилалкил или алкиларил. В еще более предпочтительном воплощении R6 представляет -СН 3. Согласно еще одному предпочтительному воплощению R9 представляет -CH2C(O)OR10 или СН 2 С(О)NHR10, где R10 представляет C1-С 10 алкил, циклоалкил, алкенил, арил, арилалкил или алкиларил. Еще одним из воплощений изобретения являются соединения формулы IIIR14 группа необязательно содержит карбонильную группу, карбоксильную группу, карбоксамидную группу, спиртовую группу или простую эфирную группу, далее R14 группа дополнительно содержит-6 010484 один или более атомов галогена. Согласно предпочтительному воплощению R11 представляет С 1-С 10 алкил, циклоалкил, алкенил,арил, арилалкил или алкиларил; или =СН 2. В еще более предпочтительном воплощении R11 представляет -СН 3 или =СН 2. Согласно еще одному предпочтительному воплощению R14 представляет -CH2C(O)OR15 или-СН 2 С(О)NHR15, где R15 представляет C1-С 10 алкил, циклоалкил, алкенил, арил, арилалкил или алкиларил. Еще одним из воплощений изобретения являются соединения формулы IVR19 группа необязательно содержит карбонильную группу, карбоксильную группу, карбоксамидную группу, спиртовую группу или простую эфирную группу, далее R19 группа дополнительно содержит один или более атомов галогена,при условии, что, когда R16 представляет -СН 3 и R19 представляет -СН 3, тогда R17 не является замещенным или незамещенным фенилом, Н-С 3 Н 7, н-С 5 Н 11 или н-С 13 Н 27,и при дополнительном условии, что, когда R16 представляет Н и R19 представляет -СН 3, тогда R17 не является замещенным или незамещенным фенилом или группой -СН 3, и, когда R16 представляет Н и R19 представляет -СН 2 СН 3, тогда R17 не является группой изо-С 3 Н 7 или замещенным или незамещенным фенилом. Согласно предпочтительному воплощению R16 представляет C1-С 10 алкил, циклоалкил, алкенил,арил, арилалкил или алкиларил. В еще более предпочтительном воплощении R16 представляет -СН 3. Согласно еще одному предпочтительному воплощению R19 представляет -CH2C(O)OR20 или-СН 2 С(О)NHR20, где R20 представляет C1-С 10 алкил, циклоалкил, алкенил, арил, арилалкил или алкиларил. Еще одним из воплощений изобретения являются соединения формулы V в которой R21 = C2-C20 алкил, циклоалкил, алкенил, арил, арилалкил или алкиларил, =CHR23, -С(О)OR23,-C(O)R23, -CH2C(О)OR23, -СН 2 С(O)NHR23, где R23 представляет Н или C1-С 10 алкил, циклоалкил или алкенил за исключением того, что, когда R21 представляет =CHR23, R23 не может быть Н;R22 = C1-C20 алкил, циклоалкил, алкенил, арил, арилалкил или алкиларил; при условии, что, когда R21 представляет -СООН, тогда R22 не является группой -СН 3, н-C5H11 или Н-С 13 Н 27, и при дополнительном условии, что, когда R21 представляет -СН 2 СООН, тогда R22 не является группой -СН 3, -СН 2 СН 3 или группой изо-С 5 Н 11, и при следующем условии, что, когда R21 представляет=СНСН 3, тогда R22 не является группой н-С 5 Н 11. Согласно предпочтительному воплощению R21 представляет С 2-С 10 алкил, циклоалкил, алкенил,арил, арилалкил или алкиларил. Еще одним из воплощений изобретения являются соединения формулы VIR25 = C1-С 20 алкил, циклоалкил, алкенил, арил, арилалкил или алкиларил; при условии, что, когда R24 представляет -СООН, тогда R25 не является группой -СН 3, н-С 5 Н 11 илиC13H27, и при дополнительном условии, что, когда R24 представляет -СН 2 СООН, тогда R25 не является группой -СН 3, -СН 2 СН 3 или группой изо-С 5 Н 11. Согласно предпочтительному воплощению R21 представляет С 2-C10 алкил, циклоалкил, алкенил,арил, арилалкил или алкиларил. Следующим воплощением изобретения являются соединения формулы VII в которой R27 = C3-C4 алкил, С 6-С 10 алкил, C12 алкил, C14 алкил, C16-C20 алкил. Еще одно воплощение изобретения составляют соединения формулы VIII в которой R28 = C1-C20 алкил, циклоалкил, алкенил, арил, арилалкил или алкиларил, при условии, что R28 не является группой -СН 3, н-С 3 Н 7, н-С 11 Н 23 или н-С 13 Н 27. Еще одно воплощение изобретения составляют фармацевтические композиции, включающие фармацевтический разбавитель или носитель и соединение формулы I, II, III, IV, V, VI, VII, VIII или IXX5 = -OR32 или -NHR32, где R32 представляет Н, C1-С 20 алкил, циклоалкил, алкенил, арил, арилалкил или алкиларил, причем R32 группа необязательно содержит карбонильную группу, карбоксильную группу, карбоксамидную группу, спиртовую группу или простую эфирную группу, далее R32 группа необязательно содержит один или более атомов галогена; при условии, что когда R29 представляет =СН 2, тогда X5 не является группой -ОН. Согласно предпочтительному воплощению R29 представляет C1-С 10 алкил, циклоалкил, алкенил,арил, арилалкил или алкиларил; или =СН 2. В еще более предпочтительном воплощениии R29 представляет -СН 3 или =СН 2. Согласно еще одному предпочтительному воплощению R32 представляет -CH2C(O)OR33 или-СН 2 С(О)NHR33, где R33 представляет C1-С 10 алкил, циклоалкил, алкенил, арил, арилалкил или алкиларил. Композиции настоящего изобретения могут быть представлены для назначения людям и животным-8 010484 в форме дозированных единиц, таких как таблетки, капсулы, пилюли, порошки, гранулы, стерильные парэнтеральные растворы или суспензии, оральные растворы или суспензии, эмульсии масло в воде и вода в масле, содержащие подходящие количества соединения, суппозитории, и в форме текучих суспензий или растворов. В используемом здесь смысле термины фармацевтический разбавитель и фармацевтический носитель имеют одно и то же значение. Для орального назначения могут приготавливаться или твердые, или жидкие единичные дозированные формы. Для приготовления твердых композиций,таких как таблетки, соединение может смешиваться с общепринятыми ингредиентами, такими как тальк,стеарат магния, дикальцийфосфат, магний-алюминиевый силикат, сульфат кальция, крахмал, лактоза,камедь акации, метилцеллюлоза и функционально сходные материалы, в качестве фармацевтических разбавителей или носителей. Капсулы приготавливаются с помощью смешения соединения с инертным фармацевтическим разбавителем и заполнения смесью твердых желатиновых капсул соответствующего размера. Мягкие желатиновые капсулы приготавливаются путем механического инкапсулирования суспензии соединения с приемлемым растительным маслом, легким жидким петролатумом или другим инертным маслом. Могут приготавливаться текучие единичные дозированные формы для орального назначения, такие как сиропы, эликсиры или суспензии. Данные формы могут растворяться в водном носителе вместе с сахаром, ароматическими ароматизирующими или вкусовыми агентами и антикоагулянтами или консервирующими агентами с образованием сиропа. Суспензии могут приготавливаться с водным носителем с помощью суспендирующего агента, такого как камедь акации, трагакант, метилцеллюлоза и аналогичные. Для парэнтерального назначения текучие формы дозированных единиц могут приготавливаться с использованием соединения и стерильного носителя. При приготовлении растворов соединение может растворяться в воде для инъекций и стерилизоваться с фильтром перед заполнением ими подходящих сосудов или ампул и герметизацией. В носителе могут растворяться адъюванты, такие как местные анестетики, консервирующие и буферирующие агенты. После заполнения сосудов композиция может замораживаться, а вода удаляется под вакуумом. Лиофилизированный порошок может затем масштабироваться в сосуде и подвергаться реконституции перед использованием. Клинические терапевтические показания, предусматриваемые для соединений изобретения, включают: (1) инфекции, являющиеся следствием инвазивных микроорганизмов, таких как стафилококки и энтерококки; (2) раковые опухоли, возникающие во многих тканях, клетки которых сверхэкспрессированы синтазой жирной кислоты, и (3) ожирения вследствие потребления избыточных калорий. Доза и длительность лечения зависит от разнообразия факторов, включающих: (1) возраст пациента,вес тела и функцию органа (например, функция печени и почек); (2) характер и степень развития заболевания, подлежащего лечению, при этом учитываются также любая существующая значительная распространенность заболевания и применяемые сопутствующие методы лечения, и (3) параметры, связанные с лекарством, такие как путь введения, частота и длительность приема доз для достижения эффекта лечения, и терапевтический показатель или индекс лекарства. В основном выбираются параметры для достижения уровней в сыворотке от 1 до 100 нг/мл с целью достижения эффективных концентраций в участке,который является целью, приблизительно от 1 до 10 мкг/мл. Примеры Изобретение далее иллюстрируется, но не ограничивается следующими примерами. Ряд соединений согласно изобретению синтезировались, как описано ниже. Биологическая активность некоторых соединений проверялась следующим образом. Соединения испытывались на (1) ингибирование очищенной человеческой FAS, (2) ингибирование активности синтеза жирных кислот в целых клетках, (3) цитотоксичность против культивированных MCF-7 раковых клеток молочной железы человека, о которых известно, что они обладают высокими уровнями FAS и активностью синтеза жирных кислот, с использованием анализов с фиолетовыми кристаллами и ХТТ, и (4) антимикробную активность. Выбранные соединения с низкими уровнями цитотоксичности затем испытывались на потерю веса на Balb/C мышах. Кроме того, характерное соединение из группы, которая обнаруживала значительную потерю веса и низкие уровни цитотоксичности, испытывалось на их действие на окисление жирных кислот и на активность карнитин-пальмитоилтрансферазы-1 (СРТ-1), а также на гипоталамическую NPY экспрессию с помощью анализа Northen на Balb/C мышах. Некоторые соединения испытывались также на активность против грамположительных и/или -отрицательных бактерий. Некоторые соединения испытывались также in vivo на противоопухолевую активность. Получение соединений(12 мкл, 0,2 ммоль) и NEt3 (0,04 мл, 0,3 ммоль) и раствору давалась возможность перемешиваться в течение 30 мин при комнатной температуре. Смесь вливалась в раствор NH4Cl(насыщ)/1N HCl (10 мл, 3:1) и экстрагировалась Et2O (315 мл). Объединенные органические вещества сушились (MgSO4), фильтровались, выпаривались и подвергались хроматографии (35% EtOAc/гексан), давая чистый продукт (1) (26,2 мг, 54%); т.пл. 66-68 С. 1 Н ЯМР (300 МГц, CDCl3)0,84 (т, J=6 Гц, 3 Н), 1,23 (м, 11 Н), 1,34-1,47 (м, 1 Н), 1,60-1,71 (м, 2 Н),3,43-3,46 (м, 1 Н), 3,87 (дт, J=1,4, 5,7 Гц, 2 Н), 4,74 (дт, J=5,7 Гц, 1 Н), 5,12 (д, J=10,6 Гц, 1 Н), 5,16 (д, J=17,3 Гц, 1 Н), 5,72-5,85 (м, 1 Н), 5,76 (д, J=2,6 Гц, 1 Н), 6,34 (д, J=2,6 Гц, 1 Н), 6,50 (шир.с, 1 Н). 13 С ЯМР (75 МГц, CDCl3)14,0, 22,6, 24,9, 29,1, 29,2, 29,4, 31,8, 35,9, 42,3, 52,2, 80,5, 117,0, 124,3,133,5, 135,4, 168,6, 168,6. ИК (NaCl) 2922, 1771, 1756, 1642, 1557 см-1. Анализ. Вычислено для C17H27NO3: С, 69,5; Н, 9,28; Найдено: С, 69,5; Н, 9,09. Метиленбутиролактон-5-октил-4-карбоксиглицинат (6). Из соединения 5 (100 мг, 0,27 ммоль) в CH2Cl2 (2,0 мл) добавлялась трифторуксусная кислота (TFA)(1,3 мл) и раствору давалась возможность перемешиваться в течение 3 ч при комнатной температуре. После выпаривания растворителей, хроматографии на колонке (50% EtOAc/2% СН 3 СО 2 Н/гексан) получалось чистое вещество 6 (61 мг, 73%). 1 Н ЯМР (300 МГц, MeOD)0,82 (т, J=7 Гц, 3 Н), 1,22 (с, 10 Н), 1,28-1,38 (м, 2 Н), 1,57-1,69 (м, 2 Н),3,55-3,59 (м, 2 Н), 3,78-3,95 (кв (ab), J=17 Гц, 2 Н), 4,63 (каж. кв, J=6,4 Гц, 1 Н), 4,88 (шир.с, 1 Н), 5,87(8, 9) К раствору С 75 (100 мг, 0,39 ммоль) в EtOAc (3,0 мл) добавлялся Pd (30 мг, 10% на углероде) и Н 2 (50 фунт./кв.дюйм) в течение 2 ч. Смесь фильтровалась через целит и выпаривалась, давая смесь диастереомеров (1,8:1 для транс 9:цис 8). Хроматография на колонке (20% EtOAc/2% СН 3 СО 2 Н/гексан) давала отдельный транс дистереомер с неотделимым изомеризованным побочным продуктом (9:10, 3,8:1,59,5 мг); и чистый цис изомер (8, 32,7 мг), (общий выход 92%).- 12010484 Очистка FAS от ZR-75-1 раковых клеток молочной железы человека. Человеческая FAS очищалась от культивированных ZR-75-1 раковых клеток молочной железы человека, полученных из Американской Коллекции Типовых Культур. Процедура, примененная из Linn etal., 1981, и Kuhajda et al., 1994, использует гипотонический лизис, последовательные осаждения полиэтиленгликоля (PEG) и анионообменную хроматографию. ZR-75-1 клетки культивировались при 37 С с 5% СО 2 в RPMI культуральной среде с 10% фетальной бычьей сывороткой, пенициллином и стрептомицином. Сливающиеся клетки в десяти Т 150 колбах лизируются с помощью 1,5 мл лизисного буфера (20 мМ трис-HCl, рН 7,5, 1 мМ EDTA (этилендиаминтетрауксусной кислоты), 0,1 мМ фенилметансульфонил фторида (PMSF), 0,1% Igepal CA-630) и гомогенизируются на льду 20 тактами в Dounce-гомогенизаторе. Лизат центрифугируется в JA-20 роторе (Beckman) при 20000 об./мин в течение 30 мин при 4 С, и супернатант (плавающий сверху слой) переносится в 42 мл лизисного буфера. К супернатанту медленно добавляется раствор 50% PEG 8000 (полиэтиленгилколь) в лизисном буфере до конечной концентрации 7,5%. После встряхивания в течение 60 мин при 4 С раствор центрифугируется в JA-20 роторе (Beckman) при 15000 об./мин в течение 30 мин при 4 С. Затем к супернатанту добавляется твердый PEG 8000 (полиэтиленгликоль) до конечной концентрации 15%. После встряхивания центрифугирование повторяется,как описано выше, гранула повторно суспендируется на протяжении ночи при 4 С в 10 мл буфера А (20 мМ K2HPO4, рН 7,4). После 0,45 мкМ фильтрования раствор белка наносится на Mono Q 5/5 анионообменную колонку (Pharmacia). Колонка промывается в течение 15 мин буфером А при 1 мл/мин и связанный материал элюируется линейным 60-мл градиентом на протяжении 60 мин до 1 М KCl. FAS (Мн примерно 270 кДа) обычно элюирует при 0,25 М KCl в трех 0,5 мл фракциях, идентифицируемых с использованием 4-15% SDS-PAGE с красителем Coomassie G250 (Bio-Rad). Концентрация FAS белка определяется с использованием аналитического реагента Coomassie Плюс Белок (Pierce) согласно инструкциям производителя с использованием бычьего сывороточного альбумина (БСА) в качестве стандарта. Данная процедура дает в результате по существу чистые препараты FAS (95%), о чем судят поFAS активность измеряется с помошью мониторинга малонил-СоА зависимого окисления NADPH спектрофотометрически при ОП 340 (оптическая плотность) на 96-луночных пластинках (Dils et al. иArslanian et al., 1975). Каждая лунка содержит 2 мкг очищенной FAS, 100 мМ K2HPO4, рН 6,5, 1 мМ дитиотреитол (Sigma), и 187,5 мкМ p-NADPH (Sigma). Исходные растворы ингибиторов приготавливаются в ДМСО при 2,1 и 0,5 мг/мл, что дает в результате концентрации 20, 10 и 5 мкг/мл, когда в каждую лунку добавляется 1 мкл исходного раствора. Для каждого эксперимента пропускается церуленин (Sigma) в качестве положительного контроля наряду с ДМСО контролями, ингибиторами и холостыми веществами(без FAS фермента) все с двукратным повторением. Анализ проводится на Molecular Devices SpectraMax Plus Spectrophotometer. Пластинка, содержащаяFAS, буферы, ингибиторы и контроли, помещается в спектрофотометр, нагретый до 37 С. При использовании кинетического протокола проводится эксперимент с применением двух контрольных лунок, содержащих 100 мкл 100 мМ K2HPO4, рН 6,5, и пластинка считывается при ОП 340 с 10 с интервалами в течение 5 мин для измерения любого малонил-СоА-независимого окисления NADPH. Пластинка удаляется из спектрофотометра, и в каждую лунку, за исключением холостых опытов, добавляются малонил-СоА(67,4 мкМ, конечная концентрация на лунку) и ацетил-СоА (61,8 мкМ, конечная концентрация на лунку). Пластинка снова считывается, как описано выше, с кинетическим протоколом для измерения малонилСоА-зависимого окисления NADPH. Разница междуОП 340 для малонил-СоА-зависимого и немалонилСоА-зависимого окисления NADPH представляет специфическую активность FAS. Вследствие чистотыIC50 для соединений против FAS определяется с помощью графического изображенияОП 340 для каждой испытанной концентрации ингибитора, выполнения линейной регрессии и компьютерного вычисления данных наилучшей эмпирической кривой, значений r2 и 95% доверительных интервалов. Концентрация соединения, дающая 50% ингибирование FAS, представляет IC50. Графические показатели ОП 340 в зависимости от времени наносятся на график с помощью SOFTmax PRO программного обеспечения (Molecular Devices) для каждой концентрации соединения. Компьютерные вычисления линейной регрессии, наилучшей эмпирической кривой, r2 и 95% доверительных интервалов осуществляются с использованием Prism Version (Graph Pad Software). Анализ роста клеток с кристаллическим фиолетовым. С помощью анализа с кристаллическим фиолетовым измеряется рост клеток, но не цитотоксичность. В данном анализе применяется окрашивание кристаллическим фиолетовым фиксированных клеток на 96-луночных пластинках с последующей солюбилизацией и измерением ОП 490 на спектрофотометре. Показатель ОП 490 соответствует росту клеток, измеренному в единицу времени. Клетки обрабатываются интересуемыми соединениями или контрольными носителями и вычисляется IC50 каждого соеди- 13010484 нения. Для измерения цитотоксичности конкретных соединений против раковых клеток в лунки на 24 луночных пластинках помещается 5104 MCF-7 раковых клеток молочной железы человека, полученных из Американской Коллекции Типовых Культур, в DMEM среде с 10% фетальной бычьей сывороткой,пенициллином и стрептомицином. После культивирования на протяжении ночи при 37 С и 5% СО 2 соединения, подвергаемые испытанию, растворенные в ДМСО, добавляются в лунки в объеме 1 мкл в следующих концентрациях: 50, 40, 30, 20 и 10 мкг/мл трехкратно. Если требуется, испытываются дополнительные концентрации. В трехкратные лунки в качестве контрольного носителя добавляется 1 мкл ДМСО. В качестве положительных контролей трехкратно пропускается С 75 в количестве 10 и 5 мкг/мл. После 72-часового инкубирования клетки окрашиваются 0,5 мл кристаллического фиолетового красителя (0,5% в 25% метаноле) в каждой лунке. Спустя 10 мин, лунки споласкиваются, сушатся на воздухе, а затем солюбилизируются 0,5 мл 10% додецилсульфата натрия со встряхиванием в течение 2 ч. После переноса 100 мкл из каждой лунки на 96-луночные пластинки, пластинки считываются при ОП 490 наMolecular Devices SpectraMax Plus Spectrophotometer. Средние значения ОП 490 вычисляются с использованием SOFTmax Pro программного обеспечения (Molecular Devices), и величины IC50 определяются с помощью анализа линейной регрессии с использованием Prism Version 3.02 (Graph Pad Software, Сан Диего).XTT анализ на цитотоксичность. ХТТ анализ представляет нерадиоактивную альтернативу анализа на цитотоксичность с высвобождением [51Cr]. ХТТ представляет соль тетразолия, которая восстанавливается до формазанового красителя только метаболически активными жизнеспособными клетками. Восстановление ХТТ измеряется спектрофотометрически в виде ОП 490-ОП 650. Для измерения цитотоксичности конкретных соединений против раковых клеток в лунки на 96 луночных пластинках помещается 9103 MCF-7 раковых клеток молочной железы человека, полученных из Американской Коллекции Типовых Культур, в DMEM среде с 10% фетальной бычьей сывороткой,инсулином, пенициллином и стрептомицином. После культивирования на протяжении ночи при 37 С и 5% СО 2, соединения, подвергаемые испытанию, растворенные в ДМСО, добавляются в лунки в объеме 1 мкл в следующих концентрациях: 80, 40, 20, 10, 5, 2,5, 1,25 и 0,625 мкг/мл с трехкратным повторением. Если требуется, испытываются дополнительные концентрации. В трехкратные лунки в качестве контрольного носителя добавляется 1 мкл ДМСО. В качестве положительных контролей трехкратно пропускается С 75 в количестве 40, 20, 10, 15, 12,5, 10 и 5 мкг/мл. После 72-часовой инкубации клетки инкубируются в течение 4 ч с ХТТ реагентом в соответствии с инструкциями производителя (Cell Prolifiration Kit II (XTT) Roche). Пластинки считываются при ОП 490 и при ОП 650 на Molecular Devices SpectraMax Plus Spectrophotometer. Три лунки, содержащие реагент ХТТ без клеток, служат в качестве контроля. Данные ХТТ сообщаются в виде ОП 490-ОП 650. Средние значения и стандартная ошибка от среднего вычисляются с использованием SOFTmax Pro программного обеспечения (Molecular Dynamics). Показатель IC50 для соединений определяется как концентрация лекарства, приводящая к 50% снижению ОП 490-ОП 650 по сравнению с контролями. Значения ОП 490-ОП 650 вычисляются для каждой концентрации соединения с использованием SOFTmax Pro программного обеспечения (Molecular Devices). Показатель IC50 вычисляется с помощью линейной регрессии с графическим изображением активности FAS в виде процента от контроля в зависимости от концентраций лекарства. Линейная регрессия, наилучшая эмпирическая кривая, r2 и 95% доверительные интервалы определяются с использованием Prism Version 3.0 (Graph Pad Software). Измерение влючения [14 С] ацетата в общие липиды и определение показателя IC50 соединений. В данном испытании измеряется включение [14 С] ацетата в общие липиды и это является мерой активности в пути синтеза жирной кислоты in vitro. Данный анализ используется для измерения ингибирования синтеза жирных кислот in vitro.MCF-7 раковые клетки молочной железы человека, культивированные, как описано выше, помещаются в количестве 5104 клеток в лунку на 24-луночные пластинки. После инкубирования на протяжении ночи соединения, подвергаемые испытанию, солюбилизированные в ДМСО, добавляются трехкратно при 5, 10 и 20 мкг/мл, с испытанием, если необходимо, более низких концентраций. В трехкратные лунки в качестве контрольного носителя добавляется ДМСО. С 75 пропускается при 5 и 10 мкг/мл трехкратно в качестве положительных контролей. После 4-часового инкубирования в каждую лунку добавляется 0,25 мкКи [14 С] ацетата. После дополнительного инкубирования в течение 2 ч среда удаляется из лунок и в каждую лунку добавляется 800 мкл смеси хлороформ-метанол (2:1) и 700 мкл 4 мМ MgCl2. Содержимое каждой лунки переносится в 1,5 мл пробирки или трубки Eppendorf и подвергается вращению на полной скорости в течение 2 мин в высокоскоростной микроцентрифуге Eppendorf 5415D. После удаления водного (верхнего) слоя в каждую пробирку добавляются дополнительные 700 мкл смеси хлороформ-метанол (2:1) и 500 мкл 4 мМ MgCl2 и центрифугируются в течение 1 мин, как описано выше. Водный слой удаляется пипет- 14010484 кой Pastuer и отбрасывается. В каждую пробирку добавляются дополнительные 400 мкл смеси хлороформ-метанол (2:1) и 200 мкл 4 мМ MgC12, затем центрифугируются, и водный слой отбрасывается. Более низкая (органическая) фаза переносится в сцинтилляционную колбу и сушится при 40 С в атмосфере азотного газа. После сушки добавляется 3 мл сцинтиллята (АРВ NBC5104) и колбы подвергаются подсчету на 14 С. С помощью сцинтилляционного счетчика Beckman вычисляют средние cpm величины для трехкратных повторов. Показатель IC50 для соединений определяется как концентрация лекарства, приводящая к 50% снижению включения [14 С] ацетата в липиды по сравнению с контролями. Он определяется с помощью графического изображения среднего cpm для каждой концентрации испытываемого ингибитора, выполнения линейной регрессии и компьютерного вычисления наилучшей эмпирической кривой, величин r2 и 95% доверительных интервалов. Средние значения cpm вычисляются с помощью сцинтилляционного счетчика Бекмана (Model LS6500) для каждой концентрации соединения. Вычисление линейной регрессии, наилучшей эмпирической кривой, r2 и 95% доверительных интервалов вычисляются с использованием Prism Version 3.0 (Graph Pad Software). Карнитин пальмитоилтрансферазный-1 (СРТ) анализ. СРТ-1 катализирует АТФ (аденозинтрифосфат) зависимый перенос длинно-цепочечных жирных кислот с ацил-СоА на ацил-карнитин, который ингибируется малонил-СоА. Так как СРТ-1 требует для активности митохондриальные мембраны, ферментная активность измеряется в пермеабилизованных клетках или митохондриях. Данный анализ использует пермеабилизированные клетки для измерения переноса [метил-14 С]L-карнитина на органически растворимое производное ацил-карнитина.MCF-7 клетки помещаются в DMEM с 10% фетальной бычьей сывороткой в количестве 106 клеток на 24-луночные пластинки в трехкратном повторении для контролей, лекарств и малонил-СоА. За два часа до начала анализа добавляются лекарства в указанных концентрациях, приготовленных из исходных растворов при 10 мг/мл в ДМСО, контрольные носители состоят из ДМСО без лекарств. Поскольку малонил-СоА не может входить в интактные клетки, он добавляется только в аналитическом буфере к клеткам, которые не подвергались предварительной инкубации с лекарством. После инкубирования на протяжении ночи при 37 С среда удаляется и заменяется 700-мкл аналитического буфера, содержащего 50 мМ имидазол, 70 мМ KCl, 80 мМ сахарозу, 1 мМ ЭГТК (этиленгликолевая тетрауксусная кислота), 2 мМ MgCl2, 1 мМ ДТТ (дитиотреитол), 1 мМ KCN, 1 мМ АТФ, 0,1% свободный от жирной кислоты бычий сывороточный альбумин, 70 мкМ пальмитоил-СоА, 0,25 мкКи [метил-14 С]L-карнитин, 40 мкг дигитонина с лекарством, контрольный ДМСО носитель или 20 мкМ малонил-СоА. Концентрации лекарств и ДМСО в аналитическом буфере являются теми же, что используются при 2-часовой предварительной инкубации. После инкубации в течение 6 мин при 37 С реакция останавливается добавлением 500 мкл охлажденной льдом 4 М перхлорной кислоты. Клетки затем собираются и центрифугируются при 13000 хg в течение 5 мин. Осадок промывается 500 мкл-ми охлажденной льдом 2 мМ перхлорной кислоты и снова центрифугируется. Получающийся осадок повторно суспендируется в 800 мкл dH20O и экстрагируется 150 мкл бутанола. Бутанольная фаза анализируется с помощью сцинтилляционной жидкости и представляет производное ацилкарнитина. Скрининг потери веса под действием новых ингибиторов FAS. Для скрининга потери первоначального веса используются мыши Balb/C (Jackson Labs). Животных содержат в помещениях при комнатной температуре с 12-часовым световым циклом дня и ночи и кормят мышиным кормом и дают воду без ограничений. На эксперимент используют по три мыши для каждого испытываемого соединения с контрольными носителями в трехкратном повторении. Для экспериментов мышей содержат отдельно для каждого испытываемого соединения по три мыши на клетку. Соединения разбавляют в ДМСО при 10 мг/мл, когда их дают в дозе 30/кг, и 30 мг/мл, когда дают в дозе 60 мг/кг, и мышей инъецируют интраперитонально 60 мг/кг лекарства в приблизительно 100 мкл ДМСО или только носителем. Мышей наблюдают и взвешивают ежедневно, средние веса и стандартные ошибки вычисляют с помощью Excel (Microsoft). Эксперименты продолжают до тех пор,пока подвергнутые обработке или лечению животные не достигнут их веса до обработки. Выбранные соединения испытываются на животных, которых содержат в метаболических клетках. На фиг. 5 показаны результаты некоторых испытаний in vivo на потерю веса. Дозы, вводимые животным, идентичны скрининговым экспериментам с тремя животными на одну метаболическую клетку. Веса животных, потребление воды и пищи и выделение мочи и фекалий измеряются ежедневно. Трех тощих мышей Balb/C (Harlan), содержавшихся на мышином корме, обрабатывают соединениями в дозах,указанных на 0 день или носителем-контролем (ДМСО) равного объема. Соединение 6 солюбилизировалось в 40 мкл ДМСО, тогда как соединение 8 солюбилизировалось в 60 мкл ДМСО. Все животные инъекцировались интраперитонально. Веса измерялись в указанные дни. Показатели ошибки представляют стандартную ошибку среднего значения. Антимикробные свойства. Для оценки антимикробной активности соединений используется анализ с микроразведением бульона. Соединения испытываются при двухкратных серийных разведениях, и концентрация, которая инги- 15010484 бирует видимый рост (ОП 600 при 10% контроля), определяется как MIC (минимальная ингибирующая концентрация). Испытываемые микроорганизмы включают Staphylococcus aureus (ATCC29213), Enterococcus faecalis (АТСС 29212), Pseudomonas aeruginosa (ATCC27853) и Escherichia coli (Ecoli)(ATCC25922). Анализ проводится в двух ростовых средах, бульоне Mueller Hinton и Триптиказа соевом бульоне (Tsoy). Агаровая пластинка с кровью (Tsoy/5% овечья кровь) инокулируется из замороженных исходных растворов (маточные или сток-растворы), содержавшихся в Tsoy бульоне, содержащем 10% глицерин, и инкубируется на протяжении ночи при 37 С. Колонии суспендируются в стерильном бульоне так, чтобы мутность соответствовала мутности 0,5 McFarland стандарта. Инокулюм разводится 1:10 в стерильном бульоне (Mueller Hinton или Триптиказа соевом) и вводится по 195 мкл на лунку 96-луночной пластины. Подвергаемые испытанию соединения, растворенные в ДМСО, добавляются в лунки в объеме 5 мкл в следующих концентрациях: 25, 12,5, 6,25, 3,125, 1,56 и 0,78 мкг/мл в двух повторах. Если требуется, испытываются дополнительные концентрации. 5 мкл ДМСО, добавляемые в две лунки, являются контрольным носителем. В каждый прогон включаются серийные разведения положительных контрольных соединений, ванкомицина (Е. faecalis и S. aureus) и тобрамицина (Е. Coli и Р. aeruginosa). После 24-часовой инкубации при 37 С пластинки считываются при ОП 600 на Molecular DevicesPro Software (Molecular Devices) и величины MIC определяются с помощью анализа линейной регрессии с использованием Prism Version 3.02 (Graph Pad Software, Сан Диего). MIC определяется как концентрация соединения, требуемая для ОП 600 показания, эквивалентного показанию 10% контрольного носителя. Испытание in vivo на противоопухолевую активность. Для изучения противоопухолевых эффектов соединения 1 in vivo используются подкожные боковые ксенотрансплантаты раковой клеточной линии толстой кишки человека, НСТ-116 на nu/nu самках мышей (Harlan). Все эксперименты с животными соответствовали установленным правилам заботы о животных. 107 НСТ-116 клеток (примерно 0,1 мл уплотненных клеток) ксенотрансплантировались из культуры в DMEM с добавлением в нее 10% FBS (фетальная бычья сыворотка) 20 атимичным мышам. Обработка начиналась, когда развивались измеримые опухоли, примерно спустя 3 дня после инокуляции. Соединение 1 (10 мг/кг) разбавлялось в 40 мкл ДМСО, и обработанные интраперитонально (i.p.) 11 животных получали JMM-III-231 10 мг/кг, i.p. в дни, указанные стрелками, а 11 животных получали ДМСО контроль. Опухоли измерялись в указанные дни. Одна мышь, обработанная соединением 1, умирала на 10 день после повторной i.p. инъекции. Результаты показаны на фиг. 4. Показатели ошибки представляют стандартную ошибку среднего значения. Для изучения противоопухолевых эффектов соединения 7 и соединения 3 in vivo используются подкожные боковые ксенотрансплантаты раковой клеточной линии толстой кишки человека, НСТ-116 наnu/nu самках мышей (Harlan). Все эксперименты с животными соответствовали установленным правилам заботы о животных. 107 НСТ-116 клеток (примерно 0,1 мл уплотненных клеток) ксенотрансплантировались из культуры в DMEM с добавлением в нее 10% FBS (фетальная бычья сыворотка) 15 атимичным мышам. Обработка начиналась, когда развивались измеримые опухоли, примерно спустя 4 дня после инокуляции. И соединение 7, и соединение 3 (10 мг/кг) разбавлялись в 20 мкл ДМСО для интраперитональной (i.p.) инъекции. 5 животных получали лекарства i.p. в дни, указанные стрелками, и 5 животных получали ДМСО контроль. Опухоли измерялись в указанные дни. Результаты показаны на фиг. 3. Показатели ошибки представляют стандартную ошибку среднего значения. Результаты биологических испытаний. в которой R1 означает C1-С 20 алкил или группу =СН 2;X1 означает NHR4, где R4 представляет собой C1-С 20 алкил, С 3 алкенил и необязательно содержит карбоксильную группу, спиртовую группу, или когда R1 означает группу =СН 2, и R2 означает С 8 алкил, X1 означает группу -NHCH2COOMe или группу -NHCH2COOtrBu. 2. Соединения по п.1, в которых R1 представляет C1-С 10 алкил или группу =СН 2. 3. Соединения по п.2, в которых R1 представляет -СН 3 или =СН 2. 4. Соединения по п.3, в которых соединение выбрано из группы, состоящей из 5. Соединения по п.1, в которых соединение выбрано из группы, состоящей из 11. Фармацевтическая композиция, включающая фармацевтический разбавитель и соединение формулы IX в которой R29 означает C1-С 20 алкил или группу =СН 2;X5 означает группу ОН или -NHR32, где R32 представляет собой C1-С 20 алкил, С 3 алкенил и необязательно содержит карбоксильную группу или спиртовую группу, или когда R1 означает группу =СН 2, и R2 означает С 8 алкил, X5 означает группу -NHCH2COOMe. 12. Фармацевтическая композиция по п.11, в которой R29 представляет собой C1-С 10 алкил или группу =СН 2. 13. Фармацевтическая композиция по п.12, в которой R29 представляет -СН 3 или =СН 2. 14. Фармацевтическая композиция по п.11, в которой R29 представляет -С 6 Н 13 или -C8H17. 15. Фармацевтическая композиция по п.11, в которой соединение выбрано из группы, состоящей из 16. Фармацевтическая композиция, включающая фармацевтический разбавитель и соединение по п.1. 17. Фармацевтическая композиция, включающая фармацевтический разбавитель и соединение по п.6. 18. Фармацевтическая композиция, включающая фармацевтический разбавитель и соединение по п.9. 19. Способ индуцирования потери веса у животного или человека, предусматривающий введение указанному субъекту эффективного количества фармацевтической композиции по п.11. 20. Способ по п.19, в котором субъектом является человек. 21. Способ по п.19, в котором субъектом является животное. 22. Способ по п.20, в котором фармацевтическая композиция включает соединение, выбранное из группы, состоящей из 23. Способ по п.21, в котором фармацевтическая композиция включает соединение, выбранное из группы, состоящей из 24. Способ ингибирования роста раковых клеток у животного или человека, предусматривающий введение указанному субъекту эффективного количества фармацевтической композиции по п.11. 25. Способ по п.24, в котором субъектом является человек. 26. Способ по п.24, в котором субъектом является животное. 27. Способ по п.25, в котором фармацевтическая композиция включает соединение, выбранное из группы, состоящей из 28. Способ по п.26, в котором фармацевтическая композиция включает соединение, выбранное из группы, состоящей из 29. Способ стимулирования активности СРТ-1 у животного или человека, предусматривающий вве- 21010484 дение указанному субъекту эффективного количества фармацевтической композиции по п.11. 30. Способ по п.29, в котором субъектом является человек. 31. Способ по п.29, в котором субъектом является животное. 32. Способ по п.30, в котором соединение представляет 34. Способ ингибирования активности нейропептида-Y у животного или человека, предусматривающий введение указанному субъекту эффективного количества фармацевтической композиции по п.11. 35. Способ по п.34, в котором субъектом является человек. 36. Способ по п.34, в котором субъектом является животное. 37. Способ ингибирования активности синтазы жирной кислоты у животного или человека, предусматривающий введение указанному субъекту эффективного количества фармацевтической композиции по п.11. 38. Способ по п.37, в котором субъектом является человек. 39. Способ по п.37, в котором субъектом является животное. 40. Способ по п.38, в котором соединение, выбрано из группы, состоящей из 41. Способ по п.39, в котором соединение выбрано из группы, состоящей из 42. Способ ингибирования роста инвазивных микробных клеток у животного или человека, предусматривающий введение указанному субъекту эффективного количества фармацевтической композиции по п.11. 43. Способ по п.42, в котором субъектом является человек. 44. Способ по п.42, в котором субъектом является животное. 45. Способ по п.43, в котором соединение выбрано из группы, состоящей из 46. Способ по п.44, в котором соединение выбрано из группы, состоящей из
МПК / Метки
МПК: C07D 307/56, A61K 31/34
Метки: фармацевтические, содержащие, их, соединения, композиции, новые, способы, использования
Код ссылки
<a href="https://eas.patents.su/26-10484-novye-soedineniya-farmacevticheskie-kompozicii-soderzhashhie-ih-i-sposoby-ih-ispolzovaniya.html" rel="bookmark" title="База патентов Евразийского Союза">Новые соединения, фармацевтические композиции, содержащие их, и способы их использования</a>