Соединения 5-(гетероциклил)алкил-n-(арилсульфонил)индола и их применение в качестве лигандов 5-ht6
Номер патента: 17007
Опубликовано: 28.09.2012
Авторы: Камбхампати Рама Састри, Конда Джагадишбабу, Рамакришна Нироджи Венката Сатья, Джасти Венкатесварлу, Котхмиркар Прабхакар
Формула / Реферат
1. Соединение формулы (I)
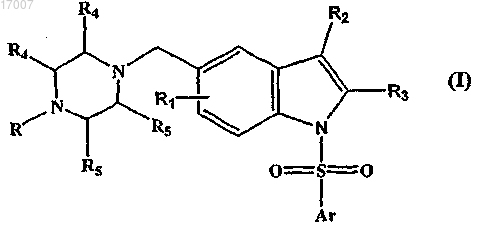
где Ar представляет собой фенил, который может быть независимо замещен одним или несколькими заместителями, выбранными из R1;
R1 независимо представляет собой один или несколько заместителей, выбранных из водорода, галогена, (C1-C3)алкила, галоген(С1-С3)алкила, (С1-С3)алкокси, галоген(C1-C3)алкокси, (С1-С3)алкилтио, цикло(С3-С6)алкила или цикло(С3-С6)алкокси;
R2 представляет собой водород, галоген, (C1-С3)алкил, галоген(С1-С3)алкил, (С1-С3)алкокси или галоген(С1-С3)алкокси;
R3 представляет собой водород, галоген, (С1-С3)алкил или галоген(С1-С3)алкил, (С1-С3)алкокси или галоген(С1-С3)алкокси;
R представляет атом водорода, (С1-С3)алкил или галоген(С1-С3)алкил;
R4 и R5 представляют собой водород, галоген, (С1-С3)алкил или галоген(С1-С3)алкил, (С1-С3)алкокси или галоген(С1-С3)алкокси.
2. Соединение по п.1, где Ar представляет собой фенил.
3. Соединение по п.1 или 2, где R1 представляет собой водород, галоген, (С1-С3)алкил, галоген(С1-С3)алкил, (С1-С3)алкокси, галоген(С1-С3)алкокси, (С1-С3)алкилтио, цикло(С3-С6)алкил или цикло(С3-С6)алкокси.
4. Соединение по любому из предшествующих пунктов, где R2 представляет собой водород, галоген, (С1-С3)алкил, галоген(С1-С3)алкил, (С1-С3)алкокси или галоген(С1-С3)алкокси.
5. Соединение по любому из предшествующих пунктов, где R3 представляет собой водород, галоген, (С1-С3)алкил или галоген(С1-С3)алкил, (С1-С3)алкокси или галоген(С1-С3)алкокси.
6. Соединение по любому из предшествующих пунктов, где оба R4 и R5 представляют собой водород.
7. Соединение по п.1, которое выбирают из группы, состоящей из
1-бензолсульфонил-5-(4-метилпиперазин-1-илметил)-1Н-индола дигидрохлорида;
1-(4-метилбензолсульфонил)-5-(4-метилпиперазин-1-илметил)-1Н-индола;
1-(4-фторбензолсульфонил)-5-(4-метилпиперазин-1-илметил)-1Н-индола;
1-(4-метоксибензолсульфонил)-5-(4-метилпиперазин-1-илметил)-1Н-индола;
1-[4-(1-метилэтил)бензолсульфонил]-5-(4-метилпиперазин-1-илметил)-1Н-индола;
1-(4-хлорбензолсульфонил)-5-(4-этилпиперазин-1-илметил)-1Н-индола дигидрохлорида;
1-(4-фторбензолсульфонил)-5-(4-этилпиперазин-1-илметил)-1Н-индола дигидрохлорида;
1-[(4-метилэтил)бензолсульфонил]-5-(4-эилпиперазин-1-илметил)-1Н-индола дигидрохлорида;
1-(4-метоксибензолсульфонил)-5-(4-этилпиперазин-1-илметил)-1Н-индола дигидрохлорида;
1-(2,4-дифторбензолсульфонил)-5-(4-этилпиперазин-1-илметил)-1Н-индола дигидрохлорида;
1-(4-бромбензолсульфонил)-5-(4-этилпиперазин-1-илметил)-1Н-индола дигидрохлорида;
1-(3-трифторметилбензолсульфонил)-5-(4-этилпиперазин-1-илметил)-1Н-индола дигидрохлорида;
1-(4-метилбензолсульфонил)-5-(4-этилпиперазин-1-илметил)-1Н-индола дигидрохлорида;
1-(2,3-дихлорбензолсульфонил)-5-(4-этилпиперазин-1-илметил)-1Н-индола дигидрохлорида;
1-(2-бромбензолсульфонил)-5-(4-этилпиперазин-1-илметил)-1Н-индола дигидрохлорида;
1-(4-хлорбензолсульфонил)-5-(4-этилпиперазин-1-илметил)-3-бром-1Н-индола дигидрохлорида;
1-бензолсульфонил-5-(4-этилпиперазин-1-илметил)-1Н-индола дигидрохлорида;
1-(2,4-дифторбензолсульфонил)-5-(4-метилпиперазин-1-илметил)-1Н-индола;
1-(2-хлор-5-триформетилбензолсульфонил)-5-(4-метилпиперазин-1-илметил)-1Н-индола;
1-(2-бромбензолсульфонил)-5-(4-метилпиперазин-1-илметил)-1Н-индола;
1-(2,3-дихлорбензолсульфонил)-5-(4-метилпиперазин-1-илметил)-1Н-индола;
1-(4-хлорбензолсульфонил)-5-(4-метилпиперазин-1-илметил)-1Н-индола;
1-(3-трифторметилбензолсульфонил)-5-(4-метилпиперазин-1-илметил)-1H-индола;
1-(4-хлорбензолсульфонил)-3-хлор-5-(4-метилпиперазин-1-илметил)-1Н-индола;
1-(4-фторбензолсульфонил)-3-хлор-5-(4-метилпиперазин-1-илметил)-1Н-индола;
1-(2,4-дифторбензолсульфонил)-3-хлор-5-(4-метилпиперазин-1-илметил)-1Н-индола дигидрохлорида;
1-(2-хлор-5-трифторметилбензолсульфонил)-3-хлор-5-(4-метилпиперазин-1-илметил)-1Н-индола дигидрохлорида;
1-(4-фторбензолсульфонил)-4-изопропокси-5-(4-метилпиперазин-1-илметил)-1Н-индола;
1-[4-(1-метилэтил)бензолсульфонил]-4-изопропокси-5-(4-метилпиперазин-1-илметил)-1Н-индола;
1-(4-фторбензолсульфонил)-3-хлор-5-(пиперазин-1-илметил)-1Н-индола дигидрохлорида;
1-(2-бромбензолсульфонил)-5-(пиперазин-1-илметил)-1Н-индола дигидрохлорида;
1-(2,4-дифторбензолсульфонил)-3-хлор-5-(пиперазин-1-илметил)-1Н-индола дигидрохлорида;
1-(бензолсульфонил)-5-(пиперазин-1-илметил)-1Н-индола дигидрохлорида;
1-[4-(1-метилэтил)бензолсульфонил]-5-(пиперазин-1-илметил)-1Н-индола дигидрохлорида;
1-(3-хлорбензолсульфонил)-5-(2,4-диметилпиперазин-1-илметил)-1Н-индола;
2-хлор-5-(4-метилпиперазин-1-илметил)-1-(3-метилбензолсульфонил)-1Н-индола;
2-метокси-5-(4-метилпиперазин-1-илметил)-1-(3-метилбензолсульфонил)-1Н-индола;
1-(3-хлорбензолсульфонил)-3-метокси-5-(4-метилпиперазин-1-илметил)-1Н-индола;
5-(4-метилпиперазин-1-илметил)-1-(4-метилбензолсульфонил)-6-трифторметил-1Н-индола;
1-(3-хлорбензолсульфонил)-7-метокси-5-(4-метилпиперазин-1-илметил)-1Н-индола;
его стереоизомеры и/или его соли.
8. Способ получения соединения формулы (I) по п.1, который включает контактирование соединения формулы (а)
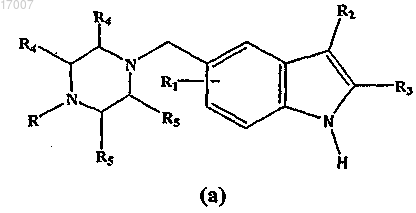
с арилсульфонильным соединением формулы ArSO2Cl, где Ar представляет собой фенил, с использованием инертного растворителя, выбранного из группы, включающей ДМСО, ДМФА, ацетонитрил, ТГФ, диэтиловый эфир и/или дифениловый эфир, и основания при температуре ниже 10°С для получения соединения формулы (I), где все заместители такие, как определено в п.1.
9. Способ по п.8, где указанные основания выбирают из гидридов щелочных металлов и гидридов щелочно-земельных металлов.
10. Фармацевтическая композиция, содержащая соединение по любому из предшествующих пунктов или фармацевтически пригодные носитель, разбавитель, реципиент или сольват наряду с терапевтически эффективным количеством соединения по п.1, его стереоизомеры, его фармацевтически приемлемые соли и любые пригодные сочетания из вышеприведенных.
11. Применение соединения по любому из пп.1-7 для получения лекарственного средства для лечения и профилактики заболевания, связанного с 5-НТ6 рецептором.
Текст
Настоящее изобретение относится к новым соединениям 5-(гетероциклил)-N(арилсульфонил)индола формулы (I), их производным, их стереоизомерам, их фармацевтически приемлемым солям и фармацевтически приемлемым композициям, содержащим их. Настоящее изобретение также относится к способу получения вышеуказанных соединений, их производных,их стереоизомеров, их фармацевтически приемлемых солей и фармацевтически приемлемых композиций, содержащих их. Эти соединения являются применимыми для лечения различных нарушений, которые относятся к функциям 5-НТ 6 рецептора. Конкретно, соединения данного изобретения являются также применимыми для лечения различных нарушений ЦНС,гематологических нарушений, расстройств пищевого поведения, заболеваний, связанных с болью,респираторных заболеваний, урогенитальных нарушений, сердечно-сосудистых заболеваний и рака. Рамакришна Нироджи Венката Сатья, Камбхампати Рама Састри,Конда Джагадишбабу, Котхмиркар Прабхакар, Джасти Венкатесварлу(71)(73) Заявитель и патентовладелец: СУВЕН ЛАЙФ САЙЕНСИЗ ЛИМИТЕД (IN) 017007 Область техники, к которой относится изобретение Настоящее изобретение относится к новым соединениям 5-(гетероциклил)алкил-N(арилсульфонил)индола формулы (I), их производным, их стереоизомерам, их фармацевтически приемлемым солям и фармацевтически приемлемым композициям, содержащим их. Настоящее изобретение также относится к способу получения вышеуказанных соединений, их производных, их стереоизомеров, их фармацевтически приемлемых солей и фармацевтически приемлемых композиций, содержащих их. Эти соединения являются применимыми для лечения различных нарушений, которые относятся к функциям 5-НТ 6 рецептора. Конкретно, соединения данного изобретения являются также применимыми для лечения различных нарушений ЦНС, гематологических нарушений, расстройств пищевого поведения, заболеваний, связанных с болью, респираторных заболеваний, урогенитальных нарушений, сердечно-сосудистых заболеваний и рака. Предпосылки создания и предшествующий уровень техники изобретения Полагают, что различные нарушения центральной нервной системы, такие как тревога, депрессия,моторные нарушения и т.д., включают расстройство в работе нейромедиатора 5-гидрокситриптамина (5 НТ) или серотонина. Серотонин локализован в центральной и периферической нервных системах и известно, что он воздействует на многие типы состояний, включающих психиатрические нарушения, моторную активность, пищевое поведение, половую активность и нейроэндокринную регуляцию в числе прочих. Подтипы 5-НТ рецептора регулируют различные эффекты серотонина. Известное семейство 5 НТ рецептора включает семейство 5-HT1 (например, 5-HT1A), семейство 5-НТ 2 (например, 5-HT2A), подтипы 5-НТ 3, 5-НТ 4, 5-НТ 5, 5-НТ 6 и 5-НТ 7. Подтип рецептора 5-НТ 6 был впервые клонирован из ткани крысы в 1993 (Monsma, F. J.; Shen, Y.;Ward, R.P.; Hamblin, M.W., Molecular Pharmacology, 1993, 43, 320-327) и в последующем из человеческой ткани (Kohen, R.; Metcalf, M.A.; Khan, N.; Druck, Т.; Huebner, K.; Sibley, D.R., Journal of Neurochemistry,1996, 66, 47-56). Рецептор представляет собой рецептор, связанный с G-белком (GPCR), положительно связанный с аденилатциклазой (Ruat, М.; Traiffort, Е.; Arrang, J.-M.; Tardivel-Lacombe, L.; Diaz, L.; Leurs,R.; Schwartz, J.-C., Biochemical Biophysical Research Communications, 1993, 193, 268-276). Рецептор обнаружен почти исключительно в областях центральной нервной системы (ЦНС) как в крысах, так и у человека. Исследования гибридизации in situ 5-НТ 6 рецептора в мозге крысы с использованием мРНК указывают на основную локализацию в областях проявления 5-НТ, включая полосатое тело, центр удовольствия, узелок обоняния и гиппокампальное образование (Ward, R.P.; Hamblin, M.W.; Lachowicz, J.E.; Hoffman, В.J.; Sibley, D.R.; Dorsa, D.M., Neuroscience, 1995, 64, 1105-1111). Наиболее высокие уровни мРНК 5-НТ 6 рецептора наблюдали в узелке обоняния, полосатом теле, центре удовольствия, зубчатой извилине,а также областях СА 1, СА 2 и СА 3 гиппокампа. Несколько низкие уровни мРНК 5-НТ 6 рецептора были обнаружены в гранулярном слое мозжечка некоторых диэнцефальных ядрах, миндалевидной железе и в коре головного мозга. Нозерн-блоттинг показал, что мРНК 5-НТ 6 рецептора, по-видимому, исключительно находится в мозге, при незначительных данных присутствия в периферических тканях. Высокое сродство ряда антипсихотических средств к 5-НТ 6 рецептору, локализация его мРНК в полосатом теле, узелке обоняния и центре удовольствия позволяет предположить, что некоторые из клинических действий этих соединений могут быть опосредованы через этот рецептор. Его способность связывать большой ряд терапевтических соединений, применяемых в психиатрии, в сочетании с интригующим распределением в мозге стимулировала значительный интерес к новым соединениям, которые обладают способностью к взаимодействию с указанным рецептором (Ref: Sleight, A.J. et al. (1997) 5-HT6 and 5-HT7receptors: molecular biology, functional correlates and possible therapeutic indications, Drug News Perspect. 10,214-224). Значительные усилия прилагаются, чтобы понять возможную роль 5-НТ 6 рецептора в психиатрии, когнитивной дисфункции, моторной функции и контроле, памяти, настроении и т.д. Соединения,которые демонстрируют сродство связывания к 5-НТ 6 рецептору, серьезно считают как вспомогательные средства при исследовании 5-НТ 6 рецептора, так и потенциальные терапевтические средства для лечения нарушений центральной нервной системы, например, см. Reavill С. и Rogers D.С., Current Opinion in Investigational Drugs, 2001, 2(1): 104-109, Pharma Press Ltd. Monsma F.J. et al. (1993) и Kohen, R. et al. (2001) показали, что некоторые трициклические антидепрессантные соединения, такие как амитриптилин, и атипичные антидепрессантные соединения, такие как миансерин, имеют высокое сродство к 5-НТ 6 рецептору. Эти открытия привели к гипотезе, что 5-НТ 6 рецептор включается в патогенез и/или лечение аффективных расстройств. Модели тревожного поведения на грызунах дают противоречивые результаты по роли 5-НТ 6 рецептора при тревожном состоянии. Лечение антагонистами 5-НТ 6 рецептора увеличива-1 017007 ет судорожный порог в тесте на максимальный электроконвульсивный шок у крыс [Stean, Т. et al. (1999)potent, selective and orally active 5-HT6) receptor antagonist. Br. J. Pharmacol. 130, 1606-1612]. Несмотря на то что это указывает на регуляцию судорожного порога 5-НТ 6 рецепторами, эффект не является таким выраженным, как эффект известных антиконвульсантных лекарств. Наше понимание ролей лигандов 5-НТ 6 рецептора является наиболее передовым для двух терапевтических показаний, при которых этот рецептор, вероятно, играет основную роль: обучение и дефициты памяти и аномальное пищевое поведение. Точную роль 5-НТ 6 рецептора еще предстоит установить при других показаниях для ЦНС, таких как тревога; хотя один агонист 5-НТ 6 уже дошел до фазы I клинических испытаний, точную роль рецептора все еще предстоит выяснить, и она находится в фокусе значительных исследований. Существует много потенциальных терапевтических применений для лигандов 5 НТ 6 рецептора у людей, основанных на непосредственных эффектах и указаниях из доступных научных исследований. Эти исследования включают локализацию рецептора, сродство лигандов с известной активностью in-vivo и различные исследования на животных, уже проводящиеся. Предпочтительно антагонистические соединения 5-НТ 6 рецепторов имеют большой спрос в качестве терапевтических средств. Одним потенциальным терапевтическим применением модуляторов функций 5-НТ 6 рецептора является усиление распознавания и памяти при заболеваниях человека, таких как болезнь Альцгеймера. Высокие уровни рецептора, обнаруженные в структурах, таких как передний мозг, включая хвост/путамен, гиппокамп, центр удовольствия и кору головного мозга, позволяют предположить роль рецептора для памяти и распознавания, поскольку известно, что эти области играют жизненно важную роль для памяти (Gerard, С.; Martres, M.P.; Lefevre, K.; Miquel, M.С; Verge, D.; Lanfumey, R.; Doucet, E.;Hamon, M.; Mestikawy E.I., S., Brain Research, 1997, 746, 207-219). Способность известных лигандов усиливать холинэргическую передачу также подтверждает потенциальное применение для распознаванияPharmacology, 1999, 126 (7), 1537-1542). При исследованиях обнаружили, что известный селективный антагонист 5-НТ 6 существенно увеличивал уровни глутамата и аспартата в лобной коре без повышения уровней норадреналина, дофамина или 5-НТ. Это селективное повышение некоторых нейрохимических факторов отмечают при запоминании и распознавании, что убедительно позволяет предположить роль лигандов 5-НТ 6 при распознавании(Dawson, L.A.; Nguyen, H.Q.; Li, P. British Journal of Pharmacology, 2000, 130 (1), 23-26). Исследования памяти и обучения на животных с использованием известного селективного антагониста 5-НТ 6 имело некоторые положительные эффекты (Rogers, D.С.; Hatcher, P.D.; Hagan, J.J. Society of Neuroscience, Abstracts, 2000, 26, 680). Родственное потенциальное терапевтическое применение для лигандов 5-НТ 6 состоит в лечении синдрома нарушения внимания (ADD, также известного как синдром нарушения внимания с гиперактивностью или ADHD) у детей, а также у взрослых. Поскольку антагонисты 5-НТ 6 очевидно усиливают активность нигростриатального дофаминового пути и ADHD связан с аномалиями в хвостовой части(Ernst, M.; Zametkin, A.J.; Matochik, J.H.; Jons, P.A.; Cohen, R.M., Journal of Neuroscience, 1998, 18(15),5901-5907), антагонисты 5-НТ 6 могут ослаблять синдромы нарушения внимания. В настоящее время доступными являются несколько полностью селективных агонистов. АгонистWyeth WAY-181187 в настоящее время проходит фазу I клинических испытаний на лечение тревоги[Cole, D.C. et al. (2005) Discovery of a potent, selective and orally active 5-HT6 receptor agonist, WAY181187. 230th ACS Natl. Meet. (Aug 28-Sept 1, Washington DC), Abstract MEDI17]. В публикации международной патентной заявки WO 03/066056 A1 сообщается, что антагонизм 5 НТ 6 рецептора может активировать нейрональный рост в центральной нервной системе млекопитающего. В еще одной публикации международной патентной заявки WO 03/0654046 А 2 раскрыт новый вариант человеческого 5-НТ 6 рецептора и предполагают, что 5-НТ 6 рецептор ассоциирован с многочисленными другими нарушениями. Публикации международных патентных заявок WO 2004/055026 A1, WO 2004/048331 A1, WO 2004/048330 A1 и WO 2004/048328 А 2 (все переуступлены Suven Life Sciences Limited) описывают родственный уровень техники. Дополнительно, WO 98/27081, WO 99/02502, WO 99/37623, WO 99/42465 иWO 01/32646 (все переуступлены Glaxo SmithKline Beecham PLC) раскрывают ряд арилсульфонамидных и сульфоксидных соединений в качестве антагонистов 5-НТ 6 рецептора и заявлены как применимые при лечении различных нарушений ЦНС. В то время как были раскрыты некоторые модуляторы 5-НТ 6, продолжает сохраняться потребность в соединениях, которые являются применимыми для модуляции 5-НТ 6. Как ни удивительно,было обнаружено,что соединения 5-(гетероциклил)алкил-N(арилсульфонил)индола формулы (I) демонстрируют очень высокое сродство к 5-НТ 6 рецептору. Следовательно, цель данного изобретения состоит в предоставлении соединений, которые являются применимыми в качестве терапевтических средств при лечении разнообразных нарушений центральной нервной системы или нарушений, на которые воздействует 5-НТ 6 рецептор.-2 017007 Сущность изобретения Настоящее изобретение относится к новым соединениям 5-(гетероциклил)алкил-N(арилсульфонил)индола общей формулы (I), их производным, их стереоизомерам, их фармацевтически приемлемым солям и фармацевтически приемлемым композициям, содержащим их. где Ar представляет собой фенил, нафтил, моноциклические или бициклические кольца, которые могут быть замещены одним или несколько независимыми заместителями, выбранными из R1;R1 представляет собой один или несколько независимых заместителей, выбранных из водорода, галогена, (C1-С 3)алкила, галоген(C1-C3)алкила, (С 1-С 3)алкокси, галоген(С 1-С 3)алкокси, алкилтио, цикло(С 3C6)алкила или цикло(С 3-С 6)алкокси;R4 и R5 представляют собой водород, галоген, (C1-C3)алкил или галоген(C1-C3)алкил, (C1C3)алкокси или галоген(C1-С 3)алкокси. Настоящее изобретение относится к применению терапевтически эффективного количества соединения формулы (I) для получения лекарственного средства при лечении или профилактике нарушения,включающего селективное сродство к 5-НТ 6 рецептору. Конкретно, соединения данного изобретения также являются применимыми при лечении различных нарушений ЦНС, гематологических нарушений, расстройств пищевого поведения, заболеваний, связанных с болью, респираторных заболеваний, урогенитальных нарушений, сердечно-сосудистых заболеваний и рака. В еще одном аспекте изобретение относится к фармацевтическим композициям, содержащим терапевтически эффективное количество по меньшей мере одного соединения формулы (I) или его индивидуальных стереоизомеров, рацемической или нерацемической смеси стереоизомеров либо фармацевтически приемлемых солей или сольватов в смеси по меньшей мере с одним подходящим носителем. В еще одном аспекте изобретение относится к композициям, содержащим соединения формулы (I),и способам применения соединений формулы (I). В еще одном аспекте изобретение относится к применению терапевтически эффективного количества соединения формулы (I) для получения лекарственного средства при лечении или профилактике нарушения, включающего селективное сродство к 5-НТ 6 рецептору. И в еще одном аспекте изобретение дополнительно относится к способу получения соединений формулы (I). Следующее представляет собой частичный перечень соединений, принадлежащих общей формуле-3 017007 1-(2-бромбензолсульфонил)-5-(4-метилпиперазин-1-илметил)-1H-индол; 1-(2,3-дихлорбензолсульфонил)-5-(4-метилпиперазин-1-илметил)-1H-индол; 1-(4-хлорбензолсульфонил)-5-(4-метилпиперазин-1-илметил)-1H-индол; 1-(3-трифторметилбензолсульфонил)-5-(4-метилпиперазин-1-илметил)-1 Н-индола гидрохлорид; 1-(4-хлорбензолсульфонил)-3-хлор-5-(4-метилпиперазин-1-илметил)-1 Н-индол; 1-(4-фторбензолсульфонил)-3-хлор-5-(4-метилпиперазин-1-илметил)-1 Н-индол; 1-(2,4-дифторбензолсульфонил)-3-хлор-5-(4-метилпиперазин-1-илметил)-1 Н-индола дигидрохлорид; 1-(2-хлор-5-трифторметилбензолсульфонил)-3-хлор-5-(4-метилпиперазин-1-илметил)-1 Н-индола дигидрохлорид; 1-(4-фторбензолсульфонил)-4-изопропокси-5-(4-метилпиперазин-1-илметил)-1 Н-индол; 1-[4-(1-метилэтил)бензолсульфонил]-4-изопропокси-5-(4-метилпиперазин-1-илметил)-1 Н-индол; 1-(4-фторбензолсульфонил)-3-хлор-5-(пиперазин-1-илметил)-1 Н-индола дигидрохлорид; 1-(2-бромбензолсульфонил)-5-(пиперазин-1-илметил)-1 Н-индола дигидрохлорид; 1-(2, 4-дифторбензолсульфонил)-3-хлор-5-(пиперазин-1-илметил)-1 Н-индола дигидрохлорид; 1-(бензолсульфонил)-5-(пиперазин-1-илметил)-1 Н-индола дигидрохлорид; 1-[4-(1-метилэтил)бензолсульфонил]-5-(пиперазин-1-илметил)-1 Н-индола дигидрохлорид; 1-(3-хлорбензолсульфонил)-5-(2,4-диметилпиперазин-1-илметил)-1H-индол; 2-хлор-5-(4-метилпиперазин-1-илметил)-1-(3-метилбензолсульфонил)-1 Н-индол; 2-метокси-5-(4-метилпиперазин-1-илметил)-1-(3-метилбензолсульфонил)-1 Н-индол; 1-(3-хлорбензолсульфонил)-3-метокси-5-(4-метилпиперазин-1-илметил)-1H-индол; 5-(4-метилпиперазин-1-илметил)-1-(4-метилбензолсульфонил)-6-трифторметил-1 Н-индол; 1-(3-хлорбензолсульфонил)-7-метокси-5-(4-метилпиперазин-1-илметил)-1H-индол; их стереоизомеры и/или их соли. Подробное описание изобретения Если не указано иначе, следующие термины, используемые в описании и формуле изобретения,имеют значения, данные ниже."(C1-C3)Алкил" означает алкильные радикалы с прямой или разветвленной цепью, содержащие от одного до трех атомов углерода, и включает метил, этил, н-пропил и изопропил."(C1-C3)Алкокси" означает алкильные радикалы с прямой или разветвленной цепью, содержащие от одного до трех атомов углерода, и включает метокси, этокси, пропилокси и изопропилокси."Галоген(C1-С 3)алкил" означает алкильные радикалы с прямой или разветвленной цепью, содержащие от одного до трех атомов углерода, и включает фторметил, дифторметил, трифторметил, трифторэтил, фторэтил, дифторэтил и т.п."Галоген(C1-С 3)алкокси" означает алкильные радикалы с прямой или разветвленной цепью, содержащие от одного до трех атомов углерода, и включает фторметокси, дифторметокси, трифторметокси,трифторэтокси, фторэтокси, дифторэтокси и т.п."Алкилтио" означает алкильные радикалы с прямой или разветвленной цепью, содержащие от одного до трех атомов углерода, и включает метилтио, этилтио, пропилтио, изопропилтио и т.п."Цикло(C3-C6)алкил" означает циклические алкильные радикалы, содержащие от трех до шести атомов углерода, и включает циклопропил, циклобутил, циклопентил или циклогексил."Цикло(С 3-С 6)алкокси" означает циклические алкильные радикалы, содержащие от трех до шести атомов углерода, и включает циклопропилокси, циклобутилокси, циклопентилокси или циклогексилокси."Моноциклическая или бициклическая кольцевая система" предназначена для обозначения как гетероарильных, так и гетероциклических колец."Гетероарил" означает 5-6-членное моноциклическое ароматическое кольцо или конденсированные 8-10-членные бициклические ароматические кольца, содержащие 1-3 гетероатома, выбранные из кислорода, азота и серы. Подходящие примеры моноциклических ароматических колец включают тиенил, фурил, пирролил, триазолил, имидазолил, оксазолил, тиазолил, оксадиазолил, изотиазолил, изоксазолил,тиадиазолил, пиразолил, пиримидинил, пиридазинил, пиразинил и пиридил. Подходящие примеры конденсированных ароматических колец включают бензоконденсированные ароматические кольца, такие как хинолинил, изохинолинил, хиназолинил, хиноксалинил, циннолинил, нафтиридинил, индолил, изоиндолил, индазолил, пирролопиридинил, бензофуранил, изобензофуранил, бензотиенил, бензимидазолил, бензоксазолил, бензизоксазолил, бензотиазолил, бензизотиазолил, бензоксадиазолил, бензотиадиазолил, бензотриазолил и т.п. Гетероарильные группы, как описано выше, могут быть связаны с оставшейся частью молекулы через атом углерода или, если он присутствует, подходящий атом азота, за исключением случаев, когда выше указано иначе."Гетероциклическое кольцо" означает 5-7-членное неароматическое кольцо, содержащее от 1 до 3 гетероатомов, выбранных из кислорода, азота и серы. Такие кольца могут быть частично ненасыщенными. Подходящие примеры гетероциклических колец включают пиперидинил, тетрагидропиридинил,-4 017007 пирролидинил, морфолинил, азепанил, диазепанил и пиперазинил. 5-7-членное гетероциклическое кольцо, как описано выше, может быть связано с оставшейся частью молекулы через атом углерода или подходящий атом азота. Термин "шизофрения" означает шизофрения, шизофреноподобное расстройство, шизоаффективное расстройство и психотическое расстройство, где термин "психотический" относится к бреду, рельефным галлюцинациям, дезорганизованной речи или дезорганизованному или кататоническому поведению, см.Diagnostic and Statistical Manual of Mental Disorder, fourth edition, American Psychiatric Association, Washington, D.C. Выражение "фармацевтически приемлемый" указывает на то, что вещество или композиция должны быть химически и/или токсикологически совместимы с другими ингредиентами, которые содержат состав, которым лечат млекопитающего."Терапевтически эффективное количество" определяют как количество соединения по настоящему изобретению, которое (i) обеспечивает лечение или профилактику конкретного заболевания, состояния или расстройства, (ii) ослабляет, смягчает или устраняет один или несколько симптомов конкретного заболевания, состояния или расстройства, (iii) предотвращает или замедляет возникновение одного или нескольких симптомов конкретного заболевания, состояния или расстройства, описанного в настоящем документе. Термины "проведение лечения", "лечить" или "лечение" включают все их значения, такие как предупреждающее, профилактическое и паллиативное. Термин "стереоизомеры" представляет собой общий термин для всех изомеров отдельных молекул,которые отличаются только ориентацией их атомов в пространстве. Он включает зеркальные изомеры(энантиомеры), геометрические (цис-транс) изомеры и изомеры соединений более чем с одним хиральным центром, которые не являются зеркальными отображениями друг друга (диастереомеры). Определенные соединения формулы (I) способны существовать в стереоизомерных формах (например, диастереомеры и энантиомеры) и изобретение относится к каждой из этих стереоизомерных форм и к их смесям, включая рацематы. Различные стереоизомерные формы можно отделять друг от друга обычными способами или любой данный изомер можно получить стереоспецифичным или асимметричным синтезом. Также изобретение относится к таутомерным формам и их смесям. Как правило, стереоизомеры получают в качестве рацематов, которые можно разделять на оптически активные изомеры, по существу, известными способами. В случае соединений общей формулы (I),имеющих асимметричный атом углерода, настоящее изобретение относится к D-форме, L-форме и к смесям D, L-форм, и, в случае нескольких асимметричных атомов углерода и диастереомерных форм, изобретение относится к этим стереоизомерным формам и к их смесям, включая рацематы. Те соединения общей формулы (I), которые имеют асимметричный атом углерода, и которые, как правило, получают в качестве рацематов, можно отделять друг от друга общепринятыми способами, или любой данный изомер можно получать стереоспецифическим или асимметричным синтезом. Однако также можно исходно использовать оптически активное соединение, а затем в качестве конечного соединения получать соответствующее оптически активное энантиомерное или диастереомерное соединение. Стереоизомеры соединений общей формулы (I) можно получать одним или несколькими путями,представленными ниже.i. Один или несколько реагентов можно использовать в их оптически активной форме.ii. В процессе восстановления можно использовать оптически чистый катализатор или хиральные лиганды вместе с металлическим катализатором. Металлический катализатор может представлять собой родий, рутений, индий и т.п. Хиральные лиганды предпочтительно могут представлять собой хиральные фосфины (Principles of Asymmetric synthesis, J.E. Baldwin Ed., Tetrahedron series, 14, 311-316).iii. Смесь стереоизомеров можно разделять общепринятыми способами, такими как образование диастереомерных солей с хиральными кислотами или хиральными аминами, или хиральными аминоспиртами, хиральными аминокислотами. Затем полученную смесь диастереомеров можно разделять такими способами, как фракционная кристаллизация, хроматография и т.п., за которыми следует дополнительная стадия выделения оптически активного продукта гидролизом производного (Jacques et. al., "Enantiomers,Racemates and Resolution", Wiley Interscience, 1981).iv. Смесь стереоизомеров можно разделять общепринятыми способами, такими как разделение с помощью микроорганизмов, разделение диастереомерных солей, образованных с хиральными кислотами или хиральными основаниями. Хиральные кислоты, которые можно использовать, могут представлять собой винно-каменную кислоту, миндальную кислоту, молочную кислоту, камфорсульфоновую кислоту, аминокислоты и т.п. Хиральные основания, которые можно использовать, могут представлять собой алкалоид хинного дерева,бруцин или основную аминокислоту, такую как лизин, аргинин и т.п. В случае соединений общей формулы (I), обладающих геометрической изомерией, настоящее изобретение относится ко всем этим геометрическим изомерам. Подходящие фармацевтически приемлемые соли будут очевидны специалистам в данной области и включают соли, описанные в J. Pharm. Sci., 1977, 66, 1-19, такие как кислотно-аддитивные соли, образо-5 017007 ванные с неорганическими кислотами, например хлористо-водородной, бромисто-водородной, серной,азотной или фосфорной кислотой; и с органическими кислотами, например янтарной, малеиновой, уксусной, фумаровой, лимонной, винно-каменной, бензойной, п-толуолсульфоновой, метансульфоновой или нафталинсульфоновой кислотой. Настоящее изобретение включает в пределах его объема все возможные стехиометрические и нестехиометрические формы. Фармацевтически приемлемые соли, составляющие часть этого изобретения, можно получать обработкой соединения формулы (I) 1-6 экв. основания, такого как гидрид натрия, метоксид натрия, этоксид натрия, гидроксид натрия, трет-бутоксид калия, гидроксид кальция, ацетат кальция, хлорид кальция,гидроксид магния, хлорид магния и т.п. Можно использовать растворители, такие как вода, ацетон, простой эфир, THF, метанол, этанол, трет-бутанол, диоксан, изопропанол, изопропиловый эфир или их смеси. В дополнение к фармацевтически приемлемым солям в изобретение включены другие соли. Они могут выступать в качестве промежуточных соединений при очистке соединений, при получении других солей или при идентификации и охарактеризации соединений или промежуточных соединений. Соединения формулы (I) могут быть получены в кристаллической или некристаллической форме, и,если они получены в кристаллической форме, они необязательно могут быть солватированными, например, в качестве гидрата. Это изобретение включает в пределах его объема стехиометрические сольваты(например, гидраты) а также соединения, содержащие различные количества растворителя (например,воды). Также настоящее изобретение относится к процессу получения соединения формулы (I) или его фармацевтически приемлемой соли, который включает следующий путь, где основное промежуточное соединение синтезируют различными способами, известными в литературе. Процесс по этому изобретению включает контактирование соединения следующей формулы (а): где все заместители являются такими, как описано выше, с арилсульфонильным соединением формулы (ArSO2Cl), где Ar является таким, как определено для соединений формулы (I), в присутствии инертного растворителя и соответствующего основания при подходящей температуре с получением соединения формулы (I), которое, при необходимости, можно дополнительно преобразовывать. В предыдущей патентной заявке США авторов настоящего изобретения WO 2004/048330 А 1 приведено более подробное описание условий реакции и реагентов, пригодных для указанных взаимопревращений соединений формулы (I). Реакцию индольного производного с арилсульфонилхлоридами (ArSO2Cl) можно проводить в присутствии инертного органического растворителя, который включает ароматические углеводороды, такие как толуол, о-, м-, п-ксилол; галогенированные углеводороды, такие как метиленхлорид, хлороформ и хлорбензол; простые эфиры, такие как диэтиловый эфир, дифениловый эфир, диизопропиловый эфир,трет-бутилметиловый эфир, диоксан, анизол и тетрагидрофуран; нитрилы, такие как ацетонитрил и пропионитрил; спирты, такие как метанол, этанол, н-пропанол, н-бутанол, трет-бутанол, а также DMF (N,Nдиметилформамид), DMSO (N,N-диметилсульфоксид) и воду. Предпочтительный перечень растворителей включает DMSO, DMF, ацетонитрил и THF. Также можно использовать их смеси в различных соотношениях. Подходящие основания, как правило, представляют собой неорганические соединения, такие как гидроксиды щелочных металлов и гидроксиды щелочно-земельных металлов, такие как гидроксид лития, гидроксид натрия, гидроксид калия и гидроксид кальция; оксиды щелочных металлов и оксиды щелочно-земельных металлов, такие как оксид лития, оксид натрия, оксид магния и оксид кальция; гидриды щелочных металлов и гидриды щелочно-земельных металлов, такие как гидрид лития, гидрид натрия, гидрид калия и гидрид кальция; амиды щелочных металлов и амиды щелочно-земельных металлов,такие как амид лития, амид натрия, амид калия и амид кальция; карбонаты щелочных металлов и карбонаты щелочно-земельных металлов, такие как карбонат лития и карбонат кальция; а также гидрокарбонаты щелочных металлов и гидрокарбонаты щелочно-земельных металлов, такие как гидрокарбонат на-6 017007 трия; металлоорганические соединения, в частности алкилы щелочных металлов, такие как метиллитий,бутиллитий, фениллитий; галогениды алкилмагния, такие как хлорид метилмагния, и алкоксиды щелочных металлов и алкоксиды щелочно-земельных металлов, такие как метоксид натрия, этоксид натрия,этоксид калия, трет-бутоксид калия и диметоксимагний, более того, органические основания, например триэтиламин, триизопропиламин, N-метилпиперидин и пиридин. Особенно предпочтительными являются гидроксид натрия, метоксид натрия, этоксид натрия, гидроксид калия, карбонат калия и триэтиламин. Пригодным является, чтобы реакцию можно было проводить в присутствии катализатора межфазного переноса, такого как гидросульфат тетра-н-бутиламмония и т.п. Инертную атмосферу можно поддерживать с использованием инертных газов, таких как N2, Ar или Не, длительность реакции можно поддерживать в диапазоне от 1 до 24 ч, предпочтительно от 2 до 6 ч. Если желательно, полученное соединение превращают в его соль. Соединения, полученные указанным выше способом получения настоящего изобретения, можно превращать в другое соединение по этому изобретению посредством дополнительных химических модификаций с использованием хорошо известных реакций, таких как окисление, восстановление, внесение защитной группы, удаление защитной группы, реакция перестановки, галогенирование, гидроксилирование, алкилирование, алкилтиолирование, деметилирование, О-алкилирование, O-ацилирование, Nалкилирование, N-алкенилирование, N-ацилирование, N-цианирование, N-сульфонилирование, реакция конденсации с использованием переходных металлов и т.п. Если необходимо, можно проводить любую одну или несколько из следующих стадий:i) превращение соединения формулы (I) в другое соединение формулы (I);ii) удаление любых защитных групп илиiii) образование его фармацевтически приемлемой соли, сольвата или пролекарства. Процесс i) можно проводить с использованием общепринятых способов взаимопревращения, таких как эпимеризация, окисление, восстановление, алкилирование, неклеофильное или электрофильное замещение ароматической группы и гидролиз сложного эфира или образование амидной связи. Для процесса ii) примеры защитных групп и способы их удаления могут быть найдены в T.W.Greene "Protective Groups in Organic Synthesis" (J. Wiley и Sons, 1991). Подходящие защитные группы амина включают сульфонил (например, тозил), ацил (например, ацетил, 2',2',2'-трихлорэтоксикарбонил,бензилоксикарбонил или трет-бутоксикарбонил) и арилалкил (например, бензил), которые можно удалять гидролизом (например, с использованием кислоты, такой как хлористо-водородная или трифторуксусная кислота), или восстановлением (например, гидрогенолизом бензильной группы или восстановительным удалением 2',2',2'-трихлорэтоксикарбонильной группы с использованием цинка в уксусной кислоте) в соответствующих случаях. Другие подходящие защитные группы амина включают трифторацетил, который можно удалять катализируемым основанием гидролизом, или связанную с твердофазной смолой бензильную группу, такую как связанная со смолой Меррифилда 2,6-диметоксибензильная группа (линкер Эллмана), которую можно удалять катализируемым кислотой гидролизом, например трифторуксусной кислотой. Для процесса iii) галогенирование, гидроксилирование, алкилирование и/или образование фармацевтически приемлемых солей можно проводить общепринятой реакцией с соответствующей кислотой или производным кислоты, как более подробно описано выше. В целях применения соединений формулы (I) для терапии они обычно будут изготовлены в виде фармацевтической композиции в соответствии со стандартной фармацевтической практикой. Фармацевтические композиции по настоящему изобретению можно изготавливать общепринятым способом с использованием одного или нескольких фармацевтически приемлемых носителей. Таким образом, активные соединения по изобретению можно изготавливать для перорального, буккального,интраназального, парентерального (например, внутривенного, внутримышечного или подкожного) или ректального введения, или в форме, подходящей для введения посредством ингаляции или инсуффляции. Для перорального введения фармацевтические композиции могут иметь форму, например, таблеток или капсул, полученных общепринятыми способами с фармацевтически приемлемыми эксципиентами,такими как связующие вещества (например, прежелатинизированный маисовый крахмал, поливинилпирролидон или гидроксипропилметилцеллюлоза); наполнители (например, лактоза, микрокристаллическая целлюлоза или фосфат кальция); смазывающие вещества (например, стеарат магния, тальк или диоксид кремния); дезинтегрирующие вещества (например, картофельный крахмал или натрия крахмала гликолят); или смачивающие вещества (например, лаурилсульфат натрия). Таблетки можно покрывать хорошо известными в данной области способами. Жидкие препараты для перорального введения могут иметь форму, например, растворов, сиропов или суспензий или они могут быть предоставлены в качестве сухого продукта для восстановления водой или другим пригодным носителем перед применением. Такие жидкие препараты можно получать общепринятыми способами с фармацевтически приемлемыми добавками, такими как суспендирующие вещества (например, сироп сорбита, метилцеллюлоза или гидрогенизированные пищевые жиры); эмульгаторы (например, лецитин или гуммиарабик); неводные носители(например, миндальное масло, масляные сложные эфиры или этиловый спирт) и консерванты (например,метил- или пропил-п-гидроксибензоаты или сорбиновая кислота).-7 017007 Для буккального введения композиция может иметь форму таблеток или пастилок, изготовленных общепринятым способом. Активные соединения по изобретению могут быть изготовлены для парентерального введения посредством инъекции, включая применение общепринятых способов катетеризации или инфузии. Составы для инъекции можно изготавливать в единичной дозированной форме, например, в ампулах или в контейнерах для множества доз с добавлением консерванта. Композиции могут иметь такие формы, как суспензии, растворы или эмульсии в масляных или водных носителях, и они могут иметь рецептурные добавки, такие как суспендирующие, стабилизирующие и/или диспергирующие вещества. Альтернативно, активный ингредиент может быть в форме порошка для восстановления пригодным носителем, например стерильной не содержащей пирогенов водой, перед применением. Активные соединения по изобретению также могут быть изготовлены в виде ректальных композиций, таких как суппозитории или удерживающие клизмы, например, содержащие общепринятые основы для суппозиториев, такие как масло какао или другие глицериды. Для интраназального введения или введения посредством ингаляции активные соединения по изобретению традиционно доставляют в форме аэрозольного спрея из находящегося под давлением контейнера или устройства для распыления или из капсулы с использованием ингалятора или инсуффлятора. В случае находящегося под давлением аэрозоля подходящий пропеллент, например дихлордифторметан,трихлорфторметан, дихлортетрафторэтан, диоксид углерода или другой подходящий газ и дозированная единица могут определяться предоставлением клапана для доставки дозированного количества. Лекарственное средство для находящегося под давлением контейнера или устройства для распыления может содержать раствор или суспензию активного соединения, в то время как для капсулы оно предпочтительно должно находиться в форме порошка. Капсулы и кассеты (изготовленные, например, из желатина) для применения в ингаляторе или инсуффляторе можно изготавливать, чтобы они содержали порошковую смесь соединения по изобретению и подходящего порошкового основания, такого как лактоза или крахмал. Аэрозольные составы для лечения состояний, указанных выше (например, мигрени) у среднего взрослого человека предпочтительно приспособлены для того, чтобы каждая измеренная доза или "выпуск" аэрозоля содержала от 20 до 1000 мкг соединения по изобретению. Общая суточная доза в случае аэрозоля будет находиться в диапазоне от 100 мкг до 10 мг. Введение можно проводить несколько раз в сутки, например 2, 3, 4 или 8 раз, например, с 1, 2 или 3 дозами каждый раз. Эффективное количество соединений общей формулы (I) или их производных, как определено выше, можно использовать для получения лекарственного средства вместе с общепринятыми фармацевтическими вспомогательными веществами, носителями и добавками. Такая терапия включает множество вариантов: например, введение двух совместимых соединений одновременно в единичной дозированной форме или введение каждого соединения по отдельности в отдельных дозах; или, если необходимо, в один и тот же промежуток времени или по отдельности для максимизации положительного эффекта или минимизации потенциальных побочных эффектов лекарственных средств согласно известным принципам фармакологии. Доза активных соединений может варьировать в зависимости от таких факторов, как путь введения,возраст и масса пациента, характер и тяжесть заболевания, подлежащего лечению, и сходные факторы. Таким образом, любое указание в настоящем документе на фармакологически эффективное количество соединений общей формулы (I) относится к указанным выше факторам. Предполагаемая доза активных соединений по этому изобретению для перорального, парентерального, назального или буккального введения среднему взрослому человеку для лечения состояний, указанных выше, составляет от 0,1 до 200 мг активного ингредиента на единичную дозу, которую можно вводить, например, от 1 до 4 раз в сутки. Для иллюстративных целей реакционная схема, изображенная в данном описании, предоставляет потенциальные пути синтеза соединений настоящего изобретения, а также ключевые интермедиаты. Для несколько детального описания индивидуальных стадий реакции см. раздел "Примеры". Специалисты в данной области смогут оценить, что для синтеза соединений изобретения могут применяться другие синтетические пути. Несмотря на то что конкретные исходные вещества и реагенты изображены на схемах и обсуждаются ниже, другие исходные вещества и реагенты могут легко применяться в качестве замены для предоставления разнообразных производных и/или условий реакций. Кроме того, многие из соединений, полученных способами, описанными ниже, могут быть дополнительно модифицированы в свете данного описания с использованием общепринятой химии, хорошо известной специалистам в данной области. Промышленные реагенты использовали без дополнительной очистки. Комнатная температура относится к 25-30 С. ИК-спектры получали, используя KBr и в твердом состоянии. Если не утверждается иначе, все масс-спектры получали, используя условия ЭРИ. Спектры 1 Н-ЯМР регистрировали при 400 МГц на приборе Bruker. В качестве растворителя применяли дейтерированный хлороформ (99,8% D). В качестве внутреннего стандарта применяли ТМС. Значения химических сдвигов выражают в миллионных долях . Для обозначения множественности сигналов ЯМР применяют следующие сокращения: с=синглет, шс=широкий синглет, д=дублет, т=триплет, к=квартет, кви=квинтет, г=гептет, дд=двойной-8 017007 дублет, дт=двойной триплет, тт=триплет из триплетов, м=мультиплет. Хроматография относится к колоночной хроматографии, осуществляемой с использованием силикагеля 100-200 меш и выполняемой под давлением азота (в условиях флэш-хроматографии). Новые соединения настоящего изобретения были получены в соответствии с методиками следующих схем и примеров, с использованием соответствующих веществ, и далее представлены в качестве примеров посредством следующих конкретных способов. Наиболее предпочтительные соединения изобретения представляют собой любые или все соединения из конкретно приведенных в этих примерах. Данные соединения не следует, однако, считать образующими единственный тип, который рассматривают в качестве изобретения, и любое сочетание из соединений или их фрагментов может само образовать тип. Следующие примеры далее иллюстрируют детали получения соединений настоящего изобретения. Специалисты в данной области легко поймут, что известные вариации условий и способов следующих препаративных методик можно применять для получения данных соединений. Пример 1. Получение 5-(4-метилпиперазин-1-илметил)-1H-индола. Стадия (i). Получение (3-метил-4-нитрофенил)-(4-метилпиперазин-1-ил)метанона. 3-Метил-4-нитробензойную кислоту (5,525 ммоль, 1,0 г) загружали в двухгорлую круглодонную колбу объемом 25 мл, соединенную с холодильником, снабженным защитной трубкой. К ней добавляли тионилхлорид (6,07 ммоль, 0,735 г) и 1,2-дихлорэтан (5 мл) и раствор кипятили с обратным холодильником в течение периода, равного 3 ч. Данную реакционную смесь добавили в еще одну колбу объемом 100 мл, содержащую раствор N-метилпиперазина (16,57 ммоль, 1,66 г) в 10 мл 1,2-дихлорэтана, который поддерживали при температуре ниже 5 С. Реакционную смесь далее перемешивали в течение 0,5 ч при 25 С. После завершения реакции реакционную смесь выливали на 50 мл воды. Слой 1,2-дихлорэтана отделяли, промывали водой (210 мл), насыщенным солевым раствором (10 мл) и сушили над безводным сульфатом натрия. Летучие вещества удаляли при пониженном давлении с получением густой сиропообразной массы. Эту густую сиропообразную массу применяли для следующей стадии реакции без очистки. Стадия (ii). Получение (4-метилпиперазин-1-ил)-[4-нитро-3-[2-(пирролидин-1-ил)винил]фенил]метанона.(3-Метил-4-нитрофенил)-(4-метилпиперазин-1-ил)метанон (3,8022 ммоль, 1,0 г) (полученный со стадии (i загружали в двухгорлую круглодонную колбу объемом 25 мл, соединенную с холодильником,в атмосфере азота. К нему добавляли 3 мл N,N-диметилформамида, диметилацеталь N,Nдиметилформамида (5,7033 ммоль) и пирролидин (5,7033 ммоль) и кипятили с обратным холодильником в течение периода, равного 6 ч. После завершения реакции, реакционную смесь выливали на 20 г воды со льдом, подщелачивали 20% раствором NaOH (pH до 10) и смесь экстрагировали этилацетатом (230 мл). Объединенные этилацетатные экстракты далее промывали водой (230 мл), насыщенным солевым раствором (30 мл) и сушили над безводным сульфатом натрия. Летучие вещества удаляли при пониженном давлении с получением густой сиропообразной массы. Эту густую сиропообразную массу применяли для следующей стадии реакции без очистки. Стадия (iii). Получение (1 Н-индол-5-ил)-(4-метилпиперазин-1-ил)метанона.(4-Метилпиперазин-1-ил)-[4-нитро-3-[2-(пирролидин-1-ил)винил]фенил]метанон (2,907 ммоль, 1,0 г) (полученный со стадии (ii, загружали в двухгорлую круглодонную колбу объемом 25 мл, соединенную с холодильником, в атмосфере азота. К нему добавляли ТГФ (7 мл), с последующим добавлением никеля Ренея (Ra-Ni) (0,1 г). Гидразингидрат (14,54 ммоль, 0,73 г) добавляли к вышеуказанной реакционной смеси таким образом, что реакционная смесь начинала кипеть с обратным холодильником. Реакционную смесь далее кипятили с обратным холодильником в течение 3 ч. После завершения реакции RaNi удаляли фильтрацией, ТГФ и метанол отгоняли и концентрат разбавляли водой (20 мл), подщелачивали 20% раствором NaOH до рН 10 и смесь экстрагировали этилацетатом (230 мл). Объединенные этилацетатные экстракты далее промывали водой (230 мл), насыщенным солевым раствором (30 мл) и сушили над безводным сульфатом натрия. Летучие вещества удаляли при пониженном давлении с получением густой сиропообразной массы. Эту густую сиропообразную массу очищали на колонке с силикагелем, причем в качестве элюента применяли этилацетат и триэтиламин (от 0,2 до 1,0%). Стадия (iv). Получение 5-(4-метилпиперазин-1-илметил)-1 Н-индола. Алюмогидрид лития (2,4691 ммоль, 0,0938 г) загружали в двухгорлую круглодонную колбу объемом 25 мл, снабженную холодильником, в атмосфере азота. К нему добавляли (1 Н-индол-5-ил)-(4 метилпиперазин-1-ил)метанон (2,0576 ммоль, 0,5 г) (полученный со стадии (iii, растворенный в 5 мл ТГФ, и массу кипятили с обратным холодильником в течение периода, равного 2 ч. После завершения реакции, реакционную смесь охлаждали до 25 С и гасили медленным добавлением воды со льдом для разложения избытка LAH. Полученный в результате осадок гидроксида алюминия удаляли фильтрацией через hy-flow. Из этой эмульсии отгоняли ТГФ и концентрат разбавляли водой (20 мл), подщелачивали 20% раствором NaOH до рН 10 и смесь экстрагировали этилацетатом (220 мл). Объединенные этилацетатные экстракты далее промывали водой (220 мл), насыщенным солевым раствором (20 мл) и сушили над безводным сульфатом натрия. Летучие вещества удаляли при пониженном давлении с получением-9 017007 густой сиропообразной массы. Эту густую сиропообразную массу очищали на колонке с силикагелем,причем в качестве элюента применяли этилацетат и триэтиламин (от 0,2 до 1,0%). Пример 2. Получение 1-бензолсульфонил-5-(4-метилпиперазин-1-илметил)-1 Н-индола дигидрохлорида. 5-(4-Метилпиперазин-1-илметил)-1H-индол (0,8733 ммоль, 0,2 г) (полученный из примера 1) растворяли в 2 мл N,N-диметилформамида. Вышеуказанный раствор далее медленно добавляли в колбу объемом 25 мл, содержащую суспензию гидрида натрия (1,31 ммоль, 31,4 мг) в 1 мл ДМФА в атмосфере азота, поддерживая в то же время температуру ниже 10 С. Реакционную смесь далее перемешивали в течение периода, равного 1 ч при 25 С. К этому хорошо перемешиваемому раствору медленно добавляли бензолсульфонилхлорид (1,31 ммоль, 0,2312 г), поддерживая в то же время температуру ниже 10 С. Реакционную смесь дополнительно перемешивали в течение периода, равного 2 ч. После завершения реакции реакционную смесь выливали на 20 г смеси лед-вода при перемешивании и полученную в результате смесь экстрагировали этилацетатом (220 мл). Объединенные этилацетатные экстракты далее промывали водой (20 мл), насыщенным солевым раствором (20 мл) и сушили над безводным сульфатом натрия. Летучие вещества удаляли при пониженном давлении с получением густой сиропообразной массы, которую очищали на колонке с силикагелем, причем в качестве элюента применяли этилацетат и триэтиламин (от 0,2 до 1,0%). Данное вещество преобразовывали в дигидрохлоридную соль в растворителе из диэтилового эфира. Интервал плавления: 266-270,5 С. ИК спектр (см-1): 3474, 2920, 2417, 1632, 1370, 1182. Масс (м/z): 370,4 (М+Н)+; 1 Н-ЯМР (мд): 2,94 (3 Н, с), 3,35-3,48 (8 Н, шс), 4,36 (2 Н, с), 6,79-6,80 (1 Н, д, J=3,74 Гц), 7,47-7,52 (3 Н,м), 7,54-7,62 (1 Н, м), 7,75 (1 Н, с), 7,78-7,79 (1 Н, д, J=3,67 Гц), 7,95-7,97 (2 Н, м), 8,07-8,09 (1 Н, д, J=8,6 Гц). Пример 3. Следующие соединения (2-34) получали, следуя методике, описанной в примере 2, с небольшими некритическими изменениями. Пример 4. Следующие соединения (35-40) могут быть получены квалифицированным специалистом в данной области, следуя методике, описанной в примере 2. Пример 5. Измерение поглощения пищи (поведенческая модель). Использовали самцов крыс Вистера (120-140 г), полученных из N.I.N. (Национальный Институт Питания, Хайдарабад, Индия). Хронический эффект соединений общей формулы (I) на поглощение пищи у хорошо питающихся крыс далее определяли следующим образом. Крыс помещали в отдельные домашние клетки на 28 дней. Во время этого периода крысам скармливали дозировано перорально или интраперитонеально композицию, содержащую соединение формулы(I) или соответствующую композицию (среду) без указанного соединения, один раз в день. Крысу обеспечивали пищей и водой ad libitum (сколько угодно). На 0, 1, 7, 14, 21 и 28 дни крысам оставляли предварительно взвешенное количество пищи. Поглощение пищи и прибавку в весе измеряли рутинным образом. Способ приема пищи также раскрыт в литературе (Kask et al., European Journal of Pharmacology, 414, 2001, 215-224 и Turnball et al., Diabetes, vol. 51,August, 2002 и некоторые внутренние модификации). Соответствующие части описаний включены здесь в качестве ссылки и они образуют часть раскрытия. Некоторые представительные соединения показали статистически значимое увеличение в поглощении пищи, когда измерения проводили вышеуказанным образом при дозах, равных либо 10 или 30 мг/кг,или в обоих случаях. Пример 6. Таблетка, содержащая соединение формулы (I). Ингредиенты объединяли и гранулировали, используя растворитель, такой как метанол. Готовую форму далее сушат и формируют в таблетки (содержащие приблизительно 20 мг активного соединения) с помощью соответствующей таблетирующей машины. Пример 7. Композиция для перорального введения. Ингредиенты смешивали и распределяли в капсулы, содержащие приблизительно 100 мг каждая; одна капсула соответствовала приблизительно полной дневной дозировке. Пример 8. Жидкая пероральная готовая форма. Ингредиенты смешивали для образования суспензии для перорального введения. Пример 9. Парентеральная готовая форма. Активный ингредиент растворяли в части воды для инъекции. Далее добавляли достаточное количество хлорида натрия при перемешивании, чтобы сделать раствор изотоничным. Раствор доводили до массы оставшейся водой для инъекций, фильтровали через мембранный фильтр 0,2 мкм и паковали в стерильных условиях. Пример 10. Готовая форма в виде суппозитория. Ингредиенты плавили вместе, смешивали на паровой бане и выливали в формы, содержащие общую массу 2,5 г. Пример 11. Готовая форма для местного применения. Все ингредиенты, исключая воду, объединяли и нагревали до приблизительно 60 С при перемешивании. Далее добавляли достаточное количество воды при приблизительно 60 С при интенсивном встряхивании для эмульгирования ингредиентов и далее добавляли воду q.s. до приблизительно 100 г. Пример 12. Модель задания распознавания объекта. Свойства соединений данного изобретения по увеличению способности к распознаванию оценивали, применяя модель распознавания у животных: модель задания распознавания объекта. В качестве экспериментальных животных использовали самцов крыс Вистера (230-280 г), полученных из N.I.N. (Национальный Институт Питания, Хайдарабад, Индия). Пример 13. Индукция пережевывания/зевоты/потягивания антагонистами 5-НТ 6 рецептора. Использовали крыс Вистера с весом 200-250 г. Регистрировали среднее количество зевков, потягиваний и бесцельных движений жевания в течение 30 мин наблюдения. Ссылка: (A) King М.V., Sleight A.J., Woolley M.L., and et al., Neuropharmacology, 2004, 47, 195-204.Pharmacology, 1999, 126(7), 1537-1542. Пример 14. Водный лабиринт. Устройство водного лабиринта состояло из кругового бассейна (1,8 м в диаметре, 0,6 м высотой),сделанного из черного Perspex (TSE systems, Germany), заполненного водой (24 С), и расположенной над ним широкоугольной видеокамеры для слежения за животным. Использовали автоматическую систему слежения [Videomot 2 (5.51), TSE systems, Germany]. Эта программа анализирует видеоизображения, полученные цифровой камерой, и карту визуального сбора данных, которая определяет длину дорожки, скорость плавания, количество заходов и продолжительность времени плавания, проведенного в каждом квадранте водного лабиринта. Ссылка: (A). Yamada N., Hattoria A., Hayashi Т., Nishikawa Т., Fukuda H. et al., Pharmacology, Biochem. and Behaviour, 2004, 78, 787-791. (B). Binder M.D., Hodges D.В., Hogan J.В., Corsa J.A., et al. TheJournal of Pharmacology and Experimental Therapeutics, 2003, 307 (2), 682-691. Пример 15. Устройство пассивного избегания. Животных дрессировали в соответствии с парадигмой пассивного избегания с одной попыткой,пошагово, в режиме свет-темнота. Устройство для дрессировки состояло из камеры 300 мм длиной, 260 мм шириной и 270 мм высотой, сконструированной по установленному проекту. Передняя часть и верхняя часть были прозрачными, позволяющими экспериментатору наблюдать поведение животного внутри- 19017007 устройства. Камера была разделена на два отделения, разделенных центральной задвижкой, которая имела небольшое отверстие шириной 50 мм и высотой 75 мм, установленное близко к передней части камеры. Меньшее из отделений имело ширину 9 мм и содержало источник освещения с низкой мощностью (6 В). Большее отделение имело ширину 210 мм и не было освещено. Пол этого темного отделения состоял из решетки из 16 горизонтальных перекладин из нержавеющей стали, имеющих диаметр 5 мм, с интервалом 12,5 мм между ними. Генератор тока подавал 0,75 мА на решетчатый пол, которые пропускались однократно каждые 0,5 с через 16 перекладин. Интервал сопротивлений 40-60 мкОм был рассчитан для контрольной группы крыс и устройство калибровалось соответственно. Электронный контур, детектирующий сопротивление животного, обеспечивал точную подачу тока посредством автоматического отклонения напряжения при изменении сопротивления. Экспериментальная методика. Проводили, как описано ранее (Fox et al., 1995). Использовали взрослых самцов крыс Вистера,имеющих массу 200-230 г. Животных приносили в лабораторию за 1 ч до эксперимента. В день дрессировки животных помещали мордочками в сторону задней части светлого отделения устройства. Таймер включали, как только животное полностью поворачивалось в сторону передней части камеры. Задержку до входа в темную камеру регистрировали (обычно 20 с) и при полном попадании в темное отделение,неустранимый разрядный шок 0,75 мА пропускали через лапки животного. Животных далее возвращали в их домашние клетки. Между каждой сессией дрессировки оба отделения камеры чистили для устранения любых отвлекающих обонятельных сигналов. Возврат этого ингибиторного стимула оценивали через 24, 72 ч и на 7 день после дрессировки, возвращая животное в светлую камеру и регистрируя их задержку до входа в темную камеру, при использовании временного критерия, равного 300 с. Ссылка: (A). Callahan P.M., Ilch С.P., Rowe N.В., Tehim A., Abst. 776.19.2004, Society for neuroscience, 2004. (В). Fox G.В., Connell A.W.U., Murphy K.J., Regan С.М., Journal of Neurochemistry, 1995, 65, 6,2796-2799. Пример 16. Анализ связывания с человеческим 5-НТ 6 рецептором. Соединения могут проходить тестирование в соответствие со следующими методиками. Материалы и методы. Источник рецептора: человеческий рекомбинант, экспрессируемый в клетках HEK293. Радиолиганд: [3 Н]ЛСД (60-80 Ки/моль). Конечная концентрация лиганда - [1,5 нМ]. Неспецифический детерминант: метиотепина мезилат [0,1 мкМ]. Соединение сравнения: метиотепина мезилат. Положительный контроль: метиотепина мезилат. Условия инкубации. Реакции осуществляли в 50 мкМ трис-HCl (рН 7,4), содержащем 10 мкМ MgCl2, 0,5 мМ ЭДТА в течение 60 мин при 37 С. Реакцию останавливали посредством быстрой вакуум-фильтрации через стекловолоконные фильтры. Радиоактивность, поглощенную фильтром, определяли и сравнивали с контрольными значениями, чтобы установить любые взаимодействия тестируемых соединений с клонированным участком связывания 5-HT6. Литературная ссылка: Monsma F.J. Jr., et al., Molecular Cloning and Expression of Novel Serotonin Receptor with High Affinity for Tricyclic Psychotropic Drugs. Mol. Pharmacol. (43): 320-327 (1993). Пример 17. Функциональный анализ 5-НТ 6 на циклическую АМФ. Антагонистические свойства соединений к человеческим 5-НТ 6 рецепторам определяли посредством тестирования их эффекта на накопление цАМФ в стабильно трансфицированных клетках HEK293. Связывание агониста с человеческим 5-НТ 6 рецептором будет приводить к увеличению активности аденилатциклазы. Соединение, которое является агонистом, будет показывать увеличение продукции цАМФ, а соединение, которое является антагонистом, будет блокировать эффект агониста. Пример 18. Фармакокинетическое исследование на грызунах. В качестве экспериментальных животных использовали самцов крыс Вистера (230-280 г), полученных из N.I.N. (Национальный Институт Питания, Хайдарабад, Индия). От трех до пяти животных помещали в каждую клетку. Животных содержали в условиях 20% депривации за один день, давали им воду ad libitum в течение всего эксперимента и поддерживали их при 12-часовом цикле свет/темнота. Одна группа крыс получала соединение NCE (3-30 мг/кг) перорально и еще одна группа животных получала такое же соединение внутривенно. При каждой отметке времени отбирали кровь из яремной вены. Плазму хранили замороженной при-20 С до анализа. Концентрации соединения NCE в плазме определяли, используя метод ЖХ-МС/МС. Запланированные отметки времени: предварительная доза 0,25, 0,5, 1, 1,5, 2, 3, 4, 6, 8, 10, 12 и 24 ч после дозирования (n=3). Соединения NCE количественно оценивали в плазме посредством утвержденного метода ЖХ-МС/МС, используя метод твердофазной экстракции. Соединения NCE количественно оценивали в интервале калибровки 2-2000 нг/мл в плазме и гомогенате мозга. Исследуемые образцы анализировали, используя калибровочные образцы в группе и образцы контроля качества, распределенные по группе. Фармакокинетические параметры Смакс, Тмакс, AUCt, AUCинф, время полужизни, объем распределения, клиренс, среднее время пребывания и, следовательно, пероральную биодоступность рассчитывали посредством неизолированной модели, используя программу WinNonlin версию 4.1 Пример 19. Исследование проникновения в мозг грызуна. В качестве экспериментальных животных использовали самцов крыс Вистера (230-280 г), полученных из N.I.N. (Национальный Институт Питания, Хайдарабад, Индия). От трех до пяти животных помещали в каждую клетку. Животных содержали в условиях 20% депривации за один день, давали им воду ad libitum в течение всего эксперимента и поддерживали их при 12-часовом цикле свет/темнота. Одна группа крыс получала соединение NCE (3-30 мг/кг) перорально или интраперитонеально. При каждой отметке времени отбирали кровь из яремной вены. Плазму и мозг хранили замороженными при -20 С до анализа. Концентрации соединения NCE в плазме и мозге определяли, используя метод ЖХ-МС/МС. Запланированные отметки времени: предварительная доза 0,25, 0,5, 1, 1,5, 2, 3, 4, 6, 8, 10, 12 и 24 ч после дозирования (n=3). Соединения NCE количественно оценивали в плазме и гомогенате мозга посредством утвержденного метода ЖХ-МС/МС, используя метод твердофазной экстракции. СоединенияNCE количественно оценивали в интервале калибровки 2-2000 нг/мл в плазме и гомогенате мозга. Ис- 21017007 следуемые образцы анализировали, используя калибровочные образцы в группе и образцы контроля качества, распределенные по группе. Фармакокинетические параметры Смакс, Тмакс, AUCt, AUCинф, время полужизни, объем распределения, клиренс, среднее время пребывания и, следовательно, Cb/Ср, отношение NCE в мозге по сравнению с плазмой рассчитывали посредством неизолированной модели, используя программу WinNonlin версию 4.1 Пример 20. Исследование мозга грызуна с помощью микродиализа для возможной модуляции нейромедиаторов. В качестве экспериментальных животных использовали самцов крыс Вистера (230-280 г), полученных из N.I.N. (Национальный Институт Питания, Хайдарабад, Индия). Расстановка групп: группа 1: среда (вода; 5 мл/кг; п.о.), группа 2: NCE (3 мг/кг; п.о.), группа 3: NCE(10 мг/кг; п.о.). Хирургическая процедура: крыс анестезировали хлоралгидратом и помещали в стереотаксическую рамку. Направляющую канюлю (СМА/12) помещали при АР: -5,2 мм, ML: +5,0 мм по отношению к брегме и DV: -3,8 мм от поверхности мозга в соответствии с атласом Paxinos and Watson (1986). В то время как животное все еще было анестезировано, зонд для микродиализа (СМА/12,4 мм, PC) вводили через направляющую канюлю и закрепляли на месте. После хирургии поддерживали период заживления,равный 48-72 ч перед тем, как животное подвергалось исследованию. За день перед исследованием животных переносили в домашние клетки для акклиматизации и имплантированный зонд перфузировали в течение ночи модифицированным раствором Рингера, состоящим из 1,3 мкМ CaCl2 (Sigma), 1,0 мкМ MgCl2 (Sigma), 3,0 мкМ KCl (Sigma), 147,0 мкМ NaCl (Sigma), 1,0 мкМ Na2HPO47H2O и 0,2 мкМ NaH2PO42H2O и 0,3 мкМ неостигмина бромида (Sigma) (pH до 7,2) со скоростью 0,2 мкл/мин, установленной с помощью микроинфузионного насоса (PicoPlus, Harward). В день эксперимента скорость перфузии изменяли до 1,2 мкл/мин и обеспечивали 3-часовую стабилизацию. После периода стабилизации отбирали четыре базали при 20-минутных интервалах перед дозированием. Образцы диализатов собирали в стеклянные виалы, используя охлаждаемый коллектор фракций СМА/170. Среду или NCE (3 или 10 мг/кг) вводили посредством зонда после отбора четырех фракций. Перфузат собирали до 6 ч после введения. Концентрации ацетилхолина в образцах диализатов измеряли методом ЖХ-МС/МС (API 4000, MDSSCIEX). Ацетилхолин количественно определяли в интервале калибровки от 0,250 до 8,004 нг/мл в диализатах. По завершении экспериментов с микродиализом животных умерщвляли и их мозг удаляли и хранили в 10% растворе формалина. С каждого мозга получали срезы по 50 мкм на криостате (Leica), окрашивали и исследовали микроскопически для подтверждения расположения зонда. Данные от животных с некорректным расположением зонда не рассматривали. Данные микродиализа выражали в виде процентных изменений (среднееS.E.M.) от базовой линии, которую определяли как среднее абсолютное значение (в фМ/10 мкл) для четырех образцов перед введением лекарства. Эффекты обработки NCE (310 мг/кг) и средой статистически оценивали с помощью однопараметрической ANOVA с последующими тестами множественного сравнения Даннетта. Во всех статистических измерениях р 0,05 считали значимым. С помощью программы Graph Pad Prism данные статистически оценивали. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I) где Ar представляет собой фенил, который может быть независимо замещен одним или несколькими заместителями, выбранными из R1;R1 независимо представляет собой один или несколько заместителей, выбранных из водорода, галогена, (C1-C3)алкила, галоген(С 1-С 3)алкила, (С 1-С 3)алкокси, галоген(C1-C3)алкокси, (С 1-С 3)алкилтио, цикло(С 3-С 6)алкила или цикло(С 3-С 6)алкокси;R4 и R5 представляют собой водород, галоген, (С 1-С 3)алкил или галоген(С 1-С 3)алкил, (С 1-С 3)алкокси или галоген(С 1-С 3)алкокси. 2. Соединение по п.1, где Ar представляет собой фенил. 3. Соединение по п.1 или 2, где R1 представляет собой водород, галоген, (С 1-С 3)алкил, галоген(С 1 С 3)алкил, (С 1-С 3)алкокси, галоген(С 1-С 3)алкокси, (С 1-С 3)алкилтио, цикло(С 3-С 6)алкил или цикло(С 3 С 6)алкокси. 4. Соединение по любому из предшествующих пунктов, где R2 представляет собой водород, галоген, (С 1-С 3)алкил, галоген(С 1-С 3)алкил, (С 1-С 3)алкокси или галоген(С 1-С 3)алкокси. 5. Соединение по любому из предшествующих пунктов, где R3 представляет собой водород, галоген, (С 1-С 3)алкил или галоген(С 1-С 3)алкил, (С 1-С 3)алкокси или галоген(С 1-С 3)алкокси. 6. Соединение по любому из предшествующих пунктов, где оба R4 и R5 представляют собой водород. 7. Соединение по п.1, которое выбирают из группы, состоящей из 1-бензолсульфонил-5-(4-метилпиперазин-1-илметил)-1 Н-индола дигидрохлорида; 1-(4-метилбензолсульфонил)-5-(4-метилпиперазин-1-илметил)-1 Н-индола; 1-(4-фторбензолсульфонил)-5-(4-метилпиперазин-1-илметил)-1 Н-индола; 1-(4-метоксибензолсульфонил)-5-(4-метилпиперазин-1-илметил)-1 Н-индола; 1-[4-(1-метилэтил)бензолсульфонил]-5-(4-метилпиперазин-1-илметил)-1 Н-индола; 1-(4-хлорбензолсульфонил)-5-(4-этилпиперазин-1-илметил)-1 Н-индола дигидрохлорида; 1-(4-фторбензолсульфонил)-5-(4-этилпиперазин-1-илметил)-1 Н-индола дигидрохлорида; 1-[(4-метилэтил)бензолсульфонил]-5-(4-эилпиперазин-1-илметил)-1 Н-индола дигидрохлорида; 1-(4-метоксибензолсульфонил)-5-(4-этилпиперазин-1-илметил)-1 Н-индола дигидрохлорида; 1-(2,4-дифторбензолсульфонил)-5-(4-этилпиперазин-1-илметил)-1 Н-индола дигидрохлорида; 1-(4-бромбензолсульфонил)-5-(4-этилпиперазин-1-илметил)-1 Н-индола дигидрохлорида; 1-(3-трифторметилбензолсульфонил)-5-(4-этилпиперазин-1-илметил)-1 Н-индола дигидрохлорида; 1-(4-метилбензолсульфонил)-5-(4-этилпиперазин-1-илметил)-1 Н-индола дигидрохлорида; 1-(2,3-дихлорбензолсульфонил)-5-(4-этилпиперазин-1-илметил)-1 Н-индола дигидрохлорида; 1-(2-бромбензолсульфонил)-5-(4-этилпиперазин-1-илметил)-1 Н-индола дигидрохлорида; 1-(4-хлорбензолсульфонил)-5-(4-этилпиперазин-1-илметил)-3-бром-1 Н-индола дигидрохлорида; 1-бензолсульфонил-5-(4-этилпиперазин-1-илметил)-1 Н-индола дигидрохлорида; 1-(2,4-дифторбензолсульфонил)-5-(4-метилпиперазин-1-илметил)-1 Н-индола; 1-(2-хлор-5-триформетилбензолсульфонил)-5-(4-метилпиперазин-1-илметил)-1 Н-индола; 1-(2-бромбензолсульфонил)-5-(4-метилпиперазин-1-илметил)-1 Н-индола; 1-(2,3-дихлорбензолсульфонил)-5-(4-метилпиперазин-1-илметил)-1 Н-индола; 1-(4-хлорбензолсульфонил)-5-(4-метилпиперазин-1-илметил)-1 Н-индола; 1-(3-трифторметилбензолсульфонил)-5-(4-метилпиперазин-1-илметил)-1H-индола; 1-(4-хлорбензолсульфонил)-3-хлор-5-(4-метилпиперазин-1-илметил)-1 Н-индола; 1-(4-фторбензолсульфонил)-3-хлор-5-(4-метилпиперазин-1-илметил)-1 Н-индола; 1-(2,4-дифторбензолсульфонил)-3-хлор-5-(4-метилпиперазин-1-илметил)-1 Н-индола дигидрохлорида; 1-(2-хлор-5-трифторметилбензолсульфонил)-3-хлор-5-(4-метилпиперазин-1-илметил)-1 Н-индола дигидрохлорида; 1-(4-фторбензолсульфонил)-4-изопропокси-5-(4-метилпиперазин-1-илметил)-1 Н-индола; 1-[4-(1-метилэтил)бензолсульфонил]-4-изопропокси-5-(4-метилпиперазин-1-илметил)-1 Н-индола; 1-(4-фторбензолсульфонил)-3-хлор-5-(пиперазин-1-илметил)-1 Н-индола дигидрохлорида; 1-(2-бромбензолсульфонил)-5-(пиперазин-1-илметил)-1 Н-индола дигидрохлорида; 1-(2,4-дифторбензолсульфонил)-3-хлор-5-(пиперазин-1-илметил)-1 Н-индола дигидрохлорида; 1-(бензолсульфонил)-5-(пиперазин-1-илметил)-1 Н-индола дигидрохлорида; 1-[4-(1-метилэтил)бензолсульфонил]-5-(пиперазин-1-илметил)-1 Н-индола дигидрохлорида; 1-(3-хлорбензолсульфонил)-5-(2,4-диметилпиперазин-1-илметил)-1 Н-индола; 2-хлор-5-(4-метилпиперазин-1-илметил)-1-(3-метилбензолсульфонил)-1 Н-индола; 2-метокси-5-(4-метилпиперазин-1-илметил)-1-(3-метилбензолсульфонил)-1 Н-индола; 1-(3-хлорбензолсульфонил)-3-метокси-5-(4-метилпиперазин-1-илметил)-1 Н-индола; 5-(4-метилпиперазин-1-илметил)-1-(4-метилбензолсульфонил)-6-трифторметил-1 Н-индола; 1-(3-хлорбензолсульфонил)-7-метокси-5-(4-метилпиперазин-1-илметил)-1 Н-индола; его стереоизомеры и/или его соли. 8. Способ получения соединения формулы (I) по п.1, который включает контактирование соединения формулы (а) с арилсульфонильным соединением формулы ArSO2Cl, где Ar представляет собой фенил, с использованием инертного растворителя, выбранного из группы, включающей ДМСО, ДМФА, ацетонитрил,ТГФ, диэтиловый эфир и/или дифениловый эфир, и основания при температуре ниже 10 С для получения соединения формулы (I), где все заместители такие, как определено в п.1. 9. Способ по п.8, где указанные основания выбирают из гидридов щелочных металлов и гидридов щелочно-земельных металлов. 10. Фармацевтическая композиция, содержащая соединение по любому из предшествующих пунктов или фармацевтически пригодные носитель, разбавитель, реципиент или сольват наряду с терапевтически эффективным количеством соединения по п.1, его стереоизомеры, его фармацевтически приемлемые соли и любые пригодные сочетания из вышеприведенных. 11. Применение соединения по любому из пп.1-7 для получения лекарственного средства для лечения и профилактики заболевания, связанного с 5-НТ 6 рецептором.
МПК / Метки
МПК: A61P 25/00, C07D 209/08, A61K 31/404
Метки: 5-ht6, применение, 5-(гетероциклил)алкил-n-(арилсульфонил)индола, качестве, лигандов, соединения
Код ссылки
<a href="https://eas.patents.su/25-17007-soedineniya-5-geterociklilalkil-n-arilsulfonilindola-i-ih-primenenie-v-kachestve-ligandov-5-ht6.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения 5-(гетероциклил)алкил-n-(арилсульфонил)индола и их применение в качестве лигандов 5-ht6</a>
Предыдущий патент: Пестицидная композиция, содержащая фенамидон и инсектицидное соединение
Следующий патент: Разрушающая и вытесняющая жидкость и способ применения
Случайный патент: Катализатор для гидрирования ненасыщенных полимеров












