Макролиды, обладающие противовоспалительной активностью
Номер патента: 10906
Опубликовано: 30.12.2008
Авторы: Орнаги Фернандо, Мереу Андреа, Пеллачини Франко, Наполетано Мауро, Моригги Ерманно
Формула / Реферат
1. Соединение формулы
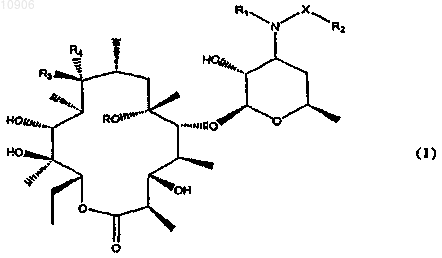
в которой X представляет собой -C(=O)-, -C(=O)-O-, -C(=O)-NH-, -SO2- или -SO2-NH-группу;
R представляет собой атом водорода или метил;
R1 представляет собой атом водорода или (C1-C3)алкильную группу;
R2 представляет собой атом водорода, (C1-C4)алкокси(C1-C4)алкильную группу,
(C5-C7)циклоалкильную группу, фенил либо 5- или 6-членный гетероарил, содержащий от 1 до 3 гетероатомов, выбранных из азота, кислорода и серы, фенил(C1-C4)алкильную или гетероарил(C1-C4)алкильную группу, необязательно замещенную 1-3 заместителями, выбранными из (C1-C4)алкильной группы,
(C1-C4)алкоксильной группы и галогена, или цепь формулы
![]()
где A представляет собой фенил либо 5- или 6-членный гетероарил, содержащий от 1 до 3 гетероатомов, выбранных из азота, кислорода и серы, причем оба необязательно замещены 1-3 заместителями, выбранными из (C1-C4)алкильной группы, (C1-C4)алкоксильной группы или галогена;
Y представляет собой O, S или NR6, где R6 - атом водорода, линейная или разветвленная (C1-C3)алкильная, (C1-C3)алкоксикарбонильная группа или бензилоксикарбонильная группа;
r - целое число от 1 до 3;
m - целое число от 0 до 3;
R3 представляет собой гидроксигруппу либо R3 вместе с R4 образуют (=O) группу или =N-O-R5 группу, в которой R5 представляет собой атом водорода, (C1-C4)алкильную группу, бензил, или группу -X-R2, в которой X и R2 имеют упомянутые выше значения;
R4 представляет собой атом водорода либо R4 вместе с R3 образуют (=O) группу или =N-O-R5 группу, в которой R5 имеет упомянутые выше значения; и
кроме того, R2 представляет собой (C1-C10)алкильную группу или (C4-C10)алкильную группу, если одновременно X представляет собой группу -C(=O)-, R1 представляет собой (C1-C3)алкильную группу, a R3 представляет собой гидроксигруппу или R3 вместе с R4 образуют =N-O-R5 группу, в которой R5 отличен от -X-R2;
а также его фармацевтически приемлемые соли.
2. Соединение по п.1, отличающееся тем, что R, R1 и R2 имеют значения, определенные формулой (I), X представляет собой -C(=O)-, -C(=O)-NH- или -SO2-группу, а R3 представляет собой гидроксигруппу либо R3 вместе с R4 образуют (=O) группу, или =N-O-R5 группу, в которой R5 представляет собой атом водорода, метил, бензил, или группу -X-R2, в которой X и R2 имеют значения, указанные в формуле (I).
3. Соединение по п.2, отличающееся тем, что R1 представляет собой атом водорода или метил, a R5 представляет собой атом водорода или группу -X-R2, в которой X и R2 имеют значения, указанные в формуле (I).
4. Соединение по п.3, отличающееся тем, что R2 представляет собой атом водорода,
(C1-C4)алкокси(C1-C4)алкильную группу, (C5-C7)циклоалкильную группу, фенил либо 5- или 6-членный гетероарил, содержащий от 1 до 3 гетероатомов, выбранных из азота, кислорода и серы,
фенил(C1-C4)алкильную или гетероарил(C1-C4)алкильную группу, необязательно замещенную 1-3 заместителями, выбранными из (C1-C4)алкильной группы, (C1-C4)алкоксильной группы и галогена, или цепь формулы
![]()
в которой A представляет собой фенил или гетероарил, выбранный из фурана, тиофена, оксазола, имидазола, пиридина, пиримидина и триазола, причем оба необязательно замещены 1-3 заместителями, выбранными из (C1-C4)алкильной группы, (C1-C4)алкоксильной группы или галогена;
Y представляет собой O, S или NR6, где R6 - атом водорода или метил;
r - целое число от 1 до 3;
m - целое число от 0 до 3; и
кроме того, R2 представляет собой (C1-C10)алкильную группу или (C4-C10)алкильную группу, если одновременно X представляет собой группу -C(=O)-, R1 представляет собой (C1-C3)алкильную группу, a R3 представляет собой гидроксигруппу или R3 вместе с R4 образуют =N-O-R5 группу, в которой R5 отличен от -X-R2.
5. Соединение по п.1, отличающееся тем, что R1 представляет собой метил, R2 представляет собой метокси(C1-C3)алкильную группу, (C5-C7)циклоалкильную группу, фенил или гетероарил, выбранный из фурана, тиофена, оксазола и пиридина, бензил или гетероарил(C1-C4)алкильную группу, необязательно замещенную заместителем, выбранным из (C1-C4)алкильной группы, метоксильной группы и галогена, или цепь формулы
![]()
в которой A представляет собой фенил или гетероарил, выбранный из фурана, тиофена, оксазола и пиридина, причем оба они необязательно замещены заместителем, выбранным из (C1-C4)алкильной группы, метоксильной группы или галогена;
Y представляет собой O, S или NR6, где R6 - атом водорода;
r - целое число от 1 до 3;
m - целое число, выбранное из 0 и 1; и
кроме того, R2 представляет собой (C1-C7)алкильную группу или (C4-C10)алкильную группу, если одновременно X представляет собой группу -C(=O)-, R1 представляет собой (C1-C3)алкильную группу, a R3 представляет собой гидроксигруппу или R3 вместе с R4 образуют =N-O-R5 группу, в которой R5 отличен от -X-R2.
6. Соединение по п.1, отличающееся тем, что R, R1, R2 и X имеют значения, определенные формулой (I), R3 представляет собой гидроксигруппу, a R4 является атомом водорода.
7. Соединение по п.6, отличающееся тем, что R1 представляет собой атом водорода или метил, а X представляет собой -C(=O)-, -C(=O)-NH- или -SO2-группу.
8. Соединение по п.7, отличающееся тем, что R2 представляет собой атом водорода,
(C1-C4)алкокси(C1-C3)алкильную группу, (C5-C7)циклоалкильную группу, фенил либо 5- или 6-членный гетероарил, содержащий от 1 до 3 гетероатомов, выбранных из азота, кислорода и серы,
фенил(C1-C4)алкильную или гетероарил(C1-C4)алкильную группу, необязательно замещенную заместителем, выбранным из (C1-C4)алкильной группы, (C1-C4)алкоксильной группы и галогена, или цепь формулы
![]()
в которой A представляет собой фенил или гетероарил, выбранный из фурана, тиофена, оксазола, имидазола, пиридина, пиримидина и триазоыр, причем оба необязательно замещены заместителем, выбранным из (C1-C4)алкильной группы, (C1-C4)алкоксильной группы или галогена;
Y представляет собой O, S или NR6, где R6 - атом водорода или метил;
r - целое число от 1 до 3;
m - целое число, выбранное из 0 и 3; и
кроме того, R2 представляет собой (C1-C7)алкильную группу или (C4-C10)алкильную группу, если одновременно X представляет собой группу -С(=O)-, R1 представляет собой (C1-C3)алкильную группу, a R3 представляет собой гидроксигруппу или R3 вместе с R4 образуют =N-O-R5 группу, в которой R5 отличен от -X-R2.
9. Соединение по п.8, отличающееся тем, что R1 представляет собой метил, a R2 представляет собой атом водорода, метокси(C1-C3)алкильную группу, (C5-C7)циклоалкильную группу фенил или гетероарил, выбранный из фурана, тиофена, оксазола и пиридина, бензил, или гетероарил(C1-C4)метильную группу, в которой гетероарил выбран из фурана, тиофена, оксазола и пиридина, необязательно замещенный заместителем, выбранным из (C1-C4)алкильной группы, метоксигруппы и галогена, или цепь формулы
![]()
в которой A представляет собой фенил или гетероарил, выбранный из фурана, тиофена, оксазола и пиридина, причем оба они необязательно замещены заместителем, выбранным из метильной группы, метоксигруппы или галогена;
Y представляет собой O, S или NR6, где R6 - атом водорода;
r - целое число от 1 до 3;
m - целое число, выбранное из 0 и 1; и
кроме того, R2 представляет собой (C1-C7)алкильную группу или (C4-C10)алкильную группу, если одновременно X представляет собой группу -С(=O)-, R1 представляет собой (C1-C3)алкильную группу, a R3 представляет собой гидроксигруппу или R3 вместе с R4 образуют =N-O-R5 группу, в которой R5 отличен от -X-R2.
10. Соединение по п.9, отличающееся тем, что R2 представляет собой метоксиметильную группу, циклоэзил, фенил или гетероарил, выбранный из фурана, тиофена, оксазола и пиридина, бензил или тиофенилметильную группу, необязательно замещенную заместителем, выбранным из метильной группы, метоксильной группы и галогена, или цепь формулы
![]()
в которой A представляет собой фенил или пиридин, причем оба они необязательно замещены метоксильной группой;
Y представляет собой O, S или NR6, где R6 - атом водорода;
r - целое число от 1 до 3;
m - целое число, выбранное из 0 и 1; и
кроме того, R2 представляет собой (C1-C7)алкильную группу или (C4-C10)алкильную группу, если одновременно X представляет собой группу -C(=O)-, R1 представляет собой (C1-C3)алкильную группу, a R3 представляет собой гидроксигруппу или R3 вместе с R4 образуют =N-O-R5 группу, в которой R5 отличен от -X-R2.
11. Соединение по п.1, отличающееся тем, что заместитель -X-R2 в значениях R5 имеет такие же значения, что и заместители X и R2 на позиции 3'.
12. Способ получения соединения по п.1, включающий:
а) деметилирование диметиламиногруппы с позиции 3' соединения формулы (II)
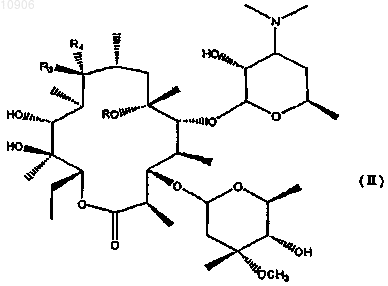
в которой R, R3 и R4 имеют значения, определенные в п.1;
б) удаление L-кладиноза гидролизом;
в) амидирование первичной или вторичной аминной группы, полученной на стадии а).
13. Способ по п.12, отличающийся тем, что R3 в формуле (II) представляет собой гидроксигруппу, а R4 представляет собой атом водорода.
14. Способ по п.12, отличающийся тем, что указанное удаление кладиноза осуществляется гидролизом при кислотном катализе, протекающем в присутствии минеральной кислоты и протонного органического растворителя.
15. Фармацевтический состав, содержащий терапевтически эффективное количество соединения по п.1 в смеси с фармацевтически приемлемым носителем.
16. Фармацевтический состав по п.15, пригодный для лечения воспалительных заболеваний.
Текст
010906 Настоящее изобретение касается макролидов, обладающих противовоспалительной активностью, а более конкретно оно касается не содержащих кладиноза 3'-амидных производных макролидов с противовоспалительной активностью, их фармацевтически приемлемых солей, а также фармацевтических составов, содержащих эти соединения в качестве активных ингредиентов. Известно, что некоторые антибиотики, в частности антибиотики класса макролидов с 14 атомами,представляющие собой производные эритромицина, помимо антибактериальной активности, обладают и противовоспалительными свойствами [Clin. Immunother., (1996), 6, 454-464]. Эритромицин - это природный макролид (The Merck Index, XIII edition, no 3714, page 654), обладающий очень широким спектром клинического применения при лечении инфекций, вызываемых грамположительными бактериями, некоторыми грамотрицательными бактериями или микоплазмой. В последнее время интерес научного сообщества сфокусировался на иммуномодулирующей и противовоспалительной активности эритромицина и его производных [Journal of AntimicrobialChemotherapy, (1998), 41, Suppl.B, 37-46]. Выявлена эффективность макролидов в терапии воспалительных процессов, таких как панбронхиолит [Thorax, (1997), 52, 915-918], бронхиальная астма [Chest, (1991), 99, 670-673] и кистозный фиброз[The Lancet, (1998), 351, 420]. Установлено, что in vitro макролиды особенно активны при модулировании метаболических функций некоторых клеток иммунной системы, таких как нейтрофилы [The journal of Immunology, (1997), 159,3395-4005] и T-лимфоциты [Life Sciences, (1992), 51, PL 231-236]; а также при модулировании таких воспалительных факторов, как интерлейкин 8 (IL-8) [Am. J. Respir. Crit. Care Med., (1997), 156, 266-271] или интерлейкин 5 (IL-5) (EP 0775489 и EP 0771564, Taisho Pharmaceutical Co., Ltd). В частности, нейтрофилы представляют собой первую клеточную линию, вовлекаемую в зону инфекции или поражения ткани на самых ранних стадиях воспалительной реакции. Нефизиологичное скопление нейтрофилов в воспалительной ткани, их активация с последующим высвобождением протеазы и рост продуцирования метаболитов, вступающих в реакцию с кислородом, все это характеризует некоторые формы воспалительной реакции, которая в большинстве случаев порождает патологическое состояние. Таким образом, хотя нейтрофилы играют важную роль в защитной иммунной реакции и в воспалительном процессе, как известно, они вовлечены и в патологические процессы, возникающие в результате большинства хронических воспалительных состояний и вследствие поражений при ишемической реперфузии (Inflammation and fever; Viera Stvrtinov, Jan Jakubovsky e Ivan Hlen Academic Electronic Press,1995). В этой же работе сообщается о патологиях, доказано влияние меняющейся функции нейтрофилов на генезис и/или развитие таких патологий, среди которых отмечены атеросклероз, повреждения в результате ишемической реперфузии, ревматоидного артрита, псориаза, васкулитов и гломеронефритов с аутоиммунными отклонениями, болезни Хорна, а также хронических воспалительных процессов легких(типа респираторного дистресс-синдрома взрослых). Хроническое обструктивное заболевание легких представляет собой хроническую патологию, характеризующуюся воспалением и прогрессирующей деструкцией легочной ткани, вызываемых объемным присутствием активированных нейтрофилов с последующим высвобождением протеинов металла и ростом продуцирования кислородных радикалов [Am. J. Respir. Crit Care Med., 1996, 153, 530-534; Chest,2000, 117 (2 Suppl), 10S-14S]. Введение макролидов астматикам сочетается со снижением гиперсекреции и гиперчувствительности легких, возникающих после окислительного и воспалительного взаимодействия с фагоцитами; этому взаимодействию будут препятствовать те немногие биологически активные липиды, которые вовлечены в патогенез бронхиальной астмы, дестабилизируя противовоспалительную активность. Судя по описанию, лечение пациентов, страдающих астмой, эритромицином в малых дозах в течение длительного времени эффективно для снижения гиперчувствительности легких (Miyatake H. et al.Chest, 1991, 99 670-673; цитирована ранее). Еще в одной работе показано, что такое же лечение пациентов с хроническим обструктивным заболеванием легких может значительно снизить частоту обострений, вызванных острой респираторной инфекцией, а также риск возникновения таких обострений (CHEST 2001, 120, 730-733). Полученные результаты не могут быть приписаны антибиотической активности макролидов, они относятся к подавлению экспрессии и высвобождению воспалительных цитокинов. Согласно упомянутой выше статье такое лечение следует предпочтительно ограничить пациентами с высоким риском обострения хронических обструктивных заболеваний легких, вызванных потенциальным риском создания резистентных патогенных штаммов. Специфическая терапевтическая эффективность макролидов в отношении заболеваний, при которых обычные противовоспалительные лекарственные средства (такие как, например, кортикостероиды) оказались неэффективными [Thorax, (1997), 52, 915-918, цитируемый выше], объясняет тот высокий интерес, адресованный этому новому потенциальному классу противовоспалительных средств. Тем не менее, тот факт, что классические макролиды обладают мощной антибактериальной актив-1 010906 ностью, не допускает их расширенное применение для постоянного лечения воспалительных процессов,не обусловленных патогенными микроорганизмами; действительно, это может вызвать быстрое появление резистентных штаммов. Поэтому было бы желательно располагать новыми веществами с макролидной структурой, которые обладают противовоспалительной активностью и в то же время лишены свойств антибиотиков. Для большей ясности приведем формулу эритромицина, в которой нумерация принята в данном описании Некоторые классы производных эритромицина, обладающие противовоспалительной активностью,описаны в литературе. В заявке на патент WO 99/16779 (Abbott Laboratories) описаны кетолиды, производные эритромицина, модифицированные по позиции 3', а также 6-O-замещенные, применяемые при лечении бактериальных инфекций. В заявке на патент JP 2001181294 (Hokuriku Pharmaceutical Co.) описаны 9-оксииминопроизводные эритромицина, этерифицированные по 3- и 3'-позициям, которые пригодны в качестве антибактериальных и противоязвенных средств. В патенте США 3928387 (Hoffman La Roche Inc.) описываются 9-оксим 3'-дездиметиламино-3'-4'дегидроэритромицина A, а также 9-оксим эритронолида A в качестве промежуточных соединений, пригодных для получения антибиотика 1745 A/X. В заявке на патент EP 0254534 (Robinson, William S.) описан очень широкий класс макролидов, содержащих 9-O-метилоксимные производные эритронолида A, а также 9-оксииминовые производные эритромицина A, например 9-O-метилоксим 3'-дездиметиламино-3'-4'-дегидроэритромицина A. В упомянутой выше заявке утверждается наличие соединений с противовирусной активностью. Кроме того, в литературе описываются некоторые классы производных эритромицина, обладающих противовоспалительной активностью. Например, в уже цитированных заявках на ЕП (Taisho) заявлены права на производные эритромицина, модифицированные по 3, 9, 11 и 12 позициям, в качестве сильных ингибиторов синтеза интерлейкин 5. В заявке на патент WO 92/16226 (Smith-Kline Beecham Corporation) заявлено использование эритромицина как противовоспалительного средства, которое за счет подавления гликопротеина млекопитающих mdr-P снижает высвобождение интерлейкин 1. В заявке на патент WO 00/42055 (Zambon Group) описаны 3'-дездиметиламино-9-оксииминомакролиды, которые наделены противовоспалительной активностью, но лишены антибиотической активности. Как указывалось выше, эффективный вклад в противовоспалительную активность, демонстрируемую макролидными соединениями, можно приписать тем изменениям, которые индуцированы в отношении некоторых метаболических функций нейтрофилов. Присутствие L-кладиноза на позиции 3 производных макролидного цикла играет существенную структурную роль в модулировании указанных выше метаболических функциональных активностей нейтрофилов [The journal of Immunology, 1997, 159, 3395-4005; упомянут выше]. Следовательно, активность сахаров может быть связана как с ее важностью для поглощения клеткой макролидных соединений, так и с взаимодействием с клеточной мишенью, вовлеченной в обе метаболические активности нейтрофилов. Тот же самый нейтральный сахар L-кладиноза, как описано, обладает высокой противовоспалительной активностью. В заявке на международный патент WO 97/00684 (Roussel Uclaf) раскрыты фармацевтические составы, содержащие кладиноз или L-кладиноз в качестве активного средства для лечения воспалительных состояний. В настоящее время неожиданно было обнаружено, что новые 3'-амидные производные макролидов,утратившие кладинозный фрагмент, обладают противовоспалительной активностью и в значительной степени лишены антибиотических свойств.-2 010906 Следовательно, предметом настоящего изобретения являются соединения формулыR представляет собой атом водорода или метил;R1 представляет собой атом водорода или (C1-C3)алкильную группу;R2 представляет собой атом водорода, (C1-C4)алкокси(C1-C4)алкильную группу, (C5-C7)циклоалкильную группу, фенил либо 5- или 6-членный гетероарил, содержащий 1-3 гетероатома, выбранных из азота, кислорода или серы, фенил(C1-C4)алкильную или гетероарил(C1-C4)алкильную группу, необязательно замещенную на 1-3 заместителя, выбранных из группы, включающей (C1-C4)алкильную группу,(C1-C4)алкоксильную группу и галоген, или цепь формулы в которой A представляет собой фенил либо 5- или 6-членный гетероцикл, содержащий 1-3 гетероатома,выбранных из азота, кислорода и серы, причем оба необязательно замещены 1-3 заместителями, выбранными из (C1-C4)алкильной группы, (C1-C4)алкоксильной группы и галогена;Y представляет собой O, S или NR6, где R6 - атом водорода или метил;r - целое число от 1 до 3;m - целое число от 0 до 3;R3 представляет собой гидроксигруппу или R3 вместе с R4 образуют (=O) группу, или =N-O-R5 группу, в которой R5 представляет собой атом водорода, (C1-C4)алкильную группу, бензил, или группу-X-R2, в которой X и R2 имеют упомянутые выше значения;R4 представляет собой атом водорода, или R4 вместе с R3 образуют (=O) группу, или =N-O-R5 группу, в которой R5 имеет упомянутые выше значения; Кроме того, R2 представляет собой (C1-C10)алкильную группу или (C4-C10)алкильную группу, если одновременно X представляет собой группу -С(=O)-, R1 представляет собой (C1-C3)алкильную группу, aR3 представляет собой гидроксигруппу или R3 вместе с R4 образуют =N-O-R5 группу, в которой R5 отличен от -X-R2; а также их фармацевтически приемлемые соли. Соединения, в которых R2 представляет собой (C1-C3)алкильную группу, если одновременно X представляет собой -С(=O)-группу, R1 представляет собой (C1-C3)алкильную группу, a R3 представляет собой гидроксигруппу или R3 вместе с R4 образуют =N-O-R5 группу, в которой R5 отличен от -X-R2, описаны в находящейся на совместном рассмотрении заявке на патент Италии, поданной 1 августа 2002 г. теми же авторами,M12002 А 001726. Оксимы формулы (I) могут иметь Z- или E-конфигурацию. Соединения формулы (I) представляют собой макролиды противовоспалительного действия, лишенные антибиотической активности, и поэтому они пригодны для лечения и профилактики воспалительных патологий. Специфическими примерами (C1-C10)алкильных групп являются метил, этил, н-пропил, изопропил,н-бутил, вторичный бутил, трет-бутил, н-пентил, 1-метилбутил, 2-этилпропил, 3-метилбутил, 3-метил-2 бутил, н-эзил, эптил, оптил, нонил, децил и им подобные. Под (C5-C7)циклоалкильными группами понимаются циклопентил, циклоэзил и циклоэптил. Под термином галоген подразумевается атом фтора, хлора, брома и йода. Под термином 5- или 6-членный гетероцикл, имеющий 1-3 гетероатома, выбранных из азота, кислорода и серы, понимают такие гетероциклы, как пиррол, тиофен, фуран, имидазол, пиразол, тиазол, изотиазол, изоксазол, оксазол,пиридин, пиразин, пиримидин, пиридазин, триазол и тиадиазол. Людям, квалифицированным в данной области, очевидно, что замещение указанных гетероарилов на частично или полностью насыщенные формы, также как и присутствие в ароматических циклах (фенильном или гетероарильных) других заместителей для R2 приводят к соединениям, которые не отступают от сущности и границ настоящего изобретения. Предпочтительными соединениями формулы (I) являются такие соединения, в которых R, R1 и R2 имеют значения, указанные в формуле (I), X представляет собой -С(=O)-, -С(=O)-N или группу -SO2-, aR3 представляет собой гидроксигруппу или R3 вместе с R4 образуют (=O) группу, или =N-O-R5 группу, в которой R5 представляет собой атом водорода, метил, бензил, или группу -X-R2, в которой X и R2 имеют-3 010906 значения, указанные в формуле (I). В пределах этой группы более предпочтительны такие соединения, в которых R1 представляет собой атом водорода или метил, a R5 представляет собой атом водорода или группу -X-R2, в которой X и R2 имеют значения, указанные в формуле (I). Далее, еще более предпочтительны такие соединения, из относящихся в этой группе, в которых R2 представляет собой атом водорода, (C1-C4)алкокси(C1-C4)алкильную группу, (C5-C7)циклоалкильную группу, фенил либо 5- или 6-членный гетероарил, содержащий 1-3 гетероатома, выбранных из азота, кислорода и серы, фенил(C1-C4)алкильную или гетероарил(C1-C4)алкильную группу, необязательно замещенную на 1-3 заместителя, выбранных из группы, включающей (C1-C4)алкильную группу,(C1-C3)алкоксильную группу и галоген, или цепь формулы в которой A представляет собой фенил или гетероарил, выбранный из фурана, тиофена, оксазола, имидазола, пиридина, пиримидина и триазола, причем они оба необязательно замещены 1-3 заместителями,выбранными из (C1-C4)алкильной группы, (C1-C4)алкоксильной группы и галогена;Y представляет собой O, S или NR6, где R6 - атом водорода или метил;R - целое число от 1 до 3;m - целое число от 0 до 3; кроме того, R2 представляет собой (C1-C10)алкильную группу или (C4-C10)алкильную группу, если одновременно X представляет собой группу -С(=O)-, R1 представляет собой (C1-C3)алкильную группу, aR3 представляет собой гидроксигруппу или R3 вместе с R4 образуют =N-O-R5 группу, в которой R5 отличен от -X-R2. В пределах этой группы более предпочтительны такие соединения, в которых R1 представляет собой метил, a R2 представляет собой метокси(C1-C3)алкильную группу, фенил или гетероарил, выбранный из фурана, тиофена, оксазола и пиридина, бензил или гетероарил(C1-C4)алкильную группу, необязательно замещенную заместителем, выбранным из (C1-C4)алкильной группы, метоксигруппы и галогена, или цепи формулы в которой A представляет собой фенил или гетероарил, выбранный из фурана, тиофена, оксазола и пиридина, причем оба они необязательно замещены заместителем, выбранным из (C1-C4)алкильной группы,метоксигруппы или галогена;r - целое число от 1 до 3;m - целое число от 0 до 1; кроме того, R2 представляет собой (C1-C7)алкильную группу или (C4-C10)алкильную группу, если одновременно X представляет собой группу -С(=O)-, R1 представляет собой (C1-C3) алкильную группу, aR3 представляет собой гидроксигруппу или R3 вместе с R4 образуют =N-O-R5 группу, в которой R5 отличен от -X-R2. Дополнительный класс предпочтительных соединений представляет собой класс, в котором R, R1,R2 и X имеют значения, определенные в формуле (I), R3 представляет собой гидроксигруппу, a R4 - атом водорода. Еще более предпочтительными соединениями из принадлежащих к этой группе являются такие соединения, в которых R1 представляет собой атом водорода или метил, а X представляет собой -С(=O)-,-C(=O)-N- или -SO2-группу. Еще более предпочтительными соединениями из принадлежащих к этой группе являются такие соединения, в которых R2 представляет собой атом водорода, (C1-C4)алкокси(C1-C3)алкильную группу,(C5-C7)циклоалкильную группу, фенил либо 5- или 6-членный гетероарил, содержащий 1-3 гетероатома,выбранных из азота, кислорода и серы, фенил(C1-C4)алкильную или гетероарил(C1-C4)алкильную группу,необязательно замещенную на заместитель, выбранный из группы, включающей (C1-C4)алкильную группу, (C1-C4)алкоксильную группу и галоген, или цепь формулы в которой A представляет собой фенил или гетероарил, выбранный из фурана, тиофена, оксазола, имидазола, пиридина, пиримидина и триазола, причем оба они необязательно замещены заместителем, выбранным из (C1-C4)алкильной группы, (C1-C4)алкоксильной группы и галогена;Y представляет собой O, S или NR6, где R6 - атом водорода или метил;r - целое число от 1 до 3;m - целое число от 0 до 3; кроме того, R2 представляет собой (C1-C7)алкильную группу или (C4-C10)алкильную группу, если одновременно X представляет собой группу -С(=O)-, R1 представляет собой (C1-C3)алкильную группу, аR3 представляет собой гидроксигруппу или R3 вместе с R4 образуют =N-O-R5 группу, в которой R5 отличен от -X-R2.-4 010906 Еще более предпочтительными соединениями из принадлежащих к этой группе являются такие соединения, в которых R1 представляет собой метил, R2 представляет собой атом водорода, метокси(C1-C3)алкильную группу, (C5-C7)циклоалкильную группу, фенил или гетероарил, выбранный из фурана, тиофена, оксазола и пиридина, необязательно замещенный на заместитель, выбранный из группы,включающей (C1-C4)алкильную группу, метоксильную группу и галоген, или цепь формулы в которой A представляет собой фенил или гетероарил, выбранный из фурана, тиофена, оксазола и пиридина, причем оба они необязательно замещены заместителем, выбранным из метильной группы, метоксильной группы или галогена;r - целое число от 1 до 3;m - целое число от 0 до 1; кроме того, R2 представляет собой (C1-C7)алкильную группу или (C4-C10)алкильную группу, если одновременно X представляет собой группу -С(=O)-, R1 представляет собой (C1-C3) алкильную группу, aR3 представляет собой гидроксигруппу или R3 вместе с R4 образуют =N-O-R5 группу, в которой R5 отличен от -X-R2. Еще более предпочтительными соединениями из принадлежащих к этой группе являются такие соединения, в которых R2 представляет собой метоксиметильную группу, циклоэзил, фенил или гетероарил, выбранный из фурана, тиофена, оксазола и пиридина, бензил или тиофенилметильную группу, необязательно замещенный заместитель, выбранный из метильной группы, метоксильной группы и галогена, или цепь формулы в которой A представляет собой фенил или пиридин, причем оба они необязательно замещены метоксильной группой;r - целое число от 1 до 3;m - целое число от 0 до 1; кроме того, R2 представляет собой (C1-C7)алкильную группу или (C4-C10)алкильную группу, если одновременно X представляет собой группу -С(=O)-, R1 представляет собой (C1-C3)алкильную группу, aR3 представляет собой гидроксигруппу или R3 вместе с R4 образуют =N-O-R5 группу, в которой R5 отличен от -X-R2. Дополнительным классом предпочтительных соединений являются такие соединения, в которых заместитель -Х-R2 в значениях R5 имеет те же значения, как заместители X и R2 в позиции 3'. Следующим предметом настоящего изобретения являются соединения формулы (I), обладающие Zили E-конфигурацией оксима в позиции 9, предпочтительна E-конфигурация. Примерами фармацевтически приемлемых солей формулы (I) являются соли органических или неорганических кислот, таких как соляная, бромисто-водородная, йодисто-водородная, азотная, серная,фосфорная, уксусная, винная, лимонная, бензойная, янтарная и глутаровая кислоты. Специфическими примерами соединений по настоящему изобретению являются такие соединения формулы (I), в которых R и R4 имеют значения, определенные формулой (I); X представляет собой-С(=O)-, -C(=O)-N- или -SO2- группу; R1 представляет собой метил; R2 представляет собой водород, метоксиметил, циклоэзил, фенил, бензил, 4-метилфенил, 4-метоксифенил, 4-фторфенил, 2-фурил,3-пиридил, 2-тиофенил, 2-хлор-3-пиридил, 2-тиофенилметил, 3-метил-5-оксазолил, (4-метоксипиридин 2-ил-метил)оксиметил, фенилтиометил, метил, этил, трет-бутил и эптил; R3 представляет собой гидрокси или R3 вместе с R4 образуют (=O) группу или =N-O-R5 группу, в которой R5 представляет собой водород, ацетил, пивалоил, 4-метоксибензоил, 2-тиофенкарбоксил, 2-тиофенацетил. Соединения формулы (I), являющиеся предметом настоящего изобретения, получают, используя схему синтеза, которая включает деметилирование диметиламиногруппы с позиции 3', удалениеL-кладиноза из соединений формулы (II)-5 010906 в которой R, R3 и R4 имеют значения, определенные для соединений формулы (I), a также последующее амидирование первичной или вторичной аминной группы по позиции 3' с целью получения соединений формулы (I). Соединения формулы (II) представляют собой эритромицин A или 6-O-метилэритромицин A (непатентованное название кларитромицин) или их получают из этих соединений с помощью возможного воздействия на макролидный цикл на уровне кетонной группы с позиции 9. Указанную кетонную группу на позиции 9 можно восстановить с получением гидроксипроизводного или ее можно обработать реагентами, пригодными для получения некоторых оксимных производных. Оксимы эритромицина A, имеющие конфигурацию Z или E, представляют собой доступные соединения, их можно приготовить стандартными методами, такими как методы, упомянутые в патенте США 3478014 (Pliva), или методы, описанные в литературе (J.C. Gase et al., The Journal of Antibiotics; 44, 313330, 1991). Производные оксима формулы (I), в которой R5 отличен от атома водорода, можно получить прямым синтезом или введением оксимной группы согласно общепринятой методике. Производные макролидов, имеющие на позиции 9 гидроксигруппу, представляют собой соединения, которые можно получить стандартными способами, например посредством обработки восстановителем типа гидридов (борогидрид натрия, борогидрид натрия, цианоборогидрид натрия, алюмоборогидрид лития)(Faghin, Journal of Antibiotics, 1990, 1334-1336) или каталитическим гидрированием. Получение соединений формулы (I) из таких субстратов включает деметилирование диметиламиногруппы на позиции 3', которое проводят стандартными способами, например, такими как обработка ацетатом натрия и йодом в присутствии органического растворителя, как это описано в патенте США 3725385 (Abbott Laboratories), или по реакции с диалкилазадикарбоксилатом в ацетоне, которое описано в патенте США 6433151 (Aventis Pharma). Из полученного таким образом 3'-деметилированного производного макролида удаление кладиноза проводят кислотным гидролизом, который осуществляют по известной технологии. Предпочтительно, чтобы удаление кладиноза проводили в присутствии минеральных кислот (таких как, например, серная или соляная кислота) и в присутствии протонного органического растворителя(такого как, например, вода, метанол или этанол). Введение функциональной группы первичного или вторичного амина на позицию 3', которое способствует введению заместителей -Х- и R2, определенных в формуле (I), проводят по методике амидирования, известной квалифицированным в этой области специалистам. В частности, такая методика синтеза касается стандартного получения амидов, сульфонамидов, мочевин, сульфомочевин и уретанов, исходя из аминного субстрата. Предпочтительно, чтобы заместители X и R2 вводились в молекулу одновременно. Например, получение амидных или сульфонамидных производных обычно осуществляется обработкой 3'-деметилированных соединений подходящими ацилхлоридами или сульфонилхлоридами, которую проводят согласно стандартной методике, например, такой как взаимодействие указанных выше соединений в присутствии основания (типа триэтиламина) и органического растворителя (типа дихлорметана или тетрагидрофурана). Помимо этого, получение производных мочевины предпочтительно осуществляют с использованием подходящих изоцианатов в присутствии органического растворителя, такого, как например, дихлорметан. Или же получение производных с более сложными амидными цепочками проводят многостадийным синтезом. Например, 3'-деметилированное производное обрабатывают -хлоралкановой кислотой (уксусной,пропионовой или масляной) и N-циклоэзилкарбодиимидом в присутствии органического растворителя(типа тетрагидрофурана), а полученное производное используют как субстрат для введения концевого участка амидной цепи, в частности, в соединения формулы (I), в которых X представляет собой -С(=O)группу, a R3 представляет собой цепь формулы -(CH2)r-Y-(CH2)m-A. Квалифицированные в данной области специалисты должны проводить эти стадии стандартным и удобным способом, для того чтобы избежать взаимодействия с функциональными группами, присутствие которых возможно на тех позициях, по которым осуществляются структурные модификации. Таким образом, например, возможное введение производных оксима может иметь место сразу после их синтеза, его можно проводить на позиции 3' одновременно с синтезом или это может составлять завершающую стадию синтеза. Что касается удаления кладиноза, то эту реакцию нельзя осуществить после модификации кетонной группы в позиции 9, за этой реакцией может следовать или ей может предшествовать возможное введение оксииминопроизводных на той же позиции, за этим может следовать или этому может предшествовать возможное действие по диметиламиногруппе. Предпочтительно, чтобы гидролиз сахара проводили после деметилирования диметиламиногруппы на позиции 3'. Однако в принципе отсутствуют взаимодействия, которые препятствуют удалению клади-6 010906 ноза на другой промежуточной стадии или в конце процесса синтеза. Как отмечалось выше, соединения формулы (I), являющиеся предметом настоящего изобретения,наделены противовоспалительной активностью и не обладают антибиотической активностью. Фармакологическую активность соединений формулы (I) определяли, используя в качестве модели воспаление кожи, для сравнения были выбраны макролиды типа эритромицина и азитромицина, обладающие как противовоспалительной, так и антибиотической активностью. Противовоспалительную активность оценивали по подавлению вызванного PMA ушного отека у мышей (Phorbol Myristate Acetate). Полученные результаты показали, что соединения, являющиеся предметом настоящего изобретения, имеют не только очень высокую активность в качестве противовоспалительных средств, но и то, что их противовоспалительная активность выше активности сравнительных соединений. Антибиотическую активность in vitro оценивали по способности к подавлению роста штаммов бактерий, чувствительных к эритромицину. Соединения по настоящему изобретению не продемонстрировали антибиотической активности, поэтому их можно использовать для лечения хронических воспалительных процессов, при этом не создается нежелательный фактор резистентности. Таким образом, людям, квалифицированным в данной области знаний, очевидно, что соединения формулы (I), обладающие противовоспалительной активностью и не имеющие антибиотической активности, могут быть полезны при лечении как острых, так и хронических состояний, а также в профилактике воспалительных патологий, в частности патологий, связанных с функциональными изменениями нейтрофилов. К ним, например, относятся ревматоидный артрит, васкулит, гломеронефрит, псориаз, атопический дерматит, язвенный колит, болезнь Хорна, повреждения при ишемической перерфузии, септический шок, атеросклероз, респираторный дистресс-синдром взрослых, хроническое обструктивное заболевание легких и астма. Терапевтически эффективные количества будут зависеть от общего физиологического состояния конкретного пациента, от способа введения и формы фармацевтического состава; обычно терапевтические дозы должны составлять приблизительно от 10 до 2000 мг/день (предпочтительно приблизительно от 30 до 1500 мг/день) Соединения по настоящему изобретению, используемые для лечения и/или профилактики указанных выше патологий, следует применять в фармацевтических формах, пригодных для перорального, ректального, сублингвального, парентального, местного, трансдермального и ингаляционного введения. Следовательно, еще одним предметом настоящего изобретения являются фармацевтические составы, содержащие терапевтически эффективное количество соединения формулы (I) или его соли в смеси с фармацевтически приемлемым носителем. Фармацевтические составы, являющиеся предметом настоящего изобретения, могут представлять собой жидкости, пригодные для перорального и/или парентального введения, например, такие как капли,сиропы, растворы, растворы, готовые для инъекций или получаемые разведением лиофилизата; однако предпочтительны твердые или полутвердые формы, такие как таблетки, капсулы, гранулы, порошки,пилюли, суппозитории, кремы, помады, гели, мази; или растворы, суспензии, эмульсии или иные формы,пригодные для введения ингаляционным или трансдермальным путем. Составы по настоящему изобретению могут содержать некоторые твердые или жидкие наполнители или разбавители, пригодные для фармацевтического использования, а также (если это требуется) другие добавки, обычно применяемые при изготовлении фармацевтических составов, такие как, например,загустители, агрегирующие средства, скользящие вещества, ароматизаторы и красители. Фармацевтические составы, являющиеся предметом настоящего изобретения, можно получить по стандартным методикам. 1Varian Gemini 200 MHz. Химические сдвиги регистрировали в -единицах, в качестве внешних стандартов использовали CHCl3 или ДМСО. Анализы методами ВЭЖХ/МС (жидкостная хроматографии высокого разрешения/массспектрометрия) проводили при использовании аппаратуры Gilson, включающей колонку Gilson XterraRP18 (5 мкм, 4,650 мм), в качестве детектора применяли УФ-диодную матрицу (220 нм), а также массспектрометр Finnigan AQA (впрыск электронов, положительная или отрицательная ионизация) и детектор ELSD (детектор рассеяния света испарительного типа, ИДРС). Использовались следующие условия: скорость тока: 1,2 мл/мин; температура колонки: 40C; градиент элюирования A/B (элюент A: 0,5% муравьиная кислота в воде; элюент В: 0,5% муравьиная кислота в ацетонитриле): t=0 мин, A/В=95:5, t=8 мин, A/В=5:95. Приведенные далее примеры предназначены для лучшей иллюстрации настоящего изобретения. В табл. 1 сведены химические структуры синтетических промежуточных соединений, а также со-7 010906 единений формулы (I). Таблица 1 Пример 1. Получение промежуточного соединения a. К раствору, содержащему 3-O-дезкладинозил-3'-дезметил-9-дигидро-эритромицин A (463 мг,0,82 ммоль), который был получен так, как это описано в находящейся на совместном рассмотрении заявке на патент Италии, поданной 1 августа 2002 г. теми же авторами,М 12002 А 001726; промежуточное соединение 4 и хлоруксусную кислоту (85,4 мг, 0,904 ммоль) в тетрагидрофуране (10 мл), при перемешивании в течение 24 ч добавили N-циклогексилкарбодиимидную смолу, N-метилполиэфир (1,2 г,1,8 ммоль/г). Полученный раствор отфильтровали, промыли ацетонитрилом, а получившийся органический раствор высушили, получив при этом промежуточное соединение а (0,427 г, выход 91%). Это соединение непосредственно использовали для дальнейших реакций.[М+1]+ 640,3. ВЭЖХ-ИДРС: Rt=4,64; степень чистоты согласно ИДРС 84,3%. Пример 2. Получение соединения 1. К суспензии NaH (80 мг, 60%, 2 ммоль) в тетрагидрофуране (10 мл) добавили (4-метоксипиридин-2 ил)-метанол (278 мг, 2 ммоль) и оставили на 45 мин для взаимодействия. Быстро добавили раствор промежуточного соединения а (0,427 мг, 0,67 ммоль) в тетрагидрофуране (5 мл) и оставили на 16 ч для взаимодействия. После проведения кислотных и основных промываний полученное сырое вещество очищали хроматографически на Biotago (40 M колонка, элюент CH2Cl2/MeOH/NH3 30/1/0,1). В результате получили соединение 1 в виде твердого белого вещества (200 мг, выход 40%).[М+1]+ 743,39. ВЭЖХ-ИДРС: Rt=3,61; степень чистоты согласно ИДРС 95,2%. 1H-ЯМР (ДМСО-d6): 8,28, 6,99 и 6,86 (3m, 3H, пиридин); 4,52 (m, 1 Н, H1'); 3,93 (s, 1 Н, H11); 3,80 (s,3H, CH3O); 3,28 (s, 3H, MeN); 0,70 (t, 3H, J=7,2 Гц, Н 15). ТСХ (CH2Cl2/MeOH/NH3 9/1/0,1) Rf=0,3. Пример 3. Получение соединения 2. К раствору 3-O-дезкладинозил-3'-дезметил-9-дигидроэритромицина A (300 мг, 0,532 ммоль) и триэтиламина (110 мкл, 0,784 ммоль) в тетрагидрофуране (3 мл) по каплям добавляли раствор фенилацетилхлорида (71 мкл 0,532 ммоль) в тетрагидрофуране (1 мл). Процесс осуществлялся при 0 С, получившую- 13010906 ся в результате смесь оставили на 8 ч для перемешивания. Взаимодействие осуществляли при добавлении метанола с последующим выпариванием растворителя при пониженном давлении. Полученный сырой продукт разбавляли этилацетатом (50 мл), органическую фазу промывали 2 н. HCl (330 мл) и K2CO3 10% (230 мл). Получившийся органический раствор высушили над безводным Na2SO4, отфильтровали,а растворитель выпарили при пониженном давлении. Было получено твердое вещество, которое очистили хроматографически на Biotage (колонка 12 М, элюент CH2Cl2/MeOH 30/1), получив в результате соединение 2 (217 мг, выход 60%) в виде твердого вещества белого цвета.[М+1]+=682,91. ВЭЖХ-ИДРС: Rt=5,90 мин; степень чистоты согласно ИДРС 100%. 1H-ЯМР (CDCl3): 7,3-7,2 (m, 5 Н, Ph); 3,82 (s, 1 Н, H11); 2,85 (s, 3H, MeN); 2,66 (m, 2H, CH2Ph); 0,87 (t,3H, J=7,4 Гц, H15). ТСХ (CH2Cl2/MeOH 9/1) Rf=0,6. Пример 4. Получение соединения 3. К раствору 3-O-дезкладинозил-3'-дезметил-9-дигидроэритромицина A (66 мг, 0,117 ммоль) и триэтиламина (33 мкл, 0,235 ммоль) в CH2Cl2 (3 мл) по каплям при 0 С добавляли раствор бензоилхлорида(16,5 мг, 0,117 ммоль) в CH2Cl2 (1 мл). Полученную смесь оставили при перемешивании на 8 ч. Реакционную смесь разбавили диэтилацетатом (50 мл), а органическую фазу промыли 2 н. HCl(330 мл), K2CO3 10% (230 мл). Полученную органическую фазу высушили над безводным Na2SO4, отфильтровали, а растворитель выпарили. В результате получили соединение 3 (55 мг, выход 70%) в виде твердого вещества белого цвета.[М+1]+ 668,63. ВЭЖХ-ИДРС: Rt=6,05 мин; степень чистоты согласно ИДРС 97,0%. 1H-ЯМР (CDCl3): 7,3-7,2 (m, 5 Н, Ph); 4,54 (d, 1 Н, J=7,3 Гц, H1'); 3,78 (s, 1H, Н 11); 2,89 (s, 3H, MeN); 0,88 (t, 3H, J=7,1 Гц, H15). ТСХ (CH2Cl2/MeOH 20/1) Rf=0,4. Пример 5. Получение соединения 4. Соединение 4 синтезировали исходя из 3-O-дезкладинозил-3'-дезметил-9-дигидроэритромицина A(300 мг, 0,532 ммоль) и 2-фуранилхлорида (70 мг, 0,532 ммоль), следуя методике, использованной для получения соединения 3. Соединение 4 (315 мг, выход 90%) получили в виде твердого вещества белого цвета.[М+1]+ 658,57. ВЭЖХ-ИДРС: Rt=5,48; степень чистоты согласно ИДРС 99,4%. 1(s, 1H, H11); 3,15 (s, 3H, MeN); 0,90 (t, 3H, J=7,4 Гц, H15). ТСХ (CH2Cl2/MeOH 10/1) Rf=0,5. Пример 6. Получение соединения 5. Соединение 5 синтезировали из 3-O-дезкладинозил-3'-дезметил-9-дигидроэритромицина A (300 мг,0,532 ммоль) и 2-тиофенацетилхлорида (85 мг, 0,53 ммоль), следуя методике, использованной для получения соединения 3. Соединение 5 (269 мг, выход 74%) получили в виде твердого вещества белого цвета.[М+1]+ 688,62. ВЭЖХ-ИДРС: Rt=5,96; степень чистоты согласно ИДРС 95,2%. 1 Н-ЯМР (CDCl3): 7,20 (m, 1H, тиофен); 6,9 (m, 2H, тиофен); 3,87 (s, 1H, H11); 2,94 (s, 3H, MeN); 2,77(m, 2H, CH2CO); 0,90 (t, 3H, J=7,4 Гц, H15). ТСХ (CH2Cl2/MeOH 10/1) Rf=0,5. Пример 7. Получение соединения 6. Соединение 6 синтезировали из 3-O-дезкладинозил-3'-дезметил-9-дигидроэритромицина A (300 мг,0,532 ммоль) и п-толуилхлорида (82 мг, 0,532 ммоль), следуя методике, использованной для получения соединения 3. Соединение 6 (350 мг, выход 95%) получили в виде твердого вещества белого цвета.[М+1]+ 682,61. ВЭЖХ-ИДРС: Rt=6,02; степень чистоты согласно ИДРС 99,9%. 1- 14010906 для получения соединения 3. Очистку полученного сырого продукта проводили хроматографически наBiotage (колонка 12 М Cartridge, элюент CH2Cl2/MeOH 30/1). Было получено соединение 7 (320 мг, выход 80%) в виде твердого вещества белого цвета.[M+l]+ 669,6 ВЭЖХ-ИДРС: Rt=4,75; степень чистоты согласно ИДРС 99,0%. 1H-ЯМР (CDCl3): 8,8-8,9 (m, 2 Н, пиридин); 7,80 е 7,37 (2m, 2H, pyridine); 3,00 е 2,94 (2s, 3H, конформеры MeN); 0,90 (t, 3H, J=73 Гц, H15). ТСХ (CH2Cl2/MeOH 10/1) Rf=0,3. Пример 9. Получение соединения 8. Соединение 8 синтезировали из 3-O-дезкладинозил-3'-дезметил-9-дигидроэритромицина A (300 мг,0,532 ммоль) и фенилацетилхлорида (105 мг, 0,532 ммоль), следуя методике, использованной для получения соединения 3. Очистку полученного сырого продукта проводили хроматографически на Biotage(колонка 12 М, элюент CH2Cl2/MeOH 40/1). Было получено соединение 8 (253 мг, выход 66%) в виде твердого вещества белого цвета.[М+1]+ 714,82. ВЭЖХ-ИДРС: Rt=7,49; степень чистоты согласно ИДРС 97,0%; 1H-ЯМР (CDCl3): 7,4-7,5 (m, 2H, Ph); 7,2-7,35 (m, 2H, Ph.); 4,60 (m, 1H, H13); 4,50 (d, 1H, J=7,4 Гц,H1'); 3,84 (s, 1H, H11); 3,77 (m, 2H, CH2S); 2,96 (s, 3H, MeN); 0,90(t, 3H, J=7,3 Гц, H15). ТСХ (CH2Cl2/MeOH 10/1) Rf=0,45. Пример 10. Получение соединения 9. Соединение 9 синтезировали из 3-O-дезкладинозил-3'-дезметил-9-дигидроэритромицина A (150 мг,0,266 ммоль) и октаноилхлорида (43 мг, 0,266 ммоль), следуя методике, использованной для получения соединения 3. Очистку полученного сырого продукта проводили хроматографически на Biotage (колонка 12 М, элюент CH2Cl2MeOH 40/1). Было получено соединение 9 (91 мг, выход 59%) в виде вязкого твердого вещества белого цвета.[М+1]+690,82. ВЭЖХ-ИДРС: Rt=6,94; степень чистоты согласно ИДРС 99,9%; 1 Н-ЯМР (CDCl3): 4,50 (d, 1 Н, J=7,4 Гц, H1'); 3,86 (s, 1H, H11); 2,91 (s, 3H, MeN); 0,93-0,84 (m, 6H, CH3(150 мг, 0,266 ммоль) и циклоэзаноилхлорида (39 мг, 0,266 ммоль), следуя методике, использованной для получения соединения 3. Очистку полученного сырого продукта проводили хроматографически наBiotage (колонка 12 М, элюент CH2Cl2/MeOH 40/1). Было получено соединение 10 (150 мг, выход 86%) в виде твердого вещества белого цвета.[М+1]+ 674,7. ВЭЖХ-ИДРС: Rt= 5,98; степень чистоты согласно ИДРС 99,9%; 1(150 мг, 0,266 ммоль) и метилсульфонилхлорида (31 мг, 0,266 ммоль), следуя методике, использованной для получения соединения 3. Соединение 11 (112 мг, выход 67%) было получено в виде твердого вещества белого цвета.[М+1]+ 642,57. ВЭЖХ-ИДРС: Rt=5,46; степень чистоты согласно ИДРС 99,0%; 1 Н-ЯМР (CDCl3): 4,57 (m, 1 Н, Н 13); 4,44 (d, 1 Н, J=7,4 Гц, H1'); 3,85 (s, 1H, H11); 2,93 (s, 3H, MeN); 2,85 (s, 3H, MeSO2); 0,90 (t, 3H, J=7,4 Гц, H15). ТСХ (CH2Cl2/MeOH 10/1) Rf=0,5. Пример 13. Получение соединения 12. Соединение 12 синтезировали из 3-O-дезкладинозил-3'-дезметил-9-дигидроэритромицина A(300 мг, 0,532 ммоль) и п-толуолсульфонилхлорида (101 мг, 0,532 ммоль), следуя методике, использованной для получения соединения 3. Очистку полученного сырого продукта проводили хроматографически на Biotage (колонка 12 М, элюент CH2Cl2/MeOH 40/1). Было получено соединение 12 (250 мг, выход 60%) в виде твердого вещества белого цвета.[М+1]+ 718,77. ВЭЖХ-ИДРС: Rt=7,71; степень чистоты согласно ИДРС 97,2%. 1 Н-ЯМР (CDCl3): 7,75 (m, 2H, MePh); 7,35 (m, 2H, PhSO2); 4,6-4,5 (m, 1H, H13); 4,51 (d, 1 Н, J=7,3 Гц,H1'); 3,88 (s, 1H, H11); 2,77 (s, 3H, MeN); 2,43 (s, 3H, CH3Ph); 0,90(t, 3H, J=7,4 Гц, H15). ТСХ (CH2Cl2/MeOH 10/1) Rf=0,5. Пример 14. Получение соединения 13. К раствору 3-O-дезкладинозил-3'-дезметил-9-дигидроэритромицина A (150 мг, 0,266 ммоль) вCH2Cl2 (2 мл) по каплям при 0 С добавляли раствор этилизоцианата (18,9 мг, 0,266 ммоль). Смесь оставили для взаимодействия при комнатной температуре на 16 ч, затем провели разведение этилацетатом(30 мл) и промывание 1 н. HCl (320 мл) и K2CO3 10% (220 мл). Полученную органическую фазу высушили над безводным Na2SO4, отфильтровали, а растворитель выпарили при пониженном давлении. Очистку полученного сырого продукта проводили хроматографически на Biotage (колонка 12 М, элюентCH2Cl2/MeOH 40/1). Было получено соединение 13 (120 мг, выход 70%) в виде твердого вещества белого цвета.[М+1]+ 674,7. ВЭЖХ-ИДРС: Rt=4,93; степень чистоты согласно ИДРС 99,0%. 1(150 мг, 0,266 ммоль) и фенилизоцианата (31,7 мг, 0,266 ммоль), следуя методике, использованной для получения соединения 13. Соединение 14 (175 мг, выход 95%) было получено в виде твердого вещества белого цвета.[М+1]+ 683,62. ВЭЖХ-ИДРС: Rt=6,21; степень чистоты согласно ИДРС 96,0%; 1H-ЯМР (CDCl3): 7,25-7,36 (m, 3H, Ph); 7,0-7,1 (m, 2H, Ph); 4,55 (m, 1H, H13); 4,25 (d, 1H, J=7,4 Гц,H1'); 3,74 (s, 1H, H11); 2,84 (s, 3H, MeN); 0,90 (t, 3H, J=7,3 Гц, H15). ТСХ (CH2Cl2/MeOH 20/1) Rf=0,2. Пример 16. Получение промежуточного соединения b. Суспензию кларитмицина (5 г, 6,7 ммоль) в метаноле (150 мл) выдерживали под слабым током N2 при механическом перемешивании. Добавляли ацетат натрия (0,66 г, 8 ммоль) и йод (2,03 г, 8 ммоль), на полученную в результате смесь воздействовали светом 400 Вт лампы. С помощью ледяной бани температуру поддерживали в пределах 10-20 С. Спустя 6 ч при пониженном давлении упарили растворитель, а сырой продукт вместе с 5% этилацетатом и метабисульфитом натрия в воде подвергли экстрации. Водную фазу подщелочили, добавив аммиак, а затем еще раз экстрагировали дихлорметаном. Органическую фазу высушили над безводнымNa2SO4, отфильтровали и упарили растворитель. Полученный сырой продукт (5,1 г) очистили хроматографически на Biotage (Silica 40 M cartridge, элюент CH2Cl2/MeOH/NH3 вначале в соотношении 100/3/0,3,а затем в соотношении 100/5/0,5) и получили промежуточное соединение b (3,2 г, 4,36 ммоль; выход 65%).[М+1]+ 734,83. ВЭЖХ-ELDS: Rt=3,60 мин; степень чистоты согласно ИДРС 99,9%. 1H-ЯМР(CDCl3) 5,05 (m, 1H, Н 13); 4,92 (d, 2H, J=4,5 Гц, Н 1); 4,41 (d, 2H, J=7,5 Гц, H1'); 3,98 (s, 1H,H11); 3,32 (s, 3H, Н 7"); 3,03 (s, 3H, СН 3 clarithro); 2,41 (s, 3H, MeN); 0,84 (t, 3H, J=7,4 Гц, H15). Пример 17. Получение промежуточного соединения c. Промежуточное соединение b (2 г, 2,72 ммоль) растворили в 1 н. растворе HCl (50 мл, 50 ммоль) и оставили при комнатной температуре при перемешивании на 2 ч. Получившийся раствор подщелочили концентрированным NH3, экстрагировали этилацетатом (350 мл). Органическую фазу высушили над безводным Na2SO4, отфильтровали, а растворитель упарили. В результате было получено промежуточное соединение c (1,56 г, выход 90%).[М+1]+ 576,48. ВЭЖХ-ИДРС: Rt=2,80 мин; степень чистоты согласно ИДРС 98%; 1- 16010906 Соединение 15 синтезировали из промежуточного соединения с (180 мг, 0,311 ммоль) и бензоилхлорида (43,7 мг, 0,311 ммоль), следуя методике, использованной для получения соединения 3. Полученный сырой продукт очищали хроматографически на диоксиде кремния (колонка Varian Mega-bond Elut,элюент: вначале CH2Cl2, затем CH2Cl2/MeOH 25/1). Было получено соединение 15 (91 мг, выход 59%) в виде твердого вещества белого цвета.[М+1]+ 682,58. ВЭЖХ-ИДРС: Rt=5,86; степень чистоты согласно ИДРС 99,9%; 1 Н-ЯМР (CDCl3): 7,4 (m, 5 Н, Ph); 5,16 (m, 1 Н, Н 13); 4,55 (d, 1 Н, J=7,0 Гц, H1'); 3,92 (s, 1H, H11); 2-96(s, 3H, CH3 clarithro); 2,90 (s, 3H, MeN); 0,83 (t, 3H, J=7,4 Гц, H15). ТСХ (CH2Cl2/MeOH 20/1) Rf=0,3. Пример 19. Получение соединения 16. Соединение 16 синтезировали из промежуточного соединения с (180 мг, 0,311 ммоль) и 4-фторбензоилхлорида (49,6 мг, 0,311 ммоль), следуя методике, использованной для получения соединения 3. Очистку полученного сырого продукта проводили хроматографически на диоксиде кремния (колонка Varian Mega-bond Elut, элюент: вначале CH2Cl2, затем CH2Cl2/MeOH 25/1). Было получено соединение 16 (130 мг, выход 60%) в виде твердого вещества белого цвета.[М+1]+ 697,5/ ВЭЖХ-ИДРС: Rt=6,01; степень чистоты согласно ИДРС 99,9%; 1H-ЯМР (CDCl3): 7,49-7,41 (m, 2H, F-Ph); 7,14-7,04 (m, 2H, PhCO); 5,17 (m, 1H, H13); 4,55 (d, 1H,J=7,1, H1'); 3,93 (s, 1H, H11); 2,96 (s, 3H, CH3 clarithro); 2,90 (s, 3H, MeN); 0,83 (t, 3H, J=7,3 Гц, H15). ТСХ (CH2Cl2/MeOH 20/1) Rf=0,3. Пример 20. Получение промежуточного соединения d. К гомогенному раствору оксима эритромицина A (7,49 г, 10 ммоль) в ацетоне (150 мл, обезвожен на молекулярных ситах в 3 ) по каплям добавляли раствор диэтилазадикарбоксилата (1,8 мл, 1,05 ммоль) в ацетоне (5 мл). Полученный раствор оставили при комнатной температуре на 24 ч для осуществления взаимодействия. После этого растворитель выпарили при пониженном давлении, получившийся сырой продукт вновь взяли вместе с 5 н. NH4Cl в H2O (3 мл) и оставили для взаимодействия на 1 ч. После этого провели подщелачивание 10% K2CO3 (200 мл) и экстрагирование этилацетатом (3200 мл). Органическую фазу высушили над безводным Na2SO4, отфильтровали, а растворитель выпарили. После очистки методом хроматографии, проведенной на Biotage (колонка 40 М, элюент CH2Cl2/MeOH/NH3 95/5/0,5),было получено промежуточное соединение d (5,5 г, выход 75%).[М+1]+735,77. ВЭЖХ-ИДРС: Rt=4,31; степень чистоты согласно ИДРС 99,0%; 1 Н-ЯМР (CDCl3): 7,6-8,4 (уширенный s, 1 Н, =N-OH); 5,07 (m, 1 Н, H13); 4,91 (d, 1H, J=4,2 Гц, Н 1'); 4,37 (d, 1H, J=7,4 Гц, H1'); 3,30 (s, 3H, H7"); 2,40 (s, 3H, MeN); 1,51 (s, 3H, H18); 0,84 (m, 3H, H15). ТСХ (CH2Cl2/MeOH/NH3 90/10/1) Rf=0,35. Пример 21. Получение промежуточного соединения e. К раствору промежуточного соединения d (4,65 мг, 6,33 ммоль) в метаноле (130 мл) по каплям добавляли 37% соляную кислоту (2,2 мл), получившуюся смесь оставили для перемешивания в течение 2 ч. С помощью 30% NH3 (2,5 мл) значение рН довели до рН 7 и растворитель удалили при пониженном давлении. Полученный сырой продукт очищали хроматографически на Biotage (колонка 40 М, элюентCH2Cl2/MeOH/NH3 95/5/0,5). Было получено промежуточное соединение e (3,2 г, степень чистоты ИДРС,выход 88%) в виде твердого вещества белого цвета.[М+1]+ 577,57. ВЭЖХ-ИДРС: Rt=3,51; степень чистоты согласно ИДРС 99,0%: 1H-ЯМР (CDCl3): 5,17 (m, 1 Н, Н 13); 4,44 (d, 1 Н, J=7,6 Гц, H1'); 3,71 (s, 1H, H11); 2,39 (s, 3H, MeN); 1,44 (s, 3H, H18); 0,8-0,9 (m, 3H, H15). ТСХ (CH2Cl2/MeOH/NH3 90/10/1) Rf=0,25. Пример 22. Получение соединения 17. К раствору промежуточного соединения e (100 мг, 0,174 ммоль) и триэтиламина (49 мкл,0,35 ммоль) в CH2Cl2 (3 мл) по каплям добавляли пивалоилхлорид (23,0 мг, 0,191 ммоль), получившуюся смесь оставили при перемешивании на 2 ч. Затем провели разбавление этилацетатом (50 мл), органическую фазу промыли 2 н. HCl (330 мл) и 10% K2CO3 (230 мл), высушили над безводным Na2SO4, отфильтровали, а растворитель выпарили. В результате хроматографической очистки на диоксиде кремния(колонка Varian Mega-bond Elut, элюент CH2Cl2/MeOH 98/2) было получено соединение 17 (50 мг, выход 46%) в виде твердого вещества белого цвета.- 17010906 ВЭЖХ-ИДРС: Rt=6,56; степень чистоты согласно ИДРС 98,0%; 1H-ЯМР (CDCl3): 5,24 (m, 1 Н, Н 13); 4,45 (d, 1 Н, J=7,2 Гц, H1'); 3,79 (s, 1H, H11); 3,00 (s, 3H, MeN); 1,41 (s, 3H, H18); 1,29 (s, 9H, tBuCO-N); 1,24 (s, 9H, tBuCO-O); 0,80-0,88 (m, 3H, H15). Пример 23. Получение соединения 18. Соединение 18 синтезировали из промежуточного соединения e (170 мг, 0,295 ммоль) и ацетилхлорида (28 мг, 0,350 ммоль), следуя методике, использованной для получения соединения 17. В результате хроматографической очистки на диоксиде кремния (элюент CH2Cl2/MeOH 95/5) было получено соединение 18 (100 мг, выход 51%) в виде твердого вещества белого цвета.[М+1]+ 661,68. ВЭЖХ-ИДРС: Rt=4,90; степень чистоты согласно ИДРС 96,0%; 1 Н-ЯМР (CDCl3): 5,35 (m, 1 Н, Н 13); 4,37 (d, 1 Н, J=7,2 Гц, H1'); 3,81 (s, 1H, H11); 3,00 (s, 3H, MeN); 2,15 (s, 3H, CH3CO-N); 2,11 (s, 3H, CH3CO-O); 1,48 (s, 3H, H18); 0,79-0,87 (m, 3H, H15). Пример 24. Получение соединения 19. Соединение 19 синтезировали из промежуточного соединения е (110 мг, 0,191 ммоль) и метоксиацетилхлорида (23,5 мг, 0,21 ммоль), следуя методике, использованной для получения соединения 17. В результате хроматографической очистки на диоксиде кремния (5 г колонка Varian Mega-bond Elut, элюент CH2Cl2/MeOH 98/2) было получено соединение 19 (20 мг, 16% выход) в виде твердого вещества белого цвета.[М+1]+ 649,58. ВЭЖХ-ИДРС: Rt=4,78; степень чистоты согласно ИДРС 99,9%; 1 Н-ЯМР (CDCl3): 5,21 (m, 1 Н, H13); 4,50 (d, 1H, J=7,4 Гц, H1'); 3,69 (s, 1H, H11); 3,42 (s, 3H, CH3O); 2,90 (s, 3H, MeN); 1,45 (s, 3H, H18); 0,83 (t, 3H, J=7,4 Гц, H15). Пример 25. Получение соединения 20. Соединение 20 синтезировали из промежуточного соединения e (100 мг, 0,173 ммоль) и п-анизилхлорида (29,6 мг, 0,173 ммоль), следуя методике, использованной для приготовления соединения 17. После хроматографической очистки на диоксиде кремния (5 г колонка Varian Mega-bond Elut,элюент CH2Cl2/MeOH 98/2) было получено соединение 20 (70 мг, выход 57%) в виде твердого вещества белого цвета. ВЭЖХ-ИДРС: Rt=5,82; степень чистоты согласно ИДРС 99,9%; 1 Н-ЯМР (CDCl3): 7,8-8,6 (уширенный s, 1H, =N-OH); 7,42 (m, 2H, MeOPh); 6,90 (m, 2H, PhCO); 5,20(m, 1H, H13); 3,83 (s, 3H, CH3O); 3,69 (s, 1H, H11); 2,93 (s, 3H, MeN); 1,46 (s, 3H, H18); 0,78-0,88 (m, 3H,H15). Пример 26. Получение соединения 21. Соединение 21 синтезировали из промежуточного соединения e (110 мг, 0,191 ммоль) и п-анизилхлорида (35 мг, 0,2 ммоль), следуя методике, использованной для приготовления соединения 17. После хроматографической очистки на диоксиде кремния (5 г колонка Varian Mega-bond Elut, элюентCH2Cl2/MeOH 98/2) было получено соединение 21 (80 мг, выход 55%) в виде твердого вещества белого цвета.[М+1]+ 845,88. ВЭЖХ-ИДРС: Rt=5,78; степень чистоты согласно ИДРС 99%; 1 Н-ЯМР (CDCl3): 8,01 (m, 2H, MeOPh'); 7,40 (m, 2H, MeOPh); 6,95 (m, 2H, Ph'CO-O); 6,88 (m, 2H,PhCO-N); 5,28 (m, 1H, H13); 3,88 (s, 3H, CH3OPh'); 3,83 (s, 3H, CH3OPh); 2,91 (s, 3H, MeN); 0,85 (m, 3H,H15). Пример 27. Получение соединения 22. Соединение 22 синтезировали из промежуточного соединения е (100 мг, 0,173 ммоль) и гидрохлорида никотилхлорида (36 мг, 0,173 ммоль), следуя методике, использованной для приготовления соединения 17. После хроматографической очистки на диоксиде кремния (5 г колонка Varian Mega-bond Elut,элюент CH2Cl2/MeOH 98/2) было получено соединение 22 (60 мг, выход 51%) в виде твердого вещества белого цвета.[М+1]+682,58. ВЭЖХ-ИДРС: Rt=5,78; степень чистоты согласно ИДРС 96%; 1 Н-ЯМР (ДМСО-d6): 10,62 (уширенный s, 1H, =N-OH); 8,54-8,59 (m, 2H, пиридин); 7,75-7,80 (m, 1 Н,пиридин); 7,44-7,47 (m, 1 Н, пиридин); 5,05 (m, 1 Н, H13); 3,88 (s, 1H, H11); 2,85 (s, 3H, MeN). Пример 28. Получение соединения 23. Соединение 23 синтезировали из промежуточного соединения e (200 мг, 0,347 ммоль) и 2-тиофенкарбонилхлорида (35 мг, 0,347 ммоль), следуя методике, использованной для приготовления- 18010906 соединения 17. После хроматографической очистки на диоксиде кремния (5 г колонка Varian Mega-bondElut, элюент CH2Cl2/MCOH 98/2) было получено соединение 23 (100 мг, выход 42%) в виде твердого вещества белого цвета.[М+1]+ 687,61. ВЭЖХ-ИДРС: Rt=5,78; степень чистоты согласно ИДРС 98%; 1 Н-ЯМР (ДМСО-d6): 10,63 (уширенный s, 1H, =N-OH); 7,70, 7,41 и 7,08 (3m, 3H, тиофен); 5,14 (m,1 Н, H13); 4,40 (d, 1H, J=7,3 Гц, H1'); 3,57 (s, 1H, H11); 2,92 (s, 3H, MeN); 0,71 (t, 3H, J=7,3 Гц, H15). Пример 29. Получение соединения 24. Соединение 24 синтезировали из промежуточного соединения е (200 мг, 0,347 ммоль) и 2-тиофенкарбонилхлорида (102 мг, 0,694 ммоль), следуя методике, использованной для приготовления соединения 17. После хроматографической очистки на диоксиде кремния (5 г колонка Varian Mega-bondElut, 5 элюент CH2Cl2/MeOH 98,5/1) было получено соединение 24 (150 мг, выход 54%) в виде твердого вещества белого цвета.[М+1]+ 797,61. ВЭЖХ-ИДРС: Rt=6,66; степень чистоты согласно ИДРС 98%; 1 Н-ЯМР (ДМСО-d6): 7,99, 7,88, 7,70, 7,41, 7,26 и 7,09 (6m, 6H, 2 тиофен); 5,22 (m, 1 Н, Н 13); 4,36 (d,1 Н, J=7,3 Гц, H1'); 2,91 (S, 3H, MeN); 0,72 (t, 3H, J=7,4 Гц, Н 15). Пример 30. Получение соединения 25. Соединение 25 синтезировали из промежуточного соединения e (200 мг, 0,347 ммоль) и 2-тиофенацетилхлорида (55,7 мг, 0,347 ммоль), следуя методике, использованной для получения соединения 17. После хроматографической очистки на диоксиде кремния (5 г колонка Varian Mega-bond Elut,элюент CH2Cl2/MeOH 98/2) было получено соединение 25 (80 мг, выход 33%, степень чистоты 95%) в виде твердого вещества белого цвета.[М+1]+ 701,62. ВЭЖХ-ИДРС: Rt=5,84; степень чистоты согласно ИДРС 98%. Пример 31. Получение соединения 26. Соединение 26 синтезировали из промежуточного соединения с (200 мг, 0,347 ммоль) и пивалоилхлорида (36,2 мг, 0,30 ммоль), следуя методике, использованной для получения соединения 3. После хроматографической очистки на диоксиде кремния (элюент CH2Cl2/MeOH вначале в соотношении 99/1, затем в соотношении 98/2) было получено соединение 26 (33 мг, выход 17%) в виде твердого вещества белого цвета.[М+1]+661,65. ВЭЖХ-ИДРС: Rt=5,90; степень чистоты согласно ИДРС 99,1%; 1 Н-ЯМР (CDCl3): 5,20 (m, 1 Н, Н 13); 4,47 (d, 1 Н, J=7,3 Гц, H1'); 3,70 (s, 1H, H11); 2,99 (s, 3H, MeN); 1,46 (s, 3H, H18); 1,29 (s, 9H, tBu); 0,80-0,92 (m, 3H, H15). Пример 32. Получение соединения 27. Соединение 27 (35 мг, выход 13%) было получено и выделено в процессе синтеза и очистки соединения 25.[М+1]+ 825,71. ВЭЖХ-ИДРС: Rt=6,76; степень чистоты согласно ИДРС 96%; 1 Н-ЯМР (CDCl3): 7,15-7,25 ( (m, 2H, тиофен); 6,87-7,00 (m, 4 Н, тиофен); 5,25 (m, 1H, H13); 4,43 (d,1 Н, J=7,2 Гц, H1'); 3,95 (m, 4H, 2CH2CO); 3,79 (s, 1H, H11); 2,97 (s, 3H, MeN); 0,8-0,9 (m, 3H, H15). Пример 33. Получение соединения 28. Соединение 28 синтезировали из промежуточного соединения e (200 мг, 0,347 ммоль) и 2-хлорникотилхлорида (61 мг, 0,347 ммоль), следуя методике, использованной для получения соединения 17. После хроматографичесекой очистки на диоксиде кремния (5 г колонка Varian Mega-bond Elut,элюент CH2Cl2/MeOH 99/1) было получено соединение 28 (100 мг, выход 40%) в виде твердого вещества белого цвета.[М+1]+ 716,65. ВЭЖХ-ИДРС: Rt=5,40; степень чистоты согласно ИДРС 95%; 1 Н-ЯМР (CDCl3): 8,42, 7,60 и 7,31 (3m, 3H, пиридин); 5,19 (m, 1 Н, H13); 4,50 (d, 1H, J=7,3 Гц, H1'); 2,91 (s, 3H, McN). Пример 34. Получение соединения 29. Соединение 29 синтезировали из промежуточного соединения e (200 мг, 0347 ммоль) и 3-метилизоксазол-5-карбонилхлорида (44 мг, 0,347 ммоль), следуя методике, использованной для получения соединения 17. После хроматографической очистки на диоксиде кремния (5 г колонка VarianMega-bond Elut, элюент CH2Cl2/MeOH 99/1) было получено соединение 29 (130 мг, выход 63%) в виде твердого вещества белого цвета.[М+1]+ 689,59. ВЭЖХ-ИДРС: Rt=5,44; степень чистоты согласно ИДРС 98%; 1 Н-ЯМР (CDCl3): 7,25 (s, 1 Н, оксазол); 5,19 (m, 1 Н, H13); 4,46 (d, 1H, J=7,3 Гц, H1'); 3,16 (s, 3H, MeN); 2,44 (s, 3H, CH3-ossaz.); 0,86 (t, 3H, J=7,3 Гц, H15). Пример 35. Фармакологическая активность in vivo. А) Острый контактный дерматит. Животные. Использовалась группа из 5 мышей CD1 (18-24 г). Введение соединений. Все производные макролидов растворили в носителе TPDS, содержащем 10% бензоилхлорида, 40% ацетона и 50% изопропанола. На внешнюю поверхность уха мышей нанесли по 15 мкл соединений, растворенных в TPDS; спустя 30 мин на ту же зону было нанесено 12 мкл 0,01% раствора ацетата тетрадеканоилфорбола (TPA), растворенного в ацетоне. Все животные были умерщвлены 6 ч спустя с помощью ингаляции CO2. Оценка полученных резульатов. Уровень отека определяли путем вычитания веса ушной пазухи необработанного уха из веса той же зоны обработанного противоположного уха. Для того чтобы определить уровень ремиссии отека разницу в весе для групп, в которых проводили обработку TPA+макролиды, сравнивали с разницей для группы, в которой проводили обработку только TPA. Активность макролидов измеряли, используя модифицированный метод Zunic et coll (1998): MDL(Lysyl) GDP, ингибирует мурамилдипептидные производные, продуцирование цитокинов активированными макрофагами и защищает мышей от воспаления, вызванного эфиром форбола и оксазолоном (J.Invest Dermatol, 111(1), 77-82). Данные, касающиеся эритромицина, относятся к обработке единичной дозой, которая составляла 500 мкг/ухо. Результаты, полученные для соединений формулы (I), приведены в табл. 2.R представляет собой атом водорода или метил;R1 представляет собой атом водорода или (C1-C3)алкильную группу;R2 представляет собой атом водорода,(C1-C4)алкокси(C1-C4)алкильную группу,(C5-C7)циклоалкильную группу, фенил либо 5- или 6-членный гетероарил, содержащий от 1 до 3 гетероатомов, выбранных из азота, кислорода и серы, фенил(C1-C4)алкильную или гетероарил(C1-C4)алкильную- 21010906 группу, необязательно замещенную 1-3 заместителями, выбранными из (C1-C4)алкильной группы,(C1-C4)алкоксильной группы и галогена, или цепь формулы где A представляет собой фенил либо 5- или 6-членный гетероарил, содержащий от 1 до 3 гетероатомов,выбранных из азота, кислорода и серы, причем оба необязательно замещены 1-3 заместителями, выбранными из (C1-C4)алкильной группы, (C1-C4)алкоксильной группы или галогена;Y представляет собой O, S или NR6, где R6 - атом водорода, линейная или разветвленная (C1C3)алкильная, (C1-C3)алкоксикарбонильная группа или бензилоксикарбонильная группа;r - целое число от 1 до 3;m - целое число от 0 до 3;R3 представляет собой гидроксигруппу либо R3 вместе с R4 образуют (=O) группу или =N-O-R5 группу, в которой R5 представляет собой атом водорода, (C1-C4)алкильную группу, бензил, или группу X-R2, в которой X и R2 имеют упомянутые выше значения;R4 представляет собой атом водорода либо R4 вместе с R3 образуют (=O) группу или =N-O-R5 группу, в которой R5 имеет упомянутые выше значения; и кроме того, R2 представляет собой (C1-C10)алкильную группу или (C4-C10)алкильную группу, если одновременно X представляет собой группу -C(=O)-, R1 представляет собой (C1-C3)алкильную группу, aR3 представляет собой гидроксигруппу или R3 вместе с R4 образуют =N-O-R5 группу, в которой R5 отличен от -X-R2; а также его фармацевтически приемлемые соли. 2. Соединение по п.1, отличающееся тем, что R, R1 и R2 имеют значения, определенные формулой(I), X представляет собой -C(=O)-, -C(=O)-NH- или -SO2-группу, а R3 представляет собой гидроксигруппу либо R3 вместе с R4 образуют (=O) группу, или =N-O-R5 группу, в которой R5 представляет собой атом водорода, метил, бензил, или группу -X-R2, в которой X и R2 имеют значения, указанные в формуле (I). 3. Соединение по п.2, отличающееся тем, что R1 представляет собой атом водорода или метил, a R5 представляет собой атом водорода или группу -X-R2, в которой X и R2 имеют значения, указанные в формуле (I). 4. Соединение по п.3, отличающееся тем, что R2 представляет собой атом водорода,(C1-C4)алкокси(C1-C4)алкильную группу, (C5-C7)циклоалкильную группу, фенил либо 5- или 6-членный гетероарил, содержащий от 1 до 3 гетероатомов, выбранных из азота, кислорода и серы,фенил(C1-C4)алкильную или гетероарил(C1-C4)алкильную группу, необязательно замещенную 1-3 заместителями, выбранными из (C1-C4)алкильной группы, (C1-C4)алкоксильной группы и галогена, или цепь формулы в которой A представляет собой фенил или гетероарил, выбранный из фурана, тиофена, оксазола, имидазола, пиридина, пиримидина и триазола, причем оба необязательно замещены 1-3 заместителями, выбранными из (C1-C4)алкильной группы, (C1-C4)алкоксильной группы или галогена;Y представляет собой O, S или NR6, где R6 - атом водорода или метил;r - целое число от 1 до 3;m - целое число от 0 до 3; и кроме того, R2 представляет собой (C1-C10)алкильную группу или (C4-C10)алкильную группу, если одновременно X представляет собой группу -C(=O)-, R1 представляет собой (C1-C3)алкильную группу, aR3 представляет собой гидроксигруппу или R3 вместе с R4 образуют =N-O-R5 группу, в которой R5 отличен от -X-R2. 5. Соединение по п.1, отличающееся тем, что R1 представляет собой метил, R2 представляет собой метокси(C1-C3)алкильную группу, (C5-C7)циклоалкильную группу, фенил или гетероарил, выбранный из фурана, тиофена, оксазола и пиридина, бензил или гетероарил(C1-C4)алкильную группу, необязательно замещенную заместителем, выбранным из (C1-C4)алкильной группы, метоксильной группы и галогена,или цепь формулы в которой A представляет собой фенил или гетероарил, выбранный из фурана, тиофена, оксазола и пиридина, причем оба они необязательно замещены заместителем, выбранным из (C1-C4)алкильной группы,метоксильной группы или галогена;r - целое число от 1 до 3;m - целое число, выбранное из 0 и 1; и кроме того, R2 представляет собой (C1-C7)алкильную группу или (C4-C10)алкильную группу, если одновременно X представляет собой группу -C(=O)-, R1 представляет собой (C1-C3)алкильную группу, aR3 представляет собой гидроксигруппу или R3 вместе с R4 образуют =N-O-R5 группу, в которой R5 отличен от -X-R2. 6. Соединение по п.1, отличающееся тем, что R, R1, R2 и X имеют значения, определенные форму- 22010906 лой (I), R3 представляет собой гидроксигруппу, a R4 является атомом водорода. 7. Соединение по п.6, отличающееся тем, что R1 представляет собой атом водорода или метил, а X представляет собой -C(=O)-, -C(=O)-NH- или -SO2-группу. 8. Соединение по п.7, отличающееся тем, что R2 представляет собой атом водорода,(C1-C4)алкокси(C1-C3)алкильную группу, (C5-C7)циклоалкильную группу, фенил либо 5- или 6-членный гетероарил, содержащий от 1 до 3 гетероатомов, выбранных из азота, кислорода и серы,фенил(C1-C4)алкильную или гетероарил(C1-C4)алкильную группу, необязательно замещенную заместителем, выбранным из (C1-C4)алкильной группы, (C1-C4)алкоксильной группы и галогена, или цепь формулы в которой A представляет собой фенил или гетероарил, выбранный из фурана, тиофена, оксазола, имидазола, пиридина, пиримидина и триазола, причем оба необязательно замещены заместителем, выбранным из (C1-C4)алкильной группы, (C1-C4)алкоксильной группы или галогена;Y представляет собой O, S или NR6, где R6 - атом водорода или метил;r - целое число от 1 до 3;m - целое число, выбранное из 0 и 3; и кроме того, R2 представляет собой (C1-C7)алкильную группу или (C4-C10)алкильную группу, если одновременно X представляет собой группу -С(=O)-, R1 представляет собой (C1-C3)алкильную группу, aR3 представляет собой гидроксигруппу или R3 вместе с R4 образуют =N-O-R5 группу, в которой R5 отличен от -X-R2. 9. Соединение по п.8, отличающееся тем, что R1 представляет собой метил, a R2 представляет собой атом водорода, метокси(C1-C3)алкильную группу, (C5-C7)циклоалкильную группу фенил или гетероарил,выбранный из фурана, тиофена, оксазола и пиридина, бензил, или гетероарил(C1-C4)метильную группу, в которой гетероарил выбран из фурана, тиофена, оксазола и пиридина, необязательно замещенный заместителем, выбранным из (C1-C4)алкильной группы, метоксигруппы и галогена, или цепь формулы в которой A представляет собой фенил или гетероарил, выбранный из фурана, тиофена, оксазола и пиридина, причем оба они необязательно замещены заместителем, выбранным из метильной группы, метоксигруппы или галогена;r - целое число от 1 до 3;m - целое число, выбранное из 0 и 1; и кроме того, R2 представляет собой (C1-C7)алкильную группу или (C4-C10)алкильную группу, если одновременно X представляет собой группу -С(=O)-, R1 представляет собой (C1-C3)алкильную группу, aR3 представляет собой гидроксигруппу или R3 вместе с R4 образуют =N-O-R5 группу, в которой R5 отличен от -X-R2. 10. Соединение по п.9, отличающееся тем, что R2 представляет собой метоксиметильную группу,циклоэзил, фенил или гетероарил, выбранный из фурана, тиофена, оксазола и пиридина, бензил или тиофенилметильную группу, необязательно замещенную заместителем, выбранным из метильной группы,метоксильной группы и галогена, или цепь формулы в которой A представляет собой фенил или пиридин, причем оба они необязательно замещены метоксильной группой;r - целое число от 1 до 3;m - целое число, выбранное из 0 и 1; и кроме того, R2 представляет собой (C1-C7)алкильную группу или (C4-C10)алкильную группу, если одновременно X представляет собой группу -C(=O)-, R1 представляет собой (C1-C3)алкильную группу, aR3 представляет собой гидроксигруппу или R3 вместе с R4 образуют =N-O-R5 группу, в которой R5 отличен от -X-R2. 11. Соединение по п.1, отличающееся тем, что заместитель -X-R2 в значениях R5 имеет такие же значения, что и заместители X и R2 на позиции 3'. 12. Способ получения соединения по п.1, включающий: а) деметилирование диметиламиногруппы с позиции 3' соединения формулы (II) в которой R, R3 и R4 имеют значения, определенные в п.1; б) удаление L-кладиноза гидролизом; в) амидирование первичной или вторичной аминной группы, полученной на стадии а). 13. Способ по п.12, отличающийся тем, что R3 в формуле (II) представляет собой гидроксигруппу, аR4 представляет собой атом водорода. 14. Способ по п.12, отличающийся тем, что указанное удаление кладиноза осуществляется гидролизом при кислотном катализе, протекающем в присутствии минеральной кислоты и протонного органического растворителя. 15. Фармацевтический состав, содержащий терапевтически эффективное количество соединения по п.1 в смеси с фармацевтически приемлемым носителем. 16. Фармацевтический состав по п.15, пригодный для лечения воспалительных заболеваний.
МПК / Метки
МПК: A61P 29/00, A61K 31/7048, C07H 17/08
Метки: противовоспалительной, активностью, макролиды, обладающие
Код ссылки
<a href="https://eas.patents.su/25-10906-makrolidy-obladayushhie-protivovospalitelnojj-aktivnostyu.html" rel="bookmark" title="База патентов Евразийского Союза">Макролиды, обладающие противовоспалительной активностью</a>
Предыдущий патент: Сопряжённые гетероциклические соединения
Следующий патент: Катализаторы окисления монооксида углерода в сигаретном дыме
Случайный патент: Машина для транспортирования рельсов и способ транспортирования












