Пролекарственные соединения фосфонатных аналогов нуклеотидов (варианты), способ их получения, способ скрининга для их идентификации и содержащая их композиция, способ антивирусной терапии или профилактики
Номер патента: 4926
Опубликовано: 28.10.2004
Авторы: Рохлофф Джон К., Спарасино Марк Л., Эйзенберг Юджин Дж., Хэ Гон-Синь, Присб Эрнест Дж., Чэпмэн Хэрлэн Х., Ли Уильям Э., Кернэн Майкл Р., Циглар Томас, Беккер Марк У.
Формула / Реферат
1. Способ скрининга для идентификации пролекарственного соединения метоксифосфонатного аналога нуклеотида, обладающего повышенной активностью в ткани-мишени, отличающийся тем, что получают по меньшей мере одно указанное пролекарственное соединение, выбирают по меньшей мере одну ткань-терапевтическую мишень и по меньшей мере одну ткань-немишень, вводят пролекарственное соединение в ткань-мишень и в указанную по меньшей мере одну ткань-немишень и определяют относительную активность, обусловленную пролекарственным соединением в указанных тканях.
2. Способ по п.1, отличающийся тем, что активность представлена антивирусной активностью или противоопухолевой активностью.
3. Способ по п.2, отличающийся тем, что активность представлена антивирусной активностью.
4. Способ по п.3, отличающийся тем, что активность представлена активностью против ВИЧ или против Hepadnavirus, такого как вирус гепатита B.
5. Способ по п.1, отличающийся тем, что в качестве пролекарственного соединения выбирают соединение PMPA или PMEA.
6. Способ по п.5, отличающийся тем, что пролекарственное соединение представлено фосфоноамидатом, сложным фосфоноэфиром или смесью фосфоноамидата и сложного фосфоноэфира.
7. Способ по п.6, отличающийся тем, что фосфоноамидат представлен фосфоноамидатом аминокислоты.
8. Способ по п.6, отличающийся тем, что сложный фосфоноэфир представлен арил фосфоноэфиром.
9. Способ по п.1, отличающийся тем, что дополнительно выбирают пролекарственное соединение, обладающее относительной активностью в ткани-мишени, в 10 раз превышающей активность в ткани-немишени.
10. Способ по п.1, отличающийся тем, что ткань-мишень и ткань-немишень находятся в организме животного, пролекарственное соединение вводят указанному животному, а относительную активность определяют посредством анализа тканей животного после введения пролекарственного соединения.
11. Способ по п.1, отличающийся тем, что активность в ткани-мишени и ткани-немишени определяют посредством анализа количества по меньшей мере одного метаболита пролекарственного соединения в данных тканях.
12. Способ по п.11, отличающийся тем, что в качестве метаболита анализируют исходное лекарственное вещество.
13. Способ по п.12, отличающийся тем, что метаболит представляет собой дифосфат исходного лекарственного вещества.
14. Способ по п.1, отличающийся тем, что в качестве ткани-мишени выбирают ткань, инфицированную вирусом, а в качестве ткани-немишени - ту же ткань, которая не инфицирована вирусом.
15. Способ по п.1, отличающийся тем, что в качестве ткани-мишени выбирают лимфоидную ткань и определяют активность в отношении ВИЧ.
16. Способ по п.1, отличающийся тем, что в качестве ткани-мишени выбирают печень и определяют активность в отношении вируса гепатита B.
17. Способ по п.1, отличающийся тем, что в качестве ткани-мишени выбирают гематологическую ткань и определяют противоопухолевую активность.
18. Способ по п.1, отличающийся тем, что в качестве ткани-мишени выбирают злокачественную ткань, а в качестве ткани-немишени - ту же ткань, но не злокачественной природы.
19. Метоксифосфонатный аналог нуклеотида общей формулы (1)
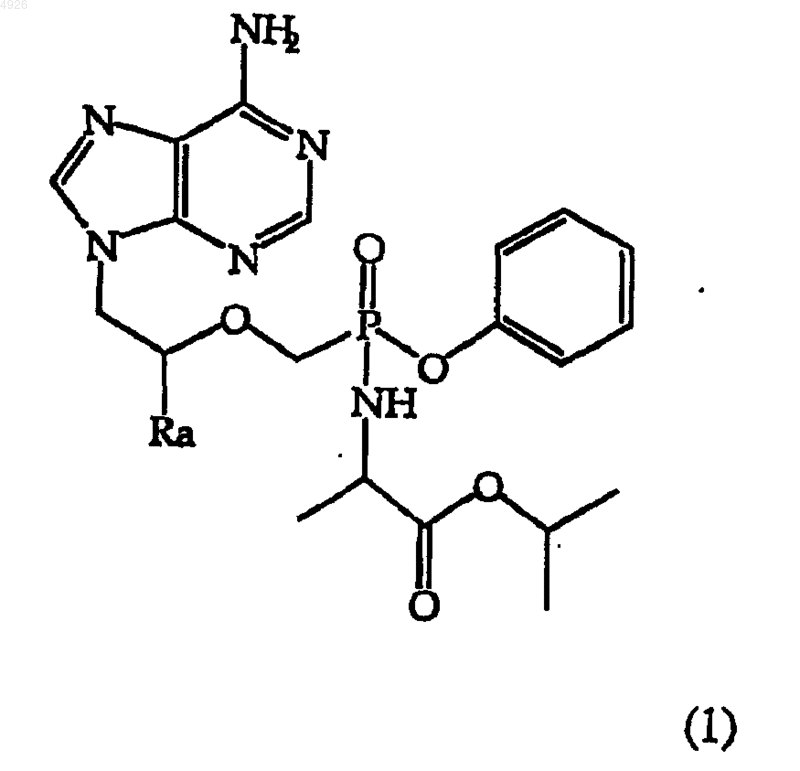
где Ra - H или метил, а также его хирально обогащенные смеси, соли, их свободные основания и сольваты.
20. Метоксифосфонатный аналог нуклеотида формулы (2)
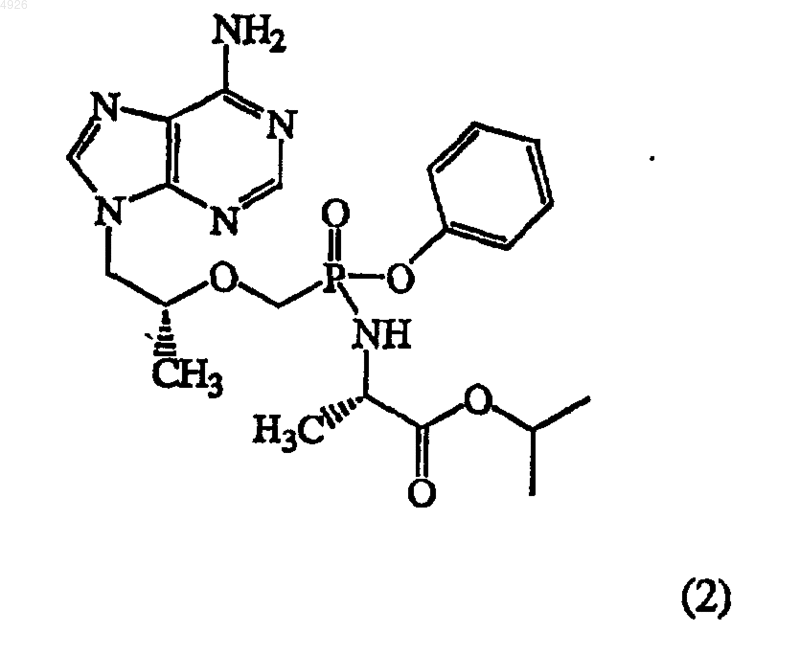
и его обогащенные диастереомеры, соли, свободные основания и сольваты.
21. Соединение, обогащенное диастереомером общей формулы (3)
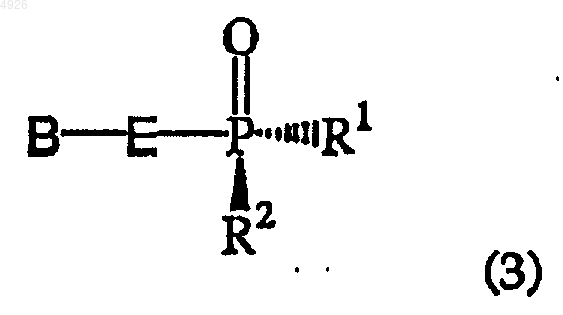
которое практически свободно от диастереомера общей формулы (4)
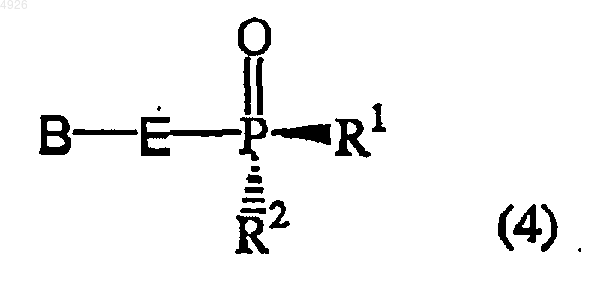
где R1 - сложный оксиэфир, который гидролизуется in vivo, или гидроксил,
B - гетероциклическое основание,
R2 - гидроксил или остаток аминокислоты, связанный с атомом P через аминогруппу аминокислоты, в котором каждый карбоксильный заместитель аминокислоты необязательно этерифицирован, но при этом оба R1 и R2 не являются гидроксилами,
E - -CH2O(CH2)2-, -CH2OCH(CH3)CH2-, -CH2OCH(CH2F)CH2-, -CH2OCH(CH2OH)CH2-, -CH2OCH(CH=CH2)CH2-, -CH2OCH(Cу CH)CH2-, -CH2OCH(CH2N3)CH2-,
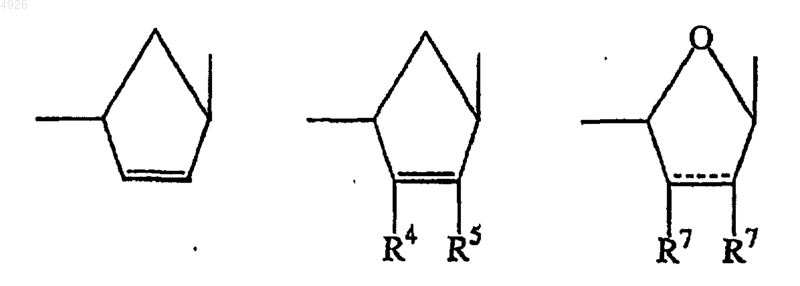
-CH2OCH(R6)OCH(R6')-, -CH2OCH(R9)CH2O- или -CH2OCH(R8)O-, где связь, расположенная справа, присоединена к гетероциклическому основанию, пунктир означает необязательную двойную связь,
R4 и R5 независимо представлены водородом, гидроксигруппой, галогеном, аминогруппой или заместителем, содержащим 1-5 атомов углерода, выбранным изацилоксигруппы, алкилоксигруппы, алкилтиогруппы, алкиламиногруппы и диалкиламиногруппы,
R6 и R6' независимо представлены H, C1-C6алкилом, C1-C6гидроксиалкилом или C2-C7алканоилом;
R7 независимо представлен H, C1-C6алкилом или, взятые вместе, образуют -O- или -CH2-;
R8 - H, C1-C6алкил, C1-C6гидроксиалкил или C1-C6галогеналкил и
R9 - H, гидроксиметил или ацилоксиметил; и его соли, свободные основания и сольваты.
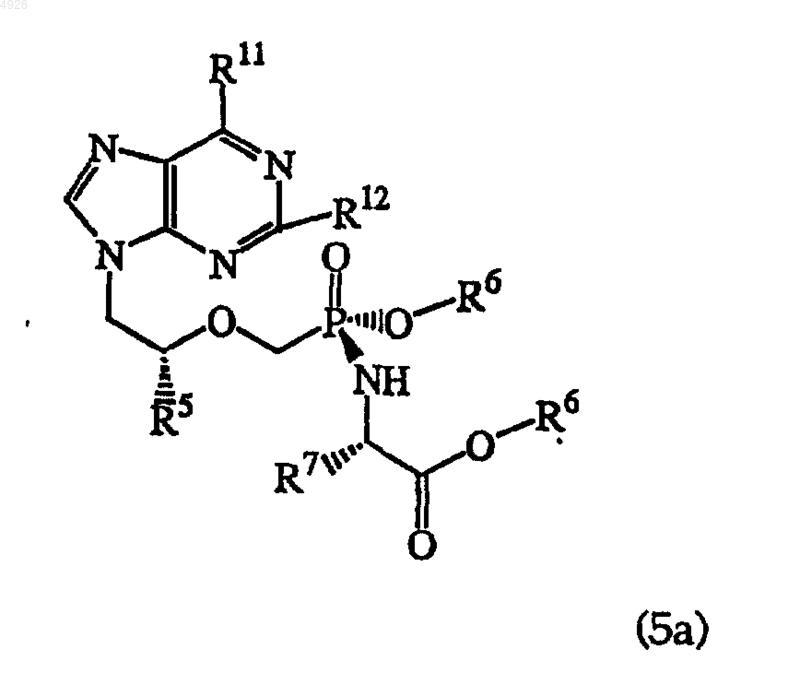
22. Метоксифосфонатный аналог нуклеотида, обогащенный диастереомером общей формулы (5a)
который практически свободен от диастереомера общей формулы (5b)
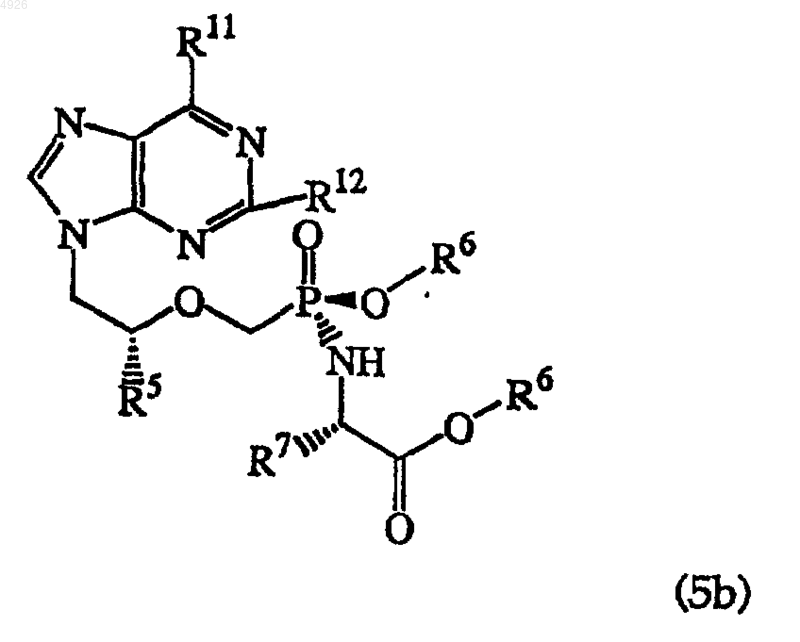
где R5 - метил или водород;
R6 независимо представлен H, алкилом, алкенилом, алкинилом, арилом или арилалкилом или R6 независимо представлен алкилом, алкенилом, алкинилом, арилом или арилалкилом, которые замещены 1-3 заместителями, выбранными из алкиламиногруппы, алкиламиноалкила, диалкиламиноалкила, диалкиламиногруппы, гидроксила, оксогруппы, галогена, аминогруппы, алкилтиогруппы, алкоксигруппы, алкоксиалкила, арилоксигруппы, арилоксиалкила, арилалкоксигруппы, арилалкоксиалкила, галогеналкила, нитрогруппы, нитроалкила, азидогруппы, азидоалкила, алкилацила, алкилацилалкила, карбоксила или алкилациламиногруппы;
R7 - боковая цепь любой природной или фармацевтически приемлемой аминокислоты, при этом, если боковая цепь содержит карбоксил, то карбоксильная группа необязательно этерифицирована алкильной или арильной группой;
R11 - аминогруппа, алкиламиногруппа, оксогруппа или диалкиламиногруппа и
R12 - аминогруппа или H,
а также его соли, таутомеры, свободные основания и сольваты.
23. Метоксифосфонатный аналог нуклеотида формулы (6)
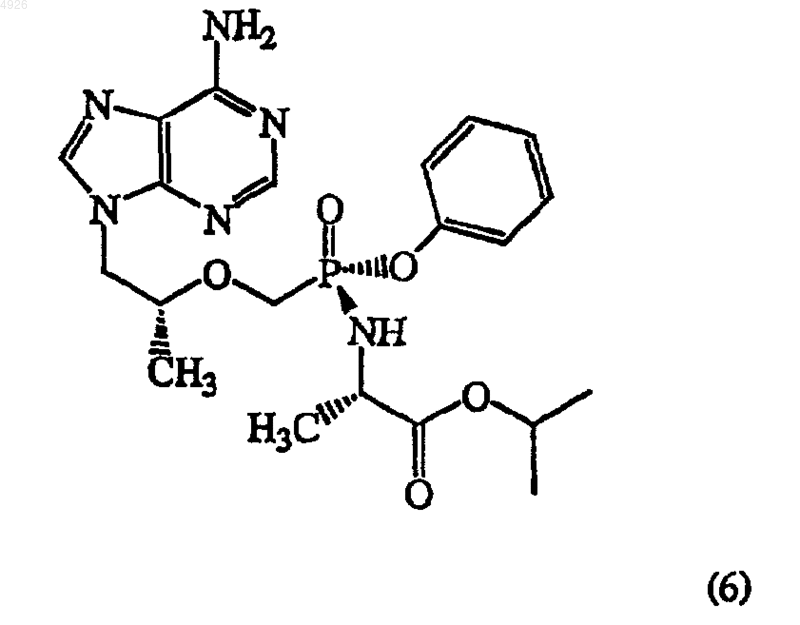
и его соли и сольваты.
24. Метоксифосфонатный аналог нуклеотида формулы (7)
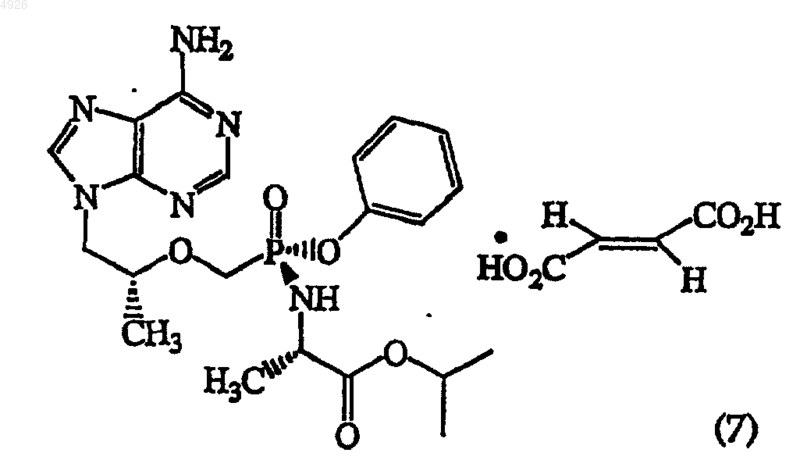
25. Композиция, отличающаяся тем, что она содержит соединение по любому из пп.19-24 и фармацевтически эффективный наполнитель.
26. Композиция по п.25, отличающаяся тем, что в качестве наполнителя она содержит гель.
27. Композиция по п.25, отличающаяся тем, что она пригодна для наружного применения.
28. Способ антивирусной терапии или профилактики, отличающийся тем, что субъекту, нуждающемуся в данном терапевтическом лечении или профилактиъх, вводят соединение по любому из пп.19-24 в терапевтически или профилактически эффективном количестве.
29. Способ получения метоксифосфонатного аналога нуклеотида, отличающийся тем, что осуществляют взаимодействие 9-(2-гидроксипропил)аденина или 9-(2-гидроксиэтил)аденина с защищенным p-толуолсульфонилоксиметилфосфонатом в присутствии алкоксида магния с получением 9-[2-(фосфонометокси)пропил]аденина (PMPA) или 9-[2-(фосфонометокси)этил]аденина (PMEA) соответственно.
30. Способ по п.29, отличающийся тем, что дополнительно проводят выделение полученного PMPA или PMEA.
31. Способ по п.29, отличающийся тем, что используют p-толуолсульфонилоксиметилфосфонат, защищенный сложным этиловым эфиром.
32. Способ по п.29, отличающийся тем, что в качестве алкоксида магния выбирают C1-C6алкоксид магния.
33. Способ по п.32, отличающийся тем, что используют трет-бутилоксид или изопропилоксид магния.
Текст
1 Область техники, к которой относится изобретение Данная заявка относится к пролекарственным соединениям метоксифосфонатным аналогам нуклеотидов. В частности, она касается усовершенствованных способов получения и идентификации таких пролекарственных соединений. Уровень техники Известно много метоксифосфонатных аналогов нуклеотидов. В основном данные соединения имеют структуру A-OCH2P(O)(OR)2, где А - остаток аналога нуклеозида и R независимо представлено водородом или различными защитными или пролекарственными функциональными группами. См. патенты США 5663159, 5977061 и 5798340, статьи Oliyai и соавт., Pharmaceuical Research, 16(11), стр. 16871693, (1999), Stella и соавт., J. Med. Chem.,23(12), стр. 1275-1282, (1980), главу, написанную Aarons L., Boddy А. и Petrak К. в монографии "Новые методы доставки лекарственных препаратов и их терапевтическое применение"Bundgaard H., стр. 291-316. Все перечисленные литературные источники и патенты специально включены в данный контекст в виде ссылки. Сущность изобретения Традиционно со времени открытия пролекарственных соединений метоксифосфонатных аналогов нуклеотидов, предназначенных для антивирусной или противоопухолевой терапии,их отбор был связан с их системным действием. Например, данные пролекарственные соединения были отобраны на основании повышенной биодоступности, т.е. способности всасываться из желудочно-кишечного тракта и быстро превращаться в исходное лекарственное вещество,что обеспечивает доступность исходного лекарственного вещества для всех тканей. Однако в настоящее время заявители обнаружили, что 2 возможен отбор пролекарственных соединений,которые накапливаются в областях проведения терапевтического лечения. В исследованиях,описанных в данном контексте, показано, что аналоги накапливаются в локализованных областях ВИЧ-инфекции. В числе других преимуществ объектом данного изобретения является снижение токсичности в отношении окружающих тканей и повышение активности исходного лекарственного вещества в тканях, представляющих собой терапевтические мишени, с помощью метоксифосфонатного аналога нуклеотида. Соответственно, на основании результатов научных наблюдений предложен способ скрининга, направленный на идентификацию пролекарственного соединения метоксифосфонатного аналога нуклеотида, который обеспечивает повышенную активность в ткани-мишени. Данный способ предусматривает(а) получение по меньшей мере одного из указанных пролекарственных соединений;(б) выбор по меньшей мере одной тканитерапевтической мишени и по меньшей мере одной ткани-нетерапевтической мишени;(в) введение пролекарственного соединения в ткань-мишень и в указанную по меньшей мере одну ткань-немишень и(г) определение относительной антивирусной активности, обусловленной пролекарственным соединением в тканях на стадии (в). В предпочтительных вариантах осуществления ткань-мишень представляет собой области активной репликации ВИЧ и/или служащие резервуаром ВИЧ, а ткань-немишень представлена интактным животным. Неожиданно было обнаружено, что выбор лимфоидной ткани в качестве ткани-мишени для реализации данного способа в отношении ВИЧ привел к идентификации пролекарственных соединений, которые усиливают доставку активного лекарственного вещества в данные ткани. Предпочтительное соединение, соответствующее данному изобретению, которое было идентифицировано данным способом, имеет структуру (1) где Ra - Н или метил, или представлено его хирально обогащенными композициями, солями,их свободными основаниями и их сольватами. Предпочтительное соединение, соответствующее данному изобретению, имеет структуру и представлено его обогащенными диастереомерами, солями, свободными основаниями и сольватами. Кроме того, было неожиданно обнаружено, что хиральность заместителей при атоме фосфора и/или амидатного заместителя является важной для обогащения, наблюдаемого при практической реализации данного изобретения. Так, в другом варианте осуществления данного изобретения представлены диастереомерно обогащенные соединения, соответствующие данному изобретению, которые имеют структуру которая практически свободна от диастереомера где R1 - сложный оксиэфир, который гидролизуется in vivo, или гидроксил,В - гетероциклическое основание,R2 - гидроксил или остаток аминокислоты,связанный с атомом Р через аминогруппу аминокислоты, в котором каждый карбоксильный заместитель аминокислоты необязательно этерифицирован, но при этом оба R1 и R2 не являются гидроксилами,Е - -СН 2 О(СН 2)2-, -СН 2 ОСН(СН 3)СН 2-,-CH2OCH(CH2F)CH2-, -СН 2 ОСН(СН 2 ОН)СН 2-,-СН 2 ОСН(СН=СН 2)СН 2-, -СН 2 ОСН(ССН)СН 2-,-CH2OCH(CH2N3)CH2-,-CH2OCH(R8)O-, где связь, расположенная справа, присоединена к гетероциклическому основанию, пунктир означает необязательную двойную связь,R4 и R5 независимо представлены водородом, гидроксигруппой, галогеном, аминогруппой или заместителем, содержащим 1-5 атомов углерода, выбранным из ацилоксигруппы, алкилоксигруппы, алкилтиогруппы, алкиламиногруппы и диалкиламиногруппы;R9 означает Н, гидроксиметил или ацилоксиметил,и их соли, свободные основания и сольваты. Диастереомеры структуры (3) определены как (S)-изомеры с атомом фосфора в качестве хирального центра. Предпочтительными вариантами осуществления данного изобретения являются диастереомерно обогащенные соединения, имеющие структуру (5 а) которая практически свободна от диастереомера где R5 - метил или водород,R6 независимо представлен Н, алкилом,алкенилом, алкинилом, арилом или арилалкилом или R6 независимо представлен алкилом,алкенилом, алкинилом, арилом или арилалкилом, которые замещены 1-3 заместителями, выбранными из алкиламиногруппы, алкиламиноалкила, диалкиламиноалкила, диалкиламиногруппы, гидроксила, оксогруппы, галогена,аминогруппы, алкилтиогруппы, алкоксигруппы,алкоксиалкила, арилоксигруппы, арилоксиалкила, арилалкоксигруппы, арилалкоксиалкила,галогеналкила, нитрогруппы, нитроалкила, азидогруппы, азидоалкила, алкилацила, алкилацилалкила, карбоксила или алкилациламиногруппы,R7 - боковая цепь любой природной или фармацевтически приемлемой аминокислоты,при этом, если боковая цепь содержит карбоксил, то карбоксильная группа необязательно этерифицирована алкильной или арильной группой;R11 - аминогруппа, алкиламиногруппа, оксогруппа или диалкиламиногруппа и 5 Предпочтительным вариантом осуществления данного изобретения является соединение структуры (6) 9-[(R)-2-(S)-(S)-1-(изопропоксикарбонил)этил]амино]феноксифосфинил] метокси]пропил]аденин, в данном контексте обозначаемый также GS-7340 Другим предпочтительным вариантом осуществления данного изобретения является фумарат структуры (5) (структура (7, 9-[(R)-2(S)-(S)-1-(изопропоксикарбонил)этил]амино] феноксифосфинил]метокси]пропил]аденин фумарат (1:1), в данном контексте обозначаемый также GS-7340-2 Соединения структуры (1)-(7) необязательно приготовлены в виде композиций, содержащих фармацевтически приемлемые наполнители. Данные композиции используют в эффективных дозах в терапии или профилактике вирусных (в особенности ВИЧ или Hepadnavirus) инфекций. В следующем варианте осуществления представлен простой способ получения 9-[2(фосфонометокси)пропил]аденина (далее в тексте "РМРА" или 9-[2-(фосфонометокси)этил] аденина (далее в тексте "РМЕА") с использованием алкоксида магния, который предусматривает смешивание 9-(2-гидроксипропил)аденина или 9-(2-гидроксиэтил)аденина, защищенного ртолуолсульфонилоксиметилфосфоната и алкоксида магния и выделение РМРА или РМЕА соответственно. Перечень чертежей и иных материалов На фиг. 1 представлены хроматограммы,полученные с помощью ВЭЖХ на С-14 для соединений, соответствующих изобретению, в моноцитарных клетках периферической крови(РВМС). Исследованы следы экстрактов РВМС из человеческой крови, инкубируемой в течение 1 ч при 37 С с TDF, GS-7340 или РМРА. На фиг. 2 показан график изменения концентраций РМРА и пролекарственного соединения, соответствующего изобретению, в плазме и РВМС после перорального введения GS 7340-2 собакам в дозе 10 мг-экв./кг. 6 На фиг. 3 проиллюстрировано воздействие на тенофовир в РВМС и плазме при введении собакам в дозе 10 мг-экв./кг. Сведения, подтверждающие возможность осуществления изобретения Исходные лекарственные вещества метоксифосфонатных аналогов нуклеотидов, используемые в данном способе скрининга, представляют собой соединения, имеющие структуру А-ОСН 2 Р(О)(ОН)2, где А - остаток аналога нуклеозида. Данные соединения известны сами по себе и не являются частью данного изобретения. В частности, исходные соединения содержат гетероциклическое основание В и агликон Е, и,в основном, имеют структуру где группа В определена ниже, а группа Е определена выше. Примеры описаны в патентах США 4659825,4808716, 4724233, 5142051,5130427, 5650510, 5663159, 5302585, 5476938,5696263, 5744600, 5688778, 5386030, 5733896,5352786 и 5798340, а также ЕР 821690 и 654037. Пролекарственные соединения для применения в способе скрининга, соответствующем данному изобретению, представляют собой ковалентно модифицированные аналоги исходных метоксифосфонатных аналогов нуклеотидов,описанных в предшествующем абзаце. Вообще,атом фосфора исходного лекарственного вещества является предпочтительным центром модификации для получения пролекарственного соединения, но на гетероциклическом основании В или агликоне Е обнаружены другие центры. Многие из данных пролекарственных соединений уже известны. Во-первых, они представляют собой сложные эфиры или амидаты атома фосфора Р, но включают также замены на основании и агликоне. Ни одна из таких модификаций сама по себе не является частью данного изобретения и ни одна не должна рассматриваться, как ограничивающая объем притязаний изобретения в данном контексте. Атом фосфора метоксифосфонатных аналогов нуклеотидов имеет две валентности для ковалентной модификации, такой как амидирование или этерификация (если один фосфорильный гидроксил этерифицирован с образованием гидроксильного заместителя агликона Е, то для замещения свободна только одна из валентностей фосфора). Сложные эфиры, как правило,представлены арилоксиэфирами. Амидаты обычно представлены природными моноаминокислотами, имеющими свободную карбоксильную группу(ы), этерифицированную алкильной или арильной группой, обычно фенильной, циклоалкильной или трет-, н- или втор-алкильными группами. Подходящие пролекарственные соединения для применения в способе скрининга, 7 соответствующем данному изобретению, описаны, например, в патенте США 5798340. Однако для применения в способе, соответствующем данному изобретению, пригодно любое пролекарственное соединение, которое считают потенциально способным к превращению invivo в клетках ткани-мишени в исходное лекарственное вещество на основе свободного метоксифосфонатного аналога нуклеотида, например,путем гидролиза, окисления или иной ковалентной трансформации, обусловленной воздействием биологических тканей. Данные пролекарственные соединения могут быть неизвестны в настоящие время, но будут идентифицированы в будущем и станут таким образом подходящими кандидатами для тестирования способом,соответствующим данному изобретению. Поскольку пролекарственные соединения являются просто кандидатами для скрининга данными способами, их структуры не имеют отношения к практической реализации или осуществлению способа скрининга, хотя, конечно, их структуры, в конечном счете, дают возможность предполагать, будет или не будет показана избирательность пролекарственного соединения при анализе. Про-остатки, связанные с исходным лекарственным веществом, могут быть одинаковыми или различными. Однако каждое пролекарственное соединение, которое предполагают использовать в способе скрининга, будет отличаться по структуре от других тестируемых пролекарственных соединений. Отличные от других, т.е. различающиеся по структуре пролекарственные соединения, как правило, отбирают на основе их стереохимических характеристик или ковалентной структуры, или сочетания вариантов указанных признаков. Однако желательно, чтобы каждое из тестируемых пролекарственных соединений было структурно и стереохимически чистым, иначе данные, полученные при скрининге, будут менее эффективными. Конечно, в объем притязаний данного изобретения входит тестирование только одного пролекарственного соединения в отдельном варианте осуществления способа, соответствующего данному изобретению, хотя обычно результаты можно затем сравнить с данными предшествующих исследований, проведенных на других пролекарственных соединениях. Обнаружено, что стереохимические характеристики пролекарственных соединений способны влиять на накопление в тканях-мишенях. Хиральные центры находятся на атомах фосфора, а также обнаружены на его заместителях. Например, аминокислота, используемая для получения амидатов, может быть D- или Lформы и, кроме того, фосфонатные сложные эфиры или сложные эфиры аминокислот могут содержать хиральные центры. Хиральные центры обнаружены также в области нуклеозидных аналогов данных молекул, но они, как правило,изначально обусловлены стереохимией исход 004926 8 ного лекарственного вещества и не будут варьировать в качестве части скрининга. Например,R-изомер РМРА является предпочтительным,поскольку он более активен, чем соответствующий S-изомер. Обычно данные диастереомеры или энантиомеры будут хирально обогащенными, если не чистыми относительно каждого из центров для того, чтобы результаты скрининга были более значимыми. Как уже отмечено, отличия стереоизомеров обусловлены обогащением или очисткой стереоизомера (как правило, в случае большинства метоксифосфонатных аналогов нуклеотидов это будет диастереомер, а не энантиомер), который не содержит других стереоизомеров по рассматриваемому хиральному центру. При этом каждое тест-соединение является практически гомогенным. Под термином практически гомогенный или хирально обогащенный понимают, что данный стереоизомер составляет более чем приблизительно 60 мас.% соединения, обычно более чем приблизительно 80 мас.% и предпочтительно более чем приблизительно 95%. Новый способ скрининга. После отбора по меньшей мере одного кандидатного пролекарственного соединения остальные стадии способа скрининга, соответствующего данному изобретению, используют для идентификации пролекарственного соединения, которое обладает необходимой избирательностью в отношении ткани-мишени. Наиболее удобным является мечение пролекарственных соединений определяемой группой, например, введение радиоактивной метки, с целью облегчения последующей детекции в тканях или клетках. Однако метка не является необходимой, поскольку могут быть также использованы другие подходящие анализы пролекарственного соединения или его метаболитов, в том числе исходного лекарственного вещества. Например,данные анализы могли бы включать массспектрометрию, ВЭЖХ (высокоэффективную жидкостную хроматографию), биоанализы или иммуноанализы. Анализ может служить для определения пролекарственного соединения и его любых одного или более метаболитов, но предпочтительно анализ проводят только с целью детекции образования исходного лекарственного вещества. Это основано на предположении (которое может не во всех случаях подтверждаться) о том, что степень и скорость превращения пролекарственного соединения в исходный дифосфат, обладающий антивирусной активностью, является одинаковой во всех тестируемых тканях. Иначе говоря, можно проводить анализ дифосфата. При скрининге пролекарственных соединений для использования при лечении ВИЧинфекции ткань-мишень предпочтительно будет представлена лимфоидной тканью. Специалистам известна лимфоидная ткань, она включает клетки CD4, лимфоциты, лимфатические узлы, 9 макрофаги и подобные макрофагам клетки, в том числе моноциты, такие как моноцитарные клетки периферической крови (РВМС) и клетки глии. Лимфоидная ткань включает в себя также нелимфоидные ткани, которые присутствуют в лимфоидных тканях, или клетки, например, легких, кожи и селезенки. Другими мишенями иных антивирусных лекарственных веществ,конечно, будут первичные области репликации или латентного периода определенных рассматриваемых вирусов, например, печень при гепатите и периферические нервы при HSV (вирусе простого герпеса). Аналогично тканямимишенями для опухолей в действительности будут сами опухоли. Данные ткани хорошо известны специалистам, и для выбора не потребуется проведение дополнительных экспериментов. При скрининге антивирусных соединений ткань-мишень может быть инфицирована вирусом. В данном контексте в способ также входит проведение скрининга с использованием тканей- или клеток-немишеней. В этом плане возможно использование любого числа или принадлежности данных тканей или клеток. Как правило, ткани, в отношении которых, как полагают, исходное лекарственное вещество является токсичным, используют в качестве тканейнемишеней. Отбор ткани-немишени полностью зависит от природы пролекарственного соединения и активности исходного лекарственного вещества. Например, ткани, отличные от тканей печени, были бы выбраны для анализа пролекарственных соединений против гепатита, в частности, вирусного гепатита В (HBV), а нетрансформированные клетки той же ткани, что опухоль, будут соответствовать условиям скрининга избирательных противоопухолевых пролекарственных соединений. Следует отметить, что способ, соответствующий данному изобретению, отличается от исследований, обычно предпринимаемых для определения пероральной биодоступности пролекарственных соединений. Объектом исследований пероральной биодоступности является идентификация пролекарственного соединения,которое проникает в систему кровообращения,будучи практически превращенным в исходное лекарственное вещество. Целью данного изобретения является поиск пролекарственных соединений, которые не метаболизируются в желудочно-кишечном тракте или системе кровообращения. Так, ткани-мишени, предназначенные для анализа в способе, соответствующем данному изобретению, как правило, не включают в себя тонкую кишку или, при включении тканей кишечника, содержат также дополнительные ткани, отличные от тканей тонкой кишки. Ткани-мишени и немишени, используемые в способе скрининга, соответствующем данному изобретению, как правило, будут находиться в 10 организме интактного живого животного. Пролекарственные соединения, содержащие сложные эфиры, более предпочтительно тестировать на собаках, обезьянах или других животных,отличных от грызунов; плазма мышей и крыс содержит высокие уровни эстераз в циркулирующей крови, которые могут дать ложный результат, если целевым субъектом терапии является человек или высшее млекопитающее. Практическая реализация способа на интактных животных не является необходимой. В объем притязаний данного изобретения входит также использование перфузированных органов,культуры органов in vitro (например, кожных трансплантатов) или клеточных линий, поддерживаемых в различных формах клеточной культуры, например, в роллер-флаконах или суспензионных системах при отсутствии силы тяжести. Например, клетки МТ-2 можно использовать в качестве ткани-мишени для отбора пролекарственных соединений против ВИЧ. Таким образом, термин "ткань" не будет ограничен обязательно организованными клеточными структурами или структурами тканей, которые можно обнаружить в естественных условиях,хотя это было бы предпочтительным. Напротив,термин "ткань" будет ограничен тем, что является синонимом термина "клетки из определенного источника, природы или стадии дифференцировки". Ткань-мишень и немишень в действительности могут быть одной и той же тканью, но данные ткани будут различаться по биологическому статусу. Например, в данном контексте способ можно было бы использовать для отбора пролекарственных соединений, которые обусловливают активность в инфицированной вирусом ткани (ткань-мишень), но остаются практически неактивными в неинфицированных вирусом клетках (соответствующая тканьнемишень). Аналогичная стратегия могла бы быть использована для выбора профилактических пролекарственных соединений, т.е. пролекарственных соединений, метаболизируемых до форм, обладающих антивирусной активностью,в случаях вирусной инфекции, но остающихся практически неметаболизированными в неинфицированных клетках. Аналогичным образом может быть осуществлен скрининг пролекарственных соединений в трансформированных клетках и такой же, но нетрансформированной ткани. При сравнительном анализе особенно эффективным был бы выбор пролекарственных соединений для лечения гематологических злокачественных новообразований, например, лейкозов. Не ограничиваясь какой-либо определенной теорией процесса, полагают, что избирательные в отношении ткани пролекарственные соединения избирательно поглощаются клетками-мишенями и/или избирательно метаболизируются в клетке по сравнению с другими тканя 11 ми или клетками. Уникальное преимущество пролекарственных соединений на основе метоксифосфоната в данном контексте состоит в том,что их метаболизм с образованием дианиона при физиологических значениях рН обусловливает невозможность их диффузии из клетки. Вследствие этого, они остаются эффективными в течение длительных периодов времени и поддерживаются в повышенных внутриклеточных концентрациях, проявляя таким образом повышенную активность. Полагают, что механизмы повышенной активности в ткани-мишени включают в себя повышенное поглощение клеткамимишенями, повышенный уровень удерживания в клетках или совместное действие данных механизмов. Однако способ, согласно которому совершается избирательность или происходит повышенная доставка в ткани-мишени, не является важным. Неважно также, что все метаболическое превращение пролекарственного соединения в исходное соединение происходит в ткани-мишени. Необходимо только, чтобы конечное превращение, обусловливающее активность лекарственного соединения, происходило в ткани-мишени; метаболизм в других тканях может приводить к образованию промежуточных продуктов, которые в итоге превращаются в антивирусные формы в ткани-мишени. Степень избирательности или повышенной доставки, которая является желательной, будет варьировать в зависимости от исходного соединения и способа, которым их измеряют (% распределения дозы или концентрация исходного лекарственного вещества). В основном, если исходное лекарственное вещество уже имеет большое терапевтическое окно, для целевого пролекарственного соединения может быть достаточной низкая степень избирательности. С другой стороны, для токсичных соединений может потребоваться широкий скрининг с целью идентификации избирательных пролекарственных соединений. Относительная стоимость способа, соответствующего данному изобретению, может быть снижена за счет проведения скрининга только в ткани-мишени и тканях, для которых известна относительная токсичность исходного соединения, например, для РМЕА,который в повышенных дозах является нефротоксичным, исследования главным образом будут сосредоточены на тканях почек и лимфоидных тканях. Стадию определения относительной антивирусной активности пролекарственного соединения в выбранных тканях обыкновенно выполняют путем анализа ткани-мишени и немишени на относительное присутствие или активность метаболита пролекарственного соединения. При этом известно, что данный метаболит обладает антивирусной или противоопухолевой активностью или превращается в метаболит, обладающий антивирусной или противоопухолевой активностью. Таким образом обычно можно опре 004926 12 делить относительное количество исходного лекарственного вещества в тканях в течение практически одного и того же периода времени,с целью идентификации пролекарственных соединений, которые метаболизируются преимущественно в ткани-мишени с образованием метаболита с антивирусной или противоопухолевой активностью или его предшественника, который в конечном счете образует активный метаболит в ткани-мишени. В случае антивирусных соединений активным метаболитом является дифосфат фосфонатных исходных соединений. Именно данный метаболит включается в вирусную нуклеиновую кислоту, нарушая таким образом элонгацию нити нуклеиновой кислоты и останавливая репликацию вируса. Метаболиты пролекарственного соединения могут быть представлены анаболическими метаболитами,катаболическими метаболитами или продуктом анаболизма и катаболизма, вместе взятых. Способ образования метаболита не является важным для практической реализации способа, соответствующего данному изобретению. Способ, соответствующий данному изобретению, не ограничен анализом метаболита,который сам по себе обладает антивирусной или противоопухолевой активностью. Напротив,можно провести анализ неактивных предшественников активных метаболитов. Предшественники обладающего антивирусной активностью метаболита дифосфата включают в себя монофосфат исходного лекарственного вещества,монофосфаты других метаболитов исходного лекарственного вещества (например, промежуточная модификация заместителя на гетероциклическом основании), само исходное вещество и метаболиты, образованные клеткой в процессе превращения пролекарственного соединения в исходную форму перед фосфорилированием. Структуры предшественников могут значительно различаться, поскольку они являются результатом клеточного метаболизма. Однако данная информация уже известна или может быть легко установлена специалистом в данной области. Если анализируемое пролекарственное соединение само по себе не проявляет противоопухолевую или антивирусную активность, то может потребоваться введение поправок в необработанные результаты анализа. Например, если внутриклеточный процессинг неактивного метаболита с образованием активного метаболита протекает с различной скоростью в разных тестируемых тканях, то необработанные результаты анализа неактивного метаболита потребовали бы введения поправки, чтобы учесть различия между типами клеток, поскольку соответствующим параметром является появление активности в ткани-мишени, а не накопление неактивных метаболитов. Однако определение надлежащих поправок находилось бы в сфере компетенции рядового специалиста. Так, когда на стадии (г) способа в данном контексте требуется 13 определение активности, данную активность можно измерить непосредственно или экстраполировать. Это не означает, что в данном контексте способ ограничен только оценкой промежуточных продуктов, которые сами по себе обладают активностью. Например, отсутствие или снижение количества пролекарственного соединения в тестируемых тканях также могло бы быть определено. На стадии (г) требуется только оценка активности, обусловленной пролекарственным соединением, поскольку оно взаимодействует с рассматриваемой тканью, и она может быть основана на экстраполяции или другом непрямом измерении. На стадии (г) способа, соответствующего данному изобретению, требуется определение"относительной" активности пролекарственного соединения. Следует понимать, что нет необходимости в том, чтобы буквально каждый анализ или серия анализов были обязательно проведены с использованием выбранной тканинемишени. Напротив, в объем притязаний данного изобретения включено использование ранее полученных контрольных данных по тканиили тканям-немишеням или алгоритмов, представляющих результаты, которые можно было бы ожидать от данных тканей-немишеней, с целью получения демонстрационной активности не в отношении мишени. Результаты, полученные на стадии (г), затем используют оптимальным образом для выбора или идентификации пролекарственного соединения, которое дает более высокую антивирусную активность в ткани-мишени, чем в ткани-немишени. Оно является именно тем пролекарственным соединением, которое отбирают для дальнейшей работы. Будет учитываться возможность проведения некоторой предварительной оценки кандидатов в пролекарственные соединения перед практическим применением способа, соответствующего данному изобретению. Например, необходимо, чтобы пролекарственное соединение обладало способностью проходить в основном в неметаболизированном виде через желудочнокишечный тракт, необходимо, чтобы оно было практически стабильным в крови, и оно должно проникать в клетки, по меньшей мере, до некоторой степени. В большинстве случаев необходимо также, чтобы оно завершало первый цикл циркуляции в печени без существенного метаболизма. Данные предварительные исследования являются необязательными и хорошо известны компетентным специалистам в данной области. Объяснения, аналогичные описанным выше для антивирусной активности, применимы также к противоопухолевым пролекарственным соединениям метоксифосфонатных аналогов нуклеотидов. Последние включают в себя, например, пролекарствеиные соединения PMEG,гуаниловый аналог РМЕА. В данном случае 14 цитотоксические фосфонаты, такие как PMEG,являются заслуживающими внимания кандидатами для продолжения исследований, поскольку их цитотоксичность в действительности обусловливает их противоопухолевую активность. Соединение, идентифицированное с помощью данного нового способа скрининга, может быть затем введено в традиционную программу предклинических или клинических испытаний для того, чтобы подтвердить, что обнаружены целевые объекты. Как правило, пролекарственное соединение считают избирательным, если активность или концентрация исходного лекарственного вещества в ткани-мишени(% распределения дозы) более чем в два раза и предпочтительно в 5 раз превышает данные параметры исходного соединения в тканинемишени. Альтернативно кандидатное пролекарственное соединение можно сравнить с контрольным пролекарственным соединением. В данном случае избирательность является относительной, а не абсолютной. Избирательными пролекарственными соединениями будут соединения, демонстрирующие в результате более чем 10-кратное превышение концентрации или активности в ткани-мишени по сравнению с прототипом, хотя степень избирательности - это отдельный вопрос. Новый способ получения исходных материалов или промежуточных продуктов. В контекст данного изобретения включен также усовершенствованный способ получения предпочтительных исходных материалов (исходных лекарственных веществ), соответствующих данному изобретению, РМЕА и (R)PMPA. Как правило, данный способ предусматривает реакцию 9-(2-гидроксипропил)аденина(НРА) или 9-(2-гидроксиэтил)аденина (НЕА) с алкоксидом магния с последующим добавлением в реакционную смесь синтона р-толуолсульфонилоксиметилфосфоната (тозилата) с защищенным агликоном и выделение РМРА или РМЕА соответственно. Предпочтительно, когда НРА представлен обогащенным или выделенным R-энантиомером. При использовании хиральной смеси НРА можно выделить R-PMPA из хиральной смеси РМРА после завершения синтеза. Как правило, тозилат защищают низшими алкильными группами, но другие подходящие группы будут очевидны для специалиста. Возможно, удобно использовать тозилат, предварительно замещенный фосфонатными заместителями пролекарственного соединения, которые способны действовать как защитные группы в реакции тозилирования, что позволяет избежать стадии депротекции и непосредственно выделять пролекарственное соединение или его промежуточный продукт. Алкильная группа алкоксида магния не является важной и может быть представлена любым разветвленным или неразветвленным С 1 15 С 6 алкилом, но предпочтительно является третбутилом (для РМРА) или изопропилом (для РМЕА). Условия реакции также не являются важными, но предпочтительно включают в себя нагревание реакционной смеси до приблизительно 70-75 С при перемешивании или умеренном взбалтывании иного рода. При отсутствии заинтересованности в сохранении фосфонатных заместителей с продукта снимают защиту (обычно с помощью бромтриметилсилана, если защитная группа тозилата представлена алкилом), а затем продукт выделяют посредством кристаллизации или другим принятым способом, который будет очевидным для специалиста. Гетероциклическое основание. В соединениях, соответствующих данному изобретению, представленных структурами (3) и (4), гетероциклическое основание В выбрано из структурR19 - H, С 1-С 9 алкил, С 2-С 9 алкенил, С 2 С 9 алкинил, С 1-С 9 алкил-С 1-С 9 алкоксигруппа или С 7-С 9 арилалкил, незамещенный или замещенный ОН, F, Cl, Вr или I, таким образом R19 включает в себя -СН 3, -СН 2 СН 3, -СНСН 2,-СНСНВr, -CH2CH2Cl, -CH2CH2F, -СН 2 ССН,-СН 2 СНСН 2, -С 3 Н 7, -СН 2 ОН, -СН 2 ОСН 3,-СН 2 ОС 2 Н 5, -СН 2 ОССН, -СН 2 ОСН 2 СНСН 2,-СН 2 С 3 Н 7,-СН 2 СН 2 ОН,-СН 2 СН 2 ОСН 3,-СН 2 СН 2 ОС 2 Н 5, -СН 2 СН 2 ОССН,-СН 2 СН 2 ОСН 2 СНСН 2 и -СН 2 СН 2 ОС 3 Н 7;R10 независимо представлят собой Н, С 1 С 15 алкил, С 2-С 15 алкенил, С 6-С 15 арилалкенил, С 6 С 15 арилалкинил, С 2-С 15 алкинил, С 1-С 6 алкиламино-С 1-С 6 алкил, С 5-С 15 аралкил, С 6-С 15 гетероаралкил, С 5-С 6 арил, С 2-С 6 гетероциклоалкил, С 2 С 15 алкил, С 3-С 15 алкенил, С 6-С 15 арилалкенил, С 3 С 15 алкинил, С 7-С 15 арилалкинил, С 1-С 6 алкиламино-С 1-С 6 алкил, С 5-С 15 аралкил, С 6-С 15 гетероалкил или С 3-С 6 гетероциклоалкил, причем ме 004926 16 тилен в структуре алкила, который не является соседним с N6, замещен -O-,необязательно оба R10 соединены вместе посредством N с образованием насыщенного или ненасыщенного С 2-С 5 гетероцикла, который содержит один или два гетероатома N и необязательно содержит дополнительный гетероатом О или S, или одна из вышеуказанных групп R10,которая замещена 1-3 атомами галогена, представлена CN или N3, но необязательно по меньшей мере одна группа R10 не является Н;R24 - O, S или Se. Гетероциклическое основание В также включает в себя как защищенные, так и незащищенные гетероциклические основания, в частности, пуриновые и пиримидиновые основания. Защитные группы для экзоциклических аминов и других лабильных групп известны (см. работу Greene и соавт. "Защитные группы в органическом синтезе" ("Protective Groups in Organic Synthesis" и включают в себя N-бензоил,изобутирил, 4,4'-диметокситритил (DMT) и т.п. Выбор защитной группы будет очевидным для специалиста и будет зависеть от природы лабильной группы и химических условий, в которых, как предполагают, будет находиться защитная группа, например, кислых, основных,окислительных или иных условий. Примерами защищенных молекул являются N4-бензоилцитозин, N6-бензоиладенин, N2-изобутирилгуанин и т.п. Защищенные основания имеют формулы Ха.1, XIa.1, XIb.1, ХIIа.1 или ХIIIа.1CR41N(R38)2, где R36 - С 1-С 19 алкил, С 1-С 19 алкенил, С 3-С 10 арил, адамантоил, алкиланил или С 3 С 10 арил, замещенный 1 или 2 атомами или группами, выбранными из галогена, метила,этила, метоксигруппы, этоксигруппы, гидроксигруппы и цианогруппы; R38 - С 1-С 10 алкил или оба R38, взятые вместе, представлены 1 морфолиногруппой, 1-пиперидином или 1 пирролидином; R40 - С 1-С 10 алкил, включающий в себя метил, этил, пропил, изопропил, бутил,изобутил, трет-бутил, пентил, гексил, октил и деканил, и R41 - водород или СН 3. Если в основаниях структуры ХIа.1 и XIb.1R39 присутствует в R22A или R23A, обе группы R39 на одном основании, как правило, будут одинаковыми. Примерами R36 являются фенил, фенил, 17 замещенный одним из вышеупомянутых арильных заместителей R36, -С 10 Н 15 (где С 10 Н 15 - 2 адамантоил), -СН 2-С 6 Н 5, -С 6 Н 5, -СН(СН 3)2,-СН 2 СН 3, метил, бутил, трет-бутил, гептанил,нонанил, ундеканил или ундеценил. Специфические основания включают в себя гипоксантин, гуанин, аденин, цитозин, инозин, тимин, урацил, ксантин, 8-азапроизводные 2-аминопурина, 2,6-диаминопурина, 2-амино-6 хлорпурина, гипоксантина, инозина и ксантина,7-деаза-8-азапроизводные аденина, гуанина, 2 аминопурина, 2,6-диаминопурина, 2-амино-6 хлорпурина, гипоксантина, инозина и ксантина; 1-деазапроизводные 2-аминопурина,2,6 диаминопурина, 2-амино-6-хлорпурина, гипоксантина, инозина и ксантина, 7-деазапроизводные 2-аминопурина, 2,6-диаминопурина, 2-амино-6-хлорпурина, гипоксантина, инозина и ксантина; 3-деазапроизводные 2 аминопурина, 2,6-диаминопурина, 2-амино-6 хлорпурина, гипоксантина, инозина и ксантина; 6-азацитозин, 5-фторцитозин, 5-хлорцитозин, 5 иодоцитозин; 5-бромцитозин, 5-метилцитозин,5-бромвинилурацил, 5-фторурацил, 5-хлорурацил, 5-иодурацил, 5-бромурацил, 5-трифторметилурацил, 5-метоксиметилурацил, 5-этинилурацил и 5-пропинилурацил. Предпочтительно, когда В представлено остатком 9-пуринила, выбранным из гуанила, 3 деазагуанила, 1-деазагуанила, 8-азагуанила, 7 деазагуанила, аденила, 3-деазааденила, 1 деазааденила, 8-азааденила, 7-деазааденила, 2,6 диаминопуринила, 2-аминопуринила, 6-хлор-2 аминопуринила и 6-тио-2-аминопуринила, или В' представлено остатком 1-пиримидинила, выбранным из цитозинила, 5-галогенцитозинила и 5-(С 1-С 3 алкил)цитозинила. Предпочтительные группы В имеют формулу где R22 независимо представлен галогеном, кислородом, NH2, X или Н, но необязательно по меньшей мере один из R22 охзначает X,X - -(CH2)m(O)n(CH2)mN(R10)2, где m = 0-2,n = 0-1, аR10 независимо представлен Н, С 1 С 15 алкил, С 2-С 15 алкенил, С 6-С 15 арилалкенил, С 6 С 15 арилалкинил, С 2-С 15 алкинил, С 1-С 6 алкиламино-С 1-С 6 алкил, С 5-С 15 аралкил, С 6-С 15 гетероаралкил, С 5-С 6 арил, С 2-С 6 гетероциклоалкил, С 2 С 15 алкил, С 3-С 15 алкенил, С 6-С 15 арилалкенил, С 3 С 15 алкинил,С 7-С 15 арилалкинил,С 1-С 6 алкиламино-С 1-С 6 алкил, С 5-С 15 аралкил, С 6-С 15 гетероалкил или С 3-С 6 гетероциклоалкил, причем метилен в структуре алкила, который не является соседним с N6, замещен -O-, 004926 18 необязательно оба R10 соединены вместе посредством N с образованием насыщенного или ненасыщенного С 2-С 5 гетероцикла, который содержит один или два гетероатома N и необязательно содержит дополнительный гетероатом О или S, или одна из вышеуказанных групп R10,которая замещена 1-3 атомами галогена, представлена CN или N3, но необязательно по меньшей мере одна группа R10 не является Н; иZ - N или СН, при условии, что гетероциклическое ядро отличается от пурина не более чем одним Z. Группы Е представляют собой агликоны,используемые в метоксифосфонатных аналогах нуклеотидов. Предпочтительно, когда группа Е представлена-СН 2 ОСН 2 СН 2-. Кроме того, предпочтительно,чтобы практически все боковые группы в хиральных центрах агликона находились исключительно в (R)-конфигурации (за исключением гидроксиметила, который представляет собой обогащенный (S)-энантиомер).-OR6, где R35 определено в колонке 64, строке 49 патента США 5798340, который включен в данный текст в виде ссылки, a R6 определен выше. Предпочтительно, когда R1 - арилоксигруппа, обыкновенно незамещенная или замещенная в пара-положении (как определено дляR2 - остаток аминокислоты при необязательном условии, что любая карбоксигруппа,связанная с N амидата посредством менее чем приблизительно 5 атомов, является этерифицированной. R2, как правило, имеет структуруR12 независимо представлен Н или С 1 С 9 алкилом, который не замещен или замещен заместителями, независимо выбранными из группы, состоящей из ОН, О, N, COOR11 и галогена, С 3-С 6 арилом, который не замещен или замещен заместителями, независимо выбранными из группы, состоящей из ОН, О, N, COOR11 и галогена, или С 3-С 9 арилалкилом, который не замещен или замещен заместителями, независимо выбранными из группы, состоящей из ОН,О, N, COOR11 и галогена;R13 независимо представлен C(O)-OR11,аминогруппой, амидом, гуанидинилом, имидазолилом, индолилом, сульфоксидом, фосфорилом, C1-С 3 алкиламиногруппой, С 1-С 3 алкилдиаминогруппой,С 1-С 6 алкениламиногруппой,гидроксигруппой,тиолом,С 1-С 3 алкоксигруппой, С 1-С 3 алктиолом, (CH2)nCOOR11, С 1 С 6 алкилом, незамещенным или замещенным ОН, галогеном, SH, NH2, фенилом, гидроксифенилом или С 7-С 10 алкоксифенилом, С 2-С 6 алкенилом, незамещенным или замещенным ОН, галогеном, SH, NH2, фенилом, гидроксифенилом или С 7-С 10 алкоксифенилом, и С 6-С 12 арилом, незамещенным или замещенным ОН, галогеном, SH,NH2, фенилом, гидроксифенилом или С 7 С 10 алкоксифенилом, иR14 представлен Н или С 1-С 9 алкилом или С 1-С 9 алкилом, независимо замещенным ОН,галогеном, COOR11, О или N; С 3-С 6 арилом; С 3 С 6 арилом, независимо замещенным ОН, галогеном, COOR11, О или N, или С 3-С 6 арилалкилом,независимо замещенным ОН, галогеном,COOR11, О или N. Предпочтительно, когда R11 представлен С 1-С 6 алкилом, наиболее предпочтительно - изопропилом, R13 является боковой цепью природной аминокислоты, n = 1, R12 - Н и R14 - Н. Согласно изобретению в соединение структуры (2) включены метаболиты, в которых фенокси- и изопропиловый сложные эфиры гидролизованы до -ОН. Аналогичным образом деэтерифицированные обогащенные метаболиты фосфоноамидата соединений (5 а), 5(b) и (6) включены в объем притязаний изобретения. Замещение арила и "О" или "N" определено в колонке 16, строках 42-58 патента США 5798340. Как правило, аминокислоты представляют собой природные или I-аминокислоты. Подходящие специфические примеры приведены в патенте США 5798340, например, в табл. 4 и колонках 8-10 данного патента. Алкил, как используют в данном контексте, если не указано иначе, представляет собой нормальный, вторичный, третичный или циклический углеводород. Если не указано иначе,алкил представлен С 1-С 12. Примерами алкилов являются-СН(СН 3)С(СН 3)3. Алкенилиалкинилы определены таким же образом, но содержат по меньшей мере одну двойную или тройную связь соответственно. При описании енольных или кетогрупп соответствующие таутомеры также ограничены,как указано. Пролекарственные соединения по данному изобретению представлены в форме свободного основания или различных солей, перечисленных в патенте США 5798340, и таким же образом,как представлено в патенте США 5798340,приготовлены в виде препаратов с фармацевтически приемлемыми наполнителями или растворяющими разбавителями для применения в качестве фармацевтических продуктов. Данные пролекарственные соединения обладают антивирусной активностью и имеют применение,уже установленное для исходных лекарственных веществ (см. патент США 5798340 и другие ссылки, касающиеся метоксифосфонатных аналогов нуклеотидов). Будет понятно, что диастереомер структуры (4) используют, по меньшей мере, в качестве промежуточного продукта при химическом получении исходного лекарственного вещества путем гидролиза invitro вне зависимости от его относительно неизбирательного характера, как показано в данных исследованиях. Для лучшего понимания изобретения приводятся следующие примеры. Пример 1 а. Введение аденина в РМЕА с использованием изопропоксида магния. К суспензии аденина (16,8 г, 0,124 моль) в диметилформамиде (ДМФ) (41,9 мл) добавляют этиленкарбонат (12,1 г, 0,137 моль) и гидроксид натрия (100 г, 0,0025 моль). Смесь нагревают при 130 С в течение ночи. Реакцию охлаждают до менее 50 С и добавляют толуол (62,1 мл). Суспензию далее охлаждают до 5 С в течение 2 ч, фильтруют и промывают толуолом (2 х). Влажное твердое вещество сушат под вакуумом при 65 С с получением 20,0 г (90%) 9-(2 гидроксиэтил)аденина в виде не совсем белого твердого вещества. Температура плавления 238240 С. 9-(2-гидроксиэтил)аденин (НЕА) (20,0 г,0,112 моль) суспендируют в ДМФ (125 мл) и нагревают до 80 С. Изопропоксид магния (11,2 г, 0,0784 моль) или, альтернативно, третбутоксид магния добавляют в смесь с последующим добавлением диэтил-р-толуолсульфонилоксиметилфосфоната (66,0 г, 0,162 моль) в 21 течение одного часа. Смесь перемешивают при 80 С в течение 7 ч. 30 мл летучих соединений удаляют вакуумной отгонкой и в реакцию вводят 30 мл свежего ДМФ. После охлаждения до комнатной температуры добавляют бромтриметилсилан (TMSBr) (69,6 г, 0,450 моль) и нагревают смесь до 80 С в течение 6 ч. Реакцию концентрируют с получением густой смолы. Смолу растворяют в 360 мл воды, экстрагируют 120 мл дихлорметана, подводят рН до 3,2 с помощью гидроксида натрия и перемешивают полученную суспензию при комнатной температуре в течение ночи. Суспензию охлаждают до 4 С в течение одного часа. Твердые вещества выделяют фильтрованием, промывают водой (2 х) и сушат под вакуумом при 56 С с получением 20 г (65,4%) 9-[2-(фосфонометокси)этил]аденина(РМЕА) в виде твердого вещества белого цвета. Температура плавления: 200 С (разложение). Данные 1 Н ЯМР-спектроскопии (D2O):3,49 (t, 2H); 3,94 (t, 2H); 4,39 (t, 2H); 8,13 (s, 1H); 8,22 (s, 1H). Пример 1b.(0,480 г, 0,012 моль). Смесь нагревают при 130 С в течение ночи. Реакцию охлаждают до 100 С и добавляют толуол (138 мл) с последующим добавлением метансульфоновой кислоты (4,7 г, 0,049 моль), поддерживая температуру реакции между 100-110 С. Дополнительное количество толуола (114 мл) добавляют для получения гомогенного раствора. Раствор охлаждают до 3 С в течение 7 ч, а затем поддерживают при 3 С в течение одного часа. Полученное твердое вещество выделяют фильтрацией и промывают ацетоном (2 х). Влажное твердое вещество сушат под вакуумом при 80 С с получением 42,6 г (75%) (R)-9-[2-(гидрокси)пропил] аденина (НРА) в виде не совсем белого твердого вещества. Температура плавления: 188-190 С.(14,2 г, 0,083 моль) или, альтернативно, изопропоксид магния добавляют в смесь в течение одного часа с последующим добавлением диэтил-р-толуолсульфонилоксиметилфосфоната (66,0 г, 0,205 моль) в течение 2 ч, поддерживая температуру при 78 С. Смесь 22 перемешивают при 75 С в течение 4 ч. После охлаждения до температуры ниже 50 С добавляют бромтриметилсилан (73,9 г, 0,478 моль) и нагревают смесь до 77 С в течение 3 ч. После завершения процесса реакцию нагревают до 80 С и удаляют летучие вещества отгонкой при атмосферном давлении. Остаток растворяют в воде (120 мл) при 50 С, а затем экстрагируют этилацетатом (101 мл). рН водной фазы подводят до значения 1,1 гидроксидом натрия, вводят затравку аутентичного (R)-PMPA и снова подводят рН водного слоя до значения 2,1 гидроксидом натрия. Полученную массу перемешивают при комнатной температуре в течение ночи. Массу охлаждают до 4 С в течение 3 ч. Твердое вещество выделяют фильтрацией, промывают водой (60 мл) и сушат под вакуумом при 50 С с получением 18,9 г (63,5%) неочищенного(R)-9-[2-(фосфонометокси)пропил] аденина (РМРА) в виде не совсем белого твердого вещества. Неочищенный (R)-9-[2-(фосфонометокси) пропил]аденин нагревают в воде (255 мл) в колбе с обратным холодильником до полного растворения твердого вещества. Раствор охлаждают до комнатной температуры в течение 4 ч. Полученную массу охлаждают при 4 С в течение 3 ч. Твердое вещество выделяют фильтрацией, промывают водой (56 мл) и ацетоном (56 мл) и сушат под вакуумом при 50 С с получением 15,0 г (50,4%) (R)-9-[2-(фосфонометокси) пропил]аденина (РМРА) в виде белого твердого вещества. Температура плавления: 278-280 С. Пример 2. Получение GS-7171 (соединение III). Синтез 1 В реактор со стеклянной колбой вводят безводный РМРА, (I) (14,6 кг, 50,8 моль), фенол(9,6 кг, 102 моль) и 1-метил-2-пирролидинон (39 кг). Смесь нагревают до 85 С и добавляют триэтиламин (6,3 кг, 62,3 моль). Затем в течение 6 ч при 100 С добавляют раствор 1,3-дициклогексилкарбодиимида (17,1 кг, 82,9 моль) в 1 метил-2-пирролидиноне (1,6 кг). Нагревание 23 продолжают в течение 16 ч. Реакцию охлаждают до 45 С, добавляют воду (29 кг) и охлаждают до 25 С. Твердые вещества удаляют из реакции путем фильтрации и промывают водой (15,3 кг). Объединенные фильтрат и промывные растворы концентрируют до образования желтовато-коричневой массы при пониженном давлении, добавляют воду (24,6 кг) и подводят рН до 11 с помощью NaOH (25% водный раствор). Примеси удаляют путем фильтрации через диатомовую землю (2 кг) с последующим промыванием водой (4,4 кг). Объединенные фильтрат и промывные растворы экстрагируют этилацетатом (28 кг). рН водного раствора подводят до значения 3,1 с помощью HCl (37% водный раствор) (4 кг). Сырец II выделяют фильтрацией и промывают метанолом (12,7 кг). Влажную лепешку сырца II суспендируют в метаноле (58 кг). Твердые вещества выделяют путем фильтрации, промывают метанолом (8,5 кг) и сушат при пониженном давлении с получением 9,33 кг соединения II в виде белого порошка: Данные 1 Н ЯМР-спектроскопии (D2O):1,2 (d, 3 Н), 3,45 (q, 2H), 3,7 (q, 2H), 4 (m, 2H), 4,2GS-7171 (III) Синтез 1 В реактор со стеклянной колбой вводят монофенил РМРА, (II), (9,12 кг, 25,1 моль) и ацетонитрил (30,7 кг). Тионилхлорид (6,57 кг,56,7 моль) добавляют при температуре ниже 50 С. Смесь нагревают при 75 С до растворения твердых веществ. Температуру реакции повышают до 80 С и собирают летучие вещества(11,4 кг) посредством перегонки при атмосферном давлении под азотом. Остаток в реакторе охлаждают до 25 С, добавляют дихлорметан (41 кг) и охлаждают до -29 С. Раствор сложного изопропилового эфира (L)-аланина (7,1 кг, 54,4 моль) в дихлорметане (36 кг) добавляют в течение 60 мин при -18 С с последующим добавлением триэтиламина (7,66 кг, 75,7 моль) в течение 30 мин при температуре от -18 до -11 С. Реакционную смесь нагревают до комнатной температуры и пятикратно промывают раствором дигидрофосфата натрия (10% водный раствор, 15,7 кг для каждого промывания). Органический раствор сушат с помощью безводного сульфата натрия (18,2 кг), фильтруют, промывают дихлорметаном (28 кг) и концентрируют до образования масла при пониженном давлении. В масло вводят ацетон (20 кг) и концентрируют смесь при пониженном давлении. В полученное масло вводят ацетон (18,8 кг). Половину раствора продукта очищают хроматографически с использованием слоя 38 х 38 см, содержащего 22 кг силикагеля 60 с размером зерна 230-400 меш. Элюцию с колонки проводят с использо 004926 24 ванием 480 кг ацетона. Процесс очистки повторяют со второй половиной масла, используя свежий силикагель и ацетон. Фракции, содержащие очищенный продукт, концентрируют при пониженном давлении с получением масла. Ацетонитрил (19,6 кг) вводят в масло и концентрируют смесь при пониженном давлении. Затем вводят ацетонитрил (66,4 кг) и охлаждают раствор до 0 до -5 С в течение 16 ч. Твердые вещества удаляют фильтрацией и концентрируют фильтрат при пониженном давлении с получением 5,6 кг соединения III в виде темного масла; Данные 1 Н ЯМР-спектроскопии (CDCl3):1,1 (m, 12H), 3,7 (m, 1 Н), 4,0 (m, 5H), 4,2 (m,1H), 5,0 (m, 1H), 6,2 (s, 2H), 7,05 (m, 5H), 8,0 (s,1H), 8,25 (d, 1H); Данные 31 Р ЯМР-спектроскопии (CDCl3):21,0, 22,5 (неспаренный). Дополнительный способ получения GS7171 (соединние III). Синтез 2 Монофенил РМРА (соединение II). Круглодонную колбу с обратным холодильником и входным отверстием для азота помещают на масляную баню при 70 С. В колбу вносят безводный РМРА (соединение I) (19,2 г,67 ммоль), N,N-диметилформамид (0,29 г, 3,3 ммоль) и тетраметиленсульфон (40 мл). Тионилхлорид (14,2 г, 119 ммоль) добавляют в течение 4 ч. В то же самое время повышают температуру нагревания до 100 С. В результате получают гомогенный раствор. В раствор в течение 5 мин добавляют фенокситриметилсилан(11,7 г, 70 ммоль). Нагревание на масляной бане при температуре 100 С продолжают далее в течение 2 ч. Реакционную смесь выливают в быстро перемешиваемый ацетон (400 мл) при охлаждении до 0 С. Твердые вещества выделяют путем фильтрации, сушат при пониженном давлении и растворяют в метаноле (75 мл). рН раствора подводят до 3,0 с помощью раствора гидроксида калия (45% водный раствор) при охлаждении на льду/в воде. Образующиеся в результате твердые вещества выделяют фильтрованием, промывают в метаноле и сушат при пониженном давлении с получением 20,4 г вещества II (синтез 2) в виде белого порошка.GS-7171 (III). Монофенил РМРА (II) (3 г, 8,3 ммоль),тетраметиленсульфон (5 мл) и N.N-диметил 25 формамид (1 капля) смешивают в круглодонной колбе на масляной бане при 40 С. Добавляют тионилхлорид (1,96 г, 16,5 ммоль). Через 20 мин прекращают нагревание прозрачного раствора,разводят его дихлорметаном (10 мл) и добавляют к раствору сложный изопропиловый эфир(L)-аланина (5 г, 33 ммоль) и диизопропилэтиламин (5,33 г, 41 ммоль) в дихлорметане (20 мл) при -10 С. Реакционную смесь нагревают до комнатной температуры и трижды промывают раствором дигидрофосфата натрия (10% водный раствор, 10 мл для каждого промывания). Органический раствор сушат над безводным сульфатом натрия и концентрируют при пониженном давлении с образованием масла. Масло смешивают с фумаровой кислотой (0,77 г, 6,6 ммоль) и ацетонитрилом (40 мл) и нагревают до кипения в колбе с обратным холодильником для получения гомогенного раствора. Раствор охлаждают на ледяной бане и выделяют твердые вещества путем фильтрации. Твердое вещество GS-7171 в виде фумарата сушат при пониженном давлении с получением 3,7 г. Соль (3,16 г, 5,3 ммоль) суспендируют в дихлорметане (30 мл) и перемешивают с раствором карбоната калия (5 мл, 2,5 М водный раствор) до растворения твердого вещества. Органический слой отделяют, промывают водой (5 мл), сушат безводным сульфатом натрия и концентрируют при пониженном давлении с образованием 2,4 г вещества III в виде желто-коричневой пены. Пример 3. А. Разделение диастереомеров посредством порционной элюентной хроматографии. Диастереомеры GS-7171 (содинение III) разделяют с помощью порционной элюентной хроматографии с использованием выпускаемой в промышленности полупрепаративной колонки для ВЭЖХ (высокоэффективной жидкостной хроматографии) Chiralpak AS, 20 мкм, 21 х 250 мм с контрольной колонкой. Chiralpak AS, 20 мкм, 21 х 50 мм. Chiralpak AS представляет собой патентованный наполнитель, производимый фирмой Diacel и имеющийся в продаже в Северной Америке в фирме Chiral Technologies,Inc. (патенты США 5202433, RE 35919,5434298, 5434299 и 5498752). Chiralpak AS является хиральной стационарной фазой (CSP),состоящей из силикагелевого носителя с покрытием из амилозотрис[(S)метилбензилкарбамата]. Смесь диастереомеров GS-7171 растворяют в подвижной фазе и аликвоты, содержащие приблизительно по 1 г GS-7171, закачивают в хроматографическую систему. Нежелательный диастереомер, обозначаемый GS-7339, дает первый главный широкий (продолжительностью приблизительно 15 мин) пик, элюирующийся с колонки. По окончании элюции пика GS-7339 подвижную фазу немедленно заменяют на 100% метиловый спирт, который обеспечивает элюцию с колонки желательного диастереомера, 004926 26 обозначаемого GS-7340 (соединение IV), в виде острого пика вместе с фронтом растворителя метилового спирта. Метиловый спирт используют для уменьшения общего времени цикла. После первой пары инжекций оба диастереомера собирают в виде отдельных больших фракций, содержащих один из очищенных диастереомеров (99,0% отдельного диастереомера). Растворители подвижной фазы удаляют под вакуумом с получением очищенного диастереомера в виде рыхлой пены. В виде двух фракций диастереомеров выделяют приблизительно 95% исходной массыGS-7171. Фракция GS-7340 составляет приблизительно 50% от общей выделенной массы. Используют следующие условия хроматографирования: Подвижная фаза(конечная): 100% метиловый спирт Скорость потока: 10 мл/мин Время прохождения: приблизительно 45 мин Детекция: УФ при длине волны 275 нм Температура: окружающей среды Профиль элюции: GS-7339 (диастереомер В)IV Б. Разделение диастереомеров GS-7171 с помощью SMB-хроматографии. Общее описание хроматографии с моделированным движущимся слоемGS-7171 (соединение III), 2,8 кг, очищают с помощью хроматографии с моделированным движущимся слоем более 10 см при слоях 5 см наполнителя (Chiral Technologies Inc., силикагель с покрытием 20 микрон Chiralpak AS) (1,2 кг). Колонки элюируют 30% метанолом в ацетонитриле. Фракции, содержащие продукт, концентрируют с образованием раствора соединения IV в ацетонитриле (2,48 кг). Раствор отверждают с образованием кристаллической массы,которую смачивают ацетонитрилом при хранении. Кристаллическую массу сушат при пониженном давлении с получением кристаллический порошок желтовато-коричневого цвета,1,301 кг соединения IV, диастереомерной чистоты 98,7%, температуры плавления 117-120 С; Данные 1 Н ЯМР-спектроскопии (CDCl3)1,15 (m, 12H), 3,7 (t, 1H), 4,0 (m, 5H), 4,2 (dd,1H), 5,0 (m, 1H), 6,05 (s, 2H), 7,1 (m, 5H), 8,0 (s,1H), 8,2 (s, 1 Н); Данные 31 Р ЯМР-спектроскопии (CDCl3)21,0 (неспаренный).GS-7171 (соединение III) хроматографируют с применением ВЭЖХ с обращенной фазой с целью разделения диастереомеров, используя следующий общий протокол. Хроматографическая колонка: PhenomenexLuna C18(2), 5 мкм, размер пор 100 , (Phenomenex, Torrance, CA) или эквивалентный вариант Контрольная колонка: Pellicular C18 (Alltech, Deerfield, IL) или эквивалентный вариант Подвижная фаза: А - 0,02% (85%) Н 3 РО 4 в смеси вода:ацетонитрил, (95:5) В - 0,02% (85%) Н 3 РО 4 в смеси вода: ацетонитрил (50:50) Градиент подвижной фазы: Время прохождения: 50 мин Задержка равновесия: 10 мин при 100% подвижной фазе А Скорость потока: 1,2 мл/мин Температура: окружающей среды Детекция: УФ при длине волны 260 нм Раствор для образца: 20 мМ буфер на основе фосфата натрия, рН 6 Время удерживания: GS-7339, приблизительно 25 минGS-7340, приблизительно 27 мин. Г. Разделение диастереомеров путем кристаллизации.GS-7340 (соединение IV). Раствор GS-7171 (соединение III) в ацетонитриле концентрируют при пониженном давлении с получением пены янтарного цвета (14,9 г). Пену растворяют в ацетонитриле (20 мл) и вносят затравку в виде кристалла вещества IV. Смесь перемешивают в течение ночи, охлаждают до 5 С и выделяют твердые вещества фильтрацией. Твердые вещества сушат с получением 2,3 г вещества IV в виде белых кристаллов, которые имеют диастереомерную чистоту 98% (по данным 31 Р ЯМР-спектроскопии). Данные 1 Н ЯМР-спектроскопии (CDCl3):1,15 (m, 12H), 3,7 (t, 1H), 3,95 (m, 2H), 4,05 (m,2 Н), 4,2 (m, 2H), 5,0 (m, 1H), 6,4 (s, 2H), 7,1 (m,5H), 8,0 (s, 1H), 8,2 (s, 1H); Данные 31 Р ЯМР-спектроскопии (CDCl3):19,5 (неспаренный). 28 Рентгеноструктурный анализ отдельного кристалла, выбранного из данного продукта дает следующие результаты: Цвет и характерные признаки кристалла бесцветный, колонновидный Размеры кристалла - 0,250,120,08 мм Кристаллическая система - орторомбическая Тип кристаллической решетки - примитивный Параметры кристаллической решеткиа = 8,352(1)GS-7340-02 (соединение V) (схема cинтез 1). В реактор со стеклянной колбой вносятGS-7340 (соединение IV) (1,294 кг, 2,71 моль),фумаровую кислоту (284 г, 2,44 моль) и ацетонитрил (24,6 кг). Смесь нагревают до кипения в системе с обратным холодильником для растворения твердых веществ, фильтруют в горячем состоянии и охлаждают до 5 С в течение 16 ч. Продукт выделяют фильтрацией, промывают ацетонитрилом (9,2 кг) и сушат с получением 1329 г вещества V в виде белого порошка: температура плавления 119,7-121,1 С; []D20 -41,7(с 1,0, уксусная кислота). Пример 5. Получение GS-7120 (соединение VI). Синтез 3 В круглодонную колбу объемом 5 л вносят монофенил РМРА,(0,629 кг). При температуре ниже 27 С добавляют тионилхлорид (0,144 кг, 1,21 моль). Смесь нагревают при 70 С до растворения твердого вещества. Летучие вещества (0,45 л) удаляют путем перегонки при атмосферном давлении под азотом. Остаток в реакторе охлаждают до 25 С, добавляют дихлорметан (1,6 кг) и охлаждают смесь до -20 С. Раствор сложного этилового эфира (L)аминомасляной кислоты (0,144 кг, 1,1 моль) в дихлорметане (1,33 кг) добавляют в течение 18 мин при температуре от -20 до-10 С с последующим добавлением триэтиламина (0,17 кг, 1,65 моль) в течение 15 мин при температуре от -8 до -15 С. Реакционную смесь нагревают до комнатной температуры и промывают четыре раза раствором дигидрофосфата 29 натрия (10% водный раствор, 0,3 л для каждого промывания). Органический раствор сушат с помощью безводного сульфата натрия (0,5 кг) и фильтруют. Твердые вещества промывают дихлорметаном (0,6 кг) и концентрируют объединенный фильтрат и промывные растворы при пониженном давлении с получением масла. Масло очищают с помощью хроматографии через слой 1513 см силикагеля 60 с размером зерна 230-400 меш. Элюцию с колонки проводят с использованием градиента дихлорметана и метанола. Фракции, содержащие очищенный продукт, концентрируют при пониженном давлении с получением 211 г соединения VI (схема синтез 3) в виде желтовато-коричневой пены. Пример 5 а. Разделение диастреомеров GS7120 с помощью порционной элюентной хроматографии. Смесь диастереомеров очищают при использовании условий, описанных для GS-7171 в примере 3 А, за исключением следующего: Подвижная фаза(конечная): 100% метиловый спирт Профиль элюции: GS-7341 (диастереомер В)GS-7342 (диастереомер А) Пример 6. Разделение диастереомеров GS7120 посредством кристаллизации. В круглодонную колбу объемом 1 л вносят монофенил РМРА, (соединение II), (50 г, 0,137 моль) и ацетонитрил (0,2 л). В экзотермических условиях при температуре 10 С добавляют тионилхлорид (0,036 кг, 0,303 моль). Смесь нагревают до кипения в системе с обратным холодильником до растворения твердого вещества. Летучие вещества (0,1 л) удаляют перегонкой при атмосферном давлении под азотом. Остаток в реакторе охлаждают до 25 С, добавляют дихлорметан (0,2 кг) и охлаждают смесь до -20 С. Раствор сложного этилового эфира (L)-аминомасляной кислоты (0,036 кг, 0,275 моль) в дихлорметане (0,67 кг) добавляют в течение 30 мин при температуре от -20 до -8 С с последующим добавлением триэтиламина (0,042 кг,0,41 моль) в течение 10 мин при температуре не выше -6 С. Реакционную смесь нагревают до комнатной температуры и промывают четыре раза раствором дигидрофосфата натрия (10% водный раствор, 0,075 л для каждого промывания). Органический раствор сушат с помощью безводного сульфата натрия (0,1 кг) и фильтруют. Твердые вещества промывают этилацетатом(0,25 л) и концентрируют объединенный фильтрат и промывные растворы при пониженном давлении с получением масла. Масло разводят этилацетатом (0,25 л), вносят затравку, перемешивают в течение ночи и охлаждают до -15 С. Твердые вещества выделяют фильтрацией и сушат при пониженном давлении с получением 30 17,7 г GS-7342 (табл. 5) в виде порошка желтовато-коричневого цвета. Данные 1 Н ЯМР-спектроскопии (CDCl3):0,95 (t, 3 Н), 1,3 (m, 6 Н), 1,7 (m, 2 Н), 3,7 (m, 2H),4,1 (m, 6 Н), 4,4 (dd, 1 Н), 5,8 (s, 2 Н), 7,1 (m, 5 Н),8,0 (s, 1H), 8,4 (s, 1H); данные 31 Р ЯМР-спектроскопии (CDCl3):21 (неспаренный). Пример 7. Разделение диастереомеров GS7097. Смесь диастереомеров очищают при использовании условий, описанных для GS-7171(конечная): 100% метиловый спирт Профиль элюции: GS-7115 (диастереомер В)GS-7114 (диастереомер А) Пример 8. Альтернативная методика получения GS-7097.GS-7097. Фенил РМРА, этил-L-аланиламидат. Фенил РМРА (15,0 г, 41,3 ммоль), гидрохлорид сложного этилового эфира L-аланина (12,6 г, 83 ммоль) и триэтиламин (11,5 мл, 83 ммоль) суспендируют с 500 мл пиридина под сухим N2. Данную суспензию смешивают с раствором трифенилфосфина (37,9 г, 145 ммоль), Aldrithiol 2 (2,2'-дипиридилдисульфидом) (31,8 г, 145 ммоль) и 120 мл пиридина. Смесь нагревают до температуры 57 С в течение 15 ч. По завершении реакции смесь концентрируют под вакуумом с получением пасты желтого цвета, 100 г. Пасту очищают колоночной хроматографией с использованием слоя 2511 см из 1,1 кг силикагеля 60 с размером зерна 230-400 меш. Колонку элюируют 8 л 2% метанола в дихлорметане с последующим использованием линейного градиента в 26 л элюента до получения конечного состава, содержащего 13% метанола. Фракции, содержащие очищенный продукт,концентрируют с получением 12,4 г сырца (5) при выходе, составляющем 65% от теоретического. По результатам 1 Н ЯМР-спектроскопии данный материал содержит приблизительно 15% (по массе) примеси триэтиламина гидрохлорида. Примеси удаляют путем растворения продукта в 350 мл этилацетата, экстракции 20 мл воды, высушивания органического раствора над безводным сульфатом натрия и концентрирования с получением 11,1 г чистого GS-7097 в виде твердого вещества белого цвета при выходе 58%. Процесс используют также для синтеза диастереомерной смеси GS-7003a и GS-7003b(фенилаланиламидата) и смеси GS-7119 и GS7335 (глициламидата). Данные диастереомеры разделяют с использованием метода порционной элюции, такого как представлен в примере 3 А, 6 и 7.(TDF) представлены в табл. 1. GS-7340 демонстрирует 10-кратное повышение антивирусной активности относительно TDF и 200-кратное повышение стабильности в плазме. Полагают,что данная более высокая стабильность в плазме приводит к более высоким уровням циркуляции в крови GS-7340 по сравнению с TDF после перорального введения. Таблица 1 Активность и стабильность in vitro Для оценки относительного содержания внутриклеточного РМРА, обусловленного внутриклеточным метаболизмом TDF, по сравнению с содержанием, связанным с GS-7340, пролекарственные соединения и РМРА метят радиоактивной меткой и вводят в интактную человеческую цельную кровь в эквимолярных концентрациях. Через 1 ч выделяют плазму, красные кровяные клетки (RBC) и мононуклеарные клетки периферической крови (РВМС) и анализируют их с помощью ВЭЖХ с применением радиометрической детекции. Результаты представляют в табл. 2. Через 1 ч GS-7340 приводит к 10-кратному и 30-кратному увеличению общей внутриклеточной концентрации структур РМРА в РВМС по сравнению с TDF и РМРА соответственно. В плазме через 1 ч 84% радиоактивности обусловлено интактным GS-7340, тогда как TDF через 1 ч не определяется. Поскольку интактный TDF не определяется в плазме, 10-кратная разница через 1 ч между TDF и GS-7340 является минимальной разницей, которая ожидается in vivo. На фиг. 1 представлены хроматограммы, полученные с помощью ВЭЖХ, всех трех соединений в РВМС. Таблица 2 Метаболиты РМРА в плазме, РВМС и RBC через 1 ч инкубирования пролекарственных соединений РМРА или РМРА в человеческой крови(метаболиты X и Y). Строчная буква "р" означает фосфорилирование. Данные результаты получают через 1 ч в человеческой крови. Ожидают возрастания разницы in vitro при увеличении периода времени, потому что 84% GS-7340 в плазме остается интактным через один час. Поскольку интактный GS-7340 присутствует в плазме после перорального введения, относительная клиническая эффективность должна быть связана с величинами IС 50 (50% подавляющая концентрация), которые наблюдают inGS-7340 являются на 2-3 порядка величины более активными, чем другие нуклеотиды и нуклеозиды. Таблица 3 Активности антиретровирусных соединений в отношении ВИЧ-1 in vitro 33 Проводят дополнительные исследования отдельных диастереомеров, соответствующих данному изобретению, в плане активности в отношении ВИЧ-1 на клеточной культуре in Ссылка на способ анализа: Arimilli M.N. и соавт., Синтез, биологическая оценка in vitro и биодоступность при пероральном введении пролекарственных соединений 9-[2-(фосфонометокси)пропил]аденина (РМРА) (Synthesis,in vitro biological evaluation and oral bioavailability of 9-[2-(phosphonovethoxy)propyl]adenine"Phe-метилэфир" представляет собой метилфенилаланинилмоноамидат, фениловый моноэфир тенофовира, "gly-метилэфир представляет собой метилглицилмоноамидат, фениловый моноэфир тенофовира. В каждом из вышеописанных случаев полагают, что изомер А имеет абсолютно такую же стереохимию, как GS-7340 (S), и полагают,что изомер В имеет абсолютно такую же стереохимию, как GS-7339. Метаболизм и стабильность in vitro отдельных диастереомеров определяют в PLCE,экстракте МТ-2 и человеческой плазме. Указанный ниже биологический образец (80 мкл) переносят в центрифужную пробирку с завинчивающейся крышкой и инкубируют при 37 С в течение 5 мин. В биологический образец добавляют раствор, содержащий 0,2 мг/мл тестсоединения в подходящем буфере, и перемешивают. Сразу же отбирают образец реакционной смеси (20 мкл) и перемешивают его с 60 мкл метанола, который содержит 0,015 мг/мл 2 гидроксиметилнафталина в качестве внутреннего стандарта для анализа с помощью ВЭЖХ. 34 Данный образец принимают за образец нулевой точки времени. Затем в определенные точки времени отбирают образцы реакционной смеси по 20 мкл и смешивают с 60 мкл метанола, содержащего внутренний стандарт. Полученную таким образом смесь центрифугируют при 15000 G в течение 5 мин и анализируют супернатант с помощью ВЭЖХ в нижеописанных условиях. Биологические образцы оценивают следующим образом.(1) PLCE (карбоксиэстераза свиной печени фирмы Sigma, 160 ед./мг белка, 21 мг белка/мл) разводят в 20 раз PBS (забуференным фосфатом солевым раствором).(2) экстракт клеток МТ-2 готовят из клеток МТ-2 согласно опубликованной методике [A.Farquhar, "Antiviral ChemistryChemotherapy",т. 5, стр. 91-98, (1994)] за исключением использования в качестве среды буфера HEPES, описанного ниже.(3) Человеческая плазма (объединенная нормальная человеческая плазма фирмы GeorgeKing Biomedical Systems, Inc.). В исследованиях используют следующие буферные системы. В исследовании на PLCB тест-соединение растворяют в PBS. PBS (забуференный фосфатом солевой раствор, Sigma) содержит 0,01 М фосфата, 0,0027 М хлорида калия и 0,137 М хлорида натрия. рН 7,4 при 37 С. В исследовании на экстрактах клеток МТ-2 тест-соединение растворяют в буфере HEPES. Буфер HEPES содержит 0,010 М HEPES, 0,05 М хлорида калия, 0,005 М хлорида магния и 0,005 М dl-дитиотреитола. рН 7,4 при 37 С. В исследовании на человеческой плазме тест-соединение растворяют в TBS. TBS (трисзабуференный солевой раствор, Sigma) содержит 0,05 М Трис, 0,0027 М хлорида калия и 0,138 М хлорида натрия. рН 7,5 при 37 С. Анализ с использованием ВЭЖХ проводят в следующих условиях. Колонка: Zorbax Rx-C8, 4,6250 мм, 5 мк(MAC-MOD Analytical, Inc. Chadds Ford, PA) Детекция: УФ при длине волны 260 нм Скорость потока: 1,0 мл/мин Время прохождения: 30 мин Вводимый объем: 20 мкл Температура колонки: температура окружающей среды Подвижная фаза А: 50 мМ фосфат калия(рН 6,0/CH3CN = 50/50 (об./об. Прохождение градиента: 0 мин 100% подвижная фаза А 25 мин 100% подвижная фаза В 30 мин 100% подвижная фаза В Результаты представлены ниже в табл. 5(которая включает также выборочные данные по IC50 из табл. 4). 35 Таблица 5 Метаболизм in vitro изомеров А и В моноамидата РМРА при 37 С Пример 10. Воздействие плазмы и РВМС после перорального введения диастереоизомеров пролекарственного соединения гончим собакам. Фармакокинетику GS 7340 изучают на собаках после перорального введения дозы 10 мгэкв./кг. Препараты. Препараты пролекарственных соединений готовят в виде растворов в 50 мМ лимонной кислоте за 0,5 ч до введения дозы. Все соединения, используемые в исследованиях, синтезированы на фирме Gilead Sciences. Используют следующие партии: Введение дозы и отбор образцов. Прижизненную фазу данного исследования проводят в соответствии с рекомендациями 36 нального института здоровья, 86-23), утвержденными Институционным Комитетом по уходу и использованию животных (InstitutionalAnimal Care and Use Committee). В исследованиях используют привязанных самцов гончих собак (102 кг). Каждое лекарственное вещество вводят перорально в виде одной дозы (1,5-2 мл/кг). Доза составляет 10 мг-экв. РМРА/кг. В случае РВМС образцы крови собирают в точках 0 (перед введением дозы), 2, 8 и 24 ч после введения дозы. В случае плазмы образцы крови собирают в точках 0 (перед введением дозы), 5,15 и 30 мин и 1, 2, 3, 4, 6, 8, 12 и 24 ч после введения дозы. Кровь (1,0 мл) сразу же подвергают центрифугированию при 2000 об./мин в течение 10 мин для получения плазмы. Образцы плазмы замораживают и поддерживают при-70 С до проведения анализа. Получение мононуклеарных клеток периферической крови (РВМС). Цельную кровь (8 мл), взятую в определенные точки времени, смешивают в равной пропорции с забуференным фосфатом солевым раствором (PBS), наслаивают на 15 мл раствораFicoll-Paque (Pharmacia Biotech,) и центрифугируют при 400 х g в течение 40 мин. Слой РВМС удаляют и однократно промывают PBS. Образованный осадок РМВС восстанавливают в 0,5 млPBS, клетки ресуспендируют, подсчитывают с использованием гемоцитометра и поддерживают при температуре 70 С до проведения анализа. Число клеток, умноженное на средний объем одной клетки, используют при вычислении внутриклеточных концентраций. Описанную величину 200 фемтол/клетку используют как объем покоящихся РВМС (см. статью B.L.A. Fridland, Antimicrob. Agents Chemother., т. 42,стр. 612, (1998. Определение РМРА и пролекарственных соединений в плазме и РВМС. Концентрацию РМРА в образцах плазмы собаки определяют путем дериватизации РМРА посредством хлорацетальдегида с образованием производного N1,N6-этенаденина, обладающего сильной флуоресценцией (см. статью L. Naesens, J. Balzarini и Е. De Clercq, Clin. Chem., т. 38, стр. 480, (1992. Вкратце, плазму (100 мкл) смешивают с 200 мкл ацетонитрила для осаждения белка. Затем образцы выпаривают досуха при пониженном давлении и комнатной температуре. Сухие образцы восстанавливают в 200 мкл дериватизационной смеси (0,34% хлорацетальдегида в 100 мМ ацетате натрия, рН 4,5),сильно перемешивают и центрифугируют. Затем супернатант переносят в чистую пробирку с завинчивающейся крышкой и инкубируют при 95 С в течение 40 мин. Дериватизированные образцы затем выпаривают досуха и восстанавливают в 100 мкл воды для проведения анализа с использованием ВЭЖХ. 37 Перед тем, как определять внутриклеточное содержание РМРА с помощью ВЭЖХ, необходимо удалить значительные количества адениновых рибонуклеотидов, присутствующих в экстрактах РВМС, с помощью селективного окисления. Используют модифицированную методику Tanaka и соавт. (см. статью К. Tanaka,A. Yoshioka, S. Tanaka и Y. Wataya, Anal. Biochem., т. 139, стр. 35, (1984. Вкратце, образцы РВМС смешивают в соотношении 1:3 с метанолом и выпаривают досуха при пониженном давлении. Высушенные образцы дериватизируют,как описано для анализа плазмы. Дериватизированные образцы смешивают с 20 мкл 1 М рамнозы и 30 мкл 0,1 М периодата натрия и инкубируют при 37 С в течение 5 мин. После инкубирования добавляют 40 мкл 4 М метиламина и 20 мкл 0,5 М инозина. После инкубирования при 37 С в течение 30 мин образцы выпаривают при пониженном давлении и восстанавливают водой для проведения анализа с использованием ВЭЖХ. Ни в одном из образцов РВМС не определяют интактное пролекарственное соединение. Для образцов плазмы, потенциально содержащих интактные пролекарственные соединения,проводят эксперименты с целью подтверждения того, что во время дериватизации с РМРА не происходят дальнейшие превращения. Стандарты пролекарственных соединений добавляют в не содержащую лекарственное вещество плазму и дериватизируют, как указано. Во всех образцах плазмы отсутствует РМРА на определяемом уровне и предполагаемый % превращения не превышает 1%. Система ВЭЖХ состоит из системы доставки растворителя Р 4000 с автоинжектором(Thermo Separation, San Jose, CA). Колонка представлена колонкой Inertsil ODS-2 (4,6 x 150 мм). Используют следующие подвижные фазы: А, 5% ацетонитрила в 25 мМ буфере на основе фосфата калия с 5 мМ бромидом тетрабутиламмония (ТВАВr), рН 6,0; В, 60% ацетонитрила в 25 мМ буфере на основе фосфата калия с 5 мМ ТВАВr, рН 6,0. Скорость потока составляет 2 мл/мин, и температуру колонки поддерживают на уровне 35 С с помощью нагревателя колонки. Градиентный профиль представляет собой 90% А/10% В в течение 10 мин для РМРА и 65% А/35% В в течение 10 мин для пролекарственного соединения. Детекцию проводят по флуоресценции с возбуждением при длине волны 236 нм и эмиссии при длине волны 420 нм,вводимый объем составляет 10 мкл. Данные получают и хранят в соответствии с лабораторной системой получения данных (PeakPro,Beckman, Allendale, NJ). Фармакокинетические расчеты. Эффекты РМРА и пролекарствеиных соединений выражают как площади под кривыми концентраций в плазме или РВМС от нуля до 24 38 ч (ППК). Величины ППК вычисляют с использованием правила трапеции. Концентрации в плазме и РВМС. Результаты данного исследования представлены на фиг. 2 и 3. На фиг. 2 показано прохождение во времени суммарного воздействия плазмы и РВМС на метаболизм GS 7340-2 после перорального введения чистых диастереомеров пролекарственных соединений РМРА. График на фиг. 3 представляет ППК (площадь под кривой) (0-24 ч) для тенофовира в собачьих РВМС и плазме после подкожного введения РМРА (s.c), TDF и пролекарственных соединений на основе амидатных сложных эфиров. Все амидатные пролекарственные соединения демонстрируют повышение при воздействии РВМС. Например, для GS-7340 показано 21 кратное повышение под воздействием РВМС по сравнению с РМРА (s.c.) и TDF и снижение в 6,25 и 1,29 раза под воздействием плазмы соответственно. Данные результаты показывают in vivo возможность пероральной доставки GS 7340,что снижает до минимума системное воздействие на РМРА и значительно повышает внутриклеточную концентрацию РМРА в клетках, которые в первую очередь чувствительны к репликации ВИЧ. Таблица 6 Воздействие на РМРА в РВМС и плазме при использовании пероральных пролекарственных соединений РМРА на собаках Пример 11. Биораспределение GS-7340. В качестве части предклинической характеризации GS-7340 определяют его биораспределение на собаках. Распределение в ткани GS7340 (изопропилаланинилмоноамидата, фенилового моноэфира тенофовира) исследуют после перорального введения гончим собакам. Двум самцам перорально вводят дозу 14C=GS-7340 му и мононуклеарные клетки периферической крови (РВМС) получают через 24 ч. Мочу и фекалии собирают в клетке в течение 24 ч. Через 24 ч после введения дозы животных умерщвляют и удаляют ткани для анализа. Общую радиоактивность в тканях определяют по окислению и с помощью сцинтилляционного счетчика. Биораспределение РМРА через 24 ч после введения одной пероральной дозы радиоактивно меченного GS 7340 представлено в табл. 4 наряду с данными предшествующих исследований сTDF (GS-4331). В случае TDF концентрация пролекарственного соединения в плазме ниже уровня чувствительности анализа, и основными структурами, наблюдаемыми в плазме, оказывается исходное лекарственное вещество. Уровни РМРА в лимфатических тканях, костном мозге и скелетной мышце повышаются в 10 раз после введения GS-7340. Накопление в лимфатических тканях согласуется с данными, обнаруженными при анализе РВМС, поскольку данные ткани в основном состоят из лимфоцитов. Аналогичным образом, накопление в костном мозге, возможно,обусловлено высоким процентом содержания лимфоцитов (70%) в данной ткани. Таблица 7 Выделение и распределение в тканях радиоактивно меченного GS-7340 у собак (среднее значение, N=2) после перорального введения дозы 10 мг-экв. РМРА/кг Рассчитано с использованием типичного выделения общего числа 15106 клеток и среднего объема РВМС 0,2 пикол/клетку ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ скрининга для идентификации пролекарственного соединения метоксифосфонатного аналога нуклеотида, обладающего повышенной активностью в ткани-мишени, отличающийся тем, что получают по меньшей мере одно указанное пролекарственное соединение,выбирают по меньшей мере одну тканьтерапевтическую мишень и по меньшей мере одну ткань-немишень, вводят пролекарственное соединение в ткань-мишень и в указанную по меньшей мере одну ткань-немишень и определяют относительную активность, обусловленную пролекарственным соединением в указанных тканях. 2. Способ по п.1, отличающийся тем, что активность представлена антивирусной активностью или противоопухолевой активностью. 3. Способ по п.2, отличающийся тем, что активность представлена антивирусной активностью. 41 4. Способ по п.3, отличающийся тем, что активность представлена активностью против ВИЧ или против Hepadnavirus, такого как вирус гепатита В. 5. Способ по п.1, отличающийся тем, что в качестве пролекарственного соединения выбирают соединение РМРА или РМЕА. 6. Способ по п.5, отличающийся тем, что пролекарственное соединение представлено фосфоноамидатом, сложным фосфоноэфиром или смесью фосфоноамидата и сложного фосфоноэфира. 7. Способ по п.6, отличающийся тем, что фосфоноамидат представлен фосфоноамидатом аминокислоты. 8. Способ по п.6, отличающийся тем, что сложный фосфоноэфир представлен арил фосфоноэфиром. 9. Способ по п.1, отличающийся тем, что дополнительно выбирают пролекарственное соединение, обладающее относительной активностью в ткани-мишени, в 10 раз превышающей активность в ткани-немишени. 10. Способ по п.1, отличающийся тем, что ткань-мишень и ткань-немишень находятся в организме животного, пролекарственное соединение вводят указанному животному, а относительную активность определяют посредством анализа тканей животного после введения пролекарственного соединения. 11. Способ по п.1, отличающийся тем, что активность в ткани-мишени и ткани-немишени определяют посредством анализа количества по меньшей мере одного метаболита пролекарственного соединения в данных тканях. 12. Способ по п.11, отличающийся тем, что в качестве метаболита анализируют исходное лекарственное вещество. 13. Способ по п.12, отличающийся тем, что метаболит представляет собой дифосфат исходного лекарственного вещества. 14. Способ по п.1, отличающийся тем, что в качестве ткани-мишени выбирают ткань, инфицированную вирусом, а в качестве тканинемишени - ту же ткань, которая не инфицирована вирусом. 15. Способ по п.1, отличающийся тем, что в качестве ткани-мишени выбирают лимфоидную ткань и определяют активность в отношении ВИЧ. 16. Способ по п.1, отличающийся тем, что в качестве ткани-мишени выбирают печень и определяют активность в отношении вируса гепатита В. 17. Способ по п.1, отличающийся тем, что в качестве ткани-мишени выбирают гематологическую ткань и определяют противоопухолевую активность. 18. Способ по п.1, отличающийся тем, что в качестве ткани-мишени выбирают злокачественную ткань, а в качестве ткани-немишени - ту же ткань, но не злокачественной природы. 42 19. Метоксифосфонатный аналог нуклеотида общей формулы (1) где Ra - Н или метил, а также его хирально обогащенные смеси, соли, их свободные основания и сольваты. 20. Метоксифосфонатный аналог нуклеотида формулы (2) и его обогащенные диастереомеры, соли, свободные основания и сольваты. 21. Соединение, обогащенное диастереомером общей формулы (3) которое практически свободно от диастереомера общей формулы (4) где R1 - сложный оксиэфир, который гидролизуется in vivo, или гидроксил,В - гетероциклическое основание,R2 - гидроксил или остаток аминокислоты,связанный с атомом Р через аминогруппу аминокислоты, в котором каждый карбоксильный заместитель аминокислоты необязательно этерифицирован, но при этом оба R1 и R2 не являются гидроксилами,Е-CH2OCH(R8)O-, где связь, расположенная справа, присоединена к гетероциклическому основанию, пунктир означает необязательную двойную связь, 43R9 - Н, гидроксиметил или ацилоксиметил,и его соли, свободные основания и сольваты. 22. Метоксифосфонатный аналог нуклеотида, обогащенный диастереомером общей формулы (5 а) который практически свободен от диастереомера общей формулы (5b)R6 независимо представлен Н, алкилом,алкенилом, алкинилом, арилом или арилалкилом или R6 независимо представлен алкилом,алкенилом, алкинилом, арилом или арилалкилом, которые замещены 1-3 заместителями, выбранными из алкиламиногруппы, алкиламиноалкила, диалкиламиноалкила, диалкиламиногруппы, гидроксила, оксогруппы, галогена,аминогруппы, алкилтиогруппы, алкоксигруппы,алкоксиалкила, арилоксигруппы, арилоксиалкила, арилалкоксигруппы, арилалкоксиалкила,галогеналкила, нитрогруппы, нитроалкила, азидогруппы, азидоалкила, алкилацила, алкилацилалкила, карбоксила или алкилациламиногруппы;R7 - боковая цепь любой природной или фармацевтически приемлемой аминокислоты,при этом, если боковая цепь содержит карбоксил, то карбоксильная группа необязательно этерифицирована алкильной или арильной группой;R11 - аминогруппа, алкиламиногруппа, оксогруппа или диалкиламиногруппа иR12 - аминогруппа или Н,а также его соли, таутомеры, свободные основания и сольваты. 23. Метоксифосфонатный аналог нуклеотида формулы (6) и его соли и сольваты. 24. Метоксифосфонатный аналог нуклеотида формулы (7) 25. Композиция, отличающаяся тем, что она содержит соединение по любому из пп.1924 и фармацевтически эффективный наполнитель. 26. Композиция по п.25, отличающаяся тем, что в качестве наполнителя она содержит гель. 27. Композиция по п.25, отличающаяся тем, что она пригодна для наружного применения. 28. Способ антивирусной терапии или профилактики, отличающийся тем, что субъекту, нуждающемуся в данном терапевтическом лечении или профилактике, вводят соединение по любому из пп.19-24 в терапевтически или профилактически эффективном количестве. 29. Способ получения метоксифосфонатного аналога нуклеотида, отличающийся тем,что осуществляют взаимодействие 9-(2 гидроксипропил)аденина или 9-(2-гидроксиэтил)аденина с защищенным р-толуолсульфонилоксиметилфосфонатом в присутствии алкоксида магния с получением 9-[2-(фосфонометокси)пропил]аденина (РМРА) или 9-[2(фосфонометокси)этил]аденина (РМЕА) соответственно. 30. Способ по п.29, отличающийся тем, что дополнительно проводят выделение полученного РМРА или РМЕА. 31. Способ по п.29, отличающийся тем, что используют р-толуолсульфонилоксиметилфосфонат, защищенный сложным этиловым эфиром. 32. Способ по п.29, отличающийся тем, что в качестве алкоксида магния выбирают С 1 С 6 алкоксид магния. 33. Способ по п.32, отличающийся тем, что используют трет-бутилоксид или изопропилоксид магния. Фиг. 3 ППК (0-24 ч) для РМРА в РВМС и плазме после перорального введения дозы 10 мг-экв./кг пролекарственных соединений РМРА собакам
МПК / Метки
МПК: A61K 31/675, A61P 31/12, C07F 9/6561, G01N 33/53, C07H 19/20
Метки: варианты, терапии, аналогов, нуклеотидов, профилактики, идентификации, пролекарственные, фосфонатных, антивирусной, получения, композиция, соединения, скрининга, способ, содержащая
Код ссылки
<a href="https://eas.patents.su/24-4926-prolekarstvennye-soedineniya-fosfonatnyh-analogov-nukleotidov-varianty-sposob-ih-polucheniya-sposob-skrininga-dlya-ih-identifikacii-i-soderzhashhaya-ih-kompoziciya-sposob-antivirus.html" rel="bookmark" title="База патентов Евразийского Союза">Пролекарственные соединения фосфонатных аналогов нуклеотидов (варианты), способ их получения, способ скрининга для их идентификации и содержащая их композиция, способ антивирусной терапии или профилактики</a>
Предыдущий патент: 2-(1h-индол-3-ил)-2-оксоацетамиды, обладающие противоопухолевой активностью
Следующий патент: Способ синтеза (3as)-5,5-диоксо-2,3,3а,4-тетрагидро-1h-пирроло[2,1-c][1,2,4]бензотиадиазина
Случайный патент: Способ удержания плазмы, имеющей электроны и ионы, в камере