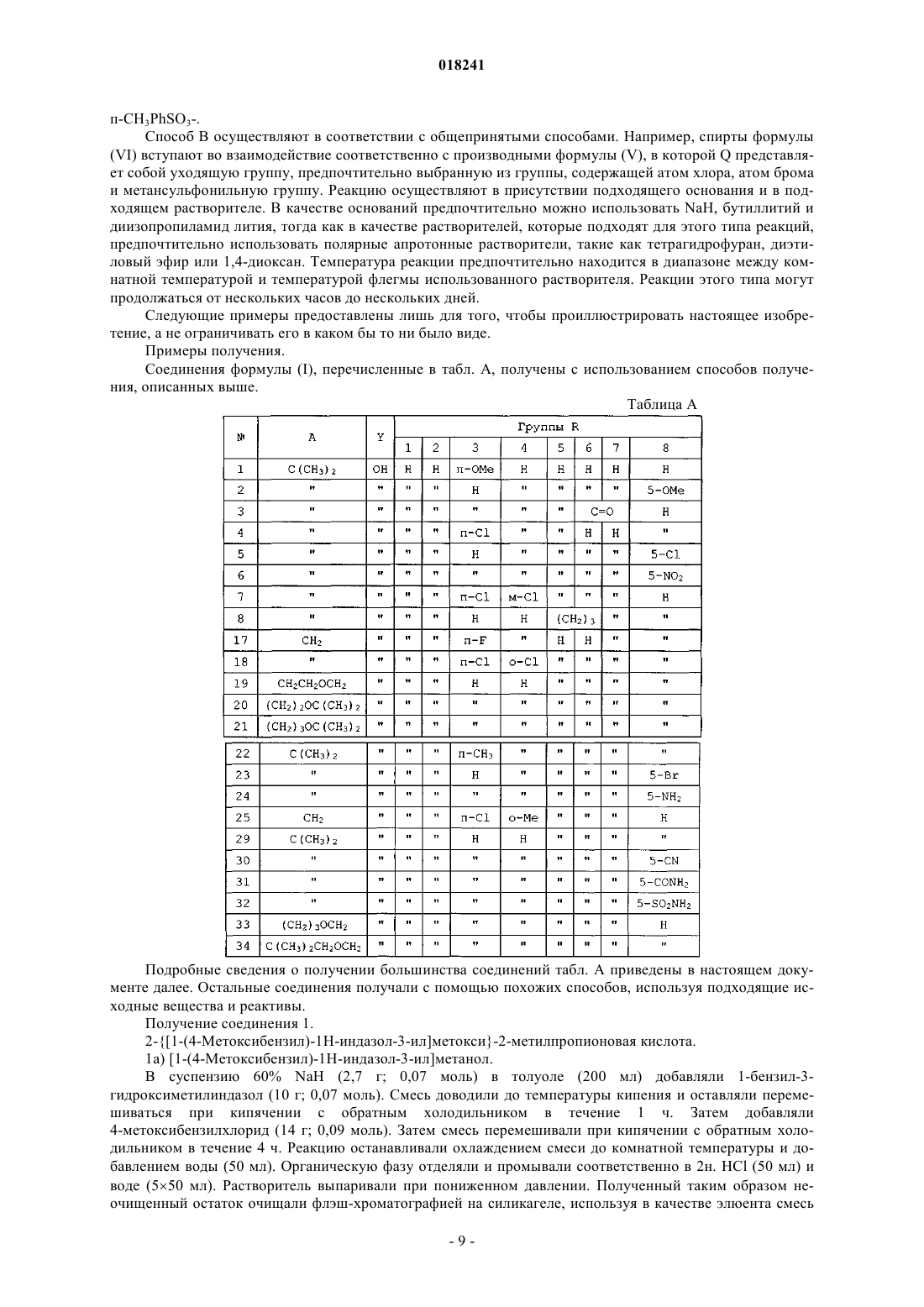
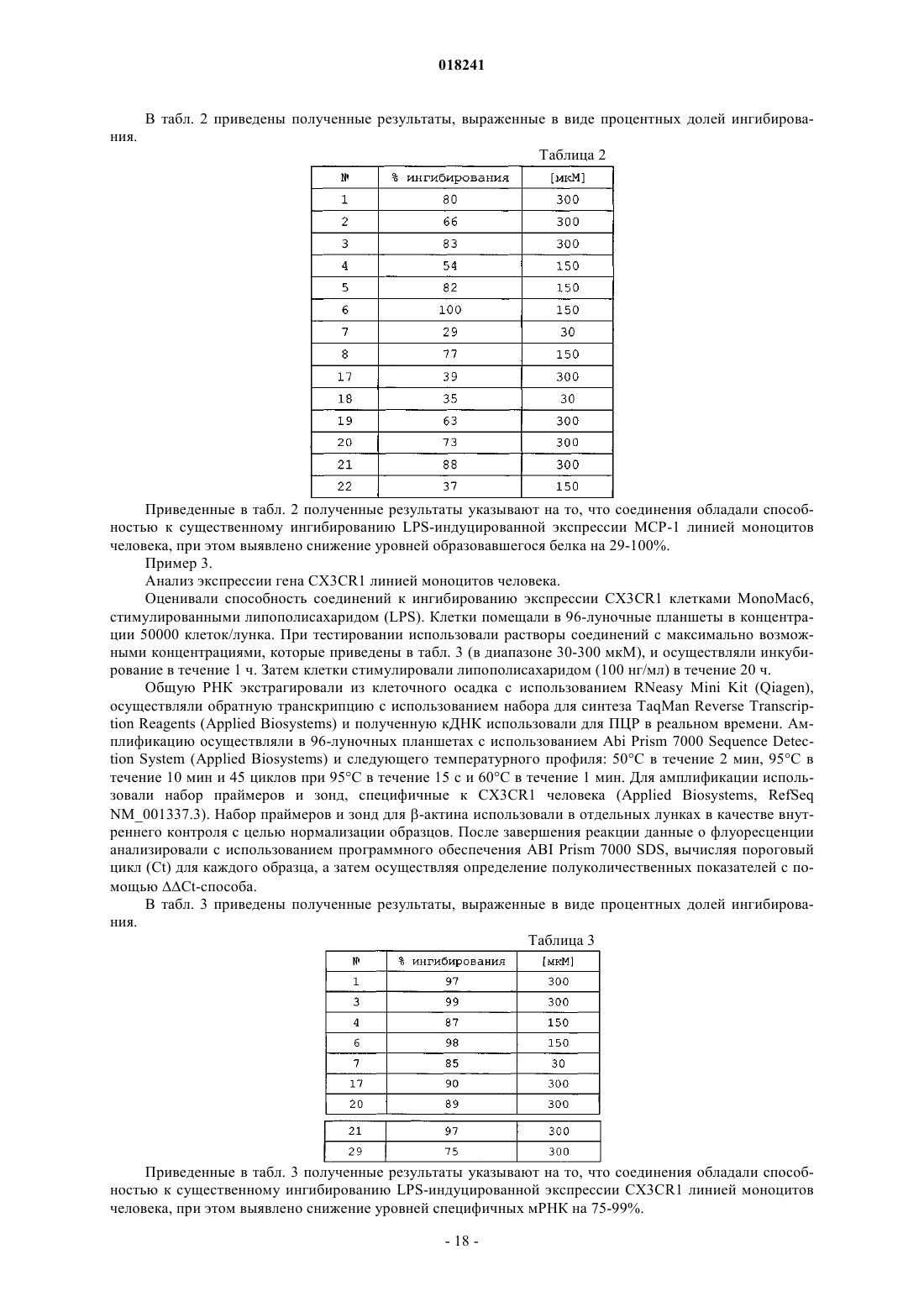
Производные 1-бензил-3-гидроксиметилиндазола и их применение для лечения заболеваний, основанных на экспрессии mcp-1, cx3cr1 и p40
Номер патента: 18241
Опубликовано: 28.06.2013
Авторы: Каццолла Никола, Гульельмотти Анджело, Гарофало Барбара, Фурлотти Гвидо, Мангано Джорджина
Формула / Реферат
1. Соединение формулы (I)

в которой А представляет собой -X1- или -X1-OC(R9)(R10)-, где
X1 представляет собой алкильную группу, которая содержит от 1 до 5 углеродных атомов, необязательно замещенных одной или несколькими алкильными группами, которые содержат от 1 до 5 углеродных атомов, или одной или несколькими алкоксильными группами, которые содержат от 1 до 3 углеродных атомов, и
R9 и R10, которые могут быть одинаковыми или отличающимися друг от друга, представляют собой водород, алкильную группу, которая содержит от 1 до 5 углеродных атомов, или алкоксильную группу, которая содержит от 1 до 3 углеродных атомов;
Y представляет собой OH;
R1 и R2, которые могут быть одинаковыми или отличающимися друг от друга, представляют собой водород, алкильную группу, которая содержит 1 углеродный атом;
R3, R4 и R8, которые могут быть одинаковыми или отличающимися друг от друга, представляют собой водород, алкильную группу, которая содержит от 1 до 5 углеродных атомов, алкоксильную группу, которая содержит от 1 до 3 углеродных атомов, атом галогена, -OH, -N(R')COR'', -CN, -CONR'R'', -SO2NR'R'', -SO2R' и трифторметил, где R' и R'', которые могут быть одинаковыми или отличающимися друг от друга, представлены водородом и алкильной группой, содержащей от 1 до 5 углеродных атомов;
R5 представляет собой водород, алкильную группу, которая содержит 1 углеродный атом, алкоксильную группу, которая содержит от 1 до 3 углеродных атомов, -OH, -N(R')(R''), нитро или R5 вместе с одним из R6 и R7 образует кольцо, которое содержит 5 или 6 углеродных атомов, где R' и R'', которые могут быть одинаковыми или отличающимися друг от друга, представлены водородом и алкильной группой, которая содержит 1 углеродный атом;
R6 и R7, которые могут быть одинаковыми или отличающимися друг от друга, представляют собой водород, алкильную группу, которая содержит 1 углеродный атом, или вместе образуют группу С=O или один из R6 и R7 вместе с R5 образует кольцо, которое содержит 5 или 6 углеродных атомов,
при условии, что A отличается от алкильной группы, содержащей 1 углеродный атом, необязательно замещенный одной или несколькими алкильными группами, которые содержат от 1 до 5 углеродных атомов, или, альтернативно, по меньшей мере одна из групп с R1 по R8 отличается от водорода,
или его фармацевтически приемлемая соль.
2. Соединение по п.1, отличающееся тем, что X1 представляет собой алкильную группу, которая содержит от 1 до 3 углеродных атомов, необязательно замещенных одной или несколькими алкильными группами, которые содержат от 1 до 3 углеродных атомов, или одной или несколькими алкоксильными группами, которые содержат 1 или 2 углеродных атома.
3. Соединение по п.1, отличающееся тем, что Х1 выбран из группы, содержащей группу CH2, группу CH2CH2 или группу C(CH3)2, и R9 и R10, которые могут быть одинаковыми или отличающимися друг от друга, представляют собой водород или группу CH3.
4. Соединение по п.1, отличающееся тем, что радикал A выбран из группы, содержащей группу CH2, группу CH2CH2, группу C(CH3)2, группу CH2CH2OCH2, группу CH2CH2OC(CH3)2 и группу CH2CH2CH2OC(CH3)2.
5. Соединение по п.1, отличающееся тем, что R3, R4 и R8, которые могут быть одинаковыми или отличающимися друг от друга, выбраны из группы, содержащей водород, алкильную группу, которая содержит от 1 до 3 углеродных атомов, алкоксильную группу, которая содержит 1 или 2 углеродных атома, атом Br, Cl или F, группу OH, трифторметил или группу -N(R')COR'', -CN, -CONR'R'', -SO2NR'R'', -SO2R', где R' и R'', которые могут быть одинаковыми или отличающимися друг от друга, представлены водородом и алкильной группой, которая содержит от 1 до 3 углеродных атомов.
6. Соединение по п.1, отличающееся тем, что R5 выбран из группы, содержащей водород, алкильную группу, которая содержит 1 углеродный атом, алкоксильную группу, которая содержит 1 или 2 углеродных атома, группу OH, или R5 вместе с одним из R6 и R7 образует кольцо, которое содержит 5 или 6 углеродных атомов.
7. Соединение по п.1, отличающееся тем, что R6 и R7, которые могут быть одинаковыми или отличающимися друг от друга, выбраны из группы, содержащей водород, алкильную группу, которая содержит 1 углеродный атом, или вместе образуют группу C=O или один из R6 и R7 вместе с R5 образует кольцо, которое содержит 5 или 6 углеродных атомов.
8. Фармацевтическая композиция, содержащая соединение формулы (I) по любому из предыдущих пунктов или его фармацевтически приемлемую соль, и по меньшей мере один фармацевтически приемлемый носитель.
9. Фармацевтическая композиция по п.8, отличающаяся тем, что указанная фармацевтически приемлемая соль представляет собой соль присоединения физиологически приемлемой органической или неорганической кислоты или основания.
10. Фармацевтическая композиция по п.9, отличающаяся тем, что указанные физиологически приемлемые кислоты выбраны из группы, содержащей соляную, бромисто-водородную, серную, фосфорную, азотную, уксусную, аскорбиновую, бензойную, лимонную, фумаровую, молочную, малеиновую, метансульфоновую, щавелевую, паратолуолсульфоновую, бензолсульфоновую, янтарную, дубильную и винную кислоты.
11. Фармацевтическая композиция по п.9, отличающаяся тем, что указанные физиологически приемлемые основания выбраны из группы, содержащей гидроксид аммония, гидроксид кальция, карбонат магния, гидрокарбонат натрия, гидрокарбонат калия, аргинин, бетаин, кофеин, холин, N,N-дибензилэтилендиамин, диэтиламин, 2-диэтиламиноэтанол, 2-диметиламиноэтанол, этаноламин, этилендиамин, N-этилморфолин, N-этилпиперидин, N-метилглюкамин, глюкамин, глюкозамин, гистидин, N-(2-гидроксиэтил)пиперидин, N-(2-гидроксиэтил)пирролидин, изопропиламин, лизин, метилглюкамин, морфолин, пиперазин, пиперидин, теобромин, триэтиламин, триметиламин, трипропиламин и трометамин.
12. Фармацевтическая композиция по любому из пп.8-11, отличающаяся тем, что указанная композиция содержит стереоизомер или энантиомер соединения формулы (I) или его фармацевтически приемлемой соли.
13. Фармацевтическая композиция по любому из пп.8-12, отличающаяся тем, что указанный фармацевтически приемлемый носитель выбран из группы, содержащей глиданты, связующие вещества, дезинтегрирующие средства, наполнители, разбавители, ароматизаторы, красители, флюидизирующие средства, смазывающие вещества, консерванты, увлажнители, абсорбенты и подсластители.
14. Применение соединения формулы (I)

в которой А представляет собой -X1- или -X1-OC(R9)(R10)-,
где X1 представляет собой алкильную группу, которая содержит от 1 до 5 углеродных атомов, необязательно замещенных одной или несколькими алкильными группами, содержащими от 1 до 5 углеродных атомов, или одной или несколькими алкоксильными группами, которые содержат от 1 до 3 углеродных атомов, и
R9 и R10, которые могут быть одинаковыми или отличающимися друг от друга, представляют собой водород, алкильную группу, которая содержит от 1 до 5 углеродных атомов, или алкоксильную группу, которая содержит от 1 до 3 углеродных атомов;
Y представляет собой OH;
R1 и R2, которые могут быть одинаковыми или отличающимися друг от друга, представляют собой водород, алкильную группу, которая содержит 1 углеродный атом;
R3, R4 и R8, которые могут быть одинаковыми или отличающимися друг от друга, представляют собой водород, алкильную группу, которая содержит от 1 до 5 углеродных атомов, алкоксильную группу, которая содержит от 1 до 3 углеродных атомов, атом галогена, -OH, -N(R')COR'', -CN, -CONR'R'', -SO2NR'R'', -SO2R' и трифторметил, где R' и R'', которые могут быть одинаковыми или отличающимися друг от друга, представлены водородом и алкильной группой, которая содержит от 1 до 5 углеродных атомов;
R5 представляет собой водород, алкильную группу, которая содержит 1 углеродный атом, алкоксильную группу, которая содержит от 1 до 3 углеродных атомов, -OH, -N(R')(R''), нитро или R5 вместе с одним из R6 и R7 образует кольцо, которое содержит 5 или 6 углеродных атомов, где R' и R'', которые могут быть одинаковыми или отличающимися друг от друга, представлены водородом и алкильной группой, которая содержит 1 углеродный атом;
R6 и R7, которые могут быть одинаковыми или отличающимися друг от друга, представляют собой водород, алкильную группу, которая содержит 1 углеродный атом, или вместе образуют группу C=O или один из R6 и R7 вместе с R5 образует кольцо, которое содержит 5 или 6 углеродных атомов,
для получения фармацевтической композиции для лечения заболеваний, основанных на экспрессии CX3CR1 и p40, выбранных из группы, состоящей из волчаночного нефрита, диабетической нефропатии, болезни Крона, язвенного колита, заболеваний коронарных сосудов, рестеноза, инфаркта миокарда, стенокардии, хронических дегенеративных воспалительных заболеваний, псориаза, диабета II типа, опухолей и рака.
15. Применение соединения формулы (I)
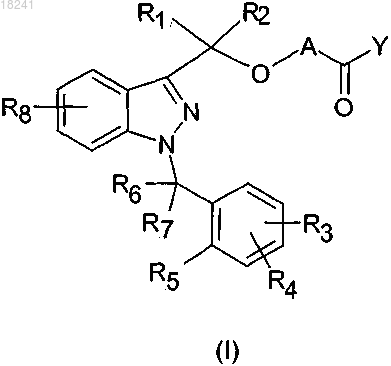
в которой А представляет собой -X1- или -X1-OC(R9)(R10)-,
где X1 представляет собой алкильную группу, которая содержит от 1 до 5 углеродных атомов, необязательно замещенных одной или несколькими алкильными группами, которые содержат от 1 до 5 углеродных атомов, или одной или несколькими алкоксильными группами, которые содержат от 1 до 3 углеродных атомов, и
R9 и R10, которые могут быть одинаковыми или отличающимися друг от друга, представляют собой водород, алкильную группу, которая содержит 1 углеродный атом;
Y представляет собой OH;
R1 и R2, которые могут быть одинаковыми или отличающимися друг от друга, представляют собой водород, алкильную группу, которая содержит 1 углеродный атом;
R3, R4 и R8, которые могут быть одинаковыми или отличающимися друг от друга, представляют собой водород, алкильную группу, которая содержит от 1 до 5 углеродных атомов, алкоксильную группу, которая содержит от 1 до 3 углеродных атомов, атом галогена, -OH, -N(R')COR'', -CN, -CONR'R'', -SO2NR'R'', -SO2R' и трифторметил, где R' и R'', которые могут быть одинаковыми или отличающимися друг от друга, представлены водородом и алкильной группой, которая содержит от 1 до 5 углеродных атомов;
R5 представляет собой водород, алкильную группу, которая содержит 1 углеродный атом, алкоксильную группу, которая содержит от 1 до 3 углеродных атомов, -OH, -N(R')(R''), нитро или R5 вместе с одним из R6 и R7 образует кольцо, которое содержит 5 или 6 углеродных атомов, где R' и R'', которые могут быть одинаковыми или отличающимися друг от друга, представлены водородом и алкильной группой, которая содержит 1 углеродный атом;
R6 и R7, которые могут быть одинаковыми или отличающимися друг от друга, представляют собой водород, алкильную группу, которая содержит 1 углеродный атом, или вместе образуют группу С=O или один из R6 и R7 вместе с R5 образует кольцо, которое содержит 5 или 6 углеродных атомов,
при условии, что A отличается от алкильной группы, которая содержит 1 углеродный атом, необязательно замещенный одной или несколькими алкильными группами, которые содержат от 1 до 5 углеродных атомов, или, альтернативно, по меньшей мере одна из групп с R1 по R8 отличается от водорода,
для получения фармацевтической композиции для лечения заболеваний, основанных на экспрессии MCP-1, CX3CR1 и p40.
16. Применение по п.15, отличающееся тем, что указанные заболевания, основанные на экспрессии MCP-1 и CX3CR1, выбраны из группы, содержащей заболевания суставов, заболевания почек, сердечно-сосудистые заболевания, метаболический синдром, ожирение, диабет, резистентность к инсулину и рак.
17. Применение по п.15, отличающееся тем, что указанные заболевания, основанные на экспрессии MCP-1, выбраны из группы, содержащей ревматоидный артрит, артрит, вызванный вирусной инфекцией, псориатический артрит, артроз, волчаночный нефрит, диабетическую нефропатию, гломерулонефрит, поликистозное поражение почек, интерстициальное заболевание легких, фиброз, рассеянный склероз, болезнь Альцгеймера, ВИЧ-ассоциированное слабоумие, атопический дерматит, псориаз, васкулит, рестеноз, атеросклероз, инфаркт миокарда, стенокардию, острые заболевания коронарных артерий, аденомы, карциномы и метастазы, метаболические заболевания и осложнения после хирургических вмешательств.
18. Применение по п.15, отличающееся тем, что указанные заболевания, основанные на экспрессии CX3CR1, выбраны из группы, содержащей ревматоидный артрит, волчаночный нефрит, диабетическую нефропатию, болезнь Крона, язвенный колит, заболевания коронарных сосудов, рестеноз, атеросклероз, инфаркт миокарда, стенокардию и осложнения после хирургических вмешательств.
19. Применение по п.15, отличающееся тем, что указанные заболевания, основанные на экспрессии p40, выбраны из группы, содержащей аутоиммунные заболевания, хронические дегенеративные воспалительные заболевания и рак.
20. Применение по п.15, отличающееся тем, что указанные заболевания, основанные на экспрессии p40, выбраны из группы, содержащей ревматоидный артрит, псориаз, гломерулонефрит, диабет, красную волчанку, болезнь Крона и опухоли.
21. Способ лечения или предупреждения заболеваний, основанных на экспрессии CX3CR1 и p40, выбранных из группы, состоящей из волчаночного нефрита, диабетической нефропатии, болезни Крона, язвенного колита, заболеваний коронарных сосудов, рестеноза, инфаркта миокарда, стенокардии, хронических дегенеративных воспалительных заболеваний, псориаза, диабета II типа, опухолей и рака, характеризующийся введением пациенту, нуждающемуся в этом, эффективного количества соединения формулы (I)

в которой А представляет собой -X1- или -X1-OC(R9)(R10)-,
где Х1 представляет собой алкильную группу, которая содержит от 1 до 5 углеродных атомов, необязательно замещенных одной или несколькими алкильными группами, которые содержат от 1 до 5 углеродных атомов, или одной или несколькими алкоксильными группами, которые содержат от 1 до 3 углеродных атомов, и
R9 и R10, которые могут быть одинаковыми или отличающимися друг от друга, представляют собой водород, алкильную группу, которая содержит от 1 до 5 углеродных атомов, или алкоксильную группу, которая содержит от 1 до 3 углеродных атомов;
Y представляет собой OH;
R1 и R2, которые могут быть одинаковыми или отличающимися друг от друга, представляют собой водород, алкильную группу, которая содержит 1 углеродный атом;
R3, R4 и R8, которые могут быть одинаковыми или отличающимися друг от друга, представляют собой водород, алкильную группу, которая содержит от 1 до 5 углеродных атомов, алкоксильную группу, которая содержит от 1 до 3 углеродных атомов, атом галогена, -OH, -N(R')COR'', -CN, -CONR'R'', -SO2NR'R'', -SO2R' и трифторметил, где R' и R'', которые могут быть одинаковыми или отличающимися друг от друга, представлены водородом и алкильной группой, которая содержит от 1 до 5 углеродных атомов;
R5 представляет собой водород, алкильную группу, которая содержит 1 углеродный атом, алкоксильную группу, которая содержит от 1 до 3 углеродных атомов, -OH, -N(R')(R''), нитро или R5 вместе с одним из R6 и R7 образует кольцо, которое содержит 5 или 6 углеродных атомов, где R' и R'', которые могут быть одинаковыми или отличающимися друг от друга, представлены водородом и алкильной группой, которая содержит 1 углеродный атом; и
R6 и R7, которые могут быть одинаковыми или отличающимися друг от друга, представляют собой водород, алкильную группу, которая содержит 1 углеродный атом, или вместе образуют группу C=O или один из R6 и R7 вместе с R5 образует кольцо, которое содержит 5 или 6 углеродных атомов.
22. Способ лечения или предупреждения заболеваний, основанных на экспрессии MCP-1, CX3CR1 и p40, характеризующийся введением пациенту, нуждающемуся в этом, эффективного количества соединения формулы (I)

в которой А представляет собой -X1- или -X1-OC(R9)(R10)-,
где X1 представляет собой алкильную группу, которая содержит от 1 до 5 углеродных атомов, необязательно замещенных одной или несколькими алкильными группами, которые содержат от 1 до 5 углеродных атомов, или одной или несколькими алкоксильными группами, которые содержат от 1 до 3 углеродных атомов, и
R9 и R10, которые могут быть одинаковыми или отличающимися друг от друга, представляют собой водород, алкильную группу, которая содержит от 1 до 5 углеродных атомов, или алкоксильную группу, которая содержит от 1 до 3 углеродных атомов;
Y представляет собой OH;
R1 и R2, которые могут быть одинаковыми или отличающимися друг от друга, представляют собой водород, алкильную группу, которая содержит 1 углеродный атом;
R3, R4 и R8, которые могут быть одинаковыми или отличающимися друг от друга, представляют собой водород, алкильную группу, которая содержит от 1 до 5 углеродных атомов, алкоксильную группу, которая содержит от 1 до 3 углеродных атомов, атом галогена, -OH, -N(R')COR'', -CN, -CONR'R'', -SO2NR'R'', -SO2R' и трифторметил, где R' и R'', которые могут быть одинаковыми или отличающимися друг от друга, представлены водородом и алкильной группой, которая содержит от 1 до 5 углеродных атомов;
R5 представляет собой водород, алкильную группу, которая содержит 1 углеродный атом, алкоксильную группу, которая содержит от 1 до 3 углеродных атомов, -OH, -N(R')(R''), нитро или R5 вместе с одним из R6 и R7 образует кольцо, которое содержит 5 или 6 углеродных атомов, где R' и R'', которые могут быть одинаковыми или отличающимися друг от друга, представлены водородом и алкильной группой, которая содержит 1 углеродный атом; и
R6 и R7, которые могут быть одинаковыми или отличающимися друг от друга, представляют собой водород, алкильную группу, которая содержит 1 углеродный атом, или вместе образуют группу C=O или один из R6 и R7 вместе с R5 образует кольцо, которое содержит 5 или 6 углеродных атомов,
при условии, что A отличается от алкильной группы, которая содержит 1 углеродный атом, необязательно замещенный одной или несколькими алкильными группами, которые содержат от 1 до 5 углеродных атомов, или, альтернативно, по меньшей мере одна из групп с R1 по R8 отличается от водорода.
Текст
ПРОИЗВОДНЫЕ 1-БЕНЗИЛ-3-ГИДРОКСИМЕТИЛИНДАЗОЛА И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, ОСНОВАННЫХ НА ЭКСПРЕССИИ MCP-1, CX3CR1 И p40 Изобретение относится к новым производным 1-бензил-3-гидроксиметилиндазола,соответствующим формуле (I), в которой A, Y и R1-R8 имеют значения, указанные в формуле изобретения, и к фармацевтической композиции, содержащей их вместе с фармацевтически приемлемым носителем. Кроме того, изобретение относится к применению производных 1-бензил-3-гидроксиметилиндазола для получения фармацевтической композиции, которая эффективна при лечении заболеваний, основанных на экспрессии MCP-1, CX3CR1 и p40, и к их применению в способе лечения или предупреждения заболеваний, основанных на экспрессии(71)(73) Заявитель и патентовладелец: АЦЬЕНДЕ КИМИКЕ РЬЮНИТЕ АНДЖЕЛИНИ ФРАНЧЕСКО Новые производные 1-бензил-3-гидроксиметилиндазола и их применение для лечения заболеваний,основанных на экспрессии MCP-1, CX3CR1 и p40. Область изобретения Настоящее изобретение относится к производным 1-бензил-3-гидроксиметилиндазола, к содержащей их фармацевтической композиции и к их применению для лечения заболеваний, основанных на экспрессии MCP-1, CX3CR1 и p40. В частности, настоящее изобретение относится к новым производным 1-бензил-3 гидроксиметилиндазола, соответствующим приведенной ниже формуле (I), и к фармацевтической композиции, содержащей их вместе с фармацевтически приемлемым носителем. Кроме того, настоящее изобретение относится к применению производных 1-бензил-3-гидроксиметилиндазола для получения фармацевтической композиции, которая эффективна для лечения заболеваний, основанных на экспрессииMCP-1, CX3CR1 и p40, и к их применению в способе лечения или предупреждения заболеваний, основанных на экспрессии MCP-1, CX3CR1 и p40. Предпосылки изобретения Как известно, MCP-1 (моноцитарный хемотаксический белок-1) является белком, который принадлежит к хемокиновому подсемейству . MCP-1 обладает мощным хемотаксическим действием на моноциты, а также оказывает свое действие на T-лимфоциты, тучные клетки и базофилы (Rollins B.J.,Chemokines, Blood 1997; 90:909-928; М. Baggiolini, Chemokines and leukocyte traffic, Nature, 1998; 392:565-568). К подсемействупринадлежат и другие хемокины, такие как MCP-2 (моноцитарный хемотаксический белок-2), MCP-3, MCP-4, MIP-1 и MIP-1, RANTES. Подсемействоотличается от подсемействатем, что в структуре подсемействапервые два цистеина расположены рядом, тогда как в подсемействеони разделены находящейся между ними аминокислотой.MCP-1 продуцируется различными типами клеток (лейкоцитами, тромбоцитами, фибробластами,клетками эндотелия и гладкомышечными клетками). Среди всех известных хемокинов MCP-1 проявляет самую высокую специфичность к моноцитам и макрофагам, для которых он является не только хемотаксическим фактором, но также и активирующим стимулом и, таким образом, индуцирует процессы образования многочисленных воспалительных факторов (супероксидов, арахидоновой кислоты и производных, цитокинов/хемокинов) и усиливает фагоцитарную активность. Секреция хемокинов целом и MCP-1 в частности в основном индуцируется различными провоспалительными факторами, например интерлейкином-1 (IL-1), интерлейкином-2 (IL-2), TNF- (фактором некроза опухоли ), интерфероном- и бактериальными липополисахаридами (LPS). Предотвращение воспалительного ответа посредством блокирования хемокина/хемокиновой рецепторной системы является одной из основных мишеней фармакологического воздействия (Gerard С. andRollins В.J., Chemokines and disease. Nature Immunol. 2001; 2:108-115). Существует множество свидетельств, которые указывают на то, что MCP-1 играет ключевую роль в ходе воспалительных процессов и при различных патологиях отмечен в качестве новой и валидированной мишени. Данные о значительном патофизиологическом вкладе MCP-1 были получены на пациентах с воспалительными заболеваниями суставов и почек (ревматоидный артрит, волчаночный нефрит, диабетическая нефропатия и отторжение после трансплантации). Однако совсем недавно было показано, что MCP-1 относится к факторам, вовлеченным в воспалительные патологии ЦНС (рассеянный склероз, болезнь Альцгеймера, ВИЧ-ассоциированное слабоумие) и другие патологии и состояния как с явным воспалительным компонентом, так и без него, включая атопический дерматит, колит, интерстициальные заболевания легких, рестеноз, атеросклероз, осложнения после хирургического вмешательства (например, ангиопластики, артериэктомии, трансплантации, замены органа и/или ткани, имплантации протеза), рак (аденомы, карциномы и метастазы) и даже такие метаболические заболевания, как резистентность к инсулину и ожирение. Кроме того, несмотря на тот факт, что система хемокинов вовлечена в управление и преодоление вирусной инфекции, недавние исследования показали, что ответ определенных хемокинов и, в частности,MCP-1 может иметь вредоносное значение в случае взаимодействия организма-хозяина и патогена. В частности, было показано, что MCP-1 относится к хемокинам, которые способствуют повреждению органов и тканей при патологиях, опосредованных альфа-вирусами, которое отличается моноцитарномакрофагальной инфильтрацией суставов и мышц (Mahalingam S. et al. Chemokines and viruses: friend orof disease pathogenesis. 2005, 107:329-342). Моноциты являются основными предшественниками макрофагов и дендритных клеток и играют решающую роль медиаторов воспалительных процессов. CX3CR1, вместе со своим лигандом CX3CL1(фракталкин), является ключевым фактором в регулировании миграции и адгезии моноцитов. CX3CR1 экспрессируется моноцитами, тогда как CX3CL1 представляет собой трансмембранный хемокин эндотелиальных клеток. Генетические исследования, проводившиеся на людях и на животных моделях, продемонстрировали важную роль CX3CR1 и CX3CL1 в патофизиологии воспалительных заболеваний. В действительности существует множество свидетельств, которые указывают на ключевой вклад CX3CR1 и его лиганда в патогенез и развитие воспалительных заболеваний суставов, почек, желудочно-кишечного тракта и сосудов (например, ревматоидного артрита, волчаночного нефрита, диабетической нефропатии,болезни Крона, язвенного колита, рестеноза и атеросклероза). Экспрессия CX3CR1 подвергается сверхрегуляции в T-клетках, которые, как полагают, накапливаются в синовиальной оболочке у пациентов, страдающих от ревматоидного артрита. Кроме того, экспрессия CX3CL1 подвергается сверхрегуляции в эндотелиальных клетках и фибробластах, присутствующих в синовиальной оболочке этих пациентов. Таким образом, система CX3CR1/CX3CL1 играет важную роль в управлении типом клеток и видом инфильтрации синовиальной оболочки и содействует патогенезу ревматоидного артрита (Nanki T. et al., "Migration of CX3CRl-positive T-cells producing type 1cytokines and cytotoxic molecules into the synovium of patients with rheumatoid arthritis", ArthritisRheumatism (2002), vol. 46, No. 11, p. 2878-2883). У пациентов, страдающих от повреждения почек, преобладающая часть воспалительных лейкоцитов, инфильтрирующих почки, экспрессирует CX3CR1, который, в частности, экспрессируется на двух основных типах клеток, которые вовлечены в самые распространенные воспалительные патологии почек и в отторжения трансплантата почки, на T-клетках и моноцитах (Segerer S. et al., Expression of thefractalkine receptor (CX3CR1) in human kidney diseases, Kidney International (2002), 62, p. 488-495). Также предполагалось, что система CX3CR1/CX3CL1 принимает участие в воспалительных заболеваниях кишечника (IBD). На самом деле, в случае с пациентами, страдающими от IBD (например, от болезни Крона и язвенного колита), значительное увеличение образования CX3CL1 капиллярной системой кишечника и значительное увеличение CX3CR1-положительных клеток было продемонстрировано как на циркуляторном уровне, так и в слизистых (Sans M. et al., "Enhanced recruitment of CX3CR1+T-cells bymucosal endothelial cell-derived fractalkine in inflammatory bowel diseases", Gastroenterology, 2007, vol. 132,No. 1, p. 139-153). Еще больший интерес представляет сообщение о ключевой роли, которую играет системаCX3CR1/CX3CL1 в повреждении сосудов и, в частности, при патологических состояниях, например при атеросклерозе и рестенозе. Отмечалось, что CX3CR1 является решающим фактором в процессе инфильтрации и накопления моноцитов в сосудистой стенке, а полиморфизм CX3CR1 у пациента связан со сниженной распространенностью атеросклероза, коронарных заболеваний и рестеноза (Liu P. et al.,"Cross-talk among Smad, MAPK and integrin signalling pathways enhances adventitial fibroblast functionsIL-12 и IL-23 являются членами маленького семейства провоспалительных гетеродимерных цитокинов. Оба цитокина имеют общую субъединицу p40, которая ковалентно соединена или с субъединицей р 35 и образует зрелую форму IL-12, или с субъединицей р 19 и образует зрелую форму IL-23. Рецептор для IL-12 образован субъединицами IL-12R1 и IL-12R2, тогда как рецептор для IL-23 образован субъединицами IL-12R1 и IL-23R.IL-12 и IL-23 в основном экспрессируются активированными дендритными клетками и фагоцитами. Рецепторы для этих двух цитокинов экспрессируются на T- и NK-клетках и NK T-клетках, но низкие уровни комплексов рецептора для IL-23 также присутствуют в моноцитах, макрофагах и дендритных клетках. Несмотря на эти сходства, существует множество свидетельств, которые указывают на то, что IL-12 и IL-23 управляют различными иммунорегуляторными сетями. На самом деле, тогда как IL-12 управляет развитием Th1 клеток, которые обладают способностью продуцировать -интерферон (IFN-), и увеличивает цитотоксический, противомикробный и противоопухолевый ответ, IL-23 управляет сетью, которая обеспечивает образование CD4+ клеток, которые обладают способностью продуцировать IL-17. Индуцирование IL-23-зависимых процессов ведет к мобилизации различных типов воспалительных клеток, например TH-17, при этом также была продемонстрирована его ключевая роль в патогенезе многих воспалительных патологий, опосредованных иммунологическими реакциями. Типичными примерами патологий, связанных с экспрессией p40, являются хронические воспалительные заболевания суставов (например, ревматоидный артрит), кожи (например, псориаз) и желудочно-кишечного тракта (например, болезнь Крона). Однако IL-23 также играет роль в содействии возникновению и росту опухолей. На самом деле, IL-23 управляет рядом сетей в микроокружении опухоли,стимулируя ангиогенез и образование медиаторов воспаления. Псориаз представляет собой хроническое воспалительное заболевание кожи, которым поражено 3% мировой популяции (Koo J. Dermatol. Clin. 1996, 14:485-96; Schon M.P. et al., N. Engl. J. Med. 2005,352:1899-912). Выявлена корреляция между аберрантным иммунным ответом 1 типа и патогенезом псориаза, а цитокины, индуцирующие этот ответ, например IL-12 и IL-23, могут представлять собой подходящие терапевтические мишени. Экспрессия IL-12 и IL-23, которые обладают общей субъединицей p40,значительно увеличивается в псориатических бляшках, а в доклинических исследованиях продемонстрирована роль этих цитокинов в патогенезе псориаза. Совсем недавно была доказана эффективность лечения пациентов, страдающих от псориаза, моноклональными антителами против IL-12 и IL-23, которая выражалась в улучшении признаков развития и тяжести заболевания, вследствие чего была увеличена роль IL-12 и IL-23 в патофизиологии псориаза. Болезнь Крона представляет собой хроническое воспалительное заболевание пищеварительного тракта, которое может поражать любую его часть - ото рта до анального отверстия. В основном оно поражает терминальную часть подвздошной кишки и четко определенные области толстой кишки. Часто оно ассоциировано с системными аутоиммунными заболеваниями, такими как язвы во рту и ревматоидный артрит. Болезнью Крона поражено более 500000 человек в Европе и 600000 человек в Соединенных Штатах. Болезнь Крона представляет собой заболевание, связанное с чрезмерной активностью цитокинов,которая опосредована Th1 клетками. IL-12 является ключевым цитокином в инициации воспалительной реакции, опосредованной Th1 клетками. Болезнь Крона отличается увеличенным образованием IL-12 клетками, представляющими антиген в ткани кишечника, а также -интерферона (IFN-) и TNF- лимфоцитами и макрофагами кишечника. Эти цитокины индуцируют и поддерживают воспалительный процесс и утолщение стенки кишечника, что является отличительными признаками данной патологии. Доклинические и клинические сведения демонстрируют то, что ингибирование IL-12 позволяет эффективно контролировать воспалительную реакцию на моделях воспаления кишечника и/или у пациентов, страдающих от болезни Крона. Теперь взаимосвязь между раком и воспалением является установленным фактом. Многие формы опухолей берут начало из воспаленных областей, а медиаторы воспаления часто продуцируются опухолями. Было установлено, что IL-23 является цитокином, который ассоциирован с раком и, в частности,экспрессия IL-23 значительно увеличена в образцах карциномы пациента по сравнению с нормальными прилежащими тканями. Кроме того, отсутствие значительной экспрессии IL-23 в нормальных прилежащих тканях указывает на сверхрегуляцию IL-23 в опухолях, что увеличивает его роль в опухолеобразовании. В европейском патенте ЕР-В-0382276 описано множество производных 1-бензил-3 гидроксиметилиндазола, обладающих обезболивающим действием. С другой стороны, в европейском патенте ЕР-В-0510748, в свою очередь, описано применение этих производных для получения фармацевтической композиции, которая эффективна при лечении аутоиммунных заболеваний. Наконец, в европейскомпатенте ЕР-В-1005332 описано применение этих производных для получения фармацевтической композиции, которая эффективна при лечении заболеваний, основанных на образовании MCP-1. Полагают, что 2-метил-2-[1-(фенилметил)-1 Н-индазол-3-ил]метоксипропионовая кислота обладает способностью к дозозависимому ингибированию образования MCP-1 и TNF-, индуцированного в моноцитах с помощью LPS из Candida albicans in vitro, тогда как для того же соединения не было выявлено влияние на образование цитокинов IL-1 и IL-6 и хемокинов IL-8, MIP-1 и RANTES (Sironi M. et al., "A smallchemotactic protein-1", European Cytokine Network, vol. 10, No. 3, 437-41, September 1999). Европейская патентная заявка ЕР-А-1185528 относится к применению производных триазина для ингибирования образования IL-12. Европейские патентные заявки ЕР-А-1188438 и ЕР-А-1199074 относятся к применению ингибиторов фермента PDE4, например Ролипрама, Арифло и диазепин-индольных производных, в лечении и предотвращении заболеваний, связанных с чрезмерным образованием IL-12. Европейская патентная заявка ЕР-А-1369119 относится к применению гиалуронана с молекулярной массой между 600000 и 3000000 Да для управления и ингибирования экспрессии IL-12. Европейская патентная заявка ЕР-А-1458687 относится к применению производных пиримидина для лечения заболеваний,связанных с чрезмерным образованием IL-12. Европейская патентная заявка ЕР-А-1819341 относится к применению азотистых гетероциклических соединений, например производных пиридина, пиримидина и триазина, для ингибирования образования IL-12 (или других цитокинов, таких как IL-23 и IL-27, которые стимулируют образование IL-12). Европейская патентная заявка ЕР-А-1827447 относится к применению производных пиримидина для лечения заболеваний, связанных с чрезмерным образованием IL-12, IL-23 и IL-27. В европейских патентных заявках ЕР-А-1869055, ЕР-А-1869056 и ЕР-А-1675862 описаны производные 1,3-тиазоло-4,5-пиримидина, которые обладают антагонистической активностью против рецептора CX3CR1. Несмотря на то что на сегодняшний день выявлены такие активности, все еще ощущается необходимость в новых фармацевтических композициях и соединениях, которые проявляют эффективность при лечении заболеваний, основанных на экспрессии MCP-1, CX3CR1 и p40. К удивлению, заявитель обнаружил новые производные 1-бензил-3-гидроксиметилиндазол с фармакологической активностью. К удивлению, заявитель обнаружил, что новые производные 1-бензил-3-гидроксиметилиндазола,соответствующие формуле (I) по настоящему изобретению, обладают способностью снижать образование хемокина MCP-1. К еще большему удивлению, заявитель обнаружил, что новые производные 1-бензил-3 гидроксиметилиндазола, соответствующие формуле (I) по настоящему изобретению, обладают способностью снижать экспрессию хемокина MCP-1. К еще большему удивлению, заявитель обнаружил, что производные 1-бензил-3 гидроксиметилиндазола, соответствующие формуле (I) по настоящему изобретению, обладают способностью снижать экспрессию субъединицы p40, которая участвует в образовании цитокинов IL-12 иIL-23, и экспрессию рецептора CX3CR1. Таким образом, в первом аспекте настоящее изобретение относится к соединению формулы (I) в которой A может представлять собой -X1- или -X1-OC(R9)(R10)-, где Х 1 может представлять собой алкильную группу, которая содержит от 1 до 5 углеродных атомов,необязательно замещенных одной или несколькими алкильными группами, которые содержат от 1 до 5 углеродных атомов, или одной или несколькими алкоксильными группами, которые содержат от 1 до 3 углеродных атомов, иR9 и R10, которые могут быть одинаковыми или отличающимися друг от друга, могут представлять собой водород, алкильную группу, которая содержит от 1 до 5 углеродных атомов, или алкоксильную группу, которая содержит от 1 до 3 углеродных атомов;R1 и R2, которые могут быть одинаковыми или отличающимися друг от друга, могут представлять собой водород, алкильную группу, которая содержит 1 углеродный атом;R3, R4 и R8, которые могут быть одинаковыми или отличающимися друг от друга, могут представлять собой водород, алкильную группу, которая содержит от 1 до 5 углеродных атомов, алкоксильную группу, которая содержит от 1 до 3 углеродных атомов, атом галогена, -OH, -N(R')COR, -CN, -CONR'R,-SO2NR'R, -SO2R' и трифторметил, где R' и R, которые могут быть одинаковыми или отличающимися друг от друга, представлены водородом и алкильной группой, которая содержит от 1 до 5 углеродных атомов;R5 может представлять собой водород, алкильную группу, которая содержит 1 углеродный атом,алкоксильную группу, которая содержит от 1 до 3 углеродных атомов, -OH, -N(R')(R), нитро или R5 вместе с одним из R6 и R7 образует кольцо, которое содержит 5 или 6 углеродных атомов, где R' и R, которые могут быть одинаковыми или отличающимися друг от друга, представлены водородом и алкильной группой, которая содержит 1 углеродный атом;R6 и R7, которые могут быть одинаковыми или отличающимися друг от друга, могут представлять собой водород, алкильную группу, которая содержит 1 углеродный атом, или вместе образуют группу С=O или один из R6 и R7 вместе с R5 образует кольцо, которое содержит 5 или 6 углеродных атомов,при условии, что A отличается от алкильной группы, содержащей 1 углеродный атом, необязательно замещенный одной или несколькими алкильными группами, которые содержат от 1 до 5 углеродных атомов, или альтернативно по меньшей мере одна из групп с R1 по R8 отличается от водорода,или его фармацевтически приемлемой соли. Во втором аспекте настоящее изобретение относится к фармацевтической композиции, которая содержит новые производные 1-бензил-3-гидроксиметилиндазола, соответствующие формуле (I), или их фармацевтически приемлемые соли вместе по меньшей мере с одним фармацевтически приемлемым носителем. Сверхрегуляция и/или увеличение экспрессии вышеупомянутых MCP-1, CX3CR1 и p40, последний,таким образом, приводит к экспрессии/образованию IL-12 и/или IL-23, что приводит к развитию патологического состояния и/или заболевания, часто в данной области обозначаются термином "сверхэкспрессия". В целях настоящего изобретения подразумевается, что термин "экспрессия" включает сверхэкспрессию, которая известна в данной области. К удивлению, заявитель обнаружил, что новые производные 1-бензил-3-гидроксиметилиндазола можно использовать для получения фармацевтической композиции, которая эффективна при лечении заболеваний, основанных на экспрессии хемокина MCP-1, субъединицы p40, и, таким образом, цитокинов IL-12 и IL-23, и рецептора CX3CR1. К еще большему удивлению, заявитель также обнаружил, что множество известных производных 1-бензил-3-гидроксиметилиндазола можно использовать для получения фармацевтической композиции,которая эффективна при лечении заболеваний, основанных на экспрессии субъединицы p40, и, таким образом, цитокинов IL-12 и IL-23, и рецептора CX3CR1. Таким образом, в дополнительном аспекте настоящее изобретение относится к применению соединения формулы (I) в которой A может представлять собой -X1- или -X1-OC(R9)(R10)-, гдеX1 может представлять собой алкильную группу, которая содержит от 1 до 5 углеродных атомов,необязательно замещенных одной или несколькими алкильными группами, которые содержат от 1 до 5 углеродных атомов, или одной или несколькими алкоксильными группами, которые содержат от 1 до 3 углеродных атомов, иR9 и R10, которые могут быть одинаковыми или отличающимися друг от друга, представляют собой водород, алкильную группу, которая содержит от 1 до 5 углеродных атомов, или алкоксильную группу,которая содержит от 1 до 3 углеродных атомовR1 и R2, которые могут быть одинаковыми или отличающимися друг от друга, могут представлять собой водород, алкильную группу, которая содержит 1 углеродный атом;R3, R4 и R8, которые могут быть одинаковыми или отличающимися друг от друга, могут представлять собой водород, алкильную группу, которая содержит от 1 до 5 углеродных атомов, алкоксильную группу, которая содержит от 1 до 3 углеродных атомов, атом галогена, -OH, -N(R')COR, -CN, -CONR'R,-SO2NR'R, -SO2R' и трифторметил, где R' и R, которые могут быть одинаковыми или отличающимися друг от друга, представлены водородом и алкильной группой, которая содержит от 1 до 5 углеродных атомов;R5 может представлять собой водород, алкильную группу, которая содержит 1 углеродный атом,алкоксильную группу, которая содержит от 1 до 3 углеродных атомов, -OH, -N(R')(R), нитро или R5 вместе с одним из R6 и R7 образует кольцо, которое содержит 5 или 6 углеродных атомов, где R' и R, которые могут быть одинаковыми или отличающимися друг от друга, представлены водородом и алкильной группой, которая содержит 1 углеродный атом;R6 и R7, которые могут быть одинаковыми или отличающимися друг от друга, могут представлять собой водород, алкильную группу, которая содержит 1 углеродный атом, или вместе образуют группу С=O или один из R6 и R7 вместе с R5 образует кольцо, которое содержит 5 или 6 углеродных атомов,при условии, что A отличается от алкильной группы, которая содержит 1 углеродный атом, необязательно замещенный одной или несколькими алкильными группами, которые содержат от 1 до 5 углеродных атомов, или альтернативно по меньшей мере одна из групп с R1 по R8 отличается от водорода,для получения фармацевтической композиции для лечения заболеваний, основанных на экспрессииMCP-1, CX3CR1 и p40. Кроме того, в дополнительном аспекте настоящее изобретение относится к способу лечения или предупреждения заболеваний, основанных на экспрессии MCP-1, CX3CR1 и p40, который отличается введением пациенту, нуждающемуся в этом, эффективного количества соединения описанной ранее формулы (I). Подробное описание изобретения Предпочтительно в описанной ранее формуле (I) радикал A может представлять собой -X1- или-X1-OC(R9)(R10)-, где X1 может представлять собой алкильную группу, которая содержит от 1 до 5 углеродных атомов, необязательно замещенных одной или несколькими алкильными группами, которые содержат от 1 до 5 углеродных атомов, или одной или несколькими алкоксильными группами, которые содержат от 1 до 3 углеродных атомов, и R9 и R10, которые могут быть одинаковыми или отличающимися друг от друга, могут представлять собой водород, алкильную группу, которая содержит 1 углеродный атом. Более предпочтительно радикал A представлен группой -X1- или -X1-OC(R9)(R10), где X1 представляет собой группу CH2, группу CH2CH2 или группу С(CH3)2 и R9 и R10, которые могут быть одинаковыми или отличающимися друг от друга, представляют собой водород или группу CH3. Преимущественно радикал A выбран из группы, содержащей CH2, группу CH2CH2, группу С(CH3)2,группу CH2CH2OCH2, группу CH2CH2OC(CH3)2 и группу CH2CH2CH2OC(CH3)2. Предпочтительно R1 и R2, которые могут быть одинаковыми или отличающимися друг от друга,могут представлять собой водород, алкильную группу, которая содержит 1 углеродный атом. Предпочтительно R3, R4 и R8, которые могут быть одинаковыми или отличающимися друг от друга,могут представлять собой водород, алкильную группу, которая содержит от 1 до 5 углеродных атомов,алкоксильную группу, которая содержит от 1 до 3 углеродных атомов, атом галогена, -OH, -N(R')COR,-CN, -CONR'R, -SO2NR'R, -SO2R' и трифторметил, где R' и R, которые могут быть одинаковыми или отличающимися друг от друга, представлены водородом и алкильной группой, которая содержит от 1 до 5 углеродных атомов. Преимущественно R5 представлен водородным атомом, алкильной группой, которая содержит от 1 до 3 углеродных атомов, алкоксильной группой, которая содержит 1 или 2 углеродных атома, атомом галогена, группой OH или R5 вместе с одним из R6 и R7 образует кольцо, которое содержит 5 или 6 углеродных атомов. Предпочтительно R6 и R7, которые могут быть одинаковыми или отличающимися друг от друга,представлены водородным атомом, алкильной группой, которая содержит от 1 до 3 углеродных атомов,или вместе образуют группу С=O или один из R6 и R7 вместе с R5 образует кольцо, которое содержит 5 или 6 углеродных атомов. В случае определенных заместителей соединение формулы (I) по настоящему изобретению может содержать асимметрический углеродный атом и поэтому может быть представлено в форме стереоизомеров и энантиомеров. В зависимости от свойств заместителей, соединение формулы (I) может образовывать соли присоединения физиологически приемлемых органических или неорганических кислот или оснований. Типичные примеры подходящих физиологически приемлемых неорганических кислот представляют собой соляную кислоту, бромисто-водородную кислоту, серную кислоту, фосфорную кислоту и азотную кислоту. Типичные примеры подходящих физиологически приемлемых органических кислот представляют собой уксусную, аскорбиновую, бензойную, лимонную, фумаровую, молочную, малеиновую, метансульфоновую, щавелевую, паратолуолсульфоновую, бензолсульфоновую, янтарную, дубильную и винную кислоты. Типичные примеры подходящих физиологически приемлемых минеральных оснований представляют собой гидроксиды, карбонаты и гидрокарбонаты аммония, кальция, магния, натрия и калия, например гидроксид аммония, гидроксид кальция, карбонат магния, гидрокарбонат натрия и гидрокарбонат калия. Типичные примеры подходящих физиологически приемлемых органических оснований представляют собой аргинин, бетаин, кофеин, холин, N,N-дибензилэтилендиамин, диэтиламин,2-диэтиламиноэтанол,2-диметиламиноэтанол,этаноламин,этилендиамин,N-этилморфолин,N-этилпиперидин, N-метилглюкамин, глюкамин, глюкозамин, гистидин, N-(2-гидроксиэтил)пиперидин,N-(2-гидроксиэтил)пирролидин, изопропиламин, лизин, метилглюкамин, морфолин, пиперазин, пиперидин, теобромин, триэтиламин, триметиламин, трипропиламин и трометамин. В зависимости от свойств заместителей, соединение формулы (I) может образовывать сложные эфиры с физиологически приемлемыми органическими кислотами или основаниями. Соединения по настоящему изобретению также включают пролекарства, стереоизомеры, энантиомеры и фармацевтически приемлемые соли или сложные эфиры соединений, представленных формулой(I), которая описана в формуле изобретения. Пролекарство соединения формулы (I) представляет собой вещество, по существу, в неактивной форме, которое после введения в живой организм метаболизируется в соединение формулы (I). Подразумевается, что термины "фармацевтически приемлемый" и "физиологически приемлемый" обозначают, без какого-либо конкретного ограничения, любое вещество, пригодное для получения фармацевтической композиции, подлежащей введению в живой организм. Соединения, соответствующие формуле (I) по настоящему изобретению, можно использовать для получения фармацевтической композиции, которая эффективна для лечения заболеваний (или патологий), основанных на экспрессии хемокина MCP-1, цитокина p40, субъединицы p40 (участвует в образовании цитокинов IL-12 и IL-23) и рецептора CX3CR1. Предпочтительно патологии, связанные с экспрессией MCP-1 и CX3CR1, представляют собой заболевания суставов, заболевания почек, сердечнососудистые заболевания, метаболический синдром, ожирение, диабет, резистентность к инсулину или рак. В частности, патологии, связанные с экспрессией MCP-1, представляют собой ревматоидный артрит, артрит, вызванный вирусной инфекцией, псориатический артрит, артроз, волчаночный нефрит, диабетическую нефропатию, гломерулонефрит, поликистозное поражение почек, интерстициальное заболевание легких, фиброз, рассеянный склероз, болезнь Альцгеймера, ВИЧ-ассоциированное слабоумие, атопический дерматит, псориаз, васкулит, рестеноз, атеросклероз, инфаркт миокарда, стенокардию, острые заболевания коронарных артерий, аденомы, карциномы и метастазы, метаболические заболевания и осложнения после таких хирургических вмешательств, как, например, ангиопластика, артериэктомия, процедуры по восстановлению циркуляции, трансплантации, замена органов, замена тканей и имплантации протезов. В частности, патологии, связанные с экспрессией CX3CR1, представляют собой ревматоидный артрит, волчаночный нефрит, диабетическую нефропатию, болезнь Крона, язвенный колит, заболевания коронарных сосудов, рестеноз, атеросклероз, инфаркт миокарда, стенокардию и осложнения после таких хирургических вмешательств, как, например, ангиопластика, артериэктомия и процедуры по восстановлению циркуляции. Предпочтительно патологии, связанные с экспрессией p40 и, таким образом, с IL-12 и IL-23, представляют собой аутоиммунные заболевания, такие как хронические дегенеративные воспалительные заболевания и рак. В частности, патологии, связанные с экспрессией p40, представляют собой ревматоидный артрит,псориаз, гломерулонефрит, диабет, красную волчанку, болезнь Крона и такие опухоли, как, например,карцинома толстой кишки, карцинома молочной железы, карцинома легких и карцинома простаты, а также новообразования на коже и в ЦНС. Предпочтительно фармацевтические композиции по настоящему изобретению получают в виде подходящих лекарственных форм, которые содержат эффективную дозу по меньшей мере одного соединения формулы (I) или его фармацевтически приемлемой соли, эфира или пролекарства и по меньшей мере один фармацевтически приемлемый носитель. Примеры фармацевтически приемлемых носителей, известных из уровня техники, представляют собой, например, глиданты, связующие вещества, дезинтегрирующие средства, наполнители, разбавители, ароматизаторы, красители, флюидизирующие средства, смазывающие вещества, консерванты, увлажнители, абсорбенты и подсластители. Примеры фармацевтически приемлемых эксципиентов, которые можно использовать, представляют собой сахара, такие как лактоза, глюкоза или сахароза, крахмалы, например кукурузный крахмал и картофельный крахмал, целлюлозу и ее производные, например карбоксиметилцеллюлозу натрия, этилцеллюлозу и ацетат целлюлозы, трагакантовую камедь, солод, желатин, тальк, кокосовое масло, воски, масла, такие как арахисовое масло, хлопковое масло, сафлоровое масло, сезамовое масло, оливковое масло,кукурузное масло и соевое масло, гликоли, такие как пропиленгликоль, полиолы, такие как глицерин,сорбит, маннит и полиэтиленгликоль, сложные эфиры, такие как этилолеат и этиллаурат, агар-агар и т.п. Примерами подходящих лекарственных форм являются таблетки, капсулы, покрытые оболочкой таблетки, гранулы, растворы и сиропы для перорального введения; содержащие лекарственное средство пластыри, растворы, пасты, кремы и мази для чрескожного введения; суппозитории для ректального введения и стерильные растворы для инъекционного или аэрозольного введения. Другие подходящие лекарственные формы представляют собой формы с замедленным высвобождением и формы на основе липосом, для перорального или инъекционного введения. Лекарственные формы также могут содержать другие традиционные ингредиенты, такие как консерванты, стабилизаторы, поверхностно-активные вещества, буферы, регуляторы осмотического давления, эмульсификаторы, подсластители, красители, ароматизаторы и т.п. При использовании для лечения определенного заболевания фармацевтическая композиция по настоящему изобретению может содержать другие фармакологически активные ингредиенты, которые эффективны при одновременном введении. Количество соединения формулы (I) или его фармацевтически приемлемой соли, эфира или пролекарства в фармацевтической композиции по настоящему изобретению может меняться в широком диапазоне в зависимости от известных факторов, например от вида патологии, подлежащей лечению, тяжести заболевания, массы тела пациента, лекарственной формы, выбранного пути введения, количества введений в сутки и эффективности выбранного соединения формулы (I). Тем не менее, профессионал в данной области сможет обычным способом легко определить оптимальное количество. В основном количество соединения формулы (I) или его фармацевтически приемлемой соли, эфира или пролекарства в фармацевтической композиции по настоящему изобретению будет таким, что оно обеспечит вводимую дозу в пределах между 0,001 и 100 мг/кг/сутки. Предпочтительно вводимая доза находится в пределах между 0,05 и 50 мг/кг/сутки и даже более предпочтительно между 0,1 и 10 мг/кг/сутки. Лекарственные формы фармацевтической композиции по настоящему изобретению могут быть получены в соответствии со способами, которые хорошо известны химикам-фармацевтам, включая смешивание, гранулирование, прессование, растворение, стерилизацию и т.п. Активность соединений по настоящему изобретению в отношении MCP-1 и CX3CR1 была продемонстрирована in vitro на моноцитах человека с помощью анализа экспрессии генов в сочетании с ПЦР в реальном времени и с помощью анализа синтеза белка в иммуноферментном тесте. Как известно специалистам в данной области, считается, что вышеупомянутые экспериментальные модели можно использовать для проверки активности соединений по отношению к экспрессии и образованию MCP-1 и к экспрессии CX3CR1. Таким образом, вышеупомянутые модели можно рассматривать в качестве моделей для предсказания активности при лечении патологий пациента, отличающихся экспрессией и образованием MCP-1, экспрессией CX3CR1 и воспалительными состояниями, при которых имеют место инфильтраты с высоким содержанием моноцитов и макрофагов. Активность соединений по настоящему изобретению в отношении p40 была продемонстрирована invitro на моноцитах человека с помощью анализа экспрессии генов посредством ПЦР в реальном времени. Как известно специалистам в данной области, вышеупомянутая экспериментальная модель может использоваться для проверки активности соединений в отношении экспрессии p40, а также может рассматриваться в качестве модели для предсказания активности при лечении патологий пациента, отличающихся экспрессией p40. Получение соединения общей формулы (I) можно осуществлять в соответствии с одной из следующих процедур. Способ A. В способе A соединения общей формулы (III) вступают во взаимодействие с соединениями формулы (IV). Заместители с R1 по R8, A и Y обозначают то же, что было указано ранее в отношении соединений формулы (I), a Q обозначает уходящую группу, выбранную из группы, содержащей галоген, CH3SO3 и п-CH3PhSO3-. Способ A осуществляют в соответствии с общепринятыми способами. Например, спирты формулы(III) взаимодействуют соответственно с производными формулы (IV), в которой Q представляет собой уходящую группу, предпочтительно выбранную из группы, содержащей атом хлора, атом брома и метансульфонильную группу. Реакцию осуществляют в присутствии подходящего основания и в подходящем растворителе. В качестве оснований предпочтительно можно использовать NaH, бутиллитий и диизопропиламид лития, тогда как в качестве растворителя, пригодного для этого типа реакции, предпочтительно можно использовать полярные апротонные растворители, такие как тетрагидрофуран, диэтиловый эфир или 1,4-диоксан. Температура реакции предпочтительно находится в диапазоне между комнатной температурой и температурой флегмы использованного растворителя. Реакции этого типа могут продолжаться от нескольких часов до нескольких дней. Способ В. В способе В соединения общей формулы (V) вступают во взаимодействие с соединениями формулы(VI). Заместители с R1 по R8, A и Y обозначают то, что было указано ранее в отношении соединений формулы (I), a Q обозначает уходящую группу, выбранную из группы, содержащей галоген, CH3SO3- и(VI) вступают во взаимодействие соответственно с производными формулы (V), в которой Q представляет собой уходящую группу, предпочтительно выбранную из группы, содержащей атом хлора, атом брома и метансульфонильную группу. Реакцию осуществляют в присутствии подходящего основания и в подходящем растворителе. В качестве оснований предпочтительно можно использовать NaH, бутиллитий и диизопропиламид лития, тогда как в качестве растворителей, которые подходят для этого типа реакций,предпочтительно использовать полярные апротонные растворители, такие как тетрагидрофуран, диэтиловый эфир или 1,4-диоксан. Температура реакции предпочтительно находится в диапазоне между комнатной температурой и температурой флегмы использованного растворителя. Реакции этого типа могут продолжаться от нескольких часов до нескольких дней. Следующие примеры предоставлены лишь для того, чтобы проиллюстрировать настоящее изобретение, а не ограничивать его в каком бы то ни было виде. Примеры получения. Соединения формулы (I), перечисленные в табл. A, получены с использованием способов получения, описанных выше. Таблица A Подробные сведения о получении большинства соединений табл. A приведены в настоящем документе далее. Остальные соединения получали с помощью похожих способов, используя подходящие исходные вещества и реактивы. Получение соединения 1. 2-[1-(4-Метоксибензил)-1 Н-индазол-3-ил]метокси-2-метилпропионовая кислота. 1 а) [1-(4-Метоксибензил)-1 Н-индазол-3-ил]метанол. В суспензию 60% NaH (2,7 г; 0,07 моль) в толуоле (200 мл) добавляли 1-бензил-3 гидроксиметилиндазол (10 г; 0,07 моль). Смесь доводили до температуры кипения и оставляли перемешиваться при кипячении с обратным холодильником в течение 1 ч. Затем добавляли 4-метоксибензилхлорид (14 г; 0,09 моль). Затем смесь перемешивали при кипячении с обратным холодильником в течение 4 ч. Реакцию останавливали охлаждением смеси до комнатной температуры и добавлением воды (50 мл). Органическую фазу отделяли и промывали соответственно в 2 н. HCl (50 мл) и воде (550 мл). Растворитель выпаривали при пониженном давлении. Полученный таким образом неочищенный остаток очищали флэш-хроматографией на силикагеле, используя в качестве элюента смесь гексана/этилацетата в соотношении 3/2. Полученный продукт кристаллизовали из смеси гексана/этилацетата в соотношении 5/1, чтобы получить 5,1 г [1-(4-метоксибензил)-1 Н-индазол-3 ил]метанола. Т.пл. 95-97 С. 1 Н-ЯМР (CDCl3,м.д.): 3,43 (т, J=6,9 Гц, 1 Н), 3,67 (с, 3H), 4,98 (д, J=6,9 Гц, 2 Н), 5,36 (с, 2 Н), 6,5-6,8(м, 2 Н), 6,9-7,4 (м, 7 Н), 7,80 (д, J=7,86 Гц, 1 Н). 1b) 2-[1-(4-Метоксибензил)-1 Н-индазол-3-ил]метокси-2-метилпропионовая кислота. В суспензию NaOH (15,6 г; 0,39 моль) в ацетоне (50 мл) добавляли [1-(4-метоксибензил)-1 Ниндазол-3-ил]метанол (8,7 г; 0,03 моль). В смесь медленно добавляли раствор хлороформа (7,2 мл; 0,09 моль) и ацетона (7,2 мл; 0,1 моль). Добавление вызывало дефлегмацию смеси растворителей. После того как добавление завершали, смесь кипятили с обратным холодильником в течение 1 ч. Реакцию останавливали охлаждением смеси до комнатной температуры и выпариванием растворителя при пониженном давлении. Полученный неочищенный остаток растворяли в толуоле (100 мл) и воде (50 мл). Водную фазу отделяли от органической фазы и затем промывали толуолом (250 мл). Объединенные органические фазы экстрагировали водой (350 мл). Объединенные водные фазы промывали гексаном(230 мл), а затем подкисляли с использованием 2 н. HCl и перемешивали при комнатной температуре. Полученное таким образом твердое вещество отфильтровывали и кристаллизовали сначала из смеси воды/уксусной кислоты в соотношении 5/1, а затем из толуола, чтобы получить 4,8 г 2-[1-(4-метоксибензил)-1 Н-индазол-3-ил]метокси-2-метилпропионовой кислоты. Т.пл. 169-171 С. 1 Н-ЯМР (ДМСО-d6,м.д.): 1,44 (с, 6 Н), 3,69 (с, 3H), 4,74 (с, 2 Н), 5,52 (с, 2 Н), 6,82-6,90 (м, 2 Н), 7,13(т, J=7,50 Гц, 1 Н), 7,18-7,26 (м, 2 Н), 7,36 (т, J=7,23 Гц, 1 Н), 7,66 (д, J=8,42 Гц, 1 Н), 7,92 (дд, J=8,14; 1,01 Гц, 1 Н), 12,76 (с, 1 Н). Получение соединения 2. 2-[(1-Бензил-5-метокси-1 Н-индазол-3-ил)метокси]-2-метилпропионовая кислота. 2 а) Бензил 1-бензил-5-метокси-1 Н-индазол-3-карбоксилат. Суспензию 5-метокси-1 Н-индазол-3-карбоновой кислоты (21,5 г; 0,11 моль) и 60% NaH (10,5 г; 0,44 моль) в N,N-диметилформамиде (ДМФА) (200 мл) перемешивали при температуре 70 С в течение 1 ч. Затем в суспензию медленно добавляли бензилхлорид (32,9 г; 0,26 моль) и смесь перемешивали при температуре 70 С в течение 4 ч. Реакцию останавливали охлаждением смеси до комнатной температуры и выливанием смеси в воду со льдом. Продукт экстрагировали этилацетатом (3250 мл). Объединенные органические фазы концентрировали при пониженном давлении. Полученный таким образом неочищенный остаток очищали посредством последовательных кристаллизаций из 95 этанола, чтобы получить 18 г бензил 1-бензил-5-метокси-1 Н-индазол-3-карбоксилата. Т.пл. 107-109 С. 1H-ЯМР (CDCl3,м.д.): 3,78 (с, 3H), 5,51 (с, 2 Н), 6,9-7,6 (м, 13 Н). 2b) (1-Бензил-5-метокси-1 Н-индазол-3-ил)метанол. К раствору бензил 1-бензил-5-метокси-1 Н-индазол-3-карбоксилата (17,7 г; 0,05 моль), диэтилового эфира (100 мл) и тетрагидрофурана (ТГФ) (170 мл), перемешивавшемуся при комнатной температуре,медленно добавляли LiAlH4 (3,8 г; 0,1 моль). После того как добавление завершали, суспензию перемешивали при кипячении с обратным холодильником в течение 24 ч. Реакцию останавливали посредством устранения избытка LiAlH4 путем добавления воды (40 мл) и 5 н. NaOH (10 мл). Органическую фазу отделяли, а растворитель выпаривали при пониженном давлении. Полученный неочищенный остаток очищали кристаллизацией из 95 этанола, чтобы получить 14 г (1-бензил-5-метокси-1 Н-индазол-3 ил)метанола. Т.пл. 97-98 С. 1H-ЯМР (CDCl3,м.д.): 3,3 (шир.с, 1 Н), 3,80 (с, 3H), 4,92 (с, 2 Н), 5,47 (с, 2 Н), 6,9-7,5 (м, 8 Н). 2 с) 1-Бензил-3-(хлорметил)-5-метокси-1 Н-индазол. К раствору (1-бензил-5-метокси-1 Н-индазол-3-ил)метанола (18 г; 0,07 моль) в хлороформе (200 мл),перемешивавшемуся при комнатной температуре, медленно добавляли тионилхлорид (15,8 г; 0,13 моль). После того как добавление завершали, раствор кипятили с обратным холодильником в течение 24 ч. Затем реакцию останавливали охлаждением смеси до комнатной температуры и выпариванием растворителя при пониженном давлении. Затем остаток несколько раз растворяли в толуоле и концентрировали при пониженном давлении. Полученный неочищенный остаток очищали кристаллизацией из гексана, чтобы получить 9,5 г 1-бензил-3-(хлорметил)-5-метокси-1 Н-индазола. Т.пл. 78-80 С. 1 Н-ЯМР (CDCl3,м.д.): 3,85 (с, 3H), 4,97 (с, 2 Н), 5,51 (с, 2 Н), 6,9-7,4 (м, 8 Н). 2d) 2-[(1-Бензил-5-метокси-1 Н-индазол-3-ил)метокси]-2-метилпропионовая кислота. К раствору, содержащему 1-бензил-3-(хлорметил)-5-метокси-1 Н-индазол (2,95 г; 0,01 моль) и этил 3-гидрокси-3-метилбутаноат (1,98 г; 0,015 моль) в ДМФА (30 мл) и перемешивавшемуся при комнатной температуре, медленно добавляли 60% NaH (0,36 г; 0,015 моль). Затем смесь нагревали при 40 С в тече- 10018241 ние 24 ч. Реакцию останавливали охлаждением суспензии до комнатной температуры и добавлением воды (200 мл). Растворитель выпаривали при пониженном давлении, а остаток обрабатывали при кипячении с обратным холодильником с использованием NaOH (0,84 г; 0,021 моль) в воде (6 мл) и 95 этанола (6 мл) в течение 6 ч. Затем смесь охлаждали до комнатной температуры и разбавляли водой (50 мл). Щелочную фазу промывали диэтиловым эфиром (220 мл) и затем подкисляли концентрированной HCl и экстрагировали диэтиловым эфиром (330 мл). Объединенные органические фазы концентрировали при пониженном давлении и полученный неочищенный остаток очищали кристаллизацией из смеси гексана/этилацетата в соотношении 10/1, чтобы получить 0,8 г 2-[(1-бензил-5-метокси-1 Н-индазол-3-ил)метокси]-2-метилпропионовой кислоты. Т.пл. 128-130 С. 1H-ЯМР (ДМСО-d6,м.д.): 1,44 (с, 6 Н), 3,77 (с, 3H), 4,69 (с, 2 Н), 5,55 (с, 2 Н), 7,02 (дд, J=9,15; 2,38 Гц, 1 Н), 7,17-7,33 (м, 5 Н), 7,41 (д, J=2,38 Гц, 1 Н), 7,55 (д, J=9,15 Гц, 1 Н), 12,79 (с, 1 Н). Получение соединения 3. 2-[(1-Бензоил-1 Н-индазол-3-ил)метокси]-2-метилпропионовая кислота. 3 а) (1-Тритилиндазол-3-ил)метанол. К раствору, содержащему изобутил 1 Н-индазол-3-карбоксилат (280 г; 1,28 моль) в хлороформе (2 л) и перемешивавшемуся при комнатной температуре, добавляли триэтиламин (300 мл; 2,16 моль) и трифенилхлорметан (400 г; 1,4 моль). Раствор перемешивали при комнатной температуре в течение 4 дней, а затем добавляли воду (500 мл). Органическую фазу отделяли и концентрировали при пониженном давлении. Полученный неочищенный остаток использовали без дополнительной очистки на следующей стадии. К раствору неочищенного изобутил 1-тритилиндазол-3-карбоксилата (180 г; 0,39 моль) в ТГФ (1 л),перемешивавшемуся при комнатной температуре, медленно добавляли суспензию LiAlH4 (18 г; 0,48 моль) в ТГФ (100 мл). После того как добавление завершали, смесь перемешивали при комнатной температуре в течение 30 мин, а затем реакцию останавливали охлаждением смеси до 0 С и последовательным добавлением воды (40 мл), 2 н. NaOH (40 мл) и воды (60 мл). Полученное таким образом твердое вещество отфильтровывали, а раствор концентрировали при пониженном давлении. Полученный неочищенный остаток очищали кристаллизацией из смеси гексана/этилацетата в соотношении 1/1. Получали 120 г (1-тритилиндазол-3-ил)метанола. Т.пл. 192-193 С. 1H-ЯМР (CDCl3;м.д.): 2,51 (т, J=6,98 Гц, 1 Н), 4,90 (д, J=6,98 Гц, 2 Н), 6,2-6,5 (м, 1 Н), 6,9-7,4 (м,17 Н), 7,6-7,8 (м, 1 Н). 3b) 2-(1-Тритилиндазол-3-илметокси)-2-метилпропионовая кислота. В суспензию (1-тритилиндазол-3-ил)метанола (78 г; 0,20 моль), ацетона (260 мл) и воды (0,5 мл),перемешивавшуюся при комнатной температуре, добавляли NaOH (76 г; 1,9 моль) и медленно добавляли смесь хлороформа/ацетона в соотношении 1/1 (100 мл). Данная реакция является экзотермической, и скорость добавления подбирали таким образом, чтобы удерживать температуру реакции близко к точке кипения. Через 30 мин после окончания добавления реакцию останавливали охлаждением смеси до комнатной температуры и выпариванием растворителя при пониженном давлении. Остаток растворяли в воде (500 мл) и промывали диэтиловым эфиром (3100 мл). Затем водную фазу подкисляли концентрированной HCl и продукт экстрагировали толуолом (3250 мл). Объединенные органические фазы концентрировали при пониженном давлении и полученный неочищенный остаток очищали кристаллизацией из смеси гексана/этилацетата в соотношении 3/7, чтобы получить 22 г 2-(1-тритилиндазол-3-илметокси)2-метилпропионовой кислоты. Т.пл. 179-180 С. 1(шир.с, 1 Н). 3c) 2-(1 Н-Индазол-3-илметокси)-2-метилпропионовая кислота. К раствору 2-(1-тритилиндазол-3-илметокси)-2-метилпропионовой кислоты (83 г; 0,174 моль) в дихлорметане (ДХМ) (900 мл), перемешивавшемуся при комнатной температуре, добавляли паратолуолсульфоновую кислоту (PTSA) (50 г; 0,29 моль). Смесь перемешивали в течение 30 мин при комнатной температуре и затем выливали в 5 н. NaOH (400 мл). Органическую фазу отделяли и промывали водой (300 мл). Объединенные водные фазы подкисляли концентрированной HCl и затем экстрагировали этилацетатом (5300 мл). Объединенные органические фазы выпаривали при пониженном давлении и полученный неочищенный остаток очищали кристаллизацией из смеси гексана/этилацетата в соотношении 1/1. Получали 42 г 2-(1 Н-индазол-3-илметокси)-2-метилпропионовой кислоты. Т.пл. 135-137 С. 1(50 мл), перемешивавшемуся при комнатной температуре, добавляли K2CO3 (6,8 г; 0,049 моль) и затем медленно добавляли раствор бензоилхлорида (5 мл; 0,043 моль) в ацетоне (30 мл). Смесь перемешивали при комнатной температуре в течение 24 ч и затем выливали в воду (1 л). Затем раствор доводили до щелочного рН с помощью 5 н. NaOH и промывали диэтиловым эфиром (3150 мл). Затем щелочную фазу подкисляли концентрированной HCl и экстрагировали диэтиловым эфиром (3300 мл). Объединенные органические фазы концентрировали при пониженном давлении и полученный неочищенный остаток очищали кристаллизацией из смеси гексана/этилацетата в соотношении 1/1. Получали 2 г 2-[(1-бензоил 1 Н-индазол-3-ил)метокси]-2-метилпропионовой кислоты. Т.пл. 132-135 С. 1(м, 3H), 8,68 (шир.с, 1 Н), 8,53 (д, J=8,42 Гц, 1 Н). Получение соединения 4. 2-[1-(4-Хлорбензил)-1H-индазол-3-ил]метокси-2-метилпропионовая кислота. 4 а) [1-(4-Хлорбензил)-1H-индазол-3-ил]метанол. Продукт получали с использованием способа, описанного в примере 1 а, используя 4-хлорбензилхлорид в качестве реактива. Полученный продукт очищали кристаллизацией из смеси гексана/этилацетата в соотношении 5/1. Т.пл. 102-104 С 1H-ЯМР (CDCl3,м.д.): 3,5 (шир.с, 1 Н), 5,01 (с, 2 Н), 5,37 (с, 2 Н), 6,8-7,5 (м, 7 Н), 7,81 (д, J=7,82 Гц,1 Н). 4b) 2-[1-(4-Хлорбензил)-1 Н-индазол-3-ил]метокси-2-метилпропионовая кислота. Продукт получали с использованием способа, описанного в примере 1b), используя [1-(4 хлорбензил)-1 Н-индазол-3-ил]метанол в качестве реактива. Полученный продукт очищали кристаллизацией из толуола. Т.пл. 186-188 С. 1(шир.с, 1 Н). Получение соединения 5. 2-[(1-Бензил-5-хлор-1 Н-индазол-3-ил)метокси]-2-метилпропионовая кислота. В суспензию 2-[(1-бензил-1 Н-индазол-3-ил)метокси]-2-метилпропионовой кислоты (20 г; 0,062 моль), полученную, как описано в патенте ЕР 0382276, в ледяной уксусной кислоте (250 мл), перемешивавшуюся при температуре приблизительно 20 С в нагревательной бане, добавляли Cl2 барботированием до тех пор, пока не было израсходовано все исходное вещество, что подтверждали с помощью ТСХ. Затем раствор выливали в воду со льдом (1 л) и перемешивали при комнатной температуре в течение ночи. Полученное таким образом твердое вещество отфильтровывали и затем кристаллизовали первый раз из 95 этанола, а второй раз из смеси гексана/этилацетата в соотношении 1/1. Получали 5,5 г 2-[(1-бензил-5-хлор-1 Н-индазол-3-ил)метокси]-2-метилпропионовой кислоты. Т.пл. 145-147 С. 1 Н-ЯМР (CDCl3,м.д.): 1,61 (с, 6 Н), 4,91 (с, 2 Н), 5,55 (с, 2 Н), 7,13-7,34 (м, 7 Н), 7,88 (д, J=1,83 Гц,1 Н), 8,67 (шир.с, 1 Н). Получение соединения 6. 2-[(1-Бензил-5-нитро-1 Н-индазол-3-ил)метокси]-2-метилпропионовая кислота. 6 а) 2-Метил-2-[(5-нитро-1 Н-индазол-3-ил)метокси]пропионовая кислота. В смесь 65% HNO3 (100 мл) и концентрированной H2SO4 (100 мл), перемешивавшуюся при температуре приблизительно 10-20 С, добавляли 2-(1 Н-индазол-3-илметокси)-2-метилпропионовую кислоту(25 г; 0,107 моль). Смесь перемешивали, поддерживая температуру равной 20 С или менее, до полного растворения исходного вещества. Затем раствор выливали в воду со льдом (приблизительно 1 л) и полученное таким образом твердое вещество отфильтровывали и промывали на фильтре сначала водой, а затем метанолом. Получали 26 г 2-метил-2-[(5-нитро-1 Н-индазол-3-ил)метокси]пропионовой кислоты, которую использовали в следующей реакции без дополнительной очистки. Т.пл. 210 С с разложением. 1H-ЯМР (CDCl3+ДМСО-d6,м.д.): 1,58 (с, 6 Н), 4,91 (с, 2 Н), 7,54 (д, J=9,18 Гц, 1 Н), 8,19 (дд, J1,J2=9,18; 2,15 Гц, 1 Н), 9,13 (д, J=2,15 Гц, 1 Н), 12,5 (шир.с, 1 Н). 6b) 2-[(5-Нитро-1-бензил-1 Н-индазол-3-ил)метокси]-2-метилпропионовая кислота. К раствору 2-метил-2-[(5-нитро-1 Н-индазол-3-ил)метокси]пропионовой кислоты (26 г; 0,093 моль) в ДМФА (200 мл) добавляли 60% NaH (10 г; 0,25 моль) и смесь перемешивали в течение 10 мин при температуре 60 С. Затем в смесь добавляли бензилхлорид (25 мл; 0,217 моль) и все вместе перемешивали при температуре 60 С в течение 18 ч. Реакцию останавливали, вылив смесь в воду (1 л), а затем подкисляли с использованием 5 н. HCl и экстрагировали продукт диэтиловым эфиром (3250 мл). Полученный остаток растворяли в 95 этаноле (100 мл) и обрабатывали с использованием 1 н. NaOH (200 мл) при кипячении с обратным холодильником в течение 2 ч. Раствор затем охлаждали до комнатной температуры и промывали диэтиловым эфиром (3200 мл). Затем щелочную фазу подкисляли концентрированной HCl и экстрагировали этилацетатом (3300 мл). Объединенные органические фазы концентрировали при пониженном давлении и полученный неочищенный остаток очищали кристаллизацией из этилацетата. Таким образом получали 16 г 2-[(5-нитро-1-бензил-1 Н-индазол-3-ил)метокси]-2-метилпропионовой кислоты. Т.пл. 129-131 С. 1H-ЯМР (CDCl3,м.д.): 1,64 (с, 6 Н), 4,99 (с, 2 Н), 5,59 (с, 2 Н), 7,80 (шир.с, 1 Н), 7,15-7,39 (м, 6 Н),8,20 (дд, J=9,24; 2,10 Гц, 1 Н), 9,00 (д, J=2,20 Гц, 1 Н). Получение соединения 7. 2-[1-(3,4-Дихлорбензил)-1 Н-индазол-3-ил]метокси-2-метилпропионовая кислота. 7 а) [1-(3,4-Дихлорбензил)-1 Н-индазол-3-ил]метанол. Продукт получали способом, который описан в примере 1a), используя 3,4-хлорбензилхлорид в качестве реактива. Полученный продукт очищали кристаллизацией из смеси гексана/этилацетата в соотношении 1/1. Т.пл. 118-120 С. 1H-ЯМР (CDCl3,м.д.): 3,1-3,3 (м, 1 Н), 4,9-5,2 (м, 2 Н), 5,38 (с, 2 Н), 6,89 (дд, J1, J2=8,27; 2,05 Гц, 1 Н),7,1-7,5 (м, 5 Н), 7,82 (дт, J1, J2=8,01; 0,93 Гц, 1 Н). 7b) 2-[1-(3,4-Дихлорбензил)-1 Н-индазол-3-ил]метокси-2-метилпропионовая кислота. Продукт получали способом, который описан в примере 1b), используя [1-(3,4-дихлорбензил)-1 Ниндазол-3-ил]метанол в качестве исходного реактива. Полученный продукт очищали кристаллизацией из толуола. Т.пл. 174-176 С. 1H-ЯМР (ДМСО-d6,м.д.): 1,44 (с, 6 Н), 4,76 (с, 2 Н), 5,64 (с, 2 Н), 7,12-7,22 (м, 2 Н), 7,41 (т,J=7,68 Гц, 1 Н), 7,54 (д, J=2,01 Гц, 1 Н), 7,58 (д, J=8,42 Гц, 1 Н), 7,72 (д, J=8,42 Гц, 1 Н), 7,95 (д, J=8,05 Гц,1 Н), 12,81 (шир.с, 1 Н). Получение соединения 8. 2-Метил-2-[1-(1,2,3,4-тетрагидронафт-1-ил)-1 Н-индазол-3-ил]метоксипропионовая кислота. Продукт получали в соответствии с процедурой, которая описана в примере 6b), используя 2-метил 2-[(1-бензил-1 Н-индазол-3-ил)метокси]пропионовую кислоту в качестве стартового вещества и 1-хлор 1,2,3,4-тетрагидронафталин в качестве реактива. Продукт очищали кристаллизацией из смеси гексана/этилацетата в соотношении 1/1. Т.пл. 132-134 С. 1[1-(4-Фторбензил)-1 Н-индазол-3-ил]метоксиуксусная кислота. 17 а) [1-(4-Фторбензил)-1 Н-индазол-3-ил]метанол. Продукт получали с помощью процедуры, описанной в примере 1a), используя 4-фторбензилхлорид в качестве реактива. Продукт очищали кристаллизацией из гексана. Т.пл. 80-81 С 1 Н-ЯМР (CDCl3,м.д.): 3,4 (шир.с, 1 Н), 5,02 (с, 2 Н), 5,38 (с, 2 Н), 6,7-7,5 (м, 7 Н), 7,83 (д, J=8,01 Гц,1 Н). 17b) [1-(4-Фторбензил)-1 Н-индазол-3-ил]метоксиуксусная кислота. Суспензию, содержащую [1-(4-фторбензил)-1 Н-индазол-3-ил]метанол (6 г; 0,022 моль), бромуксусную кислоту (4 г; 0,03 моль) и 50% NaH (3 г; 0,066 моль) в ТГФ (170 мл), перемешивали при кипячении с обратным холодильником в течение 72 ч. Затем реакцию останавливали разбавлением суспензии водой со льдом (300 мл) и промыванием водной фазы диэтиловым эфиром (3150 мл). Водную фазу подкисляли концентрированной HCl. Полученное таким образом твердое вещество отфильтровывали и очищали кристаллизацией из изопропанола. Таким образом получали 4 г [1-(4-фторбензил)-1 Н-индазол-3 ил]метоксиуксусной кислоты. Т.пл. 135-136 С. 1[1-(2,4-Дихлорбензил)-1 Н-индазол-3-ил]метоксиуксусная кислота. 18 а) [1-(2,4-Дихлорбензил)-1 Н-индазол-3-ил]метанол. Продукт получали с помощью процедуры, описанной в примере 1 а, используя 2,4-дихлорбензилхлорид в качестве реактива. Продукт очищали кристаллизацией из смеси этанола/воды в соотношении 7/3. Т.пл. 105-106 С.H-ЯМР (CDCl3,м.д.): 3,0 (шир.с, 1 Н), 5,04 (с, 2 Н), 5,52 (с, 2 Н), 6,58 (д, J=8,36 Гц, 1 Н), 6,96 (дд,J=8,34; 2,07 Гц, 1 Н), 7,1-7,5 (м, 4 Н), 7,84 (дт, J=9,79; 1,12 Гц, 1 Н). 18b) [1-(2,4-Дихлорбензил)-1 Н-индазол-3-ил]метоксиуксусная кислота. Продукт получали способом, который описан в примере 17b), используя в качестве стартового вещества [1-(2,4-дихлорбензил)-1 Н-индазол-3-ил]метанол. Продукт очищали кристаллизацией из изопропанола. Т.пл. 144-145 С. 1H-ЯМР (ДМСО-d6,м.д.): 4,10 (с, 2 Н), 4,86 (с, 2 Н), 5,70 (с, 2 Н), 6,86 (д, J=8,42 Гц, 1 Н), 7,19 (ддд,J=8,05; 7,04; 0,82 Гц, 1 Н), 7,35 (дд, J=8,42; 2,20 Гц, 1 Н), 7,42 (ддд, J=8,32; 7,04; 1,10 Гц, 1 Н), 7,63-7,69 (м,2 Н), 7,91 (дт, J=8,05; 0,91 Гц, 1 Н), 12,68 (шир.с, 1 Н). Получение соединения 19. 2-[(1-Бензил-1 Н-индазол-3-ил)метокси]этоксиуксусная кислота. 19 а) 2-[(1-Бензил-1 Н-индазол-3-ил)метокси]этанол. К раствору NaOH (2,8 г; 0,07 моль) в этиленгликоле (150 мл), перемешивавшемуся при комнатной температуре, добавляли 1-бензил-3-хлорметилиндазол, полученный, как описано в ЕР 0382276 (17,6 г; 0,07 моль). Раствор нагревали при 130 С в течение 4 ч, а затем охлаждали до комнатной температуры и растворитель выпаривали при пониженном давлении. Остаток растворяли в воде (100 мл) и продукт экстрагировали этилацетатом (3100 мл). Объединенные органические фазы концентрировали при пониженном давлении и полученный неочищенный остаток очищали кристаллизацией из смеси гексана/этилацетата в соотношении приблизительно 1/1. Таким образом получали 13,8 г 2-[(1-бензил-1 Ниндазол-3-ил)метокси]этанола. Т.пл. 67-69 С. 1 Н-ЯМР (CDCl3,м.д.): 2,15 (шир.с, 1 Н), 3,61-3,82 (м, 4 Н), 4,97 (с, 2 Н), 5,57 (с, 2 Н), 7,11-7,38 (м,8 Н), 7,81 (дт, J=8,15; 0,97 Гц, 1 Н). 19b) 2-[(1-Бензил-1 Н-индазол-3-ил)метокси]этоксиуксусная кислота. К раствору 2-[(1-бензил-1 Н-индазол-3-ил)метокси]этанола (11,28 г, 0,04 моль) в сухом тетрагидрофуране (ТГФ) (100 мл), перемешивавшемуся при комнатной температуре, добавляли 60% гидрид натрия(1,6 г, 0,04 моль). Смесь нагревали при температуре кипения в течение 2 ч, а затем охлаждали до комнатной температуры и медленно добавляли в нее раствор этилбромацетата (7,4 г, 0,044 моль) в ТГФ (7 мл). После того как добавление завершали, смесь кипятили с обратным холодильником в течение дополнительных 2 ч. Реакцию останавливали охлаждением до комнатной температуры и выпариванием растворителя при пониженном давлении. Остаток растворяли в 2 н. NaOH (100 мл) и продукт экстрагировали диэтиловым эфиром (3150 мл). Объединенные органические фазы концентрировали при пониженном давлении. Неочищенный остаток растворяли в растворе NaOH (1,9 г, 0,045 моль) в смеси воды/этанола в соотношении 1/1 (160 мл). Затем смесь перемешивали при кипячении с обратным холодильником в течение 2 ч. Реакцию останавливали концентрированием растворителя при пониженном давлении, а остаток растворяли в воде (100 мл) и промывали диэтиловым эфиром (350 мл). Затем щелочную фазу подкисляли концентрированной HCl и отфильтровывали образовавшееся твердое вещество. Продукт очищали двойной кристаллизацией из смеси гексана/этилацетата в соотношении 1/3. Получали 5,8 г 2-[(1-бензил-1 Н-индазол-3-ил)метокси]этоксиуксусной кислоты. Т.пл. 101-103 С. 1H-ЯМР (CDCl3,м.д.): 3,66-3,79 (м, 4 Н), 4,13 (с, 2 Н), 5,01 (с, 2 Н), 5,58 (с, 2 Н), 7,66 (шир.с, 1 Н),7,14-7,40 (м, 8 Н), 7,84 (дт, J=8,11; 0,99 Гц, 1 Н). Получение соединения 20. 2-2-[(1-Бензил-1 Н-индазол-3-ил)метокси]этокси-2-метилпропионовая кислота. В смесь 2-[(1-бензил-1 Н-индазол-3-ил)метокси]этанола (35 г, 0,124 моль) и NaOH (63 г, 1,57 моль) в ацетоне (180 мл) и воде (1 мл), перемешивавшейся при комнатной температуре, медленно добавляли смесь хлороформа/ацетона в соотношении 1/1 (80 мл). В процессе добавления температура вырастала до температуры дефлегмации. После того как добавление завершали, растворитель выпаривали при пониженном давлении, остаток растворяли в воде (100 мл) и промывали диэтиловым эфиром (350 мл). Водную фазу подкисляли ледяной уксусной кислотой, а затем экстрагировали диэтиловым эфиром(3150 мл). Объединенные органические фазы концентрировали при пониженном давлении. Полученный неочищенный остаток очищали кристаллизацией из смеси гексана/этилацетата в соотношении 1/1. Получали 12,4 г 2-2-[(1-бензил-1 Н-индазол-3-ил)метокси]этокси-2-метилпропионовой кислоты. Т.пл. 94-95 С. 1 К раствору NaOH (2,8 г; 0,07 моль) в 1,3-пропандиоле (150 мл), перемешивавшемуся при комнатной температуре, добавляли 1-бензил-3-хлорметилиндазол, полученный, как описано в ЕР 0382276, (17,6 г; 0,07 моль). Раствор нагревали при 130 С в течение 4 ч, а затем охлаждали до комнатной температуры и выпаривали растворитель при пониженном давлении. Остаток растворяли в воде (100 мл) и продукт экстрагировали этилацетатом (3100 мл). Объединенные органические фазы концентрировали при пониженном давлении, а полученный неочищенный остаток очищали флэш-хроматографией на силикагеле,используя смесь гексана/этилацетата в соотношении приблизительно 1/1 в качестве элюента. Таким образом получали 10,5 г 3-[(1-бензил-1 Н-индазол-3-ил)метокси]пропан-1-ола. 1H-ЯМР (CDCl3,м.д.): 1,85 (кв, J=5,83 Гц, 2 Н), 2,75 (шир.с, 1 Н), 3,71 (т, J=7,74 Гц, 4 Н), 4,91 (с,2 Н), 5,55 (с, 2 Н), 7,0-7,4 (м, 8 Н), 7,80 (д, J=7,77 Гц, 1 Н). 21b) 2-3-[(1-Бензил-1 Н-индазол-3-ил)метокси]пропокси-2-метилпропионовая кислота. Продукт получали способом, который описан в примере 20, используя 3-[(1-бензил-1 Н-индазол-3 ил)метокси]пропан-1-ол в качестве стартового вещества. Продукт очищали двойной кристаллизацией из смеси гексана/этилацетата в соотношении 7/3. Т.пл. 57-59 С. 1 Н-ЯМР (ДМСО-d6,м.д.): 1,25 (с, 6 Н), 1,72 (квинт, J=6,40 Гц, 2 Н), 3,37 (т, J=6,40 Гц, 2 Н), 3,53 (т,J=6,40 Гц, 2 Н), 4,77 (с, 2 Н), 5,62 (с, 2 Н), 7,14 (ддд, J=8,00; 7,00; 0,73 Гц, 1 Н), 7,19-7,33 (м, 5 Н), 7,38 (ддд,J=8,37; 7,00; 0,91 Гц, 1 Н), 7,66 (д, J=8,42 Гц, 1 Н), 7,79 (дт, J=8,05; 0,91 Гц, 1 Н), 12,46 (с, 1 Н). Получение соединения 22. 2-[1-(4-Метилбензил)-1 Н-индазол-3-ил]метокси-2-метилпропионовая кислота. 22 а) [1-(4-Метилбензил)-1 Н-индазол-3-ил]метанол. Продукт получали способом, который описан в примере 1 а, используя 4-метилбензилхлорид в качестве реактива. Полученный продукт очищали кристаллизацией из смеси гексана/этилацетата в соотношении 5/1. Т.пл. 90-92 С. 1H-ЯМР (CDCl3,м.д.): 2,24 (с, 3H), 3,4 (шир.с, 1 Н), 5,0 (с, 2 Н), 5,36 (с, 2 Н), 6,9-7,4 (м, 7 Н), 7,79 (д,J=7,84 Гц, 1 Н). 22b) 2-[1-(4-Метилбензил)-1 Н-индазол-3-ил]метокси-2-метилпропионовая кислота. Продукт получали способом, который описан в примере 1b), используя [1-(4-метилбензил)-1 Ниндазол-3-ил]метанол в качестве реактива. Полученный продукт очищали кристаллизацией из толуола. Т.пл. 160-162 С. 1H-ЯМР (ДМСО-d6,м.д.): 1,45 (с, 6 Н), 2,23 (с, 3H), 4,75 (с, 2 Н), 5,55 (с, 2 Н), 6,9-7,2 (м, 5 Н), 7,37 (т,J=6,98 Гц, 1 Н), 7,64 (д, J=8,32 Гц, 1 Н), 7,94 (д, J=8,32 Гц, 1 Н). Получение соединения 23. 2-[(1-Бензил-5-бром-1 Н-индазол-3-ил)метокси]-2-метилпропионовая кислота. В суспензию 2-[(1-бензил-1 Н-индазол-3-ил)метокси]-2-метилпропионовой кислоты (17,5 г; 0,054 моль) в ледяной уксусной кислоте (75 мл), перемешивавшуюся при температуре 10 С при использовании нагревательной бани, по каплям добавляли раствор Br2 (10 мл; 0,195 моль) в ледяной уксусной кислоте (75 мл). После того как добавление завершали, раствор перемешивали при комнатной температуре в течение 30 мин и затем выливали в воду (300 мл). Затем в смесь добавляли насыщенный растворNa2SO3 (100 мл) и продукт экстрагировали этилацетатом (3200 мл). Объединенные органические фазы концентрировали при пониженном давлении, а полученный неочищенный остаток очищали кристаллизацией из смеси гексана/этилацетата в соотношении 1/1. Получали 8 г 2-[(1-бензил-5-бром-1 Н-индазол-3-ил)метокси]-2-метилпропионовой кислоты. Т.пл. 168-170 С. 1H-ЯМР (CDCl3,м.д.): 1,61 (с, 6 Н), 4,91 (с, 2 Н), 5,54 (с, 2 Н), 8,11 (шир.с, 1 Н), 7,11-7,33 (м, 6 Н),7,40 (дд, J=8,87; 1,74 Гц, 1 Н), 8,04 (д, J=1,83 Гц, 1 Н). Получение соединения 24. 2-[(5-Амино-1-бензил-1 Н-индазол-3-ил)метокси]-2-метилпропионовая кислота. В суспензию 2-метил-2-[(5-нитро-1-бензил-1 Н-индазол-3-ил)метокси]пропионовой кислоты (соединение 6) (5,6 г; 0,015 моль) в метаноле (50 мл), перемешивавшуюся при комнатной температуре, добавляли формиат аммония (5,5 г; 0,087 моль), после чего очень медленно добавляли 10% палладий на угле(1 г; 0,9 ммоль). После завершения добавления смесь перемешивали при комнатной температуре в течение 30 мин и затем фильтровали, а раствор концентрировали при пониженном давлении. Остаток растворяли в воде (100 мл) и смесь нейтрализовали ледяной уксусной кислотой. Полученное таким образом твердое вещество отфильтровывали и очищали кристаллизацией из смеси этилацетата/этанола в соотношении 1/1. Таким образом получали 3 г 2-метил-2-[(5-амино-1-бензил-1 Н-индазол-3-ил)метокси]пропионовой кислоты. Т.пл. 172-173 С.[1-(4-Хлор-2-метилбензил)-1 Н-индазол-3-ил]метоксиуксусная кислота. Продукт получали способом, который описан в примере 17b), используя [1-(4-хлор-2-метилбензил)1 Н-индазол-3-ил]метанол в качестве стартового вещества. Продукт очищали кристаллизацией из изопропанола. Т.пл. 144-146 С. 1H-ЯМР (ДМСО-d6,м.д.): 2,34 (с, 3H), 4,12 (с, 2 Н), 4,88 (с, 2 Н), 5,63 (с, 2 Н), 6,71 (д, J=8,19 Гц, 1 Н),7,0-7,5 (м, 4 Н), 7,62 (д, J=8,19 Гц, 1 Н), 7,91 (д, J=7,69 Гц, 1 Н). Получение соединения 29. 2-[(1-Бензил-1 Н-индазол-3-ил)метокси]-2-метилпропионовая кислота. Получение продукта 29 осуществляли, как описано в патентной заявке ЕР 382276. Получение соединения 33. 3-[(1-Бензил-1 Н-индазол-3-ил)метокси]пропоксиуксусная кислота. 33 а) 3-[(1-Бензил-1 Н-индазол-3-ил)метокси]пропан-1-ол. К раствору NaOH (2,8 г; 0,07 моль) в 1,3-пропандиоле (150 мл), перемешивавшемуся при комнатной температуре, добавляли 1-бензил-3-хлорметилиндазол, полученный, как описано в примере 2 а) в ЕР 382276 (17,6 г; 0,07 моль). Раствор нагревали при 130 С в течение 4 ч, а затем охлаждали до комнатной температуры и выпаривали растворитель при пониженном давлении. Остаток растворяли в воде(100 мл) и продукт экстрагировали этилацетатом (3100 мл). Объединенные органические фазы концентрировали при пониженном давлении, а полученный неочищенный остаток очищали флэшхроматографией на силикагеле, используя смесь гексана/этилацетата в соотношении 1/1 в качестве элюента. Продукт очищали кристаллизацией из смеси гексана/этилацетата в соотношении приблизительно 1/1. 1H-ЯМР (CDCl3,м.д.): 1,85 (кв, J=5,83 Гц, 2 Н), 2,75 (шир.с, 1 Н), 3,71 (т, J=7,74 Гц, 4 Н), 4,91 (с,2 Н), 5,55 (с, 2 Н), 7,0-7,4 (м, 8 Н), 7,80 (д, J=7,77 Гц, 1 Н). 33b) 3-[(1-Бензил-1 Н-индазол-3-ил)метокси]пропоксиуксусная кислота. К раствору 3-[(1-бензил-1 Н-индазол-3-ил)метокси]пропан-1-ола (11,5 г, 0,04 моль) в сухом тетрагидрофуране (ТГФ) (100 мл), перемешивавшемуся при комнатной температуре, добавляли 60% гидрид натрия (1,6 г, 0,04 моль). Смесь нагревали при температуре кипения в течение 2 ч, а затем охлаждали до комнатной температуры и медленно добавляли в нее раствор этилбромацетата (7,4 г, 0,044 моль) в ТГФ(7 мл). После того как добавление завершали, смесь кипятили с обратным холодильником в течение дополнительных 2 ч. Реакцию останавливали охлаждением до комнатной температуры и выпариванием растворителя при пониженном давлении. Остаток растворяли в 2 н. NaOH (100 мл) и продукт экстрагировали диэтиловым эфиром (3150 мл). Объединенные органические фазы концентрировали при пониженном давлении. Неочищенный остаток растворяли в растворе NaOH (1,9 г, 0,045 моль) в смеси воды/этанола в соотношении 1/1 (160 мл). Затем смесь перемешивали при кипячении с обратным холодильником в течение 2 ч. Реакцию останавливали концентрированием растворителя при пониженном давлении, остаток растворяли в воде (100 мл) и промывали диэтиловым эфиром (350 мл). Затем щелочную фазу подкисляли концентрированной HCl и отфильтровывали образовавшееся твердое вещество. Продукт очищали двойной кристаллизацией из смеси гексана/этилацетата в соотношении 1/3. Таким образом получали 5,5 г 3-[(1-бензил-1 Н-индазол-3-ил)метокси]пропоксиуксусной кислоты. Получение соединения 34. 2-[(1-Бензил-1 Н-индазол-3-ил)метокси]-2-метилпропоксиуксусная кислота. 34 а) 2-[(1-Бензил-1 Н-индазол-3-ил)метокси]-2-метилпропан-1-ол. В суспензию LiAlH4 (4,48 г; 0,118 моль) в диэтиловом эфире (100 мл), перемешивавшуюся при комнатной температуре, медленно добавляли раствор метил 2-[(1-бензил-1 Н-индазол-3-ил)метокси]-2 метилпропаноата, полученного в соответствии со способом, описанным в ЕР 0382276, (20 г; 0,06 моль) в диэтиловом эфире (200 мл) и ТГФ (50 мл). После того как добавление завершали, смесь перемешивали при комнатной температуре в течение 30 мин, а затем реакцию завершали добавлением 10 н. NaOH(20 мл) и воды (40 мл). Растворитель выпаривали при пониженном давлении, а маслянистый остаток очищали дистилляцией при давлении 0,01 мм рт.ст. и температуре 190 С. Полученный таким образом твердый продукт кристаллизовали из изопропанола. Таким образом получали 11 г 2-[(1-бензил-1 Н-индазол-3-ил)метокси]-2-метилпропан-1-ола. Т.пл. 52-53 С. 1 Н-ЯМР (CDCl3,м.д.): 1,34 (с, 6 Н), 2,50 (шир.с, 1 Н), 3,51 (с, 2 Н), 4,87 (с, 2 Н), 5,55 (с, 2 Н), 7,14(ддд, J=8,04; 6,21; 1,68 Гц, 1 Н), 7,17-7,38 (м, 7 Н), 7,78 (дт, J=8,08; 1,00 Гц, 1 Н). 34b) 2-[(1-Бензил-1 Н-индазол-3-ил)метокси]-2-метилпропоксиуксусная кислота. К раствору 2-[(1-бензил-1 Н-индазол-3-ил)метокси]-2-метилпропан-1-ола (11,0 г, 0,04 моль) в сухом тетрагидрофуране (ТГФ) (100 мл), перемешивавшемуся при комнатной температуре, добавляли 60% гидрид натрия (1,6 г, 0,04 моль). Смесь нагревали при температуре кипения в течение 2 ч, затем охлаждали до комнатной температуры и медленно добавляли в нее раствор этилбромацетата (7,4 г, 0,044 моль) в ТГФ (7 мл). После того как добавление завершали, смесь кипятили с обратным холодильником в течение дополнительных 2 ч. Реакцию останавливали охлаждением до комнатной температуры и выпариванием растворителя при пониженном давлении. Остаток растворяли в 2 н. NaOH (100 мл) и продукт экстрагировали диэтиловым эфиром (3150 мл). Объединенные органические фазы концентрировали при пониженном давлении. Неочищенный остаток растворяли в растворе NaOH (1,9 г, 0,045 моль) в смеси воды/этанола в соотношении 1/1 (160 мл). Затем смесь перемешивали при кипячении с обратным холодильником в течение 2 ч. Реакцию останавливали концентрированием растворителя при пониженном давлении, остаток растворяли в воде (100 мл) и промывали диэтиловым эфиром (350 мл). Затем щелочную фазу подкисляли концентрированной HCl и отфильтровывали образовавшееся твердое вещество. Продукт очищали двойной кристаллизацией из смеси гексана/этилацетата в соотношении 1/2. Таким образом получали 4,6 г 2-[(1-бензил-1 Н-индазол-3-ил)метокси]-2-метилпропоксиуксусной кислоты. Пример 1. Анализ экспрессии гена MCP-1 линией моноцитов человека. Оценивали способность соединений к ингибированию экспрессии MCP-1 клетками MonoMac6,стимулированными липополисахаридом (LPS). Клетки помещали в 96-луночные планшеты в концентрации 50000 клеток/лунка. При тестировании использовали растворы соединений с максимально возможными концентрациями, которые приведены в табл. 1 (в диапазоне 30-300 мкМ), и осуществляли инкубирование в течение 1 ч. Затем клетки стимулировали липополисахаридом (100 нг/мл) в течение 4 ч. Общую РНК экстрагировали из клеточного осадка с использованием RNeasy Mini Kit (Qiagen),осуществляли обратную транскрипцию с использованием набора для синтеза TaqMan Reverse Transcription Reagents (Applied Biosystems) и полученную кДНК использовали для ПЦР в реальном времени. Амплификацию осуществляли в 96-луночных планшетах с использованием Abi Prism 7000 Sequence Detection System (Applied Biosystems) и следующего температурного профиля: 50 С в течение 2 мин, 95 С в течение 10 мин и 45 циклов при 95 С в течение 15 с и 60 С в течение 1 мин. Для амплификации использовали набор праймеров и зонд, специфичные к MCP-1 человека (Applied Biosystems, RefSeqNM002982.3). Набор праймеров и зонд для -актина использовали в отдельных лунках в качестве внутреннего контроля с целью нормализации образцов. После завершения реакции данные о флуоресценции анализировали с использованием программного обеспечения ABI Prism 7000 SDS, вычисляя пороговый цикл (Ct) для каждого образца, а затем осуществляя определение полуколичественных показателей с помощью Ct-способа. В табл. 1 приведены полученные результаты, выраженные в виде процентных долей ингибирования. Таблица 1 Приведенные в табл. 1 полученные результаты указывают на то, что соединения обладали способностью к существенному ингибированию LPS-индуцированной экспрессии MCP-1 линией моноцитов человека, при этом выявлено снижение уровней специфичных мРНК на 26-95%. Пример 2. Измерение образования MCP-1 линией моноцитов человека. Оценивали способность соединений к ингибированию экспрессии белка MCP-1 клеткамиMonoMac6, стимулированными липополисахаридом (LPS). Клетки помещали в 96-луночные планшеты в концентрации 50000 клеток/лунка. При тестировании использовали растворы соединений с максимально возможными концентрациями, которые приведены в табл. 2 (в диапазоне 30-300 мкМ), и осуществляли инкубирование в течение 1 ч. Затем клетки стимулировали липополисахаридом (100 нг/мл) в течение 20 ч. Количество образовавшегося MCP-1 измеряли в супернатантах, которые должным образом разводили буфером, с помощью иммуноферментного анализа (ELISA), используя коммерческий набор (ELISA В табл. 2 приведены полученные результаты, выраженные в виде процентных долей ингибирования. Таблица 2 Приведенные в табл. 2 полученные результаты указывают на то, что соединения обладали способностью к существенному ингибированию LPS-индуцированной экспрессии MCP-1 линией моноцитов человека, при этом выявлено снижение уровней образовавшегося белка на 29-100%. Пример 3. Анализ экспрессии гена CX3CR1 линией моноцитов человека. Оценивали способность соединений к ингибированию экспрессии CX3CR1 клетками MonoMac6,стимулированными липополисахаридом (LPS). Клетки помещали в 96-луночные планшеты в концентрации 50000 клеток/лунка. При тестировании использовали растворы соединений с максимально возможными концентрациями, которые приведены в табл. 3 (в диапазоне 30-300 мкМ), и осуществляли инкубирование в течение 1 ч. Затем клетки стимулировали липополисахаридом (100 нг/мл) в течение 20 ч. Общую РНК экстрагировали из клеточного осадка с использованием RNeasy Mini Kit (Qiagen),осуществляли обратную транскрипцию с использованием набора для синтеза TaqMan Reverse Transcription Reagents (Applied Biosystems) и полученную кДНК использовали для ПЦР в реальном времени. Амплификацию осуществляли в 96-луночных планшетах с использованием Abi Prism 7000 Sequence Detection System (Applied Biosystems) и следующего температурного профиля: 50 С в течение 2 мин, 95 С в течение 10 мин и 45 циклов при 95 С в течение 15 с и 60 С в течение 1 мин. Для амплификации использовали набор праймеров и зонд, специфичные к CX3CR1 человека (Applied Biosystems, RefSeqNM001337.3). Набор праймеров и зонд для -актина использовали в отдельных лунках в качестве внутреннего контроля с целью нормализации образцов. После завершения реакции данные о флуоресценции анализировали с использованием программного обеспечения ABI Prism 7000 SDS, вычисляя пороговый цикл (Ct) для каждого образца, а затем осуществляя определение полуколичественных показателей с помощью Ct-способа. В табл. 3 приведены полученные результаты, выраженные в виде процентных долей ингибирования. Таблица 3 Приведенные в табл. 3 полученные результаты указывают на то, что соединения обладали способностью к существенному ингибированию LPS-индуцированной экспрессии CX3CR1 линией моноцитов человека, при этом выявлено снижение уровней специфичных мРНК на 75-99%. Пример 4. Анализ экспрессии гена p40 линией моноцитов человека. Оценивали способность соединений к ингибированию экспрессии р 40 клетками MonoMac6, стимулированными липополисахаридом (LPS). Клетки помещали в 96-луночные планшеты в концентрации 50000 клеток/лунка. При тестировании использовали растворы соединений с максимально возможными концентрациями, которые приведены в табл. 4 (в диапазоне 30-300 мкМ), и осуществляли инкубирование в течение 1 ч. Затем клетки стимулировали липополисахаридом (100 нг/мл) в течение 4 ч. Общую РНК экстрагировали из клеточного осадка с использованием RNeasy Mini Kit (Qiagen),осуществляли обратную транскрипцию с использованием набора для синтеза TaqMan Reverse Transcription Reagents (Applied Biosystems) и полученную кДНК использовали для ПЦР в реальном времени. Амплификацию осуществляли в 96-луночных планшетах с использованием Abi Prism 7000 Sequence Detection System (Applied Biosystems) и следующего температурного профиля: 50 С в течение 2 мин, 95 С в течение 10 мин и 45 циклов при 95 С в течение 15 с и 60 С в течение 1 мин. Для амплификации использовали набор праймеров и зонд, специфичные к p40 человека (Applied Biosystems, RefSeq NM002187.3). Набор праймеров и зонд для -актина использовали в отдельных лунках в качестве внутреннего контроля с целью нормализации образцов. После завершения реакции данные о флуоресценции анализировали с использованием программного обеспечения ABI Prism 7000 SDS, вычисляя пороговый цикл (Ct) для каждого образца, а затем осуществляя определение полуколичественных показателей с помощью Ctспособа. В табл. 4 приведены полученные результаты, выраженные в виде процентных долей ингибирования. Таблица 4 Приведенные в табл. 4 полученные результаты указывают на то, что соединения обладали способностью к существенному ингибированию LPS-индуцированной экспрессии p40 линией моноцитов человека, при этом выявлено снижение уровней специфичных мРНК на 47-64%. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I)X1 представляет собой алкильную группу, которая содержит от 1 до 5 углеродных атомов, необязательно замещенных одной или несколькими алкильными группами, которые содержат от 1 до 5 углеродных атомов, или одной или несколькими алкоксильными группами, которые содержат от 1 до 3 углеродных атомов, иR9 и R10, которые могут быть одинаковыми или отличающимися друг от друга, представляют собой водород, алкильную группу, которая содержит от 1 до 5 углеродных атомов, или алкоксильную группу,которая содержит от 1 до 3 углеродных атомов;R1 и R2, которые могут быть одинаковыми или отличающимися друг от друга, представляют собой водород, алкильную группу, которая содержит 1 углеродный атом;R3, R4 и R8, которые могут быть одинаковыми или отличающимися друг от друга, представляют собой водород, алкильную группу, которая содержит от 1 до 5 углеродных атомов, алкоксильную группу,которая содержит от 1 до 3 углеродных атомов, атом галогена, -OH, -N(R')COR, -CN, -CONR'R,- 19018241-SO2NR'R, -SO2R' и трифторметил, где R' и R, которые могут быть одинаковыми или отличающимися друг от друга, представлены водородом и алкильной группой, содержащей от 1 до 5 углеродных атомов;R5 представляет собой водород, алкильную группу, которая содержит 1 углеродный атом, алкоксильную группу, которая содержит от 1 до 3 углеродных атомов, -OH, -N(R')(R), нитро или R5 вместе с одним из R6 и R7 образует кольцо, которое содержит 5 или 6 углеродных атомов, где R' и R, которые могут быть одинаковыми или отличающимися друг от друга, представлены водородом и алкильной группой, которая содержит 1 углеродный атом;R6 и R7, которые могут быть одинаковыми или отличающимися друг от друга, представляют собой водород, алкильную группу, которая содержит 1 углеродный атом, или вместе образуют группу С=O или один из R6 и R7 вместе с R5 образует кольцо, которое содержит 5 или 6 углеродных атомов,при условии, что A отличается от алкильной группы, содержащей 1 углеродный атом, необязательно замещенный одной или несколькими алкильными группами, которые содержат от 1 до 5 углеродных атомов, или, альтернативно, по меньшей мере одна из групп с R1 по R8 отличается от водорода,или его фармацевтически приемлемая соль. 2. Соединение по п.1, отличающееся тем, что X1 представляет собой алкильную группу, которая содержит от 1 до 3 углеродных атомов, необязательно замещенных одной или несколькими алкильными группами, которые содержат от 1 до 3 углеродных атомов, или одной или несколькими алкоксильными группами, которые содержат 1 или 2 углеродных атома. 3. Соединение по п.1, отличающееся тем, что Х 1 выбран из группы, содержащей группу CH2, группу CH2CH2 или группу C(CH3)2, и R9 и R10, которые могут быть одинаковыми или отличающимися друг от друга, представляют собой водород или группу CH3. 4. Соединение по п.1, отличающееся тем, что радикал A выбран из группы, содержащей группуCH2CH2CH2OC(CH3)2. 5. Соединение по п.1, отличающееся тем, что R3, R4 и R8, которые могут быть одинаковыми или отличающимися друг от друга, выбраны из группы, содержащей водород, алкильную группу, которая содержит от 1 до 3 углеродных атомов, алкоксильную группу, которая содержит 1 или 2 углеродных атома,атом Br, Cl или F, группу OH, трифторметил или группу -N(R')COR, -CN, -CONR'R, -SO2NR'R, -SO2R',где R' и R, которые могут быть одинаковыми или отличающимися друг от друга, представлены водородом и алкильной группой, которая содержит от 1 до 3 углеродных атомов. 6. Соединение по п.1, отличающееся тем, что R5 выбран из группы, содержащей водород, алкильную группу, которая содержит 1 углеродный атом, алкоксильную группу, которая содержит 1 или 2 углеродных атома, группу OH, или R5 вместе с одним из R6 и R7 образует кольцо, которое содержит 5 или 6 углеродных атомов. 7. Соединение по п.1, отличающееся тем, что R6 и R7, которые могут быть одинаковыми или отличающимися друг от друга, выбраны из группы, содержащей водород, алкильную группу, которая содержит 1 углеродный атом, или вместе образуют группу C=O или один из R6 и R7 вместе с R5 образует кольцо, которое содержит 5 или 6 углеродных атомов. 8. Фармацевтическая композиция, содержащая соединение формулы (I) по любому из предыдущих пунктов или его фармацевтически приемлемую соль, и по меньшей мере один фармацевтически приемлемый носитель. 9. Фармацевтическая композиция по п.8, отличающаяся тем, что указанная фармацевтически приемлемая соль представляет собой соль присоединения физиологически приемлемой органической или неорганической кислоты или основания. 10. Фармацевтическая композиция по п.9, отличающаяся тем, что указанные физиологически приемлемые кислоты выбраны из группы, содержащей соляную, бромисто-водородную, серную, фосфорную, азотную, уксусную, аскорбиновую, бензойную, лимонную, фумаровую, молочную, малеиновую,метансульфоновую, щавелевую, паратолуолсульфоновую, бензолсульфоновую, янтарную, дубильную и винную кислоты. 11. Фармацевтическая композиция по п.9, отличающаяся тем, что указанные физиологически приемлемые основания выбраны из группы, содержащей гидроксид аммония, гидроксид кальция, карбонат магния, гидрокарбонат натрия, гидрокарбонат калия, аргинин, бетаин, кофеин, холин,N,N-дибензилэтилендиамин, диэтиламин, 2-диэтиламиноэтанол, 2-диметиламиноэтанол, этаноламин,этилендиамин, N-этилморфолин, N-этилпиперидин, N-метилглюкамин, глюкамин, глюкозамин, гистидин, N-(2-гидроксиэтил)пиперидин, N-(2-гидроксиэтил)пирролидин, изопропиламин, лизин, метилглюкамин, морфолин, пиперазин, пиперидин, теобромин, триэтиламин, триметиламин, трипропиламин и трометамин. 12. Фармацевтическая композиция по любому из пп.8-11, отличающаяся тем, что указанная композиция содержит стереоизомер или энантиомер соединения формулы (I) или его фармацевтически приемлемой соли. 13. Фармацевтическая композиция по любому из пп.8-12, отличающаяся тем, что указанный фармацевтически приемлемый носитель выбран из группы, содержащей глиданты, связующие вещества,- 20018241 дезинтегрирующие средства, наполнители, разбавители, ароматизаторы, красители, флюидизирующие средства, смазывающие вещества, консерванты, увлажнители, абсорбенты и подсластители. 14. Применение соединения формулы (I)X1 представляет собой алкильную группу, которая содержит от 1 до 5 углеродных атомов, необязательно замещенных одной или несколькими алкильными группами, содержащими от 1 до 5 углеродных атомов, или одной или несколькими алкоксильными группами, которые содержат от 1 до 3 углеродных атомов, иR9 и R10, которые могут быть одинаковыми или отличающимися друг от друга, представляют собой водород, алкильную группу, которая содержит от 1 до 5 углеродных атомов, или алкоксильную группу,которая содержит от 1 до 3 углеродных атомов;R1 и R2, которые могут быть одинаковыми или отличающимися друг от друга, представляют собой водород, алкильную группу, которая содержит 1 углеродный атом;R3, R4 и R8, которые могут быть одинаковыми или отличающимися друг от друга, представляют собой водород, алкильную группу, которая содержит от 1 до 5 углеродных атомов, алкоксильную группу,которая содержит от 1 до 3 углеродных атомов, атом галогена, -OH, -N(R')COR, -CN, -CONR'R,-SO2NR'R, -SO2R' и трифторметил, где R' и R, которые могут быть одинаковыми или отличающимися друг от друга, представлены водородом и алкильной группой, которая содержит от 1 до 5 углеродных атомов;R5 представляет собой водород, алкильную группу, которая содержит 1 углеродный атом, алкоксильную группу, которая содержит от 1 до 3 углеродных атомов, -OH, -N(R')(R), нитро или R5 вместе с одним из R6 и R7 образует кольцо, которое содержит 5 или 6 углеродных атомов, где R' и R, которые могут быть одинаковыми или отличающимися друг от друга, представлены водородом и алкильной группой, которая содержит 1 углеродный атом;R6 и R7, которые могут быть одинаковыми или отличающимися друг от друга, представляют собой водород, алкильную группу, которая содержит 1 углеродный атом, или вместе образуют группу C=O или один из R6 и R7 вместе с R5 образует кольцо, которое содержит 5 или 6 углеродных атомов,для получения фармацевтической композиции для лечения заболеваний, основанных на экспрессииCX3CR1 и p40, выбранных из группы, состоящей из волчаночного нефрита, диабетической нефропатии,болезни Крона, язвенного колита, заболеваний коронарных сосудов, рестеноза, инфаркта миокарда, стенокардии, хронических дегенеративных воспалительных заболеваний, псориаза, диабета II типа, опухолей и рака. 15. Применение соединения формулы (I)X1 представляет собой алкильную группу, которая содержит от 1 до 5 углеродных атомов, необязательно замещенных одной или несколькими алкильными группами, которые содержат от 1 до 5 углеродных атомов, или одной или несколькими алкоксильными группами, которые содержат от 1 до 3 углеродных атомов, иR9 и R10, которые могут быть одинаковыми или отличающимися друг от друга, представляют собой водород, алкильную группу, которая содержит 1 углеродный атом;R1 и R2, которые могут быть одинаковыми или отличающимися друг от друга, представляют собой водород, алкильную группу, которая содержит 1 углеродный атом;R3, R4 и R8, которые могут быть одинаковыми или отличающимися друг от друга, представляют собой водород, алкильную группу, которая содержит от 1 до 5 углеродных атомов, алкоксильную группу,- 21018241 которая содержит от 1 до 3 углеродных атомов, атом галогена, -OH, -N(R')COR, -CN, -CONR'R,-SO2NR'R, -SO2R' и трифторметил, где R' и R, которые могут быть одинаковыми или отличающимися друг от друга, представлены водородом и алкильной группой, которая содержит от 1 до 5 углеродных атомов;R5 представляет собой водород, алкильную группу, которая содержит 1 углеродный атом, алкоксильную группу, которая содержит от 1 до 3 углеродных атомов, -OH, -N(R')(R), нитро или R5 вместе с одним из R6 и R7 образует кольцо, которое содержит 5 или 6 углеродных атомов, где R' и R, которые могут быть одинаковыми или отличающимися друг от друга, представлены водородом и алкильной группой, которая содержит 1 углеродный атом;R6 и R7, которые могут быть одинаковыми или отличающимися друг от друга, представляют собой водород, алкильную группу, которая содержит 1 углеродный атом, или вместе образуют группу С=O или один из R6 и R7 вместе с R5 образует кольцо, которое содержит 5 или 6 углеродных атомов,при условии, что A отличается от алкильной группы, которая содержит 1 углеродный атом, необязательно замещенный одной или несколькими алкильными группами, которые содержат от 1 до 5 углеродных атомов, или, альтернативно, по меньшей мере одна из групп с R1 по R8 отличается от водорода,для получения фармацевтической композиции для лечения заболеваний, основанных на экспрессииMCP-1, выбраны из группы, содержащей ревматоидный артрит, артрит, вызванный вирусной инфекцией,псориатический артрит, артроз, волчаночный нефрит, диабетическую нефропатию, гломерулонефрит,поликистозное поражение почек, интерстициальное заболевание легких, фиброз, рассеянный склероз,болезнь Альцгеймера, ВИЧ-ассоциированное слабоумие, атопический дерматит, псориаз, васкулит, рестеноз, атеросклероз, инфаркт миокарда, стенокардию, острые заболевания коронарных артерий, аденомы, карциномы и метастазы, метаболические заболевания и осложнения после хирургических вмешательств. 18. Применение по п.15, отличающееся тем, что указанные заболевания, основанные на экспрессииCX3CR1, выбраны из группы, содержащей ревматоидный артрит, волчаночный нефрит, диабетическую нефропатию, болезнь Крона, язвенный колит, заболевания коронарных сосудов, рестеноз, атеросклероз,инфаркт миокарда, стенокардию и осложнения после хирургических вмешательств. 19. Применение по п.15, отличающееся тем, что указанные заболевания, основанные на экспрессииp40, выбраны из группы, содержащей аутоиммунные заболевания, хронические дегенеративные воспалительные заболевания и рак. 20. Применение по п.15, отличающееся тем, что указанные заболевания, основанные на экспрессииp40, выбраны из группы, содержащей ревматоидный артрит, псориаз, гломерулонефрит, диабет, красную волчанку, болезнь Крона и опухоли. 21. Способ лечения или предупреждения заболеваний, основанных на экспрессии CX3CR1 и p40,выбранных из группы, состоящей из волчаночного нефрита, диабетической нефропатии, болезни Крона,язвенного колита, заболеваний коронарных сосудов, рестеноза, инфаркта миокарда, стенокардии, хронических дегенеративных воспалительных заболеваний, псориаза, диабета II типа, опухолей и рака, характеризующийся введением пациенту, нуждающемуся в этом, эффективного количества соединения формулы (I) в которой А представляет собой -X1- или -X1-OC(R9)(R10)-, где Х 1 представляет собой алкильную группу, которая содержит от 1 до 5 углеродных атомов, необязательно замещенных одной или несколькими алкильными группами, которые содержат от 1 до 5 углеродных атомов, или одной или несколькими алкоксильными группами, которые содержат от 1 до 3 углеродных атомов, иR9 и R10, которые могут быть одинаковыми или отличающимися друг от друга, представляют собой водород, алкильную группу, которая содержит от 1 до 5 углеродных атомов, или алкоксильную группу,которая содержит от 1 до 3 углеродных атомов;R1 и R2, которые могут быть одинаковыми или отличающимися друг от друга, представляют собойR3, R4 и R8, которые могут быть одинаковыми или отличающимися друг от друга, представляют собой водород, алкильную группу, которая содержит от 1 до 5 углеродных атомов, алкоксильную группу,которая содержит от 1 до 3 углеродных атомов, атом галогена, -OH, -N(R')COR, -CN, -CONR'R,-SO2NR'R, -SO2R' и трифторметил, где R' и R, которые могут быть одинаковыми или отличающимися друг от друга, представлены водородом и алкильной группой, которая содержит от 1 до 5 углеродных атомов;R5 представляет собой водород, алкильную группу, которая содержит 1 углеродный атом, алкоксильную группу, которая содержит от 1 до 3 углеродных атомов, -OH, -N(R')(R), нитро или R5 вместе с одним из R6 и R7 образует кольцо, которое содержит 5 или 6 углеродных атомов, где R' и R, которые могут быть одинаковыми или отличающимися друг от друга, представлены водородом и алкильной группой, которая содержит 1 углеродный атом; иR6 и R7, которые могут быть одинаковыми или отличающимися друг от друга, представляют собой водород, алкильную группу, которая содержит 1 углеродный атом, или вместе образуют группу C=O или один из R6 и R7 вместе с R5 образует кольцо, которое содержит 5 или 6 углеродных атомов. 22. Способ лечения или предупреждения заболеваний, основанных на экспрессии MCP-1, CX3CR1 и p40, характеризующийся введением пациенту, нуждающемуся в этом, эффективного количества соединения формулы (I)X1 представляет собой алкильную группу, которая содержит от 1 до 5 углеродных атомов, необязательно замещенных одной или несколькими алкильными группами, которые содержат от 1 до 5 углеродных атомов, или одной или несколькими алкоксильными группами, которые содержат от 1 до 3 углеродных атомов, иR9 и R10, которые могут быть одинаковыми или отличающимися друг от друга, представляют собой водород, алкильную группу, которая содержит от 1 до 5 углеродных атомов, или алкоксильную группу,которая содержит от 1 до 3 углеродных атомов;R1 и R2, которые могут быть одинаковыми или отличающимися друг от друга, представляют собой водород, алкильную группу, которая содержит 1 углеродный атом;R3, R4 и R8, которые могут быть одинаковыми или отличающимися друг от друга, представляют собой водород, алкильную группу, которая содержит от 1 до 5 углеродных атомов, алкоксильную группу,которая содержит от 1 до 3 углеродных атомов, атом галогена, -OH, -N(R')COR, -CN, -CONR'R,-SO2NR'R, -SO2R' и трифторметил, где R' и R, которые могут быть одинаковыми или отличающимися друг от друга, представлены водородом и алкильной группой, которая содержит от 1 до 5 углеродных атомов;R5 представляет собой водород, алкильную группу, которая содержит 1 углеродный атом, алкоксильную группу, которая содержит от 1 до 3 углеродных атомов, -OH, -N(R')(R), нитро или R5 вместе с одним из R6 и R7 образует кольцо, которое содержит 5 или 6 углеродных атомов, где R' и R, которые могут быть одинаковыми или отличающимися друг от друга, представлены водородом и алкильной группой, которая содержит 1 углеродный атом; иR6 и R7, которые могут быть одинаковыми или отличающимися друг от друга, представляют собой водород, алкильную группу, которая содержит 1 углеродный атом, или вместе образуют группу C=O или один из R6 и R7 вместе с R5 образует кольцо, которое содержит 5 или 6 углеродных атомов,при условии, что A отличается от алкильной группы, которая содержит 1 углеродный атом, необязательно замещенный одной или несколькими алкильными группами, которые содержат от 1 до 5 углеродных атомов, или, альтернативно, по меньшей мере одна из групп с R1 по R8 отличается от водорода. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2
МПК / Метки
МПК: A61K 31/415, C07D 231/56, A61P 25/00, A61P 29/00, A61P 13/00
Метки: применение, cx3cr1, mcp-1, заболеваний, лечения, 1-бензил-3-гидроксиметилиндазола, основанных, производные, экспрессии
Код ссылки
<a href="https://eas.patents.su/24-18241-proizvodnye-1-benzil-3-gidroksimetilindazola-i-ih-primenenie-dlya-lecheniya-zabolevanijj-osnovannyh-na-ekspressii-mcp-1-cx3cr1-i-p40.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 1-бензил-3-гидроксиметилиндазола и их применение для лечения заболеваний, основанных на экспрессии mcp-1, cx3cr1 и p40</a>
Предыдущий патент: Угловая опора для окна или двери
Следующий патент: Способ обработки ствола скважины и способ и система для разрушения фильтрационной корки на поверхности ствола скважины
Случайный патент: Система обжига