(бифенил)карбоновые кислоты и их производные
Номер патента: 12417
Опубликовано: 30.10.2009
Авторы: Зунозэ Михиро, Хэррисон Ричард Джон, Вильсон Фрэнцис, Хернандес-Перни Ремедиос, Тэйлор Джесс, Смельт Кэтрин, Буссард Сирилле, Райд Элисон, Кансфильд Эндру, Леформаль Адэляйн, Меджер Джереми, Ридер Валери, Буккардт Свенья
Формула / Реферат
1. Соединение общей формулы (I)
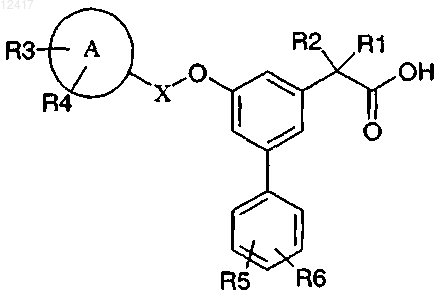
где А представляет собой кольцо, выбранное из группы, состоящей из фенила; С3-7-циклоалкила и гетероциклила, выбранного из циклопентанового, циклогексанового или циклогептанового кольца, которое может содержать до максимального количества двойных связей и в котором по крайней мере от 1 атома углерода до 4 атомов углерода замещены на гетероатом, выбранный из группы, состоящей из серы, включая -S(O)-, -S(O)2-, кислорода или азота, включая =N(O)-, и причем кольцо связано с остальной молекулой посредством атома углерода или азота;
X представляет собой линейную С1-С4-алкиленовую группу, необязательно замещенную одним или более заместителем из группы F, Cl, Br, I, и С1-С4-алкильные группы, необязательно замещенные одним или более F, Cl, Br, I;
R1, R2 независимо друг от друга выбраны из группы, состоящей из Н; алкила, выбранного из группы СН3, С2Н5, изо-С3Н7, н-C3H7, изо-С4Н9, н-C4H9, втор-C4H9, трет-С4Н9; алкенила, выбранного из С2Н3, изо-С3Н5, н-C3H5, н-C4H7, изо-С4Н7, втор-C4H7; или R1 и R2 являются частью насыщенного или ненасыщенного кольца, имеющего от 3 до 6 С-атомов, которое может содержать один или более гетероатомов из группы N, S или О и в котором гетероатомы могут быть одинаковыми или различными в случае, если присутствует более одного гетероатома;
R3, R4, R5 и R6 независимо друг от друга выбраны из группы, состоящей из Н; F; Cl; Br; I; CN; ОН; C(O)N(R7R8); S(O)2R7; SO2N(R7R8); S(O)N(R7R8); N(R7)S(O)2R8; N(R8)S(O)R8; S(O)2R7; N(R7)S(O)2N(R8R8a); SR7; N(R7R8); N(R7)C(O)R8; N(R7)C(O)N(R8R8a); N(R7)C(O)OR8; OC(O)N(R7R8); C(O)R7; замещенного или незамещенного С1-С4-алкила и замещенного и незамещенного С1-С4-алкокси, где заместители обеих групп С1-С4-алкил и С1-С4-алкокси выбраны из F, Cl, Br, I, CF3;
R7, R8, R8a независимо друг от друга выбраны из группы, состоящей из Н, С1-С4-алкила, гетероциклила, выбранного из циклопентанового, циклогексанового или циклогептанового кольца, которое может содержать до максимального количества двойных связей и в котором по крайней мере от 1 атома углерода до 4 атомов углерода замещены на гетероатом, выбранный из группы, состоящей из серы, включая -S(O)-, -S(O)2-, кислорода или азота, включая =N(O)-, и причем кольцо связано с остальной молекулой посредством атома углерода или азота; и С3-7-циклоалкила, где С1-С4-алкил, гетероциклил и С3-7-циклоалкил необязательно замещены одним или более заместителем, независимо выбранным из группы, состоящей из F, Cl, Br, I и CF3;
и/или его фармацевтически приемлемые соли или сложные эфиры.
2. Соединение по п.1, где А; X; R1 и R2; и R3, R4, R5 и R6 независимо друг от друга имеют следующие значения:
А представляет собой фенил; циклопропил; циклогексил или 6-членный ароматический гетероцикл;
X представляет собой группу СН2, необязательно замещенную одним или более заместителем из группы F, Cl, Br, I, и С1-С4-алкильные группы, необязательно замещенные одним или более F, Cl, Br, I; и/или
R1 и R2 представляют собой Н; или R1 представляет собой Н и R2 представляет собой СН3, C2H5, С3Н7 или С4Н9 или их изомеры; или R1 и R2 представляют собой СН3, или R1, R2 совместно с атомом углерода, к которому они присоединены, образуют циклопропильное кольцо; и/или
R3, R4, R5 и R6 независимо друг от друга выбраны из группы, состоящей из Н; ОН; С1-С4-алкила или С1-С4-алкокси, частично или полностью замещенных F, Cl, Br, I; C(O)NH2, S(О)2-С1-С4-алкила, S(О)2-гетероциклила;
и/или его фармацевтически приемлемые соли или сложные эфиры.
3. Соединение по любому из пп.1, 2, где А; X; R1 и R2; R3, R4, R5 и R6 независимо друг от друга имеют следующие значения:
А представляет собой фенил; или
X представляет собой СН2 или СНСН3; или
R1 и R2 представляют собой Н; или R1 представляет собой Н, a R2 представляет собой СН3, С2Н5, C3H7 и С4Н9 или их изомеры; или R1 и R2 представляют собой СН3, или R1, R2 совместно вместе с атомом углерода, к которому они присоединены, образуют циклопропильное кольцо, или
R3, R4, R5 и R6 независимо друг от друга выбраны из группы, состоящей из Н, ОН, СН3, ОСН3, CF3, OCF3, C(O)NH2, S(O)2-C1-C4-алкила, S(О)2-гетероциклила, F и Cl;
и/или его фармацевтически приемлемые соли или сложные эфиры.
4. Соединение по п.1, выбранное из группы, состоящей из следующих соединений:
I) [5-(4-фторбензилокси)-4'-трифторметилбифенил-3-ил]уксусная кислота;
II) [5-(4-изопропилбензилокси)-4'-трифторметилбифенил-3-ил]уксусная кислота;
III) [4'-трифторметил-5-(4-трифторметилбензилокси)бифенил-3-ил]уксусная кислота;
IV) [5-(4-метансульфонилбензилокси)-4'-трифторметилбифенил-3-ил]уксусная кислота;
V) (5-циклогексилметокси-4'-трифторметилбифенил-3-ил)уксусная кислота;
VI) {5-[4-(пирролидин-1-сульфонил)бензилокси]-4'-трифторметилбифенил-3-ил}уксусная кислота;
VII) (5-бензилоксибифенил-3-ил)уксусная кислота;
VIII) 2-(5-бензилокси-4'-трифторметилбифенил-3-ил)пентановая кислота;
IX) (5-бензилокси-3',5'-дихлорбифенил-3-ил)уксусная кислота;
X) 5-бензилокси-4'-трифторметилбифенил-3-ил)уксусная кислота;
XI) (5-бензилокси-3',5'-бис-трифторметилбифенил-3-ил)уксусная кислота;
XII) (5-бензилокси-3',4'-дихлорбифенил-3-ил)уксусная кислота;
XIII) (5-бензилокси-4'-трифторметоксибифенил-3-ил)уксусная кислота;
XIV) (5-бензилокси-3'-метоксибифенил-3-ил)уксусная кислота;
XV) (5-бензилокси-3'-карбамоилбифенил-3-ил)уксусная кислота;
XVI) (5-бензилокси-3'-гидроксибифенил-3-ил)уксусная кислота;
XVII) (5-бензилокси-4'-метансульфонилбифенил-3-ил)уксусная кислота;
XXIII) (5-бензилокси-4'-сульфамоилбифенил-3-ил)уксусная кислота;
XIX) 2-(5-бензилокси-4'-трифторметилбифенил-3-ил)пропионовая кислота;
XX) 2-(5-бензилокси-4'-трифторметилбифенил-3-ил)-2-метилпропионовая кислота;
XXI) 1-(5-бензилокси-4'-трифторметилбифенил-3-ил)циклопропанкарбоксиловая кислота;
XXII) (5-бензилокси-4'-фторбифенил-3-ил)уксусная кислота;
XXIII) (5-бензилокси-4'-хлорбифенил-3-ил)уксусная кислота;
XXIV) (4'-ацетиламин-5-бензилоксибифенил-3-ил)уксусная кислота;
XXV) (5-бензилокси-4'-гидроксибифенил-3-ил)уксусная кислота;
XXVI) (5-бензилокси-4'-изопропоксибифенил-3-ил)уксусная кислота;
XXVII) (5-бензилокси-3',5'-дифторбифенил-3-ил)уксусная кислота;
XXVIII) (5-бензилокси-3'-изопропоксибифенил-3-ил)уксусная кислота;
XXIX) (5-бензилокси-4'-метоксибифенил-3-ил)уксусная кислота;
XXX) (5-бензилокси-2'-метоксибифенил-3-ил)уксусная кислота;
XXXI) (5-бензилокси-2'-метилбифенил-3-ил)уксусная кислота;
XXXII) (5-бензилокси-3'-метилбифенил-3-ил)уксусная кислота;
XXXIII) (5-бензилокси-3'-трифторметилбифенил-3-ил)уксусная кислота;
XXXIV) (5-бензилокси-2'-фторбифенил-3-ил)уксусная кислота;
XXXV) (5-бензилокси-4'-метилбифенил-3-ил)уксусная кислота;
XXXVI) (5-бензилокси-3'-фторбифенил-3-ил)уксусная кислота;
XXXVII) (5-бензилокси-3'-хлорбифенил-3-ил)уксусная кислота;
XXXVIII) (5-бензилокси-3'-трифторметоксибифенил-3-ил)уксусная кислота;
XXXIX) 2-{5-[4-(пирролидин-1-сульфонил)бензилокси]-4'-трифторметилбифенил-3-ил}пентановая кислота;
XL) 2-(5-циклопропилметокси-4'-трифторметилбифенил-3-ил)пентановая кислота;
XLI) [5-(4-хлорбензилокси)-4'-трифторметилбифенил-3-ил]уксусная кислота;
XLII) (5-циклопропилметокси-4'-трифторметилбифенил-3-ил)уксусная кислота;
XLIII) [5-(5-метилизоксазол-3-илметокси)-4'-трифторметилбифенил-3-ил]уксусная кислота;
XLIV) [5-(3,5-дихлорбензилокси)-4'-трифторметилбифенил-3-ил]уксусная кислота;
XLV) [5-(тетрагидропиран-4-илметокси)-4'-трифторметилбифенил-3-ил]уксусная кислота;
XLVI) [5-(4-диметилсульфамоилбензилокси)-4'-трифторметилбифенил-3-ил]уксусная кислота;
XLVII) [5-(1-фенилэтокси)-4'-трифторметилбифенил-3-ил]уксусная кислота;
XLVIII) {5-[4-(морфолин-4-карбонил)бензилокси]-4'-трифторметилбифенил-3-ил}уксусная кислота;
XLIX) [4'-трифторметил-5-(3-трифторметилбензилокси)бифенил-3-ил]уксусная кислота;
L) [4'-трифторметил-5-(2-трифторметилбензилокси)бифенил-3-ил]уксусная кислота;
LI) (5-фенэтилокси-4'-трифторметилбифенил-3-ил)уксусная кислота;
LII) [5-(тетрагидропиран-2-илметокси)-4'-трифторметилбифенил-3-ил]уксусная кислота;
LIII) [5-(4-диметилкарбамоилбензилокси)-4'-трифторметилбифенил-3-ил]уксусная кислота;
LIV) [5-(4-метилкарбамоилбензилокси)-4'-трифторметилбифенил-3-ил]уксусная кислота;
LV) {5-[4-(пирролидин-1-карбонил)бензилокси]-4'-трифторметилбифенил-3-ил}уксусная кислота;
LVI) {5-[4-(морфолин-4-сульфонил)бензилокси]-4'-трифторметилбифенил-3-ил}уксусная кислота;
LVII) [5-(4-трифторметоксибензилокси)-4'-трифторметилбифенил-3-ил]уксусная кислота;
LVIII) [5-(2-хлорбензилокси)-4'-трифторметилбифенил-3-ил]уксусная кислота;
LIX) [5-(3-хлорбензилокси)-4'-трифторметилбифенил-3-ил]уксусная кислота;
LX) [5-(4-метилбензилокси)-4'-трифторметилбифенил-3-ил]уксусная кислота;
LXI) 2-(5-бензилокси-4'-трифторметилбифенил-3-ил)-пент-4-еновая кислота;
LXII) (R)-2-(5-циклопропилметокси-4'-трифторметилбифенил-3-ил)пентановая кислота;
LXIII) (S)-2-(5-циклопропилметокси-4'-трифторметилбифенил-3-ил)пентановая кислота;
LXIV) (R)-2-(5-бензилокси-4'-трифторметилбифенил-3-ил)пентановая кислота;
LXV) (S)-2-(5-бензилокси-4'-трифторметилбифенил-3-ил)пентановая кислота;
и/или их фармацевтически приемлемых солей или сложных эфиров.
5. Соединение по любому из пп.1-4 для применения в качестве лекарственного средства.
6. Применение соединения по любому из пп.1-4 для получения лекарственного средства для модулирования g-секретазы.
7. Применение соединения по любому из пп.1-4 для получения лекарственного средства для лечения болезни, связанной с повышенным уровнем образования Аb42.
8. Применение соединения по любому из пп.1-4 для получения лекарственного средства для лечения болезни Альцгеймера.
9. Фармацевтическая композиция, включающая соединение по любому из пп.1-4 в смеси с инертным носителем.
10. Способ получения соединения по любому из пп.1-4, который включает стадии соединения необязательно защищенного фенильного производного уксусной кислоты с подходящим ароматическим соединением и, при необходимости, последующей функционализации и снятия защиты полученного таким образом бифенильного соединения.
11. Способ по п.10, дополнительно включающий стадию реакции бифенильного соединения с подходящим галогенидом или дигалогенидом до получения соединения по п.1, где по крайней мере один из R1, R2 является отличным от Н.
12. Способ получения фармацевтической композиции, включающий стадии:
a) получения соединения по п.1 и
b) приготовления фармацевтической композиции, содержащей указанное соединение.
13. Способ модулирования g-секретазы у млекопитающего, отличающийся тем, что указанному млекопитающему вводят соединение по любому из пп.1-4.
14. Способ лечения болезни, связанной с повышенным уровнем образования Аb42, у млекопитающего, отличающийся тем, что указанному млекопитающему вводят соединение по любому из пп.1-4.
15. Способ лечения болезни Альцгеймера у млекопитающего, отличающийся тем, что указанному млекопитающему вводят соединение по любому из пп.1-4.
Текст
012417 Настоящее изобретение относится к соединениям общей формулы (I) с данными ниже определениями А, X, R1-R6 и/или их солям или сложным эфирам. Кроме того, изобретение относится к применению упомянутых соединений для лечения болезни Альцгеймера, а также к их применению для модулирования активности -секретазы. Болезнь Альцгеймера является наиболее распространенной формой нейродегенеративного заболевания. Она в первую очередь, но не исключительно, связана со старением и клинически проявляется не только в виде прогрессирующей потери памяти, познавательных способностей, логического мышления и здравого смысла, но и в виде эмоциональной нестабильности и постепенно ведет к глубокой умственной деградации и смерти. Определяющими патологическими признаками болезни Альцгеймера являются наличие нейрофибриллярных клубков и амилоидных бляшек в мозге, которые, как считается, играют главную роль в патогенезе этого заболевания. Эти бляшки в основном состоят из пептидов, образованных в результате расщепления амилоидного белка-предшественника (АРР). белка из 695 аминокислот, функция которого до сих пор является лишь предметом различных гипотез. АРР обрабатывают в две стадии; первая стадия (катализ -секретазой) вызывает образование секретируемого и мембраносвязанного С 99-фрагмента. С 99 является субстратом для второй протеолитической активности посредством -секретазы, которая приводит, например, к образованию пептидов, содержащих от 37 до 42 остатков. Количество более длинной изоформы, А 42, селективно увеличивается у пациентов, имеющих определенные мутации в определенном белке (пресенилине); была установлена связь этих мутаций с ранним началом наследственной болезни Альцгеймера. Поэтому считается, что А 42 является главным виновником патогенеза болезни Альцгеймера. Стало ясно, что активность -секретазы нельзя приписывать одному определенному белку и что она связана с совокупностью различных белков, включающих Aphl, никастрин, пресенилин и Pen-2 (как описано в De Strooper (2003) Neuron 38, 9). Итак, хотя молекулярный механизм 2-й стадии расщепления до сих пор остается неясным, комплекс -секретазы стал одной из важнейших мишеней в поиске соединений для лечения болезни Альцгеймера. Другие подсказки при поиске новых способов лечения были получены из эпидемиологических исследований, например, вывод о том, что прием определенных нестероидных противовоспалительных препаратов (НПВП), похоже, связан с уменьшением риска развития болезни Альцгеймера (Akiyama et alNeurobiol. Aging 19, 607). Действительно, такой вывод недавно подтвердили биохимические исследования, в которых было продемонстрировано воздействие некоторых НПВП на -секретазу (Weggen et al (2001) Nature 414, 6860,212; Morihara et al (2002) J. Neurochem. 4,1009; Eriksen (2003) J. Clin. Invest. 112,440). Дальнейшее получение соединений, демонстрирующих аналогичное воздействие, до сих пор тормозилось нехваткой понимания молекулярного механизма описанных воздействий. Таким образом, имеется острая необходимость в новых соединениях, которые бы модулировали активность -секретазы, открывая тем самым новые перспективы в лечении болезни Альцгеймера. Целью настоящего изобретения является получение таких соединений. Цель достигается применением соединения общей формулы (I)X представляет собой линейную С 1-С 4-алкиленовую группу, необязательно замещенную одним или более заместителем из группы F, Cl, Br, I, и С 1-С 4-алкильные группы, необязательно замещенные одним или более F, Cl, Br, F;R1, R2 независимо друг от друга выбраны из группы, состоящей из Н; алкила, выбранного из группы СН 3, С 2 Н 5, изо-С 3 Н 7, н-C3H7, изо-С 4 Н 9, н-C4H9, втор-C4H9, трет-С 4 Н 9; алкенила, выбранного из С 2 Н 3, изоС 3 Н 5, н-C3H5, н-C4H7, изо-С 4 Н 7, втор-C4H7; или R1 и R2, являются частью насыщенного или ненасыщенного кольца, имеющего от 3 до 6 С-атомов, которое может содержать один или более гетероатомов из-1 012417 группы N, S или О, и в котором гетероатомы могут быть одинаковыми или различными в случае, если присутствует более одного гетероатома;R3, R4, R5 и R6 независимо друг от друга выбраны из группы, состоящей из Н; F; Cl; Br; I; CN; ОН;N(R8R8a); SR7; N(R7R8); N(R7)C(O)R8; N(R7)C(O)N(R8R8a); N(R7)C(O)OR8; OC(O)N(R7R,S); C(O)R7; замещенного или незамещенного С 1-С 4-алкила и замещенного и незамещенного С 1-С 4-алкокси, где заместители обеих групп С 1-С 4-алкил и С 1-С 4-алкокси выбраны из F, Cl, Br, I, CF3;R7, R8, R8a независимо друг от друга выбраны из группы, состоящей из Н; C1-C4-алкила; гетероциклила; и С 3-7-циклоалкила, где С 1-С 4-алкил; гетероциклил; и С 3-7-циклоалкил необязательно замещены одним или более заместителем, независимо выбранным из группы, состоящей из F, Cl, Br, I и CF3; и/или их соли или сложные эфиры. Применительно к данному случаю термин "замещенный" включает как частичное, так и полное замещение. Заместители могут быть как насыщенными, так и ненасыщенными. Сложными эфирами являются эфиры формуле (I), где Н карбоксильной группы замещается органическим остатком R7a. Специалисту в данной области известны подходящие органические остатки. Предпочтительные R7a включают: незамещенный или, по крайней мере, монозамещенный алкил, предпочтительно C1-С 10-алкил, алкенил, предпочтительно С 2-С 10-алкенил, алкинил, предпочтительно С 3-С 10-алкинил, и незамещенное или,по крайней мере, монозамещенное, насыщенное или ненасыщенное, ароматическое или неароматическое кольцо, имеющее от 3 до 6 С-атомов, которое может содержать один или более гетероатомов из группыN, S или О, и в котором гетероатомы могут быть одинаковыми или различными в случае, если присутствует более одного гетероатома. Указанные заместители выбираются из группы, состоящей из галогена,алкила, алкенила, алкинила, N, S, О, карбоксила, сульфонила и тому подобных, которые могут затем замещаться. Примеры обычных ароматических групп включают арильные группы, например, фенильные группы, и гетероарильные группы, которые могут быть замещены, предпочтительно приводимыми ниже заместителями. Термин "С 1-С 4-алкил" относится к метилу, этилу, н-пропилу, изопропилу, н-бутилу, изобутилу и трет-бутилу."С 3-7-циклоалкил" или С 3-7-циклоалкильное кольцо" означает циклоалкильную цепь, имеющую от 3 до 7 атомов углерода, например, циклопропил, циклобутил, циклопентил, циклогексил, циклогексенил,циклогептил. Каждый водород циклоалкильного углерода может быть замещен заместителем."Гетероциклил" или "гетероцикл" означает циклопентановое, циклогексановое или циклогептановое кольцо, которое может содержать вплоть до максимального количества двойных связей (ароматическое или неароматическое кольцо, полностью насыщенное, частично насыщенное или ненасыщенное), в котором, по крайней мере от одного атома углерода до 4 атомов углерода замещаются гетероатомом,выбранным из группы, состоящей из серы (включая-S(O)-,-S(O)2-), кислорода или азота (включая =N(O, и в котором кольцо связано с остальной молекулой посредством атома углерода или азота. Примеры гетероцикла включают, не ограничиваясь, фуран, тиофен, пиррол, пирролин, имидазол, имидазолин, пиразол, пиразолин, оксазол, оксазолин, изоксазол, изоксазолин, тиазол, тиазолин, изотиазол, изотиазолин,тиадиазол, тиадиазолин, тетрагидрофирран, тетрагидротиофен, пирролидин, имидазолидин, пиразолидин, оксазолидин, изоксазолидин, тиазолидин, изотиазолидин, тиадиазолидин, сульфолан, пиран, дигидропиран, тетрагидропиран, имидазолидин, пиридин, пиридазин, пиразин, пиримидин, пиперазин, пиперидин, морфолин, тетразол, триазол, триазолидин, тетразолидин, азепин или гомопиперазин. "Гетероцикл" также означает азетидин. В предпочтительных формах реализации изобретение относится к соединению общей формулы (I),где А; X; R1 и R2; и R3, R4, R5 и R6 независимо друг от друга имеют следующие значения: А представляет собой фенил; циклопропил; циклогексил; или 6-членный ароматический гетероцикл;X представляет собой группу СН 2, необязательно замещенную одним или более заместителем из группы F, Cl, Br, I, и С 1-С 4-алкильные группы, необязательно замещенные одним или более F, Cl, Br, I; и/илиR3, R4, R5 и R6 независимо друг от друга выбраны из группы, состоящей из Н; ОН; С 1-С 4-алкил или С 1-С 4-алкокси, частично или полностью замещенных F, Cl, Br, I; C(O)NH2, S(О)2-С 1-С 4-алкилом, S(O)2 гетероциклилом; и/или их соли или сложные эфиры; В данной группе форм реализации еще более предпочтительно, если все группы А; X; R1 и R2; и R3,R4, R5 и R6 имеют вышеприведенные значения. Более предпочтительно, если А; X; R1 и R2; и R3, R4, R5 и R6 независимо друг от друга имеют следующие значения:X представляет собой СН 2 или СНСН 3; и/илиR3, R4, R5 и R6 независимо выбираются из группы Н, ОН, СН 3, ОСН 3, CF3,OCF3, C(O)NH2, S(О)2-С 1-С 4-алкил, S(О)2-гетероциклил, F, и Cl; и/или их соли или сложные эфиры. В этой группе форм реализации еще более предпочтительно, чтобы все группы А; X; R1 и R2; и R3,R4, R5 и R6 имели вышеприведенные значения. В еще более предпочтительной форме реализации изобретение относится к соединениям, выбранным из группы, включающей:LXV) (S)-2-(5-бензилокси-4'-трифторметилбифенил-3-ил)пентановая кислота; и/или их соли или сложные эфиры. Некоторые из соединений, описываемых в изобретении, и/или их соли и сложные эфиры будут существовать в различных стереоизомерических формах. Все эти формы являются предметом настоящего изобретения. Ниже описаны примеры солей соединений согласно изобретению. Список различных приводимых ниже солей не является полным или ограничивающим. Соединения согласно изобретению, содержащие одну или более кислотную группу, могут использоваться согласно изобретению, например, в виде их солей щелочных металлов, солей щелочноземельных металлов или солей аммония. Более точные примеры таких солей включают натриевые соли,калийные соли, соли кальция, соли магния или соли аммония или органические амины, такие как, например, этиламин, этаноламин, триэтаноламин или аминокислоты. Соединения согласно изобретению, содержащие одну или более основных групп, то есть групп, которые можно протонировать, в соответствии с изобретением могут использоваться в форме их солей с неорганическими или органическими кислотами. Примеры подходящих кислот включают хлороводород, бромводород, фосфорную кислоту, серную кислоту, азотную кислоту, метансульфоновую кислоту, р-толуолсульфокислоту, нафталиндисульфоновую кислоту, щавелевую кислоту, уксусную кислоту, винную кислоту, молочную кислоту, салициловую кислоту, бензойную кислоту, муравьиную кислоту, пропионовую кислоту, пивалиновую кислоту, диэтилуксусную кислоту, малоновую кислоту, янтарную кислоту, пимелиновую кислоту, фумаровую кислоту,малеиновую кислоту, яблочную кислоту, сульфаминовую кислоту, фенилпропионовую кислоту, глюконовую кислоту, аскорбиновую кислоту, изоникотиновую кислоту, лимонную кислоту, адипиновую кислоту и другие кислоты, известные специалисту в данной области. Термин "фармацевтически приемлемый" означает одобренный управляющим органом, таким как ЕМЕА (Европа) и/или PDA (США) и/или любым другим национальным управляющим органом по использованию применительно к животным, предпочтительно к людям. Предлагаемые в изобретении соединения, содержащие несколько основных групп, могут одновременно образовывать разные соли. Если предлагаемое в изобретении соединение одновременно содержит в молекуле кислотную и основную группы, кроме указанных форм солей, изобретение также включает внутренние соли и бетаины. Соответствующие соли соединений согласно изобретению можно получать обычными методами,известными специалистам в данной области, например, путем взаимодействия соединения с органической или неорганической кислотой или основанием в растворе или диспергаторе или посредством анионного или катионного обмена с другими солями. Кроме того, изобретение включает все соли соединений согласно изобретению, которые, ввиду низкой физиологической совместимости, не подходят для прямого использования в фармацевтических препаратах, но которые могут использоваться, например, как промежуточные соединения для химических реакций или для получения фармацевтически приемлемых солей, или которые могут подходить для изучения любым подходящим образом, например исследованием in vitro, способности соединения согласно изобретению к модулированию активности -секретазы. Изобретение также включает все сольваты соединений согласно изобретению. Настоящее изобретение включает далее производные/пролекарства (включая их соли) соединений согласно изобретению, которые содержат физиологически допустимые группы и группы расщепления и которые при обмене веществ превращаются у животных, предпочтительно млекопитающих, еще предпочтительней у человека, в соединение согласно изобретению. Кроме того, настоящее изобретение включает метаболиты соединений согласно изобретению. Термин "метаболиты" относится ко всем молекулам, полученным из любого соединения согласно изобретению, в клетке или организме, предпочтительно млекопитающих.-4 012417 Термин "метаболиты" предпочтительно относится к молекулам, которые отличаются от любой молекулы, присутствующей в любой такой клетке или организме в физиологических условиях. Структура метаболитов соединений согласно изобретению будет очевидна любому специалисту в данной области, использующему различные подходящие методы. Соединения общей формулы (I) могут быть получены любым способом, опубликованным в литературе, или аналогичными способами. Методы синтеза соединений описаны, например, в Houben-Weyl, Methoden der Organischen ChemieYork. В зависимости от обстоятельств каждого конкретного случая и во избежание побочных реакций во время синтеза соединения общей формулы (I) может быть необходимо или желательно временно заблокировать функциональные группы посредством введения защитных групп и снять с них защиту на более поздней стадии синтеза или ввести функциональные группы в форме групп-предшественников и на более поздней стадии преобразовать их в желаемые функциональные группы. Специалистам в данной области известны подходящие стратегии синтеза, защитные группы и группы-предшественники. При желании, соединения формулы (I) можно очистить посредством обычных методов очистки, например, посредством рекристаллизации или хроматографии. Исходные материалы для получения соединений формулы (I) имеются в продаже или могут быть получены в соответствии с методами или аналогично методам, описанными в литературе. Они могут служить основой для получения других соединений согласно изобретению несколькими способами, хорошо известными специалистам в данной области. В частности, предлагаемые изобретения подходят для лечения болезни Альцгеймера. Ниже раскрываются детали, относящиеся к указанному применению. Данные соединения могут использоваться для модулирования активности -секретазы. Применительно к данному тексту термин "модулирование активности -секретазы" относится к воздействию на обработку АРР комплексом -секретазы. Предпочтительно он относится к воздействию,при котором общая скорость обработки АРР остается в основном аналогичной скорости в отсутствие данных соединений, но при котором относительные количества обрабатываемого продукта изменяются,предпочтительно таким образом, что количество образующегося А 42-пептида уменьшается. Ранее было показано, что комплекс -секретазы также участвует в обработке Notch-белка. Notch является сигнальным белком, играющим ключевую роль в процессах развития (Обзор в Schweisguth F(2004) Curr. Biol. 14, R129). Относительно применения указанных соединений для модулирования активности -секретазы при лечении представляется особо благоприятным не препятствовать активности -секретазы, связанной с обработкой Notch во избежание предполагаемых нежелательных побочных эффектов. Таким образом, предпочтительны соединения, не оказывающие воздействия на активность секретазы, связанную с обработкой Notch. Применительно к данному изобретению "воздействие на активность, связанную с обработкойNotch" включает как замедление, так и стимулирование активности, связанной с обработкой Notch, определенным фактором. Считается, что соединение не влияет на активность, связанную с обработкой Notch, если указанный фактор составляет менее 20, предпочтительней менее 10, еще предпочтительней менее 5 и наиболее предпочтительно - менее 2 при соответствующем исследовании, как описано в Shimizu et al (2000) Mol.Cell. Biol, 20: 6913 at a concentration of 30 M. Такое модулирование -секретазы может выполняться, например, у животных, таких как млекопитающие. Примерами млекопитающих являются мыши, крысы, морские свинки, обезьяны, собаки, коты. Модулирование может также выполняться у людей. В частной форме реализации изобретения указанное модулирование выполняется in vitro или в клеточной культуре. Как известно специалистам в данной области, существует несколько исследований in vitro и в клеточной культуре. Пример такого исследования описан в WO-03/008635. Концентрации различных продуктов расщепления -секретазы (А-пептидов) можно определять различными методами, известными специалистам в данной области. Примеры таких методов включают определение пептидов масс-спектрометрией или обнаружение антител. Подходящие антитела от The Genetics Company, Inc. (Швейцария) имеются в продаже. Дальнейшая информация раскрывается, например, в N. Ida et al. (1996) J. Biol. Chem. 271, 22908, и М. Jensen et al. (2000) Mol.Med. 6, 291. Наборы на основе антител также производятся Innogenetics (Бельгия). Клетки, которые могут применяться в таких исследования, включают клетки, которые физиологически экспрессируют комплекс -секретазы, и клетки, которые случайно или постоянно экспрессируют-5 012417 некоторые или все белки, взаимодействующие с комплексом -секретазы. Специалистам в данной области известны многочисленные клеточные линии, подходящие для таких исследований. Особенно подходят клетки и клеточные линии нейронного или глиального происхождения. Кроме того, могут использоваться клетки и ткани мозга, а также их гомогенаты и мембранные препараты. Такие исследования могут выполняться, например для изучения эффективности соединений согласно изобретению, в различных экспериментальных условиях и конфигурациях. Кроме того, такие исследования могут выполняться как часть функциональных исследований комплекса -секретазы. Например, один или более белков, взаимодействующих с комплексом у-секретазы животного (либо в форме их дикого типа, либо имеющих определенные мутации и/или модификации), предпочтительно млекопитающего, еще предпочтительней человека, могут экспрессироваться в определенных клеточных линиях и может изучаться эффективность соединений согласно изобретению. Мутированные формы белков, взаимодействующих с комплексом -секретазы, могут быть либо мутированными формами, описанными у некоторых животных, предпочтительно у млекопитающих, еще предпочтительней у человека, либо мутированными формами, которые не были ранее описаны у указанных животных. Модификации белков, взаимодействующих с комплексом -секретазы, включают как любую физиологическую модификацию указанных белков, так и другие модификации, описанные как модификации белков в биологической системе. Примеры таких модификаций включают, но не ограничиваются ими, гликозилирование, фосфорилирование, пренилирование, миристилирование и фарнезилирование. Кроме того, соединения согласно изобретению могут использоваться для получения лекарства для модулирования активности -секретазы. Изобретение также относится к использованию указанных соединений для получения лекарства для модулирования активности -секретазы. Активность -секретазы может модулироваться разными способами, т.е., приводить к разным профилям различных А-пептидов. Предпочтительны применения соединения для модулирования активности -секретазы, приводящие к уменьшению относительного количества образуемого А-пептитда. Ниже раскрываются соответствующие дозы, способы применения, составы и т.д. Изобретение далее относится к применению соединений согласно изобретению для лечения заболевания, связанного с повышенным уровнем образования А 42. Применительно к данному случаю "лечение" относится ко всем процессам, при которых может наблюдаться замедление, прерывание, задержка или прекращение развития болезни, но не обязательно наступать полное устранение всех симптомов. Применительно к данному случаю термин "повышенный уровень образования А 42" относится к состоянию, при котором уровень образования А 42-пептида увеличен вследствие общего увеличения обработки АРР или, предпочтительно, к состоянию, при котором образование А 42-пептида увеличено вследствие модификации профиля обработки АРР в сравнении с диким типом/состоянием отсутствия патологии. Как указано выше, такой повышенный уровень А 42 является признаком пациентов, у которых развивается или которые страдают от болезни Альцгеймера. Кроме того, изобретение относится к составу, включающему предлагаемое соединение в смеси с инертным носителем. В предпочтительной форме реализации изобретение относится к составу, включающему предлагаемое соединение в смеси с инертным носителем, где инертный носитель является фармацевтическим носителем. Термин "носитель" относится к разбавителям, адъювантам, инертным наполнителям или связующим веществам, с которыми соединение назначается для приема. Такие фармацевтические носители могут быть стерильными жидкостями, например, водой или маслами, в том числе маслами нефтяного, животного, растительного или синтетического происхождения, включая, но не ограничивая, арахисовое масло, соевое масло, минеральное масло, кунжутное масло и тому подобные. Вода предпочтительна в качестве носителя в фармацевтических композициях для перорального применения. Физиологический раствор или водный раствор декстрозы предпочтительны в случае внутривенного введения фармацевтической композиции. Физиологические растворы, водный раствор декстрозы или глицериновые растворы предпочтительно используются в качестве жидкого носителя для инъекционных растворов. Подходящие фармацевтические наполнители включают крахмал, глюкозу, лактозу, сахарозу, желатин, солод, рис,муку, мел, силикагель, стеариновокислый натрий, глицеролмоностеарат, тальк, хлористый натрий, сухое обезжиренное молоко, глицерин, пропилен, гликоль, воду, этанол и т.д. При необходимости, композиция может также содержать небольшие количества увлажняющих или эмульгирующих агентов или а рН-6 012417 буферных агентов. Эти композиции могут иметь форму растворов, суспензий, таблеток, пилюль, капсул,порошков, составов замедленного высвобождения и т.д. Композиции могут иметь форму суппозитория с традиционными связывающими веществами и носителями, такими как триглицериды. Пероральные составы могут включать стандартные носители, такие как фармацевтического качества маннитол, лактоза,крахмал, стеарат магния, сахарин натрия, целлюлоза, карбонат натрия и т.д. Примеры подходящих фармацевтических носителей описаны в "Remington's Pharmaceutical Sciences" Е.В. Мартина (E.W. Martin). Такие композиции будут содержать терапевтически эффективное количество соединения, предпочтительно в очищенной форме, вместе с подходящим количеством носителя для обеспечения нужной формы приема пациентом. Составы должны соответствовать форме приема. Кроме того, изобретение относится к способу получения соединения согласно изобретению, который включает стадии соединения, необязательного защищенного фенильного производного уксусной кислоты с подходящим ароматическим соединением и, при необходимости, последующей функционализации и снятия защиты полученного таким образом бифенильного соединения. В одной из форм реализации производное дигидроксифенилуксусной кислоты может быть алкилировано галидом бензила, обычно бромистым бензилом, используя неорганическое основание, такое как карбонат щелочного металла, обычно карбонат калия в подходящем растворителе, таком как ацетонитрил. Полученный в результате спирт может быть преобразован в трифлат, используя, например, трифторметансульфоангидрид, органическое основание, такое как пиридин, и в подходящем растворителе,таком как дихлорметан. Этот трифлат может быть затем соединен с бороновой кислотой при разнообразных условиях, известных специалистам в данной области, для проведения реакции Сузуки, обычно используя такой растворитель, как 1,2-диметоксиэтан, галид щелочного металла, такой как фторид цезия, и соединение палладия, такое как тетракис(трифенилфосфин)палладий(0). Необязательно способ получения соединения согласно изобретению также может включать стадию реакции бифенильного соединения с подходящим галидом или дигалидом, результатом которой является соединение согласно изобретению, где по крайне мере R1 или R2 является отличным от Н. Преобразование сложного эфира в кислоту может происходить с использованием основания, такого как гидроксид щелочного металла, обычно гидроксид лития, в присутствии воды или других подходящих растворителей, таких как тетрагидрофуран или метанол. В другой форме реализации для получения соединения согласно изобретению дибромфторбензол может обрабатываться бензиловым спиртом в присутствии гидрида щелочного металла, обычно гидрида натрия, в подходящем апротонном растворителе, таком как тетрагидрофуран. Продукт обрабатывают подходящим производным малоновой кислоты, таким как смешанный сложный эфир малоновой кислоты и трет-бутила и этанола в присутствии гидрида щелочного металла, обычно гидрида натрия, и галида металла, обычно галида меди, предпочтительно бромида меди. Дальнейшая обработка в кислотном растворителе, таком как уксусная кислота, при повышенной температуре, дает сложный эфир бензилоксибромфенилуксусной кислоты. Он может быть связан с бороновой кислотой при различных условиях, известных специалистам в данной области для реакции Сузуки, обычно используя такие растворители как 1,2-диметоксиэтан и вода, карбонат щелочного металла, такой как карбонат калия, и папладиевое соединение, такое как тетракис(трифенилфосфин)палладиум(0). Преобразование сложного эфира в кислоту может проводиться с использованием основания, такого как гидроксид щелочного металла, обычно гидроксид лития в присутствии воды или других подходящих растворителей, таких как тетрагидрофуран и метанол. При необходимости, бифенильная карбоновая кислота может быть алкилирована обработкой в подходящем апротонном растворителе, таком как тетрагидрофуран с подходящим основанием, таким как гексаметилдисилазид металла, обычно LiHMDS, и подходящим галидом при подходящей температуре,обычно-15 С. В другой форме реализации такая группа может быть введена обработкой сложного эфира в подходящем растворителе, таком как DMF, с подходящим основанием, таким как гидрид щелочного металла,обычно гидрид натрия при подходящей температуре, такой как-4 С, и с подходящим галидом. Преобразование сложного эфира в кислоту может проводиться с использованием основания, такого как гидроксид щелочного металла, обычно гидроксид лития в присутствии воды и других подходящих растворителей, таких как тетрагидрофуран или метанол. Кроме того, настоящее изобретение относится к способу получения лекарственного средства,включающему стадии:a) получения соединения согласно изобретению,b) приготовления лекарственного средства, содержащего указанное соединение. Соединения согласно изобретению и их фармацевтически приемлемые соли, при необходимости, в сочетании с другими фармацевтически активными соединениями, пригодными для лечения или предотвращения болезни Альцгеймера, такими как Aricept (Eisai), Donepezil (Pfizer), Cognex (Warner-Lambert),Tacrine (Warner-Lambert), Axura (Merz), Memantine (Merz), или с другими лекарственными средствами,пригодными для лечения болезни Альцгеймера, известными специалисту в данной области, могут вво-7 012417 диться животным, предпочтительно млекопитающим, еще предпочтительней человеку, в виде самостоятельных лекарственных препаратов, в смеси друг с другом или в виде фармацевтических препаративных форм. Известны и могут использоваться различные системы доставки для приема предлагаемого в изобретении вещества для лечение болезни Альцгеймера/модулирования активности -секретазы, например,инкапсуляция в липосомах, микрочастицы и микрокапсулы. Если не возможна доставка непосредственно в центральную нервную систему, предпочтительно в мозг, желательно выбрать и/или модифицировать методы введения таким образом, чтобы дать фармацевтическому соединению возможность пересечь гематоэнцефалический барьер. Методы введения включают, но не ограничиваются, интрадермальный, внутримышечный, интраперитокеальный, внутривенный, подкожный, интраназальный, эпидуральный и оральный. Соединения могут вводиться любым обычным способом, например, внутривенным вливанием, в виде болюса, абсорбцией через эпителиальную или кожно-слизистую выстилку, а также вместе с другими биологически активными агентами. Применение может быть системным или местным. Кроме того, может быть желательным введение фармацевтических композиций согласно изобретению в центральную нервную систему любым подходящим способом, включая интравентрикулярное и интратекальное впрыскивание; интравентрикулярное впрыскивание можно облегчать при помощи интравентрикулярного катетера, например, присоединенного к резервуару, такому как резервуар Омайя. Может также применяться пульмональное введение, например, с использованием ингалятора или распылителя или составы с аэрозольным агентом. В другой форме реализации соединение может доставляться в везикулу, в частности, липосому(Langer (1990) Science 249, 1527; Treat et al. (1989) Liposomes in the Therapy of Infectious Disease and Cancer, Lopez-Berestein and Fidler, eds., Liss, New York, 353; Lopez-Berestein, ibid., 317). В еще одной форме реализации соединение может доставляться посредством контролируемой системы высвобождения. В одной из форм реализации может использоваться насос (Sefton (1987) CRC Grit.Ref. Biomed. Eng. 14, 201; Buchwald et al. (1980) Surgery 88, 507; Saudek et al. (1989) N. Engl. J. Med. 321,574). В еще одной форме реализации могут использоваться полимерные материалы (Medical Applicationset al. (1989) Ann. Neurol. 25, 351; Howard et al. (1989) J. Neurosurg. 71, 858). Еще в одной форме реализации контролируемая система высвобождения может помещаться вблизи терапевтической мишени, т.е. мозга, таким образом требуя лишь долю системной дозы (e.g. Goodson,1984, In: Medical Applications of Controlled Release, supra, Vol. 2, 115). Другие системы контролируемого высвобождения обсуждаются в Langer (1990, Science 249, 1527). С целью выбора подходящего способа введения специалист в данной области рассмотрит также способы применения, которые применялись для других известных лекарств против болезни Альцгеймера. Например, Aricept/Donepezil и Cognex/Tacrine (все- ингибиторы ацетилхолинэстеразы) принимаются перорально, Axura/Memantine (антагонист NMDA-рецептора) выпускается как в виде таблеток/жидкости, так и в виде раствора для внутривенного применения. Кроме того, специалист в данной области учтет все имеющиеся данные относительно способов приема лекарств семейства НСПВ, полученные в результате клинических испытаний и в других исследованиях, изучая их воздействие на болезнь Альцгеймера. При выборе дозы специалист в данной области выберет такую дозу, которая, как показали доклинические и/или клинические исследования, не является токсичной и которая соответствует вышеприведенным величинам или которая может отклоняться от этих величин. Точная дозировка для использования в препаративной форме будет также зависеть от способа введения, серьезности заболевания или расстройства и будет определяться врачом и обстоятельствами болезни конкретного пациента. Однако допустимые пределы для внутривенного введения составляют обычно от 20 до 500 мкг активного вещества на килограмм веса тела. Подходящие пределы доз для интраназального применения составляют обычно от около 0,01 мг на кг веса тела до 1 мг на кг веса. Эффективные дозы могут быть экстралолированы от кривых зависимости "доза-эффект" или тестовых систем животных моделей. Типичной животной моделью является штамм трансгенной мыши "Tg2576", содержащий АРР 695 форму с двойной мутацией KM670/671NL. Для справки см. патент US5877399 и Hsiao et al. (1996) Science 274, 99, а также Kawarabayahsi T (2001) J. Neurosci. 21, 372; Frautschy et al. (1998) Am. J. Pathol. 152,307; Irizarry et al. (1997) J. Neuropathol. Exp. Neurol. 56., 965; Lehman et al. (2003) Neurobiol. Aging 24, 645. Специалистам в данной области доступно значительное количество данных из различных исследований, содержащих информацию, позволяющую выбрать подходящие дозировки для необходимых терапевтических схем. Опубликовано большое количество исследований, в которых описывается воздействие молекул на-8 012417 активность -секретазы. Примерами таких исследований могут служить Lim et al. (2001) Neurobiol. Aging 22, 983; Lim et al. (2000) J Neurosci. 20, 5709; Weggen et al. (2001) Nature 414, 212; Eriksen et al. (2003) JClin Invest. 112, 440; Yan et al. (2003) J Neurosci. 23, 7504; Общая информация Все реакции проводились в инертной атмосфере. Спектры ЯМР были получены на Bruker dpx400.LCMS проводилась на Agilent 1100 с помощью ZORBAX SB-CI8, 4,6150 мм, 5-микронной колонкой для способов А и В и ZORBAX SB-CI8, 4,675 мм, 3,5-микронной колонкой для способа С. Скорость потока в колонке составляла 1 мл/мин, и в качестве растворителей использовалась вода и ацетонитрил(0,1% TFA) объемом инъекции 10 мкл. Длина волн составляла 254 и 210 нм. Способы описаны ниже:-9 012417 Примеры Пример 1. Получение [5-(4-фторбензилокси)-4'-трифторметилбифенил-3-ил]уксусной кислоты (I). Сложный метиловый эфир (3,5-дигидроксифенил)-уксусной кислоты (0,500 г, 2,75 ммоль) в MeCN(5 мл) обрабатывали K2CO3 (0,095 г, 6,88 ммоль) и 4-фторбензилбромидом (0,520 г, 2,75 ммоль). Полученную в результате смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь сразу же очищали посредством хроматографии на испарительной колонке (EtOAc: изогексан) с получением сложного метилового эфира [3-(4-фторбензилокси)-5-гидроксифенил]уксусной кислоты(0,15 г). Сложный метиловый эфир [3-(4-фторбензилокси)-5-гидроксифенил]уксусной кислоты (0,14 г) вDCM (5 мл) обрабатывали пиридином (116 мкл, 1,44 ммоль) и капельно добавляли трифторметансульфоангидрид (0,16 г, 0,58 ммоль). Смесь перемешивали в течение 3 ч при комнатной температуре. Смесь разбавили дополнительным количеством DCM, промыли раствором HCl (1 М водн.), высушили (MgSO4) и сконцентрировали под вакуумом до получения сложного метилового эфира [3-(4-фторбензилокси)-5 трифторметансульфонилоксифенил]-уксусной кислоты в виде оранжево-коричневого масла (0,16 г). Сложный метиловый эфир [3-(4-фторбензилокси)-5-трифторметансульфонилоксифенил]уксусной кислоты) соединяли в DME (4 мл) с CsF (0,13 г, 0,83 ммоль), 4-трифторметилбензилбороновой кислотой(0,086 г, 0,45 ммоль) и тетракис(трифенилфосфин)палладиумом(0) (0,013 г, 0,011 ммоль). Смесь нагревали до 90 С в течение 10 мин в микроволновой печи СЕМ. Смесь разбавляли EtOAc, промывали водой и раствором NaHCO3 (насыщ. водн.), высушивали (MgSO4) и сконцентрировали под вакуумом. Остаток очищали посредством хроматографии на испарительной колонке (EtOAc : изогексан) до получения сложного метилового эфир 5-(4-фторбензилокси)-4'-трифторметилбифенил-3-ил)уксусной кислоты(0,035 г) в виде белого твердого вещества. Сложный метиловый эфир 5-(4-фторбензилокси)-4'-трифторметилбифенил-3-ил]уксусной кислоты(0,035 г) в THF (2 мл) обрабатывали раствором LiOH (210 мкл, 1 М водн.) и несколькими каплями МеОН. Смесь перемешивали при комнатной температуре в течение 2 ч и затем разводили водой, подкисляли раствором HCl (2 М водн.) и экстрагировали при помощи EtOAc (3). Экстракты соединяли, высушивали(MgSO4) и концентрировали в вакууме. Сырой продукт очищали посредством препаративной ЖХВД с получением 5-(4-фторбензинокси)-4'-трифторметилбифенил-3-ил]уксусной кислоты в виде белого твердого вещества (0,012 г, 0,03 ммоль). 1 Н ЯМР (CDCl3)7,65 (q, 4 Н), 7,41 (q, 2 Н) 7,07 (m, 4 Н), 6,94 (s, 1H),5,06 (s, 2H), 3,68 (s, 2H); ЖХМС метод (А), 5,2 мин. Пример 2. Скринирование соединений согласно изобретению на предмет активности модулирования -секретазы. Скринирование выполнялось с использованием клеток SKN нейробластомы, несущих АРР"шведского мутанта" (точковые мутации в положениях 595 и 596, нумерация основана на АРР 695), выращенных в DMEM/NUT-mix F12 (НАМ) от Gibco (кат. No. 31330-38), содержащей 5% Serum/Fe с добавлением 1% заменимых аминокислот, 100 ед./мл Pen/Strep. Клетки выращивались почти до оптимальной плотности культуры. Скринирование выполнялось с использованием исследования, описанного в Citron et al (1997) Nature Medicine 3: 67.IС 50-значения выбранных соединений согласно изобретениию на активность -секретазы. Диапазоны активности: А =1 мкМ: В = 1-10 мкМ; С = 10-100 мкМ; D = 100-300 мкМ.- 11012417 Пример 3. Определение воздействия соединений согласно изобретению на циклооксигеназу-1 и циклооксигеназу-2 (Сох-1, Сох-2). Ингибирование Сох-1 и Сох-2 определялось при помощи тест-системы для скрининга ингибирования Colorimetric Сох от фирмы Cayman Chemical Company, Ann Arbor, MI, USA. (Cat. No. 760111), следуя инструкциям производителя. Следующие соединения демонстрируют ингибирование 50% при 100 мкМ:(II). Аналогичная описанной в примере 1 методика замещения 4-фторбензилбромида 4 изопропилбензилбромидом. 1 Н ЯМР (CDCl3)7,66 (m, 4H), 7,38 (d, 2 Н), 7,27 (d, 2 Н), 7,13 (s, 1H), 7,11 (s,1H), 6,97 (s, 1H), 5,07 (s, 2H), 3,70 (s, 2H), 2,93 (m, 1H), 1,26 (d, 6H); ЖХМС метод (A), RT = 5,0 мин. Пример 5. Получение [4'-трифторметил-5-(4-трифторметилбензилокси)бифенил-3-ил]уксусной кислоты (III). Аналогичная описанной в примере 1 методика замещения 4-фторбенизилбромида 4 трифторметилбензилбромидом. 1 Н ЯМР (CDCl3)7,60-7,70 (m, 6H), 7,56 (d, 2H), 7,12 (s, 1H), 7,11 (s, 1H),6,95 (s, 1H), 5,17 (s, 2H), 3,70 (s, 2 Н); ЖХМС метод (A), RT = 4,5 мин. Пример 6. Получение [5-(4-метансульфонилбензилокси)-4'-трифторметилбифенил-3-ил]уксусной кислоты (IV). Аналогичная описанной в примере 1 методика замещения 4-фторбензилбромида 1-бромметил-4 инэтансульфонилбензолом. 1 Н ЯМР (CDCl3)7,93 (d, 2H), 7,55-7,65 (m, 6 Н), 7,11 (s, 1H), 7,04 (s, 1H),6,93 (s, 1H), 5,17 (s, 2 Н), 3,60 (s, 2H), 3,03 (s, 3 Н); ЖХМС метод (А), (М-Н-) 462,9, RT = 3,9 мин. Пример 7. Получение (5-циклогексилметокси-4'-трифторметилбифенил-3-ил)уксусной кислоты (V). Аналогичная описанной в примере 1 методика замещения 4-фторбензилбромида бромметилциклогексаном. 1 Н ЯМР (CDCl3)7,67 (s, 4H), 7,07 (s, 1H). 7,03 (s, 1H), 6.86 (s, 1H), 3,78 (d, 2H), 3,69 (s, 2H),1,80-1,67 (m, 6H), 1,38-1,15 (m, 3 Н), 1,14-1,00 (m, 2 Н); ЖХМС метод (A), RT = 5,5 мин. Пример 8. Получение 5-[4-(пирролидин-1-сульфонил)бензилокси]-4'-трифторметилбифенил-3 илуксусной кислоты (VI). Аналогичная описанной в примере 1 методика замещения 4-фторбензилбромида 4-(пирролидин-1 сульфонил)бензилбромидом. 1 Н ЯМР (CDCl3)7,85 (d, 2 Н), 7,58-7,72 (m, 6 Н), 7,14 (s, 1 Н), 7,11 (s, 1H). 6,96 (s, 1H), 5,19 (s, 2H), 3,71 (s, 2H), 3.20-3.30 (m, 4H), 1,70-1.80 (m, 4H); ЖХСМ метод (A), RT = 4,2 мин. Пример 9. Получение (5-бензилоксибифенил-3-ил)уксусной кислоты (VII). Получение 1-бензилокси-3,5-дибромбензола. Бензиловый спирт (9,7 мл, 94 ммоль) капельно добавляли к суспензии NaH (4,0 г 60% суспензии в минеральном масле, 100 ммоль) в THF (150 мл) при комнатной температуре, и смесь перемешивали при комнатной температуре в течение 1 ч перед тем как добавить 1,3-дибром-5-фторбензол (15,9 г, 62,5 ммоль). Реакция протекала при перемешивании при комнатной температуре в течение 12 ч. Осторожно была добавлена вода, и THF выпаривали при пониженном давлении. Остаток экстрагировали при помощи изогексана (3), и объединенные органические экстракты промывали раствором NaOH (1M водн.),водой, рассолом, высушивали (MgSO4), отфильтровывали и концентрировали при пониженном давлении. Остаток очищали посредством хроматографии на испарительной колонке (EtOAc : петролейный эфир), в результате чего был получен 1-бензилокси-3,5-дибромбензол (14,7 г, 65 ммоль) в виде бесцветной жидкости с выходом 69%. 1 Н ЯМР (CDCl3)7,45-7,33 (m, 5H), 7,30-7,28 (m, 1H), 7,10-7,08 (m, 2H), 5,02 (s,2H). Получение сложного этилового эфира (3-бензилокси-5-бромфенил)уксусной кислоты.- 12012417 Смешанный сложный эфир малоновой кислоты и трет-бутила и этанола (10,2 мл, 53,8 ммоль) капельно добавляли к суспензии NaH (2,2 г 60% суспензии в минеральном масле, 53,8 ммоль) в диоксане(200 мл) при комнатной температуре, и смесь перемешивали при этой температуре в течение 1 ч перед тем как добавить CuBr (7,7 г, 53,8 ммоль) и 1-бензилокси-3,5-дипромбензол (9,2 г, 26,9 ммоль). Реакционную смесь нагревали в течение 5 ч до возникновения естественной циркуляции. Осторожно добавили раствор HCl (1 М водн., 100 мл), и смесь экстрагировали при помощи изогексана (3). Объединенные органические экстракты промывали раствором HCl (1 М водн.), водой, рассолом, высушивали (MgSO4), отфильтровывали и концентрировали при пониженном давлении. Остаток очищали посредством хроматографии на испарительной колонке (EtOAc: петролейный эфир) с получением посредством элюирования восстановленного 1-бензилокси-3,5-дибромбензола (3,2 г, 9,4 ммоль) с 35% выходом и смешанного сложного эфира 2-(3-бензилокси-5-бромфенил)-малоновой кислоты и трет-бутила и этанола (7,2 г, содержит 1,4 эквивалента смешанного сложного эфира малоновой кислоты и трет-бутила и этанола 10 ммоль) в виде бесцветной жидкости с выходом 37%. Смешанный сложный эфир 2-(3-бензилокси-5-бромфенил)-малоновой кислоты и трет-бутила и этанола (7,2 г, содержит 1,4 эквивалента смешанного сложного эфира малоновой кислоты и трет-бутила и этанола 10 ммоль) растворяли в ледяной АсОН (50 мл) и нагревали в течение 12 ч до возникновения естественной циркуляции. АсОН удаляли при пониженном давлении. Остаток сливали в раствор Na2 СО 3(нас. водн.), и смесь экстрагировали при помощи EtOAc (3). Объединенные органические экстракты промывали водой, рассолом, высушивали (MgSO4), отфильтровывали и концентрировали при пониженном давлении с образованием смешанного сложного эфира (3-бензилокси-5-бромфенил)малоновой кислоты и трет-бутила и этанола (6,8 г, 9,7 ммоль) в виде жидкости желтого цвета с выходом 97%. 1 Н ЯМР(t, 3H). Получение сложного этилового эфира (5-бензилоксибифенил-3-ил)-уксусной кислоты. Сложный этиловый эфир (3-бензилокси-5-бромфенил)-уксусной кислоты (0,250 г., 0,72 ммоль),бензолбороновая кислота (0,10 г, 0,86 ммоль) и тетракис(трифенилфосфин)палладиум(0) (0,04 г, 0,04 ммоль) были суспендированы в смеси раствора K2CO3 (0,72 мл, 1,44 ммоль, (2 М водн.) и DME (2 мл). Эту реакционную смесь облучали в микроволновой печи СЕМ при температуре 120 С в течение 30 мин. Реакционную смесь разбавляли водой и экстрагировали при помощи Et2O (3). Объединенные органические экстракты промывали водой, высушивали (MgSO4), отфильтровывали и концентрировали при пониженном давлении. Остаток очищали хроматографией на испарительной колонке (EtOAc : петролейный эфир) с получением сложного этилового эфира (5-бензилоксибифенил-3-ил)-уксусной кислоты (0,12 г,0,35 ммоль) в виде бесцветной смолы с выходом 48% . 1 Н ЯМР (CDCl3)7,59-7,54 (m, 2H), 7,48-7,30 (m,8 Н), 7,13-7,11 (m, 2 Н), 6,94-6,91 (m, 1H), 5,12 (s, 2H), 4,16 (q, 2H), 3,64 (s, 2H), 1,27 (t, 3H). Получение (5-бензилоксибифенил-3-ил)уксусной кислоты. Раствор NaOH (1 мл, 1 М водн.) добавляили к раствору сложного этилового эфира (5 бензилоксибифенил-3-ил)уксусной кислоты (0,12 г, 0,35 ммоль) в EtOH (2 мл), и смесь перемешивали при комнатной температуре в течение 12 ч. Реакционную смесь разбавляли раствором HCl (2 М водн.) и экстрагировали при помощи EtOAc (3). Объединенные органические экстракты промывали водой, рассолом, высушивали (MgSO4), отфильтровывали и концентрировали при пониженном давлении с получением (5-бензилоксибифенил-3-ил)уксусной кислоты (0,12 г, 0,31 ммоль) в виде бесцветного твердого вещества с выходом 90%. 1 Н ЯМР (CDCl3)7,57-7,56 (m, 2 Н), 7,48-7,30 (m, 8 Н), 7,15-7,10 (m, 2 Н), 6,946,90 (m, 1 Н), 5,11 (s, 2H), 3,69 (s, 2 Н); ЖХСМ метод (A), RT = 4,2 мин. Пример 10. Получение 2-(5-бензилокси-4'-трифторметилбифенил-3-ил)пентановой кислоты (VIII).(5-Бензилокси-4'-трифторметилбифенил-3-ил)уксусную кислоту (0,09 г, 0,23 ммоль) в THF (1,2 мл) капельно добавили к раствору LHMDS в гексане (0,49 мл, 0,49 ммоль, 1,0 М) при -15 С. Через 30 мин добавляли йодопропан (0,08 мл, 0,82 ммоль) в THF (0,3 мл) и смесь перемешивали еще в течение 30 мин при -15 С. Затем смесь резко охлаждали, вылив на смесь льда и раствора HCl (2 М водн.). Эту смесь затем экстрагировали при помощи EtOAc (2), промывали раствором NaHSO3 (10% водн.), и органические вещества высушивали (MgSO4) и концентрировали in vacuo для получения желтого масла. Масло очищали хроматографией на испарительной колонке (EtOAc : петролейный эфир) с получением 2-(5 бензилокси-4'-трифторметилбифенил-3-ил)-пентановой кислоты (0,016 г, 0,04 ммоль) с выходом 18%. 1 Н ЯМР (CDCl3)7,69-7,63 (m, 4H), 7,47-7,42 (m, 2 Н), 7,40 (t, 2 Н), 7,35-7,31 (m, 1 Н), 7,13-7,09 (m, 2 Н), 7,016,99 (m, 1 Н), 5,11 (s, 2H), 3,63-3,59 (m, 1H), 2,11-2,03 (m, 1H), 1,84-1,75 (m, 1H), 1,36-1,26 (m, 2H), 0,92 (t,3 Н); ЖХМС метод (A), (M-H-) 385, RT = 4,9 мин. Пример 11. Получение (5-бензилокси-3',5'-дихлорбифенил-3-ил)уксусной кислоты (IX). Аналогичная описанной в примере 9 методика замещения бензолбороновой кислоты 3,5 дихлорбензолбороновой кислотой. 1 Н ЯМР (CDCl3)7,30-7,55 (m, 8 Н), 7,05 (s, 2 Н), 6,92 (s, 1 Н), 5,11 (s,2H), 3,69 (s, 2H); ЖХСМ метод (A), RT- 5,0 мин. Пример 12. Получение 5-бензилокси-4'-трифторметилбифенил-3-ил)уксусной кислоты (X). Аналогичная описанной в примере 9 методика замещения бензолбороновой кислоты 4- 13012417 трифторметилбензолбороновой кислотой. 1 Н ЯМР (CDCl3)7,66 (m, 4H), 730-7,48 (m, 5H), 7,11 (s, 2H),6,97 (s, 1H), 5,11 (s, 2H), 3,71 (s, 2H); ЖХСМ метод (A), RT = 4,3 мин. Пример 13. Получение (5-бензилокси-3',5'-бис-трифторметилбифенил-3-ил)уксусной кислоты (XI). Аналогичная описанной в примере 9 методика замещения бензолбороновой кислоты 3,5 бистрифторметилбензолбороновой кислотой. 1 Н ЯМР (CDCl3)7,96 (br s, 2H), 7,85 (br s, 1H), 7,48-7,32(m, 5H), 7,13-7,09 (m, 2H), 7,02-7,00 (m, 1H), 5,13 (s, 2H), 3,72 (s, 2H); ЖХСМ метод (A), RT = 4,6 мин. Пример 14. Получение (5-бензилокси-3',4'-дихлорбифенил-3-ил)уксусной кислоты (XII). Аналогичная описанной в примере 9 методика замещения бензолбороновой кислоты 3,4 дихлорбензолбороновой кислотой. 1 Н ЯМР (CDCl3)7,63 (d, 1 Н), 7,50-7,30 (m, 7H), 7,08-7,03 (m, 2H),6,96-6,93 (m, 1H), 5,10 (s, 2H), 3,68 (s, 2H); ЖХСМ метод (A), RT = 4,6 мин. Пример 15. Получение (5-бензилокси-4'-трифторметоксибифенил-3-ил)уксусной кислоты (XIII). Аналогичная описанной в примере 9 методика замещения бензолбороновой кислоты 4 трифторметоксибензолбороновой кислотой. 1 Н ЯМР (CDCl3)7.58-7.53 (m, 2H), 7.47-7.31 (m, 5H), 7.297.23 (m, 2H), 7.09-7.05 (m, 2H), 6.95-6.92 (m, 1H), 5.11 (s, 2H), 3.67 (s, 2H); ЖХСМ метод (A), RT = 4.4 мин. Пример 16. Получение (5-бензилокси-3'-метоксибифенил-3-ил)уксусной кислоты (XIV). Аналогичная описанной в примере 9 методика замещения бензолбороновой кислоты 3 метоксибензолбороновой кислотой. 1 Н ЯМР (CDCl3)7,47-7,32 (m, 6H), 7,12-7,07 (m, 4H), 6,93-6,89 (m,2H), 5,11 (s, 2H), 3,85 (s, 3 Н), 3,69 (s, 2H); ЖХСМ метод (A), RT = 4,2 мин. Пример 17. Получение (5-бензилокси-3'-карбамоилбифенил-3-ил)уксусной кислоты (XV). Аналогичная описанной в примере 9 методика замещения бензолбороновой кислоты бензамид-3 бороновой кислотой. 1 Н ЯМР (CDCl3)12,30- 12,45 (br, 1H), 8,13 (s, 2 Н), 7,87-7,79 (m, 2 Н), 7,56-7,.22 (m,8 Н), 6,97 (s, 1H), 5,18 (s, 2H), 3,63 (s, 2H); ЖХСМ метод (A), RT = 3,6 мин. Пример 18. Получение (5-бензилокси-3'-гидроксибифенил-3-ил)уксусной кислоты (XVI). Аналогичная описанной в примере 9 методика замещения бензолбороновой кислоты 3 гидроксибензолбороновой кислотой. 1 Н ЯМР (CDCl3)7,45-7,28 (m, 6 Н), 7,13-7,08 (m, 3 Н), 7,01 (s, 1H),6,91 (s, 1H), 6,97 (s, 1 H), 6,82-6,08 (m, 1H), 5,09 (s, 2H), 3,67 (s, 2H); ЖХСМ метод (A), RT = 3,8 мин. Пример 19. Получение (5-бензилокси-4'-метансульфонилбифенил-3-ил)уксусной кислоты (XVII). Аналогичная описанной в примере 9 методика замещения бензолбороновой кислоты 4 метансульфонилбензолбороновой кислотой. 1 Н ЯМР (CDCl3)7,98 (d, 2H), 7,74-7,72 (d, 2H), 7,46-7,35(m, 5H), 7,13-7,12 (m, 2H), 7,00 (s, 1H), 5,12 (s, 2H), 3,71 (s, 2H), 3,09 (s, 3 Н); ЖХСМ метод (A), RT = 3,8 мин. Пример 20. Получение (5-бензилокси-4'-сульфамоилбифенил-3-ил)уксусной кислоты (XVIII). Аналогичная описанной в примере 9 методика замещения бензолбороновой кислоты пинаконовым эфиром бензолсульфонамид-4-бороновой кислоты. 1 Н ЯМР (CDCl3)7,89-7,83 (m, 4H), 7,49-7,21 (m, 9H),7,00 (s, 1 Н), 5,17 (s, 2H), 3,62 (s, 2H); ЖХСМ метод (A), RT = 3,6 мин. Пример 21. Получение 2-(5-бензилокси-4'-трифторметилбифенил-3-ил)пропионовой кислоты (XIX). Аналогичная описанной в примере 10 методика замещения пропилйодида метилйодидом. 1 Н ЯМР(CDCl3)7,70-7,62 (m, 4H), 7,48-7,30 (m, 5 Н), 7,15-7,09 (m, 2H), 7,02-7,00 (m, 1H), 5,12 (s, 2H), 3,80 (q,1H), 1,56 (d, 3 Н); ЖХСМ метод (В), RT = 12,3 мин. Пример 22. Получение 2-(5-бензилокси-4'-трифторметилбифенил-3-ил)-2-метилпропионовой кислоты (XX). Получение метил-2-(5-бензилокси-4'-трифторметилбифенил-3-ил)-2-метилпропионата. Сложный метиловый эфир (5-бензилокси-4'-трифторметилбифенил-3-ил)уксусной кислоты (0,15 г,0,37 ммоль) в DMF (1,5 мл) капельно добавили к суспензии NaH (0,072 г 60% суспензии в минеральном масле, 1,79 ммоль) в DMF (1 мл) при -4 С, и перемешивали смесь в течение 1 ч перед тем как был добавлен метилйодид (0,12 мл, 1,86 ммоль). Реакция проходила при перемешивании при температуре от -4 С до 0 С в течение 2,5 ч, смесь была разбавлена DMF и подогревалась до комнатной температуры в течение ночи. Осторожно добавляли раствор NH4Cl (нас. водн.), и смесь экстрагировали при помощи EtOAc. Объединенные органические экстракты промывали рассолом, высушивали (MgSO4), отфильтровывали и концентрировали при пониженном давлении. Остаток очищали хроматографией на испарительной колонке (EtOAc: петролейный эфир) с получением сложного метилового эфира 2-(5-бензилокси-4'трифторметилбифенил-3-ил)-2-метилпропионовой кислоты (0,12 г, 0,28) в виде бесцветного масла с выходом 76%. 1 Н ЯМР (CDCl3)7,67 (m, 4H), 7,47 (m, 2H), 7,41 (m, 2 Н), 7,36 (m, 1 Н), 1,13 (m, 1H), 7,07 (m,1H), 7,00 (m, 1H), 5,12 (s, 2H), 3,66 (s, 3H), 1,61 (s, 6H); ЖХСМ метод (3), RT = 5,6 мин. Получение 2-(5-бензилокси-4'-трифторметилбифенил-3-ил)-2-метилпропионовой кислоты. Раствор сложного метилового эфира 2-(5-бензилокси-4'-трифторметилбифенил-3-ил)-2 метилпропионовой кислоты (0,12 г, 0,28 ммоль) в THF (4 мл) обрабатывали при комнатной температуре раствором KOH (0,17 г, 3,00 ммоль) в метаноле и воде (3 мл, 6:1). Через два дня смесь подкисляли лимонной кислотой и экстрагировали при помощи EtOAc. Объединенные органические экстракты промывали раствором NaHCO3 (нас. водн.), рассолом, высушивали (MgSO4), отфильтровывали и концентриро- 14012417 вали при пониженном давлении. Остаток очищали хроматографией на испарительной колонке (EtOAc: петролейный эфир) с получением 2-(5-бензилокси-4'-трифторметилбифенил-3-ил)-2-метилпропионовой кислоты (0,045 г, 0,11 ммоль) в виде твердого вещества белого цвета с выходом 39%. 1 НЯМР (d4-MeOD) 7,79-7,71 (m, 4H), 7,50-7,46 (m, 2 Н), 7,42-7,36 (m, 2 Н), 7,35-7,29 (m, 1H), 7,25-7,23 (m, 1H), 7,17-7,14 (m,1H), 7,08-7,05 (m, 1H), 5,17 (s, 2H), 1,59 (s, 6H); ЖХСМ метод (A), RT = 4,8 мин. Пример 23. Получение 1-(5-бензилокси-4'-трифторметилбифенил-3-ил)циклопропанкарбоновой кислоты (XXI). Аналогичная описанной в примере 22 методика замещения метилйодида 1,2-дибромэтаном. 1-(5-Бензилокси-4'-трифторметилбифенил-3-ил)циклопропанкарбоновая кислота была получена в виде белого твердого вещества. 1 Н ЯМР (d6-DMSO) 7,90 (d, 2H), 7,80 (d, 2H), 7,49 (d, 2H), 7,41 (t, 2H),7,37-7,31 (m, 1H), 7,27-7,23 (m, 2H) 7,07-7,02 (m, 1 Н), 5,19 (s, 2H), 1,49-1,43 (m, 2H), 1,25-1,20 (m, 2H); ЖХСМ метод (A), RT = 4,7 мин. Используя аналогичную описанной в примере 9 методику для замещения бензолбороновой кислоты подходящей бороновой кислотой, были синтезированы следующие соединения: Пример 41. Получение 2-5-[4-(пирролидин-1-сульфонил)бензилокси]-4'-трифторметилбифенил-3 ил)пентановой кислоты (XXXIX). Аналогичная описанной в примере 10 методика замещения (5-бензилокси-4'-трифторметилбифенил-3-ил)уксусной кислоты 5-[4-(пирролидин-1-сульфонил)бензилокси]-4'-трифторметилбифенил 3-илуксусной кислотой, которая сама получена в соответствии с описанной в примере 9 методикой замещения бензилового спирта 4-(пирролидин-1-сульфонил)-бензиловым спиртом, дала 2-5-[4(пирролидин-1-сульфонил)бензилокси]-4'-трифторметилбифенил-3-илпентановую кислоту, ЖХ метод В, время удержания 12,6 мин. Пример 42. Получение 2-(5-циклопропилметокси-4'-трифторметилбифенил-3-ил)пентановой кислоты (XL). Аналогичная описанной в примере 10 методика замещения (5-бензилокси-4'-трифторметилбифенил-3-ил)уксусной кислоты 5-циклопропилметокси-4'-трифторметилбифенил-3-илуксусной кислотой, которая сама была получена в соответствии с описанной в примере 9 методикой замещения бензилового спирта циклопропилметиловым спиртом, дала 2-(5-циклопропилметокси-4'-трифторметилбифенил-3-ил)пентановую кислоту, ЖХ метод В. время удержания 12,8 мин. Пример 43. Получение [5-(4-хлорбензилокси)-4'-трихлорметилбифенил-3-ил]уксусной кислотыEtOH (50 мл) добавляли 10% Pd/C (5 мас.%), и полученную черную суспензию перемешивали в атмосфере Н 2 в течение 5 ч. Полученную в результате смесь отфильтровывали через броунмиллерит и выпаривали до сухости. Остаток очищали хроматографией на испарительной колонке (EtOAc : петролейный эфир) с получением 2,3 г (93%) сложного этилового эфира (5-гидрокси-4'-трифторметилбифенил-3 ил)уксусной кислоты в виде твердого вещества белого цвета. Суспензию сложного этилового эфира (5-гидрокси-4'-трифторметилбифенила-3-ил)уксусной кислоты (70 мг, 0,22 ммоль), K2CO3 (60 мг, 2,0 эквивалента), 4-хлорбензилбромида (50 мг, 1,1 эквивалента) вMeCN (2 мл) нагревали до 80 С в течение 2 ч. Полученную в результате суспензию отфильтровывали и выпаривали до сухости. Остаток очищали хроматографией на испарительной колонке (EtOAc : петролейный эфир) с получением 85 мг (83%) сложного этилового эфира [5-(4-хлорбензокси)-4'трифлорметилбифенил-3-ил]уксусной кислоты в виде прозрачного масла. Сложный эфир [5-(4-Хлорбензокси)-4'-трифторметилбифенил-3-ил]уксусной кислоты (3) (85 мг,0,19 ммоль) гидролизировали, как описано в примере 9 с получением 71 мг (90%) [5-(4-хлорбензилокси)4'-трифторметилбифенил-3-ил]-уксусной кислоты в виде твердого вещества белого цвета. ЖХ метод С,время удержания 3,4 мин. Аналогичным образом, используя в качестве алкилирующего агента подходящий галид, были получены следующие соединения:(LXI). Замещение в соответствии с примером 10 йодопропана аллилйодидом дало 2-(5-бензилокси-4'трифторметилбифенил-3-ил)-пент-4-еновую кислоты, ЖХ метод С, время удержания 3,5 мин. Пример 64. Получение (R)-2-(5-циклопронилметокси-4'-трифторметилбифенил-3-ил)пентановой килоты (LXII) и (S)-2-(5-циклопропилметокси-4'-трифторметилбифенил-3-ил)пентановой кислоты(LXIII) Энантиомеры 2-(5-циклопропилметокси-4'-трифторметилбифенил-3-ил)пентановой кислоты были разделены на 5 см колонке Chiralpak AD 70/30 гептан/изопропанолом с 0,1% уксусной кислотой в качества элюэнта при скорости потока 80 мл/мин. Первый пик на выходе из колонки был обозначен R, а второй пик - S. Пример 65. Получение (R)-2-(5-Бензилокси-4'-трифторметилбифенил-3-ил)пентановой кислоты(LXIV) и (S)-2-(5-бензилокси-4'-трифторметилбифенил-3-ил)пентановой кислоты (LXV). Энантиомеры 2-(5-бензилокси-4'-трифторметилбифенил-3-ил)пентановой кислоты были разделены на 8 см Chiralpak AD метанолом и 0,1% TFA в качестве элюэнта при скорости потока 80 мл/мин. Первый пик на выходе из колонки (16 мин) был обозначен R, а второй пик (26 мин)-S. Пример 66. Скрининг соединений согласно изобретению на предмет активности модулирования секретазы. Был проведен скрининг с использованием клеток нейробластомы SKN, несущих АРР 695- дикого типа, выращенные в DMEM/NUT-mix F12 (НАМ) производства Gibco (cat no. 31330-38), содержащей 5%Serum/Fe, дополненных 1% заменимых аминокислот. Клетки выращивались почти до оптимальной плотности культуры. Скрининг осуществлялся с использованием теста, описанного в Citron et al (1997) Nature Medicine 3: 67.IC50-значения по активности -секретазы выбранных соединений согласно изобретению. Следующие соединения демонстрируют IC5010 мкМ:(S)-2-(5-бензилокси-4'-трифторметилбифенил-3-ил)-пентановая кислота. Пример 67. Демонстрация проникновения CNS. Исследование in-vivo. Всего 24 мышам (С 57) было перорально введено 100 мг/кг вещества в 10% пропиленгликоле, 7,5% этаноле и 82,5% солютоле. В определенное время (2, 4 и 8 ч), группа из восьми- 18012417 мышей была умерщвлена, а образцы плазмы и ткани мозга были собраны в соответствии с руководствомNIH. Биоаналитические данные. Образцы плазмы были приготовлены следующим образом. 200 мкл ацетонитрила, содержащего внутренний стандарт, добавили к 100 мкл плазмы для осаждения белков. После вортексирования образцы центрифугировали при 10000g в течение 10 мин, а надосадочные жидкости перенесли в пробирки для образцов HPLS для анализа методом LC-MS-MS. Калибровочные стандарты были приготовлены посредством добавления нужных объемов стоковых растворов соединений непосредственно в чистую плазму (из интактных животных) и обрабатывались идентично собранным образцам плазмы. Ткани мозга сначала гомогенизировали в двух объемах буфера PBS (например, 100 мг тканей в 200 мкл PBS). 200 мкл ацетонитрила, содержащего внутренний стандарт, добавили к 100 мкл гомогенизированных тканей для осаждения белков. Каждый гомогенат тканей приготовляли в триплете. После вортексирования образцы центрифугировали при 10000 g в течение 10 мин, и надосадочные жидкости перенесли в пробирки для образцов HPLC для анализа посредством LC-MS-MS. Калибровочные стандарты были приготовлены добавлением нужных объемов стоковых растворов непосредственно в гомогенат чистых тканей мозга (из интактных животных) и обрабатывались идентично собранным образцам плазмы. Анализ LC-MS-MS выполняли в режиме электрораспыления с положительной ионизацией. Градиент LC от 95% воды до 95% ацетонитрила создавали на Sciex 4000 масс-спектрометре, сопряженном с системой Agilent 1100 HPLC. Масс-спектрометрия проводилась до 11 мин. При вышеописанных условиях процентное соотношение концентрации мозга и плазмы составляло 28,6 для (R)-2-(5-бензилокси-4'-трифторметилбифенил-3-ил)пентановой кислоты и 32,0 для (S)-2-(5 бензилокси-4'-трифторметилбифенил-3-ил)пентановой кислоты. Пример 68. Демонстрация эффективности in vivo. Средства для снижения А 42 согласно изобретению могут использоваться для лечения болезни Альцгеймера (БА) у млекопитающих, таких как человек, или же в общепринятых животных моделях,таких как мыши, крысы или морские свинки. Млекопитающее может не иметь диагноза БА или не иметь генетической предрасположенности к БА, но может быть трансгенным, так что оно производит и откладывает А таким же образом, как это происходит у человека. Средства, снижающие уровень А 42, могут вводиться в любой стандартной форме, используя любой стандартный метод. Например (но не ограничиваясь), средства для снижения уровня А 42 могут быть в форме жидкости, таблеток или капсул для приема перорально или в виде инъекций. Средства для снижения уровня А 42 могут вводиться в любой дозе, достаточной для значительного снижения уровней А 42 в плазме крови, спинномозговой жидкости или мозге. Для определения, снижает ли экстренное применение средства для снижения А 42 уровень А 42 in"шведский" вариант, или же модель трансгенной мыши, разработанную д-ром Ван Льювеном(K.U.Leuven, Belgium) и его соавторами, с нейро-специфичной экспрессией клинического мутанта предшественника амилоидного белка человека [V717I] (Moechars et al., 1999 J. Biol. Chem. 274, 6483). Права на продажу этой модели были переданы reMYND NV. Одиночная трансгенная мышь демонстрирует спонтанное прогрессирующее накопление -амилоида (А) в мозге, которое в конечном счете приводит к образованию амилоидных бляшек в подлежащей ткани, гиппокампе и коре головного мозга. Животные этого возраста имеют высокие уровни А в мозге, но не имеют детектируемых отложений А. Мыши,подвергшиеся лечению средством, снижающим уровень А 42, будут исследованы и будет проведено их сравнение с мышами, не подвергавшимися такому лечению или для лечения которых использовались связующие вещества. У них будет исследован уровень растворимого А 42 в мозге и тотальный А стандартными методами, например, методом ИФА. Периоды лечения могут исчисляться часами и днями и будут уточняться в зависимости от результатов снижения А 42, как только будет установлен период наступления эффекта. Показан типичный протокол измерения снижения А 42 in vivo, но это только один из многочисленных вариантов, который может использоваться для оптимизации уровней детектируемого А. Например, можно растворить аликвоты соединений в DMSO (в объеме, равном 1/10 объему конечного состава), вортексировать их и далее растворить (1:10) 10% (вес/объем) раствором гидрокcипропилциклодекстрина (НВС, Aldrich, Ref33,260-7) в PBS, после чего подвергнуть их разрушению ультразвуком в течение 20 с. Средство для снижения А 42 может вводиться одноразово перорально за три-четыре часа до умерщвления и анализа или же может вводиться альтернативно в течение курса в нескольких дней, и животные в таком случае умерщвляются через три-четыре часа после введения последний дозы. При умерщвлении собирается кровь. Сбор крови осуществляется посредством кардиальной пункции во время анестезии смесью Ketalar (Ketamin), Rompun (Xylazin 2%) и Atropin (2:1:1) в сборные пробирки, обработанные EDTA. Кровь центрифугируют при 4000 g в течение 5 мин при 4 С и извлекают плазму для анализа.- 19012417 Мышам делается анестезия смесью Ketalar (Ketamin), Rompun (Xylazin 2%) и Atropin (2:1:1) и транскардиально вводится физиологическая сыворотка при 4 С. Мозг извлекают из черепа, задний и передний мозг разделяют разрезом во фронтальной плоскости. Мозжечок извлекают. Передний мозг равномерно разделяют на левое и правое полушария, используя сагиттальный разрез по средней линии. Одно полушарие сразу же погружается в жидкий азот и хранится при -70 С до гомогенизации в целях биохимического исследования. Мозг гомогенизируют, используя прибор Potter, стеклянную пробирку (без моющего средства, 2 см 3) и механический гомогенизатор (650 об/мин). Объем свежеприготовленного 20 мМ Tris/HCl буфера(рН 8,5) с ингибиторами протеиназ (1 таблетка на 50 мл Tris/HCl-буфера, CompleteTM, Roche, Mannheim,Germany), равный 6,51/2 веса мозга, используется в качестве буфера гомогенизации. Образцы переносят с -70 С в камеру для образцов с жидким азотом, и перед гомогенизацией каждый отдельный образец предварительно нагревают инкубированием на столе в течение нескольких секунд. Гомогенаты собирают в пробирки TLX центрифуги Beckman на льду. Между двумя образцами прибор Potter и стеклянную пробирку тщательно прополаскивают дистиллированной водой (AD) без моющих средств и высушивают впитывающей бумагой. Образцы центрифугируют в охлажденной ультрацентрифуге (Beckman, Mannheim, Germany) в течение 1 ч 20 мин при 48000 об/мин (135.000g) при 4 С. Супернатанты (растворимая фракция, содержащая секретируемый АРР и амилоидный белок) отделяют от осадка (мембранной фракции, содержащей мембранно-связанные АРР фрагменты и амилоидный протеин бляшек в случае старых животных). Небольшие обращенно-фазовые колонки (C18-Sep-Pack Vac 3 сс cartridges, Waters, Massachusetts,MA) монтируют на вакуумной системе и промывают 80% ацетонитрилом в 0,1% трифторуксусной кислоте (A-TFA), после чего дважды в 0,1% TFA. Затем наносят образцы, и колонки последовательно промывают 5 и 25% A-TFA. Амилоидные пептиды элюируют с 75% A-TFA, и элюаты собирают в 2 мл пробирки на льду. Элюаты сушат сублимацией в концентраторе speedvac (Savant, Farmingdale, NY") в течение ночи и растворяют в 240 мкл образца растворителя из набора для ИФА. Для количественного анализа уровня А-42 человека в водорастворимой фракции гомогенатов мозга используют имеющиеся в продаже наборы для ИФА (ферментного иммуносорбентного теста) (h Amyloid /42 ELISA. high sensitive, The Genetics Company, Zurich, Switzerland). Этот тест проводят в соответствии с протоколом изготовителя. В нескольких словах, эталон (раствор синтетического А 1-42) и образцы приготовляют в 96-луночной пропиленовой чашке без способности связывать белок (Greiner bioone, Frickenhausen, Germany). Стандартные растворы с конечными концентрациями 1000, 500, 250, 125,62,5, 31,3 и 15,5 пг/мл и образцы приготовляют в растворителе образцов, поставляемом с набором ИФА,до конечного объема 60 мкл. Образцы, эталоны и контрольные пробы (50 мкл) добавляют в полистироловую чашку с анти-А покрытием (иммобилизованное антитело селективно распознает С-концевую часть антигена), затем добавляют селективный конъюгат анти-А-антитела (биотинилированное антитело) и инкубируют в течение ночи при 4 С для образования антитело-амилоид-антитело-комплекса. На следующий день добавляют конъюгат стрептавидина с пероксидазой, а 30 мин спустя - смесь ТМВ/пероксидаза, в результате чего происходит преобразование субстрата в окрашенный продукт. Эту реакцию останавливают добавлением серной кислоты (1 М), и интенсивность цвета измеряют фотометрией при помощи ИФА-ридера, используя 450 нм фильтр. Количественный анализ содержимого образцов получают сравнением спектральной поглощательной способности с эталонной кривой, полученной при помощи синтетической А 1-42. В такой модели будет полезным снижение А 42 по крайней мере на 20% по сравнению с животными, не подвергавшимися лечению. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение общей формулы (I) где А представляет собой кольцо, выбранное из группы, состоящей из фенила; С 3-7-циклоалкила и гетероциклила, выбранного из циклопентанового, циклогексанового или циклогептанового кольца, которое может содержать до максимального количества двойных связей и в котором по крайней мере от 1 атома углерода до 4 атомов углерода замещены на гетероатом, выбранный из группы, состоящей из серы, включая -S(O)-, -S(O)2-, кислорода или азота, включая =N(O)-, и причем кольцо связано с остальной- 20012417 молекулой посредством атома углерода или азота;X представляет собой линейную С 1-С 4-алкиленовую группу, необязательно замещенную одним или более заместителем из группы F, Cl, Br, I, и С 1-С 4-алкильные группы, необязательно замещенные одним или более F, Cl, Br, I;R1, R2 независимо друг от друга выбраны из группы, состоящей из Н; алкила, выбранного из группы СН 3, С 2 Н 5, изо-С 3 Н 7, н-C3H7, изо-С 4 Н 9, н-C4H9, втор-C4H9, трет-С 4 Н 9; алкенила, выбранного из С 2 Н 3, изоС 3 Н 5, н-C3H5, н-C4H7, изо-С 4 Н 7, втор-C4H7; или R1 и R2 являются частью насыщенного или ненасыщенного кольца, имеющего от 3 до 6 С-атомов, которое может содержать один или более гетероатомов из группы N, S или О и в котором гетероатомы могут быть одинаковыми или различными в случае, если присутствует более одного гетероатома;R3, R4, R5 и R6 независимо друг от друга выбраны из группы, состоящей из Н; F; Cl; Br; I; CN; ОН;C(O)R7; замещенного или незамещенного С 1-С 4-алкила и замещенного и незамещенного С 1-С 4-алкокси,где заместители обеих групп С 1-С 4-алкил и С 1-С 4-алкокси выбраны из F, Cl, Br, I, CF3;R7, R8, R8a независимо друг от друга выбраны из группы, состоящей из Н, С 1-С 4-алкила, гетероциклила, выбранного из циклопентанового, циклогексанового или циклогептанового кольца, которое может содержать до максимального количества двойных связей и в котором по крайней мере от 1 атома углерода до 4 атомов углерода замещены на гетероатом, выбранный из группы, состоящей из серы, включая S(O)-, -S(O)2-, кислорода или азота, включая =N(O)-, и причем кольцо связано с остальной молекулой посредством атома углерода или азота; и С 3-7-циклоалкила, где С 1-С 4-алкил, гетероциклил и С 3-7 циклоалкил необязательно замещены одним или более заместителем, независимо выбранным из группы,состоящей из F, Cl, Br, I и CF3; и/или его фармацевтически приемлемые соли или сложные эфиры. 2. Соединение по п.1, где А; X; R1 и R2; и R3, R4, R5 и R6 независимо друг от друга имеют следующие значения: А представляет собой фенил; циклопропил; циклогексил или 6-членный ароматический гетероцикл;X представляет собой группу СН 2, необязательно замещенную одним или более заместителем из группы F, Cl, Br, I, и С 1-С 4-алкильные группы, необязательно замещенные одним или более F, Cl, Br, I; и/илиR1 и R2 представляют собой Н; или R1 представляет собой Н и R2 представляет собой СН 3, C2H5,С 3 Н 7 или С 4 Н 9 или их изомеры; или R1 и R2 представляют собой СН 3, или R1, R2 совместно с атомом углерода, к которому они присоединены, образуют циклопропильное кольцо; и/илиR3, R4, R5 и R6 независимо друг от друга выбраны из группы, состоящей из Н; ОН; С 1-С 4-алкила или С 1-С 4-алкокси, частично или полностью замещенных F, Cl, Br, I; C(O)NH2, S(О)2-С 1-С 4-алкила, S(О)2 гетероциклила; и/или его фармацевтически приемлемые соли или сложные эфиры. 3. Соединение по любому из пп.1, 2, где А; X; R1 и R2; R3, R4, R5 и R6 независимо друг от друга имеют следующие значения: А представляет собой фенил; илиX представляет собой СН 2 или СНСН 3; илиR1 и R2 представляют собой Н; или R1 представляет собой Н, a R2 представляет собой СН 3, С 2 Н 5,C3H7 и С 4 Н 9 или их изомеры; или R1 и R2 представляют собой СН 3, или R1, R2 совместно вместе с атомом углерода, к которому они присоединены, образуют циклопропильное кольцо, илиR3, R4, R5 и R6 независимо друг от друга выбраны из группы, состоящей из Н, ОН, СН 3, ОСН 3, CF3,OCF3, C(O)NH2, S(O)2-C1-C4-алкила, S(О)2-гетероциклила, F и Cl; и/или его фармацевтически приемлемые соли или сложные эфиры. 4. Соединение по п.1, выбранное из группы, состоящей из следующих соединений:LXV) (S)-2-(5-бензилокси-4'-трифторметилбифенил-3-ил)пентановая кислота; и/или их фармацевтически приемлемых солей или сложных эфиров. 5. Соединение по любому из пп.1-4 для применения в качестве лекарственного средства. 6. Применение соединения по любому из пп.1-4 для получения лекарственного средства для модулирования -секретазы. 7. Применение соединения по любому из пп.1-4 для получения лекарственного средства для лечения болезни, связанной с повышенным уровнем образования А 42. 8. Применение соединения по любому из пп.1-4 для получения лекарственного средства для лечения болезни Альцгеймера. 9. Фармацевтическая композиция, включающая соединение по любому из пп.1-4 в смеси с инерт- 22012417 ным носителем. 10. Способ получения соединения по любому из пп.1-4, который включает стадии соединения необязательно защищенного фенильного производного уксусной кислоты с подходящим ароматическим соединением и, при необходимости, последующей функционализации и снятия защиты полученного таким образом бифенильного соединения. 11. Способ по п.10, дополнительно включающий стадию реакции бифенильного соединения с подходящим галогенидом или дигалогенидом до получения соединения по п.1, где по крайней мере один изR1, R2 является отличным от Н. 12. Способ получения фармацевтической композиции, включающий стадии:a) получения соединения по п.1 иb) приготовления фармацевтической композиции, содержащей указанное соединение. 13. Способ модулирования -секретазы у млекопитающего, отличающийся тем, что указанному млекопитающему вводят соединение по любому из пп.1-4. 14. Способ лечения болезни, связанной с повышенным уровнем образования А 42, у млекопитающего, отличающийся тем, что указанному млекопитающему вводят соединение по любому из пп.1-4. 15. Способ лечения болезни Альцгеймера у млекопитающего, отличающийся тем, что указанному млекопитающему вводят соединение по любому из пп.1-4.
МПК / Метки
МПК: C07D 295/22, C07C 235/34, A61K 31/192, C07C 59/72, A61P 25/28, C07D 261/08, C07C 317/22, C07D 309/06, C07C 59/68, C07D 295/18, C07C 311/17
Метки: кислоты, бифенил)карбоновые, производные
Код ссылки
<a href="https://eas.patents.su/24-12417-bifenilkarbonovye-kisloty-i-ih-proizvodnye.html" rel="bookmark" title="База патентов Евразийского Союза">(бифенил)карбоновые кислоты и их производные</a>
Предыдущий патент: Производные замещенного 2-алкилхиназолинона как ингибиторы parp
Следующий патент: Калиевая соль ингибитора вич-интегразы
Случайный патент: Резьбовое соединение для труб












