Устойчивый полиморф гидрохлорида n-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамина, способы его получения и фармацевтические применения
Номер патента: 5318
Опубликовано: 30.12.2004
Авторы: Коннелл Ричард Д., Норрис Тимоти, Мойер Джеймс Д., Рэггон Джеффри У., Ферранте Карен Дж., Моурин Майкл Дж., Силберман Сандра Л., Фостер Барбара А., Каджиджи Шама М.
Формула / Реферат
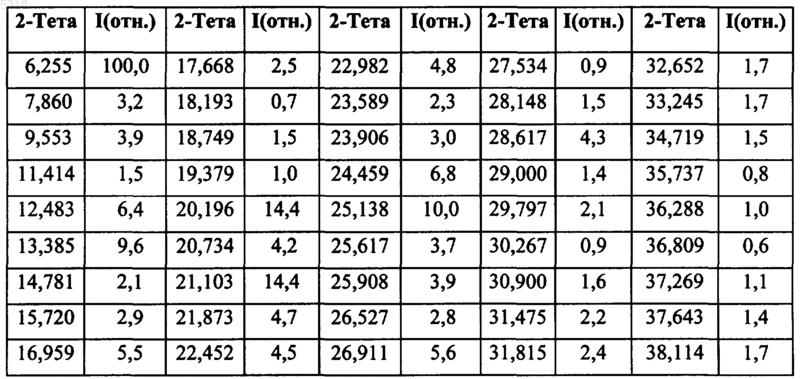
1. Однородный кристаллический полиморф гидрохлорида N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамина, названный полиморфом B, показывающий порошковую рентгенограмму с характеристическими пиками, выраженными в градусах 2-тета, при приблизительно 6,26, 12,48, 13,39, 16,96, 20,20, 21,10, 22,98, 24,46, 25,14 и 26,91.
2. Полиморф по п.1, характеризующийся порошковой рентгенограммой, показанной на фиг. 3.
3. Кристаллический полиморф гидрохлорида N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамина, названный полиморфом B, показывающий порошковую рентгенограмму с характеристическими пиками, выраженными в градусах 2-тета, при приблизительно 6,26, 12,48, 13,39, 16,96, 20,20, 21,10, 22,98, 24,46, 25,14 и 26,91, свободный от полиморфа A.
4. Полиморф по п.3, характеризующийся порошковой рентгенограммой, показанной на фиг. 3.
5. Полиморф по п.3 для использования при лечении аномального клеточного роста клеток, экспрессирующих рецептор эпидермального фактора роста (EGFR), у млекопитающего.
6. Композиция, содержащая кристаллический полиморф гидрохлорида N-(3-этинилфенил)-6,7-бис-(2-метоксиэтокси)-4-хиназолинамина, названный полиморфом B, показывающий порошковую рентгенограмму с характеристическими пиками, выраженными в градусах 2-тета, при приблизительно 6,26, 12,48, 13,39, 16,96, 20,20, 21,10, 22,98, 24,46, 25,14 и 26,91, и носитель, причем композиция свободна от полиморфа A.
7. Композиция по п.6, в которой гидрохлорид N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамина показывает порошковую рентгенограмму с характеристическими пиками, выраженными в градусах 2-тета, при приблизительно
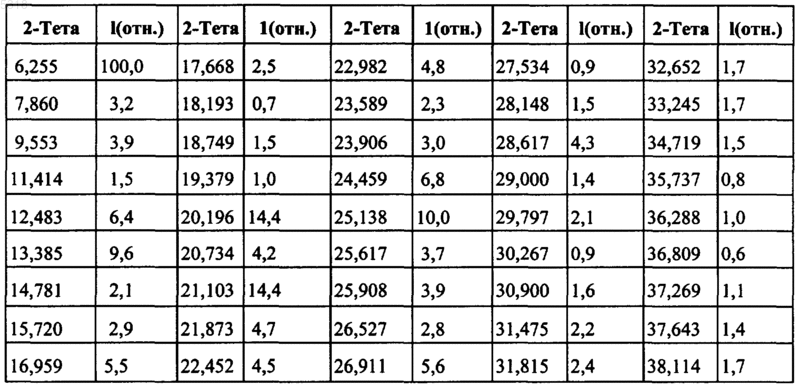
8. Композиция по п.6, в которой гидрохлорид N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамина в форме полиморфа B характеризуется порошковой рентгенограммой, показанной на фиг. 3.
9. Композиция, состоящая из однородного кристаллического полиморфа гидрохлорида N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамина в форме полиморфа B, характеризующийся следующими пиками.
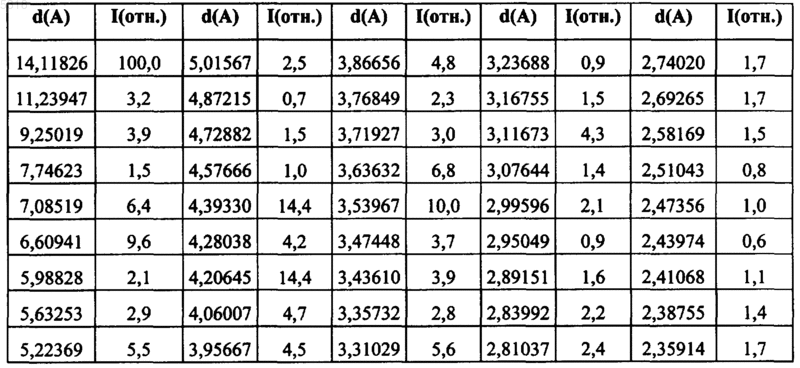
или
и по крайней мере одного носителя.
10. Фармацевтическая композиция, содержащая терапевтически эффективное количество полиморфа по п.3 и фармацевтически приемлемый носитель, причем композиция свободна от полиморфа A.
11. Фармацевтическая композиция по п.10, где указанная композиция адаптирована для орального введения.
12. Фармацевтическая композиция по п.11, где указанная композиция находится в форме таблетки.
13. Фармацевтическая композиция по п.10, где терапевтически эффективное количество составляет от 1 до 7000 мг.
14. Фармацевтическая композиция по п.13, где терапевтически эффективное количество составляет от 5 до 2500 мг.
15. Фармацевтическая композиция по п.14, где терапевтически эффективное количество составляет от 100 до 1600 мг.
16. Фармацевтическая композиция по п.14, где терапевтически эффективное количество составляет от 5 до 200 мг.
17. Фармацевтическая композиция по п.16, где терапевтически эффективное количество составляет от 25 до 200 мг.
18. Фармацевтическая композиция, содержащая кристаллический полиморф по п.3 и любой из химиотерапевтического агента и иммунотерапевтического агента, для применения при лечении NSCLC (немелкоклеточного рака легких), злокачественностей у детей, цервикальной и других опухолей, вызываемых или промотируемых вирусом папилломы человека (HPV), рака эндометрия, глиомы, меланомы, изофагита Баррета (предракового синдрома), рака надпочечников, опухолевых кожных болезней или атеросклероза у млекопитающего.
19. Фармацевтическая композиция, содержащая кристаллический полиморф по п.3 и противоопухолевое средство, выбранные из группы, состоящей из митотического ингибитора, алкилирующего средства, антиметаболита, интеркаляционного антибиотика, ингибитора фактора роста, ингибитора клеточного цикла, фермента, ингибитора топоизомеразы, биомодулятора, антигормона и антиандрогена для использования при лечении аномального клеточного роста клеток, экспрессирующих рецептор эпидермального фактора роста (EGFR), у млекопитающего.
20. Фармацевтическая композиция, содержащая N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамин или одну из его фармацевтически приемлемых солей в безводной или гидратной формах, и один или оба антитела против EGFR и против EGF, или вещество из группы, состоящей из ингибиторов MMP (матрикс-металлопротеиназы), VEGFR (рецептора сосудистого эндотелиального фактора роста), фарнезилтрансферазы, CTLA4 (цитотоксичного антигена 4 T-лимфоцитов) и erbB2, MAb к VEGFr, rhuMab-VEGF, MAb к erbB2 и Mab к avb3, для применения при лечении NSCLC (немелкоклеточного рака легких), злокачественностей у детей, цервикальной и других опухолей, вызываемых или промотируемых вирусом папилломы человека (HPV), рака эндометрия, глиомы, меланомы, изофагита Баррета (предракового синдрома), рака надпочечников и рака кожи, аутоиммунных, опухолевых кожных болезней или атеросклероза у млекопитающего.
21. Применение полиморфа по п.3 для изготовления лекарственного средства, полезного для лечения аномального клеточного роста клеток, экспрессирующих рецептор эпидермального фактора роста (EGFR), у млекопитающего.
22. Применение по п.21, где аномальный клеточный рост представляет рак головного мозга, плоскоклеточный рак, рак мочевого пузыря, желудка, поджелудочной железы, рак печени, мультиформную глиобластому, рак молочной железы, головы, шеи, пищевода, предстательной железы, колоректальный рак, рак легких, почечно-клеточный рак, рак почек, яичников, женского полового тракта или щитовидной железы.
23. Применение по п.21, где аномальный клеточный рост представляет немелкоклеточный рак легких (NSCLC), рефракторный рак яичников или рак головы и шеи.
24. Применение по п.21, где лекарственное средство содержит от 1 до 7000 мг полиморфа.
25. Применение по п.24, где лекарственное средство содержит от 5 до 2500 мг полиморфа.
26. Применение по п.25, где лекарственное средство содержит от 100 до 1600 мг полиморфа.
27. Применение по п.25, где лекарственное средство содержит от 5 до 200 мг полиморфа.
28. Применение по п.27, где лекарственное средство содержит от 25 до 200 мг полиморфа.
29. Применение по п.22, где аномальный клеточный рост представляет рак поджелудочной железы.
30. Применение по п.22, где аномальный клеточный рост представляет колоректальный рак.
31. Применение по п.22, где аномальный клеточный рост представляет рак предстательной железы.
32. Применение по п.22, где аномальный клеточный рост представляет рак молочной железы.
33. Применение по п.22, где аномальный клеточный рост представляет рак пищевода.
34. Применение по п.22, где аномальный клеточный рост представляет рак яичников.
35. Применение по п.22, где аномальный клеточный рост представляет мультиформную глиобластому.
36. Применение по п.22, где аномальный клеточный рост представляет рак печени.
37. Применение по п.22, где аномальный клеточный рост представляет рак почек.
38. Применение по п.22, где аномальный клеточный рост представляет рак желудка.
39. Применение по п.22, где аномальный клеточный рост представляет рак мочевого пузыря.
40. Применение по п.23, где аномальный клеточный рост представляет немелкоклеточный рак легких (NSCLC).
41. Применение по п.23, где аномальный клеточный рост представляет рак головы и шеи.
42. Применение соединения по п.3 или композиции по п.6 для изготовления лекарственного средства, полезного для лечения опухоли у млекопитающего путем индуцирования дифференциации опухолевых клеток, экспрессирующих рецептор эпидермального фактора роста (EGFR) в опухоли.
43. Применение фармацевтической композиции, содержащей N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамин или одну из его фармацевтически приемлемых солей в безводной или гидратной формах, для изготовления лекарственного средства, полезного для лечения NSCLC (немелкоклеточного рака легких), злокачественностей у детей, цервикальной и других опухолей, вызываемых или промотируемых вирусом папилломы человека (HPV), рака эндометрия, изофагита Баррета (предракового синдрома) или опухолевых кожных болезней у млекопитающего.
44. Применение кристаллического полиморфа по п.3 и фармацевтически приемлемого носителя для изготовления лекарственного средства, полезного для лечения NSCLC (немелкоклеточного рака легких), злокачественностей у детей, цервикальной и других опухолей, вызываемых или промотируемых вирусом папилломы человека (HPV), рака эндометрия, глиомы, меланомы, изофагита Баррета (предракового синдрома), рака надпочечников, опухолевых кожных болезней или атеросклероза у млекопитающего.
45. Применение по п.43 или 44 для лечения немелкоклеточного рака легких (NSCLC).
46. Применение по п.43 или 44 для лечения рака эндометрия.
47. Применение по п.44 для лечения глиомы.
48. Применение по п.44 для лечения меланомы.
49. Применение N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамина или одной из его фармацевтически приемлемых солей в безводной или гидратной формах для изготовления лекарственного средства, полезного для ингибирования развития базально- или плоскоклеточного рака кожи в участках, подвергнутых воздействию солнечного излучения, или у лиц с высоким риском заболевания указанным видом рака.
50. Способ получения кристаллического полиморфа гидрохлорида N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамина, названного полиморфом B, который свободен от полиморфа A, включающий стадию перекристаллизации гидрохлорида N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамина в растворителе, содержащем спирт.
51. Способ по п.50, в котором растворитель дополнительно содержит воду.
52. Способ по п.50, в котором гидрохлорид N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамина получают посредством сочетания соединения формулы 6
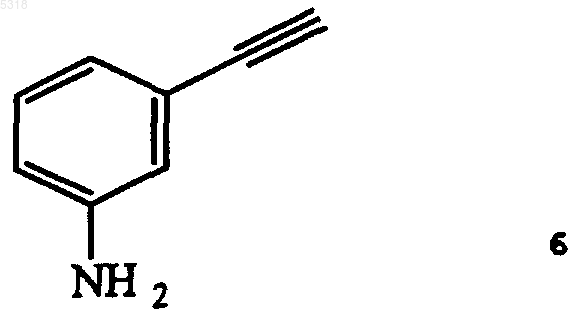
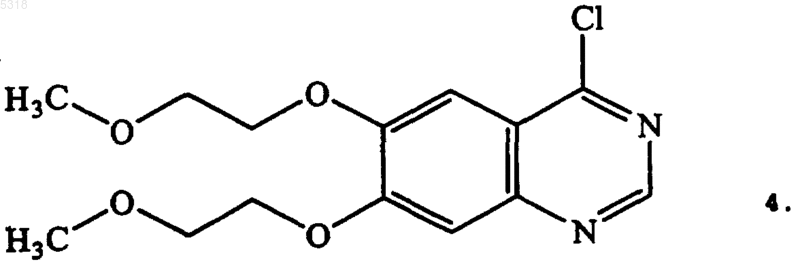
с соединением формулы 4
53. Способ по п. 52, в котором указанное соединение формулы 6 получают нагреванием соединения формулы 5
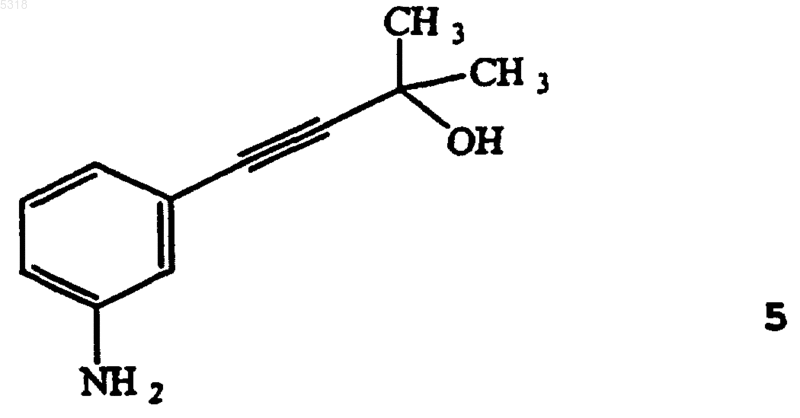
в суспензии щелочи на основе металла в растворителе.
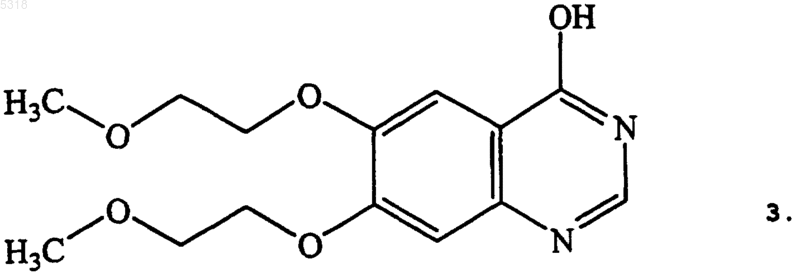
54. Способ по п.52, в котором указанное соединение формулы 4 получают хлорированием соединения формулы 3
55. Способ получения полиморфа B по п.1, включающий стадии
a) хлорирования замещением исходного соединения хиназолинамина формулы 3
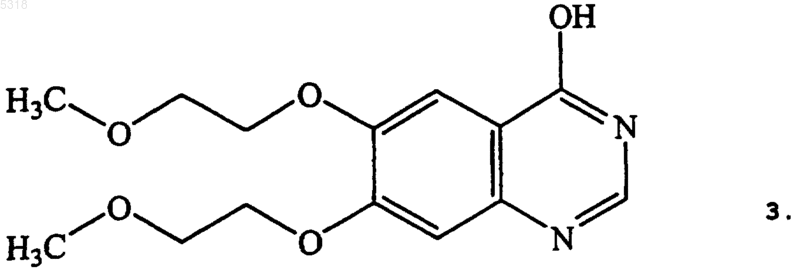
содержащего гидроксильную группу, с получением соединения формулы 4
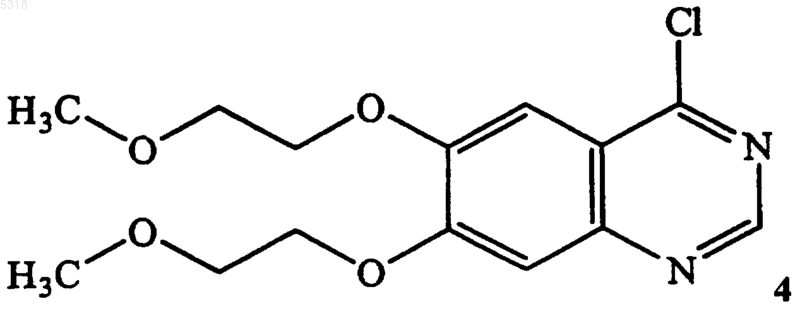
посредством его взаимодействия в смеси растворителей тионилхлорида, метиленхлорида и диметилформамида,
b) получения соединения формулы 6

in situ из исходного соединения формулы 5
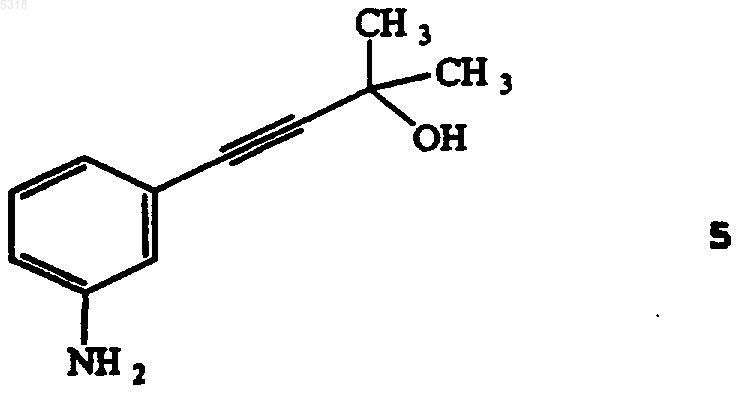
нагреванием соединения формулы 5 в суспензии щелочи на основе металла в растворителе;
c) взаимодействия соединения формулы 6 in situ с соединением формулы 4, где соединение формулы 6 замещает хлор в соединении формулы 4 с образованием гидрохлорида N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамина;
d) перекристаллизации гидрохлорида N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамина в спирте в форму полиморфа B.
56. Способ по п.55, в котором хлорирование замещением гасят в присутствии водного раствора гидроксида натрия.
57. Способ по п.55, в котором хлорирование замещением гасят в присутствии водного раствора бикарбоната натрия.
58. Способ по п.55, в котором хлорирование замещением гасят в присутствии водного раствора гидроксида калия, водного раствора бикарбоната калия, водного раствора карбоната калия, водного раствора карбоната натрия или их смеси.
59. Способ получения кристаллического полиморфа гидрохлорида N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамина, названного полиморфом B, путем перекристаллизации, включающей стадии
a) кипячения спирта, воды и гидрохлорида N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамина с тем, чтобы получить раствор;
b) охлаждения раствора до температуры примерно 65-70шC;
c) очистки раствора и
d) осаждения полиморфа В путем дальнейшего охлаждения очищенного раствора.
60. Способ получения композиции, содержащей кристаллический полиморф гидрохлорида N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамина, названный полиморфом B, показывающий порошковую рентгенограмму с характеристическими пиками, выраженными в градусах 2-тета, при приблизительно 6,26, 12,48, 13,39, 16,96, 20,20, 21,10, 22,98, 24,46, 25,14 и 26,91, который свободен от полиморфа A, включающий смешивание кристаллического полиморфа с носителем.
61. Способ по п.60, в котором гидрохлорид N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамина в форме полиморфа B характеризуется порошковой рентгенограммой, показанной на фиг. 3.
62. Способ по п.60, в котором носитель представляет собой фармацевтически приемлемый носитель.
Текст
N-(3-Этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамин в форме гидрохлорида или мезилата или в безводной и гидратированной форме полезен при лечении у млекопитающих гиперпролиферативных нарушений, таких как раковые заболевания. Патент США 5747498, выданный 5 мая 1998, включенный в данное описание во всей полноте в качестве ссылки, относится, в примере 20, к гидрохлориду [6,7-бис-(2-метоксиэтокси) хиназолин-4-ил]-(3-этинилфенил)амина,который, как описывается в патенте, является ингибитором erbB-семейства онкогенных и протоонкогенных протеинтирозинкиназ, таких как рецептор эпидермального фактора роста(EGFR), и, следовательно, полезен для лечения у людей пролиферативных нарушений, таких как раковые заболевания. Мезилатная форма, описываемая в международной публикации РСТWO 99/55683 полезна при лечении пролиферативных нарушений и более предпочтительна, по сравнению с гидрохлоридом, при парентеральных способах введения, т.е. в растворах более эффективна. Мезилаты более растворимы в водных композициях, чем гидрохлориды, и, таким образом, мезилаты легче доставляются в случае парентеральных способов введения. Однако гидрохлорид предпочтительнее в случае введения твердых форм, таких как таблетки, и при оральном введении. В данной заявке делаются ссылки на различные публикации. Все публикации во всей полноте включены в данное описание в качестве ссылок для более полного описания уровня техники, к которой относится данное изобретение. Краткое изложение сущности изобретения Настоящее изобретение относится к полиморфам и способам селективного получения полиморфов гидрохлорида N-(3-этинилфенил)6,7-бис(2-метоксиэтокси)-4-хиназолинамина, в частности, в устойчивой полиморфной форме. Настоящее изобретение также относится к новым применениям N-(3-этинилфенил)-6,7 бис(2-метоксиэтокси)-4-хиназолинамина в либо его гидрохлоридной, либо мезилатной формах, в безводной или гидратированной форме, а также в его различных полиморфных формах, при лечении у млекопитающих гиперпролиферативных нарушений, таких как раковые заболевания. 2 Описание фигур Фиг. 1. Порошковая рентгенограмма гидрохлорида полиморфа А, термодинамически менее устойчивой формы, в широком интервале для демонстрации первых пиков. Фиг. 2. Порошковая рентгенограмма гидрохлорида полиморфа А, термодинамически менее устойчивой формы, в более узком интервале для более подробной демонстрации. Фиг. 3. Порошковая рентгенограмма гидрохлорида полиморфа В, термодинамически более устойчивой формы, в широком интервале для демонстрации первых пиков. Фиг. 4. Порошковая рентгенограмма гидрохлорида полиморфа В, термодинамически более устойчивой формы, в более узком интервале для более подробной демонстрации. Подробное описание изобретения Описывается по существу однородный кристаллический полиморф гидрохлорида N-(3 этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамина, названный полиморфом В, который показывает порошковую рентгенограмму с характеристическими пиками, выраженными в градусах 2-тета, при приблизительно 6,26, 12,48,13,39, 16,96, 20,20, 21,10, 22,98, 24,46, 25,14 и 26,91. Полиморф также характеризуется порошковой рентгенограммой, представленной на фиг. 3. Описывается кристаллический полиморф гидрохлоридаN-(3-этинилфенил)-6,7-бис(2 метоксиэтокси)-4-хиназолинамина, названный полиморфом В, который показывает порошковую рентгенограмму с характеристическими пиками, выраженными в градусах 2-тета, при приблизительно 6,26, 12,48, 13,39, 16,96, 20,20,21,10, 22,98, 24,46, 25,14 и 26,91, по существу,свободный от полиморфа, названного полиморфом А. Полиморф также характеризуется порошковой рентгенограммой, представленной на фиг. 3. Полиморф, названный полиморфом В, может находиться, по существу, в чистой форме относительно полиморфа А. Также описывается композиция, содержащая по существу однородный кристаллический полиморф гидрохлорида N-(3-этинилфенил)-6,7 бис(2-метоксиэтокси)-4-хиназолинамина, показывающий порошковую рентгенограмму с характеристическими пиками, выраженными в градусах 2-тета, при приблизительно 6,26, 12,48,13,39, 16,96, 20,20, 21,10, 22,98, 24,46, 25,14 и 26,91. Гидрохлорид N-(3-этинилфенил)-6,7 бис(2-метоксиэтокси)-4-хиназолинамина также показывает порошковую рентгенограмму с характеристическими пиками, выраженными в градусах 2-тета, при приблизительно величинах,указанных ниже в табл. 3 или табл. 4. И гидрохлорид N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамина в форме полиморфа В может характеризоваться порошковой рентгенограммой, представленной на фиг. 3. 3 Также описывается композиция, содержащая кристаллический полиморф гидрохлоридаN-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4 хиназолинамина, названный полиморфом В,показывающий порошковую рентгенограмму с характеристическими пиками, выраженными в градусах 2-тета, при приблизительно 6,26, 12,48,13,39, 16,96, 20,20, 21,10, 22,98, 24,46, 25,14 и 26,91, при массовом % полиморфа В относительно полиморфа А, составляющем по меньшей мере 70%. Такая композиция может содержать по меньшей мере 75 мас.% полиморфа В; по меньшей мере 80 мас.% полиморфа В; по меньшей мере 85 мас.% полиморфа В; по меньшей мере 90 мас.% полиморфа В; по меньшей мере 95 мас.% полиморфа В; по меньшей мере 97 мас.% полиморфа В; по меньшей мере 98 мас.% полиморфа В; или по меньшей мере 99 мас.% полиморфа В относительно полиморфа А. Также описывается способ получения полиморфа В гидрохлорида N-(3-этинилфенил)6,7-бис(2-метоксиэтокси)-4-хиназолинамина путем перекристаллизации гидрохлорида N-(3 этинилфенил)-6,7-бис(2-метоксиэтокси)-4 хиназолинамина из растворителя, содержащего спирт и воду. Способ перекристаллизации может включать стадии:b) охлаждения раствора до температуры примерно 65-70 С;d) осаждения полиморфа В путем дальнейшего охлаждения очищенного раствора. В указанном способе, гидрохлорид N-(3 этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамина получают с помощью стадий сочетания соединения формулы 6 Соединение формулы 6 получают посредством реакции соединения формулы 5 в суспензии щелочного металла и растворителя и при нагревании. Соединение формулы 4 получают хлорированием соединения формулы 3 Также описывается фармацевтическая композиция для лечения гиперпролиферативного нарушения у млекопитающего, содержащая,по существу, терапевтически эффективное количество полиморфа В и фармацевтически приемлемый носитель. Фармацевтическую композицию можно адаптировать для орального введения. Она может находиться в форме таблетки. Также описывается способ лечения гиперпролиферативного нарушения у млекопитающего, включающий введение указанному млекопитающему терапевтически эффективного количества полиморфа В. Способ может предназначаться для лечения рака, выбранного из рака головного мозга,плоских клеток, мочевого пузыря, желудка,поджелудочной железы, молочной железы, головы, шеи, пищевода, предстательной железы,колоректального рака, рака легких, почек, яичника, женского полового тракта и щитовидной железы. Способ также может быть подходящим для лечения рака, выбранного из немелкоклеточного рака легких (NSCLC), рефракторного рака яичников, рака головы и шеи, колоректального рака и рака почек. В указанном способе терапевтически эффективное количество может составлять от примерно 0,001 до примерно 100 мг/кг/сутки или от примерно 1 до примерно 35 мг/кг/сутки. В указанном способе терапевтически эффективное количество также может составлять от примерно 1 до примерно 7000 мг/сутки; от примерно 5 до примерно 2500 мг/сутки; от примерно 5 до примерно 200 мг/сутки; или от примерно 25 до примерно 200 мг/сутки. Также описывается способ лечения гиперпролиферативного нарушения у млекопитающего, включающий введение указанному млекопитающему терапевтически эффективного количества полиморфа В в сочетании с противоопухолевым средством, выбранным из группы, состоящей из митотических ингибиторов, алкилирующих средств, антиметаболитов, интеркаляционных антибиотиков, ингибиторов фактора роста, ингибиторов клеточного цикла, ферментов, ингибиторов топоизомераз, биомодуляторов, антигормонов и антиандрогенов. Также описывается способ получения композиции, содержащей по существу однородный кристаллический полиморф гидрохлоридаN-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4 хиназолинамина, названный полиморфом В,который показывает порошковую рентгенограмму с характеристическими пиками, выраженными в градусах 2-тета, при приблизительно 6,26, 12,48, 13,39, 16,96, 20,20, 21,10, 22,98, 5 24,46, 25,14 и 26,91, включающий смешивание кристаллического полиморфа, названного полиморфом В, с носителем. Носитель может представлять собой фармацевтически приемлемый носитель. Также описывается способ получения полиморфа В гидрохлорида N-(3-этинилфенил)6,7-бис(2-метоксиэтокси)-4-хиназолинамина,включающий стадию перекристаллизации гидрохлоридаN-(3-этинилфенил)-6,7-бис(2 метоксиэтокси)-4-хиназолинамина из растворителя, содержащего спирт. В таком способе растворитель может дополнительно содержать воду. В указанном способе гидрохлорид N-(3 этинилфенил)-6,7-бис(2-метоксиэтокси)-4 хиназолинамина получают посредством сочетания соединения формулы 6 В указанном способе соединение формулы 6 получают посредством реакции соединения формулы 5 в суспензии щелочного металла и растворителя и при нагревании. В указанном способе соединение формулы 4 получают хлорированием соединения формулы 3 Также описывается способ получения полиморфа В по п.1 формулы изобретения, включающий стадии а) хлорирования замещением исходного соединения хиназолинамина формулы 3 содержащего гидроксильную группу, с образованием соединения формулы 4 посредством его взаимодействия в смеси растворителей тионилхлорида, метиленхлорида и диметилформамида,b) получения соединения формулы 6in situ из исходного материала соединения формулы 5 посредством реакции последнего в суспензии щелочного металла и растворителя и при нагревании; с) взаимодействия соединения формулы 6in situ с соединением формулы 4, где соединение формулы 6 замещает хлор в соединении формулы 4, с образованием гидрохлорида N-(3 этинилфенил)-6,7-бис(2-метоксиэтокси)-4 хиназолинамина; а) перекристаллизации гидрохлорида N-(3 этинилфенил)-6,7-бис(2-метоксиэтокси)-4 хиназолинамина, в спирте, с образованием формы полиморфа В. В данном способе хлорирование замещением можно погасить в присутствии водного раствора гидроксида натрия; водного раствора бикарбоната натрия; водного раствора гидроксида калия; водного раствора бикарбоната калия; водного раствора карбоната калия; водного раствора карбоната натрия или их смеси. Также описывается способ получения полиморфа В гидрохлорида N-(3-этинилфенил)6,7-бис(2-метоксиэтокси)-4-хиназолинамина путем перекристаллизации, включающий стадииb) охлаждения раствора до температуры примерно 65-70 С;d) осаждения полиморфа В путем дальнейшего охлаждения очищенного раствора. Также описывается композиция, состоящая в основном из гидрохлорида N-(3 этинилфенил)-6,7-бис(2-метоксиэтокси)-4 хиназолинамина в форме полиморфа А, характеризующегося пиками на его порошковой рентгенограмме, показанной на фиг. 1. Также описывается композиция, состоящая в основном из гидрохлорида N-(3 этинилфенил)-6,7-бис(2-метоксиэтокси)-4 хиназолинамина в форме полиморфа А, характеризующегося пиками, показанными ниже в табл. 1 или 2. Также описывается пролекарство любого из соединения, описываемого в данном описании. Также описывается способ индуцирования дифференциации опухолевых клеток в опухоли,включающий контактирование клеток с эффек 7 тивным количеством любого из соединений или композиций, описываемых в данном описании. Также описывается способ леченияNSCLC (немелкоклеточного рака легких), злокачественностей у детей, цервикальной и других опухолей, вызываемых или промотируемых вирусом папилломы человека (HPV), меланомы,эзофагита Барретта (предракового синдрома),рака надпочечников и рака кожи и аутоиммунных, опухолевых кожных болезней и атеросклероза у млекопитающего, включающий введение указанному млекопитающему терапевтически эффективного количества фармацевтической композиции, содержащей по меньшей мере одно соединение из N-(3-этинилфенил)-6,7-бис(2 метоксиэтокси)-4-хиназолинамина и его фармацевтически приемлемых солей в безводной и гидратированной формах. Лечение может дополнительно включать паллиативную или неоадъювантную/адъювантную монотерапию; или может включать блокировку рецепторов эпидермального фактора роста (EGFR). Способ также можно применять при лечении опухолей, экспрессирующих EGFRvIII. Способ также может включать сочетание с любой химиотерапией и иммунотерапией; или лечение с любыми из антител против EGFR и против EGF или с теми и другими; или введение указанному млекопитающему вещества группы,состоящей из ингибиторов ММР (матриксметаллопротеиназы), VEGFR (рецептора сосудистого эндотелиального фактора роста), фарнезилтрансферазы, CTLA4. (цитотоксичного антигена 4 Т-лимфоцитов) и еrbB2, МАb к VEGFr,rhuMAb-VEGF, MAb к erbB2 и Маb к avb3. Используемые фармацевтические соединения могут представлять собой активаторы облучения - радиосенсибилизаторы при лечении рака или при сочетании с антигормональным лечением, или для ингибирования роста опухолей у людей по схеме лечения с лучевой терапией. Также описывается способ химиопрофилактики базально- или плоскоклеточного рака кожи в участках, подвергнутых воздействию солнечного излучения, или у лиц с высоким риском заболевания указанным видом рака,причем указанный способ включает введение указанным лицам терапевтически эффективного количества фармацевтической композиции, содержащей по меньшей мере одно соединение изN-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4 хиназолинамина, и его фармацевтически приемлемых солей в безводной и гидратированной формах. Также описывается способ индуцирования дифференциации опухолевых клеток в опухоли,включающий контактирование клеток с эффективным количеством по меньшей мере одного соединения из N-(3-этинилфенил-6,7-бис(2 метоксиэтокси)-4-хиназолинамина, и его фар 005318 8 мацевтически приемлемых солей в безводной и гидратированной формах. Согласно цели настоящего изобретения оно предлагает способ получения гидрохлорида получая его более подходящим для таблетки и орального введения и состоящим, по существу,из устойчивой полиморфной формы (полиморфная форма В), а также предлагает соединение в такой полиморфной форме В и промежуточную полиморфную форму А, по существу, в чистой форме. Другой целью настоящего изобретения является обеспечение такой устойчивой полиморфной формы В в фармацевтической композиции для орального введения. Устойчивость гидрохлорида необходима по причине его применения при лечении пациентов, так как изменения будут воздействовать на уровень эффективной дозировки и введение. Обнаружено,что гидрохлоридN-(3 этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамина существует в двух полиморфных состояниях - полиморф А и В. Это обстоятельство вносит различие с мезилатами, существующими в трех полиморфных состояниях (полиморфы мезилата А, В и С). Обнаружено, что полиморф В гидрохлорида является термодинамически наиболее устойчивой и нужной формой, и настоящее изобретение включает соединение полиморф В в, по существу, чистой полиморфной форме В и фармацевтические композиции с, по существу, чистой формой полиморфа В, в частности, в форме таблеток, и способ избирательного получения такого соединения. Гидрохлорид, описываемый в патенте США 5747498, фактически содержит смесь полиморфов А и В, которая из-за ее частично сниженной устойчивости (т.е. из-за компонента полиморфа А) не является более предпочтительной для формы таблеток, чем формы солей мезилатов. Конкретно, настоящее изобретение относится к способам получения форм гидрохлоридаN-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4 хиназолинамина и получения устойчивой формы В с высоким выходом. Обнаружено, что мезилатная соль N-(3-этинилфенил)-6,7-бис(2 метоксиэтокси)-4-хиназолинамина существует в по меньшей мере трех полиморфных формах,обозначенных А, В и С, с возрастающей устойчивостью с различными порошковыми рентгенограммами. Порошковые рентгенограммы гид 9 рохлоридных полиморфных форм A (A1 и A2) и В (B1 и B2) приводятся на фиг. 1-4: кривые на фиг. 1 и 3 относятся к более широкому интервалу, чтобы полностью показать первые пики для А и В, соответственно, и кривые на фиг. 2 и 4 относятся к более узкому интервалу, чтобы показать, в основном, подробности для А и В, соответственно. Данные, содержащиеся в рентгенограммах на вышеуказанных фиг. 1-4, приведены в табл. 1-4. Таблица 1. Полиморф А. Анод: Сu - длина волны 1: 1,54056, длина волны 2: 1,54439 (отн. интенсивность 0,500) Диапазон 1 - сопряженный 3000-40000,величина шага 0,040, период шага 1,00, ширина выравнивания 0,300, порог 1,0. Следует иметь в виду, что порошковая рентгенограмма является только одним из многих способов для характеристики расположения атомов соединения гидрохлорида N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамина, и что для идентификации в образце,композиции или других препаратах присутствия полиморфа В гидрохлорида N-(3-этинилфенил)6,7-бис(2-метоксиэтокси)-4-хиназолинамина можно использовать другие способы, хорошо известные в данной области, например, рентгенографию монокристалла. Настоящее изобретение относится к соединению, представляющему собой полиморф В гидрохлорида N-(3-этинилфенил)-6,7-бис (2 метоксиэтокси)-4-хиназолинамина, показывающему порошковую рентгенограмму с характеристическими пиками, выраженными в градусах 2-тета, при приблизительно 6,26, 12,48, 13,39,16,96, 20,20, 21,10, 22,98, 24,46, 25,14 и 26,91. Данное изобретение также относится к полиморфу гидрохлорида N-(3-этинилфенил)-6,7 бис(2-метоксиэтокси)-4-хиназолинамина, показывающему порошковую рентгенограмму с характеристическими пиками, выраженными в градусах 2-тета, при приблизительно, величинах, приведенных выше в табл. 4. Данное изобретение также относится к соединению, представляющему собой полиморф А гидрохлорида N-(3-этинилфенил)-6,7-бис(2 метоксиэтокси)-4-хиназолинамина, показывающему порошковую рентгенограмму с характеристическими пиками, выраженными в градусах 2-тета, при приблизительно 5,58, 9,84, 11,25,18,86, 22,70, 23,50, 24,18, 24,59, 25,40 и 29,24. Данное изобретение также относится к полиморфу гидрохлорида N-(3-этинилфенил)-6,7 бис(2-метоксиэтокси)-4-хиназолинамина, показывающему порошковую рентгенограмму с характеристическими пиками, выраженными в градусах 2-тета, при приблизительно, величинах, приведенных выше в табл. 2. Способ получения Полиморф В в, по существу, чистой форме гидрохлоридаN-(3-этинилфенил)-6,7-бис(2 метоксиэтокси)-4-хиназолинамина (соединение формулы 1) получают, согласно способу настоящего изобретения, посредством стадий 1) хлорирования замещением исходного хиназолинаминового соединения (формула 3) содержащего гидроксильную группу, например,путем его взаимодействия в смеси растворителей тионилхлорида, метиленхлорида и диметилформамида, и в заключение гашением реакции водным раствором гидроксида натрия или бикарбоната натрия. Соединение формулы 4 получают с высоким выходом с заменой гидроксильной группы хлором; 2) получения соединения формулы 6 из исходного вещества формулы 5 путем реакции последнего в суспензии NaOH(или KОН или их сочетания) в толуоле при нагревании; 3) взаимодействия соединения формулы 6 с соединением формулы 4 со стадии 1, где соединение формулы 6 замещает хлор с образованием гидрохлорида N-(3-этинилфенил)-6,7 бис(2-метоксиэтокси)-4-хиназолинамина(соединение формулы 2) с выходом 97%; 4) перекристаллизации соединения формулы 2 (содержащего как полиморф А, так и полиморф В) в более устойчивый полиморф В в растворителе, содержащем спирт (например,2 В-этанол) и воду, как правило, с высоким выходом, например, примерно 85%. Соответственно, настоящее изобретение относится к способу получения полиморфа В гидрохлоридаN-(3-этинилфенил)-6,7-бис(2 метоксиэтокси)-4-хиназолинамина,включающему перекристаллизацию гидрохлорида N-(3 этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамина в растворителе, содержащем спирт и воду. В одном из вариантов, способ включает стадии кипячения спирта, воды и гидрохлоридаN-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4 хиназолинамина для образования раствора; охлаждения раствора до температуры примерно 65-70 С; очистки раствора и осаждения полиморфа В путем дальнейшего охлаждения очищенного раствора. В одном из вариантов, спирт представляет собой этанол. В предпочтительном варианте, отношение этанола к воде составляет примерно 4:1. Также ожидается, что другие 12 низшие спирты, например, спирты C1-C4, также подходят для перекристаллизации полиморфа В с доведением отношения спирта к воде до необходимого. В другом предпочтительном варианте соединение, которое перекристаллизовывают,присутствует в количестве относительно общего объема растворителя при отношении массы к объему примерно 0,05. В одном из вариантов,гидрохлорид N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамина получают посредством сочетания соединения формулы 6 с соединением формулы 4. В другом варианте соединение формулы 6 получают посредством реакции соединения формулы 5 в суспензии щелочного металла и растворителя при нагревании. В одном из вариантов соединение формулы 4 получают хлорированием соединения формулы 3 путем взаимодействия последнего в смеси растворителей, состоящей из тионилхлорида, метиленхлорида и диметилформамида, и последующего гашения реакции водным раствором гидроксида натрия. Альтернативно, водный раствор гидроксида натрия можно заменить на водный раствор бикарбоната натрия. Данное изобретение относится к полиморфу В гидрохлорида N-(3-этинилфенил)-6,7 бис(2-метоксиэтокси)-4-хиназолинамина, полученному описанными выше способами. В одном из вариантов полиморф В получают, используя исходные вещества, описанные в данном описании. В предпочтительном варианте полиморф В получают путем взаимодействия описанных в данном описании исходных веществ с реагентами и в условиях согласно способам, описанным в описании и в приведенных далее примерах. Общий синтез Обнаружено, что гидрохлорид N-(3 этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамина существует в двух различных безводных полиморфных формах А и В. В способе получения различных полиморфов используют компоненты, реагирующие по отдельности согласно приведенной далее схеме. Применения Как описывается в упомянутом выше патенте США 5747498 и международной публикации РСТWO 99/55683, соединения, полученные согласно настоящему изобретению, полезны для лечения у млекопитающего гиперпролиферативного нарушения, включающего применение терапевтически эффективного количества гидрохлоридной или мезилатной формы N-(3-этинилфенил)-6,7-бис(2-метоксиэток 13 си)-4-хиназолинамина и фармацевтически приемлемого носителя. Термин "соединение(я) изобретения", используемый в данном описании, относится,предпочтительно, к форме полиморфа В гидрохлорида N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамина, но это не означает,что исключаются мезилатная форма и ее три полиморфа, или полиморф А гидрохлоридной формы, или смесь полиморфов В и А гидрохлоридной формы, или другие некристаллические формы соединения. Термин "лечение", используемый в данном описании, если нет иных указаний, означает реверсию, облегчение, ингибирование развития или предупреждение нарушения или состояния,к которым применим такой термин, или одного или нескольких симптомов такого нарушения или состояния. Термин "лечение", используемый в данном описании, относится к процессу лечения, когда "лечение" имеет только что указанные выше значения. Термин "аномальный клеточный рост", используемый в данном описании, относится к росту клеток, независимому от нормальных регуляторных механизмов (например, утрата контактного торможения), включая аномальный рост здоровых клеток и рост аномальных клеток. Это включает, но не ограничивается перечисленным, аномальный рост: (1) опухолевых клеток (опухолей), как доброкачественных, так и злокачественных, экспрессирующих активированный Ras-онкоген; (2) опухолевых клеток,как доброкачественных, так и злокачественных,где Ras-белок активируется в результате онкогенной мутации в другом гене; (3) доброкачественных и злокачественных клеток при других пролиферативных заболеваниях, где происходит аберрантная Ras-активация. Примерами таких доброкачественных пролиферативных болезней являются псориаз, доброкачественная гипертрофия предстательной железы, вирусная папиллома человека (HPV) и рестеноз. Термин"аномальный клеточный рост", используемый в данном описании, также относится к и включает аномальный рост клеток, как доброкачественных, так и злокачественных, являющийся результатом активности ферментов фарнезилпротеинтрансферазы, протеинкиназ, протеинфосфатаз, липидкиназ, липидфосфатаз, или активности факторов транскрипции, или внутриклеточных рецепторных белков, или рецепторных белков клеточной поверхности. Гидрохлорид [6,7-бис(2-метоксиэтокси)хиназолин-4-ил]-(3-этинилфенил)амина, предпочтительно устойчивая форма полиморфа В, также дополнительно используется для лечения различных других опухолей человека, содержащих гиперпролиферирующие клетки, активируемые каскадами реакций сигнальной трансдукции,стимулированными EGFR, или путем сверхэкспрессии (например, из-за одного или несколь 005318 14 ких факторов - из измененной транскрипции,измененной деградации мРНК или амплификации гена) самого белка EGFR, другого рецепторного белка, с которым EGFR может образовывать активные гетеродимеры, или одного из лигандов, который активирует EGFR (например,EGF, TGF, амфирегулина, -целлюлина, гепаринсвязывающего EGF или эпирегулина), или гетеродимеризующего рецептора, или благодаря зависимости или частичной зависимости от активности белка EGFR "нормального" уровня,или активируемыми внеклеточным лигандом,каскадами внутриклеточной сигнальной трансдукции и/или генетическими изменениями или полиморфизмами, приводящими к замещениям аминокислот, что вызывает повышенную или лиганднезависимую активность (например,EGFRvIII, Archer G.E. et а 1. (1999), Clinical Cancer Research, 5:2646-2652). Такие опухоли,включающие как доброкачественные, так и злокачественные, включают ренальные опухоли(такие как рак почки, почечно-клеточный рак или рак почечных лоханок), опухоли печени,почек, мочевого пузыря (в частности, инвазивные опухоли), молочной железы (включая опухоли, положительные и отрицательные по эстрогенным рецепторам, и опухоли, положительные и отрицательные по рецепторам прогестерона), желудка, пищевода (включая рак слизистой Барретта, плоскоклеточный рак и аденокарциномы), гортани, яичников, колоректальный рак (в частности, глубоко прорастающие опухоли), в том числе, ануса, предстательной железы, поджелудочной железы, легких (в частности, немелкоклеточный рак легких (NSCLC),аденокарциномы, крупноклеточные опухоли и плоскоклеточный рак, но также реактивныеin situ) бронхиальные повреждения, связанные как с аденокарциномами NSCLC, так и с плоскоклеточными раковыми заболеваниями), женского полового тракта, включая рак вульвы,эндотермия, матки (например, саркомы), цервикальный, вагинальный, вульвальный рак и рак маточных труб, рак щитовидной железы, рак печени, кожные раковые заболевания, саркомы,опухоли головного мозга, включая глиобластомы (в том числе, глиобластому мультиформную), астроцитомы, шванномы, эпендимоны,медулобластомы, менингиомы и аденомы гипофиза, и различные другие опухоли головы и шеи(в частности, мелкоклеточные карциномы), и метастазы всех опухолей, перечисленных выше. Гидрохлорид [6,7-бис(2-метоксиэтокси)хиназолин-4-ил]-(3-этинилфенил)амина, предпочтительно стабильная форма полиморфа В, также применяют для лечения многих других гиперпластических состояний человека, содержащих гиперпролиферирующие клетки, активируемые каскадами реакций сигнальной трансдукции,которые можно стимулировать EGFR, такие как 15 доброкачественная гиперплазия кожи (например, псориаз) или предстательной железы (например, ВРН), хронический панкреатит, или реактивная гиперплазия эпителия протоков поджелудочной железы, или болезнь почек(включая пролиферативный гломерулонефрит и болезнь почек, вызванную диабетом) у млекопитающего, в виде композиции, содержащей терапевтически эффективное количество гидрохлорида N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамина, предпочтительно в форме полиморфа В, и фармацевтически приемлемый носитель. Кроме того, фармацевтические композиции, содержащие соединения, полученные согласно настоящему изобретению, обеспечивают предупреждение имплантации бластоцитов у млекопитающего, и такие композиции содержат терапевтически эффективное количество гидрохлорида N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамина, предпочтительно, в форме полиморфа В, и фармацевтически приемлемый носитель. Гидрохлорид [6,7-бис(2-метоксиэтокси)хиназолин-4-ил]-(3-этинилфенил)амина, предпочтительно устойчивая форма полиморфа В, также используется для лечения различных других нарушений, при которых клетки активируются каскадами реакций сигнальной трансдукции,стимулированными EGFR, или путем сверхэкспрессии (например, из-за одного или нескольких из факторов измененной транскрипции, измененной деградации мРНК или амплификации гена) самого белка EGFR, другого рецепторного белка, с которым EGFR может образовывать активные гетеродимеры, или одного из лигандов, который активирует EGFR (например, EGF,TGF, амфирегулина, -целлюлина, гепаринсвязывающего EGF или эпирегулина), или гетеродимеризующего рецептора, или благодаря зависимости или частичной зависимости от активности белка EGFR "нормального" уровня,или активируемыми внеклеточным лигандом,каскадами внутриклеточной сигнальной трансдукции и/или генетическими изменениями или полиморфизмами, приводящими к замещениям аминокислот, что вызывает повышенную или лиганднезависимую активность (например,EGFRvIII, Archer G.E. et al. (1999), Clinical Cancer Research, 5:2646-2652). Такие нарушения могут включать нарушения нейронные, глиальные, астроцитальные, гипоталамуса и другие нарушения гландулярного, макрофагального,эпителиального, стромального или бластоцельного характера, в которые могут быть вовлечены аберрантная или "нормальная" функция,экспрессия, активация или передача сигналов через EGFR. Такие нарушения также могут вовлекать модуляцию EGF (или другими лигандами, активирующими EGFR, или гетеродимеризующими рецепторами) адипоцитного липогенеза, резорбции костей, высвобождения CRH 16 гипоталамусом, накопления жира в печени, Тклеточной пролиферации, пролиферации или дифференциации тканей кожи, пролиферации или дифференциации корнеальной эпителиальной ткани, макрофагового хемотаксиса или фагоцитоза, астроглиальной пролиферации, заживления ран, поликистозной болезни почек,легочной эпителиальной пролиферации или дифференциации (например, связанных с астматическим перерождением дыхательных путей или восстановлением тканей), воспалительного артрита (например, ревматоидного артрита, артрита, связанного с системной красной волчанкой, псориатического артрита), тестикулярного продуцирования андрогена, пролиферации тимусных эпителиальных клеток, пролиферации эпителиальных клеток матки, ангиогенеза, выживания клеток, апоптоза, NFkB-активации,пролиферации сосудистых гладкомышечных клеток, рестеноза или секреции жидкости легкими. Гидрохлорид [6,7-бис(2-метоксиэтокси)хиназолин-4-ил]-(3-этинилфенил)амина, предпочтительно устойчивая форма полиморфа В, также используется для лечения ряда лейкозов (хронических и острых) и лимфоидных злокачественностей (например, лимфоцитарных лимфом),диабета, диабетических и других ретинопатий,таких как ретинопатия или преждевременная возрастная макулярная дегенерация, твердых опухолей у детей, глиомы, гемангиом, меланом,в том числе, внутриглазной или увеальной меланом, саркомы Капоши, болезни Ходжкина,эпидермоидных раковых заболеваний, раковых заболеваний эндокринной системы (например,паращитовидной железы, надпочечников), тонкой кишки, уретры, полового члена и мочеточника, атеросклероза, болезней кожи, таких как экзема и склеродерма, грибовидных микозов,сарком мягких тканей и неоплазмы центральной нервной системы (например, первичной лимфомы ЦНС, спинальных осевых опухолей, глиом ствола мозга или аденом гипофиза). Лечение любого из гиперпролиферативных или других нарушений, описанных выше, может применяться как монотерапия, или может включать, в дополнение к гидрохлориду [6,7-бис(2 метоксиэтокси)хиназолин-4-ил]-(3-этинилфенил)амина, предпочтительно устойчивой формы полиморфа В, применение одного или нескольких дополнительных лекарственных средств или видов лечения (например, радиотерапия,химиорадиотерапия), которые по характеру являются антигиперпролиферативными, противоопухолевыми или антигиперпластическими. Такого совместного лечения можно достигнуть путем одновременного, последовательного,циклического или раздельного дозирования отдельных компонентов лечения. Гидрохлорид[6,7-бис(2-метоксиэтокси)хиназолин-4-ил]-(3 этинилфенил)амина, предпочтительно устойчивую форму полиморфа В, типично, применяют в 17 дозах 1-7000 мг/сутки, предпочтительно, 5-2500 мг/сутки, наиболее предпочтительно, 5-200 мг/сутки, в случае любого из описанных выше видов лечения. Кроме того, различные формы N-(3 этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамина, включая мезилатные и гидрохлоридные формы (все формы полиморфов), так же как и другие фармацевтически приемлемые формы солей и безводные и гидратированные формы, можно применять для лечения, с помощью терапевтически эффективного количества вышеуказанных соединений и фармацевтически приемлемого носителя, специфических состояний NSCLC (немелкоклеточного рака легких),злокачественностей у детей, цервикальных и других опухолей, вызванных или промотируемых вирусом папилломы человека (HPV), меланомы, эзофагита Барретта (предраковый синдром) и надпочечников и рака кожи, а также аутоиммунных и неопластических кожных заболеваний, таких как грибовидный микоз, у млекопитающего, а также для химиопрофилактики базально- или плоскоклеточного рака кожи, в частности, в участках, подвергнутых воздействию солнечного излучения, или у лиц, у которых, как известно, имеется высокий риск заболевания такими раковыми болезнями. Кроме того, вышеуказанные соединения полезны при лечении атеросклероза, причем в гиперпролиферации сосудистых гладкомышечных клеток, ответственных за образование атеросклеротических бляшек, участвует эпидермальный фактор роста (G.E. Peoples et al., Proc. Natl.Acad. Sci. USA, 92:6547-6551, 1995). Соединения настоящего изобретения являются сильными ингибиторами белков еrbBсемейства онкогенных и протоонкогенных протеинтирозинкиназ, таких как рецептор эпидермального фактора роста (EGFR), erbB2, HER3 или HER4, и, таким образом, все адаптируются к лечебному применению в качестве антипролиферативных средств (например, противораковых) млекопитающими, в частности, людьми. Соединения настоящего изобретения также являются ингибиторами развития кровеносных сосудов и/или образования и развития сосудов. Соединения настоящего изобретения также могут быть полезны при лечении других нарушений, в которые вовлекаются аберрантная экспрессия, взаимодействия или активация лиганд/рецептор или события передачи сигналов,связанные с различными протеинтирозинкиназами. Такие нарушения могут включать нарушения нейронные, глиальные, астроцитальные,гипоталамуса и другие нарушения гландулярного, макрофагального, эпителиального, стромального или бластоцельного характера, в которые могут быть вовлечены аберрантная функция, экспрессия, активация или передача сигналов еrbB-тирозинкиназ. Кроме того, соединения настоящего изобретения могут иметь полез 005318 18 ность для лечения воспалительных, ангиогенных и иммунологических нарушений, включая как идентифицированные, так и пока неизвестные тирозинкиназы, которые ингибируются соединениями настоящего изобретения. Кроме непосредственного лечения вышеуказанных недомоганий соединениями, они могут применяться при лечении и вообще в виде паллиативной или неоадъювантной/адъювантной монотерапии, при блокировании рецепторов эпидермального фактора роста (EGFR) и для применения при лечении опухолей, экспрессирующих вариантную форму EGFR, известную как EGFRvIII, как описано в научной литературе (например, в DK Moscatello et al.,Cancer Res., 55:5536-5539, 1995), а также в сочетании с химиотерапией и иммуннотерапией. Как описано подробнее ниже, также возможно лечение сочетаниями с антителами как противEGFR, так и против EGF, или сочетанием с ингибиторами ММР (матрикс-металлопротеиназ),других тирозинкиназ, включая VEGFR (рецептор сосудистого эндотелиального фактора роста), фарнезил-трансферазы, CTLA4 (цитотоксичный антиген 4 к Т-лимфоцитам) и еrbB2. Другие виды лечения включают МАb к VEGFr и другие антитела, связанные с раковыми заболеваниями, в том числе, rhuMAb-VEGF (Genetech,Phase III), MAb к erbB2, доступные как герцептин (Genetech, Phase III), или МAb к avb3, доступные как витаксин (Applied Molecular Evolution/MedImmune, Phase II). Изобретение также относится к фармацевтической композиции и способу лечения любого из указанных нарушений у млекопитающего,включающему введение указанному млекопитающему терапевтически эффективного количества N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамина, предпочтительно в форме полиморфа В гидрохлорида, и фармацевтически приемлемого носителя. Комбинированная терапия Активное соединение можно применять в виде единственной терапии или можно привлекать одно или несколько других веществ и лечебных средств, таких как сочетания антител как против EGFR, так и против EGF, или сочетание ингибиторов ММР матриксметаллопротеиназ), других тирозинкиназ, включая VEGFR (рецептор сосудистого эндотелиального фактора роста), фарнезил-трансферазы,CTLA4 (цитотоксичный антиген 4 к Т-лимфоцитам) и еrbB2, а также MAb к VEGFr и другие антитела, связанные с раковыми заболеваниями,в том числе, rhuMAb-VEGF, MAb к еrbB2 или кavb3. Таким образом, активное соединение можно применять с одним или несколькими другими противоопухолевыми веществами, например, веществами, выбранными из, например,митотических ингибиторов, например, винбластина; алкилирующих средств, например, цис 19 платина, карбоплатина и циклофосфамида; антиметаболитов, например, 5-фторурацила, цитозинарабинозида и гидроксимочевины, или, например, с одним из предпочтительных антиметаболитов, описываемых в заявке на европейский патент 239362, таким как N-(5-[N-(3,4 дигидро-2-метил-4-оксохиназолин-6-илметил)N-метиламино]-2-теноил)-L-глутаминовая кислота; ингибиторов фактора роста; ингибиторов клеточного цикла; интеркаляционных антибиотиков, например, адриамицина и блеомицина; ферментов, например, интерферона; и антигормонов, например, антиэстрогенов, таких как нольвадекс (тамоксифен), или, например, антиандрогенов, таких как казодекс (4'-циaнo-3(4-фторфенилсульфонил)-2-гидрокси-2-метил 3'-(трифторметил) пропионанилид). По другому варианту воплощения изобретения, соединения изобретения можно вводить в сочетании с антиангиогенезным(и) средством(ами), таким(и) как ингибитор(ы) ММР-2(матрикс-металлопротеиназы-2), ингибитор(ы) ММР-9 (матрикс-металлопротеиназы-9) и/или ингибитор(ы) COX-II (циклооксигеназы II) при способах лечения и в композициях, описанных здесь. В случае комбинированной терапии и фармацевтических композиций, описанных в данном описании, эффективные количества соединения изобретения и химиотерапевтического или другого средства, полезного для ингибирования аномального клеточного роста (например,другого антипролиферативного средства, антиангиогенного средства, ингибитора сигнальной трансдукции или усилителя иммунной системы) могут быть определены специалистами в данной области техники, основываясь на эффективных количествах для соединения, описываемого в данном описании, и соединений, известных или описываемых как химиотерапевтические или другие средства. Составы композиций и способы введения в случае таких лечений и композиций могут основываться на информации, приведенной в данном описании для композиций и способов лечения, включающих соединение данного изобретения в качестве единственного активного средства, и сведения, приведенные для химиотерапевтического или другого средства в сочетании с ним. Изобретение также относится к получению соединений, используемых в способе лечения гиперпролиферативного нарушения у млекопитающего, включающем введение указанному млекопитающему терапевтически эффективного количества гидрохлорида N-(3-этинилфенил)6,7-бис(2-метоксиэтокси)-4-хиназолинамина в сочетании с противоопухолевым средством,выбранным из группы, состоящей из митотических ингибиторов, алкилирующих средств, антиметаболитов, интеркаляционных антибиотиков, ингибиторов факторов роста, ингибиторов клеточного цикла, ферментов, ингибиторов то 005318 20 поизомераз, биомодуляторов, антигормонов и антиандрогенов. Соединения также полезны в качестве радиосенсибилизаторов в случае лечения рака и могут быть соединены с антигормональной терапией. Параметры дополнительной лучевой терапии приводятся, например, в PCT/US 99/10741, опубликованной 25 ноября 1999, в международной публикацииWO 99/60023,включенной в данное описание в качестве ссылки. При таком типе лечения, например, для ингибирования роста опухоли, используют дозу излучения 1-100 Гр предпочтительно в сочетании с, по меньшей мере, 50 мг фармацевтического соединения, при предпочтительной схеме дозирования в течение по меньшей мере 5 дней в неделю в течение примерно двух-десяти недель. Таким образом, данное изобретение также относится к способу ингибирования аномального клеточного роста у млекопитающего, включающему введение млекопитающему количества соединения по изобретению или его фармацевтически приемлемой соли или сольвата или пролекарства в сочетании с лучевой терапией,где количество соединения, его фармацевтически приемлемой соли, сольвата или пролекарства в сочетании с лучевой терапией является эффективным для ингибирования аномального клеточного роста у млекопитающего. Методы обеспечения лучевой терапией известны в технике, и указанные методы можно использовать при комбинированной терапии, описываемой в данном описании. Антиангиогенные средства, такие как ингибиторы ММР-2 (матрикс-металлопротеиназы 2), ингибиторы ММР-9 (матрикс-металлопротеиназы 9) и ингибиторы СОХ-II (циклооксигеназы II), можно применять в сочетании с соединением изобретения в способах и фармацевтических композициях, описываемых в данном описании. Примеры полезных ингибиторовCOX-II включают целебрекс (алекоксиб),вальдекоксиб и рофекоксиб. Примеры полезных ингибиторов матрикс-металлопротеиназ описываются в WO 96/33172 (опубликованной 24 октября 1996), WO 96/27583 (опубликованной 7 марта 1996), заявке на европейский патент 97304971.1 (поданной 8 июля 1997), заявке на европейский патент 99308617.2 (поданной 29 октября 1999), WO 98/07697 (опубликованной 26 февраля 1998), WO 98/03516 (опубликованной 29 января 1998), WO 98/34918 (опубликованной 13 августа 1998), WO 98/34915 (опубликованной 13 августа 1998), WO 98/33768 (опубликованной 6 августа 1998), WO 98/30566(опубликованной 16 июля 1998), публикации европейского патента 606046 (опубликованной 13 июля 1994), публикации европейского патента 931788 (опубликованной 28 июля 1999), WO 90/05719 (опубликованной 31 мая 1990), WO 99/52910 (опубликованной 21 октября 1999), 21(поданной 21 июля 1998), заявке на европейский патент 99302232.1 (поданной 25 марта 1999),заявке на патент Великобритании 9912961.1(поданной 3 июня 1999), предварительной заявке на патент США 60/148464 (поданной 12 августа 1999), патенте США 5863949 (выданном 26 января 1999), патенте США 5861510(выданном 19 января 1999) и публикации европейского патента 780386 (опубликованной 25 июня 1997), которые все включены в данное описание в качестве ссылок. Предпочтительными ингибиторами ММР-2 и ММР-9 являются ингибиторы с незначительной активностью или отсутствием активности ингибирования ММР-1. Более предпочтительными являются ингибиторы, селективно ингибирующие ММР-2 и/или ММР-9 относительно других матриксметаллопротеиназ (т.е. ММР-1, ММР-3, ММР-4,ММР-5, ММР-6, ММР-7, ММР-8, ММР-10,ММР-11, ММР-12 и ММР-13). Некоторыми конкретными примерами ингибиторов ММР, полезных в настоящем изобретении, являются AG-3340, RO 32-3555, RS 130830 и соединения, перечисленные в приведенном далее перечне: 3-4-(4-фторфенокси)бензолсульфонил](1-гидроксикарбамоилциклопентил)амино]пропионовая кислота; гидроксиамид 3-экзо-3-[4-(4-фторфенокси) бензолсульфониламино]-8-оксабицикло[3.2.1] октан-3-карбоновой кислоты; гидроксиамид 22 гидроксиамид 3-эндо-3-[4-(4-фторфенокси) бензолсульфониламино]-8-оксабицикло[3.2.1] октан-3-карбоновой кислоты и гидроксиамид (R)-3-[4-(4-фторфеноси)бензолсульфониламино]тетрагидрофуран-3-карбоновой кислоты; и их фармацевтически приемлемые соли и сольваты указанных соединений. Другие антиангиогенные средства, в том числе, другие ингибиторы СОХ-II и другие ингибиторы ММР, также можно использовать в настоящем изобретении. Соединения настоящего изобретения также можно применять с ингибиторами сигнальной трансдукции, такими как другие средства,которые могут ингибировать реакции EGFR(рецептор эпидермального фактора роста), такие как антитела к EGFR, антитела к EGF и другие молекулы, являющиеся ингибиторами EGFR; ингибиторы VEGF (сосудистый эндотелиальный фактор роста), такие как VEGF-рецепторы и молекулы, которые могут ингибироватьVEGF; и ингибиторы рецептора еrbВ 2, такие как другие органические молекулы или антитела,связывающиеся с еrbВ 2-рецептором, например,герцептин (Genetech, Inc.of South San Francisco, Калифорния, США). Ингибиторы EGFR описываются, например, в WO 95/19970 (опубликованной 27 июля 1995), WO 98/14451 (опубликованной 9 апреля 1998), WO 98/02434 (опубликованной 22 января 1998), а другие соединения описываются в патенте США 5747498 (выданном 5 мая 1998), и такие вещества можно использовать в настоящем изобретении, как описано выше. EGFRингибирующие соединения включают, но не ограничиваются перечисленным, моноклональные антитела С 225 и анти-EGFR 22Mab (ImClone Systems Incorporated of New York, НьюЙорк, США), соединения ZD-1839 (AstraWhitehouse Station, Нью-Джерси, США),VRCTC-310 (Ventech Research) и слитый с EGF токсин (Seragen Inc. of Hopkinton, Массачусетс). Указанные и другие EGFR-ингибирующие вещества можно использовать в настоящем изобретении. Ингибиторы VEGF, например, SU-5416 иSU-6668 (Sugen Inc. of South San Francisco, Калифорния, США), также можно сочетать с соединением настоящего изобретения. Ингибиторы VEGF описываются, например, в WO 99/24440 (опубликованной 20 мая 1999), международной заявке PCT/IB99/00797 (поданной 3 мая 1999), в WO 95/21613 (опубликованной 17 августа 1995), WO 99/61422 (опубликованной 2 декабря 1999), патенте США 5834504 (выданном 10 ноября 1998), WO 98/50356 (опубликованной 12 ноября 1998), патенте США 5883113WO 98/02437 (опубликованной 22 января 1998),которые все внесены в данное описание в качестве ссылок. Другими примерами некоторых специфических ингибиторов VEGF, полезных для настоящего изобретения, являются IM862(Cytran Inc. of Kirkland, Вашингтон, США); моноклональные антитела против VEGF от Genetech, Inc. of South San Francisco, Калифорния; и ангиозим-синтетический рибозим от RibozymeVEGF можно использовать в настоящем изобретении, как описано в описании. Кроме того, с соединением изобретения можно соединять ингибиторы еrbВ 2-рецептора,такие как GW-282974 (Glaxo Wellcome plc), и моноклональные антитела AR-209 (AronexWO 98/02434 (опубликованной 22 января 1998),WO 99/35146 (опубликованной 15 июля 1999),WO 99/35132 (опубликованной 15 июля 1999),WO 98/02437 (опубликованной 22 января 1998),WO 97/13760 (опубликованной 17 апреля 1997),WO 95/19970 (опубликованной 27 июля 1995),патенте США 5587458 (выданном 24 декабря 1996) и патенте США 5877305 (выданном 2 марта 1999), которые все включены в данное описание в качестве ссылок. Ингибиторы еrbВ 2 рецептора, полезные для настоящего изобретения, также описываются в предварительной заявке на патент США 60/117341, поданной 27 января 1999, и в предварительной заявке на патент США 60/117346, поданной 27 января 1999, которые обе включены в данное описание в качестве ссылок. Соединения-ингибиторы рецептора еrbВ 2 и вещества, описанные в вышеуказанных заявках РСТ, патентах США и предварительных заявках на патент США, как и другие соединения и вещества, ингибирующие еrbВ 2-рецептор, можно применять с соединением настоящего изобретения согласно настоящему изобретению. Соединение изобретения также можно применять с другими средствами, полезными при лечении аномального клеточного роста или рака, в том числе, но не только с ними, со средствами, способными усиливать противоопухолевые иммунные реакции, такими как антитела к CTLA4 (цитотоксический антиген 4 к лимфоцитам), и другими средствами, способными блокировать CTLA4; и антипролиферативными средствами, такими как ингибиторы фарнезилпротеинтрансферазы. Специфичные к CTLA4 24 антитела, которые можно использовать в настоящем изобретении, включают антитела, описываемые в предварительной заявке на патент США 60/113647 (поданной 23 декабря 1998),включенной в данное описание в качестве ссылки, однако, в настоящем изобретении можно использовать и другие антитела к CTLA4. Такого совместного лечения можно достигнуть путем одновременного, последовательного или раздельного дозирования отдельных компонентов лечения. Ожидается, что соединение изобретения может придать аномальным клеткам большую чувствительность к лечению облучением с целью уничтожения и/или подавления роста таких клеток. Соответственно, данное изобретение также относится к способу сенсибилизации аномальных клеток у млекопитающего при лечении облучением, включающему введение млекопитающему количества соединения изобретения,его фармацевтически приемлемой соли, сольвата или пролекарства, эффективного для сенсибилизации аномальных клеток при лечении облучением. Количество соединения, соли, сольвата или пролекарства в данном способе можно определить согласно способу установления эффективных количеств соединения изобретения,описанному в данном описании. Целью изобретения также являются содержащие радиоизотопы соединения, идентичные вышеописанному соединению изобретения,но в которых один или несколько атомов заменены атомом с атомной массой или массовым числом, отличающимися от атомной массы или массового числа, обычно обнаруживаемых в природе. Примеры изотопов, которые можно вводить в соединение изобретения, включают изотопы водорода, углерода, азота и кислорода,такие как 2H, 3H, 13 С, 14 С, 15N, 18 О и 17 О, соответственно. Соединения настоящего изобретения и фармацевтически приемлемые соли указанных соединений, содержащие вышеуказанные изотопы и/или другие изотопы других атомов, входят в объем данного изобретения. Некоторые содержащие радиоизотопы соединения настоящего изобретения, например, соединения, в которые включены радиоактивные изотопы, такие как 3H и 14 С, полезны при анализах разрушения тканей лекарственным средством и/или субстратом. Изотопы трития, т.е. 3H, и углерода-14,т.е. 14 С, особенно предпочтительны по причине легкости их получения и обнаружения. Кроме того, замещение более тяжелыми изотопами,такими как дейтерий, т.е. 2H, может дать некоторые лечебные преимущества, являющиеся результатом большей метаболической устойчивости, например, повышенное время полужизниin vivo или потребность в пониженной дозировке, и, следовательно, может быть предпочтительным при некоторых обстоятельствах. Содержащие радиоизотопы соединения данного 25 изобретения, как правило, можно получить процедурами, описанными в способах и/или примерах, приведенных ниже, и заменой легкодоступным содержащим радиоизотоп реагентом реагента, не содержащего радиоизотоп, с использованием способов, хорошо известных в технике. Соответственно, ссылка на соединение изобретения для применения в способах лечения и фармацевтических композициях, описанных ниже, также охватывает формы соединения,содержащие радиоактивные изотопы. Гидрохлорид [6,7-бис(2-метоксиэтокси)хиназолин-4-ил]-(3-этинилфенил)амина, предпочтительно устойчивую форму полиморфа В, как правило, применяют в дозах 1-7000 мг/сутки,предпочтительно 5-2500 мг/сутки, наиболее предпочтительно 5-200 мг/сутки, в случае любого из описанных выше видов лечения. К пациентам, которых можно лечить соединением изобретения, одним или в сочетании,относятся, например, пациенты, которым поставлен диагноз как имеющим, например, псориаз, ВРН, рак легких, рак костей, рак поджелудочной железы, рак кожи, рак головы и шеи,кожную или внутриглазную меланому, рак яичников, рак прямой кишки, рак анальной области, рак желудка, рак толстой кишки, рак молочной железы, гинекологические опухоли (например, саркому матки, рак маточных труб, рак эндометрия, рак шейки матки, рак влагалища или рак вульвы), болезнь Ходжкина, рак пищевода, рак тонкой кишки, рак эндокринной системы (например, рак щитовидной железы, паращитовидной железы или надпочечников),саркому мягких тканей, рак уретры, рак полового члена, рак предстательной железы, хронический или острый лейкоз, твердые опухоли у детей, лимфоцитарную лимфому, рак мочевого пузыря, рак почек или мочеточника (например,почечно-клеточный рак, рак почечных лоханок) или неоплазму центральной нервной системы(например, первичную лимфому ЦНС, спинальные осевые опухоли, глиомы ствола мозга или аденомы гипофиза). Активность Активность in vitro соединений настоящего изобретения при ингибировании рецепторной тирозинкиназы (и, таким образом, последующей пролиферативной реакции, например, рака) можно определить при помощи следующих процедур. Активность соединений настоящего изобретения, in vitro, можно определить по степени ингибирования фосфорилирования экзогенного субстрата (например, Lys3-гастрина или статистического сополимера полиGLuТyr (4:1) (I.(1992 на тирозине с помощью киназы рецептора эпидермального фактора роста испытываемым соединением по сравнению с контролем. Аффинный очищенный растворимый EGFрецептор человека (96 нг) получают согласноEGF (2 мкг/мл) в буфере для фосфорилирования с добавлением ванадата (РВV:500 мM HEPES,рН 7,4; 125 мМ NaCl; 24 мМ MgCl2; 100 мкМ ортованадата натрия) в общем объеме 10 мкл в течение 20-30 мин при комнатной температуре. Испытываемое соединение, растворенное в диметилсульфоксиде (ДМСО), разводят в PBV, и 10 мкл смешивают со смесью EGFpeuenrop/EGF, и инкубируют в течение 10-30 мин при 30 С. Реакцию фосфорилирования инициируют, добавляя 20 мкл смеси 33 РАТР/субстрат (120 мкМ Lys3-гастрина (последовательность в однобуквенном коде для аминокислот KKKGPWLEEEEEAYGWLDF), 50 мМHepes, pH 7,4, 40 мкМ АТР, 2 мкКи -[33P]-ATP) к смеси EGF-p/EGF, и проводят инкубацию в течение 20 мин при комнатной температуре. Реакцию останавливают, добавляя 10 мкл раствора для прекращения реакции (0,5 М ЭДТК,pH 8; 2 мМ АТР) и 6 мкл 2 н НСl. Пробирки центрифугируют при 14000 об/мин, 4 С, в течение 10 мин. Отбирают пипеткой по 35 мкл супернатанта из каждой пробирки на 2,5 см кружок бумаги Whatman P81, объем промывают четыре раза 5% уксусной кислотой по 1 л на промывку и затем сушат на воздухе. В результате субстрат связывается с бумагой с потерей свободного АТР при промывке. С помощью жидкостного сцинтиляционного счетчика измеряют количество включенного [33P]. Включение в отсутствие субстрата (например, Lys3-гастрина) вычитают изо всех величин как фон, и вычисляют ингибирование в процентах относительно контрольных образцов, где испытываемое соединение не присутствует. Такие анализы, осуществленные с рядом доз испытываемых соединений, позволяют определить приближенное значение IC50 для ингибирования in vitro EGFR-киназной активности. Другие способы определения активности соединений настоящего изобретения описываются в патенте США 5747498, включенном в данное описание в качестве ссылки. Фармацевтические композиции Фармацевтические композиции могут находиться, например и наиболее предпочтительно, в форме, подходящей для орального введения, такой как таблетка, капсула, пилюля, порошок, композиций с отсроченным высвобождением, раствора и суспензии. Менее предпочтительными (причем предпочтительной формой в случае формы мезилата) являются композиции для парентеральной инъекции, такие как стерильный раствор, суспензия или эмульсия, для местного введения в виде мази или крема или для ректального введения в виде суппозитория. Фармацевтическая композиция может нахо 27 диться в единичных лекарственных формах,подходящих для однократного введения определенных дозировок. Фармацевтическая композиция будет включать обычный фармацевтический носитель или эксципиент и соединение по изобретению в качестве активного ингредиента. Кроме того,композиция может содержать другие лечебные или фармацевтические средства, носители, адъюванты и т.п. Примеры форм для парентерального введения включают растворы или суспензии активных соединений в стерильных водных растворах, например, водных растворах пропиленгликоля или декстрозы. Такие лекарственные формы, при необходимости, можно забуферить подходящим образом. Подходящие фармацевтические носители включают инертные разбавители или наполнители, воду и различные органические растворители. Фармацевтические композиции, при необходимости, могут содержать дополнительные ингредиенты, такие как ароматизаторы, связующие вещества, эксципиенты и т.п. Так, в случае орального введения можно использовать таблетки, содержащие различные эксципиенты,такие как лимонная кислота, вместе с различными дезинтегрантами, такими как крахмал,альгиновая кислота и некоторые сложные силикаты, и со связующими веществами, такими как сахароза, желатин и гуммиарабик. Кроме того,для целей таблетирования часто полезны смазывающие вещества, такие как стеарат магния,лаурилсульфат натрия и тальк. Твердые композиции подобного типа также можно использовать для наполнения мягких и твердых желатиновых капсул. Предпочтительные вещества для этого включают лактозу или молочный сахар и высокомолекулярные полиэтиленгликоли. Когда для орального введения требуются водные суспензии или эликсиры, активное соединение можно объединять с различными подслащивающими агентами или ароматизаторами, окрашивающими веществами или красителями и,при необходимости, с эмульгаторами или суспендирующими веществами, вместе с разбавителями, такими как вода, этанол, пропиленгликоль, глицерин или их сочетания. Кроме того,соединение изобретения также можно вводить местно, и это можно осуществить с помощью кремов, желе, гелей, паст, мазей и т.п. согласно обычной фармацевтической практике. Соединение изобретения также можно вводить млекопитающему, иному, чем человек. Дозировка для введения млекопитающему будет зависеть от вида животного и болезни или нарушения, которые необходимо лечить. Соединение можно вводить животным в форме капсулы, болюса, таблетки или жидкой композиции для вливания в ротовую полость. Соединение также можно вводить животным путем инъекции или в виде имплантата. Такие композиции 28 получают обычными способами согласно стандартной ветеринарной практике. В качестве альтернативы, соединение можно вводить с кормом для животного, и для указанной цели можно получить концентрированную кормовую добавку или премикс для смешивания с обычным кормом для животного. Способы получения различных фармацевтических композиций с определенным количеством активного соединения известны или будут очевидны для специалистов в данной области техники. Для примера см. Remington's Pharmaceutical Sciences, Mack Publishing Company,Easter, Pa., 15th Edition (1975). Введение и дозировка Введение соединений настоящего изобретения (далее "активного(ых) соединения(ий)" можно осуществить любым способом, обеспечивающим доставку соединений к месту действия. Такие способы включают, предпочтительно, оральные способы, например, введение в форме таблеток, интрадуоденальные способы,парентеральная инъекция (в том числе, внутривенная, подкожная, внутримышечная, внутрисосудистая инъекция или инфузия), местное и ректальное введение. Хотя обычно предпочтительно парентеральное введение, для гидрохлорида полиморфа В предпочтительно оральное введение. Количество вводимого активного соединения будет зависеть от субъекта, которого лечат,тяжести нарушения или состояния, способа введения и предписаний лечащего врача. Однако,эффективная дозировка находится в интервале от примерно 0,001 до примерно 100 мг на кг массы тела в сутки, предпочтительно от примерно 1 до примерно 35 мг/кг/сутки, в однократной или разделенной дозах. Для человека массой 70 кг это будет составлять от примерно 0,05 до примерно 7 г/сутки, предпочтительно от примерно 0,2 до примерно 2,5 г/сутки. В некоторых случаях уровни дозировки меньше нижнего предела вышеуказанного интервала могут быть более чем достаточны, в то время как в других случаях можно использовать еще более высокие дозы, без вызывания какого-либо вредного побочного действия, при условии, что такие более высокие дозы сначала делят на несколько небольших доз для введения на протяжении дня. Гидрохлорид [6,7-бис(2-метоксиэтокси)хиназолин-4-ил]-(3-этинилфенил)амина, предпочтительно устойчивая форма полиморфа В, в дозах 1-7000 мг/сутки, предпочтительно 5-2500 мг/сутки, наиболее предпочтительно 5-200 мг/сутки, также полезен для лечения пациентов(что определяют, например, по возрастающему времени жизни) путем использования комбинированных терапий, например, при NSCLC(IIIb/V) как 1-й курс лечения вместе с карбоплатином/паклитакселом или гемцитабином/цисплатином, при NSCLC (IIIb/V) как 2-й курс ле 29 чения вместе с таксотером, и при раковых болезнях головы и шеи как 2-й курс лечения с метотрексатом для пациентов, невосприимчивых к 5FU/цисплатину. Гидрохлорид [6,7-бис(2-метоксиэтокси)хиназолин-4-ил]-(3-этинилфенил)амина, предпочтительно устойчивая форма полиморфа В, в дозах 1-7000 мг/сутки, предпочтительно 5-2500 мг/сутки, наиболее предпочтительно 5-200 мг/сутки, также полезен для лечения пациентов в других состояниях, в том числе, с раком поджелудочной железы, с или без одновременного лечения гемцитабином, как первый курс лечения, в случае рака почки, рака желудка, рака предстательной железы, колоректального рака(например, как 2-й курс лечения для пациентов,лечение которых 5FU/LCV/иринотеканом потерпело неудачу), а также печеночноклеточного рака, рака мочевого пузыря, головного мозга, яичников, молочной железы и цервикального рака. В случае такого лечения, у пациентов с запущенным, неподдающимся лечению заболеванием эффективность лечения легко проконтролировать по возросшей интенсивности реакции, увеличивающемуся времени развития заболевания или по увеличению времени жизни. Гидрохлорид [6,7-бис(2-метоксиэтокси)хиназолин-4-ил]-(3-этинилфенил)амина, предпочтительно устойчивую форму полиморфа В, как правило, применяют в дозах 1-7000 мг/сутки,предпочтительно 5-2500 мг/сутки, наиболее предпочтительно 5-200 мг/сутки, в случае любого из описанных выше видов лечения. Примеры и препараты, приведенные ниже,дополнительно иллюстрируют и дают примеры соединений настоящего изобретения и способов получения таких соединений. Данное изобретение можно лучше понять с помощью подробностей экспериментов, приведенных далее. Однако специалисту в данной области будет понятно,что конкретные способы и обсуждаемые результаты только иллюстрируют изобретение, которое полностью описано в формуле изобретения,приведенной далее. Подробности экспериментов Пример 1. Получение соединения формулы 4. Реакция 30 Диметилформамид Метиленхлорид 50% раствор гидроксида натрия Гептан Описанная далее процедура является примером процедуры, которой следуют при синтезе соединения формулы 4. В чистый сухой футерованный стеклом сосуд в атмосфере азота загружают 88,0 кг соединения формулы 3, 880,0 л метиленхлорида и 11,0 кг диметилформамида. К смеси добавляют 89 кг тионилхлорида, поддерживая температуру смеси во время загрузки при t ниже 30 С. Затем содержимое реакционного сосуда нагревают в течение минимум пяти часов при температуре образования флегмы перед тем, как отобрать образцы для контроля завершения реакции, и доводят рН до 7,0-8,0, используя 50% растворNaOH в нужном количестве, и поддерживают температуру реакционной смеси при ниже 25 С. Двухфазную смесь перемешивают в течение пятнадцати-двадцати минут и оставляют отстаиваться минимум на тридцать минут. Слои разделяют, и органический слой концентрируют до 1/3 его объема, удаляя метиленхлорид. Добавляют 880 л гептана, и продолжают отгонку оставшегося метиленхлорида до тех пор, пока температура дистиллята не достигнет 65-68 С. Затем смесь охлаждают до 10-15 С в течение 5 часов и гранулируют в течение минимум 1 часа,выделяя твердое вещество фильтрацией и промывая его 220 л гептана. Твердое вещество (соединение формулы 4) сушат в вакуумной сушилке при 45-50 С. Пример 2. Альтернативное получение соединения формулы 4. В реакции, указанной в примере 1, можно успешно использовать бикарбонат натрия вместо гидроксида натрия, как показано в данном примере. Кол-во Тионилхлорид При синтезе соединения формулы 4 используют вещества, перечисленные далее. Еди- ЭквиваленВещества Кол-во ницы ты/объемы Соединение 1 эквива 88,0 кг формулы 3 лент 2,5 эквиваТионилхлорид 89,0 кг лента В чистый сухой футерованный стеклом сосуд в атмосфере азота загружают 30,0 кг соединения формулы 3, 300,0 л метиленхлорида и 3,75 кг диметилформамида. К смеси добавляют 36,4 кг тионилхлорида, поддерживая температуру смеси во время загрузки при t ниже 30 С. Затем содержимое реакционного сосуда нагревают в течение минимум 13 ч при температуре образования флегмы перед тем, как отобрать образцы для контроля завершения реакции. Реакционную смесь охлаждают до 20-25 С, и медленно при перемешивании добавляют раствор 64,2 кг бикарбоната натрия в 274 л воды, охлажденный до 4 С, таким образом, что температура сохраняется при t ниже 10 С. Конечный рН смеси доводят до 7,0-8,0, используя 50% раствор NaOH в нужном количестве. Двухфазную смесь перемешивают в течение пятнадцатидвадцати минут и оставляют отстаиваться минимум на тридцать минут при 10-20 С. Слои разделяют, и органический слой концентрируют до 1/3 его объема, удаляя метиленхлорид. Добавляют 375 л гептана, и продолжают отгонку оставшегося метиленхлорида до тех пор, пока температура дистиллята не достигнет 65-68 С. Затем смесь охлаждают до 0-5 С в течение 4 ч и гранулируют в течение минимум 1 ч, причем твердое вещество выделяют фильтрацией и промывают его 90 л гептана. Твердое вещество (соединение формулы 4) сушат в вакуумной сушилке при 45-50 С. Пример 3. Получение соединения формул 6 и 2 (стадия 2). Реакция Для синтеза соединения формулы 6 как промежуточного соединения и соединения формулы 2 используют перечисленные далее вещества. Вещества 32 Вспомогательная фильтрующая присадка Соединение формулы 4 Ацетонитрил Пример 4. Получение соединения формулы 2. Приведенная далее процедура является примером процедуры синтеза соединения формулы 2 и промежуточного соединения формулы 6. В чистый сухой реакционный сосуд в атмосфере азота загружают 61,1 кг соединения формулы 5, 4,5 кг гидроксида натрия (гранулы) и 489 л толуола, и доводят температуру реакционной смеси до 105-108 С. Удаляют ацетон перегонкой при атмосферном давлении в течение четырех часов, добавляя толуол для поддержания минимального объема в 6 л растворителя на кг соединения формулы 5. Затем реакционную смесь кипятят при температуре флегмы с возвратом дистиллята в реактор до завершения реакции. Затем реакционную смесь охлаждают до 20-25 С, и затем в реакционную смесь загружают суспензию из 40,0 л толуола и 0,5 кг вспомогательной фильтрующей присадки, и смесь энергично перемешивают в течение 10-15 минут. Полученное вещество фильтруют для удаления фильтрующей присадки, и остаток на фильтре промывают 30 л толуола (соединение формулы 6). Фильтрат (соединение формулы 6) помещают в чистый сухой реакционный сосуд в атмосфере азота, и в реакционный сосуд загружают 90,8 кг соединения формулы 4 вместе с 732 л ацетонитрила. Содержимое реакционного сосуда нагревают до температуры образования флегмы и тщательно перемешивают. Скорость перемешивания уменьшают, когда появляется твердое вещество. Когда реакция завершится,содержимое реакционного сосуда охлаждают до 19-25 С в течение трех-четырех часов, и содержимое перемешивают в течение по меньшей мере одного часа при температуре 20-25 С. Затем твердое вещество (соединение формулы 2,форма полиморфа А, или смесь полиморфов А и В) выделяют фильтрацией, и остаток на фильтре промывают двумя 50-л порциями ацетонитрила и сушат в вакууме при температуре 40-45 С. Обнаружено, что получению полиморфа А способствует снижение количества ацетонитрила относительно толуола, и, в частности, благоприятно использовать изопропанол вместо ацетонитрила. Однако применение изопропанола или других спиртов в качестве сорастворителей неблагоприятно из-за предрасположенности к образованию простой эфирной связи между спиртовым кислородом и углеродом-4 хиназо 33 лина вместо требуемой этинилфениламиногруппы. Также обнаружено, что доведение рН реакционной смеси до величины между рН 1 и рН 7, предпочтительно, между рН 2 и рН 5, более предпочтительно, между рН 2,5 и рН 4, наиболее предпочтительно, до рН 3, будет улучшать скорость реакции. Пример 5. Перекристаллизация соединения формулы 2 (которое может представлять собой форму полиморфа А или смесь полиморфов А и В) в полиморф В (стадия 3). Реакция При превращении полиморфа А (или смесей полиморфов А и В) в полиморф В соединения формулы 2 используются указанные далее вещества. Едини- ЭквиваленВещества Кол-во цы ты/объемы Полиморф А 117,6 кг 1 эквивалент(Формула 2) Этанол 2 В 1881,6 л 16 л/кг Вода 470,4 л 4 л/кг Приведенная далее процедура является примером процедур, используемых для превращения полиморфа А (или смесей полиморфов А и В) в термодинамически более устойчивый полиморф В соединения формулы 2. В чистый сухой реактор в атмосфере азота загружают 117,6 кг полиморфа А (или смеси полиморфов А и В) вместе со 1881,6 л этанола 2 В и 470,4 л воды. Температуру доводят до образования флегмы (80 С), и смесь перемешивают до тех пор, пока твердое вещество не растворится. Раствор охлаждают до 65-70 С и очищают фильтрацией. При низкой скорости перемешивания раствор охлаждают еще до 5060 С в течение минимум 2 ч, и выпавший осадок гранулируют в течение 2 ч при указанной температуре. Затем смесь охлаждают до 0-5 С в течение минимум 4 ч и гранулируют в течение минимум 2 ч при указанной температуре. Твердое вещество (полиморф В) выделяют фильтрацией и промывают по меньшей мере 100 л этанола 2 В. Определяют, что твердое вещество представляет собой кристаллическую форму полиморфа В гидрохлорида [6,7-бис(2-метоксиэтокси)хиназолин-4-ил]-(3-этинилфенил)амина,по существу свободного от полиморфа А. Твердое вещество, полученное таким способом,представляет собой по существу однородные кристаллы формы полиморфа В, относительно формы полиморфа Д. Способ позволяет получать полиморф В в количестве по меньшей мере 70 мас.%, по меньшей мере 80 мас.%, по меньшей мере 90 мас.%, по меньшей мере 95 мас.% и по меньшей мере 98 мас.% относительно массы полиморфа А. Следует иметь в виду, что описанные здесь способы являются только приме 005318 34 рами и не предназначаются для исключения изменений вышеуказанных параметров, которые позволяют получать полиморф В с изменением грануляции и выходов согласно требуемым хранению, обращению и применениям соединения. Твердое вещество сушат в вакууме при температуре ниже 50 С, и полученный продукт измельчают, и получают полиморф В в пригодной для применения форме. Пример 6. Клинические исследования с применением лечения устойчивой формой полиморфа В гидрохлорида [6,7-бис(2-метоксиэтокси)хиназолин-4-ил]-(3-этинилфенил)амина. Устойчивая форма полиморфа В гидрохлорида [6,7-бис(2-метоксиэтокси)хиназолин-4 ил]-(3-этинилфенил)амина является сильным,селективным и орально активным ингибитором рецептора эпидермального фактора роста(EFGR) протеинтирозинкиназы онкогена, связанного с аберрантным ростом, характеризующим раковые клетки. Указанное соединение оценивают при клинических испытаниях на здоровых добровольцах и на больных раком,для того, чтобы оценить его профиль безопасности и эффективность. Клинические исследования стадии I Клинические исследования стадии I устойчивой формы полиморфа В гидрохлорида [6,7 бис(2-метоксиэтокси)хиназолин-4-ил]-(3-этинилфенил)амина эффективно осуществлены сначала на добровольцах, а затем на больных раком, при однократных дозах в интервале 25200 мг/сутки или 100-1600 мг/неделю. Результаты таких исследований показали отсутствие вредного действия, превышающего умеренное по тяжести в случае дозы 150 мг/сутки. При исследовании по схеме ежедневного приема доза 200 мг/сутки была ограничена по токсичности из-за диареи. Такое побочное действие эффективно регулируется при уровне дозы 150 мг ежедневно с использованием лоперамида (имодиума). Другим наблюдаемым при таких исследованиях вредным действием, и наиболее заметным токсическим действием при дозе 150 мг ежедневно, были мономорфные высыпания,напоминающие угри, аналогичные сообщениям о действии при клинических испытаниях других средств, ингибирующих EGFR. Указанные высыпания отмечались "выше пояса", в том числе,на лице, волосистой части головы, шее, руках,грудной клетке и спине. Высыпания имеют уникальную гистопатологию инфильтрации PMN с легкой эпидермальной гиперпролиферацией. Это не связано с гиперчувствительностью к лекарственным средствам, и, оказывается, "не называется" дерматологическим состоянием. Такие высыпания не стали существенной помехой для пациентов, находящихся на испытаниях стадии II. Устойчивую форму полиморфа В гидрохлорида [6,7-бис(2-метоксиэтокси)хиназолин 4-ил]-(3-этинилфенил)амина испытывали в целом на 290 пациентах на стадии I и перешедших 35 на испытания стадии II, и демонстрируется профиль безопасности с хорошей переносимостью. Кроме того, при исследованиях стадии I наблюдают предварительные доказательства эффективности. Например, при исследовании на стадии I 28 пациентов 8 пациентов оставались живыми свыше года после обследования после лечения, и 12 пациентов оставались живыми в течение 9-22 месяцев. Для того, чтобы установить подходящий профиль безопасности, устойчивую форму полиморфа В гидрохлорида [6,7-бис(2-метоксиэтокси)хиназолин-4-ил]- (3-этинилфенил) амина также применяют при дозах 1-7000 мг/сутки,предпочтительно 5-2500 мг/сутки, наиболее предпочтительно 5-200 мг/сутки, при комбинированных клинических исследованиях стадии I с одним или несколькими другими лекарственными средствами или видами лечения, выбранными, предпочтительно, из одной из следующей группы: таксол, гемцитабин, таксотер, капцитабин, 5FU, цисплатин, темозоломид, лучевая терапия и химиолучевая терапия. Клинические исследования стадии II и стадии III Инициируют три исследования стадии II с одним средством устойчивой формой полиморфа В гидрохлорида[6,7-бис(2-метоксиэтокси)хиназолин-4-ил]-(3-этинилфенил)амина при неподдающемся лечению немелкоклеточном раке легких, запущенном раке головы и шеи и неподдающемся лечению раке яичников,при ежесуточной дозе 150 мг. Признаки противоопухолевой активности одного агента для устойчивой формы полиморфа В гидрохлорида[6,7-бис(2-метоксиэтокси)хиназолин-4-ил]-(3-этинилфенил) амина обнаруживают у пациентов с запущенными раковыми заболеваниями при нескольких различных видах опухолей. Например, начальные результаты показывают, что устойчивая форма полиморфа В гидрохлорида[6,7-бис-(2 метоксиэтокси)хиназолин-4-ил]-(3-этинилфенил)амина является хорошо переносимым оральным лечебным средством, которое активно в виде монотерапии, когда его назначают пациентам с запущенным раком головы и шеи. По предварительным результатам 3 пациента имели объективные частичные реакции, в то время как у других 9 пациентов имелись доказательства стабилизации у них состояния болезни. О высыпаниях, напоминающих угри, которые несомненно характерны для всех ингибиторовEGFR, проходящих клинические испытания, в данном исследовании сообщается приблизительно для 70% пациентов в первой группе. Начальные результаты, получающиеся на 48 пациентах исследования стадии II при неподдающемся лечению немелкоклеточном раке легких (NSCLC) также показывают эффективность лечения устойчивой формой полиморфа В гидрохлорида [6,7-бис(2-метоксиэтокси)хина 005318 36 золин-4-ил]-(3-этинилфенил)амина, как единственным лекарственным противораковым средством в отношении NSCLC. При исследовании первых 19 пациентов, состояние которых оценивали, 5 имели объективные частичные реакции, в то время как другие 4 пациента показали факт стабилизации у них состояния болезни. Частичные реакции наблюдают у двух пациентов, которых ранее лечили по двум и трем разным схемам химиотерапии. Таким образом, оказывается, что устойчивая форма полиморфа В гидрохлорида [6,7-бис(2-метоксиэтокси)хиназолин-4-ил]-(3-этинилфенил)амина является хорошо переносимым оральным лечебным средством, активным при немелкоклеточном раке легких. Квалификационные критерии в случае исследования с произвольно меченным единственным веществом требуют пациентов, которым назначается химиотерапия на основе платины, и имеющих опухоли, гистопатология которых подтверждает, что указанные опухоли EGFRположительны. Первостепенной конечной точкой в исследовании является реакция, указывающая на стабилизацию заболевания, и скорость развития болезни среди второстепенных результатов. Доказательства противоопухолевой активности также можно увидеть на пациентах с раком яичников при продолжающемся исследовании стадии II. По предварительным результатам у 2 пациентов имелись объективные частичные реакции, в то время как другие 4 пациента показали факт стабилизации у них состояния болезни. Задокументированные доказательства противоопухолевой активности также видны на других типах EGFR-положительных опухолей,включая колоректальный и почечно-клеточный рак, при исследованиях стадии II пациентов со многими типами опухолей. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Однородный кристаллический полиморф гидрохлорида N-(3-этинилфенил)-6,7 бис(2-метоксиэтокси)-4-хиназолинамина,названный полиморфом В, показывающий порошковую рентгенограмму с характеристическими пиками, выраженными в градусах 2-тета, при приблизительно 6,26, 12,48, 13,39, 16,96, 20,20,21,10, 22,98, 24,46, 25,14 и 26,91. 2. Полиморф по п.1, характеризующийся порошковой рентгенограммой, показанной на фиг. 3. 3. Кристаллический полиморф гидрохлорида N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамина, названный полиморфом В, показывающий порошковую рентгенограмму с характеристическими пиками, выраженными в градусах 2-тета, при приблизительно 6,26, 12,48,13,39, 16,96, 20,20, 21,10, 22,98, 24,46, 25,14 и 26,91, свободный от полиморфа А. 37 4. Полиморф по п.3, характеризующийся порошковой рентгенограммой, показанной на фиг. 3. 5. Полиморф по п.3 для использования при лечении аномального клеточного роста клеток,экспрессирующих рецептор эпидермального фактора роста (EGFR), у млекопитающего. 6. Композиция, содержащая кристаллический полиморф гидрохлорида N-(3-этинилфенил)-6,7-бис-(2-метоксиэтокси)-4-хиназолинамина, названный полиморфом В, показывающий порошковую рентгенограмму с характеристическими пиками, выраженными в градусах 2 тета, при приблизительно 6,26, 12,48, 13,39,16,96, 20,20, 21,10, 22,98, 24,46, 25,14 и 26,91, и носитель, причем композиция свободна от полиморфа А. 7. Композиция по п.6, в которой гидрохлорид N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамина показывает порошковую рентгенограмму с характеристическими пиками,выраженными в градусах 2-тета, при приблизительно 8. Композиция по п.6, в которой гидрохлорид N-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамина в форме полиморфа В характеризуется порошковой рентгенограммой,показанной на фиг. 3. 9. Композиция, состоящая из однородного кристаллического полиморфа гидрохлорида N(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4 хиназолинамина в форме полиморфа В, характеризующийся следующими пиками. и по крайней мере одного носителя. 10. Фармацевтическая композиция, содержащая терапевтически эффективное количество 38 полиморфа по п.3 и фармацевтически приемлемый носитель, причем композиция свободна от полиморфа А. 11. Фармацевтическая композиция по п.10,где указанная композиция адаптирована для орального введения. 12. Фармацевтическая композиция по п.11,где указанная композиция находится в форме таблетки. 13. Фармацевтическая композиция по п.10,где терапевтически эффективное количество составляет от 1 до 7000 мг. 14. Фармацевтическая композиция по п.13,где терапевтически эффективное количество составляет от 5 до 2500 мг. 15. Фармацевтическая композиция по п.14,где терапевтически эффективное количество составляет от 100 до 1600 мг. 16. Фармацевтическая композиция по п.14,где терапевтически эффективное количество составляет от 5 до 200 мг. 17. Фармацевтическая композиция по п.16,где терапевтически эффективное количество составляет от 25 до 200 мг. 18. Фармацевтическая композиция, содержащая кристаллический полиморф по п.3 и любой из химиотерапевтического агента и иммунотерапевтического агента, для применения при лечении NSCLC (немелкоклеточного рака легких), злокачественностей у детей, цервикальной и других опухолей, вызываемых или промотируемых вирусом папилломы человека (HPV),рака эндометрия, глиомы, меланомы, изофагита Баррета (предракового синдрома), рака надпочечников, опухолевых кожных болезней или атеросклероза у млекопитающего. 19. Фармацевтическая композиция, содержащая кристаллический полиморф по п.3 и противоопухолевое средство, выбранные из группы, состоящей из митотического ингибитора,алкилирующего средства, антиметаболита, интеркаляционного антибиотика, ингибитора фактора роста, ингибитора клеточного цикла, фермента, ингибитора топоизомеразы, биомодулятора, антигормона и антиандрогена для использования при лечении аномального клеточного роста клеток, экспрессирующих рецептор эпидермального фактора роста (EGFR), у млекопитающего. 20. Фармацевтическая композиция, содержащаяN-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамин или одну из его фармацевтически приемлемых солей в безводной или гидратной формах, и один или оба антитела против EGFR и против EGF, или вещество из группы, состоящей из ингибиторов ММР (матрикс-металлопротеиназы), VEGFR (рецептора сосудистого эндотелиального фактора роста),фарнезилтрансферазы, CTLA4 (цитотоксичного антигена 4 Т-лимфоцитов) и erbB2, MAb кavb3, для применения при лечении NSCLC (не 39 мелкоклеточного рака легких), злокачественностей у детей, цервикальной и других опухолей,вызываемых или промотируемых вирусом папилломы человека (HPV), рака эндометрия,глиомы, меланомы, изофагита Баррета (предракового синдрома), рака надпочечников и рака кожи, аутоиммунных, опухолевых кожных болезней или атеросклероза у млекопитающего. 21. Применение полиморфа по п.3 для изготовления лекарственного средства, полезного для лечения аномального клеточного роста клеток, экспрессирующих рецептор эпидермального фактора роста (EGFR), у млекопитающего. 22. Применение по п.21, где аномальный клеточный рост представляет рак головного мозга, плоскоклеточный рак, рак мочевого пузыря, желудка, поджелудочной железы, рак печени, мультиформную глиобластому, рак молочной железы, головы, шеи, пищевода, предстательной железы, колоректальный рак, рак легких, почечно-клеточный рак, рак почек, яичников, женского полового тракта или щитовидной железы. 23. Применение по п.21, где аномальный клеточный рост представляет немелкоклеточный рак легких (NSCLC), рефракторный рак яичников или рак головы и шеи. 24. Применение по п.21, где лекарственное средство содержит от 1 до 7000 мг полиморфа. 25. Применение по п.24, где лекарственное средство содержит от 5 до 2500 мг полиморфа. 26. Применение по п.25, где лекарственное средство содержит от 100 до 1600 мг полиморфа. 27. Применение по п.25, где лекарственное средство содержит от 5 до 200 мг полиморфа. 28. Применение по п.27, где лекарственное средство содержит от 25 до 200 мг полиморфа. 29. Применение по п.22, где аномальный клеточный рост представляет рак поджелудочной железы. 30. Применение по п.22, где аномальный клеточный рост представляет колоректальный рак. 31. Применение по п.22, где аномальный клеточный рост представляет рак предстательной железы. 32. Применение по п.22, где аномальный клеточный рост представляет рак молочной железы. 33. Применение по п.22, где аномальный клеточный рост представляет рак пищевода. 34. Применение по п.22, где аномальный клеточный рост представляет рак яичников. 35. Применение по п.22, где аномальный клеточный рост представляет мультиформную глиобластому. 36. Применение по п.22, где аномальный клеточный рост представляет рак печени. 37. Применение по п.22, где аномальный клеточный рост представляет рак почек. 40 38. Применение по п.22, где аномальный клеточный рост представляет рак желудка. 39. Применение по п.22, где аномальный клеточный рост представляет рак мочевого пузыря. 40. Применение по п.23, где аномальный клеточный рост представляет немелкоклеточный рак легких (NSCLC). 41. Применение по п.23, где аномальный клеточный рост представляет рак головы и шеи. 42. Применение соединения по п.3 или композиции по п.6 для изготовления лекарственного средства, полезного для лечения опухоли у млекопитающего путем индуцирования дифференциации опухолевых клеток, экспрессирующих рецептор эпидермального фактора роста (EGFR) в опухоли. 43. Применение фармацевтической композиции, содержащей N-(3-этинилфенил)-6,7 бис(2-метоксиэтокси)-4-хиназолинамин или одну из его фармацевтически приемлемых солей в безводной или гидратной формах, для изготовления лекарственного средства, полезного для лечения NSCLC (немелкоклеточного рака легких), злокачественностей у детей, цервикальной и других опухолей, вызываемых или промотируемых вирусом папилломы человека(предракового синдрома) или опухолевых кожных болезней у млекопитающего. 44. Применение кристаллического полиморфа по п.3 и фармацевтически приемлемого носителя для изготовления лекарственного средства, полезного для лечения NSCLC (немелкоклеточного рака легких), злокачественностей у детей, цервикальной и других опухолей,вызываемых или промотируемых вирусом папилломы человека (HPV), рака эндометрия,глиомы, меланомы, изофагита Баррета (предракового синдрома), рака надпочечников, опухолевых кожных болезней или атеросклероза у млекопитающего. 45. Применение по п.43 или 44 для лечения немелкоклеточного рака легких (NSCLC). 46. Применение по п.43 или 44 для лечения рака эндометрия. 47. Применение по п.44 для лечения глиомы. 48. Применение по п.44 для лечения меланомы. 49. Применение N-(3-этинилфенил)-6,7 бис(2-метоксиэтокси)-4-хиназолинамина или одной из его фармацевтически приемлемых солей в безводной или гидратной формах для изготовления лекарственного средства, полезного для ингибирования развития базально- или плоскоклеточного рака кожи в участках, подвергнутых воздействию солнечного излучения,или у лиц с высоким риском заболевания указанным видом рака. 50. Способ получения кристаллического полиморфа гидрохлорида N-(3-этинилфенил) 41 6,7-бис(2-метоксиэтокси)-4-хиназолинамина,названного полиморфом В, который свободен от полиморфа А, включающий стадию перекристаллизации гидрохлорида N-(3-этинилфенил)6,7-бис(2-метоксиэтокси)-4-хиназолинамина в растворителе, содержащем спирт. 51. Способ по п.50, в котором растворитель дополнительно содержит воду. 52. Способ по п.50, в котором гидрохлоридN-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4 хиназолинамина получают посредством сочетания соединения формулы 6 53. Способ по п. 52, в котором указанное соединение формулы 6 получают нагреванием соединения формулы 5 в суспензии щелочи на основе металла в растворителе. 54. Способ по п.52, в котором указанное соединение формулы 4 получают хлорированием соединения формулы 3 55. Способ получения полиморфа В по п.1,включающий стадии а) хлорирования замещением исходного соединения хиназолинамина формулы 3 содержащего гидроксильную группу, с получением соединения формулы 4 посредством его взаимодействия в смеси растворителей тионилхлорида, метиленхлорида и диметилформамида,b) получения соединения формулы 6in situ из исходного соединения формулы 5 нагреванием соединения формулы 5 в суспензии щелочи на основе металла в растворителе;c) взаимодействия соединения формулы 6in situ с соединением формулы 4, где соединение формулы 6 замещает хлор в соединении формулы 4 с образованием гидрохлорида N-(3 этинилфенил)-6,7-бис(2-метоксиэтокси)-4 хиназолинамина;d) перекристаллизации гидрохлорида N-(3 этинилфенил)-6,7-бис(2-метоксиэтокси)-4 хиназолинамина в спирте в форму полиморфа В. 56. Способ по п.55, в котором хлорирование замещением гасят в присутствии водного раствора гидроксида натрия. 57. Способ по п.55, в котором хлорирование замещением гасят в присутствии водного раствора бикарбоната натрия. 58. Способ по п.55, в котором хлорирование замещением гасят в присутствии водного раствора гидроксида калия, водного раствора бикарбоната калия, водного раствора карбоната калия, водного раствора карбоната натрия или их смеси. 59. Способ получения кристаллического полиморфа гидрохлорида N-(3-этинилфенил)6,7-бис(2-метоксиэтокси)-4-хиназолинамина,названного полиморфом В, путем перекристаллизации, включающей стадииb) охлаждения раствора до температуры примерно 65-70 С;d) осаждения полиморфа В путем дальнейшего охлаждения очищенного раствора. 60. Способ получения композиции, содержащей кристаллический полиморф гидрохлоридаN-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамина, названный полиморфом В, показывающий порошковую рентгенограмму с характеристическими пиками, выраженными в градусах 2-тета, при приблизительно 6,26, 12,48,13,39, 16,96, 20,20, 21,10, 22,98, 24,46, 25,14 и 26,91, который свободен от полиморфа А,включающий смешивание кристаллического полиморфа с носителем. 61. Способ по п.60, в котором гидрохлоридN-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4 хиназолинамина в форме полиморфа В характеризуется порошковой рентгенограммой, показанной на фиг. 3. 62. Способ по п.60, в котором носитель представляет собой фармацевтически приемлемый носитель.
МПК / Метки
МПК: C07D 239/04, A61K 31/505
Метки: применения, получения, гидрохлорида, полиморф, n-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамина, фармацевтические, устойчивый, способы
Код ссылки
<a href="https://eas.patents.su/23-5318-ustojjchivyjj-polimorf-gidrohlorida-n-3-etinilfenil-67-bis2-metoksietoksi-4-hinazolinamina-sposoby-ego-polucheniya-i-farmacevticheskie-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Устойчивый полиморф гидрохлорида n-(3-этинилфенил)-6,7-бис(2-метоксиэтокси)-4-хиназолинамина, способы его получения и фармацевтические применения</a>
Следующий патент: Новые оксабиспидиновые соединения, полезные при лечении сердечных аритмий
Случайный патент: Двухбарьерная система для in situ процесса конверсии углеводородов












