Способ получения (+/-) 3 – (3,4 – дихлорфенил) – 2 – диметиламино-2 – метилпропан-1-ола или церикламина (inn)
Формула / Реферат
1. Способ изготовления (+/-)3-(3,4-дихлорфенил)-2-диметиламин-2-метилпропан-1-ола (I) или церикламина, включающий
i) арилирование метакриловой кислоты хлоридом диазония 3,4-дихлоранилина, приготовляемым in situ, с получением (+/-)2-хлор-3-(3,4-дихлорфенил)-2-метилпропионовой кислоты (IV)

ii) аминирование кислоты (IV) амином HNR1R2, где R1 и R2 означают независимо водород или метил, с получением аминокислоты (III)
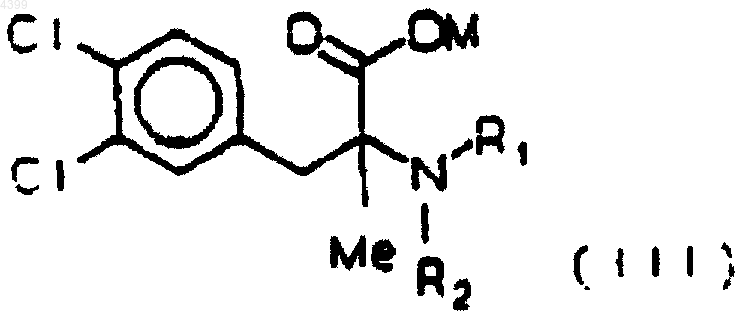
где M означает щелочной или щелочно-земельный металл или еще один водород, R1 и R2 определены как указано выше, затем
iii) этерификацию кислоты (III) и последующее метилирование аминовой группы получаемого сложного эфира формальдегидом и муравьиной кислотой с получением эфира (+/-)3-(3,4-дихлорфенил)-2-диметиламин-2-метилпропионовой кислоты формулы (II)
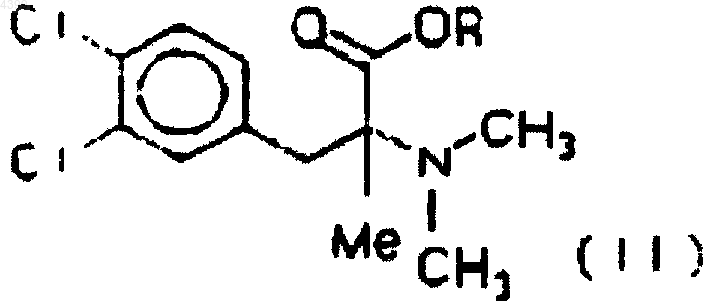
где Me означает метил, a R означает алкил с 1-4 атомами углерода, затем
iv) восстановление эфира (II) металлогидридом или органометаллогидридом с получением (+/-)3-(3,4-дихлорфенил)-2-диметиламин-2-метилпропан-1-ола или церикламина (INN) формулы (I)
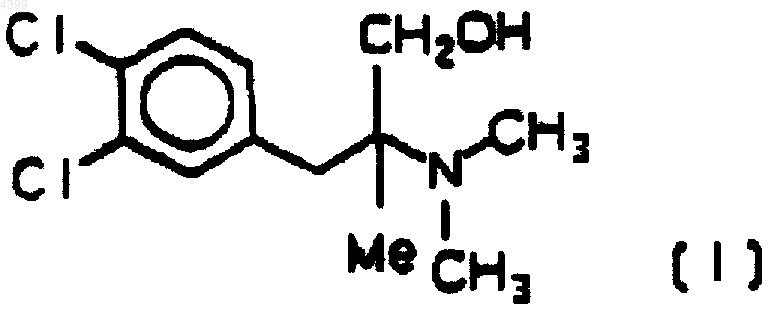
и получение солянокислой соли.
2. Способ по п.1, где хлорид диазония 3,4-дихлоранилина применяют для арилирования в количестве 1 моль вместе с 1,5 моль метакриловой кислоты в присутствии 0,02 моль хлорида меди с получением кислоты (IV).
3. Способ по п.1 или 2, где 1 моль кислоты (IV) аминируют в ацетонитриле, нагревая под давлением при 40шC в течение 15-20 ч с 1 моль соды, и с от 3 до 10 моль диметиламина, с получением аминокислоты (III), где M означает натрий, R1 и R2 оба означают метил.
4. Способ по п.1 или 3, где 1 моль аминокислоты (III) этерифицируют в толуоле диметилсульфатом в количестве от 1,4 до 2,8 моль и затем N-метилируют формальдегидом и муравьиной кислотой, когда в аминокислоте (III) R1 и R2 означают водород, и диметилсульфатом в количестве от 1,2 до 2,0 моль, когда в аминокислоте (III) R1 и R2 означают метил, с получением аминоэфира (II), в котором R, R1 и R2 означают метил.
5. Способ по п.1 или 4, где эминоэфир (II) восстанавливают комплексом алюмогидрида лития и тетрагидрофурана, полученным присоединением тетрагидрофурана к алюмогидриду лития, в среде толуола при мольном соотношении алюмогидрида лития к аминоэфиру, равном примерно (0,57-0,60):1, с получением (+/-)3-(3,4-дихлорфенил)-2-диметиламин-2-метилпропан-1-ола (I), который можно перевести в гидрохлорид.
6. Способ по п.1, где
хлорид диазония 3,4-дихлоранилина применяют в количестве 1 моль для арилирования 1,5 моль метакриловой кислоты в присутствии 0,02 моль хлорида меди, с получением кислоты (IV),
1 моль кислоты (IV) аминируют в ацетонитриле нагревом под давлением при 40шC в течение 15-20 ч с 1 моль соды и 3-10 моль диметиламина, с получением аминокислоты (III), где M означает натрий, а R1 и R2 оба означают метил,
1 моль аминокислоты (III) этерифицируют в толуоле диметилсульфатом в количестве 1,4-2,8 моль и затем N-метилируют формальдегидом и муравьиной кислотой, когда в аминокислоте (III) R1 и R2 означают водород, и диметилсульфатом в количестве 1,2-2,0 моль, когда в аминокислоте (III) R1 и R2 означают метил, с получением аминоэфира (II), где R, R1 и R2 означают метил,
аминоэфир (II) восстанавливают комплексом алюмогидрида лития и тетрагидрофурана, полученным присоединением тетрагидрофурана к алюмогидриду лития, в среде толуола при мольном соотношении алюмогидрида лития к аминоэфиру, равном примерно (0,57-0,60):1, с получением (+/-)3-(3,4-дихлорфенил)-2-диметиламин-2-метилпропан-1-ола (I) или церикламина, который можно перевести в гидрохлорид.
7. Промежуточные соединения, выбранные из группы, включающей (+/-)2-хлор-3-(3,4-дихлорфенил)-2-диметилпропионовую кислоту, (+/-)3-(3,4-дихлорфенил)-2-диметиламин-2-метилпропионовую кислоту и ее натриевую соль, сложный метиловый эфир (+/-)3-(3,4-дихлорфенил)-2-диметиламин-2-метилпропионовой кислоты.
Текст
1 Настоящее изобретение относится к способу получения церикламина (INN), промежуточным соединениям упомянутого способа и их получения. Область применения и уровень техники Церикламин - это (+/-)3-(3,4-дихлорфенил)-2-диметиламино-2-метилпропан-1-ол формулы (I) гидрохлорид которого, как оказалось, является ингибитором освобождения серотонина, с фармакологической точки зрения, и показывает антидепрессантную активность у человека. Получение церикламина подробно описано в патенте ЕР 237 366, опубликованном 16 сентября 1987 г., а также в статье, которая вышла вJ. CHEM. SOC. PERKIN TRANS. I, 1996, стр. 1495-1498. В этих двух документах основным предшественником церикламина является 2 амино-3-(3,4-дихлорфенил)-2-метилпропионовая кислота, которую на первой стадии восстанавливают боргидридом до 2-амино-3-(3,4-дихлорфенил)-2-метилпропан-1-ола - соединения,которое на второй стадии N,N-диметилируют в реакции с формальдегидом и муравьиной кислотой, как показано на схеме 1 далее. Схема 1 На своей первой стадии этот синтез требует применения сильного восстанавливающего агента и определенных энергетических условий для эффективного восстановления карбоксила. Эти условия способствуют протеканию побочных реакций, которые приводят к образованию субпродуктов, особенно путем дегалогенирования, как это было продемонстрировано в J.CHEM. SOC. PERKIN TRANS. I, упомянутом выше, причем удаление этих субпродуктов приводит к снижению выхода основного продукта,а присутствуя в следовых количествах в конечном продукте, они рассматриваются как возможно токсичные примеси с фармакологической точки зрения. Что касается получения 2-амино-3-(3,4 дихлорфенил)-2-метилпропионовой кислоты,основного компонента этих реакций, то патент ЕР 237 366 описывает ее получение в соответствии со способом, описанным в патенте FR 7702360, заключающемся в алкилировании изоцианоэфира формулы СН 3-СН-(NС)-СОOR галогенидом 3,4-дихлорбензила с последующим одновременным гидролизом изоциановой и 2 эфирной группы полученного интермедиата с получением, соответственно, амино- и карбоксильной групп аминокислоты. Этот синтез с лишь большим трудом можно адаптировать к промышленному производству в силу того, что в нем используются коммерчески недоступные реактивы, получить которые можно только с использованием очень сложных способов, в особенности это касается изоцианоэфира. В публикации в J. CHEM. SOC. PERKIN.TRANS. I, 1994, стр. 1495-1498, описан синтез,исходным веществом которого является амидN-бензилиденаланина, который алкилировали 3,4-дихлорбензилхлоридом с получением интермедиата, который подвергали двум последовательным гидролизам: сначала гидролизу Шиффова основания, а затем амида с получением, в результате, аминокислоты. Так же как и в способе, описанном в FR77 02360, основным недостатком этого синтеза является необходимость получения амида Nбензилиденаланина. Для получения этого критического соединения могут быть рассмотрены альтернативные способы. Так, начиная с 1-(3,4-дихлорфенил) пропан-2-она, можно либо посредством реакции Стрекера с получением аминонитрила, гидролизуя который можно получить кислоту, либо, что более применимо, посредством реакции Бюхерера-Берга с получением 5-(3,4-дихлорбензил)5-метилгидантоина, гидролизуя который в щелочной среде также получают кислоту. Этот последний способ может быть легко осуществлен путем минимально адаптированной методики, описанной в патенте ЕР 569 276. Однако эти синтезы зависят от получения 1-(3,4-дихлорфенил)пропан-2-она, который, какой бы способ получения ни рассматривался, принуждает к применению экономически невыгодного многоступенчатого синтеза, начинающегося, например, с 3,4-дихлорбензальдегида, как это описано в Chimie Ther., 3, 1968, стр. 313-320. Для продвижения и коммерциализации церикламина, как фармацевтически активного вещества, предназначенного для лечения депрессии у людей, учитывая современное состояние дел, необходим способ промышленного изготовления, который был бы надежным и имел бы бесспорное экономическое значение. Краткое описание изобретения Порожденное предшествующим опытом,который независимо от способа опирался на сложные исходные соединения, требующие сложных и дорогостоящих способов получения,настоящее изобретение направлено на способ получения церикламина новым путем, требующим всего четырехступенчатого синтеза и использующим в качестве исходных веществ реагенты, имеющиеся в настоящий момент на рынке. Кроме того, этот способ позволяет получать химические интермедиаты, сведения о которых еще не опубликованы. 3 Таким образом, во-первых, целью настоящего изобретения является новый способ изготовления церикламина, а во-вторых - новые химические соединения, которые являются интермедиатами упомянутого способа. Схема 2 Основной целью настоящего изобретения является, как показано на схеме 2 выше, способ изготовления церикламина, состоящий изi) арилирования метакриловой кислоты хлористым диазонием 3,4-дихлоранилина, приготовленным in situ, с получением (+/-)2-хлор-3(3,4-дихлорфенил)-2-метилпропионовой кислоты (IV)HNR1R2, где R1 и R2 означают водород или метил, с получением аминокислоты (III) где М означает щелочной или щелочноземельный металл или водород, а R1 и R2 -как определено выше,iii) этерификации кислоты (III) и затем,при условии, что R1 и/или R2 означают водород,метилировании амина формальдегидом и муравьиной кислотой с получением эфира (+/-)3(3,4-дихлорфенил)-2-диметиламин-2-метилпропионовой кислоты (II) где R означает низший алкил,iv) восстановления эфира (II) металлогидридом или органометаллическим гидридом с получением (+/-)3-(3,4-дихлорфенил)-2-диметиламин-2-метилпропан-1-ола или церикламина(INN) формулы (I) и получения соли с помощью соляной кислоты. Второй целью настоящего изобретения являются химические соединения, представляющие собой интермедиаты упомянутого способа,то есть соединения формулы (V) 4 где А означает диметиламиногруппу или хлор,при условии, что В означает ОН,В означает ОМ, где М означает щелочной или щелочно-земельный металл или водород,или В означает OR, где R означает низший алкильный радикал. Подробное описание изобретения Способ настоящего изобретения позволяет, как было показано, получить церикламин в четырехступенчатом синтезе, где исходным веществом является 3,4-дихлоранилин, что дает бесспорное преимущество в сравнении с синтезами, применявшимися до сих пор. Рассматривая стадии способа более подробно, следует обратить внимание, что первую стадию, которая состоит в получении галогенированной кислоты (IV) путем арилирования метакриловой кислоты диазониевой солью 3,4 дихлоранилина (или 3,4-дихлорбензолдиазониевой солью), проводят в соответствии с реакцией Мирвайна, хорошо задокументированной,особенно в Org. React., 11, 189 (1960) и 24, 225259 (1976). В соответствии с этой реакцией G.(1991 получил метилэфир, соответствующий хлорированному интермедиату (IV) настоящего способа. Этот эфир, будучи включен в способ настоящего изобретения, дал неутешительные результаты на стадии аминирования из-за неконтролируемой нестабильности и/или реактивности, что приводило к образованию смеси соединений, неприменимой в контексте промышленного использования способа. В синтезе настоящего изобретения реакция Мирвайна служит для получения диазониевой соли 3,4-дихлоранилина на первой стадии традиционным способом с помощью нитрита натрия в кислой среде, и затем, на второй стадииin situ, для проведения арилирования метакриловой кислоты, катализируемого металлогалогенидом, выбранным из хлоридов или бромидов кобальта, марганца, или, альтернативно, железа или меди, что предпочтительней. Когда катализатор является бромидом Сu+ или Сu, в результате получается бромированный аналог кислоты (IV); более предпочтительно, однако,проводить диазотизацию в солянокислой среде,тогда арилирование метакриловой кислоты катализируется хлоридом Fe или хлоридом меди, предпочтительно Сu+, с получением 2-хлор 3-арил-2-метилпропионовой кислоты (IV). Практически реакция диазотирования происходит в ацетоне при температуре ниже чем 10 С, используя 3-5 или более кратный избыток предпочтительно 4 М кислоты, по отношению к 3,4-дихлоранилину, и от 1 до 1,5 моль нитрита натрия. Последующее арилирование проводят в избытке 1,25-2 М, предпочтительно 1,5 М, метакриловой кислоты, при добавлении в качестве катализатора 0,05-0,005 моль, предпочтительно 0,02 моль, выбранного металлогалогенида. 5 Вторая стадия способа представляет собой аминирование галогенированной кислоты, а точнее хлорированной кислоты (IV), аминомHNR1R2, где R1 и R2 означают водород или метил. Этот тип реакции описан в основном в работе "Advanced Organic Chemistry" - J. March 3rd Edition (ed. J. Wiley Intersciences), стр. 364 и далее, и состоит, применительно к настоящему изобретению, в реакции амина, выбранного из аммиака, метиламина и диметиламина, с интермедиатом (IV). По причинам чисто практического характера, аммиак и особенно диметиламин являются предпочтительными, поскольку дают возможность проводить реакцию в различных растворителях, выбранных из воды,низших спиртов, низкокипящих галогенированных углеводородов, ароматических углеводородов или, альтернативно, алифатических кетонов или нитрилов, включая особенно ацетон и ацетонитрил, которые являются предпочтительными растворителями. На практике, проведение реакции заключается в растворении или диспергировании интермедиата (IV) в выбранном растворителе или смеси растворителей и добавлении на 1 моль(TV) от 0,1 до 3 моль, более предпочтительно 1 моль, поташа или, предпочтительнее, соды в хлопьях, и, дополнительно, от 0,01 до 0,2 моль так называемого межфазного катализатора, такого как хлорид бензилтриэтиламмония. Выбранный амин вводят в смесь, охлажденную до 0 С, либо в ожиженной форме, либо пробулькивая в виде газа, в количестве от 2 до 100 моль избытка по отношению к (IV). Предпочтительно использовать 30-70 моль избытка, когда применяют аммиак, и 3-10 моль избытка, когда применяют диметиламин. В последнем случае альтернативный путь состоит во введении его в твердом состоянии в форме соли кислоты, такой как гидрохлорид, добавляя при этом эквимолярное количество поташа или соды для получения диметиламина из его соли in situ. Реакцию проводят в герметично закрытом реакторе при перемешивании и температуре от 20 до 80 С в течение от 4 до 48 ч. В предпочтительных условиях реакция завершается нагревом до 30-50 С, предпочтительно до 40 С, через 15-20 ч контакта. Затем реактор охлаждают до 10 С, избыток амина дегазируют пропусканием через соответствующую жидкость, которой может быть вода или низший спирт, после чего реакционную смесь выпаривают с получением остатка, представляющего собой щелочнометаллическую соль искомой аминокислоты(III), где R1 и R2 соответствуют применявшемуся амину, каковую соль либо использовали как есть на следующей стадии способа, если она была достаточно чистой, либо обрабатывали ее с получением кислотной формы путем замещения, растворяя остаток в минимальном объеме воды с последующим подкислением раствора до изоэлектрического значения рН кислоты (III) 6 концентрированной кислотой, такой как соляная или серная, при котором нерастворимая кислота(III) может быть выделена. По причинам практического характера промышленной и экономической природы, предпочтительно, однако, чтобы в следующей стадии способа участвовала щелочно-металлическая соль. Третья стадия способа состоит в этерификации интермедиата (III) в солевой или несолевой форме и затем, дополнительно, N,Nдиметилировать амин, в котором R1 и/или R2 означают водород. Возможны несколько способов этерификации, их обзор можно найти, например, в работе "Advanced Organic Chemistry" J. March - 3rd Edition (ed. J. Wiley Intersciences) стр. 348 и далее. Помимо других, можно использовать реакции с низшими первичными спиртами, такими как метанол, этанол, пропанол или, альтернативно, с вторичными спиртами, такими как изопропанол, путем нагрева кислоты (III) с одним из этих спиртов и обычно используемым катализатором, таким как концентрированная серная кислота, паратолуолсульфоновая кислота или тионилхлорид, или,альтернативно, связывая воду, образующуюся в ходе реакции дегидратирующим агентом, либо посредством азеотропной дистилляции; такие реакции приводят к получению аминоэфиров(II), в которых R означает низший алкил с числом углеродных атомов от 1 до 3. На практике, предпочтительно проведение алкилирования кислоты (III) алкилирующими реагентами формулы W-(R)n, где n имеет значение 1 или 2, R означает метил при значении n 1 или 2, или, когда n означает 2, один из двух радикалов R произвольно может быть водородом,а другой - метилом; W означает радикал типа одновалентного аниона, когда n означает 1, и который может быть галогеном, предпочтительно бромом или хлором, или, альтернативно,W означает двухвалентный радикал, когда n означает 2, такой как карбонат-ион или сульфатион, последний на практике более предпочтителен. Осуществление настоящего способа представляет собой адаптацию способа патента FR 7108700, поскольку предусматривается алкилирование кислоты (III) диметилсульфатом. В среде толуола происходит реакция 1 моля кислоты (III) в кислой или, предпочтительно, солевой форме, где R1 и R2 означают метил, с от 0,9 до 2,5 моль диметилсульфата, а если R1 и/или R2 означают водород, то с 1,2-3,5 моль диметилсульфата. Предпочтительно, в случае,когда R1 и R2 в кислоте (III) представлены метилом, использовать 1,2-2,0 моль, с получением аминоэфира (II) в котором R, R1 и R2 означают метил, а когда R1 и/или R2 в кислоте (III) представлены водородом, использовать 1,4-2,8 моль диметилсульфата. В этом последнем случае получается смесь интермедиатных эфиров, в которых R означает метил, R1 и/или R2 означают 7 водород или метил; эти соединения подвергаются без выделения дополнительному Nметилированию в реакции Эшвайлера-Кларка с формальдегидом и муравьиной кислотой. На практике рабочая процедура этой реакции состоит из диспергирования в толуоле кислоты(III), предпочтительно в форме ее натриевой соли, и затем, при кипячении растворителя под обратным холодильником, введении диметилсульфата. Реакционная среда затем выдерживается под обратным холодильником в течение 15 ч, затем добавляют воду и после щелочной экстракции эфир получают в толуольной фазе,после чего выпаривают растворитель и получают N,N-диметилированный аминоэфир (II). При желании толуольная фаза может быть подвергнута дополнительному метилированию. Для этого к ней добавляют водный раствор формальдегида и затем чистую муравьиную кислоту. Смесь при эффективном перемешивании кипятят под обратным холодильником от 30 мин до 3 ч, что позволяет завершить метилирование и получить диметиламиноэфир. Что касается стадии восстановления эфира, то обзор общего характера можно найти вEdition (ed. J. Wiley Intersciences) стр. 1093 и далее. Структура эфира (II) и, в особенности,наличие двойного замещения хлором, запрещает использование восстанавливающих агентов и/или интенсивных условий, как, например, каталитическое гидрогенизация или так называемая реакция Буво и Бланка. Таким образом,наилучший способ состоит в восстановлении эфира (II) металлогидридами или органометаллогидридами, которые для монометаллических гидридов имеют общую формулу M1(H)y1(R3)z1,где M1 означает алюминий или бор, R3 означает линейный или разветвленный низший алкил с числом углеродных атомов от 2 до 4, у 1 означает 1, 2 или 3, z1 означает 0, 1 или 2, а суммаy1+z1 в любом случае равна 3, или кремнийорганическими гидридами, как, например, гидрид полиметилгидроксисилоксана, чье действие катализируется комплексным металловосстанавливающим агентом, таким, например, который описан в публикации WO 96/12694. Двуметаллические комплексные гидриды, используемые для восстановления эфира (II), имеют общую формулу M2M1(H)y2(R3)z2, где M1 означает алюминий или бор, М 2 означает щелочной металл,особенно литий или натрий, R3 означает линейный или разветвленный низший алкил с числом углеродных атомов от 2 до 4 , либо линейную или разветвленную низшую алкоксигруппу с числом углеродных атомов от 2 до 4, либо, альтернативно, алкоксиалкоксигруппу, у 2 означает 2, 3 или 4, z2 означает 0, 1, 2 или 3, а суммаy2+z2 в любом случае равна 4. В числе этих гидридов предпочтительными являются двуметаллические, у которых z2 означает 0, M1 означает алюминий, а М 2 - литий, 004399 8 или где M1 означает бор, а М 2 - натрий, а именно, в последнем случае, боргидрид натрия, который предпочтительно используют в присутствии Льюисовой кислоты, такой как АlСl3 или в присутствии сильной кислоты, такой как серная кислота. Что касается гидридов, где z2 означает 1, 2 или 3, из них предпочтительны те, у которых z2 имеет значение 2, М 2 означает натрий,M1 означает алюминий, а R3 означает алкоксиалкоксигруппу, такую как метоксиэтоксигруппу. Гидрид, являющийся предпочтительным на практике, это литий-алюминиевый гидрид(ЛАГ), который используется в форме своего ассоциированного комплекса с тетрагидрофураном (ТГФ), растворимого в толуоле, предпочтительном реакционном растворителе. Таким образом, методика на первой стадии включает получение ЛАГ-ТГФ-комплекса в толуоле добавлением от 3 до 10 моль-эквивалентов ТГФ к 1 моль ЛАГ и затем, после образования растворимого комплекса, введение от 1,5 до 2,0 моль эфира (II), предпочтительно от 1,65 до 1,75 моль этого эфира на 1 моль используемого ЛАГ. Реакцию проводили в атмосфере азота, поддерживая ее от 30 мин до 24 ч при температуре между 10 и 110 С. Предпочтительными условиями для этой реакции восстановления являются 1-3 ч при температуре 60-110 С, после чего комплексы разрушали водой в щелочной среде и выделяли церикламин (I) путем фильтрования солей и выпаривания растворителей. Продукт, полученный в грубом виде, очищали кристаллизацией в алканах с точкой кипения от 50 до 100 С,таких как гексан, и последующим высаливанием соляной кислотой в соответствии с традиционными способами, адаптированными к промышленности. Полная последовательность реакций, наиболее подходящих для изготовления церикламина в четыре стадии, начиная с 3,4 дихлоранилина, такова:i) диазотирование 3,4-дихлоранилина в ацетоне, в солянокислой среде, при температуре ниже 10 С, используя 4 моль кислоты по отношению к 3,4-дихлоранилину и от 1 до 1,5 моль нитрита натрия, затем реакция с 1,5 моль метакриловой кислоты, арилирование которой катализируется 0,02 моль хлорида меди, с получением хлорированной интермедиатной кислотыii) аминирование интермедиат (IV) аммиаком или, более предпочтительно, диметиламином в ацетоне или, более предпочтительно, в ацетонитриле, путем растворения или диспергирования интермедиата (IV) в растворителе,добавления 1 моль соды в хлопьях на 1 моль,затем введения при температуре примерно 0 С либо от 30 до 70 моль аммиака, либо, что более предпочтительно, от 3 до 10 моль диметиламина, с последующим прогреванием смеси при перемешивании и под давлением при 30-50 С, 9 предпочтительно при 40 С, в течение 15-20 ч,затем выпаривание реакционную смесь с получением натриевой соли аминокислоты (III), в которой R1 и R2 означают водород, в случае аминирования аммиаком, и, предпочтительно,метил, в случае аминирования диметиламином,затемiii) метилирование натриевой соли аминокислоты (III) проведением реакции 1 моля солевой формы кислоты (III), где R1 и R2 означают метил, в толуоле, под обратным холодильником,с от 1,2 до 2,0 моля диметилсульфата с получением эфира (II), где R, R1 и R2 означают метил, а когда R1 и R2 в аминокислоте (III) означают водород, проведением реакции с от 1,4 до 2,8 моль диметилсульфата, после чего без дальнейшей очистки, N-метилировать смесь полученных эфиров, в которых R означает метил, а R1 и/илиR2 означают водород или метил, формальдегидом и муравьиной кислотой с получением эфира(ТГФ), путем проведения реакции в толуоле, в атмосфере азота, которая состоит в добавлении 3-10 молярных эквивалентов ТГФ к 1 моль ЛАГ, введении от 1,65 до 1,75 моль эфира (II),проведении восстановления в течение 1-3 ч при температуре 60-110 С, разрушении комплекса водой в щелочной среде и, после выпаривания растворителей, получении церикламида (I), который далее очищают кристаллизацией из гексана и высаливанием соляной кислотой в соответствии со способами, адаптированными к условиям производства. В дополнение, в качестве новых химических соединений формулы (V), являющихся интермедиатами упомянутого способа, настоящее изобретение рассматривает следующие:(+/-)2-хлор-3-(3,4-дихлорфенил)-2-метилпропионовая кислота,(+/-)3-(3,4-дихлорфенил)-2-диметиламино 2-метилпропионовая кислота и ее натриевые соли,метил(+/-)3-(3,4-дихлорфенил)-2-диметиламино-2-метилпропионат. Примеры, приведенные ниже, демонстрируют, не ограничиваясь им, предпочтительный способ изготовления церикламина, где в качестве исходных веществ выступают 3,4-дихлоранилин и метакриловая кислота. Примеры Общие термины в описаниях примеров следует понимать следующим образом. Высушивание растворителей следует понимать как добавление достаточного количестваMgSO4 с последующим отделением его путем фильтрования,Дистилляция или удаление растворителей посредством дистилляции следует понимать как 10 дистилляцию под вакуумом от 25 до 50 мм ртутного столба. Указанные температуры плавления не являются точными, они были определены с помощью дифференциального термоанализа (приборMettler с печью type 20 и программером ТС 11). Хроматографическую чистоту определяли с помощью тонкослойной хроматографии (ТСХ) на силикагеле (поставщик - Merk), количественный и пропорциональный состав элюирующих смесей указан в каждом конкретном случае. Спектры протонного магнитного резонанса (Н 1 ЯМР) получали на приборе Varian ЕМ 360 (60 МГц), соединения растворяли в дейтерохлороформе или дейтерированном диметилсульфоксиде, для внутреннего сравнения использовали T.M.S. Показанные спектры демонстрируются как сдвиг сигналов в ррm (частях на миллион) относительно T.M.S., их наличие и число протонов, которому они соответствуют. Пример 1 (предпочтительный вариант).i) Получение (+/-)2-хлор-3-(3,4-дихлорфенил)-2-метилпропионовой кислоты [(IV), соединение (V) для А=Сl, В=ОН]. Растворяют 60,0 г (0,37 моль) 3,4-дихлоранилина в 300 мл ацетона в реакторе. Не превышая 20 С, добавляют 125 мл 36% НСl в течение 10 мин. Смесь охлаждают до 0 С и, в атмосфере азота, добавляют раствор 27,7 г (0,39 моль) 97% нитрита натрия в 74 мл воды в течение 15 мин, сохраняя температуру между 0 и 5 С. Затем последовательно добавляют 47,8 г(0,56 моль) метакриловой кислоты и 104 мл чистой уксусной кислоты, после чего при температуре между 3 и 5 С добавляют раствор 0,76 г (7,4 ммоль) хлорида меди в 24 мл 10% НСl. Этот процесс является экзотермическим и сопровождается выделением азота. Затем смесь оставляют на 2 ч при перемешивании, чтобы достигнуть температуры 20 С, после чего добавляют 74 мл воды. Отбирают нижнюю органическую фазу, а водную фазу дважды экстрагируют 200 мл толуола. К объединенной органической фазе добавляют 740 мл воды и при температуре менее 25 С добавляют 150 мл 30% раствора NaOH. Щелочную фазу отделяют, а толуольную фазу экстрагируют 200 мл воды. Объединенную щелочную фазу подкисляют при температуре менее 25 С используя 60 мл 93% H2SO4, и затем смесь экстрагируют 750 мл толуола. Кислую фазу отделяют, экстрагируют 350 мл толуола, после чего объединенную органическую фазу высушивают и растворитель удаляют посредством дистилляции. Остаток(106 г) смешивают с 110 мл гексана при примерно 50 С, затем раствор охлаждают до 0 С при перемешивании. Нерастворимый материал отфильтровывали, дважды промывали 30 мл гексана при 0 С, затем сушили под вакуумом при 40 С до постоянного веса. Вес: 80,2 г, выход - 80,9%, Тпл.=105,2 С.ii) Получение (+/-)3-(3,4-дихлорфенил)-2 диметиламин-2-метилпропионовой кислоты и ее натриевой соли - [(III) М=Н или Na, соединение(V) для А=диметиламино-группа, В=ОМ]. 50,0 мл ацетонитрила, в который предварительно было введено 10,0 г (220 мл) диметиламина, было введено на холоду в реактор постоянного объема, затем добавляли 1,5 г (37,5 ммоль) NaOH в хлопьях и 10,0 г хлорированной кислоты, полученной на предыдущей стадии. Реактор закрывали и затем грели при перемешивании при 40 С в течение 17 ч, в ходе чего давление сначала увеличивалось, а затем падало в силу проистекания реакции. Реактор охлаждали до примерно 10 С, открывали, и смесь подвергали дистилляции под вакуумом. К остатку добавляли 50 мл толуола, удаляли его и снова добавляли 30 мл толуола при перемешивании. Нерастворимый(s, 2H); 7,3 (m, 3 Н). Кислота была получена растворением 7,5 г(25 ммоль) натриевой соли в 40 мл воды и последующим подкислением до рН 6,5-6,6 с помощью 36% НСl. Суспензию оставляли при перемешивании на 2 ч при 5 С, после чего кислоту (III) отфильтровывали и сушили под вакуумом. Вес: 6,6 г, выход: 95%, Тпл.=250 С. Н 1 ЯМРppm; 1,45 (s, 3 Н); 3,0 (s, 6H); 3,2 (s, 2H); 7,4 (m,3 Н); 9,75 (s, 1H).=CH1; соединение (V) для А=диметиламиногруппа, В=OR]. 7,0 г (23 ммоль) натриевой соли, полученной на предыдущей стадии, в 21,0 мл толуола вводили в реактор. Суспензию нагревали до кипения под обратным холодильником и затем добавляли 4,2 г (33 ммоль) диметилсульфата в течение 15 мин. При этом среда меняется и появляются две фазы; в течение 2 ч смесь кипятят под обратным холодильником, охлаждают до 70 С, добавляют 10 мл воды и оставляют смесь при перемешивании на 12 ч при 20-25 С. Водную фазу затем отделяют, а толуольную фазу экстрагируют дважды 10 мл воды. Объединенную водную фазу подщелачивают при температуре менее 25 С 6 мл 30% натронного щелока и затем экстрагируют 30 мл толуола. Органическую фазу отделяют, водную фазу экстрагируют дважды 10 мл толуола и объеди 004399 12 ненную органическую фазу промывают 10 мл воды. Толуол удаляют дистилляцией с получением грубого препарата соединения (II) в форме бледно-желтого вязкого масла с уровнем очистки, достаточным для использования на следующей стадии восстановления. Вес: 4,3 г, выход: 63,2%. ТСХ: Rf=0,75 (хлороформ-метанол-толуолконцентрированный аммиак 30-30-30-1,5, объем/объем). Н 1 ЯМРppm; 1,2 (t, 3 Н); 2,4 (s, 6 Н); 3,1iv) Получение (+/-)3-(3,4-дихлорфенил)-2 диметиламино-2-метилпропан-1-ол (I) или церикламин (INN). 0,35 г (8,74 ммоль) литий-алюминиевого гидрида в виде порошка в 8,5 мл полностью высушенного толуола вводили в сухой реактор,защищенный от влаги в атмосфере азота. Затем по каплям добавляли 1,4 мл сухого тетрагидрофурана до образования суспензии. Этот процесс является слабо экзотермическим. Затем добавляли раствор 4,3 г (15 ммоль) диметиламиноэфира, полученного на предыдущей стадии iii),в 4,3 мл толуола. Этот процесс также экзотермический, поэтому температура повышалась от 23 до 32 С. Смесь при перемешивании оставляли на 2,5 ч при 20 С, затем нагревали в течение 1,5 ч до 60 С и затем еще 1 ч до вскипания толуола под обратным холодильником, после чего оставили на 16 ч. Затем по каплям добавляли 0,33 мл воды при температуре менее 18 С, затем раствор 0,06 г NaOH хлопьями в 0,33 мл воды,затем 1,00 мл воды. Суспензию перемешивали в течение 30 мин. Нерастворимый материал отфильтровывали, дважды последовательно смешивали с 15,5 мл толуола и отфильтровывали. Объединенную толуольную фазу выпаривали и остаток растворяли при кипячении под обратным холодильником в 16 мл гексана и, по мере охлаждения до 40 С, происходила кристаллизация. После охлаждения до 20 С суспензию оставляли на 2 ч при температуре менее 5 С, нерастворимый материал отфильтровывали, промывали холодным гексаном и затем сушили при 50 С под вакуумом до постоянного веса. Вес: 3,40 г, выход: 87,8%, Тпл.=86,3 С. ТСХ: Rf=0,10-0,40 (этанол-гексан-хлороформ, объем/объем/объем). Н 1 ЯМРppm; 0,8 (s, 3 Н); 2,05 (s, 1H); 2,4(s, 6H); 2,75 (s, 2H); 3,3 (s, 2H); 7,3 (m, 3 Н). Гидрохлорид: 2,0 г (7,63 ммоль) полученного соединения (I) растворяли при 40 С в 5,2 мл сухого этанола. После охлаждения до 30 С добавляли 2,5 г 11,8% (вес/объем) солянокислого этанола (8,01 ммоль), после чего раствор нагревали до 50 С и добавляли 8,0 мл диизопропилового эфира. Раствор охлаждали при пере 13 мешивании, при 35 С происходила кристаллизация, при этой температуре смесь оставляли на 2 ч, после чего охлаждали до 10 С. Через 2 ч нерастворимый материал отфильтровывали,промывали и сушили под вакуумом до постоянного веса. Вес: 1,9 г, выход: 83,3%, Тпл.=173,3 С. ТСХ: Rf=0,40-0,60 (хлороформ-этанолгексан-концентрированный аммиак, 30-30-301,5, объем/объем). Пример 2.i) (+/-)2-Хлор-3-(3,4-дихлорфенил)-2-метилпропионовая кислота, [(IV), получена как описано в пункте i) примера 1 выше].ii) Получение (+/-)2-амино-3-(3,4-дихлорфенил)-2-метилпропионата натрия, [(III) М=Na,R1=R2=H]. Реакцию проводили в соответствии с рабочим протоколом, описанным в пункте ii) примера 1, начиная с 10,0 г (0,037 моль) хлорированной кислоты (IV) и 35,0 г (2,06 моль) аммиака. В ходе реакции получали натриевую соль продукта. Вес: 8,3 г, выход: 82,2%, Тпл.=275280 С. ТСХ: Rf=0,30-0,40 (хлороформ-этанолгексан-концентрированный аммиак, 30-30-301,5, объем/объем). Н 1 ЯМРррm; 1,35 (s, 3 Н); 2,1 (s, 2 Н); 3,0iii a) 7,0 г (26 ммоль) натриевой соли кислоты, полученной выше, в 21 мл сухого толуола вводили в реактор. Суспензию кипятили под обратным холодильником при перемешивании и добавляли по каплям 4,6 г (36 ммоль) диметилсульфата. Смесь оставляли при кипячении под обратным холодильником в течение 2 ч и затем охлаждали до 40 С и добавляли 10 мл воды,после чего смесь охлаждали до 20 С. Смесь перемешивали 15 мин и затем оставляли на 16 ч. Водную фазу отделяли, а толуольную фазу дважды экстрагировали 6 мл воды. Комбинированную водную фазу подщелачивали при температуре менее 25 С 4,2 мл 30% натронного щелока и затем экстрагировали 20 мл толуола. Органическую фазу отделяли, а водную фазу дважды экстрагировали 5 мл толуола, и затем объединенную органическую фазу промывали 6 мл воды.iii b) 7,8 г (78 ммоль) 30% раствора формальдегида добавляли в реактор к полученной толуольной фазе. Смесь подвергали кипячению под обратным холодильником при перемешивании и затем добавляли 5,8 г (101 ммоль) 80% муравьиной кислоты, сохраняя температуру 8590 С. Смесь грели, перемешивая, при 85-90 С 1,5 ч, затем охлаждали до 35 С и добавляли 8,4 мл 30% натронного щелока при температуре менее 35 С. Органическую фазу отделяли, а 14 водную фазу дважды экстрагировали 8 мл толуола, после чего объединенную толуольную фазу промывали трижды 6 мл воды, и затем толуол удаляли дистилляцией. Полученный грубый препарат диметиламиноэфира (II), чистый по ТСХ, был достаточно чист для использования в конечной стадии восстановления. Вес: 4,3 г, выход: 57,2%. ТСХ: Rf=0,40-0,60 (дихлорметан-ацетон 85-15 объем/объем). Н 1 ЯМР: идентичен соединению, полученному по пункту iii) примера 1.(I) или церкламина (INN). Продукт был изготовлен как описано в пункте iv) примера 1. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ изготовления (+/-)3-(3,4-дихлорфенил)-2-диметиламин-2-метилпропан-1 ола (I) или церикламина, включающийi) арилирование метакриловой кислоты хлоридом диазония 3,4-дихлоранилина, приготовляемым in situ, с получением (+/-)2-хлор-3(3,4-дихлорфенил)-2-метилпропионовой кислоты (IV)HNR1R2, где R1 и R2 означают независимо водород или метил, с получением аминокислоты (III) где М означает щелочной или щелочноземельный металл или еще один водород, R1 иR2 определены как указано выше, затемiii) этерификацию кислоты (III) и последующее метилирование аминовой группы получаемого сложного эфира формальдегидом и муравьиной кислотой с получением эфира (+/-)3(3,4-дихлорфенил)-2-диметиламин-2-метилпропионовой кислоты формулы (II)iv) восстановление эфира (II) металлогидридом или органометаллогидридом с получением (+/-)3-(3,4-дихлорфенил)-2-диметиламин-2 метилпропан-1-ола или церикламина (INN) формулы (I) и получение солянокислой соли. 2. Способ по п.1, где хлорид диазония 3,4 дихлоранилина применяют для арилирования в количестве 1 моль вместе с 1,5 моль метакриловой кислоты в присутствии 0,02 моль хлорида меди с получением кислоты (IV). 3. Способ по п.1 или 2, где 1 моль кислоты(IV) аминируют в ацетонитриле, нагревая под давлением при 40 С в течение 15-20 ч с 1 моль соды, и с от 3 до 10 моль диметиламина, с получением аминокислоты (III), где М означает натрий, R1 и R2 оба означают метил. 4. Способ по п.1 или 3, где 1 моль аминокислоты (III) этерифицируют в толуоле диметилсульфатом в количестве от 1,4 до 2,8 моль и затем N-метилируют формальдегидом и муравьиной кислотой, когда в аминокислоте (III)R1 и R2 означают водород, и диметилсульфатом в количестве от 1,2 до 2,0 моль, когда в аминокислоте (III) R1 и R2 означают метил, с получением аминоэфира (II), в котором R, R1 и R2 означают метил. 5. Способ по п.1 или 4, где эминоэфир (II) восстанавливают комплексом алюмогидрида лития и тетрагидрофурана, полученным присоединением тетрагидрофурана к алюмогидриду лития, в среде толуола при мольном соотношении алюмогидрида лития к аминоэфиру, равном примерно (0,57-0,60):1, с получением (+/-)3-(3,4 дихлорфенил)-2-диметиламин-2-метилпропан-1 ола (I), который можно перевести в гидрохлорид. 6. Способ по п.1, где 16 хлорид диазония 3,4-дихлоранилина применяют в количестве 1 моль для арилирования 1,5 моль метакриловой кислоты в присутствии 0,02 моль хлорида меди, с получением кислоты(IV),1 моль кислоты (IV) аминируют в ацетонитриле нагревом под давлением при 40 С в течение 15-20 ч с 1 моль соды и 3-10 моль диметиламина, с получением аминокислоты (III), где М означает натрий, а R1 и R2 оба означают метил,1 моль аминокислоты (III) этерифицируют в толуоле диметилсульфатом в количестве 1,42,8 моль и затем N-метилируют формальдегидом и муравьиной кислотой, когда в аминокислоте (III) R1 и R2 означают водород, и диметилсульфатом в количестве 1,2-2,0 моль, когда в аминокислоте (III) R1 и R2 означают метил, с получением аминоэфира (II), где R, R1 и R2 означают метил,аминоэфир (II) восстанавливают комплексом алюмогидрида лития и тетрагидрофурана,полученным присоединением тетрагидрофурана к алюмогидриду лития, в среде толуола при мольном соотношении алюмогидрида лития к аминоэфиру, равном примерно (0,57-0,60):1, с получением (+/-)3-(3,4-дихлорфенил)-2-диметиламин-2-метилпропан-1-ола (I) или церикламина, который можно перевести в гидрохлорид. 7. Промежуточные соединения, выбранные из группы, включающей (+/-)2-хлор-3-(3,4 дихлорфенил)-2-диметилпропионовую кислоту,(+/-)3-(3,4-дихлорфенил)-2-диметиламин-2-метилпропионовую кислоту и ее натриевую соль,сложный метиловый эфир (+/-)3-(3,4-дихлорфенил)-2-диметиламин-2-метилпропионовой кислоты.
МПК / Метки
МПК: A61P 25/24, C07C 215/28
Метки: inn, дихлорфенил, церикламина, получения, диметиламино-2, способ, метилпропан-1-ола
Код ссылки
<a href="https://eas.patents.su/9-4399-sposob-polucheniya-3-34-dihlorfenil-2-dimetilamino-2-metilpropan-1-ola-ili-ceriklamina-inn.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения (+/-) 3 – (3,4 – дихлорфенил) – 2 – диметиламино-2 – метилпропан-1-ола или церикламина (inn)</a>
Предыдущий патент: Одно- и двузамещенные 3-пропил-гамма-аминомасляные кислоты
Случайный патент: Способ гидрирования альфа-, омега-динитрилов и каталитическая смесь












