Новый способ получения производных аминокислот
Номер патента: 19040
Опубликовано: 30.12.2013
Авторы: Канцлер Ральф, Мерсарт Ален, Пинилла Вероник, Хаманн Йёрг, Буви Дидье, Томас Антуан
Формула / Реферат
1. Способ получения в основном оптически чистого (R)-2-ацетамидо-N-бензил-3-метоксипропионамида (I), включающий следующие стадии:
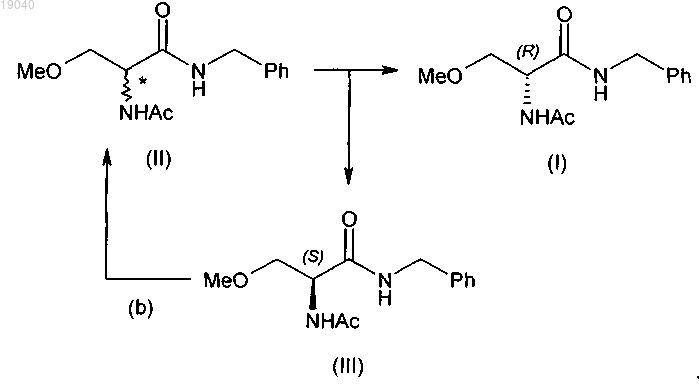
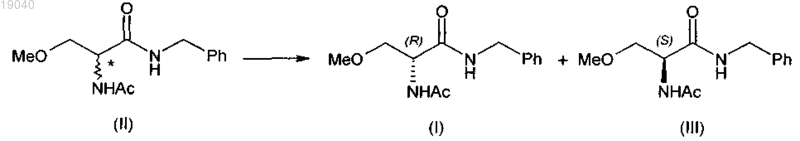
(а) разделение 2-ацетамидо-N-бензил-3-метоксипропионамида (II) на (R)-2-ацетамидо-N-бензил-3-метоксипропионамид (I) и (S)-2-ацетамидо-N-бензил-3-метоксипропионамид (III)
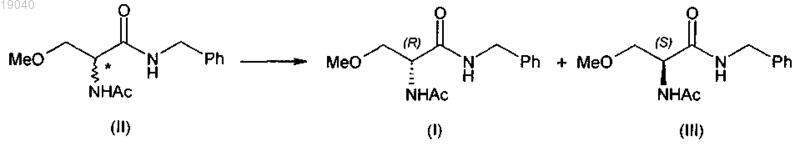
(b) рацемизацию полученного таким образом (S)-2-ацетамидо-N-бензил-3-метоксипропионамида (III) в 2-ацетамидо-N-бензил-3-метоксипропионамид (II);
(c) дополнительное разделение указанного 2-ацетамидо-N-бензил-3-метоксипропионамида (II) на соединение формулы (I) и соединение формулы (III)
2. Способ по п.1, отличающийся тем, что разделение проводят путем хирального хроматографического разделения с использованием хиральной неподвижной фазы (ХСФ) и подвижной фазы.
3. Способ по п.2, отличающийся тем, что хиральное хроматографическое разделение проводят с помощью многоколоночной хроматографии (МКХ).
4. Способ по п.2, отличающийся тем, что хиральная неподвижная фаза (ХСФ) представляет собой полисахаридный хиральный селектор, нанесенный на основу из диоксида кремния или иммобилизованный на ней.
5. Способ по п.4, отличающийся тем, что полисахаридный хиральный селектор выбран из группы, включающей трис-(4-метилбензоат)целлюлозы, трибензоат целлюлозы, трис-(3,5-диметилфенилкарбамат)амилозы, трис-(3,5-диметилфенилкарбамат)целлюлозы, трис-(4-метилфенилкарбамат)целлюлозы, трис-(3,5-дихлорфенилкарбамат)целлюлозы, трис-[(S)-α-метилбензилкарбамат]амилозы и трис-(3-хлор-4-метилфенилкарбамат)целлюлозы.
6. Способ по любому из пп.2-5, отличающийся тем, что подвижная фаза выбрана из группы, включающей гептан, гексан, метанол, этанол, изопропанол, н-пропанол, ацетонитрил, изопропилацетат, этилацетат, дихлорметан, хлороформ, метил-трет-бутиловый эфир и их смеси.
7. Способ по п.6, отличающийся тем, что подвижная фаза представляет собой смесь этилацетата и метанола или ацетонитрила.
8. Способ по любому предыдущему пункту, отличающийся тем, что рацемизацию проводят по реакции (S)-2-ацетамидо-N-бензил-3-метоксипропионамида (III) с основанием, выбранным из группы, включающей метоксид натрия, гидроксид калия, гидроксид натрия, карбонат калия, карбонат натрия, триэтиламин, 1,8-диазабицикло[5.4.0]ундец-7-ен и сильно или слабо основные анионообменные смолы.
9. Способ по п.8, отличающийся тем, что основание выбрано из группы, включающей метоксид натрия, гидроксид калия, гидроксид натрия, карбонат калия и карбонат натрия.
10. Способ по п.8, который проводят при температуре от 20 до 80°С.
11. Способ по п.8, который проводят в растворителе, выбранном из группы, включающей метанол, этанол, тетрагидрофуран, 2-метилтетрагидрофуран и ацетонитрил.
12. Способ по п.1, отличающийся тем, что 2-ацетамидо-N-бензил-3-метоксипропионамид (II) получают с помощью следующих стадий:
(i) взаимодействие соединения формулы (VIa)
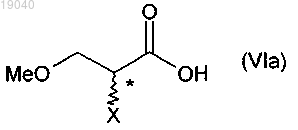
в которой X обозначает отщепляющуюся группу, с алкилгалогенформиатом в присутствии основания и бензиламина с получением соединения формулы (V)
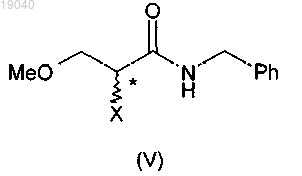
в котором X является таким, как определено для соединения (VIa);
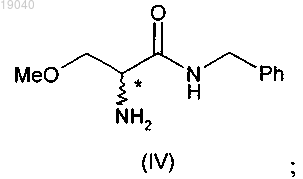
(ii) проведение аммонолиза указанного соединения (V) с получением соединения формулы (IV)
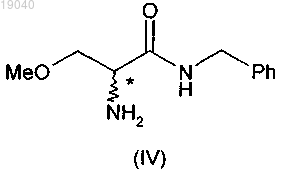
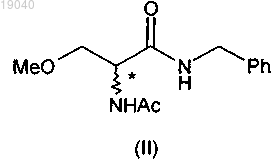
(iii) ацетилирование указанного соединения формулы (IV) уксусным ангидридом в растворителе с получением соединения формулы (II);
(iv) выделение соединения формулы (II).
13. Способ по п.12, отличающийся тем, что соединение формулы (VIIIa), в которой X обозначает отщепляющуюся группу и R обозначает С1-С10-алкил, образуется in situ на стадии (i) до реакции с бензиламином
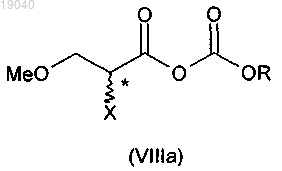
14. Способ по п.12 или 13, отличающийся тем, что X обозначает галоген, предпочтительно бром.
15. Способ по любому из пп.12-14, отличающийся тем, что соединение (VIa) получают in situ по реакции 2,3-дибромэтилпропионата (VIIa) или 2,3-дибромметилпропионата (VIIb) с метоксидом натрия в метаноле при температуре ниже 10°С.
16. Способ по любому из пп.12-15, отличающийся тем, что стадию (ii) проводят с избытком водного раствора аммиака в присутствии метанола.
17. Способ по любому из пп.12-16, отличающийся тем, что стадию (iii) проводят при температуре от 50 до 70°С.
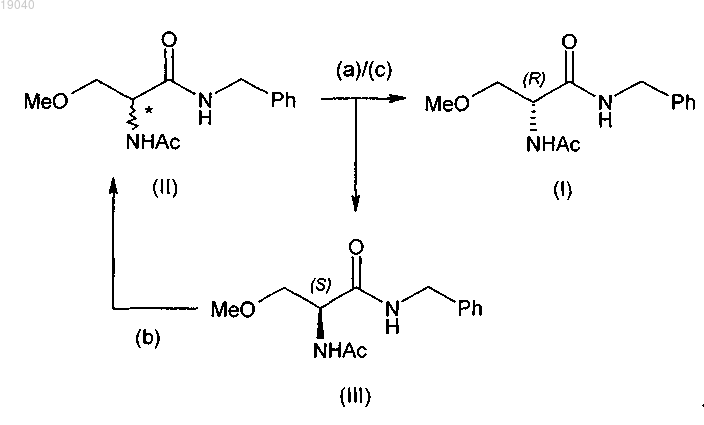
18. Способ получения в основном оптически чистого (R)-2-ацетамидо-N-бензил-3-метоксипропионамида (I), включающий следующие стадии:
(i) взаимодействие 2,3-дибромэтилпропионата (VIIa) или 2,3-дибромметилпропионата (VIIb)
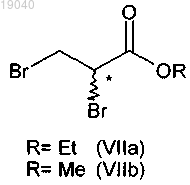
с метоксидом натрия в метаноле в присутствии алкилхлорформиата, затем бензиламина с получением 2-бром-N-бензил-3-метоксипропионамида (Va)
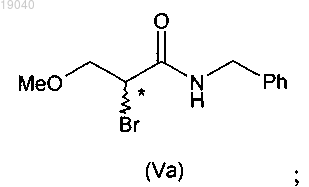
(ii) взаимодействие указанного соединения формулы (Va) с водным раствором аммиака с получением 2-амино-N-бензил-3-метоксипропионамида (IV)
(iii) ацетилирование указанного соединения формулы (IV) уксусным ангидридом в растворителе с получением 2-ацетамидо-N-бензил-3-метоксипропионамида (II)
(iv) выделение указанного соединения формулы (II);
(v) разделение указанного 2-ацетамидо-N-бензил-3-метоксипропионамида (II) на (R)-2-ацетамидо-N-бензил-3-метоксипропионамид (I) и (S)-2-ацетамидо-N-бензил-3-метоксипропионамид (III)
(vi) рацемизацию полученного таким образом (S)-2-ацетамидо-N-бензил-3-метоксипропионамида (III) в 2-ацетамидо-N-бензил-3-метоксипропионамид (II);
(vii) дополнительное разделение указанного 2-ацетамидо-N-бензил-3-метоксипропионамида (II) на соединение формулы (I) и соединение формулы (III)
19. Способ по п.1, отличающийся тем, что 2-ацетамидо-N-бензил-3-метоксипропионамид (II)
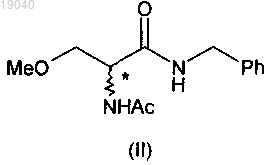
получают с помощью следующих стадий:
(i) ацетилирование О-метил-D,L-серина (X)
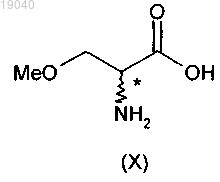
с получением 2-ацетамидо-3-метоксипропионата (IX)
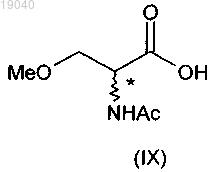
(ii) взаимодействие указанного 2-ацетамидо-3-метоксипропионата (IX) с бензиламином с получением 2-ацетамидо-N-бензил-3-метоксипропионамида (II);
(iii) выделение указанного соединения формулы (II).
20. Способ по п.19, отличающийся тем, что стадию (i) проводят в присутствии уксусного ангидрида в растворителе, выбранном из группы, включающей уксусную кислоту, толуол, тетрагидрофуран, 2-метилтетрагидрофуран, изобутилацетат, дихлорметан, воду и их смеси.
21. Способ по п.19, отличающийся тем, что стадию (ii) проводят в присутствии катализатора, выбранного из группы, включающей борную кислоту, фенилбороновую кислоту, 3,4,5-трифторфенилбороновую кислоту, 2-(N,N-диизопропиламинометил)фенилбороновую кислоту и 2-(N,N-диметиламинометил)фенилбороновую кислоту.
22. Способ по п.19, отличающийся тем, что стадию (ii) проводят в присутствии дициклогексил- (ДЦК) или диизопропилкарбодиимида (ДИК) в растворителе, выбранном из группы, включающей тетрагидрофуран, этилацетат и дихлорметан.
23. Способ по любому из пп.19, 21 и 22, отличающийся тем, что стадию (ii) проводят при кипячении с обратным холодильником в растворителе, выбранном из группы, включающей толуол, N-метилпирролидон и их смеси, тетрагидрофуран, 2-метилтетрагидрофуран, циклопентилметиловый эфир, ди-н-бутиловый эфир и фторбензол.
Текст
НОВЫЙ СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ АМИНОКИСЛОТ(71)(73) Заявитель и патентовладелец: ЮСБ ФАРМА ГМБХ (DE) В изобретении описан альтернативный способ получения аминопроизводных. В частности,в изобретении описан улучшенный способ получения лакозамида (ЛКА), (R)-2-ацетамидо-Nбензил-3-метоксипропионамида, который применим в качестве спазмолитического лекарственного средства. Предпочтительным объектом изобретения является способ получения оптически обогащенного (R)-2-ацетамидо-N-бензил-3-метоксипропионамида (I), включающий разделение 2 ацетамидо-N-бензил-3-метоксипропионамида (II). Настоящее изобретение относится к новому способу получения производных аминокислот. В частности, настоящее изобретение относится к улучшенному способу получения лакозамида(ЛКА), (R)-2-ацетамидо-N-бензил-3-метоксипропионамида, который применим в качестве спазмолитического лекарственного средства. Для ЛКА обнаружена противоэпилептическая эффективность с помощью экспериментальных моделей судорог на различных грызунах и антиноцицептивная активность с помощью экспериментальных моделей на животных, которые отображают различные типы и симптомы невропатической, а также хронической воспалительной боли. В патенте US 5378729 описано получение содержащих функциональные группы аминокислот по реакции аминов с ацетилирующими производными карбоновой кислоты при условиях образования амида. Однако в патенте US 5378729 не описано прямое получение одного энантиомера, содержащего функциональные аминокислоты, такого как лакозамид. Патент US 5773475 относится к способам получения "в основном оптически чистого" лакозамида,определенного в указанном патенте, с использованием D-серина в качестве исходного вещества. Указанный способ получения включает использование метилйодида и оксида серебра(I) в качестве Ометилирующего реагента, который обладает теми недостатками, что является дорогостоящим и приводит к частичной рацемизации продукта, подвергшегося О-метилированию. Это является основным недостатком с точки зрения производительности способа в промышленности. В патенте US 6048899 описаны варианты способа, описанного в патенте US 5773475. Заявка на международный патент, опубликованная как WO 2006/037574, относится к улучшенному пути синтеза лакозамида, в котором в качестве альтернативы О-метилирующему реагенту, метилйодиду и оксиду серебра(I), в частности, используют диметилсульфат. Однако использование избытка диметилсульфата, как это описано в WO 2006/037574, при крупномасштабном получении лакозамида может привести к затруднениям, связанным с безопасностью и охраной окружающей среды. Кроме того, использование стадий введения/удаления защитных групп атома N аминогруппы при промышленной реализации способа в целом может привести к затруднениям, связанным с высокой стоимостью и низкой производительностью. Поэтому необходим альтернативный и улучшенный способ получения лакозамида, который является конкурентоспособным, более экономичным, обеспечивает повышенную производительность и не обладает основными недостатками, связанными с безопасностью и охраной окружающей среды. Первым объектом настоящего изобретения является способ получения оптически обогащенного(R)-2-ацетамидо-N-бензил-3-метоксипропионамида (I), включающий разделение 2-ацетамидо-N-бензил 3-метоксипропионамида (II), как показано на приведенной ниже схеме 1. Схема 1 Выражение "оптически обогащенное" при использовании в настоящем изобретении при указании конкретного соединения означает, что более 50%, предпочтительно более 75%, более предпочтительно более 85%, наиболее предпочтительно более 94% соединения содержит стереогенный центр, отмеченный как , в указанной конфигурации (R) или (S). Поэтому выражение "оптически обогащенный (R)-2-ацетамидо-N-бензил-3-метоксипропионамид" означает, что более 50%, предпочтительно более 75%, более предпочтительно более 85%, наиболее предпочтительно более 94% соединения содержит стереогенный центр, отмеченный как , в конфигурации (R). Вторым объектом настоящего изобретения является способ получения в основном оптически чистого (R)-2-ацетамидо-N-бензил-3-метоксипропионамида (I), включающий разделение 2-ацетамидо-Nбензил-3-метоксипропионамида (II), как это показано на схеме 1. Выражение "в основном оптически чистое" при использовании в настоящем изобретении при указании конкретного соединения означает, что не менее 95%, предпочтительно не менее 96%, более предпочтительно не менее 97%, наиболее предпочтительно не менее 98%, еще более предпочтительно не менее 99% соединения содержит стереогенный центр, отмеченный как , в указанной конфигурации (R) или (S). Поэтому выражение(R)-2-ацетамидо-N-бензил-3 метоксипропионамид" означает, что не менее 95%, предпочтительно не менее 96%, более предпочти-1 019040 тельно не менее 97%, наиболее предпочтительно не менее 98%, еще более предпочтительно не менее 99% соединения содержит стереогенный центр, отмеченный как , в конфигурации (R). Термин "разделение" при использовании в настоящем изобретении означает разделение смеси энантиомеров на соответствующие отдельные энантиомеры. Энантиомеры могут содержаться в смеси в различных соотношениях. Типичные соотношения энантиомеров в контексте настоящего изобретения находятся в диапазоне примерно от 3/97 до 97/3, предпочтительно примерно от 5/95 до 95/5, более предпочтительно примерно от 30/70 до 70/30, наиболее предпочтительно примерно от 40/60 до 60/40, еще более предпочтительно примерно от 45/55 до 55/45. Предпочтительно, если смесь представляет собой рацемическую смесь. В настоящем изобретении рацемическая смесь означает смесь, содержащую 50% одного энантиомера и 50% второго энантиомера. Разделение можно провести по различным методикам, включая превращение в диастереоизомеры,дифференциальную адсорбцию, хиральное распознавание, биохимические методики, механическое разделение, кинетическое разделение и дерацемизацию, подробно описанные в публикации Jerry March "Advanced Organic Chemistry", fourth edition, Chapter 4, pages 120-125. Предпочтительно, если в настоящем изобретении разделение проводят по методике дифференциального разделения, более предпочтительно путем хирального хроматографического разделения с использованием колонок, заполненных хиральной неподвижной фазой (ХСФ), и подвижной фазы. Хиральное хроматографическое разделение можно проводить в периодическом режиме или с помощью многоколоночной хроматографии (МКХ). Термин "многоколоночная хроматография" (МКХ) при использовании в настоящем изобретении означает технологию непрерывного хроматографического разделения, основанную на непрерывном регулируемом инжектировании смесей в последовательность соединенных колонок, заполненных неподвижной фазой. Затем отдельные компоненты смеси непрерывно выходят из системы. Этот подход включает, но не ограничивается только ими, хроматографический режим с псевдодвижущимся слоем (режим ПДС), режим, в котором входной и выходной порты работают асинхронно (такой как режим Varicol), и режим, в котором при переключении происходит изменение во времени входных и выходных скоростей потока и/или концентраций. Использование методики ПДС для разделения рацемических смесей на энантиомеры описано, например, в публикации "Lit mobile simule. Application a la separation d'isomeres optiques [Simulated mobilebed. Application to the separation of optical isomers]" by R.M. Nicoud, Information Chimie No. 368 (May 1995), p. 113-115. Система Varicol описана в заявке на международный патент WO 00/25885 и режим, в котором при переключении происходит изменение во времени входных и выходных скоростей потока и/или концентраций, описан в патенте U.S.5102553. Поэтому в предпочтительном варианте осуществления настоящего изобретения разделение 2 ацетамидо-N-бензил-3-метоксипропионамида (II) проводят путем хирального хроматографического разделения. В другом предпочтительном варианте осуществления разделение 2-ацетамидо-N-бензил-3 метоксипропионамида (II) проводят с помощью МКХ. Колонки, использующиеся в настоящем изобретении, обычно заполнены посредством ХСФ, которая представляет собой основу из диоксида кремния, на которую по методикам, хорошо известным в данной области техники, нанесен полимерный хиральный селектор. Полимерный хиральный селектор дополнительно можно иммобилизовать на основе из диоксида кремния, что дает колонку, которая, наряду с другими преимуществами, обладает большей стойкостью к воздействию растворителей. В предпочтительном варианте осуществления настоящего изобретения хиральное хроматографическое разделение 2-ацетамидо-N-бензил-3-метоксипропионамида (II) проводят с использованием колонки,которая включает полимерный хиральный селектор, который иммобилизован на основе из диоксида кремния. Полимерный хиральный селектор в контексте настоящего изобретения обычно включает полисахарид, например амилозу или целлюлозу. Примерами полимерного хирального селектора, который можно использовать в настоящем изобретении, являются трис-(4-метилбензоат)целлюлозы, трибензоат целлюлозы, трис-(3,5-диметилфенилкарбамат)амилозы,трис-(3,5-диметилфенилкарбамат)целлюлозы,трис-(4-метилфенилкарбамат)целлюлозы, трис-(3,5-дихлорфенилкарбамат)целлюлозы, трис[(S)метилбензилкарбамат]амилозы и трис-(3-хлор-4-метилфенилкарбамат)целлюлозы. В предпочтительном варианте осуществления настоящего изобретения хиральное хроматографическое разделение 2-ацетамидо-N-бензил-3-метоксипропионамида (II) на его энантиомеры проводят с использованием трис-(3,5-дихлорфенилкарбамат)целлюлозы, иммобилизованного на основе из диоксида кремния, в качестве хиральной неподвижной фазы. Примерами подвижной фазы, которую можно использовать в настоящем изобретении, являются алканы, такие как гептан, гексан, спирты, такие как метанол, этанол, изопропанол, н-пропанол, ацетонитрил, изопропилацетат, этилацетат, дихлорметан, хлороформ, простые эфиры, такие как метил-трет-2 019040 бутиловый эфир (МТБЭ), или их смеси. Если используют смеси растворителей, то отношение количеств растворителей зависит от типов растворителей, образующих смесь, от типа колонки, которую используют, и от растворимости разделяемого соединения в этих смесях. Примерами смесей растворителей в контексте настоящего изобретения являются смеси дихлорметана и спирта или смеси, содержащие ацетонитрил и спирт, или смеси, содержащие этилацетат и спирт. Предпочтительно, если смеси дихлорметана и спирта содержат от 90 до 99% дихлорметана. Предпочтительно, если смеси ацетонитрила и спирта содержат от 90 до 99% ацетонитрила. Предпочтительно, если смеси этилацетата и спирта содержат от 90 до 99% этилацетата. Предпочтительными растворителями в контексте настоящего изобретения являются этанол, метанол, н-пропанол, изопропанол, ацетонитрил, дихлорметан и этилацетат. В предпочтительном варианте осуществления настоящего изобретения в качестве подвижной фазы используют смесь этилацетата и метанола. В другом варианте осуществления настоящего изобретения в качестве подвижной фазы используют смесь этилацетата и метанола в соотношении 90/10 об./об. В другом предпочтительном варианте осуществления настоящего изобретения в качестве подвижной фазы используют ацетонитрил. В контексте настоящего изобретения обеспечивается производительность хирального хроматографического разделения, превышающая 1 кг разделенной рацемической смеси на 1 кг хиральной неподвижной фазы в день. В предпочтительном варианте осуществления настоящего изобретения обеспечивается производительность хирального хроматографического разделения, превышающая 2 кг разделенной рацемической смеси на 1 кг хиральной неподвижной фазы в день. Как показано на схеме 2, вторым объектом настоящего изобретения является способ получения в основном оптически чистого (R)-2-ацетамидо-N-бензил-3-метоксипропионамида (I), включающий:(c) дополнительное разделение полученного 2-ацетамидо-N-бензил-3-метоксипропионамида (II). Схема 2 Стадии (а) и (с) обычно проводят путем хирального хроматографического разделения, предпочтительно с помощью МКХ.(R)-2-Ацетамидо-N-бензил-3-метоксипропионамид (I), полученный на стадиях (а) и (с), может быть оптически обогащенным или в основном оптически чистым. Обычно (R)-2-ацетамидо-N-бензил-3 метоксипропионамид (I), полученный на стадиях (а) и (с), является в основном оптически чистым. Это особенно полезно, поскольку исключается проведение повторяющихся стадий очистки, таких как кристаллизация, которые влияют на производительность всего способа.(S)-2-Ацетамидо-N-бензил-3-метоксипропионамид (III), полученный на стадии (а), может быть оптически обогащенным или в основном оптически чистым. Термин "рацемизация" при использовании в настоящем изобретении означает превращение оптически обогащенного энантиомера или в основном оптически чистого энантиомера в смесь, содержащую указанный энантиомер и второй энантиомер, вплоть до образования рацемической смеси. Стадию (b) обычно можно провести по реакции оптически обогащенного или в основном оптически чистого (S)-2-ацетамидо-N-бензил-3-метоксипропионамида (III) с основанием с подкислением или без подкисления сред. Примерами оснований, которые можно использовать в настоящем изобретении, являются метоксид натрия, гидроксид калия, гидроксид натрия, карбонат калия, карбонат натрия, третичные амины, такие как триэтиламин, 1,8-диазабицикло[5.4.0]ундец-7-ен и сильно или слабо основные анионообменные смолы, такие как AMBERLYST A21, AMBERLITE IRA400 или IRA410, и т.п. Предпочтительными основаниями в контексте настоящего изобретения являются метоксид натрия,гидроксид калия, гидроксид натрия, карбонат калия и карбонат натрия. Если проводят подкисление сред, то его предпочтительно проводят с использованием стехиометрического количества кислоты в пересчете на основание, чтобы исключить образование любых продуктов разложения. Указанный общий способ является особенно полезным, поскольку в нем устранено любое снижение производительности, которое иногда может происходить при использовании стадии разделения. В действительности побочным продуктом способа часто является нежелательный энантиомер, который необходимо удалить из реакционной среды. При рециркуляции нежелательного энантиомера и проведении дополнительного разделения, например разделения с помощью хиральной хроматографии, увеличиваются суммарный выход способа и производительность. Стадии (b) и (с) можно проводить несколько раз, что дополнительно увеличивает суммарный выход способа. В предпочтительном варианте осуществления настоящего изобретения в качестве основания используют метоксид натрия. Рацемизацию обычно проводят в растворителе при температуре от 20 до 80 С, предпочтительно при температуре от 40 до 60 С. Для исключения образования продуктов разложения реакцию более предпочтительно проводят при температуре ниже 60 С. Примерами растворителей, которые можно использовать на стадии (b), являются спирты, такие как метанол, этанол, простые эфиры, такие как тетрагидрофуран (ТГФ), 2-метилтетрагидрофуран, или ацетонитрил. В предпочтительном варианте осуществления настоящего изобретения растворителем является метанол. 2-Ацетамидо-N-бензил-3-метоксипропионамид (II) можно получить ацетилированием 2-амино-Nбензил-3-метоксипропионамида (IV) по методикам, известным специалисту в данной области техники,как показано на приведенной ниже схеме 3. Схема 3 Ацетилирование предпочтительно можно провести с использованием ацетилирующего реагента,такого как уксусный ангидрид или ацетилхлорид. Особенно предпочтительным ацетилирующим реагентом в контексте настоящего изобретения является уксусный ангидрид. Ацетилирование обычно проводят в растворителе при температуре от 20 до 70 С. Примерами растворителей, которые можно использовать для ацетилирования, являются дихлорметан, тетрагидрофуран,этилацетат, изопропилацетат и изобутилацетат. Предпочтительными растворителями являются изопропилацетат и изобутилацетат. Ацетилирование предпочтительно проводят при температуре от 50 до 70 С. Ацетилирование более предпочтительно проводят при температуре, равной примерно 60 С. 2-Амино-N-бензил-3-метоксипропионамид (IV) можно получить по методике, описанной на схеме 1 в патенте US 6048899, который включен в настоящее изобретение в качестве ссылки, с использованием рацемического серина в качестве исходного вещества или по любой другой методике, известной специалисту в данной области техники. Альтернативно, 2-амино-N-бензил-3-метоксипропионамид (IV) можно получить аммонолизом соединения (V), в котором X обозначает отщепляющуюся группу, по следующей схеме 4. Схема 4 Термин "отщепляющаяся группа" при использовании в настоящем изобретении обладает таким же значением, как описанное в данной области техники (Advanced Organic Chemistry: reactions, mechanisms и structure - Third Edition by Jerry March, John Wiley и Sons Ed., 1985, p. 179), т.е. означает группу, которая является частью молекулы субстрата и присоединена к ней и в реакции, в которой молекула субстрата подвергается замещению (например, с помощью нуклеофила), она (отщепляющаяся группа) подвергается замещению. Примерами отщепляющейся группы в контексте настоящего изобретения являются галогенидная или сульфонатная группы. Термин "сульфонатная группа" при использовании в настоящем изобретении обозначает группу формулы -O-SO2-Ra, в которой Ra обозначает алкил или арил, определенный выше в настоящем описании. Предпочтительными сульфонатными группами являются метансульфонатная, паратолуолсульфонатная или трифторметансульфонатная группы. Предпочтительно, если отщепляющаяся группа X в соединении формулы (V) представляет собой галоген, более предпочтительно бром или хлор. Наиболее предпочтительно, если X обозначает бром. Реакцию аммонолиза можно провести по методикам, известным в данной области техники. Например, аммонолиз можно провести по методике, описанной в заявке на международный патент, опубликованной как WO 03/014080. В контексте настоящего изобретения аммонолиз предпочтительно проводят с помощью водного раствора аммиака в присутствии метанола. В предпочтительном варианте осуществления настоящего изобретения избыток аммиака в пересчете на количество соединения (V) используют для исключения образования примесей вторичных аминов. Например, используют от 20 до 25 мол.экв. аммиака в пересчете на количество соединения (V). После реакции аммонолиза 2-амино-N-бензил-3-метоксипропионамид (IV) обычно экстрагируют из реакционных сред растворителем. Примерами растворителей, которые можно использовать для указанной экстракции, являются изобутилацетат, изопропилацетат, пропилацетат, этилацетат, 2 метилтетрагидрофуран, дихлорметан и толуол. Предпочтительно, если в качестве растворителя для экстракции 2-амино-N-бензил-3 метоксипропионамида (IV) используют изобутилацетат. Экстракцию изобутилацетатом предпочтительно проводят при значении рН, превышающем 10 и меньше чем 12, более предпочтительно при значении рН,равном от 11 до 12, чтобы повысить выход выделяемого 2-амино-N-бензил-3-метоксипропионамида (IV). В другом варианте осуществления настоящего изобретения 2-амино-N-бензил-3 метоксипропионамид (IV) можно получить по реакции Габриэля соединения (V), в котором отщепляющейся группой является галоген. В этом варианте осуществления типичные условия проведения реакции включают взаимодействие соединения формулы (V) со фталимидом калия и последующее взаимодействие образовавшегося таким образом промежуточного продукта с гидразином в этаноле, как показано на приведенной ниже схеме 5. Схема 5 Соединение формулы (V) можно синтезировать по различным методикам, известным в данной области техники. Например, 2-бром-N-бензил-3-метоксипропионамид (Va) можно получить по методике,описанной в публикации Bioorganic and Medicinal Chemistry, 2004, 3079. Альтернативно, соединения формулы (V), предлагаемые в настоящем изобретении, можно получить по реакции соединения формулы (VI), в которой X обозначает отщепляющуюся группу, определенную выше в настоящем изобретении, и Y обозначает гидроксигруппу или С 1-С 10-алкоксигруппу, с бензиламином по следующей схеме 6. Схема 6 Термин "гидроксигруппа" при использовании в настоящем изобретении обозначает группу формулы -ОН. Термин "алкоксигруппа" при использовании в настоящем изобретении обозначает группу формулы-ORb, в которой Rb обозначает C1-C10-алкил, определенный выше. Термин "алкил" при использовании в настоящем изобретении означает группу, которая является насыщенным, одновалентным углеводородным радикалом, содержащим линейный (неразветвленный),разветвленный или циклический фрагмент или их комбинацию. Условия проведения реакции зависят от природы групп X и Y. Соединение формулы (VI), в которой X обозначает галоген и Y обозначает гидроксигруппу, ниже в настоящем изобретении называющееся соединением формулы (VIa), можно превратить in situ в смешанный ангидрид (VIIIa) (методика А), в котором R обозначает C1-С 10-алкил, или в хлорангидрид кислоты(VIIIb) (методика В) и затем промежуточные продукты взаимодействуют с бензиламином, как показано на приведенной ниже схеме 7. По методике А соединение формулы (VIa), в которой X обозначает хлор или бром, вводят в реакцию с алкилгалогенформиатом, например этилхлорформиатом или изобутилхлорформиатом, при температуре от -10 до 10 С, затем добавляют основание и получают соответствующий смешанный ангидрид(VIIIa), который не выделяют из реакционных сред. Смешанный ангидрид (VIIIa) вводят в реакцию с бензиламином в растворителе при температуре от -10 до 10 С. Предпочтительно, если указанная температура равна от -5 до 0 С. Примерами растворителя, который можно использовать в этом варианте осуществления, являются дихлорметан, этилацетат, изобутилацетат, тетрагидрофуран, толуол, пропилацетат, изопропилацетат. В предпочтительном варианте осуществления настоящего изобретения в качестве растворителя используют изобутилацетат или толуол. Примерами подходящих оснований в этом варианте осуществления являются триэтиламин, пиридин, N-метилморфолин, основание Хюнига. В предпочтительном варианте осуществления настоящего изобретения основанием является N-метилморфолин. Соединение формулы (VIa), которое можно использовать в качестве исходного вещества в методике А, представляет собой 2-хлор-3-метоксипропионовую кислоту (VIc) или 2-бром-3 метоксипропионовую кислоту (VId). 2-Хлор-3-метоксипропионовую кислоту (VIc) продают различные поставщики. 2-Бром-3-метоксипропионовую кислоту (VId) легко получить по реакции 2,3-бромпропионовой кислоты или соответствующих алкиловых эфиров с метоксидом натрия в метаноле с выходами более 85%. Методика получения 2-бром-3-метоксипропионовой кислоты (VId), например, описана в публикацииL.L. WoodV. du Vigneaud, J. Biol. Chemistry, 1940, 134, 413. В предпочтительном варианте осуществления настоящего изобретения 2-бром-3 метоксипропионовую кислоту (VId) можно получить с использованием в качестве исходного вещества имеющегося в продаже 2,3-дибромэтилпропионата (VIIa) или 2,3-дибромметилпропионата (VIIb). 2,3 Дибромэтилпропионат (VIIa) или 2,3-дибромметилпропионат (VIIb) вводят в реакцию с метоксидом натрия в органическом растворителе, предпочтительно метаноле, при температуре ниже 10 С, предпочтительно ниже 0 С, и получают 2-бром-3-метоксиметилпропионат (VIe), который затем in situ вводят в реакцию с гидроксидом натрия при температуре от 0 до 25 С, предпочтительно при температуре от 20 до 25 С, и после подкисления смеси водным раствором хлористо-водородной кислоты получают 2-бром-3 метоксипропионовую кислоту (VId) с выходом от 80 до 90% по следующей схеме 8. Схема 8 Для исключения образования продуктов разложения предпочтительно используют стехиометрическое количество гидроксида натрия в пересчете на количество 2-бром-3-метоксиметилпропионата (VIe). Таким образом, 2-хлор-3-метоксипропионовую кислоту (VIc) и 2-бром-3-метоксипропионовую кислоту (VId), которые можно использовать в способе, предлагаемом в настоящем изобретении, легко получить из недорогих исходных веществ. 2-Бром-3-метоксипропионовая кислота (VId) является особенно предпочтительной, поскольку она дает соответствующее соединение формулы (V) с более высоким выходом и более высокой чистотой,чем соответствующая 2-хлор-3-метоксипропионовая кислота (VIc). По методике В соединения формулы (VIa), в которой X обозначает хлор или бром, можно превратить в соответствующий хлорангидрид кислоты по стандартным методикам, известным специалисту в данной области техники, или по реакции с соединением, выбранным из группы, включающей тионилхлорид, оксалилхлорид, трихлорид фосфора, пентахлорид фосфора, оксихлорид фосфора, дихлорангидрид фенилфосфоновой кислоты и N-хлорсукцинимид, предпочтительно с тионилхлоридом. Указанную методику В можно провести в растворителе, выбранном из группы, включающей дихлорметан, толуол, изобутилацетат или изопропилацетат, при температуре, равной от 20 до 60 С. Примером соединения (VIa), которое можно использовать в методике В, является 2-хлор-3-6 019040 метоксипропионовая кислота (VIc). Соединение формулы (VI), в которой X обозначает галоген и Y обозначает C1-С 10-алкоксигруппу,ниже в настоящем изобретении называющееся соединением формулы (VIb), можно превратить в соответствующее соединение формулы (V) по реакции с бензиламином (методика С) или омылить и получить соответствующую кислоту (VIa), которую затем можно подвергнуть любым из превращений (методики А и В), указанным выше на схеме 7, как это показано ниже на схеме 9. Схема 9 Методика А более предпочтительна, чем методики В и С, поскольку она дает соединение (V) с более высоким выходом и улучшенного качества. Таким образом, в одном варианте осуществления 2-ацетамидо-N-бензил-3-метоксипропионамид(i) взаимодействие соединения формулы (VIa)(ii) проведение аммонолиза соединения (V), полученного на стадии (i), в котором X является таким,как определено для соединения (VIa);(iii) ацетилирование полученного таким образом соединения формулы (IV)(iv) выделение соединения формулы (II). Стадию (i) предпочтительно проводят по реакции соединения (VIa) с этилхлорформиатом или изобутилхлорформиатом, затем добавляют N-метилморфолин, что приводит к образованию соединения(VIIIa) in situ. Таким образом, в предпочтительном варианте осуществления настоящего изобретения соединение формулы (VIIIa), в которой X обозначает галоген и R обозначает C1-С 10-алкил, образуется in situ, как это показано выше на схеме 7. Затем соединение формулы (VIIIa), образовавшееся in situ, вводят в реакцию с бензиламином и получают соединение формулы (V). Реакцию на стадии (i) проводят при температуре от -10 до 10 С. Предпочтительно, если указанная температура равна от -5 до 0 С. Стадию (ii) предпочтительно проводят путем обработки соединения (V) молярным избытком водного раствора аммиака в присутствии метанола. Более предпочтительно, если используют от 20 до 25 мол.экв. аммиака в пересчете на количество соединения (V). Стадию (iii) предпочтительно проводят с использованием уксусного ангидрида в качестве ацетилирующего реагента и при температуре от 50 до 70 С. Более предпочтительно, если ацетилирование проводят при температуре, равной примерно 60 С. Альтернативно, соединение формулы (V) можно синтезировать по реакции соединения формулы(VIIa) или (VIIb) при условиях, указанных выше для превращения (VIIa) или (VIIb) в (VId), с последую-7 019040 щей реакцией с бензиламином без выделения промежуточного соединения (VI). Это обеспечивает увеличение выхода и производительности, поскольку способ в целом включает на одну стадию меньше. Примерами соединений формулы (V), предлагаемых в настоящем изобретении,являются 2-бром-N-бензил-3-метоксипропионамид (Va) и 2-хлор-N-бензил-3-метоксипропионамид (Vb). Примерами соединений формулы (VI), предлагаемых в настоящем изобретении, являются 2-бром-3 метоксипропионовая кислота (VId), метиловый эфир 2-бром-3-метоксипропионовой кислоты (VIe), этиловый эфир 2-бром-3-метоксипропионовой кислоты, 2-хлор-3-метоксипропионовая кислота (VIc), метиловый эфир 2-хлор-3-метоксипропионовой кислоты, этиловый эфир 2-хлор-3-метоксипропионовой кислоты и 2-бром-3-метоксипропионилхлорид. Предпочтительно соединения (V), (IV) и (II) соответственно выделяют из реакционных сред раньше, чем они подвергнутся какому-либо последующему химическому превращению. Указанное выделение можно провести по любым методикам, известным специалисту в данной области техники. Соединение формулы (V) предпочтительно выделяют путем кристаллизации из смеси растворителей, выбранных из группы, включающей гептан, толуол, изобутилацетат, пропилацетат, метил-третбутиловый эфир. В предпочтительном варианте осуществления указанная смесь включает гептан. Соединение формулы (VI) можно выделять или не выделять из реакционных сред. Соединение формулы (II) предпочтительно выделяют путем кристаллизации из смеси растворителей, выбранных из группы, включающей изобутилацетат, изопропилацетат, пропилацетат, 2-Мететрагидрофуран и ацетонитрил. В предпочтительном варианте осуществления настоящего изобретения указанная смесь включает изобутилацетат или этилацетат. В предпочтительном варианте осуществления 2-ацетамидо-N-бензил-3-метоксипропионамид (II),предлагаемый в настоящем изобретении, получают способом, включающим следующие стадии:(iv) выделение полученного таким образом соединения формулы (II). В этом предпочтительном варианте осуществления 2-бром-3-метоксиметил пропионовую кислоту(VId) получают из имеющегося в продаже 2,3-дибромэтилпропионата (VIIa) или 2,3 дибромметилпропионата (VIIb), как это показано на схеме 8 в настоящем изобретении. Условия проведения реакций на стадиях (i)-(iv) являются такими, как описанные выше в настоящем изобретении для методики А на схеме 7. В предпочтительном варианте осуществления настоящего изобретения 2,3-дибромэтилпропионат (VIIa) можно превратить в 2-бром-N-бензил-3-метоксипропионамид(Va) без выделения 2-бром-3-метоксиметилпропионовой кислоты (VId), которая образовалась in situ. Таким образом, в предпочтительном варианте осуществления настоящее изобретение относится к способу получения 2-ацетамидо-N-бензил-3-метоксипропионамида (II), включающему следующие стадии:(iv) выделение полученного таким образом соединения формулы (II). В другом варианте осуществления настоящего изобретения 2-ацетамидо-N-бензил-3 метоксипропионамид (II) получают по реакции 2-ацетамидо-3-метоксипропионовой кислоты (IX) с алкилхлорформиатом, предпочтительно этил- или изобутилхлорформиатом, с получением смешанного ангидрида, который затем вводят в реакцию с бензиламином. 2-Ацетамидо-3-метоксипропионовую кислоту (IX) можно получить ацетилированием имеющегося в продаже О-метил-D,L-серина (X) по следующей схеме 10. Схема 10 Таким образом, настоящее изобретение также относится к способу получения лакозамида, включающему следующие стадии:(ii) взаимодействие полученной таким образом 2-ацетамидо-3-метоксипропионовой кислоты (IX) с алкилхлорформиатом, затем бензиламином;(iii) выделение соединения формулы (II);(v) рацемизацию полученного таким образом (S)-2-ацетамидо-N-бензил-3-метоксипропионамида(III). Стадию (i) обычно проводят с использованием уксусного ангидрида в качестве ацетилирующего реагента в уксусной кислоте, толуоле, тетрагидрофуране, 2-метилтетрагидрофуране, изобутилацетате,дихлорметане или воде или в их смеси. В предпочтительном варианте осуществления настоящего изобретения указанную стадию проводят в смеси тетрагидрофурана и воды. Стадию (ii) обычно проводят в присутствии этилхлорформиата или изобутилхлорформиата и Nметилморфолина или триэтиламина в тетрагидрофуране, 2-метилтетрагидрофуране, толуоле, этилацетате или дихлорметане. Альтернативно, стадию (ii) можно провести в присутствии катализатора, выбранного из группы,включающей борную кислоту, фенилбороновую кислоту, 3,4,5-трифторфенилбороновую кислоту, 2(N,N-диизопропиламинометил)фенилбороновую кислоту и 2-(N,N-диметиламинометил)фенилбороновую кислоту, путем кипячения с обратным холодильником в растворителе, выбранном из группы, включающей толуол, N-метилпирролидон и их смеси, тетрагидрофуран, 2-метилтетрагидрофуран, циклопентилметиловый эфир, ди-н-бутиловый эфир, фторбензол, с использованием аппарата Дина-Старка, молекулярных сит или сульфата натрия для непрерывного удаления воды. Катализатор, предлагаемый в настоящем изобретении, может быть растворим в реакционных средах или может находиться на твердой подложке. В предпочтительном варианте осуществления настоящего изобретения в качестве растворителя используют смесь толуола и N-метилпирролидона. Отношение объема толуола к объему Nметилпирролидона составляет, например, 80/20 или 99/1. В другом варианте осуществления бензилирование соединения формулы (IX) с получением соединения формулы (II) можно провести бензиламином в присутствии ди-трет-бутилдикарбоната (Вос 2 О), в присутствии пиридина, триэтиламина или основания Хюнига в растворителе, выбранном из группы,включающей тетрагидрофуран, 2-метилтетрагидрофуран, этилацетат и дихлорметан. В другом варианте осуществления бензилирование соединения формулы (IX) с получением соединения формулы (II) можно провести бензиламином в присутствии ангидрида н-пропанфосфоновой ки-9 019040 слоты (Т 3 Р), в присутствии триэтиламина или основания Хюнига в растворителе, выбранном из группы, включающей этилацетат, тетрагидрофуран, дихлорметан и 2-метилтетрагидрофуран. В еще одном варианте осуществления бензилирование соединения формулы (IX) с получением соединения формулы (II) можно провести бензиламином в присутствии дициклогексил- (ДЦК) или диизопропилкарбодиимида (ДИК) в растворителе, выбранном из группы, включающей тетрагидрофуран, этилацетат и дихлорметан. В еще одном варианте осуществления бензилирование соединения формулы (IX) с получением соединения формулы (II) можно провести в неразбавленном бензиламине в присутствии гексаметилдисилазана (ГМДС). В еще одном варианте осуществления бензилирование соединения формулы (IX) с получением соединения формулы (II) можно провести путем нагревания твердой смеси (IX) с бензиламином состава 1:1 при температуре выше 130 С. Катализаторы, использующиеся на стадии бензилирования в этом предпочтительном варианте осуществления настоящего изобретения, могут быть растворимы в реакционных средах или могут находиться на твердой подложке. Этот способ является особенно полезным, поскольку для превращения исходного вещества в соединение (II) он включает небольшое количество химических стадий. Предпочтительным объектом настоящего изобретения является способ получения лакозамида,включающий следующие стадии:(i) взаимодействие соединения формулы (VIa)(ii) проведение аммонолиза соединения (V), полученного на стадии (i), в котором X является таким,как определено для соединения (VIa)(iii) ацетилирование полученного таким образом соединения формулы (IV)(iv) выделение соединения формулы (II);(v) проведение разделения 2-ацетамидо-N-бензил-3-метоксипропионамида (II) на (R)-2-ацетамидоN-бензил-3-метоксипропионамид (I) и (S)-2-ацетамидо-N-бензил-3-метоксипропионамид (III). Еще более предпочтительным объектом настоящего изобретения является способ получения (R)-2 ацетамидо-N-бензил-3-метоксипропионамида (I), включающий следующие стадии:(i) взаимодействие соединения формулы (VIa)(ii) проведение аммонолиза соединения (V), полученного на стадии (i), в котором X является таким,как определено для соединения (VIa)(iii) ацетилирование полученного таким образом соединения формулы (IV)(iv) выделение соединения формулы (II);(vi) рацемизацию полученного таким образом (S)-2-ацетамидо-N-бензил-3-метоксипропионамида(vii) дополнительное разделение полученного 2-ацетамидо-N-бензил-3-метоксипропионамида (II). Стадию (iv) предпочтительно проводят путем кристаллизации в растворителе, выбранном из группы, включающей толуол, этилацетат, изобутилацетат, изопропилацетат, ацетонитрил, 2 метилтетрагидрофуран и их смеси. Таким образом, предпочтительно получают соединение (II), по данным ВЭЖХ обладающее чистотой, составляющей не менее примерно 98%, более предпочтительно чистотой, составляющей не менее примерно 99%, наиболее предпочтительно чистотой, составляющей не менее примерно 99,5%. В этих двух вариантах осуществления, подробно описанных выше в настоящем изобретении, стадию (v) предпочтительно проводят путем хирального хроматографического разделения. В одном варианте осуществления настоящего изобретения хиральное хроматографическое разделение проводят с помощью МКХ. Указанное разделение предпочтительно проводят с использованием ХСФ, которая включает полисахаридный хиральный селектор, нанесенный на основу из диоксида кремния или иммобилизованный на ней по методикам, хорошо известным в данной области техники, и подвижной фазы, как это подробно описано выше. В предпочтительном варианте осуществления настоящего изобретения полимерный хиральный селектор выбран из группы, включающей трис-(4-метилбензоат)целлюлозы, трибензоат целлюлозы, трис(3,5-диметилфенилкарбамат)амилозы трис-(3,5-диметилфенилкарбамат)целлюлозы,трис-(4 метилфенилкарбамат)целлюлозы трис-(3,5-дихлорфенилкарбамат)целлюлозы,трис-(3,5 диметилфенилкарбамат)амилозы и трис-(3-хлор-4-метилфенилкарбамат)целлюлозы, и растворитель выбран из группы, включающей алканы, такие как гептан, гексан, спирты, такие как метанол, этанол, изопропанол, н-пропанол, ацетонитрил, изопропилацетат, этилацетат, дихлорметан, хлороформ, простые эфиры, такие как метил-трет-бутиловый эфир (МТБЭ), или их смеси. В предпочтительном варианте осуществления настоящего изобретения разделение на стадии (v) проводят с использованием в качестве полимерного хирального селектора трис-(3,5 дихлорфенилкарбамат)целлюлозы, иммобилизованного на основе из диоксида кремния, и смесь этилацетата и метанола в соотношении 90/10 об./об. используют в качестве подвижной фазы. Стадию (vi) предпочтительно проводят по реакции соединения (III) с метоксидом натрия с последующим стехиометрическим подкислением. Температура рацемизации предпочтительно ниже 60 С. В способе получения лакозамида в основном оптически чистый (R)-2-ацетамидо-N-бензил-3 метоксипропионамид (I), полученный после стадии разделения, для очистки можно дополнительно кристаллизовать. Эту кристаллизацию предпочтительно проводят в этилацетате. В предпочтительном варианте осуществления настоящего изобретения кристаллизацию инициируют путем внесения в кристаллизующуюся среду затравки кристаллов в основном оптически чистого (R)2-ацетамидо-N-бензил-3-метоксипропионамида (I). В этом предпочтительном варианте осуществления внесение затравки кристаллов следует проводить при температуре, равной от 60 до 80 С, предпочтительно при температуре, равной от 65 до 75 С. Способ, предлагаемый в настоящем изобретении, является более предпочтительным, чем другие известные способы получения лакозамида, поскольку: исходные вещества легкодоступны; не требуется введение защитных групп для аминогрупп, содержащихся в промежуточных продуктах синтеза, что привело бы к проведению дополнительных стадий введения/удаления защитных групп и тем самым к увеличению стоимости производства; не требуется использование реагентов, которые оказывают вредное воздействие на окружающую среду; нежелательный энантиомер (III) в конечном счете можно рециркулировать в лакозамид и тем самым увеличить суммарную производительность способа. В другом варианте осуществления настоящее изобретение относится к способу получения в основном оптически чистого (R)-2-ацетамидо-N-бензил-3-метоксипропионамида (I), включающему следую- 11019040(ii) ацетилирование полученного таким образом (R)-2-амино-N-бензил-3-метоксипропионамида(iii) кристаллизация полученного таким образом(R)-2-ацетамидо-N-бензил-3 метоксипропионамида. В этом варианте осуществления разделение предпочтительно проводят посредством образования соли диастереоизомера по реакции соединения формулы (IV) с кислотой, выбранной из группы, включающей R)-(-)-миндальную кислоту, (S)-(+)-миндальную кислоту, (D)-(+)-яблочную кислоту, (L)-(-)яблочную кислоту, (+)-О,О'-дибензоилвинную кислоту, (L)-N-ацетилаланин и (D)-N-ацетиллейцин, т.е. по методике превращения в диастереоизомеры, описанной в публикации Jerry March in "Advanced Organic Chemistry", fourth edition, Chapter 4, p. 120-125. Разделение предпочтительно проводят в растворителе, выбранном из группы, включающей ацетон,метанол, этанол, 1-пропанол, метил-трет-бутиловый эфир, гептан, циклогексан, метилэтилкетон, изопропилацетат и их смеси. Разделение предпочтительно проводят при температуре, равной от 20 до 60 С, с последующим охлаждением до температуры, равной от 0 до 20 С.(R)-2-Ацетамидо-N-бензил-3-метоксипропионамид дополнительно кристаллизуют и получают в основном оптически чистый (R)-2-ацетамидо-N-бензил-3-метоксипропионамид. Указанную кристаллизацию повторяют несколько раз, пока не получают (R)-2-ацетамидо-N-бензил-3-метоксипропионамид необходимой оптической чистоты. Альтернативно, стадию разделения можно провести путем хирального хроматографического разделения с использованием методик дифференциальной адсорбции, более предпочтительно с использованием хирального хроматографического разделения, проводимого в периодическом режиме, или с помощью МКХ (многоколоночная хроматография), включая режим ПДС (с псевдодвижущимся слоем) или режим,в котором входной и выходной порты работают асинхронно, или режим, в котором при переключении происходит изменение во времени входных и выходных скоростей потока и/или концентраций, как подробно описано выше для случая 2-ацетамидо-N-бензил-3-метоксипропионамида (II). 2-Амино-N-бензил-3-метоксипропионамид (IV), использующийся в этом варианте осуществления,можно получить по любой из методик, описанных выше в настоящем изобретении. Все стадии способов, указанные выше, и в особенности способов получения соединения (II), включая синтез и экстракцию соединений, можно по отдельности или совместно провести в периодическом режиме или в непрерывном режиме, например, с использованием микрореакторов. Примеры Приведенные ниже примеры представлены только для иллюстративных целей и не предназначены для рассмотрения и не должны рассматриваться в качестве каким-либо образом ограничивающих настоящее изобретение. Специалисты в данной области техники должны понимать, что без выхода за пределы объема и сущности настоящего изобретения можно выполнить обычные изменения и модификации приведенных ниже примеров. Спектры ЯМР (ядерного магнитного резонанса) снимают на спектрометре Bruker 400 МГц в виде растворов в дейтерированном хлороформе (CDCl3). Химические сдвиги приведены в частях на миллион(ч./млн, ) в слабопольную сторону от тетраметилсилана, и внутренним стандартом является дейтерированный растворитель (CDCl3). Данные 1H ЯМР приведены в следующем порядке: химический сдвиг, мультиплетность (s, синглет;d, дублет; t, триплет; q, квартет; m, мультиплет; кажущийся и/или мультиплетный резонанс), константа спин-спинового взаимодействия (J) в герцах (Гц) и количество протонов. Исследования с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ) проводят с использованием Alliance Waters 2695, снабженного колонкой Atlantis Т 3 3 мкм (4,6100 мм), с детектированием при длине волны, равной 200 нм - состав начального растворителя=вода: 90 об.%/вода + 1% Н 3 РО 4: 10 об.%; состав конечного растворителя=вода + 1% Н 3 РО 4: 10 об.%/ацетонитрил: 90 об.% в течение 6 мин, затем приведение в равновесие с начальным растворителем в течение 1 мин. Хиральную ВЭЖХ проводят на приборе Merck-Hitachi L-7100, снабженном Daicel Chiralpak OJ-H 5 мкм. Используют элюент, представляющий собой смесь гептан/этанол 96/4, при скорости потока, равной 2 мл/мин. Исследования с помощью газовой хроматографии (ГХ) проводят с использованием Agilent 6890 series, снабженного колонкой Altech GC DB-5MS (15 м 0,25 мм). Печь нагревают до 50 С и используют скорость потока гелия, равную 1,5 мл/мин, и ПИД (пламенный ионизационный детектор) нагревают до 300 С. Масс-спектры (МС): спектры ИАД (ионизация при атмосферном давлении) снимают с использованием масс-спектрометра с ионной ловушкой FINNIGAN (San Jose, CA, USA) LCQ. Источник ХИАД (химическая ионизация при атмосферном давлении) работает при температуре, равной 450 С, и нагреватель В сухой аппаратуре в атмосфере азота имеющийся в продаже 2,3-дибромэтилпропионат (VII) (1 экв.) растворяют в 4 об. сухого метанола и раствор охлаждают до -10 С при перемешивании. Медленно добавляют 25% мас./мас. раствор метоксида натрия в метаноле (1,1 экв.), так чтобы температура поддерживалась ниже -5 С. После добавления смеси дают нагреться до комнатной температуры и затем реакционную смесь перемешивают при 20 С в течение 1 ч. При температуре, поддерживаемой ниже 23 С, медленно добавляют 20% водный раствор гидроксида натрия (1 экв.). Затем реакционную смесь перемешивают при 20 С в течение 1 ч. 37% водный раствор HCl медленно добавляют до рН 5-6 и реакционную смесь концентрируют до минимального объема, при котором возможно перемешивание, т.е. до 1 об. на 1 об. соединения (VII), в вакууме при температуре, равной не более 40 С. 37% водный раствор HCl добавляют до рН 2 и солеобразный остаток переносят в минимальное количество воды (0,6 об.) и получают раствор и соединение (VId) экстрагируют изобутилацетатом (32 об.). Органический слой выпаривают примерно до 4 об. и получают раствор 2-бром-3 метоксипропионовой кислоты (VId). Пример 1b. Получение 2-бром-N-бензил-3-метоксипропионамида (Va) из 2-бром-3 метоксипропионовой кислоты (VId). Методика А Раствор 2-бром-3-метоксипропионовой кислоты (VId) (1 экв., количество рассчитано с помощью анализа массы) в изобутилацетате, полученный на предыдущей стадии, при перемешивании охлаждают до -5 С. Добавляют этилхлорформиат (1,1 экв.) и получают массу при температуре от -5 до 0 С. Капельную воронку промывают с помощью 0,1 об. изобутилацетата. Медленно добавляют N-метилморфолин(1,1 экв.) и получают массу при температуре от -5 до 0 С. Капельную воронку промывают с помощью 0,1 об. изобутилацетата. Затем раствор перемешивают в течение 30 мин при -5/0 С. Добавляют бензиламин(1,1 экв.) и получают массу при температуре от -5 до 0 С. Капельную воронку промывают с помощью 0,25 об. изобутилацетата. Реакционной смеси дают нагреться до 25-30 С и затем перемешивают в течение примерно 1 ч (по данным ВЭЖХ площадь пика (VId) составляет менее 0,2%). Добавляют 1 об. воды на 1 об. исходного раствора (VId) и смесь перемешивают в течение 15 мин. Водный слой отделяют и органический слой промывают водой (0,5 об.). Раствор концентрируют в вакууме при 40 С примерно до 2,5-3 об. изобутилацетата и при 30-35 С вносят затравку кристаллов соединения (Va) и суспензию охлаждают до комнатной температуры, пока не произойдет эффективное инициирование кристаллизации. При такой же температуре медленно добавляют примерно 5 об. гептана. Затем суспензию постепенно охлаждают до -10 С. Кристаллы отфильтровывают, промывают охлажденной смесью 1:2 iButOAc/гептан (1 об. и гептаном (2 об. и сушат при 40 С в вакууме. 2-Бром-N-бензил-3 метоксипропионамид (Va) выделяют с выходом 70% (в пересчете на этилдибромпропионат, использованный на стадии 1). ние 15 мин по каплям добавляют 1,1 экв. SOCl2. После добавления перемешивают в течение 20 мин при 20 С. Затем реакционную смесь охлаждают до -10 С и в течение 15 мин по каплям добавляют 2 экв. триэтиламина. Нагревают до 20 С и перемешивают в течение 20 мин при 20 С. Реакционную смесь охлаждают до -10 С, по каплям добавляют 1 экв. бензиламина и реакционной смеси дают нагреться до 20 С. Добавляют 1 об. воды на 1 об. исходного раствора VId и смесь перемешивают в течение 15 мин. Водный слой отделяют и органический слой промывают водой (0,5 об.). Раствор концентрируют в вакууме при 40 С примерно до 2,5-3 об. изобутилацетата и при 30-35 С вносят затравку кристаллов соединения (Va) и суспензию охлаждают до комнатной температуры, пока не произойдет эффективное инициирование кристаллизации. При такой же температуре медленно добавляют примерно 5 об. гептана. Затем суспензию постепенно охлаждают до -10 С. Кристаллы отфильтровывают, промывают охлажденной смесью 1:2 5,2 г 2,3-дибромэтилпропионата (VII) растворяют в 20 мл метанола. При температуре, равной от -10 до -5 С, в течение 5 мин добавляют 4,08 мл 30% раствора метанолята натрия в метаноле. Раствор перемешивают в течение 10 мин при температуре, равной от 0 до 5 С. Затем к смеси добавляют 10,9 мл бензиламина и ее перемешивают в течение 2 ч при комнатной температуре. Метанол выпаривают и остаток переносят в 100 мл 1 М хлористо-водородной кислоты. Образовавшийся осадок экстрагируют с помощью 50 мл дихлорметана. Затем дихлорметан досуха выпаривают из среды. Остаток: 4,2 г бесцветного неочищенного вещества. Остаток перекристаллизовывают из смеси 6 мл метил-трет-бутилового эфира и 3 мл н-гептана и выделяют 2,79. Выход=51,26%; ЖХ-МС (жидкостная хроматография - масс-спектрометрия): 97,9% [М+Н]=272. Пример 1d. Получение 2-амино-N-бензил-3-метоксипропионамида (IV) аммонолизом 2-бром-Nбензил-3-метоксипропионамида (Va) 2-Бром-N-бензил-3-метоксипропионамид (Va) (1 экв.) растворяют в 6 об. 28% водного раствора аммиака и 2 об. метанола. Раствор при перемешивании нагревают при 100 С в течение примерно 2 ч под давлением, равном 7 бар. Реакционную смесь концентрируют в вакууме при 50-60 С до осаждения солей. При комнатной температуре добавляют минимальное количество воды, обеспечивающее растворение солей. Значение рН раствора доводят до 12 50% водным раствором гидроксида натрия и 2-амино-Nбензил-3-метоксипропионамид (IV) экстрагируют изобутилацетатом (3-42 об.). Объединенные органические слои подвергают азеотропной сушке. Соли, осадившиеся после сушки,удаляют фильтрованием и соединение (IV) сразу используют на следующей стадии без дополнительной очистки. За протеканием реакции можно следить с помощью ВЭЖХ. ЖХ-МС (+Cl) (относительная интенсивность) 210 (12), 209 (М 1, 100). Образец выпаривают досуха (масло): 1 Н ЯМР (CDCl3)1,74 (br, s, NH2), 3,34 (s, OCH3), 3,53-3,61 Объем объединенных органических слоев, полученных на предыдущей стадии, доводят до 7 об. в пересчете на исходное количество 2-бром-N-бензил-3-метоксипропионамида (Va), использовавшегося на предыдущей стадии, и температуру раствора доводят до 60 С. По каплям добавляют 1 экв. (в пересчете на исходное количество 2-бром-N-бензил-3-метоксипропионамида (Va), использовавшегося на предыдущей стадии) уксусного ангидрида, поддерживая температуру ниже 70 С. Добавляют 0,5 об. воды и смесь перемешивают в течение 15 мин. Водный слой сливают и отбрасывают и эту операцию повторяют. Затем в раствор вносят затравку кристаллов 2-ацетамидо-N-бензил-3-метоксипропионамида (II) и медленно охлаждают до 0 С. Кристаллы отфильтровывают, промывают 2 об. изобутилацетата при 0 С и сушат в вакууме при 40 С. Таким образом выделяют 2-ацетамидо-N-бензил-3-метоксипропионамид (II) с выходом 80%.(II): т.пл. 122-123 С; 1 Н ЯМР (CDCl3):2,02 (s, C(O)CH3), 3,37 (s, OCH3), 3,42 (dd, J=7,8, 9,0 Гц,CHH'OCH3), 3,80 (dd, J=4,0, 9,0 Гц, CHH'OCH3), 4,47 (d, J=6,0 Гц, NHCH2), 4,49-4,56 (m, CH), 6,41 (br d,J=6,0 Гц, NH), 6,73 (br s, NH), 7,22-7,37 (m, 5 PhH) Пример 1f. Разделение 2-ацетамидо-N-бензил-3-метоксипропионамида (II) на (R)-2-ацетамидо-Nбензил-3-метоксипропионамид (I) и (S)-2-ацетамидо-N-бензил-3-метоксипропионамид (III). Методика А. Готовят загрузочный раствор 2,1 кг 2-ацетамидо-N-бензил-3-метоксипропионамида (II) в ацетонитриле и его перемешивают в атмосфере азота до полного растворения. Раствор непрерывно загружают в систему ПДС, которая снабжена шестью одинаковыми колонками, обладающими длиной 12,46 см и внутренним диаметром 4,8 см, в конфигурации 1-2-2-1. Каждая колонка содержит 125 г хиральной неподвижной фазы, включающей трис-(3,5-диметилфенилкарбамат)целлюлозы, нанесенный на основу из диоксида кремния, и энантиомеры разделяют с использованием ацетонитрила в качестве подвижной фазы. В основном оптически чистый (R)-2-ацетамидо-N-бензил-3-метоксипропионамид (I) экстрагируют из потока и получают с энантиомерным избытком, составляющим 99%. Методика В. Готовят загрузочный раствор 12 кг 2-ацетамидо-N-бензил-3-метоксипропионамида (II) в смеси этилацетат-МеОН (90/10) и перемешивают в атмосфере азота до полного растворения. Раствор непрерывно загружают в систему ПДС, которая снабжена шестью одинаковыми колонками, обладающими длиной 12,46 см и внутренним диаметром 4,8 см, в конфигурации 1-2-2-1. Каждая колонка содержит 125 г хиральной неподвижной фазы, включающей трис-(3,5-дихлорфенилкарбамат)целлюлозы, иммобилизованный на основе из диоксида кремния и энантиомеры разделяют с использованием смеси этилацетатМеОН (90/10) в качестве подвижной фазы. В основном оптически чистый (R)-2-ацетамидо-N-бензил-3-метоксипропионамид (I) экстрагируют из потока и получают с энантиомерным избытком, составляющим 99%. Пример 1g. Рацемизация (S)-2-ацетамидо-N-бензил-3-метоксипропионамида (III) в 2-ацетамидо-Nбензил-3-метоксипропионамид (II). К раствору (S)-2-ацетамидо-N-бензил-3-метоксипропионамида (III), выделенного на предыдущей стадии, в 5 об. метанола в токе азота добавляют 0,05 экв. метоксида натрия. Смесь нагревают при 60 С в течение 8 ч, затем охлаждают до 10 С. Реакцию останавливают с помощью 0,05 экв. водного раствора HCl, поддерживая температуру массы равной примерно 20 С. Метанол отгоняют при атмосферном давлении, пока не останется примерно 1 об. растворителя. Затем проводят азеотропную перегонку с 9 об. изопропилацетата. Перегонку проводят с непрерывным добавлением изопропилацетата, так чтобы поддерживался полный объем, равный 10 об. (примерно 5 об. отгоняются для обеспечения остаточного содержания МеОН 0,1% - по данным ГХ). Смесь охлаждают до 60 С и промывают водой. Оставшуюся в органическом слое воду удаляют азеотропной перегонкой с изопропилацетатом по той же методике, что и указанная выше. Для кристаллизации раствор охлаждают до 0 С. Суспензию фильтруют и осадок на фильтре промывают изопропилацетатом. Твердое вещество сушат при пониженном давлении при 40 С. 2-Ацетамидо-N-бензил-3-метоксипропионамид (II) получают с выходом 74%. Полученный выше 2-ацетамидо-N-бензил-3-метоксипропионамид (II) обрабатывают при условиях,описанных в примере 1 е. Пример 2. Получение 2-амино-N-бензил-3-метоксипропионамида 5,54 г (0,04 моль) 2-хлор-3-метоксипропионовой кислоты (VIc) растворяют в 50 мл дихлорметана Раствор охлаждают до -5 С. В течение 5 мин добавляют 6,24 мл (0,048 моль) изобутилхлорформиата. Раствор охлаждают до -10 С. В течение 5 мин к раствору по каплям добавляют 5,28 мл (0,048 моль) Nметилморфолина, температура повышается до -2 С (температура бани: -15 С). Для завершения образования ангидрида мелкодисперсную жидкую суспензию перемешивают в течение 30 мин при -5 С. Затем суспензию охлаждают до -10 С, затем в течение 20 мин при температуре в диапазоне от -10 до -5 С добавляют раствор, приготовленный из 5,24 мл (0,048 моль) бензиламина и 10 мл дихлорметана. Мелкодисперсную жидкую суспензию перемешивают в течение еще 1 ч без использования охлаждающей бани. Конечная температура: 11 С. Суспензию четырежды экстрагируют с помощью 10 мл воды,10 мл 5% гидрокарбоната натрия,10 мл 1 М хлористо-водородной кислоты,10 мл воды. Оставшийся слой продукта выпаривают досуха. Остаток: 9,36 г маслообразного продукта (80%). Пример 2.2. Получение 2-амино-N-бензил-3-метоксипропионамида (IV) из N-бензил-2-хлор-3 метоксипропионамида (Vb) 12,07 г N-бензил-2-хлор-3-метоксипропионамида (Vb) растворяют в 66 мл метанола. Раствор переносят в автоклав и обрабатывают с помощью 212 мл 28% водного раствора аммиака. Автоклав закрывают и в течение 2 ч нагревают при 120 С. Конечное давление: 5,3 бар. Раствор выпаривают досуха. Остаток переносят в 200 мл воды и дважды экстрагируют дихлорметаном для удаления менее полярных примесей. Водный слой, содержащий продукт, обрабатывают 35% раствором гидроксида натрия и дважды экстрагируют дихлорметаном. Слой, содержащий дихлорметан,отделяют и выпаривают досуха. Остаток: 6,52 г коричневатого масла. Выход: 59%. ЖХ-МС: 91,6% [М+Н] 209. Пример 3. Получение лакозамида из 2-амино-N-бензил-3-метоксипропионамида (IV). Пример 3.1. Разделение диастереоизомеров 2-амино-N-бензил-3-метоксипропионамида (IV) с помощью солей 3.1.1. Разделение с помощью (+)-(+)-О,О'-дибензоилвинной кислоты. 500 мг 2-амино-N-бензил-3-метоксипропионамид (IV) при комнатной температуре растворяют в 2,5 мл 1-пропанола. Одновременно 430 мг (+)-(+)-О,О'-дибензоилвинной кислоты при комнатной температуре растворяют в 2,5 мл 1-пропанола. Раствор соли при комнатной температуре добавляют к раствору 2 амино-N-бензил-3-метоксипропионамид (IV)/1-пропанол. В 10 мл смеси при комнатной температуре вносят затравку кристаллов (R)-2-амино-N-бензил-3-метоксипропионамида (IVa) и перемешивают в течение примерно 5 мин. При этом осаждаются белые хлопьевидные кристаллы. Эти кристаллы отделяют. Из раствора получают 320 мг твердого продукта (выход: 23,5%, химическая чистота: 84%, хиральная чистота: 68% R-энантиомера и 32% S-энантиомера). 160 мг указанного твердого продукта добавляют к 4 мл 1-пропанола и растворяют при нагревании на водяной бане при температуре, равной примерно 85 С. Смесь охлаждают и вносят затравку кристаллов, как это описано выше. Белые хлопьевидные кристаллы отделяют примерно через 5 мин при комнатной температуре (выход: 55 мг, 34%, химическая чистота 96%, хиральная чистота 26% S-энантиомера; 74% R-энантиомера (IVa. 55 мг добавляют к 1 мл 1-пропанола и растворяют при нагревании на водяной бане при температуре, равной примерно 85 С. Смесь охлаждают до комнатной температуры. Внесение затравки кристаллов не требуется. Осадившиеся белые кристаллы можно отделить после перемешивания в течение от 5 до 10 мин (выход: 30 мг, 75%, химическая чистота 98,3%, хиральная чистота 15% Sэнантиомера и 85% R-энантиомера (IVa. 3.1.2. Разделение с помощью N-ацетил-D-лейцина. К 6 г 2-амино-N-бензил-3-метоксипропионамида (IV) добавляют 4,99 г N-ацетил-D-лейцина в 30 мл изопропилацетата. Суспензию нагревают при 85 С в течение 1 ч и затем фильтруют при 80 С (выход: 5,06 г, 46,5%; хиральная чистота: 80,5% R-энантиомера (IVa), 19,5% S-энантиомера). 2 г этой соли нагревают при 85 С в 10 мл изопропилацетата в течение 1 ч и затем фильтруют при 80 С (выход: 1,14 г,57,25%, хиральная чистота: 97,5% R-энантиомера (IVa), 2,5% S-энантиомера). Пример 3.2. Получение (R)-2-ацетамидо-N-бензил-3-метоксипропионамида (I) из (R)-2-амино-Nбензил-3-метоксипропионамида (IVa). 1,12 г (R)-2-Амино-N-бензил-3-метоксипропионамид (IVa) (0,0054 моль) растворяют в 25 мл ди- 16019040 хлорметана. После добавления 0,756 мл уксусного ангидрида (0,8167 г, 0,08 моль) смесь перемешивают в течение 2 ч при комнатной температуре. Затем смесь последовательно экстрагируют с помощью 5 мл воды, 5 мл 1 М хлористо-водородной кислоты, 5 мл 5% раствора гидрокарбоната натрия и 5 мл воды. Фазу, содержащую органический продукт, выпаривают (ВЭЖХ: R-изомер: 93,46% (I), S-изомер: 6,54% Пример 4.1. Получение N-ацетил-О-метил-D,L-серина (IX). В сосуд, снабженный механической мешалкой, при 20 С добавляют 1,0 экв. О-метил-D,L-серина. Добавляют 6 об. тетрагидрофурана и 0,65 об. воды. В течение 5 мин по каплям добавляют 1,2 экв. уксусного ангидрида. Белую суспензию перемешивают до завершения превращения (за протеканием реакции следят с помощью ВЭЖХ, типичная длительность реакции: 16 ч). После завершения реакции смесь становится гомогенной. С помощью азеотропной перегонки удаляют тетрагидрофуран, а также воду. Для полного удаления воды и уксусной кислоты добавляют толуол (следят с помощью KF и ГХ). Полученное неочищенное твердое вещество кристаллизуют из 6 об. ацетона. Влажное твердое вещество сушат при 40 С в вакууме в течение ночи. N-ацетил-О-метил-D,L-серин (IX) получают в виде белого твердого вещества с 80% выходом и химической чистотой, по данным ВЭЖХ составляющей более 99%. Полученный спектр ЯМР согласуется с характеристиками соединения (IX), приведенными в литературе (S.V. Andurkar et al., Tetrahedron: Asymmetry, 9, 3841-3854). Пример 4.2. Получение 2-ацетамидо-N-бензил-3-метоксипропионамида (II) из N-ацетил-О-метилD,L-серина (IX). Пример 4.2.1. Использование изобутилхлорформиата и N-метилморфолина. В реакционный сосуд, снабженный механической мешалкой, помещают 1,0 экв. N-ацетил-О-метилD,L-серина (IX) и 10 об. безводного ТГФ. После охлаждения до -20 С последовательно по каплям добавляют 1,15 экв. изобутилхлорформиата и затем 1,15 экв. N-метилморфолина, поддерживая температуру ниже -15 С. Реакционнуюсмесь перемешивают в течение еще 15 мин при -20 С и затем по каплям добавляют 1,15 экв. бензиламина, поддерживая температуру массы ниже -15 С. После перемешивания в течение еще 15 мин смеси дают нагреться до комнатной температуры и соли удаляют фильтрованием. Фильтрат концентрируют досуха в вакууме и оставшееся твердое вещество перекристаллизовывают из этилацетата. Полученные кристаллы сушат вакууме в течение ночи при температуре, равной 50 С. Соединение (II) получают с 62% выходом и чистотой 99,6%. Пример 4.2.2. Использование безводной борной кислоты В реакционный сосуд, снабженный аппаратом ДинаСтарка, механической мешалкой и датчиком температуры, добавляют 1,0 экв. N-ацетил-О-метил-D,Lсерина (IX) и 8 об. толуола. Добавляют 0,1 экв. безводной борной кислоты и 1 экв. бензиламина. Суспензию кипятят с обратным холодильником в течение 16 ч при непрерывном удалении воды с помощью аппарата Дина-Старка. После завершения реакции реакционная смесь становится гомогенной. Добавляют 1 об. воды и реакционную смесь постепенно охлаждают до 0 С. Фильтруют в вакууме через пористый стеклянный фильтр. Промывают минимальным количеством воды и толуола. Влажное твердое вещество сушат при 40 С в вакууме в течение ночи. 2-Ацетамидо-N-бензил-3-метоксипропионамид (II) получают с выходом 65% и химической чистотой, по данным ВЭЖХ составляющей более 99%. Спектр ЯМР согласуется с данными для эталонного образца лакозамида. 4.2.3. Использование трифенилбороксина в качестве катализатора. В реакционный сосуд, снабженный аппаратом Дина-Старка, механической мешалкой и датчиком температуры, помещают 1,0 экв. N-ацетил-О-метил-D,L-серина (IX) и 8 об. толуола. Добавляют 0,6 экв. фенилбороновой кислоты (или 0,2 экв. соответствующего трифенилбороксина) и реакционную смесь кипятят с обратным холодильником. Затем в течение 2 ч непрерывно добавляют 1 экв. бензиламина и реакционную смесь в течение еще 22 ч кипятят с обратным холодильником. После завершения превращения смесь охлаждают до 75 С и добавляют 3 об. этилацетата. Гомогенную смесь охлаждают до 60 С и вносят 1% мас./мас. затравки кристаллов (II). Кристаллизации дают проткать при этой температуре и смесь фильтруют при 0 С, промывают свежей смесью толуол/этилацетат (70:30) и сушат в вакууме в течение 24 ч. Соединение (II) получают с 70% выходом и химической чистотой, превышающей 94,5%. 4.2.4. Использование диизопропилкарбодиимида. К суспензии 1,0 экв. N-ацетил-О-метил-D,L-серина в 10 об. дихлорметана при 15 С по каплям добавляют раствор 1,2 экв. диизопропилкарбодиимида (ДИК) в 1 об. дихлорметана. Смесь перемешивают в течение 2 ч при 20 С, затем охлаждают до 0 С и перемешивают в течение еще 1 ч. 1,3 Диизопропилмочевину отфильтровывают и к полученному фильтрату по каплям добавляют 1,05 экв. бензиламина, поддерживая температуру ниже 20 С. После завершения превращения раствор выпаривают досуха и получают неочищенное вещество, которое затем кристаллизуют из этилацетата. Соединение (II) получают с 78,2% выходом и чистотой, превышающей 98,8%. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения в основном оптически чистого (R)-2-ацетамидо-N-бензил-3 метоксипропионамида (I), включающий следующие стадии:(b) рацемизацию полученного таким образом (S)-2-ацетамидо-N-бензил-3-метоксипропионамида(c) дополнительное разделение указанного 2-ацетамидо-N-бензил-3-метоксипропионамида (II) на соединение формулы (I) и соединение формулы (III) 2. Способ по п.1, отличающийся тем, что разделение проводят путем хирального хроматографического разделения с использованием хиральной неподвижной фазы (ХСФ) и подвижной фазы. 3. Способ по п.2, отличающийся тем, что хиральное хроматографическое разделение проводят с помощью многоколоночной хроматографии (МКХ). 4. Способ по п.2, отличающийся тем, что хиральная неподвижная фаза (ХСФ) представляет собой полисахаридный хиральный селектор, нанесенный на основу из диоксида кремния или иммобилизованный на ней. 5. Способ по п.4, отличающийся тем, что полисахаридный хиральный селектор выбран из группы,включающей трис-(4-метилбензоат)целлюлозы,трибензоат целлюлозы,трис-(3,5 диметилфенилкарбамат)амилозы,трис-(3,5-диметилфенилкарбамат)целлюлозы,трис-(4 метилфенилкарбамат)целлюлозы,трис-(3,5-дихлорфенилкарбамат)целлюлозы,трис-[(S)-метилбензилкарбамат]амилозы и трис-(3-хлор-4-метилфенилкарбамат)целлюлозы. 6. Способ по любому из пп.2-5, отличающийся тем, что подвижная фаза выбрана из группы, включающей гептан, гексан, метанол, этанол, изопропанол, н-пропанол, ацетонитрил, изопропилацетат, этилацетат, дихлорметан, хлороформ, метил-трет-бутиловый эфир и их смеси. 7. Способ по п.6, отличающийся тем, что подвижная фаза представляет собой смесь этилацетата и метанола или ацетонитрила. 8. Способ по любому предыдущему пункту, отличающийся тем, что рацемизацию проводят по реакции (S)-2-ацетамидо-N-бензил-3-метоксипропионамида (III) с основанием, выбранным из группы,включающей метоксид натрия, гидроксид калия, гидроксид натрия, карбонат калия, карбонат натрия,триэтиламин, 1,8-диазабицикло[5.4.0]ундец-7-ен и сильно или слабо основные анионообменные смолы. 9. Способ по п.8, отличающийся тем, что основание выбрано из группы, включающей метоксид натрия, гидроксид калия, гидроксид натрия, карбонат калия и карбонат натрия. 10. Способ по п.8, который проводят при температуре от 20 до 80 С. 11. Способ по п.8, который проводят в растворителе, выбранном из группы, включающей метанол,этанол, тетрагидрофуран, 2-метилтетрагидрофуран и ацетонитрил. 12. Способ по п.1, отличающийся тем, что 2-ацетамидо-N-бензил-3-метоксипропионамид (II) получают с помощью следующих стадий:(i) взаимодействие соединения формулы (VIa) в которой X обозначает отщепляющуюся группу, с алкилгалогенформиатом в присутствии основания и бензиламина с получением соединения формулы (V) в котором X является таким, как определено для соединения (VIa);(ii) проведение аммонолиза указанного соединения (V) с получением соединения формулы (IV)(iii) ацетилирование указанного соединения формулы (IV) уксусным ангидридом в растворителе с получением соединения формулы (II);(iv) выделение соединения формулы (II). 13. Способ по п.12, отличающийся тем, что соединение формулы (VIIIa), в которой X обозначает отщепляющуюся группу и R обозначает С 1-С 10-алкил, образуется in situ на стадии (i) до реакции с бензиламином 14. Способ по п.12 или 13, отличающийся тем, что X обозначает галоген, предпочтительно бром. 15. Способ по любому из пп.12-14, отличающийся тем, что соединение (VIa) получают in situ по реакции 2,3-дибромэтилпропионата (VIIa) или 2,3-дибромметилпропионата (VIIb) с метоксидом натрия в метаноле при температуре ниже 10 С. 16. Способ по любому из пп.12-15, отличающийся тем, что стадию (ii) проводят с избытком водного раствора аммиака в присутствии метанола. 17. Способ по любому из пп.12-16, отличающийся тем, что стадию (iii) проводят при температуре от 50 до 70 С. 18. Способ получения в основном оптически чистого (R)-2-ацетамидо-N-бензил-3 метоксипропионамида (I), включающий следующие стадии:(ii) взаимодействие указанного соединения формулы (Va) с водным раствором аммиака с получением 2-амино-N-бензил-3-метоксипропионамида (IV)(iii) ацетилирование указанного соединения формулы (IV) уксусным ангидридом в растворителе с получением 2-ацетамидо-N-бензил-3-метоксипропионамида (II)(iv) выделение указанного соединения формулы (II);(vi) рацемизацию полученного таким образом (S)-2-ацетамидо-N-бензил-3-метоксипропионамида(vii) дополнительное разделение указанного 2-ацетамидо-N-бензил-3-метоксипропионамида (II) на соединение формулы (I) и соединение формулы (III)(iii) выделение указанного соединения формулы (II). 20. Способ по п.19, отличающийся тем, что стадию (i) проводят в присутствии уксусного ангидрида в растворителе, выбранном из группы, включающей уксусную кислоту, толуол, тетрагидрофуран, 2 метилтетрагидрофуран, изобутилацетат, дихлорметан, воду и их смеси. 21. Способ по п.19, отличающийся тем, что стадию (ii) проводят в присутствии катализатора, выбранного из группы, включающей борную кислоту, фенилбороновую кислоту, 3,4,5 трифторфенилбороновую кислоту, 2-(N,N-диизопропиламинометил)фенилбороновую кислоту и 2-(N,Nдиметиламинометил)фенилбороновую кислоту. 22. Способ по п.19, отличающийся тем, что стадию (ii) проводят в присутствии дициклогексил(ДЦК) или диизопропилкарбодиимида (ДИК) в растворителе, выбранном из группы, включающей тетрагидрофуран, этилацетат и дихлорметан. 23. Способ по любому из пп.19, 21 и 22, отличающийся тем, что стадию (ii) проводят при кипячении с обратным холодильником в растворителе, выбранном из группы, включающей толуол, N- 20019040
МПК / Метки
МПК: C07C 237/22, C07C 237/52, C07C 231/20, C07C 237/06
Метки: способ, аминокислот, получения, новый, производных
Код ссылки
<a href="https://eas.patents.su/22-19040-novyjj-sposob-polucheniya-proizvodnyh-aminokislot.html" rel="bookmark" title="База патентов Евразийского Союза">Новый способ получения производных аминокислот</a>
Предыдущий патент: Способ получения бензонорборненов
Следующий патент: Карбазолкарбоксамидные соединения, применимые в качестве ингибиторов киназы
Случайный патент: Катализатор для гидрирования ненасыщенных полимеров












