Способ получения бензонорборненов
Номер патента: 19039
Опубликовано: 30.12.2013
Авторы: Грибков Денис, Вальтер Харальд, Антельманн Бьёрн, Жордано Фанни, Де Месмакер Ален
Формула / Реферат
1. Способ получения 9-дихлорметилен-1,2,3,4-тетрагидро-1,4-метанонафталин-5-иламина формулы (I)
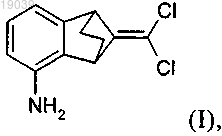
который включает:
а) реакцию циклопентадиена с CXCl3, где X обозначает хлор или бром, в присутствии радикального инициатора с получением соединения формулы (II)
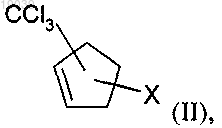
в которой X обозначает хлор или бром; или
аа) реакцию циклопентадиена с CXCl3, где X обозначает хлор, в присутствии металлсодержащего катализатора с получением соединения формулы (II)
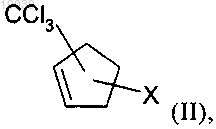
в которой X обозначает хлор;
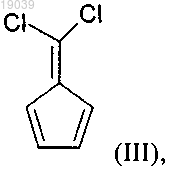
b) реакцию соединения формулы (II) с основанием в присутствии подходящего растворителя с получением соединения формулы (III)
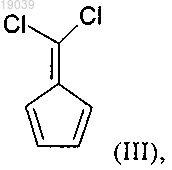
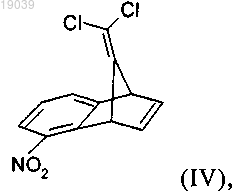
с) превращение соединения формулы (III) в присутствии 1,2-дигидро-6-нитробензола в соединение формулы (IV)

d) гидрирование соединения формулы (IV) в присутствии металлсодержащего катализатора.
2. Способ по п.1, который включает:
а) реакцию циклопентадиена с CXCl3, где X обозначает хлор или бром, в присутствии радикального инициатора с получением соединения формулы (II)

в которой X обозначает хлор или бром.
3. Соединение формулы (IV)
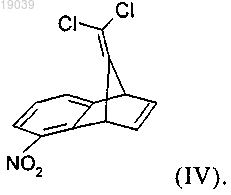
4. Способ получения соединения формулы (III)
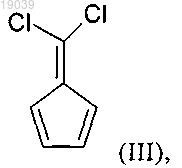
который включает:
а) реакцию циклопентадиена с CXCl3, где X обозначает хлор или бром, в присутствии радикального инициатора с получением соединения формулы (II)
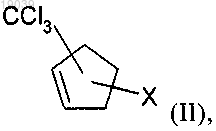
в которой X обозначает хлор или бром;
b) реакцию соединения формулы (II) с основанием в присутствии подходящего растворителя.
5. Способ по п.4, в котором X обозначает бром.
6. Способ по п.1, в котором:
аа) циклопентадиен вводят в реакцию с CCl4 в присутствии металлсодержащего катализатора с получением соединения формулы (II)

в которой X обозначает хлор.
7. Способ по п.1, который включает:
аа) реакцию циклопентадиена с CXCl3, где X обозначает хлор, в присутствии металлсодержащего катализатора, где металлический компонент катализатора выбран из группы, включающей рутений, медь, железо, палладий и родий, с получением соединения формулы (II)
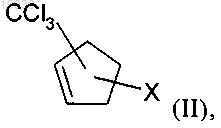
в которой X обозначает хлор;
b) реакцию соединения формулы (II) с основанием, выбранным из алкоголятов щелочных металлов, в присутствии подходящего растворителя с получением соединения формулы (III)
с) превращение соединения формулы (III) в присутствии 1,2-дигидро-6-нитробензола в соединение формулы (IV)
d) гидрирование соединения формулы (IV) в присутствии металлсодержащего катализатора.
Текст
(71)(73) Заявитель и патентовладелец: ЗИНГЕНТА ПАРТИСИПЕЙШНС АГ (CH) Грибков Денис, Антельманн Бьрн,Жордано Фанни, Вальтер Харальд, Де Месмакер Ален (CH) Представитель: В изобретении описан новый способ получения 9-дихлорметилен-1,2,3,4-тетрагидро-1,4 метанонафталин-5-иламина, который включает а) реакцию циклопентадиена в присутствии радикального инициатора и CXCl3, где X обозначает хлор или бром, с получением соединения формулы (II), или аа) реакцию циклопентадиена с CXCl3, где X обозначает хлор, в присутствии металлсодержащего катализатора с получением соединения формулы (II), в которой X обозначает хлор, b) реакцию соединения формулы (II) с основанием в присутствии подходящего растворителя с получением соединения формулы (III); с) превращение соединения формулы (III) в присутствии 1,2-дигидро-6-нитробензола в соединение формулы (IV) и d) гидрирование соединения формулы (IV) в присутствии металлсодержащего катализатора. Настоящее изобретение относится к получению 9-дихлорметилен-1,2,3,4-тетрагидро-1,4 метанонафталин-5-иламина. 9-Дихлорметилен-1,2,3,4-тетрагидро-1,4-метанонафталин-5-иламин является ценным промежуточным продуктом для получения бензонорборненовых фунгицидов, как описано, например, в WO 2007/048556. Из WO 2007/048556 известен способ получения 9-дихлорметилен-1,2,3,4-тетрагидро-1,4 метанонафталин-5-иламина путем: а) реакции соединения формулы (А) в которой R' и R" обозначают, например, C1-C4-алкил, с получением соединения формулы (С)b) гидрирования соединения формулы (С) в присутствии подходящего металлсодержащего катализатора с получением соединения формулы (D) с) озонирования соединения формулы (D) с последующей обработкой восстановительным реагентом с получением соединения формулы (Е)d) реакции соединения формулы (Е) со смесью трифенилфосфин/тетрахлорид углерода с получением 2,9-дихлорметилиден-5-нитробензонорборнена формулы (F) е) гидрирования соединения формулы F в присутствии металлсодержащего катализатора с получением 9-дихлорметилен-1,2,3,4-тетрагидро-1,4-метанонафталин-5-иламина. Недостатком этого способа предыдущего уровня техники является наличие большого числа стадий реакции, что снижает выход продукта. Кроме того, реакция озонолиза, которую трудно осуществлять, и дорогостоящая стадия d), для проведения которой необходимо использовать трифенилфосфин, делают этот способ неэкономичным и неподходящим для крупномасштабного производства. Поэтому задачей настоящего изобретения является разработка нового способа получения 9 дихлорметилен-1,2,3,4-тетрагидро-1,4-метанонафталин-5-иламина, в котором исключены недостатки известного способа и который дает возможность получать 9-дихлорметилен-1,2,3,4-тетрагидро-1,4 метанонафталин-5-иламин с высокими выходами и при хорошем качестве и экономически эффективным путем с меньшим количеством стадий реакции. Таким образом, настоящее изобретение относится к способу получения 9-дихлорметилен-1,2,3,4 тетрагидро-1,4-метанонафталин-5-иламина формулы (I) который включает: а) реакцию циклопентадиена с CXCl3, где X обозначает хлор или бром, предпочтительно бром, в присутствии радикального инициатора с получением соединения формулы (II) в которой X обозначает хлор или бром; или аа) реакцию циклопентадиена с CXCl3, где X обозначает хлор, в присутствии металлсодержащего катализатора с получением соединения формулы (II)b) реакцию соединения формулы (II) с основанием в подходящем растворителе с получением соединения формулы (III) с) превращение соединения формулы (III) в присутствии 1,2-дигидро-6-нитробензола в соединение формулы (IV)d) гидрирование соединения формулы (IV) с помощью источника водорода в присутствии металлсодержащего катализатора. В одном варианте осуществления этот способ включает: а) реакцию циклопентадиена с CXCl3, где X обозначает хлор или бром, предпочтительно бром, в присутствии радикального инициатора с получением соединения формулы (II) в которой X обозначает хлор или бром. Стадии реакции а) и аа). Соединения формулы (II) могут находиться в следующих изомерных формах или в виде их смесей: где X обозначает хлор или бром. Продукт, полученный на стадиях реакций а) и аа), можно использовать без обработки на следующей стадии реакции b). Выделение или очистка определенного изомера или смеси изомеров формулы (II) не являются необходимыми. Соединение формулы (IV) является новым и специально разработано для способа, предлагаемого в настоящем изобретении, и поэтому образует еще один объект настоящего изобретения. В принципе для проведения стадии реакции а) можно использовать большое количество радикальных инициаторов следующих классов: органические пероксиды (например, метилэтилкетонпероксид,бензоилпероксид), органические азосоединения, соли и комплексы металлов (Cu, Ru). Предпочтительные радикальные инициаторы выбраны из группы, включающей азо-бис-изобутиронитрил, дибензоилпероксид и бис-(трет-бутилциклогексил)пероксидикарбонат. Особенно предпочтительным является азо-бисизобутиронитрил. Стадию реакции а) предпочтительно проводят при повышенных температурах, предпочтительно при температуре от 20 до 100 С, предпочтительно от 60 до 100 С, наиболее предпочтительно от 80 до 90 С. Использование бромтрихлорметана является предпочтительным, особенно при условиях инициирования с помощью пероксида или азосоединений. В особенно предпочтительной методике проведения стадии реакции аа) циклопентадиен вводят в реакцию с CCl4 в присутствии металлсодержащего катализатора с получением соединения формулы (II) в которой X обозначает хлор. Для проведения стадии аа) присутствие радикального инициатора не является необходимым, но может быть полезным для уменьшения содержания катализатора (использование меньшего количества катализатора). Подходящими металлическими компонентами катализатора являются, например, выбранные из группы, включающей рутений, медь, железо, палладий и родий. Предпочтительные катализаторы содержат комплексы рутения(II) или меди(I). Особенно предпочтительные катализаторы выбраны из группы,включающей Ru(PPh3)3Cl2, Ru(кумол)PPh3Cl2, Ru(Cp)PPh3Cl2, катализатор Граббса I (бензилиден-бис(трициклогексилфосфин)дихлоррутений) и CuCl в комбинации с амином-лигандом, особенно с диаминовым или триаминовым лигандом. Катализатор Граббса I, CuCl/тетраметилэтилендиамин (ТМЭДА) или пентаметилдиэтилентриамин являются наиболее предпочтительными катализаторами. Стадию реакции аа) можно проводить в присутствии инертного растворителя, предпочтительно в отсутствие растворителя, если используют Ru-катализатор. Стадию реакции аа) предпочтительно проводят при повышенных температурах, в частности при температуре от 20 до 100 С, предпочтительно от 60 до 100 С, наиболее предпочтительно от 60 до 80 С. Продукт, полученный на стадии реакции аа), представляет собой смесь трех возможных изомеров. Выделение или очистка определенного изомера или смеси изомеров не являются необходимыми. В особенно предпочтительном варианте осуществления стадию реакции аа) можно успешно провести путем нагревания смеси циклопентадиена и 1,5-3 экв., предпочтительно 2 экв., тетрахлорида углерода в ацетонитриле в присутствии 0,5-2 мол.%, предпочтительно 1 мол.%, содержащего медь(I) катализатора, предпочтительно CuCl, и 1-4 мол.%, предпочтительно 2 мол.%, тетраметилэтан-1,2-диамина(ТМЭДА) и после перегонки получить выделенный продукт с выходом 70-80%. Добавление к реакционной смеси каталитического количества (обычно 1 мол.%) радикального инициатора, указанного выше, особенно N,N-азо-бис-изобутиронитрила, может уменьшить содержание катализатора (использование меньшего количества катализатора). Стадия реакции аа) обладает дополнительными преимуществами. Использование CCl4 является менее дорогостоящим, продукт присоединения с тетрахлоридом углерода (СТСМ-циклопентен) является гораздо более устойчивым, чем бромсодержащее производное (ВТСМ-циклопентен), реакция гораздо менее экзотермична и поэтому является более подходящей для крупномасштабного производства, и на следующей стадии не образуется бромид-анион. На стадиях реакции а) и аа) CCl3Br или CCl4 используют в избытке по отношению к циклопентадиену, предпочтительно 1,5-5 экв., более предпочтительно 2-3 экв. CCl3Br или CCl4 в пересчете на 1 экв. циклопентадиена. Стадия реакции b). Основаниями, предпочтительными для использования на стадии реакции b), являются алкоголяты щелочных металлов, например трет-бутоксид натрия и трет-бутоксид калия, или амиды металов, такие как NaNH2 или диизопропиламид лития. За исключением кетонов и сложных эфиров можно использовать все инертные растворители. Растворители, подходящие для использования на стадии реакции b), выбраны из группы, включающей метил-трет-бутиловый эфир (МТБЭ), метилциклогексан (МЦГ) или их смесь, тетрагидрофуран (ТГФ), диглим и толуол. Дополнительным растворителем, подходящим для использования на стадии реакции b), является хлорбензол. Стадию реакции b) предпочтительно проводят при температуре в диапазоне от -20 до +20 С, предпочтительно при температуре от -10 до 10 С, наиболее предпочтительно от -5 до 5 С. В предпочтительном варианте осуществления настоящего изобретения соединение формулы (III)(его раствор) используют непосредственно на следующей стадии без выделения. Соединение формулы(III) является ценным промежуточным продуктом для получения соединения формулы (I). Соединение формулы (III) известно из следующих публикаций: (a) Moberg, С.; Nilsson, M. J. Organomet. Chem., 1973,49, 243-248; (b) Siemionko, R.K.; Berson, J.A. J. Am. Chem. Soc., 1980, 102, 3870-3882. Однако методика получения, описанная в указанной публикации, является очень неблагоприятной, поскольку: 1) методику, в том виде, как она описана, невозможно воспроизвести (получали соединение с низким выходом); 2) используют очень дорогое и токсичное исходное вещество (никелоцен); 3) образуется большое количество отходов металла (никельсодержащие соединения); 4) методику невозможно масштабировать для промышленного использования (отсутствие больших количеств никелоцена, опасность переработки больших количеств никелоцена). В отличие от этого получение соединения формулы (III) из циклопентадиена является новым и очень эффективным способом и поэтому образует еще один объект настоящего изобретения. Поэтому другим объектом настоящего изобретения является способ получения соединения формулы (III) который включает: а) реакцию циклопентадиена в присутствии радикального инициатора и CXCl3, где X обозначает хлор или бром, предпочтительно бром, с получением соединения формулы (II) в которой X обозначает хлор или бром;b) реакцию соединения формулы (II) с основанием в присутствии подходящего растворителя. Стадия реакции с). 1,2-Дигидро-6-нитробензол образуется in situ [например, из 6-нитроантраниловой кислоты формулы (А) так, как это описано в публикациях L. Paquette et al., J Amer Chem. Soc, 99, 3734 (1977) и Н Seidel,Chemische Berichte, 34, 4351 (1901)]. Стадию реакции с) проводят при повышенных температурах, предпочтительно при температуре от 30 до 60 С, наиболее предпочтительно от 30 до 40 С. Стадия реакции d). Металлсодержащие катализаторы, предпочтительные для использования в реакции гидрирования,выбраны из группы, включающей никель Ренея, платину, предпочтительно платину на носителе, таком как углерод, палладий, предпочтительно палладий на носителе, таком как углерод, но не ограничиваются указанной группой. Особенно предпочтительным катализатором является никель Ренея. Подходящими источниками водорода являются водород или гидразин, предпочтительно водород. Стадию реакции d) проводят при температуре в диапазоне от низких до повышенных температур,предпочтительно при температуре от 0 до 80 С, предпочтительно от 30 до 60 С. Предпочтительный вариант способа, предлагаемого в настоящем изобретении, включает: аа) реакцию циклопентадиена с CXCl3, где X обозначает хлор, в присутствии металлсодержащего катализатора, где металлический компонент катализатора выбран из группы, включающей рутений,медь, железо, палладий и родий, с получением соединения формулы (II)b) реакцию соединения формулы (II) с основанием, выбранным из числа алкоголятов щелочных металлов, в присутствии подходящего растворителя с получением соединения формулы (III) с) превращение соединения формулы (III) в присутствии 1,2-дигидро-6-нитробензола в соединение формулы (IV)d) гидрирование соединения формулы (IV) с помощью источника водорода в присутствии металлсодержащего катализатора. Примеры получения. Пример Р 1. Получение соединения формулы (IIa) Азо-бис-изобутиронитрил (2,5 г) растворяли в бромтрихлорметане (250 г). Бромтрихлорметан (650 г) в инертной атмосфере (азот) помещали в стеклянный ректор и нагревали до 85 С. В реактор одной порцией добавляли 1/3 раствора азо-бис-изобутиронитрила (84 г) и содержимое реактора повторно нагревали до 85 С, затем при 85 С в течение 2,5 ч одновременно добавляли оставшиеся 2/3 раствора азобис-изобутиронитрила (168,5 г) и смесь циклопентадиена (100 г, свежеперегнанный) и метилциклогексана (10 г). Реакционную смесь перемешивали при 85 С в течение еще 1 ч и затем охлаждали до температуры окружающей среды. Большую часть растворителя (бромтрихлорметан) выпаривали в вакууме(6070 С, 15050 мбар). К остатку после перегонки добавляли метилциклогексан (50 г) и перегонку продолжали (6070 С, 15015 мбар). Неочищенный продукт (остаток после перегонки) сушили в вакууме в течение еще 30 мин (70 С, 15 мбар). Получали 389 г соединения формулы (IIa) в виде коричневого масла, чистота 94%, выход 92%, смесь региоизомеров. Пример Р 2. Получение соединения формулы (III)(27,83 г, соединение (IIa, метилциклогексан (62 мл), метил-трет-бутиловый эфир (62 мл) и бис-(2 метоксиэтил)овый эфир (диглим, 6,7 г). Смесь охлаждали до -10 С в бане со смесью лед/NaCl. В реактор в течение 10 мин добавляли трет-бутоксид натрия (20,3 г) в виде твердого вещества, поддерживая температуру ниже +5 С. После завершения добавления реакционную смесь перемешивали при 0-5 С в течение 2 ч. Реакцию останавливали смесью охлажденной льдом воды (80 мл) и льда (40 г) и затем 32% раствором HCl (примерно 3 мл) значение рН водной фазы доводили до 2. Водную фазу отделяли и органическую фазу сушили при 0 С над безводным карбонатом калия. Карбонат калия отфильтровывали и промывали метил-трет-бутиловым эфиром (10 мл). К объединенному фильтрату добавляли метилэтилкетон(соединение формулы (III определяли с помощью спектроскопии 1 Н ЯМР (ядерный магнитный резонанс). Выход 81% [9,7 г 9,9% (примерно 0,53 М) раствора]. Раствор хранили в холодильнике и затем использовали на следующей стадии. Пример Р 3. Получение соединения формулы (IV) Холодный раствор 6,6-дихлорфульвена, полученного на предыдущей стадии (9% раствор в смеси метил-трет-бутиловый эфир/метилциклогексан = 1:1), помещали в стеклянный реактор и быстро нагревали до 35 С. В реактор добавляли трет-пентилнитрит (2,66 г), затем при 35 С в течение 80 мин одновременно добавляли трет-пентилнитрит (9,46 г) и раствор 6-нитроантраниловой кислоты (11,6 г, 96,6%) в метилэтилкетоне (42 мл). Реакционную смесь перемешивали при такой же температуре в течение еще 30 мин и затем все летучие вещества удаляли в роторном испарителе. Полученный остаток кристаллизовали из метанола (20 мл) при +5 С в течение 15 ч. Коричневое кристаллическое вещество отфильтровывали,промывали холодным метанолом (15 мл) и сушили на воздухе. Выход 7,10 г (42%, чистота продукта 98%). Пример Р 4. Гидрирование соединения формулы (IV). В автоклав помещали ТГФ (130 мл), влажный никель Ренея (2 г) и соединение формулы (IV) (20 г). Автоклав закрывали, содержимое начинали перемешивать, трижды продували азотом для удаления кислорода и затем трижды продували водородом. В реакторе создавали давление водорода, равное 5 бар. Затем содержимое автоклава нагревали при 40 С, поддерживая давление путем добавления дополнительного количества водорода по мере необходимости. После прекращения потребления водорода,обычно через 3-4 ч, реакционную смесь выдерживали при 40 С в течение еще 30 мин. Затем давление сбрасывали и содержимое охлаждали до температуры окружающей среды. Растворитель удаляли в вакууме, полученное масло кристаллизовалось при выдерживании, получали 18 г соединения формулы (I) от желтоватого до коричневатого цвета (96%, чистота продукта 94%). Смесь циклопентадиена (2,0 г), азо-бис-изобутиронитрила (0,5 г), бензилиден-бис(трициклогексилфосфин)дихлоррутения (катализатор Граббса первого поколения, 12,2 мг, 0,05 мол.%) и тетрахлорида углерода (14 г) нагревали в инертной атмосфере (аргон) при 75 С. За ходом превращения следили с помощью ГХ (газовая хроматография). Через 4 ч реакция завершалась и получали хлор(трихлорметил)циклопентен в виде смеси трех изомеров с выходом 85% (ГХ, в качестве стандарта использовали додекан). Пример Р 6. Получение СТСМ-циклопентена формулы (IIa) с использованием катализатора Раствор катализатора. Смесь хлорида меди(I) (0,99 г), тетраметилэтилендиамина (ТМЭДА, 2,32 г) и ацетонитрила (100 мл) нагревали в атмосфере азота при 75 С в течение 25 мин и затем охлаждали до комнатной температуры. Раствор циклопентадиена. Свежеприготовленный циклопентадиен (66,0 г) растворяли в тетрахлориде углерода (307 г). Реакция. В стеклянный реактор в атмосфере азота помещали ацетонитрил (80 г) и 40% раствора катализатора. Смесь нагревали при 75 С. Затем в реактор одной порцией добавляли 40% раствора циклопентадиена,затем одновременно добавляли оставшиеся количества раствора катализатора и раствора циклопентадиена, поддерживая температуру в диапазоне от 60 до 70 С. Раствор циклопентадиена добавляли в течение 1 ч и раствор катализатора добавляли в течение 1,5 ч. Реакционную смесь перемешивали при 70 С в течение еще 1 ч, охлаждали до температуры окружающей среды и фильтровали. Растворитель удаляли в роторном испарителе и остаток фракционировали с помощью перегонки в вакууме (40-45 С, 0,1 мбар). Выход 170 г (75%, чистота 97-98%), смесь трех региоизомеров. Пример Р 7. Получение соединения формулы (III) трет-Бутоксид натрия (69,2 г) перемешивали с хлорбензолом (175 мл) при комнатной температуре в течение 30 мин и получали тонкодисперсную суспензию. В стеклянный реактор в инертной атмосфере(азот) помещали хлор(трихлорметил)циклопентен (69,1 г), хлорбензол (275 мл) и бис-(2 метоксиэтил)овый эфир (диглим, 21,1 г). Смесь охлаждали до -20 С и в реактор в течение 35 мин порциями добавляли суспензию трет-бутоксида натрия, поддерживая температуру ниже +3 С. После завершения добавления реакционную смесь перемешивали при -5 С в течение 3 ч. Реакцию останавливали смесью 0,5 М водного раствора HCl (300 мл) и льда (200 г). Значение рН водной фазы поддерживали равным 2. Водную фазу отделяли и органическую фазу дважды экстрагировали такой же смесью воды со льдом (необходимо для полного удаления трет-бутанола и диглима). Концентрацию 6,6 дихлорфульвена определяли с помощью спектроскопии 1 Н ЯМР с использованием хлорбензола (растворитель) в качестве внутреннего стандарта. Выход 75% [510 г 6,8% (примерно 0,52 М) раствора]. Раствор хранили в морозильнике или в твердом диоксиде углерода и затем использовали на следующей стадии. Примечание: выход непосредственно после остановки реакции (без дополнительных экстракций) составлял 85%. Часть раствора была потеряна при разделении фаз. Предпочтительным бензонорборненовым фунгицидом, который можно успешно получить с использованием способа, предлагаемого в настоящем изобретении, является (9-дихлорметилен-1,2,3,4 тетрагидро-1,4-метанонафталин-5-ил)амид 3-дифторметил-1-метил-1 Н-пиразол-4-карбоновой кислоты формулы (V) химическим названием которого является 1S,4R)-9-дихлорметилен-1,2,3,4-тетрагидро-1,4 метанонафталин-5-ил)амид 3-дифторметил-1-метил-1 Н-пиразол-4-карбоновой кислоты, и соединение формулы (Vb) химическим названием которого является 1R,4S)-9-дихлорметилен-1,2,3,4-тетрагидро-1,4 метанонафталин-5-ил)амид 3-дифторметил-1-метил-1 Н-пиразол-4-карбоновой кислоты. Углы оптического вращения []23,5 равны -119,26 и +119,23 (в тетрагидрофуране) соответственно. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения 9-дихлорметилен-1,2,3,4-тетрагидро-1,4-метанонафталин-5-иламина формулы который включает: а) реакцию циклопентадиена с CXCl3, где X обозначает хлор или бром, в присутствии радикального инициатора с получением соединения формулы (II) в которой X обозначает хлор или бром; или аа) реакцию циклопентадиена с CXCl3, где X обозначает хлор, в присутствии металлсодержащего катализатора с получением соединения формулы (II)b) реакцию соединения формулы (II) с основанием в присутствии подходящего растворителя с получением соединения формулы (III) с) превращение соединения формулы (III) в присутствии 1,2-дигидро-6-нитробензола в соединение формулы (IV)d) гидрирование соединения формулы (IV) в присутствии металлсодержащего катализатора. 2. Способ по п.1, который включает: а) реакцию циклопентадиена с CXCl3, где X обозначает хлор или бром, в присутствии радикального инициатора с получением соединения формулы (II) в которой X обозначает хлор или бром. 3. Соединение формулы (IV) 4. Способ получения соединения формулы (III) который включает: а) реакцию циклопентадиена с CXCl3, где X обозначает хлор или бром, в присутствии радикального инициатора с получением соединения формулы (II) в которой X обозначает хлор или бром;b) реакцию соединения формулы (II) с основанием в присутствии подходящего растворителя. 5. Способ по п.4, в котором X обозначает бром. 6. Способ по п.1, в котором: аа) циклопентадиен вводят в реакцию с CCl4 в присутствии металлсодержащего катализатора с получением соединения формулы (II) в которой X обозначает хлор. 7. Способ по п.1, который включает: аа) реакцию циклопентадиена с CXCl3, где X обозначает хлор, в присутствии металлсодержащего катализатора, где металлический компонент катализатора выбран из группы, включающей рутений,медь, железо, палладий и родий, с получением соединения формулы (II)b) реакцию соединения формулы (II) с основанием, выбранным из алкоголятов щелочных металлов,в присутствии подходящего растворителя с получением соединения формулы (III) с) превращение соединения формулы (III) в присутствии 1,2-дигидро-6-нитробензола в соединение формулы (IV)d) гидрирование соединения формулы (IV) в присутствии металлсодержащего катализатора.
МПК / Метки
МПК: C07C 211/61, C07C 23/08, C07C 205/12, C07C 17/25, C07C 22/02
Метки: получения, бензонорборненов, способ
Код ссылки
<a href="https://eas.patents.su/10-19039-sposob-polucheniya-benzonorbornenov.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения бензонорборненов</a>
Предыдущий патент: Сульфонатные соли 2-амино-3-карбэтоксиамино-6-(4-фторбензиламино)пиридина
Следующий патент: Новый способ получения производных аминокислот
Случайный патент: Установка и способ отделения газового конденсата из смесей углеводородов высокого давления












