Производные арилметилкарбониламинотиазола и их применение в качестве противоопухолевых средств
Номер патента: 5375
Опубликовано: 24.02.2005
Авторы: Амичи Раффаэлла, Варази Марио, Салом Барбара, Вульпетти Анна, Вилла Мануэла, Певарелло Паоло
Формула / Реферат
1. Производное 2-амино-1,3-тиазола, представленное формулой (I)
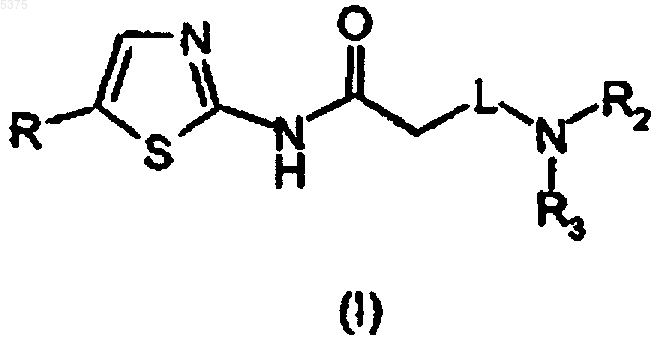
где L представляет собой фенил или 1,3-тиазолильную группу;
R представляет собой C1-C6алкил или моно- или дизамещенную аминогруппу, где заместитель выбран из C1-C6алкила, необязательно замещенного гидрокси или C1-C6алканоилокси;
R2 и R3 независимо выбраны из H; гидрокси; C1-C6алкила, необязательно замещенного ди(C1-C6алкил)аминокарбонилом или C1-C6алкилпиперазинилом; C1-C6алканоила, необязательно замещенного галогеном, гидрокси, C1-C6алкокси, C1-C6алкоксикарбонилом, ди(C1-C6алкил)амино; оксало или C1-C6алкоксалил;
или R2 и R3 вместе с атомом азота, с которым они связаны, образуют 2-оксопирролидинильное кольцо;
или его фармацевтически приемлемая соль.
2. Производное 2-амино-1,3-тиазола по п.1, где R представляет собой C1-C6алкиламино или ди(C1-C6алкил)амино, где C1-C6алкильный радикал необязательно замещен гидроксигруппой; или неразветвленную или разветвленную C1-C4алкильную группу;
или его фармацевтически приемлемая соль.
3. Производное 2-амино-1,3-тиазола по п.1, выбранное из группы, включающей следующие соединения:
N-(4-{2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксоэтил}-1,3-тиазол-2-ил)-2-метилпропанамид;
2-[(4-{2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксоэтил}-1,3-тиазол-2-ил)амино]-2-оксоуксусную кислоту;
2-хлор-N-(4-{2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксоэтил}-1,3-тиазол-2-ил)ацетамид;
2-[2-(гликолоиламино)-1,3-тиазол-4-ил]-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид;
2-амино-N-(4-{2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксоэтил}-1,3-тиазол-2-ил)ацетамид;
N-(5-изопропил-1,3-тиазол-2-ил)-2-[2-(2-оксо-1-пирролидинил)-1,3-тиазол-4-ил]ацетамид;
N-(4-{2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксоэтил}-1,3-тиазол-2-ил)-2-метоксиацетамид;
3,3,3-трифтор-N-(4-{2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксоэтил}-1,3-тиазол-2-ил)пропанамид;
2-(диметиламино)-N-(4-{2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксоэтил}-1,3-тиазол-2-ил)ацетамид;
N-(5-изопропил-1,3-тиазол-2-ил)-2-(2-{метил[2-(4-метил-1-пиперазинил)этил]амино}-1,3-тиазол-4-ил)ацетамид;
2-(2-{[2-(диметиламино)-2-оксоэтил]амино}-1,3-тиазол-4-ил)-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид;
2-[4-(диметиламино)фенил]-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид;
2-[4-(ацетиламино)фенил]-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид
и их фармацевтически приемлемые соли.
4. Способ получения производного 2-амино-1,3-тиазола, указанного в п.1, или его фармацевтически приемлемой соли, предусматривающий
взаимодействие соединения, представленного формулой (III)
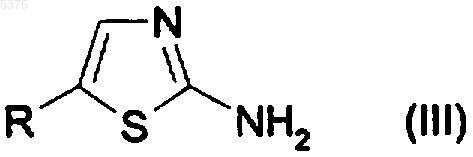
с соединением, представленным формулой (IV)
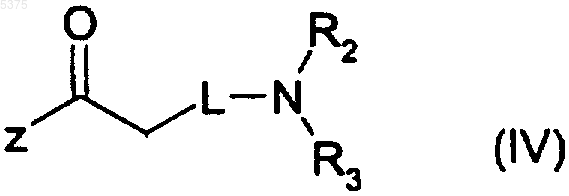
где R, L, R2 и R3 определены в п.1 и
Z представляет собой гидрокси или подходящую удаляемую группу,
с получением производного 2-амино-1,3-тиазола, представленного формулой (I), где R, L, R2 и R3 определены в п.1.
5. Способ получения производного 2-амино-1,3-тиазола, указанного в п.1, или его фармацевтически приемлемой соли, предусматривающий
взаимодействие соединения, представленного формулой (I)
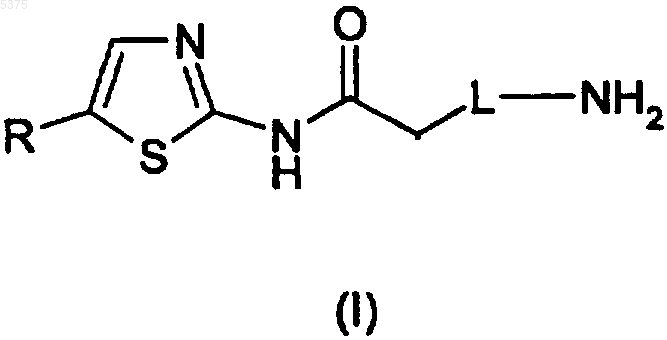
с соединением, представленным формулой (V)
R4-COX (V),
где R, L и R4 определены в п.1, и
X представляет собой гидрокси или подходящую удаляемую группу,
с получением производного 2-амино-1,3-тиазола, представленного формулой (II), где R, L и R4 определены в п.1.
6. Способ получения производного 2-амино-1,3-тиазола, указанного в п.1, или его фармацевтически приемлемой соли, предусматривающий
взаимодействие производного 2-амино-1,3-тиазола, представленного формулой (I), где оба или по крайней мере один из R2 и R3 представляют собой атом водорода, с соединением, представленным формулой (VI)
R'Y (VI),
где R' имеет значения R2 или R3, но отличные от водорода, и
Y представляет собой подходящую удаляемую группу,
с получением производного 2-амино-1,3-тиазола формулы (I), где оба или по крайней мере один из R2 и R3 является отличным от водорода; и, необязательно, преобразованием производного 2-амино-1,3-тиазола, представленного формулой (I), в другое производное 2-амино-1,3-тиазола, представленное формулой (I), и/или в его соль.
7. Фармацевтическая композиция, содержащая производное 2-амино-1,3-тиазола, указанного в п.1, и по крайней мере один фармацевтически приемлемый носитель и/или разбавитель.
Текст
005375 Предпосылки изобретения Область изобретения Настоящее изобретение относится к производным арилметилкарбониламинотиазола и более конкретно 2-(арилметилкарбониламино)-1,3-тиазола, к способу их получения, к содержащим их фармацевтическим композициям и их применению в качестве терапевтических средств, в частности, при лечении злокачественных опухолей и нарушений клеточной пролиферации. Предпосылки изобретения Некоторые цитотоксические лекарственные средства, такие как, например, фторурацил (5-ФУ),доксорубицин и камптотецины, повреждают ДНК или влияют на клеточные метаболические пути и, таким образом, во многих случаях вызывают опосредованное блокирование клеточного цикла. Поэтому эти средства приводят к значительной токсичности и побочным эффектам посредством нанесения необратимых повреждений как нормальным, так и опухолевым клеткам. В связи с этим требуются соединения, способные действовать как высокоизбирательные противоопухолевые средства, приводя к выключению и апоптозу опухолевых клеток со сравнимой эффективностью, но обладающие меньшей токсичностью по сравнению с доступными в настоящее время лекарственными средствами. Хорошо известно, что последовательность событий в течение клеточного цикла управляется рядом контрольных точек, по-другому называемых точками рестрикции, которые регулируются семейством ферментов, известных как циклинзависимые киназы (cdk). В свою очередь, сами cdk регулируются на многих уровнях, таких как, например, связывание циклинов. Координированная активация и инактивация различных комплексов циклин/cdk необходима для нормальной последовательности событий в течение клеточного цикла. Оба критических перехода G1-S иG2-M контролируются активацией деятельности различных циклинов/cdk. Предполагают, что во времяG1 циклин D/cdk4 и циклин E/cdk2 опосредуют запуск S-фазы. Для течения S-фазы требуется активность циклина A/cdk2, тогда как активация циклина A/cdc2 (cdk1) и циклина B/cdc2 требуется для запуска метафазы. Для общей ссылки на циклин и циклинзависимые киназы см., например, Kevin R. Webster et al., в Ехр. Opin. Invest. Drugs, 1998, Vol.7(6), 865-887. Контрольные точки в опухолевых клетках являются дефективными, что частично приводит к нарушению регуляции активности cdk. Например, измененная экспрессия циклина Е и cdk наблюдалась в опухолевых клетках, а делеция в гене р 27 KIP ингибитора cdk приводила, как было показано, к большей заболеваемости злокачественными опухолями у мышей. Увеличивающееся количество доказательств служит подтверждением того заключения, что cdk являются ферментами, лимитирующими скорость течения клеточного цикла и, как таковые, представляют собой молекулярные мишени для терапевтического вмешательства. В частности, прямое ингибирование активности cdk/циклиновой киназы должно способствовать ограничению нерегулируемой пролиферации опухолевой клетки. Сущность изобретения Объектом изобретения являются соединения, которые могут использоваться при лечении клеточных пролиферативных нарушений, ассоциированных с измененной клеточнозависимой киназной активностью. Другим объектом являются соединения, которые обладают ингибиторной активностью в отношении cdk/циклиновой киназы. Другим объектом изобретения являются соединения, которые могут использоваться в терапии в качестве противоопухолевых средств, но в плане токсичности и побочных эффектов лишены недостатков,которые присущи доступным в настоящее время противоопухолевым лекарственным средствам, которые обсуждались выше. В настоящее время авторы настоящего изобретения обнаружили, что производные 2-амино-1,3 тиазола обладают ингибирующей активностью в отношении cdk/циклиновой киназы и могут использоваться в терапии в качестве противоопухолевых средств, а в плане токсичности и побочных эффектов лишены вышеупомянутых недостатков, связанных с доступными в настоящее время противоопухолевыми лекарственными средствами. Более конкретно, соединения по данному изобретению могут использоваться для лечения разнообразных злокачественных опухолей, включающих в качестве неограничивающих примеров карциному,такую как карциномы мочевого пузыря, молочной железы, толстого кишечника, почки, печени, легкого,включая мелкоклеточный рак легкого, пищевода, желчного пузыря, яичника, поджелудочной железы,желудка, шейки матки, щитовидной железы, предстательной железы и кожи, включая плоскоклеточную карциному; опухоли из кроветворных клеток лимфоидного ряда, включая лейкоз, острый лимфолейкоз,острый лимфобластный лейкоз, В-клеточную лимфому, Т-клеточную лимфому, лимфому Ходжкина,неходжкинскую лимфому, волосато-клеточную лимфому и лимфому Беркитта; опухоли из кроветворных клеток миелоидного ряда, включая острый и хронический миелогенные лейкозы, миелодиспластический синдром и промиелоцитарный лейкоз; опухоли мезенхимального происхождения, включая фибросаркому и рабдомиосаркому; опухоли центральной и периферической нервной системы, включая астроцито-1 005375 му, нейробластому, глиому и шванному; другие опухоли, включая меланому, семиному, тератокарциному, остеосаркому, пигментную склеродермию, кератоксантому, фолликулярный рак щитовидной железы и саркому Капоши. Ввиду ключевой роли cdk в регуляции клеточной пролиферации производные 2-амино-1,3-тиазола также применимы для лечения разнообразных нарушений клеточной пролиферации, таких как, например, доброкачественная гиперплазия предстательной железы, семейный аденоматоз-полипоз, нейрофиброматоз, псориаз, пролиферация гладкомышечных клеток сосудов, ассоциированная с атеросклерозом,фиброз легких, артрит, гломерулонефрит и послеоперационные стеноз и рестеноз. Соединения по изобретению могут использоваться при лечении болезни Альцгеймера, что подтверждается тем фактом, что cdk5 вовлечена в фосфорилирование тау-белка (J. Biochem., 117, 741-749,1995). Соединения по данному изобретению в качестве модуляторов апоптоза могут быть также использованы при лечении злокачественных опухолей, вирусных инфекций, профилактике развития СПИД у ВИЧ-инфицированных субъектов, аутоиммунных заболеваний и нейродегенеративных нарушений. Соединения по данному изобретению могут быть использованы при ингибировании опухолевого ангиогенеза и метастазирования. Соединения по данному изобретению могут также действовать в качестве ингибиторов других протеинкиназ, например протеинкиназы С, her2, raf1, MEK1, МАР-киназы, рецептора EGF, рецептора PDGF,рецептора IGF, киназы PI3, киназы weel, Src, Аbl, и таким образом быть эффективными при лечении заболеваний, ассоциированных с другими протеинкиназами. Соответственно, настоящее изобретение относится к способу лечения нарушений клеточной пролиферации, ассоциированных с измененной клеточно-опосредованной киназной активностью, путем введения млекопитающему при такой необходимости эффективного количества производного 2-амино 1,3-тиазола, представленного формулой (I) или (II) где L представляет собой фенильную группу или 5- или 6-членный ароматический гетероцикл, содержащий один или несколько гетероатомов, выбранных из группы, включающей азот, кислород и серу;(i) атом галогена, нитрогруппу или выбран из группы, включающей пирролидино, морфолино, пиперазино,N-алкилпиперазино,N-арилпиперазино,N-арилалкилпиперазино,пиперидино и азабицикло[3,2,2]нонан; или(ii) аминогруппу, необязательно дополнительно замещенную одной или несколькими группами, которые могут быть одинаковыми или различными, выбранными из группы, включающей алкил, арил,арилалкил, алкилсульфонил, арилсульфонил, арилалкилсульфонил, алкилкарбонил, арилкарбонил и арилалкилкарбонил, в которых алкильные радикалы необязательно дополнительно замещены одной или несколькими гидрокси или аминогруппами; или(iii) С 3-С 6 циклоалкил, необязательно замещенный неразветвленной или разветвленной C1-C6 алкильной группой; или(iv) неразветвленную или разветвленную C1-C6 алкильную группу или арилалкильную группу, которая необязательно замещена одним или несколькими заместителями, выбранными из группы, включающей галоген, циано, карбокси, гидрокси, нитро, алкилтио, алкокси, неразветвленный или разветвленный(v) арильную группу, которая необязательно замещена одним или несколькими заместителями, выбранными из группы, включающей галоген, циано, карбокси, гидрокси, нитро, алкилтио, алкокси, неразветвленный или разветвленный C1-C6 алкил, арилтио, арилокси, амино, алкиламино, диалкиламино, ариламино, арилалкиламино, гидроксиаминокарбонил, алкоксиаминокарбонил, C2-C4 алкенил, C2-C4 алкинил,C3-C6 циклоалкил, алкил-C3-C6 циклоалкил, алкилкарбонил, арилкарбонил, арилалкилкарбонил, алкилсульфонил, арилсульфонил, арилалкилсульфонил, аминосульфонил, алкиламиносульфонил, диалкиламиносульфонил, алкилкарбониламино, арилалкилкарбониламино, ариламиносульфонил, арилалкиламиносульфонил, арилкарбониламино, алкилсульфониламино, арилсульфониламино, арилалкилсульфониламино, алкоксикарбонил, арилоксикарбонил, аминокарбонил, алкиламинокарбонил, ариламинокарбонил,-2 005375 диалкиламинокарбонил, арилалкиламинокарбонил, пирролидино, морфолино, пиперазино, Nалкилпиперазино, N-арилпиперазино, N-арилалкилпиперазино, пиперидино и азабицикло[3,2,2]нонан;R1 представляет собой атом водорода или неразветвленную или разветвленную C1-C4 алкильную группу, необязательно замещенную одним или несколькими гидрокси, алкокси, амино, алкиламино или диалкиламиногруппами;R2 и R3, которые могут быть одинаковыми или различными, представляют собой атом водорода,циклоалкильную группу, неразветвленную или разветвленную C1-C6 алкильную группу или арильную группу, каждая из которых необязательно замещена, как описано выше для R; илиR4 представляет собой карбокси, перфторированную алкильную группу, C2-C4 алкинильную группу,2-оксопирролидинил, пиперидинил или неразветвленную или разветвленную C1-C6 алкильную группу или арильную группу, которая необязательно замещена, как описано выше для R; или его фармацевтически приемлемой соли. В предпочтительном осуществлении вышеописанного способа нарушение клеточной пролиферации выбрано из группы, включающей злокачественные опухоли, болезни Альцгеймера, вирусные инфекции,аутоиммунные заболевания и нейродегенеративные нарушения. Конкретные виды злокачественных опухолей, которые могут подвергаться лечению, включают карциному, плоскоклеточную карциному, опухоли из кроветворных клеток миелоидного и лимфоидного ряда, опухоли мезенхимального происхождения, опухоли центральной и периферической нервной системы, меланому, семиному, тератокарциному, остеосаркому, пигментную склеродермию, кератоксантому, фолликулярный рак щитовидной железы и саркому Капоши. В другом предпочтительном осуществлении вышеописанного способа нарушение клеточной пролиферации выбрано из группы, включающей доброкачественную гиперплазию предстательной железы,семейный аденоматоз-полипоз, нейрофиброматоз, псориаз, пролиферацию гладкомышечных клеток сосудов, ассоциированную с атеросклерозом, фиброз легких, артрит, гломерулонефрит и постоперационные стеноз и рестеноз. Кроме того, способ по данному изобретению относится к ингибированию опухолевого ангиогенеза и метастазирования. Способ по данному изобретению также может относиться к ингибированию клеточного цикла или cdk-циклинзависимому ингибированию. Настоящее изобретение также относится к производному 2-амино-1,3-тиазола, представленному формулами (I) или (II) где L представляет собой фенильную группу или 5- или 6-членный ароматический гетероцикл, содержащий один или несколько гетероатомов, выбранных из группы, включающей азот, кислород и серу;(i) атом галогена, нитрогруппу или выбран из группы, включающей пирролидино, морфолино, пиперазино,N-алкилпиперазино,N-арилпиперазино,N-арилалкилпиперазино,пиперидино и азабицикло[3,2,2]нонан; или(ii) аминогруппу, необязательно замещенную одной или несколькими группами, которые являются одинаковыми или различными, выбранными из группы, включающей алкил, арил, арилалкил, алкилсульфонил, арилсульфонил, арилалкилсульфонил, алкилкарбонил, арилкарбонил и арилалкилкарбонил, в которых алкильные радикалы необязательно дополнительно замещены одной или несколькими гидрокси или аминогруппами; или(iii) C3-C6 циклоалкил, необязательно замещенный неразветвленной или разветвленной C1C6 алкильной группой; или(iv) неразветвленную или разветвленную C1-C6 алкильную группу или арилалкильную группу, которая необязательно замещена одним или несколькими заместителями, выбранными из группы, включающей заместители галоген, циано, карбокси, гидрокси, нитро, алкилтио, алкокси, неразветвленный или разветвленный C1-C6 алкил, арилтио, арилокси, амино, алкиламино, диалкиламино, ариламино, арилалкиламино, гидроксиаминокарбонил, алкоксиаминокарбонил, C2-C4 алкенил, С 2-С 4 алкинил, C3C6 циклоалкил, алкил-C3-C6 циклоалкил, алкилкарбонил, арилкарбонил, арилалкилкарбонил, алкилсульфонил, арилсульфонил, арилалкилсульфонил, аминосульфонил, алкиламиносульфонил, ариламиносульфонил, диалкиламиносульфонил, алкилкарбониламино, арилалкиламиносульфонил, арилкарбониламино,арилалкилкарбониламино, алкилсульфониламино, арилсульфониламино, арилалкилсульфониламино,алкоксикарбонил, арилоксикарбонил, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил,-3 005375 ариламинокарбонил, арилалкиламинокарбонил, пирролидино, морфолино, пиперазино, N-алкилпиперазино, N-арилпиперазино, N-арилалкилпиперазино, пиперидино или азабицикло[3,2,2]нонан; или(v) арильную группу, которая необязательно замещена одним или несколькими заместителями, выбранными из группы, включающей галоген, циано, карбокси, гидрокси, нитро, алкилтио, алкокси, неразветвленный или разветвленный C1-C6 алкил, арилтио, арилокси, амино, алкиламино, диалкиламино, ариламино, арилалкиламино, гидроксиаминокарбонил, алкоксиаминокарбонил, С 2-С 4 алкенил, C2-C4 алкинил,C3-C6 циклоалкил, алкил-C3-C6 циклоалкил, алкилкарбонил, арилкарбонил, арилалкилкарбонил, алкилсульфонил, арилсульфонил, арилалкилсульфонил, аминосульфонил, алкиламиносульфонил, ариламиносульфонил, диалкиламиносульфонил, алкилкарбониламино, арилалкиламиносульфонил, арилкарбониламино, арилалкилкарбониламино, алкилсульфониламино, арилсульфониламино, арилалкилсульфониламино, алкоксикарбонил, арилоксикарбонил, аминокарбонил, алкиламинокарбонил, диалкиламинокарбонил,ариламинокарбонил, арилалкиламинокарбонил, пирролидино, морфолино, пиперазино, N-алкилпиперазино, N-арилпиперазино, N-арилалкилпиперазино, пиперидино и азабицикло[3,2,2]нонан;R1 представляет собой атом водорода или неразветвленную или разветвленную C1-C4 алкильную группу, необязательно замещенную одним или несколькими гидрокси, алкокси, амино, алкиламино или диалкиламиногруппами;R2 и R3, которые могут быть одинаковыми или различными, представляют собой атом водорода,циклоалкильную группу, неразветвленную или разветвленную C1-C6 алкильную группу или арильную группу, каждая из которых необязательно замещена, как описано выше для R; илиR4 представляет собой карбокси, перфторированную алкильную группу, С 2-С 4 алкенильную группу,С 2-С 4 алкинильную группу, 2-оксопирролидинил, пиперидинил или неразветвленную или разветвленнуюC1-C6 алкильную группу или арильную группу, которая необязательно замещена, как описано выше дляR; или его фармацевтически приемлемой соли. Настоящее изобретение также относится к способу получения производного 2-амино-1,3-тиазола,описанного выше, или его фармацевтически приемлемой соли путем взаимодействия соединения, представленного формулой (III)Z представляет собой гидрокси или подходящую удаляемую группу,с получением производного 2-амино-1,3-тиазола, представленного формулой (I), где R, L, R1, R2 и R3 определены выше. Настоящее изобретение также относится к способу получения производного 2-амино-1,3-тиазола,описанного выше, или его фармацевтически приемлемой соли путем взаимодействия соединения, представленного формулой (I)(V) где R, R1, L и R4 определены выше, и Х представляет собой гидрокси или подходящую удаляемую группу, такую как хлор или бром,с получением производного 2-амино-1,3-тиазола, представленного формулой (II), где R, L, R1 и R4 определены выше. Настоящее изобретение также относится к способу получения производного 2-амино-1,3-тиазола,описанного выше, или его фармацевтически приемлемой соли путем взаимодействия производного 2 амино-1,3-тиазола, представленного формулой (I), где оба или по крайней мере один из R2 и R3 представляют собой атом водорода, с соединением, представленным формулой (VI)-4 005375 где R' имеет значения R2 или R3, но отличные от водорода, иY представляет собой подходящую удаляемую группу,с получением производного 2-амино-1,3-тиазола формулы (I), где оба или по крайней мере один из R2 иR3 является отличным от водорода; и, необязательно, преобразования производного 2-амино-1,3-тиазола,представленного формулой (I) или (II), в другое производное 2-амино-1,3-тиазола, представленное формулой (I) или (II), и/или в его соль. Настоящее изобретение также относится к фармацевтической композиции, включающей производное 2-амино-1,3-тиазола, описанное выше, и по крайней мере один фармацевтически приемлемый носитель и/или разбавитель. Более полную оценку изобретения и многих сопутствующих ему преимуществ легко осуществить и понять в свете следующего подробного описания. Подробное описание изобретения Некоторые 2-амино-1,3-тиазолы известны как гербициды, промежуточные продукты синтеза и даже как лекарственные средства. Среди них, например, 2-бензамидо-1,3-тиазолы известны в качестве антиаллергических средств (ЕР-А-261503, Valeas S.P.A.); 5-алкил-2-фенилалкилкарбониламино-1,3-тиазолы известны в качестве ингибиторов протеинкиназы С (WO 98/04536, Otsuka Pharmaceutical Co.); 5-арилтио-2 ациламино-1,3-тиазолы известны в качестве противоопухолевых средств (ЕР-А-412404, Fujisawa Pharm.Co.); 4-амино-2-карбониламино-1,3-тиазолы известны в качестве ингибиторов циклинзависимых киназ(WO 99/21845, Agouron Pharmaceuticals Inc.). Используемый здесь термин атом галогена, если не оговорено иного, относится к атому фтора,хлора, брома или йода. Используемые здесь термины алкил и алкокси, если не оговорено иного, включают C1-C6 алкил и C1-C6 алкоксигруппы. Термин неразветвленный или разветвленный включает C1-C6 алкил или C1C6 алкоксигруппу, выбранные из метила, этила, н-пропила, изопропила, н-бутила, изобутила, вторбутила, трет-бутила, н-пентила, н-гексила, метокси, этокси, н-пропокси, изопропокси, н-бутокси и тому подобное. Аналогично, термин N-алкилпиперазинил, алкилсульфонил, алкилкарбонил, алкилтио, диалкиламино, алкоксиамино, арилалкил, алкиламино, алкилциклоалкил, алкоксикарбонил, алкоксикарбониламино и тому подобное включает вышеуказанные группы, где алкильные и алкоксильные радикалы содержат, например, C1-C6 алкильную или алкоксильную группу. Если не оговорено иного, термин циклоалкил относится к C3-C6 циклоалкильной группе, такой как циклопропил, циклобутил, циклопентил и циклогексил, равно как циклоалкильной и конденсированной циклоалкильной группам, содержащим до 10 атомов углерода, таким как, например, адамантановая группа. Термин арил включает моно-, би- или поликарбоциклические или гетероциклические углеводороды, содержащие от 1 до 4 кольцевых радикалов, где по крайней мере одно из колец является ароматическим, либо конденсированные, либо связанные друг с другом одинарными связями. Таким образом,данные группы могут содержать от 5 до 20 атомов углерода, предпочтительно от 6 до 20 атомов углерода. Термин гетероцикл, следовательно, охватывающий гетероароматические кольца, включает 5- или 6-членные насыщенные или ненасыщенные карбоциклы, где один или несколько атомов углерода заменены одним или несколькими атомами, выбранными из азота, кислорода и серы. Примерами предпочтительных арильных групп являются фенил, 1-нафтил, 2-нафтил, инданил, инденил, бифенил, бензоциклоалкил, например бицикло[4,2,0]окта-1,3,5-триен, бензогетероциклил, например бензодиоксолил, хиноксалил, индолил, необязательно бензоконденсированный пирролил, фурил,тиенил, имидазолил, пиразолил, тиазолил, оксазолил, изоксазолил, тетразолил, пиридил, пиразинил, пиримидил и тому подобное. Термин C2-C4 алкенил или алкинил включает группу, выбранную из винила, аллила, 1-пропенила,изопропенила, 1-бутанола, 2-бутенила, 3-бутенила, этинила, пропинила, бутинила и тому подобного. Термин перфторированный алкил и алкоксигруппа относится к C1-C4 алкильной или алкоксильной группе, дополнительно замещенной более чем одним атомом фтора, такой как, например, трифторметил, 2,2,2-трифторэтил, 1,1,2,2,2-пентафторэтил, трифторметокси и тому подобным. Фармацевтически приемлемые соли соединений формулы (I) или (II) включают кислотноаддитивные соли неорганических или органических, например азотной, соляной, бромисто-водородной,серной, перхлорной, фосфорной, уксусной, трифторуксусной, пропионовой, гликолевой, молочной, щавелевой, малоновой, яблочной, малеиновой, винной, лимонной, бензойной, коричной, миндальной, метансульфоновой, изэтионовой и салициловой кислот, равно как и соли неорганических или органических оснований, например гидроксидов, карбонатов или бикарбонатов щелочных или щелочно-земельных металлов, особенно натрия, калия, кальция или магния, нециклических или циклических аминов, предпочтительно метиламина, этиламина, диэтиламина, триэтиламина или пиперидина. Соединения формулы (I) или (II) могут иметь асимметрические атомы углерода и могут, таким образом, существовать либо в виде рацемических смесей, либо в виде отдельных оптических изомеров.-5 005375 Соответственно, также в объем настоящего изобретения входит применение в качестве противоопухолевого средства всех возможных изомеров и их смесей и как метаболитов, так и фармацевтически приемлемых биологических предшественников (иначе называемых пролекарствами) соединений формулы (I) или (II). Предпочтительные соединения по данному изобретению формулы (I) или (II) представляют собой соединения, в которых L представляет собой фенил, тиазол, имидазол, оксазол, пиразол, изоксазол, тиофен, пиридин или пиримидин; R представляет собой (i) атом галогена, (ii) группу, выбранную из ариламино, алкиламино или диалкиламино, где алкильный радикал может быть дополнительно замещен одной или несколькими гидрокси- или аминогруппами, (iii) C3-C6 циклоалкильную группу, необязательно замещенную алкильной группой, (iv) неразветвленную или разветвленную C1-C4 алкильную или арилалкильную группу, каждая из которых необязательно замещена, как указано выше, (v) необязательно замещенную арильную группу; R1 представляет собой водород или C1-C4 алкильную группу, необязательно замещенную гидрокси или амино. Еще более предпочтительными соединениями в пределах данного класса являются соединения формулы (I) или (II), где L представляет собой фенил или тиазол; R выбран из группы, включающей алкиламино или диалкиламино, где алкильный радикал может быть дополнительно замещен одной или несколькими гидрокси- или аминогруппами, C3-C6 циклоалкилом, неразветвленным или разветвленнымC1-C4 алкилом, необязательно замещенным одним или несколькими гидрокси, амино, алкиламино, диалкиламино, пирролидино, морфолино, N-алкилпиперазино, азабицикло[3,2,2]нонаном; R1 представляет собой водород; R2 и R3 представляют собой, одинаковые или различные, водород, адамантил, неразветвленный или разветвленный C1-C6 алкил, необязательно замещенный одним или несколькими гидрокси,алкокси, амино, алкиламино, диалкиламино, пирролидино, морфолино, N-алкилпиперазино, имидазолом,3-азабицикло[3,2,2]нонаном, аминокарбонилом, диалкиламинокарбонилом; или, вместе с атомом азота, с которым они связаны, R2 и R3 образуют 4-морфолинильное, N-алкилпиперазинильное, пирролидинильное, 2-оксо-1-пирролидинильное, имидазолильное или 3-азабицикло[3,2,2]нонильное кольцо; и R4 представляет собой карбокси, перфорированный алкил, С 2-С 4 алкенил, С 2-С 4 алкинил, 2-оксопирролидинил,пиперидинил, арил, необязательно замещенный галогеном, диалкиламино, аминосульфонилом, аминокарбонилом, алкокси, гидрокси, алкилкарбониламино, амино, пирролидино, N-алкилпиперазино, морфолино; или R4 представляет собой неразветвленную или разветвленную C1-C6 алкильную группу, необязательно замещенную галогеном, гидрокси, алкокси, алкилтио, арилтио, C3-C6 циклоалкилом, циано, карбокси, амино, алкиламино, диалкиламино, пирролидино, морфолино, N-алкилпиперазино, азабицикло[3,2,2]нонаном, аминокарбонилом, алкиламинокарбонилом, диалкиламинокарбонилом, арилом, необязательно замещенным галогеном, диалкиламино, аминосульфонилом, аминокарбонилом, алкокси, гидрокси, алкилкарбониламино, амино, алкиламино, пирролидино, N-алкилпиперазино или морфолино. Примеры предпочтительных соединений формулы (I) или (II) по данному изобретению, которые могут находиться в виде фармацевтически приемлемых солей, например гидробромида или гидрохлорида, включают следующее:N-(5-циклопропил-1,3-тиазол-2-ил)-2-[4-(диметиламино)фенил]ацетамид. Соединения формулы (I) или (II) и их соли могут быть получены, например, в соответствии со способом, предусматривающим(а) взаимодействие соединения формулы (III) где R, L, R1, R2 и R3 определены выше и Z представляет собой гидрокси или подходящую удаляемую группу, с получением соединения формулы (I), где R, L, R1, R2 и R3 определены выше; или(b) взаимодействие соединения формулы (I)(V) где R, R1, L и R4 определены выше и Х представляет собой гидрокси или подходящую удаляемую группу, такую как хлор или бром, с получением соединения формулы (II), где R, L, R1 и R4 определены выше; или(с) взаимодействие соединения приведенной выше формулы (I), где оба или по крайней мере один из R2 и R3 представляет собой атом водорода, с соединением формулы (VI)(VI) где R' имеет значения R2 или R3, но является отличным от водорода, и Y представляет собой подходящую удаляемую группу, такую как хлор, бром, мезил, тозил, гидрокси или формил (СНО), с получением соединения формулы (I), где оба или по крайней мере один из R2 и R3 является отличным от водорода; и,необязательно, преобразование соединения формулы (I) или (II) в иное соединение формулы (I) или (II) и/или в их соль. Как понятно среднему специалисту в данной области, если соединение формулы (I) или (II), полученное в соответствии с описанным выше способом, получают в виде смеси изомеров, его разделение на отдельные изомеры формулы (I) или (II) в соответствии с обычными методами входит в объем настоящего изобретения. Аналогично, преобразование в свободное соединение (I) или (II) соответствующей ему соли в соответствии с хорошо известными в данной области методами входит в объем настоящего изобретения. Описанные выше способы (а), (b), (с) являются аналогичными способами, которые могут быть осуществлены в соответствии с хорошо известными в данной области методами. Взаимодействие соединения формулы (III) с соединением формулы (IV), где Z представляет собой гидроксигруппу, в соответствии со способом (а) или соединения формулы (I), где и R2, и R3 представляют собой атомы водорода, с карбоновой кислотой формулы (V), где Х представляет собой гидроксигруппу, в соответствии со способом (b) может быть осуществлен в присутствии связующего агента, такого как, например, карбодиимид, т.е. 1,3-дициклогексилкарбодиимид, 1,3-диизопропилкарбодиимид или 1(3-диметиламинопропил)-3-этилкарбодиимид, или с использованием карбодиимида на полимерном носителе, таком как N-циклогексилкарбодиимид, N'-метилполистирол, в подходящем растворителе, таком как, например, дихлорметан, хлороформ, тетрагидрофуран, диэтиловый эфир, 1,4-диоксан, ацетонитрил,толуол или N,N-диметилформамид, при температуре в интервале приблизительно от -10 С до температуры возгонки в течение подходящего промежутка времени, т.е. приблизительно от 30 мин до 8 суток. Взаимодействие соединения формулы (III) с соединением формулы (IV), где Z представляет собой гидрокси, или соединения формулы (I), где R2 и R3 представляют собой атомы водорода, с соединением формулы (V), где Х представляет собой гидрокси, также может быть осуществлено, например, в соответствии с методом смешанных ангидридов с использованием алкилхлорформиата, такого как этил, изобутил и изопропилхлорформиат, в присутствии третичного основания, такого как триэтиламин, N,Nдиизопропилэтиламин или пиридин, в подходящем растворителе, таком как, например, толуол, дихлорметан, хлороформ, тетрагидрофуран, ацетонитрил, диэтиловый эфир, 1,4-диоксан или N,Nдиметилформамид, при температуре в интервале приблизительно от -30 С до комнатной температуры. Взаимодействие соединения формулы (III) с производным карбоновой кислоты формулы (IV), где Z представляет собой подходящую удаляемую группу, в соответствии со способом (а) или соединения формулы (I), где R2 и R3 представляют собой атомы водорода, с производным карбоновой кислоты формулы (V), где Х представляет собой подходящую удаляемую группу, в соответствии со способом (b) может быть осуществлено в присутствии третичного основания, такого как триэтиламин, N,Nдиизопропилэтиламин или пиридин, в подходящем растворителе, таком как, например, толуол, дихлорметан, хлороформ, диэтиловый эфир, тетрагидрофуран, ацетонитрил или N,N-диметилформамид, при температуре в интервале приблизительно от -10 С до температуры возгонки. Взаимодействие соединения формулы (I) с соединением формулы (VI), где Y представляет собой подходящую удаляемую группу, в соответствии со способом (с) может быть осуществлено в присутствии подходящего основания, такого как карбонат калия, триэтиламин, N,N-диизопропилэтиламин или пиридин, в подходящем растворителе, таком как этанол, ацетонитрил, N,N-диметилформамид, 1,4 диоксан или тетрагидрофуран, при температуре в интервале приблизительно от комнатной температуры до температуры возгонки. Взаимодействие соединения формулы (I) с соединением формулы (VI), где Y представляет собой гидрокси, в соответствии со способом (с) может быть осуществлено в условиях реакции Мицунобу в-9 005375 присутствии трифенилфосфина и диэтилазидодикарбоксилата, в подходящем растворителе, таком как тетрагидрофуран, при температуре в интервале приблизительно от 0 С до комнатной температуры. Взаимодействие соединения формулы (I) с соединением формулы (VI), где Y представляет собой СНО, в соответствии со способом (с) может быть осуществлено в присутствии традиционных восстановителей, таких как, например, боргидрид натрия, цианоборгидрид натрия или триацетоксиборгидрид натрия, в подходящем растворителе, таком как метанол или этанол, при температуре в интервале приблизительно от комнатной температуры до температуры возгонки. Также в соответствии с известными методами может быть осуществлено необязательное преобразование соединения формулы (I) или (II) в иное соединение формулы (I) или (II). Например, описанный выше способ (с) может рассматриваться как необязательное преобразование соединения по данному изобретению в иное соединение по данному изобретению. В соответствии с известными методами может быть осуществлено необязательное образование соли соединения формулы (I) или (II) или преобразование соли в свободное соединение, а также разделение смеси изомеров на отдельные изомеры. Соединения формул (III), (IV), (V) и (VI) в соответствии со способом по настоящему изобретению представляют собой известные соединения или могут быть получены в соответствии с известными способами. Соединение формулы (IV) или формулы (V), где Z или Х представляет собой удаляемую группу,определенную выше, может быть получено в соответствии с обычными методами из соответствующих карбоновых кислот формулы (IV) или (V), где Z или Х представляет собой гидрокси. Соединение формулы (III), где R определен выше, может быть получено, например, путем взаимодействия соединения формулы (VII) где R определен выше и W представляет собой бром или хлор, с тиомочевиной в подходящем растворителе, таком как метанол, этанол, тетрагидрофуран, 1,4-диоксан или толуол, при температуре в интервале приблизительно от комнатной температуры до температуры возгонки в течение подходящего промежутка времени в интервале приблизительно от 1 ч приблизительно до 24 ч. Соединения формул (IV)-(VII) в некоторых случаях представляют собой коммерческие продукты или могут быть получены с методами, хорошо известными в данной области. При получении соединений формулы (I) в соответствии со способом по настоящему изобретению необязательные функциональные группы обоих исходных продуктов или их промежуточных соединений, которые могут вызывать нежелательные побочные реакции, должны быть надежно защищены обычными методами. Аналогично, преобразование защищенных исходных продуктов или их промежуточных соединений в свободные лишенные защиты соединения может быть осуществлено известными методами. Фармакология Соединения формулы (I) или (II) проявляют активность ингибиторов cdk/циклинов, о чем свидетельствуют положительные результаты испытания в соответствии со следующей методикой. Ингибирующую активность предполагаемых ингибиторов cdk/циклинов и эффективность отобранных соединений определяли в соответствии с методом проведения анализа, основанным на применении 96-луночного планшета MultiScreen-PH (Millipore), в котором на дно каждой лунки помещали фосфоцеллюлозную фильтровальную бумагу, что позволяло связывать положительно заряженный субстрат по окончании стадии промывания/фильтрования. Когда радиоактивно помеченный фосфатный радикал переносился сериновой/треониновой киназой на связанный с фильтром гистон, испускаемый свет измеряли с помощью сцинтилляционного счетчика. Анализ ингибирования активности сdk2/циклина А проводили в соответствии со следующим протоколом. Киназная реакция: 1,5 М субстрата гистона HI, 25M АТФ (0,5 мкКи Р 33g-АТФ), 100 нг комплекса циклин A/cdk2, 10M ингибитора в конечном объеме 100 мкл буфера (Трис-НСl 10 мМ, рН 7,5, MgCl2 10 мМ, 7,5 мМ ДТТ) добавляли в каждую лунку с U-образным дном 96-луночного планшета. После инкубации в течение 10 мин при 37 С реакцию останавливали 20 мкл 120 мМ ЭДТА. Улавливание: 100 мкл переносили из каждой лунки на планшет Multiscreen, давая субстрату связаться с фосфоцеллюлозным фильтром. Планшеты затем промывали 3 раза 150 pi/лунку не содержащего Са/Мg ФБР и фильтровали с использованием фильтровальной системы Multiscreen. Определение: фильтрам давали высохнуть при 37 С, затем добавляли 100 мкл сцинтиллятора на лунку и 33 Р-меченый гистон HI определяли путем подсчета радиоактивности с помощью прибора TopCount. Результаты: данные анализировали и выражали как % ингибирования в зависимости от общей активности фермента (принятой за 100%).- 10005375 Все соединения, проявившие 50%-ное ингибирование, анализировали в дальнейшем с целью исследования и определения кинетического профиля ингибитора путем расчета Ki. Использовали протокол, соответствующий описанному выше, за исключением концентраций АТФ и субстрата. Варьировали и концентрацию АТФ, и концентрацию субстрата гистона HI: 4, 8, 12, 24, 48AM для АТФ (содержащего пропорционально разведенный Р 33g-АТФ) и 0,4, 0,8, 1,2, 2,4, 4,8 AM для гистона использовали в отсутствие и в присутствии двух различных, надлежащим образом выбранных концентраций ингибитора. Экспериментальные данные анализировали с помощью компьютерной программы "SigmaPlot" для определения Ki, применяя уравнение случайной системы биореагентов где А=АТФ, а В=гистон HI. В качестве примера сообщается об ингибирующей активности по отношению к комплексуcdk2/циклин А, выраженное как значение IC50, соединения по данному изобретению, а именно 2-[2(ацетиламино)-1,3-тиазол-4-ил]-N-(5-изопропил-1,3-тиазол-2-ил)ацетамида [0,5 (М)]. Кроме того, ингибирующую активность предполагаемых ингибиторов cdk/циклина и эффективность отобранных соединений определяли с помощью методики проведения анализа, основанной на использовании анализа на 96-луночном планшете для SPA (Scintillation Proximity Assay). Анализ основан на способности гранул для SPA, покрытых стрептавидином, улавливать биотинилированный пептид,полученный из сайта фосфорилирования гистона. Когда радиоактивно помеченный фосфатный радикал переносился сериновой/треониновой киназой на биотинилированный гистоновый пептид, испускаемый свет измеряли с помощью сцинтилляционного счетчика. Анализ ингибирования активности cdk5/p25 проводили в соответствии со следующим протоколом. Киназная реакция: 1,0 М субстрата биотинилированного гистонового пептида, 0,25 мкКи Р 33g-АТФ,4 нМ комплекса cdk2/p25, 0-100 мкМ ингибитора в конечном объеме 100 мкл буфера (Hepes 20 мМ, рН 7,5, MgCl2 15 мМ, 1 мМ ДТТ) добавляли в каждую лунку с U-образным дном 96-луночного планшета. После инкубации в течение 20 мин при 37 С реакцию останавливали добавлением 500 мкг гранул дляSPA в фосфатно-буферном растворе, содержащем 0,1% Тритона Х-100, 50 мкМ АТФ и 5 мМ ЭДТА. Гранулам давали осесть и радиоактивность, включенную в 33 Р-меченый пептид, определяли с помощью сцинтилляционного счетчика Top Count. Результаты: данные анализировали и выражали как % ингибирования, используя формулу 100(1-(неизв.-контроль)/(ферм. контроль-контроль Значения IC50 рассчитывали, применяя разновидность четырехпараметрического логического уравненияY=100/[1+106LogEC50-Х)наклон)] где Х=lоg (мкМ), а Y=% ингибирования. Таким образом, соединения формулы (I) или (II) могут использоваться для подавления нерегулируемой пролиферации опухолевых клеток, и, следовательно, в терапии для лечения различных опухолей,таких как, например, карциномы, например карцинома молочной железы, карцинома легкого, карцинома мочевого пузыря, карцинома толстой кишки, опухоли яичников и эндометрия, саркомы, например саркомы мягких тканей и костей, и злокачественные новообразования из кроветворной ткани, такие как,например, лейкозы. Кроме того, соединения формулы (I) или (II) также могут использоваться в лечении других клеточно-пролиферативных заболеваний, таких как псориаз, пролиферация гладкомышечных клеток сосудов,связанная с атеросклерозом и послеоперационным стенозом и рестенозом, и в лечении болезни Альцгеймера. Соединения формулы (I) или (II) по настоящему изобретению, подходящие для введения млекопитающему, например человеку, могут быть введены обычными путями, а уровень дозировки зависит от возраста, массы тела, состояния пациента и пути введения. Например, подходящая дозировка, принятая для перорального введения соединения формулы (I) или (II), может варьироваться приблизительно от 10 приблизительно до 500 мг на дозу, от 1 до 5 раз в сутки. Соединения по настоящему изобретению могут применяться либо сами по себе, либо, альтернативно, в сочетании с известными противораковыми способами лечения, такими как лучевая терапия или химиотерапия, в сочетании с цитостатическими или цитотоксическими средствами, антибиотикоподобными средствами, алкилирующими средствами, антиметаболитными средствами, гормональными сред- 11005375 ствами, иммунными средствами, интерфероноподобными средствами, ингибиторами циклооксигеназ(например, ингибиторами СОХ-2), ингибиторами матриксных металлопротеаз, ингибиторами теломеразы, ингибиторами тирозинкиназ, блокаторами рецептора фактора роста, анти-HER средствами, антиEGFR средствами, антиангиогенетическими средствами, ингибиторами фарнезилтрансферазы, ингибиторами пути передачи сигнала ras-raf, ингибиторами клеточного цикла, иными ингибиторами cdk, связывающими тубулин средствами, ингибиторами топоизомеразы I, ингибиторами топоизомеразы II и т.п. Например, соединения по данному изобретению могут вводиться в сочетании с одним или несколькими химиотерапевтическими средствами, такими как, например, таксан, производные таксана, инкапсулированные таксаны, СРТ-11, производные кампотецина, антрациклиновые гликозиды, например доксорубицин, идарубицин, эпирубицин, этопозид, навелбин, винбластин, карбоплатин, цисплатин, эстрамустин, целекоксиб, Sugen SU-5416, Sugen SU-6668, герцептин и т.п., необязательно в их липосомных препаратах. При приготовлении в виде фиксированной дозы такие комбинированные продукты включают соединения по данному изобретению в дозировках, описанных выше, и другое фармацевтически активное средство в одобренных дозировках. Соединения формулы (I) могут применяться последовательно с известными противораковыми средствами, если комбинированный препарат неприемлем. Соединения по данному изобретению могут вводиться в виде разнообразных дозированных форм,например перорально в виде таблеток, капсул, таблеток, покрытых сахаром или пленкой, жидких растворов или суспензий; ректально в форме суппозиториев; парентерально, например внутримышечно, или с помощью внутривенной, и/или интратекальной, и/или интраспинальной инъекции или инфузии. Настоящее изобретение также включает фармацевтические композиции, содержащие соединение формулы (I) или (II) или их фармацевтически приемлемую соль в сочетании с фармацевтически приемлемым наполнителем (который может представлять собой носитель или разбавитель). Фармацевтические композиции, содержащие соединения по данному изобретению, обычно готовят в соответствии со следующими обычными методами и вводят в фармацевтически приемлемой форме. Например, твердые дозированные формы могут содержать в сочетании с активным соединением разбавители, например лактозу, декстрозу, тростниковый сахар, сахарозу, целлюлозу, кукурузный крахмал или картофельный крахмал; смазывающие вещества, например силикагель, тальк, стеариновую кислоту, стеарат магния или кальция и/или полиэтиленгликоли; связующие вещества, например крахмалы,гуммиарабик, желатин, метилцеллюлозу, карбоксиметилцеллюлозу или поливинилпирролидон; разрыхлители, например крахмал, альгиновую кислоту, альгинаты или натрийкрахмалгликолят; шипучие смеси; красители; подсластители; смачивающие вещества, такие как лецитин, полисорбаты, лаурилсульфаты; и,вообще, нетоксичные и фармакологически инертные вещества, применяемые в фармацевтических препаратах. Фармацевтические препараты могут быть произведены обычным образом путем процессов смешивания, гранулирования, нанесения сахарного или пленочного покрытия. Жидкие дисперсии для перорального введения, для таблетирования, могут представлять собой сиропы, эмульсии и суспензии. Сиропы могут содержать в качестве носителя, например, сахарозу или сахарозу с глицерином,и/или маннитом, и/или сорбитом. Суспензии и эмульсии могут содержать в качестве носителя, например, натуральную смолу, агарагар, альгинат натрия, пектин, метилцеллюлозу, карбоксиметилцеллюлозу или поливиниловый спирт. Суспензии или растворы для внутримышечных инъекций могут содержать в сочетании с активным соединением фармацевтически приемлемый носитель, например стерильную воду, оливковое масло,этилолеат, гликоли, например пропиленгликоль, и, при необходимости, подходящее количество лидокаина гидрохлорида. Растворы для внутривенных инъекций или инфузий могут содержать в качестве носителя, например, стерильную воду, или, предпочтительно, они могут находиться в форме стерильных водных изотонических солевых растворов, или они могут содержать в качестве носителя пропиленгликоль. Суппозитории могут содержать в сочетании с активным соединением фармацевтически приемлемый носитель, например масло какао, полиэтиленгликоль, поверхностно-активное вещество на основе сложного эфира полиоксиэтиленсорбитана и жирной кислоты или лецитин. Следующие примеры иллюстрируют, но не ограничивают, настоящее изобретение. Примеры В дополнение к общему описанию данного изобретения, дальнейшее понимание может быть достигнуто с помощью конкретных особых примеров, которые приведены здесь исключительно в иллюстративных целях и не призваны ограничивать объем притязаний, если иное не указано особо. Пример 1. Получение 2-амино-5-изопропил-1,3-тиазола. 2 мл (18,6 ммоль) 3-метилбутиральдегида растворяли в 15 мл 1,4-диоксана. При 0 С добавляли 40,4 мл (18,6 ммоль) 2% (по объему) раствора брома в 1,4-диоксане. Смесь выдерживали при комнатной температуре при перемешивании в течение 2 ч, затем добавляли 2,83 г (37,2 ммоль) тиомочевины и 5 мл этанола.- 12005375 После выдерживания 6 ч при комнатной температуре раствор упаривали досуха, остаток растворяли в CH2Cl2 и продукт экстрагировали добавлением 1 М соляной кислоты; водный слой подщелачивали, используя 30% гидрат аммония, и вновь экстрагировали добавлением CH2Cl2. Органическую фазу сушили над сульфатом натрия и упаривали в вакууме. Остаток подвергали хроматографии на колонке с силикагелем, элюируя циклогексаном-этилацетатом, с получением 1,1 г (выход 42%) указанного в заголовке соединения. 1 Н-ЯМР (DMSO-d6) м.д.: 6,6 (с, 2 Н, NH2); 6,58 (с, 1 Н, тиазол СН); 2,9 (м, 1 Н, СНМе 2); 1,18 (с, 3 Н,МеСНМе); 1,17 (с, 3 Н, МеСНМе). Аналогично, исходя из соответствующего альдегида, может быть получен следующий продукт: 2 амино-5-циклопропил-1,3-тиазол. Пример 2. Получение трет-бутил-4-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксоэтил-1,3 тиазол-2-илкарбамата.EDCI (20,6 г, 107 ммоль) добавляли к раствору 2-2[(трет-бутоксикарбонил)амино]-1,3-тиазол-4 илуксусной кислоты (25 г, 97 ммоль) в СНСl3 (200 мл) при охлаждении на льду. После перемешивания в течение 1 ч добавляли по каплям раствор 2-амино-5-изопропил-1,3-тиазола(13,7 г, 97 ммоль) в СНСl3 (150 мл) и полученную смесь выдерживали при 0 С в течение 1 ч, а затем при комнатной температуре в течение ночи. Раствор промывали водой, 5% лимонной кислотой, насыщенным раствором бикарбоната натрия и солевым раствором. Сушка над сульфатом натрия и упаривание позволяли получить твердое вещество, которое подвергали хроматографии на колонке с силикагелем, используя СН 2 Сl2:МеОН 95:5 в качестве элюента с получением указанного в заголовке соединения в виде бесцветного твердого вещества (22 г; 59%). Т.пл. 196-197 С. 1 Н-ЯМР (DMSO-d6) м.д.: 12 (с, уширенный, 1 Н, NH); 11,4 (с, уширенный, 1 Н, NHBoc); 7,14 (с, 1 Н,Н 4-тиазол); 6,9 (с, 1 Н, Н 5-тиазол'); 3,7 (с, 2 Н, СН 2); 3,08 (м, 1 Н, СНМе 2); 1,42 (с, 9 Н, t-Bu); 1,22 (д, 6 Н,СНМе 2). Аналогично, исходя из соответствующей карбоновой кислоты, может быть получен следующий продукт: трет-бутил-4-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксоэтилфенилкарбамат. Т.пл. 179-180 С. 1 Н-ЯМР (DMSO-d6) м.д.: 12,1 (с, уширенный, 1 Н, NH); 9,22 (с, уширенный, 1 Н, NHBoc); 7,35 (д,2 Н, Ph); 7,19 (с, 1 Н, Н 4-тиазол); 7,15 (д, 2 Н, Ph); 3,6 (с, 2 Н, СН 2); 3,08 (м, 1 Н, СНМе 2); 1,43 (с, 9 Н, t-Bu); 1,11 (д, 6 Н, СНМе 2). Пример 3. Получение 2-(2-амино-1,3-тиазол-4-ил)-N-(5-изопропил-1,3-тиазол-2-ил)ацетамида. Трифторуксусную кислоту (168 мл) добавляли к раствору трет-бутил-4-2-[(5-изопропил-1,3 тиазол-2-ил)амино]-2-оксоэтил-1,3-тиазол-2-илкарбамата (22 г, 57,51 ммоль) в CH2Cl2 (750 мл) и анизола (9,33 мл, 86,27 ммоль) при охлаждении на льду. После перемешивания в течение 2 ч при 0 С раствор выдерживали при комнатной температуре в течение ночи и затем упаривали. Остаток растворяли в CH2Cl2 и растворитель выпаривали (500 мл 3). Остаток затем распределяли между CH2Cl2 и водой. Органический слой дополнительно промывали водой, насыщенным раствором бикарбоната натрия и солевым раствором. Сушка над сульфатом натрия и упаривание позволяли получить твердое вещество, которое растирали с изопропиловым эфиром/циклогексаном с получением указанного в заголовке соединения в виде бежевого твердого вещества (13 г; 81%). Т.пл. 201-203 С. 1 Н-ЯМР (DMSO-d6) м.д.: 11,98 (с, уширенный, 1 Н, NH); 7,13 (с, уширенный, 1 Н, NHBoc); 7-6,6 (м,4 Н, Ph); 5,9 (с, уширенный, 2 Н, NH2); 3,55 (с, 2 Н, СН 2); 3,08 (м, 1 Н, СНМе 2); 1,12 (д, 6 Н, СНМе 2). Аналогично могут быть получены следующие продукты: 2-(4-аминофенил)-N-(5-изопропил-1,3 тиазол-2-ил)ацетамид. Т.пл. 165-166 С. 1 Н-ЯМР (DMSO-d6) м.д.: 11,98 (с, уширенный, 1 Н, NH); 7,13 (с, 1 Н, Н 4-тиазол); 7-6,6 (м, 4 Н, Ph); 5,9 (с, уширенный, 2 Н, NH2); 3,55 (с, 2 Н, СН 2); 3,08 (м, 1 Н, СНМе 2); 1,12 (д, 6 Н, СНМе 2). 4-Амино-N-(4-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксоэтил-1,3-тиазол-2-ил)бутанамид; 3-амино-N-(4-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксоэтил-1,3-тиазол-2-ил)пропанамид; и 2-амино-N-(4-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксоэтил-1,3-тиазол-2-ил)ацетамид. Пример 4. Получение 2-хлор-N-(4-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксоэтил-1,3-тиазол 2-ил)ацетамида.EDCI (0,49 г, 2,54 ммоль) добавляли к раствору дихлоруксусной кислоты (0,24 г, 2,54 ммоль) в СНСl3(10 мл) при охлаждении на льду. После перемешивания в течение 1 ч при 0 С добавляли по каплям раствор 2-(2-амино-1,3-тиазол-4 ил)-N-(5-изопропил-1,3-тиазол-2-ил)ацетамида (0,6 г, 2,12 ммоль) в СНСl3 (10 мл) и полученную смесь выдерживали при 0 С в течение 1 ч, а затем при комнатной температуре в течение ночи.- 13005375 Раствор промывали водой, 5% лимонной кислотой, водой, насыщенным раствором бикарбоната натрия и солевым раствором. Сушка над сульфатом натрия и упаривание позволяли получить твердое вещество, которое подвергали хроматографии на колонке с силикагелем, используя СН 2 Сl2, а затем CH2Cl2:MeOH 99:1 в качестве элюента с получением указанного в заголовке соединения в виде бесцветного твердого вещества (0,49 г; 65%). Т.пл. 176-178 С. 1 Н-ЯМР (CDCl3) м.д.: 11 (с, уширенный, 2 Н, 2NH); 7,01 (с, 1 Н, Н 4-тиазол); 6,83 (с, 1 Н, Н 5-тиазол'); 4,23 (с, 2 Н, СН 2 Сl); 3,83 (с, 2 Н, СН 2 СО); 3,1 (м, 1 Н, СНМе 2); 1,35 (д, 6 Н, СНМе 2). Аналогично могут быть получены следующие продукты: 2-[2-(ацетиламино)-1,3-тиазол-4-ил]-N-(5 изопропил-1,3-тиазол-2-ил)ацетамид. Т.пл. 174-176 С. 1 Н-ЯМР (DMSO-d6) м.д.: 12,1 (2 с, уширенный, 2 Н, 2NH); 7,15 (с, 1 Н, Н 4-тиазол); 6,93 (с, 1 Н, НSтиазол'); 3,77 (с, 2 Н, СН 2); 3,3 (с, 3 Н, СН 3); 3,1 (м, 1 Н, СНМе 2); 1,22 (д, 6 Н, СНМе 2). 4-Хлор-N-(4-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксоэтил-1,3-тиазол-2-ил)бутанамид. Т.пл. 170-172 С. 1 Н-ЯМР (DMSO-d6) м.д.: 12,15 (с, уширенный, 1 Н, NH); 12,05 (с, уширенный, 1 Н, NH); 7,12 (с, 1 Н,Н 4-тиазол); 6,95 (с, 1 Н, Н 5-тиазол'); 3,76 (с, 2 Н, СН 2 СО); 3,62 (т, 2 Н, СН 2 СН 2 СН 2 Сl); 3,08 (м, 1 Н, СНМе 2); 2,55 (т, 2 Н, СН 2 СН 2 СН 2 Сl); 2 (тт, 2 Н, СН 2 СН 2 СН 2 Сl); 1,1 (д, 6 Н, СНМе 2).N-(5-циклопропил-1,3-тиазол-2-ил)-2-[4-(диметиламино)фенил]ацетамид. Пример 5. Получение N-(4-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксоэтил-1,3-тиазол-2-ил)2-метилпропанамида. К раствору изомасляной кислоты (49 мкл, 0,53 ммоль) в СН 2 Сl2 (1,5 мл) добавляли Nциклогексилкарбодиимид, N'-метилполистирол (0,4 г, загрузка 2 ммоль/г, 0,798 ммоль), Nгидроксибензотриазол (0,072 г, 0,53 ммоль) и раствор 2-(2-амино-1,3-тиазол-4-ил)-N-(5-изопропил-1,3 тиазол-2-ил)ацетамида (0,075 г, 0,266 ммоль) в СН 2 Сl2/ДМФ (0,4 мл/0,6 мл). Реакционную смесь выдерживали при перемешивании при комнатной температуре в течение приблизительно 8 суток. По прошествии этого времени добавляли PS-Trisamine (0,44 г, загрузка 3,62 ммоль/г, 1,596 ммоль), перемешивание продолжали в течение приблизительно 6 ч и затем смесь фильтровали. Смолу промывали в CH2Cl2 (1 мл х 5), органические слои объединяли и упаривали досуха с получением после растирания с диизопропиловым эфиром указанного в заголовке соединения. Аналогично, исходя из соответствующих карбоновых кислот, могут быть получены следующие соединения:N-(4-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксоэтил-1,3-тиазол-2-ил)-2-(3-пиридинил)-1,3-тиазол-4-карбоксамид; 2-[2-(ацетиламино)-1,3-тиазол-4-ил]-N-(5-циклопропил-1,3-тиазол-2-ил)ацетамид. Пример 6. Получение этил-2-[(4-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксоэтил-1,3-тиазол-2 ил)амино]-2-оксоацетата. Раствор этилоксалилхлорида (1,2 мл, 10,6 ммоль) в СНСl3 (3 мл) добавляли по каплям к раствору 2(2-амино-1,3-тиазол-4-ил)-N-(5-изопропил-1,3-тиазол-2-ил)ацетамида (2,5 г, 8,85 ммоль) и триэтиламина (1,85 мл, 13,28 ммоль) в СНСl3/ДМФ (50 мл/15 мл) при охлаждении при 0 С. Реакционную смесь перемешивали приблизительно в течение 1 ч при 0 С и при комнатной температуре в течение ночи, затем промывали водой, 5% лимонной кислотой, водой, насыщенным раствором бикарбоната натрия, солевым раствором,сушили над сульфатом натрия и упаривали досуха с получением указанного в заголовке соединения, которое применяли без дальнейшей очистки (1,2 г). Аналогично, исходя из соответствующих хлорангидридов кислот, могут быть получены и использованы в качестве неочищенных веществ следующие соединения: этил-3-[(4-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксоэтил-1,3-тиазол-2-ил)амино]-3-оксопропаноат и этил-4-[(4-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксоэтил-1,3-тиазол-2-ил)амино]-4-оксобутаноат. Пример 7. Получение 2-[(4-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксоэтил-1,3-тиазол-2 ил)амино]-2-оксоуксусной кислоты.- 15005375 Неочищенное вещество, полученное в примере 6 (0,5 г; 1,31 ммоль), растворяли в 1,4 диоксане/метаноле (10 мл/5 мл) и обрабатывали 1 н. NaOH (1,5 мл, 1,5 ммоль) в течение приблизительно 48 ч, 1 н. НСl (1,5 мл, 1,5 ммоль) добавляли при охлаждении на ледяной бане и полученный раствор фильтровали, промывали метанолом и сушили с получением соединения в виде бесцветного твердого вещества (0,25 г, 54%). Т.пл. 214-215 С. 1 Н-ЯМР (DMSO-d6) м.д.: 12,65 (с, уширенный, 1 Н, NH); 12,1 (с, уширенный, 1 Н, NH); 7,15 (с, 1 Н,Н 4-тиазол); 7,1 (с, 1 Н, Н 5-тиазол'); 4,8 (с, 2 Н, СН 2); 3,1 (м, 1 Н, СНМе 2); 1,21 (д, 6 Н, СНМе 2). Аналогично могут быть получены следующие соединения:(0,07 г, 3,15 ммоль). Реакционную смесь перемешивали при 45 С в течение приблизительно 20 мин, добавляли тетрагидрофуран (20 мл) и еще через 1 ч добавляли дополнительное количество метанола (0,03 мл) и LiBH4 (0,018 г). Перемешивание продолжали в течение 1 ч, суспензию гасили 1 н НСl, разбавляли водой и экстрагировали добавлением CH2Cl2. Органический слой промывали 1 н НСl, солевым раствором, сушили и упаривали. Остаток растирали с диизопропиловым эфиром и далее подвергали хроматографии на силикагеле, используя СНСl3:МеОН:30% NH4OH 97:3:0,3 в качестве элюента, с получением указанного в заголовке соединения в виде бесцветного твердого вещества (0,154 г, 28%). Т.пл. 173-175 С. 1 Н-ЯМР (СDСl3) м.д.: 6,95 (с, 1 Н, Н 4-тиазол); 6,7 (с, 1 Н, Н 5-тиазол'); 4,26 (с, 2 Н, СН 2OН); 3,8 (с, 2 Н,СН 2); 3,1 (м, 1 Н, СНМе 2); 1,21 (д, 6 Н, СНМе 2). Аналогично, исходя из соответствующих сложноэфирных производных, могут быть получены следующие соединения: 3-гидрокси-N-(4-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксоэтил-1,3-тиазол-2-ил)пропанамид; и 4-гидрокси-N-(4-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксоэтил-1,3-тиазол-2-ил)бутанамид. Пример 9. Получение 2-(диметиламино)-N-(4-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксоэтил-1,3-тиазол-2-ил)ацетамида. Смесь 2-хлор-N-(4-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксоэтил-1,3-тиазол-2-ил)ацетамида(0,5 г, 1,4 ммоль), 2 М диметиламина в метаноле (3,5 мл, 7 ммоль) и йодида калия (0,116 г, 0,7 ммоль) нагревали с обратным холодильником в течение приблизительно 6 ч. После охлаждения раствор разбавляли водой, подкисляли 1 н НСl и экстрагировали добавлением диэтилового эфира для удаления непрореагировавших продуктов. Водный раствор затем защелачивали 1 н NaOH и экстрагировали добавлением диэтилового эфира. Органический слой сушили над сульфатом натрия и упаривали. Остаток очищали по методу хроматографии на силикагеле, используя CH2Cl2:MeOH 97:3, а затем 95:5 в качестве элюента. Указанное в заголовке соединение получали с выходом 20% (0,1 г) в виде светло-желтого твердого вещества. Т.пл. 70-71 С. 1 Н-ЯМР (DМSО-d6) м.д.: 12,1 (с, уширенный, 1 Н, NH); 11,8 (с, уширенный, 1 Н, NH); 7,17 (с, 1 Н,Н 4-тиазол); 6,95 (с, 1 Н, Н 5-тиазол'); 3,75 (с, 2 Н, CH2NMe2); 3,17 (с, 2 Н, СН 2); 3,1 (м, 1 Н, СНМе 2); 2,12 (с,6 Н, NMe2); 1,22 (д, 6 Н, СНМе 2). Пример 10. Получение 2-(2-2-(диметиламино)-2-оксоэтиламино-1,3-тиазол-4-ил)-N-(5-изопропил 1,3-тиазол-2-ил)ацетамида. Смесь 2-(2-амино-1,3-тиазол-4-ил)-N-(5-изопропил-1,3-тиазол-2-ил)ацетамида (0,6 г, 2,12 ммоль), 2 хлор-N,N-диметилацетамида (0,27 мл, 1,96 ммоль) и сухого карбоната калия (0,54 г, 3,92 ммоль) в сухом ДМФ (5 мл) перемешивали при 60 С в течение приблизительно 4 ч. После охлаждения раствор разбавляли водой, экстрагировали добавлением СНСl3. Органический слой промывали солевым раствором, сушили и упаривали. Остаток очищали по методу хроматографии на силикагеле, используя СН 2 Сl2, а потомCH2Cl2:MeOH 95:5 в качестве элюента. Указанное в заголовке соединение получали с выходом 62% (0,5 г) в виде бесцветного твердого вещества. Т.пл. 211-213 С.- 16005375 1 Н-ЯМР (DMSO-d6) м.д.: 7,02 (с, 1 Н, Н 4-тиазол); 6,75 (с, 1 Н, Н 5-тиазол'); 5 (с, 2 Н, NHCH2); 3,43 (с,2 Н, NHCOCH2); 3,55 (с, 2 Н, СН 2); 3,1 (с, 3 Н, NMe); 2,98 (м, 1 Н, СНМе 2); 2,82 (с, 3 Н, NMe); 1,2 (д, 6 Н,СНМе 2). Аналогично, исходя из соответствующих алкилгалогенидов, могут быть получены следующие продукты: 2-2-[2-(амино-2-оксоэтил)амино]-1,3-тиазол-4-ил-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид. Т.пл. 172-174 С. 1 Н-ЯМР (DMSO-d6) м.д.: 7,6 (с, уширенный, 1 Н, NHCO); 7,2 (с, уширенный, 1 Н, NH); 7,09 (с, 1 Н,Н 4-тиазол); 6,72 (с, 1 Н, Н 5-тиазол'); 4,7 (с, 2 Н, NHCH2); 3,45 (с, 2 Н, NHCOCH2); 2,95 (м, 1 Н, СНМе 2); 1,2N-(5-Изопропил-1,3-тиазол-2-ил)-2-(2-[2-(4-метил-1-пиперазинил)этил]амино-1,3-тиазол-4-ил) ацетамид (1 г, 2,45 ммоль) и 40% формальдегид в воде (0,17 мл, 2,45 ммоль) смешивали в СНСl3 (10 мл) и затем обрабатывали триацетоксиборгидридом натрия (0,727 г, 3,43 ммоль). Смесь перемешивали при комнатной температуре в атмосфере азота в течение 5 ч. Реакционную смесь гасили добавлением водного насыщенного раствора бикарбоната натрия и продукт экстрагировали добавлением СНСl3. Органический слой промывали солевым раствором, сушили и упаривали. Указанное в заголовке соединение получали после хроматографической очистки с выходом 75%. Аналогично могут быть получены следующие продукты: 2-2-[(2,3-дигидроксипропил)(метил)амино]-1,3-тиазол-4-ил-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид;N-(5-изопропил-1,3-тиазол-2-ил)-2-(4-метил-[(1-пиперазинил)этил]аминофенил)ацетамид; 2-4-[(2,3-дигидроксипропил)(метил)амино]фенил-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид; 3-2-(2-[4-(диметиламино)фенил]ацетиламино)-1,3-тиазол-5-ил](метил)амино]пропилацетат; 2-2-(2-[4-(диметиламино)фенил]ацетиламино)-1,3-тиазол-5-ил](метил)амино]этилацетат; 2-2-(2-[2-(ацетиламино)-1,3-тиазол-4-ил]ацетиламино)-1,3-тиазол-5-ил](метил)амино]этилацетат и 3-2-(2-[2-(ацетиламино)-1,3-тиазол-4-ил]ацетиламино)-1,3-тиазол-5-ил](метил)амино]пропилацетат. Пример 12. Получение N-(4-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксоэтилфенил)-2-метоксиацетамида. К раствору 2-метоксиуксусной кислоты (41 мкл, 0,53 ммоль) в CH2Cl2 (1,5 мл), Nциклогексилкарбодиимида, N'-метилполистирола (0,53 г, загрузка 2 ммоль/г, 1,064 ммоль), предварительно промытому CH2Cl2 (5 мл 3), добавляли 4-ДМАП (0,032 г, 0,266 ммоль) и раствор 2-(4 аминофенил)-N-(5-изопропил-1,3-тиазол-2-ил)ацетамида (0,076 г, 0,266 ммоль) в СН 2 Сl2/ДМФ (0,4 мл/О,6 мл). Реакционную смесь выдерживали при перемешивании при комнатной температуре в течение приблизительно 72 ч, смолу отфильтровывали, промывали CH2Cl2 (10 мл 3), фильтраты промывали,промывали водой, 5% соляной кислотой, водой, насыщенным раствором бикарбоната натрия и водой,сушили и упаривали.- 17005375 Аналогично, исходя из соответствующих карбоновых кислот, могут быть получены следующие соединения:N-(4-2-[(5-изопропил-1,3-тиазол-2-ил)амино]-2-оксоэтилфенил)-2-[5-(1-пирролидинил)-2 Н-1,2,3,4 тетраазол-2-ил]ацетамид. Пример 13. Получение N-(5-изопропил-1,3-тиазол-2-ил)-2-[2-(2-оксо-1-пирролидинил)-1,3-тиазол-4 ил]ацетамида. Смесь 2,8 г (0,01 моль) 2-(2-амино-1,3-тиазол-4-ил)-N-(5-изопропил-1,3-тиазол-2-ил)ацетамида, 4,84 г (0,02 моль) этилйодбутирата и 2,76 г (0,02 моль) карбоната калия в 50 мл абсолютного этанола перемешивали с обратным холодильником в течение 5 ч. Смесь охлаждали и фильтровали и соли промывали двумя порциями по 20 мл этанола. Этанол удаляли при пониженном давлении и остаток растворяли в 100 мл СН 2 Сl2. Раствор промывали 30 мл воды, сушили и растворитель выпаривали. Остаток очищали по методу хроматографии на силикагеле, используя СН 2 Сl2:МеОН 95:5 в качестве элюента, с получением указанного в заголовке соединения с выходом 30% (1,05 г). Пример 14. Получение 1-(2,2-диэтоксиэтил)циклопропана. Диазометан (6,17 г, 147 ммоль) добавляли по каплям к 3,02 г (21 ммоль) 3-бутенальдиэтилацеталя в 10 мл сухого эфира при интенсивном перемешивании при 0 С. Затем разом добавляли 70 мг (0,312 ммоль) ацетата палладия(II) в 50 мл сухого эфира. Затем перемешивание при 0 С продолжали до тех пор,пока не прекращалось выделение N2 (10 мин). Эфир отгоняли для снижения объема реакционной смеси до 10 мл. Остаток отфильтровывали на стеклянной воронке, снабженной фриттой, и фильтрат упаривали. Неочищенный продукт (2,57 г) содержал 97% указанного в заголовке соединения (GC) и применялся без дальнейшей очистки. Пример 15. Получение 2-циклопропилацетальдегида. 1-(2,2-Диэтоксиэтил)циклопропан (2,57 г, 16 ммоль) суспендировали в водном растворе НСl (0,1 М,120 мл) и перемешивали при комнатной температуре в течение 30 ч, после чего ТСХ показала полное преобразование продукта с получением мутного раствора. Реакционную смесь экстрагировали добавлением эфира. Эфирный раствор промывали водой, сушили и растворитель упаривали. Остаток очищали по методу хроматографии на силикагеле, используя петролейный эфир:этилацетат 95:5 в качестве элюента, с получением указанного в заголовке соединения в виде масла (1,07 г, 80%). Пример 16. Получение 2-[2-(ацетиламино)-1,3-тиазол-4-ил]-N-(5-амино-1,3-тиазол-2-ил)ацетамида. Раствор 2-[2-(ацетиламино)-1,3-тиазол-4-ил]-N-(5-нитро-1,3-тиазол-2-ил)ацетамида (1 г, 3,23 ммоль) в этаноле (150 мл) гидрировали в присутствии 10% Pd/C (0,1 г, 10% (по массе при комнатной температуре в течение приблизительно 5 ч. Реакционную смесь фильтровали и упаривали. Остаток растирали с диизопропиловым эфиром с получением указанного в заголовке соединения с выходом 89% (0,8 г). Аналогично, исходя из соответствующего нитропроизводного, может быть получено следующее соединение: 2-[4-(диметиламино)фенил]-N-(5-амино-1,3-тиазол-2-ил)ацетамид. Пример 17. Получение 3-[2-(2-[2-(ацетиламино)-1,3-тиазол-4-ил]ацетиламино)-1,3-тиазол-5-ил] аминопропилацетата. Раствор 2-[2-(ацетиламино)-1,3-тиазол-4-ил]-N-(5-амино-1,3-тиазол-2-ил)ацетамида (0,5 г, 1,79 ммоль),3-бромпропилацетата (0,4 г, 2,15 ммоль), 2,6-лутидина (0,25 мл, 2,15 ммоль) в ДМФ (10 мл) нагревали при- 18005375 70 С в течение 72 ч. Реакционную смесь разбавляли водой, подкисляли 0,5 н НСl и экстрагировали добавлением CH2Cl2. Водный слой доводили до значения рН 7/8 0,5 н NaOH и экстрагировали добавлениемCH2Cl2. Органический слой промывали солевым раствором, сушили и упаривали. Остаток подвергали хроматографии на силикагеле, используя СН 2 Сl2:МеОН 95:5 в качестве элюента, с получением указанного в заголовке соединения с выходом 45%. Аналогично могут быть получены следующие соединения: 2-[2-(2-[2-(ацетиламино)-1,3-тиазол-4-ил]ацетиламино)-1,3-тиазол-5-ил]аминоэтилацетат; 2-[2-(2-[4-(диметиламино)фенил]ацетиламино)-1,3-тиазол-5-ил]аминоэтилацетат и 3-[2-(2-[4-(диметиламино)фенил]ацетиламино)-1,3-тиазол-5-ил]аминопропилацетат. Пример 18. Получение 2-[2-(ацетиламино)-1,3-тиазол-4-ил]-N-5-[(3-гидроксипропил)(метил) амино]-1,3-тиазол-2-илацетамида. 3-2-(2-[2-(Ацетиламино)-1,3-тиазол-4-ил]ацетиламино)-1,3-тиазол-5-ил](метил)амино]пропилацетат (0,5 г, 1,27 ммоль) растворяли в метаноле (50 мл) и обрабатывали 1 н NaOH (1,4 мл, 1,4 ммоль) при 0 С в течение приблизительно 24 ч. Растворитель упаривали и остаток растворяли в СН 2 Сl2/воде. Органический слой промывали водой, солевым раствором, сушили и упаривали. Остаток подвергали хроматографии на силикагеле, используя СН 2 Сl2:МеОН 95:5 в качестве элюента, с получением указанного в заголовке соединения с выходом 40%. Аналогично могут быть получены следующие соединения: 2-[2-(ацетиламино)-1,3-тиазол-4-ил]-N-5-[(3-гидроксипропил)амино]-1,3-тиазол-2-илацетамид; 2-[2-(ацетиламино)-1,3-тиазол-4-ил]-N-5-[(2-гидроксиэтил)(метил)амино]-1,3-тиазол-2-илацетамид; 2-[2-(ацетиламино)-1,3-тиазол-4-ил]-N-5-[(2-гидроксиэтил)амино]-1,3-тиазол-2-илацетамид и 2-[4-(диметиламино)фенил]-N-5-[(2-гидроксиэтил)амино]-1,3-тиазол-2-илацетамид; 2-[4-(диметиламино)фенил]-N-5-[(2-гидроксиэтил)(метил)амино]-1,3-тиазол-2-илацетамид; 2-[4-(диметиламино)фенил]-N-5-[(3-гидроксипропил)(метил)амино]-1,3-тиазол-2-илацетамид и 2-[4-(диметиламино)фенил]-N-5-[(3-гидроксипропил)амино]-1,3-тиазол-2-илацетамид. Очевидно, что в свете приведенного выше описания возможны многочисленные модификации и вариации настоящего изобретения. Таким образом, следует понимать, что данное изобретение может быть осуществлено несколько иначе, чем здесь конкретно описано, без выхода за рамки прилагаемой формулы изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Производное 2-амино-1,3-тиазола, представленное формулой (I) где L представляет собой фенил или 1,3-тиазолильную группу;R представляет собой C1-C6 алкил или моно- или дизамещенную аминогруппу, где заместитель выбран из C1-C6 алкила, необязательно замещенного гидрокси или C1-C6 алканоилокси;R2 и R3 независимо выбраны из Н; гидрокси; C1-C6 алкила, необязательно замещенного ди(C1C6 алкил)аминокарбонилом или C1-C6 алкилпиперазинилом; C1-C6 алканоила, необязательно замещенного галогеном, гидрокси, C1-C6 алкокси, C1-C6 алкоксикарбонилом, ди(C1-C6 ал-кил)амино; оксало или C1C6 алкоксалил; или R2 и R3 вместе с атомом азота, с которым они связаны, образуют 2-оксопирролидинильное кольцо; или его фармацевтически приемлемая соль. 2. Производное 2-амино-1,3-тиазола по п.1, гдеR представляет собой C1-C6 алкиламино или ди(C1-C6 алкил)амино, где C1-C6 алкильный радикал необязательно замещен гидроксигруппой; или неразветвленную или разветвленную C1-C4 алкильную группу; или его фармацевтически приемлемая соль. 3. Производное 2-амино-1,3-тиазола по п.1, выбранное из группы, включающей следующие соединения:N-(5-изопропил-1,3-тиазол-2-ил)-2-(2-метил[2-(4-метил-1-пиперазинил)этил]амино-1,3-тиазол-4 ил)ацетамид; 2-(2-[2-(диметиламино)-2-оксоэтил]амино-1,3-тиазол-4-ил)-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид; 2-[4-(диметиламино)фенил]-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид; 2-[4-(ацетиламино)фенил]-N-(5-изопропил-1,3-тиазол-2-ил)ацетамид и их фармацевтически приемлемые соли. 4. Способ получения производного 2-амино-1,3-тиазола, указанного в п.1, или его фармацевтически приемлемой соли, предусматривающий взаимодействие соединения, представленного формулой (III)Z представляет собой гидрокси или подходящую удаляемую группу,с получением производного 2-амино-1,3-тиазола, представленного формулой (I), где R, L, R2 и R3 определены в п.1. 5. Способ получения производного 2-амино-1,3-тиазола, указанного в п.1, или его фармацевтически приемлемой соли, предусматривающий взаимодействие соединения, представленного формулой (I)(V) где R, L и R4 определены в п.1, и Х представляет собой гидрокси или подходящую удаляемую группу,с получением производного 2-амино-1,3-тиазола, представленного формулой (II), где R, L и R4 определены в п.1. 6. Способ получения производного 2-амино-1,3-тиазола, указанного в п.1, или его фармацевтически приемлемой соли, предусматривающий взаимодействие производного 2-амино-1,3-тиазола, представленного формулой (I), где оба или, по крайней мере, один из R2 и R3 представляют собой атом водорода, с соединением, представленным формулой (VI)(VI) где R' имеет значения R2 или R3, но отличные от водорода, иY представляет собой подходящую удаляемую группу,с получением производного 2-амино-1,3-тиазола формулы (I), где оба или, по крайней мере, один изR2 и R3 является отличным от водорода; и, необязательно, преобразованием производного 2-амино-1,3 тиазола, представленного формулой (I), в другое производное 2-амино-1,3-тиазола, представленное формулой (I), и/или в его соль. 7. Фармацевтическая композиция, содержащая производное 2-амино-1,3-тиазола, указанного в п.1,и по крайней мере один фармацевтически приемлемый носитель и/или разбавитель.
МПК / Метки
МПК: A61K 31/426, C07D 277/46, A61P 35/00
Метки: арилметилкарбониламинотиазола, производные, противоопухолевых, применение, средств, качестве
Код ссылки
<a href="https://eas.patents.su/21-5375-proizvodnye-arilmetilkarbonilaminotiazola-i-ih-primenenie-v-kachestve-protivoopuholevyh-sredstv.html" rel="bookmark" title="База патентов Евразийского Союза">Производные арилметилкарбониламинотиазола и их применение в качестве противоопухолевых средств</a>
Предыдущий патент: Новые соединения бензо [b]пирано[3,2-h]акридин-7-она, способ их получения и содержащие их фармацевтические композиции
Следующий патент: Новые соединения бензолсульфонамида, способ их получения и фармацевтические композиции их содержащие
Случайный патент: Стабилизатор переменного напряжения (варианты)

























