Новые замещенные димерные соединения, способ их получения и содержащая их фармацевтическая композиция
Номер патента: 3300
Опубликовано: 24.04.2003
Авторы: Лезьер Даниель, Гийоме Жераль, Делягранж Филипп, Декамп-Франсуа Кароль, Беннежан Каролин, Лефулон Франсуа, Иус Саид, Вио Мари-Клод, Ренар Пьер
Формула / Реферат
1. Соединения формулы (I)
A-G1-Cy-G2-Cy-G3-B (I),
где A представляет собой группы формулы
-NHC(Q)R1 или -NHC(Q)NHR2,
где Q обозначает атом кислорода или серы,
R1 обозначает линейную или разветвленную (C1-C6)алкильную группу, замещенную или незамещенную атомом галогена, линейную или разветвленную (C2-C6)алкенильную группу, (C3-C8)циклоалькильную группу, арильную или гетероарильную группу,
R2 обозначает линейную или разветвленную (C1-C6)алкильную группу,
B представляет собой группы формулы
-NHC(Q)R1, -NHC(Q)NHR2, -NHC(Q)OR2, -C(Q)OR3 или -NHR3,
где R1 и R2 имеют приведенные выше значения и R3 обозначает атом водорода, линейную или разветвленную (C1-C6)алкильную группу,
G1 и G3, которые могут быть одинаковыми или разными, означают линейный или разветвленный алкилен с цепью, содержащей 1-4 атома углерода,
Су означает циклическую структуру формулы (II)
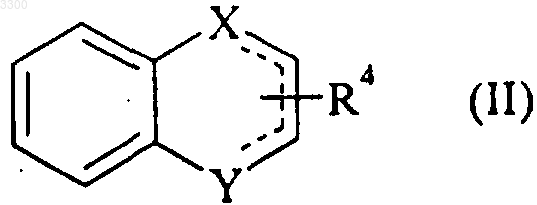
где X и Y, которые могут быть одинаковыми или различными, представляют собой атом углерода, CH или CH2-группу,
R4 означает атом водорода или галогена, или CF3, гидрокси, карбокси, формил, амино, NHRa, NRaRa1, NHCORa, CONHRa, Ra, ORa, CORa или COORa группу (где Ra имеет такие же значения как и R1, который определен выше, и также может означать атом водорода и Ra1 могут иметь любое значение Ra),
символ - - - означает, что связи являются ординарными или двойными, при условии соблюдения валентности атомов,
где G2 является заместителем бензольного кольца и G1 (и G3 соответственно) является заместителем кольца, содержащего X и Y,
циклическую структуру формулы (III)
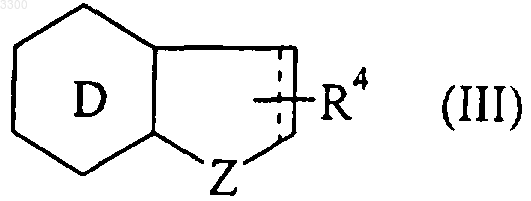
где Z представляет собой атом серы или кислорода, или NH, NSO2Ph или NRa группу (Ra определен выше),
D является бензольным или пиридиновым кольцом,
следует учесть, что когда D является пиридиновым кольцом, тогда Z означает NH, NSO2Ph или NRa группу,
R4 определен выше,
когда G2 является заместителем кольца D и G1 (и G3 соответственно) является заместителем кольца, содержащего Z,
символ - - - означает, что связь является одинарной или двойной, при условии, что валентность атомов соблюдена,
следует учесть, что два кольца (Cy) соединения формулы (I) представляют собой одну и ту же циклическую структуру (индол/индол, нафталин/нафталин, бензофуран/бензофуран и т.д.), но заместитель R4 может быть различным,
G2 представляет собой цепь формулы (IV)
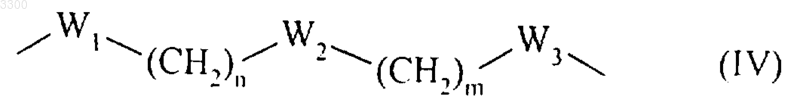
где W1 и W3, которые могут быть одинаковыми или различными, представляют собой связь, атом кислорода или серы, или -NH группу,
W2 означает связь или атом кислорода,
n является целым числом, где 0_ n_ 6,,
m является целым числом, где 0_ m_ 6,
при условии, что не может быть двух последовательных гетероатомов и что определенная таким образом цепь формулы (IV) может содержать одну или более насыщенных связей, где соединение формулы (I) не может представлять собой
диэтил 2-(ацетиламино)-2-{[5-({3-[(2-ацетиламино)-3-этокси-2-(этоксикарбонил)-3-оксопропил]-1H-индол-5-ил}метил)-1H-индол-3-ил]метил}малонат или
N-{2-[5-({3-[2-(ацетиламино)этил] -1H-индол-5-ил}метил)-1H-индол-3-ил]этил}ацетамид,
под "арилом" имеются в виду нафтильная, фенильная и бифенильная группы,
под "гетероарилом" имеются в виду любая насыщенная или ненасыщенная моно- или бициклическая группа, содержащая от 5 до 10 атомов и содержащая от 1 до 3 гетероатомов, выбранных из азота, серы или кислорода,
возможно, чтобы "арильная" и "гетероарильная" группы были замещены одним или несколькими одинаковыми или различными радикалами, выбранными из гидрокси, карбокси, линейного или разветвленного (C1-C6)алкокси, линейного или разветвленного (C1-C6)алкила, полигалоген(C1-C6)алкила, в котором алкильная часть является линейной или разветвленной, формила, циано, нитро, амино, линейного или разветвленного (C1-C6)алкиламино, ди-(C1-C6)алкиламино, в котором каждая алкильная часть является линейной или разветвленной, или из атомов галогена,
их энантиомеры и диастереомеры и их соли присоединения фармацевтически приемлемой кислоты и основания.
2. Соединения формулы (I) по п.1, где Cy представляет собой циклическую структуру формулы (II), их энантиомеры и диастереомеры и их соли присоединения фармацевтически приемлемой кислоты или основания.
3. Соединения формулы (I) по п.1, где Cy представляет собой нафталин, их энантиомеры и диастереомеры и их соли присоединения фармацевтически приемлемой кислоты или основания.
4. Соединения формулы (I) по п.1, где Cy представляет собой циклическую структуру формулы (III), их энантиомеры и диастереомеры и их соли присоединения фармацевтически приемлемой кислоты или основания.
5. Соединения формулы (I) по п.1, где Cy представляет собой бензотиофен или бензофуран, их энантиомеры и диастереомеры и их соли присоединения фармацевтически приемлемой кислоты или основания.
6. Соединения формулы (I) по п.1, где Cy представляет собой индол, их энантиомеры и диастереомеры и их соли присоединения фармацевтически приемлемой кислоты или основания.
7. Соединения формулы (I) по п.1, где Cy представляет собой азаиндол, их энантиомеры и диастереомеры и их соли присоединения фармацевтически приемлемой кислоты или основания.
8. Соединения формулы (I) по п.1, где G2 представляет собой одинарную связь, их энантиомеры и диастереомеры и их соли присоединения фармацевтически приемлемой кислоты или основания.
9. Соединения формулы (I) по п.1, где G2 представляет собой группу -W4-(CH2)p-W'4-, где W4 и W'4, которые могут быть одинаковыми или различными, представляют собой атом кислорода или серы, или NH, а p является целым числом, где 1_ p_ 12, их энантиомеры и диастереомеры и их соли присоединения фармацевтически приемлемой кислоты или основания.
10. Соединения формулы (I) по п.1, где G2 представляет собой группу -O-(CH2)p-O-, где p является целым числом, где 1_ p_ 12, их энантиомеры и диастереомеры и их соли присоединения фармацевтически приемлемой кислоты или основания.
11. Соединения формулы (I) по п.1, где G2 представляет собой группу -W4-(CH2)p,-W'4-(CH2)p"-W"4-, где W4, W'4 и W"4, которые могут быть одинаковыми или различными, представляют собой атом кислорода или серы, или NH, а p' и p" являются целыми числами, где 2_ p' + p"_ 12, их энантиомеры и диастереомеры и их соли присоединения фармацевтически приемлемой кислоты или основания.
12. Соединения формулы (I) по п.1, где G2 представляет собой группу -O-(CH2)p-O-(CH2)p"-O-, где p' и p" определены выше, их энантиомеры и диастереомеры и их соли присоединения фармацевтически приемлемой кислоты или основания.
13. Соединения формулы (I) по п.1, в которых A и B, которые могут быть одинаковыми или различными, представляют собой группу NR1C(Q)R2 и C(Q)NR2R3, их энантиомеры и диастереомеры и их соли присоединения фармацевтически приемлемой кислоты или основания.
14. Соединения формулы (I) по п.1, представляющие собой
N-(2-{7-[2-({8-[2-(ацетиламино)этил]-2-нафтил} окси)этокси]-1-нафтил}этил)ацетамид,
N-(2-{7-[3-({8-[2-(ацетиламино)этил]-2-нафтил}окси)пропокси]-1-нафтил}этил)ацетамид,
N-(2-[7-[4-({8-[2-(ацетиламино)этил]-2-нафтил}окси)бутокси]-1-нафтил] этил)ацетамид,
N-[2-(7-{(6-({8-[2-(ацетиламино)этил]-2-нафтил}окси)гексил)окси}-1-нафтил)этил] ацетамид,
N-[2-(7-{[5-({8-[2-(ацетиламино)этил]-2-нафтил}окси)пентил]окси}-1-нафтил}этил)ацетамид,
N-[2-(7-{[8-({ 8-[2-(ацетиламино)этил]-2-нафтил} окси)октил]окси}-1-нафтил)этил] ацетамид,
N-[2-(7-{[10-({ 8-[2-(ацетиламино)этил]-2-нафтил} окси)децил]окси}-1-нафтил)этил] ацетамид и
N-(2-{7-[4-({8-[2-(ацетиламино)этил]-7-метокси-2-нафтил}окси)бутокси]-2-метокси-1-нафтил} этил)ацетамид,
и их соли присоединения фармацевтически приемлемой кислоты или основания.
15. Соединение формулы (I) по п.1, представляющее собой N-[2-(7-{2-[2-({8-[2-(ацетиламино)этил]-2-нафтил}окси)этокси]этокси} -1-нафтил)этил]ацетамид и его соли присоединения фармацевтически приемлемой кислоты или основания.
16. Соединения формулы (I) по п.1, представляющие собой
N-(2-{7-[4-({8-[2-(2-фуроиламино)этил]-2-нафтил}окси)бутокси]-1-нафтил}этил)-2-фурамид,
2-бром-N-[2-(7-[4-[(8-{2-[(бромацетил)амино] этил} -2-нафтил)окси]бутокси] -1-нафтил)этил]ацетамид,
N-[2-(7-{4-[(8-[ 2-[(циклопропилкарбонил)амино]этил] -2-нафтил)окси] бутокси}-1-нафтил)этил]циклопропанкарбоксамид, и
N-(2-{7-[4-([8-[2-(3-бутеноиламино)этил]-2-нафтил] окси)бутокси]-1-нафтил}этил)-3-бутенамид
и их соли присоединения фармацевтически приемлемой кислоты или основания.
17. Соединение формулы (I) по п.1, представляющее собой N-(2-{7-[4-([8-[2-(ацетиламино)этил]-5,6,7,8-тетрагидро-2-нафталенил] окси)бутокси]-1,2,3,4-тетрагидро-1-нафталенил} этил)ацетамид, его энантиомеры и диастереоизомеры и его соли присоединения фармацевтически приемлемой кислоты или основания.
18. Соединения формулы (I) по п.1, представляющее собой N-{ 2-[5-(4-[3-[2-(ацетиламино)этил]-1-(фенилсульфонил)-1H-индол-5-ил]оксибутокси)-1-(фенилсульфонил)-1H-индол-3-ил]оксиэтил}ацетамид и N-(2-{5-[4-([3-[2-(ацетиламино)этил]-1H-индол-5-ил}окси)бутокси]-1H-индол-3-ил}этил)ацетамид, и их соли присоединения фармацевтически приемлемой кислоты или основания.
19. Соединения формулы (I) по п.1, представляющие собой N-(2-{5-[4-([3-[2-(ацетиламино)этил]-1-бензофуран-5-ил]окси)бутокси]-1-бензофуран-3-ил}этил)ацетамид и N-(2-{5-[4-([3-[2-(ацетиламино)этил]-1-бензотиен-5-ил] окси)бутокси]-1-бензотиен-3-ил}этил)ацетамид, и их соли присоединения фармацевтически приемлемой кислоты или основания.
20. Соединения формулы (I) по п.1, представляющие собой N-(2-{5-[4-([3-[2-(ацетиламино)этил]-1-метил-1H-пирроло[3,2-b]пиридин-5-ил}окси)бутокси]-1-метил-1H-пирроло[3,2-b]пиридин-3-ил}этил)ацетамид и N-(2-[5-[4-({3-[2-(ацетиламино)этил]-1-метил-1H-пир-роло[3,2-b]пиридин-5-ил}окси)пропокси]-1-метил-1H-пирроло[3,2-b]пиридин-3-ил]этил)ацетамид и их соли присоединения фармацевтически приемлемой кислоты или основания.
21. Соединение формулы (I) по п.1, представляющее собой N-[2-{8-[2-(ацетиламино)этил]-2-нафтил} этил]ацетамид и его соли присоединения фармацевтически приемлемой кислоты или основания.
22. Соединение формулы (I) по п.1, представляющее собой N-{2-[5-{3-[2-(ацетиламино)этил]-1H-индол-3-ил} -1H-индол-3-ил]этил}ацетамид и его соли присоединения фармацевтически приемлемой кислоты или основания.
23. Способ получения соединений формулы (I) по п.1, отличающийся тем, что в качестве исходного вещества используют соединение формулы (V)
A-G1-Cy-OMe (V),
где A, G1 и Cy определены для формулы (I),
которое подвергают деметилированию с использованием обычных агентов, таких как HBr, AlCl3, AlBr3, BBr3 или двойные системы кислота Льюиса/нуклеофил, например, такие как AlCl3/PhCH2SH или BBr3/Me2S, с получением соединения формулы (VI)
A-G1-Cy-OH (VI),
где A, G1 и Cy определены выше,
которое преобразуют обычным образом, например, путем воздействия N,N-диметилтиокарбамата натрия до соответствующего тиола формулы (VII)
A-G1-Cy-SH (VII),
где A, G1 и Cy определены выше,
или до соответствующего производного амина формулы (VIII)
A-G1-Cy-NHR1a (VIII)
где A, G1 и Cy определены выше, и R'a может иметь любое из значений Ra, определенных для формулы (I), и может также являться атомом водорода,
причем соединения формул (VI), (VII) и (VIII) представляют соединение формулы (IX)
A-G1-Cy-W4H (IX),
где W4 является атомом кислорода или серы или NH или NRa группой (где Ra определено выше),
соединение формулы (IX), которое конденсируют с
соединением формулы (X)

где Hal представляет собой атом брома, хлора или йода, и n, W2 и m определены для формулы (I), при условии, что не может быть двух последовательных гетероатомов и что определенная таким образом цепь может иметь одну или несколько ненасыщенных связей,
или соединение формулы (XI)
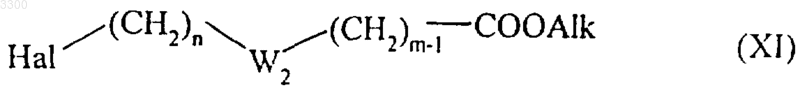
где Hal, W2, n и m определены выше, a Alk представляет собой алкильный радикал (с условием, что не может быть двух последовательных гетероатомов и что определенная таким образом цепь может иметь одну или несколько ненасыщенных связей), с последующим восстановлением,
с получением соединения формулы (XII)
A-G1-Cy-W4-(CH2)n-W2-(CH2)m-OH (XII),
где A, G1, Cy, W2, W4, n и m определены для формулы (I), при условии, что в цепи W4-(CH2)n-W2-(CH2)m-OH не может быть двух последовательных гетероатомов и что определенная таким образом цепь может иметь одну или несколько ненасыщенных связей,
гидроксильную группу которого преобразуют обычным образом в удаляемую группу, например, такую как мезилат, тозилат или галогеновое производное, с образованием соединения формулы (XII')
A-G1-Cy-W4-(CH2)n-W2-(CH2)m-E (XII'),
где A, G1, Cy, W2, W4, n и m определены выше и E является мезильной или тозильной группой или атомом галогена,
которое подвергают воздействию соединения формулы (XIII)
B-G3-Cy-W4'H (XIII),
где B, G3 и Cy такие, как определены для формулы (I), a W4' может иметь те же значения, что и W4, определенное выше,
с получением соединения формулы (I/a), частного случая соединений формулы (I)
A-G1-Cy-W4-(CH2)n-W2-(CH2)m-W4'-Cy-G3-B (I/a),
где A, G1, Cy, W4, n, W2, m, W4', G3 и B определены выше,
(причем соединения формулы (I/a), где группы A-G1-Cy-W4- и W4'-Cy-G3-B одинаковы, можно получить непосредственно из соединения формулы (IX), которое конденсируют в основной среде с соединением формулы (X')
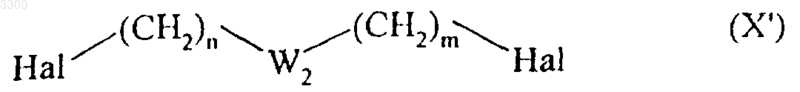
где Hal, n, m и W2 определены выше),
или преобразуют с использованием, например, фенил бис(трифторметансульфонимида) в основной среде до соответствующего трифторметансульфоната формулы (XIV)
A-G1-Cy-OSO2CF3 (XIV),
где A, G1 и Cy определены выше,
которое подвергают в условиях катализа подходящим соединением палладия воздействию производного борной кислоты (RbB(OH)2) или производного олова (RbSnBu3) (где Rb является группой формулы (XV)
B-G3-Cy-W3-(CH2)m-W2-(CH2)n-CH2 (XV),
где B, G3, Cy, W3, m, W2 и n определены выше, при условии, что в цепи -W3-(CH2)m-W2- не может быть двух последовательных гетероатомов и определенная таким образом цепь может иметь одну или несколько ненасыщенных связей),
с получением соединения формулы (I/b), частного случая соединений формулы (I)
A-G1-Cy-CH2-(CH2)n-W2-(CH2)m-W3-Cy-G3-B (I/b),
где A, G1, Cy, n, W2, m, W3, G3 и B определены выше (при условии, что в цепи -W2-(CH2)m-W3- не может быть двух последовательных гетероатомов и определенная таким образом цепь может иметь одну или несколько ненасыщенных связей),
причем соединения формулы (I/c), частный случай соединений формулы (I)
A-G1-Cy-W1-(CH2)n-W2-(CH2)m-W3-Cy-G3-B (I/c),
где A, G1, Cy, W1, n, W2, m, G3 и B определены выше, при условии, что в цепи -W1-(CH2)n-W2- не может быть двух последовательных гетероатомов и определенная таким образом цепь может иметь одну или несколько ненасыщенных связей),
получены по аналогичной методике, исходя из соединений формулы (XIV')
B-G3-Cy-OSO2CF3 (XIV'),
где B, G3 и Cy определены выше,
или обрабатывают в условиях сочетания с использованием, например, соединений никеля или палладия соединением формулы (XIV') с получением при этом соединения формулы (I/d), частного случая соединений формулы (I)
A-G1-Cy-Cy-G3-B (I/d),
где A, G1, Cy, G3 и B определены выше,
все соединения от (I/a) до (I/d), составляющие соединения формулы (I), которые при желании можно очистить обычными методами очистки, разделяют, где это необходимо, на изомеры с помощью обычного способа разделения и переводят, при необходимости, в соли их присоединения фармацевтически приемлемой кислоты или основания.
24. Соединения формулы (XII") по п.23
A-G1-Cy-W4-(CH2)n-W2-(CH2)m-E' (XII"),
где A, G1, Cy, W2, W4, n и m определены выше и E' является гидроксильной или атомом галогена (фтор, хлор, бром, или йод), при условии, что
когда Cy представляет собой нафталин, и когда одновременно G1-A представляет собой группу -(CH2)2-NR1C(Q)R2- или -(CH2)2-NR1C(Q)NR2-R3- (где R1, R2 и R3 определены выше), цепь -W4-(CH2)n-W2-(CH2)m- не может представлять собой O-алкильную цепь,
соединение формулы (XII") не может представлять собой N-{2-[5-(2-гидроксиэтокси)-1H-индол-3-ил]этил}ацетамид,
их энантиомерам и диастереомерам и к их солям присоединения к фармацевтически приемлемым кислоте или основанию,
в качестве промежуточных соединений синтеза, а также в качестве соединений для использования при лечении заболеваний, связанных с мелатонинергической системой.
25. Фармацевтическая композиция, содержащая в качестве активного ингредиента, по меньшей мере, одно соединение формулы (I) по любому из пп.1-22 или 24 или его фармацевтически приемлемую соль прибавления кислоты или основания в сочетании с одним или несколькими фармацевтически приемлемыми эксципиентами.
26. Фармацевтическая композиция по п.25 для использования при получении лекарственного средства для лечения заболеваний, связанных с мелатонинергической системой.
Текст
1 Настоящее изобретение относится к новым замещенным димерным соединениям, к способу их получения и к содержащим их фармацевтическим композициям. Из предшествующей области известны димерные нафталиновые структуры [J. Chem.Soc., Dalton Trans., 1979, (10), pp. 1497-502], которые исследовали на предмет их координационных свойств в комплексах с металлами. Кроме того, были описаны индольные димеры с их"курареподобной" активностью (Хим.-фарм. журн., 1984, 18(1), стр. 29-31). Благодаря их новой структуре соединения по настоящему изобретению являются новыми и обладают фармакологическими свойствами,которые очень ценны в отношении мелатониновых рецепторов. Многочисленные исследования последних десяти лет показали ключевую роль мелатонина(N-ацетил-5-метокситриптамина) во многих патофизиологических явлениях и в регулировании циркадного ритма. Однако период его полураспада довольно недолог вследствие того факта, что он быстро преобразуется в ходе обмена веществ. Поэтому большой интерес заключается в возможности обеспечения аналогами мелатонина, которые метаболически более стабильны, имеют характер агониста или антагониста и которые, возможно, будут обладать терапевтическим эффектом, превосходящим эффект самого гормона. В дополнение к их целебному воздействию при нарушениях циркадного ритма (J.Neurosurg., 1985, 63, pp. 321-341) и нарушений сна (Psychopharmacology, 1990, 100, pp. 222226), лиганды мелатонинергической системы обладают ценными фармакологическими свойствами по отношению к центральной нервной системе, в особенности успокаивающими и антипсихотическими свойствами (Neuropharmacology of Pineal Secretions, 190, 8 (3-4), pp. 264272) и болеутоляющими свойствами (Pharmacopsychiat., 1987, 20, pp. 222-223), а также для лечения болезни Паркинсона (J. Neurosurg.,1985, 63, рр. 321-341) и болезни Альцгеймера(Brain Research, 1990, 528, рр. 170-174). Эти соединения также проявили активность по отношению к некоторым видам рака (Melatonin Clinical Perspectives, Oxford University Press,1988, pp. 164-165), овуляции (Science, 1987, 227,pp. 714-720), диабету (Clinical Endocrinology,1986, 24, pp. 359-364) и при лечении ожирения(International Journal of Eating Disorders, 1996,20(4), pp. 443-446). Эти разнообразные эффекты проявляются через посредничество определенных рецепторов мелатонина. Молекулярно-биологические исследования показали существование ряда подтипов рецепторов, способных к связыванию этого гормона (Trends Pharmacol. Sci., 1995, 16,р. 50; WO 97/04094). Для различных видов,включая млекопитающих, оказалось возможным 2 локализовать и охарактеризовать некоторые из этих рецепторов. Для того чтобы иметь возможность лучше понять физиологические функции этих рецепторов, большим преимуществом является доступность определенных лигандов. Более того, такие соединения, селективно взаимодействуя с тем или иным из этих рецепторов,могут являться прекрасными лекарствами для использования лечащими врачами при лечении патологий, связанных с мелатонинергической системой, некоторые из которых упоминались выше. В дополнение к тому факту, что соединения по настоящему изобретению являются новыми, они проявляют очень сильное сродство к рецепторам мелатонина и/или селективность в отношении одного или другого подтипа рецепторов мелатонина. Более конкретно настоящее изобретение относится к соединениям формулы (I)A-G1-Cy-G2-Cy-G3-B А представляет собой группу формулы где Q представляет собой атом серы или кислорода,R1, R2 и R3, которые могут быть одинаковыми или различными, представляют собой атом водорода, или группу Ra, где Ra является незамещенной или замещенной линейной или разветвленной (С 1-С 6)алкильной группой, незамещенной или замещенной линейной или разветвленной (С 2-С 6)алкенильной группой, незамещенной или замещенной линейной или разветвленной (С 2-С 6)алкинильной группой, незамещенной или замещенной (С 3-С 8)циклоалкильной группой, незамещенной или замещенной циклоалкил(С 3-С 8)алкильной(С 1-С 6) группой, в которой алкильная часть является линейной или разветвленной,полигалоген(С 1-С 6)алкильной группой, в которой алкильная часть является линейной или разветвленной, арильной группой, арил(С 1-С 6)алкильной группой, в которой алкильная часть является линейной или разветвленной, арил(С 2-С 6)алкенильной группой, в которой алкенильная часть является линейной или разветвленной, гетероарильной группой,гетероарил(С 1-С 6)алкильной группой, в которой алкильная часть является линейной или разветвленной, или гетероарил(С 2-С 6)алкенильной группой, в которой алкенильная часть является линейной или разветвленной,или групп вида R2 и R3 вместе с несущими их атомом азота образуют группу, выбранную из пиперазинила, пиперидинила и пирролидинила,В представляет собой группу формулы где Q, R1, R2 и R3 определены выше, 3G1 и G3, которые могут быть одинаковыми или различными, представляют собой линейную или разветвленную алкиленовую цепь, содержащую от 1 до 4 атомов углерода, которая необязательно замещена одной или несколькими одинаковыми или различными группами, выбранными из гидрокси, карбокси, формила, Ra,ORa, COORa и CORa (где Ra определен выше),Су представляет собой циклическую структуру формулы (II)X и Y, которые могут быть одинаковыми или различными, представляют собой атом серы, кислорода или углерода, или СН, или СН 2 группу,R4 представляет собой атом водорода или галогена, или CF3, гидрокси, карбокси, формила,амино, NHRa, NRaRa1, NHCORa, CONHRa, Ra,ORa, CORa или COORa группу (где Ra определен выше, и Ra1 может иметь любое из значений Ra). Символозначает, что связи являются одинарными или двойными, при условии соблюдения валентности атомов,где G2 является заместителем бензольного кольца и G1 (и G3 соответственно) является заместителем кольца, содержащего X и Y,или циклическую структуру формулы (III) где Z представляет собой атом серы или кислорода, или СН, СН 2, NH, NSO2Ph, или NRa-группу (где Ra определена выше),D является бензольным или пиридиновым кольцом,R4 определен выше,символозначает, что связь является одинарной или двойной, при условии, что валентность атомов соблюдена,где G2 является заместителем кольца D иG1 (и G3 соответственно) является заместителем кольца, содержащего Z,следует учесть, что два кольца (Су) соединений формулы (I) представляют собой одну и ту же основную циклическую структуру(индол/индол, нафталин/нафталин, бензофуран/ бензофуран и так далее), но заместитель R4 может быть различным,G2 представляет собой цепь формулы (IV) где W1, W2 и W3, которые могут быть одинаковыми или различными, представляют собой связь, атом кислорода или серы, или СН 2, CHRa,NH или NRa-группу (где Ra определено выше),n является целым числом, где 0n6,m является целым числом, где 0n6, 003300 4 при условии, что не может быть двух последовательных гетероатомов и что определенная таким образом цепь формулы (IV) может содержать одну или более ненасыщенных связей,где соединение формулы (I) не может представлять собой диэтил 2-(ацетиламино)-2-[5-([3-[(2-ацетиламино)-3-этокси-2-(этоксикарбонил)-3-оксопропил]-1 Н-индол-5-ил]метил)-1H-индол-3-ил] метилмалонат, илиN-2-[5-(3-[2-(ацетиламино)этил]-1 Ниндол-5-илметил)-1 Н-индол-3-ил]этилацетамид,под "арилом" имеются в виду нафтильная,фенильная и бифенильная группы,под "гетероарилом" имеются в виду любая насыщенная или ненасыщенная моно- или бициклическая группа, содержащая от 5 до 10 атомов и содержащая от 1 до 3 гетероатомов,выбранных из азота, серы или кислорода,возможно, чтобы "арильная" и "гетероарильная" группы были замещены одним или несколькими одинаковыми или различными радикалами, выбранными из гидрокси, карбокси, линейного или разветвленного (С 1-С 6)алкокси, линейного или разветвленного (С 1-С 6) алкила, полигалоген(С 1-С 6)алкила, в котором алкильная часть является линейной или разветвленной, формила, циано, нитро, амино, линейного или разветвленного (С 1-С 6)алкиламино,ди-(С 1-С 6)алкиламино, в котором каждая алкильная часть является линейной или разветвленной, или из атомов галогена,термин "замещенный" в применении к терминам "алкил", "алкенил" и "алкинил" означает, что эти группы замещены одним или несколькими одинаковыми или различными радикалами, выбранными из гидрокси, линейного или разветвленного (С 1-С 6)алкокси, полигалоген(С 1-С 6)алкильной группы, в которой алкильная часть является линейной или разветвленной,амино, линейного или разветвленного (С 1 С 6)алкиламино, ди-(С 1-С 6)алкиламино, в котором каждая алкильная часть является линейной или разветвленной, или из атомов галогена,термин "замещенный" в применении к терминам "циклоалкил" и "циклоалкилалкил" означает, что циклические части этих групп замещены одним или несколькими одинаковыми или различными радикалами, выбранными из гидрокси, линейного или разветвленного (С 1 С 6)алкокси, полигалоген(С 1-С 6)алкильной группы, в которой алкильная часть является линейной или разветвленной, амино, линейной или разветвленной (С 1-С 6)алкиламино, ди-(С 1-С 6) алкиламино, в котором каждая алкильная часть является линейной или разветвленной, или из атомов галогена,их энантиомеры и диастереомеры и их соли присоединения фармацевтически приемлемой кислоты или основания. 5 Из фармацевтически приемлемых кислот можно указать в качестве не ограничивающего примера хлористо-водородную кислоту, бромисто-водородную кислоту, серную кислоту, фосфоновую кислоту, уксусную кислоту, трифторуксусную кислоту, молочную кислоту, пировиноградную кислоту, малоновую кислоту, янтарную кислоту, глутаровую кислоту, фумаровую кислоту, винную кислоту, малеиновую кислоту, лимонную кислоту, аскорбиновую кислоту, метансульфокислоту, камфарную кислоту и так далее. Из фармацевтически приемлемых оснований можно указать в качестве не ограничивающего примера гидроксид натрия, гидроксид калия, триэтиламин, трет-бутиламин и так далее. Предпочтительными соединениями по изобретению являются соединения формулы (I),в которой Су представляет собой циклическую структуру формулы (II), например, такую как нафталиновая или тетрагидронафталиновая, или формулы (III), например, такую как индол, азаиндол, бензотиофен или бензофуран. Предпочтительно данное изобретение относится к соединениям формулы (I), в которойG2 является одинарной связью,или группой -W4-(CH2)p-W'4- (где W4 и W'4,которые могут быть одинаковыми или различными, представляют собой атом кислорода или серы, или NH или NRa группу, и р является целым числом, где 1 р 12), например, такую как группа -О-(СН 2)р-О- (где р определено выше),или группой формулы -W4-(CH2)p'-W'4(CH2)p"-W"4- (где W4, W'4 и W"4, которые могут быть одинаковыми или различными, представляют собой атом кислорода или серы, или NH или NRa группу, и р' и р" являются двумя целыми числами, где 2 р' + р"12), например, такой как группа -О-(СН 2)р-O-(СН 2)р-О- (где р' и р" определены выше). Предпочтительными заместителями А и В по изобретению являются группы NR1C(Q)R2,NR1C(Q)NR2R3 и C(Q)NR2R3, и более конкретно,группы NR1OR2 и CONR2R3. Еще более конкретно данное изобретение относится к соединениям формулы (I), которые представляют собойN-2-[5-[3-[2-(ацетиламино)этил]-1Hиндол-3-ил]-1 Н-индол-3-ил]этилацетамид. Энантиомеры, диастереомеры и соли присоединения фармацевтически приемлемых кислот и оснований предпочтительных соединений по изобретению составляют неотъемлемую часть данного изобретения. Настоящее изобретение относится также к способу получения соединений формулы (I),заключающемуся в том, что в качестве исходного вещества используют соединение формулыA-G1-Cy-OMe которое подвергают деметилированию с использованием обычных агентов, таких как НВr,АlСl3, АlВr3, ВВr3 или двойные системы кислота Льюиса/нуклеофил, например, такие какAlCl3/PhCH2SH или BBr3/Me2S, с получением соединения формулы (VI)A-G1-Cy-OH где A, G1 и Су определены выше,которое преобразуют обычным образом,например, путем воздействия N,Nдиметилтиокарбамата натрия до соответствующего тиола формулы (VII)A-G1-Cy-SH где A, G1 и Су определены выше,или до соответствующего производного амина формулы (VIII)A-G1-Cy-NHR'a где A, G1 и Су определены выше, и R'a может иметь любое из значений Ra, определенных для формулы (I), и может также являться атомом водорода,с соединениями формул (VI), (VII) и (VIII),которые представляют соединение формулы (IX)A-G1-Cy-W4H где W4 является атомом кислорода или серы,или NH или NRa группой (где Ra определено выше),с соединением формулы (IX) конденсируют с соединение формулы (X) где Hal представляет собой атом брома, хлора или йода, и n, W2 и m определены для формулы(I), при условии, что не может быть двух последовательных гетероатомов, и что определенная таким образом цепь может иметь одну или несколько ненасыщенных связей,или соединение формулы (XI) где Hal, W2, n и m определены выше, a Alk представляет собой алкильный радикал (с условием, что не может быть двух последовательных гетероатомов, и что определенная таким образом цепь может иметь одну или несколько ненасыщенных связей), с последующим восстановлением, 003300 8 с получением соединения формулы (XII)A-G1-Cy-W4-(CH2)n-W2-(CH2)m-OH где A, G1, Су, W2, W4, n и m определены в формуле (I) при условии, что в цепи W4-(CH2)n-W2(CH2)m-OH не может быть двух последовательных гетероатомов, и что определенная таким образом цепь может иметь одну или несколько ненасыщенных связей,гидроксильную группу которого преобразуют обычным образом в удаляемую группу,например, такую как мезилат, тозилат, или галогеновое производное, с образованием соединения формулы (ХII')A-G1-Cy-W4-(CH2)n-W2-(CH2)m-E где A, G1, Су, W2, W4, n и m определены выше, и Е является мезильной или тозильной группой,или атомом галогена, которое подвергают воздействию соединения формулы (XIII)B-G3-Cy-W4'H где В, G3 и Су, такие как определены для формулы (I), a W4' может иметь те же значения, что и W4, определенное выше,с получением соединения формулы (I/a),частного случая соединений формулы (I)(I/a), где группы A-G1-Cy-W4- и W4'-Cy-G3-B одинаковы, можно получить непосредственно из соединения формулы (IX), которое конденсируют в основной среде м соединением формулы где Hal, n, m и W2 определены выше),или преобразуют с использованием, например,фенил бис(трифторметансульфонимида) в основной среде до соответствующего трифторметансульфоната формулы (XIV)A-G1-Cy-OSO2CF3 где A, G1 и Су определены выше,которое подвергают в условиях катализа подходящим соединением палладия воздействию производного борной кислоты (РbВ(ОН)2) или производного олова (RbSnBu3) (где Rb является группой формулы (XV)B-G3-Cy-W3-(CH2)m-W2-(CH2)n-CH2 где В, G3, Су, W3, m, W2 и n определены выше, при условии, что в цепи -W3-(CH2)m-W2 не может быть двух последовательных гетероатомов и определенная таким образом цепь может иметь одну или несколько ненасыщенных связей,с получением соединения формулы (I/b),частного случая соединений формулы (I) где A, G1, Су, n, W2, m, W3, G3 и В определены выше, при условии, что в цепи -W2(CH2)m-W3- не может быть двух последовательных гетероатомов и определенная таким образом цепь может иметь одну или несколько ненасыщенных связей, 9 причем соединения формулы (I/с), частный случай соединений формулы (I) где A, G1, Су, W1, n, W2, m, G3 и В определены выше, при условии, что в цепи -W1-(CH2)nW2- не может быть двух последовательных гетероатомов и определенная таким образом цепь может иметь одну или несколько ненасыщенных связей,получены по аналогичной методике, исходя из соединений формулы (XIV)B-G3-Cy-OSO2CF3 где В, G3 и Су определены выше,или обрабатывают в условиях сочетания с использованием, например, соединений никеля или палладия соединением формулы (XIV) с получением при этом соединения формулы (I/d),частного случая соединений формулы (I)A-G1-Cy-Cy-G3-B где A, G1, Су, G3 и В определены выше,все соединения от (I/a) до (I/d), составляющие соединения формулы (I), которые при желании можно очистить обычными методами очистки, разделяют, где это необходимо, на изомеры с помощью обычного способа разделения и переводят, при необходимости, в соли их присоединения фармацевтически приемлемой кислоты или основания. Соединения формулы (V) легко доступны специалисту в данной области в соответствии со способами, описанными в литературе. Оказалось, что соединения по данному изобретению и содержащие их фармацевтические композиции могут использоваться при лечении нарушений мелатонинергической системы. Изобретение относится также к соединениям формулы (XII")A-G1-Cy-W4-(CH2)n-W2-(CH2)m-E' где A, G1, Су, W2, W4, n и m определены выше, и Е' является гидроксильной или атомом галогена(фтор, хлор, бром, или йод),при условии, что когда Су представляет собой нафталин и когда одновременно G1-A представляет собой илиNR C(Q)NR2-R3- (где R1, R2 и R3 определены выше), цепь -W4-(CH2)n-W2-(CH2)m- не может представлять собой О-алкильную цепь,соединение формулы (XII") не может представлять собой N-2-[5-(2-гидроксиэтокси)1H-индол-3-ил]этилацетамид, их энантиомерам и диастереомерам, и к их солям присоединения к фармацевтически приемлемым кислоте или основанию, в качестве промежуточных соединений синтеза, а также в качестве соединений для использования при лечении заболеваний,связанных с мелатонинергической системой. Фармакологическое исследование соединений по данному изобретению фактически показало, что они нетоксичны, обладают очень 10 большим сродством к рецепторам мелатонина и имеют значительную активность в отношении центральной нервной системы и, в частности,терапевтическими свойствами в отношении нарушений сна, успокаивающими, антипсихотическими и болеутоляющими свойствами, а также были обнаружены свойства в отношении микроциркуляции, что дает возможность утверждать, что соединения по данному изобретению могут использоваться при лечении стресса,нарушений сна, тревоги, сезонных аффективных расстройств, сердечно-сосудистых патологий,патологий пищеварительной системы, бессонницы и усталости при смене часовых поясов,шизофрении, приступов паники, меланхолии,нарушений аппетита, ожирения, бессонницы,психических расстройств, эпилепсии, сахарного диабета, болезни Паркинсона, старческого слабоумия, различных расстройств, связанных с нормальным или патологическим старением,мигрени, потери памяти, болезни Альцгеймера и нарушений церебральной циркуляции. В другой области активности, по-видимому, соединения по изобретению можно использовать для лечения сексуальных расстройств, поскольку они обладают свойствами ингибирования овуляции и иммуномодулирующими свойствами и могут быть использованы для лечения злокачественных опухолей. Соединения предпочтительно могут быть использованы для лечения сезонных аффективных расстройств, нарушений сна, сердечнососудистых патологий, бессонницы и усталости при смене часовых поясов, нарушений аппетита и ожирения. Например, соединения будут использованы для лечения сезонных аффективных расстройств и нарушений сна. Настоящее изобретение относится к фармацевтическим композициям, содержащим, по меньшей мере, одно соединение формулы (I) само по себе, или в сочетании с одним или несколькими фармацевтически приемлемыми эксципиентами. Среди фармацевтических композиций в соответствии с изобретением можно указать более конкретно те, которые пригодны для перорального, парентерального, назального, наили чрескожного, ректального, наязычного,глазного или респираторного введения, и, в частности, таблетки или драже, подъязычные таблетки, саше, пакетики, желатиновые капсулы,язычки, лепешки, суппозитории, кремы, мази,кожные гели и ампулы для питья или инъекций. Дозировка меняется в зависимости от пола, возраста и массы пациента, способа введения, природы терапевтического показания или лечения и колеблется от 0,01 мг до 1 г в течение 24 ч в один или несколько приемов. Следующие примеры иллюстрируют изобретение, но никоим образом не ограничивают его. Следующие получения позволяют получить 11 соединения по изобретению или промежуточные соединения синтеза для использования при получении изобретения. Получение 1. N-[2-(7-гидрокси-1-нафтил) этил]ацетамид. В инертной атмосфере 27,5 ммоль комплекса трибромидбор/диметилсульфид растворяли в 100 мл хлористого метилена и перемешивали 15 мин при комнатной температуре. Добавляли раствор 13,7 ммоль N-[2-(7-метокси 1-нафтил)этил]ацетамида в 50 мл хлористого метилена и кипятили реакционную смесь в течение 30 ч. После охлаждения реакционную смесь осторожно гидролизовали и удаляли хлористый метилен путем упаривания. Затем смесь экстрагировали этилацетатом и объединенные органические фазы промывали 1 М водным раствором гидрокарбоната калия. Органическую фазу сушили над сульфатом магния и концентрировали с получением указанного в заголовке соединения. Белый твердый продукт. Температура плавления: 125-126 С. Получения 2-19 осуществляли методом,аналогичным получению 1, исходя из соответствующего субстрата. Получение 2. N-Бутил-N'-[2-(7-гидрокси-1 нафтил)этил]мочевина. Получение 3. N-[2-(7-гидрокси-1-нафтил) этил]циклопропанкарбоксамид. Получение 4. 4-(7-Гидрокси-1-нафтил)-Nметилбутанамид. Получение 5. N-[2-(7-гидрокси-1-нафтил) этил]-3-бутенамид. Получение 6. N-[2-(7-гидрокси-3-фенил-1 нафтил)этил]ацетамид. Получение 7. N-[2-(5-гидроксибензотиофен-3-ил)этил]бутанамид. Получение 8. 2,2,2-Трифтор-N-[2-(5 гидроксибензотиофен-3-ил)этил]ацетамид. Получение 9. 4-(5-Гидрокси-1-бензофуран 3-ил)-N-метилбутанамид. Получение 10. N-[2-(5-гидрокси-1-бензофуран-3-ил)этил]циклопропанкарбоксамид. Получение 11. N-[2-(5-гидрокси-1-бензофуран-3-ил)этил]-N'-пропилмочевина. Получение 12. N-2-[5-гидрокси-2-(3 метоксибензил)-1-бензофуран-3-ил]этилацетамид. Получение 13. N-[2-(5-гидрокси-1 Н-индол 3-ил)этил]-N'-пропилтиомочевина. Получение 14. N-[2-(5-гидрокси-1H-индол 3-ил)этил]циклобутанкарбоксамид. Получение 15. N-[2-(5-гидрокси-1-метил 1 Н-пирроло[2,3-b]пиридин-3-ил)этил]ацетамид. Получение 16. N-[2-(5-гидрокси-1-метил 1 Н-пирроло[2,3-b]пиридин-3-ил)этил]-N'-пропилмочевина. Получение 17. N-[2-(6-гидрокси-3,4-дигидро-2 Н-хромен-4-ил)этил]ацетамид. Получение 18. N-[(6-гидрокси-2 Н-хромен 3-ил)метил]бутанамид. 12 Получение 19. N-[(7-гидрокси-1,4-бензодиоксин-2-ил)метил]-N'-пропилмочевина. Получение 20. N-[2-(7-меркапто-1-нафтил) этил]бензамид. Стадия A. N-[2-(7-гидрокси-1-нафтил) этил]бензамид. Методика аналогична получению 1, исходя из N-[2-(7-метокси-1-нафтил)этил]бензамида. Стадия В. N-[2-(7-меркапто-1-нафтил) этил]бензамид. Продукт, полученный на стадии А (9 ммоль), добавляли при перемешивании к раствору гидроксида калия (10 ммоль), растворенного в 15 мл воды и 16 мл тетрагидрофурана. Раствор охлаждали с использованием бани со льдом и солью и добавляли по каплям при перемешивании диметилтиокарбамоилхлорид (89 ммоль), растворенный в тетрагидрофуране (15 мл). После перемешивания в течение получаса при поддержании пониженной температуры реакционную смесь экстрагировали хлороформом. Органические фазы объединяли, высушивали над сульфатом магния, фильтровали и затем концентрировали при пониженном давлении. Остаток растворяли в дифениловом эфире(10 мл) и кипятили 1 ч в атмосфере азота. Дифениловый эфир удаляли упариванием при пониженном давлении до тех пор, пока не получили раствор приблизительно в 2 мл. Эти 2 мл дистиллята, пока еще горячие, осторожно выливали в 50 мл гексана, получая после охлаждения твердое вещество, которое выделяли фильтрованием. Полученное таким образом твердое вещество добавляли к раствору гидроксида калия(380 мг), растворенного в смеси вода/метанол (1 мл/10 мл). Этот раствор кипятили 12 ч, а затем охлаждали и концентрировали при пониженном давлении. Остаток растворяли в 20 мл хлороформа и 3 раза экстрагировали водой. Органическую фазу сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток хроматографировали на силикагеле,получая указанный в заголовке продукт. Получение 21. 2-Фенил-N-[2-(5-меркапто 1-бензофуран-3-ил)этил]ацетамид. Методика аналогична получению 20, исходя из 2-фенил-N-[2-(5-гидрокси-1-бензофуран-3 ил)этил]ацетамида. Получение 22. N-[2-(5-аминобензотиофен 3-ил)этил]циклогексанкарбоксамид. Стадия A. N-[2-(5-гидроксибензотиофен-3 ил)этил]циклогексанкарбоксамид. Методика аналогична получению 1, исходя из N-[2-(5-метоксибензотиофен-3-ил)этил]циклогексанкарбоксамида. Стадия В. N-[2-(5-бромбензотиофен-3-ил) этил]циклогексанкарбоксамид. Трифенилфосфин (10 ммоль) и ацетонитрил (70 мл) помещали в трехгорлую колбу,снабженную капельной воронкой, холодильником, сверху которого помещали трубку, заполненную хлоридом кальция, и механической ме 13 шалкой. Раствор охлаждали с использованием бани со льдом, продолжая перемешивание, и добавляли бром (10 ммоль). По завершении добавления баню со льдом убирали и после этого добавляли продукт, полученный на стадии А (8 ммоль). Реакционную смесь перемешивали при 60-70 С до тех пор, пока исходное вещество не исчезало. По окончании реакции смесь отфильтровывали и затем фильтрат концентрировали при пониженном давлении. Остаток растворяли в этилацетате, промывали водой, а затем насыщенным раствором гидрокарбоната калия и еще раз водой, а затем сушили над сульфатом магния и концентрировали при пониженном давлении. Остаток фильтровали через силикагель, получая указанный в заголовке продукт. Стадия С. N-[2-(5-йодбензотиофен-3-ил) этил]циклогексанкарбоксамид. Смесь продукта, полученного на стадии В(2 ммоль), йодида калия (30 ммоль) и йодида меди(I) (10 ммоль) в гексаметилфосфорамиде (6 мл) нагревали при 150-160 С при перемешивании в атмосфере азота до тех пор, пока не достигался 90% уровень преобразования. После этого добавляли разбавленную хлористоводородную кислоту, затем эфир и далее смесь фильтровали для удаления нерастворимых солей меди(I). Органическую фазу отделяли, промывали раствором сульфита натрия и водой,сушили над сульфатом магния и упаривали, получая остаток, который хроматографировали на силикагеле с получением указанного в заголовке продукта. Стадия D. N-[2-(5-винилбензотиофен-3 ил)этил]циклогексанкарбоксамид. 15 ммоль продукта, полученного на стадии С, 16 ммоль винилтрибутилолова и 0,43 ммоль тетракис(трифенилфосфин)палладия нагревали при 110 С при перемешивании в течение 3 ч в 30 мл N-метил-2-пирролидона. После удаления растворителя путем упаривания остаток растворяли в 20 мл хлористого метилена и обрабатывали 10%-м водным раствором фторида калия. В результате экстракции, концентрирования при пониженном давлении и хроматографии на силикагеле получали чистый указанный в заголовке продукт. Стадия Е. N-[2-(5-формилбензотиофен-3 ил)этил]циклогексанкарбоксамид. К раствору 10 ммоль продукта, полученного на стадии D, в смеси 50 мл диоксана и 25 мл воды, при комнатной температуре М добавляли 1,10 г четырехокиси осмия в 2-метил-2 пропаноле, а затем 8,70 г периодата натрия. После перемешивания в течение ночи при комнатной температуре суспензию фильтровали и концентрировали фильтрат при пониженном давлении. Полученный остаток растворяли в хлористом метилене. Органическую фазу промывали водой, сушили и упаривали. Остаток очищали 14 хроматографией на силикагеле с получением указанного в заголовке продукта. Стадия F. 3-2-[(Циклогексилкарбонил) амино]этил-1-бензотиофен-5-карбоновая кислота. К раствору 6,88 ммоль продукта, полученного на стадии Е, в 30 мл ацетона, при комнатной температуре добавляли 2,7 г перманганата калия в 50 мл смеси ацетон/вода (50/50). Раствор перемешивали 2 ч при комнатной температуре и затем фильтровали. Фильтрат концентрировали при пониженном давлении и хроматографировали на силикагеле с получением указанного в заголовке продукта. Стадия G. Хлорангидрид 3-2-[(циклогексилкарбонил)амино]этил-1-бензотиофен-5 карбоновой кислоты. 5 ммоль продукта, полученного на стадииF, растворяли в 40 мл тионилхлорида. После перемешивания в инертной атмосфере в течение 1 ч, тионилхлорид удаляли упариванием при пониженном давлении с получением указанного в заголовке продукта. Стадия Н. N-[2-(5-аминобензотиофен-3 ил)этил]циклогексанкарбоксамид. Раствор продукта, полученного на стадииG (20 ммоль) в хлористом метилене (30 мл),содержащий бромид тетрабутиламмония (20 мг), охлаждали на ледяной бане. После добавления азида натрия (25 ммоль), растворенного в 5 мл воды, раствор энергично перемешивали при 0 С в течение 2 ч. Органическую фазу отделяли, промывали водой (25 мл) и сушили над сульфатом магния. После фильтрования добавляли трифторуксусную кислоту (30 ммоль) и перемешивали этот раствор при кипячении в течение 60 ч. После охлаждения органическую фазу промывали насыщенным раствором гидрокарбоната натрия(25 мл) и концентрировали при пониженном давлении. После этого остаток растворяли в метаноле (20 мл) и затем добавляли воду (80 мл) и карбонат калия (30 ммоль). После перемешивания при комнатной температуре в течение 20 ч реакционную смесь концентрировали при пониженном давлении до объема приблизительно 60 мл, а затем экстрагировали 3 раза эфиром(350 мл). После высушивания над сульфатом натрия органическую фазу фильтровали и затем упаривали при пониженном давлении. Остаток хроматографировали на силикагеле с получением указанного в заголовке продукта. Получение 23. 2-(5-Амино-1-бензофуран 3-ил)-N-гексиламид. Методика аналогична получению 22. Получение 24. 8-[2-(Ацетиламино)этил]-2 нафтилтрифторметансульфонат. К раствору 0,07 моль соединения, полученного в приготовлении 1, в 1 л хлористого метилена добавляли 60 мл триэтиламина. Реакционную смесь кипятили до растворения и по 15 сле этого добавляли 0,1 моль фенил бис(трифторметансульфонимида) и 0,75 моль карбоната калия. После 4 ч кипячения смесь промывали 1 л 1 М раствора гидрокарбоната натрия, а затем 1 л 1 М соляной кислоты. Органическую фазу сушили, концентрировали и очищали хроматографией на силикагеле с получением указанного в заголовке продукта. Получение 25. 3-2-[(Циклопропилкарбонил)амино]этил-1-бензофуран-5-ил трифторметансульфонат. Методика аналогична получению 24, исходя из продукта, полученного в получении 10. Получение 26. 3-[2-(Ацетиламино)этил]-1 метил-1 Н-пирроло-[2,3-b]пиридин-5-ил трифторметансульфонат. Методика аналогична получению 24, исходя из продукта, полученного в получении 15. Получение 27. N-[2-(7-гидрокси-1,2,3,4 тетрагидро-1-нафталенил)этил]ацетамид. Методика аналогична получению 1, исходя из N-[2-(7-метокси-1,2,3,4-тетрагидро-1-нафталенил)этил]ацетамида. Температура плавления: 149-150 С. Получение 28. N-2-[(5-гидрокси-1-фенилсульфонил)-1 Н-индол-3-ил]этилацетамид. Стадия A. N-2-[(5-метокси-1-фенилсульфонил)-1 Н-индол-3-ил]этилацетамид. Растворяли 5 г (21,5 ммоль) мелатонина в 150 мл хлористого метилена. При перемешивании добавляли 3,41 г (84 ммоль) гидроксида натрия и 0,35 г (0,9 ммоль) гидросульфата тетрабутиламмония. Охлаждали смесь на ледяной бане и добавляли по каплям 4,06 мл (31,5 ммоль) бензолсульфонилхлорида. После перемешивания в течение ночи при комнатной температуре отфильтровывали избыток гидроксида натрия и катализатора. Удаляли растворитель упариванием в вакууме и перекристаллизовывали оставшийся остаток. Температура плавления: 140-141 С. Стадия В. N-2-[(5-гидрокси-1-фенилсульфонил)-1 Н-индол-3-ил]этилацетамид. Методика аналогична получению 1, исходя из продукта, полученного на стадии А. Температура плавления: 205-206 С. Получение 29. N-[2-(5-гидрокси-1-бензофуран-3-ил)этил]ацетамид. Температура плавления: 140 С. Получение 30. N-[2-(5-гидрокси-1 Н-индол 3-ил)этил]ацетамид. Методика аналогична получению 1, исходя из мелатонина. Бесцветное масло. Получение 31. Трет-бутил 2-(7-гидрокси-1 нафтил)этилкарбамат. В 100-мл круглодонной колбе суспендировали гидробромид 8-(2-аминоэтил)-2-нафтола (3 г, 1,12 ммоль) в 30 мл хлористого метилена и добавляли триэтиламин (3,88 мл, 2,8 ммоль). Охлаждали реакционную смесь до 0 С с ис 003300 16 пользованием ледяной бани и добавляли по каплям ди-трет-бутилдикарбонат (2,2 г, 1 моль),растворенный в 10 мл хлористого метилена. Перемешивали реакционную смесь при комнатной температуре в течение 4 ч. Промывали реакционную смесь 0,5 М водным раствором соляной кислоты, а затем водой. Высушивали органическую фазу над сульфатом магния и упаривали ее при пониженном давлении. Перекристаллизовывали полученный остаток из циклогексана/толуола (1/10). Температура плавления: 72-73 С. Получение 32. N-[2-(5-гидрокси-1-метил 1 Н-пирроло[3,2-b]пиридин-3-ил)этил]ацетамид. Методика аналогична получению 1, исходя из N-[2-(5-метокси-1-метил-1 Н-пирроло[3,2-b] пиридин-3-ил)этил]ацетамида. Получение 33. 3-[2-(ацетиламино)этил]1 Н-индол-5-ил трифторметансульфонат. Методика аналогична получению 24, исходя из соединения, полученного в получении 30. Получение 34. N-[2-(5-гидроксибензотиофен-3-ил)этил]ацетамид. Методика аналогична получению 1, исходя из N-[2-(5-метоксибензотиофен-3-ил)этил]ацетамида. Температура плавления: 166-168 С. Получение 35. N-[2-(7-гидрокси-2-метокси-1-нафтил)этил]ацетамид. Методика аналогична получению 1, исходя из(0,009 моль), растворяли в 20 мл смеси диметилсульфоксида (6 мл) и бутанона (14 мл). Добавляли 0,027 моль карбоната калия и 0,036 моль дибромэтана и кипятили эту смесь в течение 48 ч. После этого реакционную смесь охлаждали и выливали воду. Водную фазу экстрагировали Et2O, а затем органическую фазу промывали водой до тех пор, пока промывные воды не стали нейтральными, а затем высушивали над сульфатом магния и упаривали при пониженном давлении. Полученный остаток очищали хроматографией на силикагеле (элюент: ацетон/циклогексан (2/8 и перекристаллизовывали. Белый твердый продукт. Температура плавления: 110-111 С. Элементный микроанализ: % С, % Н, % N: вычислено: 57,15; 5,40; 4,17; найдено: 57,28; 5,38; 3,91. Стадия В. N-(2-7-[2-(8-[2-(ацетиламино) этил]-2-нафтилокси)этокси]-1-нафтилэтил) ацетамид. 17 В 100-мл круглодонной колбе 0,003 моль соединения, полученного в приготовлении 1, и 0,003 моль соединения, полученного на стадии А, растворяли в смеси 3 мл диметилсульфоксида и 20 мл бутанона. Добавляли 0,009 моль карбоната калия и 1 кристалл йодида калия и затем кипятили смесь 12 ч. После этого реакционную смесь охлаждали и выливали в 100 мл воды. Образовавшийся осадок фильтровали на вакуумном фильтре и перекристаллизовывали. Бежевый твердый продукт. Температура плавления: 220-222 С. Элементный микроанализ: % С, % Н, % N: вычислено: 71,69; 6,61; 5,57; найдено: 72,03; 6,60; 5,53. Пример 2. N-[2-[7-(2-[8-(2-[(бутиламино)карбонил]аминоэтил)-2-нафтил]оксиэтокси)-1-нафтил]этил]ацетамид. Методика та же, что в примере 1, при замене на стадии В нафтола, синтезированного в получении 1, на соединение, синтезированное в получении 2. Пример 3. N-(2-7-[2-(8-[2-(3-бутеноиламино)этил]-2-нафтилокси)этокси]-1-нафтил этил)-3-бутенамид. Методика та же, что в примере 1, при замене синтезированного в получении 1 соединения на соединение, синтезированное в получении 5. Пример 4. N-[2-(7-[2-(8-[2-(ацетиламино)этил]-2-нафтил-окси)этил]тио)этил]бензамид. Методика та же, что в примере 1, при замене синтезированного в получении 1 нафтола на соединение, синтезированное в получении 20. Пример 5. N-[2-(5-[2-(3-[2-(бутиламино) этил]-1-бензотиофен-5-илокси)этил]амино-1 бензотиофен-3-ил)этил]циклогексанкарбоксамид. Методика та же, что в примере 1, при замене: на стадии А соединения, синтезированного в получении 1, на соединение, синтезированное в получении 7,на стадии В соединения, синтезированного в получении 1, на соединение, синтезированное в получении 22. Пример 6. N-(2-7-[3-(8-[2-(ацетиламино) этил]-2-нафтилокси)пропокси]-1-нафтил этил)ацетамид. Стадия A. N-2-[7-(3-гидроксипропилокси) нафт-1-ил]этилацетамид. В 100-мл круглодонной колбе 0,022 моль соединения, полученного в приготовлении 1,растворяли в 30 мл диметилформамида, добавляли 0,066 моль карбоната калия и 0,033 моль 3 бромпропан-1-ола, а затем нагревали эту смесь при 80 С в течение 4 ч. Реакционную смесь охлаждали и выливали в 100 мл 1 М раствора НСl. 18 Водную фазу 3 раза экстрагировали Et2O и высушивали затем органическую фазу над MgSO4 и упаривали при пониженном давлении. Указанный в заголовке продукт выделяли путем перекристаллизации. Белый твердый продукт. Температура плавления: 141-142 С. Стадия В. 3-(8-[2-(ацетиламино)этил]-2 нафтилокси)пропилметансульфонат. В 250-мл круглодонной колбе растворяли спирт, полученный на стадии А, в 50 мл хлористого метилена и добавляли 0,012 моль триэтиламина. Смесь охлаждали в бане со льдом и солью при -10 С и затем добавляли по каплям 0,012 моль мезилхлорида при перемешивании на магнитной мешалке. Реакционную смесь перемешивали при комнатной температуре 4 ч. Затем добавляли 100 мл воды, после чего экстрагировали СН 2 Сl2. Органическую фазу промывали водой, сушили над MgSO4 и упаривали при пониженном давлении. Полученное масло очищали хроматографией на силикагеле (элюент: ацетон/циклогексан (2/8. Стадия С. N-(2-7-[3-([8-[2-(ацетиламино) этил]-2-нафтил]окси)пропокси]-1-нафтилэтил) ацетамид. В 100-мл круглодонную колбу, содержащую 30 мл метанола, небольшими порциями добавляли 0,06 г натрия. Когда натрий был полностью израсходован, добавляли 0,0033 моль соединения, синтезированного в получении 1, и перемешивали смесь 20 мин. Метанол удаляли упариванием при пониженном давлении, остаток растворяли в 15 мл ДМФА, а затем добавляли 0,0027 моль соединения, полученного на стадии В. После этого реакционную смесь кипятили 12 ч, после чего охлаждали и выливали в 100 мл воды и 10 мл 3 М НСl. После экстракции этилацетатом органическую фазу промывали 10%-м раствором гидроксида натрия и затем водой. После высушивания над MgSO4 и удаления растворителя упариванием при пониженном давлении, путем перекристаллизации получали указанное в заголовке соединение. Бежевый твердый продукт. Температура плавления: 101-103 С. Элементный микроанализ: % С, % Н, % N: вычислено: 74,67; 6,87; 5,18; найдено: 74,31; 6,87; 5,15. Пример 7. N-(2-7-[3-(8-[2-(ацетиламино) этил]-2-нафтилокси)пропокси]-3-фенил-1 нафтилэтил)ацетамид. Методика та же, что в примере 6, при замене на стадии С соединения, синтезированного в получении 1, на соединение, синтезированное в получении 6. Пример 8. N-метил-4-7-[3-(8-[4-(метиламино)-4-оксобутил]-2-нафтилокси)пропокси] нафт-1-илбутанамид. 19 Методика та же, что в примере 6, при замене синтезированного, на соединение, синтезированное в получении 4. Пример 9. N-(2-[5-[3-(3-[4-(метиламино)-4 оксобутил]-1-бензофуран-3-ил)этил]циклопропанкарбоксамид. Методика та же, что в примере 6, при замене: на стадии А соединения, синтезированного в получении 1, на соединение, синтезированное в получении 9,на стадии В соединения, синтезированного в получении 1, на соединение, синтезированное в получении 10. Пример 10. N-2-[1-метил-5-(3-[1-метил 3-(2-[(пропиламино)карбонил]аминоэтил)-1 Нпирроло[2,3-b]пиридин-5-ил]оксипропокси) этил]ацетамид. Методика та же, что в примере 6, при замене: на стадии А соединения, синтезированного в получении 1, на соединение, синтезированное в получении 15,на стадии С соединения, синтезированного в получении 1, на соединение, синтезированное в получении 16. Пример 11. N-(2-6-[3-(4-[2-(ацетиламино)этил]-3,4-дигидро-2 Н-хромен-6-илокси)пропокси]-3,4-дигидро-2 Н-хромен-4-илэтил)ацетамид. Методика та же, что в примере 6, при замене соединения получения 1, на соединение получения 17. Пример 12. N-(2-7-[4-(8-[2-(ацетиламино)этил]-2-нафтилокси)бутокси]-1-нафтил этил)ацетамид. Стадия А. Этил 4-(8-[2-(ацетиламино) этил]-2-нафтилокси)бутаноат. В 100-мл круглодонной колбе 0,022 моль соединения, полученного в приготовлении 1,растворяли в 50 мл ацетонитрила, добавляли 0,066 моль карбоната калия и перемешивали реакционную смесь при 80 С в течение 30 мин. Затем по каплям добавляли 0,033 моль этил 1 бромбутирата и перемешивали реакционную смесь 1 ч при 80 С. Ацетонитрил удаляли упариванием при пониженном давлении, а остаток растворяли в 1 н. растворе НСl. После экстракции этилацетатом, промывания органической фазы водой, сушки над MgSO4 и упаривания при пониженном давлении указанное в заголовке соединения очищали перекристаллизацией. Бежевый твердый продукт. Температура плавления: 64-66 С. Стадия В. N-2-[7-(4-гидроксибутилокси) нафт-1-ил]этилацетамид. В 250-мл круглодонной колбе сложный эфир, полученный на стадии А (0,009 моль),растворяли в 100 мл абсолютного эфира. Порциями добавляли 0,009 моль алюмогидрида лития и перемешивали реакционную смесь 6 ч при 20 комнатной температуре. После этого реакционную смесь гидролизовали несколькими каплями 1 М NaOH и фильтровали выпавший осадок. Фильтрат сушили над MgSO4 и упаривали при пониженном давлении. Полученный остаток высаживали из смеси Еt2 О/петролейный эфир(1/1), фильтровали на вакуумном фильтре и перекристаллизовывали. Белый твердый продукт. Температура плавления: 82-84 С. Элементный микроанализ: % С, % Н, % N: вычислено: 71,73; 7,69; 4,64; найдено: 72,00; 7,58; 4,45. Стадия С. 4-(8-[2-(Ацетиламино)этил]-2 нафтилокси)бутилметансульфонат. Методика та же, что на стадии В примера 6, исходя из соединения, полученного на стадии В. Стадия D. N-(2-7-[4-(8-[2-(ацетиламино) этил]-2-нафтилокси)бутокси]-1-нафтилэтил) ацетамид. Методика та же, что на стадии С примера 6. Бежевое твердое вещество. Температура плавления: 176-178 С. Элементный микроанализ: % С, % Н, % N: вычислено: 74,97; 7,08; 5,46; найдено: 75,17; 7,01; 5,21. Пример 13. N-(2-7-[4-(8-[4-(метиламино)-4-оксобутил]-2-нафтилокси)бутокси]-1 нафтилэтил)-3-бутенамид. Методика та же, что в примере 12, при замене на стадии А соединения получения 1 на соединение получения 4, и при замене на стадииD соединения получения 1 на соединение получения 5. Пример 14. N-(2-7-[4-(8-[2-(ацетиламино)этил]-2-нафтилокси)бутокси]-1-нафтил этил)циклопропанкарбоксамид. Методика та же, что в примере 12, при замене на стадии D соединения получения 1 на соединение получения 3. Пример 15. 2,2,2-Трифтор-N-[2-(5-4-[32-[2,2,2-(трифторацетил)амино]этил-1-бензотиофен-5-ил]окси]бутокси-1-бензотиофен-3 ил)этил]ацетамид. Методика та же, что в примере 12, при замене соединения получения 1 на соединение получения 8. Пример 16. N-(6-[4-(3-[(бутириламино) метил]-2 Н-хромен-6-илокси)бутокси]-2 Нхромен-3-илметил)бутанамид. Методика та же, что в примере 12, при замене на стадии А соединения получения 1 на соединение получения 18. Пример 17. N-[2-(7-(6-(8-[2-(ацетиламино)этил]-2-нафтилокси)гексил)окси-1-нафтил) этил]ацетамид. Стадия А. N-(2-7-[(6-гидроксигексил) окси]-1-нафтилэтил)ацетамид. 21 Методика та же, что на стадии А в примере 6, при замене 3-бромпропан-1-ола на 6 бромгексан-1-ол. Белое твердое вещество. Температура плавления: 58-61 С. Элементный микроанализ: % С; % Н; % N: вычислено: 72,91; 8,41; 4,25; найдено: 73,22; 8,17; 4,02. Стадия В. 6-(8-[2-(ацетиламино)этил]-2 нафтилокси)гексилметансульфонат. Методика та же, что на стадии В примера 6. Белое твердое вещество. Температура плавления: 66-67 С. Стадия С. N-[2-(7-(6-([8-[2-(ацетиламино) этил]-2-нафтил]окси)гексил)окси-1 нафтил)этил]ацетамид. Методика та же, что на стадии С примера 6. Белый твердый продукт. Температура плавления: 142-144 С. Элементный микроанализ: % С, % Н, % N: вычислено: 75,52; 7,46; 5,18; найдено: 75,32; 7,59; 4,96. Пример 18. N-[2-(7-[6-(8-[2-(ацетиламино)этил]-6-фенил-2-нафтилокси)гексил]окси 3-фенил-1-нафтил)этил]ацетамид. Методика та же, что в примере 17, при замене соединения, синтезированного в получении 1, на соединение, синтезированное в получении 6. Пример 19. 2-Фенил-N-2-[5-(6-[(3-2-[(2 фенилацетил)амино]этил-1-бензофуран-5-ил) тио]гексилтио)-1-бензофуран-5-ил]этилацетамид. Методика та же, что в примере 17, при замене соединения, синтезированного в получении 1, на соединение получения 21. Пример 20.N-гексил-2-5-[(6-[3-(2[(пропиламино)карбонил]амино-1-бензофуран-3-ил ацетамид. Методика та же, что в примере 17, при замене: на стадии А соединения получения 1 на соединение получения 23,на стадии В соединения получения 1 на соединение получения 11. Пример 21. N-2-[5-[(6-[3-[2-(ацетиламино)этил]-2-(3-метоксибензил)-1-бензофуран-5 ил]оксигексил)окси]-2-(3-метоксибензил)-1 бензофуран-3-ил]этилацетамид. Методика та же, что в примере 17, при замене соединения получения 1 на соединение получения 12. Пример 22. N-2-[5-(6-[(3-[2-[(циклобутилкарбонил)амино]этил]-1 Н-индол-5-ил) окси]гексилокси)-1 Н-индол-3-ил]этилциклобутанкарбоксамид. 22 Методика та же, что в примере 17, при замене соединения получения 1 на соединение получения 14. Пример 23. N-(2-5-[(6-[3-(2-[(пропиламино)карботиоил]аминоэтил)-1 Н-индол-5 ил]оксигексил)окси]-1 Н-индол-3-илэтил) циклобутанкарбоксамид. Методика та же, что в примере 17, при замене: на стадии А соединения получения 1 на соединение получения 14,на стадии В соединения получения 1 на соединение получения 13. Пример 24.N'-пропил-N-(7-[(6-[3([(пропиламино)карбонил]аминометил)-1,4 бензодиоксин-6-ил]оксигексил)окси]-1,4 бензодиоксин-2-илметил)мочевина. Методика та же, что в примере 17, при замене соединения получения 1 на соединение получения 19. Пример 25. N-[2-(7-8-[2-(ацетиламино) этил]-2-нафтил-1-нафтил)этил]ацетамид. В атмосфере азота 5,53 ммоль соединения,синтезированного в получении 24, 1,94 ммоль дихлорбис(трифенилфосфин)никеля, 3,87 ммоль трифенилфосфина и 8,30 ммоль цинка суспендировали в 20 мл безводного ДМФА. После нагревания в течение 48 ч при 120 С в атмосфере азота реакционную смесь концентрировали и распределяли полученный остаток междуCH2Cl2 и 1 М NaHCO3. После этого органическую фазу сушили над Na2SO4 и концентрировали в вакууме. Указанное в заголовке соединение получали путем хроматографирования на силикагеле. Температура плавления: 192,2-193,4 С. Пример 26. N-(2-5-(3-2-[(циклопропилкарбонил)амино]этил-1-бензофуран-5-ил)-1 бензофуран-3-илэтил)циклопропанкарбоксамид. Методика та же, что в примере 25, при замене соединения, синтезированного в получении 24, на соединение, синтезированное в получении 25. Пример 27. N-2-[5-3-[2-(ацетиламино) этил]-1-метил-1 Н-пирроло[2,3-b]пиридин-5-ил 1-метил-1 Н-пирроло[2,3-b]-пиридин-3-ил] этилацетамид. Методика та же, что в примере 25, при замене соединения, синтезированного в получении 24, на соединение, синтезированное в получении 26. Пример 28. N-[2-(7-[5-(8-[2-(ацетиламино)этил]-2-нафтилокси)пентил]окси-1 нафтил)этил]ацетамид. Стадия А. Метил 5-(8-[2-(ацетиламино) этил]-2-нафтилокси)пентаноат. В 250-мл круглодонной колбе растворяли полученное в получении 1 соединение (4,6 г; 20 23 ммоль) в 70 мл ацетонитрила. Добавляли карбонат калия (8,3 г; 60 ммоль) и перемешивали на магнитной мешалке при кипячении в течение 30 мин. После этого добавляли по каплям метил 5 бромвалерат (3,4 мл, 24 ммоль) и кипятили 12 ч. Удаляли ацетонитрил упариванием при пониженном давлении. Растворяли остаток в воде и 3 раза экстрагировали этилацетатом. Промывали органическую фазу водным раствором 1 М соляной кислоты, а затем водой до тех пор, пока промывные воды не становились нейтральными,высушивали над сульфатом магния и упаривали при пониженном давлении. Высаживали полученное масло из смеси диэтиловый эфир/ петролейный эфир (1/2). Фильтровали на вакуумном фильтре образовавшийся осадок и перекристаллизовывали его из смеси толуол/циклогексан (1/2). Стадия В. N-(2-7-[(5-гидроксипентил) окси]-1-нафтилэтил)ацетамид. В 100-мл круглодонной колбе растворяли полученное на стадии А соединение (3,42 г, 10 ммоль) в 50 мл безводного тетрагидрофурана. Небольшими порциями добавляли алюмогидрид лития (379,5 мг; 10 ммоль). Перемешивали при комнатной температуре 6 ч. Гидролизовали реакционную смесь 100 мл водного раствора 1 М соляной кислоты. Экстрагировали водную фазу хлористым метиленом 3 раза. Сушили органическую фазу над сульфатом магния и упаривали при пониженном давлении. Полученное масло использовали непосредственно на следующей стадии. Стадия С. 5-(8-[2-(ацетиламино)этил]-2 нафтилокси)пентилметансульфонат. В 250-мл круглодонной колбе растворяли полученное на стадии В соединение (3,15 г, 10 ммоль) в 50 мл хлористого метилена и добавляли триэтиламин (1,6 мл; 12 ммоль). Охлаждали в бане со льдом и солью при 0 С, и затем добавляли по каплям мезилхлорид (0,93 мл, 12 ммоль) при перемешивании с использованием магнитной мешалки. Давали реакционной смеси дойти до комнатной температуры и перемешивали 5 ч. Добавляли 100 мл воды и 3 раза экстрагировали водную фазу хлористым метиленом. Промывали органическую фазу 320 мл водного раствора 1 М соляной кислоты, а затем водой, высушивали над сульфатом магния и упаривали при пониженном давлении. Очищали полученное масло хроматографией на силикагеле (элюент: ацетон/циклогексан (3/7. Бесцветное масло. Стадия D. N-[2-(7-[5-(8-[2-(ацетиламино) этил]-2-нафтилокси)пентил]окси-1-нафтил) этил]ацетамид. В 100-мл круглодонную колбу, содержащую 30 мл метанола, небольшими порциями добавляли натрий (0,07 г, 0,0030 г/атом). Когда натрий полностью израсходуется, добавляли нафтол (0,82 г, 3,6 ммоль). Перемешивали на 24 магнитной мешалке 20 мин. Удаляли метанол упариванием при пониженном давлении. Растворяли полученный остаток в 15 мл диметилформамида. Добавляли соединение, полученное на стадии С (1,2 г, 3 ммоль), и кипятили 12 ч. Оставляли реакционную смесь охлаждаться и выливали ее в смесь 100 мл воды и 10 мл 3 М соляной кислоты. Экстрагировали водную фазу дважды этилацетатом. Сушили над сульфатом магния и удаляли этилацетат упариванием при пониженном давлении. Перекристаллизовывали полученный твердый остаток из ацетонитрила. Температура плавления: 134-136 С. Пример 29. N-[2-(7-2-[2-(8-[2-(ацетиламино)этил]-2-нафтилокси)этокси]этокси-1 нафтил)этил]ацетамид. В 100-мл круглодонной колбе растворяли соединение, полученное в получении 1 (1,14 г, 5 ммоль) в 50 мл ацетонитрила. Добавляли карбонат калия (0,83 г, 6 ммоль) и перемешивали на магнитной мешалке при кипячении в течение 30 мин. После этого добавляли по каплям бис(2 бромэтиловый) эфир (0,25 мл, 2 ммоль) и кипятили 12 ч. Удаляли ацетонитрил упариванием при пониженном давлении. Растворяли полученный остаток в водном растворе 1 М гидроксида натрия. Отфильтровывали полученный осадок, промывали его водой и перекристаллизовывали его из ацетонитрила, а затем из этилацетата. Температура плавления: 135-138 С. Пример 30. N-(2-7-[4-(8-[2-(ацетиламино)этил]-5,6,7,8-тетрагидро-2-нафталенилокси) бутокси]-1,2,3,4-тетрагидро-1-нафталенилэтил) ацетамид. В 100-мл круглодонной колбе растворяли соединение, полученное в получении 27 (0,8 г,3,4 ммоль) в 50 мл ацетонитрила. Добавляли карбонат калия (0,57 г, 4,1 ммоль) и перемешивали на магнитной мешалке при кипячении в течение 30 мин. После этого добавляли по каплям 1,4-дибромбутан (0,16 мл, 1,4 ммоль) и кипятили 12 ч. Удаляли ацетонитрил упариванием при пониженном давлении. Растворяли полученный остаток в водном растворе 1 М гидроксида натрия. Отфильтровывали полученный осадок, промывали его водой и перекристаллизовывали его из ацетонитрила. Температура плавления: 119-121 С. Пример 31. трет-Бутил 2-7-[4-(8-[2(ацетиламино)этил]-2-нафтилокси)бутокси]-1 нафтилэтилкарбамат. В 100-мл круглодонную колбу, содержащую 30 мл метанола, небольшими порциями добавляли натрий (0,07 г, 0,0030 г/атом). Когда натрий полностью израсходуется, добавляли соединение, полученное в получении 31 (1 г, 3,6 ммоль). Перемешивали на магнитной мешалке 20 мин. Удаляли метанол упариванием при пониженном давлении. Растворяли полученный остаток в 15 мл диметилформамида. Добавляли 25 соединение, полученное на стадии С (1,1 г, 3 ммоль) и кипятили 12 ч. Давали реакционной смеси охладиться и выливали ее в смесь 100 мл воды и 10 мл 3 М соляной кислоты. Дважды экстрагировали водную фазу этилацетатом. Промывали органическую фазу 10%-м водным раствором гидроксида натрия, а затем водой. Сушили над сульфатом магния и удаляли этилацетат упариванием при пониженном давлении. Перекристаллизовывали полученный твердый остаток из толуола. Температура плавления: 101-103 С. Пример 32. N-2-[5-(4-[3-[2-(ацетиламино)этил]-1-(фенилсульфонил)-1 Н-индол-5 ил]оксибутокси)-1-(фенилсульфонил)-1 Ниндол-3-ил]этилацетамид. Растворяли 1 г (2,79 ммоль) соединения,полученного в получении 28, в 20 мл ацетонитрила. Добавляли при перемешивании 0,38 г(2,79 ммоль) карбоната калия и 0,13 мл (1,11 моль) 1,4-дибромбутана. После кипячения в течение ночи выливали реакционную смесь в 200 мл воды и льда. Отфильтровывали осадок,промывали эфиром, высушивали и перекристаллизовывали из смеси диоксан/вода. Температура плавления: 203-204 С. Пример 33. N-(2-5-[4-(3-[2-(ацетиламино)этил]-1-бензофуран-5-илокси)бутокси]-1 бензофуран-3-илэтил)ацетамид. Растворяли 0,70 г (3,19 ммоль) соединения,полученного в получении 29, в 20 мл ацетонитрила. Добавляли при перемешивании 0,44 г(3,19 ммоль) карбоната калия и 0,15 мл (1,28 моль) 1,4-дибромбутана. После кипячения в течение ночи выливали реакционную смесь в 200 мл воды и льда. Отфильтровывали осадок,промывали эфиром, высушивали и перекристаллизовывали из толуола. Температура плавления: 171-172 С. Пример 34. N-(2-5-[4-([3-[2-(ацетиламино)этил]-1 Н-индол-5-ил]окси)бутокси]-1Hиндол-3-илэтил)ацетамид. Растворяли 1 г (4,58 ммоль) соединения,полученного в получении 30, в 20 мл ацетонитрила. Добавляли при перемешивании 0,63 г(4,58 ммоль) карбоната калия и 0,22 мл (1,83 моль) 1,4-дибромбутана. После кипячения в течение ночи выливали реакционную смесь в 200 мл воды и льда. Отфильтровывали осадок,промывали ацетоном и высушивали. Температура плавления: 208-209 С. Пример 35. Гидрохлорид N-2-[7-(4-[8-(2 аминоэтил)-2-нафтил]оксибутокси)-1-нафтил] этилацетамида. В 100-мл колбе суспендировали полученное в примере 31 соединение в метаноле. Барботировали через него газообразный хлористый водород до тех пор, пока не была получена прозрачная фаза. Перемешивали при комнатной температуре 5 ч. Фильтровали на вакуумном фильтре образовавшийся осадок и перекристал 003300 26 лизовывали его из смеси ацетонитрил/метанол(3/1). Температура плавления: 188-189 С. Пример 36. N-(2-7-[4-(8-[2-(2-фуроиламино)этил]-2-нафтилокси)бутокси]-1-нафтил этил)-2-фурамид. Стадия А. трет-Бутил 2-(7-4-[8-[2-(третбутоксикарбонил)амино]этил-2-нафтил]окси бутокси)-1-нафтилэтилкарбамат. В круглодонной колбе на 100 мл растворяли соединение, полученное в получении 31 (5 ммоль), в 50 мл ацетонитрила. Добавляли карбонат калия (0,83 г, 6 ммоль) и перемешивали на магнитной мешалке при кипячении в течение 30 мин. После этого добавляли по каплям 1,4 дибромбутан (0,37 мл, 2 ммоль) и кипятили 12 ч. Удаляли ацетонитрил упариванием при пониженном давлении. Растворяли полученный остаток в воде и экстрагировали 3 раза этилацетатом. Промывали органическую фазу 1 М водным раствором гидроксида натрия, 1 М водным раствором соляной кислоты, а затем водой до тех пор, пока промывные воды не становились нейтральными, сушили над сульфатом магния и упаривали при пониженном давлении. Перекристаллизовывали полученный остаток из метанола. Температура плавления: 139-140 С. Стадия В. Дигидрохлорид 2-[7-(4-[8-(2 аминоэтил)-2-нафтил]оксибутокси)-1-нафтил] этиламина. В 100-мл колбе суспендировали полученное на стадии А соединение (2 г, 3,2 ммоль) в метаноле. Барботировали через него газообразный хлористый водород до тех пор, пока не была получена прозрачная фаза. Перемешивали при комнатной температуре 5 ч. Фильтровали на вакуумном фильтре образовавшийся осадок и перекристаллизовывали его из ацетонитрила. Температура плавления: 240 С. Стадия С. N-(2-7-[4-(8-[2-(2-фуроиламино)этил]-2-нафтилокси)бутокси]-1-нафтил этил)-2-фурамид. В 250-мл колбе суспендировали полученное на стадии В соединение (10 ммоль) в смеси хлороформ/вода (3/2). Добавляли при перемешивании карбонат калия (50 ммоль). Охлаждали реакционную смесь до 0 С с использованием ледяной бани и затем добавляли 2 фуроилхлорид (22 ммоль). Продолжали перемешивание при 0 С в течение 1 ч при комнатной температуре. Разделяли на две фазы. Промывали органическую фазу 1 М водным раствором соляной кислоты, а затем водой до тех пор,пока промывные воды не становились нейтральными, сушили его над сульфатом магния и упаривали при пониженном давлении. Перекристаллизовывали полученный остаток из ацетонитрила. Температура плавления: 179-180 С. 27 Пример 37. 2-Бром-N-[2-(7-4-[(8-2[(бромацетил)амино]этил-2-нафтил)окси]бутокси-1-нафтил)этил]ацетамид. Методика та же, что в примере 36, при замене на стадии С 2-фуроилхлорида на бромацетилхлорид. Температура плавления: 155-157 С. Пример 38. N-[2-(7-4-[(8-2-[(циклопропилкарбонил)амино]этил-2-нафтил)окси] бутокси-1-нафтил)окси]бутокси-1-нафтил) этил]циклопропанкарбоксамид. Методика та же, что в примере 36, при замене на стадии С 2-фуроилхлорида на циклопропанкарбонилхлорид. Температура плавления: 177-179 С. Пример 39. N-(2-7-[4-(8-[2-(3-бутеноиламино)этил]-2-нафтилокси)бутокси]-1 нафтилэтил)-3-бутенамид. Методика та же, что в примере 36, при замене на стадии С 2-фуроилхлорида на 3 бутеноилхлорид. Температура плавления: 146-148 С. Пример 40. N-(2-5-[4-(3-[2-(ацетиламино)этил]-1-бензотиен-5-илокси)бутокси]-1 бензотиен-3-илацетамид. В 250-мл круглодонной колбе растворяли соединение, полученное в получении 33, в ацетонитриле, добавляли карбонат калия и кипятили 30 мин. Частями добавляли 1,4-дибромбутан и кипятили 15 ч. Упаривали досуха, добавляли воду, фильтровали и перекристаллизовывали полученный осадок из диоксана. Температура плавления: 202-204 С. Пример 41. N-[2-(7-[8-(8-[2-(ацетиламино)этил]-2-нафтилокси)октил]окси-1-нафтил) этил]ацетамид. В 100-мл круглодонной колбе растворяли соединение, полученное в получении 1 (1,14 г, 5 ммоль), в 50 мл ацетонитрила. Добавляли карбонат калия (0,83 г, 6 ммоль) и перемешивали на магнитной мешалке при кипячении 30 мин. Затем добавляли по каплям 1,8-дибромоктан(0,25 мл, 2 ммоль) и кипятили 12 ч. Удаляли ацетонитрил упариванием при пониженном давлении. Растворяли полученный осадок в 1 М водном растворе гидроксида натрия. Отфильтровывали полученный осадок, промывали его водой и перекристаллизовывали из ацетонитрила. Температура плавления: 137-139 С. Пример 42. N-[2-(7-[10-(8-[2-(ацетиламино)этил]-2-нафтилокси)децил]окси-1 нафтил)этил]ацетамид. Методика та же, что в примере 40, при замене 1,8-дибромоктана на 1,10-дибромдекан. Температура плавления: 134-135 С. Пример 43. Метил 7-[4-(8-[2-(ацетиламино)этил]-2-нафтилокси)бутокси]-1-нафтил ацетат. 28 Стадия А. 2-(7-Гидроксинафт-1-ил)уксусная кислота. В 250-мл круглодонной колбе растворяли 2-(7-метоксинафт-1-ил)уксусную кислоту в уксусной кислоте. Добавляли бромистоводородную кислоту и кипятили реакционную смесь 4 ч. Удаляли уксусную кислоту и бромисто-водородную кислоту упариванием при пониженном давлении. Растворяли твердое вещество в воде и фильтровали на вакуумном фильтре. Промывали осадок петролейным эфиром и перекристаллизовывали его из толуола. Температура плавления: 151-152 С. Стадия В. Метил 2-(7-гидроксинафт-1-ил) этаноат. Растворяли полученное на стадии А соединение в 100 мл СН 2 Сl2. Охлаждали смесь на ледяной бане. Добавляли по каплям тионилхлорид и выдерживали реакционную смесь при этой температуре в течение 20 мин после добавления. Оставляли на 1 ч при комнатной температуре при перемешивании. Растворитель удаляли упариванием при пониженном давлении,затем добавляли метанол до завершения реакции и перекристаллизовывали полученное твердое вещество из смеси толуол/циклогексан (4/1). Температура плавления: 115 С. Стадия С. Метил 7-[4-(8-[2-(ацетиламино)этил]-2-нафтилокси)бутокси]-1 нафтилацетат. В 250-мл круглодонной колбе растворяли соединение в ацетонитриле, добавляли карбонат калия и кипятили реакционную смесь 30 мин. Добавляли бромистое соединение и кипятили в течение 12 ч. Фильтровали реакционную смесь на вакуумном фильтре. Фильтрат упаривали при пониженном давлении и растворяли полученное масло в эфире при перемешивании. Отфильтровывали полученный осадок и перекристаллизовывали его из метанола. Температура плавления: 109-110 С. Пример 44. 7-[4-(8-[2-(ацетиламино) этил]-2-нафтилокси)бутокси]-1 нафтилуксусная кислота. В 100-мл круглодонной колбе растворяли полученное в примере 43 соединение в ТГФ и добавляли метанол, воду и гидроксид натрия. Выдерживали реакционную смесь при комнатной температуре при перемешивании в течение 4 ч. Раствор концентрировали, гидролизовали и подкисляли концентрированной соляной кислотой. Фильтровали полученный осадок и перекристаллизовывали из смеси толуол/циклогексан (4/1). Температура плавления: 131-132 С. Пример 45. N-(2-7-[4-(8-[2-(ацетиламино)этил]-7-метокси-2-нафтилокси)бутокси]-2 метокси-1-нафтилэтил)ацетамид. Методика та же, что в примере 34, исходя из соединения, синтезированного в получении 35. 29 Пример 46. (2-5-[4-(3-[2-(Ацетиламино) этил]-1-метил-1 Н-пирроло[3,2-b]пиридин-5-ил окси)бутокси]-1-метил-1 Н-пирроло[3,2-b]пиридин-3-илэтил)ацетамид. Методика та же, что в примере 34, исходя из соединения, синтезированного в получении 32. Пример 47. N-(2-5-[4-(3-[2-(ацетиламино)этил]-1-метил-1 Н-пирроло[3,2-b]пиридин-5 илокси)пропокси]-1-метил-1 Н-пирроло[3,2-b] пиридин-3-илэтил)ацетамид. Методика та же, что в примере 34, исходя из соединения, синтезированного в получении 32, и при замене 1,4-дибромбутана на 1,3 дибромпропан. Пример 48. N-2-[5-3-[2-(ацетиламино) этил]-1 Н-индол-5-ил-1 Н-индол-3-ил]этил ацетамид. Методика та же, что в примере 25, при замене соединения, синтезированного в получении 24, на соединение, синтезированное в получении 33. Температура плавления: 237-238 С. Фармакологическое исследование Пример А. Исследование острой токсичности. Острую токсичность оценивали после перорального введения группам, каждая из которых состояла из 8 мышей (262 г). За животными наблюдали с регулярными интервалами в течение первых суток и ежедневно в течение 2 недель последующей обработки. ОпределялиLD50 (доза, вызывающая смерть 50% животных) и демонстрировали низкую токсичность соединения по изобретению. Пример В. Исследование связывания рецептора мелатонина на клетках pars tuberalis овцы. Исследования связывания рецептора мелатонина соединениями по изобретению проводили в соответствии с обычными методами на клетках pars tuberalis овцы. Фактически pars tuberalis аденогипофиза млекопитающих отличаются высокой плотностью рецепторов мелатонина (Journal of Neuroendocrinology, 1, рр. 1-4,1989). Протокол. 1) Овечьи pars tuberalis мембраны готовили и использовали в качестве ткани-мишени в опытах по поглощению для определения связывающих способностей и сродства к 2-[125I]йодмелатонину. 2) Овечьи pars tuberalis мембраны готовили и использовали в качестве ткани-мишени в опытах по конкурентному связыванию с использованием различных тестовых соединений в сравнении с мелатонином. Каждый опыт осуществляли трижды и для каждого соединения тестировали интервал различных концентраций. После статистической обработки эти результаты дают возможность 30 определить связывающее сродство тестируемого соединения. Результаты. По-видимому, соединения изобретения обладают сильным сродством к рецепторам мелатонина. Пример С. Исследование связывания mt1 и МТ 2 рецепторов мелатонина. Эксперименты по связыванию mt1 и МТ 2 рецепторов осуществляли с использованием 2[125I]-йодмелатонина в качестве контрольного лиганда. Удержанную радиоактивность определяли с использованием жидкостного сцинтилляционного счетчика. Затем проводили эксперименты по конкурентному связыванию с использованием различных тестируемых соединений. Для каждого соединения тестировали интервал различных концентраций. Результаты дают возможность определить связывающее сродство тестируемых соединений (IС 50). Так, значения (IC50), найденные для соединений изобретения, показывают связывание для того или иного подтипа mt1 и МТ 2 рецепторов,причем эти значения 10 мкМ. Пример D. Действие соединений изобретения на циркадные ритмы двигательной активности крысы. Участие мелатонина во влиянии на большинство физиологических, биохимических и поведенческих циркадных ритмов при чередовании день/ночь давало возможность создать фармакологическую модель для исследования мелатониновых лигандов. Влияние соединений исследуют относительно множества параметров и, в частности,относительно циркадных ритмов двигательной активности, которые являются надежным индикатором активности эндогенных циркадных часов. В этом исследовании оценивали влияние таких соединений на конкретную экспериментальную модель, а именно, на крысу, помещенную во временную изоляцию (постоянная темнота). Протокол эксперимента. Самцов крыс в возрасте одного месяца подвергали, как только они появлялись в лаборатории, световому циклу в 12 ч света за 24 ч(СТ 12:12). Спустя 2-3 недели адаптации их помещали в клетки, снабженные колесом, соединенным с записывающей системой, для того, чтобы определить фазы двигательной активности и таким образом проконтролировать нихтемеральный(СТ) или циркадный (ТТ) ритмы. Как только записанные ритмы показывали стабильный пример дневного цикла СТ 12:12,крыс помещали в постоянную темноту (ТТ). Спустя 2-3 недели, когда был ясно установлен свободный порядок (ритм, отражающий 31 ритм эндогенных часов), крысам ежедневно вводили тестируемое соединение. Наблюдения проводили путем визуализации ритмов активности- влияние светового ритма на ритмы активности,- исчезновение влияния на эти ритмы в полной темноте,- влияние при ежедневном введении соединения; временное или длительное влияние. Программное обеспечение дало возможность- измерить продолжительность и интенсивность этой активности, период ритма животных в течение свободного порядка и во время обработки,- возможность показать методом спектрального анализа существование циркадного и нециркадного (например, ультра-) компонентов. Результаты. С очевидностью показано, что соединения по изобретению обладают значительным действием на циркадный ритм через мелатонинергическую систему. Пример Е. Тест в светлой/темной клетке. Соединения по изобретению исследовали на поведенческой модели, тесте в светлой/темной клетке, дающей возможность выявить успокаивающую активность соединений. Оборудование состояло из 2 поливиниловых коробок, покрытых плексигласом. Одна из коробок находилась в темноте. Над другой коробкой помещали лампу, получая интенсивность света в центре коробки приблизительно в 4000 люкс. Светлую коробку отделял от темной коробки светонепроницаемый пластмассовый туннель. Животных тестировали индивидуально в течение 5-минутной сессии. Пол каждой клетки чистили перед каждой сессией. В начале каждого теста мышь помещали в туннель лицом к темной коробке. Время, проведенное мышью в освещенной коробке, и число прохождений через туннель, регистрировали после первого прохождения в темную коробку. После введения соединений за 30 мин до начала теста соединения по изобретению существенно увеличивали время, проведенное в освещенной клетке, и число прохождений через туннель, что показывает успокаивающую активность соединений изобретения. Пример F. Активность соединений изобретения по отношению к каудальной артерии крысы. Соединения изобретения тестировали invitro на каудальной артерии крысы. В этих сосудах имеются рецепторы мелатонина, предоставляя, таким образом, подходящую фармакологическую модель для изучения активности мелатонинового лиганда. Раздражение этих рецепторов может вызвать либо сужение кровеносных сосудов, либо расширение, в зависимости от исследуемого артериального сегмента. 32 Протокол. Одномесячных крыс приучили к циклу свет/темнота в 12 ч/12 ч за период от 2 до 3 недель. После умерщвления каудальную артерию извлекали и выдерживали в среде, сильно насыщенной кислородом. Затем артерии канюлировали с обоих концов, подвешивали вертикально в камере для органов в подходящей среде и заливали через их проксимальные концы. Изменения давления в залитом потоке дало возможность оценки сосудосуживающего или сосудорасширяющего эффекта этих соединений. Активность соединений оценивали на сегментах, которые были предварительно сокращены фенилэфрином (1 мкМ). Кривую концентрация/отклик определили не кумулятивно при добавлении концентрации тестового соединения к предварительно сокращенному сегменту. Когда наблюдаемый эффект достигал равновесия,среду поменяли и оставили препарат на 20 мин перед добавлением той же концентрации фенилэфрина и дополнительной концентрации тестового соединения. Результаты. Соединения изобретения значительно изменяют диаметр каудальных артерий, сокращенных предварительно фенилэфрином. Пример G. Фармацевтическая композиция - таблетки. 1000 таблеток, содержащих 5-мг дозу N-(27-[4-(8-[2-(ацетиламино)этил]-2-нафтилокси) бутокси]-1-нафтилэтил)ацетамида (пример 12),20 г пшеничного крахмала, 20 г кукурузного крахмала, 30 г лактозы, 2 г стеарата магния, 1 г двуокиси кремния, 2 г гидроксипропилцеллюлозы. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения формулы (I)A-G1-Cy-G2-Cy-G3-B где А представляет собой группы формулы-NHC(Q)R1 или -NHC(Q)NHR2,где Q обозначает атом кислорода или серы,R1 обозначает линейную или разветвленную (С 1-С 6)алкильную группу, замещенную или незамещенную атомом галогена, линейную или разветвленную (С 2-С 6)алкенильную группу, (С 3 С 8)циклоалькильную группу, арильную или гетероарильную группу,R2 обозначает линейную или разветвленную (С 1-С 6)алкильную группу,В представляет собой группы формулы-NHC(Q)R1, -NHC(Q)NHR2, -NHC(Q)OR2,-C(Q)OR3 или -NHR3,где R1 и R2 имеют приведенные выше значения и R3 обозначает атом водорода, линейную или разветвленную (С 1-С 6)алкильную группу,G1 и G3, которые могут быть одинаковыми или разными, означают линейный или разветв 33 ленный алкилен с цепью, содержащей 1-4 атома углерода,Су означает циклическую структуру формулы (II) где X и Y, которые могут быть одинаковыми или различными, представляют собой атом углерода, СН или СН 2 группу,R4 означает атом водорода или галогена,или CF3, гидрокси, карбокси, формил, амино,NHRa, NRaRa1, NHCORa, CONHRa, Ra, ORa,CORa или COORa группу (где Ra имеет такие же значения как и R1, который определен выше, и также может означать атом водорода и Ra1 могут иметь любое значение Ra),символ - - - означает, что связи являются ординарными или двойными, при условии соблюдения валентности атомов,где G2 является заместителем бензольного кольца и G1 (и G3 соответственно) является заместителем кольца, содержащего X и Y,циклическую структуру формулы (III) где Z представляет собой атом серы или кислорода, или NH, NSO2Ph или NRa группу (Ra определен выше),D является бензольным или пиридиновым кольцом,следует учесть, что когда D является пиридиновым кольцом, тогда Z означает NH, NSO2Ph илиNRa группу,R4 определен выше,когда G2 является заместителем кольца D и G1(и G3 соответственно) является заместителем кольца, содержащего Z,символ - - - означает, что связь является одинарной или двойной, при условии, что валентность атомов соблюдена,следует учесть, что два кольца (Су) соединения формулы (I) представляют собой одну и ту же циклическую структуру (индол/индол, нафталин/нафталин, бензофуран/бензофуран и т.д.),но заместитель R4 может быть различным,G2 представляет собой цепь формулы (IV) где W1 и W3, которые могут быть одинаковыми или различными, представляют собой связь,атом кислорода или серы, или -NH группу,W2 означает связь или атом кислорода,n является целым числом, где 0n6,m является целым числом, где 0m6,при условии, что не может быть двух последовательных гетероатомов и что определенная таким образом цепь формулы (IV) может содержать одну или более насыщенных связей, 003300 34 где соединение формулы (I) не может представлять собой диэтил 2-(ацетиламино)-2-[5-(3-[(2 ацетиламино)-3-этокси-2-(этоксикарбонил)-3 оксопропил]-1 Н-индол-5-илметил)-1H-индол 3-ил]метилмалонат илиN-2-[5-(3-[2-(ацетиламино)этил]-1 Ниндол-5-илметил)-1 Н-индол-3-ил]этилацетамид,под "арилом" имеются в виду нафтильная,фенильная и бифенильная группы,под "гетероарилом" имеются в виду любая насыщенная или ненасыщенная моно- или бициклическая группа, содержащая от 5 до 10 атомов и содержащая от 1 до 3 гетероатомов,выбранных из азота, серы или кислорода,возможно, чтобы "арильная" и "гетероарильная" группы были замещены одним или несколькими одинаковыми или различными радикалами, выбранными из гидрокси, карбокси, линейного или разветвленного (С 1-С 6) алкокси, линейного или разветвленного (С 1 С 6)алкила, полигалоген(С 1-С 6)алкила, в котором алкильная часть является линейной или разветвленной, формила, циано, нитро, амино, линейного или разветвленного (С 1-С 6)алкиламино,ди-(С 1-C6)алкиламино, в котором каждая алкильная часть является линейной или разветвленной, или из атомов галогена,их энантиомеры и диастереомеры и их соли присоединения фармацевтически приемлемой кислоты и основания. 2. Соединения формулы (I) по п.1, где Су представляет собой циклическую структуру формулы (II), их энантиомеры и диастереомеры и их соли присоединения фармацевтически приемлемой кислоты или основания. 3. Соединения формулы (I) по п.1, где Су представляет собой нафталин, их энантиомеры и диастереомеры и их соли присоединения фармацевтически приемлемой кислоты или основания. 4. Соединения формулы (I) по п.1, где Су представляет собой циклическую структуру формулы (III), их энантиомеры и диастереомеры и их соли присоединения фармацевтически приемлемой кислоты или основания. 5. Соединения формулы (I) по п.1, где Су представляет собой бензотиофен или бензофуран, их энантиомеры и диастереомеры и их соли присоединения фармацевтически приемлемой кислоты или основания. 6. Соединения формулы (I) по п.1, где Су представляет собой индол, их энантиомеры и диастереомеры и их соли присоединения фармацевтически приемлемой кислоты или основания. 7. Соединения формулы (I) по п.1, где Су представляет собой азаиндол, их энантиомеры и диастереомеры и их соли присоединения фар 35 мацевтически приемлемой кислоты или основания. 8. Соединения формулы (I) по п.1, где G2 представляет собой одинарную связь, их энантиомеры и диастереомеры и их соли присоединения фармацевтически приемлемой кислоты или основания. 9. Соединения формулы (I) по п.1, где G2 представляет собой группу -W4-(CH2)p-W'4-, гдеW4 и W'4, которые могут быть одинаковыми или различными, представляют собой атом кислорода или серы, или NH, а р является целым числом, где 1p12, их энантиомеры и диастереомеры и их соли присоединения фармацевтически приемлемой кислоты или основания. 10. Соединения формулы (I) по п.1, где G2 представляет собой группу -О-(СН 2)р-О-, где р является целым числом, где 1 р 12, их энантиомеры и диастереомеры и их соли присоединения фармацевтически приемлемой кислоты или основания. 11. Соединения формулы (I) по п.1, где G2 представляет собой группу -W4-(CH2)p,-W'4(CH2)p"-W"4-, где W4, W'4 и W"4, которые могут быть одинаковыми или различными, представляют собой атом кислорода или серы, или NH, а р' и р" являются целыми числами, где 2 р' + р"12, их энантиомеры и диастереомеры и их соли присоединения фармацевтически приемлемой кислоты или основания. 12. Соединения формулы (I) по п.1, где G2 представляет собой группу -О-(СН 2)р-О-(СН 2)р"О-, где р' и р" определены выше, их энантиомеры и диастереомеры и их соли присоединения фармацевтически приемлемой кислоты или основания. 13. Соединения формулы (I) по п.1, в которых А и В, которые могут быть одинаковыми или различными, представляют собой группуNR1C(Q)R2 и C(Q)NR2R3, их энантиомеры и диастереомеры и их соли присоединения фармацевтически приемлемой кислоты или основания. 14. Соединения формулы (I) по п.1, представляющие собойN-(2-7-[4-(8-[2-(ацетиламино)этил]-7 метокси-2-нафтилокси)бутокси]-2-метокси-1 нафтилэтил)ацетамид,и их соли присоединения фармацевтически приемлемой кислоты или основания. 15. Соединение формулы (I) по п.1, представляющее собой N-[2-(7-2-[2-(8-[2-(ацетиламино)этил]-2-нафтилокси)этокси]этокси-1 нафтил)этил]ацетамид и его соли присоединения фармацевтически приемлемой кислоты или основания. 16. Соединения формулы (I) по п.1, представляющие собойN-(2-7-[4-([8-[2-(3-бутеноиламино)этил]2-нафтил]окси)бутокси]-1-нафтилэтил)-3 бутенамид и их соли присоединения фармацевтически приемлемой кислоты или основания. 17. Соединение формулы (I) по п.1, представляющее собой N-(2-7-[4-([8-[2-(ацетиламино)этил]-5,6,7,8-тетрагидро-2-нафталенил]окси) бутокси]-1,2,3,4-тетрагидро-1-нафталенилэтил) ацетамид, его энантиомеры и диастереоизомеры и его соли присоединения фармацевтически приемлемой кислоты или основания. 18. Соединения формулы (I) по п.1, представляющее собой N-2-[5-(4-[3-[2-(ацетиламино)этил]-1-(фенилсульфонил)-1 Н-индол-5 ил]оксибутокси)-1-(фенилсульфонил)-1 Ниндол-3-ил]оксиэтилацетамид и N-(2-5-[4-([3[2-(ацетиламино)этил]-1 Н-индол-5-илокси) бутокси]-1 Н-индол-3-илэтил)ацетамид, и их соли присоединения фармацевтически приемлемой кислоты или основания. 19. Соединения формулы (I) по п.1, представляющие собой N-(2-5-[4-([3-[2-(ацетиламино)этил]-1-бензофуран-5-ил]окси)бутокси]1-бензофуран-3-илэтил)ацетамид и N-(2-5-[4([3-[2-(ацетиламино)этил]-1-бензотиен-5-ил] окси)бутокси]-1-бензотиен-3-илэтил)ацетамид,и их соли присоединения фармацевтически приемлемой кислоты или основания. 20. Соединения формулы (I) по п.1, представляющие собой N-(2-5-[4-([3-[2-(ацетиламино)этил]-1-метил-1 Н-пирроло[3,2-b]пиридин-5-илокси)бутокси]-1-метил-1 Н-пирроло[3,2-b]пиридин-3-илэтил)ацетамид и N-(2-[5[4-(3-[2-(ацетиламино)этил]-1-метил-1 Н-пирроло[3,2-b]пиридин-5-илокси)пропокси]-1 37 метил-1 Н-пирроло[3,2-b]пиридин-3-ил]этил) ацетамид и их соли присоединения фармацевтически приемлемой кислоты или основания. 21.Соединение формулы (I) по п.1, представляющее собой N-[2-8-[2-(ацетиламино) этил]-2-нафтилэтил]ацетамид и его соли присоединения фармацевтически приемлемой кислоты или основания. 22. Соединение формулы (I) по п.1, представляющее собой N-2-[5-3-[2-(ацетиламино) этил]-1 Н-индол-3-ил-1 Н-индол-3-ил]этил ацетамид и его соли присоединения фармацевтически приемлемой кислоты или основания. 23. Способ получения соединений формулы (I) по п.1, отличающийся тем, что в качестве исходного вещества используют соединение формулы (V)A-G1-Cy-OMe где A, G1 и Су определены для формулы (I),которое подвергают деметилированию с использованием обычных агентов, таких как НВr, АlСl3, АlВr3, ВВr3 или двойные системы кислота Льюиса/нуклеофил, например, такие как AlCl3/PhCH2SH или BBr3/Me2S, с получением соединения формулы (VI)A-G1-Cy-OH где A, G1 и Су определены выше,которое преобразуют обычным образом,например, путем воздействия N,N-диметилтиокарбамата натрия до соответствующего тиола формулы (VII)A-G1-Cy-SH где A, G1 и Су определены выше,или до соответствующего производного амина формулы (VIII)A-G1-Cy-NHR1a где A, G1 и Су определены выше, и R'a может иметь любое из значений Ra, определенных для формулы (I), и может также являться атомом водорода,причем соединения формул (VI), (VII) и(VIII) представляют соединение формулы (IX)A-G1-Cy-W4H где W4 является атомом кислорода или серы илиNH или NRa группой (где Ra определено выше),соединение формулы (IX), которое конденсируют с соединением формулы (X) где Hal представляет собой атом брома, хлора или йода, и n, W2 и m определены для формулы(I), при условии, что не может быть двух последовательных гетероатомов и что определенная таким образом цепь может иметь одну или несколько ненасыщенных связей,или соединение формулы (XI) где Hal, W2, n и m определены выше, a Alk представляет собой алкильный радикал (с условием, что не может быть двух последователь 003300 38 ных гетероатомов и что определенная таким образом цепь может иметь одну или несколько ненасыщенных связей), с последующим восстановлением,с получением соединения формулы (XII)A-G1-Cy-W4-(CH2)n-W2-(CH2)m-OH где A, G1, Су, W2, W4, n и m определены для формулы (I), при условии, что в цепи W4-(CH2)nW2-(CH2)m-OH не может быть двух последовательных гетероатомов и что определенная таким образом цепь может иметь одну или несколько ненасыщенных связей) гидроксильную группу которого преобразуют обычным образом в удаляемую группу,например, такую как мезилат, тозилат или галогеновое производное, с образованием соединения формулы (XII')A-G1-Cy-W4-(CH2)n-W2-(CH2)m-E где A, G1, Су, W2, W4, n и m определены выше, и Е является мезильной или тозильной группой или атомом галогена,которое подвергают воздействию соединения формулы (XIII)B-G3-Cy-W4'H где В, G3 и Су такие, как определены для формулы (I), a W4' может иметь те же значения, что и W4, определенное выше,с получением соединения формулы (I/a),частного случая соединений формулы (I)A-G1-Cy-W4-(CH2)n-W2-(CH2)m-W4'-Cy-G3-B (I/a) где A, G1, Су, W4, n, W2, m, W4', G3 и В определены выше,(причем соединения формулы (I/a), где группы A-G1-Cy-W4- и W4'-Cy-G3-B одинаковы,можно получить непосредственно из соединения формулы (IX), которое конденсируют в основной среде с соединением формулы (X') где Hal, n, m и W2 определены выше),или преобразуют с использованием, например,фенил бис(трифторметансульфонимида) в основной среде до соответствующего трифторметансульфоната формулы (XIV)A-G1-Cy-OSO2CF3 где A, G1 и Су определены выше,которое подвергают в условиях катализа подходящим соединением палладия воздействию производного борной кислоты (RbB(OH)2) или производного олова (RbSnBu3) (где Rb является группой формулы (XV)B-G3-Cy-W3-(CH2)m-W2-(CH2)n-CH2 (XV) где В, G3, Су, W3, m, W2 и n определены выше,при условии, что в цепи -W3-(CH2)m-W2- не может быть двух последовательных гетероатомов и определенная таким образом цепь может иметь одну или несколько ненасыщенных связей),с получением соединения формулы (I/b),частного случая соединений формулы (I) где А, G1, Су, n, W2, m, W3, G3 и В определены выше (при условии, что в цепи -W2-(CH2)m-W3 не может быть двух последовательных гетероатомов и определенная таким образом цепь может иметь одну или несколько ненасыщенных связей,причем соединения формулы (I/с), частный случай соединений формулы (I)A-G1-Cy-W1-(CH2)n-W2-(CH2)m-W3-Cy-G3-B (I/c) где A, G1, Су, W1, n, W2, m, G3 и В определены выше, при условии, что в цепи -W1-(CH2)n-W2 не может быть двух последовательных гетероатомов и определенная таким образом цепь может иметь одну или несколько ненасыщенных связей),получены по аналогичной методике, исходя из соединений формулы (XIV)B-G3-Cy-OSO2CF3 где В, G3 и Су определены выше,или обрабатывают в условиях сочетания с использованием, например, соединений никеля или палладия соединением формулы (XIV) с получением при этом соединения формулы (I/d),частного случая соединений формулы (I)A-G1-Cy-Cy-G3-B где A, G1, Су, G3 и В определены выше,все соединения от (I/а) до (I/d), составляющие соединения формулы (I), которые при желании можно очистить обычными методами очистки, разделяют, где это необходимо, на изомеры с помощью обычного способа разделения и переводят, при необходимости, в соли их присоединения фармацевтически приемлемой кислоты или основания.A-G1-Cy-W4-(CH2)n-W2-(CH2)m-E' где A, G1, Су, W2, W4, n и m определены выше и Е' является гидроксильной или атомом галогена(фтор, хлор, бром или йод), при условии, что когда Су представляет собой нафталин, и когда одновременно G1-A представляет собой илиNR C(Q)NR2-R3- (где R1, R2 и R3 определены выше), цепь -W4-(CH2)n-W2-(CH2)m- не может представлять собой O-алкильную цепь,соединение формулы (XII") не может представлять собой N-2-[5-(2-гидроксиэтокси)1 Н-индол-3-ил]этилацетамид,их энантиомерам и диастереомерам и к их солям присоединения к фармацевтически приемлемым кислоте или основанию,в качестве промежуточных соединений синтеза, а также в качестве соединений для использования при лечении заболеваний, связанных с мелатонинергической системой. 25. Фармацевтическая композиция, содержащая в качестве активного ингредиента, по меньшей мере, одно соединение формулы (I) по любому из пп.1-22 или 24 или его фармацевтически приемлемую соль прибавления кислоты или основания в сочетании с одним или несколькими фармацевтически приемлемыми эксципиентами. 26. Фармацевтическая композиция по п.25 для использования при получении лекарственного средства для лечения заболеваний, связанных с мелатонинергической системой.
МПК / Метки
МПК: C07C 233/72, A61K 31/353, C07D 403/12
Метки: фармацевтическая, композиция, содержащая, димерные, замещенные, соединения, получения, новые, способ
Код ссылки
<a href="https://eas.patents.su/21-3300-novye-zameshhennye-dimernye-soedineniya-sposob-ih-polucheniya-i-soderzhashhaya-ih-farmacevticheskaya-kompoziciya.html" rel="bookmark" title="База патентов Евразийского Союза">Новые замещенные димерные соединения, способ их получения и содержащая их фармацевтическая композиция</a>

























