Энантиоселективный синтез промежуточных соединений для получения азетидинонов
Номер патента: 6898
Опубликовано: 28.04.2006
Авторы: Фу Ксиаойонг, Тирувенгадам Т.К., Тэнн Чоу-Хонг, Макаллистер Тимоти Л.
Формула / Реферат
1. Способ получения соединения формулы I
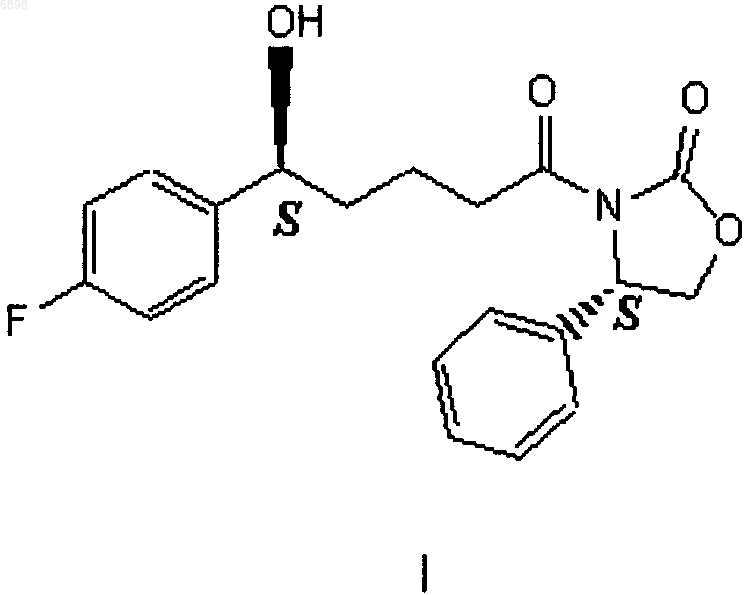
который включает стадии:
а) смешивания соединения формулы II
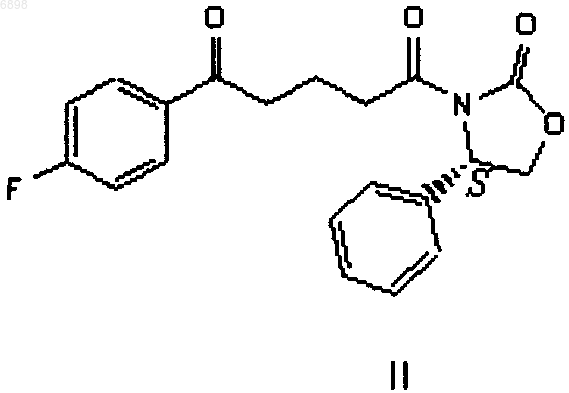
с тетрагидрофураном в присутствии кислоты или альтернативно с тетрагидрогидрофураном в отсутствие кислоты с образованием смеси;
b) комбинирования смеси стадии а) с катализатором, выбираемым из или (А) соединения, входящего в группу соединений, представленных формулой III, или (В) соединения формулы IV

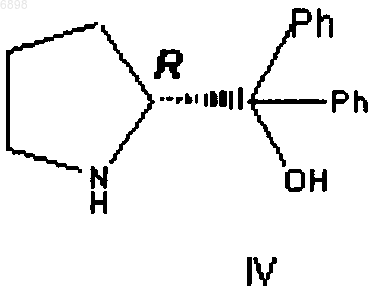
где R1 в формуле III означает (C1-C6)-алкил и где R и S определяют стереохимию хирального углерода;
c) восстановления кетона, соседнего с п-фторфенилом с помощью комплекса борантетрагидрофуран; и
d) прекращения реакции с помощью МеОН.
2. Способ по п.1, в котором кислота, используемая на стадии а), представляет собой ВF3ЧOEt2, ВСl3, п-толуолсульфоновую кислоту, трифторуксусную кислоту, метансульфоновую кислоту или камфорсульфоновую кислоту.
3. Способ по п.2, в котором катализатор формулы IV используют в присутствии триалкилбората.
4. Способ по п.3, в котором триалкилборат является триметилборатом.
5. Способ по п.2, в котором указанная кислота присутствует в соотношении 1-10 мол.% по отношению к указанному соединению формулы II.
6. Способ по п.2, в котором указанная кислота присутствует в соотношении 1-5 мол.% по отношению к указанному соединению формулы II.
7. Способ по п.2, в котором указанная кислота присутствует в соотношении 2-3 мол.% по отношению к указанному соединению формулы II.
8. Способ по п.1, в котором указанный катализатор присутствует в соотношении 0,1-10 мол.% по отношению к указанному соединению формулы II.
9. Способ по п.1, в котором указанный катализатор присутствует в соотношении 1-5 мол.% по отношению к указанному соединению формулы II.
10. Способ по п.1, в котором указанный катализатор присутствует в соотношении 2-3 мол.% по отношению к указанному соединению формулы II.
11. Способ по п.1, в котором температура на стадии восстановления с) составляет от -15 до 65шС.
12. Способ по п.1, в котором температура на стадии восстановления с) составляет от -10 до 55шС.
13. Способ по п.1, в котором температура на стадии восстановления с) составляет от 0 до 30шС.
14. Способ по п.1, в котором температура на стадии восстановления с) составляет от 23 до 28шС.
15. Способ по п.1, в котором на стадии а) присутствует кислота.
16. Способ по п.1, в котором на стадии а) отсутствует кислота.
17. Способ по п.16, в котором температура на стадии восстановления с) составляет от 23 до 28шС.
18. Способ по п.16, в котором указанный катализатор представлен в соотношении 0,1-10 мол.% по отношению к указанному соединению формулы II.
19. Способ по п.16, в котором указанный катализатор представлен в соотношении 1-5 мол.% по отношению к указанному соединению формулы II.
20. Способ по п.16, в котором указанный катализатор представлен в соотношении 2-3 мол.% по отношению к указанному соединению формулы II.
21. Соединение формулы I
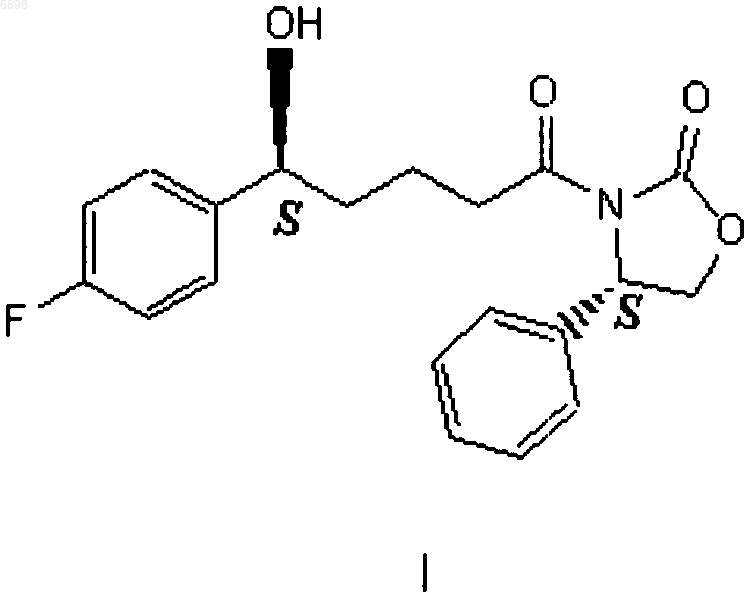
полученное способом по п.15.
22. Соединение формулы I

полученное способом по п.16.
Текст
006898 Предпосылки изобретения Это изобретение относится к способу синтеза промежуточных соединений, используемых для получения гидроксиалкилзамещенных азетидинонов. Гидроксиалкилзамещенные азетидиноны, например 1-(4-фторфенил)-3(R)-[3(S)-гидрокси-3-(4-фторфенил)пропил)]-4(S)-(4-гидроксифенил)-2-азетидинон,описаны в патенте US5767115. Эти соединения используют в качестве гипохолестеролемических агентов при лечении и предупреждении атеросклероза. Способ получения соответствующих азетидинонов, не содержащих 3-гидроксизаместителей, описан в патентах US5728827 и US5561227. Другие способы получения 1-(4-фторфенил)-3(R)-[3(S)гидрокси-3-(4-фторфенил)пропил)]-4(S)-(4-гидроксифенил)-2-азетидинона описаны в патентах US5631365, US5739321 и US6207822 B1 (патент '822). Что касается способа, описанного в патенте '822, то промежуточное соединение формулы I, защищено подходящей гидроксизащитной группой, например силильной защитной группой, такой как группа, полученная из хлортриметилсилана (ТМССl) или трет-бутилдиметилсилилхлорида (ТБДМССl). Этот силилированный продукт далее реагирует с силилэнолом или силилирующим агентом, таким как бистриметилсилил ацетамид (БСА). Затем добавляют циклизующий агент, такой как фтористая соль четвертичного алкил-, арил-алкил- или арилалкил-алкиламмония, для того чтобы вызвать внутримолекулярную циклизацию предварительно силилированного соединения формулы I. В заключение защитную группу убирают от циклизованного соединения, используя известные методы, такие как обработка разбавленной кислотой, для того чтобы получить гипохолестеролемические азетидиноны формулы Краткое описание изобретения Изобретение предлагает улучшенный, простой, обеспечивающий высокий выход способ получения промежуточных соединений, необходимых для получения азетидинонов. Промежуточное соединение формулы I получают способом, который включает в себя стадии: а) смешивания соединения формулы II с тетрагидрофураном в присутствии кислоты или альтернативно смешивания с тетрагидрофураном в отсутствии кислоты для образования смеси;b) комбинирования смеси стадии а) с катализатором, выбираемым из или (А) соединения, выбранного из группы соединений, представленных формулой III, или (В) соединения формулы IV где R1 в формуле III означает (C1-C6)-алкил и где R и S указывают на стереохимию у хирального углерода;c) восстановления кетона соседнего с п-фторфенилом с помощью комплекса борантетрагидрофуран; иd) прекращения реакции с помощью МеОН. Детальное описание В качестве одного из воплощений изобретения здесь описан способ получения соединений формулы I который включает стадии (а)-(d), описанные выше. В предпочтительном воплощении изобретения способ включает стадии:a) смешивания соединения формулы II с тетрагидрофураном в присутствии кислоты с образованием смеси;b) комбинирования смеси стадии а) с катализатором, выбираемым из или (А) соединения, выбираемого из группы соединений, представленных формулой III, или (В) соединения формулы IV где R1 в формуле III означает (C1-C6)-алкил и где R и S определяют стереохимию хирального углерода;d) прекращения реакции с помощью МеОН. Кроме уточнений, сделанных выше, следующие уточнения введены в описание и формулу изобретения. Эти уточнения применимы независимо от того, используется ли термин сам по себе или в сочетании с другими терминами. Так термин "алкил" применим как к "алкилу" самому, так и к "алкилу", входящему частью в другой термин, "алкокси", "алкиламино" и тому подобные."Алкил" представляет собой линейную или разветвленную насыщенную углеводородную цепь,включающую указанное число атомов углерода. Там, где число атомов углерода не указано, имеют в виду от 1 до 6 атомов углерода. Кислоту для стадии а) выбирают из группы, включающей BF3OEt2, ВСl3, п-толуолсульфоновую кислоту, трифторуксусную кислоту, метансульфоновую кислоту и камфорсульфоновую кислоту. Если используют катализатор формулы IV, то его следует использовать в присутствии триалкилбората, предпочтительно триметилбората. В другом воплощении данного изобретения соотношение кислоты и соединения формулы II составляет 1-10 мол.%, предпочтительно 1-5 мол.%, более предпочтительно 2-3 мол.%. Еще в одном воплощении данного изобретения соотношение катализатора и соединения формулы II на стадии b) составляет 0,1-10 мол.%, предпочтительно 1-5 мол.%, более предпочтительно 2-3 мол.%. В другом воплощении данного изобретения температура на восстановительной стадии с), как правило, составляет от -15 до 65 С, предпочтительно от -10 до 55 С, более предпочтительно от 0 до 30 С и обычно от 23 до 28 С.-2 006898 Еще в одном воплощении изобретения описан способ получения соединения формулы I в котором не используют кислоту на стадии (а). Способ таким образом включает стадии:a) растворения соединения формулы II в тетрагидрофуране с образованием смеси;b) комбинирования смеси стадии а) с катализатором, выбранным из или (А) соединения, выбранного из группы соединений, представленных формулой III, или (В) соединения формулы IV где R1 в формуле III означает (C1-C6)-алкил и где R и S определяют стереохимию хирального углерода;d) прекращения реакции с помощью МеОН. В предпочтительном воплощении альтернативного способа (при отсутствии кислоты на стадии а,описанного непосредственно выше, температура стадии восстановления с) составляет от 23 до 28 С. В другом воплощении альтернативного способа (при отсутствии кислоты на стадии (а, описанного непосредственно выше, соотношение катализатора и соединения формулы II на стадии b) составляет 0,110 мол.%, предпочтительно 1-5 мол.%, более предпочтительно 2-3 мол.%. Данное изобретение предлагает новый способ химически селективного и стереоселективного восстановления кетона соседнего с п-фторфенилом, используя ВН 3-ТГФ-комплекс. В патенте US6207822B1 ('822 патент), содержание которого включено здесь в виде ссылки, описано восстановление такого кетона при применении ВН 3 Me2S (БМС) комплекса в качестве восстанавливающего агента. Однако применение этого БМС комплекса может вести к проблемам, связанным с окружающей средой. Замена БМС на комплекс борана с тетрагидрофураном устраняет выделения, вредные для окружающей среды,возрастающие при использовании БМС комплекса. Однако простая замена ВН 3 Me2S на ВН 3-ТГФ при восстановлении приводит к существенному вкладу избыточного восстановления амидной связи по сравнению с восстановлением кетона, соседнего с п-фторфенилом, что приводит к низкой селективности. Так первоначальные эксперименты с ВН 3-ТГФ дают нужный процент желательного энантиомера (SS) по сравнению с нежелательным энантиомером(SR), но выход раствора не оптимален в связи с получением вышеупомянутого избыточно восстановленного побочного продукта из амида. В данном способе найдены такие вещества, которые изменяют последовательность присоединения, что позволяет преодолеть низкую хемоселективность при восстановлении. Получение избыточно восстановленного побочного продукта из амида было значительно понижено и в то же время это привело к высокой диастереоселективности продукта.-3 006898 Новый способ связан с добавлением ВН 3-ТГФ к раствору соединения формулы II и (R)-тетрагидро 1-метил-3,3-дифенил-1H,3 Н-пирроло[1,2-с][1,3,2]оксазаборолидин-(обозначенного как (R)-МеСБС) катализатора в ТГФ (от фирмы Sigma-Aldrich, St. Louis, Missouri, США). В нескольких экспериментах получены результаты, в которых избыточно восстановленный побочный продукт был минимизирован до 1% с диастереоселективностью, равной 97:3. Фактически молярный эквивалент (экв.) ВН 3-ТГФ выдерживался в 0,6 экв., тогда как выход в мол.%, как правило, превышал 97%. Аналогичные результаты достигаются с катализатором, полученным "in-situ" при использовании соединения формулы IV (Rдифенилпролинол) и триметилбората (см. М. Masui, Т. Shioiri, Synlett, 1997, 273). Следующие примеры получения соединения формулы I иллюстрируют данное изобретение, однако,данное изобретение не ограничивается этими примерами. Специалистам ясно, что различные варианты предлагаемого способа с другими реагентами могут быть осуществлены в пределах объема данного изобретения. Растворы продуктов, приведенные в следующих примерах (которые содержат соединение формулы I), могут быть непосредственно использованы в последующих стадиях способа получения гидроксиалкилзамещенных азетидинонов или альтернативно соединения формулы I могут быть кристаллизованы или выделены другими методами, известными специалистам. Примеры Сокращенные обозначения, использованные в описании схем, препаратов и образцов приведены ниже.(R)-МеСБС = (R)-тетрагидро-1-метил-3,3-дифенил-1H,3 Н-пирроло-[1,2-с][1,3,2]оксазаборолидин,ТГФ = тетрагидрофуран,ЖХВР = жидкостная хроматография высокого разрешения,МеОН = метанол,атм. = атмосфера,мл = миллилитр,г = грамм,ПТСК = п-толуолсульфоновая кислота,КСК = (IS)-(+)-10-камфорсульфоновая кислота,ТФУК = трифторуксусная кислота,разн. = разность между SS % и SR %. Пример 1 (кислота отсутствует на стадии (а. Пятьдесят (50) г соединения формулы II загружают в трехгорлую 1000 мл круглодонная колбу, оснащенную термометром, устройством для напуска N2 и дополнительной воронкой. Загружают 500 мл ТГФ для растворения 50 г соединения формулы II при температуре от 20 до 25 С. Загруженную смесь концентрируют при 1 атм до объема около 150 мл. Температуру поддерживают от 20 до 25 С. Добавляют 4,2 мл приготовленного лабораторно (R)-МеСБС катализатора в толуоле (3 мол.%). Медленно в течение 1,5 ч добавляют 70,4 мл 1 М раствора боран-ТГФ комплекса в ТГФ (фирмы Aldrich Chemical Company,Milwaukee, Wisconsin, США) при температуре между 23-28 С. Для мониторинга хода реакции с помощью ЖХВР берут пробы смеси. После того как реакция завершена медленно добавляют 20 мл МеОН для поддержания температуры ниже 25 С с целью прекращения реакции. Реакционную смесь концентрируют под вакуумом до достижения объема смеси около 100 мл при температуре ниже 40 С. Добавляют 250 мл толуола и раствор 5 мл серной кислоты в 100 мл воды. Смесь перемешивают около 10 мин и дают ей отстояться. Отделяют нижний кислотный слой. Дважды промывают оставшуюся смесь. Затем концентрируют под вакуумом при температуре ниже 50 С до достижения объема около 100 мл. Результаты варьируются, но, как правило, выход составляет 99 и 95% разн. Пример 2 (в присутствии кислоты (ПТСК) на стадии (а. Пятьдесят (50) кг соединения формулы II и 0,8 кг п-толуолсульфоновой кислоты (ПТСК) загружают в 300 галлонный (1135,5 л) стеклянный футерованный реактор, оснащенный термопарой, усройством для напуска N2 и питательным резервуаром. Загружают 267 кг безводного ТГФ для растворения 50 кг соединения формулы II и п-толуолсульфоновой кислоты при температуре от 20 до 25 С. Эту смесь концентрируют при 1 атм до объема 185 л. Температуру поддерживают от 20 до 25 С. Затем к этой смеси добавляют 200 л ТГФ. Смесь концентрируют при 1 атм до объема 185 л. Температуру поддерживают от 20 до 25 С. Добавляют 3,4 кг предварительно подготовленного (R)-МеСБС катализатора в толуоле (3 мол.%). 70,3 кг 1 М раствора боран-ТГФ комплекса в ТГФ медленно, в течение 1,5 ч добавляют при температуре от 23 до 28 С. Из смеси отбирают пробы для мониторинга хода реакции с помощью ЖХВР. После окончания реакции используют ту же последовательную процедуру, которая описана в примере 1 (то есть останавливают реакцию посредством МеОН, смесь концентрируют в вакууме и так далее, но при соответствующих для этого примера соотношениях реагентов), соединение формулы I получают со средним выходом 98,4%. Выход продукта составляет 97%, выход раствора 100% и разн. 93,6%. Пример 3 (на стадии (а) присутствует кислота). Пятнадцать (15) кг соединения формулы II загружают в 50 галлонный (185,25 л) стекляный футерованный реактор, оснащенный термопарой, устройством для напуска N2 и питательным резервуаром. За-4 006898 гружают 150 л безводного ТГФ для растворения 15 кг соединения формулы II при температуре от 20 до 25 С. Эту смесь концентрируют при 1 атм до объема около 55 л. Температуру поддерживают от 20 до 25 С. Добавляют 1,5 кг предварительно приготовленного (R)-МеСБС катализатора в толуоле (3 мол.%). Медленно добавляют в течение 1,5 ч 18,55 кг 1 М раствора боран-ТГФ комплекса в ТГФ при температуре от 23 до 28 С. Из смеси отбирают пробы для мониторинга хода реакции с помощью ЖХВР. После окончания реакции используют ту же последовательную процедуру, которая описана в примере 1 (то есть останавливают реакцию посредством МеОН, смесь концентрируют в вакууме и так далее, но при соответствующих соотношениях реагентов для этого примера), соединение формулы I получают со средним выходом 100% и разн. 95,4%. Пример 4. (На стадии (а) присутствует кислота (КСК. Тридцать (30) г соединения формулы II и 0,386 г (2 мол.%) (1S)-(+)-10-камфорсульфоновой кислоты(КСК) загружают в 500 мл трехгорлую стекляную круглодонную колбу, оснащенную термометром, устройством для напуска N2 и дополнительной воронкой. Загружают 111 мл безводного ТГФ для растворения 30 г соединения формулы II и (1S)-(+)-10-камфорсульфоновой кислоты при температуре около 20 до 25 С. Добавляют 2,2 мл предварительно приготовленного (R)-МеСБС катализатора в толуоле (3 мол.%). Медленно добавляют в течение 1,5 ч 39,9 мл 1 М раствора боран-ТГФ комплекса в ТГФ при температуре между около 23 и 28 С. Из смеси отбирают пробы для мониторинга хода реакции с помощью ЖХВР. После окончания реакции используют ту же последовательную процедуру, которая описана в примере 1(то есть останавливают реакцию посредством МеОН, смесь концентрируют в вакууме и так далее, но при соответствующих соотношениях реагентов для этого примера), получают соединение формулы I. Результаты варьируются, но, как правило, выход составляет 99% и разн. 94%. Пример 5. Применяют метод, описанный в примере 4, с использованием других кислот, отличных от КСК. Эта группа других кислот включает BF3OEt2, ВСl3, трифторуксусную кислоту (ТФК) или метансульфоновую кислоту. Результаты варьируются, но, как правило, все результаты по выходам дают благоприятныеSS:RS соотношения, равные 95-97% к 3-5% и процент разн. от 91 до 93,8%. Как правило, получают химические выходы, близкие к 97% и выше. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы I который включает стадии: а) смешивания соединения формулы II с тетрагидрофураном в присутствии кислоты или альтернативно с тетрагидрогидрофураном в отсутствие кислоты с образованием смеси;b) комбинирования смеси стадии а) с катализатором, выбираемым из или (А) соединения, входящего в группу соединений, представленных формулой III, или (В) соединения формулы IV где R1 в формуле III означает (C1-C6)-алкил и где R и S определяют стереохимию хирального углерода;d) прекращения реакции с помощью МеОН. 2. Способ по п.1, в котором кислота, используемая на стадии а), представляет собой ВF3OEt2, ВСl3,п-толуолсульфоновую кислоту, трифторуксусную кислоту, метансульфоновую кислоту или камфорсульфоновую кислоту. 3. Способ по п.2, в котором катализатор формулы IV используют в присутствии триалкилбората. 4. Способ по п.3, в котором триалкилборат является триметилборатом. 5. Способ по п.2, в котором указанная кислота присутствует в соотношении 1-10 мол.% по отношению к указанному соединению формулы II. 6. Способ по п.2, в котором указанная кислота присутствует в соотношении 1-5 мол.% по отношению к указанному соединению формулы II. 7. Способ по п.2, в котором указанная кислота присутствует в соотношении 2-3 мол.% по отношению к указанному соединению формулы II. 8. Способ по п.1, в котором указанный катализатор присутствует в соотношении 0,1-10 мол.% по отношению к указанному соединению формулы II. 9. Способ по п.1, в котором указанный катализатор присутствует в соотношении 1-5 мол.% по отношению к указанному соединению формулы II. 10. Способ по п.1, в котором указанный катализатор присутствует в соотношении 2-3 мол.% по отношению к указанному соединению формулы II. 11. Способ по п.1, в котором температура на стадии восстановления с) составляет от -15 до 65 С. 12. Способ по п.1, в котором температура на стадии восстановления с) составляет от -10 до 55 С. 13. Способ по п.1, в котором температура на стадии восстановления с) составляет от 0 до 30 С. 14. Способ по п.1, в котором температура на стадии восстановления с) составляет от 23 до 28 С. 15. Способ по п.1, в котором на стадии а) присутствует кислота. 16. Способ по п.1, в котором на стадии а) отсутствует кислота. 17. Способ по п.16, в котором температура на стадии восстановления с) составляет от 23 до 28 С. 18. Способ по п.16, в котором указанный катализатор представлен в соотношении 0,1-10 мол.% по отношению к указанному соединению формулы II. 19. Способ по п.16, в котором указанный катализатор представлен в соотношении 1-5 мол.% по отношению к указанному соединению формулы II. 20. Способ по п.16, в котором указанный катализатор представлен в соотношении 2-3 мол.% по отношению к указанному соединению формулы II. 21. Соединение формулы I полученное способом по п.15. 22. Соединение формулы I полученное способом по п.16. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2/6
МПК / Метки
МПК: C07D 263/26
Метки: получения, промежуточных, соединений, энантиоселективный, азетидинонов, синтез
Код ссылки
<a href="https://eas.patents.su/7-6898-enantioselektivnyjj-sintez-promezhutochnyh-soedinenijj-dlya-polucheniya-azetidinonov.html" rel="bookmark" title="База патентов Евразийского Союза">Энантиоселективный синтез промежуточных соединений для получения азетидинонов</a>
Предыдущий патент: Фармацевтическая композиция для лечения заболеваний, характеризующихся снижением и/или нарушением когнитивных функций
Следующий патент: Форма для введения, включающая неустойчивое в кислой среде действующее вещество, единица действующего вещества, способ ее получения и микросфера
Случайный патент: Счетный блок водосчетчика и его электрическая схема











