Пролекарства 5-(5-фенил-4-(пиридин-2-илметиламино)хиназолин-2-ил)пиридин-3-сульфонамида на основе фосфорамидной кислоты
Формула / Реферат
1. Соединение структурной формулы I
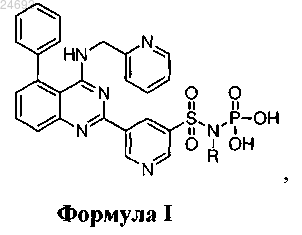
где R представляет собой H или -PO3H,
или его фармацевтически приемлемая соль.
2. Соединение по п.1, где R представляет собой H, или его фармацевтически приемлемая соль.
3. Соединение по п.1, характеризующееся структурной формулой II
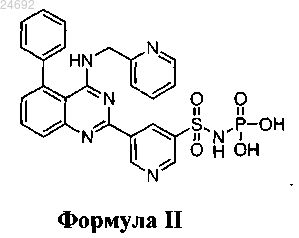
4. Соединение по пп.1, 2, где фармацевтически приемлемая соль представляет собой противоион; противоион представляет собой Na+, K+, Ca+2, Mg+2 или (NH3+-CH2-С(CH2OH)3).
5. Соединение по п.4, где соединение выбрано из
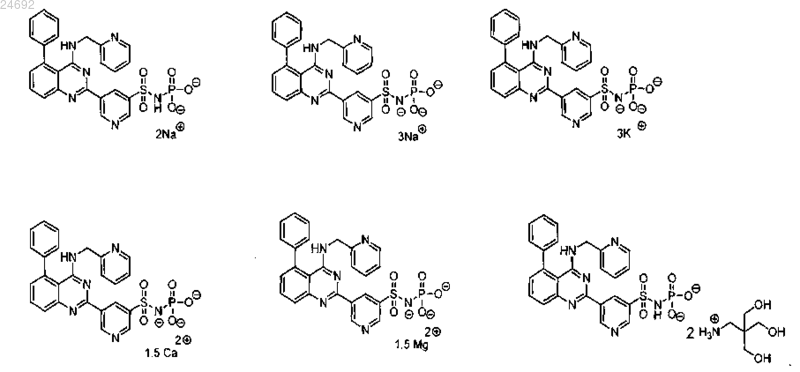
6. Соединение по п.1, где соединение характеризуется формулой III
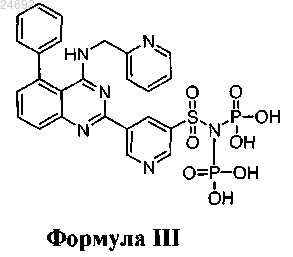
или его фармацевтически приемлемая соль.
7. Фармацевтическая композиция для лечения связанного с IKur состояния, содержащая терапевтически эффективное количество по меньшей мере одного соединения по любому из пп.1-6.
8. Способ лечения или профилактики аритмии, включающий введение нуждающемуся в этом пациенту эффективного количества по меньшей мере одного соединения по любому из пп.1-6.
9. Способ контроля частоты сердечных сокращений, включающий введение нуждающемуся в этом пациенту эффективного количества по меньшей мере одного соединения по любому из пп.1-6.
10. Способ лечения связанного с IKur состояния, включающий введение нуждающемуся в этом пациенту эффективного количества по меньшей мере одного соединения по любому из пп.1-6.
Текст
ПРОЛЕКАРСТВА 5-(5-ФЕНИЛ-4-(ПИРИДИН-2-ИЛМЕТИЛАМИНО)ХИНАЗОЛИН-2 ИЛ)ПИРИДИН-3-СУЛЬФОНАМИДА НА ОСНОВЕ ФОСФОРАМИДНОЙ КИСЛОТЫ Соединение структурной формулы I Уорриер Джаякумар С., Ядев Навнат Дняноба (US) где R представляет собой H или -PO3H, или его фармацевтически приемлемая солевая форма. Соединения применимы в качестве ингибиторов функции калиевых каналов и в лечении и профилактике аритмии, связанных с IKur нарушений и других опосредованных функцией ионных каналов нарушений. Область техники Настоящее изобретение в основном относится к пролекарственным средствам и, более конкретно, к пролекарственным средствам на основе фосфорамидной кислоты, их композициям и способам применения таких соединений в лечении и профилактике аритмии, связанных с IKur нарушений и других опосредованных функцией ионных каналов нарушений. Уровень техники Фибрилляция предсердий (AF) представляет собой наиболее часто наблюдаемый тип сердечной аритмии, и, как правило, клинически ее устанавливают при измерении пульса и впоследствии могут подтвердить с помощью электрокардиограммы (ЭКГ). AF вызывает кардиогенную церебральную эмболию,и вследствие этого ее рассматривают как аритмию, которая оказывает существенное влияние на прогнозы в отношении продолжительности жизни и на качество жизни. Известно, что возникновение AF увеличивается с возрастом и что повторяющиеся приступы AF приводят к хронической AF (The Journal ofAmerican Medical Association, 285:2370-2375 (2001) и Circulation, 114:119-123 (2006. Процесс сердечной реполяризации регулируется несколькими выходящими потоками, из которых,как предполагают, важнейшую роль играет сверхбыстрый калиевый ток задержанного выпрямления(IKur). Указанный поток отсутствует в желудочках и по этой причине представляет собой подходящую мишень для селективной модуляции потенциалов действия (АР) в предсердиях (Wang. Z. et al., "Sustainedmodel", Cardiovasc Res., 42:477-489 (1999) и Nattel, S., "New ideas about atrial fibrillation 50 years on",Nature, 415:219-226 (2002. Предполагают, что сверхбыстрый активирующий калиевый ток задержанного выпрямления (IKur) представляет собой нативный эквивалент клонированному калиевому каналу, обозначенному Kv1.5, и наряду с тем, что он присутствует в предсердии человека, оказывается, что он отсутствует в желудочке человека. Кроме того, вследствие своей высокой скорости активации и ограниченной медленной инактивации предполагают, что IKur вносит существенный вклад в реполяризацию предсердия человека. Следовательно, специфический блокатор IKur, представляющий собой соединение, которое блокирует Kv1.5,будет преодолевать недостаток других соединений путем удлинения рефрактерности за счет задержки реполяризации в предсердии человека, не вызывая задержек в реполяризации желудочков, что лежит в основе аритмогенного эффекта после деполяризаций и приобретенного синдрома удлинения интервалаQT, наблюдаемого при лечении современными антиаритмическими средствами III класса. Улучшенное средство для профилактики и лечения AF должно пролонгировать рефрактерный период предсердий и поддерживать нормальный синусовый ритм без воздействия на желудочек. В публикации согласно PCTWO 2011/028741 A1 раскрыты соединения, применимые в качестве ингибиторов функции калиевых каналов, которые используются для лечения и профилактики аритмии,связанных с IKur нарушений. Содержание публикации согласно PCT включено в настоящий документ посредством ссылки. Соединения - ингибиторы IKur могут демонстрировать pH-зависимую растворимость иpH-зависимую биодоступность. Для ограничения риска долговременного проявления пониженной биодоступности у пациентов, получающих сопутствующие виды терапии с подавлением выработки кислоты желудочного сока, было бы оптимальным разработать пролекарственное средство, которое бы ограничивало указанное свойство. Пролекарственные средства представляют собой новые химические соединения, которые при введении пациенту преобразуются в соответствующую исходную молекулу внутри организма. Стратегии или методологии на основе пролекарственных средств можно использовать для значительного усиления свойств лекарственного средства или для преодоления свойственной лекарственному средству недостаточности в отношении фармацевтических или фармакокинетических свойствах. Различные формы пролекарственных средств хорошо известны в настоящей области техники и описаны:d) Testa, B. et al., Hydrolysis in Drug and Prodrug Metabolism, Wiley-VCH (2003). Существуют многочисленные стратегии на основе пролекарственных средств, которые предоставляют выбор в отношении модуляции условий для регенерации исходного лекарственного средства, физических, фармацевтических или фармакокинетических свойств пролекарственного средства и функциональной группы, к которой могут быть прикреплены относящиеся к пролекарственному средству модификации. Идентификация пролекарственных средств с требуемыми свойствами часто является трудной и не осуществляется простым способом. Сущность изобретения Соответственно, настоящее изобретение включает соединения структурной формулы I где R представляет собой H или -PO3H,или их фармацевтически приемлемую солевую форму. Кроме того, изобретение включает фармацевтическую композицию, содержащую терапевтически эффективное количество по меньшей мере одного соединения структурной формулы I. Более того, настоящее изобретение включает способ лечения или профилактики сердечной аритмии, включающий введение нуждающемуся в этом пациенту эффективного количества по меньшей мере одного соединения структурной формулы I. Более того, настоящее изобретение включает способ контроля частоты сердечных сокращений и способ лечения связанного с IKur состояния, включающий введение нуждающемуся в этом пациенту эффективного количества по меньшей мере одного соединения структурной формулы I. Под использованием соответствующего эффективного количества по меньшей мере одного описанного в настоящем документе соединения предусмотрены способы лечения (включая в себя улучшение) или профилактики аритмий, фибрилляции предсердий, трепетания предсердий, наджелудочковых аритмий, нарушений со стороны желудочно-кишечного тракта (таких как рефлюксный эзофагит или нарушение перистальтики), воспалительного или иммунологического заболевания (такого как хроническая обструктивная болезнь легких), диабета, когнитивных расстройств, мигрени, эпилепсии, гипертензии или лечения связанных с IKur состояний или контроля частоты сердечных сокращений. Также предусмотрены фармацевтические композиции, содержащие терапевтически эффективное количество по меньшей мере одного описанного в настоящем документе соединения и его фармацевтически приемлемый инертный наполнитель или носитель. Такие композиции могут дополнительно содержать одно или несколько других средств. Например, по меньшей мере одно другое противоаритмическое средство (такое как соталол, дофетилид, дилтиазем или верапамил), или по меньшей мере один блокатор кальциевого канала, или по меньшей мере одно антитромбоцитарное средство (такое как клопидогрель, кангрелор, тиклопидин, CS-747, ифетробан и аспирин), или по меньшей мере одно антигипертензивное средство (такое как бета-адренергический блокатор, ингибитор ACE (например, каптоприл,зофеноприл, фозиноприл, эналаприл, церонаприл, цилазоприл, делаприл, пентоприл, квинаприл, рамиприл или лизиноприл), антагонист A II, антагонист ET, двойной антагонист ET/A II, или ингибитор вазопептидазы (например, омапатрилат или гемопатрилат, или по меньшей мере одно антитромботическое/антитромболитическое средство (такое как tPA, рекомбинантный tPA, TNK, nPA, ингибиторы фактора VIIa, ингибиторы фактора Xa (такие как разаксабан), ингибиторы фактора XIa или ингибиторы тромбина), или по меньшей мере одно противосвертывающее средство (такое как варфарин или гепарин), или по меньшей мере один ингибитор ГМГ-КоА редуктазы (правастатин, ловастатин, аторвастатин,симвастатин, NK-104 или ZD-4522), или по меньшей мере одно противодиабетическое средство (такое как бигуанид или комбинация бигуанида/глибурида), или по меньшей мере один тиромиметик, или по меньшей мере один антагонист минералокортикоидного рецептора (такой как спиронолактон или эплеринон), или по меньшей мере один сердечный гликозид (такой как дигиталис или уабаин). Также предусмотрены соединения для применения в терапии. Также предусмотрены соединения для применения в терапии, где терапия представляет собой лечение (включая в себя улучшение) или профилактику аритмий, фибрилляции предсердий, трепетания предсердий, наджелудочковых аритмий,нарушений со стороны желудочно-кишечного тракта (таких рефлюксный эзофагит или нарушение перистальтики), воспалительного или иммунологического заболевания (такого как хроническая обструктивная болезнь легких), диабета, когнитивных расстройств, мигрени, эпилепсии, гипертензии, или лечение связанных с IKur состояний, или контроль частоты сердечных сокращений. И дополнительно те случаи,где терапия представляет собой лечение или профилактику сердечной аритмии. Также предусмотрено применение соединений формулы I, II или III в получении лекарственного средства для лечения или профилактики аритмий, фибрилляции предсердий, трепетания предсердий,наджелудочковых аритмий, нарушений со стороны желудочно-кишечного тракта (таких рефлюксный эзофагит или нарушение перистальтики), воспалительного или иммунологического заболевания (такого как хроническая обструктивная болезнь легких), диабета, когнитивных расстройств, мигрени, эпилепсии,гипертензии или лечения связанных с IKur состояний или контроля частоты сердечных сокращений и дополнительно для лечения или профилактики сердечной аритмии. Подробное описание изобретения Ниже перечислены определения различных терминов для описания настоящего изобретения. Указанные определения применяются в отношении терминов, используемых в настоящем описании изобретения (если нет иных ограничений в конкретных случаях) либо отдельно, либо в качестве части большей группы. Настоящее изобретение также включает изотопно меченые соединения согласно настоящему изобретению, в которых один или несколько атомов замещены атомом с таким же атомным числом, но атомной массой или массовым числом, отличным от атомной массы или массового числа, обычно встречающегося в природе. Примеры изотопов, подходящих для включения соединения согласно настоящему изобретению, включают в себя такие изотопы водорода, как 2H или D и 3H или T, такие изотопы углерода, как 11C, 13C и 14C, такие изотопы хлора, как 36Cl, такие изотопы фтора, как 18F, такие изотопы йода,как 123I и 125I, такие изотопы азота, как 13N и 15N, такие изотопы кислорода, как 15O, 17O и 18O, такие изотопы фосфора, как 32P, и такие изотопы серы, как 35S. Определенные изотопно меченые соединения согласно настоящему изобретению, например соединения, включающие в себя радиоактивный изотоп, являются применимыми в лекарственном средстве и/или в исследованиях по распределению субстрата в тканях. Радиоактивные изотопы тритий, 3H, и углерод-14, 14C, являются особенно применимыми для указанных целей ввиду их простоты встраивания и доступных средств обнаружения. Замещение более тяжелыми изотопами, такими как дейтерий, 2H или D, может предоставить определенные терапевтические преимущества, являющиеся результатом большей метаболической стабильности, например увеличения периода полураспада in vivo или пониженных требованиях в отношении дозировки, и, следовательно,может быть предпочтительным в некоторых обстоятельствах. Замещение такими позитронно-активными изотопами, как 11C, 18F, 15O и 13N, может быть применимо в таких исследованиях, как позитронноэмиссионная топография (PET) для изучения степени занятости рецептора субстратом."Фармацевтически приемлемый" относится к тем соединениям, материалам, композициям и/или лекарственным формам, которые по результатам тщательной медицинской оценки являются подходящими для контакта с тканями людей и животных, не вызывая избыточной токсичности, раздражения, аллергической реакции или других проблем или осложнений в соответствии с целесообразным соотношением риск/польза или которые были иным образом одобрены Управлением по контролю качества пищевых продуктов и лекарственных средств США как приемлемое для применения у людей или домашних животных."Терапевтически эффективное количество" относится к такому количеству соединения, которое,будучи введенным субъекту, является достаточным для осуществления лечения описанного в настоящем документе заболевания или нарушения. Количество соединения, которое составляет "терапевтически эффективное количество", будет варьировать в зависимости от соединения, нарушения и его тяжести и возраста подлежащего лечению субъекта, но может быть рутинным образом определено специалистом в настоящей области техники. Используемые в настоящем документе термины "проведение лечения" или "лечение" охватывают лечение, профилактику и/или снижение риска описанного в настоящем документе заболевания или нарушения или лечение, профилактику или снижение риска симптома заболевания или нарушения у такого субъекта, как человек, и включает в себя:i) ингибирование заболевания или нарушения, т.е. прекращение его развития; илиii) облегчение заболевания или нарушения, т.е. обеспечение регрессии нарушения."Субъект" относится к теплокровному животному, такому как млекопитающее, такому как человек или ребенок человека, который поражен или потенциально может быть поражен одним или несколькими описанными в настоящем документе заболеваниями и нарушениями. Термины "включая в себя", "такой как", "например" и подобное предусмотрены для отражения иллюстративных вариантов осуществления, а не для ограничения объема настоящего изобретения. Описанные в настоящем документе соединения, которые содержат кислотный фрагмент, могут образовывать соли с разнообразными органическими и неорганическими основаниями. Иллюстративные основные соли включают в себя соли аммония, такие соли щелочных металлов, как соли натрия, лития и калия, такие соли щелочно-земельных металлов, как соли кальция и магния, соли с органическими основаниями (например, органическими аминами), такие как бензатины, дициклогексиламины, гидрабамины(образованные с N,N-бис-(дегидроабиетил)этилендиамином), N-метил-D-глюкамины, N-метил-Dглюкамиды, трет-бутиламины и соли с такими аминокислотами, как аргинин, лизин и подобное. Наряду с тем, что соли соединений согласно настоящему изобретение проиллюстрированы как характеризующиеся отрицательным зарядом (и, следовательно, теряющие водород) на определенных атомах, следует понимать, что отрицательный заряд может присутствовать на другом атоме заместителя, и что один из других атомов водорода может быть удален (таутомер аниона). Более того, отрицательный заряд может присутствовать на различных атомах на различных молекулах, тем самым формируя смесь анионов. Не предусмотрено, что настоящее изобретение ограничено конкретным изображением анионного заряда, показанным на соединениях. Согласно первому варианту осуществления настоящего изобретения предусмотрено соединение структурной формулы I где R представляет собой H,или его фармацевтически приемлемая соль. Согласно второму варианту осуществления настоящего изобретения предусмотрено соединение,характеризующееся структурной формулой II Согласно третьему варианту осуществления настоящего изобретения предусмотрены соли структурной формулы I и структурной формулы II, где фармацевтически приемлемая соль представляет собойNa(+), K(+), Ca(+2), Mg(+2) или (NH3(+)-CH2-C(CH2OH)3). Согласно четвертому варианту осуществления настоящего изобретения предусмотрены соединения,выбранные из группы, состоящей из: или их таутомеры. Согласно пятому варианту осуществления настоящего изобретения предусмотрено соединение формулы III или его фармацевтически приемлемая соль. Согласно шестому варианту осуществления настоящего изобретения предусмотрена фармацевтическая композиция, содержащая терапевтически эффективное количество по меньшей мере одного соединения формулы I или формулы II. Согласно первому варианту осуществления шестого аспекта предусмотрено по меньшей мере одно другое терапевтическое средство. Согласно седьмому варианту осуществления настоящего изобретения предусмотрен способ лечения или профилактики аритмии, включающий введение нуждающемуся в этом пациенту эффективного количества по меньшей мере одного соединения любой из структурной формулы I или структурной формулы II. Согласно восьмому варианту осуществления настоящего изобретения предусмотрен способ контроля частоты сердечных сокращений, включающий введение нуждающемуся в этом пациенту эффективного количества по меньшей мере одного соединения любой из структурной формулы I или структурной формулы II. Согласно девятому варианту осуществления настоящего изобретения предусмотрен способ лечения связанного с IKur состояния, включающий введение нуждающемуся в этом пациенту эффективного количества по меньшей мере одного соединения любой из структурной формулы I или структурной формулыII. Настоящее изобретение можно осуществить в других конкретных формах, не отклоняясь от его сущности и существенных признаков. Настоящее изобретение охватывает все комбинации предпочтительных аспектов и/или вариантов осуществления настоящего изобретения, указанных в настоящем документе. Следует понимать, что любой и все варианты осуществления настоящего изобретения можно рассматривать совместно с любым другим вариантом осуществления или вариантами осуществления для описания дополнительных более предпочтительных вариантов осуществления. Также следует понимать,что каждый отдельный элемент предпочтительных вариантов осуществления представляет собой свой собственный независимый предпочтительный вариант осуществления. Более того, подразумевается, что любой элемент варианта осуществления комбинируется с любым и всеми другими элементами из любого варианта осуществления для описания дополнительного варианта осуществления. Сокращения, используемые в настоящем описании, в частности в представленных ниже иллюстративных примерах, хорошо известны специалистам в настоящей области техники. Некоторые используемые сокращения представляют собой следующее:Boc = трет-бутилоксикарбоксил,AcOH или HOAc = уксусная кислота,CH2Cl2 или DCM = дихлорметан,CH3CN или ACN = ацетонитрил,CDCl3 = дейтерохлороформ,CHCl3 = хлороформ,Cs2CO3 = карбонат цезия,DEA = диэтиламин,разв. = разведенный,DIPEA или основание Хунига = диизопропилэтиламин,DME= 1,2-диметоксиэтан,DMF = диметилформамид,DMSO = диметилсульфоксид,кДНК = комплементарная ДНК,EDTA = этилендиаминтетрауксусная кислота,Et3N или TEA = триэтиламин,EtOAc = этилацетат,Et2O = простой диэтиловый эфир,EtOH = этанол,экв. = эквиваленты,HCl = соляная кислота,H2SO4 = серная кислота,K2CO3 = карбонат калия,KOAc = ацетат калия,K3PO4 = фосфат калия,LiOH = гидроксид лития,MeOH = метанол,мин = минута или минуты,MgSO4 = сульфат магния,NaCl = хлорид натрия,NaH = гидрид натрия,NaHCO3 = бикарбонат натрия,Na2CO3 = карбонат натрия,NaOH = гидроксид натрия,Na2SO3 = сульфит натрия,Na2SO4 = сульфат натрия,NH3 = аммиак,NH4Cl = хлорид аммония,NH4OH = гидроксид аммония,PG = защитная группа,POCl3 = оксихлорид фосфора,-5 024692i-PrOH или IPA = изопропанол,PS = полистирол,SiO2 = оксид кремния,SnCl2 = хлорид олова (II),TFA = трифторуксусная кислота,THF = тетрагидрофуран. Следующие примеры представлены для иллюстрации, но не для ограничения, некоторых предпочтительных вариантов осуществления настоящего изобретения и не предназначены для ограничения объема настоящего изобретения. Если не указано иное, сокращения и химические символы характеризуются своими обычными и общепринятыми значениями. Если не указано иное, описанные в настоящем документе соединения были получены, выделены и охарактеризованы с использованием схем и других способов, раскрытых в настоящем документе, или могут быть получены с их использованием. Общие способы. Следующие способы использовали в рабочих примерах, за исключением случаев, в которых указано иное. Используемые в определении характеристик примеров аналитические способы ВЭЖХ и ВЭЖХ/МС являются следующими. Обращенно-фазовую аналитическую ВЭЖХ/МС проводили на системах Shimadzu LC10AS в сочетании с масс-спектрометрами Waters ZMD или на системе Waters AQUITY в сочетании с массспектрометром Waters MICROMASS ZQ. Способ A. Линейный градиент от 0 до 100% В в течение 3,2 мин, поддерживая на уровне 100% В в течение 1,5 мин. УФ-визуализация при 220 нм. Колонка: Ascentis Express C18 (52,1 мм, 2,7 мкм). Объемная скорость потока: 1 мл/мин. Подвижная фаза A: 10 мМ NH4COOH, 98% воды, 2% ацетонитрила. Подвижная фаза B. 10 мМ NH4COOH, 2% воды, 98% ацетонитрила. Способ B. Линейный градиент от 10 до 100% В в течение 15 мин, поддерживая на уровне 100% В в течение 12 мин. УФ-визуализация при 220 нм. Колонка: XBridge фенил (4,6150 мм) 3,5 мкм SC/1072. Объемная скорость потока: 1 мл/мин. Буфер: 0,05% TFA в воде pH 2,5. Подвижная фаза A: буфер: ацетонитрил (95:5). Подвижная фаза B: ацетонитрил: буфер (95:5). Способ C. Линейный градиент от 10 до 100% В в течение 15 мин, поддерживая на уровне 100% В в течение 12 мин. УФ-визуализация при 220 нм. Колонка: SUNFIRE C18 (4,6150 мм) 3,5 мкм SC/862. Объемная скорость потока: 1 мл/мин. Буфер: 0,05% TFA в воде pH 2,5. Подвижная фаза A: буфер: ацетонитрил (95:5). Подвижная фаза B: ацетонитрил: буфер (95:5). Способ D. Линейный градиент от 0 до 100% В в течение 2 мин. УФ-визуализация при 220 нм. Колонка: PUROSPHERstar RP-18 (555 мм, 3 мкм). Объемная скорость потока: 2,5 мл/мин. Буфер: 10 мМ NH4OAc в воде. Подвижная фаза A: буфер: ацетонитрил (90:10). Подвижная фаза B: ацетонитрил: буфер (10:90). Способ E. Линейный градиент от 0 до 100% В в течение 23 мин, поддерживая на уровне 100% В в течение 18 мин. УФ-визуализация при 220 нм. Колонка: XBridge фенил (4,6150 мм) 3,5 мкм. Объемная скорость потока: 1 мл/мин. Буфер: 0,05% TFA в воде pH 2,5. Подвижная фаза A: буфер: ацетонитрил (95:5). Подвижная фаза B: ацетонитрил: буфер (95:5). Способ F. Линейный градиент от 10 до 100% В в течение 30 мин, поддерживая на уровне 100% В в течение 25 мин. УФ-визуализация при 220 нм. Колонка: XBridge фенил (4,6150 мм), 3,5 мкм. Объемная скорость потока: 1 мл/мин. Буфер: 0,05% TFA в воде pH 2,5. Подвижная фаза A: буфер: ацетонитрил (95:5). Подвижная фаза B: ацетонитрил: буфер (95:5). Способ G. Линейный градиент от 10 до 100% В в течение 30 мин, поддерживая на уровне 100% В 25 мин. УФ-визуализация при 220 нм. Колонка: SUNFIRE C18 (4,6150 мм) 3,5 мкм. Объемная скорость потока: 1 мл/мин. Буфер: 0,05% TFA в воде pH 2,5. Подвижная фаза A: буфер: ацетонитрил (95:5). Подвижная фаза B: ацетонитрил: буфер (95:5). Способ Н. Линейный градиент от 10 до 100% В в течение 15 мин, поддерживая на уровне 100% В в течение 12 мин. УФ-визуализация при 220 нм. Колонка: XBridge фенил (4,6150 мм) 3,5 мкм SC/749. Объемная скорость потока: 1 мл/мин. Буфер: 0,05% TFA в воде pH 2,5. Подвижная фаза A: буфер: ацетонитрил (95:5). Подвижная фаза B: ацетонитрил: буфер (95:5). Способ I. Линейный градиент от 0 до 100% В в течение 3,2 мин, поддерживая на уровне 100% В в течение 1,5 мин. УФ-визуализация при 220 нм. Колонка: Ascentis Express C8 (52,1 мм, 2,7 мкм). Объемная скорость потока: 1 мл/мин. Подвижная фаза A: 10 мМ NH4COOH, 98% воды, 2% ацетонитрила. Подвижная фаза B: 10 мМ NH4COOH, 2% воды, 98% ацетонитрила. Способ J. Линейный градиент от 10 до 100% В в течение 30 мин, поддерживая на уровне 100% В в течение 25 мин. УФ-визуализация при 220 нм. Колонка: SUNFIRE C18 (4,6150 мм) 3,5 мкм SC/862. Объемная скорость потока: 1 мл/мин. Буфер: 0,05% TFA в воде pH 2,5. Подвижная фаза A: буфер: ацетонитрил (95:5). Подвижная фаза B: ацетонитрил: буфер (95:5). Способ K. Линейный градиент от 10 до 100% В в течение 15 мин, поддерживая на уровне 100% В в течение 12 мин. УФ-визуализация при 220 нм. Колонка: XBridge фенил (4,6150 мм) 3,5 мкм. Объемная скорость потока: 1 мл/мин. Буфер: 0,05% TFA в воде pH 2,5. Подвижная фаза A: буфер: ацетонитрил (95:5). Подвижная фаза B: ацетонитрил: буфер (95:5). Способ L. Линейный градиент от 0 до 100% В в течение 2,5 мин, поддерживая на уровне 100% В в течение 2 мин. УФ-визуализация при 220 нм. Колонка: PUROSPHERstar RP-18 (455 мм, 3 мкм). Объемная скорость потока: 2,5 мл/мин. Буфер: 20 мМ NHUOAc в воде. Подвижная фаза A: буфер: ацетонитрил (90:10). Подвижная фаза B: ацетонитрил: буфер (10:90). Способ M. Линейный градиент от 10 до 100% В в течение 30 мин, поддерживая на уровне 100% В в течение 25 мин. УФ-визуализация при 220 нм. Колонка: Eclipse XDB C18 (1504,6 мм, 3,5 мкм). Объемная скорость потока: 1,0 мл/мин. Подвижная фаза A: 20 мМ NH4OAc в воде. Подвижная фаза B: ацетонитрил. Способ N. Линейный градиент от 0 до 100% В в течение 2 мин, поддерживая на уровне 0% В в течение 3 мин. УФ-визуализация при 220 нм. Колонка: ZORBAX SB C18 (504,6 мм, 5 мкм). Объемная скорость потока: 5,0 мл/мин. Подвижная фаза A: 10% MeOH-90% Н 2 О-0,1% TFA. Подвижная фаза B: 90% MeOH-10% Н 2 О-0,1% TFA. Способ O. Линейный градиент от 10 до 100% В в течение 15 мин, поддерживая на уровне 100% В в течение 12 мин. УФ-визуализация при 220 нм. Колонка: SUNFIRE C18 (4,6150 мм, 3,5 мкм). Объемная скорость потока: 1 мл/мин. Буфер: 0,05% TFA в воде pH 2,5. Подвижная фаза A: буфер: ацетонитрил (95:5). Подвижная фаза B: ацетонитрил: буфер (95:5). Спектры 1H ЯМР получали с помощью спектрофотометров с преобразованием Bruker или JEOLFOURIER, работающих при следующих частотах: 1H ЯМР: 400 МГц (Bruker или JEOL) или 500 МГц(JEOL). 13 С ЯМР: 100 МГц (Bruker или JEOL). Данные спектров регистрируют в следующем формате: химический сдвиг (мультиплетность, константы взаимодействия и число атомов водорода). Химические сдвиги устанавливают в м.д. слабопольного сдвига относительно внутреннего стандарта тетраметилсилана (единицы , тетраметилсилан = 0 м.д.) и/или соотносят с пиками растворителя, которые в спектрах 1H ЯМР соответствуют 2,49 м.д. для CD2HSOCD3, 3,30 м.д. для CD2HOD и 7,24 м.д. дляCHCl3, и которые в спектрах 13 С ЯМР соответствуют 39,7 м.д. для CD3SOCD3, 49,0 м.д. для CD3OD и 77,0 м.д. для CDCl3. Все спектры 13 С ЯМР подвергали подавлению спин-спинового взаимодействия с протонами. Пример 1. 5-(5-Фенил-4-(пиридин-2-илметиламино)хиназолин-2-ил)пиридин-3-илсульфонилфосфорамидная кислота (2) Получение 5-(5-фенил-4-пиридин-2-илметил)амино)хиназолин-2-ил)пиридин-3-сульфонамида (1) можно найти в международной патентной публикацииWO 2011/028741. К раствору 5-(5-фенил-4-пиридин-2-илметил)амино)хиназолин-2-ил)пиридин-3-сульфонамида (1)(3,0 г, 6,4 ммоль) в DCM (50 мл) добавляли DIPEA (2,237 мл, 12,81 ммоль) и реакционную смесь перемешивали с течение 20 мин. POCl3 (2,39 мл, 25,6 ммоль) добавляли при 0C и реакционную смесь перемешивали с течение 4 ч. DCM и избыток POCl3 удаляли под действием вакуума и остаток растворяли в 100 мл воды и перемешивали в течение 1 ч. Полученное твердое вещество фильтровали и твердое вещество отмывали избытком воды и высушивали под действием вакуума для получения 5-(5-фенил-4(пиридин-2-илметиламино)хиназолин-2-ил)пиридин-3-илсульфонилфосфорамидной кислоты (2) (2,5 г,4,6 ммоль, выход 71%, чистота 97%, грязно-белый цвет). Способ рекристаллизации. К раствору аморфной 5-(5-фенил-4-пиридин-2-илметил)амино)хиназолин-2-ил)пиридин-3 ил)сульфонил)фосфорамидной кислоты (2) (6,00 г, 10,9 ммоль) (чистота согласно ВЭЖХ 97%) в DMSO фильтровали и отмывали несколько раз водой и высушивали под действием вакуума для получения чистой кристаллической 5-(5-фенил-4-пиридин-2-илметил)амино)хиназолин-2-ил)пиридин-3 ил)сульфонил)фосфорамидной кислоты (2) (4,6 г, 8,4 ммоль, выход 77%). 1(6,40 мг, 0,161 ммоль) в 0,500 мл воды. Реакционную смесь перемешивали в атмосфере азота при комнатной температуре в течение 2 ч. Реакционную смесь концентрировали до сухого состояния и остаток отмывали с помощью этилацетата (28 мл), ацетона (28 мл) и ацетонитрила (28 мл) для получения тринатрий(5-(5-фенил-4-пиридин-2-илметил)амино)хиназолин-2-ил)пиридин-3 ил)сульфонилфосфорамидата (3) (0,028 г, 0,046 ммоль, выход 85%) в виде твердого вещества розового цвета. 1(d, J=1,76 Гц, 1H). Способ D. ЖХ/МС: время удерживания 1,24 мин, [M+1] = 469. Способ C. ВЭЖХ: чистота 95,1%, время удерживания 6,18 мин. Способ Е. ВЭЖХ: чистота 94,0%, время удерживания 12,16 мин. Элементный анализ: соединение являлось гигроскопическим, и точный элементный анализ не был получен. Пример 3. Динатрий(5-(5-фенил-4-пиридин-2-илметил)амино)хиназолин-2-ил)пиридин-3 ил)сульфонилфосфорамидат (4)(9,95 мг, 0,249 ммоль) в 1 мл воды. Реакционную смесь перемешивали в атмосфере азота при комнатной температуре в течение 2 ч. Реакционную смесь концентрировали до сухого состояния и остаток отмывали с помощью этилацетата (210 мл), ацетона (210 мл) и ацетонитрила (215 мл) для получения динатрий(5-(5-фенил-4-пиридин-2-илметил)амино)хиназолин-2-ил)пиридин-3-ил)сульфонилфосфорамидата(4) (0,040 г, 0,068 ммоль, выход 52%) в виде твердого вещества желтого цвета. 1 К суспензии 5-(5-фенил-4-пиридин-2-илметил)амино)хиназолин-2-ил)пиридин-3 ил)сульфонил)фосфорамидной кислоты (2) (0,030 г, 0,054 ммоль) в смеси ацетон/вода (2:2 мл) добавляли 2-амино-2-гидроксиметилпропан-1,3-диол (0,012 г, 0,11 ммоль). Полученную смесь перемешивали в атмосфере азота при комнатной температуре в течение 2 ч. Реакционную смесь концентрировали до сухого состояния и остаток отмывали с помощью этилацетата (28 мл), ацетона (28 мл) для получения трис-(5-(5-фенил-4-пиридин-2-илметил)амино)хиназолин-2-ил)пиридин-3 ил)сульфонилфосфорамидата (5) (0,028 г, 0,034 ммоль, выход 64%) в виде твердого вещества белого цвета. 1(9,0 мг, 0,16 ммоль) в 0,5 мл воды. Полученную смесь перемешивали в атмосфере азота при комнатной температуре в течение 2 ч. Реакционную смесь концентрировали до сухого состояния и остаток отмывали с помощью этилацетата (28 мл), ацетона (28 мл) и ацетонитрила (28 мл) для получения трикалий(5-(5-фенил-4-пиридин-2-илметил)амино)хиназолин-2-ил)пиридин-3 ил)сульфонилфосфорамидата (6) (0,028 г, 0,043 ммоль, выход 78%) в виде твердого вещества коричневого цвета. 1 К суспензии 5-(5-фенил-4-пиридин-2-илметил)амино)хиназолин-2-ил)пиридин-3 ил)сульфонил)фосфорамидной кислоты (2) (0,200 г, 0,365 ммоль) в этаноле (5 мл) добавляли гидроксид кальция (0,041 г, 0,55 ммоль) в 2 мл воды. Полученную смесь перемешивали в атмосфере азота при комнатной температуре в течение 2 ч. Реакционную смесь концентрировали до сухого состояния и остаток отмывали с помощью этилацетата (210 мл), ацетона (210 мл) и ацетонитрила (215 мл) для получения кальций(5-(5-фенил-4-пиридин-2-илметил)амино)хиназолин-2-ил)пиридин-3 ил)сульфонилфосфорамидата (7) (0,195 г, 0,322 ммоль, выход 88,6%) в виде твердого вещества белого цвета. 1H ЯМР (400 МГц, DMSO-d6)(м.д.): 4,77 (d, J=4,27 Гц, 2H), 6,92 (t, J=4,14 Гц, 1H), 7,26-7,35 (m,2H) 7,39 (d, J=8,03 Гц, 1H), 7,50-7,60 (m, 5H), 7,79 (td, J=7,65, 1,76 Гц, 1H), 7,83-7,89 (m, 1H), 7,91-7,96 (m,1H), 8,30 (d, J=4,27 Гц, 1H), 9,10 (s, 1H), 9,25 (t, J=2,13 Гц, 1H), 9,73 (d, J=2,01 Гц, 1H). Способ I. ЖХ/МС: время удерживания 1,66 мин, [M-1] = 547. Способ В. ВЭЖХ: чистота 94,3%, время удерживания 6,17 мин. Способ C. ВЭЖХ: чистота 94,45%, время удерживания 5,97 мин. Элементный анализ: соединение являлось гигроскопическим, и точный элементный анализ не был получен. Пример 7. Магний(5-(5-фенил-4-пиридин-2-илметил)амино)хиназолин-2-ил)пиридин-3 ил)сульфонилфосфорамидат (8) К суспензии 5-(5-фенил-4-пиридин-2-илметил)амино)хиназолин-2-ил)пиридин-3 ил)сульфонил)фосфорамидной кислоты (2) (0,050 г, 0,091 ммоль) в этаноле (5 мл) добавляли гидроксид магния (7,97 мг, 0,137 ммоль) в 1 мл воды. Полученную смесь перемешивали в атмосфере азота при комнатной температуре в течение 2 ч. Реакционную смесь концентрировали до сухого состояния и остаток отмывали с помощью этилацетата (25 мл), ацетона (210 мл) и ацетонитрила (210 мл) для получения магний(5-(5-фенил-4-пиридин-2-илметил)амино)хиназолин-2-ил)пиридин-3 ил)сульфонилфосфорамидата (8) (0,040 г, 0,069 ммоль, выход 76%) в виде твердого веществ желтого цвета. Анализ 1H ЯМР не проводили из-за низкой растворимости. Способ I. ЖХ/МС: время удерживания 1,66 мин, [M-1] = 547. Способ В. ВЭЖХ: чистота 98,1%, время удерживания 6,18 мин. Способ C. ВЭЖХ: чистота 95,6%, время удерживания 5,98 мин. Элементный анализ: MF C25H20N6SPO5Mg Н 2 О, расчетное значение C, 46,15; H, 4,41; N, 12,92; мг,4,15; Н 2 О, 11,70; обнаруженное значение C, 40,66; H, 4,12; N, 11,23; мг, 4,14; H2O,11,70; С и N не согласуются.(0,150 г, 0,320 ммоль) в CHCl3 (10 мл) добавляли триэтиламин (0,268 мл, 1,92 ммоль) с последующим добавлением 4-диметиламинопиридина (7,8 мг, 0,064 ммоль) в атмосфере азота. Реакционную смесь перемешивали при 0C в течение 5 мин и диэтилфосфорохлоридат (0,331 г, 1,92 ммоль) добавляли по каплям. Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение ночи. Реакционную смесь разбавляли с помощью DCM (20 мл) и воды (20 мл) и экстрагировали с помощью DCM (350 мл). Комбинированные органические слои отмывали водой и солевым раствором и высушивали на Na2SO4, фильтровали и концентрировали при отрицательном давлении. Остаток очищали с помощью очистки ВЭЖХ для получения этилгидродиэтоксифосфорил-5-(5-фенил-4-пиридин-2 илметил)амино)хиназолин-2-ил)пиридин-3-ил)сульфонил)фосфорамидата (9) (0,045 г, 0,063 ммоль, 20% выход) в виде твердого вещества желтого цвета. Условия препаративной ВЭЖХ (водная масса): колонка: Atlantis dcl8 (19250 мм) 10 мкм,подвижная фаза A: 10 мм ацетата аммония,подвижная фаза B: ацетонитрил,градиент: от 10 до 60% В в течение 10 мин,объемная скорость потока: 15 мл/мин,время удерживания: 11,35 мин; 1(br. s., 1H), 7,09-7,20 (m, 3H), 7,44-7,54 (m, 5H), 7,61-7,72 (m, 2H), 7,85-7,96 (m, 1H), 8,42 (d, J=4,02 Гц,1 Н), 9,21 (dd, J=6,78, 2,01 Гц, 2 Н), 9,67 (d, J=2,01 Гц, 1H). Способ D. ЖХ/МС: время удерживания 1,56 мин, [M+1] = 713,2. К суспензии этилгидродиэтоксифосфорил-5-(5-фенил-4-пиридин-2-илметил)амино)хиназолин-2 ил)пиридин-3-ил)сульфонил)фосфорамидата (9) (0,040 г, 0,056 ммоль) в DCM (5 мл) добавляли йодтриметилсилан (0,067 г, 0,34 ммоль) по каплям, в атмосфере азота при 0C. Смесь перемешивали с течение 2 ч при 0C и растворитель удаляли при отрицательном давлении. Остаток охлаждали до 0C и обрабатывали с помощью смеси ацетона (10 мл) и H2O (0,20 мл). После перемешивания при 0C в течение 1 ч смесь перемешивали при комнатной температуре в течение ночи. Полученную суспензию фильтровали и твердое вещество отмывали с помощью ацетона (20 мл), высушивали и очищали с помощью препаративной ВЭЖХ для получения 5-(5-фенил-4-пиридин-2-илметил)амино)хиназолин-2-ил)пиридин-3 ил)сульфонил)(фосфоно)фосфорамидной кислоты (10) (0,025 г, 0,040 ммоль, выход 71%) в виде твердого вещества белого цвета. Условия препаративной ВЭЖХ: колонка: KROMASIL С-4 (25021,2) мм, 5 мкм,подвижная фаза A: 10 мМ ацетата аммония в воде,подвижная фаза B: ацетонитрил,градиент: от 20 до 40% В в течение 7 мин, 100% В в течение 12,5 мин,объемная скорость потока: 17 мл/мин,время удерживания: 9 мин; 1P (162,0 МГц, DMSO-d6)(м.д.): -8,820, -8,917, -15,535, -15,629. Способ I. ЖХ/МС: время удерживания 1,56 мин, [M-1] = 627. Способ Н. ВЭЖХ: чистота 95,0%, время удерживания 5,27 мин. Протокол исследований растворимости соединений согласно настоящему изобретению. Растворимость соединений согласно настоящему изобретению оценивали при различных значенияхpH. Растворимость исследовали с использованием описанной ниже процедуры. Избыточное количество соединения в виде порошка уравновешивали с помощью 1 мл буфера в 2 мл стеклянном флаконе и распределение соединения в буфере обеспечивали путем перемешивания вихревым способом с последующей обработкой ультразвуком. Флаконы встряхивали при 300 об/мин при комнатной температуре в течение 24 ч. Через 24 ч инкубации суспензию фильтровали и фильтрат анализировали с помощью ВЭЖХ для количественного определения растворенной фракции соединения с использованием калибровочной кривой из четырех точек. Примечание: время инкубации устанавливали на основании данных растворимости в воде. Если соединение являлось стабильным в буфере вплоть до 24 ч, то растворимость измеряли через 24 ч, иначе регистрируют данные кинетической растворимости. Данные о растворимости при различных условияхpH через 24 ч (мг/мл) представлены ниже в табл. 1. Используя описанное выше исследование, получили представленные ниже данные. Таблица 1 За счет улучшения зависимой от pH растворимости соединения согласно настоящему изобретению способны преодолеть зависимую от pH абсорбцию соединения. Следовательно, абсорбция соединения не будет зависеть от изменений содержания желудочной кислоты у пациента. Изменения значения pH желудка могут происходить под действием других принятых внутрь лекарственных средств или пищи. Соединение будет абсорбироваться более однородно независимо от pH желудка. Полезность. Соединения согласно настоящему изобретению являются применимыми в качестве пролекарственных средств соединения (1). Было показано, что соединение (1) представляет собой ингибитор IKur, таким образом, соединения согласно настоящему изобретению являются применимыми в лечении связанных сIKur нарушений. Анализы для определения степени активности соединения в качестве ингибитора IKur, хорошо известны в настоящей области техники и описаны в таких ссылках, как J. Gen. Physiol, 101(4):513-543 (Apr. 1993) и Br. J. Pharmacol, 115(2):267-274 (May 1995). Анализы для определения степени активности соединения в качестве ингибитора других представителей подсемейства Kv1 также хорошо известны в настоящей области техники. Например, ингибирование Kv1.1, Kv1.2 и Kv1.3 можно измерить с использованием процедур, описанных Grissmer, S. et al.,Mol. Pharmacol., 45(6): 1227-1234 (Jun. 1994); ингибирование Kv1.4 можно измерить с использованием процедур, описанных Petersen, K.R. et al., Pflugers Arch., 437(3):381-392 (Feb. 1999); ингибирование Kv1.6 можно измерить с использованием процедур, описанных Bowlby, M.R. et al., J. Neurophysiol. 73(6):22212229 (Jun. 1995); и ингибирование Kv1.7 можно измерить с использованием процедур, описанныхKalman, K. et al., J. Biol. Chem., 273(10):5851-5857 (Mar. 6, 1998). Полагают, что данные Kv1.5 (IC50=46 мМ) демонстрируют способность соединения 1 и, следовательно, соединений согласно настоящему изобретению действовать в качестве пролекарственных средств для соединения 1 для значительного увеличения ингибирования канала Kv1.5 потенциалзависимых K+ каналов. Предполагают, что в связи с проявлением активности в качестве ингибиторов каналаKv1.5 потенциалзависимых K+ каналов соединения согласно настоящему изобретению применимы в лечении заболеваний человека, связанных с каналом Kv1.5. Пролекарственные средства на основе фосфорамидной кислоты согласно настоящему изобретению подвергали анализам in vitro на клетках (фиксация потенциала) или изолированном сердце (метод Лангендорфа) и обнаружили, что соединения согласно настоящему изобретению превращались в свое исходное соединение в присутствии фосфатов, присутствующих в указанных анализах. Модели in vivo, модели PD на кроликах использовали для исследования соединений согласно настоящему изобретению. Модель PD на кроликах выбирали в качестве дополняющего исследования пролекарственных средств согласно настоящему изобретению, поскольку преобладающая экспрессия IKur в предсердии кролика и человека предоставляет полноценные данные фармакодинамики и безопасности для блокаторов IKur. В частности, модель эффективного рефрактерного периода предсердия кролика(AERP) использовали для исследования соединений согласно настоящему изобретению. Используемые для испытания соединений согласно настоящему изобретению модели in vivo подтвердили, что пролекарственные средства согласно настоящему изобретению эффективно расщепляются до соответствующих исходных соединений для обеспечения требуемой терапевтической активности в ингибированииIKur. Более того, фармакодинамическая оценка однократной дозы у кроликов показала, что соединения согласно настоящему изобретению характеризуются аналогичной фармакологией in vivo у кролика при сравнении с исходной формой пролекарственных средств. Кроме того, провели перекрестное исследование соединения 1 и соединения 2 (согласно примеру 1) после однократного перорального введения ненативным самцам яванского макака с предварительным лечением фамотидином или без него. Вид: самцов яванского макака (N=5), которых предварительно идентифицировали как отвечающих на лечение фамотидином, использовали для указанного исследования. Схема исследования: перекрестное исследования на четырех группах с 7-дневным отмывочным периодом между лечениями. Как исследуемые соединения, так и фамотидин вводили в желатиновых капсулах. Доза соединения 2 составляла 66,2 мг/капсула/животное,что эквивалентно 50 мг/капсула/животное соединения 1. Физическая форма как для соединения 1, так и соединения 2 являлась кристаллической. D90, D50 и D10 для соединения 1 составляли 12,5, 4,8 и 1,2 мкм соответственно. D90,D50 и D10 для соединения 2 составляли 13,9, 4 и 3,3 мкм соответственно. Таблица 2 Временные точки забора образцов: образцы крови собирали в 0 мин (перед введением дозы), через 15, 30, 45 мин, 1, 2, 4, 6, 8, 24 и 48 ч после введения дозы. Биологический анализ: образцы плазмы анализировали в отношении концентраций соединения 1 и соединения 2 с использованием научно обоснованных биоаналитических способов. Фармакокинетический анализ: фармакокинетические параметры Cmax, Tmax и AUC (0-t) рассчитывали с использованием способа некомпартментного анализа. Исследования фамотидина на яванских макаках: наблюдаемая биодоступность соединения 1 в настоящем исследования составляла 16% и наблюдаемая биодоступность соединения 1 при введении дозы в качестве пролекарственного средства, соединения 2 составляла 83%. Для соединения 1 снижение Cmax составляло 66-75%, когда яванские макаки получали предварительное лечение фамотидином, и значениеAUC (24 ч) снижалось на 21-66%. Для соединения 2 (измеряя соединение 1), наблюдали снижение в значении Cmax с -31 до 25% и снижение AUC (24 ч) с 2 до 15%, когда яванские макаки получали предварительное лечение фамотидином. Исследования фамотидина на яванских макаках: биодоступность соединения 1 в DIC улучшалась с 16 до 83% с введением дозы соединения 2 (при 10 мг/кг). Минимальное изменение в значении Cmax и AUC соединения 1 наблюдали при лечении фамотидином, с помощью соединения 2. Пролекарственные средства на основе N-сульфонилфосфорамидной кислоты характеризуются улучшенным профилем зависимой от pH растворимости соединения 1 (показанного в примере 1) с превосходным воздействием в дозе 5 и 100 мг/кг кристаллической суспензии у крыс с повышенной биодоступностью и при отсутствии наблюдаемого существенного содержания циркулирующего пролекарственного средства. Провели фармакокинетические исследования высоких доз у крыс (100 мг/кг) и обнаружили, что присутствовало 1% циркулирующего пролекарственного средства. Соединения согласно настоящему изобретению можно вводить внутривенно или перорально для ограничение зависимой от pH растворимости. Физические, химические свойства и свойства растворимости указанных пролекарственных средств можно дополнительно модулировать путем выбора противоиона фармацевтически приемлемой соли. Соединения согласно настоящему изобретение представляют собой пролекарственные средства соединения (1). В связи с этим соединения согласно настоящему изобретение характеризуются применимостью в обеспечении соединения (1) в качестве терапевтического средства. Соединение (1) ингибирует подсемейство Kv1 потенциалзависимых K+ каналов, и по этой причине предполагают, что они применимы в лечении и/или профилактике следующих различных нарушений: сердечные аритмии, включая в себя наджелудочковые аритмии, предсердные аритмии, трепетание пред- 14024692 сердий, фибрилляция предсердий, осложнения сердечной ишемии, и применяются в качестве средств для контроля частоты сердечных сокращений, включая в себя поддержание нормального синусового ритма; стенокардия, включая в себя облегчение симптомов Принметала, вазоспастических симптомов и вариантных симптомов; нарушения со стороны желудочно-кишечного тракта, включая в себя рефлюксный эзофагит, функциональную диспепсию, нарушения перистальтики (включая в себя запор и диарею) и синдром раздраженного кишечника; нарушения сосудистой и висцеральной гладкой мускулатуры, включая в себя бронхиальную астму, хроническую обструктивную болезнь легких, синдром острой дыхательной недостаточности у взрослых, заболевание периферических кровеносных сосудов (включая в себя перемежающуюся хромоту), венозную недостаточность, импотенцию, церебральный и коронарный спазм и болезнь Рейно; воспалительное и иммунологическое заболевание, включая в себя воспалительное заболевание кишечника, ревматоидный артрит, отторжение трансплантата, бронхиальную астму,хроническую обструктивную болезнь легких, кистозный фиброз и атеросклероз; нарушения клеточной пролиферации, включая в себя рестеноз и злокачественную опухоль (включая в себя лейкоз); нарушения системы слуха; нарушения зрительной системы, включая в себя макулярную дегенерацию и катаракту; диабет, включая в себя диабетическую ретинопатию, диабетическую нефропатию и диабетическую нейропатию; мышечное заболевание, включая в себя миотонию и атрофию; периферическая нейропатия; когнитивные расстройства; мигрень; потеря памяти, включая в себя болезнь Альцгеймера и деменцию; опосредованные ЦНС двигательная дисфункция, включая в себя болезнь Паркинсона и атаксию; эпилепсия; и другие опосредованные ионными каналами нарушения. Поскольку соединение (1) представляет собой ингибитор подсемейства Kv1 потенциалзависимыхK+ каналов, предполагают, что соединение (1) применимо для лечения различных дополнительных нарушений, включая в себя следующее: невосприимчивость трансплантата органов или ткани, реакция"трансплантат против хозяина", обусловленная пересадкой костного мозга, ревматоидный артрит, системная красная волчанка, аутоиммунный тиреоидит, рассеянный склероз, тяжелая миастения, увеит при диабете I типа, ювенильный сахарный диабет или сахарный диабет с поздним началом, задний увеит,аллергический энцефаломиелит, гломерулонефрит, инфекционные заболевания, вызванные патогенными микроорганизмами, воспалительные и гиперпролиферативные кожные заболевания, псориаз, атопический дерматит, контактный дерматит, экзематозный дерматит, себорейный дерматит, красный плоский лишай, обыкновенная пузырчатка, буллезный пемфигоид, буллезный эпидермолиз, крапивница, острый ограниченный отек, васкулит, эритемы, кожные эозинофилии, красная волчанка, акне, очаговая алопеция, кератоконъюнктивит, весенний конъюнктивит, связанный с болезнью Бехчета увеит, кератит, герпетический кератит, коническая роговица, дистрофия роговицы Фукса, бельмо роговицы, пемфигоид конъюнктивы, склерит - язва Мурена, эндокринная офтальмопатия, синдром Фогта-Коянаги-Гадара, саркоидоз, аллергии на пыльцу, обратимое обструктивное заболевание дыхательных путей, бронхиальная астма, аллергическая бронхиальная астма, эндогенная бронхиальная астма, экзогенная бронхиальная астма, вызванная пылью бронхиальная астма, хроническая или трудноизлечимая бронхиальная астма,поздняя бронхиальная астма и гиперреактивность дыхательных путей, бронхит, язвы желудка, вызванное ишемическими заболеваниями и тромбозом повреждение сосудов, ишемические заболевания кишечника,воспалительные заболевания кишечника, некротизирующий энтероколит, поражения кишечника, связанные с термическими ожогами и опосредованными лейкотриеном B4 заболеваниями, заболевания брюшной полости, проктит, эозинофильный гастроэнтерит, мастоцитоз, болезнь Крона, язвенный колит, мигрень, ринит, экзема, интерстициальный нефрит, синдром Гудпасчера, гемолитический уремический синдром, диабетическая нефропатия, рассеянный склероз, синдром Гийена-Барре, болезнь Меньера, полиневрит, множественный неврит, мононеврит, радикулопатия, гипертиреоидит, диффузный токсический зоб, истинная эритроцитарная аплазия, апластическая анемия, гипопластическая анемия, идиопатическая тромбоцитопеническая пурпура, аутоиммунная гемолитическая анемия, агранулоцитоз, злокачественная анемия, мегалобластическая анемия, анэритроплазия, остеопороз, саркоидоз, пневмофиброз, идиопатическая межуточная пневмония, дерматомиозит, вульгарная лейкодерма, вульгарный ихтиоз, фотоаллергическая чувствительность, кожная Т-клеточная лимфома, артериосклероз, атеросклероз, синдром аортита, нодозный полиартериит, миокардоз, склеродермия, гранулема Вегенера, синдром Шегрена, адипоз,эозинофильный фасцит, повреждения десны, периодонта, альвеолярной кости, цементного вещества зубов, гломерулонефрит, мужская форма алопеции или сенильная алопеция за счет профилактической эпиляции или обеспечивая прорастание волос и/или стимулируя развитие и рост волос, мышечная дистрофия; пиодермия и синдром Сезари, болезнь Аддисона, ишемически-реперфузионное повреждение органов, которое происходит при консервации, трансплантации или ишемическом заболевании, синдром токсического шока, псевдомембранозный колит, вызванный лекарственным средством или облучением колит, ишемическая острая почечная недостаточность, хроническая почечная недостаточность, токсикоз,вызванный кислородом в легких или лекарственными средствами, рак легких, эмфизема легких, катаракта, сидероз, пигментный ретинит, возрастная макулярная дегерация, рубцевание стекловидного тела,ожог роговицы щелочью, дерматит -экссудативная эритема, линеарный IgA-зависимый буллезный дерматит и цементный дерматит, гингивит, периодонит, сепсис, панкреатит, вызванные загрязнением окружающей среды заболевания, старение, карциногенез, метастазирование карциномы и гипобаропатия,- 15024692 заболевание, вызванное высвобождением гистамина или лейкотриена-C4, болезнь Бехчета, аутоиммунный гепатит, первичный биллиарный цирроз, склерозирующий холангит, частичная резекция печени,острый некроз печени, вызванный токсином некроз, вирусный гепатит, шок, или аноксия, вирусный гепатит В, не-A/не-B гепатит, цирроз, алкогольный цирроз, печеночная недостаточность, фульминантная печеночная недостаточность, печеночная недостаточность с поздним началом, "острая-на-хроническую" печеночная недостаточность, нарастание химиотерапевтического эффекта, цитомегаловирусная инфекция, инфекция ЦМВЧ, СПИД, злокачественная опухоль, сенильная деменция, травма и хроническая бактериальная инфекция. Соединение (1) представляет собой потенциальное антиаритмическое средство, которое является применимым в профилактике и лечении (включая в себя частичное облегчение или устранение) аритмий. В качестве ингибиторов Kv1,5 соединения в пределах объема настоящего изобретения являются особенно применимыми в селективной профилактике и лечении наджелудочковых аритмий, таких как фибрилляция предсердий и трепетание предсердий. Под "селективной профилактикой и лечением наджелудочковых аритмий" подразумевают профилактику или лечение наджелудочковых аритмий, при которых соотношение удлинения эффективного рефрактерного периода предсердия к удлинению эффективного рефрактерного периода желудочка составляет больше чем 1:1. Указанное соотношение также может быть больше чем 4:1, даже больше чем 10:1. Кроме того, соотношение может быть таким, что удлинение эффективного рефрактерного периода предсердия достигается без заметно обнаруживаемого удлинения эффективного рефрактерного периода желудочка Кроме того, соединение (1) блокирует IKur и, таким образом, может быть применимым в профилактике и лечении всех связанных с IKur состояний. "Связанное сIKur состояние" представляет собой нарушение, которое можно предотвратить, частично облегчить или вылечить путем введения блокатора IKur. Известно, что ген Kv1,5 экспрессируется в ткани желудка, ткани кишечника/толстой кишки, легочной артерии и бета-клетках поджелудочной железы. Таким образом,введение блокатора IKur может обеспечить применимое лечение таких нарушений, как: рефлюксный эзофагит, функциональная диспепсия, запор, бронхиальная астма и диабет. Кроме того, известно, чтоKv1,5 экспрессируется в аденогипофизе. Таким образом, введение блокатора IKur может стимулировать секрецию гормона роста Ингибиторы IKur могут быть дополнительно применимыми при таких нарушениях клеточной пролиферации, как лейкоз, и таких аутоиммунных заболеваниях, как ревматоидный артрит и отторжение трансплантата. Настоящее изобретение, таким образом, включает способы профилактики или лечения одного или нескольких вышеупомянутых нарушений, включающие стадию введения нуждающемуся в этом субъекту эффективного количества по меньшей мере одного соединения формулы I, II или III, предпочтительно соединения, проиллюстрированного в примерах, более предпочтительно в примерах 1-8, даже более предпочтительно в примере 1. Другие терапевтические средства, такие как описанные ниже терапевтические средства, могут применяться с соединениями согласно настоящему изобретению в настоящих способах. В способах согласно настоящему изобретению такое(ие) другое(ие) терапевтическое(ие) средство(а) могут быть введены до, одновременно или после введения соединения(й) согласно настоящему изобретению. Дозировка и состав. Настоящее изобретение также включает фармацевтические композиции, содержащее по меньшей мере одно из соединений формулы I, II, III, предпочтительно соединения, проиллюстрированные во всех примерах, более предпочтительно в примере 1, или их соли, способные к профилактике или лечению одного или нескольких вышеупомянутых нарушений, в количестве, эффективном для этого, и фармацевтически приемлемый инертный наполнитель или разбавители. Композиции согласно настоящему изобретению могут содержать другие описанные ниже терапевтические средства и могут быть введены в состав, например, с использованием общепринятых твердых или жидких инертных наполнителей или разбавителей, а также фармацевтических добавок того типа, который соответствует способу требуемого введения (например, вспомогательные вещества, связующие, консерванты, стабилизаторы, ароматизаторы и т.д.) согласно таким техникам, которые хорошо известны в настоящей области получения фармацевтических составов. Соединения формулы I, II, III, предпочтительно соединения, проиллюстрированные во всех примерах, более предпочтительно в примере 1, можно вводить любыми подходящими способами, например перорально, например, в форме таблеток, капсул, гранул или порошков; сублингвально; буккально; парентерально, например, с помощью техник подкожной, внутривенной, внутримышечной или интрастернальной инъекции или инфузии (например, в виде стерильных водных или неводных растворов или суспензий для инъекций); назально, например, с помощью спрея для ингаляции; местно, например, в форме крема или мази; или ректально, например, в форме суппозиториев; в составах дозированных единиц, содержащих нетоксические фармацевтически приемлемые инертные наполнители или разбавители. Настоящее соединения, например, можно вводить в форме, подходящей для немедленного высвобождения или замедленного высвобождения. Немедленное высвобождение или замедленное высвобождение может быть достигнуто путем применения подходящих фармацевтических композиций, содержащих настоящие соединения, или, в частности, в случае замедленного высвобождения, путем применения таких уст- 16024692 ройств, как подкожные имплантаты или осмотические насосы. В случае, когда соединения формулы I, II,III, предпочтительно соединения, проиллюстрированные во всех примерах, более предпочтительно в примере 1, вводят для профилактики или лечения аритмий, соединения могут быть введены для достижения химического превращения в нормальный синусовый ритм, или могут необязательно использоваться совместно с электрокардиоверсией. Иллюстративные композиции для перорального введения включают в себя суспензии, которые могут содержать, например, микрокристаллическую целлюлозу для придания объема, альгиновую кислоту или альгинат натрия в качестве суспендирующего средства, метилцеллюлозу в качестве усилителя вязкости и такие подсластители или ароматизаторы, которые известны в настоящей области техники; и таблетки немедленного высвобождения, которые могут содержать, например, микрокристаллическую целлюлозу, гидрофосфат кальция, крахмал, стеарат магния и/или лактозу и/или другие вспомогательные вещества, связующие, наполнители, разрыхлители, разбавители и смазывающие средства, которые известны в настоящей области техники. Соединения формулы I, II, III, предпочтительно соединения, проиллюстрированные во всех примерах, более предпочтительно в примере 1, также могут быть доставлены через ротовую полость путем сублингвального и/или буккального введения. Формованные таблетки,прессованные таблетки или лиофилизированные таблетки представляют собой иллюстративные формы,которые могут быть использованы. Иллюстративные композиции включают в себя композиции, в которых настоящее(ие) соединение(я) включено(ы) в состав с такими быстрорастворяющими разбавителями,как маннит, лактоза, сахароза и/или циклодекстрины. Также в такие составы могут быть включены такие высокомолекулярные вспомогательные вещества, как целлюлозы (AVICEL) или полиэтиленгликоли(PEG). Такие составы также могут включать в себя такое вспомогательное вещество для содействия адгезии к слизистым оболочкам, как гидроксипропилцеллюлоза (НРС), гидроксипропилметилцеллюлоза(НРМС), натрийкарбоксиметилцеллюлоза (SCMC), сополимер малеинового ангидрида (например,Gantrez), и такие средства для контроля высвобождения, как полиакриловый сополимер (например,Carbopol 934). Смазывающие средства, способствующие скольжению средства, ароматизаторы, красители и стабилизаторы также могут быть добавлены для простоты производства и применения. Иллюстративные композиции для введения с помощью назального аэрозоля или ингаляции включают в себя растворы в солевом растворе, которые могут содержать, например, бензиловый спирт или другие подходящие консерванты, стимуляторы абсорбции для усиления биодоступности и/или другие солюбилизаторы или диспергирующие средства, которые известны в настоящей области техники. Иллюстративные композиции для парентерального введения включают в себя растворы или суспензии для инъекций, которые могут содержать, например, подходящие нетоксические, парентерально приемлемые разбавители или растворители, такие как маннит, 1,3-бутандиол, вода, раствор Рингера, изотонический раствор хлорида натрия, или другие подходящие диспергирующие или смачивающие и суспендирующие средства, включая в себя синтетические моно- или диглицериды и жирные кислоты,включая в себя олеиновую кислоту. Иллюстративные композиции для ректального введения включают в себя суппозитории, которые могут содержать, например, такое подходящее нераздражающее вспомогательное вещество, как масло какао, синтетические сложные эфиры глицерида или полиэтиленгликоли, которые являются твердыми при обычных температурах, но превращаются в жидкость и/или растворяются в ректальной полости для высвобождения лекарственного средства. Иллюстративные композиции для местного введение включают в себя такой местный носитель, какPlastibase (минеральное масло, желатинизированное с помощью полиэтилена). Эффективное количество соединения согласно настоящему изобретению может быть определено специалистом в настоящей области техники, и включает в себя иллюстративные дозированные количества для взрослого человека от приблизительно 0,001 до 100 мг/кг массы тела активного соединения в день, которое может быть введено в однократной дозе или в форме отдельных разделенных доз, например, от 1 до 4 раз в день. Предпочтительные диапазоны доз для человека составляют от приблизительно 1 до приблизительно 10 мг один раз в день и даже более предпочтительные диапазоны составляют от приблизительно 2 до приблизительно 6 мг один раз в день. Следует понимать, что конкретный уровень дозы и частота дозировки для любого конкретного субъекта могут варьировать и будут зависеть от факторов, включающих в себя активность конкретного используемого соединения, метаболическую стабильность и продолжительность действия указанного соединения, вид, возраст, массу тела, общее состояния здоровья, пол и рацион питания субъекта, путь и время введения, скорость выведения, комбинацию лекарственных средств и тяжесть конкретного состояния. Предпочтительные субъекты для лечения включают в себя животных, наиболее предпочтительно такие виды млекопитающих, как люди и домашние животные, такие как собаки, кошки и подобное, подвергающиеся вышеупомянутым нарушениям. Соединения согласно настоящему изобретению можно использовать отдельно или в комбинации друг с другом и/или другими подходящими терапевтическими средствами, применимыми в лечении вышеупомянутых нарушений или других нарушений, включая в себя следующее: другие антиаритмические средства, такие как средства I класса (например, пропафенон), средства II класса (например, карвадиол и пропранолол), средства III класса (например, соталол, дофетилид, амиодарон, азимилид и ибутилид),- 17024692 средства IV класса (например, дилтиазем и верапамил), антагонисты 5HT (например, суламсерод, сертралин и трописертон) и дронедарон; такие блокаторы кальциевых каналов (как L-типа, так и Т-типа),как дилтиазем, верапамил, нифедипин, амлодипин и мибефрадил; такие ингибиторы циклооксигеназы(т.е. ингибиторы СОХ-1 и/или СОХ-2), как аспирин, индометацин, ибупрофен, пироксикам, напроксен,CELEBREX, VIOXX и НПВС; такие антитромбоцитарные средства, как блокаторы GPIIb/IIIa (например, абциксимаб, эптифибатид и тирофибан), антагонисты P2Y12 (например, клопидогрель, кангрелор, тиклопидин и CS-747), антагонисты P2Y1, антагонисты рецептора тромбоксана (например, ифетробан), аспирин, и ингибиторы PDE-III (например, дипиридамол) с аспирином или без него; такие диуретики, как хлоротиазид, гидрохлоротиазид, флуметиазид, гидрофлуметиазид, бендрофлуметиазид, метилхлоротиазид, трихлорометиазид, политиазид, бензтиазид, этакриновая кислота, трикринафен, хлорталидон, фуросемид, мусолимин, буметанид, триамтренен, амилорид и спиронолактон; такие антигипертензивные средства, как альфа-адренергические блокаторы, бета-адренергические блокаторы, блокаторы кальциевых каналов, диуретики, ингибиторы ренина, ингибиторы АСЕ, (например, каптоприл, зофеноприл, фозиноприл, эналаприл, церонаприл, цилазаприл, делаприл, пентоприл, квинаприл, рамиприл, лизиноприл), антагонисты А II (например, лозартан, ирбесартан, валсартан), антагонисты ЕТ (например,ситаксентан, атрсентан и соединения, раскрытые в патентах США 5612359 и 6043265), двойной антагонист ET/AII (например, соединения, раскрытые в WO 00/01389), ингибиторы нейтральной эндопептидазы (NEP), ингибиторы вазопепсидазы (двойные ингибиторы NEP-ACE) (например, омапатрилат и гемопатрилат), нитраты, и комбинации таких антигипертензивных средств; такие антитромботические/тромболитические средства, как активатор тканевого плазминогена (tPA), рекомбинантный tPA,тенектеплаза (TNK), ланотеплаза (nPA), ингибиторы фактора VIIa, ингибиторы фактора Xa (такие как разаксабан), ингибиторы XIa, ингибиторы тромбина (например, гирудин и аргатробан), ингибиторы PAI1 (т.е. инактиваторы ингибиторов активатора тканевого плалзминогена), ингибиторы 2-антиплазмина,стрептокиназа, урокиназа, проурокиназа, анизоилированный активатор комплекса плазминогена и стрептокиназы, и активаторы плазминогена животных или слюнных желез; такие антикоагулирующие средства, как варфарин и гепарины (включая в себя нефракционированные и низкомолекулярные гепарины,такие как эноксапарин и далтепарин); такие ингибиторы ГМГ-КоА редуктазы, как правастатин, ловастатин, аторвастатин, симвастатин, NK-104 (также известный как итавастатин, или нисвастатин или нисбастатин) и ZD-4522 (также известный как розувастатин, или атавастатин или визастатин); другие снижающие содержание холестерина/липидов средства, такие как ингибиторы скваленсинтазы, фибраты и способствующие выведению желчных кислот средства (например, QUESTRAN); такие антипролиферативные средства, как циклоспорин A, TAXOL, FK 506 и адриамицин; такие противоопухолевые средства, как TAXOL, адриамицин, эпотилоны, цисплатин и карбоплатин; такие противодиабетические средства, как бигуаниды (например, метформин), ингибиторы глюкозидазы (например, акарбоз), инсулины, меглитиниды (например, репаглинид), сульфонилмочевины (например, глимепирид, глибурид и глипизид), комбинации бигуанида/глибурида (т.е. GLUCOVANCE), тиозилидиндионы (например, троглитазон, розиглитазон и пиоглитазон), агонисты PPAR-гамма, ингибиторы aP2 и ингибиторы DP4; тиромиметики (включая в себя антагонисты тиреоидных рецепторов) (например, тиротропин, политироид, KB130015 и дронедарон); такие антагонисты минералокортикоидных рецепторов, как спиронолактон и эплеринон; средства, восстанавливающие секрецию гормона роста; противоостеопорозные средства (например, алендронат и ралоксифен); такие средства гормонзаместительной терапии, как эстроген (включая в себя конъюгированные экстрогены в премарине), и эстрадиол; такие антидепрессанты, как нефазодон и сертралин; такие анксиолитические средства, как диазепам, лоразепам, буспирон и гидроксизин памоат; пероральные противозачаточные средства; такие противоязвенные средства и средства против гастроэзофагеального рефлюкса, как фамотидин, ранитидин и омепразол; такие средства против ожирения, как орлистат; сердечные гликозиды, включая в себя дигиталис и уабаин; ингибиторы фосфодиэстеразы, включая в себя ингибиторы PDE III (например, цилостазол), и ингибиторы PDE V (например, силденафил); ингибиторы протеин-тирозинкиназы; такие стероидные противовоспалительные средства, как преднизон и дексаметазон; и другие противовоспалительные средства, такие как ENBREL. Комбинации могут быть введены в состав совместно или находиться в форме наборов, упакованных для обеспечения соответствующих дозировок для совместного введения. Вышеперечисленные другие терапевтические средства при использовании в комбинации с соединениями согласно настоящему изобретению могут использоваться, например, в таких количествах, которые указаны в Настольном справочнике врача (PDR) или иным образом определены специалистом в настоящей области техники. Процитированные в настоящем описании изобретения публикации и ссылки, включая в себя без ограничения патенты и заявки на выдачу патента полностью в полной процитированной части включены в настоящий документ посредством ссылки, как если бы отдельная публикация или ссылка была конкретно и отдельно предусмотрена для включения посредством ссылки в настоящий документ как представленная в полном объеме. Любая заявка на выдачу патента, на основании которой испрашивается приоритет настоящей заявки, также включена в настоящий документ таким же образом, как описано выше для публикаций и ссылок. Наряду с тем, что настоящее изобретение было описано с акцентом на конкретные варианты осуществления, специалистам в настоящей области техники будет очевидно, что можно использовать варианты конкретных соединений и способов и что предусмотрено, что настоящее изобретение можно осуществить на практике иным способом, чем конкретно описано в настоящем документе. Соответственно, настоящее изобретение включает в себя все модификации, находящиеся в пределах сущности и объема настоящего изобретения, определяемых последующей формулой изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение структурной формулы I где R представляет собой H или -PO3H,или его фармацевтически приемлемая соль. 2. Соединение по п.1, где R представляет собой H, или его фармацевтически приемлемая соль. 3. Соединение по п.1, характеризующееся структурной формулой II 4. Соединение по пп.1, 2, где фармацевтически приемлемая соль представляет собой противоион; противоион представляет собой Na+, K+, Ca+2, Mg+2 или (NH3+-CH2-С(CH2OH)3). 5. Соединение по п.4, где соединение выбрано из 6. Соединение по п.1, где соединение характеризуется формулой III или его фармацевтически приемлемая соль. 7. Фармацевтическая композиция для лечения связанного с IKur состояния, содержащая терапевтически эффективное количество по меньшей мере одного соединения по любому из пп.1-6. 8. Способ лечения или профилактики аритмии, включающий введение нуждающемуся в этом пациенту эффективного количества по меньшей мере одного соединения по любому из пп.1-6. 9. Способ контроля частоты сердечных сокращений, включающий введение нуждающемуся в этом пациенту эффективного количества по меньшей мере одного соединения по любому из пп.1-6. 10. Способ лечения связанного с IKur состояния, включающий введение нуждающемуся в этом пациенту эффективного количества по меньшей мере одного соединения по любому из пп.1-6.
МПК / Метки
МПК: C07F 9/6558, C07D 401/14
Метки: фосфорамидной, основе, кислоты, пролекарства, 5-(5-фенил-4-(пиридин-2-илметиламино)хиназолин-2-ил)пиридин-3-сульфонамида
Код ссылки
<a href="https://eas.patents.su/21-24692-prolekarstva-5-5-fenil-4-piridin-2-ilmetilaminohinazolin-2-ilpiridin-3-sulfonamida-na-osnove-fosforamidnojj-kisloty.html" rel="bookmark" title="База патентов Евразийского Союза">Пролекарства 5-(5-фенил-4-(пиридин-2-илметиламино)хиназолин-2-ил)пиридин-3-сульфонамида на основе фосфорамидной кислоты</a>
Предыдущий патент: Способ синтеза спиртов
Следующий патент: Высоковольтный изолятор и высоковольтная линия электропередачи, использующая данный изолятор
Случайный патент: Устойчивые к имидазолиноновому гербициду растения подсолнечника и их применение












