Применение 2-[6-(3-аминопиперидин-1-ил)-3-метил-2,4-диоксо-3,4-дигидро-2н-пиримидин-1-илметил]-4-фторбензонитрила
Номер патента: 17799
Опубликовано: 29.03.2013
Авторы: Кристофер Роналд Дж., Огава Ацуси, Ковингтон Пол
Формула / Реферат
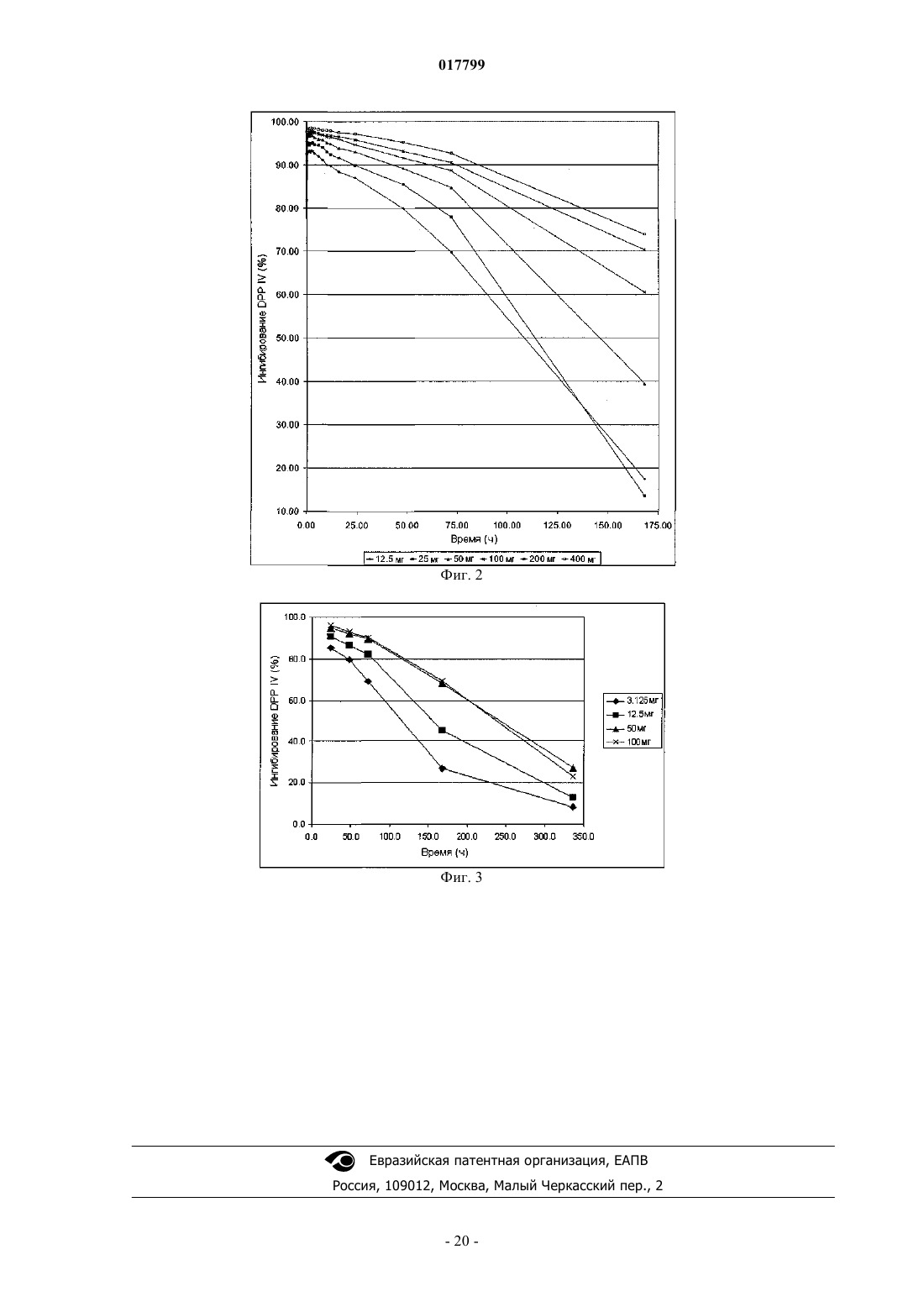
1. Применение 2-[6-(3-аминопиперидин-1-ил)-3-метил-2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-илметил]-4-фторбензонитрила (соединение I) или его фармацевтически приемлемой соли в качестве лекарственного средства при введении еженедельной дозы в пределах от 50 до 200 мг соединения I пациенту, где еженедельную дозу вводят один раз в неделю.
2. Применение по п.1, где еженедельная доза соединения I, вводимая пациенту, составляет от 100 до 200 мг.
3. Применение по п.1, где еженедельная доза соединения I, вводимая пациенту, составляет 50, 75, 100, 125, 150, 175 или 200 мг.
4. Применение 2-[6-(3-аминопиперидин-1-ил)-3-метил-2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-илметил]-4-фторбензонитрила (соединение I) или его фармацевтически приемлемой соли для лечения диабета при введении еженедельной дозы в пределах от 50 до 200 мг, где еженедельную дозу вводят один раз в неделю.
5. Применение 2-[6-(3-аминопиперидин-1-ил)-3-метил-2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-илметил]-4-фторбензонитрила (соединение I) или его фармацевтически приемлемой соли для лечения рака при введении еженедельной дозы в пределах от 50 до 200 мг, где еженедельную дозу вводят один раз в неделю.
6. Применение 2-[6-(3-аминопиперидин-1-ил)-3-метил-2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-илметил]-4-фторбензонитрила (соединение I) или его фармацевтически приемлемой соли для лечения аутоиммунных расстройств при введении еженедельной дозы в пределах от 50 до 200 мг, где еженедельную дозу вводят один раз в неделю.
7. Применение 2-[6-(3-аминопиперидин-1-ил)-3-метил-2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-илметил]-4-фторбензонитрила (соединение I) или его фармацевтически приемлемой соли для лечения ВИЧ-инфекции при введении еженедельной дозы в пределах от 50 до 200 мг, где еженедельную дозу вводят один раз в неделю.
8. Применение 2-[6-(3-аминопиперидин-1-ил)-3-метил-2,4-диоксо-3,4-дигидро-2Н-пиримидин-1-илметил]-4-фторбензонитрила (соединение I) или его фармацевтически приемлемой соли в получении лекарственного средства для лечения заболевания или состояния, выбранного из диабета, рака, аутоиммунного расстройства или ВИЧ-инфекции, причем лекарственное средство получают таким образом, что соединение I вводится в еженедельной дозе в пределах от 50 до 200 мг, где еженедельную дозу вводят один раз в неделю.
Текст
Предложено применение 2-[6-(3-аминопиперидин-1-ил)-3-метил-2,4-диоксо-3,4-дигидро-2 Нпиримидин-1-илметил]-4-фторбензонитрила и его фармацевтически приемлемой соли для ингибирования дипептидилпептидазы IV, в частности, для лечения состояний, опосредованных(71)(73) Заявитель и патентовладелец: ТАКЕДА ФАРМАСЬЮТИКАЛ КОМПАНИ ЛИМИТЕД (JP) Область, к которой относится изобретение Изобретение относится к применению 2-[6-(3-аминопиперидин-1-ил)-3-метил-2,4-диоксо-3,4 дигидро-2 Н-пиримидин-1-илметил]-4-фторбензонитрила (соединение I) или его фармацевтической соли для ингибирования дипептидилпептидазы IV и лечения состояний, опосредованных DPP-IV. Описание предшествующего уровня техники Дипептидилпептидаза IV (IUBMB Enzyme Nomenclature EC.3,4,14,5) представляет собой мембранный белок типа II, который в литературе имеет множество различных наименований, включая DPP4,DP4, DAP-IV, FAP, белок 2, образующий комплекс с аденозиндезаминазой, аденозиндезаминазасвязывающий белок (ADAbp), дипептидиламинопептидаза IV; Хаа-Pro-дипептидиламинопептидаза; GlyPro нафтиламидаза; постпролиндипептидиламинопептидаза IV; лимфоцитарный антиген CD26; гликопротеин GP110; дипептидилпептидаза IV; глицилпролинаминопептидаза; глицилпролинаминопептидаза;X-пролилдипептидиламинопептидаза; pepX; лейкоцитарный антиген CD26; глицилпролилдипептидиламинопептидаза; дипептидил-пептидгидролаза; глицилпролиламинопептидаза; дипептидиламинопептидаза IV; DPP IV/CD26; аминоацил-пролилдипептидиламинопептидаза; молекула, запускающая механизм Тклеток Тр 103; X-PDAP. Дипептидилпептидаза IV в настоящей заявке обозначена как "DPP-IV."DPP-IV представляет собой неклассическую серинаминодипептидазу, которая удаляет Хаа-Pro дипептиды с амино-конца (N-конца) полипептидов и белков. Также сообщалось о DPP-IV-зависимом медленном высвобождении дипептидов типа X-Gly или X-Ser для некоторых природных пептидов.DPP-IV конститутивно экспрессируется на эпителиальных и эндотелиальных клетках различных тканей (кишечника, печени, легких, почек и плаценты), и она также обнаружена в жидкостях организма.DPP-IV также экспрессируется на циркулирующих Т-лимфоцитах, и было показано, что она является синонимичной клеточно-поверхностному антигену CD-26.DPP-IV является ответственной за метаболическое расщепление некоторых эндогенных пептидов(GLP-1 (7-36), глюкагон) in vivo и продемонстрировала протеолитическую активность против различных других пептидов (GHRH, NPY, GLP-2, VIP) in vitro.GLP-1 (7-36) представляет собой состоящий из 29 аминокислот пептид, полученный в результате пост-трансляционного процессинга проглюкагона в тонком кишечнике. GLP-1 (7-36) проявляет различные действия in vivo, включая стимуляцию секреции инсулина, ингибирование секреции глюкагона, способствует насыщению и замедлению опорожнения желудка. На основании его физиологического профиля считают, что действия GLP-1 (7-36) являются благоприятными для профилактики и лечения диабета типа II и потенциального ожирения. Например, было обнаружено, что экзогенное введение GLP-1 (7-36)(непрерывная инфузия) диабетическим пациентам являтся эффективным в такой популяции пациентов. К сожалению, GLP-1 (7-36) быстро разлагается in vivo, и было показано, что он имеет короткий период полужизни in vivo (t1/2=1,5 мин). На основании исследования генетически выведенных мышей с DPP-IV "нокаутом" и на основанииin vivo/in vitro исследований с селективными ингибиторами DPP-IV, было показано, что DPP-IV является основным ферментом, разлагающим GLP-1 (7-36) in vivo. GLP-1 (7-36) разлагается под действием DPPIV эффективным образом до GLP-1 (9-36), который, как считают, действует как физиологический антагонист GLP-1 (7-36). Поэтому считают, что ингибирование DPP-IV in vivo должно быть полезным для потенцирования эндогенных уровней GLP-1 (7-36) и снижения образования его антагониста GLP-1 (936). Таким образом, считают, что ингибиторы DPP-IV представляют собой полезные средства для профилактики, замедления развития и/или лечения состояний, опосредованных DPP-IV, в частности, диабета и, более конкретно, сахарного диабета типа 2, диабетической дислипидемии, состояний, характеризующихся нарушенной толерантностью к глюкозе (IGT); состояний, характеризующихся нарушением уровня глюкозы в плазме натощак (IFG), метаболического ацидоза, избыточного накопления кетоновых тел, регуляции аппетита и ожирения. Было показано, что некоторые соединения ингибируют DPP-IV. Тем не менее, все еще существует потребность в новых ингибиторах DPP-IV и способах введения таких ингибиторов для лечения заболевания. Краткое изложение изобретения Настоящее изобретение относится к применению 2-[6-(3-аминопиперидин-1-ил)-3-метил-2,4 диоксо-3,4-дигидро-2 Н-пиримидин-1-илметил]-4-фторбензонитрила (соединение I) структурной формулы в качестве лекарственного средства при введении один раз в неделю дозы в пределах от 50 до 250 мг соединения I пациенту. Введение выполняют один раз в неделю и, необязательно, его осуществляют 1 раз в неделю в виде разовой дозы. Необязательно, введение осуществляют 1 раз в неделю в течение периода времени по меньшей мере 30 дней и, необязательно, в течение периода времени по меньшей мере 60 дней. В одном варианте введение осуществляют 1 раз в неделю утром и, необязательно, осуществляют 1 раз в неделю утром до первого приема пищи пациентом в этот день. Введение можно осуществлять при помощи различных способов введения, включая, но не ограничиваясь этим, способ, выбранный из группы, включающей пероральное, парентеральное, интраперитонеальное, внутривенное, внутриартериальное, чрескожное, сублингвальное, внутримышечное, ректальное,трансбуккальное, интраназальное, липосомальное, при помощи ингаляции, вагинальное, внутриглазное,при помощи локальной доставки, подкожное, введение в жировую ткань, внутрисуставное, интраперитонеальное и интратекальное введение. В одном конкретном варианте введение осуществляют перорально. Соединение I можно использовать для лечения ряда заболеваний. В одном варианте введение соединения I осуществляют для лечения такого болезненного состояния пациента, как диабет типа I или типа II. В другом варианте введение соединения I осуществляют для лечения пред-диабетических пациентов. Еще в одном варианте введение соединения I осуществляют для лечения воспалительного заболевания кишечника, болезни Крона, энтеритов, вызванных химиотерапией, мукозита слизистой оболочки полости рта или синдрома укороченной толстой кишки. В другом варианте введение соединения I или фармацевтической композиции, включающей соединение I, осуществляют для улучшения приживаемости после трансплантации костного мозга. В другом варианте введение соединения I осуществляют для лечения пациентов, страдающих от состояний, опосредованных DPP-IV, таких как диабет и, более конкретно, сахарный диабет типа 2; диабетическая дислипидемия; нарушенная толерантность к глюкозе (IGT); нарушенный уровень глюкозы в плазме натощак (IFG); метаболический ацидоз; избыточное накопление кетоновых тел; для регулирования аппетита; ожирение; осложнения, связанные с диабетом, включая диабетическую невропатию, диабетическую ретинопатию и заболевание почек; гиперлипидемия, включая гипертриглицеридемию, гиперхолестеринемию, гипо(ЛВП)емию и постпрандиальную гиперлипидемию; атеросклероз; артериальная гипертензия; инфаркт миокарда, стенокардия, церебральный инфаркт, церебральная апоплексия и метаболический синдром. Соединение I может быть введено в сочетании с одним или несколькими противодиабетическими или инкретиновыми соединениями, отличными от соединения I. Такая комбинированное терапевтическое применение осуществляют при введении пациенту один раз в неделю дозы, находящейся в пределах от 50 до 250 мг соединения I. В одном варианте пациенту один раз в неделю вводят дозу 50, 75 или 100 мг, 150 или 200 мг соединения I в сочетании с одним или несколькими противодиабетическими соединениями, отличными от соединения I. Необходимо отметить, что в настоящей заявке предусматриваются некоторые другие пределы доз для конкретного противодиабетического и инкретинового соединения. Предполагается, что в объем настоящего изобретения включены сочетания лекарственных средств,охватывающие все раскрываемые пределы для соединения I в сочетании с любыми пределами доз, описанных в настоящей заявке для других противодиабетических или инкретиновых соединений. Сочетание соединения I с одним или несколькими противодиабетическими соединениями, отличными от соединения I, обеспечивает отличные эффекты, такие как 1) усиление терапевтических эффектов соединения I и/или противодиабетических соединений; 2) снижение побочных эффектов соединенияI и/или противодиабетических соединений; и 3) снижение дозы соединения I и/или противодиабетических соединений. Одно или несколько противодиабетических или инкретиновых соединений для введения в сочетании с соединением I, необязательно, могут быть выбраны из группы, включающей модуляторы сигнального пути инсулина, соединения, влияющие на нарушенную продукцию глюкозы в печени, средства,усиливающие чувствительность к инсулину, и средства, стимулирующие секрецию инсулина. Одно или несколько противодиабетических или инкретиновых соединений для введения в сочетании с соединением I также, необязательно, могут быть выбраны из группы, включающей ингибиторы протеинтирозинфосфатазы, ингибиторы глютамин-фруктоза-6-фосфатамидотрансферазы, ингибиторы глюкоза-6-фосфатазы, ингибиторы фруктоза-1,6-бисфосфатазы, ингибиторы гликогенфосфорилазы, антагонисты рецептора глюкагона, ингибиторы фосфоенолпируваткарбоксикиназы, ингибиторы киназы пируватдегидрогеназы, ингибиторы альфа-глюкозидазы, ингибиторы опорожнения желудка, активаторы глюкокиназы, агонисты рецептора GLP-1, агонисты рецептора GLP-2, модуляторы UCP, модуляторыRXR, ингибиторы GSK-3, модуляторы PPAR, метформин, инсулин, 2-адренергические антагонисты,деацетилазы (например, резерватрол, агонист сиртуина, полифенолы) и ингибиторы натрийзависимого транспорта глюкозы (SGLT2). Одно или несколько противодиабетических или инкретиновых соединений для введения в сочетании с соединением I также необязательно могут быть выбраны из группы, включающей ингибиторыGSK-3, агонисты ретиноидного X рецептора, агонисты бета-3 AR, модуляторы UCP, противодиабетические тиазолидиндионы, агонисты PPAR гамма не-глитазонового типа, агонисты двойного действия PPAR гамма/PPARальфа, противодиабетические ванадийсодержащие соединения и бигуаниды. Одно или несколько противодиабетических или инкретиновых соединений для введения в сочетании с соединением I также, необязательно, могут представлять собой тиазолидиндионы, выбранные из группы, включающей(S)-(3,4-дигидро-2-(фенилметил)-2 Н-1-бензопиран-6-ил)метилтиазолидин-2,4-дион,5-[4-(3-(5-метил-2-фенил-4-оксазолил)-1-оксопропил)фенил]метилтиазолидин-2,4-дион,5-[4-(1-метилциклогексил)метокси)фенил]метил]тиазолидин-2,4-дион,5-[4-(2-(1-индолил)этокси)фенил]метилтиазолидин-2,4-дион,5-4-[2-(5-метил-2-фенил-4-оксазолил)этокси]бензилтиазолидин-2,4-дион,5-(2-нафтилсульфонил)тиазолидин-2,4-дион,бис 4-[(2,4-диоксо-5-тиазолидинил)метил]фенилметан,5-4-[2-(5-метил-2-фенил-4-оксазолил)-2-гидроксиэтокси]бензилтиазолидин-2,4-дион,5-[4-(1-фенил-1-циклопропанкарбониламино)бензил]тиазолидин-2,4-дион,5-[4-(2-(2,3-дигидроиндол-1-ил)этокси)фенилметил]тиазолидин-2,4-дион,5-([3-(4-хлорфенил)-2-пропинил]-5-фенилсульфонил)тиазолидин-2,4-дион,5-[3-(4-хлорфенил)-2-пропинил]-5-(4-фторфенилсульфонил)тиазолидин-2,4-дион,5-[4-(2-(метил-2-пиридиниламино)этокси)фенил]метилтиазолидин-2,4-дион,5-[4-(2-(5-этил-2-пиридил)этокси)фенил]метилтиазолидин-2,4-дион,5-[4-3,4-дигидро-6-гидрокси-2,5,7,8-тетраметил-2 Н-1-бензопиран-2-ил)метокси)фенил]метилтиазолидин-2,4-дион,5-[6-(2-фторбензилокси)нафталин-2-илметил]тиазолидин-2,4-дион,5-([2-(2-нафтил)бензоксазол-5-ил]метил)тиазолидин-2,4-дион и 5-(2,4-диоксотиазолидин-5-илметил)-2-метокси-N-(4-трифторметилбензил)бензамид, включая любые фармацевтически приемлемые соли этих соединений. В одном варианте одно или несколько противодиабетических соединений для введения в сочетании с соединением I включают метформин. В одном конкретном варианте метформин в указанном сочетании включает одну или несколько фармацевтически приемлемых солей метформина. В другом конкретном варианте метформин в указанном сочетании включает HCl соль метформина. В другом конкретном варианте метформин в указанном сочетании вводят при суточной дозе в пределах от 125 до 2550 мг. В другом варианте метформин в указанном сочетании вводят при суточной дозе в пределах от 250 до 2550 мг. В других вариантах метформин в указанном сочетании вводят в лекарственной форме немедленного высвобождения или пролонгированного высвобождения. В другом варианте одно или несколько противодиабетических соединений для введения в сочетании с соединением I включают одно или несколько производных сульфонилмочевины. Одно или несколько противодиабетических соединений для введения в сочетании с соединением I также, необязательно, могут быть выбраны из группы, включающей глизоксепид, глибурид, глибенкламид, ацетогексамид, хлорпропамид, глиборнурид, толбутамид, толазамид, глипизид, карбутамид, гликуидон, глигексамид, фенбутамид, толцикламид, глимепирид и гликлазид, включая их любые фармацевтически приемлемые соли. В одном варианте одно или несколько противодиабетических соединений для введения в сочетании с соединением I включают глимепирид. Одно или несколько противодиабетических соединений для введения в сочетании с соединением I также, необязательно, могут быть выбраны из группы, включающей инкретиновые гормоны или их миметики, антагонисты бета-клеточных имидазолиновых рецепторов и быстродействующие стимуляторы секреции инсулина. В другом варианте одно или несколько противодиабетических соединений для введения в сочетании с соединением I включают инсулин. Одно или несколько противодиабетических соединений для введения в сочетании с соединением I также, необязательно, могут представлять собой один или несколько агонистов GLP-1, включая, например, экстендатид. Одно или несколько противодиабетических соединений для введения в сочетании с соединением I также, необязательно, могут представлять собой один или несколько агонистов GLP-2, включая, например, рекомбинантный человеческий GLP-2. Одно или несколько противодиабетических соединений для введения в сочетании с соединением I также, необязательно, могут представлять собой одно или несколько противодиабетических производных D-фенилаланина. Одно или несколько противодиабетических соединений для введения в сочетании с соединением I также, необязательно, могут быть выбраны из группы, включающей репаглинид, митиглинид и натеглинид, включая их любые фармацевтически приемлемые соли. В одном варианте одно или несколько противодиабетических соединений для введения в сочетании с соединением I включают кальциевую соль митиглинида в форме гидрата. Одно или несколько противодиабетических соединений для введения в сочетании с соединением I также, необязательно, могут представлять собой один или несколько ингибиторов альфа-глюкозидазы. Одно или несколько противодиабетических соединений для введения в сочетании с соединением I также, необязательно, могут быть выбраны из группы, включающей акарбозу, воглибозу и миглитол,включая их любые фармацевтически приемлемые соли. В одном варианте одно или несколько противодиабетических соединений для введения в сочетании с соединением I включают воглибозу. В другом варианте воглибозу, используемую в таком сочетании, вводят при суточной дозе в пределах от 0,1 до 1 мг. Одно или несколько противодиабетических соединений для введения в сочетании с соединением I также необязательно, могут представлять собой розиглитазон, включая его любые фармацевтически приемлемые соли. В одном варианте розиглитазон, используемый в таком сочетании, включает малеатную соль розиглитазона. Одно или несколько противодиабетических соединений для введения в сочетании с соединением I также, необязательно, могут представлять собой тезаглитазар, мураглитазар или навеглитазар, включая их любые фармацевтически приемлемые соли. Одно или несколько противодиабетических соединений для введения в сочетании с соединением I также, необязательно, могут представлять собой пиоглитазон, включая его любые фармацевтически приемлемые соли. В одном варианте пиоглитазон, используемый в таком сочетании, включает HCl соль пиоглитазона. В другом варианте пиоглитазон, используемый в таком сочетании, вводят при суточной дозе в пределах от 7,5 до 60 мг. В другом варианте пиоглитазон, используемый в таком сочетании, вводят при суточной дозе в пределах от 15 до 45 мг. Одно или несколько противодиабетических соединений для введения в сочетании с соединением I также, необязательно, могут включать метформин и пиоглитазон. В одном варианте пиоглитазон, используемый в таком сочетании, включает одну или несколько фармацевтически приемлемых солей пиоглитазона. В другом варианте пиоглитазон, используемый в таком сочетании, включает HCl соль пиоглитазона. Еще в одном варианте, пиоглитазон, используемый в таком сочетании, вводят при суточной дозе в пределах от 7,5 до 60 мг. В другом варианте, пиоглитазон, используемый в таком сочетании, вводят при суточной дозе в пределах от 15 до 45 мг. В другом варианте каждого из вышеприведенных вариантов, метформин, используемый в таком сочетании, включает одну или несколько фармацевтически приемлемых солей метформина. В одном конкретном варианте метформин, используемый в таком сочетании, включает HCl соль метформина. В другом конкретном варианте метформин, используемый в таком сочетании, вводят при суточной дозе в пределах от 125 до 2550 мг. Еще в одном варианте метформин,используемый в таком сочетании, вводят при суточной дозе в пределах от 250 до 2550 мг. В отношении каждого из приведенных выше вариантов воплощения изобретения и их вариантов соединение I можно вводить в форме свободного основания или в форме его фармацевтически приемлемой соли. В конкретных вариантах соединение I вводят в форме HCl, метансульфонатной, сукцинатной,бензоатной, толуолсульфонатной, R-(-)манделатной или бензолсульфонатной соли соединения I. Краткое описание чертежей Фиг. 1 иллюстрирует ингибирование DPP IV в плазме после разового перорального введения соединения I обезьяне; фиг. 2 - ингибирование DPP IV в плазме после разового перорального введения соединения I человеку; фиг. 3 - ингибирование DPP IV в плазме после разового перорального введения соединения I человеку. Определения Если не установлено иное, следующие термины, используемые в описании и формуле изобретения,должны иметь следующие значения в целях настоящей заявки."Заболевание" конкретно включает любое болезненное состояние животного или его органа и включает болезненное состояние, которое может быть вызвано или связано с медицинским или ветеринарным лечением, применяемым к этому животному, т.е. "побочными эффектами" такого лечения."Фармацевтически приемлемый" означает полезный для получения, являющийся в целом безопасным, нетоксичным и не являющийся ни биологически ни каким-либо иным образом нежелательным,включая приемлемый как для применения в ветеренарии, так и для фармацевтического применения для человека."Фармацевтически приемлемые соли" означает соли, которые являются фармацевтически приемлемыми, как определено выше, и которые обладают желаемой фармакологической активностью. Такие соли включают, но не ограничиваются этим, кислотно-аддитивные соли, образованные с неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, серная кислота, азотная кислота, фосфорная кислота и подобные; или с органическими кислотами, такими как уксусная кислота, трифторуксусная кислота, пропионовая кислота, капроновая кислота, энантовая кислота, циклопентанпропионовая кислота, гликолевая кислота, пировиноградная кислота, молочная кислота, малоновая кислота, янтарная кислота, оксиянтарная кислота, малеиновая кислота, фумаровая кислота, винная кислота, лимонная кислота, бензойная кислота, орто-(4-гидроксибензоил)бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, 1,2 этандисульфоновая кислота, 2-гидроксиэтансульфоновая кислота, бензолсульфоновая кислота, пара-4 017799 хлорбензолсульфоновая кислота, 2-нафталинсульфоновая кислота, пара-толуолсульфоновая кислота,камфорсульфоновая кислота, 4-метилбицикло[2,2,2]окт-2-ен-1-карбоновая кислота, глюкогептоновая кислота, 4,4'-метиленбис(3-гидрокси-2-ен-1-карбоновая кислота), 3-фенилпропионовая кислота, триметилуксусная кислота, трет-бутилуксусная кислота, лаурилсерная кислота, глюконовая кислота, глутаминовая кислота, гидроксинафтойная кислота, салициловая кислота, стеариновая кислота, муконовая кислота и подобные. Фармацевтически приемлемые соли также включают, но не ограничиваются этим, основноаддитивные соли, которые могут быть образованы, когда присутствующие кислотные протоны способны к взаимодействию с неорганическими или органическими основаниями. Приемлемые неорганические основания включают, но не ограничиваются этим, гидроксид натрия, карбонат натрия, гидроксид калия,гидроксид алюминия и гидроксид кальция. Приемлемые органические основания включают, но не ограничиваются этим, этаноламин, диэтаноламин, триэтаноламин, трометамин, N-метилглюкамин и подобные."Лечение" или "лечить" означает любое введение терапевтически эффективного количества соединения и включает:(1) профилактику возникновения заболевания у животного, которое может быть предрасположено к заболеванию, но пока еще не испытывает или не демонстрирует патологию или симптоматологию такого заболевания,(2) ингибирование заболевания у животного, которое испытывает или демонстрирует патологию или симптоматологию такого заболевания (т.е. остановку дальнейшего развития патологии и/или симптоматологии), или(3) облегчение заболевания у животного, которое испытывает или демонстрирует патологию или симптоматологию такого заболевания (т.е. обратное развитие патологии и/или симптоматологии). Подробное описание изобретения 1. Применение 2-[6-(3-аминопиперидин-1-ил)-3-метил-2,4-диоксо-3,4-дигидро-2 Н-пиримидин-1 илметил]-4-фторбензонитрила Настоящее изобретение относится к применению 2-[6-(3-аминопиперидин-1-ил)-3-метил-2,4 диоксо-3,4-дигидро-2 Н-пиримидин-1-илметил]-4-фторбензонитрила (обозначенному в настоящей заявке как "Соединение I"), структура которого приведена ниже. Пример 1 описывает один способ получения соединения I. Необходимо отметить, что могут быть использованы другие способы синтеза соединения I, как должно быть понятно специалистам в данной области. Как описано ниже, соединение I обладает пролонгированным действием ингибирования DPPIV. Соединение I можно применять в форме его свободного основания и также можно вводить в форме солей и гидратов, которые преобразуются in vivo в форму свободного основния соединения I. Например,в объем настоящего изобретения входит введение соединения I в виде фармацевтически приемлемой соли, полученной из различных органических и неорганических кислот и оснований, в соответствии с процедурами, хорошо известными в данной области. Как используется в настоящей заявке, соединение I включает соли и гидраты соединения I, если не указано иное. Фармацевтически приемлемая соль соединения I предпочтительно придает улучшенные фармакокинетические свойства соединению I по сравнению с формой его свободного основания. Фармацевтически приемлемые соли также могут изначально придавать желаемые фармакокинетические свойства соединению I, которые ранее отсутствовали у этого соединения, и даже могут положительно влиять на фармакодинамические свойства соединения, в том, что касается его терапевтической активности в организме. Конкретные примеры солей соединения I включают, но не ограничиваются этим, формы солей, образованных с неорганическими или органическими кислотами, например гидрогалогениды, такие как гидрохлорид, гидробромид, гидройодид; другие минеральные кислоты и их соотвествующие соли, такие как сульфат, нитрат, фосфат и т.д.; алкил и моноарилсульфонаты, такие как этансульфонат, толуолсульфонат и бензолсульфонат; и другие органические кислоты и их соответствующие соли, такие как ацетат,трифторацетат, тартрат, малеат, сукцинат, цитрат, бензоат, салицилат и аскорбат. Дополнительные кислотно-аддитивные соли включают, но не ограничиваются этим: адипат, альгинат, аргинат, аспартат,бисульфат, бисульфит, бромид, бутират, камфорат, камфорсульфонат, каприлат, хлорид, хлорбензоат,циклопентанпропионат, диглюконат, дигидрофосфат, динитробензоат, додецилсульфат, фумарат, галактерат (из муциновой кислоты), галактуронат, глюкогептаоат, глюконат, глутамат, глицерофосфат, гемисукцинат, гемисульфат, гептаноат, гексаноат, гиппурат, гидрохлорид, гидробромид, гидройодид, 2-5 017799 гидроксиэтансульфонат, йодид, изетионат, изобутират, лактат, лактобионат, малат, малонат, манделат,метафосфат, метансульфонат, метилбензоат, моногидрофосфат, 2-нафталинсульфонат, никотинат, нитрат, оксалат, олеат, памоат, пектинат, персульфат, фенилацетат, 3-фенилпропионат, фосфат, фосфонат и фталат. В конкретных вариантах соединение I вводят в виде HCl, метансульфонатной, сукцинатной, бензоатной, толуолсульфонатной, R-(-)манделатной или бензолсульфонатной соли соединения I. Пример 1 описывает получение формы сукцинатной соли соединения I. Введение и применение соединения I Настоящее изобретение относится к применению соединения I в качестве лекарственного средства для введения пациенту один раз в неделю с использованием дозы в пределах от 50 мг/неделя до 250 мг/неделя соединения I, необязательно в пределах от 50 до 200 мг соединения I, необязательно в пределах от 50 до 150 мг соединения I и необязательно в пределах от 50 до 100 мг соединения I (в каждом случае в расчете на молекулярную массу формы свободного основания соединения I). Конкретные количества доз, которые могут быть использованы, включают, но не ограничиваются этим, 50, 75 и 100 мг соединения I в неделю в режиме один раз в неделю. Необходимо заметить, что если конкретно не указано иное, соединение I можно вводить в форме его свободного основания или в виде фармацевтически приемлемой соли. Однако размер доз и диапазоны, указанные в настоящей заявке, всегда даются в расчете на молекулярную массу формы свободного основания соединения I. Соединение I можно вводить любым способом введения, в частности, путем перорального введения соединения I. Этот тип введения является предпочтительным, благодаря его простоте, а также тому, что пациент самостоятельно может осуществлять введение. Соединение I можно вводить любому пациенту, для которого может быть полезным курс лечения,приводящий к снижению активности DPP-IV in vivo. Фиг. 1 иллюстрирует, а пример 3 описывает наблюдаемый эффект, который введение соединения I оказывает на активность DPP-IV в плазме у обезьян после разового перорального введения. Как может быть видно из данных, представленных на фиг. 1, при введении соединения I один раз в день при уровнях дозирования, описанных в настоящей заявке, соединение I можно эффективно использовать в отношении болезненных состояний, когда желательно снизить активность DPP-IV в плазме. В свете представленных данных полагают, что при введении пациенту по меньшей мере 2,5 мг соединения I, активность DPP-IV в плазме пациента можно снизить более чем на 60% относительно базовой линии в течение периода времени, по меньшей мере 6 ч, 12 ч, 18 и даже 24 ч после введения. Кроме того, как подробно описано ниже, фиг. 2 и 3 иллюстрируют наблюдаемый эффект, который введение соединения I оказывает на активность DPP-IV в плазме человека после разового перорального введения. Как может быть видно из данных, представленных на фиг. 2, при введении соединения I при уровнях дозирования, описанных в настоящей заявке, соединение I может быть эффективно использовано в отношении болезненных состояний, когда желательно снизить активность DPP-IV в плазме. В свете представленных данных, полагают, что при введении пациенту по меньшей мере 12,5 мг соединения I,активность DPP-IV в плазме пациента может быть снижена более чем на 10% относительно базовой линии в течение периода времени по меньшей мере 168 ч после введения; при введении пациенту по меньшей мере 50 мг соединения I, активность DPP-IV в плазме пациента может быть снижена более чем на 35% относительно базовой линии в течение периода времени по меньшей мере 168 ч после введения; и при введении пациенту по меньшей мере 200 или 400 мг соединения I, активность DPP-IV в плазме пациента может быть снижена более чем на 70% относительно базовой линии в течение периода времени по меньшей мере 168 ч после введения. Примеры конкретных применений для введения соединения I включают, но не ограничиваются этим, профилактику, замедление развития и/или лечение состояний,опосредованных DPP-IV, в частности диабета и, более конкретно, сахарного диабета типа 2, диабетической дислипидемии, нарушенной толерантности к глюкозе (IGT), нарушенного уровня глюкозы в плазме натощак (IFG), метаболического ацидоза, избыточного накопления кетоновых тел, регулирования аппетита, ожирения и осложнений, связанных с диабетом, включая диабетическую невропатию, диабетическую ретинопатию, воспалительного заболевания кишечника, болезни Крона, энтеритов, вызванных химиотерапией, мукозитов слизистой оболочки полости рта, синдрома укороченной толстой кишки и заболевания почек. Состояния, опосредованные DPP-IV, дополнительно включают гиперлипидемию, такую как гипертриглицеридемия, гиперхолестеринемия, гипо(ЛВП)емия и гиперлипидемия после приема пищи; атеросклероз; артериальную гипертензию; инфаркт миокарда, стенокардию, церебральный инфаркт,церебральную апоплексию и метаболический синдром. Считается, что введение соединения I пациентам, страдающим диабетом типа I или типа II, в течение минимального периода лечения по меньшей мере 30 дней улучшает один или несколько сердечнососудистых показателей. Примеры сердечно-сосудистых показателей, которые могут быть улучшены,включают, но не ограничиваются этим, снижение среднего показателя систолического кровяного давления, повышение ЛВП холестерина, улучшение отношения ЛНП/ЛВП и снижение уровня триглицеридов. Также считается, что введение соединения I в сочетании с одним или несколькими противодиабе-6 017799 тическими соединениями пациентам, страдающим диабетом типа I или типа II, в течение минимального периода лечения по меньшей мере 30 дней улучшает один или несколько сердечно-сосудистых показателей. Примеры сердечно-сосудистых показателей, которые могут быть улучшены, включают, но не ограничиваются этим, снижение среднего показателя систолического кровяного давления, повышение ЛВП холестерина, улучшение отношения ЛНП/ЛВП и снижение уровня триглицеридов. Также считается, что введение соединения I в сочетании с одним или несколькими противодиабетическими или инкретиновыми соединениями пациентам, страдающим желудочно-кишечными воспалительными заболеваниями (включая, но не ограничиваясь этим, воспалительное заболевание кишечника,болезнь Крона, энтериты, вызванные химиотерапией, мукозит слизистой оболочки полости рта и синдром укороченной толстой кишки) в течение минимального периода лечения по меньшей мере 30 дней улучшает состояние слизистой выстилки желудочно-кишечного тракта. Улучшение состояния слизистой выстилки желудочно-кишечного тракта может быть продемонстрировано, но не ограничивается этим,увеличением площади поверхности в кишечнике, снижением воспаления и/или повышением абсорбции питательных веществ. В одном варианте соединение I вводят пациенту, страдающему диабетом типа 2. Пациенты, принимающие соединение I, также могут чаще иметь нарушение функции секреции инсулина из панкреатических островков, чем у пациентов, у которых наблюдается развитие резистентности к инсулину в периферических инсулин-чувствительных тканях/органах. Преимущественно, введение соединения I один раз в неделю, при уровнях дозирования, описанных в настоящей заявке, также можно использовать для лечения пациентов, которые являются преддиабетическими. Считается, что введение соединения I пациенту, который является преддиабетическим,полезно для замедления развития диабета типа II у такого пациента. Поддержание повышенного уровня глюкозы в крови десенсибилизирует функцию панкреатических островков и нарушает секрецию инсулина. Путем улучшения уровней циклического AMP и динамики кальция в бета-клетках, клетки активируют гены, восстанавливающие поврежденные клеточные компоненты, и являются менее чувствительными к токсичности глюкозы. Ожидается, что введение соединения I один раз в неделю при уровнях дозирования, описанных в настоящей заявке, будет иметь ряд желательных биологических эффектов in vivo. Например, введение соединения I один раз в неделю при уровнях дозирования, описанных в настоящей заявке, снижает уровень глюкозы в крови пациента по сравнению с плацебо контролем. Такое снижение уровня глюкозы в крови после приема пищи помогает диабетическим пациентам поддерживать более низкие уровни глюкозы. Ожидается также, что введение соединения I один раз в неделю при уровнях дозирования, описанных в настоящей заявке, будет иметь эффект повышения уровня инсулина у пациента или чувствительности к инсулину. Инсулин способствует поступлению глюкозы в мышечную, жировую и некоторые другие ткани. Механизм, посредством которого клетки могут поглощать глюкозу, состоит в облегчении диффузии путем стимуляции инсулинового рецептора. С-пептид и инсулин представляют собой белковые цепи, образованные путем активации и деления проинсулина (неактивного предшественника инсулина). С-пептид и инсулин образуются и хранятся в бета клетках поджелудочной железы. Когда инсулин высвобождается в кровоток, также высвобождаются равные количества С-пептида. Это делает С-пептид полезным в качестве маркера продукции инсулина. Введение соединения I в соответствии с настоящим изобретением, как ожидается, будет повышать уровни С-пептида в организме пациента. 3. Применение соединения I в комбинированной терапии Соединение I также может применяться в сочетании с одним или несколькими другими противодиабетическими и/или инкретиновыми соединениями. Примеры таких других противодиабетических соединений включают, но не ограничиваются этим, модуляторы сигнального пути инсулина, подобные ингибиторам протеинтирозинфосфатазы(РТРаза) и ингибиторам глютамин-фруктоза-6 фосфатамидотрансферазы (GFAT); соединения, влияющие на нарушенную продукцию глюкозы в печени, подобные ингибиторам глюкоза-6-фосфатазы (G6Pаза), ингибиторам фруктоза-1,6-бисфосфатазы (F1,6-ВРаза), ингибиторам гликогенфосфорилазы (GP), антагонистам рецептора глюкагона и ингибиторам фосфоенолпируваткарбоксикиназы (РЕРСК); ингибиторы пируватдегидрогеназакиназы (PDHK); средства, повышающие чувствительность к инсулину (инсулин-сенсибилизирующие вещества); средства, повышающие секрецию инсулина (усилители секреции инсулина); ингибиторы альфа-глюкозидазы; ингибиторы опорожнения желудка; активаторы глюкокиназы, агонисты рецептора GLP-1, агонисты рецептора GLP-2, модуляторы UCP, модуляторы RXR, ингибиторы GSK-3, модуляторы PPAR, метформин, инсулин и 2-адренергические антагонисты. Соединение I можно вводить по меньшей мере с одним другим из указанных противодиабетических соединений, либо одновременно в виде одной дозы, в одно и то же время в виде раздельных доз или последовательно (т.е., когда одну дозу вводят до или после введения другой дозы). Примеры ингибиторов РТРазы, которые могут быть использованы в сочетании с соединением I,включают, но не ограничиваются этим, ингибиторы, раскрытые в патентах США 6057316, 6001867 и публикациях заявок РСТWO 99/58518, WO 99/58522, WO 99/46268, WO 99/46267, WO 99/46244,-7 017799WO 99/46237, WO 99/46236 и WO 99/15529. Примеры ингибиторов GFAT, которые могут быть использованы в сочетании с соединением I,включают, но не ограничиваются этим, ингибиторы, раскрытые в Mol. Cell. Endocrinol. 1997, 135(1), 6777. Примеры ингибиторов G6Pазы, которые могут быть использованы в сочетании с соединением I,включают, но не ограничиваются этим, ингибиторы, раскрытые в публикациях заявок РСТWO 00/14090, WO 99/40062 и WO 98/40385, Европейской патентной публикацииЕР 682024 и Diabetes 1998, 47, 1630-1636. Примеры ингибиторов F-l,6-BРазы, которые могут быть использованы в сочетании с соединением I,включают, но не ограничиваются этим, ингибиторы, раскрытые в Публикациях заявок РСТWO 00/14095, WO 99/47549, WO 98/39344, WO 98/39343 и WO 98/39342. Примеры ингибиторов GP, которые могут быть использованы в сочетании с соединением I, включают, но не ограничиваются этим, ингибиторы, раскрытые в Патенте США 5998463, публикациях заявок РСТWO 99/26659, WO 97/31901, WO 96/39384 и WO 9639385 и Европейских патентных публикацияхЕР 978279 и ЕР 846464. Примеры антагонистов рецептора глюкагона, которые могут быть использованы в сочетании с соединением I, включают, но не ограничиваются этим, антагонисты, раскрытые в патентах США 5880139 и 5776954, публикациях заявок РСТWO 99/01423, WO 98/22109, WO 98/22108, WO 98/21957, WO 97/16442 и WO 98/04528 и описанные в Bioorg. Med. Chem. Lett. 1992, 2, 915-918, J. Med.Chem. 1998, 41, 5150-5157 и J. Biol Chem. 1999, 274; 8694-8697. Примеры ингибиторов РЕРСК, которые могут быть использованы в сочетании с соединением I,включают, но не ограничиваются этим, ингибиторы, раскрытые в патенте США 6030837 и Mol. Biol.Diabetes 1994, 2, 283-99. Примеры ингибиторов PDHK, которые могут быть использованы в сочетании с соединением I,включают, но не ограничиваются этим, ингибиторы, раскрытые в J. Med. Chem. 42 (1999) 2741-2746. Примеры средств, повышающих чувствительность к инсулину, которые могут быть использованы в сочетании с соединением I, включают, но не ограничиваются этим, ингибиторы GSK-3, агонисты рецептора ретиноида X (RXR), агонисты Бета-3 AR, модуляторы UCP, противодиабетические тиазолидиндионы (глитазоны), агонисты PPAR гамма не-глитазонного типа, двойные агонисты PPAR гамма/PPAR альфа, противодиабетические соединения, содержащие ванадий, и бигуаниды, такие как метформин. Примеры ингибиторов GSK-3 включают, но не ограничиваются этим, ингибиторы, раскрытые в публикациях заявок РСТWO 00/21927 и WO 97/41854. Примеры модуляторов RXR включают, но не ограничиваются этим, соединения, раскрытые в патентах США 4981784, 5071773, 5298429 и 5506102 и публикациях заявок РСТWO 89/05355,WO 91/06677, WO 92/05447, WO 93/11235, WO 95/18380, WO 94/23068 и WO 93/23431. Примеры агонистов Бета-3 AR включают, но не ограничиваются этим, CL-316,243 (Lederle Laboratories) и агонисты, раскрытые в патенте США 5705515 и публикациях заявок РСТWO 99/29672,WO 98/32753, WO 98/20005, WO 98/09625, WO 97/46556 и WO 97/37646. Примеры модуляторов UCP включают агонисты UCP-1, UCP-2 и UCP-3. Примеры модуляторовUCP включают, но не ограничиваются этим, модуляторы, раскрытые в Vidal-Puig et al, Biochem. Biophys.(ВМ-13.1246),5-(2-нафтилсульфонил)тиазолидин-2,4-дион (AY-31637), бис(4-[(2,4-диоксо-5-тиазолидинил)метил]фенилметан (YM268), 5-4[2-(5-метил-2-фенил-4-оксазолил)-2-гидроксиэтокси]бензилтиазолидин-2,4-дион (AD-5075), 5-[4-(1 фенил-1-циклопропанкарбониламино)бензил]тиазолидин-2,4-дион (DN-108), 5-[4-(2-(2,3-дигидроиндол 1-ил)этокси)фенилметил]тиазолидин-2,4-дион, 5-([3-(4-хлорфенил)-2-пропинил]-5-фенилсульфонил)тиазолидин-2,4-дион, 5-([3-(4-хлорфенил)-2-пропинил]-5-(4-фторфенилсульфонил)тиазолидин-2,4-дион, 5[4-(2-(метил-2-пиридиниламино)этокси)фенил]метилтиазолидин-2,4-дион(розиглитазон), 5-[4-(2-(5 этил-2-пиридил)этокси)фенил]метилтиазолидин-2,4-дион (пиоглитазон; продаваемый под торговой маркой ACTOS), 5-[6-(2-фторбензилокси)нафталин-2-илметил]тиазолидин-2,4-дион (МСС 555), 5-[2(2-нафтил)бензоксазол-5-ил]метилтиазолидин-2,4-дион (Т-174), эдаглитазон (ВМ-13-1258), ривоглитазон (CS-011) и 5-(2,4-диоксотиазолидин-5-илметил)-2-метокси-N-(4-трифторметилбензил)бензамид(KRP297). Примеры агонистов PPAR гамма не-глитазонного типа включают, но не ограничиваются этим, аналоги N-(2-бензоилфенил)-L-тирозина, такие как GI-262570, регликсан (JTT501) и FK-614 и метаглидазен(МВХ-102). Примеры двойных агонистов PPAR гамма/PPAR альфа включают, но не ограничиваются этим, оме-8 017799WO 99/08501 и Diabetes 2000, 49(5), 759-767; тезаглитазар, мураглитазар и навеглитазар. Примеры противодиабетических соединений, содержащих ванадий, включают, но не ограничиваются этим, соединения, раскрытые в патенте США 5866563. Метформин (диметилдигуанид) и его гидрохлоридная соль поставляются на рынок под торговой маркой GLUCOPHAGE. Примеры средств, повышающих секрецию инсулина, включают, но не ограничиваются этим, антагонисты рецептора глюкагона (как описано выше), производные сульфонилмочевины, инкретиновые гормоны или их миметики, в частности глюкагон-подобный пептид-1 (GLP-1), или агонисты GLP-1, антагонисты бета-клеточных имидазолиновых рецепторов и быстродействующие стимуляторы секреции инсулина, подобные противодиабетическим производным фенилуксусной кислоты, противодиабетическим производным D-фенилаланина и митиглинида и их фармацевтически приемлемые соли. Примеры производных сульфонилмочевины включают, но не ограничиваются этим, глизоксепид,глибурид, глибенкламид, ацетогексамид, хлорпропамид, глиборнурид, толбутамид, толазамид, глипизид,карбутамид, гликуидон, глигексамид, фенбутамид, толцикламид; глимепирид и гликлазид. Толбутамид,глибенкламид, гликлазид, глиборнурид, гликуидон, глизоксепид и глимепирид можно вводить в форме, в которой они поставляются на рынок под торговыми марками RASTINON HOECHST, AZUGLUCON,DIAMICRONT GLUBORID, GLURENORM, PRO-DIABAN и AMARYL, соответственно. Примеры агонистов GLP-1 включают, но не ограничиваются этим, агонисты, раскрытые в патентах США 5120712, 5118666 и 5512549 и РСТ публикацииWO 91/11457. В частности, агонисты GLP1 включают соединения, подобные GLP-1 (7-37), при этом в таких соединениях на карбокси-конце амидная функциональной группы Arg36 замещается на Gly в 37-м положении и GLP-1 (7-36)NH2 молекулы, и их варианты и аналоги, включая GLN9-GLP-1 (7-37), D-GLN9-GLP-1 (7-37), ацетил LYS9-GLP-1 (7-37),LYS18-GLP-1 (7-37) и, в частности, GLP-1 (7-37)OH, VAL8-GLP-1 (7-37), GLY8-GLP-1 (7-37), THR8-GLP-1(7-37), GLP-1 (7-37) и 4-имидазопропионил-GLP-1. Одним конкретным примером агониста GLP-1 является Экстендатид, состоящий из 39-аминокислот пептид-амид, который поставляется на рынок под торговой маркой BYETTA. Экзенатид имеет эмпирическую формулу C184H282N50O60S и молекулярную массу 4186,6 Да. Аминокислотная последовательность Экзенатида следующая: H-His-Gly-Glu-Gly-Thr-Phe-Thr-Ser-Asp-Leu-Ser-Lys-Gln-Met-Glu-Glu-GluAla-Val-Arg-Leu-Phe-Ile-Glu-Trp-Leu-Lys-Asn-Gly-Gly-Pro-Ser-Ser-Gly-Ala-Pro-Pro-Pro-Ser-NH2. Примеры агонистов глюкагон-подобного пептида-2 (GLP-2) или GLP-2 включают, но не ограничиваются этим, агонисты, раскрытые в патенте США 7056886 и публикациях заявок РСТWO 00/53208, WO 01/49314 и WO 03/099854. Одним конкретным примером агониста GLP-2 являетсяTEDUGLUTIDE, 39-аминокислотный пептид-амид (NPS Pharmaceuticals, Inc.). Примеры антагонистов бета-клеточных имидазолиновых рецепторов включают, но не ограничиваются этим, антагонисты, описанные в РСТ публикацииWO 00/78726 и J. Pharmacol. Exp. Ther. 1996; 278; 82-89. Примером противодиабетического производного фенилуксусной кислоты является репаглинид и его фармацевтически приемлемые соли. Примеры противодиабетических производных D-фенилаланина включают, но не ограничиваются этим, натеглинид (N-[(транс-4-изопропилциклогексил)карбонил]-D-фенилаланин, ЕР 196222 и ЕР 526171) и репаглинидS)-2-этокси-4-2-3-метил-1-[2-(1-пиперидинил)фенил]бутил]амино]-2 оксоэтилбензойная кислота, ЕР 0147850 А 2 и ЕР 0207331 А 1). Предполагается, что натеглинид включает конкретные кристаллические формы (полиморфы), раскрытые в патенте США 5488510 и Европейской патентной публикацииЕР 0526171 В 1. Репаглинид и натеглинид можно вводить в форме, в которой они поставляются на рынок под торговыми марками NOVONORM и STARLIX, соответственно. Примеры ингибиторов альфа-глюкозидазы включают, но не ограничиваются этим, акарбозу, N-(1,3 дигидрокси-2-пропил)валиоламин (воглибозу) и 1-дезоксиноиримициновое производное миглитола. Акарбоза представляет собой 4",6"-дидезокси-4'-[(1S)-(1,4,6/5)-4,5,6-тригидрокси-3-гидроксиметил-2 циклогексениламино]мальтотриозу. Структура акарбозы также может быть описана как O-4,6-дидезокси 4-1S,4R,5S,6S]-4,5,6-тригидрокси-3-(гидроксиметил)-2-циклогексен-1-ил]аминоальфа-D-глюкопиранозил-(1-4)-О-альфа-D-глюкопиранозил-(1-4)-D-глюкопираноза. (Патент США 4062950 и Европейская патентная публикацияЕР 0226121). Акарбозу и миглитол можно вводить в формах, в которых они поставляются на рынок под торговыми марками GLUCOBAY и DIASTABOL 50, соответственно. Примеры ингибиторов опорожнения желудка, отличных от GLP-1, включают, но не ограничиваются этим, ингибиторы, раскрытые в J. Clin. Endocrinol. Metab. 2000, 85(3), 1043-1048 и Diabetes Care 1998; 21; 897-893, в частности амилин и его аналоги, такие как прамлинтид. Амилин описан в Diabetologia 39,1996, 492-499. Примеры 2-адренергических антагонистов включают, но не ограничиваются этим, мидаглизол, который описан в Diabetes 36, 1987, 216-220. Инсулин, который может быть использован в сочетании с со-9 017799 единением I, включает, но не ограничивается этим, препараты животного инсулина, выделенные из поджелудочной железы быка и свиньи; препараты человеческого инсулина, генетически синтезированные с использванием Escherichia coli или дрожжей; цинк инсулин; протаминцинк инсулин; фрагмент или производное инсулина (например, INS-1) и пероральный инсулиновый препарат. Противодиабетическое соединение для введения в сочетании с соединением I выбирают из группы,включающей натеглинид, митиглинид, репаглинид, метформин, экстендатид, розиглитазон, тезаглитазар,пиоглитазон, глизоксепид, глибурид, глибенкламид, ацетогексамид, хлорпропамид, глиборнурид, толбутамид, толазамид, глипизид, карбутамид, гликуидон, глигексамид, фенбутамид, толцикламид, глимепирид и гликлазид, включая их любые фармацевтически приемлемые соли. Примеры препарата и композиции ингибиторов РТРазы, ингибиторов GSK-3, не являющихся малыми молекулами соединений-миметиков, ингибиторов GFAT, ингибиторов G6 Разы, антагонистов рецептора глюкагона, ингибиторов РЕРСК, ингибиторов F-1,6-ВРазы, ингибиторов GP, модуляторов RXR,агонистов Бета-3 AR, ингибиторов PDHK, ингибиторов опорожнения желудка и модуляторов UCP раскрыты в патентах, заявках на патенты и ссылках, приведенных в настоящей заявке. В случае комбинированной терапии с соединением I другое противодиабетическое соединение можно вводить (например, путем введения и в лекарственной форме) спосбом, известным per se для такого соединения. Соединение I и другое противодиабетическое соединение можно вводить последовательно (т.е. в разное время) или одновременно, либо одно за другим в форме двух раздельных доз, либо в одной объединенной разовой дозе. В одном конкретном варианте воплощения изобретения другое противодиабетическое соединение вводят с соединением I в виде одной объединенной лекарственной формы. Доза противодиабетического соединения может быть выбрана из диапазона, известного для клинического применения такого соединения. Любые терапевтические соединения для лечения диабетических осложнений, антигиперлипемические соединения, средства против ожирения или гипотензивные соединения можно использовать в сочетании с соединением I таким же образом, как и описанные выше противодиабетические соединения. Примеры терапевтических соединений от диабетических осложнений включают, но не ограничиваются этим, ингибиторы альдозредуктазы, такие как толрестат, эпалрестат,зенарестат, зополрестат, миналрестат, фидарестат, СТ-112 и ранирестат; нейротропные факторы и усиливающие их соединения, такие как NGF, NT-3, BDNF и промоторы продукции-секреции нейротрофина,описанные в(например,4-(4-хлорфенил)-2-(2-метил-1-имидазолил)-5-[3-(2 метилфенокси)пропил]оксазол); стимуляторы регенерации нервной ткани, такие как Y-128; ингибиторы РКС, такие как рубоксистауринмезилат; ингибиторы AGE, такие как ALT946, пимагедин, Nфенацилтиазолийбромид (ALT766), ALT-711, ЕХО-226, пиридорин и пиридоксамин; акцепторы реактивного кислорода, такие как тиокаприловая кислота; церебральные вазодилататоры, такие как тиаприд и мексилетин; агонисты рецептора соматостатина, такие как BIM23190; и ингибиторы регулирующей сигналы апоптоза киназы-1 (ASK-1). Примеры антигиперлипемических соединений включают, но не ограничиваются этим, ингибиторы HMG-CoA редуктазы, такие как правастатин, симвастатин, ловастатин,аторвастатин, флувастатин, розувастатин и питавастатин; ингибиторы скваленсинтазы, такие как соединения, описанные в WO 97/10224 (например, N-(3R,5S)-1-(3-ацетокси-2,2-диметилпропил)-7-хлор-5(2,3-диметоксифенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ил]ацетил]пиперидин-4-уксусная кислота); фибратные соединения, такие как безафибрат, клофибрат, симфибрат и клинофибрат; ингибиторы АСАТ, такие как авасимиб и эфлюцимиб; анионно-обменные смолы, такие как колестирамин; пробукол; лекарственные средства на основе никотиновой кислоты, такие как никомол и ницеритрол; этиликозапентат; и растительные стеролы, такие как соевый стерол и -оризанол. Примеры средств против ожирения включают, но не ограничиваются этим, дексфенфлурамин, фенфлурамин, фентермин, сибутрамин, амфепрамон, дексамфетамин, мазиндол, фенилпропаноламин, клобензорекс; антагонисты рецептора МСН, такие как SB-568849 и SNAP-7941; антагонисты нейропептида Y, такие как СР-422935; антагонисты каннабиноидного рецептора, такие как SR-141716 и SR-147778; антагонист грелина; ингибиторы 11-гидроксистероиддегидрогеназы, такие как BVT-3498; ингибиторы панкреатической липазы, такие как орлистат и ATL-962; агонисты Бета-3 AR, такие как AJ-9677; пептидные препараты, снижающие аппетит, такие как лептин и CNTF (Ciliary Neurotropic Factor); агонисты холецистокинина, такие как линтитрипт и FPL-15849; и средства для подавления аппетита, такие как Р-57. Примеры гипотензивных соединений включают ингибиторы ангиотензин-превращающего фермента, такие как каптоприл, эналаприл и делаприл; антагонисты ангиотензина II, такие как кандезартанцилексетил, лозартан, эпрозартан,валзартан, телмизартан, ирбезартан, олмезартанмедоксомил, тазозартан и 1-2'-(2,5-дигидро-5-оксо-4 Н 1,2,4-оксадиазол-3-ил)бифенил-4-ил]метил]-2-этокси-1 Н-бензимидазол-7-карбоновая кислота; блокаторы кальциевых каналов, такие как манидипин, нифедипин, никардипин, амлодипин и эфонидипин; агенты открытия калиевых каналов, такие как левкромакалим, L-27152, AL0671 и NIP-121; клонидин; деацетилазы, такие как резерватрол, агонист сиртуина, полифенолы; агонист MCR4; натрийзависимые ингибиторы транспорта глюкозы (SGL T2). Структура активных средств, указанных в настоящей заявке под кодовыми номерами, родовыми или товарными наименованиями, могут быть взяты из действующего издания сборника "The MerckIndex" или из баз данных, например международных патентов (например, IMS World Publications). Их соответствующее содержание включено в настоящую заявку посредством ссылки. Любой специалист в данной области имеет полную возможность идентифицировать активные вещества и, на основе указанных ссылочных документов, также может получать и испытывать фармацевтические показания и свойства на стандартных моделях для испытаний, как in vitro, так и in vivo. Применение соединения I в композиции лечения состояний, опосредованных DPP-IV Соединение I может быть включено в фармацевтическую композицию для лечения состояний, опосредованных DPP-IV, адаптированную для различных способов введения. Например, соединение I может быть включено в фармацевтическую композицию, адаптированную для введения способом, выбранным из группы, включающей пероральное, парентеральное, интраперитонеальное, внутривенное, внутриартериальное, чрескожное, сублингвальное, внутримышечное, ректальное, трансбуккальное, интраназальное,липосомальное введение, введение при помощи ингаляции, вагинальное, внутриглазное введение, введение при помощи целенаправленной доставки (например, при помощи катетера или стента), подкожное,введение в жировую ткань, внутрисуставное, интраперитонеальное и интратекальное введение. Как таковое, соединение I можно формулировать в различные фармацевтически приемлемые композиции,включая формы для инъекций (например, подкожных, внутривенных, внутримышечных и интраперитонеальных инъекций), капельные вливания, формы для наружного применения (например, назальные спреи, чрескожные препараты; мази и т.д.), и суппозитории (например, ректальные и вагинальные суппозитории). Эти различные фармацевтически приемлемые композиции можно получать известными способами, традиционно используемыми в фармацевтической промышленности, с использованием фармацевтически приемлемого носителя, который традиционно используют в фармацевтической промышленности. Соединения I в форме свободного основания, соли и гидраты его, также как и любые другие вещества могут быть включены в такую композицию для ее предполагаемого назначения, включая другие активные ингредиенты, если не указано иное. Конкретные формы солей соединения I, которые можно использовать, включают, но не ограничиваются этим, HCl, метансульфонатную, сукцинатную, бензоатную, толуолсульфонатную, R-(-)манделатную или бензолсульфонатную соль соединения I. Как отмечено выше, соединение I можно выгодным образом использовать при введении пациенту при суточной дозе в пределах от 50 до 250 мг/неделя соединения I, необязательно в пределах от 50 до 200 мг соединения I,необязательно в пределах от 50 до 150 мг соединения I и необязательно в пределах от 50 до 100 мг соединения I (в каждом случае в расчете на молекулярную массу формы свободного основания соединенияI). Конкретные количества доз, которые могут быть использованы, включают, но не ограничиваются этим, 50, 75 и 100 мг соединения I в неделю. Как уже отмечено выше, соединение I преимущественно можно использовать для перорального введения. Следовательно, композиции, включающие соединение I, необязательно, могут быть адаптированы для перорального введения. Такая фармацевтическая композиция представляет собой твердую лекарственную форму, адаптированную для перорального введения. В этой связи композиция, например,может быть в форме таблетки или капсулы. Пример 2 представляет примеры твердых лекарственных форм, включающих соединение I, адаптированных для перорального введения. Такая фармацевтическая композиция представляет собой жидкую лекарственную форму, адаптированную для перорального введения. Как уже было отмечено выше, соединение I преимущественно можно использовать для парентерального введения. Следовательно, композиции, включающие соединение I, необязательно, могут быть адаптированны для парентерального введения. Такая фармацевтическая композиция представляет собой лекарственную форму в виде раствора, адаптированную для парентерального введения. В другом варианте такая фармацевтическая композиция представляет собой лекарственную форму в виде суспензии,адаптированную для парентерального введения. Как отмечено выше, соединение I преимущественно можно использовать в сочетании с одним или несколькими другими противодиабетическими и/или инкретиновыми соединениями. Следовательно,композиции по настоящему изобретению необязательно могут содержать соединение I в сочетании с одним или несколькими другими противодиабетическими или инкретиновыми соединениями в объединенной лекарственной форме в виде разовых доз. Необязательно, такая форма в виде разовых доз, включающая соединение I в сочетании с одним или несколькими другими противодиабетическими и/или инкретиновыми соединениями, является адаптированной для перорального введения и необязательно представляет собой твердую лекарственную форму для перорального использования. Альтернативно, такая форма в виде разовых доз, включающая соединение I в сочетании с одним или несколькими другими противодиабетическими и/или инкретиновыми соединениями, может быть адаптирована для парентерального введения и необязательно представляет собой лекарственную форму в виде раствора. Такая форма в виде разовой дозы, включающая соединение I в сочетании с одним или несколькими другими противодиабетическими соединениями, содержит от 50 до 250 мг/неделя соединения I на пациента, необязательно в пределах от 50 до 200 мг соединения I, необязательно в пределах от 50 до 150 мг соединения I и необязательно в пределах от 50 до 100 мг соединения I (в каждом случае в расчете на молекулярную массу формы свободного основания соединения I). Такая комбинированная лекарственная форма в виде разовой дозы, включающая соединение I в сочетании с одним или несколькими другими противодиабетическими соединениями, содержит 50, 75 и 100 мг соединения I. Любое противодиабетическое соединение или ряд противодиабетических соединений могут быть объединены с соединением I с образованием такой комбинированной формы в виде разовых доз. Такая комбинированная лекарственная форма в виде разовых доз содержит соединение I и один или несколько членов из группы, включающей модуляторы сигнального пути инсулина, подобные ингибиторам протеинтирозинфосфатазы (РТРаза) и ингибиторам глютамин-фруктоза-6-фосфатамидотрансферазы (GFAT),соединения, влияющие на нарушение продукции глюкозы в печени, подобные ингибиторам глюкоза-бфосфатазы (G6Pa3a), ингибиторам фруктоза-1,6-бисфосфатазы (F-1,6-ВРаза), ингибиторам гликогенфосфорилазы (GP), антагонистам рецептора глюкагона и ингибиторам фосфоенолпируваткарбоксикиназы(РЕРСК); ингибиторы пируватдегидрогеназакиназы (PDHK); средства, усиливающие чувствительность к инсулину (инсулин-сенсибилизирующие средства); средства, повышающие секрецию инсулина (средства, усиливающие секрецию инсулина); ингибиторы альфа-глюкозидазы; ингибиторы опорожнения желудка; активаторы глюкокиназы, агонисты рецептора GLP-1, агонисты рецептора GLP-2, модуляторыUCP, модуляторы RXR, ингибиторы GSK-3, модуляторы PPAR, метформин, инсулин; и 2 адренергические антагонисты. Соединение I можно вводить по меньшей мере с одним другим из указанных противодиабетических соединений, либо одновременно в виде одной дозы, в одно и то же время в виде раздельных доз, или последовательно (т.е., когда одну дозу вводят до или после введения другой дозы). Такая комбинированная лекарственная форма в виде разовой дозы содержит соединение I и противодиабетический тиазолидиндион. Конкретные примеры тиазолидиндионов, которые могут быть использованы в этом варианте, включают, но не ограничиваются этим, (S)-(3,4-дигидро-2-(фенилметил)-2 Н-1 бензопиран-6-ил)метилтиазолидин-2,4-дион(енглитазон),5-[4-(3-(5-метил-2-фенил-4-оксазолил)-1 оксопропил)фенил]метилтиазолидин-2,4-дион(дарглитазон),5-[4-(1-метилциклогексил)метокси)фенил]метилтиазолидин-2,4-дион(циглитазон), 5-[4-(2-(1-индолил)этокси)фенил]метилтиазолидин-2,4 дион (DRF2189), 5-4-[2-5-метил-2-фенил-4-оксазолил)этокси)]бензилтиазолидин-2,4-дион (ВМ 13,1246),5-(2-нафтилсульфонил)тиазолидин-2,4-дион(KRP297). Такой комбинированной лекарственной форме в виде разовой дозы представляет собой 5-[4-(2-(5 этил-2-пиридил)этокси)фенил]метилтиазолидин-2,4-дион (пиоглитазон) и его гидрохлорид, который поставляется на рынок под торговой маркой ACTOS. Также тиазолидиндион представляет собой 5-[4-(2-(метил-2-пиридиниламино)этокси)фенил]метилтиазолидин-2,4-дион (розиглитазон) и его малеатную соль. Такая комбинированная лекарственная форма в виде разовой дозы содержит соединение I и агонистPPAR гамма не-глитазонного типа. Комбинированная лекарственная форма в виде разовой дозы содержит соединение I и бигуанид. Конкретный пример бигуанида, который может быть использован, представляет собой Метформин (диметилдигуанид) и его гидрохлоридную соль, который поставляется на рынок под торговой маркой GLUCOPHAGE. Такая комбинированная лекарственная форма в виде разовой дозы содержит соединение I и производное сульфонилмочевины. Конкретные примеры производных сульфонилмочевины, которые могут быть использованы, включают, но не ограничиваются этим, глизоксепид, глибурид, глибенкламид, ацетогексамид, хлорпропамид, глиборнурид, толбутамид, толазамид, глипизид, карбутамид, гликуидон, глигексамид, фенбутамид, толцикламид; глимепирид и гликлазид. Толбутамид, глибенкламид, гликлазид,глиборнурид, гликуидон, глизоксепид и глимепирид можно вводить в форме, в которой они поставляются на рынок под торговыми марками RASTINON HOECHST, AZUGLUCON, DIAMICRONT,GLUBORID, GLURENORM, PRO-DIABAN и AMARIL, соответственно. Также такая комбинированная лекарственная форма в виде разовой дозы содержит соединение I и противодиабетическое производное D-фенилаланина. Конкретные примеры противодиабетических производных D-фенилаланина, которые могут быть использованы, включают, но не ограничиваются этим,- 12017799 репаглинид и натеглинид, которые можно вводить в форме, в которой они поставляются на рынок под торговыми марками NOVONORM и STARLIX, соответственно. Такая комбинированная лекарственная форма в виде разовой дозы содержит соединение I и ингибитор альфа-глюкозидазы. Конкретные примеры ингибиторов альфа-глюкозидазы, которые могут быть использованы, включают, но не ограничиваются этим, акарбозу, миглитол и воглибозу, которые можно вводить в форме, в которой они поставляются на рынок под торговыми марками GLUCOBAY, DIASTABOL 50 и BASEN, соответственно. Противодиабетическое соединение для введения в сочетании с соединением I в такой комбинированной форме в виде разовой дозы выбирают из группы, включающей натеглинид, репаглинид, метформин, экстендатид, розиглитазон, пиоглитазон, глизоксепид, глибурид, глибенкламид, ацетогексамид,хлорпропамид, глиборнурид, толбутамид, толазамид, глипизид, карбутамид, гликуидон, глигексамид,фенбутамид, толцикламид, глимепирид и гликлазид, включая их любые фармацевтически приемлемые соли. Каждая из перечисленных выше комбинированных форм в виде разовой дозы, включающей сочетание соединения I с одним или несколькими другими противодиабетическими соединениями, фармацевтическая композиция, необязательно, может быть адаптирована для перорального введения и, в этой связи, необязательно может представлять собой твердую лекарственную форму, такую как таблетка или капсула, или, альтернативно, может представлять собой жидкую лекарственную форму, адаптированную для перорального введения. Доза противодиабетического соединения может быть выбрана из диапазона,известного для применения такого соединения в клинических условиях. Любое из терапевтических соединений для лечения диабетических осложнений, антигиперлипемических соединений, средств против ожирения или гипотензивных соединений можно использовать в сочетании с соединением I таким же способом, как и описанные выше противодиабетические соединения. Примеры терапевтических соединений для лечения диабетических осложнений включают, но не ограничиваются этим, ингибиторы альдозаредуктазы, такие как толрестат, эпалрестат, зенарестат, зополрестат, миналрестат, фидарестат, СТ 112 и ранирестат; нейротропные факторы и усиливающие их соединения, такие как NGF, NT-3, BDNF, и промоторы продукции-секреции нейротрофина, описанные в WO 01/14372 (например, 4-(4-хлорфенил)2-(2-метил-1-имидазолил)-5-[3-(2-метилфенокси)пропил]оксазол); стимуляторы регенерации нервной ткани, такие как Y-128; ингибиторы РКС, такие как рубоксистауринмезилат; ингибиторы AGE, такие какALT946, пимагедин, N-фенацилтиазолийбромид (ALT766), ALT-711, ЕХО-226, пиридорин и пиридоксамин; акцепторы реактивного кислорода, такие как липоевая кислота; церебральные вазодилататоры, такие как тиаприд и мексилетин; агонисты рецептора соматостатина, такие как BIM23190; и ингибиторы регулирующей сигналы апоптоза киназы-1 (ASK-1). Примеры антигиперлипемического соединения включают, но не ограничиваются этим, ингибиторы HMG-CoA редуктазы, такие как правастатин, симвастатин, ловастатин, аторвастатин, флувастатин, розувастатин и питавастатин; ингибиторы скваленсинтазы, такие как соединения, описанные в WO 97/10224 (например, N-(3R,5S)-1-(3-ацетокси-2,2 диметилпропил)-7-хлор-5-(2,3-диметоксифенил)-2-оксо-1,2,3,5-тетрагидро-4,1-бензоксазепин-3-ил]ацетил]пиперидин-4-уксусная кислота); фибратные соединения, такие как безафибрат, клофибрат, симфибрат и клинофибрат; ингибиторы АСАТ, такие как авасимиб и эфлюцимиб; анионно-обменные смолы,такие как колестирамин; пробукол; лекарственные средства на основе никотиновой кислоты, такие как никомол и ницеритрол; этиликозапентат; и растительные стеролы, такие как соевый стерол и -оризанол. Примеры средств против ожирения включают, но не ограничиваются этим, дексфенфлурамин, фенфлурамин, фентермин, сибутрамин, амфепрамон, дексамфетамин, мазиндол, фенилпропаноламин, клобензорекс; антагонисты рецептора МСН, такие как SB-568849 и SNAP-7941; антагонисты нейропептида Y,такие как СР-422935; антагонисты каннабиноидного рецептора, такие как SR-141716 и SR-147778; антагонист грелина; ингибиторы 11-гидроксистероиддегидрогеназы, такие как BVT-3498; ингибиторы панкреатической липазы, такие как орлистат и ATL-962; агонисты бета-3 AR, такие как AJ-9677; пептидные препараты, снижающие аппетит, такие как лептин и CNTF (Ciliary Neurotropic Factor); агонисты холецистокинина, такие как линтитрипт и FPL-15849; и средства для подавления аппетита, такие как Р-57. Примеры гипотензивных соединений включают ингибиторы ангиотензинпревращающего фермента, такие как каптоприл, эналаприл и делаприл; антагонисты ангиотензина II, такие как кандезартанцилексетил,лозартан, эпрозартан, валзартан, телмизартан, ирбезартан, олмезартанмедоксомил, тазозартан и 1-2'(2,5-дигидро-5-оксо-4 Н-1,2,4-оксадиазол-3-ил)бифенил-4-ил]метил]-2-этокси-1 Н-бензимидазол-7-карбоновая кислота; блокаторы кальциевых каналов, такие как манидипин, нифедипин, никардипин, амлодипин и эфонидипин; агенты открытия калиевых каналов, такие как левкромакалим, L-27152, AL0671 иNIP-121; клонидин. Применение соединения I в наборах и изделиях, предназначенных для лечения состояний, опосредованных DPP-IV Соединение I может применяться в наборах, включающих фармацевтическую композицию для лечения состояний, опосредованных DPP-IV, включающую соединение I (и, необязательно, одно или несколько других противодиабетических соединений), где такой набор дополнительно включает инструк- 13017799 ции, которые содержат один или несколько видов информации, выбранных из группы, включающей указание болезненного состояния, при котором следует применять фармацевтическую композицию, информацию, касающуюся хранения фармацевтической композиции, информацию о дозировках и инструкции,касающиеся способа введения фармацевтической композиции. Набор также может включать упаковочные материалы. Упаковочные материалы могут включать контейнер, который содержит фармацевтическую композицию. Контейнер необязательно может содержать этикетку с указанием болезненного состояния, при котором следует вводить соединение, информацию, касающуюся хранения, информацию о дозировках и/или инструкции, касающиеся способа введения композиции. Набор также может включать дополнительные компоненты для хранения или введения композиции. Набор также может включать композицию в форме разовой дозы или в форме нескольких доз. Фармацевтическая композиция в наборе содержит несколько доз фармацевтической композиции,где такая фармацевтическая композиция представляет собой лекарственную форму в виде разовых доз,которая содержит соединение I в количестве, которое находится в одном из пределов доз, определенных в настоящей заявке. Фармацевтическая композиция в наборе содержит несколько доз фармацевтической композиции,включающей соединение I, где такая фармацевтическая композиция представляет собой лекарственную форму в виде разовых доз, которая содержит соединение I и одно или несколько других противодиабетических соединений, описанных в настоящей заявке. Соединение I может применяться в изделии, включающему фармацевтическую композицию для лечения состояний, опосредованных с DPP-IV, включающему соединение I (и, необязательно, одно или несколько других противодиабетических соединений), где такие изделия дополнительно содержат упаковочные материалы, упаковочный материал содержит контейнер, который содержит композицию. Кроме того изделие, упомянутое выше, включает упаковку, где упаковка содержит этикетку, указывающую один или несколько видов информации, выбранных из группы, включающей указание болезненного состояния, при котором следует применять фармацевтическую композицию, информацию, касающуюся хранения фармацевтической композиции, информацию о дозировках и/или инструкции, касающиеся способа введения фармацевтической композиции. Фармацевтическая композиция в изделии включает несколько доз фармацевтической композиции как указано в описании, где такая фармацевтическая композиция представляет собой лекарственную форму в виде разовых доз, которые содержат соединение I в количестве, которое находится в одном из пределов доз, определенных в настоящей заявке. Фармацевтическая композиция в изделии включает несколько доз фармацевтической композиции,где такая фармацевтическая композиция представляет собой лекарственную форму в виде разовых доз,которая содержит соединение I и одно или несколько других противодиабетических соединений, описанных в настоящей заявке. Необходимо заметить, что упаковочный материал, используемый в наборах и изделиях, описанных в заявке, может образовывать множество раздельных контейнеров, таких как разделенный флакон или разделенный пакет из фольги. Упаковка может быть в любой удобной форме или в форме, известной в данной области, которая выполнена из фармацевтически приемлемого материала, например, такого как бумага или картонный футляр, стеклянная или пластиковая бутыль или сосуд, закрывающийся контейнер (например, для содержания в нем с "повторными заполнениями" таблеток для помещения в другой контейнер) или блистерная упаковка с индивидуальными дозами для выдавливания из упаковки в соответствии со схемой терапевтического лечения. Контейнер для использования зависит от конкретной лекарственной формы, для которой он предназначен. Возможно использование более чем одного контейнера вместе в единой упаковке для коммерческой продажи лекарственной формы в виде разовых доз. Например, таблетки могут содержаться в флаконе, который, в свою очередь, содержится в коробке. Одним конкретным примером набора является так называемая блистерная упаковка. Блистерные упаковки хорошо известны в упаковочной индустрии и широко используются для упаковки фармацевтических стандартных лекарственных форм (таблетки, капсулы и подобные). Блистерные упаковки, в основном, состоят из листа из относительно жесткого материала (предпочтительно, жесткого прозрачного пластика), покрытого фольгой. В процессе упаковки в жестком материале образуют углубления. Углубления имеют размер и форму индивидуальных таблеток или капсул, которые должны быть упакованы,или могут иметь размер и форму для размещения в упаковке множества таблеток и/или капсул. Далее таблетки или капсулы помещают в соответствующие углубления и лист относительно жесткого материала покрывают гибкой фольгой с герметичным уплотнением, при этом лицевая сторона фольги противоположна направлению, в котором были образованы углубления. В результате, таблетки или капсулы являются индивидуально запаянными или запаянными вместе, как это желательно, в углублениях между фольгой и листом. Прочность листа предпочтительно является такой, чтобы таблетки или капсулы могли быть извлечены из блистерной упаковки вручную при надавливании на углубления, при этом в фольге образуется отверстие в месте углубления. Таблетку или капсулу затем можно извлечь через указанное отверстие. 4-Фтор-2-метилбензонитрил (3) Смесь 2-бром-5-фтортолуола (2) (3,5 г, 18,5 ммоль) и CuCN (2 г, 22 ммоль) в N,Nдиметилформамиде (ДМФА) (100 мл) нагревали при кипячении с обратным холодильником в течение 24 часов. Реакционную смесь разбавляли водой и экстрагировали гексаном. Органические слои сушили надH-ЯМР (400 МГц, CDCl3):7,60 (дд, J=5,6, 8,8 Гц, 1 Н) , 6,93-7,06 (м, 2 Н), 2,55 (с, 3 Н). 2-Бромметил-4-фторбензонитрил (4) Смесь 4-фтор-2-метилбензонитрила (3) (2 г, 14,8 ммоль), N-бромсукцинимид (NBS) (2,64 г, 15 ммоль) и азобисизобутиронитрил (AIBN) (100 мг) в CCl4 нагревали при кипячении с обратным холодильником в атмосфере азота в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры. Твердые вещества удаляли при помощи фильтрации. Органический раствор концентрировали с получением неочищенного продукта в виде масла, которое использовали на следующей стадии без дополнительной очистки. 1 Н-ЯМР (400 МГц, CDCl3):7,68 (дд, J=5,2, 8,4 Гц, 1 Н), 7,28 (дд, J=2,4, 8,8 Гц, 1 Н), 7,12 (м, 1 Н), 4,6(с, 2 Н). 2-(6-Хлор-3-метил-2,4-диоксо-3,4-дигидро-2 Н-пиримидин-1-илметил)-4-фторбензонитрил (6) Смесь неочищенного 3-метил-6-хлорурацила (5) (0,6 г, 3,8 ммоль), 2-бромметил-4 фторбензонитрила (0,86 г, 4 ммоль) и K2CO3 (0,5 г, 4 ммоль) в диметилсульфоксиде (ДМСО) (10 мл) перемешивали при 60 С в течение 2 ч. Реакционную смесь разбавляли водой и экстрагировали этилацетатом (EtOAc). Органические слои сушили над MgSO4 и растворитель удаляли. Остаток очищали при помощи колоночной хроматографии. Получали 0,66 г продукта (выход: 60%). 1 Н-ЯМР (400 МГц, CDCl3):7,73 (дд, 1 = 12, 8,4 Гц, 1 Н), 7,26 (д, J=4,0 Гц, 1 Н), 7,11-7,17 (м, 1 Н),6,94 (дд, J=2,0, 9,0 Гц, 1 Н), 6,034 (с, 2 Н) , 3,39 (с, 3 Н) . 2-(6-Хлор-3-метил-2,4-диоксо-3,4-дигидро-2 Н-пиримидин-1-илметил)-4-фторбензонитрил (5) (300 мг, 1,0 ммоль), дигидрохлорид (R)-3-аминопиперидина (266 мг, 1,5 ммоль) и бикарбонат натрия (500 мг,5,4 ммоль) перемешивали в запаянной пробирке в этаноле (EtOH,3 мл) при 100 С в течение 2 ч. Конечное соединение получали в виде соли ТФУК после очистки при помощи ВЭЖХ. 1 Соль ТФУК соединения I суспендировали в дихлорметане (ДХМ) и затем промывали насыщенным раствором Na2CO3. Органический слой сушили и удаляли под вакуумом. Остаток растворяли в ацетонитриле и при 0 С добавляли HCl в диоксане (1,5 экв.). После удаления растворителя получали соль HCl. 1MS (ES) [m+H] рассчитано для C18H20FN5O2, 357,38; найдено, 357,38. Основная процедура получения солей соединения I Бензонитрильный продукт может быть выделен в виде свободного основания, если требуется, но предпочтительно, продукт может быть далее преобразован в соответствующую кислотно-аддитивную соль. В частности, бензонитрильный продукт (приблизительно 10 мг) в растворе МеОН (1 мл) обрабатывали различными кислотами (1,05 экв). Растворам давали выстояться в течение трех дней на открытом воздухе. Если образовывался осадок, то смесь фильтровали и соль сушили. Если не было никакого твердого осадка, то смесь концентрировали в вакууме и выделяли осадок. Таким способом получали соли соединения I из следующих кислот: бензойной, пара-толуолсульфоновой, янтарной, R-(-)-миндальной и бензолсульфоновой. Стадии выделения и/или очистки промежуточных соединений в описанных выше способах могут быть необязательными, если полученные из реакционной смеси промежуточные соединения относительно чистые и побочные продукты или примеси в реакционной смеси не служат препятствием для дальнейших стадий реакции. Где это возможно, одну или несколько стадий выделения можно исключить для достижения более короткого времени обработки, и исключение дальнейших обработок также может обеспечить более высокие выходы продуктов реакции. 2. Примеры композиций лекарственных форм, включающих сукцинатную соль 2-[6-(3 аминопиперидин-1-ил)-3-метил-2,4-диоксо-3,4-дигидро-2 Н-пиримидин-1-илметил]-4-фторбензонитрила Ниже представлены примеры композиций таблеток, которые можно использовать для введения сукцинатной соли 2-[6-(3-аминопиперидин-1-ил)-3-метил-2,4-диоксо-3,4-дигидро-2 Н-пиримидин-1 илметил]-4-фторбензонитрила (сукцинатная соль соединения I). Необходимо заметить, что представленные композиции могут варьировать, как это известно специалистам в данной области. Примеры композиций таблеток следующие: 12,5 мг соединения I (масса формы свободного основания) на таблетку Состав ядра таблетки Эффект введения на активность в плазме DPP-IV Разовую дозу соединения I вводили перорально обезьяне при дозе 0,3 мг/кг. Фиг. 1 иллюстрирует наблюдаемый эффект, который введение соединения I оказывает на активность DPP-IV в плазме обезьян после введения. Как можно видеть, соединение I снижало активность DPP-IV в плазме у обезьян более чем на 90% относительно базовой линии через 12 ч после введения. В свете представленных данных полагают, что при введении пациенту по меньшей мере 25 мг соединения I активность DPP-IV в плазме пациента может быть снижена более чем на 60% относительно базовой линии в течение периода времени по меньшей мере 6, 12, 18 и даже 24 ч непосредственно после введения. Эффект совместного введения с пиоглитазоном на уровень глюкозы в плазме Эффект введения соединения I в сочетании с пиоглитазоном был исследован при помощи измерения уровней глюкозы в плазме у мышей. Самок мышей db/db (BKS. Cg-+Leprdb/+Leprdb) (возраст - 6 недель, CLEA Japan (Tokyo, Japan разделяли на 4 группы (n=7 в каждой группе), включая от группы А по группу D. Группа А имела свободный доступ к измельченному корму СЕ-2 (CLEA Japan) в течение 21 дня. Группа В имела свободный доступ к измельченному корму СЕ-2 (CLEA Japan), содержащему 0,03%(мас./мас.) сукцинатной соли соединения I, в течение 21 дня. Дозу соединения I в группе В рассчитывали так, чтобы она составляла 74,82,5 (среднее значениеSD) мг/кг массы тела/день. Группа С имела свободный доступ к измельченному корму СЕ-2 (CLEA Japan), содержащему 0,0075% (мас./мас.) пиоглитазонгидрохлорида, в течение 21 дня. Дозу пиоглитазона в группе С рассчитывали так, чтобы она составляла 17,70,6 (среднее значениеSD) мг/кг массы тела/день. Группа D имела свободный доступ к измельченному корму СЕ-2 (CLEA Japan), содержащему 0,03% (мас./мас.) сукцинатной соли соединения I в сочетании с 0,0075% (мас./мас.) пиоглитазонгидрохлорида, в течение 21 дня. Дозы соединения I и пиоглитазона в группе D рассчитывали так, чтобы они составляли 63,11,9 (среднее значениеSD) мг/кг массы тела/день и 15,80,5 (среднее значениеSD) мг/кг массы тела/день, соответственно. В течение 21 дня введения порошкообразного корма не было никакой существенной разницы в количестве введимого порошкообразного корма в указанных 4 группах. По прошествие 21 дня введения порошкообразного корма брали пробы крови из глазничных вен мышей при помощи капиллярной пипетки в условиях доступа к корму, и уровни глюкозы в плазме определяли ферментативным методом с использованием Как показано в табл. 1, сочетание соединения I с пиоглитазоном демонстрирует превосходные эффекты по снижению уровней глюкозы в плазме. Эффект введения на активность DPP-IV в плазме Разовую дозу соединения I вводили перорально 6 субъектам при дозе 12,5, 25, 50, 100, 200 и 400 мг,соответственно (всего 36 человек). Фиг. 2 иллюстрирует наблюдаемый эффект, который введение соединения I оказывает на активность DPP-IV в плазме человека после введения. Как можно было увидеть,соединение I снижало активность DPP-IV в плазме человека более чем на 10% относительно базовой линии через 168 ч после введения. Таким образом, как можно видеть из данных, представленных на фиг. 2,при введении соединения I один раз в неделю при уровнях дозирования, определенных в настоящей заявке, соединение I может быть эффективно использовано в отношении болезненных состояний, где необходимо снижение активности DPP-IV в плазме. В свете представленных данных полагают, что при введении пациенту по меньшей мере 50 мг соединения I активность DPP-IV в плазме пациента может быть снижена более чем на 35% относительно базовой линии в течение периода времени по меньшей мере 168 ч непосредственно после введения, при введении пациенту по меньшей мере 100 мг соединенияI активность DPP-IV в плазме пациента может быть снижена более чем на 60% относительно базовой линии в течение периода времени по меньшей мере 168 ч непосредственно после введения, и при введении пациенту по меньшей мере 200 мг соединения I, активность DPP-IV в плазме пациента может быть снижена более чем на 70% относительно базовой линии в течение периода времени по меньшей мере 168 ч непосредственно после введения. Эффект введения на активность DPP-IV в плазме Разовую дозу соединения I вводили перорально при дозе 3,125 мг (9 человек), 12,5 мг (8 человек),50 мг (7 человек) и 100 мг (8 человек), соответственно. Фиг. 3 иллюстрирует наблюдаемый эффект, который введение соединения I оказывает на активность DPP-IV в плазме человека после введения. Как можно видеть, соединение I снижало активность DPP-IV в плазме человека более чем на 20% относительно базовой линии на время 168 ч после введения. Таким образом, как можно видеть из данных, представленных на фиг. 3, при введении соединения I один раз в неделю при уровнях дозирования, определенных в настоящей заявке, соединение I может быть эффективно использовано в отношении болезненных состояний, где необходимо снижение активности DPP-IV в плазме. В свете представленных данных пола- 18017799 гают, что введение пациенту по меньшей мере 50 мг соединения I активность DPP-IV в плазме пациента может быть снижена более чем на 65% относительно базовой линии в течение периода времени по меньшей мере 168 ч после введения. Специалистам в данной области должно быть понятно, что в отношении применения соединения,ракрытого в настоящем изобретении, возможны различные модификации и варианты без отклонения от сущности или объема изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение 2-[6-(3-аминопиперидин-1-ил)-3-метил-2,4-диоксо-3,4-дигидро-2 Н-пиримидин-1 илметил]-4-фторбензонитрила (соединение I) или его фармацевтически приемлемой соли в качестве лекарственного средства при введении еженедельной дозы в пределах от 50 до 200 мг соединения I пациенту, где еженедельную дозу вводят один раз в неделю. 2. Применение по п.1, где еженедельная доза соединения I, вводимая пациенту, составляет от 100 до 200 мг. 3. Применение по п.1, где еженедельная доза соединения I, вводимая пациенту, составляет 50, 75,100, 125, 150, 175 или 200 мг. 4. Применение 2-[6-(3-аминопиперидин-1-ил)-3-метил-2,4-диоксо-3,4-дигидро-2 Н-пиримидин-1 илметил]-4-фторбензонитрила (соединение I) или его фармацевтически приемлемой соли для лечения диабета при введении еженедельной дозы в пределах от 50 до 200 мг, где еженедельную дозу вводят один раз в неделю. 5. Применение 2-[6-(3-аминопиперидин-1-ил)-3-метил-2,4-диоксо-3,4-дигидро-2 Н-пиримидин-1 илметил]-4-фторбензонитрила (соединение I) или его фармацевтически приемлемой соли для лечения рака при введении еженедельной дозы в пределах от 50 до 200 мг, где еженедельную дозу вводят один раз в неделю. 6. Применение 2-[6-(3-аминопиперидин-1-ил)-3-метил-2,4-диоксо-3,4-дигидро-2 Н-пиримидин-1 илметил]-4-фторбензонитрила (соединение I) или его фармацевтически приемлемой соли для лечения аутоиммунных расстройств при введении еженедельной дозы в пределах от 50 до 200 мг, где еженедельную дозу вводят один раз в неделю. 7. Применение 2-[6-(3-аминопиперидин-1-ил)-3-метил-2,4-диоксо-3,4-дигидро-2 Н-пиримидин-1 илметил]-4-фторбензонитрила (соединение I) или его фармацевтически приемлемой соли для лечения ВИЧ-инфекции при введении еженедельной дозы в пределах от 50 до 200 мг, где еженедельную дозу вводят один раз в неделю. 8. Применение 2-[6-(3-аминопиперидин-1-ил)-3-метил-2,4-диоксо-3,4-дигидро-2 Н-пиримидин-1 илметил]-4-фторбензонитрила (соединение I) или его фармацевтически приемлемой соли в получении лекарственного средства для лечения заболевания или состояния, выбранного из диабета, рака, аутоиммунного расстройства или ВИЧ-инфекции, причем лекарственное средство получают таким образом, что соединение I вводится в еженедельной дозе в пределах от 50 до 200 мг, где еженедельную дозу вводят один раз в неделю.
МПК / Метки
МПК: A61K 31/513, A61P 31/18, A61P 35/00, A61P 3/10, A61P 5/50
Метки: 2-[6-(3-аминопиперидин-1-ил)-3-метил-2,4-диоксо-3,4-дигидро-2н-пиримидин-1-илметил]-4-фторбензонитрила, применение
Код ссылки
<a href="https://eas.patents.su/21-17799-primenenie-2-6-3-aminopiperidin-1-il-3-metil-24-diokso-34-digidro-2n-pirimidin-1-ilmetil-4-ftorbenzonitrila.html" rel="bookmark" title="База патентов Евразийского Союза">Применение 2-[6-(3-аминопиперидин-1-ил)-3-метил-2,4-диоксо-3,4-дигидро-2н-пиримидин-1-илметил]-4-фторбензонитрила</a>
Предыдущий патент: Водонепроницаемая паропроницаемая обувь
Следующий патент: Антагонисты рецептора глюкагона, композиции, содержащие такие соединения
Случайный патент: Способ получения высокочистой внутренней соли 3-карбокси-n,n,n-триметил-1-пропиламмоний гидроксида