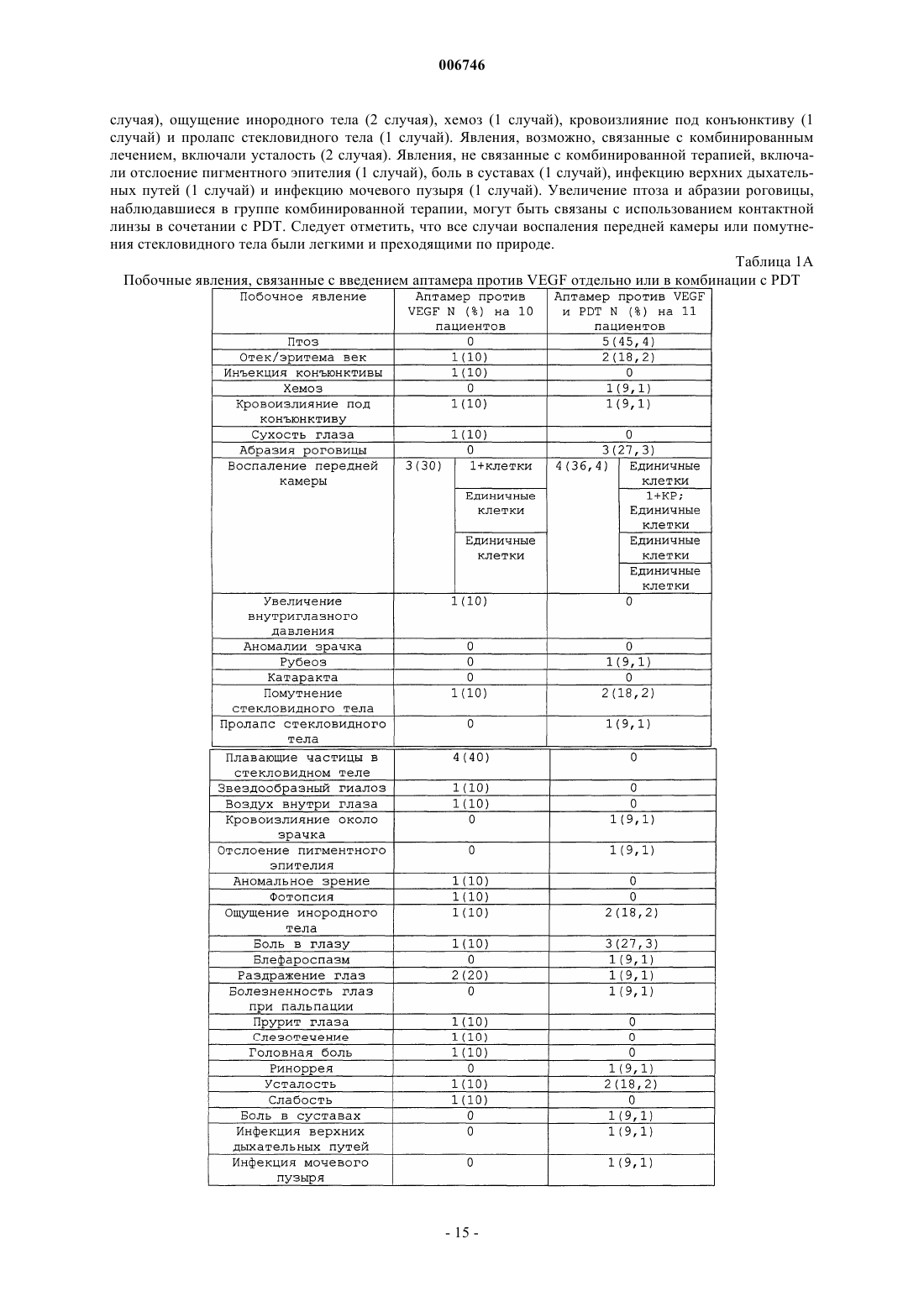
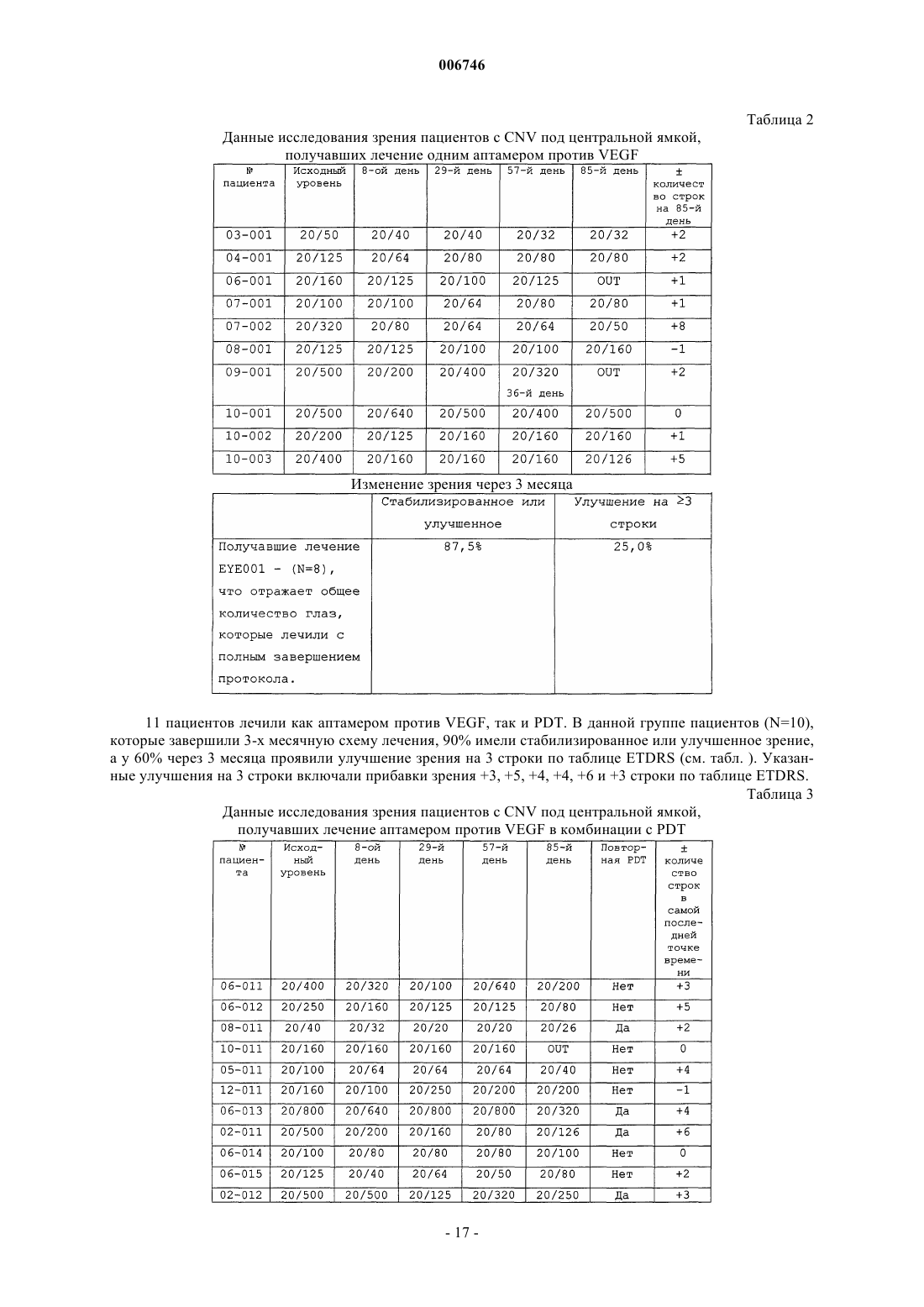
Способы лечения глазных неоваскулярных заболеваний
Формула / Реферат
1. Способ лечения глазного неоваскулярного заболевания у пациента, где данный способ включает этапы:
(a) введения указанному пациенту эффективного количества аптамера против VEGF; и
(b) обеспечения пациента фототерапией.
2. Способ по п.1, в котором указанная фототерапия включает фотодинамическую терапию (PDT).
3. Способ по п.1, в котором указанная фототерапия включает термическую лазерную фотокоагуляцию.
4. Способ по п.1, в котором указанное неоваскулярное заболевание выбирают из группы, состоящей из ишемической ретинопатии, внутриглазной неоваскуляризации, возрастной дегенерации желтого пятна, неоваскуляризации роговицы, неоваскуляризации сетчатки, неоваскуляризации сосудистой оболочки, диабетического отека желтого пятна, диабетической ишемии сетчатки, диабетического отека сетчатки и пролиферативной диабетической ретинопатии.
5. Способ по п.4, в котором указанное неоваскулярное заболевание представляет собой возрастную дегенерацию желтого пятна.
6. Способ по п.4, в котором указанное неоваскулярное заболевание представляет собой пролиферативную диабетическую ретинопатию.
7. Способ по п.1, в котором аптамер против VEGF включает нуклеиново-кислотный лиганд к фактору роста сосудистого эндотелия (VEGF).
8. Способ по п.7, в котором указанный нуклеиново-кислотный лиганд VEGF включает рибонуклеиновую кислоту.
9. Способ по п.7, в котором указанный нуклеиново-кислотный лиганд VEGF включает дезоксирибонуклеиновую кислоту.
10. Способ по п.7, в котором указанный нуклеиново-кислотный лиганд VEGF включает модифицированные нуклеотиды.
11. Способ по п.10, в котором указанный нуклеиново-кислотный лиганд VEGF включает 2'F-модифицированные нуклеотиды.
12. Способ по п.11, в котором указанный нуклеиново-кислотный лиганд VEGF включает полиалкиленгликоль.
13. Способ по п.12, в котором указанный полиалкиленгликоль представляет собой полиэтиленгликоль (PEG).
14. Способ по п.7, в котором указанный нуклеиново-кислотный лиганд VEGF включает рибонуклеиновую кислоту и дезоксирибонуклеиновую кислоту.
15. Способ по п.10, в котором указанный нуклеиново-кислотный лиганд VEGF включает 2'-О-метил (2'-ОМе) модифицированные нуклеотиды.
16. Способ по п.10, в котором указанный нуклеиново-кислотный лиганд VEGF является модифицированной группой, которая уменьшает активность эндонуклеаз или экзонуклеаз на нуклеиново-кислотном лиганде, относящемся к немодифицированному нуклеиново-кислотному лиганду, без неблагоприятного воздействия на аффинитет связывания указанного лиганда.
17. Способ по п.16, в котором указанная часть включает фосфоротиоат.
18. Способ по п.1, в котором указанный аптамер против VEGF вводят инъекцией.
19. Способ по п.1, в котором указанный этап введения включает введение устройства в глаз указанного пациента, причем указанное устройство включает указанный аптамер против VEGF.
20. Способ по п.19, в котором указанное устройство доставляет указанный аптамер против VEGF в глаз диффузией через склеру.
21. Способ по п.19, в котором указанное устройство доставляет указанный аптамер против VEGF непосредственно в стекловидное тело глаза.
22. Способ по п.2, в котором указанная фотодинамическая терапия (PDT) включает этапы:
(i) доставки фотосенсибилизатора в глазную ткань пациента; и
(ii) воздействия на фотосенсибилизатор света, имеющего длину волн, поглощаемую фотосенсибилизатором в течение времени и при интенсивности, достаточных для ингибирования неоваскуляризации в указанной ткани глаза.
23. Способ по п.22, в котором указанный фотосенсибилизатор выбирают из группы, состоящей из производных бензопорфирина (BPD), моноаспартилхлорина е6, фталоцианина цинка, этиопурпурина олова, тетрагидрокситетрафенилпорфирина и порфимернатрия (PHOTOFRINR) и зеленых порфиринов.
24. Способ по п.22, в котором указанный фотосенсибилизатор представляет собой производное бензопорфирина.
Текст
006746 Область изобретения Изобретение относится к способам лечения неоваскуляризации глаз с использованием средств, которые ингибируют VEGF. Предпосылки изобретения Ангиогенез или аномальный рост кровеносных сосудов рассматривали как важную причину патологических состояний во многих областях медицины, включая офтальмологию, онкологию и ревматологию. Например, эксудативная или неоваскулярная форма возрастной дегенерации желтого пятна (AMD) является ведущей причиной слепоты у пожилых людей. В настоящее время нет стандартной и эффективной терапии для лечения эксудативной AMD у большинства пациентов. Было показано, что термическая лазерная фотокоагуляция и фотодинамическая терапия (PDT) являются благоприятными для подгрупп таких пациентов. Однако только некоторая часть пораженных глаз отвечает критериям показаний для таких терапевтических вмешательств, и у пациентов, подвергшихся такому лечению, имеется высокая частота рецидивов. Проведенные недавно преклинические исследования свидетельствовали о том, что фармакологическое вмешательство или лечение против ангиогенеза можно использовать для лечения различных форм глазной неоваскуляризации, такой как неоваскуляризация сосудистой оболочки (CNV). Большая часть указанной работы была сосредоточена на блокировании фактора роста сосудистого эндотелия (VEGF),который считали участвующим в патогенезе CNV, вторичного в отношении AMD, и в патогенезе диабетической ретинопатии. VEGF представляет собой важный цитокиновый фактор роста, участвующий в ангиогенезе, и, как представляется, играет решающую роль в глазной неоваскуляризации. Исследования,проверенные на людях, показали, что высокие концентрации VEGF имеют место при расстройствах сетчатки, связанных со стекловидным телом и ангиогенезом, но не при неактивных или не связанных с неовасклуяризацией патологических состояниях. В иссеченных участках CNV после экспериментальных субмакулярных хирургических вмешательств также были выявлены высокие уровни VEGF. Другие исследования показали обратное развитие или предотвращение неоваскуляризации во множественных сосудистых ложах в нескольких экспериментальных моделях на животных с использованием различных типов средств против VEGF, включая фрагменты антител. Таким образом, лечение против VEGF представляет собой перспективный новый способ лечения по поводу AMD, диабетической ретинопатии и родственных расстройств. В дополнение к возможному эффекту против ангиогенеза, лечение против VEGF можно использовать в качестве средства против сосудистой проницаемости. VEGF первоначально именовали фактором сосудистой проницаемости вследствие его мощной способности вызывать утечку из кровеносных сосудов. Недавно проведенные исследования показали, что VEGF может играть важную роль, вызывая утечку из сосудов при диабетической ретинопатии, и что разрушение гематоретинального барьера, вызванного диабетом, может быть дозозависимо ингибировано лечением против VEGF. Поэтому лечение противVEGF представляет собой двунаправленную атаку на CNV за счет свойств, направленных против ангиогенеза и против сосудистой проницаемости. Существующие способы лечения глазных неоваскулярных заболеваний нуждаются в усовершенствовании их способности ингибировать или устранить различные формы неоваскуляризации, включая неоваскуляризацию сосудистой оболочки, вторичную в отношении AMD, и диабетическую ретинопатию. Кроме того, имеется сохраняющаяся и значительная необходимость в идентификации новых способов терапии для лечения глазной неоваскуляризации. Настоящее изобретение удовлетворяет данные нужды и, кроме того, предоставляет другие преимущества. Сущность изобретения Авторы изобретения провели клинические испытания аптамера против VEGF с фототерапией и без нее у пациентов с неоваскуляризацией сосудистой оболочки в области под центральной ямкой сетчатки,вызванной возрастной дегенерацией желтого пятна для определения профиля безопасности терапии множественными инъекциями. Авторы изобретения обнаружили, что лечение против VEGF с фотодинамической терапией (PDT) или без нее было как безопасным, так и эффективным при лечении пациентов,страдающих AMD и родственными расстройствами. У большинства пациентов, получавших аптамер против VEGF, через 3 месяца после лечения проявлялось устойчивое или улучшенное зрение. У пациентов, получавших лечение против VEGF в комбинации с PDT, проявлялось наиболее значительное улучшенное зрение. Таким образом, лечение против VEGF или отдельно, или в сочетании с ангиогенными способами лечения отчетливо представляет собой перспективное лечение по поводу различных форм глазной неоваскуляризации, включая ADM и диабетическую ретинопатию. Соответственно, настоящее изобретение описывает способ лечения пациента, страдающего глазным неоваскулярным заболеванием, причем данный способ включает следующие этапы: (а) введение пациенту эффективного количества аптамера против VEGF; и (b) обеспечение пациента фототерапией, такой как фотодинамическая терапия или термическая лазерная фотокоагуляция. В одном варианте реализации изобретения фотодинамическая терапия (PDT) включает этапы:(i) доставки фотосенсибилизатора в глазную ткань пациента; и (ii) воздействия на фотосенсибилизатор света, имеющего длину волн, поглощаемую фотосенсибилизатором в течение времени и при интенсив-1 006746 ности, достаточной для ингибирования неоваскуляризации в ткани глаза пациента. Можно использовать различные фотосенсибилизаторы, включая, но не ограничиваясь, производные бензопорфирина (BPD),моноаспартилхлорин е 6, фталоцианин цинка, этиопурпурин олова, тетрагидрокситетрафенилпорфирин,порфимернатрий (PHOTOFRIN) и зеленые порфирины. В родственном аспекте настоящее изобретение предоставляет способ лечения глазного неоваскулярного заболевания у пациента, причем данный способ включает введение пациенту: (а) эффективного количества аптамера против VEGF; и (b) второго соединения, способного уменьшить или предотвратить развитие нежелательных новых сосудов. Средства против VEGF или другие соединения, которые можно комбинировать с апатмерами против VEGF, включают, но не ограничиваются, антитела или фрагменты антител, специфичных для VEGF; антитела, специфичные для рецепторов VEGF; соединения, которые ингибируют, контролируют и/или модулируют передачу сигнала тирозинкиназы; полипептиды VEGF; олигонуклеотиды, которые ингибируют экспрессию VEGF на уровне нуклеиновых кислот, например антисмысловые РНК; ретиноиды; композиции, содержащие факторы роста; антитела, которые связываются с коллагенами; и различные органические соединения и другие средства, обладающие активностью ингибирования ангиогенеза. В предпочтительном варианте реализации изобретения средство против VEGF представляет собой нуклеиново-кислотный лиганд фактора роста сосудистого эндотелия (VEGF). Нуклеиново-кислотный лиганд VEGF может включать рибонуклеиновую кислоту, дезоксирибонуклеиновую и/или модифицированные нуклеотиды. В особенно предпочтительных вариантах реализации нуклеиново-кислотный лигандVEGF включает 2' F-модифицированные нуклеотиды, 2'-O-метил(2'-ОМе) модифицированные нуклеотиды, и/или полиалкиленгликоль, такой как полиэтиленгликоль (PEG). В некоторых вариантах реализации нуклеиново-кислотный лиганд VEGF является модифицированной группой, например фосфоротиоатом,который уменьшает активность эндонуклеаз или экзонуклеаз на нуклеиново-кислотном лиганде, относительно к немодифицированному нуклеиново-кислотному лиганду без неблагоприятного воздействия на аффинитет связывания лиганда. Еще в одном аспекте изобретение предоставляет способ лечения глазного неоваскулярного заболевания у пациента, причем способ включает этапы: (а) введения пациенту эффективного количества средства, которое ингибирует развитие новых глазных сосудов, например аптамера против VEGF; и (b) предоставления пациенту лечения, которое разрушает аномальные кровеносные сосуды в глазу, напримерPDT. Аптамер против VEGF можно вводить внутрь глаза инъекцией. Альтернативно, аптамер можно доставить с использованием внутриглазного имплантата. Способы изобретения можно использовать для лечения различных неоваскулярных заболеваний,включая, но не ограничиваясь, ишемическую ретинопатию, внутриглазную неоваскуляризацию, возрастную дегенерацию желтого пятна, неоваскуляризацию роговицы, неоваскуляризацию сетчатки, неоваскуляризацию сосудистой оболочки, диабетический отек желтого пятна, диабетическую ишемию сетчатки, диабетический отек сетчатки и пролиферативную диабетическую ретинопатию. Другие преимущества и признаки настоящего изобретения будут очевидны из следующего его подробного описания и из формулы изобретения. Определения Под глазным неоваскулярным заболеванием подразумевается заболевание, характеризуемое развитием новых сосудов глаз, т.е. развитием аномальных кровеносных сосудов в глазу пациента. Под пациентом подразумевается любое животное, имеющее глазную ткань, которая может подвергаться неоваскуляризации. Предпочтительно, животное представляет собой млекопитающее, которое включает, но не ограничивается, людей и других приматов. Термин также включает одомашненных животных, таких как коровы, свиньи, овцы, лошади, собаки и кошки. Под фототерапией подразумевается любой процесс или процедура, при которой на пациента воздействует специфическая доза света определенной длины волн, включающего лазерный свет, для лечения заболевания или другого медицинского состояния. Под фотодинамической терапией или PDT подразумевается любая форма фототерапии, при которой используют активированный светом препарат или соединение, именуемое фотосенсибилизатором,для лечения заболевания или другого медицинского состояния, характеризуемого быстро растущей тканью, включая формирование аномальных кровеносных сосудов (т.е. ангиогенез). Обычно PDT представляет собой двухэтапный процесс, который включает местное или системное введение фотосенсибилизатора пациенту с последующей активацией фотосенсибилизатора облучением специфической дозой света определенной длины волн. Под средством против VEGF подразумевается соединение, которое ингибирует активность или продукцию фактора роста сосудистого эндотелия (VEGF). Под фотосенсибилизатором или фотоактивным средством подразумевается поглощающий свет препарат или другое соединение, которое после воздействия на него света определенной длины волн становится активированным, проявляя посредством этого желательное физиологическое действие, например нарушение или разрушение нежелательных клеток или ткани.-2 006746 Под термической лазерной фотокоагуляцией подразумевается форма фототерапии, при которой лазерные световые лучи направлены в глаз пациента для прижигания аномальных кровеносных сосудов в глазу для закупорки их во избежание дальнейшей утечки. Под эффективным количеством подразумевается количество, достаточное для лечения симптома глазного неоваскулярного заболевания. Используемый здесь термин свет включает все длины волн электромагнитного излучения, включая видимый свет. Предпочтительно, длину волн излучения выбирают для соответствия длинам волн, которые возбуждают фотосенсибилизатор. Еще предпочтительнее, длина волн излучения соответствует длине волн возбуждения фотосенсибилизатора и имеет низкое поглощение тканями, не являющимися мишенями. Краткое описание чертежей Прилагаемая фигура демонстрирует собой химическую структуру NX1838, средства против VEGF. Подробное описаниеVEGF (фактор роста сосудистого эндотелия) представляет собой важный стимул для роста новых кровеносных сосудов в глазу. Авторы изобретения обнаружили, что терапия против VEGF предоставляет безопасное и эффективное лечение по поводу неоваскулярного заболевания, в частности при комбинации с вторичной терапией, которая способна уменьшить или устранить глазную неоваскуляризацию, такая как, например, фотодинамическая терапия (РDТ). Авторы изобретения обнаружили, что комбинация указанных способов терапии значительно более благоприятна при лечении состояний, характеризуемых развитием нежелательной новой сосудистой системы в глазу, чем большинство обычных видов лечения,включая использование любого из указанных видов лечения отдельно. Соответственно, настоящее изобретение предоставляет способ лечения глазного неоваскулярного заболевания, который включает введение пациенту средства против VEGF и лечение пациента фототерапией (например, PDT) или другими способами лечения, такими как фотокоагуляция, которые разрушают аномальные кровеносные сосуды в глазу. Данный способ можно использовать для лечения ряда офтальмологических заболеваний и расстройств, отмеченных развитием глазной неоваскуляризации, включая,но не ограничиваясь, ишемическую ретинопатию, внутриглазную неоваскуляризацию, возрастную дегенерацию желтого пятна, неоваскуляризацию роговицы, неоваскуляризацию сетчатки, неоваскуляризацию сосудистой оболочки, диабетический отек желтого пятна, диабетическую ишемию сетчатки, диабетический отек сетчатки и пролиферативную диабетическую ретинопатию. Лечение против VEGF Имеются разнообразные способы лечения против VEGF, которые ингибируют активность или продукцию VEGF, включая аптамеры и антитела против VEGF, и их можно использовать в способах настоящего изобретения. Предпочтительные средства против VEGF представляют собой нуклеиновокислотные лиганды VEGF, такие как лиганды, описанные в патентах США 6168778 В 1, 6147204,6051698, 6011020, 5958691, 5817785, 5811533, 5696249, 5683867, 5670637 и 5475096. Особенно предпочтительным средством против VEGF является EYE001 (ранее именовавшееся NX1838), которое представляет собой модифицированный, пегилированный аптамер, который связывается с высоким сродством с основной растворимой изоформой человеческого VEGF, и имеет общую структуру, показанную на фигуре (описанную в патенте США 6168788, Journal of Biological Chemistry, Vol. 273(32): 20556-20567(1998); и In Vitro Cell Dev. Biol.-Animal Vol. 35:533-542 (1999. Альтернативно, средства против VEGF могут представлять собой, например, антитела или фрагменты антител против VEGF, такие как средства, описанные в патентах США 6100071, 5730977 иWO 98/45331. Другие подходящие средства против VEGF или соединения, которые можно использовать в комбинации со средствами против VEGF, в соответствии с настоящим изобретением включают, но не ограничиваются, антитела, специфичные для рецепторов VEGF (например, патенты США 5955311,5874542 и 5840301); соединения, которые ингибируют, регулируют и/или модулируют передачу сигналов тирозинкиназы (например, патент США 6313138 В 1); полипептиды VEGF (например, патент США 6270933 В 1 и WO 99/47677); олигонуклеотиды, которые ингибируют экспрессию VEGF на уровне нуклеиновых кислот, например антисмысловых РНК (например, патенты США 5710136,5661135, 5641756, 5639872 и 5639736), ретиноидов (например, патент США 6001885), композиции,содержащие факторы роста (например, патент США 5919459), антитела, которые связываются с коллагенами (например, WO 00/40597), и различные органические соединения и другие средства с активностью, ингибирующей ангиогенез (патенты США 6297238 В 1, 6258812 В 1 и 6114320). Введение средств против VEGF Как только у пациента было диагностировано неоваскулярное заболевание глаза, пациента лечат введением средства против VEGF для блокирования отрицательных эффектов VEGF, облегчая посредством этого симптомы, связанные с неоваскуляризацией. Как обсуждено выше, в данной области известно широкое разнообразие средств против VEGF, и их можно использовать в настоящем изобретении. Способы получения этих средств против VEGF хорошо известны, и многие из них являются коммерчески доступными лекарственными препаратами. Средства против VEGF можно вводить системно, например перорально или внутримышечной или внутривенной инъекцией в смеси с фармацевтически приемлемым носителем, приспособленным для-3 006746 конкретного пути введения. Для введения средств против VEGF можно использовать разнообразные физиологически приемлемые носители, и их композиции известны специалистам в данной области и описаны, например, в публикации Remington's Pharmaceutical Sciences (18th edition), ed. A. Gennaro, 1990,Mack Publishing Company, Easton, PA and Pollock et al. Средства против VEGF предпочтительно вводят парентерально (например, внутримышечной, внутрибрюшинной, внутривенной, внутриглазной инъекцией, инъекцией внутрь стекловидного тела или подкожной инъекцией или имплантатом). Композиции для парентерального введения включают стерильные водные или неводные растворы, суспензии или эмульсии. Можно использовать разнообразные водные носители, например воду, воду с добавлением буфера, солевой раствор и им подобные. Примеры других подходящих носителей включают полипропиленгликоль, полиэтиленгликоль, растительные масла, желатин, гидрированные нафталины и инъецируемые органические сложные эфиры, такие как этилолеат. Такие композиции могут также содержать дополнительные вещества, такие как консервирующие, смачивающие, буферизующие, эмульгирующие и/или диспергирующие агенты. Для регулирования высвобождения активных ингредиентов можно использовать биологически совместимые, биологически разлагаемые лактидные полимеры, сополимеры лактидов/гликолидов или сополимеры полиоксиэтиленаполиоксипропилена. Альтернативно, средства против VEGF можно вводить перорально. Композиции, предназначенные для перорального применения, можно приготовить в твердой или жидкой формах в соответствии с любым способом изготовления фармацевтических композиций, известным в данной области. Композиции могут необязательно содержать подслащивающие, ароматизирующие, красящие, одорирующие и консервирующие агенты для предоставления более приятного на вкус препарата. Твердые лекарственные формы для перорального введения включают капсулы, таблетки, пилюли,порошки и гранулы. В целом, данные фармацевтические препараты содержат активный ингредиент,смешанный с нетоксичными, фармацевтически приемлемыми эксципиентами. Они могут включать, например, инертные разбавители, такие как карбонат кальция, карбонат натрия, лактозу, сахарозу, глюкозу,маннит, целлюлозу, крахмал, фосфат кальция, фосфат натрия, каолин и им подобные. Можно также использовать связывающие агенты, буферы и/или смазывающие агенты (например, стеарат магния). Таблетки и пилюли можно дополнительно изготовить с растворяющимися в кишечнике покрытиями. Жидкие лекарственные формы для перорального введения включают фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы и мягкие желатиновые капсулы. Указанные формы содержат инертные разбавители, обычно используемые в данной области, такие как вода или масляная среда, и могут также включать вспомогательные вещества, такие как смачивающие агенты, эмульгирующие агенты и суспендирующие агенты. Средства против VEGF можно также вводить местно, например накладкой или непосредственным нанесением в глаз или ионтофорезом. Средства против VEGF можно предоставить в композициях пролонгированного высвобождения,таких как композиции, описанные, например, в патентах США 5672659 и 5595760. Применение композиций немедленного или пролонгированного высвобождения зависит от природы подвергающегося лечению состояния. Если состояние состоит из острого или сверхострого расстройства, лечение формой немедленного высвобождения будет предпочтительнее, чем композицией пролонгированного высвобождения. Альтернативно, для определенных профилактических или долгосрочных способов лечения может быть целесообразна композиция пролонгированного высвобождения. Средство против VEGF можно также доставлять с использованием внутриглазного имплантата. Такие имплантаты могут представлять собой биологически разлагаемые и/или биологически совместимые имплантаты или они могут представлять собой не биологически разлагаемые имплантаты. Имплантаты могут быть проницаемыми или не проницаемыми для активного агента, и их можно вставлять в камеру глаза, такую как передняя или задняя камеры, или его можно имплантировать в склеру, трансхороидальное пространство или бессосудистую область снаружи от стекловидного тела. В предпочтительном варианте реализации имплантат можно разместить над бессосудистой областью, такую как на склеру, с тем,чтобы обеспечить возможность диффузии через склеру препарата к желательному участку лечения, например к внутриглазному пространству и желтому пятну глаза. Кроме того, участокдиффузии через склеру расположен предпочтительно вблизи желтого пятна. Примеры имплантатов для доставки средства против VEGF включают, но не ограничиваются, устройства, описанные в патентах США 3416530; 3828777; 4014335; 4300557; 4327725; 4853224; 4946450; 4997652; 5147647; 5164188; 5178635; 5300114; 5322691; 5403901; 5443505; 5466466; 5476511; 5516522; 5632984; 5679666; 5710165; 5725493; 5743274; 5766242; 5766619; 5770592; 5773019; 5824072; 5824073; 5830173; 5836935; 5869079; 5902598; 5904144; 5916584; 6001386; 6074661; 6110485; 6126687; 6146366; 6251090; и 6299895 и в WO 01/30323 и WO 01/28474, которые все включены сюда в качестве ссылки. Дозировка Количество активного ингредиента, которое комбинируют с материалами носителей для изготовления единичной дозировки, будут варьировать в зависимости от индивидуума, подвергаемого лечению, и-4 006746 конкретного вида введения. В целом, средство против VEGF следует вводить в количестве, эффективном для уменьшения или устранения симптома глазного неоваскулярного заболевания. Уровни дозировки порядка приблизительно от 1 мкг/кг до 100 мг/кг массы тела на введение можно использовать при лечении указанных выше неоваскулярных расстройств. При введении непосредственно в глаз предпочтительный диапазон дозировки составляет от около 0,3 до около 3 мг на глаз. Дозировку можно вводить в виде одиночной дозы или разделенной на множество доз. В целом, желательную дозировку следует вводить через установленные интервалы в течение продолжительного периода, обычно, по меньшей мере, в течение нескольких недель, хотя могут понадобиться более длинные периоды введения в течение нескольких месяцев или более. Специалисту в данной области будет понятно, что точные отдельные дозировки можно в некоторой степени откорректировать в зависимости от разнообразных факторов, включая вводимое специфическое средство против VEGF, время введения, путь введения, природу композиции, скорость выведения, конкретное расстройство, подвергаемое лечению, тяжесть расстройства и возраст, массу, здоровье и пол пациента. Широкие колебания необходимой дозировки следует ожидать ввиду различной эффективности различных путей введения. Например, следовало бы ожидать, что пероральное введение в целом потребует более высокие уровни дозировки, чем введение внутривенной инъекцией или инъекцией в стекловидное тело. Изменения указанных уровней дозировки можно подобрать с использованием стандартных эмпирических, обычных приемов для оптимизации, которые хорошо известны в данной области. Точные уровни и типы терапевтически эффективной дозировки предпочтительно определяет лечащий врач с учетом указанных выше факторов. В дополнение к лечению ранее существовавших неоваскулярных заболеваний средства противVEGF можно вводить профилактически для предотвращения или замедления начала указанных расстройств. При профилактических видах применения средство против VEGF вводят пациенту, восприимчивому или подвергнутому иным образом риску конкретного неоваскулярного расстройства. Опять же точные количества, которые вводят, зависят от различных факторов, таких как состояние здоровья, масса и т.д. пациента. Эффективность лечения против VEGF Для оценки эффективности лечения против VEGF с целью лечения глазной неоваскуляризации авторы изобретения провели ряд исследований, которые описаны в примерах ниже, которые включали введение аптамера против VEGF с фотодинамической терапией или без нее у пациентов, страдающих неоваскуляризацией сосудистой оболочки в области под центральной ямкой сетчатки, вызванной возрастной дегенерацией желтого пятна. Фаза 1 А исследования однократной инъекции внутрь стекловидного тела при лечении против VEGF у пациентов с неоваскуляризацией сосудистой оболочки в области под центральной ямкой сетчатки (CNV), вызванной возрастной дегенерацией желтого пятна (AMD), выявила отличный профиль безопасности (пример 6). Офтальмологическое обследование выявило, что у 80% пациентов проявлялось устойчивое или улучшенное зрение через 3 месяца после лечения и что у 27% глаз продемонстрировано улучшение зрения на 3 строки или более по таблице оценки остроты зрения(ETDRS) в указанный период времени. Не было выявлено связанных с лечением местных или системных побочных явлений. Указанные данные продемонстрировали, что лечение против VEGF представляет собой перспективный новый путь для лечения неоваскулярных заболеваний глаз, включая эксудативную дегенерацию желтого пятна и диабетическую ретинопатию. Авторы изобретения также провели фазу 1 В исследования лечения против VEGF множественными уменьшающимися дозами с использованием множественных инъекций в стекловидное тело аптамера против VEGF с фотодинамической терапией или без нее у пациентов с CNV под центральной ямкой сетчатки, вызванной AMD (пример 7). Исследование безопасности показало отсутствие значительных проблем безопасности, связанных с препаратом. Офтальмологическое обследование выявило, что у 87,5% пациентов, которые получали один аптамер против VEGF, проявлялось устойчивое или улучшенное зрение через 3 месяца после лечения и что у 25% глаз продемонстрировано улучшение зрения на 3 строки или более по таблице ETDRS в указанный период времени. 3-строчную прибавку по таблице ETDRS через 3 месяца наблюдали у 60% пациентов, которые получали как аптамер против VEGF, таки и фотодинамическую терапию. Множественные инъекции аптамера против VEGF внутрь стекловидного тела были очень хорошо переносимы в данном исследовании на фазе 1 В. Результаты данного клинического исследования фазы 1 В лечения против VEGF множественными инъекциями внутрь стекловидного тела (пример 7) расширяют отличный профиль безопасности, отмеченный в проведенном авторами изобретения исследовании однократной инъекции фазы 1 А (пример 6). В частности, исследование фазы 1 В показывает безопасность при внутриглазном и системном введении трех последовательных вводимых ежемесячно инъекций аптамера против VEGF внутрь стекловидного тела. Не были отмечены серьезные побочные явления, связанные с лечением. Встречавшиеся побочные явления оказались не связанными с самой инъекцией внутрь стекловидного тела или в некоторых случаях были незначительными, вероятно, ввиду самой инъекции. Улучшение зрения на 3 строки у 25% в группе, получавшей лечение только аптамером, через 3 месяца было благоприятным в сравнении с анамнестическими контролями, такими как результаты основ-5 006746 ного испытания PDT (2,2%) и его контролями (1,4%) через 3 месяца (Arch. Ophthalmol. 1999, 117:13291345), и контрольной группой с ложным облучением (3%) (Ophthalmology 1999, 106; 12:2239-2247), где такое улучшение в указанный период времени было отмечено не более чем у 3% пациентов. Улучшение зрения на 3 строки в 25% случаев через 3 месяца согласуется с частотой улучшения 26,7%, отмеченной на фазе 1 А исследования аптамера. Может быть, что воздействия препарата против проницаемости вызвали резорбцию подсетчаточной жидкости и, таким образом, улучшение зрения в данных случаях. Представляет интерес то, что недавно проведенное исследование с использованием фрагмента антитела против VEGF от Genetech также показало улучшение зрения на 3 строки в 26% случаев на фазе 1 А клинического испытания. Указанный фрагмент антитела разделяет тот же механизм блокирования внеклеточного VEGF, что и аптамер против VEGF. Уровень стабилизации или улучшения в 87,5%, наблюдавшийся через 3 месяца на фазе 1 В исследования, также преимущественен по сравнению с частотой 50,5% у пациентов, получавших лечение PDT в основном испытании (Arch. Ophthalmol. 1999, 117:1329-1345), частотой 44% у контролей PDT и частотой 48% в группе с ложным облучением (Ophthalmology 1999, 106; 12:2239-2247). Улучшение зрения на 3 строки через 3 месяца у 60% пациентов, которые получали как аптамер против VEGF, так и PDT, также было вдохновляющим. На фазе 3 основного испытания PDT такое улучшение зрения было выявлено лишь у 2,2% пациентов (Arch. Ophthalmol. 1999, 117:1329-1345). Обе указанные группы исследований включали глаза с классической CNV под центральной ямкой сетчатки. Улучшение зрения, наблюдавшееся в указанных группах, подтверждается данными о том, что исследователи выбирают повторное лечение PDT через 3 месяца лишь в 40% случаев по сравнению с частотой повторного лечения 93%, о которой сообщали в центральном испытании PDT (Arch. Ophthalmol. 1999,117:1329-1345). Кроме того, многочисленные преклинические исследования в настоящее время показывают, что терапия против VEGF может предотвратить вызванную VEGF неоваскуляризацию роговицы, радужной оболочки, сетчатки и сосудистой оболочки (Arch. Ophthalmol. 1996, 114:66-7; Invest. Ophthalmol. Vis. Sci. 1994, 35:101). Описанные ниже в примерах 1-5 преклинические исследования с использованием EYE001 предоставляют свидетельство о том, что лечение против VEGF можно использовать для уменьшения сосудистой проницаемости и глазной неовасклуризации. Аптамер против VEGF проявил высокую эффективность на модели неоваскуляризации сетчатки при ретинопатии недоношенности (ROP), где неоваскуляризация сетчатки была ингибирована на 80%, по сравнению с контролями (р=0,0001). Анализ на модели Miles показала почти полное ослабление опосредованной VEGF сосудистой утечки после добавления EYE001, и модель ангиогенеза роговицы также показала значительное уменьшение неоваскуляризации при использовании EYE001. Анализ на модели Miles у морских свинок свидетельствует о том, что аптамер против FEGF может значительно уменьшить сосудистую проницаемость. Данное свойство уменьшения сосудистой проницаемости может оказаться клинически важным для уменьшения количества жидкости и отека при CNV и диабетическом отеке желтого пятна. Таким образом, лечение противVEGF может действовать и как средство против проницаемости, и/или как средство против ангиогенеза. Фотодинамическая терапия (PDT) Как обсуждено выше, один вариант реализации способа изобретения включает введение средства против VEGF в комбинации с фотодинамической терапией (PDT). PDT представляет собой двухэтапный процесс, который начинается с местного или системного введения поглощающего свет светочувствительного агента, такого как производное порфирина, которое избирательно накапливается в тканяхмишенях пациента. После облучения светом активирующей длины в клетках, содержащих фотосенсибилизатор, продуцируются реактивные виды кислорода, которые способствуют гибели клеток. Например,при лечении глазных заболеваний, характеризуемых глазной неоваскуляризацией, выбирают фотосенсибилизатор, который накапливается в новой сосудистой сети глаза. Затем на глаз пациента воздействуют светом соответствующей длины волн, что приводит к разрушению аномальных кровеносных сосудов,улучшая посредством этого остроту зрения пациента. Фотосенсибилизаторы Фотодинамическую терапию в соответствии с изобретением можно выполнять с использованием ряда фотоактивных соединений. Например, фотосенсибилизатор может представлять собой любое химическое соединение, которое собирается в одном или более типов отобранных тканей-мишеней и, при воздействии света определенной длины волн, поглощает свет и вызывает повреждение или разрушение тканей-мишеней. В сущности, любое химическое соединение, которое собирается в отобранной мишени и поглощает свет, можно использовать в данном изобретении. Предпочтительно, фотосенсибилизатор нетоксичен для животного, которому он введен, и способен включаться в нетоксичную композицию. Фотосенсибилизатор также предпочтительно нетоксичен в его разложившейся под действием света форме. Идеальные фотосенсибилизаторы характеризуются отсутствием токсичности для клеток в отсутствие фотохимического эффекта и легко выводятся из тканей, не являющихся мишенями. Достаточно большой перечень фотосенсибилизаторов можно найти, например, в публикацииKreimer-Birnmaum, Sem. Hematol. 26: 157-73, 1989. Светочувствительные соединения включают, но не ограничиваются, хлорины, бактериохлорины, фталоцианины, порфирины, пурпурины, мероцианины,-6 006746 феофорбиды, псоралены, аминолевулиновую кислоту (ALA), производные гематопорфирина, порфицены, порфацианин, экспандированные соединения, подобные порфирину, и пролекарства, такие как аминолевулиновая кислота, которая может продуцировать лекарственные препараты, такие как протопорфирин (см., например, фотосенсибилизаторы, описанные в патентах США 5438071; 5405957; 5198460; 5190966; 5173504; 5171741; 5166197; 5095030; 5093349; 5079262; 5028621; 5002962; 4968715; 4920143; 4883790; 4866168; и 4649151). Предпочтительными фотосенсибилизирующими агентами являются производные бензопорфирина (BPD), моноаспартилхлорин е 6, фталоцианин цинка, этиопурпурин олова, тетрагидрокситетрафенилпорфирин и порфимернатрий (PHOTOFRIN). Особенно мощная группа фотосенсибилизаторов включает зеленые порфирины, которые подробно описаны Levy et al., патент США 5171749. Любой из описанных выше фотосенсибилизаторов можно использовать в способах изобретения. Конечно, также можно использовать смеси двух или более фотоактивных соединений; однако, эффективность лечения зависит от поглощения света фотосенсибилизатором, так что, если используют смеси,предпочтительны компоненты с одинаковыми максимумами поглощения. Фотосенсибилизирующие агенты настоящего изобретения предпочтительно имеют спектр поглощения, который находится в пределах диапазона длины волн от 350 до 1200 нм, предпочтительно приблизительно от 400 до 900 нм, а наиболее предпочтительно от 600 до 800 нм. Фотосенсибилизатор составлен так, чтобы обеспечить эффективную концентрацию в глазной ткани-мишени. Фотосенсибилизатор может быть соединен со специфическим связывающим лигандом, который может связываться со специфическим поверхностным компонентом глазной ткани-мишени или,если желательно, приготовлен с носителем, который доставляет более высокие концентрации к тканимишени. Природа композиции будет частично зависеть от способа введения и природы выбранного фотосенсибилизатора. Можно использовать любой фармацевтически приемлемый эксципиент или их комбинацию, подходящую для конкретного фотоактивного соединения. Так, фотосенсибилизатор можно вводить в виде водной композиции, в виде композиции, вводимой через слизистые оболочки или через кожу, или в виде композиции для перорального применения. Как указано выше, способ изобретения особенно эффективен для лечения пациентов, страдающих потерей остроты зрения, связанной с нежелательной неоваскуляризацией. Было показано, что возросшие количества рецепторов LDL связаны с неоваскуляризацией. Зеленые порфирины, и в частности BPD-MA,сильно взаимодействуют с такими липопротеидами. Сам LDL можно использовать в качестве носителя для зеленых порфиринов или липосомных композиций. Считают, что липосомные композиции доставляют зеленые порфирины избирательно к липопротеину низкой плотности, компоненту плазмы, который, в свою очередь, действует в качестве носителя для более эффективной доставки активного ингредиента к желаемому участку. Путем увеличения распределения зеленого порфирина в липопротеиновую фракцию крови липосомные композиции могут привести к более эффективной доставке фотосенсибилизатора к сети новых сосудов. Композиции зеленых порфиринов с вовлечением липокомплексов, включающих липосомы, описаны в патенте США 5214036. Липосомный BPD-MA для внутривенного введения можно получить от компании QLT PhotoTherapeutics Inc., Vancouver, British Columbia. Фотосенсибилизатор можно ввести местно или системно любым из множества путей, например перорально, парентерально (например, внутривенной, внутримышечной, внутрибрюшинной или подкожной инъекцией), местно посредством накладок или имплантатов, или соединение можно поместить непосредственно в глаз. Фотосенсибилизирующий агент можно ввести в сухой композиции, такой как пилюли, капсулы, суппозитории или накладки. Фотосенсибилизирующий агент можно также ввести в жидкой композиции, в виде агента с водой или с фармацевтически приемлемыми эксципиентами, такими как раскрыто в приведенной выше публикации Remington's Pharmaceutical Sciences. Жидкая композиция может также представлять собой суспензию или эмульсию. Подходящие эксципиенты для суспензий и для эмульсий включают воду, солевой раствор, декстрозу, глицерин и им подобные. Указанные композиции могут содержать небольшие количества нетоксичных вспомогательных веществ, таких как смачивающие или эмульгирующие агенты, антиоксиданты, буферные агенты, регулирующие рН, и им подобные. Доза фотосенсибилизатора может широко варьировать в зависимости от многообразия факторов,таких как тип фотосенсибилизатора, способ введения, композиция, в которой он содержится, такая как в форме липосом, или от того, связан ли он со специфичным для мишени лигандом, таким как антитело или иммунологически активный фрагмент. Другие факторы, которые влияют на дозу фотосенсибилизирующего агента, включают предполагаемую в качестве мишени клетку (клетки), массу пациента и время обработки светом. Хотя различные фотоактивные соединения требуют различных диапазонов дозировки,типичная дозировка находится в диапазоне 0,1-50 мг/м 2 (площади поверхности тела), предпочтительно приблизительно 1-10 мг/м 2, и еще предпочтительнее приблизительно 2-8 мг/м 2. Различные параметры, используемые для фотодинамической терапии в изобретении, взаимосвязаны. Поэтому дозу следует также подобрать с учетом других параметров, например интегральной плотности потока, интенсивности падающего света, длительности освещения, используемого при фотодинамической терапии, и интервала времени между введением дозы и терапевтическим световым облучением.-7 006746 Все указанные параметры следует подобрать для получения значительного усиления остроты зрения без значительного повреждения ткани глаза. Световая обработка После того как пациенту был введен фотосенсибилизатор, глазную ткань-мишень облучают светом при длине волн, которая поглощается использованным фотосенсибилизатором. Спектры описанных здесь фотосенсибилизаторов известны в данной области; определение спектра для любого конкретного фотоактивного соединения представляет собой простую задачу. Для зеленых порфиринов желательный диапазон длины волн составляет в целом приблизительно от 550 до 695 нм. Длина волн в данном диапазоне особенно предпочтительна для усиленного проникновения в ткани тела. В результате воздействия света фотосенсибилизатор переходит в возбужденное состояние и, как считают, взаимодействует с другими соединениями для образования реактивных промежуточных соединений, таких как синглетный кислород, который может вызвать разрыв клеточных структур. Возможные клеточные мишени включают клеточную мембрану, митохондрии, мембраны липосом и ядро. Подтверждения, полученные на опухолевых и неоваскулярных моделях, указывают на то, что окклюзия сосудистой сети является основным механизмом фотодинамической терапии, причем окклюзия происходит в результате повреждения эндотелиальных клеток с последующей адгезией, дегрануляцией тромбоцитов и формированием тромба. Интегральная плотность потока во время обработки световым излечением может широко варьировать в зависимости от типа ткани, глубины ткани-мишени и количества лежащей поверх жидкости или крови, но предпочтительно она варьирует от 500 до 200 Дж/см 2. Интенсивность падающего света обычно варьирует приблизительно от 150 до 900 мВт/см 2, причем предпочтительнее диапазон приблизительно от 150 до 600 мВт/см 2. Однако в качестве эффективного и имеющего преимущество для уменьшения времени обработки можно выбрать использование более высоких уровней интенсивности падающего света. Оптимальное время после введения фотоактивного агента до обработки светом может также широко варьировать в зависимости от способа введения, формы введения и конкретной глазной ткани, выбранной в качестве мишени. Типичные периоды времени после введения фотоактивного агента находятся в диапазоне от около 1 мин до около 2 ч, предпочтительно приблизительно от 5 до 30 мин, а предпочтительнее приблизительно от 10 до 25 мин. Длительность воздействия светового облучения составляет предпочтительно приблизительно от 1 до 30 мин, в зависимости от мощности источника излучения. Длительность воздействия светового облучения также зависит от желательной интегральной плотности потока. Например, для интенсивности падающего света 600 мВт/см 2 интегральной плотности потока 50 Дж/см 2 требуется облучение длительностью 90 с; интегральная плотность потока 150 Дж/см 2 требует облучение длительностью 270 с. Облучение, кроме того, определяется его интенсивностью, длительностью и определением времени относительно введения фоточувствительного агента (интервала после инъекции). Интенсивность должна быть достаточной для того, чтобы излучение проникло через кожу и/или достигло подлежащих лечению тканей-мишеней. Длительность должна быть достаточной для фотоактивации количества фоточувствительного агента, достаточного для действия на ткани-мишени. Как интенсивность, так и длительность должны быть ограничены во избежание избыточного воздействия на пациента. Интервал после инъекции перед воздействием света важен, потому что, в целом, чем скорее подается свет после введения фоточувствительного агента, тем 1) ниже требуемое количество света и 2) ниже эффективное количество фоточувствительного агента. Клиническое обследование и фотография глазного дна обычно не выявляют изменения цвета непосредственно после фотодинамической терапии, хотя незначительное побеление сетчатки происходит в некоторых случаях приблизительно через 24 ч. Окклюзию неоваскуляризации сосудистой оболочки предпочтительно подтверждают гистологически наблюдением повреждения эндотелиальных клеток. Можно также оценить наблюдения для выявления вакуолизированной цитоплазмы и аномальных ядер,связанных с разрывом неоваскулярной ткани. В целом, эффекты фотодинамической терапии в отношении уменьшения неоваскуляризации можно оценить с использованием стандартных ангиографических методик с использованием флюоресцеина в определенные периоды после лечения. Эффективность PDT можно также определить посредствомклинической оценки остроты зрения с использованием средств, являющихся стандартными в данной области, таких как обычные глазные таблицы, при использовании которых остроту зрения оценивают по способности различать буквы определенного размера, обычно при пяти буквах на строке данного размера. Другие виды терапии для лечения неоваскулярных заболеваний В дополнение к PDT, существует ряд других видов терапии для лечения неоваскулярного заболевания, которые можно использовать в комбинации с видами терапии против VEGF. Например, форма фототерапии, известной как термическая лазерная фотокоагуляция, представляет собой стандартную офтальмологическую процедуру для лечения диапазона глазных расстройств, включая заболевания сосудов сетчатки (например, диабетическая ретинопатия), заболевания сосудов, сосудистой оболочки и поражения желтого пятна (например, старческая дегенерация желтого пятна). Данная процедура включает ис-8 006746 пользование лазерного света для прижигания аномальных кровеносных сосудов в глазу пациента для закупорки их от дальнейшей утечки (см., например, Arch. Ophthalmol. 1991, 109:1109-1114). Альтернативно, соединения, способные уменьшить или предотвратить развитие нежелательной сети новых сосудов, включая другие средства против VEGF, средства против ангиогенеза или другие средства, которые ингибируют развитие глазной неоваскуляризации, можно использовать в комбинации с терапией противVEGF. Признаки и другие детали изобретения будут теперь конкретнее описаны и выделены в следующих примерах, описывающих предпочтительные методики и результаты экспериментов. Указанные примеры приведены с целью иллюстрации изобретения и не должны рассматриваться как ограничивающие. Примеры В следующих примерах использовали пегилированный аптамер против VEGF EYE001. Как обсуждалось выше, данный аптамер представляет собой конъюгированный с полиэтиленгликолем (PEG) олигонуклеотид, который связывается с основной растворимой человеческой изоформой VEGF, VEGF165, с высокой специфичностью и аффинитетом. Аптамер связывается и инактивирует VEGF образом, подобным связыванию высокоаффинного антитела, направленного против VEGF. В примерах 1-5 сообщены преклинические результаты исследований с аптамером против VEGF на различных моделях глазной неоваскуляризации, в примере 6 сообщены результаты фазы 1 А клинического испытания безопасности при эксудативной AMD, и в примере 7 сообщены результаты фазы 1 В клинического испытания. В целом,дозировки и концентрации выражены в виде только массы олигонуклеотида EYE001 (NX1838) и основаны на приблизительном коэффициенте поглощения для аптамера единицы 37 мкг/мл/А 260. Пример 1. Анализ проницаемости кожных сосудов (анализ Miles). Одним из видов биологической активности VEGF является увеличение сосудистой проницаемости посредством специфического связывания с рецепторами на сосудистых эндотелиальных клетках. Взаимодействие приводит к расслаблению плотных эндотелиальных контактов с последующей утечкой сосудистой жидкости. Сосудистую утечку, вызванную VEGF, можно измерить in vivo слежением за утечкой красителя Эванса синего из сосудистой системы морской свинки как следствия внутрикожной инъекцииGrowth Factor, Microvascular Hyperpermeability, and Angiogenesis. Am. J. Pathol. 1995, 146:1029). Аналогичным образом, анализ можно использовать для измерения способности соединения блокировать данную биологическую активность VEGF.VEGF165 (20-30 нМ) предварительно смешивали ex vivo с EYE001 (от 30 нМ до 1 мкМ) и затем вводили внутрикожной инъекцией в выбритую кожу на спине морских свинок. Через 30 мин после инъекции утечку красителя Эванса синего вокруг инъекции количественно определяли с использованием компьютеризированного устройства морфометрического анализа. Данные (не показаны) продемонстрировали, что вызванная VEGF утечка индикаторного красителя из сосудистой системы почти полностью ингибирована совместным введением EYE001 в таких низких концентрациях, как 100 нМ. Пример 2. Анализ ангиогенеза роговицы. Гранулы метакрилатного полимера, содержащие VEGF165 (3 пМ), имплантировали в строму роговицы крыс для того, чтобы вызвать рост кровеносных сосудов в лишенной нормы сосудов роговице.EYE001 вводили внутривенно крысам в дозах 1, 3 и 10 мг/кг 1 или 2 раза в день в течение 5 дней. В конце периода лечения делали микрофотографии всех отдельных роговиц. Степень, в которой новые сосуды развивались в ткани роговицы, и их ингибирование EYE001 количественно определяли стандартизированным морфометрическим анализом микрофотографий. Данные (не показаны) продемонстрировали, что системное лечение EYE001 приводит к значительному ингибированию (65%) зависимого от VEGF ангиогенеза в роговице при сравнении с лечением солевым раствором с фосфатным буфером (PBS). Лечение введением 1 раз в день в дозе 10 мг/кг было так же эффективно, как лечение 2 раза в день. Доза 3 мг/кг имела активность, аналогичную дозе 10 мг/кг, но значимая эффективность не была очевидна при дозе 1 мг/кг. Пример 3. Исследование ретинопатии недоношенности. Даже хотя ROP четко отличается от диабетической ретинопатии и AMD, мышиную модель ROP использовали для демонстрации роли VEGF в аномальной васкуляризации сетчатки, которая происходит при данном заболевании (Smith L.E., Wesolowski Е., McLellan A., Kostyk S.K., Amato D.R., Sullivan R.,D'Amore P.A. Oxygen-induced retinopathy in the mouse. Invest. Ophthalmol. Vis. Sci. 1994,35:101). Указанные данные предоставили обоснование для исследования антиангиогенных свойств EYE001 на данной модели. Пометы из 9, 8, 8, 7 и 7 мышей соответственно оставляли в воздухе помещения или вызывали у них гипероксию и лечили внутрибрюшинным введением PBS или EYE001 (1, 3 или 10 мг/кг/д). Конечную точку анализа, разрастание новых капилляров через внутреннюю ограничивающую мембрану сетчатки в стекловидное тело, оценивали микроскопической идентификацией и подсчетом зачатков новых сосудов в 20 гистологических срезах каждого глаза от всех получавших лечение и контрольных мышей. Уменьшение сетчаточной новой сосудистой сети на 80% относительно не получавшего лечения контроля наблюдали при дозах как 10 мг/кг, так и 3 мг/кг (р=0,0001 для обеих доз).-9 006746 Пример 4. Ксенотрансплантаты человеческих опухолей. Эффективность EYE001 in vivo тестировали на ксенотрансплантатах человеческих опухолей (рабдомиосаркома А 673 и аденомиосаркома), имплантированных голым мышам. В обоих случаях мышей лечили внутрибрюшинным введением EYE001 в дозе 10 мг/кг 1 раз в день после развития проросших опухолей (200 мг). Контрольные группы лечили контрольным аптамером со скремблированной последовательностью (олигонуклеотидом). Лечение мышей EYE001 в дозе 10 мг/кг 1 раз в день ингибировало рост опухоли рабдомиосаркомы А 673 на 80%, а аденомиосаркомы - на 84% относительно контроля. На модели аденомиосаркомы через 2 недели после окончания терапии у получавших лечение животных размер опухоли снова увеличивался так бурно, что больше не было никакого различия размера опухоли по сравнению с контролями. Пример 5. Фармакокинетика EYE001 при введении в стекловидное тело у кроликов. Кроликов получали и за ними осуществляли уход в соответствии со всеми применимыми руководствами штата и федерального регулирования и соблюдали Принципы ухода за лабораторными животными (публикация Национального института здоровья 85-23, новая редакция 1985 г.). Всего 18 самцам Новозеландских белых кроликов вводили EYE001 внутривенной инъекцией. Каждое животное получало дозу в виде двухсторонней инъекции в дозе 0,50 мг/глаз (1,0 мг/животное) в объеме 40 мкл/глаз. Брали образцы ЭДТА-плазмы и жидкой части стекловидного тела за период 28 дней после введения дозы и хранили в замороженном состоянии (-70 С) до анализа. Жидкую часть стекловидного тела из каждого глаза собирали отдельно, после того как животных забивали обескровливанием. Концентрации EYE001 в образцах жидкой части стекловидного тела определяли методом анализа ВЭЖХ, аналогичным описанному ранее Tucker et al. (Detection and plasma pharmacokinetics of an anti-vascular endothelial growth factoroligonucleotide-aptamer (NX1838) in rhesus monkeys. J. Chromatogr. Biomed. Appl. 1999, 732:203-212) и методом анализа двойной гибридизации, аналогичным описанному ранее Drolet et al. (PharmacokineticsVitreous Humor of Rhesus Monkeys. Pharm. Res., 2000, 17:1503-1510). Концентрацию в жидкой части стекловидного тела рассчитывали усреднением результатов обоих анализов. Концентрации EYE001 в плазме определяли только анализом двойной гибридизации. После однократной дозы EYE001 в виде двухстороннего введения по 0,50 мг/глаз (1,0 мг/животное) исходные уровни в жидкой части стекловидного тела составили приблизительно 350 мкг/мл и уменьшались видимым процессом выведения первого порядка приблизительно до 1,7 мкг/мл к 28-му дню. По оценкам, конечный период полувыведения составил 83 ч, аналогичный 94-часовому периоду полувыведения, наблюдавшемуся у макак резус (Drolet et al., см. выше). Через 4 недели после введения EYE0012 уровни препарата в жидкой части стекловидного тела (190 нМ) оставались значительно выше КD дляVEGF (200 пМ), свидетельствуя о том, что у людей целесообразно введение 1 раз в день, допуская, что фармакокинетические параметры сравнимы в жидкой части стекловидного тела у кроликов и людей. В отличие от высоких уровней EYE001, обнаруженных в жидкой части стекловидного тела, концентрации в плазме были значительно ниже и находились в диапазоне от 0,092 до 0,005 мкг/мл от 1-го до 21-го дня. Уровни в плазме снизились видимым процессом выведения первого порядка, а также определенным конечным периодом полувыведения 84 ч. Таким образом, конечный период полувыведения из плазмы имитировал период полувыведения из жидкой части стекловидного тела, как наблюдали у макак резус (Droletet al., см. выше), и указывает на классическую кинетику в виде качелей, при которой выведение из глаза представляет собой определяющий скорость этап выведения препарата из плазмы. Указанные данные согласуются с высокостабильным (устойчивым к нуклеазе) аптамером, который подвергается медленной скорости высвобождения из жидкой части стекловидного тела в системное кровообращение. Пример 6. Исследование фазы 1 А клинического испытания. Авторы изобретения провели многоцентровое, открытое исследование с увеличением дозы однократной инъекции в стекловидное тело EYE001 у пациентов с CNV под центральной ямкой сетчатки,вызванной возрастной дегенерацией желтого пятна, и с остротой зрения хуже, чем 20/200 по таблице для определения остроты зрения ETDRS. Начальная доза составила 0,25 мг, инъецированная однократно в стекловидное тело. Испытывали также дозировки 0,5, 1, 2 и 3 мг. Выполняли полное обследование глаз с фотографией глазного дна и флюоресцентной ангиографией. Лечили всего 15 пациентов. Критерии отбора Пациентов для исследования отбирали с использованием следующих критериев включения и исключения. Критерии включения. Требовалось, чтобы пациентам было 50 лет и их общее состояние здоровья было хорошим, чтобы лучшая корригированная острота зрения у них в одном глазу была хуже, чем 20/200 по таблице ETDRS,и составляла 20/400 или хуже, по меньшей мере, для первого пациента каждой группы (n=3); чтобы лучшая корригированная острота зрения в другом глазу была равна или была лучше, чем 20/64; чтобы имелась CNV в области под центральной ямкой сетчатки (классическая и/или скрытая CNV) с размером площади диска по данным Исследования фотокоагуляции желтого пятна (MPS) 3,5; чтобы глазные среды были прозрачными и имелось адекватное расширение зрачка для обеспечения возможности получе- 10006746 ния стереоскопической фотографии глазного дна хорошего качества; и чтобы внутриглазное давление составляло 22 мм рт.ст. или ниже. Критерии исключения. Критерии исключения включали значительные помутнения сред, включая катаракту, которые могли вмешиваться в определение остроты зрения, оценку токсичности или фотографию глазного дна; присутствие глазных заболеваний, включая глаукому, диабетическую ретинопатию, окклюзию сосудов сетчатки или другие состояния (кроме CNV в результате AMD), которые могут значительно воздействовать на зрение; присутствие других причин CNV, включая патологическую миопию (сферический эквивалент-8 диоптрий или более отрицательная величина), синдром глазного гистоплазмоза, ангиоидные полосы сетчатки, разрыв сосудистой оболочки и многоочаговый хороидит; пациентов, которым могло быть показано или предполагалось дополнительное лазерное лечение по поводу CNV; любую внутриглазную операцию в пределах 3 месяцев включения в исследование; кровь, занимающую 50% поражения; предшествующую витрэктомию; предшествующую или сопутствующую терапию другим исследуемым средством для лечения AMD, кроме поливитаминов и минеральных микроэлементов; любое из следующих лежащих в основе системных заболеваний, включая неконтролируемый диабет или присутствие диабетической ретинопатии; сердечные заболевания, включающие инфаркт миокарда в пределах 12 месяцев перед включением в исследование, и/или поражение коронарных артерий, связанное с клиническими симптомами, и/или указания на ишемию, отмеченные на ЭКГ; инсульт (в пределах 12 месяцев после включения в исследование); активные расстройства с кровотечением; любую крупную хирургическую процедуру в пределах 1 месяца после включения в исследование; активную пептическую язвенную болезнь с кровотечением в пределах 6 месяцев после включения в исследование; и сопутствующую системную терапию кортикостероидами (например, перорально преднизоном) или другие антиангиогенные лекарственные препараты (например, талидомид). Лекарственное средство для исследования Лекарственный продукт представлял собой готовый к использованию стерильный раствор, составленный из EYE001 (ранее NX1838), растворенного в 10 мМ фосфате натрия и 0,9% растворе для инъекций хлорида натрия с буфером, и представленный в стерильном и апирогенном стеклянном цилиндрическом корпусе шприца емкостью 1 см 3 с покрытой пробкой, прикрепленной к пластиковому поршню, и резиновым торцовым колпачком на предварительно прикрепленной игле 27 калибра. Пегилированный аптамер давали при концентрациях активного препарата 1, 2,5, 5, 10, 20 или 30 мг/мл EYE001 (выраженные в виде содержания олигонуклеотида) для обеспечения объема доставки 100 мкл. Включение пациентов в исследование Перед набором пациентов в исследование получали письменное одобрение протокола Учрежденческим аналитическим советом, информированное согласие и любую дополнительную информацию о пациентах. Результаты Исследование безопасности с ранжированием однократной дозы выполняли у 15 пациентов при дозах, варьирующих от 0,25 до 3,0 мг/глаз без достижения ограничивающей дозу токсичности. Вязкость композиции предотвращала дальнейшее повышение дозы за пределы 3 мг. Возраст пациентов находился в диапазоне от 64 до 92 лет. В исследование были введены 8 мужчин и 7 женщин - все европеоидной расы. 11 из 15 пациентов испытали всего 17 побочных эффектов от легкой до умеренной степени тяжести,включая 6, которые, вероятно или возможно, были связаны с введением EYE001: легкое внутриглазное воспаление, скотома, визуальное искажение, крапивница, боль в глазу и усталость. Кроме того, было одно тяжелое неблагоприятное явление, которое не было связано с исследуемым препаратом. Это был диагноз карциномы молочной железы у одной пациентки, у которой объемное образование было отмечено перед лечением. Через 3 месяца после инъекции EYE001 в 12 из 15 (80%) глазах проявилось стабильное или улучшенное зрение. У 4 пациентов (26,7%) имелось значительно улучшенное зрение в той же точке времени,которое определяли как улучшение зрения на 3 строки по таблице для определения остроты зренияETDRS. Пациенты с таким улучшением зрения через 3 месяца отметили увеличение, составившее +6, +4 и +3 строки, по таблице для определения остроты зрения ETDRS. Не были отмечены неожиданные явления, связанные с безопасностью для зрения. Оценка цветных фотографий и флюоресцеиновых ангиограмм не выявила признаков токсического действия на сетчатку или сосудистую оболочку. Клиническое исследование фазы 1 А, проведенное авторами изобретения, показало, что однократные дозы аптамера против VEGF в стекловидное тело можно безопасно вводить в количестве до 3 мг/глаз. Не были отмечены существенные глазные или системные побочные эффекты. Клиницисты солидарны в том, что для оценки любого потенциального лечения по поводу эксудативной AMD желательно наблюдение в течение минимум 1 года. Тем не менее, имеются 3-месячные данные некоторых перспективных исследований, и их можно использовать для оценки как безопасности для глаз, так и потенциальных тенденций нового лечения. Исторические контроли указывают на то, что лишь в 1,4% (основное фотодинамическое испытание)- 11006746 проявилось значительное улучшение зрения, как определено прибавкой на 3 или более строк по таблице для определения остроты зрения ETDRS через 3 месяца. Кроме того, в группе, получавшей лечение PDT в исследовании ТАР (Arch. Ophthalmol. 1999, 117:1329-1345), такое улучшенное зрение отметили лишь в 2,2% случаев через 3 месяца. Указанные данные подтверждают клиническое впечатление авторов изобретения о том, что редко отмечают значительное улучшение зрения в любую временную рамку при любом типе (классическом, скрытом или смешанном) CNV, вызванной AMD. В исследовании авторов изобретения через 3 месяца после введения в стекловидное тело аптамера против VEGF в 80% глаз проявилось стабилизированное или улучшенное зрение, причем 26,7% глаз проявили увеличение на 3 или более строк по таблице для определения остроты зрения ETDRS. Указанные наблюдения улучшения зрения подтверждаются клиническими и ангиографическими данными у некоторых из пациентов, получавших лечение аптамером. Стабилизация зрения всегда была целью исследований эксудативной AMD, поэтому значительное улучшение остроты зрения (3 строки по ETDRS),наблюдавшееся у 26,7% пациентов через 3 месяца только при одной дозе, было неожиданным. Ясно, что исторические контроли не подходят для сравнения. Кроме того, короткий период наблюдения, маленький размер выборки и различный тип CNV (т.е. процентная доля классической, скрытой или смешаннойCNV) исключали любые окончательные выводы или сравнения. Однако оказывается, что лечение глаз аптамером, действительно оказалось, по меньшей мере, безопасным для зрения через 3 месяца и оправдывает дальнейшие исследования. Резюмируя изложенное выше, преклинические и ранние клинические результаты применения однократных инъекций в стекловидное тело аптамера против VEGF являются очень вдохновляющими. Была установлена безопасность однократных инъекций в стекловидное тело в дозировках до 3 мг/глаз. Пример 7. Исследование фазы 1 В клинического испытания. Авторы изобретения провели многоцентровое, открытое исследование фазы 1 В с повторным введением дозы 3 мг/глаз EYE001 (аптамера против VEGF) у пациентов с CNV под центральной ямкой сетчатки, вызванной AMD, с остротой зрения хуже, чем 20/100 в исследуемом глазу, и лучшей или равной 20/400 в другом глазу. Если 3 или более пациентов испытывали ограничивающую дозу токсичность(DLT), дозу уменьшали до 2 мг, а, затем, при необходимости, до 1 мг. Предполагаемое количество подлежавших лечению пациентов составляло 20; 10 пациентов одним аптамером против VEGF и 10 пациентов как терапией против VEGF, так и PDT. 11 районов в США выбрали для исследований. Определение DLT Если пациент в исследовании испытывал любую из следующих DLT, дозировку уменьшали, как описано выше. Глазная DLT Фотографическая оценка Ускоренное формирование катаракты: прогрессирование на одну единицу, определенное Протоколом распределения по степени помутнения хрусталика Исследования возрастных глазных заболеваний(AREDS), адаптированным по Висконсинской системе определения степени катаракты. Клиническое обследование Клинически значимое воспаление, которое было тяжелым (заслоняющим визуализацию сосудистой сети сетчатки) и угрожающим зрению. Другие глазные аномалии, обычно не наблюдаемые у пациентов с AMD, такие как окклюзия артерий или вен сетчатки, острое отслоение сетчатки и диффузное кровоизлияние в сетчатку. Острота зрения: удвоение или ухудшение угла зрения (потеря 15 букв); переход к восприятию отсутствия света (NLP) для пациентов, чья начальная балльная оценка остроты зрения составляет менее чем 15 букв, до тех пор пока потеря зрения не вызвана кровоизлиянием в стекловидное тело, связанным с процедурой инъекции со 2-го по 7-ой день, с 30-го по 35-ый день или с 58-го по 63-ий день. Тонометрия: увеличение от исходного уровня внутриглазного давления (IOР) на 25 мм рт.ст. при двух отдельных обследованиях, по меньшей мере, с интервалом 1 день или стойкое давление 30 мм рт.ст. в течение более чем 1 недели, несмотря на фармакологическое вмешательство. Флюоресцеиновая ангиограмма Значительные сосудистые аномалии сетчатки или сосудистой оболочки, не наблюдавшиеся в исходном состоянии, такие как отсутствие перфузии сосудистой оболочки (поражающее один или более квадрантов), задержка времени артерио-венозного прохождения (более чем 15 с); окклюзия артерий или вен сетчатки (любое отклонение от исходной картины); или диффузное изменение проницаемости сетчатки, поражающее кровообращение сетчатки в отсутствие внутриглазного воспаления. Системная DLT Токсичность III (тяжелой) или IV (угрожающей жизни) степени или любая значимая тяжелая токсичность, которая, как считает исследователь, связана с изучаемым препаратом. Критерии отбора Пациентов для исследования отбирали с использованием следующих критериев включения и исключения.- 12006746 Критерии включения Офтальмологические критерии включали наилучшую корригированную остроту зрения в исследуемом глазу хуже, чем 20/100, по таблице ETDRS, наилучшую корригированную остроту зрения в другом глазу, равную или лучшую, чем 20/400, неоваскуляризацию сосудистой оболочки под центральной ямкой с активной CNV (или классической и/или скрытой) размером менее чем 12 общих площадей диска, вызванную возрастной дегенерацией желтого пятна, прозрачные глазные среды и адекватное расширение зрачка для обеспечения возможности получения хорошего качества стереоскопической фотографии глазного дна и внутриглазное давление 21 мм рт.ст. или менее. Общие критерии включали пациентов любого пола в возрасте 50 лет; функциональный статус 2 в соответствии со шкалой Восточной кооперативной онкологической группы (ECOG)/Всемирной Организации Здравоохранения (ВОЗ), нормальную электрокардиограмму (ЭКГ) или клинически незначительные изменения; женщины должны использовать эффективное контрацептивное средство, находиться в периоде постменопаузы в течение,по меньшей мере, 12 месяцев перед вхождением в исследование или быть подвергнутыми хирургической стерилизации; в противном случае необходимо в пределах 48 ч перед лечением выполнить исследование сыворотки на беременность, и его результат должен иметься перед началом лечения; эффективную форму контрацептивного средства необходимо применять в течение, по меньшей мере, 28 дней после последней дозы EYE001; адекватную гематологическую функцию: гемоглобин 10 г/дкл; количество тромбоцитов 150x109/л; количество лейкоцитов 4 х 109/л; частичное тромбопластиновое время (РТТ) в пределах нормального диапазона учреждения; адекватную почечную функцию; сывороточный креатинин и азот мочевины крови (BUN) в пределах двойного верхнего предела нормального уровня (ULN), принятого в учреждении; адекватную функцию печени; сывороточный билирубин 1,5 мг/дкл; соотношение между глутамат-оксалоацетат аминотрансферазой и аланинтрансминазой сыворотки (SGOT/ALT), соотношение между глутамат-пируват аминотрансферазой и аспартат-аминтрансферазой сыворотки(SGPT/AST) и щелочной фосфатазы в пределах двойного ULN, принятого в учреждении; письменное информированное согласие; и способность возвратиться на все посещения во время исследования. Критерии исключения. Пациенты не подлежали включению в исследование, если присутствовали любые из следующих критериев в исследуемом глазу или системно: пациенты, которым планировали назначить или которые получали любую предшествующую фотодинамическую терапию визудином; значительные помутнения сред, включая катаракту, которые могут мешать остроте зрения, оценке токсичности или фотографии глазного дна; присутствие других причин неоваскуляризации сосудистой оболочки, включая патологическую миопию (сферически эквивалент -8 диоптрий или более отрицательная величина), синдром глазного гистоплазмоза, ангиоидные полосы сетчатки, разрыв сосудистой оболочки и многоочаговый хороидит; пациенты, которым могло быть показано или рассматриваться дополнительное лазерное лечение по поводу неоваскуляризации сосудистой оболочки; любая внутриглазная операция в пределах 3 месяцев включения в исследование; предшествующая витрэктомия; предшествующая или сопутствующая терапия другим исследуемым средством для лечения AMD, кроме поливитаминов и минеральных микроэлементов; предшествующее облучение другого глаза фотонами или протонами; известные аллергии на флюоресцеиновый краситель, используемый при ангиографии, или к компонентам композиции EYE001; любое из следующих лежащих в основе системных заболеваний, включая неконтролируемый сахарный диабет или присутствие диабетической ретинопатии; сердечные заболевания; инфаркт миокарда в пределах 12 месяцев перед включением в исследование, и/или поражение коронарных артерий, связанное с клиническими симптомами, и/или указания на ишемию, отмеченные на ЭКГ; нарушенная почечная или печеночная функция, инсульт (в пределах 12 месяцев после включения в исследование); активная инфекция, активные расстройства с кровотечением; любая крупная хирургическая процедура в пределах 1 месяца после включения в исследование; активная пептическая язвенная болезнь с кровотечением в пределах 6 месяцев после включения в исследование; сопутствующая системная терапия кортикостероидами(например, перорально преднизоном) или другими антиангиогенными лекарственными препаратами (например, талидомид); предшествующее облучение головы и шеи; любое лечение исследуемым средством за последние 60 дней по поводу любого состояния; любой диагноз рака за последние 5 лет, за исключением базальноклеточной или плоскоклеточной карциномы. Лекарственное средство для исследованияEYE001 использовали в качестве терапии против VEGF в данном исследовании. Лекарственное вещество EYE001 представляет собой пегилированный аптамер против VEGF. Его композицию составляли в солевом растворе с фосфатным буфером при рН 5-7. Для доведения рН можно добавить гидрохлорид натрия или хлористо-водородную кислоту.EYE001 составляли в композицию в трех различных концентрациях: 3 мг/100 мкл, 2 мг/100 мкл и 1 мг/100 мкл, упакованную в стерильный градуированный стеклянный шприц емкостью 1 мл I типа в соответствии с Фармакопеей США (USP), снабженный стерильной иглой 27 калибра. Лекарственный продукт не содержал консервантов и был предназначен для однократного применения только инъекцией в стекловидное тело. Продукт не использовали, если он был мутным или в нем присутствовали частицы.- 13006746 Активный ингредиент представлял собой лекарственное вещество EYE001, (пегилированный) аптамер против VEGF в концентрациях 30, 20 и 10 мг/мл. Эксципиентами были хлорид натрия по USP; одноосновный фосфат моногидрат натрия по USP; двухосновный фосфат гептагидрат натрия по USP; гидроксид натрия по USP; хлористо-водородная кислота по USP и вода для инъекций по USP. Доза и введение Препарат. Лекарственный продукт представлял собой готовый к использованию стерильный раствор, предоставленный в стеклянном шприце одноразового использования. Шприц удаляли после хранения в холодильнике,по меньшей мере, в течение 30 мин (но не больше, чем 4 ч) перед использованием для обеспечения возможности раствору достичь комнатной температуры. Введение содержимого шприца включало прикрепление резьбового пластикового стержня поршня к резиновой пробке внутри цилиндрического корпуса шприца. Затем резиновый торцевой колпачок удаляли для обеспечения возможности введения продукта. Схема и длительность лечения. EYE001 вводили в виде инъекций в стекловидное тело 100 мкл в трех случаях через интервалы в 28 дней. Пациентов включали в исследование для получения 3 мг/инъекцию. Если 3 или более пациентов испытывали ограничивающую дозу токсичность (DLT), дозу уменьшали до 2 мг и далее, если необходимо, до 1 мг, каждую еще у 10 пациентов. Назначение PDT.PDT назначали с EYE001 только в случаях с преимущественной классической CNV. Стандартные требования и процедуры для назначения PDT использовали, как описано в публикации в Arch. Ophthalmol. 1999, 117:1329-1345. PDT требовалось назначать за 5-10 дней перед введением аптамера против VEGF. Включение пациентов в исследование. Перед набором пациентов в исследование получали письменное одобрение протокола Учрежденческим Аналитическим Советом (IRB) и заполненный бланк информированного согласия. Страницы скрининга бланка истории болезни заполнял персонал района исследования. В исследование включали пациентов, которые отвечали критериям пригодности для включения и предоставили письменное информированное согласие. График наблюдения. Офтальмолог проводил клиническое обследование пациентов через несколько дней после инъекции и снова через 1 месяц перед следующей инъекцией. Определения остроты зрения по таблицам ETDRS, кодахромовую фотографию и флюоресцеиновую ангиографию проводили ежемесячно в течение первых 4 месяцев. Исходы. Параметры безопасности, приведенные под разделом DLT выше, представляли собой первичный итог исследований. Кроме того, процентная доля пациентов со стабилизированным (изменение на 0 строк или лучше) или улучшенным зрением через 3 месяца, процентная доля пациентов с улучшением на 3 строки или более через 3 месяца и необходимость повторного лечения PDT, по данным определения исследователем, представляли собой другие исследуемые итоги. Результаты. У 21 пациента, получавшего лечения в данном исследовании, не были отмечены тяжелые побочные эффекты, связанные с ним. 2 пациента испытали тяжелые побочные явления, не связанные с лечением. Одна пациентка, 86-летняя женщина с длительно существующим анамнезом заболевания периферических сосудов, а также пограничной гипертонией и сахарным диабетом II типа, перенесла 2 инфаркта миокарда, второй из которых был смертельным. Первый случай произошел через 11 дней после первой внутриглазной инъекции аптамера против VEGF. Второй случай произошел через 16 дней после третьей и последней инъекции. Острые инфаркты миокарда произошли приблизительно с интервалом 2 месяца. Предполагается, что указанные случаи были не связаны с терапией аптамером, а, на основании фармакокинетических данных, системными уровнями препарата можно пренебречь. Второй пациент, 76-летний мужчина с 10-месячным анамнезом депрессии, совершил попытку суицида приемом внутрь ацетаминофена через 11 дней после третьей и последней дозы аптамера против VEGF. Психическое состояние пациента улучшилось. Лечение пациента осталось неизменным, и в настоящее время пациент находится под наблюдением в исследовании. В табл. 1 А-С показаны не связанные с лечением или нетяжелые случаи, отмеченные в данных группах. У пациентов, получавших лечение одним аптамером против VEGF, глазные побочные явления были,вероятно, связаны с введением аптамера против VEGF и включали плавающие частицы в стекловидном теле (4 случая), легкое воспаление передней камеры (3 случая), раздражение глаз (2 случая), увеличенное внутриглазное давление (1 случай), воздух внутри глаз (1 случай), помутнение стекловидного тела (1 случай), кровоизлияние под конъюнктиву (1 случай), боль в глазу (1 случай), отек/эритема век (1 случай), сухость глаза (1 случай) и инъекция конъюнктивы (1 случай). Случаи, возможно, связанные с введением аптамера против VEGF, включали звездообразный гиалоз (1 случай), аномальное зрение (1 случай) и усталость (1 случай). Случаи, названные не связанными с введением аптамера против VEGF,включали головную боль (1 случай) и слабость (1 случай). У пациентов, получавших лечение аптамером против VEGF и PDT, побочные явления, вероятно, связанные с комбинацией терапии, включали птоз (5 случаев), легкое воспаление передней камеры (4 случая), абразию роговицы (3 случая), боль в глазу (3- 14006746 случая), ощущение инородного тела (2 случая), хемоз (1 случай), кровоизлияние под конъюнктиву (1 случай) и пролапс стекловидного тела (1 случай). Явления, возможно, связанные с комбинированным лечением, включали усталость (2 случая). Явления, не связанные с комбинированной терапией, включали отслоение пигментного эпителия (1 случай), боль в суставах (1 случай), инфекцию верхних дыхательных путей (1 случай) и инфекцию мочевого пузыря (1 случай). Увеличение птоза и абразии роговицы,наблюдавшиеся в группе комбинированной терапии, могут быть связаны с использованием контактной линзы в сочетании с PDT. Следует отметить, что все случаи воспаления передней камеры или помутнения стекловидного тела были легкими и преходящими по природе. Таблица 1 А Побочные явления, связанные с введением аптамера против VEGF отдельно или в комбинации с PDT- 15006746 Таблица 1 В Побочные явления, связанные с введением одного аптамера против VEGF Таблица 1 С Побочные явления, связанные с введением аптамера против VEGF и PDT 2 пациента выбрали преждевременное прекращение участия в исследовании. Одна пациентка считала, что ее зрение не улучшалось, и она не хотела подвергаться дальнейшим инъекциям. У другого пациента была депрессия и проблемы с транспортировкой. Оба пациента отозвали свое согласие перед третьей и последней инъекцией аптамера. Острота зрения у обоих пациентов оставалась стабильной в течение их участия в исследовании. Третий пациент умер перед конечным посещением. В исследовании ни у одного из пациентов не потребовалось снижение дозы. Обзор цветных фотографий и флюоресцеиновых ангиограмм у данных пациентов не выявил признаков токсического действия на сосуды сетчатки или сосудистую оболочку. Из тех пациентов (N=8), которые завершили 3-месячную схему лечения одним аптамером противVEGF, 87,5% имели стабилизированное или улучшенное зрение, а у 25,0% через 3 месяца имелось улучшение зрения на 3 строки по таблице ETDRS (см. табл. 2).- 16006746 Таблица 2 Данные исследования зрения пациентов с CNV под центральной ямкой,получавших лечение одним аптамером против VEGF Изменение зрения через 3 месяца 11 пациентов лечили как аптамером против VEGF, так и PDT. В данной группе пациентов (N=10),которые завершили 3-х месячную схему лечения, 90% имели стабилизированное или улучшенное зрение,а у 60% через 3 месяца проявили улучшение зрения на 3 строки по таблице ETDRS (см. табл. ). Указанные улучшения на 3 строки включали прибавки зрения +3, +5, +4, +4, +6 и +3 строки по таблице ETDRS. Таблица 3 Данные исследования зрения пациентов с CNV под центральной ямкой,получавших лечение аптамером против VEGF в комбинации с PDT- 17006746 Изменение зрения через 3 месяца Из остающихся пациентов, которые не проявили улучшения на 3 строки, лишь у одного проявилась потеря зрения через 3 месяца лишь на одну строку в указанную точку времени. Ни один пациент в данной группе не потерял более одной строки зрения через 3 месяца. Повторное лечение PDT через 3 месяца (потребность в котором определялась исключительно исследователем) выполнили на 4 из 10 глаз (40%) пациентов, которые участвовали в течение полной продолжительности исследования. Другие варианты реализации Хотя настоящее изобретение было описано со ссылкой на предпочтительные варианты реализации,специалист в данной области легко установит его существенные характеристики и, не отходя от его сущности и диапазона притязаний, может внести различные изменения и модификации изобретения для приспособления его к различным видам и условиям применения. Специалисты в данной области распознают или смогут установить с использованием обычного экспериментирования многие эквиваленты конкретных вариантов реализации описанного здесь изобретения. Предполагается, что такие эквиваленты охватываются диапазоном настоящего изобретения. Все публикации, патенты и патентные заявки, упомянутые в данном описании, включены сюда в качестве ссылки. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ лечения глазного неоваскулярного заболевания у пациента, где данный способ включает этапы:(a) введения указанному пациенту эффективного количества аптамера против VEGF; и(b) обеспечения пациента фототерапией. 2. Способ по п.1, в котором указанная фототерапия включает фотодинамическую терапию (PDT). 3. Способ по п.1, в котором указанная фототерапия включает термическую лазерную фотокоагуляцию. 4. Способ по п.1, в котором указанное неоваскулярное заболевание выбирают из группы, состоящей из ишемической ретинопатии, внутриглазной неоваскуляризации, возрастной дегенерации желтого пятна, неоваскуляризации роговицы, неоваскуляризации сетчатки, неоваскуляризации сосудистой оболочки,диабетического отека желтого пятна, диабетической ишемии сетчатки, диабетического отека сетчатки и пролиферативной диабетической ретинопатии. 5. Способ по п.4, в котором указанное неоваскулярное заболевание представляет собой возрастную дегенерацию желтого пятна. 6. Способ по п.4, в котором указанное неоваскулярное заболевание представляет собой пролиферативную диабетическую ретинопатию. 7. Способ по п.1, в котором аптамер против VEGF включает нуклеиново-кислотный лиганд к фактору роста сосудистого эндотелия (VEGF). 8. Способ по п.7, в котором указанный нуклеиново-кислотный лиганд VEGF включает рибонуклеиновую кислоту. 9. Способ по п.7, в котором указанный нуклеиново-кислотный лиганд VEGF включает дезоксирибонуклеиновую кислоту. 10. Способ по п.7, в котором указанный нуклеиново-кислотный лиганд VEGF включает модифицированные нуклеотиды. 11. Способ по п.10, в котором указанный нуклеиново-кислотный лиганд VEGF включает 2'F-модифицированные нуклеотиды. 12. Способ по п.11, в котором указанный нуклеиново-кислотный лиганд VEGF включает полиалкиленгликоль.- 18006746 13. Способ по п.12, в котором указанный полиалкиленгликоль представляет собой полиэтиленгликоль (PEG). 14. Способ по п.7, в котором указанный нуклеиново-кислотный лиганд VEGF включает рибонуклеиновую кислоту и дезоксирибонуклеиновую кислоту. 15. Способ по п.10, в котором указанный нуклеиново-кислотный лиганд VEGF включает 2'-О-метил(2'-ОМе) модифицированные нуклеотиды. 16. Способ по п.10, в котором указанный нуклеиново-кислотный лиганд VEGF является модифицированной группой, которая уменьшает активность эндонуклеаз или экзонуклеаз на нуклеиновокислотном лиганде, относящемся к немодифицированному нуклеиново-кислотному лиганду, без неблагоприятного воздействия на аффинитет связывания указанного лиганда. 17. Способ по п.16, в котором указанная часть включает фосфоротиоат. 18. Способ по п.1, в котором указанный аптамер против VEGF вводят инъекцией. 19. Способ по п.1, в котором указанный этап введения включает введение устройства в глаз указанного пациента, причем указанное устройство включает указанный аптамер против VEGF. 20. Способ по п.19, в котором указанное устройство доставляет указанный аптамер против VEGF в глаз диффузией через склеру. 21. Способ по п.19, в котором указанное устройство доставляет указанный аптамер против VEGF непосредственно в стекловидное тело глаза. 22. Способ по п.2, в котором указанная фотодинамическая терапия (PDT) включает этапы:(ii) воздействия на фотосенсибилизатор света, имеющего длину волн, поглощаемую фотосенсибилизатором в течение времени и при интенсивности, достаточных для ингибирования неоваскуляризации в указанной ткани глаза. 23. Способ по п.22, в котором указанный фотосенсибилизатор выбирают из группы, состоящей из производных бензопорфирина (BPD), моноаспартилхлорина е 6, фталоцианина цинка, этиопурпурина олова, тетрагидрокситетрафенилпорфирина и порфимернатрия (PHOTOFRIN) и зеленых порфиринов. 24. Способ по п.22, в котором указанный фотосенсибилизатор представляет собой производное бензопорфирина.
МПК / Метки
МПК: C07H 21/00, C12Q 1/68, C12N 5/10, A61K 31/70
Метки: заболеваний, лечения, неоваскулярных, способы, глазных
Код ссылки
<a href="https://eas.patents.su/20-6746-sposoby-lecheniya-glaznyh-neovaskulyarnyh-zabolevanijj.html" rel="bookmark" title="База патентов Евразийского Союза">Способы лечения глазных неоваскулярных заболеваний</a>