Замещенные диоксопиперидинилфталимидные производные
Формула / Реферат
1. Соединение формулы Ia
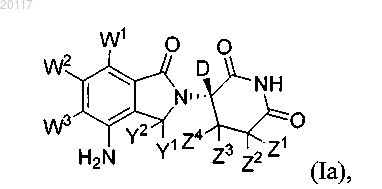
или его фармацевтически приемлемая соль, где
каждый W независимо выбран из водорода или дейтерия;
каждый Y независимо выбран из водорода или дейтерия и
каждый Z независимо выбран из водорода или дейтерия;
и каждый представитель по меньшей мере одной пары Z, присоединенной к общему атому углерода, является дейтерием.
2. Соединение по п.1, где W1, W2 и W3 одновременно являются водородом.
3. Соединение по п.1, где Z1, Z2, Z3 и Z4 одновременно являются дейтерием.
4. Соединение по п.1, где каждый Y одновременно является дейтерием.
5. Соединение по п.1, где соединение выбирается из группы, состоящей из
Соединения 102а
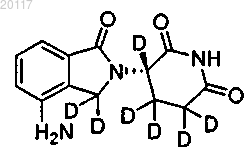
Соединения 104а
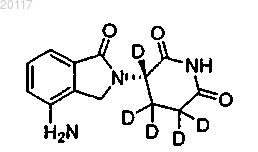
Соединения 105а
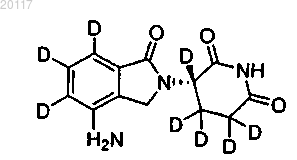
Соединения 106а

и их фармацевтически приемлемых солей.
6. Апирогенная фармацевтическая композиция, содержащая соединение по п.1 и фармацевтически приемлемый носитель.
7. Способ лечения заболевания или состояния, выбранного из миелодиспластических синдромов, множественной миеломы, неходжкинской лимфомы, папиллярной и фолликулярной карциномы щитовидной железы, рака предстательной железы, хронического лимфоцитарного лейкоза, амилоидоза, комплексного регионального болевого синдрома I типа, злокачественной меланомы, радикулопатии, миелофиброза, глиобластомы, глиосаркомы, злокачественных глиом, миелогенной лейкемии, рефрактерного плазмоклеточного новообразования, хронического миеломоноцитарного лейкоза, фолликулярной лимфомы, меланомы цилиарного тела и хронической меланомы, меланомы радужной оболочки, рецидивирующей интерокулярной меланомы, меланомы внеглазного распространения, солидных опухолей, Т-клеточной лимфомы, эритроидной лимфомы, монобластного и моноцитарного лейкоза, миелоидного лейкоза, опухоли головного мозга, менингиомы, опухолей спинного мозга, рака щитовидной железы, лимфомы из клеток зоны мантии, немелкоклеточного рака легкого, рака яичников, почечно-клеточного рака, миелофиброза, лимфомы Беркитта, лимфомы Ходжкина, крупноклеточной лимфомы и макроглобулинемии Вальденстрема, у пациента, нуждающегося в этом, предусматривающий стадию введения пациенту композиции по п.6.
8. Способ по п.7, где заболевание выбирается из миелодиспластических синдромов или множественной миеломы.
Текст
Данное изобретение относится к новым замещенным диоксопиперидинилфталимидным производным и их фармацевтически приемлемым кислотно-аддитивным солям. Изобретение также обеспечивает композиции, содержащие соединение согласно настоящему изобретению, и применение таких композиций для лечения заболеваний и состояний, благоприятно подвергаемых лечению иммуномодуляторным агентом. Родственная заявка Настоящая заявка заявляет преимущество и приоритет предварительной заявки США 61/114,989,поданной 14 ноября 2008, которая включена сюда путем ссылки во всей своей полноте. Предшествующий уровень техники Многие современные лекарственные средства страдают от плохих свойств абсорбции, распределения, метаболизма и/или выделения (ADME), которые препятствуют их более широкому применению. Плохие свойства ADME являются также главной причиной отрицательного результата для лекарственных кандидатов в клинических испытаниях. Несмотря на то, что технологии приготовления лекарственных средств и стратегии пролекарств могут применяться в некоторых случаях для улучшения определенных свойств ADME, эти подходы часто терпят неудачу в отношении лежащих в основе проблемADME, которые существуют для многих лекарственных средств и лекарственных кандидатов. Одной из таких проблем является быстрый метаболизм, который является причиной того, что ряд лекарственных средств, которые в противном случае были бы высокоэффективны в лечении заболевания, выводятся из организма слишком быстро. Возможным решением проблемы быстрого выведения лекарственных средств является частое введение доз или высокие дозы, чтобы достичь достаточно высокой концентрации лекарственного средства в плазме. Это, однако, вызывает ряд потенциальных проблем, связанных с лечением, таких как плохое соблюдение больным режима дозирования, побочные эффекты, которые становятся более сильными для более высоких доз, и увеличенная стоимость лечения. В некоторых исключительных случаях ингибитор метаболизма может вводиться совместно с лекарственным средством, которое выводится слишком быстро. Так обстоит дело с классом ингибиторов протеаз лекарственных средств, которые используются для лечения ВИЧ-инфекции. Управление по контролю за качеством пищевых продуктов и лекарственных средств (FDA) рекомендует, чтобы эти лекарственные средства были совместно дозированы с ритонавиром, ингибитором фермента 3 А 4 цитохрома Р 450 (CYP3A4), фермента, который обычно отвечает за их метаболизм (см. Kempf D.J. et al., Antimicrobial agents and chemotherapy, 1997, 41(3): 654-60). Ритонавир, однако, приводит к побочным действиям и увеличивает лекарственную нагрузку для ВИЧ-пациентов, которые должны уже принимать комбинацию различных лекарственных средств. Аналогично, CYP2D6 ингибитор квинидин добавляют к декстрометорфану с целью снизить быстрый CYP2D6 метаболизм декстрометорфана при лечении псевдобульбарного аффекта. Квинидин, однако, имеет нежелательные побочные эффекты, которые сильно ограничивают свое применение в потенциальной комбинированной терапии (см. Wang L. et al., ClinicalPharmacology and Therapeutics, 1994, 56(6 Pt 1): 659-67; и инструкцию FDA по применению квинидина наwww.accessdata.fda.gov). В общем, комбинирование лекарственных средств с ингибиторами цитохрома Р 450 не является удовлетворительной стратегией для уменьшения выведения лекарственных средств. Ингибирование активности фермента CYP может влиять на метаболизм и выведение других лекарственных средств, метаболизируемых тем же ферментом. Ингибирование CYP может приводить к накоплению других лекарственных средств в организме до токсических уровней. Потенциально привлекательной стратегией для улучшения метаболических свойств лекарственного средства является модифицирование дейтерием. При этом подходе пытаются замедлить CYPопосредованный метаболизм лекарственного средства путем замещения одного или более атомов водорода атомами дейтерия. Дейтерий является безопасным, стабильным, нерадиоактивным изотопом водорода. По сравнению с водородом дейтерий образует более прочные связи с углеродом. В некоторых случаях увеличенная прочность связи, обеспечиваемая дейтерием, может положительно влиять на ADME свойства лекарственного средства, создавая потенциал для улучшенной эффективности, безопасности и/или переносимости лекарственного средства. Вместе с тем, так как размер и форма дейтерия по существу идентичны размеру и форме водорода, не предполагалось, что замещение водорода дейтерием влияло бы на биохимическую активность и избирательность лекарственного средства по сравнению с исходным химическим соединением, которое содержало только водород. За последние 35 лет о влиянии замещения дейтерием на скорость метаболизма сообщалось для очень небольшого процента разрешенных лекарственных средств (см., например, Blake M.I. et al, J PharmPharmacol 1999, 79-88; Fisher M.B. et al., Curr Opin Drug Discov Devel, 2006, 9:101-09 ("Fisher". Результаты являлись варьируемыми и непредсказуемыми. Для некоторых соединений дейтерирование приводило к пониженному метаболическому выведению in vivo. Для других отсутствовало изменение в метаболизме. Еще одни демонстрировали увеличенное метаболическое выведение. Непостоянство в воздействии дейтерия также привело экспертов к подверганию сомнению или отказу от модифицирования дейтерием как жизнеспособной стратегии разработки лекарственных средств для ингибирования нежелательного метаболизма (см. Foster at р. 35 и Fisher at p. 101). Влияние модифицирования дейтерием на метаболические свойства лекарственных средств является непредсказуемыми, даже если атомы дейтерия включены в известные сайты метаболизма. Только фактически получая и тестируя дейтерированное лекарственное средство можно определить, насколько и будет ли скорость метаболизма отличаться от скорости своего недейтерированного аналога. См., например,-1 020117Fukuto et al. (J. Med. Chem. 1991, 34, 2871-76). Многие лекарственные средства имеют несколько сайтов,где возможен метаболизм. Сайт(ы), в котором(ых) требуется замещение дейтерием, и степень дейтерирования, необходимая, чтобы видеть влияние на метаболизм, если это имеет место, могут отличаться для каждого лекарственного средства. Данное изобретение относится к новым замещенным диоксопиперидинилфталимидным производным и их фармацевтически приемлемым солям. Изобретение также обеспечивает композиции, содержащие соединение по этому изобретению, и применение таких композиций в способах лечения заболеваний и состояний, благоприятно подвергаемых лечению иммуномодуляторным агентом. Леналидомид, химически известный как или 3-(4-амино-1,3-дигидро-1-оксо-2 Н-изоиндо-2-ил)-2,6 пиперидиндион или 3-(4-амино-1-оксо-1,3-дигидро-2 Н-изоиндол-2-ил)пиперидин-2,6-дион, и его фармацевтически приемлемые соли раскрыты как иммуномодуляторные агенты. Леналидомид, как показано,ингибирует секрецию провоспалительных цитокинов, таких как фактор некроза опухоли альфа (TNF-),и увеличивает секрецию противовоспалительных цитокинов у животных и человека. Снижение уровнейTNF- является важной терапевтической стратегией для лечения многих воспалительных, инфекционных,иммунологических и злокачественных заболеваний (РСТ-публикация WO 98/03502). Как было продемонстрировано, леналидомид пригоден для лечения анемии, вызванной миелодиспластическими синдромами, ассоциированными с цитогенетической аномалией - делецией 5q, а также для лечения множественной миеломы при использовании в комбинации с дексаметазоном. (http://www.fda.gov/cder/foi/label/2006/021880s001.pdf). Леналидомид также участвует в клинических испытаниях, один или в комбинации с другими терапевтическими агентами, лечения неходжкинской лимфомы, папиллярной и фолликулярной карциномы щитовидной железы, рака предстательной железы, хронического лимфоцитарного лейкоза, амилоидоза,комплексного регионального болевого синдрома I типа, злокачественной меланомы, радикулопатии, миелофиброза, глиобластомы, глиосаркомы, злокачественных глиом, миелогенной лейкемии, рефрактерного плазмоклеточного новообразования, хронического миеломоноцитарного лейкоза, фолликулярной лимфомы, меланомы цилиарного тела и хронической меланомы, меланомы радужной оболочки, рецидивирующей интерокулярной меланомы, меланомы внеглазного распространения, солидных опухолей, Тклеточной лимфомы, эритроидной лимфомы (erythroid lymphoma), монобластного и моноцитарного лейкоза, миелоидного лейкоза, опухоли головного мозга, менингиомы, опухолей спинного мозга, рака щитовидной железы, лимфомы из клеток зоны мантии, немелкоклеточного рака легкого, рака яичников,рака предстательной железы, почечно-клеточного рака, миелофиброза, лимфомы Беркитта, лимфомы Ходжкина, крупноклеточной лимфомы и макроглобулинемии Вальденстрема. Леналидомид связан со значительными потенциальными токсическими явлениями, которые включают врожденные дефекты человека, нейтропению, тромбоцитопению, тромбоз глубоких вен и эмболию легких. См. (http://www.fda.gov/cder/foi/label/2006/021880s001.pdf). Большинство пациентов, принимающих леналидомид, нуждалось в отсрочке или снижении дозы во время клинических испытаний вследствие гематологических токсических явлений. Не проводилось никаких клинических исследований для оценки взаимосвязи между воздействием и безопасностью. Несмотря на целебное действие леналидомида, существует сохраняющаяся потребность в новых соединениях для лечения вышеуказанных заболеваний и состояний. Определения Термины "облегчать" и "лечить" используются взаимозаменяемо и включают как терапевтическое,так и профилактическое лечение. Оба термина обозначают снижение, подавление, ослабление, уменьшение, остановку или стабилизирование развития или прогрессирования заболевания (например, заболевания или нарушения, определенного здесь), уменьшение тяжести заболевания или улучшение симптомов,связанных с заболеванием."Заболевание" означает любое состояние или нарушение, которое нарушает или мешает нормальному функционированию клетки, ткани или органа. Следует понимать, что некоторое варьирование природного изотопного состава встречается в синтезированном соединении в зависимости от происхождения химических веществ, используемых в синтезе. Таким образом, препарат леналидомида может по своей природе содержать небольшие количества дейтерированных изотопологов. Концентрация часто встречающихся в природе стабильных изотопов водорода, несмотря на это варьирование, является небольшой и несущественной по отношению к степени стабильного изотопного замещения соединений по настоящему изобретению. См., например, Wada, Eand Hanba, Y, Seikagaku, 1994, 66: 15; Gannes, LZ et al, Comp Biochem Physiol A Mol Integr Physiol, 1998,119: 725. Подразумевается, что в соединениях по настоящему изобретению любой атом, не обозначенный специально как конкретный изотоп, представляет собой любой стабильный изотоп этого атома. Если не указано иное, когда положение обозначается конкретно как "Н" или "водород", предполагается, что это положение имеет водород в своем распространенном в природе изотопном составе. Также если не указано иное, если положение обозначается конкретно как "D" или "дейтерий", предполагается, что это положение имеет содержание дейтерия, которое по меньшей мере в 3340 раз больше, чем природная распро-2 020117 страненность дейтерия, которая составляет 0.015% (т.е. по меньшей мере 50.1% включения дейтерия). При использовании здесь термин "фактор изотопного обогащения" означает соотношение между изотопным составом и природной распространенностью конкретного изотопа. В других вариантах осуществления изобретения соединение согласно настоящему изобретению имеет фактор изотопного обогащения для каждого обозначенного атома дейтерия по меньшей мере 3500(52.5% включения дейтерия для каждого обозначенного атома дейтерия), по меньшей мере 4000 (60% включения дейтерия), по меньшей мере 4500 (67.5% включения дейтерия), по меньшей мере 5000 (75% дейтерия), по меньшей мере 5500 (82.5% включения дейтерия), по меньшей мере 6000 (90% включения дейтерия), по меньшей мере 6333.3 (95% включения дейтерия), по меньшей мере 6466.7 (97% включения дейтерия), по меньшей мере 6600 (99% включения дейтерия) или по меньшей мере 6633.3 (99.5% включения дейтерия). Термин "изотополог" относится к соединению, которое отличается от определенного соединения согласно изобретению только по изотопному составу. Термин "соединение", когда относится к соединению согласно данному изобретению, касается совокупности молекул, имеющих одинаковую химическую структуру, за исключением того, что может иметься изотопная вариация среди атомов, составляющих молекулу. Таким образом, специалистам в данной области техники будет ясно, что соединение, представленное конкретной химической структурой, содержащей указанные атомы дейтерия, будет также содержать небольшие количества изотопологов, имеющих атомы водорода в одном или более обозначенных положений дейтерия в этой структуре. Относительное содержание таких изотопологов в соединении согласно настоящему изобретению будет зависеть от ряда факторов, включая изотопную чистоту дейтерированных реагентов, использованных для получения соединения и эффективности включения дейтерия на различных стадиях синтеза, использованных для получения соединения. Однако, как указано выше, относительное содержание таких изотопологов в целом будет составлять менее чем 49.9% соединения. В других вариантах осуществления изобретения относительное количество таких изотопологов в целом будет составлять менее чем 47.5%,менее чем 40%, менее чем 32.5%, менее чем 25%, менее чем 17.5%, менее чем 10%, менее чем 5%, менее чем 3%, менее чем 1% или менее чем 0.5% соединения. Изобретение также обеспечивает соли соединений согласно изобретению. Соль соединения согласно настоящему изобретению образуется между кислотной и основной группой соединения, как например, функциональной аминогруппой, или основанием, и кислотной группой соединения, как например, функциональная карбоксильная группа. Согласно другому предпочтительному варианту осуществления соединение является фармацевтически приемлемой кислотно-аддитивной солью. При использовании здесь термин "фармацевтически приемлемый" относится к компоненту, который, в рамках тщательной медицинской проверки, является пригодным для применения в контакте с тканями человека и других млекопитающих без чрезмерной токсичности, раздражения, аллергической реакции и т.п., и соответствует допустимому соотношению польза/риск. "Фармацевтически приемлемая соль" означает любую нетоксичную соль, которая при введении реципиенту, способна обеспечивать прямо или опосредованно соединение согласно настоящему изобретению. "Фармацевтически приемлемый противоион" означает ионную часть соли, которая является нетоксичной при высвобождении из соли при введении реципиенту. Кислоты, используемые обычно для образования фармацевтически приемлемых солей, включают неорганические кислоты, такие как сероводородная, соляная, бромисто-водородная, йодисто-водородная,серная и фосфорная кислоты, а также органические кислоты, такие как пара-толуолсульфоновая кислота,салициловая, винная, дивинная (bitartaric), аскорбиновая, малеиновая, бензолсульфоновая, фумаровая кислота, глюконовая, глюкуроновая, муравьиная, глутаминовая, метансульфоновая, этанульфоновая,бензолсульфоновая, молочная, щавелевая, парабромфенилсульфоновая, угольная, янтарная, лимонная,бензойная и уксусная кислоты, и родственные неорганические и органические кислоты. Такие фармацевтически приемлемые соли таким образом включают сульфат, пиросульфат, бисульфат, сульфит, бисульфит, фосфат, моногидрогенфосфат, дигидрогенфосфат, метафосфат, пирофосфат, хлорид, бромид, йодид,ацетат, пропионат, деканоат, каприлат, акрилат, формиат, изобутират, капрат, гептаноат, пропиолат, оксалат, малонат, сукцинат, суберат, себацинат, фумарат, малеат, бутин-1,4-диоат, гексин-1,6-диоат, бензоат, хлор-бензоат, метилбензоат, динитробензоат, гидроксибензоат, метоксибензоат, фталат, терефталат,сульфонат, ксиленсульфонат, фенилацетат, фенилпропионат, фенилбутират, цитрат, лактат, гидроксибутират, гликолят, малеат, тартрат, метансульфонат, пропансульфонат, нафталин-1-сульфонат,нафталин-2-сульфонат, манделат и подобные соли. Предпочтительные фармацевтически приемлемые кислотно-аддитивные соли включают соли, образованные с минеральными кислотами, такими как соляная и бромисто-водородная кислоты, и особенно соли, образованные с органическими кислотами, такими как малеиновая кислота. Соединения согласно настоящему изобретению содержат один или более асимметрических атомов углерода. По существу, соединение согласно настоящему изобретению может существовать как отдельные энантиомеры, а также как смесь энантиомеов. Следовательно, соединение согласно настоящему изо-3 020117 бретению может включать не только рацемическую смесь, но также отдельные соответствующие энантиомеры, по существу, не содержащие другие энантиомеры. Термин "по существу не содержащий другие энантиомеры" при использовании здесь означает, что присутствуют менее чем 25% других энантиомеров, предпочтительно менее чем 10% других энантиомеров, более предпочтительно менее чем 5% других энантиомеров и наиболее предпочтительно менее чем 2% других энантиомеров. Способы получения или синтеза энантиомеров хорошо известны в данной области техники и могут применяться, насколько это практически возможно, к конечным соединениям, или к исходным соединениям, или к промежуточным соединениям. Если не указано иное, когда раскрытое соединение названо или изображено структурой без определения стереохимии и имеет один или более хиральных центров, предполагается, что оно представляет все возможные стереоизомеры соединения. Термин "стабильные соединения", при использовании здесь, относится к соединениям, которые обладают стабильностью, достаточной, чтобы сделать возможным производство, и которые сохраняют целостность соединения в течение достаточного периода времени, применимого для целей, раскрытых здесь (например, приготовление терапевтических продуктов, промежуточные соединения для применения в производстве терапевтических соединений, способные к выделению или сохранению промежуточные соединения, лечение заболевания или состояния, чувствительных к терапевтическим агентам)."Трет","t", и "t-" каждый обозначают "третичный". "США" обозначает Соединенные Штаты Америки. Везде в настоящем описании термины "каждый Y," "каждый Z" и "каждый W" означают все группы"Y" (например, Y1 и Y2), все группы "Z" (например, Z1, Z2, Z3, Z4 и Z5) и все группы "W" (например, W1,W2, W3 и W4), соответственно. Терапевтические соединения Согласно одному из вариантов осуществления изобретения настоящее изобретение обеспечивает соединение формулы I или его соль, где каждый W независимо выбран из водорода и дейтерия; каждый Y независимо выбран из водорода и дейтерия; каждый Z независимо выбран из водорода и дейтерия и по меньшей мере один W, один Y или один Z означает дейтерий. В одном из вариантов осуществления изобретения Z5 означает дейтерий. В другом варианте осуществления изобретения W1, W2 и W3 являются одинаковыми. В одном аспекте этого варианта осуществления изобретения W1, W2 и W3 одновременно представляют собой дейтерий. В другом аспекте этого варианта осуществления изобретения W1, W2 и W3 одновременно представляют собой водород. В другом варианте осуществления изобретения каждый Z, присоединенный к общему атому углерода (например, Z1 и Z2; или Z и Z4), является одинаковым. В одном аспекте этого варианта осуществления изобретения каждый представитель по меньшей мере одной пары Z , присоединенной к общему атому углерода, является дейтерием. В другом аспекте этого варианта осуществления изобретения Z1, Z2, Z3 и Z4 одновременно представляют собой дейтерий. В другом аспекте этого варианта осуществления изобретения Z1, Z2, Z3, Z4 и Z5 одновременно представляют собой дейтерий. Еще в одном аспекте Z1, Z2, Z3,Z4 и Z5 одновременно представляют собой дейтерий, и W1, W2 и W3 одновременно представляют собой водород. Еще в одном варианте осуществления изобретения каждый Y одновременно является дейтерием. В другом варианте осуществления изобретения соединение выбирается из любого соединения,представленного ниже Соединение 109 и их фармацевтически приемлемые соли. Леналидомид является рацемическим соединением, которое имеет один хиральный центр. Хиральный центр леналидомида и хиральные центры структурно родственных лекарственных средств классаIMiD (иммуномодулирующие средства), например, актимида (помалидомида) и таломида (талидомида),подвергаются эпимеризации в физиологических условиях. Например, известно, что в таких условиях одиночный энантиомер структурно схожего актимида (помалидомида) превращается в рацемическое соединение в течение 1-2 ч. См. Тео, SK et. al., Chirality, 2003, 15(4): 348-351. Было бы полезно обеспе-5 020117 чить соединение, сходное с (S)-энантиомером леналидомида, но которое эпимеризуется при более низкой скорости, так как (S)-энантиомер леналидомида представляет собой энантиомер, который обладает наибольшим иммуномодуляторным эффектом. В этой связи, предполагается, что соединения формулы I,где Z5 означает дейтерий, эпимеризуются при более низкой скорости, чем соединения, где Z5 является водородом. Более низкая скорость эпимеризации для определенного соединения может быть полезной,например, благодаря максимальному увеличению концентрации энантиомера, обладающего наибольшим иммуномодуляторным эффектом. Таким образом, в другом варианте осуществления изобретение обеспечивает соединение формулыI, которое представляет собой соединение формулы Ia или Ib где W, Y и Z являются такими, как определено выше. Скорость эпимеризации соединения формулы Ia или Ib при сравнении с соответствующим энантиомером леналидомида может быть легко измерена, используя методы, хорошо известные специалисту в данной области техники. Например, чистые образцы соединений формулы Ia и Ib, а также чистые образцы каждого энантиомера леналидомида могут выделяться и анализироваться, используя хиральную ВЭЖХ. Эти чистые образцы могут растворяться до соответствующей концентрации в соответствующем физиологическом буфере, или жидкости организма, или их имитанте и контролироваться в течение периода времени (например, приблизительно каждые 5 мин), используя хиральную ВЭЖХ, чтобы оценить скорость эпимеризации. В дополнительном варианте осуществления изобретения соединение выбирают из любого соединения, представленного ниже Соединение 106b и их фармацевтически приемлемые соли. В других вариантах осуществления изобретения любой атом, не обозначенный как дейтерия, в любом из вариантов осуществления изобретения, представленных выше, присутствует согласно своей природной изотопной распространенности. Синтез соединений, раскрытых здесь, может быть легко осуществлен химиками-синтетиками, являющимися специалистами в данной области, основываясь на иллюстративном синтезе и примерах, описанных здесь. Релевантные процедуры и промежуточные соединения раскрыты, например, в патенте США 5635517 и заявке на патент США 2006052609, в добавление к Muller, GW et al., Bioorg MedChem Lett, 1999, 9(11): 1625. Такие способы могут осуществляться с использованием соответствующих дейтерированных и при необходимости других изотопсодержащих реагентов и/или промежуточных соединений для синтеза соединений, изображенных здесь, или с применением стандартных протоколов синтеза, известных в данной области, для введения изотопных атомов в химическую структуру. Иллюстративный синтез Подходящий способ для синтеза соединений формулы I изображен на схемах 1 и 2. Схема 1. Синтез подходящим образом дейтерированного 3-аминопиперидин-2,6-диона (13) Как показано на схеме 1, подходящим образом дейтерированный d,l-глутамин 10 реагирует с Cbzхлоридом с получением карбамата 11, который затем циклизуют с 1,1'-карбонилдиимидазолом (CDI) с получением 12. Затем карбаматную защитную группу удаляют из соединения 12 путем гидрогенолиза,давая подходящим образом дейтерированный 3-аминопиперидин-2,6-дион 13. Этот амин затем используют, как показано на схеме 2, для получения соединения формулы I. Схема 2. Синтез соединения формулы I Формула I Как изображено на схеме 2, для получения соединения формулы I соответствующим образом дейтерированный 1-бром-2-метилбензол 14 литируется н-бутиллитием с последующей реакцией с метилхлорформиатом для получения сложного эфира 16. Альтернативно, сложный эфир 16 может быть получен обработкой соответствующим образом дейтерированной 2-метилбензойной кислоты сульфонилхлоридом в метаноле. Сложный эфир 16 нитруется азотной кислотой в дихлорэтане с индиевым катализатором, давая нитросоединение 17, которое затем превращают в бензилгалогенид 18 путем обработки Nбромсукцинимидом. Реакция бензилгалогенида 18 с соответствующим образом дейтерированным 3 аминопиперидин-2,6-дионом 13 в присутствии триэтиламина и при нагревании дает циклизованное нитросоединение 19, которое затем превращают в соединение формулы I путем гидрирования, используя катализатор Pd/C. При желании R- и S-энантиомеры соединения формулы I могут быть затем разделены хиральной ВЭЖХ тем же способом, который известен для родственных соединений IMiD класса лекарственных средств. Примеры такого типа энантиомерного разделения хиральной ВЭЖХ представлены вSembongi K. et al., BiologicalPharmaceutical Bulletin, 2008, 31(3): 497-500; Murphy-Poulton S.F. et al.,Journal of Chromatography, B: Analytical Technologies in the Biomedical and Life Sciences, 2006, 831(1-2): 48-56; Eriksson T. et al., Journal of Pharmacy and Pharmacology, 2000, 52(7): 807-817; Eriksson T. et al., Chirality 1998, 10(3): 223-228; Reepmeyer J.C. et al., Chirality, 1996, 8(1): 11-17; Aboul-Enein, H. Y. et al., Journal of Liquid Chromatography, 1991, 14(4): 667-73 и Teo S.K. et al., Chirality, 2003, 15(4): 348-351. Подразумевается, что специфические подходы и соединения, представленные выше, не являются ограничивающими. Химические структуры в схемах здесь изображают переменные, которые таким образом определены соответственно определениям химических групп (фрагменты, атомы и т.д.) соответствующего положения в представленных здесь формулах соединений, определенных таким же названием переменной (т.е., R1, R2, R3 и т.д.) или нет. Пригодность химической группы в структуре соединения для применения в синтезе другого соединения находится в пределах объема знаний специалиста в данной области техники. Дополнительные способы синтеза соединений представленных здесь формул и их синтетических предшественников, включая те, которые находятся в пределах путей, не показанных подробно здесь на схемах, имеются в арсенале методов химиков-специалистов в данной области техники. Превращения синтетической химии и методики защитных групп (защита и снятие защиты), применимые для синтеза подходящих соединений, известны в данной области техники и включают, например, описанные в R.Fieser's Reagents for Organic Synthesis, John Wiley and Sons (1994); and L. Paquette, ed., Encyclopedia of Reagents for Organic Synthesis, John Wiley and Sons (1995) и их последующих изданиях. Комбинации заместителей и переменных, предполагаемые настоящим изобретением, представляют собой только те, которые приводят к получению стабильных соединений. Композиции Изобретение также обеспечивает апирогенные фармацевтические композиции, содержащие эффективное количество соединения формулы I (например, включая любую из представленных здесь формул) или его фармацевтически приемлемой соли и приемлемый носитель. Носитель(и) должен быть "приемлемым" в том смысле, что является совместимым с другими ингредиентами состава и, в случае фармацевтически приемлемого носителя, не является вредным для его реципиента в количествах, обычно используемых в медикаментах. Фармацевтически приемлемые носители, адъюванты и растворители, которые могут использоваться в фармацевтических композициях согласно настоящему изобретению, включают, но не ограниваются этим, ионообменники, оксид алюминия, стеарат алюминия, лецитин, сывороточные белки, такие как сывороточный альбумин человека, буферные вещества, такие как фосфаты, глицин, сорбиновую кислоту,сорбат калия, смесь частичных глицеридов насыщенных растительных жирных кислот, воду, соли или электролиты, такие как протамин сульфат, вторичный кислый фосфат натрия, вторичный кислый фосфат калия, хлорид натрия, соли цинка, коллоидный диоксид кремния, трисиликат магния, поливинилпирролидон, вещества на основе целлюлозы, полиэтиленгликоль, карбоксиметилцеллюлозу натрия, полиакрилаты, воска, блок-сополимер полиэтилена и полиоксипропилена, полиэтиленгликоль и ланолин. При необходимости растворимость и биодоступость соединений согласно настоящему изобретению в фармацевтических композициях может быть усилена способами, хорошо известными в данной области техники. Один способ включает применение липидных наполнителей в составе. См. "Oral Lipid-BasedFormulations: Enhancing the Bioavailability of Poorly Water-Soluble Drugs (Drugs and the Pharmaceutical Sciences)," David J. Hauss, ed. Informa Healthcare, 2007 и "Role of Lipid Excipients in Modifying Oral and Parenteral Drug Delivery: Basic Principles and Biological Examples," Kishor M. Wasan, ed. Wiley-Interscience,2006. Другой известный способ усиления биодоступности представляет собой применение аморфной формы соединения согласно настоящему изобретению, при необходимости включенного в состав вместе с полоксамером, таким как LUTROL и PLURONIC (BASF Corporation), или блок-сополимерами этиленоксида и пропиленоксида. См. патент США 7014866 и патентные публикации США 20060094744 и 20060079502. Фармацевтические композиции согласно настоящему изобретению включают композиции, подходящие для перорального, ректального, назального, местного (включая буккальное и сублингвальное),вагинального или парентерального (включая подкожное, внутримышечное, внутривенное и интрадермальное) введения. В определенных вариантах осуществления изобретения соединение согласно представленным здесь формулам вводится трансдермально (например, используя трансдермальный пластырь или ионтофоретические методы). Другие составы могут быть легко представлены в форме единичной дозы, например, таблеток и капсул с замедленным высвобождением, и в липосомах, и могут быть получены способами, хорошо известными в области фармации. См., например, Remington: The Science andPractice of Pharmacy, Lippincott WilliamsWilkins, Baltimore, MD (20th ed. 2000). Такие препаративные способы включают стадию введения в ассоциацию с молекулой вводимых ингредиентов, таких как носитель, которые составляют один или более вспомогательных ингредиентов. В общем, композиции получают, равномерно и тщательно вводя в ассоциацию активные ингредиенты с жидкими носителями, липосомами или тонкоизмельченными твердыми носителями, или и с теми, и другими, и затем, если необходимо, придавая форму продукту. В определенных предпочтительных вариантах осуществления изобретения соединение вводится перорально. Композиции согласно настоящему изобретению, пригодные для перорального введения,могут быть представлены в виде дискретных единиц, таких как капсулы, саше или таблетки, при этом каждая содержит заранее определенное количество активного ингредиента; в виде порошка или гранул, в виде раствора или суспензии в водной жидкости или неводной жидкости, или в виде жидкой эмульсии масло-в-воде, или жидкой эмульсии вода-в-масле, или упакованными в липосомы и в виде болюса и т.д. Мягкие желатиновые капсулы могут использоваться для содержания таких суспензий, которые могут благоприятно увеличивать скорость абсорбции соединения. В случае таблеток для перорального применения носители, которые обычно используются, включают лактозу и кукурузный крахмал. Смазывающие вещества, такие как стеарат магния, обычно также добавляются. Для перорального введения в форме капсулы используемые разбавители включают лактозу и сухой кукурузный крахмал. Если водные суспензии вводятся перорально, активный ингредиент комбинируется с эмульгирующими и суспендирующими агентами. При желании могут добавляться определенные подсластители, и/или корригенты вкуса и запаха, и/или окрашивающиеся вещества. Композиции, подходящие для перорального введения, включают таблетки для рассасывания, содержащие ингредиенты в основе, имеющей запах и вкус, обычно сахарозу и аравийскую камедь или трагакантовую камедь; и пастилки, содержащие активный ингредиент в инертной основе, такой как желатин и глицерин, или сахароза и аравийская камедь. Композиции, подходящие для парентерального введения, включают водные и неводные стерильные инъекционные растворы, которые могут содержать антиоксиданты, буферы, бактериостаты и растворен-9 020117 ные вещества, которые приводят к составу, изотоническому по отношению к крови предполагаемого реципиента; и водные и неводные стерильные суспензии, которые могут включать суспендирующие агенты и загустители. Составы могут быть представлены в виде контейнеров, содержащих однократную дозу или несколько доз, например, в виде герметично закрытых ампул и флаконов, и могут храниться в высушенном замораживанием (лиофилизированном) состоянии, требующем только добавления стерильного жидкого носителя, например, воды для инъекций, непосредственно перед применением. Экстемпоральные инъекционные растворы и суспензии могут быть получены из стерильных порошков, гранул и таблеток. Такие инъекционные растворы могут быть в форме, например, стерильной инъекционной водной или масляной суспензии. Эта суспензия может быть приготовлена в виде состава согласно методам, известным в данной области, с использованием подходящих диспергирующих или смачивающих агентов(таких как, например, Tween 80) и суспендирующих агентов. Стерильный инъекционный препарат может также являться стерильным инъекционным раствором или суспензией в нетоксичном приемлемом для парентарального введения разбавителе или растворителе, например в растворе 1,3-бутандиола. Среди приемлемых разбавителей и растворителей, которые могут использоваться, присутствуют манит, вода,раствор Рингера и изотонический раствор хлорида натрия. Кроме того, стерильные, нелетучие масла обычно используются в качестве растворителя или суспендирующей среды. Для этой цели любое смягчающее нелетучее масло может использоваться, включая синтетические моно- или диглицериды. Жирные кислоты, такие как олеиновая кислота и производные диглицериды, применяются для получения инъекционных лекарственных средств, как например, природные фармацевтически приемлемые масла,такие как оливковое или касторовое масло, особенно в их полиоксиэтилированных вариантах. Эти масляные растворы или суспензии могут также содержать длинноцепочечный спиртовой разбавитель или диспергирующее вещество. Фармацевтические композиции согласно настоящему изобретению могут вводиться в форме суппозиториев для ректального введения. Эти композиции могут быть получены смешением соединения согласно настоящему изобретению с подходящим нераздражающим наполнителем, который является твердым веществом при комнатной температуре, но жидким при ректальной температуре, и, следовательно,будет плавиться в прямой кишке, высвобождая активные компоненты. Такие материалы включают, но не ограничиваются этим, масло какао, пчелиный воск и полиэтиленгликоли. Фармацевтические композиции согласно настоящему изобретению могут вводиться при помощи назального аэрозоля или ингаляции. Такие композиции получают согласно методам, хорошо известным в области технологии приготовления лекарственных средств, и могут быть приготовлены в виде растворов в физиологическом растворе, используя бензиловый спирт или другие подходящие консерванты, усилители абсорбции для усиления биодоступности, фторуглероды и/или другие растворяющие или диспергирующие агенты, известные в данной области техники. Известно, что такое введение является эффективным для лекарственных средств, применяемых при эректильной дисфункции: Rabinowitz JD и ZaffaroniAC, Патент США 6803031, переданный Alexza Molecular Delivery Corporation. Местное введение фармацевтических композиций согласно настоящему изобретению особенно применимо, когда требуемое лечение включает области или органы, легко доступные местного применения. Для применения местно на коже фармацевтическая композиция должна быть приготовлена с подходящей мазью, содержащей активные компоненты, суспендированные или растворенные в носителе. Носители для местного применения соединений по настоящему изобретению включают, но не ограничиваются этим, минеральное масло, жидкий вазелин, белый вазелин, пропиленгликоль, полиоксиэтиленполиоксипропиленовое соединение, эмульгирующий воск и воду. Альтернативно, фармацевтическая композиция может быть приготовлена с подходящим лосьоном или кремом, содержащими активное соединение, суспендированное или растворенное в носителе. Подходящие носители включают, но не ограничиваются этим, минеральное масло, сорбитан моностеарат, полисорбат 60, цетиловый сложноэфирный воск, цетеариловый спирт, 2-октилдодеканол, бензиловый спирт и воду. Фармацевтические композиции согласно настоящему изобретению могут также местно применяться в нижнем отделе кишечника посредством ректального суппозитория или при помощи подходящей клизмы. Трансдермальные пластыри для местного применения и ионтофоретическое введение также включены в данное изобретение. Применение рассматриваемого терапевтического средства может быть локальным для того, чтобы вводить в интересующий участок. Различные приемы могут использоваться для предоставления рассматриваемых композиций в интересующий участок, такие как инъекция, применение катетеров, троакаров, пулек (projectiles), плюронилового геля, стентов, полимеров для замедленного высвобождения лекарственных средств или другого устройства, которое обеспечивает внутренний доступ. Таким образом, согласно еще одному варианту осуществления изобретения соединения согласно настоящему изобретению могут быть включены в композиции для покрытия имплантируемого медицинского устройства, такого как протезы, искусственные клапаны, сосудистые трансплантаты, стенты или катетеры. Подходящие покрытия и общее получение покрытых имплантируемых устройств известны в данной области техники и показаны в патентах США 6099562; 5886026 и 5304121. Покрытия обычно представляют собой биосовместимые полимерные материалы, такие как гидрогелевый полимер, полиме- 10020117 тилдисилоксан, поликапролактон, полиэтиленгликоль, полимолочная кислота, этиленвинилацетат и их смеси. Покрытия могут при необходимости дополнительно покрываться подходящим верхним покрытием из фторсиликона, полисахаридов, полиэтиленгликоля, фосфолипидов или их комбинаций для придания композиции свойств контролируемого высвобождения. Покрытия для инвазивных устройств представляют собой включенные для определения фармацевтически приемлемого носителя, адъюванта или разбавителя, поскольку те термины используются здесь. В одном предпочтительном варианте осуществления изобретения соединение формулы I вводят в состав вместе с гидрогелем для доставки в глаза как описано в патентной публикации США 2005074497. Согласно другому варианту осуществления изобретение предоставляет способ покрытия имплантируемого медицинского устройства, предусматривающий стадию контактирования указанного устройства с композицией покрытия, описанной выше. Специалисту в данной области будет очевидно, что покрытие устройства будет происходить перед имплантацией млекопитающему. Согласно другому варианту осуществления изобретение предоставляет способ импрегнирования имплантируемого устройства высвобождения лекарственного средства, предусматривающий стадию контактирования указанного устройства для высвобождения лекарства с соединением или композицией согласно настоящему изобретению. Имплантируемые устройства высвобождения лекарственных средств включают, но не ограничиваются этим, биоразлагаемые полимерные капсулы или буллиты (bullets), неразлагаемые, диффундирующие полимерные капсулы и биоразлагаемые полимерные облатки. Согласно другому варианту осуществления изобретение предоставляет имплантируемое медицинское устройство, покрытое соединением или композицией, содержащей соединение согласно настоящему изобретению, так что указанное соединение является терапевически активным. Согласно другому варианту осуществления изобретение обеспечивает имплантируемое устройство для высвобождения лекарства, импрегнированное или содержащее соединение или композицию, содержащую соединение согласно настоящему изобретению, так что указанное соединение высвобождается из указанного устройства и является терапевтически активным. Если орган или ткань доступны в результате удаления из пациента, такие орган или ткань могут быть погружены в среду, содержащую композицию по настоящему изобретению, при этом орган может быть окрашен композицией по настоящему изобретению, или композиция по настоящему изобретению может применяться любым другим подходящим способом. В другом варианте осуществления композиция согласно настоящему изобретению дополнительно содержит второй терапевтический агент. Второй терапевтический агент включает любое соединение или терапевтический агент, который, как известно, имеет или демонстрирует полезные свойства при введении с иммуномодуляторным, антиангиогенным или антинеопластическим агентом. Такие агенты описаны подробно в патенте США 5635517, а также в РСТ-публикациях WO 2005097125, WO 2005055929, WO 2004041190, WO 2006060507, WO 2006058008, WO 2006053160, WO 2005044178, WO 2004100953, WO 2006089150, WO 2006036892, WO 2006018182, WO 2005082415, WO 2005048942, WO 2005042558, WO 2005035714 и WO2005027842; и в патентных публикациях США US 2005100529, US 2006030594, US 2005143344 и US 2006079461, каждая из упомянутых ссылок описывает вторые терапевтические агенты,которые могут комбинироваться с леналидомидом. В одном из вариантов осуществления изобретения второй терапевтический агент представляет собой агент, используемый для лечения или предотвращения заболевания или состояния, выбранного из миелодиспластических синдромов, множественной миеломы, неходжкинской лимфомы, папиллярной и фолликулярной карциномы щитовидной железы, рака предстательной железы, хронического лимфоцитарного лейкоза, амилоидоза, комплексного регионального болевого синдрома I типа, злокачественной меланомы, радикулопатии, миелофиброза, глиобластомы, глиосаркомы, злокачественных глиом, миелогенной лейкемии, рефрактерного плазмоклеточного новообразования, хронического миеломоноцитарного лейкоза, фолликулярной лимфомы, меланомы цилиарного тела и хронической меланомы, меланомы радужной оболочки, рецидивирующей интерокулярной меланомы, меланомы внеглазного распространения, солидных опухолей, Т-клеточной лимфомы, эритроидной лимфомы, монобластного и моноцитарного лейкоза, миелоидного лейкоза, опухоли головного мозга, менингиомы, опухолей спинного мозга, рака щитовидной железы, лимфомы из клеток зоны мантии, немелкоклеточного рака легкого, рака яичников,рака предстательной железы, почечно-клеточного рака, миелофиброза, лимфомы Беркитта, лимфомы Ходжкина, крупноклеточной лимфомы и макроглобулинемии Вальденстрема. В другом варианте осуществления изобретения второй терапевтический агент представляет собой агент, используемый для лечения или предотвращения заболевания или состояния, выбранного из нарушенного сна, гемоглобинопатии, анемии, макулярной дегенерации, атеросклероза, рестеноза, боли, иммунодефицита, повреждения ЦНС и связанных симптомов, нарушений ЦНС, паразитарного заболевания или заболевания, вызываемого асбестом. Еще более предпочтительно вторым терапевтическим агентом, совместно входящим в состав с соединением по настоящему изобретению, является агент, используемый для лечения миелодиспластических синдромов или множественной миеломы. В другом предпочтительном варианте осуществления изобретения второй терапевтический агент выбирают из альдеслейкина; ингибитора р 38 МАР-киназы, например, раскрытого в US 2006079461; ингибитора 24-гидроксилазы, например, раскрытого в WO 2006036892; аминоптеридинона, например, раскрытого в WO 2006018182; ингибитора IGF-R, например, раскрытого в WO 2005082415; ингибитора СОХ-2, например, раскрытого в WO 2005048942; олигомера из нуклеиновых оснований, например, раскрытого в WO 2005042558; соединения хлорпромазина, например, раскрытого в WO 2005027842. В еще одном предпочтительном варианте осуществления изобретения второй терапевтический агент выбирается из пеметрекседа, топотекана, доксорубицина, бортезомиба, гемцитабина, дакарбазина,дексаметазона, биаксина, доксила, винкристина, декадрона, азацитидина, ритуксимаба, преднизона, доцетаксела, мелфалана или их комбинации. В другом варианте осуществления изобретение обеспечивает отдельные лекарственные формы соединения согласно настоящему изобретению и второго терапевтического агента, которые ассоциированы друг с другом. Термин "ассоциированы друг с другом" при использовании здесь означает, что отдельные лекарственные формы упакованы вместе или иным образом соединены друг с другом так, что является очевидным, что эти отдельные лекарственные формы предполагается продавать и вводить вместе (в диапазоне менее чем 24 ч друг за другом, последовательно или одновременно). В фармацевтических композициях согласно изобретению соединение согласно настоящему изобретению присутствует в эффективном количестве. При использовании здесь термин "эффективное количество" относится к количеству, которое при введении в соответствующем режиме дозирования является достаточным, чтобы снизить или облегчить тяжесть, длительность или прогрессирование нарушения,подвергаемого лечению, предотвратить развитие нарушения, подвергаемого лечению, вызвать регрессию нарушения, подвергаемого лечению, или усилить или улучшить профилактический или терапевтический эффект другой терапии. Взаимосвязь дозировки для животных и человека (в расчете на мг на кв. м поверхности тела) описана в Freireich et al., 1966, Cancer Chemother Rep, 50: 219. Площадь поверхности тела может быть приблизительно определена на основе роста и массы пациента. См., например, Scientific Tables, Geigy Pharmaceuticals, Ardsley, N.Y., 1970, 537. Эффективное количество соединения согласно настоящему изобретению может находиться в диапазоне от около 0,005 до около 200 мг/кг, более предпочтительно от около 0,01 до около 100 мг/кг, более предпочтительно от 0,05 до около 60 мг/кг. Эффективные дозы могут также изменяться, что понятно специалистам в данной области, в зависимости от заболевания, подвергаемого лечению, тяжести заболевания, пути введения, пола, возраста и общего состояния здоровья пациента, применения наполнителя, возможности совместного применения с другими терапевтическими воздействиями, такими как применение других агентов, и заключения лечащего врача. Например, правила для отбора эффективной дозы могут быть определены ссылкой на инструкцию по применению леналидомида. Для фармацевтических композиций, которые содержат второй терапевтический агент, эффективное количество второго терапевтического агента составляет между около 20 и 100% дозировки, обычно используемой в режиме монотерапии, использующей только тот агент. Предпочтительно, эффективное количество составляет между около 70 и 100% обычной дозы при монотерапии. Обычные дозировки при монотерапии для этих вторых терапевтических агентов хорошо известны в данной области. См., например, Wells et al., eds., Pharmacotherapy Handbook, 2nd Edition, Appleton and Lange, Stamford, Conn. (2000);PDR Pharmacopoeia, Tarascon Pocket Pharmacopoeia 2000, Deluxe Edition, Tarascon Publishing, Loma Linda,Calif. (2000), каждая из ссылок включена сюда во всей своей полноте путем ссылки. Ожидается, что некоторые из вторых терапевтических агентов, указанных выше, будут действовать синергетически с соединениями согласно настоящему изобретению. Если это будет происходить, это даст возможность уменьшить эффективную дозировку второго терапевтического агента и/или соединения согласно настоящему изобретению, по сравнению с той, которая требуется при монотерапии. Это имеет преимущество минимизации токсических побочных эффектов или второго терапевтического агента, или соединения согласно настоящему изобретению, синергетических улучшений эффективности,улучшенной простоты введения или применения и/или уменьшенных общих расходов на препарат или состав соединения. Способы лечения Согласно другому варианту осуществления изобретения изобретение обеспечивает способ лечения заболевания, которое благоприятно лечится леналидомидом у пациента, нуждающегося в этом, предусматривающий стадию введения пациенту эффективного количества соединения или композиции согласно настоящему изобретению. Такие заболевания хорошо известны в данной области и раскрыты в патенте США 5635517, а также в РСТ-публикациях WO 2005097125, WO 2005055929, WO 2004041190,WO 2006060507, WO 2006058008, WO 2006053160, WO 2005044178, WO 2004100953, WO 2006089150,WO 2006036892, WO 2006018182, WO 2005082415, WO 2005048942, WO 2005042558, WO 2005035714 иWO 2005027842; и в патентных публикациях США US 2005100529, US 2006030594, US 2005143344 и US 2006079461. В еще одном предпочтительном варианте осуществления изобретения заболевание или состояние выбирают из миелодиспластических синдромов, множественной миеломы, неходжкинской лимфомы,папиллярной и фолликулярной карциномы щитовидной железы, рака предстательной железы, хронического лимфоцитарного лейкоза, амилоидоза, комплексного регионального болевого синдрома I типа,злокачественной меланомы, радикулопатии, миелофиброза, глиобластомы, глиосаркомы, злокачественных глиом, миелогенной лейкемии, рефрактерного плазмоклеточного новообразования, хронического миеломоноцитарного лейкоза, фолликулярной лимфомы, меланомы цилиарного тела и хронической меланомы, меланомы радужной оболочки, рецидивирующей интерокулярной меланомы, меланомы внеглазного распространения, солидных опухолей, Т-клеточной лимфомы, эритроидной лимфомы, монобластного и моноцитарного лейкоза; миелоидного лейкоза, опухоли головного мозга, менингиомы,опухолей спинного мозга, рака щитовидной железы, лимфомы из клеток зоны мантии, немелкоклеточного рака легкого, рака яичников, рака предстательной железы, почечно-клеточного рака, миелофиброза,лимфомы Беркитта, лимфомы Ходжкина, крупноклеточной лимфомы и макроглобулинемии Вальденстрема. В другом варианте осуществления изобретения заболевание выбирают из миелодиспластических синдромов и множественной миеломы. Определение пациента, нуждающегося в таком лечении, может основываться на мнении пациента или специалиста в области медицины и может быть субъективным (например, мнение) или объективным(например, измеренным посредством теста или диагностического метода). В другом варианте осуществления изобретения вышеуказанный способ лечения предусматривает дополнительную стадию совместного введения пациенту одного или более вторых терапевтических агентов. Выбор второго терапевтического агента может быть сделан из любого второго терапевтического агента, который, как известно, является пригодным для совместного введения с леналидомидом. Выбор второго терапевтического агента также зависит от конкретного заболевания или состояния, которое подвергают лечению. Примеры вторых терапевтических агентов, которые могут быть использованы в способах согласно настоящему изобретению, представляют собой те, которые указаны выше для применения в комбинированных композициях, содержащих соединение согласно настоящему изобретению и второй терапевтический агент. В одном варианте осуществления изобретения второй терапевтический агент и соответствующее заболевание, для которого второй терапевтический агент совместно вводится с соединением согласно настоящему изобретению, представлены в табл. 1 ниже. Таблица 1. Вторые терапевтические агенты для различных заболеваний или состояний Термин "совместно вводимый" при использовании здесь означает, что второй терапевтический агент может вводиться вместе с соединением согласно настоящему изобретению как часть одной лекарственной формы (например, композиции согласно настоящему изобретению, содержащей соединение согласно изобретению и второй терапевтический агент, как описано выше) или как отдельные, составные лекарственные формы. Альтернативно, дополнительный агент может вводиться до, последовательно или после введения соединения согласно настоящему изобретению. При таком лечении комбинированной терапией и соединения согласно настоящему изобретению, и второй терапевтический агент(ы) вводятся стандартными способами. Введение пациенту композиции согласно настоящему изобретению, содержащей и соединение согласно настоящему изобретения, и второй терапевтический агент, не исключает отдельное введение того же терапевтического агента, любого другого второго терапевтического агента или любого соединения согласно настоящему изобретению пациенту в другое время в ходе лечения. Эффективные количества этих вторых терапевтических агентов хорошо известны специалистам в данной области, и руководство по дозировке может быть обнаружено в патентах и опубликованных патентных заявках, упомянутых здесь, а также в Wells et al., eds., Pharmacotherapy Handbook, 2nd Edition,Appleton and Lange, Stamford, Conn. (2000); PDR Pharmacopoeia, Tarascon Pocket Pharmacopoeia 2000, Deluxe Edition, Tarascon Publishing, Loma Linda, Calif. (2000) и других медицинских руководствах. Однако вполне в компетенции специалиста в данной области определить оптимальный эффективный количественный диапазон второго терапевтического агента. В одном из вариантов осуществления настоящего изобретения, если второй терапевтический агент вводится пациенту, эффективное количество соединения согласно настоящему изобретению является меньшим, чем составляло бы его эффективное количество, если бы второй терапевтический агент не вводился. В другом варианте осуществления эффективное количество второго терапевтического агента является меньшим, чем составляло бы его эффективное количество, если бы соединение согласно настоящему изобретению не вводилось. Следовательно, нежелательные побочные эффекты, связанные с высокими дозами каждого агента, могут быть минимизированы. Другие потенциальные преимущества(включая, без ограничения, улучшенные режимы дозирования и/или сниженную стоимость лекарственного средства) будут очевидны специалистам в данной области. Согласно еще одному аспекту настоящее изобретение обеспечивает применение соединения формулы I отдельно или вместе с одним или более описанных выше вторых терапевтических агентов в производстве лекарственного средства, или в виде одной композиции, или в виде отдельных лекарственных форм, для лечения или предупреждения у пациента заболевания, нарушения или симптома, указанных выше. Другой объект данного изобретения представляет собой соединение формулы I для применения в лечении или предупреждении у пациента заболевания, нарушения или их симптома, описанных здесь. Примеры Пример 1. Синтез соли дейтерия хлорида (S)-3-(амино-d2)(пиперидин-1,3,4,4,5,5-d6)-2,6-диона (24). Промежуточное соединение 24 получали, как показано на схеме 3 ниже. Детали синтеза следующие. Схема 3. Получение промежуточного соединения 24 Синтез (S)-5-амино-(2-бензилоксикарбониламино)-5-оксо-(2,3,3,4,4-d5)пентановой кислоты (22). Оксид дейтерия (Cambridge Isotopes, 99 атом.% D, 2,5 мл) добавляли в суспензию L-глутамин-2,3,3,4,4-d5 20 (CDN Isotopes, 99,2 атом.% D, 2.58 g, 17,09 ммоль, 1,0 экв.) в тетрагидрофуране (150 мл), и суспензию перемешивали в течение 0,25 ч (ч). N-(Бензилоксикарбонилокси)сукцинимид 21 (8.93 г, 35,88 ммоль, 2.1 экв.) добавляли одной порцией и полученную смесь перемешивали при комнатной температуре в течение 42 ч. Смесь концентрировали при пониженном давлении для удаления большей части тетрагидрофурана, и насыщенный водный раствор бикарбоната натрия (30 мл) добавляли к остаточному маслянистому твердому веществу. Смесь разбавляли водой (10 мл) и промывали этилацетатом (50 мл). Органическую фазу удаляли. Водную фазу подкисляли до рН 1-2 смесью концентрированной соляной кислоты и льда. Смесь экстрагировали этилацетатом (550 мл). Объединенные органические фазы промывали солевым раствором (50 мл), сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении, получая гелеобразный остаток. Этот остаток растворяли в метаноле (30 mL), раствор разбавляли толуолом (30 мл) и смесь концентрировали при пониженном давлении. Остаток повторно растворяли в метаноле (30 ил) и полученный раствор разбавляли толуолом (30 мл), и затем вносили затравку перед концентрированием. Смесь концентрировали при пониженном давлении при комнатной температуре, получая белое твердое вещество. Это вещество суспендировали в 1:1 толуоле/гептане (60 мл) и концентрировали при пониженном давлении. Полученное белое твердое вещество сушили при высоком вакууме в течение 1,75 ч, получая 3.80 г (78%) соединения 22. Синтез (S)-бензил-2,6-диоксо(пиперидин-3,4,4,5,5-d5)-3-илкарбамата (23). Смесь соединеия 22 (3.27 г, 11.47 ммоль, 1,0 экв.) и N,N'-карбонилдиимидазола "CDI" (3,60 г, 13,72 ммоль, 1,2 экв.) в тетрагидрофуране (75 мл) нагревали с обратным холодильником в течение 8,5 ч. Прозрачный раствор образовывался через приблизительно 0,75 ч, и желтый цвет постепенно появлялся в ходе реакции. Реакционную смесь охлаждали до комнатной температуры и перемешивали в течение ночи. Реакционную смесь концентрировали при пониженном давлении, чтобы удалить большую часть тетрагидрофурана, и оставшееся желтое масло разделяли между этилацетатом (150 мл) и 1 н соляной кислотой (100 мл). Органическую фазу промывали солевым раствором (75 мл), сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении, получая бесцветное масло, которое медленно кристаллизовалось. Неочищенный продукт очищали на автоматизированной хроматографической системе Analogix, элюируя с градиентом 25-67% этилацетатом/гептанами. Фракции, содержащие продукты, концентрировали при пониженном давлении, давая 2,41 г (79%) соединения 23 в виде белого твердого вещества. Синтез соли дейтерия хлорида (S)-3-(амино-d2)(пиперидин-1,3,4,4,5,5-d6)-2,6-диона (24). Смесь соединения 23 и метанола-d1 (Cambridge Isotopes, 99 атом.% D, 10 мл) нагревали, пока не растворится все твердое вещество, затем охлаждали до комнатной температуры и концентрировали при пониженном давлении. Оставшееся твердое вещество повторно растворяли в смеси метанола-d1 (10 мл) и тетрагидрофурана (10 мл) и добавляли 10% Pd-C (50 мг). Смесь подвергали гидрированию при 35-40 фунтов/кв. дюйм давления водорода в течение 2,75 ч. Смесь фильтровали через слой целита, который затем промывали метанолом-d1 (40 мл). Раствор 35% хлорида дейтерия в оксиде дейтерия (Aldrich, 99.5 атом.% D, 0,75 мл) добавляли к объединенным фильтратам. Через несколько минут образовывалось небольшое количество белого твердого вещества. Смесь затем концентрировали при пониженном давлении, получая влажное твердое вещество. Это влажное твердое вещество азеотропно сушили, концентрируя при пониженном давлении с толуолом (425 мл). Полученное белое твердое вещество дополнительно сушили под высоким вакуумом при комнатной температуре в течение 1,5 ч, получая 0,58 г (103%) соединения 24. Пример 2. Синтез метил 2-(бромметил-d2)-3-нитробензоата (27). Промежуточное соединение 27 получали, как показано на схеме 4 ниже. Детали синтеза являются следующими. Схема 4. Получение промежуточного соединения 27. Синтез метил 2-(метил-d3)-3-нитробензоата (26). Натрий (0,27 г, 11,7 ммоль, 11,7 мол.%) растворяли в метаноле-d1 (Aldrich, 99,5 атом.% D, 250 мл). Добавляли метил 2-метил-3-нитробензоат 25 (19,5 г, 100 ммоль) и смесь нагревали с обратным холодильником в течение 25 ч. Отбирали алкивоту реакционной смеси и концентрировали в потоке азота. 1 Н ЯМР остаточного твердого вещества показал приблизительно 88% включения дейтерия в 2-метильную группу. Смесь нагревали с обратным холодильников в течение дополнительных 18 ч. 1 Н ЯМР аликвоты показал приблизительно 92% включения дейтерия. Смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении, получая коричневое твердое вещество. Это твердое вещество комбинировали с приблизительно 1,6 г материала (приблизительно 95% D) из более ранней порции, и все твердые вещества растворяли в свежем метаноле-d1 (200 мл). Добавляли раствор натрия (0,27 г, 11,7 ммоль) в метаноле-d1 (15 мл) и смесь нагревали с обратным холодильником в течение 24 ч. 1 Н ЯМР аликвоты показал приблизительно 99% включения дейтерия. Смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении, получая коричневое твердое вещество. Твердое вещество растворяли в простом метил-трет-бутиловом эфире (600 мл) и раствор промывали водой (100 мл). Органическую фазу отделяли, промывали водой (200 мл), солевым раствором (100 мл), сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении, получая 19.3 г (88% объединенный выход) соединения 26 в виде грязно-белого твердого вещества. Синтез метил 2-(бромметил-d2)-3-нитробензоата (27). Бензоилпероксид (25% воды) (1,6 г, 4,5 ммоль, 5 мол.%) добавляли к суспензии соединения 26 (17,8 г, 90 ммоль, 1,0 экв.) и N-бромсукцинимида (17,8 г, 99 ммоль, 1,1 экв.) в тетрахлориде углерода (350 мл). Реакционную смесь нагревали с обратным холодильников в течение 22,5 ч и затем охлаждали до комнатной температуры. N-Бромсукцинимид (5.3 г, 30 ммоль, 0,33 экв.) и бензоилпероксид (25% воды) (0,5 г) добавляли и реакционную смесь нагревали с обратным холодильником в течение 8 ч, охлаждали до комнатной температуры и перемешивали в течение ночи. Желтую органическую суспензию промывали насыщенным раствором тиосульфата натрия (250 мл), водой (200 мл), солевым раствором (200 мл), сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении, получая 27,9 г неочищенного продукта, который частично кристаллизовался. Неочищенный продукт растворяли в минимальном объеме дихлорметана и адсорбировали на силикагеле. Адсорбированный материал вносили в виде сухой нагрузки в колонку с силикагелем (400 g), упакованную с использованием гептанов. Колонку элюировали гептанами (2 л), 5% простым метил-трет-бутиловым эфиром/гептанами (2 л), 10% простым метил-трет-бутиловым эфиром/гептанами (2 л) и 20% простым метил-трет-бутиловым эфиром/гептанами(3.5 л). Фракции, содержащие продукт, концентрировали при пониженном давлении, и полученное твердое вещество растирали в гексанах (приблизительно 100 мл), фильтровали и высушивали, получая 20.2 г(104). Соединение 104 получали, как изображено на схеме 5 ниже. Детали синтеза представлены ниже. Схема 5. Получение соединения 104 Синтез 3-(4-нитро-1-оксо-3,3-d2-изоиндолин-2-ил)(пиперидин-3,4,4,5,5-d5)-2,6-диона (28). Триэтиламин (1,05 г, 1,45 мл, 10,4 ммоль, 2,1 экв.) добавляли по каплям через шприц в перемешиваемую суспензию 24 (0,86 г, 4,97 ммоль, 1,0 экв.) и 27 (1,37 г, 4,37 ммоль, 1,0 экв.) в безводном N,Nдиметилацетамиде (15 мл). Реакционную смесь нагревали до приблизительно 85 С в течение 1,5 ч. Реакционная смесь становилась темно-синей при нагревании и образовании суспензии. Реакционную смесь охлаждали до комнатной температуры и медленно добавляли оксид дейтерия (Cambridge Isotopes, 99 атом.% D, 10 мл) к реакционной смеси. Смесь перемешивали в течение 10 мин, затем твердое вещество фильтровали, промывали оксидом дейтерия (20 мл) и затем метанолом-d1 (Cambridge Isotopes, 99 атом.%D, 20 мл), и сушили, получая 1.01 г соединения 28 в виде светло-серого твердого вещества. 1 Н ЯМР показал, что соединение 28 содержало приблизительно 7-8% Н в 3-положении пиперидиндионового кольца и приблизительно 6-7% Н в 3-положении изоиндолинонового кольца. Часть неочищенного продукта 28(500 мг) затем суспендировали в ацетонитриле (40 мл) и добавляли оксид дейтерия (Cambridge Isotopes,99,8 атом.% D, 4 мл), за которым следовал триэтиламин (0,23 мл, 1,68 ммоль). Суспензию нагревали с обратным холодильником в течение 8 ч, охлаждали до комнатной температуры и перемешивали в течение ночи. Твердое вещество отфильтровывали, промывали ацетонитрилом (5 мл) и сушили, получая 371 мг грязно-белого твердого вещества. 1 Н ЯМР показал, что выделенное соединение 28 содержало приблизительно 3% Н в 3-положении пиперидиндионового кольца и приблизительно 2% Н в 3-положении изоиндолинонового кольца. Синтез 3-(4-амино-1-оксо-3,3-d2-изоиндолин-2-ил)(пиперидин-3,4,4,5,5-d5)-2,6-диона (104). Приблизительно 10 мг 10% палладия на угле (приблизительно на 50% увлажненного оксидом дейтерия) добавляли в суспензию соединения 28 (350 мг) в метаноле-d1 (Cambridge Isotopes, 99 атом.% D,350 мл) и смесь подвергали воздействию атмосферы дейтериевого газа (приблизительно 50 фунтов/кв. дюйм) в течение 5 ч. Смесь фильтровали через слой целлита и слой промывали метнолом-d1 (100 мл). Фильтрат концентрировали при пониженном давлении, получая белое твердое вещество с присутствием некоторого количества вязкого материала. Неочищенный продукт растирали с горячим этилацетатом(dd, J1= 7.6, J2= 7.6, 1H), 11.02 (s, 1H). 13 С-ЯМР (75 MHz, DMSO-d6):111.08, 117.04, 126.16, 129.55, 133.04, 144.32, 144.38, 169.62, 172.01,173.69. ВЭЖХ (метод: колонка Zorbax 4.650 мм SB-Aq 3.5 мкм - градиентный метод, 2-98% ACN + 0,1% муравьиной кислоты в течение 6,0 мин с масс-селективным детектором с ионизацией электрораспылением в режиме регистрации положительных ионов; 0,63 мл/мин; длина волны: 254 нм): время удерживания: 3,99 мин; 98,6% чистоты; MS (M+H): 267,0. Пример 4. Хиральное разделение соединения 104. Энантиомеры соединения 104 разделяли хиральной хроматографией как описано ниже. Порции соединения 104 (25 мг/порцию) для инъецирования в прибор ВЭЖХ растворяли в метаноле-D (Cambridge Isotopes, 99 атом.% D, 15-17 мл/порцию) обработкой ультразвуком. Разделение проводили 36 инъекциями на колонку Daicel ChiralPak AD (20250 мм, 10 мкм) с приблизительно 1400 мкл раствора соединения 104 на инъекцию. Каждый прогон элюировании системой растворителей изопропанол/гексаны, показанной в табл. 2 ниже. Таблица 2. Система растворителей для разделения хиральной ВЭЖХ Фракции, содержащие первый элюируемый энантиомер, собирали и концентрировали, получая 34,2 мг в виде грязно-белого твердого вещества. Анализ хиральной ВЭЖХ показал для первого элюируемого энантиомера 99% ее. Анализ ВЭЖХ показал для образца 95,8% чистоту. 1H ЯМР продемонстрировал,что первый элюируемый энантиомер содержал приблизительно 2% Н 3-положении пиперидиндионового кольца и приблизительно 2% Н в 3-положении изоиндолинонового кольца. 1H-ЯМР (300 MHz, DMSO-d6):5.41 (s, 2 Н), 6.79 (d, J= 7.9, 1H), 6.91 (d, J= 7.3, 1H), 7.18 (dd, J1= 7.9,J2= 7.3, 1H), 10.99 (s, 1H). ВЭЖХ (метод: колонка Zorbax 4.650 мм SB-Aq 3,5 мкм - градиентный метод,2-98% ACN + 0,1% муравьиной кислоты в течение 6.0 мин с масс-селективным детектором с ионизацией электрораспылением в режиме регистрации положительных ионов; 0,63 мл/мин; длина волны: 254 нм): время удерживания: 3,91 мин; чистота 95,8%; хиральная ВЭЖХ (метод: колонка Chiralpak AD 25 см изократический метод, 50% гексана/50% изопропанола в течение 45 при 0,600 мл/мин; длина волны: 210 нм): время удерживания: 12,08 мин; 99% ее. MS (М+Н): 267,3. Фракции, содержащие второй элюируемый энантиомер, собирали и концентрировали, получая 29.1 мг в виде светло-желтовато-коричневого твердого вещества. Анализ хиральной ВЭЖХ показал для второго элюируемого энантиомера 99% ее. Анализ ВЭЖХ показал для образца 99% чистоту. 1H ЯМР продемонстрировал, что второй элюируемый энантиомер содержал приблизительно 2% Н 3-положении пиперидиндионового кольца и приблизительно 2% Н в 3-положении изоиндолинонового кольца. 1H-ЯМР (300 MHz, DMSO-d6):5.41 (s, 2 Н), 6.79 (d, J=7.9, 1H), 6.91 (d, J=7.6, 1H), 7.18 (dd, J1=7.9,J2=7.3, 1H), 10.98 (s, 1H). ВЭЖХ (метод: колонка Zorbax 4.650 мм SB-Aq 3.5 мкм - градиентный метод,2-98% ACN + 0,1% муравьиной кислоты в течение 6,0 мин с масс-селективным детектором с ионизацией электрораспылением в режиме регистрации положительных ионов; 0,63 мл/мин; длина волны: 254 нм): время удерживания: 3,91 мин; 99,6% чистота; хиральная ВЭЖХ (метод: колонка Chiralpak AD 25 см изократический метод, 50% гексана/ 50% изопропанола в течение 45 мин при 0,600 мл/мин; длина волны: 210 нм): время удерживания: 14,75 мин; 99,3% ее. MS (M+H): 267,3. Предполагается без дополнительного описания, что специалист в данной области может, используя предшествующее описание и иллюстративные примеры, получить и использовать соединения согласно настоящему изобретению и выполнять заявленные способы. Следует понимать, что вышеупомянутые обсуждение и примеры представляют только подробное описание определенных предпочтительных примеров. Специалисту в данной области будет ясно, что могут быть сделаны различные модификации и эквиваленты, не выходя за рамки сущности и объема настоящего изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы Ia или его фармацевтически приемлемая соль, где каждый W независимо выбран из водорода или дейтерия; каждый Y независимо выбран из водорода или дейтерия и каждый Z независимо выбран из водорода или дейтерия; и каждый представитель по меньшей мере одной пары Z, присоединенной к общему атому углерода, является дейтерием. 2. Соединение по п.1, где W1, W2 и W3 одновременно являются водородом. 3. Соединение по п.1, где Z1, Z2, Z3 и Z4 одновременно являются дейтерием. 4. Соединение по п.1, где каждый Y одновременно является дейтерием. 5. Соединение по п.1, где соединение выбирается из группы, состоящей из соединения 102 а и их фармацевтически приемлемых солей. 6. Апирогенная фармацевтическая композиция, содержащая соединение по п.1 и фармацевтически приемлемый носитель. 7. Способ лечения заболевания или состояния, выбранного из миелодиспластических синдромов,множественной миеломы, неходжкинской лимфомы, папиллярной и фолликулярной карциномы щитовидной железы, рака предстательной железы, хронического лимфоцитарного лейкоза, амилоидоза, комплексного регионального болевого синдрома I типа, злокачественной меланомы, радикулопатии, миелофиброза, глиобластомы, глиосаркомы, злокачественных глиом, миелогенной лейкемии, рефрактерного плазмоклеточного новообразования, хронического миеломоноцитарного лейкоза, фолликулярной лимфомы, меланомы цилиарного тела и хронической меланомы, меланомы радужной оболочки, рецидивирующей интерокулярной меланомы, меланомы внеглазного распространения, солидных опухолей, Тклеточной лимфомы, эритроидной лимфомы, монобластного и моноцитарного лейкоза, миелоидного лейкоза, опухоли головного мозга, менингиомы, опухолей спинного мозга, рака щитовидной железы,лимфомы из клеток зоны мантии, немелкоклеточного рака легкого, рака яичников, почечно-клеточного рака, миелофиброза, лимфомы Беркитта, лимфомы Ходжкина, крупноклеточной лимфомы и макроглобулинемии Вальденстрема, у пациента, нуждающегося в этом, предусматривающий стадию введения пациенту композиции по п.6. 8. Способ по п.7, где заболевание выбирается из миелодиспластических синдромов или множественной миеломы.
МПК / Метки
МПК: A61K 31/445, A01N 43/40
Метки: замещенные, диоксопиперидинилфталимидные, производные
Код ссылки
<a href="https://eas.patents.su/20-20117-zameshhennye-dioksopiperidinilftalimidnye-proizvodnye.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные диоксопиперидинилфталимидные производные</a>
Предыдущий патент: Система и способ для подводной внутрискважинной работы
Следующий патент: Молекула нуклеиновой кислоты биосинтетического кластера, кодирующая нерибосомальные пептидсинтазы, и ее применение
Случайный патент: Трансформаторы с осевым воздушным охлаждением












