Молекула нуклеиновой кислоты биосинтетического кластера, кодирующая нерибосомальные пептидсинтазы, и ее применение
Номер патента: 20118
Опубликовано: 29.08.2014
Авторы: Крастель Филипп, Шмитт Эстер, Лихти Бригитта-Мария, Мур Чарлз
Формула / Реферат
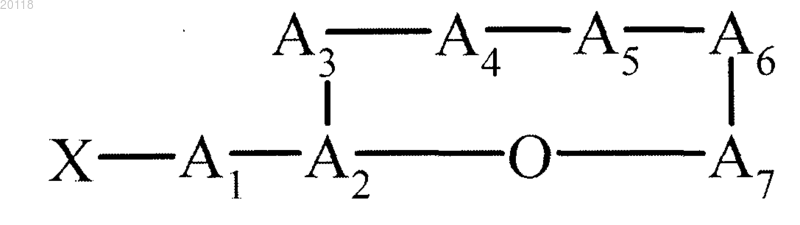
1. Выделенный полинуклеотид, содержащий один или более функциональных фрагментов биосинтетического генного кластера, который кодирует NRPS2 или NRPS1, нерибосомальную пептидсинтазу, участвующую в продукции соединения формулы (I)

в которой сложноэфирная связь находится между карбоксильной группой А7 и гидроксильной группой А2 и необязательно атом азота амидной связи между А5 и А6 заменен на метил;
в которой X и A1, каждый независимо друг от друга, являются необязательными элементами и
X обозначает любой химический остаток, в частности Н или ацильный остаток, предпочтительно СН3СН2СН(СН3)СО, (СН3)2СНСН2СО или (СН3)2СНСО;
A1 обозначает стандартную аминокислоту, которая не представляет собой аспарагиновую кислоту, в частности обозначает глутамин;
А2 обозначает треонин или серин, предпочтительно треонин;
А3 обозначает неосновную стандартную аминокислоту или ее неосновное производное, в частности лейцин;
А4 обозначает Ahp, дегидро-Ahp, пролин или их производное, в частности Ahp или ее производное, в частности производное Ahp 3-амино-2-пиперидон;
А5 обозначает изолейцин или валин, в частности изолейцин;
А6 обозначает тирозин или его производное, в частности тирозин;
А7 обозначает лейцин, изолейцин или валин, в частности изолейцин или валин, в частности изолейцин;
или соединения формулы (I')
в которой сложноэфирная связь находится между карбоксильной группой А7 и гидроксильной группой А2 и необязательно атом азота амидной связи между А5 и А6 заменен на метил;
в которой
X обозначает СН3СО, (СН3)2СНСО, CH3S(О)СН2СО, СН3СН2СН(СН3)СО или С6Н5СО;
A1 обозначает глутамин;
А2 обозначает треонин;
А3 обозначает лейцин;
А4 обозначает Ahp, дегидро-Ahp, пролин или 5-гидроксипролин;
А5 обозначает изолейцин или валин, в частности изолейцин;
А6 обозначает тирозин;
А7 обозначает изолейцин или валин, в частности изолейцин;
причем указанный полинуклеотид включает:
(i) нуклеотидную последовательность, которая идентична по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 98% последовательности, выбранной из группы, состоящей из SEQ ID NO: 46, 48, 50, 52, 1, 3, 5, 7, 9, 11, 13, 54, 56, 58 и 60, которая кодирует домен NRPS2, и/или ее комплемент;
(ii) нуклеотидную последовательность, которая гибридизуется в жестких условиях с комплементарной цепью нуклеотидной последовательности, выбранной из группы, состоящей из SEQ ID NO: 46, 48, 50, 52, 1, 3, 5, 7, 9, 11, 13, 54, 56, 58 или 60, которая кодирует домен NRPS2, и/или ее комплемент;
(iii) нуклеотидную последовательность, которая кодирует аминокислотную последовательность, идентичную по меньшей мере на 80%, по меньшей мере на 90%, по меньшей мере на 95% последовательности, выбранной из группы, состоящей из SEQ ID NO: 47, 49, 51, 53, 2, 4, 6, 8, 10, 12, 14, 55, 57, 59 или 61, которая представляет собой домен NRPS2, и/или ее комплемент;
(vi) нуклеотидную последовательность, которая гибридизуется в жестких условиях с комплементарной цепью нуклеотидной последовательности, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 47, 49, 51, 53, 2, 4, 6, 8, 10, 12, 14, 55, 57, 59 или 61, которая представляет собой домен NRPS2, и/или ее комплемент;
(v) нуклеотидную последовательность, которая идентична по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 98% последовательности, выбранной из группы, состоящей из SEQ ID NO: 15, SEQ ID NO: 28, и/или ее комплемент; или
(vi) нуклеотидную последовательность, которая гибридизуется в жестких условиях с комплементарной цепью нуклеотидной последовательности, выбранной из группы, состоящей из SEQ ID NO: 15, SEQ ID NO: 28, и/или ее комплемент;
(vii) нуклеотидную последовательность, которая идентична по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 98% последовательности, выбранной из группы, состоящей из SEQ ID NO: 30, 32, 34, 36, 38, 40, 42 и 44, которая кодирует домен NRPS1, и/или ее комплемент;
(viii) нуклеотидную последовательность, которая гибридизуется в жестких условиях с комплементарной цепью нуклеотидной последовательности, выбранной из группы, состоящей из SEQ ID NO: 30, 32, 34, 36, 38, 40, 42 и 44, которая кодирует домен NRPS1, и/или ее комплемент;
(ix) нуклеотидную последовательность, которая кодирует аминокислотную последовательность, идентичную по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90%, по меньшей мере на 95% последовательности, выбранной из группы, состоящей из SEQ ID NO: 31, 33, 35, 37, 39, 41, 43, 45, которая представляет собой домен NRPS1, и/или ее комплемент;
(х) нуклеотидную последовательность, которая гибридизуется в жестких условиях с комплементарной цепью нуклеотидной последовательности, которая кодирует аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 31, 33, 35, 37, 39, 41, 43, 45, которая представляет собой домен NRPS1, и/или ее комплемент;
(xi) нуклеотидную последовательность, которая идентична по меньшей мере на 85%, по меньшей мере на 90%, по меньшей мере на 95%, по меньшей мере на 98% последовательности, выбранной из группы, состоящей из SEQ ID NO: 26, и/или ее комплемент; или
(xii) нуклеотидную последовательность, которая гибридизуется в жестких условиях с комплементарной цепью нуклеотидной последовательности, выбранной из группы, состоящей из SEQ ID NO: 26, и/или ее комплемент;
где нуклеотидные последовательности, указанные в подпунктах (i)-(xii), кодируют экспрессионный продукт, который сохраняет активность соответствующего(их) домена(ов) NRPS, представленного(ых) в референс-последовательности(ях) SEQ ID NO: 47, 49, 51, 53, 2, 4, 6, 8, 10, 12, 14, 55, 57, 59, 61 31, 33, 35, 37, 39, 41, 43 и/или 45.
2. Полинуклеотид по п.1, который кодирует продукт экспрессии, сохраняющий активность:
(а) одного или нескольких следующих доменов NRPS2:
(i) домен тиолирования, имеющий последовательность SEQ ID NO: 47;
(ii) домен конденсации, имеющий последовательность SEQ ID NO: 49;
(iii) домен аденилирования пролина, имеющий последовательность SEQ ID NO: 51;
(iv) домен тиолирования, имеющий последовательность SEQ ID NO: 53;
(v) домен конденсации, имеющий последовательность SEQ ID NO: 2;
(vi) домен аденилирования изолейцина, имеющий последовательность SEQ ID NO: 4;
(vii) домен тиолирования, имеющий последовательность SEQ ID NO: 6;
(viii) домен конденсации, имеющий последовательность SEQ ID NO: 8;
(ix) домен аденилирования тирозина, имеющий последовательность SEQ ID NO: 10;
(х) домен N-метилирования, имеющий последовательность SEQ ID NO: 12;
(xi) домен тиолирования, имеющий последовательность SEQ ID NO: 14;
(xii) домен конденсации, имеющий последовательность SEQ ID NO: 55;
(xiii) домен аденилирования изолейцина, имеющий последовательность SEQ ID NO: 57;
(xiv) домен тиолирования, имеющий последовательность SEQ ID NO: 59;
(xv) тиоэстеразный домен, имеющий последовательность SEQ ID NO: 61; или
(b) одного или нескольких следующих доменов NRPS1:
(xvi) загрузочный домен, имеющий последовательность SEQ ID NO: 31;
(xvii) домен аденилирования глутамина, имеющий последовательность SEQ ID NO: 33;
(xviii) домен тиолирования, имеющий последовательность SEQ ID NO: 35;
(xix) домен конденсации, имеющий последовательность SEQ ID NO: 37;
(хх) домен аденилирования треонина, имеющий последовательность SEQ ID NO: 39;
(xxi) домен тиолирования, имеющий последовательность SEQ ID NO: 41;
(xxii) домен конденсации, имеющий последовательность SEQ ID NO: 43; и
(xxiii) домен аденилирования лейцина, имеющий последовательность SEQ ID NO: 45.
3. Полинуклеотид по п.1 или 2, который содержит нуклеотидную последовательность, кодирующую аминокислотную последовательность, которая представлена в SEQ ID NO: 29.
4. Полинуклеотид по п.1 или 2, который содержит нуклеотидную последовательность, кодирующую аминокислотную последовательность, которая представлена в SEQ ID NO: 27.
5. Выделенный полипептид, кодируемый одним или несколькими полинуклеотидом(ами) по одному из пп.1-4.
6. Выделенный полипептид, участвующий в продукции соединения формулы (I) или (I'), который содержит аминокислотную последовательность, выбранную из группы, состоящей из:
(i) аминокислотной последовательности, кодируемой полинуклеотидом по п.4, представляющей собой NRPS1, аминокислотной последовательности, кодируемой полинуклеотидом по п.3, представляющей собой NRPS2, и SEQ ID NO: 63, представляющей собой цитохром Р450; и
(ii) функционального варианта указанной аминокислотной последовательности, который по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90%, по меньшей мере на 95% идентичен этой аминокислотной последовательности, и сохраняющего, по существу, такую же каталитическую функцию.
7. Выделенный полинуклеотид, содержащий нуклеотидную последовательность, которая кодирует один или несколько полипептид(ов) по п.6.
8. Полинуклеотид по п.7, содержащий:
(i) нуклеотидную последовательность, кодирующую SEQ ID NO: 27 или ее функциональный вариант; и
(ii) нуклеотидную, последовательность, кодирующую SEQ ID NO: 29 или ее функциональный вариант.
9. Полинуклеотид по п.8, дополнительно содержащий нуклеотидную последовательность, кодирующую SEQ ID NO: 63 или ее функциональный вариант.
10. Полинуклеотид по одному из пп.7-9, выделенный из штамма Chondromyces crocatus NPH-MB180, который имеет регистрационный номер DSM 19329.
11. Экспрессионный вектор, содержащий полинуклеотид по одному из пп.7-10, в котором открытые рамки считывания функционально связаны с контролирующими транскрипцию и трансляцию последовательностями.
12. Экспрессионный вектор по п.11, включающий полинуклеотид по п.9.
13. Клетка-хозяин, подвергнутая генно-инженерной манипуляции с использованием одного или более рекомбинантных полинуклеотидов по одному из пп.1-4 и 7-10 или экспрессионного вектора по п.11 или 12.
14. Клетка-хозяин по п.13, в которой полинуклеотиды интегрированы в геном.
15. Клетка-хозяин по п.13 или 14, дополнительно содержащая одну или несколько открытую(ых) рамку(ок) считывания, которая(ые) необходима(ы) для продукции соединения формулы (I) или (I'), выбранную(ые) из группы, состоящей из SEQ ID NO: 16, SEQ ID NO: 18, SEQ ID NO: 20, SEQ ID NO: 22 и SEQ ID NO: 24 или их функциональный вариант.
16. Клетка-хозяин по одному из пп.13-15, предназначенная для продукции соединения формулы (I) или (I') или формул (II)-(VII), (XI)-(XIV) и (XVII) и (XVIII), представленных на фиг. 1А и 1В.
17. Клетка-хозяин по одному из пп.13-16, в которой рекомбинантные полинуклеотиды модифицированы для оптимизации экспрессии генов.
18. Клетка-хозяин по одному из пп.13-17, в которой наиболее часто встречающиеся кодоны полинуклеотида выбраны таким образом, чтобы соответствовать наиболее часто встречающимся кодонам белков, преобладающим в клетке-хозяине.
19. Клетка-хозяин по одному из пп.13-18, где клетка-хозяин выбрана из группы, состоящей из Е. coli, Streptomyces lividans, Streptomyces griseofuscus, Streptomyces ambofaciens, Bacillus subtilis, Salmonella typhimurium, Myxococcus xanthus, Sorangium cellulosum, Chondromyces crocatus, видов Pseudomonas, Streptomyces, Bacillus и Staphylococcus, дрожжей, Drosophila S2, Spodoptera Sf9, CHO, COS или меланомы Боуэна, и аденовирусов.
20. Клетка-хозяин по одному из пп.13-19, где клетка-хозяин выбрана из видов отряда Myxococcales или рода Pseudomonas или Streptomyces.
21. Клетка-хозяин по одному из пп.13-20, где указанная клетка представляет собой Chondromyces crocatus.
22. Способ получения соединения формулы (I) или (I') или формул (II)-(VII), (XI)-(XIV) и (XVII) и (XVIII), представленных на фиг. 1А и 1В, включающий культивирование клетки-хозяина по одному из пп.13-21 в условиях получения указанного соединения.
23. Способ по п.22, дополнительно включающий стадию рекуперации указанного соединения.
24. Способ по п.22 или 23, в котором клетку-хозяин культивируют в среде для роста, содержащей изомасляную кислоту.
Текст
МОЛЕКУЛА НУКЛЕИНОВОЙ КИСЛОТЫ БИОСИНТЕТИЧЕСКОГО КЛАСТЕРА,КОДИРУЮЩАЯ НЕРИБОСОМАЛЬНЫЕ ПЕПТИДСИНТАЗЫ, И ЕЕ ПРИМЕНЕНИЕ[enzyme В изобретении описан полинуклеотид, содержащий один или несколько функциональных фрагментов биосинтетического генного кластера, участвующего в образовании соединения формулы (I) или (I'). В изобретении описан также способ получения соединения формулы (I) или (I') или формул (II)-(VII), (XI)(XIV) и (XVII), и (XVIII). Кроме того, в изобретении описано также применение указанного соединения в виде фармацевтической композиции. Настоящее изобретение относится к созданию полинуклеотида, содержащего один или несколько функциональных фрагментов биосинтетического генного кластера, участвующего в образовании соединения формулы (I) или (I'). Настоящее изобретение относится также к способу получения соединения формулы (I) или (I') или формул (II)-(VII), (XI)-(XIV) и (XVII), и (XVIII). Кроме того, в настоящем изобретении описано также применение указанного соединения в виде фармацевтической композиции. Многие встречающиеся в естественных условиях продукты, полученные из микроорганизмов, обладают различными видами биологической активности в отношении высших организмов и благодаря своим терапевтическим свойствам используются в течение столетий. Большая часть этих встречающихся в естественных условиях продуктов принадлежит к классам поликетидов и нерибосомальных пептидов,и они синтезируются с помощью модульных ферментативных систем, таких как поликетидсинтазы (PKS) и нерибосомальные пептидсинтазы (NRPS) (Finkering и Marahiel 2004; Staunton и Weissman, 2001). Кроме того, существуют пути, содержащие в одном и том же каскаде гены как PKS, так и NRPS, и в результате образующие вторичные метаболиты, которые являются гибридами этих двух классов. Встречающиеся в естественных условиях продукты, образующиеся с помощью этих путей биосинтеза, создаются из небольших относительно простых конструктивных элементов (блоков), таких как карбоновые кислоты с короткой цепью и аминокислоты. Однако конечные встречающиеся в естественных условиях продукты,образовавшиеся с помощью этих путей, отличаются очень большим разнообразием и часто являются структурно сложными, как правило, содержащими несколько стереоцентров. По указанным причинам основанные на синтезе подходы к получению этих соединений часто являются нецелесообразными с практической точки зрения, и поэтому ферментация остается общепринятым средством их получения. Однако ферментативные процессы имеют присущие им проблемы, связанные с тем, что они основаны на использовании микроорганизмов, метаболизм которых не характеризован, которые часто являются генетически неподдающимися обработке и часто плохо растут и продуцируют представляющие интерес соединения в недостаточном количестве. Для решения этих проблем можно выбирать подход, основанный на гетерологичной экспрессии пути PKS или NRPS в хорошо охарактеризованном организме-хозяине,который не имеет указанных недостатков (обзор Wenzel и Muller, 2005). Фактически этот подход можно распространять на экспрессию молчащих или криптических путей PKS и NRPS для исследовательских целей (Shen, 2004) или его можно применять для экспрессии путей из организмов, которые нельзя культивировать в лабораторных условиях. Кроме того, перенос путей PKS и NRPS в гетерологичных хозяев позволяет эффективно конструировать биоинженерными методами пути вторичных метаболитов,позволяющие создавать новые аналоги родительского соединения. Преимущество гетерологичной экспрессии состоит в том, что, как правило, пути PKS и NRPS локализованы в смежном кластере на геноме. Таким образом, эти пути в принципе относительно легко клонировать в стандартных векторах на основе ВАС или космид. Несмотря на кажущуюся простоту переноса пути из одного микроорганизма в другой, различия между двумя организмами, связанные с регуляцией, наиболее часто встречающимся кодонами или метаболизмом, являются значительными препятствиями для осуществления успешной гетерологичной экспрессии. Кроме того, молекулярные инструменты,позволяющие эффективно применять эту стратегию, такие, например, как создание библиотек ВАС и рекомбинантные подходы к клонированию, стали доступны только относительно недавно (Wenzel и Muller, 2005). По этим причинам в литературе описано лишь несколько примеров успешной гетерологичной экспрессии. Выбор приемлемого гетерологичного хозяина является важной составляющей при разработке стратегии экспрессии. Новый хозяин должен легко поддаваться генетической обработке, с ним должно быть легко работать в лабораторных условиях, и он должен обладать способностью использовать пути PKS или NRPS. Например, присутствие фосфопантетеинтрансферазы в новом хозяине имеет решающее значение для облегчения активации импортируемой PKS или NRPS (Pfeifer и др., 2001). Кроме того, для эффективной экспрессии импортируемого пути чрезвычайным важным является, чтобы новый хозяин имел сходный с нативным хозяином профиль наиболее часто встречающихся кодонов. Наиболее часто применяемыми хозяевами являлись Escherichia coli, Bacillus subtilis, Pseudomonas putida и небольшая группа хорошо охарактеризованных штаммов Streptomyces (см. обзор у Zhang и Pfeifer, 2008). К другим ранее применявшимся хозяевам относятся Myxococcus xanthus и нитчатые грибы. Некоторые из этих штаммов-хозяев модифицировали посредством мутагенеза так, чтобы основные присущие им системы вторичного метаболизма становились молчащими, с целью удаления фоновых профилей метаболитов и для предупреждения участия доступного пула предшественников в последующем пути биосинтеза. Для переноса конкретного пути требуется упаковка пути в приемлемом, обладающем способностью к переносу генетическом элементе. Предварительно должна быть определена последовательность системы PKS или NRPS, по меньшей мере, на аминокислотном уровне, и более предпочтительно на нуклеотидном уровне. Как правило, эту последовательность применяют для создания зонда, предназначенного для определения локализации ВАС или космидного клона в сконструированной на основе нативного хозяина геномной библиотеке. Из-за большого размера этих кластеров путей (как правило, превышающего 30 т.п.н. или часто превышающего 100 т.п.н.) они часто не захватываются одной ВАС или космидным клоном, когда применяют стратегию клонирования, основанную на методе дробовика. Таким образом,часто необходимо реконструировать путь для создания индивидуальной ВАС или конструкции индивидуального космидного вектора, содержащей целиком весь путь. Если необходимо экспрессировать очень большие пути, то их можно разделять на части для включения в две или большее количество векторных конструкций, подлежащих экспрессии в транс-ориентации в новом хозяине (Gu и др., 2007). И, наконец,векторная конструкция должна обладать также необходимыми для переноса плазмиды функциями (например, oriT из RK2) для ее переноса из Е. coli, несущей конструкцию, в нового хозяина. Для гарантии того, что конструкция будет стабильна в новом хозяине, ее целесообразно интегрировать в хромосому хозяина. Для осуществления этого конструкция должна содержать сайт, предназначенный для эффективной интеграции в хромосому. Например, в этой системе для встраивания в хромосому часто применяют фаговый сайт присоединения С 31 для Streptomyces (Binz и др., 2008). Кроме того, часто является необходимым встраивать новый промотор перед путем биосинтеза, который должен соответствующим образом функционировать в новом хозяине. Если два рассматриваемых организма являются близко родственными и поэтому, вероятно, должны характеризоваться наличием многих одинаковых регуляторных элементов, то эту стадию можно исключать. И, наконец, для отбора успешных случаев переноса и интеграции конструкции (модифицированная ВАС или космида) в новом хозяине требуется селектируемый маркер, как правило, кассета, обусловливающая устойчивость к антибиотикам. Как правило, эти манипуляции осуществляют в Е. coli и часто путем использования рекомбинации Red/ET (Zhang и др., 1998). Этот подход клонирования наиболее пригоден для применения крупных ДНК-конструкций, при использовании которых манипуляции с применением рестриктаз являются чрезвычайно важными. После интеграции конструкции в нового хозяина осуществляют ферментацию и последующий химический анализ для определения того, является экспрессия пути успешной или нет. Если гетерологичная экспрессия оказалась успешной, то практически во всех случаях встречающийся в естественных условиях продукт продуцируется в более низких титрах по сравнению с титрами, обнаруженными в нативном хозяине. Несмотря на это очевидное препятствие (недостаток), успешная гетерологичная экспрессия обеспечивает платформу для осуществления экспрессии, дающую широкие возможности для применения традиционных методологий улучшения штамма. Настоящее изобретение относится к идентификации биосинтетического кластера, участвующего в биосинтезе депсипептидов формулы I в которой сложноэфирная связь находится между карбоксильной группой А 7 и гидроксильной группой А 2 и необязательно атом азота амидной связи между А 5 и А 6 заменен на метил; в которой X и А 1 каждый независимо друг от друга являются необязательными элементами; и в которойX обозначает любой химический остаток, прежде всего Н или ацильный остаток, предпочтительно СН 3 СН 2 СН(СН 3)СО, (СН 3)2 СНСН 2 СО или (СН 3)2 СНСО;A1 обозначает стандартную аминокислоту, которая не представляет собой аспарагиновую кислоту,предпочтительно обозначает глутамин; А 2 обозначает треонин или серин, предпочтительно треонин; А 3 обозначает неосновную стандартную аминокислоту или ее неосновное производное, предпочтительно обозначает лейцин; А 4 обозначает Ahp (2-аминогептановая кислота), дегидро-Ahp, пролин или их производные, прежде всего Ahp или ее производное, предпочтительно производное Ahp 3-амино-2-пиперидон; А 5 обозначает изолейцин или валин, предпочтительно изолейцин; А 6 обозначает тирозин или его производное, предпочтительно тирозин; А 7 обозначает лейцин, изолейцин или валин, прежде всего изолейцин или валин, предпочтительно изолейцин; и к разработке гетерологичных экспрессионных систем для получения нерибосомальных пептидов формулы I, включая их фармацевтически приемлемые соли или производные. В частности, изобретение относится к применению биосинтетического генного кластера для биосинтеза депсипептидов формулы в которой сложноэфирная связь находится между карбоксильной группой А 7 и гидроксильной группой А 2 и необязательно атом азота амидной связи между А 5 и А 6 заменен на метил; в которой А 1 обозначает глутамин; А 2 обозначает треонин; А 3 обозначает лейцин; А 4 обозначает Ahp, дегидро-Ahp, пролин или 5-гидроксипролин; А 5 обозначает изолейцин или валин, предпочтительно изолейцин; А 6 обозначает тирозин; А 7 обозначает изолейцин или валин, предпочтительно изолейцин. В частности, настоящее изобретение относится к идентификации биосинтетического кластера, участвующего в биосинтезе нерибосомальных пептидов формулы (II), (III), (IV), (V), (VI), (VII), (XI), (XII)(XIV), (XVII) и/или (XVIII), представленных на фиг. 1, и к разработке гетерологичных экспрессионных систем для получения нерибосомальных пептидов формулы I или (I'), включая их фармацевтически приемлемые соли или производные. Соединения формулы (I), прежде всего формулы (I'), представляют собой нерибосомальные полипептиды, которые принадлежат к семейству депсипептидов, продуцируемых штаммом миксобактерийChondromyces crocatus NPH-MB180. Установлено, что эти депсипептиды являются высокоэффективными и селективными ингибиторами человеческого калликреина 7 (hK7) и эластазы. Человеческий калликреин 7 представляет собой фермент, обладающий активностью сериновой протеазы, и он представляет собой потенциальную мишень для лечения атопического дерматита. Подробные физико-химические данные новых соединений, а также методы ферментации и экстракции, описаны в заявке на патент РСТ РСТ/ЕР 08/060689, опубликованной как WO 2009/024527. В контексте настоящего описания понятие соединение формулы (I) или депсипептиды формулы(I) относится к соединениям формулы (I), указанным выше, и прежде всего к нерибосомальным пептидам формулы (II), (III), (IV), (V), (VI), (VII), (XI), (XII), (XIII), (XIV) и/или (XVIII), представленным на фиг. 1, и любым производным, которые сохраняют практически такую же протеазную активность. Примеры таких производных также описаны в заявке на патент РСТ, опубликованной как WO 2009/024527. В контексте настоящего описания понятие соединение формулы (I') или депсипептиды формулы(I')относится к соединениям формулы (I') указанным выше, и прежде всего к нерибосомальным пептидам формулы (II), (III), (IV), (V), (VI), (VII), (XI), (XII), (XIII), (XIV), (XVII) и/или (XVIII), представленным на фиг. 1, и любым производным, которые сохраняют практически такую же протеазную активность. В основу изобретения была положена техническая задача разработать биосинтетический кластер или его функциональные части, который(ые) участвуют в биосинтезе депсипептидов формулы (I) или(I'). Техническая задача решается с помощью вариантов осуществления изобретения, охарактеризованных в формуле изобретения. Другая техническая задача, положенная в основу изобретения, была разработать репрессируемые промоторы, пригодные для гетерологичной экспрессии генов, например, для синтеза представляющего интерес рекомбинантного белка. Первым вариантом осуществления настоящего изобретения (1) является полинуклеотид, содержащий один или несколько функциональных фрагментов биосинтетического генного кластера, который кодирует нерибосомальную пептидсинтазу (NRPS), обозначенную далее как NRPS2, которая участвует в образовании соединения формулы (I) или (I'), содержащий:(I) нуклеотидную последовательность, которая идентична по меньшей мере на 80%, предпочтительно по меньшей мере на 85%, предпочтительно по меньшей мере на 90%, предпочтительно по меньшей мере на 95%, предпочтительно по меньшей мере на 98% последовательности, выбранной из группы,включающей SEQ ID NO: l, 3, 5, 7, 9, 11, 13, 46, 48, 50, 52, 54, 56, 58 и 60, которая кодирует домен(II) нуклеотидную последовательность, которая гибридизуется с комплементарной цепью нуклеотидной последовательности, выбранной из группы, включающей SEQ ID NO: l, 3, 5, 7, 9, 11, 13, 46, 48,50, 52, 54, 56, 58 или 60, которая кодирует домен NRPS2, и/или ее комплемент;(III) нуклеотидную последовательность, которая кодирует аминокислотную последовательность,идентичную по меньшей мере на 60%, предпочтительно по меньшей мере на 70%, предпочтительно по меньшей мере на 80%, предпочтительно по меньшей мере на 90%, предпочтительно по меньшей мере на 95%о последовательности, выбранной из группы, включающей SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 47, 49,51, 53, 55, 57, 59 или 61, которая представляет собой домен NRPS2, и/или ее комплемент;(IV) нуклеотидную последовательность, которая гибридизуется с комплементарной цепью нуклеотидной последовательности, которая кодирует аминокислотную последовательность, выбранную из группы, включающей SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 47, 49, 51, 53, 55, 57, 59 или 61, которая представляет собой домен NRPS2, и/или ее комплемент;(V) нуклеотидную последовательность, которая идентична по меньшей мере на 80%, предпочтительно по меньшей мере на 85%, предпочтительно по меньшей мере на 90%, предпочтительно по мень-3 020118 шей мере на 95%, предпочтительно по меньшей мере на 98% последовательности, выбранной из группы,включающей SEQ ID NO: 15, SEQ ID NO: 28, и/или ее комплемент; или(VI) нуклеотидную последовательность, которая гибридизуется с комплементарной цепью нуклеотидной последовательности, выбранной из группы, включающей SEQ ID NO: 15, SEQ ID NO: 28, и/или ее комплемент; где нуклеотидные последовательности, указанные в подпунктах (I)-(VI), кодируют экспрессионный продукт, который сохраняет активность соответствующего(их) домена(ов) NRPS, представленного(ых) в референс-последовательности(ях) SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 47, 49, 51, 53, 55, 59 и/или 61. Вторым вариантом осуществления изобретения (2) является полинуклеотид, указанный в варианте осуществления (1), где этот полинуклеотид кодирует экспрессионный продукт, который сохраняет активность одного или нескольких следующих NRPS2-доменов:(XIV) домен тиолирования, имеющий последовательность SEQ ID NO: 59; и/или,(XV) тиоэстеразный домен, имеющий последовательность SEQ ID NO: 61. В конкретном подварианте варианта осуществления изобретения (2) указанные полинуклеотиды,кодирующие NRPS2, которая участвует в образовании соединения формулы (I) или (I'), содержат нуклеотидную последовательность, кодирующую аминокислотную последовательность, которая представлена в SEQ ID NO: 29. Третьим вариантом осуществления настоящего изобретения (3) является полинуклеотид, содержащий один или несколько функциональных фрагментов биосинтетического генного кластера, кодирующего NRPS1, где NRPS участвует в образовании соединения формулы (I) или (I'), содержащий:(I) нуклеотидную последовательность, которая идентична по меньшей мере на 80%, предпочтительно по меньшей мере на 85%, предпочтительно по меньшей мере на 90%, предпочтительно по меньшей мере на 95%, предпочтительно по меньшей мере на 98% последовательности, выбранной из группы,включающей SEQ ID NO: 30, 32, 34, 36, 38, 40, 42 и 44, которая кодирует домен NRPS, и/или ее комплемент;(II) нуклеотидную последовательность, которая гибридизуется с комплементарной цепью нуклеотидной последовательности, выбранной из группы, включающей SEQ ID NO: 30, 32, 34, 36, 38, 40, 42 и 44, которая кодирует домен NRPS, и/или ее комплемент;(III) нуклеотидную последовательность, которая кодирует аминокислотную последовательность,идентичную по меньшей мере на 60%, предпочтительно по меньшей мере на 70%, предпочтительно по меньшей мере на 80%, предпочтительно по меньшей мере на 90%, предпочтительно по меньшей мере на 95% последовательности, выбранной из группы, включающей SEQ ID NO: 31, 33, 35, 37, 39, 41, 43, 45,которая представляет собой домен NRPS1, и/или ее комплемент;(IV) нуклеотидную последовательность, которая гибридизуется с комплементарной цепью нуклеотидной последовательности, которая кодирует аминокислотную последовательность, выбранную из группы, включающей SEQ ID NO: 31, 33, 35, 37, 39, 41, 43, 45, которая представляет собой домен NRPS1,и/или ее комплемент;(V) нуклеотидную последовательность, которая идентична по меньшей мере на 80%, предпочтительно по меньшей мере на 85%, предпочтительно по меньшей мере на 90%, предпочтительно по меньшей мере на 95%, предпочтительно по меньшей мере на 98% последовательности, выбранной из группы,включающей SEQ ID NO: 26, и/или ее комплемент; или(VI) нуклеотидную последовательность, которая гибридизуется с комплементарной цепью нуклеотидной последовательности, выбранной из группы, включающей SEQ ID NO: 26, и/или ее комплемент;(VII) где нуклеотидные последовательности, указанные в подпунктах (I)-(VI), кодируют экспрессионный продукт, который сохраняет активность соответствующего(их) домена(ов) NRPS, представленного(ых) в референс-последовательности(ях) SEQ ID NO: SEQ ID NO: 31, 33, 35, 37, 39, 41, 43, 45. В четвертом варианте осуществления изобретения полинуклеотид, указанный в варианте осуществления (3), кодирует экспрессионный продукт, который сохраняет активность одного или нескольких следующих доменов NRPS1:(VIII) домен аденилирования лейцина, имеющий последовательность SEQ ID NO: 45. В конкретном случае варианта осуществления изобретения (4) полинуклеотид, кодирующийNRPS1, которая участвует в образовании соединения формулы (I) или (I'), содержит нуклеотидную последовательность, кодирующую аминокислотную последовательность, которая представлена в SEQ IDNO: 27. Другим вариантом осуществления изобретения является полипептид, кодируемый одним или несколькими описанными выше фрагментами. В частности, этот полипептид, пригодный для образования соединения формулы (I) или (I'), содержит аминокислотную последовательность, выбранную из группы,включающей:(II) функциональный вариант аминокислотной последовательности, представленной в подпункте(I), последовательность которого на 60%, предпочтительно по меньшей мере на 70%, предпочтительно по меньшей мере на 80%, предпочтительно по меньшей мере на 90%, предпочтительно по меньшей мере на 95% идентична референс-последовательности, представленной в подпункте (I), и сохраняющий в значительной степени такую же каталитическую функцию. Изобретение относится также к полинуклеотиду, содержащему нуклеотидную последовательность,которая кодирует один или несколько указанных выше полипептидов. Другим вариантом осуществления изобретения является полинуклеотид, содержащий:(I) нуклеотидную последовательность, кодирующую SEQ ID NO: 27 или ее функциональный вариант; и(II) нуклеотидную последовательность, кодирующую SEQ ID NO: 29 или ее функциональный вариант. Указанный полинуклеотид может содержать также нуклеотидную последовательность, кодирующую SEQ ID NO: 63 или ее функциональный вариант. В конкретном варианте осуществления изобретения указанный полинуклеотид выделяют из штамма Chondromyces crocatus NPH-MB180, который имеет регистрационный номер DSM 19329. Изобретение относится также к экспрессионному вектору, содержащему полинуклеотид, описанный выше в одном из вариантов осуществления изобретения, в котором открытые рамки считывания функционально связаны с контролирующими транскрипцию и трансляцию последовательностями. Следующим вариантом осуществления изобретения является клетка-хозяин, трансфектированная и экспрессирующая полинуклеотид или экспрессионный вектор, описанный выше в одном из вариантов осуществления изобретения, прежде всего клетка-хозяин, предназначенная для гетерологичного производства соединения формулы (I) или (I') или соединения формул (II)-(VII), (XI)-(XIV) и (XVII), и (XVIII). Другим вариантом осуществления изобретения является способ получения соединения формулы (I) или (I') или соединения формул (II)-(VII), (XI)-(XIV) и (XVII), и (XVIII), заключающийся в том, что культивируют клетку-хозяина, описанную в предыдущем варианте осуществления изобретения, в условиях, в которых образуется указанное соединение. Одним из вариантов осуществления изобретения является антитело, которое специфически связывается с полипептидом или с NRPS, или доменами NRPS, описанными выше в одном из вариантов осуществления изобретения, и применение указанного антитела, например, для очистки полипептида илиNRPS. Одним из вариантов осуществления изобретения является фармацевтическая композиция, содержащая полинуклеотид, вектор, полипептид, NRPS или домены NRPS, или антитело, описанные выше в одном из вариантов осуществления изобретения. Одним из вариантов осуществления изобретения является фармацевтическая композиция, содержащая депсипептиды формулы (I) или (I'), полученные путем культивирования рекомбинантной клеткихозяина, которая содержит полинуклеотиды, предлагаемые в изобретении, описанные выше в одном из вариантов осуществления изобретения. Одним из вариантов осуществления изобретения являются депсипептиды формулы (I) или (I'),предназначенные для приготовления фармацевтической композиции, применяемой с целью лечения и/или диагностики заболевания или состояния, т.е. атопического дерматита. В одном из конкретных вариантов осуществления изобретения депсипептиды формулы (I) или (I') являются селективными ингибиторами человеческого калликреина (hK7) и эластазы, прежде всего селективным ингибитором человеческого калликреина (hK7), который обладает ферментативной активностью, прежде всего активностью сериновой протеазы. Следующим вариантом осуществления изобретения является биосинтетический генный кластер,кодирующий NRPS, которая участвует в образовании соединения формулы (I) или (I'), содержащий полинуклеотид, описанный выше в одном из вариантов осуществления изобретения. Другим вариантом осуществления изобретения является полинуклеотидная последовательность,описанная выше в одном из вариантов осуществления изобретения, предназначенная для идентификации биосинтетического генного кластера, предлагаемого в изобретении, который можно получать с помощью способа, заключающегося в том, что (а) конструируют нуклеотидную библиотеку, состоящую из геномной ДНК штамма Chondromyces crocatus или родственного штамма; (б) культивируют штаммы библиотеки в виде колоний; и (в) анализируют рост колоний с помощью молекулы-зонда, основой которой является полинуклеотид, описанный выше в одном из вариантов осуществления изобретения, с целью идентификации клонов, содержащих генный кластер NRPS, и (I') идентифицируют генный кластерNRPS. Сущность настоящего изобретения состоит в создании биосинтетического кластера или его функциональных фрагментов, участвующих в биосинтезе депсипептидов формулы (I) или (I'), прежде всего депсипептидов формул (II)-(VII), (XI)-(XIV) и (XVII), и (XVIII). Наиболее важным является тот факт, что идентификацию биосинтетического кластера для депсипептида формулы (I) или (I') можно использовать для гетерологичной экспрессии указанного(ых) депсипептида(ов). Подразумевается, что понятие нерибосомальные пептиды относится к классу пептидов, принадлежащему к семейству сложных встречающихся в естественных условиях продуктов, построенных из простых аминокислотных мономеров. Они синтезируются в организме многих бактерий и грибов с помощью крупных многофункциональных белков, называемых нерибосомальными пептидсинтетазами(NRPS). Уникальной особенностью системы NRPS является способность синтезировать пептиды, которые содержат протеиногенные, а также непротеиногенные аминокислоты. Подразумевается, что понятие нерибосомальная пептидсинтаза (NRPS) относится к крупному многофункциональному белку, который организован в виде координированных групп активных центров,называемых модулями, при этом каждый модуль необходим для катализа одного индивидуального цикла увеличения длины продукта и модификации этой функциональной группы. Количество и порядок расположения модулей, и тип доменов, присутствующих в модуле у каждой NRPS, определяет структурную вариацию образовавшегося пептидного продукта, задавая количество, порядок расположения, выбор аминокислот, подлежащих включению, и модификацию, ассоциированную с конкретным типом удлинения. Понятие домен относится к функциональной части белка, важной для каталитической активности. Указанные домены являются консервативными среди обладающих одинаковой каталитической активностью ферментов из различных видов. Минимальный набор доменов, необходимых для цикла удлинения, состоит из модуля, включающего домены аденилирования (А), тиолирования (Т) или пептидильный белок-носитель (РСР) и домен конденсации (С). Домен аденилирования ответственен за выбор субстрата и ковалентную фиксацию на фосфопантетеиновом плече Т-домена в виде сложного тиоэфира посредством промежуточного продукта, представляющего собой производное АМФ. С-домен катализирует образование пептидной связи между аминоацил- или пептидил-S-PCP из расположенного в обратном направлении модуля и аминоацильным остатком, прикрепленным к РСР в соответствующем расположенном в прямом направлении модуле. Результатом является удлинение пептида на один остаток, фиксированный на РСР-домене в расположенном в прямом направлении модуле. Может присутствовать необязательный модифицирующий домен, предназначенный для эпимеризации,N-метилирования и гетероциклизации субстрата. Модули могут находиться на одной или нескольких полипептидных цепях. Во многих случаях в последнем модуле присутствует крайний С-концевой тиоэстеразный (ТЕ) домен, который ответственен за высвобождение/циклизацию конечного продукта. 1. Полинуклеотиды, кодирующие биосинтетические генные кластеры, предназначенные для получения соединения формулы (I) или (I') Ниже в табл. 1 описаны конкретные примеры полинуклеотидов биосинтетических генных кластеров, предназначенных для получения соединения формулы (I) или (I'), и соответствующие им функции и аминокислотные последовательности. Таблица 1. Открытые рамки считывания и функциональные домены биосинтетического генного кластера, предназначенного для синтеза депсипептидов Координаты даны в виде положений нуклеотидов в каркасе биосинтетического генного кластера Выделенный биосинтетический генный кластер для синтеза депсипептидов формулы (I) или (I') состоит из 8 открытых рамок считывания (ОРС), включая ОРС 6 и ОРС 7, которые кодируют нерибосомальную пептидсинтетазу, обозначенную также как NRPS1 и NRPS2. NRPS1 и NRPS2 содержат NRPSдомены, и их соответствующая предполагаемая функция указана в табл. 1. Значение понятий полинуклеотид(ы) , полинуклеотидная последовательность и полипептид хорошо известно в данной области, и эти понятия, если специально не указано иное, применяют в зависимости от контекста настоящего изобретения (например, касательно SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15,16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60, 62 соответственно). Например, понятие полинуклеотидная последовательность в контексте настоящего описания относится ко всем формам встречающихся в естественных условиях или полученных рекомбинантно типов нуклеиновых кислот и/или нуклеотидных последовательностей, а также к химически синтезированным нуклеиновым кислотам и/или нуклеотидным последовательностям. Под это понятие подпадают также аналоги нуклеиновых кислот и производные нуклеиновых кислот, такие, например, как замкнутая ДНК, ПНК(пептидная нуклеиновая кислота), олигонуклеотидтиофосфаты и замещенные рибоолигонуклеотиды. Кроме того, понятие полинуклеотидная последовательность относится также к любой молекуле, которая содержит нуклеотиды или нуклеотидные аналоги. Предпочтительно понятие полинуклеотидная последовательность относится к молекуле нуклеиновой кислоты, т.е. к дезоксирибонуклеиновой кислоте (ДНК) и/или рибонуклеиновой кислоте (РНК). Полинуклеотидную последовательность в контексте настоящего изобретения можно получать с помощью методов химического синтеза, известных обычному специалисту в данной области, или с помощью технологии рекомбинантной ДНК, или можно выделять из встречающихся в естественных условиях источников, или применять комбинацию этих методов. ДНК и РНК могут необязательно содержать не встречающиеся в естественных условиях нуклеотиды и могут быть одно- или двухцепочечными. Понятие полинуклеотидная последовательность относится также к смысловой и антисмысловой ДНК и РНК, что означает полинуклеотидную последовательность, которая является комплементарной конкретной последовательности нуклеотидов в ДНК и/или РНК. Кроме того, понятие полинуклеотидная последовательность может относиться к ДНК или РНК,или их гибридам, или любой их модификации, известной в данной области (см., например, примеры модификаций в US 5525711, US 4711955, US 5792608 или ЕР 302175). Полинуклеотидная последовательность может быть одно- или двухцепочечной, линейной или кольцевой, встречающейся в естественных условиях или синтетической и не имеет никакого ограничения с позиций размера. Например, полинуклеотидная последовательность может представлять собой геномную ДНК, кДНК, мРНК, антисмысловую РНК, рибозим или ДНК, которая кодирует указанные РНК или химеропласты (Gamper, Nucleic Acids Research, 28, 2000, сс. 4332-4339). Указанная полинуклеотидная последовательность может иметь форму плазмидной или вирусной ДНК или РНК. Понятие полинуклеотидная последовательность может относиться также к олигонуклеотиду(ам), в который(ые) включают любые модификации, известные в данной области, такие как фосфотиоаты или пептидные нуклеиновые кислота (ПНК). Понятия генный кластер или биосинтетический генный кластер относятся к группе генов или их вариантов, которые участвуют в биосинтезе депсипептидов формулы (I) или (I'). Для генетической модификации генного кластера или биосинтетического генного кластера используют любые методы генетической рекомбинации, известные в данной области, такие как мутагенез, инактивация или замена нуклеиновых кислот, которые можно применять для создания вариантов соединений формулы (I) или(I'). Кодирующая последовательность ДНК или нуклеотида или последовательность, кодирующая конкретный полипептид или белок, представляет собой последовательность ДНК, которая транскрибируется и транслируется в полипептид или белок, когда ее помещают под контроль соответствующих регуляторных последовательностей. В конкретном варианте осуществления изобретения полинуклеотиды, предлагаемые в настоящем изобретении (например, SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40,42, 44, 46, 48, 50, 52, 54, 56, 58, 60, 62 соответственно), можно применять в комбинации. В альтернативном варианте изобретение относится к фрагменту или функциональному варианту SEQ ID NO: 1, 3, 5, 7,9, 11, 13, 15, 16, 18, 20, 22, 24, 26, 28, 30, 32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60, 62. В контексте полинуклеотидных последовательностей понятие ее фрагмент или ее функциональный фрагмент относится к конкретному(ым) фрагменту(ам) или мутантному варианту молекул нуклеиновых кислот. Фрагмент полинуклеотида может, например, кодировать полипептид, предлагаемый в настоящем изобретении (например, полипептид, последовательность которого представлена в SEQ IDNO: 2, 4, 6, 8, 10, 12 или 14), который имеет по меньшей мере одну аминокислотную делецию, если этот полипептид сохраняет практически такую же функцию, что и полипептид дикого типа (функция каждого полипептида более подробно описана в табл. 1 и на фиг. 2). Указанный укороченный полипептид можно рассматривать в качестве функционального фрагмента полипептида, предлагаемого в настоящем изобретении (например, последовательность которого представлена в SEQ ID NO: 2, 4, 6, 8, 10, 12 или 14, 17,19, 21, 23, 25, 27, 29, 31, 33, 35, 37, 39, 41, 43, 45, 47, 49, 51, 53, 55, 57, 59,61,63). Функциональный вариант полинуклеотида может, например, кодировать полипептид, предлагаемый в настоящем изобретении (например, полипептид, последовательность которого представлена в SEQID NO: 2, 4, 6, 8, 10, 12 или 14, 17, 19, 21, 23, 25, 27, 29, 31, 33, 35, 37, 39, 41, 43, 45, 47, 49, 51, 53, 55, 57,59, 61, 63), имеющий по меньшей мере одну аминокислотную замену или добавление, если этот полипептид практически сохраняет такую же функцию, что и полипептид дикого типа (функция каждого полипептида более подробно описана в табл. 1 и на фиг. 2). Указанный укороченный полипептид можно рассматривать в качестве функционального фрагмента полипептида, предлагаемого в настоящем изобретении (например, последовательность которого представлена в SEQ ID NO 2, 4, 6, 8, 10, 12 или 14, 17, 19,21, 23, 25, 27, 29, 31, 33, 35, 37, 39, 41, 43, 45, 47, 49, 51, 53, 55, 57, 59, 61, 63). Последовательность функциональных вариантов полинуклеотида/полипептида, предлагаемого в изобретении, идентична по меньшей на 50, 55, 60%, предпочтительно по меньшей мере 70%, более предпочтительно по меньшей мере на 80, 85, 90, 95 и наиболее предпочтительно по меньшей мере 99% соответствующим исходным полинуклеотидным/полипептидным последовательностям, представленным в табл. 1. Например, полипептид идентичен/гомологичен по меньшей мере на 50, 55 60%, предпочтительно по меньшей мере 70%, более предпочтительно по меньшей мере 80, 85, 90, 95% и наиболее предпочтительно по меньшей мере 99% полипептиду, последовательность которого представлена в SEQ ID NO 2, 4,6, 8, 10, 12 или 14, 17, 19, 21, 23, 25, 27, 29, 31, 33, 35, 37, 39, 41, 43, 45, 47, 49, 51, 53, 55, 57, 59, 61, 63 соответственно. Касательно нуклеотидной последовательности нерибосомальных пептидсинтетаз (NRPS) или других ОРС, описанных в табл. 1, понятие фрагмент в контексте настоящего описания означает нуклеотидную последовательность, состоящую по меньшей мере из 7, по меньшей мере из 10, по меньшей мере из 15, по меньшей мере из 20, по меньшей мере из 30, по меньшей мере из 50, по меньшей мере из 100,по меньшей мере из 150, по меньшей мере из 200, по меньшей мере из 250, по меньшей мере из 300, по меньшей мере из 350, по меньшей мере из 400, по меньшей мере из 450, по меньшей мере из 500, по меньшей мере из 550, по меньшей мере из 600, по меньшей мере из 650 или по меньшей мере из 700 нуклеотидов. Понятие гибридизуется в контексте настоящего описания относится к гибридизации в общепринятых условиях гибридизации, предпочтительно в строгих условиях, описанных, например, у Sambrook иRussell, Molecular Cloning: A Laboratory Manual, CSH Press, Cold Spring Harbor, NY, USA, 2001. Если специально не указано иное, то условия предпочтительно являются нестрогими. Условия гибридизации можно создавать с использованием стандартных протоколов, описанных, например, у Sambrook, 2001(см. выше). Определение условий хорошо известно специалисту в данной области, и это определение можно осуществлять согласно протоколам, известным в данной области. Так, для выявления только специфически гибридизующихся последовательностей, как правило, требуются строгие условия гибридизации и отмывки. В качестве примера можно осуществлять гибридизацию в следующих очень строгих условиях (но, не ограничиваясь только ими): буфер для гибридизации: 2SSC; 10 раствор Денхарда (Фиколл 400 + ПЭГ + БСА; соотношение 1:1:1); 0,1% ДСН; 5 мМ ЭДТК; 50 мМ Na2HPO4; 250 мкг/мл ДНК спермы сельди; 50 мкг/мл тРНК; или 0,25 М натрий-фосфатный буфер, рН 7,2; 1 М ЭДТК, 7% ДСН Гибридизацию в расслабленных условиях для выявления гомологии или не полностью комплементарных последовательностей можно, например, осуществлять, используя 6SSC, 1% ДСН, при 65 С. Как хорошо известно, длина зонда и состав подлежащей определению нуклеиновой кислоты представляют собой дополнительные параметры условий гибридизации. Полинуклеотидные последовательности, которые обладают способностью гибридизоваться с полинуклеотидными последовательностями, представленными в настоящем описании, также подпадают под объем изобретения и их можно выделять, например, из геномных библиотек или библиотек кДНК животных или из библиотек ДНК микроорганизмов. Предпочтительно указанные полинуклеотиды получают из микроорганизмов, прежде всего микроорганизмов, принадлежащих к классу протеобактерий, прежде всего дельта-протеобактерий, прежде всего Myxococcales, прежде всего Sorangiineae, прежде всегоPolyangiaceae, но наиболее предпочтительно Chondromyces, например Chondromyces crocatus или из его улучшенного штамма. Альтернативно этому указанные варианты нуклеотидных последовательностей, предлагаемых в изобретении, можно получать с помощью генной инженерии или химического синтеза. Указанные полинуклеотидные последовательности, обладающие способностью гибридизоваться, можно идентифицировать и выделять с использованием полинуклеотидных последовательностей, представленных в настоящем описании, или их частей или обратных комплементов, например, с помощью гибридизации на основе стандартных методов (см., например, Sambrook и Russell, Molecular Cloning: A Laboratory Manual, издво CSH Press, Cold Spring Harbor, NY, USA, 2001). Нуклеотидные последовательности, содержащие одинаковые или практически одинаковые нуклеотидные последовательности, представленные в перечне последовательностей, или их части/фрагменты, можно применять, например, в качестве зондов для гибридизации. Фрагмент можно применять также в качестве зонда или праймера для диагностирования, секвенирования или клонирования генного кластера NRPS. Применяемые в качестве зондов для гибридизации фрагменты могут представлять собой также синтетические фрагменты, полученные с помощью обычных методов синтеза, последовательности которых практически идентичны нуклеотидной последовательности, предлагаемой в изобретении. В контексте настоящего описания процент идентичности между двумя последовательностями представляет собой функцию количества идентичных положений, характерных для последовательностей (т.е.% идентичности = количество идентичных положений/общее количество положений х 100), принимая во внимание количество брешей и длину каждой бреши, которую необходимо интродуцировать для оптимального выравнивания двух последовательностей. Сравнение последовательностей и определение процента идентичности двух последовательностей определяют с помощью описанного ниже математического алгоритма. Предпочтительно степень идентичности/гомологии определяют путем сравнения соответствующей последовательности с нуклеотидными последовательностями, перечисленными в перечне последовательностей (SEQ ID NO:). Когда сравниваемые последовательности имеют неодинаковую длину, степень гомологии предпочтительно означает процент нуклеотидных остатков в более короткой последовательности, которые идентичны нуклеотидным остаткам в более длинной последовательности. Степень гомологии можно определять с помощью известных компьютерных программ, таких как программа DNASTAR, с использованием процедуры анализа ClustalW. Эту программу можно получать от фирмы DNASTAR, Inc., 1228 South Park Street, Madison, WI 53715 или от фирмы DNASTAR, Ltd., Abacus House, WestEaling, London W13 0AS UK (supportdnastar.com), и она доступна на сервере на узле EMBL сети. При использовании метода анализа Clustal для решения вопроса о том, является ли конкретная последовательность идентичной референс-последовательности, например, на 80%, для сравнений аминокислотных последовательностей предпочтительно следует применять следующие установки: матрица:blosum 30; штраф за открытие бреши: 10,0; штраф за удлинение бреши: 0,05; отсрочка выравнивания различающихся последовательностей (Delay divergent): 40; разделяющее брешь расстояние: 8. Для сравнений нуклеотидных последовательностей штраф за удлинение бреши предпочтительно устанавливают на уровне 5,0. Если две нуклеотидные последовательности, подлежащие сравнению при сравнительном анализе последовательностей, отличаются по длине, то понятие идентичность относится к более короткой последовательности и части более длинной последовательности, которая совпадает с более короткой последовательностью. Другими словами, когда сравниваемые последовательности имеют разную длину, то степень идентичности предпочтительно либо относится к проценту нуклеотидных остатков в более короткой последовательности, идентичных нуклеотидным остаткам в более длинной последовательности, или к проценту нуклеотидов в более длинной последовательности, идентичных по нуклеотидной последовательности в более короткой последовательности. В этом контексте специалист в данной области легко может определять положения части более длинной последовательности, совпадающей с более короткой последовательностью. В целом, специалисту в данной области известно, какие молекулы нуклеиновых кислот можно получать, например, из встречающихся в естественных условиях источниках, или можно получать с помощью методов синтеза или рекомбинации, таких как ПЦР. Эти молекулы нуклеиновых кислот, включая модифицированные или дериватизированные молекулы нуклеиновых кислот, можно получать с помощью методов, описанных в соответствующей литературе. Кроме того, идентичность означает, что существует функциональная и/или структурная эквивалентность между соответствующей нуклеотидной последовательностью или соответственно полипептидами(например,кодируемыми этой последовательностью полипептидами). Нуклеотидные/аминокислотные последовательности, которые идентичны по меньшей мере на 50, 55, 60%, предпочтительно по меньшей мере на 70%, более предпочтительно по меньшей мере на 80, 85, 90, 95% и наиболее предпочтительно по меньшей мере на 99% представленным в настоящем описании конкретным нуклеотидным/аминокислотным последовательностям, могут представлять производные/варианты этих последовательностей, которые предпочтительно обладают такой же биологической функцией. Они могут представлять собой либо встречающиеся в естественных условиях варианты, например, последовательности из других экотипов, сортов, видов и т.д., или мутации, и указанные мутации могут образовываться в естественных условиях или могут быть получены посредством преднамеренного мутагенеза. Кроме того, вариации могут представлять собой полученные путем синтеза последовательности. Аллельные варианты могут представлять собой встречающиеся в естественных условиях варианты или полученные с помощью синтеза варианты или варианты, полученные методами рекомбинантной ДНК. Отклонения от вышеописанных полинуклеотидов можно получать, например, с помощью делеции, замены, добавления,инсерции и/или рекомбинации. Понятие добавление относится к встраиванию по меньшей мере одного остатка нуклеиновой кислоты/аминокислоты на конец данной последовательности, а понятие инсерция относится к встраиванию по меньшей мере одного остатка нуклеиновой кислоты/аминокислоты внутрь данной последовательности. Варианты полипептидов и, в частности, полипептиды, кодируемые различными вариантами нуклеотидных последовательностей, предлагаемых в изобретении, предпочтительно обладают определенными общими характеристиками. К таким характеристикам относятся, например, биологическая активность, молекулярная масса, иммунологическая реактивность, конформация и т.д., и физические свойства,такие, например, как миграционное поведение при осуществлении гель-электрофореза, хроматографическое поведение, коэффициенты седиментации, растворимость, спектроскопические свойства, стабильность, оптимальное значение рН, температурный оптимум и т.д. Одним из конкретных вариантов осуществления изобретения является полинуклеотид, который кодирует один или несколько экспрессионных продуктов, которые сохраняют активность одного или нескольких следующих NRPS1-доменов:(VIII) домен аденилирования лейцина, имеющий последовательность SEQ ID NO:45. Одним из конкретных вариантов осуществления изобретения является полинуклеотид, который ко- 10020118 дирует один или несколько экспрессионных продуктов, которые сохраняют активность всех указанных выше NRPS1-доменов. Альтернативным вариантом осуществления изобретения является полинуклеотид, который кодирует один или несколько экспрессионных продуктов, которые сохраняют активность всех указанных вышеNRPS1-доменов, за исключением того, что один, два или три домена аденилирования заменены на один или несколько доменов аденилирования, имеющих другую аминокислотную специфичность. Другим конкретным вариантом осуществления изобретения является полинуклеотид, который кодирует один или несколько экспрессионных продуктов, которые сохраняют активность одного или нескольких следующих NRPS2-доменов:(XIV) домен тиолирования, имеющий последовательность SEQ ID NO: 59; и/или,(XV) тиоэстеразный домен, имеющий последовательность SEQ ID NO: 61. Одним из конкретных вариантов осуществления изобретения является полинуклеотид, который кодирует один или несколько экспрессионных продуктов, которые сохраняют активность всех указанных выше NRPS2-доменов. Альтернативным вариантом осуществления изобретения является полинуклеотид,который кодирует один или несколько экспрессионных продуктов, которые сохраняют активность всех указанных выше NRPS2-доменов, за исключением того, что один, два, три или четыре домена аденилирования заменены на другой домен аденилирования, имеющий другую аминокислотную специфичность. Предполагается, что ОРС 6, кодирующая NRPS1, ОРС 7, кодирующая NRPS2, и ОРС 8, кодирующая цитохром Р 450, кодируют ферменты, имеющие решающее значение для биосинтеза депсипептидов формулы (I) или (I'). Таким образом, следующим объектом настоящего изобретения является полинуклеотид,содержащий:(I) нуклеотидную последовательность, которая кодирует SEQ ID NO: 27 (NRPS1) или ее функциональный вариант; и(II) нуклеотидную последовательность, которая кодирует SEQ ID NO: 29 (NRPS2) или ее функциональный вариант. Полинуклеотид может содержать также нуклеотидную последовательность, кодирующую SEQ IDNO: 63 или ее функциональный вариант. В одном из конкретных вариантов осуществления изобретения указанные полинуклеотиды выделяют из штамма Chondromyces crocatus NPH-MB180, который имеет регистрационный номер DSM 19329. 2. NRPS и другие полипептиды, участвующие в формировании соединения формулы (I) или (I') Изобретение относится также к полипептидам, кодируемым полинуклеотидами, предлагаемыми в изобретении, в частности, к представленным в табл. 1, например, NRPS1 и NRPS2. Изобретение относится также к их функциональному фрагменту и функциональному варианту. Настоящее изобретение относится также к вариантам полипептидов, последовательность которых представлена в SEQ ID NOS: 2, 4, 6, 8, 10, 12, 14, 17, 19, 21, 23, 25, 27, 29, 31, 33, 35, 37, 39, 41, 43, 45, 47,49, 51, 53, 55, 57, 59, 61, 63, или фрагментам, содержащим по меньшей мере 50, 75, 100, 150, 200, 300, 400 или 500 их последовательно расположенных аминокислот. Понятие вариант включает производные или аналоги этих полипептидов. В частности, варианты могут отличаться по аминокислотной последовательности от полипептидов, имеющих последовательность SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 17, 19, 21, 23,25, 27, 29, 31, 33, 35, 37, 39, 41, 43, 45, 47, 49, 51, 53, 55, 57, 59, 61, 63, на 1, 2, 3, 4, 5 или большее количество замен, добавлений, делеций, слияний и укорочений, которые могут присутствовать в любой комбинации. Варианты могут представлять собой встречающиеся в естественных условиях или созданные in vitro. В частности, указанные варианты можно создавать, используя методы генной инженерии, такие как сайтнаправленный мутагенез, случайный химический мутагенез, процедуры делеций с использованием экзонуклеазы III, и стандартные методы клонирования. В альтернативном варианте такие варианты,фрагменты, аналоги или производные можно создавать с помощью процедур химического синтеза или модификации. Специалистам в данной области известны также другие методы создания вариантов. Они включают процедуры, с помощью которых нуклеотидные последовательности, полученные из природных изолятов,модифицируют для создания нуклеиновых кислот, которые кодируют полипептиды, обладающие характеристиками, которые повышают их ценность при промышленном применении или в лабораторных условиях. При применении таких процедур создают и характеризуют большое количество последовательностей вариантов, отличающихся одним или несколькими нуклеотидами относительно последовательности, полученной из природного изолята. Предпочтительно эти нуклеотидные различия приводят к изменениям аминокислот относительно полипептидов, кодируемых нуклеиновыми кислотами их природных изолятов. Например, варианты можно создавать с помощью ПЦР пониженной точности. При осуществлении ПЦР пониженной точности амплификацию ДНК осуществляют в условиях, в которых точность ДНКполимеразы является низкой, в результате этого имеет место высокий уровень точечных мутаций по всей длине ПЦР-продукта. ПЦР пониженной точности описана у Leung D.W. и др., Technique, 1, 1989, cc. 1115 и Caldwell R. С. и Joyce G.F., PCR Methods Applic, 2, 1992, cc. 28-33. Варианты можно создавать также,используя сайтнаправленный мутагенез для получения сайтспецифических мутаций в любом представляющим интерес клонированном сегменте ДНК. Мутагенез с использованием олигонуклеотидов описан у Reidhaar-Olson J.F. и Sauer R.T. и др., Science, 241, 1988, cc. 53-57. Варианты можно создавать также,используя стратегии направленной эволюции, например, описанные в US 6361974 и 6372497. Варианты полипептидов, последовательности которых представлены в SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, могут представлять собой варианты, в которых 1, 2, 3, 4, 5 или большее количество аминокислотных остатков полипептидов, последовательности которых представлены в SEQ ID NOS: 2, 4, 6, 8, 10, 12, 14, 17, 19, 21, 23,25, 27, 29, 31, 33, 35, 37, 39, 41, 43, 45, 47, 49, 51, 53, 55, 57, 59, 61, 63, заменены на консервативные или неконсервативные аминокислотные остатки (предпочтительно на консервативный аминокислотный остаток), при этом такой замененный аминокислотный остаток может кодироваться или не кодироваться генетическим кодом. Консервативные замены представляют собой случаи, когда осуществляют замену данной аминокислоты в полипептиде на другую аминокислоту, имеющую сходные характеристики. Как правило, в качестве консервативных замен рассматриваются следующие замены: замена алифатической аминокислоты, такой как Ala, Val, Leu и Ile, на другую алифатическую аминокислоту; замена Ser на Thr или наоборот; замена кислого остатка, такого как Asp или Glu, на другой кислый остаток; замена остатка, несущего амидную группу, такого как Asn или Gln, на другой остаток, несущий амидную группу; замена основного остатка, такого как Lys или Arg, на другой основный остаток; и замена ароматического остатка, такого как Phe или Tyr, на другой ароматический остаток. Другие варианты представляют собой случаи, когда один или несколько аминокислотных остатков полипептидов, последовательности которых представлены в SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 17, 19, 21,23, 25, 27, 29, 31, 33, 35, 37, 39, 41, 43, 45, 47, 49, 51, 53, 55, 57, 59, 61, 63, включают замещающую группу. Кроме того, другие варианты представляют собой случаи, когда полипептид ассоциируют с другим соединением, например соединением, предназначенным для увеличения времени полужизни полипептида (например, полиэтиленгликолем). Дополнительные варианты представляют собой случаи, когда дополнительные аминокислоты сливают с полипептидом, например лидерную последовательность, секреторную последовательность, последовательность пропротеина или последовательность, которая облегчает очистку, обогащение или стабилизацию полипептида. В некоторых вариантах осуществления изобретения фрагменты, производные и аналоги сохраняют такую же биологическую функцию или активность, которая присуща полипептидам, последовательности которых представлены в SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 17, 19, 21, 23, 25, 27, 29, 31, 33, 35, 37, 39, 41,43, 45, 47, 49, 51, 53, 55, 57, 59, 61, 63. Понятие его фрагмент в контексте настоящего описания касательно полипептидов относится к функциональному фрагменту, который обладает практически такой же(биологической) активностью, что и полипептиды, предлагаемые в настоящем изобретении (например,последовательности которых представлены в SEQ ID NO: 2, 4, 6, 8, 10, 12 или 14, 17, 19, 21, 23, 25, 27,29, 31, 33, 35, 37, 39, 41, 43, 45, 47, 49, 51, 53, 55, 57, 59, 61, 63 соответственно), которые могут кодироваться полинуклеотидами, предлагаемыми в настоящем изобретении (например, полинуклеотидами, последовательности которых представлены в SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 16, 18, 20, 22, 24, 26, 28, 30,32, 34, 36, 38, 40, 42, 44, 46, 48, 50, 52, 54, 56, 58, 60, 62 соответственно). В других вариантах осуществления изобретения фрагменты, производные и аналоги сохраняют такую же биологическую функцию или активность, которая присуща полипептидам, последовательности которых представлены в SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 17, 19, 21, 23, 25, 27, 29, 31, 33, 35, 37, 39, 41,43, 45, 47, 49, 51, 53, 55, 57, 59, 61, 63, за исключением того, что по меньшей мере 1, 2, 3, 4, 5, 6 или 7 доменов аденилирования заменены на другой домен аденилирования, придавая другую аминокислотную специфичность. В других вариантах осуществления изобретения фрагмент, производное и/или аналог включает слитую гетерологичную последовательность, которая облегчает очистку, обогащение, выявление, стабилизацию или секрецию полипептида, которую можно ферментативно отщеплять, полностью или частично, от фрагмента, производного или аналога. Другим объектом настоящего изобретения являются полипептиды или их фрагменты, которые идентичны по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90% или по меньшей мере на 95% одному из полипептидов, последовательность которого представлена в SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 17, 19, 21, 23, 25, 27, 29, 31, 33, 35, 37, 39, 41, 43, 45, 47, 49,51, 53, 55, 57, 59, 61, 63, или его фрагментам, содержащим по меньшей мере 50, 75, 100, 150, 200, 300,400 или 500 последовательно расположенных его аминокислот. Должно быть очевидно, что идентичность аминокислот подразумевает возможность наличия описанных выше консервативных замен. Полипептиды или фрагменты, гомологичные одному из полипептидов, последовательность которого представлена в SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 17, 19, 21, 23, 25, 27, 29, 31, 33, 35, 37, 39, 41, 43, 45,47, 49, 51, 53, 55, 57, 59, 61, 63, или его фрагментам, содержащим по меньшей мере 50, 75, 100, 150, 200,300, 400 или 500 последовательно расположенных его аминокислот, можно получать путем выделения кодирующих их нуклеиновых кислот с помощью описанных выше методов. В альтернативном варианте гомологичные полипептиды или фрагменты можно получать с помощью процедур биохимического обогащения или очистки. Последовательность, потенциально гомологичную полипептидам или фрагментам, можно определять с помощью протеолитического расщепления,гель-электрофореза и/или микросеквенирования. Последовательность предполагаемого гомологичного полипептида или фрагмента можно сравнивать с одним из полипептидов, последовательности которых представлена в SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 17, 19, 21, 23, 25, 27, 29, 31, 33, 35, 37, 39, 41, 43, 45, 47,49, 51, 53, 55, 57, 59, 61, 63, или его фрагментов, содержащих по меньшей мере 50, 75, 100, 150, 200, 300,400 или 500 последовательно расположенных его аминокислот. Полипептиды, последовательности которых представлены в SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 17, 19,21, 23, 25, 27, 29, 31, 33, 35, 37, 39, 41, 43, 45, 47, 49, 51, 53, 55, 57, 59, 61, 63, или их фрагменты, содержащие по меньшей мере 50, 75, 100, 150, 200, 300, 400 или 500 последовательно расположенных аминокислот, или по меньшей мере 40, 50, 75, 100, 150, 200 или 300 последовательно расположенных аминокислот, можно применять для различных целей. Например, полипептиды или их фрагменты, производные или аналоги можно применять для катализа биохимических реакций согласно методу, представленному в настоящем описании. Полипептиды, последовательности которых представлены в SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 17, 19,21, 23, 25, 27, 29, 31, 33, 35, 37, 39, 41, 43, 45, 47, 49, 51, 53, 55, 57, 59, 61, 63, или их фрагменты, содержащие по меньшей мере 50, 75, 100, 150, 200, 300, 400 или 500 последовательно расположенных их аминокислот, можно применять для создания антител, которые специфически связываются с полипептидами или фрагментами, производными или аналогами. В конкретном варианте осуществления изобретения полипептиды, предлагаемые в настоящем изобретении (например, последовательности которых представлены в SEQ ID NO: 2, 4, 6, 8, 10, 12 или 14,17, 19, 21, 23, 25, 27, 29, 31, 33, 35, 37, 39, 41, 43, 45, 47, 49, 51, 53, 55, 57, 59, 61, 63 соответственно),можно использовать в комбинации. Понятие активность или функциональность в контексте настоящего описания относится, прежде всего, к способности полипептида(ов) или его(их) фрагмента(ов) проявлять ферментативную активность, например, активность пептидсинтазы NRPS1 и NRPS2. Специалисту в данной области должно быть очевидно, что (биологическая) активность или функциональность, указанная в настоящем описании, часто коррелирует с уровнем экспрессии (например, белка/мРНК). Если не указано иное, то понятие экспрессия в контексте настоящего описания относится к экспрессии молекулы нуклеиновой кислоты,кодирующей полипептид/белок (или его фрагмент), предлагаемый в изобретении, где активность относится к активности указанного полипептида/белка. Методы/анализы, предназначенные для определения активности полипептидов, предлагаемых в настоящем изобретении, хорошо известны в данной области. 3. Экспрессионные векторы, рекомбинантные клетки-хозяева и методы получения депсипептидов формулы (I) или (I') Представленные в настоящем описании полинуклеотиды, предлагаемые в изобретении, можно применять, например, для гетерологичной экспрессии соединения формулы (I) или (I'). В конкретных вариантах осуществления изобретения их можно применять для гетерологичной экспрессии соединений формулы (I'). Таким образом, следующим объектом настоящего изобретения является вектор, содержащий молекулы нуклеиновых кислот, представленные в настоящем описании, более конкретно экспрессионные векторы и рекомбинантные клетки-хозяева, содержащие молекулы нуклеиновых кислот и/или вектор. Понятие вектор в контексте настоящего описания относится прежде всего к плазмидам, космидам, бактериальным искусственным хромосомам (ВАС), искусственным хромосомам дрожжей, вирусам,бактериофагам и другим векторам, обычно применяемым в генетической инженерии. В предпочтительном варианте осуществления изобретения векторы, предлагаемые в изобретении, можно применять для трансформации клеток, например клеток грибов, клеток микроорганизмов, таких как дрожжевые или бактериальные клетки, или клеток животных. Понятие экспрессионный вектор относится к носителю, с помощью которого нуклеиновую кислоту можно интродуцировать в клетку-хозяина, что приводит к экспрессии интродуцированной последовательности. Как указано в настоящем описании, полипептиды можно получать, встраивая нуклеиновую кислоту, кодирующую полипептид, в вектор таким образом, чтобы функционально связывать кодирующую последовательность с последовательностью, которая обладает способностью обеспечивать экспрессию кодируемого полипептида в приемлемой клетке-хозяине. Например, экпрессионный вектор может содержать помотор, сайт связывания рибосом для инициации трансляции и терминатор транскрипции. Вектор может включать также соответствующие последовательности для модуляции уровней экспрессии, сайт инициации репликации и селектируемый маркер. Промоторы, пригодные для экспрессии полипептида или его фрагмента в бактериях, представляют собой промоторы Е. coli lac или trp, промотор lacl,промотор lacZ, промотор Т 3, промотор Т 7, промотор gpt, промотор фага лямбда PR, промотор фага лямбда PL, промоторы из оперонов, кодирующих гликолитические ферменты, такие как 3 фосфоглицераткиназа (PGK), и промотор кислой фосфатазы. Грибные промоторы включают промотор фактора. Промоторы, пригодные для экспрессии в Pseudomonas putida, включают (но, не ограничиваясь только ими) соответствующие транскрипционные промоторы семи генов 16S рРНК (РР), которые присутствуют в геноме (РР 16SA, РР 16SB, РР 16SC, РР 16SD, РР 16SE, РР 16SF, РР 16SG), транскрипционные промоторы факторов, обусловливающих устойчивость к антибиотикам, транскрипционные промоторы любого из регуляторных генов репрессора поглощения железа (Fur). Более подробное описание регуляторных промоторов репрессора поглощения железа (Fur) представлено также ниже. К промоторам эукариотических организмов относятся немедленно-ранний промотор CMV, промотор тимидинкиназыHSV, промоторы белков теплового шока, ранний и поздний промотор SV40, LTR из ретровирусов и промотор мышиного металлотионеина-I. Можно применять также другие промоторы, для которых известна их способность контролировать экспрессию генов в прокариотических или эукариотических клетках или их вирусах. Экспрессионные векторы млекопитающих могут содержать также сайт инициации репликации, любые необходимые сайты связывания рибосом, сайт полиаденилирования, донорные и акцепторные сайты сплайсинга, последовательности терминации транскрипции и 5'-фланкирующие нетранскрибируемые последовательности. В некоторых вариантах осуществления изобретения последовательности ДНК, выведенные из сайтов сплайсинга и полиаденилирования SV40, можно применять для получения требуемых нетранскрибируемых генетических элементов. Векторы для экспрессии полипептида или его фрагмента в эукариотических клетках могут содержать также энхансеры для повышения уровней экспрессии. Энхансеры представляют собой обладающие цис-активностью элементы ДНК, как правило, длиной от примерно 10 до примерно 300 пар оснований,которые действуют на промотор, повышая регулируемую им транскрипцию. Примерами являются дальний энхансер сайта инициации репликации (100-270 пар оснований) SV40, энхансер раннего промотора цитомегаловируса, дальний энхансер сайта инициации репликации полиомы и энхансеры аденовирусов. Кроме того, экспрессионные векторы предпочтительно содержат один или несколько селектируемых маркерных генов для отбора клеток-хозяев, содержащих вектор. Примерами селектируемых маркеров, которые можно применять, являются гены, кодирующие дигидрофолатредуктазу, или гены, обусловливающие устойчивость к неомицину культур эукариотических клеток, гены, обусловливающие устойчивость к тетрациклину или ампициллину у Е. coli, и ген TRP1 S. cerevisiae. Примером приемлемого маркера является кассета aacCl, обусловливающая устойчивость к гентамицину. Другие селектируемые маркеры могут включать нуклеотидную кассету, которая обусловливает устойчивость к ампициллину(например, bla), хлорамфениколу (например, cat), канамицину (например, аасС 2, aadB или другие модифицирующие аминогликозиды ферменты) или тетрациклину (например, tetA или tetB). Соответствующую последовательность ДНК можно встраивать в вектор различными методами. В целом, последовательность ДНК встраивают путем лигирования в требуемое положение в векторе после расщепления вставки и вектора соответствующими рестриктазами. В альтернативном варианте соответствующие сайты, распознаваемые рестриктазами, можно создавать в последовательности ДНК с помощью ПЦР. Различные методы клонирования описаны у Ausbel и др., Current Protocols in Molecular Biology, изд-во John Wiley 503 Sons, Inc., 1997 и у Sambrook и др., Molecular Cloning: A Laboratory Manual, 2 ое изд., изд-во Cold Spring Harbour Laboratory Press, 1989. Очевидно, что указанные и другие методы находятся в компетенции специалистов в данной области. Вектор может, например, иметь форму плазмиды, вирусной частицы или фага. Другие векторы включают производные хромосомных, нехромосомных и синтетических последовательностей ДНК, вирусов, бактериальных плазмид, фаговой ДНК, бакуловирусов, дрожжевых плазмид, векторов, полученных из комбинаций плазмид и фаговой ДНК, вирусной ДНК, например, вируса коровьей оспы, аденовируса, вируса чумы птицы и вирус ложного бешенства. Ряд клонирующих и экспрессионных векторов для применения в сочетании с прокариотическими и эукариотическими хозяевами описан у Sambrook и др.,Molecular Cloning: A Laboratory Manual, 2-ое изд., изд-во Cold Spring Harbour, N.Y., 1989. Конкретные бактериальные векторы, которые можно применять, включают поступающие в продажу плазмиды, содержащие генетические элементы хорошо известных клонирующих векторов pBR322 (ATCC 37017), рКК 223-3 (фирма Pharmacia Fine Chemicals, Уппсала, Швеция), pGEM1 (фирма Promega Biotec, Мэдисон, шт. Висконсин, США) pQE70, pQE60, pQE-9 (фирма Qiagen), pD10, phiX174, pBluescript II KS, pNH8A,pNH16a, pNH18A, pNH46A (фирма Stratagene), ptrc99a, pKK223-3, pKK233-3, pDR540, pRIT5 (фирма Pharmacia), pKK232-8 and pCM7. Конкретные эукариотические векторы включают pSV2CAT, pOG44, pXTl, pSG(фирма Stratagene) pSVK3, pBPV, pMSG и pSVL (фирма Pharmacia). Однако можно применять и любой другой вектор, если он может реплицироваться и является стабильным в клетке-хозяине. Вектор можно интродуцировать в клетки-хозяева с помощью любого из ряда методов, включая электропорацию, трансформацию, трансфекцию, трансдукцию, вирусное заражение, с помощью генных пушек или Ti-опосредуемый перенос генов. При необходимости созданные клетки-хозяева можно культивировать в общепринятых питательных средах, при необходимости модифицированных для активации промоторов, отбора трансформантов или амплификации генов, предлагаемых в настоящем изобретении. После трансформации приемлемого штамма-хозяина и выращивания штамма-хозяина до соответствующей клеточной плотности селектируемый промотор можно индуцировать соответствующими средствами(например, с помощью температурного сдвига или химической индукции) и клетки можно культивировать в течение дополнительного периода, давая им продуцировать требуемый полипептид или его фрагмент. Согласно следующему объекту изобретения рекомбинантная клетка-хозяин, предлагаемая в настоящем изобретении, обладает способностью экспрессировать или экспрессирует полипептид, кодируемый полинуклеотидной последовательностью, предлагаемой в настоящем изобретении. В конкретном варианте осуществления изобретения полипептид, присутствующий в клетке-хозяине, может быть гетерологичным относительно клетки-хозяина. Обзор примеров различных экспрессионных систем, которые можно применять для создания клетки-хозяина, предлагаемой в настоящем изобретении, например,описанной выше конкретной системы, представлен, например, у Glorioso и др., Expression of RecombinantMolecular Biology), изд-во Humana Press, USA, 2004. Трансформацию или обработку с помощью генной инженерии клетки нуклеотидной последовательностью или вектором, предлагаемой/предлагаемым в изобретении, можно осуществлять с помощью стандартных методов, описанных, например, Sambrook и Russell, Molecular Cloning: A Laboratory Manual,изд-во CSH Press, Cold Spring Harbor, NY, USA, 2001. Кроме того, клетку-хозяина, предлагаемую в настоящем изобретении, культивируют в питательных средах, требуемых для конкретной применяемой клетки-хозяина, в частности касательно значения рН, температуры, концентрации солей, аэрации, антибиотиков, витаминов, микроэлементов и т.д. Как правило, клетка-хозяин, предлагаемая в настоящем изобретении, может представлять собой прокариотическую или эукариотическую клетку, содержащую нуклеотидную последовательность, вектор и/или полипептид, предлагаемые в изобретении, или клетку, полученную из указанной клетки и содержащую нуклеотидную последовательность, вектор и/или полипептид, предлагаемые в изобретении. В предпочтительном варианте осуществления изобретения клетка-хозяин содержит, например, в результате генно-инженерной обработки нуклеотидную последовательность или вектор, предлагаемую/предлагаемый в изобретении, в таком виде, что нуклеотидные последовательности, предлагаемые в настоящем изобретении, интегрированы в ее геном. Примерами такой клетки-хозяина, предлагаемой в изобретении (но также клетки-хозяина, предлагаемой в изобретении, в целом) являются (но, не ограничиваясь только ими) бактериальная, дрожжевая, грибная, растительная, животная или человеческая клетка. Понятие клетка-хозяин или выделенная клетка-хозяин относится к микроорганизму, который несет генетическую информацию, необходимую для образования соединения формулы (I) или соединения формулы (I'), вне зависимости от того, известна ли для организма способность продуцировать указанное соединение или нет. В контексте настоящего описания понятие относится также к организмам, в которых обнаружена генетическая информация, необходимая для производства, например соединения формулы (I) или (I'), в качестве присутствующей в организме в естественных условиях, и к организмам, в которые генетическая информация интродуцирована с помощью методов рекомбинации. Клетка-хозяин может представлять собой любые клетки-хозяева, известные специалистам в данной области, включая прокариотические клетки или эукариотические клетки. В качестве репрезентативных примеров приемлемых хозяев можно упомянуть: бактериальные клетки, такие как Е. coli, Streptomyces lividans, Streptomyces griseofuscus, Streptomyces ambofaciens, Bacillus subtilis, Salmonella typhimurium, Myxococcus xanthus, Sorangium cellulosum, Chondromyces crocatus и различные виды рода Pseudomonas, Streptomyces,Bacillus и Staphylococcus, грибные клетки, такие как клетки дрожжей, клетки насекомых, такие как клетки Drosophila S2 и Spodoptera Sf9, клетки животных, такие как СНО, COS или меланомы Боуэна и аденовирусы. Выбор пригодного хозяина находится в компетенции специалистов в данной области. В качестве организмов-источников в контексте настоящего описания подразумеваются такие организмы, как протеобактерии, предпочтительно дельта-протеобактерии, более предпочтительно миксобактерии, более предпочтительно представители сем. Sorangiineae, более предпочтительно Polyangiaceae,наиболее предпочтительно Chondromyces, причем Chondromyces crocatus или его улучшенный штамм являются наиболее предпочтительными. Понятие рекомбинантная клетка-хозяин в контексте настоящего описания относится к клеткехозяину, созданной с помощью генной инженерии с использованием нуклеотидной последовательности,предлагаемой в настоящем изобретении или содержащей вектор или полипептид или его фрагмент,предлагаемый в настоящем изобретении. Изобретение позволяет получать депсипептиды формулы (I) или формулы (I') путем экспрессии в гетерологичной рекомбинантной клетке-хозяине, т.е. в штамме,отличном от встречающегося в естественных условиях штамма-продуцента. Хотя в примерах проиллюстрировано применение бактериального штамма, согласно настоящему изобретению можно применять любой организм или любую экспрессионную систему. Выбор организма зависит от задачи, стоящей перед специалистом в данной области. Например, штамм, поддающийся генетической манипуляции, можно применять для облегчения модификации и производства депсипептидных производных. В одном из конкретных вариантов осуществления изобретения клетку-хозяина выбирают из видов рода Myxococcocus или Pseudomonas, например Pseudomonas putida. В одном из более конкретных вариантов осуществления изобретения клетки-хозяева, например, Pseudomonas putida, содержат нуклеотиды,кодирующие NRPS1 (SEQ ID NO: 27) и NRPS2 (SEQ ID NO: 29) или их функциональные варианты. Клетки могут содержать также нуклеотидную последовательность, кодирующую цитохром Р 450, представленную в SEQ ID NO: 63, или функциональный вариант. Они могут содержать одну или несколькоSEQ ID NO: 17, SEQ ID NO: 18, SEQ ID NO: 21, SEQ ID NO: 23, SEQ ID NO: 25 и SEQ ID NO: 27. Предпочтительно каждая открытая рамка считывания находится под контролем функциональных транскрибируемых и транслируемых последовательностей, в результате чего эти ОРС экспрессируются в приемлемых условиях рекомбинантной клеткой-хозяином. Конкретный пример гетерологичной экспрессии вPseudomonas putida дополнительно описан в примерах ниже. Согласно вышесказанному другим вариантом осуществления изобретения является способ получения соединения формулы (I) или формулы (I'), заключающийся в том, что культивируют рекомбинантную клетку-хозяина в таких условиях, что происходит синтез соединения формулы (I) или формулы (I'),например, формул (II)-(VII), (XI)-(XIV) и (XVII), и (XVIII), и выделяют указанное соединение. В контексте настоящего описания понятие такие условия относится к условиям культивирования рекомбинантных клеток-хозяев, позволяющим экпрессировать и выделять соединение формулы (I) или соединение формулы (I'). В одном из конкретных вариантов осуществления изобретения рекомбинантная клетка-хозяин представляет собой Pseudomonas putida. В другом конкретном варианте осуществления изобретения рекомбинантная клетка-хозяин представляет собой Pseudomonas putida, и клетки выращивают при температуре ниже 30 С, например при температуре от 10 до 20 С, например, примерно при 15 С. В другом конкретном варианте осуществления изобретения питательная среда содержит изомасляную кислоту, например изомасляную кислоту в количестве от 1 до 5 г/л, например изомасляную кислоту в количестве примерно 2 г/л. Например, рекомбинантные клетки-хозяева, предлагаемые в изобретении, предпочтительно могут отличаться способностью потенциировать или повышать образование депсипептидов формулы (I) или формулы (I'). 4. Применение регулируемых железом промоторов для гетерологичной экспрессии генов Другим объектом изобретения является гетерологичная экспрессия генов или синтез представляющих интерес рекомбинантных белков в клетке-хозяине, например клетках-хозяевах p. Pseudomonas, таких как Pseudomonas putida. В некоторых случаях, в частности, когда экспрессия рекомбинантного белка может нарушать рост бактерий, существует необходимость в контроле гетерологичной экспрессии гена таким образом, чтобы она ингибировалась вплоть до переходной стадии роста или вплоть до достижения клеткой-хозяином плотности здоровой популяции или наиболее пригодной стадии для гетерологичной экспрессии гена. При создании изобретения было установлено, что гетерологичную экспрессию генов можно успешно регулировать с помощью регулируемых Fur промоторов в рекомбинантной клеткехозяине, например, в Pseudomonas putida. Хотя в настоящем изобретении применение указанных промоторов описано для гетерологичной экспрессии биосинтетического генного кластера для депсипептидов,регулируемые Fur промоторы, предлагаемые в изобретении, можно применять более широко в области гетерологичной экспрессии генов или синтеза представляющего интерес рекомбинантного белка. Таким образом, в настоящем изобретении предложны средства регуляции и повышения гетерологичной экспрессии генов в рекомбинантной клетке-хозяине, предпочтительно в бактериальной клеткехозяине, например в видах р. Pseudomonas, например, в Pseudomonas putida. Одним из вариантов осуществления изобретения является кассета экспрессии, предназначенная для гетерологичной экспрессии генов или для синтеза представляющего интерес рекомбинантного белка. Указанная кассета экспрессии представляет собой полинуклеотидную последовательность, которая содержит по меньшей мере одну открытую рамку считывания, кодирующую представляющий интерес зрелый рекомбинантный белок (обозначена ниже как кодирующая последовательность), функционально слитую с регулируемым железом промотором. В контексте гетерологичной экспрессии генов понятие представляющий интерес рекомбинантный белок относится к белку, который в естественных условиях не экспрессируется под контролем регулируемого железом промотора. В предпочтительных вариантах осуществления изобретения представляющий интерес рекомбинантный белок может представлять собой фермент, терапевтический белок,включая (но, не ограничиваясь только ими) гормон, фактор роста, антикоагулянт, агонист или антагонист рецептора или рецептор-ловушка), антитела (включая диагностические или терапевтические) или альтернативные связывающие мишень каркасы, такие как (но, не ограничиваясь только ими) полученные из фибронектина белки, однодоменные антитела, одноцепочечные антитела, нанотела и т.п. В контексте кассеты экспрессии понятие функционально связана относится к полинуклеотидной последовательности, содержащей промотор, функционально связанный с полинуклеотидной последовательностью, кодирующей белок, таким образом, что промотор контролирует экспрессию нуклеотидной последовательности, кодирующей белок. Кассета экспрессии, предлагаемая в изобретении, может содержать также другие регуляторные последовательности, необходимые для требуемой экспрессии представляющего интерес рекомбинантного белка в клетке-хозяине, например, 5'-нетранслируемую область, сигнальный пептид, область полиаденилирования и/или другие 3'-нетранслируемые области. 4.1 Регулируемые железом промоторы и регулируемые Fur промоторы Согласно одному из конкретных вариантов осуществления изобретения регулируемый железом промотор, который можно применять в кассете экспрессии, предлагаемой в изобретении, которая описана в параграфе 4, может представлять собой любой бактериальный промотор, транскрипция которого полностью или частично подавляется белком, выбранным из репрессора поглощения железа (Fur) или гомологов белков-репрессоров Fur, которые функционируют в ответ на доступность железа в культуральной среде. К ним относятся также любые промоторы, содержащие сайт связывания репрессора Fur,которые могут быть функционально связаны с кодирующей последовательностью таким образом, чтобы контролировать экспрессию указанной кодирующей последовательности Fur-зависимым образом и в ответ на доступность железа в культуральной среде. Примеры бактериальных белков-репрессоров Fur известны в данной области и описаны, например, у Carpenter и др., 2009. В контексте настоящего описания подразумевается, что подавление промотора происходит в ответ на внешний стимул или цис-элемент или репрессор, если промоторная активность в условиях репрессии(т.е. в присутствии репрессора или репрессирующего стимула и/или сайта связывания репрессора) по меньшей мере в 5 раз ниже, чем промоторная активность в условиях дерепрессии (т.е. в отсутствии репрессора или репрессирующего стимула и/или сайта связывания репрессора), при количественной оценке с помощью анализа репортерного гена, такого как анализ репортерного гена lacZ. Сайты связывания репрессора Fur известны в данной области и обнаружены у многих видов бактерий, таких как Е. coli, Pseudomonas aeruGlnosa, Salmonella typhimurium и Bacillus subtilis (Carpenter и др.,2002). Другие сайты связывания репрессора Fur можно открывать на основе гомологии с консенсусной последовательностью SEQ ID NO: 64 сайтов связывания репрессора Fur. В предпочтительных вариантах осуществления изобретения сайт связывания репрессора Fur выбирают из группы, включающей любую из SEQ ID NO: 64-68. Регулируемые Fur промоторы известны в данной области и идентифицированы у многих видов бактерий, таких как Е. coli, Pseudomonas aeruGlnosa, Vibrio cholera, Salmonella typhimurium, Bacillus subtilis,Helicobacter pylorii, Mycobacterium tuberculosis, Bradyrhizobium japonicum, Listeria monocytogenes, Campylobacter jejuni, Streptomyces coelicolor, Yersinia pestis и Staphylococcus aureus (Carpenter и др., 2002). Примеры регулируемых Fur промоторов включают (но, не ограничиваясь только ими) любой из промоторов,имеющих последовательность, представленную в SEQ ID NO: 69-71. В предпочтительных вариантах осуществления изобретения регулируемый Fur промотор представляет собой полинуклеотидную последовательность, выбранную из группы, включающей: а) SEQ ID NO: 69,б) фрагмент SEQ ID NO: 69, сохраняющий практически такую же промоторную активность, что и промоторная активность SEQ ID NO: 69,в) вариант промотора, имеющего последовательность, представленную в SEQ ID NO: 69, который идентичен по меньшей мере на 50, 60, 70, 80, 90 или 95% SEQ ID NO: 69. В одном из вариантов осуществления изобретения фрагмент последовательности, представленной вSEQ ID NO: 69, представляет собой фрагмент, который содержит по меньшей мере один сайт связывания репрессора Fur, последовательность которого представлена в SEQ ID NO: 65 или SEQ ID NO: 66, и любые последовательности, расположенные в 3'-направлении относительно SEQ ID NO: 69. В одном из вариантов осуществления изобретения указанный вариант промотора может представ- 17020118 лять собой нуклеиновую кислоту, которая содержит сайты связывания репрессора Fur, идентичную SEQID NO: 65 или SEQ ID NO: 66, или имеющую не более 1, 2, 3, 4 или 5 нуклеотидных замен в любом из сайтов связывания репрессора Fur, последовательность которых представлена в SEQ ID NO: 65 и SEQ IDNO: 66. В другом варианте осуществления изобретения указанный вариант промотора, имеющего последовательность, представленную в SEQ ID NO: 69, представляет собой функциональный вариант, который сохраняет практически такую же активность, что и SEQ ID NO: 69. В конкретном варианте осуществления изобретения указанный вариант промотора представляет собой функциональный вариант, который сохраняет практически такую же активность, что и SEQ ID NO: 69, и идентичен по меньшей мере на 50%SEQ ID NO: 69, но содержит два сайта связывания репрессора, которые идентичны SEQ ID NO: 65 и SEQID NO: 66 соответственно или которые имеют не более 1, 2, 3, 4 или 5 нуклеотидных замен при сравнительном анализе первичной структуры с последовательностями SEQ ID NO: 65 и SEQ ID NO: 66 соответственно. Для определения промоторной активности промотора и сравнения с помоторной активностью SEQID NO: 69 можно применять любой приемлемый анализ репортерного гена, такой как анализ репортерного гена lacZ, и измерять экспрессию репортерного гена непосредственно, например, оценивая уровни мРНК, или косвенно, измеряя ферментативную активность репортера (например, активность бетагалактозидазы) в условиях наличия репрессора и при его отсутствии. Если активность в условиях наличия репрессора и при его отсутствии не различается существенно для тестируемого промотора и промотора, последовательность которого представлена в SEQ ID NO: 69, то считается, что тестируемый промотор сохраняет практически такую же промоторную активность, что и промотор, последовательность которого представлена в SEQ ID NO: 69. 4.2 Экспрессионные векторы и рекомбинантные клетки-хозяева, содержащие кассету экспрессии с регулируемыми железом промоторами Кассету экспрессии можно встраивать в любые приемлемые экспрессионные векторы. В контексте синтеза представляющего интерес рекомбинантного белка с использованием регулируемых Fur промоторов понятие экспрессионный вектор означает носитель, с помощью которого нуклеиновую кислоту можно интродуцировать в клетку-хозяина, получая в результате гетерологичную экспрессию гена, который кодирует представляющий интерес рекомбинантный белок. Его можно получать, например, на основе плазмиды, бактериофага или космиды или других искусственных хромосом или других векторов, обычно применяемых для получения рекомбинантного белка в клетке-хозяине. Указанный экспрессионный вектор содержит также помимо кассеты экспрессии средства для проникновения в клетки-хозяева и/или репликации в указанной клетке-хозяине, и/или средства для секреции полипептида на поверхность клетки или вне клетки. Экспрессионные векторы могут включать также средства для репликации или размножения в более чем одном типе клеток, например, по меньшей мере в двух типах клеток, одном прокариотическом типе клеток и одном эукариотическом типе клеток. Конкретные бактериальные векторы, которые можно применять, включают поступающие в продажу плазмиды, содержащие генетические элементы хорошо известных клонирующих векторов pBR322 (ATCC 37017), рКК.223-3 (фирма Pharmacia Fine Chemicals, Уппсала, Швеция), pGEM1 (фирма Promega Biotec, Мэдисон, шт. Висконсин, США) pQE70, pQE60, pQE-9 (фирма Qiagen), pD10, phiX174, pBluescrip t II KS,pNH8A, pNH16a, pNH18A, pNH46A (фирма Stratagene), ptrc99a, pKK223-3, pKK233-3, pDR540, pRIT5 (фирмаPharmacia), pKK232-8 и рСМ 7. Конкретные эукариотические векторы включают pSV2CAT, pOG44, pXT1,pSG (фирма Stratagene) pSVK3, pBPV, pMSG и pSVL (фирма Pharmacia). Однако можно применять любой другой вектор, если он может реплицироваться и является стабильным в клетке-хозяине. Экспрессионный вектор можно интродуцировать в клетки-хозяева с помощью любого из ряда методов, включая трансформацию путем электропорации, трансфекцию, трансдукцию, вирусное заражение, с помощью генных пушек или Ti-опосредуемый перенос генов. При необходимости созданные клетки-хозяева можно культивировать в общепринятых питательных средах, при необходимости модифицированных для активации промоторов, отбора трансформантов или амплификации генов, кодирующих представляющий интерес рекомбинантный белок. Согласно следующему объекту изобретения рекомбинантная клетка-хозяин, предлагаемая в настоящем изобретении, обладает способностью экспрессировать или экспрессирует представляющий интерес рекомбинантный белок. Обзор примеров различных экспрессионных систем, которые можно применять для создания клетки-хозяина, предлагаемой в настоящем изобретении, например, описанной выше конкретной системы, представлен, например, у Glorioso и др., Expression of Recombinant Genes in Eukaryotic Systems, изд-во Academic Press Inc., Burlington, USA, 1999; Paulina Balbas и Argelia Lorence , Recombinant Gene Expression: Reviews and Protocols, 2-ое изд. Reviews and Protocols (Methods in MolecularBiology), изд-во Humana Press, USA, 2004. Трансформацию или конструирование с помощью генной инженерии клетки нуклеотидной последовательностью или вектором, предлагаемой/предлагаемым в изобретении, можно осуществлять с по- 18020118Manual, изд-во CSH Press, Cold Spring Harbor, NY, USA, 2001. Кроме того, клетку-хозяина, предлагаемую в настоящем изобретении, культивируют в питательных средах, требуемых для конкретной применяемой клетки-хозяина, в частности касательно значения рН, температуры, концентрации солей, аэрации, антибиотиков, витаминов, микроэлементов и т.д. Как правило, рекомбинантная клетка-хозяин, предлагаемая в настоящем изобретении, может представлять собой прокариотическую или эукариотическую клетку, содержащую экспрессионную кассету и/или вектор, предлагаемые в изобретении, или клетку, полученную из указанной клетки и содержащую экспрессионную кассету и/или вектор, предлагаемые в изобретении. Таким образом, изобретение относится к рекомбинантной клетке-хозяину, которая содержит либо интегрированную/интегрированные в ее геном, либо в виде аутосомального репликона, экспрессионную кассету или экспрессионный вектор, предлагаемую/предлагаемый в изобретении, как описано выше, для гетерологичной экспрессии гена или для синтеза представляющего интерес рекомбинантного белка в пригодных для роста культуры условиях. Рекомбинантная клетка-хозяин может представлять собой любую клетку, пригодную для гетерологичной экспрессии представляющего интерес рекомбинантного белка в пригодных для роста культуры условиях. Предпочтительно такая рекомбинантная клетка-хозяин представляет собой бактериальную клетку. В предпочтительном варианте осуществления изобретения рекомбинантная клетка-хозяин представляет собой бактериальную клетку-хозяина, трансформированную или трансфектированную экспрессионным вектором, который содержит открытую рамку считывания, кодирующую зрелый представляющий интерес рекомбинантный белок, функционально связанную с регулируемым железом промотором,описанным в предыдущем параграфе. В более конкретном варианте осуществления изобретения рекомбинантную клетку-хозяина выбирают из видов p. Pseudomonas, например, Pseudomona putida, наиболее предпочтительно штамма Pseudomonas putida KT2440, содержащих экпрессионный вектор, предлагаемый в изобретении, при этом регулируемый железом промотор выбирают из группы, включающей любую из последовательностей, представленных в SEQ ID NO: 69-71, или любого функционального варианта промотора. Изобретение относится также к применению кассеты экспрессии, экспрессионных векторов и/или рекомбинантных клеток-хозяев, описанных выше, для гетерологичной экспрессии генов, например, для синтеза представляющего интерес рекомбинантного белка. 4.3 Методы осуществления гетерологичной экспрессии генов Рекомбинантную клетку-хозяина, предлагаемую в изобретении, которая содержит регулируемый железом промотор, можно предпочтительно применять для гетерологичной экпресссии генов, например,для синтеза представляющего интерес рекомбинантного белка. После трансформации приемлемой клетки-хозяина и выращивания клетки-хозяина до соответствующей клеточной плотности, регулируемый Fur промотор можно дерепрессировать с помощью соответствующих средств (например, хелатирующего Fe агента, истощение Fe) и клетки можно культивировать в течение дополнительного периода, давая им продуцировать представляющий интерес белок. Так, одним из вариантов осуществления изобретения является способ гетерологичной экпресссии генов или синтеза представляющего интерес рекомбинантного белка в клетке-хозяине, предпочтительно в бактериальной клетке-хозяине и более предпочтительно в видах p. Pseudomonas, заключающийся в том,что: а) культивируют указанную клетку-хозяина, которая содержит кассету экспрессии, включающую регулируемый железом промотор, в условиях репрессии,б) заменяют питательные среды для дерепрессии регулируемого железом промотора на соответствующей стадии производства,в) выращивают клетки в дерепрессрующих условиях для осуществления гетерологичной экспрессии генов и/или синтеза представляющего интерес рекомбинантного белка. В одном из конкретных вариантов осуществления изобретения репрессирующие условия получают,обеспечивая достаточную концентрацию железа в питательной среде, а дерепрессирующие условия получают путем создания сред с дефицитом железа. Такие условия можно создавать путем естественного применения и истощения железа на фазе роста. В альтернативном варианте такие условия можно создавать, добавляя в среду хелатирующий агент. Любой приемлемый хелатирующий железо агент можно применять для дерепрессии регулируемого железом промотора. Примерами таких хелатирующих железо агентов являются (но, не ограничиваясь только ими) этилендиаминтетрауксусная кислота (ЭДТК), цитрат или соединения, для которых известно,что они действуют как поглощающие железо сидерофоры (например, десферриоксамин, энтеробактин или бациллибактин). В одном из предпочтительных вариантов осуществления изобретения указанный хелатирующий железо агент представляет собой 2'2'-дипиридил. Хелатирующий агент можно добавлять в среду, например, в концентрации, по меньшей мере, равной или предпочтительно в 3 раза более высокой, чем концентрация железа в питательной среде. 4.4 Конкретные варианты осуществления изобретения, связанные с применением регулируемых железом промоторов для гетерологичной экспрессии генов Вариант осуществления изобретения 1: Кассета экспрессии, которую можно применять для гетерологичной экспрессии генов в клеткехозяине, предпочтительно в бактериальной клетке, более предпочтительно в клетке-хозяинеPseudomonas, содержащая регулируемый железом промотор, функционально связанный с геном, который в естественных условиях не регулируется указанным регулируемым железом промотором. Вариант осуществления изобретения 2: Кассета экспрессии по варианту осуществления изобретения 1, в которой регулируемый железом промотор представляет собой бактериальный промотор, репрессируемый белком, который выбран из группы, включающей регуляторные белки-репрессоры поглощения железа (Fur), или любую гомологичную промоторную последовательность, функция которой, заключающаяся в контроле транскрипции,репрессируется белком-репрессором Fur. Вариант осуществления изобретения 3: Кассета экспрессии по варианту осуществления изобретения 2, в которой промотор, репрессируемый белком-репрессором Fur, представляет собой полинуклеотидную последовательность, выбранную из группы, которая включает:(а) SEQ ID NO: 69,(б) фрагмент SEQ ID N0:69, который сохраняет практически такую же промоторную активность,что и активность SEQ ID NO: 69,(в) полинуклеотидную последовательность, которая по меньшей мере на 50% идентична SEQ IDNO: 69, сохраняющую практически такую же промоторную активность, что и активность SEQ ID NO: 69. Вариант осуществления изобретения 4: Рекомбинантная клетка-хозяин, содержащая кассету экспрессии по одному из вариантов осуществления изобретения 1-3. Вариант осуществления изобретения 5: Рекомбинантная клетка-хозяин по варианту осуществления изобретения 4, выбранная из бактериальных видов. Вариант осуществления изобретения 6: Рекомбинантная клетка-хозяин по варианту осуществления изобретения 5, выбранная из видов p.Pseudomonas, например Pseudomonas putida. Вариант осуществления изобретения 7: Применение регулируемого железом промотора для синтеза представляющего интерес рекомбинантного белка в клетке-хозяине. Вариант осуществления изобретения 8: Применение по варианту осуществления изобретения 7, в котором регулируемый железом промотор представляет собой бактериальный промотор, репрессируемый белком, который выбран из группы,включающей регуляторные белки-репрессоры поглощения железа (Fur), или любую гомологичную промоторную последовательность, функция которой, заключающаяся в контроле транскрипции, репрессируется белком-репрессором Fur. Вариант осуществления изобретения 9: Применение по варианту осуществления изобретения 7, в котором промотор, репрессируемый белком-репрессором Fur, представляет собой полинуклеотидную последовательность, выбранную из группы, которая включает:(а) SEQ ID NO: 69,(б) фрагмент SEQ ID NO: 69, который сохраняет практически такую же промоторную активность,что и активность SEQ ID NO: 69,(в) полинуклеотидную последовательность, которая по меньшей мере на 50% идентична SEQ IDNO: 69, сохраняющую практически такую же промоторную активность, что и активность SEQ ID NO: 69. Вариант осуществления изобретения 10: Применение по одному из вариантов осуществления изобретения 7-9, в котором синтез представляющего интерес рекомбинантного белка контролируют путем модуляции концентрации железа в питательной среде. Вариант осуществления изобретения 11: Применение по одному из вариантов осуществления изобретения 7-10, в котором синтез представляющего интерес рекомбинантного белка осуществляют в бактериальной клетке-хозяине, предпочтительно относящейся к видам p. Pseudomonas, например Pseudomonas putida. Вариант осуществления изобретения 12: Применение по одному из вариантов осуществления изобретения 7-11, в котором синтез представляющего интерес рекомбинантного белка индуцируют, добавляя в среду хелатор железа в концентрации,достаточной для хелатирования железа и дерепрессии регулируемого железом промотора. Вариант осуществления изобретения 13: Применение по варианту осуществления изобретения 12, в котором хелатор железа представляет собой 2'2'-дипиридил. 5. Депсипептиды, полученные в результате гетерологичной экспрессии, и их применение Изобретение относится также к соединениям формулы (I) или (I'), например, формул (II)-(VII), (XI)(XIV) и (XVII), и (XVIII), которые можно получать или которые получены описанным выше способом. Еще одним объектом изобретения является фармацевтическая композиция, содержащая соединения формулы (I) или (I'), например, формул (II)-(VII), (XI)-(XIV) и (XVII), и (XVIII), которые можно получать или которые получены описанным выше способом. Фармацевтическая композиция следует приготавливать и дозировать в соответствии с надлежащей клинической практикой с учетом клинического состояния индивидуального пациента, места введения фармацевтической композиции, метода введения, схемы введения и других факторов, известных практикующим специалистам. Эффективное количество фармацевтической композиции для указанных в настоящем описании целей определяют с учетом этих обстоятельств. Специалисту в данной области известно, что эффективное количество фармацевтической композиции, вводимое индивидууму, должно среди прочего зависеть от природы соединения. Например, если соединение представляет собой полипептид или белок, то общее фармацевтически эффективное количество фармацевтической композиции на дозу, при введении парентеральным путем должно составлять от 1 мкг белка/кг веса тела пациента/день до 10 мг белка/кг веса тела пациента/день, хотя, как отмечалось выше, это количество должно зависеть от терапевтических показаний. Более предпочтительно указанная доза составляет по меньшей мере 0,01 мг белка/кг/день и, например для человека, от примерно 0,01 до 1 мг белка/кг/день. При непрерывном применении фармацевтическую композицию, как правило, вводят в дозе от примерно 1 до примерно 50 мкг/кг/ч, либо с использованием 1-4 инъекций в день, либо путем непрерывной подкожной инфузии, например, с помощью мининасоса. Можно применять также раствор в пакете для внутривенных инфузий. Продолжительность лечения, необходимая для достижения видимых изменений, и интервал после осуществления лечения до появления ответов, вероятно, должен варьироваться в зависимости от требуемого действия. Конкретные количества можно определять с помощью общепринятых тестов, хорошо известных специалистам в данной области. Фармацевтические композиции, предлагаемые в изобретении, можно вводить орально, парентерально, интрацистернально, внутрибрюшинно, применять местно (например, в виде порошков, мазей,капель или трансдермального пластыря), трансбуккально или с помощью орального или назального спрея. Фармацевтические композиции, предлагаемые в изобретении, предпочтительно содержат фармацевтически приемлемый носитель. Под фармацевтически приемлемым носителем подразумевается нетоксичный твердый, полутвердый или жидкий наполнитель, разбавитель, капсулирующий материал или вспомогательное вещество для препаративной формы любого типа. Понятие парентеральный в контексте настоящего описания относится к путям введения, включающим внутривенную, внутримышечную,внутрибрюшинную, внутригрудинную, подкожную и внутрисуставную инъекцию и инфузию. Фармацевтическую композицию можно вводить также с использованием систем с замедленным высвобождением. Приемлемыми примерами композиций с замедленным высвобождением являются полупроницаемые полимерные матрицы в виде изделий определенной формы, например, пленок или микрокапсул. Матрицы с замедленным высвобождением включают полилактиды (US 3773919, ЕР 58481),сополимеры L-глутаминовой кислоты и гамма-этил-L-глутамата (Sidman U. и др., Biopolymers 22, 1983,cc. 547-556), поли(2-гидроксиэтилметакрилат) (R. Langer и др., J. Biomed. Mater. Res. 15, 1981, cc. 167-277 и R. Langer, Chem. Tech. 12, 1982, cc. 98-105), этилвинилацетат (R. Langer и др., выше.) или поли-D-(-)-3 гидроксимасляная кислоту (ЕР 133988). Фармацевтическая композиция с замедленным высвобождением также представляет собой включенное в липосому соединение. Содержащую фармацевтическую композицию липосому приготавливают хорошо известными методами (см. DE 3218121; Epstein и др., Proc.Natl. Acad. Sci. (USA) 82, 1985, cc. 3688-3692; Hwang и др., Proc. Natl. Acad. Sci. (USA) 77, 1980, cc. 40304034; EP 52322; EP 36676; EP 88046; EP 143949; EP 142641; заявку на японский патент. 83-118008; US 4485045 и 4544545; и ЕР 102324). Как правило, липосомы представляют собой маленькие везикулы(примерно 200-800 ангстрем) униламеллярного типа, в которых содержание липидов превышает примерно 30 мол.% холестерина, при этом выбранную пропорцию можно регулировать для достижения оптимального лечения. Для парентерального введения фармацевтическую композицию, как правило, приготавливают путем смешения ингредиентов требуемой чистоты в виде инъецируемой формы, представляющей собой стандартную дозу (раствор, суспензия или эмульсия), с фармацевтически приемлемым носителем, т.е. нетоксичным для реципиентов соединением, используя обычно применяемые дозы и концентрации и совместимые с другими ингредиентами препаративной формы. Как правило, препаративные формы получают путем приведения компонентов фармацевтической композиции в однородный и плотный контакт с жидкими носителями или тонкоизмельченными тверды- 21020118 ми носителями или с обоими типами носителей. Затем при необходимости продукту придают требуемую форму. Предпочтительно носитель представляет собой носитель для парентерального применения, более предпочтительно раствор, изотоничный крови реципиента. Примерами таких носителей-наполнителей являются вода, физиологический раствор, раствор Рингера и раствор декстрозы. Неводные наполнители,такие как нелетучие масла и этилолеат, также можно применять согласно настоящему описанию, например, в виде липосом. Носитель может содержать минорные количества добавок, таких как субстанции,которые повышают изотоничность и химическую стабильность. Такие материалы являются нетоксичными для реципиентов в применяемых дозах и концентрациях и включают буферы, такие как фосфатный,цитратный, сукцинатный, содержащий уксусную кислоту и другие органические кислоты или их соли; антиоксиданты, такие как аскорбиновая кислота; низкомолекулярные (состоящие менее чем из примерно 10 остатков) полипептиды, например полиаргинин или трипептиды; белки, такие как сывороточный альбумин, желатин или иммуноглобулины; гидрофильные полимеры, такие как поливинилпирролидон; аминокислоты, такие как глицин, глутаминовая кислота, аспарагиновая кислота или аргинин; моносахариды, дисахариды и другие углеводы, включая целлюлозу или ее производные, глюкозу, манозу или декстрины; хелатирующие агенты, такие как ЭДТК; сахарные спирты, такие как маннит или сорбит; противоионы, такие как натрий; и/или неионогенные поверхностно-активные вещества, такие как полисорбаты, полоксамеры или ПЭГ. Компоненты фармацевтической композиции, предназначенной для терапевтического введения,должны быть стерильными. Для достижения стерильности обычно используют фильтрацию через стерильные фильтрующие мембраны (например, мембраны с размером пор 0,2 мкм).Терапевтические компоненты фармацевтической композиции, как правило, помещают в контейнер, имеющий стерильный порт доступа, например, пакет с раствором для внутривенной инфузии или пузырек, снабженный пробкой, которую можно протыкать гиподермической инъекционной иглой. Компоненты фармацевтической композиции, как правило, должны храниться в однодозовых или многодозовых контейнерах, например, запечатанных ампулах или пузырьках, в виде водного раствора или в виде лиофилизированной препаративной формы, предназначенной для восстановления. Например,в случае лиофилизированной препаративной формы 10-миллилитровые флаконы заполняют 5 мл стерилизованного фильтрацией 1% (мас./об.) водного раствора и образовавшуюся смесь лиофилизируют. Раствор для инфузий получают восстановлением лиофилизированного(ых) соединения(й), используя бактериостатическую воду для инъекций. Настоящее изобретение относится также к применению вышеуказанных депсипептидов и их производных в качестве лекарственного средства. Например, для лечения рака, в частности рака яичника, или для лечения воспалительных и/или гиперпролиферативных и зудящих кожных болезней, таких как келоиды, гипертрофированные шрамы, угри, атопический дерматит, псориаз, пустулезный псориаз, розовые угри, синдром Нетертона, или других зудящих дерматозов, таких как узловатая почесуха Гайда, неспецифический зуд у престарелых, а также других болезней, отличающихся дисфункцией эпителиального барьера, таких как возрастная кожа, воспалительное заболевания кишечника и болезнь Крона, а также панкреатита или рака, в частности рака яичника, муковосцидоза (CF), хронического обструктивного заболевания легких (ХОЗЛ), легочного фиброза, респираторного дистресс-синдрома взрослых, хронического бронхита, наследственной эмфиземы, ревматоидного артрита, IBD (воспалительное заболевание кишечника), псориаза, астмы. Одним из вариантов осуществления настоящего изобретения является применение вышеуказанных депсипептидов и их производных в качестве лекарственного средства, предназначенного для лечения воспалительных и/или гиперпролиферативных и зудящих кожных болезней, таких как келоиды, гипертрофированные рубцы, угри, атопический дерматит, псориаз, пустулезный псориаз, розовые угри, синдром Нетертона, или других зудящих дерматозов, таких как узловатая почесуха Гайда, неспецифический зуд у престарелых, а также других болезней, отличающихся дисфункцией эпителиального барьера, таких как возрастная кожа, воспалительное заболевания кишечника и болезнь Крона, а также панкреатита или рака, в частности рака яичника. Другим вариантом осуществления настоящего изобретения является применение вышеуказанных депсипептидов и их производных в качестве лекарственного средства, предназначенного для лечения муковосцидоза (CF), хронического обструктивного заболевания легких (ХОЗЛ), легочного фиброза, респираторного дистресс-синдрома взрослых, хронического бронхита, наследственной эмфиземы, ревматоидного артрита, IBD, псориаза, астмы. Еще одним вариантом осуществления настоящего изобретения является применение вышеуказанных депсипептидов и их производных в качестве лекарственного средства, предназначенного для лечения воспалительных и/или гиперпролиферативных и зудящих кожных болезней, таких как келоиды, гипертрофированные рубцы, угри, атопический дерматит, псориаз, пустулезный псориаз, розовые угри,синдром Нетертона, или других зудящих дерматозов, таких как узловатая почесуха Гайда, неспецифический зуд у престарелых. 6. Антитела к полипептидам, предлагаемым в изобретении Конкретным вариантом настоящего изобретения является антитело, которое специфически связы- 22020118 вается с полипептидом, предлагаемым в изобретении, или его фрагментами, описанными и определенными выше, и его применение. Кроме того, указанное антитело можно применять для очистки полипептида, в частности нерибосомального пептида и/или нерибосомальных пептидсинтаз (NRPS). Понятие антитело хорошо известно в данной области. В контексте настоящего описания понятие антитело относится, в частности, к полным молекулам иммуноглобулинов, а также к частям таких молекул иммуноглобулинов, практически сохраняющим специфичность связывания. Кроме того, понятие относится к модифицированным и/или измененным молекулам антител, таким как химерные или гуманизированные антитела, полученные рекомбинантным путем или путем синтеза/синтезированные антитела, и к интактным антителам, а также к фрагментам антител, таким как разделенные легкие и тяжелые цепи, Fab, Fab/c, Fv, Fab', F(ab')2. Понятие антитело относится также к бифункциональным антителам, трифункциональным антителам и конструкциям антител,типа одноцепочечных Fv (scFv) или слитых с белком антител. Методы получения антител хорошо известны в данной области и описаны, например, у Howard иBethell, Basic Methods in Antibody Production and Characterization, изд-во Crc. Pr. Inc., 2000. Антитела к полипептиду, предлагаемому в настоящем изобретении, можно получать, например, путем непосредственной инъекции полипептида (или его фрагмента) в организм животного или путем обработки полипептидом (или его фрагментом) животного. Полученные таким образом антитела затем должны сами связывать полипептид (или его фрагмент). При таком методе даже фрагмент полипептида можно применять для создания антител, связывающихся с полным полипептидом, если его связывание является специфическим, как определено выше. Наиболее предпочтительными в контексте настоящего изобретения являются моноклональные антитела. Для получения моноклональных антител можно использовать любые методы, которые обеспечивают продуцирование антител в непрерывных культурах клеточных линий. Примеры таких методов включают метод, основанный на применении гибридом, метод основанный на применении триом, метод,основанный на применении человеческих В-клеточных гибридом, и метод, основанный на примененииEBV-гибридом, для получения человеческих моноклональных антител (Shepherd и Dean, Monoclonal Antibodies: A Practical Approach, изд-во Oxford University Press, 2000; Goding и Goding, Monoclonal Antibodies: Principles and Practice - Production and Application of Monoclonal Antibodies in Cell Biology, Biochemistry and Immunology, изд-во Academic Pr Inc, USA, 1996). Производные антител можно получать также с помощью пептидомиметиков. Кроме того, методы,описанные для получения одноцепочечных антител (см. среди прочего US 4946778), можно адаптировать для получения одноцепочечных антител, специфически распознающих полипептид, предлагаемый в изобретении. Кроме того, можно использовать трансгенных животных для экспрессии гуманизированных антител к полипептиду, предлагаемому в изобретении. Понятие специфически связывается в контексте настоящего описания относится к реакции связывания, которая позволяет определять присутствие нерибосомального пептида и/или нерибосомальных пептидсинтаз (NRPS) и антитела в присутствии гетерогенной популяции белков и других биологических агентов. Так, в созданных условиях анализа специфические антитела и полипептиды связываются друг с другом и не связываются в заметном количестве с другими компонентами, присутствующими в образце. Для специфического связывания с анализируемым веществом-мишенью в таких условиях может требоваться связывающий фрагмент, который отбирают по его специфичности к конкретному анализируемому веществу-мишени. Можно применять целый ряд форматов иммуноанализов для отбора антител, обладающих специфической реактивностью в отношении конкретного антигена. Например, как правило,для отбора моноклональных антител, обладающих специфической иммунореактивностью в отношении анализируемого вещества, используют твердофазные иммуноанализы ELISA (см. у Shepherd и Dean,Monoclonal Antibodies: A Practical Approach, изд-во Oxford University Press, 2000 и/или Howard и Bethell,Basic Methods in Antibody Production and Characterization, изд-во Crc. Pr. Inc., 2000, описание форматов иммуноанализов и условий, которые можно применять для определения специфической иммунореактивности). Как правило, специфическая или селективная реакция характеризуется сигналом, превышающим по меньшей мере в 2 раза отношение фонового сигнал к шумовому, и более предпочтительно превышающим более чем в 10-100 раз фоновый сигнал. Понятие очистка в контексте настоящего описания относится к сериям процессов, предназначенных для выделения одного типа белка из сложной смеси. Очистка белка является очень важной для характеризации функции, структуры и взаимодействий представляющего интерес белка. Исходным материалом могут являться (но, не ограничиваясь только ими) биологическая ткань или культура микроорганизмов. Различные стадии процесса очистки могут обеспечивать высвобождение белка из матрикса, в который он заключен, разделение белковой и небелковой частей смеси и, наконец, отделение требуемого белка от других белков. Стадии разделения основаны на различиях в размере, физико-химических свойств и аффинности к связыванию белков. Настоящее изобретение дополнительно описано с помощью не ограничивающих его объем чертежей, последовательностей и примеров. На чертежах показано: на фиг. 1 - перечень подтвержденных структур, продуцируемых штаммом Chondromyces NPHMB180, биосинтез которых происходил с использованием кластера NRPS, предлагаемого в настоящем изобретении; на фиг. 2 - архитектура доменов биосинтетического генного кластера NRPS, кодирующего соединение формулы (I) или (I'), на примере предполагаемого пути биосинтеза соединений формул (II), (III), (VI) и (VII)-(XVII). L, загрузочный домен; AQ, домен аденилирования (Gln); T, домен тиолирования; С, домен конденсации; NM, домен N-метилирования; ТЕ, тиоэстеразный домен, АР домен аденилирования (Pro);AT, домен аденилирования (Thr); AL, домен аденилирования (Leu); AE, домен аденилирования (Glu); AI,домен аденилирования (Ile); AY, домен аденилированияе (Tyr); на фиг. 3 - выравнивание десяти аминокислотных остатков, которые образуют связывающий карман двух доменов аденилирования в NRPS-сегменте F 10517242, с остатками в доменах, которые наиболее близко соответствуют указанным доменам аденилирования;. на фиг. 4 - результаты, полученные на основе сравнительного анализа, проведенного с использованием программы BLASTp, домена N-метилирования Chondromide и Chondromyces NPH-MB180, свидетельствующие о том, что домен N-метилирования локализован в NRPS-сегменте F 10517242. Мотивы домена N-метилирования выделены жирным шрифтом; на фиг. 5 - предполагаемая интерконверсия соединения, содержащего гидроксипролин с образованием остатка ahp. В водных средах наблюдается равновесие между содержащим гидроксипролин соединением, например, соединением формулы (XVIII), и содержащим ahp соединением, например, формулы(II); на фиг. 6 - результаты обнаружения соединения формулы II с помощью ЖХ-МС-анализа экстрактов полученной в результате гетерологичной экспрессии культуры P. putida KT2440. На ЖХВРхроматограммах представлены позитивные (левые панели) и негативные (правые панели) результаты ионного определения с помощью МС: А) референс-соединение формулы II; Б) день 6, среда LBD; В) день 6, отрицательный контроль P. putida. МС-спектры: Г) референс-соединение формулы И, по данным ЖХВР-анализа погона, представленного на А; Д) день 6, среда LBD, пик, элюированный через 3,2 мин по данным ЖХВР-анализа погона, представленного на Б. В настоящем изобретении сделаны ссылки на следующие нуклеотидные и аминокислотные последовательности:SEQ ID NO: 1 - нуклеотидная последовательность, кодирующая аминокислотную последовательность домена 1, представляющего собой домен конденсации Val/Ile.SEQ ID NO: 2 - аминокислотная последовательность домена 1, представляющего собой домен конденсации Val/Ile.SEQ ID NO: 3 - нуклеотидная последовательность, кодирующая аминокислотную последовательность домена 2, представляющего собой домен аденилирования Val/Ile.SEQ ID NO: 4 - аминокислотная последовательность домена 2, представляющего собой домен аденилирования Val/Ile.SEQ ID NO: 5 - нуклеотидная последовательность, кодирующая аминокислотную последовательность домена 3, представляющего собой домен тиолирования Val/Ile.SEQ ID NO: 6 - аминокислотная последовательность домена 3, представляющего собой домен тиолирования Val/Ile.SEQ ID NO: 7 - нуклеотидная последовательность, кодирующая аминокислотную последовательность домена 4, представляющего собой домен конденсации Tyr.SEQ ID NO: 8 - аминокислотная последовательность домена 4, представляющего собой домен конденсации Tyr.SEQ ID NO: 9 - нуклеотидная последовательность, кодирующая аминокислотную последовательность домена 5, представляющего собой домен аденилирования Tyr.SEQ ID NO: 10 - аминокислотная последовательность домена 5, представляющего собой домен аденилирования Tyr.SEQ ID NO: 11 - нуклеотидная последовательность, кодирующая аминокислотную последовательность домена 6, представляющего собой домен 6-N-метилирования Tyr.SEQ ID NO: 12 - аминокислотная последовательность домена 6, представляющего собой домен 6-Nметилирования Tyr.SEQ ID NO: 13 - нуклеотидная последовательность, кодирующая аминокислотную последовательность домена 7, представляющего собой домен тиолирования Tyr.SEQ ID NO: 14 - аминокислотная последовательность домена 7, представляющего собой домен тиолирования Tyr.SEQ ID NO: 15 - нуклеотидная последовательность, кодирующая NRPS-фрагмент, содержащий домен аденилирования, домен конденсации и домен тиолирования Val/Ile и Tyr соответственно и домен 6N-метилирования Tyr. Функция и предполагаемая роль нуклеотидных и аминокислотных последовательностей, представ- 24020118 ленных в настоящем описании, дополнительно указана выше в табл. 1 и ниже в примерах. Примеры Изобретение проиллюстрировано с помощью следующих примеров: Пример 1. Геномная последовательность NPH-MB180; сборка и анализ Полный геном NPH-MB180 секвенировали, используя метод секвенирования фирмы 454 Life Sciences (пиросеквенирование, 454-секвенирование) (платформа для секвенирования на основе пирофосфата) с получением черновой последовательности. Осуществляли один цикл секвенирования методом дробовика с последующими двумя циклами секвенирования методом Paired-End (методом парноконцевого прочтения). Циклы по методу Paired-End использовали в качестве дополнительной техники к более традиционному методу дробовика. В целом, они представляли собой циклы секвенирования физически разрезанных и циклизованных фрагментов хромосомальной ДНК, лигированных с коротким сегментом ДНК-адаптера. Это обеспечивало дивергентное секвенирование, начиная от адаптера, дающее два коротких прочитанных элемента (-150-200 пар оснований), которые локализованы на расстоянии примерно 3 т.п.н. друг от друга (средний размер разрезанной, циклизованной ДНК). Перекрытие (гомология) двух коротких прочитанных элементов на двух различных наборах последовательно соединенных участков ДНК (контиг) дает возможность неперекрывающимся наборам последовательно соединенных участков ДНК связываться друг с другом и образовывать стык с помощью фрагментов из неидентифицированных нуклеотидов (N), приблизительную длину которых определяют с точностью до 3 т.п.н. Наборы последовательно соединенных участков ДНК, связанные таким образом, называют каркасами. В целом использовали 1295834 индивидуальных прочитанных элемента, получая в результате 31067400 секвенированных пар. Как правило, при использовании этого метода секвенирования средняя длина прочитанного элемента составляла 239 оснований. Эти прочитанные элементы объединяли, получая наборы последовательно соединенных участков ДНК с использованием перекрывающихся последовательностей между прочитанными элементами. Это позволяло получать 4038 наборов последовательно соединенных участков ДНК,что соответствовало 15449316 основаниям со средней длиной набора последовательно соединенных участков ДНК, составляющей 8931 пару оснований. Применение цикла перекрытия спаренных концов для получения каркасов позволяло объединять 96 каркасов, содержащих 15029556 оснований. Средний размер каркаса составлял 1227671 оснований и средний размер каркаса составлял 156557 оснований. Данные о геноме анализировали с целью идентификации генного кластера NRPS, ответственного за биосинтез депсипептидов формулы (I) или (I'). Общий подход состоял в поиске с использованием программы BLAST (Altschul и др., 1990; Gish W. и States D.J. 1993) для 96 каркасов с использованием доменов NRPS в качестве запрашиваемых при поиске. NRPS-домены подтверждали на основе доменов аденилирования, так как эти домены позволяют точно установить, какие аминокислоты включены в нерибосомальный пептид и следовательно являются хорошими маркерами для идентификации специфического кластера NRPS (Marahiel M.A. и др., 1997). В целом ожидалось, что будет найден кластер NRPS, содержащий в своей архитектуре домены аденилирования со следующей специфичностью и в следующем относительном порядке расположения: Gln-Thr-Val-Glu-Ile-Tyr+(N-meth.)-Ile. Кроме того, ожидалось, что генный кластер начинается загрузочным доменом, который обладает способностью инициировать биосинтез с использованием карбоновой кислоты, такой как изомасляная кислота, и, кроме того, ожидалось,что кластер должен заканчиваться тиоэстеразным доменом. Существовала также вероятность, что могут присутствовать другие биосинтетические единицы, которые облегчают окисление остатка глутамата с образованием остатка 3-амино-6-гидроксипиперидона (Ahp). Относительная локализация этих вспомогательных генов, если они присутствуют в этом кластере, являлась непредсказуемой. Кроме того, на этой стадии непредсказуемой являлась локализация стартовых кодонов транскрипции и стоп-кодонов, позволяющих определять, присутствует один или несколько транскриптов. Пример 2. Идентификация всех доменов аденилирования NRPS в геномной последовательностиNPH-MB180 с помощью BLAST-анализа Подход, на котором основывалась идентификация NRPS-кластера, предусматривал первоначальную идентификацию всех доменов аденилирования NRPS в геноме NPH-MB180. Домены аденилирования NRPS являются специфическими для аминокислот, которые они утилизируют, и поэтому эти домены анализировали для идентификации правильного NRPS-кластера на основе количества и относительного расположения аминокислот, которые образуют депсипептиды формулы (I) или (I'). Для этой цели при создании изобретения домен аденилирования валина циклоспорина применяли в качестве примера общего домена аденилирования для идентификации всех возможных NRPS-кластеров в базе данных геномных последовательностей. Для осуществления этого использовали tBLASTn-анализ (Altschul и др., 1990;Gish W. и States D.J., 1993) генома для идентификации всех доменов аденилирования NRPS на основе гомологии аминокислотных последовательностей. Этот подход позволил идентифицировать 14 возможных NRPS-кластеров (табл. 2), и каркасы, содержащие эти кластеры обозначали символами от А до N в сочетании с номером начального нуклеотида BLAST-совпадения (хита) (например, А 12171827). Идентифицировали каждый домен аденилирования из этого перечня и специфичность каждого домена опре- 25020118 деляли путем анализа консервативных аминокислотных остатков, определяющих специфичность домена(см. более подробное описание в примере 3). Таблица 2. Содержащие NRPS каркасы и описание прогнозируемых доменов аденилирования В этом первом анализе не удалось идентифицировать какой-либо из кластеров NRPS с правильным составом доменов аденилирования и имеющий общий размер ожидаемого кластера (30 т.п.н.) для кодирования пути биосинтеза. Фактически не был идентифицирован NRPS-путь, содержащий семь доменов аденилирования, который ожидалось обнаружить в представляющем интерес пути. Однако следует отметить каркас F 10517242, содержащий домены аденилирования изолейцина и тирозина (табл. 2). При этом этот каркас (каркас 72) является совсем коротким (7,4 т.п.н.), но возможно он является частью представляющего интерес кластера NRPS, при этом остальная часть кластера осталась несеквенированной(остатки в областях брешей при секвенировании). Открытие домена N-метилирования между доменом аденилирования тирозина и частичным Т-доменом является дополнительным подтверждением этой гипотезы (см. более подробно в примере 4). На основе этих данных было сделано заключение о том, что геномная последовательность не содержит полный кластер биосинтетических генов. Так, можно предположить, что примерно 20 т.п.н. в 5'направлении и 6 т.п.н. в 3'-направлении остались непрочитанными. Пример 3. Прогнозирование специфичности доменов аденилирования NRPS Специфичность доменов аденилирования, указанных в настоящем описании, прогнозировали с использованием следующего общего протокола. Домены аденилирования идентифицировали, используя поиск на основе tBLASTn (Altschul и др., 1990; Gish W. и States D.J., 1993), при котором осуществляли выравнивание аминокислотной последовательности домена аденилирования валина циклоспоринсинтазы(CssA) и представляющей интерес геномной ДНК Chondromyces. Используя программное обеспечение для сравнительного анализа множества последовательностей ClustalX (Higgins и др., 1996) транслированный домен аденилирования Chondromyces сравнивали с GrsA (PheA) (синтетаза грамицидина S) на аминокислотном уровне между двумя коровыми мотивами (A3 и А 6), описанными у Marahiel и др., 1997. При таком сравнительном анализе последовательностей идентифицировали десять аминокислот, описанных Marahiel с соавторами, которые характерны для кармана связывания домена аденилирования и поэтому определяют аминокислотную специфичность. Затем десять аминокислот сравнивали с аминокислотными кодами домена аденилирования, используя данные, описанные у Rausch и др., 2005 и Stachelhaus и др., 1999. Два домена аденилирования, идентифицированные в сегменте биосинтетического кластера, характеризовались высоким уровнем гомологии с десятью аминокислотами, которые определяют карманы связывания изолейцина и тирозина (фиг. 3). Специфичность этих аминокислот не являлась абсолютной,и аминокислоты со сходными химическими характеристиками часто встречались в виде замен аминокислот, которые определяют домен. Это определяет вариабельность структур, синтезированных на основе одного оперона NRPS. При создании изобретения высказано предположение о том, что домен аденилирования изолейцина может акцептировать также и валин в свой карман связывания, что представляет собой особенность, описанную для других изолейциновых доменов аденилирования у Rausch и др.,2005. Фактически доступные инструменты прогнозирования NRPS (например, http://wwwab.informatik.uni-tuebingen.de/software/NRPSpredictor), как правило, не позволяют рассматривать домен аденилирования как изолейцинспецифический или валинспецифический. Пример 4. Прогнозирование доменов N-метилирования NRPS С использованием описанного ниже подхода прогнозировалось присутствие домена Nметилирования непосредственно по соседству с доменом аденилирования тирозина в 3'-направлении. Аминокислотную последовательность домена N-метилирования Chondromyces crocatus NPH-МВ 180 из кластера Хондромицес (Chondromide) NRPS использовали для поиска в геноме сходных доменов с помощью tBLASTn (Altschul и др., 1990; Gish W. и States D.J., 1993). С помощью этого подхода в NRPSсегменте идентифицировали домен N-метилирования, имеющий величину ожидания 510-43 и 46%-ную идентичность аминокислотной последовательности (фиг. 4). Кроме того, следует отметить, что домен Nметилирования из этого NRPS-сегмента нес ожидаемые аминокислотные мотивы, которые обычно встречаются в функциональных доменах N-метилирования (von Dohren H. и др., 1997; Marahiel М.А. и др., 1997). Для подтверждения этих данных осуществляли сравнение N-метилтрансферазы Apsy-6 из биосинтетического кластера анабенопептилида штамма 90 бактерий р. Анабена (Rouhiainen и др., 2000) и описанной выше N-метилатрансферазы. Полученные с помощью BLASTp результаты этого сравнения подтвердили, что для этих доменов характерна высокая степень гомологии с величиной ожидания 210-65, подтверждая тем самым начальную идентификацию этого домена. Присутствие этого домена непосредственно по соседству с доменом аденилирования тирозина согласуется с ожидаемой архитектурой генного кластераNRPS. Кроме того, домены N-метилирования являются относительно редкими и поэтому присутствие этого домена внутри NRPS-сегмента убедительно подтверждает принадлежность этого сегмента к кластерам NRPS. Пример 5. Идентификация полного биосинтетического генного кластера NRPS Идентифицировали и характеризовали полноразмерные гены биосинтеза нерибосомальных пептидов, ответственные за производство депсипептидов формулы (I'). Гены биосинтеза собирали в каркас,состоящий из каркаса F 10517242, встроенного в каркас D 942267 (табл. 1). Объединение этих каркасов осуществляли после того, как анализ последовательностей нуклеотидов, непосредственно примыкающих к каркасу F 10517242, показало, что это инсерционное соседство к исходной сборке генома являлось искомым. Указанную возможность такой сборки подтверждали с помощью ПЦР с последующим секвенированием ДНК областей, объединяющих каркасы. В этом каркасе находятся восемь смежных открытых рамок считывания, которые, вероятно, ответственны за биосинтез, модификацию и внеклеточный экспорт депсипептидов формулы (I'). Кроме того, в этих открытых рамках считывания локализована предполагаемая секретируемая протеаза, которая, в конечном итоге, может представлять собой встречающуюся в естественных условиях клеточную мишень для депсипептидов, для которых продемонстрировано, что они являются ингибиторами протеаз. Организация этих ОРС и соответствующих доменовNRPS продемонстрирована на фиг. 2. Непосредственно перед коровыми открытыми рамками считывания нерибосомальных пептидов(ОРС 6 и ОРС 7) находятся пять ОРС. Каждая из ОРС 1 и ОРС 2 гомологична двум различным неохарактеризованным белкам, описанным для Sorangium cellulosum. Гипотетическая функция этих белков не известна, однако существует предположение о том, что они присутствуют только в представителях сем.Polyangiaceae. Кроме того, белки Sorangium, гомологичные ОРС 2, встречаются по меньшей мере 5 раз в геноме S. cellulosum. Эти белки, вероятно, совместно транскрибируются с ОРС 3, учитывая, что их нуклеотидные последовательности практически точно соприкасаются. ОРС 3 отличается высокой гомологией последовательности с сериновой протеазой, прежде всего с протеазой, принадлежащей к группе субтилизина. При создании изобретения биохимическим путем было установлено, что депсипептиды являются высокоспецифическими ингибиторами сериновой протеазы, и поэтому весьма вероятно, что депсипептиды являются ингибиторами сериновой протеазы, кодируемой ОРС 3. И, наоборот, ОРС 3 может участвовать в придании устойчивости к депсипептидам штамму Chondromyces. OPC4 и ОРС 5 являются гомологами пермеаз сидерофоров и общих циклических пептидпермеаз, транспортеров ABC-типа. Вероятно, что эта систем пермеаз участвует в экспорте депсипептидов через цитоплазматическую мембрану. Фактически возможно, что все пять этих ОРС вовлечены в процесс транслокации через мембрану и что напоминающая сериновую протеазу ОРС 3 обладает сходством с семейством сериновых протеаз только потому, что так же, как и истинные протеазы, она связывается с ингибитором протеаз. Коровый биосинтетический кластер депсипептидов начинается с ОРС 6 и простирается до ОРС 7. Эти две ОРС вместе имеют длину порядка 15 т.п.н. Как и все биосинтетические кластеры NRPS их можно подразделять на функциональные домены, которые имеют общую топологию, включая домен конденсации, за которым следует домен аденилирования, за которым следует домен тиолирования (Marahiel и др., 1997). Эти три доменных модуля, как правило, несколько раз повторяются в кластере NRPS, каждый из них предназначен для включения в пептид одной аминокислоты. Согласно этой схеме биосинтетический кластер депсипептидов включает семь таких модульных повторов, соответствующих семи аминокислотам, входящим в ядро пептида. Домены аденилирования придают аминокислотную специфичность к увеличивающемуся пептиду и их можно анализировать для идентификации аминокислот, которые они акцептируют и затем включают в состав пептида. Предсказанная аминокислотная специфичность семи доменов аденилирования, присутствующих в ОРС 6 и 7, в целом согласуется с конечной структурой депсипептидов с одним исключением. Предполагалось, что четвертый домен аденилирования (домен 7.3) акцептирует и включает пролин в увеличивающийся пептид в этом положении, однако конечный пептид содержал в этом положении нестандартную аминокислоту 3-амино-6-гидроксипиперидон (aph). Присутствие ahp было выявлено в нескольких депсипептидах, включая родственные анабенопептолиды, продуцируемые штаммом 90 бактерий р. Анабена (Rouhiainen и др., 2000). Высказано предположение о том, что образование ahp происходит в анабенопептолидах после включения глутамина в положение четыре цепи, который затем вновь вступает во взаимодействие с амином предыдущей кислоты, образуя ahp (Rouhiainen и др., 2000). Однако в литературе описаны также и специфические в отношении ahp домены аденилирования (Rausch и др., 2005). При создании изобретения высказано предположение о том, что в содержащих ahp депсипептидах, выделенных из штамма MB 180, которые имеют формулы II-VII, XI-XIII и XVII, имел место новый процесс образования ahp, в котором пролин сначала включался в увеличивающийся пептид в положение четыре, а затем происходило образование ahp с помощью оксидоредуктазы. Действительно, неожиданно в биосинтетическом кластере депсипептидов был обнаружен ген цитохрома Р 450 (ОРС 8) в положении, находящемся непосредственно за биосинтетическим кластером NRPS, и он вероятно, катализирует конверсию путем гидроксилирования остатка пролина. Важно отметить, что те депсипептидные аналоги, которые содержат пролин в этом положении, были выделены из штамма MB 180 (формула XIV). Продемонстрировано также, что аналоги, содержащие 5-гидроксипролин (формула XVIII), спонтанно образуют содержащие ahp депсипептиды (например,формулы II) при инкубации в водной среде в течение нескольких дней (фиг. 5). Указанная интерконверсия между 5-гидроксипролиновой формой и содержащей ahp формой, как также было установлено при создании изобретения, является обратимой. Хотя неясно, имеет ли место эта стратегия также и в случае других депсипептидов, вероятно, что в применяемом при создании изобретении штамме MB 180 эта стратегия участвовала в образовании ahp. Биосинтетический кластер депсипептидов начинался в ОРС 6 с загружающего домена, который инициирует биосинтез с помощью стартовой единицы. Стартовой единицей, как можно предположить на основе структурной вариации остатка X в депсипептидах формулы (I'), являются карбоновые кислоты,такие как СН 3 СН 2 СН(СН 3)СООН, (СН 3)2 СНСООН, С 6 Н 5 СООН, CH3S(O)CH2COOH или СН 3 СООН. Хотя для нерибосомальных пептидов является характерной инициация с помощью небольшого остатка кислоты, выбор остатка значительно варьируется от пептида к пептиду. Однако сложные карбоновые кислоты, функционирующие в качестве стартовых единиц, встречаются относительно редким для нерибосомальных пептидов. Загрузочный домен, применяемый для инициации биосинтеза депсипептидов, отличается от загружающего домена анабенопептолидов, как структурно, так и по используемой стартовой единице. Фактически загрузочный домен депсипептидов является близко родственным стандартному домену конденсации, хотя формильная группа загружающего домена анабенопептолидов очень напоминает ранее описанные формилтрансферазы (Rouhiainen и др., 2000). После того, как карбоновая кислота, представляющая собой стартовую единицу, конденсируется с образованием альфа-аминогруппы аминокислоты глутамина, что определяется доменом 6.2, цепь продолжает увеличиваться каждый раз на одну аминокислоту, что происходит последовательно с помощью биосинтетического аппарата NRPS(фиг. 2). Аппарат для биосинтеза депсипептидов обеспечивает синтез одной аминокислоты пептида каждый раз, что не отличается от простого синтеза с помощью NRPS-пептида, до тех пор, пока он не встречает относительно редкий домен метилтрансферазы (домен 7.10), который метилирует вторичный амин пептидной связи. В этом случае происходит образование третичного амина на аминогруппе, полученной из тирозина. Вероятно, указанное метилирование имеет место после добавления тирозина к увеличивающемуся пептиду, но до добавления следующей и конечной аминокислоты. Это убедительно подтверждается локализацией домена N-метилазы непосредственно за специфическим для тирозина доменом аденилирования. И, наконец, пептид удаляется из конечного домена тиолирования и циклизуется с образованием сложноэфирной связи между спиртовой группой треонина и альфа-кето-группой конечного изолейцина. Это осуществляется с помощью стандартного тиоэстеразного домена (домен 7.15), который представляет собой конечный домен, локализованный в ОРС 7. Неясно, происходит ли образование ahp до или после этой стадии образования тиоэфирной группы. Тем не менее, набор генов, входящих в этот биосинтетический кластер, достаточен для получения полной структуры депсипептидов формулы (I'). Пример 6. Гетерологичная экспрессия депсипептидов в Pseudomonas putida КТ 2440 Ниже описан один пример подхода достижения гетерологичной экспрессии депсипептида формулы(I) или (I') в штамме Pseudomonas putida KT2440. Этот хозяин имеет несколько преимуществ по сравнению с естественным штаммом-продуцентом С. crocatus, таких как быстрая скорость роста и предсказуемый рост, доступность генетических инструментов и валидированное применение для крупномасштабной ферментации. Кроме того, этот хозяин имеет процентное содержание GC в геноме, сходное с С. crocatus, и несет нативные NRPS-системы; два признака, важных при разработке стратегий гетерологичной экспрессии. Биосинтетический генный кластер клонировали в космиде pWEB-TNC (фирма Epicenter Biotechnologies, Мэдисон, шт. Висконсин, США), который пригоден для включения крупных вставок; имеющий решающее значение признак, поскольку длина биосинтетического генного кластера превышает 30 т.п.п. Клонирование биосинтетического генного кластера осуществляли путем первоначальной идентификации соответствующей рестриктазы, которая может осуществлять расщепление вне пограничных участков биосинтетического кластера с образованием линейного ДНК-фрагмента размером примерно 30-40 т.п.п. Анализ данных о геномной последовательности позволил установить, что фермент XmnI пригоден для этой задачи и обеспечивает получение 15 различных ДНК-фрагментов, размер которых находится в указанном диапазоне, при расщеплении полной геномной ДНК. Предположительно из этих 15 ДНКфрагментов один фрагмент размером 39 т.п.н. содержал биосинтетический кластер. Указанные 15 ДНКфрагментов отделяли от других хромосомных фрагментов, образовавшихся в результате расщепления, с помощью электрофореза в агарозном геле. 15 ДНК-фрагментов, размер которых находился в требуемом диапазоне, вырезали из геля, используя ДНК-стандарты соответствующего размера в качестве ориентира,и клонировали в космиде pWEB-TNC согласно инструкциям производителя. Космидный клон, содержащий полный биосинтетический кластер, идентифицировали, осуществляя ПЦР колоний, и подтверждали секвенированием ДНК. Можно применять альтернативный подход, предусматривающий создание случайной полученной по методу дробовика библиотеки полного генома с использованием космиды или ВАС-вектора с последующей гибридизацией колоний с библиотекой клонов с использованием радиоактивномеченного зонда для идентификации представителя библиотеки клонов, который содержит представляющий интерес биосинтетический кластер. После получения клонированного пути биосинтеза требовалось встраивать несколько генетических компонентов в космидный клон для обеспечения успешной гетерологичной экспрессии. Эти компоненты представляли собой I) селектируемый маркер для идентификации успешных переносов в гетерологичного хозяина, II) промотор, функционирующий в гетерологичном хозяине, III) сайт интеграции с хромосомой в гетерологичном хозяине и IV) функции, обеспечивающие способность плазмиды к конъюгационному переносу, обусловленные последовательностью oriT pRK2013 (для применения в сочетании с функциями переноса (точка начала переноса) RK2). Селектируемые маркеры, выбранные для применения в Pseudomonas putida KT2440, в данном примере представляли собой кассету aacCI, обусловливающую устойчивость к гентамицину (Blondelet-Rouault и др., 1997). Другие селектируемые маркеры могли включать нуклеотидные кассеты, обусловливающие устойчивость к ампициллину (например, Ыа), хлорамфениколу (например, cat), канамицину (например, аасС 2, aadB или другие модифицирующие аминогликозиды ферменты) или тетрациклину (например, tetA и tetB). В качестве промотора, контролирующего гетерологичную экспрессию в Pseudomonas putida KT2440, при создании настоящего изобретения применяли промотор гена фумаразы С-1 (РР 0944) (см. также пример 8). Контролирующие транскрипцию промоторы можно выбирать из контролирующих транскрипцию промоторов для любого из перечисленных выше генов, обусловливающих устойчивость к антибиотикам, или из любых контролирующих транскрипцию промоторов, функционирующих в Pseudomonas putida KT2440, включая (но, не ограничиваясь только ими) контролирующие транскрипцию промоторы семи генов 16S рРНК, присутствующих в геноме Pseudomonas putida KT2440 (РР 16SA, РР 16SB, РР 16SC, РР 16SD, РР 16SE, РР 16SF, РР 16SG),контролирующие транскрипцию промоторы любого присутствующего в Pseudomonas putida KT2440 регуляторного гена репрессора поглощение железа (Fur) (включая промоторы fagA (РР 0943), или промоторы другого гомолога fumC, fumC-2 [PP 1755]), участвующие в биосинтезе и транспорте сидерофора или сидерофорподобных соединений (включая pvdE [РР 4216], fpvA [РР 4217]), или контролирующие транскрипцию промоторы генов РР 4243 или РР 0946. Применение промоторов из P. putida, в том числе промотора фумаразы С-1, как указанов настоящем описании, служит второй цели в разработанной при создании изобретения стратегии, обеспечивая сайт интеграции с хромосомой в таком хозяине, как Р.putida, через опосредуемую RecA интеграцию в хромосому. Для облегчения эффективной интеграции в хромосому фрагмент размером 1046 пар оснований промоторной области включали в космидную конструкцию. Промоторный элемент помещали на 3'-конец требуемой вставки для усиления транскрипции в расположенных в по ходу транскрипции генов биосинтетического кластера. Конъюгацию плазмиды облегчали путем включения нуклеотидной последовательности oriT из pSET152. Последовательность oriT является необходимой и достаточной для успешного конъюгационного переноса космиды, когда функции переноса RK2 расположены в транс-ориентации. Эти три генетических компонента клонировали последовательно (5'-фактор устойчивости к гентамицину-опТ-промотор fumC1-3'), используя в качестве каркаса pUC19. Указанную кассету для гетерологичной экспрессии получали с помощью стандартных методов молекулярной биологии. После завершения создания кассету для гетерологичной экспрессии переносили из pUC19 в космидный клон, содержащий биосинтетический генный кластер. Указанную инсерцию осуществляли таким образом, чтобы 3'-конец вставки, содержащий промоторный элемент, располагался на расстоянии 20 пар оснований от стартового кодона трансляции первой открытой рамки считывания биосинтетического генного кластера, создавая тем самым транскрипционное слияние проморного элемента с биосинтетическим генным кластером. Промотор предназначался для обеспечения транскрипции генной кластера и его
МПК / Метки
МПК: C07K 11/02, C07K 14/195
Метки: нерибосомальные, кодирующая, молекула, нуклеиновой, пептидсинтазы, кластера, биосинтетического, применение, кислоты
Код ссылки
<a href="https://eas.patents.su/30-20118-molekula-nukleinovojj-kisloty-biosinteticheskogo-klastera-kodiruyushhaya-neribosomalnye-peptidsintazy-i-ee-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Молекула нуклеиновой кислоты биосинтетического кластера, кодирующая нерибосомальные пептидсинтазы, и ее применение</a>
Предыдущий патент: Замещенные диоксопиперидинилфталимидные производные
Следующий патент: Автоматическое инъекционное устройство с предохранителем спускового механизма
Случайный патент: Способы получения алкилированных углеводородов из текучей среды, полученной способом термической переработки in situ












