Замещенные производные триазолопиридазина
Формула / Реферат
1. Соединение формулы I

или его фармацевтически приемлемая соль,
где R1 означает CH3 или CD3;
R2 означает -C(CD3)3 и
каждый Y1a, Y1b и Y2 независимо представляет собой водород или дейтерий.
2. Соединение по п.1, в котором Y1a и Y1b являются одинаковыми.
3. Соединение по п.1, выбранное из следующих соединений:
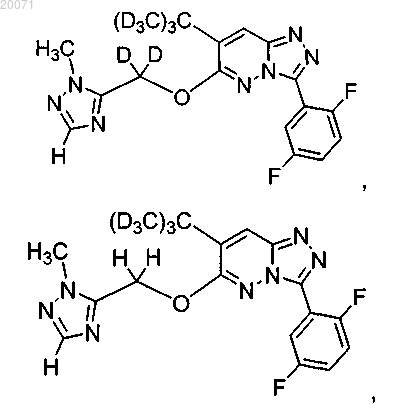

или его фармацевтически приемлемая соль.
4. Соединение по любому из пп.1, 2 или 3, в котором изотопный состав любого атома, не обозначенного как дейтерий, является таким же, как в природе.
5. Соединение по п.3, где соединение представляет собой
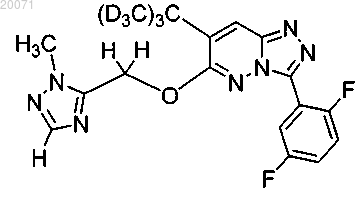
или
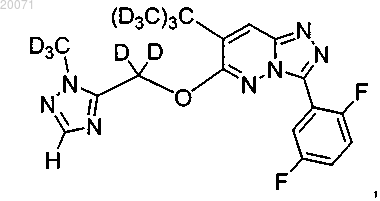
или его фармацевтически приемлемая соль.
6. Фармацевтическая композиция для лечения тревоги или судорог, содержащая соединение по п.1 и фармацевтически приемлемый носитель.
7. Фармацевтическая композиция по п.6, приготовленная для перорального введения.
8. Способ лечения пациента, страдающего от тревоги или судорог, содержащий стадию введения пациенту, нуждающемуся в этом, фармацевтической композиции по п.6 в терапевтически эффективном количестве.
Текст
Изобретение относится к новым замещенным триазолопиридазинам формулы I к их производным и фармацевтически приемлемым солям. Изобретение также относится к композициям, содержащим соединение, соответствующее настоящему изобретению, и к применению таких композиций в способах лечения заболеваний или патологических состояний,которые эффективно лечить путем введения антагониста рецептора 1-GABA-A и/или агониста рецептора 2, 3 и 5 GABA-A. Перекрестная ссылка на родственную заявку По заявке на данное изобретение испрашивается приоритет по предварительной заявке США 61/093293, поданной 29 августа 2008 г., содержание которой включено в настоящее изобретение путем ссылки. Настоящее изобретение относится к новым замещенным триазолопиридазинам, к их производным и фармацевтически приемлемым солям. Настоящее изобретение также относится к композициям, содержащим соединение, соответствующее настоящему изобретению, и к применению таких композиций в способах лечения заболеваний или патологических состояний, которые эффективно лечить путем введения антагониста рецептора 1-GABA-А.L-838417, также известный под названием 7-трет-бутил-3-(2,5-дифторфенил)-6-(1-метил-1 Н-1,2,4 триазол-5-илметокси)[1,2,4]триазоло[4,3-b]пиридазин, действует на бензодиазепиновый сайт рецептораGABA-A в качестве антагониста подтипов 1 и в качестве функционально селективного аллостерического агониста подтипов 2, 3 и 5. В настоящее время является L-838417 возможным доклиническим средством для лечения нарушений центральной нервной системы. Несмотря на превосходную активность L-838417, сохраняется необходимость в новых соединениях,которые являются антагонистами рецептора 1-GABA-A. Краткое описание чертежей На фиг. 1 представлены данные по зависимости от времени для стабильности соединений, соответствующих настоящему изобретению, в микросомах печени человека. На фиг. 2 представлены данные по зависимости от времени для стабильности соединений, соответствующих настоящему изобретению, в микросомах печени крыс. На фиг. 3 представлены данные по концентрации соединений, соответствующих настоящему изобретению, в плазме после внутривенного введения крысам. На фиг. 4 представлены данные по концентрации соединений, соответствующих настоящему изобретению, в плазме после перорального введения крысам. Определения. Термин "лечение" означает снижение, подавление, ослабление, уменьшение, остановку или стабилизацию развития или прогрессирования заболевания (например, заболевания или патологического состояния, указанного в настоящем изобретении)."Заболевание" означает любое патологическое состояние или нарушение, которое поражает клетку,ткань или орган или препятствует их нормальному функционированию. Следует понимать, что в синтезированном соединении в зависимости от происхождения химических веществ, использовавшихся для синтеза, могут наблюдаться некоторые отклонения от изотопного состава, наблюдающегося в природе. Так, полученный L-838417 неизбежно будет содержать небольшие количества дейтерированных изотопологов. Концентрация содержащихся в природе нестабильных изотопов водорода и углерода, независимо от этих отклонений, невелика и несущественна по сравнению с содержанием стабильных изотопов в соединениях, соответствующих настоящему изобретению. См., например, публикацию Wada, E. et al., Seikagaku, 1994, 66:15; Gannes, L.Z. et al., Comp. Biochem. Physiol.Mol. Integr. Physiol., 1998, 119:725. Когда для соединения, соответствующего настоящему изобретению,указано, что оно в определенном положении содержит дейтерий, следует понимать, что в этом положении находится дейтерий при содержании, намного большем, чем содержание дейтерия в природе, которое равно 0,015%. В положении, обозначенном как содержащее дейтерий, для каждого атома, в указанном соединении обозначенного как дейтерий, минимальное значение коэффициента изотопного обогащения обычно равно не менее 3000 (содержание дейтерия равно 45%). Термин "коэффициент изотопного обогащения" при использовании в настоящем изобретении означает отношение содержания изотопа к содержанию конкретного изотопа в природе. В других вариантах осуществления соединение, соответствующее настоящему изобретению, характеризуется коэффициентом изотопного обогащения для каждого обозначенного атома дейтерия, равным не менее 3500 (содержание дейтерия для каждого обозначенного атома дейтерия равно 52,5%), не менее 4000 (содержание дейтерия равно 60%), не менее 4500 (содержание дейтерия равно 67,5%), не менее 5000 (содержание дейтерия равно 75%), не менее 5500 (содержание дейтерия равно 82,5%), не менее 6000 (содержание дейтерия равно 90%), не менее 6333,3 (содержание дейтерия равно 95%), не менее 6466,7 (содержание дейтерия равно 97%), не менее 6600 (содержание дейтерия равно 99%) или не менее 6633,3 (содержание дейтерия равно 99,5%). В соединениях, предлагаемых в настоящем изобретении, любой атом, специально не обозначенный как конкретный изотоп, означает любой стабильный изотоп этого атома. Если не указано иное, то, когда в определенном положении соединения специально указано "Н" или "водород", это означает, что в этом положении находится водород, обладающий природным изотопным составом. Также, если не указано иное, когда в определенном положении соединения специально указано "D" или "дейтерий", то это означает, что в этом положении находится дейтерий при содержании, по меньшей мере в 3340 раз большем,-1 020071 чем содержание дейтерия в природе, которое равно 0,015% (т.е. содержание дейтерия, равное не менее 50,1%). Термин "изотополог" означает соединение, которое отличается от указанного соединения, соответствующего настоящему изобретению, только изотопным составом. Термин "соединение" при использовании в настоящем изобретении означает набор молекул, обладающих одинаковой химической структурой, в которых изотопный состав атомов, образующих молекулы, может быть разным. Таким образом, специалистам в данной области техники должно быть понятно,что соединение, описывающееся конкретной химической структурой, содержащее указанные атомы дейтерия, также будут содержать меньшее количество изотопологов, содержащих атомы водорода в одном или большем количестве отмеченных положений дейтерия в этой структуре. Относительное содержание таких изотопологов в соединении, соответствующем настоящему изобретению, будет зависеть от целого ряда факторов, включая изотопную чистоту дейтерированных реагентов, использовавшихся для получения соединения, и эффективность включения дейтерия на различных стадиях синтеза, использовавшихся для получения соединения. Однако, как указано выше, содержание таких изотопологов в соединении будет меньше 49,9%. Настоящее изобретение также относится к солям соединений, раскрытых в настоящем изобретении. Соль соединения, соответствующего настоящему изобретению, образуется с помощью кислотной и основной группы соединения, такой как функциональная аминогруппа, или основной и кислотной и группы соединения, такой как функциональная карбоксигруппа. В другом варианте осуществления соединение представляет собой фармацевтически приемлемую соль присоединения с кислотой. Термин "фармацевтически приемлемый" при использовании в настоящем изобретении означает компонент, который с медицинской точки зрения применим для взаимодействия с тканями человека и низших животных без проявления нежелательной токсичности, раздражения, аллергической реакции и т.п. и характеризуется разумным соотношением польза/риск."Фармацевтически приемлемая соль" означает любую нетоксичную соль, которая после введения реципиенту может прямо или косвенно образовать соединение, соответствующее настоящему изобретению. "Фармацевтически приемлемый противоион" означает ионный компонент соли, который является нетоксичным при высвобождении из соли после введения реципиенту. Кислоты, обычно использующиеся для получения фармацевтически приемлемых солей, включают неорганические кислоты, такие как дисульфид водорода, хлористо-водородная, бромисто-водородная,йодисто-водородная, серная и фосфорная кислоты, а также органические кислоты, такие как паратолуолсульфоновая, салициловая, винная, дивинная, аскорбиновая, малеиновая, бензолсульфоновая, фумаровая,глюконовая, глюкуроновая, муравьиная, глутаминовая, метансульфоновая, этансульфоновая, бензолсульфоновая, молочная, щаевлевая, парабромфенилсульфоновая, угольная, янтарная, лимонная, бензойная и уксусная кислоты, а также родственные неорганические и органические кислоты. Таким образом,такие фармацевтически приемлемые включают сульфат, пиросульфат, бисульфат, сульфит, бисульфит,фосфат, моногидрофосфат, дигидрофосфат, метафосфат, пирофосфат, хлорид, бромид, йодид, ацетат,пропионат, деканоат, каприлат, акрилат, формиат, изобутират, капринат, гептаноат, пропионат, оксалат,малонат, сукцинат, суберат, себацинат, фумарат, малеат, бутин-1,4-дикарбоксилат, гексин-1,6 дикарбоксилат, бензоат, хлорбензоат, метилбензоат, динитробензоат, гидроксибензоат, метоксибензоат,фталат, терефталат, сульфонат, ксилол сульфонат, фенилацетат, фенилпропионат, фенилбутират, цитрат,лактат, -гидроксибутират, гликолят, малеат, тартрат, метансульфонат, пропансульфонат, нафталин-1 сульфонат, нафталин-2-сульфонат, манделат и другие соли. В одном варианте осуществления фармацевтически приемлемые соли присоединения с кислотами включают образованные с неорганическими кислотами, такими как хлористо-водородная кислота и бромисто-водородная кислота, и предпочтительно образованные с органическими кислотами, такими как малеиновая кислота. Соединения, соответствующие настоящему изобретению (например, соединения формулы I), могут содержать асимметрический атом углерода, например, вследствие замещения дейтерием или по другим причинам. Сами по себе соединения, соответствующие настоящему изобретению, могут существовать в виде отдельных энантиомеров или смесей двух энантиомеров. Соответственно, соединение, соответствующее настоящему изобретению, может существовать в виде рацемической смеси или скалемической смеси или в виде соответствующих отдельных стереоизомеров, которые в основном не содержат другого возможного стереоизомера. Термин "в основном не содержит других стереоизомеров" при использовании в настоящем изобретении означает, что содержится менее 25% других стереоизомеров, предпочтительно менее 10% других стереоизомеров, более предпочтительно менее 5% других стереоизомеров и наиболее предпочтительно менее 2% других стереоизомеров или менее "Х"% других стереоизомеров(где X является целым числом, равным от 0 до 100 включительно). Методики получения или синтеза отдельного энантиомера данного соединения известны в данной области техники и их можно использовать,если это возможно, для получения конечных соединений, или исходного вещества, или промежуточных продуктов. Если не указано иное, то если раскрытое соединение названо или изображено с помощью структуры без указания стереохимической конфигурации и оно содержит один или большее количество хираль-2 020071 ных центров, то следует понимать, что оно характеризует все возможные стереоизомеры соединения. Термин "стабильные соединения" при использовании в настоящем изобретении означает соединения, которые характеризуются стабильностью, достаточной для их приготовления и обеспечивающей их целостность в течение периода времени, достаточного для их использования для задач, указанных в настоящем изобретении (например, для приготовления лекарственных средств, промежуточных продуктов для использования при получении терапевтических соединений, получения пригодных для выделения или хранения промежуточных соединений, лечения заболевания или патологического состояния, реагирующего на лекарственные средства)."трет-" означает третичный. "US" означает Соединенные Штаты Америки. В настоящем описании переменная может обладать общим значением (например,"каждый R") или может обладать специальным значением (например, R1, R2, R3 и т.п.). Если не указано иное, то, когда переменная обладает общим значением, она включает все отдельные варианты данной конкретной переменной. Терапевтические соединения. Настоящее изобретение относится к соединению формулы I или его фармацевтически приемлемой соли,где R1 означает СН 3 или CD3;R2 означает -С(СО 3)3 и каждый Y1a, Y1b и Y2 независимо представляет собой водород или дейтерий. В одном варианте осуществления настоящего изобретения Y1a и Y1b означают водород. В другом варианте осуществления настоящего изобретения Y1a и Y1b означают дейтерий. В другом варианте осуществления настоящего изобретения Y2 означает водород. В другом варианте осуществления настоящего изобретения Y2 означает дейтерий. Другой вариант осуществления настоящего изобретения относится к соединениям, в которых Y1a и 1bY являются одинаковыми. В одном варианте осуществления настоящего изобретения Y1a и Y1b означают дейтерий. В еще одном варианте осуществления соединение выбрано из числа любых соединений, приведенных в табл. 1. Таблица 1 Примеры соединений формулы I В некоторых вариантах осуществления соединение выбрано из числа любых соединений 102, 103,104, 105, 109, 110, 111 и 112 или их фармацевтически приемлемых солей. В других вариантах осуществ-3 020071 ления соединение выбрано из числа любых соединений 102, 103 и 105 или их фармацевтически приемлемых солей. В одном объекте соединение выбрано из группы, включающей соединение 103 или соединение 105 или их фармацевтически приемлемые соли. В другом наборе вариантов осуществления любой атом, не обозначенный как дейтерий в любом из вариантов осуществления, указанных выше, характеризуется природным изотопным составом. Синтез соединений формулы I без труда могут провести химики-синтетики с общей подготовкой в соответствии с типичными синтезами и примерами, приведенными в настоящем изобретении. Другие методики и промежуточные продукты раскрыты, например, в публикациях патентов РСТ WO 98/04559 иWO 00/44752. Такие методики можно выполнить с использованием соответствующих дейтерированных и необязательно других изотопозамещенных реагентов и/или промежуточных продуктов для синтеза соединений, указанных в настоящем изобретении, или по стандартным методикам синтеза, использующимся в данной области техники для введения изотопов атомов в химическую структуру. Некоторые промежуточные продукты можно использовать без очистки или с очисткой (например, с помощью фильтрования,перегонки, возгонки, кристаллизации, растирания, твердофазной экстракции и хроматографии). Типичные синтезы. Соединения формулы I можно получить по приведенным ниже схемам. Схема 1 Общая схема получения соединений формулы I Синтез соединений формулы I обычно можно провести, как показано на схеме 1. Промежуточный продукт 12 получают радикальным алкилированием 3,6-дихлорпиридазина 11 соответствующим образом дейтерированной триметилуксусной кислотой 10. D9-Триметилуксусная кислота имеется в продаже, и ее можно использовать для получения таких соединений, в которых R2 означает -C(CD3)3. Затем соответствующим образом дейтерированный 3,6-дихлор-4-трет-бутилпиридазин 12 конденсируют с 2,5-дифторбензогидразидом 13 и получают 14. Замещение хлора на анион, полученный из соответствующим образом дейтерированного (2-метил-2 Н-1,2,4-триазол-3-ил)метанола 15 и NaH, дает соединения формулы I. Альтернативно, превращение 14 в соединения формулы I проводят с помощью nBuLi в ТГФ(тетрагидрофуран) или карбоната цезия в ДМСО или при аналогичных условиях, известных специалисту в данной области техники. Схема 2 Синтез соединения 15. Схема 2 иллюстрирует получение дейтерированных аналогов 15. В соответствии с описанием в публикации Dallacker F. et al, Chemiker-Zeitung, 1986, 110:101-108 и Dallacker F. et al, Chemiker-Zeitung,1986, 110, p. 275-281, 1,2,4-триазол (16) вводят в реакцию с R1-I и получают соответствующим образом дейтерированный метилтриазол 17, который затем обрабатывают формальдегидом или дейтерированным формальдегидом и получают 15. Специалист в данной области техники должен понимать, что при этих условиях возможен обмен на дейтерий с получением соединения, в которых Y2 означает дейтерий. Конкретные методики и соединения, указанные выше, не являются ограничивающими. Химические структуры, приведенные на схемах в настоящем изобретении, содержат переменные, которые определены в соответствии с определениями химических групп (фрагменты, атомы и т.п.), находящихся в соответствующих положениях в формулах соединений, указанных в настоящем изобретении, независимо от того, обозначены ли эти переменные одинаковыми символами (т.е. R1, R2, R3 и т.п.) или нет. Заключение о пригодности химической группы, находящейся в структуре соединения, для использования в синтезе другого соединения находится в пределах компетенции специалиста с общей подготовкой в данной области техники. Дополнительные методики синтеза соединений формулы I и их синтетических предшественников,включая использующиеся в последовательностях реакций, явно не указанных на схемах, приведенных в настоящем изобретении, известны химикам с общей подготовкой в данной области техники. Преобразования, использующиеся в синтетической химии, и методологии применения защитных групп (введение и удаление и защитных групп), применимые при синтезе использующихся соединений, известны в данной области техники и включают, например, описанные в публикациях Larock R., Comprehensive OrganicSons (1994) и Paquette L., ed., Encyclopedia of Reagents for Organic Synthesis, John WileySons (1995) и в их последующие изданиях. Комбинации заместителей и переменных, использующиеся в настоящем изобретении, являются только такими, которые приводят к образованию стабильных соединений. Композиции. Настоящее изобретение также относится к апирогенным композициям, содержащим эффективное количество соединения формулы I (например, включая любую из формул, приведенных в настоящем изобретении) или фармацевтически приемлемой соли указанного соединения и приемлемый носитель. Композицию, соответствующую настоящему изобретению, предпочтительно готовить для использования в фармацевтике ("фармацевтическая композиция"), причем носитель является фармацевтически приемлемым носителем. Носитель (носители) является "приемлемым" в том смысле, что он совместим с другими ингредиентами композиции и, в случае фармацевтически приемлемого носителя, при использовании в количестве, содержащемся в лекарственном средстве, он не оказывает вредного воздействия на реципиента. Фармацевтически приемлемый носитель включает вспомогательные вещества и разбавители, которые можно использовать в фармацевтических композициях, соответствующих настоящему изобретению. Фармацевтически приемлемый носитель включает одну или большее количество солей, электролитов,солюбилизирующих реагентов, растворителей, буферов, эмульгирующих реагентов, ароматизаторов,красителей, подсластителей, наполнителей, смазывающих реагентов, разбавителей, суспендирующих реагентов, загустителей, диспергирующих реагентов, смачивающих реагентов, веществ, увеличивающих биологическую доступность и стимуляторов абсорбции. Конкретные фармацевтически приемлемые носители включают, но не ограничиваются только ими, 1,3-бутандиол, 2-октилдодеканол, камедь акации,оксид алюминия, стеарат алюминия, пчелиный воск, бензиловый спирт, фосфаты, вещества на основе целлюлоз, цетеариловый спирт, цетиловые сложные эфиры, воск, масло какао, коллоидный диоксид кремния, кукурузный крахмал, гидрофосфат натрия, эмульгирующийся воск, блок-сополимеры этиленоксид-пропиленоксид, желатин, глицерин, глицин, сывороточный альбумин человека, ионообменники, изотонический раствор хлорида натрия, лактозу, лецитин, жидкий вазелин, спирт с длинной цепью,LUTROL, стеарат магния, трисиликат магния, маннит, минеральное масло, олеиновую кислоту и глицериды, оливковое масло или касторовое масло, предпочтительно их полиоксиэтилированные производные, смеси частичных глицеридов насыщенных растительных жирных кислот, PLURONIC, полиакрилаты, полиэтиленгликоль, блок-сополимеры полиэтилен-полиоксипропилен, полисорбат 60, поливинилпирролидон, гидрофосфат калия, сорбат калия, пропиленгликоль, протаминсульфат, раствор Рингера,сывороточные белки, натриевую соль карбоксиметилцеллюлозы, хлорид натрия, сорбиновую кислоту,сорбитанмоностеарат, сахарозу, трагакантовую камедь, Tween 80, воду, воск, белый вазелин, ланолин и соли цинка. Фармацевтические композиции, соответствующие настоящему изобретению, включают пригодные для перорального, ректального, назального, местного (включая трансбуккальное и сублингвальное), вагинального, парентерального (включая подкожное, внутримышечное, внутривенное и внутрикожное) и чрескожного введения. Выбор фармацевтически приемлемого носителя, подходящего для использования с композицией каждого типа, хорошо известен в данной области техники. Аналогичным образом, методики объединения активного ингредиента (ингредиентов) и носителей для приготовления разовых дозированных форм различных фармацевтических композиций, соответствующих настоящему изобретению,также хорошо известны в данной области техники. См., например, Remington: The Science and Practice ofPharmacy, Lippincott WilliamsWilkins, Baltimore, MD (20th ed. 2000). В другом варианте осуществления композиция, соответствующая настоящему изобретению, дополнительно содержит второе терапевтическое средство. Второе терапевтическое средство может быть выбрано из числа любых соединений или терапевтических средств, для которых известно, что они обладают полезными характеристиками или которые проявляют их при введении вместе с соединением, обладающим таким же механизмом действия, как L-838417. Предпочтительно, если второе терапевтическое средство является средством, применимым для лечения или предупреждения заболевания или патологического состояния, выбранного из группы, включающей нарушения центральной нервной системы, включая тревогу и судороги; и невропатическую,воспалительную и связанную с мигренью боль. В другом варианте осуществления настоящее изобретение относится к отдельным дозированным формам соединения, соответствующего настоящему изобретению, и одному или большему количеству любых из описанных выше вторых терапевтических средств, в которых соединение и второе терапевтическое средство объединены друг с другом. Термин "объединены друг с другом" при использовании в настоящем изобретении означает, что отдельные дозированные формы упакованы вместе или иным образом объединены друг с другом, так что отдельные дозированные формы можно без труда продавать и вводить вместе (в течение менее 24 ч одну после другой последовательно или одновременно). В фармацевтических композициях, соответствующих настоящему изобретению, соединение, соответствующее настоящему изобретению, содержится в эффективном количестве. При использовании в настоящем изобретении термин "эффективное количество" означает количество, которое при введении в надлежащем режиме дозировки достаточно для уменьшения или ослабления тяжести, длительности или прогрессирования подвергающегося лечению нарушения, предупреждения развития подвергающегося лечению нарушения, обеспечения регрессии подвергающегося лечению нарушения или усиления или улучшения профилактического или терапевтического эффекта (эффектов) другого лечения. Соотношение между дозами для животных и людей (в миллиграммах на площадь поверхности тела,выраженную в квадратных метрах) описано в публикации Freireich et al. (1966), Cancer Chemother. Rep. 50:219. Площадь поверхности тела можно примерно определить по росту и массе тела пациента. См.,например, Scientific Tables, Geigy Pharmaceuticals, Ardsley, N.Y., 1970, 537. В одном варианте осуществления эффективное количество соединения, соответствующего настоящему изобретению, может находиться в диапазоне от примерно 0,01 до примерно 5000 мг средства. В более предпочтительных вариантах осуществления диапазон составляет примерно от 0,1 до 2500 мг, или от 0,2 до 1000 мг, или более предпочтительно примерно от 1 до 500 мг. Обычно средство вводят от 1 до 3 раз в сутки. Как известно специалистам в данной области техники, эффективные дозы также меняются в зависимости от подвергающегося лечению заболевания, пути введения, пола, возраста и общего состояния здоровья пациента, использующегося инертного наполнителя, возможности использования совместно с другими терапевтическими средствами, такого как использование других лекарственных средств, и решение лечащего врача. Например, указания по выбору эффективной дозы можно получить из информации по использованию L-838417. В случае фармацевтических композиций, которые содержат второе терапевтическое средство, эффективное количество второго терапевтического средства составляет примерно от 20 до 100% от дозы,обычно назначаемой в режиме монотерапии при использовании именно этого средства. Эффективное количество предпочтительно составляет примерно от 70 до 100% от дозы, обычно назначаемой в режиме монотерапии. Назначаемые в режиме монотерапии дозы этих вторых терапевтических средств хорошо известны в данной области техники. См., например, Wells et al., eds., Pharmacotherapy Handbook, 2ndEdition, Appleton and Lange, Stamford, Conn. (2000); PDR Pharmacopoeia, Tarascon Pocket Pharmacopoeia,2000, Deluxe Edition, Tarascon Publishing, Loma Linda, Calif. (2000), содержание которых во всей их полноте включено в настоящее изобретение путем ссылки. Предполагается, что некоторые вторые терапевтические средства, указанные выше, будут действовать синергетически с соединениями, соответствующими настоящему изобретению. В таком случае можно будет снизить эффективную дозу второго терапевтического средства и/или соединения, соответствующего настоящему изобретению, по сравнению с необходимыми в режиме монотерапии. Это обеспечивает следующие преимущества: сведение к минимуму токсических побочных эффектов второго терапевтического средства или соединения, соответствующего настоящему изобретению, синергетическое повышение эффективности, облегчение введения или использования и/или снижение общей стоимости соединения, препарата или композиции. Способы лечения. В другом варианте осуществления настоящее изобретение относится к способу ингибирования подтипа -1 рецептора GABA-A в клетке, включающему взаимодействие клетки с одним или большим количеством соединений формулы I, описанных в настоящем изобретении. В другом варианте осуществления настоящее изобретение относится к способу активации одного или большего количества подтипов 2, 3 и 5 рецептора GABA-A в клетке. В другом варианте осуществления настоящее изобретение относится к способу лечения пациента,страдающего от заболевания или подверженного заболеванию, которое целесообразно лечить с помощьюL-838417, включающему стадию введения указанному пациенту эффективного количества соединения формулы I или его соли или композиции, соответствующей настоящему изобретению. Такие заболевания хорошо известны в данной области техники и раскрыты в следующих патентах и публикациях заявок, но не ограничиваются только ими: WO 1998/004559, WO 2000/044752, WO 2006/061428. Такие заболевания включают, но не ограничиваются только ими, нарушения центральной нервной системы, включая тревогу и судороги; и невропатическую, воспалительную и связанную с мигренью боль. Способы, указанные в настоящем изобретении, также включают такие, в которых пациента определяют как нуждающегося в конкретном утвержденном лечении. Определение пациента как нуждающегося в лечении может быть решением пациента или специалиста здравоохранения, и оно может быть субъективным (например, мнение) или объективным (например, основанным на данных обследования или диагностической методики). В другом варианте осуществления любой из описанных выше способов лечения включает дополнительную стадию совместного введения указанному пациенту одного или большего количества вторых терапевтических средств. Второе терапевтическое средство можно выбрать из числа любых вторых терапевтических средств, для которых известно, что они применимы для совместного введения с L-838417. Выбор второго терапевтического средства также зависит от конкретного подвергающегося лечению заболевания или патологического состояния. Примерами вторых терапевтических средств, которые можно использовать в способах, соответствующих настоящему изобретению, являются указанные выше для использования в комбинированных композициях, содержащих соединение, соответствующее настоящему изобретению, и второе терапевтическое средство. Термин "совместное введение" при использовании в настоящем изобретении означает, что второе терапевтическое средство можно вводить вместе с соединением, соответствующим настоящему изобретению, в виде части одной дозированной формы (такой как композиция, соответствующая настоящему изобретению, содержащая соединение, соответствующее настоящему изобретению, и второе терапевтическое средство, описанное выше) или в виде нескольких отдельных дозированных форм. Альтернативно, дополнительное средство можно вводить до, последовательно или после введения соединения, соответствующего настоящему изобретению. При такой комбинированной терапии и соединения, соответствующие настоящему изобретению, и второе терапевтическое средство (средства) вводят по обычным методикам. Введение пациенту композиции, соответствующей настоящему изобретению, содержащей и соединение, соответствующее настоящему изобретению, и второе терапевтическое средство, не исключает раздельного введения указанному пациенту того же терапевтического средства, любого другого второго терапевтического средства или другого соединения, соответствующего настоящему изобретению, в другой момент времени в течение курса лечения. Эффективные количества этих вторых терапевтических средств хорошо известны специалистам в данной области техники, и рекомендации по дозировке приведены в патентах и публикациях заявок на патенты, указанных в настоящем изобретении, а также в публикациях Wells et al., eds., PharmacotherapyPharmacopoeia, 2000, Deluxe Edition, Tarascon Publishing, Loma Linda, Calif. (2000) и других медицинских книгах. Однако определение оптимального эффективного диапазона количеств второго терапевтического средства входит в компетенцию специалиста в данной области техники. В одном варианте осуществления настоящего изобретения, в котором субъекту вводят второе терапевтическое средство, эффективное количество соединения, соответствующего настоящему изобретению, меньше его эффективного количества, которое нужно вводить, когда не вводят второе терапевтическое средство. В другом варианте осуществления эффективное количество второго терапевтического средства меньше его эффективного количества, которое нужно вводить, когда не вводят соединение, соответствующее настоящему изобретению. Таким образом, можно свести к минимуму нежелательные побочные эффекты, связанные с большими дозами средства. Другие возможные преимущества (включая,без наложения ограничений, улучшенные режимы дозировки и/или сниженную стоимость лекарственного средства) должны быть очевидны специалистам в данной области техники. Еще одним объектом настоящего изобретения является применение соединения формулы I по отдельности или вместе с одним или большим количеством описанных выше вторых терапевтических средств для приготовления лекарственного средства в виде единой композиции или в виде отдельных дозированных форм для лечения или предупреждения у пациента указанного заболевания, нарушения или симптома. Другим объектом настоящего изобретения является соединение формулы I или фармацевтическая композиция, содержащая соединение формулы I, предназначенное для применения для лечения или предупреждения у пациента заболевания, нарушения или его симптома, указанных в настоящем изобретении. Фармацевтические наборы. Настоящее изобретение также относится к наборам, предназначенным для применения для лечения нарушений центральной нервной системы, включая тревогу и судороги; и невропатическую, воспалительную и связанную с мигренью боль. Эти наборы включают (а) фармацевтическую композицию, содержащую соединение формулы I или его соль, в которых указанная фармацевтическая композиция находится в контейнере; и (b) инструкции, в которых описана методика применения фармацевтической композиции для лечения нарушений центральной нервной системы, включая тревогу и судороги; и невропатическую, воспалительную и связанную с мигренью боль. Контейнер может представлять собой любой сосуд или другое герметизированное или герметизируемое устройство, которое может содержать указанную фармацевтическую композицию. Примеры включают флаконы, ампулы, флаконы с отделениями или многокамерные флаконы, в которых каждое отделение или камера содержит одну дозу указанной композиции, пакет с отделениями, в котором каждое отделение содержит одну дозу указанной композиции, или дозирующее устройство, которое подает разовые дозы указанной композиции. Контейнер может обладать любой обычной формой, известной в данной области техники, и изготовлен из фармацевтически приемлемого материала, например, представляет собой бумажный или пластмассовый флакон или банку, повторно герметизируемый пакет (например, содержащий упаковку таблеток для помещения в другой контейнер), или блистерную упаковку, содержащую разовые дозы, выдавливаемые из упаковки в соответствии с режимом лечения. То, какой контейнер используется, может зависеть от конкретной содержащейся дозированной формы, например,обычную картонную коробку обычно не используют для жидкой суспензии. Понятно, что для продажи разовых дозированных форм в одну упаковку можно помещать более одного контейнера. Например, таблетки можно помещать во флаконы, которые, в свою очередь, помещают в коробку. В одном варианте осуществления контейнером является блистерная упаковка. Наборы, соответствующие настоящему изобретению, также могут содержать устройство для введения или отмеривания разовой дозы фармацевтической композиции. Такое устройство может представлять собой ингалятор, если указанная композиция является композицией для ингаляции; шприц и иголку,если указанная композиция является композицией для инъекции; шприц, ложечку, насос или сосуд с маркировкой объема или без нее, если указанная композиция является жидкой композицией для перорального введения; или любое другое мерное или подающее устройства, подходящее для дозирования препарата композиции, находящейся в наборе. В одном варианте осуществления наборы, соответствующие настоящему изобретению, могут содержать в отдельном отделении контейнера фармацевтическую композицию, содержащую второе терапевтическое средство, такую как одна из перечисленных выше, предназначенную для применения для совместного введения с соединением, соответствующим настоящему изобретению. Примеры Пример 1. Синтез 7-(трет-бутил-d9)-3-(2,5-дифторфенил)-6-1-метил-1H-1,2,4-триазол-5 ил)метокси)[1,2,4]триазоло[4,3-b]пиридазина (соединение 103). Соединение 103 получают из соответствующим образом дейтерированных промежуточных продуктов, как это в целом представлено на приведенной выше схеме 1. Стадия 1. 4-(трет-Бутил-d9)-3,6-дихлорпиридазин (12 а). Концентрированную серную кислоту (5,7 мл, 108 ммоль) прибавляют к суспензии свежеочищенного 3,6-дихлорпиридазина 11 (5,4 г, 33,5 ммоль) в дистиллированной воде (130 мл). Смесь нагревают до 65 С и прибавляют триметилуксусную кислоту-d9, 10 а (6,0 г, 54 ммоль, изотопы CDN, 99 атм.% D), затем нитрат серебра (1,1 г, 7 ммоль). К смеси в течение 10-15 мин прибавляют раствор пероксидисульфат аммония (12,3 г, 54 ммоль) в дистиллированной воде (35 мл), поддерживая температуру реакционной смеси равной 65-75 С. Смесь перемешивают в течение 30 мин и охлаждают до комнатной температуры. Смесь выливают на лед (100 г) и значение смеси рН доводят до 9-10 концентрированным раствором гидроксида аммония. Водную смесь экстрагируют дихлорметаном (230 мл). Объединенные экстракты промывают 1 н. гидроксидом натрия (10 мл), сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении. Неочищенный продукт очищают с помощью колоночной хроматографии на силикагеле при элю-8 020071(5,8 г, 42 ммоль) в ксилоле (30 мл) нагревают при 150 С при перемешивании в течение 36 ч. После охлаждения до комнатной температуры смесь концентрируют при пониженном давлении. Остаток растирают с дихлорметаном (40 мл), фильтруют и фильтрат концентрируют при пониженном давлении. Неочищенный продукт очищают с помощью хроматографии на силикагеле при элюировании смесью 20-50% этилацетат/гептаны и получают 5,6 г (60%) 14 а в виде почти белого твердого вещества. Стадия 3. 7-(трет-Бутил-d9)-3-(2,5-дифторфенил)-6-1-метил-1 Н-1,2,4-триазол-5 ил)метокси)[1,2,4]триазоло[4,3-b]пиридазин (соединение 103). К раствору (1-метил-1H-1,2,4-триазол-5-ил)метанола 15 а (0,45 г, 4,0 ммоль, имеется в продаже) в ДМФ (диметилформамид) (20 мл) прибавляют 60% гидрид натрия в минеральном масле (0,17,4,3 ммоль). Смесь перемешивают в течение 15 мин и прибавляют 14 а (1,2 г, 3,6 ммоль). Смесь перемешивают в течение 3 ч при комнатной температуре, затем разбавляют водой (100 мл). Осадок собирают фильтрованием и несколько раз промывают водой. Неочищенный продукт очищают с помощью колоночной хроматографии на силикагеле при элюировании смесью 5% метанол/дихлорметан. Продукт дополнительно очищают перекристаллизацией из смеси этилацетат-гептаны (1:1) и получают 1,25 г (78%) соединения 103 в виде белого твердого вещества. 1 Н-ЯМР (300 МГц, CDCl3):3,91 (s, 3 Н), 5,55 (s, 2 Н), 7,23-7,28 (m, 2 Н), 7,62-7,68 (m, 1 Н), 7,93 (s,1H), 8,00 (s, 1H). 13 С-ЯМР (75 МГц, CDCl3):34,55, 35,66, 59,37, 115,58 (dd, J1=16,6 Гц, J2=9,2 Гц), 117,63 (dd, J1=25,8 Гц, J2=6,6 Гц), 117,72 (dd, J1=24,5 Гц, J2=12,2 Гц), 118,72 (dd, J1=24,0 Гц, J2=8,5 Гц), 121,74, 137,85, 143,47,145,00, 149,49, 151,13, 155,70 (d, J=160,9 Гц), 159,01 (d, J=155,9 Гц), 158,70. ВЭЖХ (высокоэффективная жидкостная хроматография) (методика: колонка Waters Atlantis Т 3 2,150 мм 3 мкм С 18-RP-градиентная методика 5-95% АЦН + 0,1% муравьиной кислоты за 14 мин(1,0 мл/мин) с выдерживанием в течение 4 мин при 95% АЦН; длина волны: 254 нм): время удерживания: 5,41 мин; чистота 99,3%. МС (масс-спектрометрия (М+Н): 409,2. Элементный анализ (C19H10D9F2N7O): Рассчитано: С=55,88, Н=4,69, N=24,01. Найдено: С=55,98,Н=4,53, N=23,98. Пример 2. Синтез (1-(метил-d3)-1H-1,2,4-триазол-5-ил)-1,1-d2-метанола (15b). Промежуточный продукт 15b получают из соответствующим образом дейтерированных промежуточных продуктов, как это в целом представлено на приведенной выше схеме 2.Isotopes, 99 атм.% D). Мутную смесь охлаждают до 0 С и в течение 20 мин прибавляют 1,8-диазабицикло[5.4.0]ундец-7-ен ("DBU") (13,2 мл, 0,87 моль). Смеси дают медленно нагреться до комнатной температуры и перемешивают в течение ночи. Затем смесь фильтруют через слой целита и фильтрат концентрируют при пониженном давлении и получают 7,3 г (100%) неочищенного 17 а в виде желтого масла. ГХМС показывает, что чистота равна 90%. Соотношение региоизомеров составляет 12:1. Стадия 2. (1-(Метил-d3)-1H-1,2,4-триазол-5-ил)-1,1-d2-метанол (15b). Смесь 17 а (5 г, 58 ммоль) и параформальдегид-d2 (10 г, 333 ммоль, Cambridge Isotopes, 99 атм.% D) нагревают в герметизированной пробирке при 170 С в течение 5 ч. Смесь охлаждают до комнатной температуры и разбавляют дихлорметаном (20 мл). Твердое вещество удаляют фильтрованием и фильтрат концентрируют при пониженном давлении. Неочищенный продукт очищают с помощью хроматографии на короткой колонке с силикагелем при элюировании смесью 75% ТГФ/гептаны и получают 4,8 г (71%) 15b в виде почти белого твердого вещества. Пример 3. Синтез 7-(трет-бутил-d9)-3-(2,5-дифторфенил)-6-1-(метил-d3)-1 Н-1,2,4-триазол-5-ил)1,1-d2-метокси)[1,2,4]триазоло[4,3-b]пиридазина (соединение 105). Соединение 105 получают из соответствующим образом дейтерированных промежуточных продуктов, как это в целом представлено на приведенной выше схеме 1.(100 мл). Осадок собирают фильтрованием и несколько раз промывают водой. Неочищенный продукт очищают с помощью колоночной хроматографии на силикагеле при элюировании смесью 5% метанол/дихлорметан. Продукт дополнительно очищают перекристаллизацией из смеси этилацетат/гептан(1:1) и получают 0,52 г (70%) соединения 105 в виде белого твердого вещества. 1 Н-ЯМР (300 МГц, CDCl3):7,23-7,28 (m, 2H), 7,63-7,67 (m, 1H), 7,92 (s, 1H), 8,00 (s, 1H). 13 С-ЯМР (75 МГц, CDCl3): отсутствуют сигналы при 35,66 и 59,37. ВЭЖХ (методика: колонка Waters Atlantis Т 3 2,150 мм 3 мкм C18-RP-градиентная методика 5-95% АЦН + 0,1% муравьиной кислоты за 14 мин (1,0 мл/мин) с выдерживанием в течение 4 мин при 95% АЦН; длина волны: 254 нм): время удерживания: 5,40 мин; чистота 99,0%. МС (М+Н): 414,3. Элементный анализ (C19H5D14F2N7O): Рассчитано: С=55,20, Н=4,63, N=23,72, F=9,19. Найдено:C=54,88, H=4,45, N=23,46, F=9,59. Пример 4. Синтез (1-(метил-d3)-1 Н-1,2,4-триазол-5-ил)метанола (15 с). Промежуточный продукт 15 с получают из соответствующим образом дейтерированных промежуточных продуктов, как это в целом представлено на приведенной выше схеме 2.(1-(Метил-d3)-1H-1,2,4-триазол-5-ил)метанол (15 с). Смесь 17 а (5 г, 58 ммоль, см. пример 2) и параформальдегида (10 г, 333 ммоль) нагревают в герметизированной пробирке при 170 С в течение 5 ч. Смесь охлаждают до комнатной температуры и разбавляют дихлорметаном (20 мл). Твердое вещество удаляют фильтрованием и фильтрат концентрируют при пониженном давлении. Неочищенный продукт очищают с помощью хроматографии на короткой колонке с силикагелем при элюировании смесью 5% метанол/дихлорметан и получают 5,0 г (75%) 15 с в виде почти белого твердого вещества. Пример 5. Синтез 7-(трет-бутил-d9)-3-(2,5-дифторфенил)-6-1-(метил-d3)-1H-1,2,4-триазол-5 ил)метокси)[1,2,4]триазоло[4,3-b]пиридазина (соединение 104). Соединение 104 получают из соответствующим образом дейтерированных промежуточных продуктов, как это в целом представлено на приведенной выше схеме 1.(100 мл). Осадок собирают фильтрованием и несколько раз промывают водой. Неочищенный продукт очищают с помощью колоночной хроматографии на силикагеле при элюировании смесью 5% метанол/дихлорметан. Продукт дополнительно очищают перекристаллизацией из смеси этилацетат/гептан(1:1) и получают 1,31 г (88%) соединения 104 в виде белого твердого вещества. С-ЯМР (75 МГц, CDCl3):34,55, 59,36, 115,53 (dd, J1=16,6 Гц, J2=8,8 Гц), 117,63 (dd, J1=24,4 Гц,J2=12,8 Гц), 117,71 (dd, J1=24,1 Гц, J2=8,0 Гц), 118,77 (dd, J1=23,9 Гц, J2=8,5 Гц), 121,75, 137,85, 143,48,145,00, 149,50, 151,15, 155,76 (d, J=163,5 Гц), 159,08 (d, J=156,9 Гц), 158,71. ВЭЖХ (методика: колонка Waters Atlantis T3 2,150 мм 3 мкм C18-RP- градиентная методика 5-95% АЦН + 0,1% муравьиной кислоты за 14 мин (1,0 мл/мин) с выдерживанием в течение 4 мин при 95% АЦН; длина волны: 254 нм): время удерживания: 5,40 мин; чистота 99,6%. МС (М+Н): 412,2. Элементный анализ (C19H7D12F2N7O): Рассчитано: С=55,47, Н=4,67, N=23,83. Найдено: С=55,49,Н=4,76, N=23,87. Пример 6. Синтез 7-трет-бутил-3-(2,5-дифторфенил)-6-1-(метил-d3)-1 Н-1,2,4-триазол-5-ил)-1,1-d2 метокси)[1,2,4]триазоло[4,3-b]пиридазина (соединение 101). Соединение 101 получают из соответствующим образом дейтерированных промежуточных продуктов, как это в целом представлено на приведенной выше схеме 1. 7-трет-Бутил-3-(2,5-дифторфенил)-6-1-(метил-d3)-1 Н-1,2,4-триазол-5-ил)-1,1-d2 метокси)[1,2,4]триазоло[4,3-b]пиридазин (ссылочное соединение 101). К раствору 15b (0,24 г, 4,0 ммоль, см. пример 2) в ДМФ (10 мл) прибавляют 60% гидрид натрия в минеральном масле (0,08, 2,1 ммоль). Смесь перемешивают в течение 15 мин и прибавляют известное соединение 7-трет-бутил-6-хлор-3-(2,5-дифторфенил)[1,2,4]триазоло[4,3-b]пиридазин, 14b (0,58 г,1,8 ммоль, полученный, как это описано в заявке на патент WO 1998004559). Смесь перемешивают в течение 3 ч при комнатной температуре, затем разбавляют водой (100 мл). Осадок собирают фильтрованием и несколько раз промывают водой. Неочищенный продукт очищают с помощью колоночной хроматографии на силикагеле при элюировании смесью 75% ТГФ/гептаны. Продукт дополнительно очищают перекристаллизацией из смеси этилацетат/гептан (1:1) и получают 0,53 г (72%) соединения 101 в виде белого твердого вещества. 1 Н-ЯМР (300 МГц, CDCl3):1,41 (s, 9H), 7,23-7,28 (m, 2H), 7,62-7,68 (m, 1H), 7,92 (s, 1 Н), 8,00 (s,1H). 13 С-ЯМР (75 МГц, CDCl3): появляется сигнал при 28,96, отсутствует сигнал при 35,66 и 59,36. ВЭЖХ (методика: колонка Waters Atlantis Т 3 2,150 мм 3 мкм C18-RP-градиентная методика 5-95% АЦН + 0,1% муравьиной кислоты за 14 мин (1,0 мл/мин) с выдерживанием в течение 4 мин при 95% АЦН; длина волны: 254 нм): время удерживания: 5,42 мин; чистота 99,7%. МС (М+Н): 405,3. Элементный анализ (C19H14D5F2N7O): Рассчитано: С=56,43, Н=4,74, N=24,25, F=9,40. Найдено: С=56,22, Н=4,73, N=23,87, F=9,35. Пример 7. Исследование метаболической стабильности. Микросомы печени человека (20 мг/мл) и микросомы печени крыс (20 мг/мл) получают у Xenotech,LLC (Lenexa, KS). -Никотинамидадениндинуклеотидфосфат, восстановленный из (NADPH), хлорид магния (MgCl2) и диметилсульфоксид (ДМСО) приобретают у фирмы Sigma-Aldrich. Определение метаболической стабильности. Исходные 7,5 мМ растворы исследуемых соединений (L-838417, ссылочное соединение 101, соединение 103, соединение 104 и соединение 105) готовят в ДМСО. Исходные 7,5 мМ растворы разводят до 12,5 мкМ в ацетонитриле (АЦН). 20 мг/мл микросомы печени (человека или крыс) разводят до 2,5 мг/мл в 0,1 М буфере на основе фосфата калия, рН 7,4, содержащем 3 мМ MgCl2. Разведенные микросомы(375 мкл) по 3 порции помещают в лунки 96-луночного полипропиленового планшета с глубокими лунками. 10 мкл 12,5 мкМ раствора исследуемого соединения прибавляют к микросомам и смесь предварительно нагревают в течение 10 мин. Реакции инициируют путем прибавления 125 мкл предварительно нагретого раствора NADPH. Конечный объем реакционной смеси равен 0,5 мл, и он содержит 0,5 мг/мл микросом печени человека, 0,25 мкМ исследуемого соединения и 2 мМ NADPH в 0,1 М буфере на основе фосфата калия, рН 7,4 и 3 мМ MgCl2. Реакционные смеси инкубируют при 37 С и отбирают аликвоты по 50 мкл через 0, 5, 10, 20 и 30 мин и для остановки реакции прибавляют в лунки 96-луночных планшетов с мелкими лунками, которые содержат 50 мкл охлажденного льдом АЦН с внутренним стандартом. Планшеты выдерживают при 4 С в течение 20 мин и затем в лунки планшетов прибавляют 100 мкл воды и после этого центрифугируют и получают таблетку осажденных белков. Надосадочные жидкости переносят в другой 96-луночный планшет и содержание оставшегося исследуемого соединения определяют с помощью ЖХ-МС/МС (ЖХ - жидкостная хроматография) с использованием масс-спектрометра AppliedBio-systems API 4000. В качестве положительного контроля используют 7-этоксикумарин (1 мкМ). Анализ данных. Полученные in vitro значения t1/2 для исследуемых соединений рассчитывают по наклону линейной регрессии зависимости выраженного в % содержания оставшегося исследуемого соединения (In) от времени инкубации по формуле где k - [наклон линейной регрессии зависимости выраженного в % содержания оставшегося исследуемого соединения (In) от времени инкубации]. Анализ данных проводят с помощью программного обеспечения Microsoft Excel. Результаты этих экспериментов приведены на фиг. 1 (микросомы печени человека) и 2 (микросомы печени крыс). Как показано на фиг. 1, после инкубации с микросомами печени человека в течение 30 мин примерно 70% L-838417 остаются неизмененными. Период полуразложения L-838417 найден равным 54,4 мин. В отличие от этого, все соединения 101, 103, 104 и 105 стабильны в микросомах печени человека (после инкубации в течение 30 мин остаются неизмененными более 80% исследуемых соединений). В микросомах печени крыс примерно 70% L-838417 и ссылочного соединения 101 после инкубации в течение 30 мин остаются неизмененными (фиг. 2). Рассчитанные значения периодов полуразложения равны 50,5 мин для L-838417 и 52,7 мин для соединения 101. После инкубации в течение 30 мин остаются неизмененными более 80% всех соединений 103, 104 и 105, и все они считаются стабильными в микросомах крыс. Пример 8. Исследование фармакокинетики и биологической доступности соединений 103 и 105 после перорального и внутривенного введения крысам. Трем самцам крыс Sprague-Dawley (массой 200-250 г каждый) устанавливают канюлю в яремную вену и через нее вводят одну дозу, содержащую 1 мг/кг L-838417, соединения 103 и соединения 105 (в виде смеси состава 1:1:1, содержащей 1 мг/мл каждого из трех соединений в 10% диметилсульфоксиде(ДМСО), 10% N,N-диметилацетамида (ДМА) и 60% полиэтиленгликоля (ПГ). Еще трем самцам крысSprague-Dawley (массой 200-250 г каждый) через желудочный зонд вводят одну дозу, содержащую 1 мг/кг L-838417, соединения 103 и соединения 105 (в виде смеси состава 1:1:1, содержащей 1 мг/мл каждого из трех соединений в 10% диметилсульфоксиде (ДМСО), 10% N,N-диметилацетамида (ДМА) и 60% полиэтиленгликоля (ПГ). Кровь (0,25 мл) у подвергнутых внутривенному лечению подопытных крыс берут ретроорбитально через 2, 5, 15 и 30 мин и 1, 2, 4 и 6 ч после введения. Кровь (0,25 мл) у подвергнутых пероральному лечению подопытных крыс берут ретроорбитально через 5, 15, 30 и 45 мин и 1, 2, 4 и 6 ч после введения. Кровь собирают в пробирки, содержащие K2 ЭДТК (ЭДТК - анион этилендиаминтетрауксусной кислоты) в качестве антикоагулянта в указанные выше моменты времени. Пробы крови хранят на льду и затем центрифугируют и получают плазму. Аликвоты плазмы (0,125 мкл) помещают в 96-луночные планшеты с глубокими лунками и до исследования с помощью ЖХ-МС/МС с использованием массспектрометра Applied Bio-systems API 4000 хранят при -80 С. Результаты проводимой с помощью внутривенного введения части этого исследования приведены ниже на фиг. 3 и в табл. 2. Таблица 2 Фармакокинетика L-838417, соединения 103 и соединения 105 после внутривенного введения крысам Sprague-Dawley Эти результаты показывают, что после внутривенного введения крысам соединения 103 и 105 характеризуются примерно на 80% более длительным периодом полуразложения и приводят к более чем в 2 раза увеличенным ППК 0-6, чем недейтерированный L-838417. Кроме того, оба соединения 103 и 105 выводятся примерно на 60% медленнее, чем L-838417. Результаты проводимой с помощью перорального введения части этого исследования приведены на фиг. 4 и в табл. 3. Таблица 3 Фармакокинетика L-838417, соединения 103 и соединения 105 после перорального введения крысам Sprague-Dawley Эти результаты показывают, что после перорального введения крысам соединения 103 и 105 характеризуются более чем в 2 раза увеличенным Cmax, чем L-838417. Кроме того, результаты показывают, что после перорального введения соединения 103 и 105 приводят к более чем в 2,5 раза увеличенным ППК 0-6,чем недейтерированный L-838417. Без дополнительного описания предполагается, что специалист с общей подготовкой в данной области техники с использованием предшествующего описания и иллюстративных примеров может получить и использовать соединения, соответствующие настоящему изобретению, и осуществить заявленные способы. Следует понимать, что предшествующее рассмотрение и примеры представляют собой подробное описание лишь некоторых предпочтительных вариантов осуществления. Специалисты с общей подготовкой в данной области техники должны понимать, что без отклонения от сущности и объема настоящего изобретения в него можно внести различные модификации и изменения. Все патенты, статьи из журналов и другие документы, рассмотренные или цитированные выше, включены в настоящее изобретение путем ссылки. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы I или его фармацевтически приемлемая соль,где R1 означает CH3 или CD3;R2 означает -C(CD3)3 и каждый Y1a, Y1b и Y2 независимо представляет собой водород или дейтерий. 2. Соединение по п.1, в котором Y1a и Y1b являются одинаковыми. 3. Соединение по п.1, выбранное из следующих соединений: или его фармацевтически приемлемая соль. 4. Соединение по любому из пп.1, 2 или 3, в котором изотопный состав любого атома, не обозначенного как дейтерий, является таким же, как в природе. 5. Соединение по п.3, где соединение представляет собой или его фармацевтически приемлемая соль. 6. Фармацевтическая композиция для лечения тревоги или судорог, содержащая соединение по п.1 и фармацевтически приемлемый носитель. 7. Фармацевтическая композиция по п.6, приготовленная для перорального введения. 8. Способ лечения пациента, страдающего от тревоги или судорог, содержащий стадию введения пациенту, нуждающемуся в этом, фармацевтической композиции по п.6 в терапевтически эффективном количестве.
МПК / Метки
МПК: A61K 31/41, A01N 43/64
Метки: замещенные, производные, триазолопиридазина
Код ссылки
<a href="https://eas.patents.su/17-20071-zameshhennye-proizvodnye-triazolopiridazina.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные производные триазолопиридазина</a>
Предыдущий патент: Способ индексирования подземного участка с целью получения геологической информации
Следующий патент: Способ получения спирта
Случайный патент: Переработка углеводородного газа












