Производные 1-бензил-3-гидроксиметилиндазола и их применение для лечения заболеваний, основанных на экспрессии мср-1, сх3сr1 и р40
Номер патента: 18976
Опубликовано: 30.12.2013
Авторы: Гульельмотти Анджело, Мангано Джорджина, Фурлотти Гвидо, Каццолла Никола
Формула / Реферат
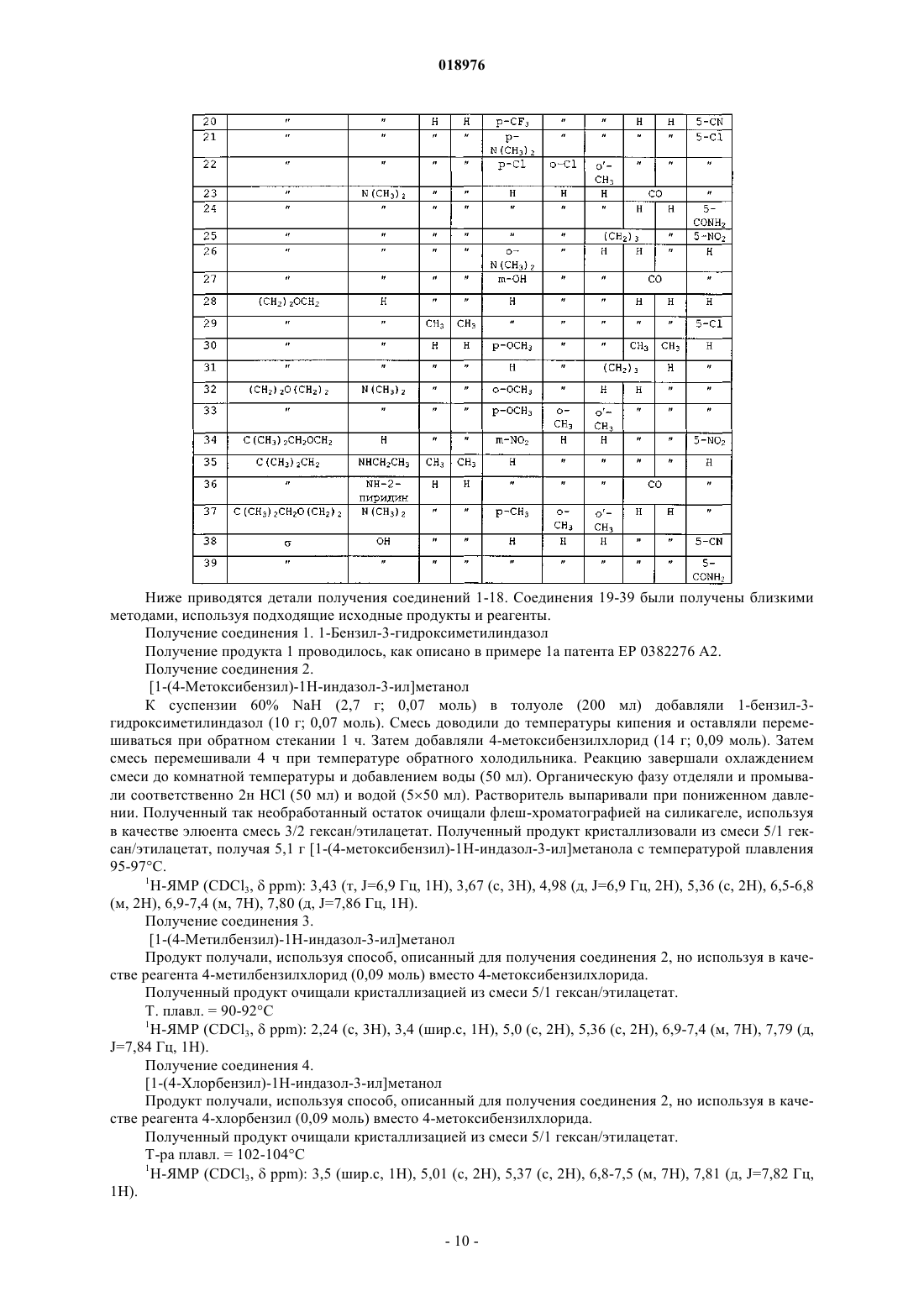
1. Соединение формулы (I)
в которой
А может быть связью s, -X1 или -X1-O-X2-,
где Х1 и Х2, которые могут быть одинаковыми или отличаться друг от друга, могут быть алкильной группой, содержащей от 1 до 5 атомов углерода, возможно замещенных одной или более алкильными группами, содержащими от 1 до 5 атомов углерода, или одной или более алкоксигруппами с 1-3 атомами углерода,
Y означает Н, когда А является связью s, или Y может означать Н, -ОН или -N(R11)(R12), когда А есть -Х1- или -X1-O-X2-,
где R11 может быть водородом, алкильной группой, содержащей от 1 до 5 атомов углерода, или R11 вместе с R12 образует 4-7-звенный гетероцикл,
R12 может быть водородом, алкильной группой, содержащей от 1 до 5 атомов углерода, или R12 вместе с R11 образуют 4-7-звенный гетероцикл,
R1 и R2, которые могут быть одинаковыми или отличаться друг от друга, могут означать водород, алкильную группу, содержащую от 1 до 5 атомов углерода,
R3, R4 и R8, которые могут быть одинаковыми или отличаться друг от друга, могут означать водород, алкильную группу, содержащую от 1 до 5 атомов углерода, алкоксигруппу с 1-3 атомами углерода, атом галогена, -ОН, -N(R')(R"), -N(R')COR", -CN, -CONR'R", -SO2NR'R", -SO2R', нитро и трифторметил; с R' и R", которые могут быть одинаковыми или отличаться друг от друга, означающими водород и алкильную группу, содержащую от 1 до 5 атомов углерода,
R5 может быть водородом, алкильной группой, содержащей от 1 до 5 атомов углерода, алкоксигруппой с 1-3 атомами углерода, атомом галогена, -ОН, - N(R')(R"), -N(R')COR", нитро и трифторметилом, или R5 вместе с одним из R6 и R7 образуют цикл, содержащий 5 или 6 атомов углерода; с R' и R", которые могут быть одинаковыми или отличаться друг от друга, означающими водород и алкильную группу, содержащую от 1 до 5 атомов углерода,
R6 и R7, которые могут быть одинаковыми или отличаться друг от друга, могут означать водород, алкильную группу, содержащую от 1 до 5 атомов углерода, или вместе образуют группу C=O, или один из R6 и R7 вместе с R5 образуют цикл, содержащий 5 или 6 атомов углерода,
при условии, что когда А означает связь s и Y, R1, R2, R6 и R7 означают атомы водорода, то
если R8 означает атом водорода, то группа, связанная с атомом азота в положении 1 индазольного кольца, не является бензильной группой, 4-хлорбензильной группой или 2-4-дихлорбензильной группой,
если R8 означает атом фтора в положении 5 индазольного цикла, то группа, соединенная с атомом азота в положении 1 индазольного цикла, отлична от 5-хлоро-2-метоксибензильной группы, и
если R8 означает трифторметильную группу в положении 6 индазольного цикла, то группа, соединенная с атомом азота в положении 1 индазольного цикла, не является 2-4-дихлорбензильной группой,
или его фармацевтически приемлемая соль.
2. Соединение по п.1, отличающееся тем, что X1 и Х2 независимо друг от друга означают алкильную группу, содержащую от 1 до 4 атомов углерода, возможно замещенных одной или более алкильными группами с 1-3 атомами углерода или одной или более алкоксигруппами, содержащими 1 или 2 атома углерода.
3. Соединение по п.1, отличающееся тем, что Х1 выбран из группы, содержащей группу СН2, группу СН2СН2, группу С(СН3)2 и группу С(СН3)2СН2, и Х2 выбран из группы, содержащей группу СН2, группу СН2СН2 и группу СН2СН2СН2.
4. Соединение по п.1, отличающееся тем, что остаток А выбран из группы, содержащей связь s, группу СН2СН2, группу СН2СН2СН2, группу С(СН3)2СН2, группу СН2СН2ОСН2, группу СН2СН2ОСН2СН2, группу С(СН3)2СН2ОСН2 и группу С(СН3)2СН2ОСН2СН2.
5. Соединение по п.1, отличающееся тем, что R11 и R12, которые могут быть одинаковыми или отличаться друг от друга, означают атом водорода, алкильную группу с 1-3 атомами углерода или вместе образуют 5- или 6-звенный гетероцикл.
6. Соединение по п.1, отличающееся тем, что R1 и R2, которые могут быть одинаковыми или отличаться друг от друга, означают атом водорода или алкильную группу с 1-3 атомами углерода.
7. Соединение по п.1, отличающееся тем, что R3, R4 и R8, которые могут быть одинаковыми или отличаться друг от друга, выбраны из группы, содержащей атом водорода, алкильную группу с 1-3 атомами углерода, алкоксигруппу, содержащую 1 или 2 атома углерода, атом Br, Cl или F, ОН-группу, нитрогруппу, трифторметильную группу или группу N(R')(R"), -N(R')COR", -CN, -CONR'R", -SO2NR'R", -SO2R', причем R' и R", которые могут быть одинаковыми или отличаться друг от друга, означают атом водорода и алкильную группу с 1-3 атомами углерода.
8. Соединение по п.1, отличающееся тем, что R5 выбран из группы, содержащей атом водорода, алкильную группу с 1-3 атомами углерода, алкоксигруппу, содержащую 1 или 2 атома углерода, атом галогена, ОН-группу, или R5 вместе с одним из R6 и R7 образуют цикл, содержащий 5 или 6 атомов углерода.
9. Соединение по п.1, отличающееся тем, что R6 и R7, которые могут быть одинаковыми или отличаться друг от друга, выбраны из группы, содержащей атом водорода, алкильную группу с 1-3 атомами углерода, или вместе образуют группу C=O, или один из R6 и R7 вместе с R5 образуют цикл, содержащий 5 или 6 атомов углерода.
10. Фармацевтическая композиция для лечения заболеваний, основанных на экспрессии МСР-1, CX3CR1 и р40, содержащая соединение формулы (I) по любому из предыдущих пунктов или его фармацевтически приемлемую соль и по меньшей мере один фармацевтически приемлемый наполнитель.
11. Фармацевтическая композиция по п.10, отличающаяся тем, что указанная фармацевтически приемлемая соль является солью присоединения к физиологически приемлемым органическим или неорганическим кислотам или основаниям.
12. Фармацевтическая композиция по п.11, отличающаяся тем, что указанные физиологически приемлемые кислоты выбраны из группы, содержащей соляную кислоту, бромисто-водородную кислоту, серную кислоту, фосфорную кислоту, азотную кислоту, уксусную кислоту, аскорбиновую кислоту, бензойную кислоту, лимонную кислоту, фумаровую кислоту, молочную кислоту, малеиновую кислоту, метансульфоновую кислоту, щавелевую кислоту, паратолуолсульфоновую кислоту, бензолсульфоновую кислоту, янтарную кислоту, дубильную кислоту и винную кислоту.
13. Фармацевтическая композиция по п.11, отличающаяся тем, что указанные физиологически приемлемые основания выбраны из группы, содержащей гидроксид аммония, гидроксид кальция, карбонат магния, гидрокарбонат натрия, гидрокарбонат калия, аргинин, бетаин, кофеин, холин, N,N-дибензилэтилендиамин, диэтиламин, 2-диэтиламиноэтанол, 2-диметиламиноэтанол, этаноламин, этилендиамин, N-этилморфолин, N-этилпиперидин, N-метилглюкамин, глюкамин, глюкозамин, гистидин, N-(2-гидроксиэтил)пиперидин, N-(2-гидроксиэтил)пирролидин, изопропиламин, лизин, метилглюкамин, морфолин, пиперазин, пиперидин, теобромин, триэтиламин, триметиламин, трипропиламин и трометамин.
14. Фармацевтическая композиция по любому из пп.10-13, отличающаяся тем, что указанный фармацевтически приемлемый наполнитель выбран из группы, содержащей регуляторы сыпучести, связующие, агенты, вызывающие дезинтеграцию, наполнители, разбавители, вкусовые добавки, красители, флюидизаторы, смазки, консерванты, увлажнители, абсорбенты и подсластители.
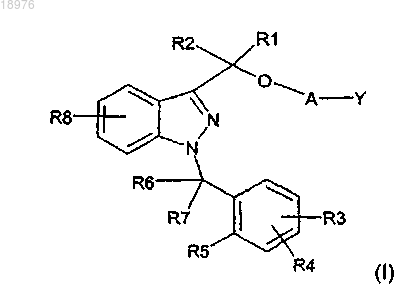
15. Применение соединения формулы (I)
в которой
А может быть связью s, -Х1- или -Х1-O-Х2-,
где X1 и Х2, которые могут быть одинаковыми или отличаться друг от друга, могут означать алкильную группу, содержащую от 1 до 5 атомов углерода, возможно замещенных одной или более алкильными группами, содержащими от 1 до 5 атомов углерода, или одной или более алкоксигруппами с 1-3 атомами углерода,
Y означает Н, когда А является связью s, или Y может означать Н, -ОН или -N(R11)(R12), когда А означает
-Х1,- или -Х1-О-Х2-,
где R11 может быть водородом, алкильной группой, содержащей от 1 до 5 атомов углерода, или R11 вместе с R12 образует 4-7-звенный гетероцикл,
R12 может быть водородом, алкильной группой, содержащей от 1 до 5 атомов углерода, или R12 вместе с R11 образуют 4-7-звенный гетероцикл,
R1 и R2, которые могут быть одинаковыми или отличаться друг от друга, могут означать водород, алкильную группу, содержащую от 1 до 5 атомов углерода,
R3, R4 и R8, которые могут быть одинаковыми или отличаться друг от друга, могут означать водород, алкильную группу, содержащую от 1 до 5 атомов углерода, алкоксигруппу с 1-3 атомами углерода, атом галогена, -ОН, -N(R')(R"), -N(R')COR", -CN, -CONR'R", -SO2NR'R", -SO2R', нитро и трифторметил; причем R' и R", которые могут быть одинаковыми или отличаться друг от друга, означают водород и алкильную группу, содержащую от 1 до 5 атомов углерода,
R5 может быть водородом, алкильной группой, содержащей от 1 до 5 атомов углерода, алкоксигруппой с 1-3 атомами углерода, атомом галогена, -ОН, -N(R')(R"), -N(R')COR", нитро и трифторметилом, или R5 вместе с одним из R6 и R7 образуют цикл, содержащий 5 или 6 атомов углерода; причем R' и R", которые могут быть одинаковыми или отличаться друг от друга, означают водород и алкильную группу, содержащую от 1 до 5 атомов углерода,
R6 и R7, которые могут быть одинаковыми или отличаться друг от друга, могут означать водород, алкильную группу, содержащую от 1 до 5 атомов углерода, или вместе образуют группу C=O, или один из R6 и R7 вместе с R5 образуют цикл, содержащий 5 или 6 атомов углерода,
для получения фармацевтической композиции для лечения заболеваний, основанных на экспрессии МСР-1, CX3CR1 и р40, где указанные заболевания, основанные на экспрессии МСР-1 и CX3CR1, выбраны из группы, содержащей заболевания суставов, заболевания почек, сердечно-сосудистые заболевания, метаболический синдром, ожирение, диабет и резистентность к инсулину, и указанные заболевания, основанные на экспрессии p40, выбраны из группы, содержащей аутоиммунные заболевания и хронические дегенеративные воспалительные заболевания.
16. Применение по п.15, отличающееся тем, что указанные заболевания, основанные на экспрессии МСР-1, выбраны из группы, содержащей ревматоидный артрит, артрит, вызванный вирусными инфекциями, псориатический артрит, артроз, люпус-нефрит, диабетическую нефропатию, гломерулонефрит, поликистоз почек, интерстициальные заболевания легких, фиброз, рассеянный склероз, болезнь Альцгеймера, деменцию, связанную с ВИЧ, атопический дерматит, псориаз, васкулит, рестеноз, атеросклероз, инфаркт миокарда, стенокардию, острые коронарные заболевания, метаболические заболевания и осложнения после хирургических вмешательств.
17. Применение по п.15, отличающееся тем, что указанные заболевания, основанные на экспрессии CX3CR1, выбраны из группы, содержащей ревматоидный артрит, люпус-нефрит, диабетическую нефропатию, болезнь Крона, неспецифический язвенный колит, коронарные расстройства, рестеноз, атеросклероз, инфаркт миокарда, стенокардию и осложнения после хирургических вмешательств.
18. Применение по п.15, отличающееся тем, что указанные заболевания, основанные на экспрессии p40, выбраны из группы, содержащей ревматоидный артрит, псориаз, гломерулонефрит, диабет, красную волчанку и болезнь Крона.
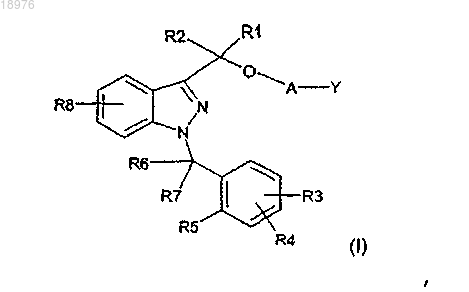
19. Способ лечения или предупреждения заболеваний, основанных на экспрессии МСР-1, CX3CR1 и p40, характеризующийся введением нуждающемуся в этом лицу эффективного количества соединения формулы (I)
в которой
А может быть связью s, -Х1- или -X1-O-X2-,
где X1 и Х2, которые могут быть одинаковыми или отличаться друг от друга, могут означать алкильную группу, содержащую от 1 до 5 атомов углерода, возможно замещенных одной или более алкильными группами, содержащими от 1 до 5 атомов углерода, или одной или более алкоксигруппами с 1-3 атомами углерода,
Y означает Н, когда А является связью s, или Y может означать Н, -ОН или -N(R11)(R12), когда А есть -X1- или -Х1-О-Х2-,
где R11 может быть водородом, алкильной группой, содержащей от 1 до 5 атомов углерода, или R11 вместе с R12 образует 4-7-звенный гетероцикл,
R12 может быть водородом, алкильной группой, содержащей от 1 до 5 атомов углерода, или R12 вместе с R11 образуют 4-7-звенный гетероцикл,
R1 и R2, которые могут быть одинаковыми или отличаться друг от друга, могут означать водород, алкильную группу, содержащую от 1 до 5 атомов углерода,
R3, R4 и R8, которые могут быть одинаковыми или отличаться друг от друга, могут означать водород, алкильную группу, содержащую от 1 до 5 атомов углерода, алкоксигруппу с 1-3 атомами углерода, атом галогена, -ОН, -N(R')(R"), -N(R')COR", -CN, -CONR'R", -SO2NR'R", -SO2R', нитро и трифторметил; причем R' и R", которые могут быть одинаковыми или отличаться друг от друга, означают водород и алкильную группу, содержащую от 1 до 5 атомов углерода,
R5 может быть водородом, алкильной группой, содержащей от 1 до 5 атомов углерода, алкоксигруппой с 1-3 атомами углерода, атомом галогена, -ОН, -N(R')(R"), -N(R')COR", нитро и трифторметилом, или R5 вместе с одним из R6 и R7 образуют цикл, содержащий 5 или 6 атомов углерода; причем R' и R", которые могут быть одинаковыми или отличаться друг от друга, означают водород и алкильную группу, содержащую от 1 до 5 атомов углерода,
R6 и R7, которые могут быть одинаковыми или отличаться друг от друга, могут означать водород, алкильную группу, содержащую от 1 до 5 атомов углерода, или вместе образуют группу C=O, или один из R6 и R7 вместе с R5 образуют цикл, содержащий 5 или 6 атомов углерода,
где указанные заболевания, основанные на экспрессии МСР-1 и CX3CR1, выбраны из группы, содержащей заболевания суставов, заболевания почек, сердечно-сосудистые заболевания, метаболический синдром, ожирение, диабет и резистентность к инсулину, и указанные заболевания, основанные на экспрессии р40, выбраны из группы, содержащей аутоиммунные заболевания и хронические дегенеративные воспалительные заболевания.
Текст
ПРОИЗВОДНЫЕ 1-БЕНЗИЛ-3-ГИДРОКСИМЕТИЛИНДАЗОЛА И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, ОСНОВАННЫХ НА ЭКСПРЕССИИ МСР-1, СХ 3 СR1 И Р 40 Настоящее изобретение относится к новым производным 1-бензил-3-гидроксиметилиндазола по формуле (I), описанным в формуле изобретения, и к фармацевтической композиции, содержащей их вместе с фармацевтически приемлемым наполнителем. Кроме того, настоящее изобретение относится к применению производных 1-бензил-3-гидроксиметилиндазола для получения фармацевтической композиции, которая эффективна в лечении заболеваний, основанных на экспрессии МСР-1, CX3CR1 и р 40, и к ее применению в процессе лечения или предупреждения заболеваний, основанных на экспрессии МСР-1, CX3CR1 и р 40.(71)(73) Заявитель и патентовладелец: АЦЬЕНДЕ КИМИКЕ РЬЮНИТЕ АНДЖЕЛИНИ ФРАНЧЕСКО Область техники, к которой относится изобретение Настоящее изобретение относится к производным 1-бензил-3-гидроксиметилиндазола, к содержащей их фармацевтической композиции и к их применению для лечения заболеваний, основанных на экспрессии МСР-1, CX3CR1 и р 40. В частности, настоящее изобретение относится к новым производным 1-бензил-3 гидроксиметилиндазола согласно формуле (I) ниже и к фармацевтической композиции, содержащей их вместе с фармацевтически приемлемым наполнителем. Кроме того, настоящее изобретение относится к применению производных 1-бензил-3-гидроксиметилиндазола для получения фармацевтической композиции, которая эффективна в лечении заболеваний, основанных на экспрессии МСР-1, CX3CR1 и р 40, и к их применению в процессе лечения или предупреждения заболеваний, основанных на экспрессии МСР 1, CX3CR1 и р 40. Уровень техники Как известно, МСР-1 (Monocyte Chemotactic Protein-1, моноцитарный хемотаксический белок-1) является белком, относящимся к -подсемейству хемокинов. МСР-1 оказывает мощное хемотаксическое действие на моноциты и проявляет свое действие также на Т-лимфоцитах, мастоцитах и базофилахChemotactic Protein-2), МСР-3, МСР-4, MIP-1 и MIP-1, RANTES. Подсемействоотличается от подсемействатем, что для -подсемейства первые два цистеина в структуре являются соседними, тогда как в -подсемействе они разделены промежуточной аминокислотой. МСР-1 производится разными типами клеток (лейкоциты, тромбоциты, фибробласты, эндотелиальные клетки и клетки гладких мышц). Из всех известных хемокинов МСР-1 отличается самой высокой специфичностью к моноцитам и макрофагам, для которых он представляет не только хемотаксический фактор, но также активационный стимул, вызывая в результате процессы продуцирования многих воспалительных факторов (супероксиды, арахидоновая кислота и производные, цитокины/хемокины) и усиливая фагоцитарную активность. Секреция хемокинов вообще и МСР-1, в частности, типично вызывается различными провоспалительными факторами, например интерлейкином-1 (IL-1), интерлейкином-2 (IL-2), TNF (Tumour NecrosisFactor, -фактор некроза опухолей), интерфероном- и бактериальным липополисахаридом (LPS). Предупреждение воспалительной реакции путем блокирования системы рецепторов хемокин/хемокин представляет собой одну из главных целей фармакологического вмешательства (Gerard С.,Rollins B. J., Chemokines and disease. Nature Immunol. 2001; 2:108-115). Имеется много оснований предполагать, что МСР-1 играет ключевую роль в воспалительных процессах и он указывался как новая и подтвержденная мишень в различных патологиях. Доказательство существенного патофизиологического вклада МСР-1 было получено в случае пациентов с суставными и почечными воспалительными заболеваниями (ревматоидный артрит, люпуснефрит, диабетическая нефропатия и отторжение после трансплантации). Однако недавно МСР-1 был указан среди факторов, вовлеченных в воспалительные патологии CNS(рассеянный склероз, болезнь Альцгеймера, деменция, связанная с ВИЧ) и другие патологии и состояния, с и без очевидного воспалительного компонента, включая атопический дерматит, колит, интерстициальные заболевания легких, рестеноз, атеросклероз, осложнения после хирургического вмешательства(например, пластика сосудов, артеректомия, трансплантация, замена органа и/или ткани, вживление протезов), рак (аденома, карцинома и метастазы) и даже метаболические заболевания, такие как резистентность к инсулину и ожирение. Кроме того, несмотря на то, что хемокинетическая система участвует в контроле и преодолении вирусных инфекций, недавние исследования продемонстрировали, что реакция на некоторые хемокины, в частности, МСР-1, может иметь вредную роль в случае взаимодействий организм-хозяин/возбудитель. В частности, МСР-1 указывался среди хемокинов, которые вносят вклад в повреждение органов и ткани при патологиях, обусловленных альфа-вирусами, характеризующихся инфильтрацией моноцитов/макрофагов в суставы и мышцы (Mahalingam S. et al. Chemokines and viruses: friend or foes Trends inpathogenesis. 2005; 107:329-342). Моноциты являются основными предшественниками макрофагов и дендритных клеток и играют решающую роль как медиаторы воспалительных процессов. CX3CR1 с его лигандом CX3CL1 (фракталкин) представляет собой ключевой фактор в регулировании миграции и адгезивности моноцитов.CX3CR1 экспрессируется в моноцитах, тогда как CX3CL1 является трансмембранным хемокином в эндотелиальных клетках. Генетические исследования на человеке и моделях на животных продемонстрировали важную роль CX3CR1 и CX3CL1 в патофизиологии воспалительных болезней. Действительно,имеется много оснований предполагать ключевой вклад CX3CR1 и его лиганда в патогенез и развитие суставных, почечных, желудочно-кишечных и сосудистых воспалительных заболеваний (например, ревматоидный артрит, люпус-нефрит, диабетическая нефропатия, болезнь Крона, неспецифический язвенный колит, рестеноз и атеросклероз). Экспрессия CX3CR1 перерегулируется в Т-клетках, которые, как считается, аккумулируются в синовиальной оболочке у пациентов, страдающих ревматоидным артритом. Кроме того, экспрессияCX3CL1 перерегулируется в эндотелиальных клетках и фибробластах, присутствующих в синовиальной оболочке у этих пациентов. Следовательно, система CX3CR1/CX3CL1 играет важную роль в контроле типа клетки и виде инфильтрации синовиальной оболочки и способствует патогенезу ревматоидного артрита (Nanki Т. et al., "Migration of CX3CRl-positive T cells producing type 1 cytokines and cytotoxic molecules into the synovium of patients with rheumatoid arthritis", ArthritisRheumatism (2002), vol. 46, No. 11,pp. 2878-2883). У пациентов, страдающих поражением почек, большинство воспалительных лейкоцитов, которые проникают в почку, экспрессируют CX3CR1, и, в частности, он экспрессируется на двух из основных типов клеток (Т-клетках и моноцитах), участвующих в большинстве общих воспалительных почечных патологий и в отторжении пересаженной почки (Segerer S. et al., Expression of the fractalkine receptor(ВБК). Действительно, в случае пациентов, страдающих ВБК (например, болезнь Крона, неспецифический язвенный колит), было продемонстрировано значительное повышение продукции CX3CL1 кишечной капиллярной системой и существенное повышение CX3CR1-положительных клеток, все на уровне кровообращения и в слизистой (Sans M. et al., "Enhanced recruitment of CX3CR1+T cells by mucosal endothelial cell-derived fractalkine in inflammatory bowel diseases", Gastroenterology 2007, vol. 132, No. 1, pp. 139-153). Еще более интересной является демонстрация ключевой роли, которую играет системаCX3CR1/CX3CL1 в повреждении сосудов, в частности в патологических условиях, например, атеросклероз и рестеноз. CX3CR1 указывается как критический фактор в процессе инфильтрации и аккумуляции моноцитов в стенке сосудов, и полиморфизм CX3CR1 у людей ассоциируется с пониженным распространением атеросклероза, коронарных нарушений и рестеноза (Liu P. et al., "Cross-talk among Smad,МАРК and integrin signalling pathways enhances adventitial fibroblast functions activated by transformingIL-12 и IL-23 являются членами малого семейства провоспалительных гетеродимерных цитокинов. Оба цитокина содержат общую субъединицу p40, которая ковалентно связана либо с субъединицей р 35 с получением зрелой формы IL-12, либо с субъединицей р 19 с получением зрелой формы IL-23. Рецептор для IL-12 образован субъединицами IL-12R1 и IL-12R2, а рецептор для IL-23 состоит из субъединицIL-12 и IL-23 экспрессируются главным образом активированными дендритными клетками и фагоцитами. Рецепторы для этих двух цитокинов экспрессируются на клетках Т и NK, и клетках NK-T, но незначительные уровни комплексов рецептора для IL-23 также присутствуют в моноцитах, макрофагах и дендритных клетках. Несмотря на эту схожесть, имеется много оснований предполагать, что IL-12 и IL-23 контролируют разные иммунологические цепи. Действительно, тогда как IL-12 контролирует рост клеток Th1, которые способны продуцировать гамма-интерферон (IFN-), и повышает цитотоксичную, противомикробную и противоопухолевую реакцию, IL-23 регулирует цепь, которая ведет к образованию клеток CD4+, способных продуцировать IL-17. Индукция процессов, зависимых от IL-23, приводит к мобилизации различных типов воспалительных клеток, например TH-17, было показано, что она является решающей для патогенеза многочисленных воспалительных патологий, обусловленных иммунологическими реакциями. Типичными примерами патологий, связанных с экспрессией р 40, являются хронические воспалительные заболевания суставного аппарата (например, ревматоидный артрит), дерматологического аппарата (например, псориаз) и желудочно-кишечного аппарата (например, болезнь Крона). Однако IL-23 играет также роль в стимуляции возникновения и роста опухолей. Действительно, IL-23 регулирует ряд цепей в опухолевой микросреде, стимулируя ангиогенез и продукцию медиаторов воспаления. Псориаз является хроническим воспалительным заболеванием кожи, которое охватывает 3% мирового населения (Koo J. Dermatol. Clin. 1996; 14:485-96; Schon M.P. et al., N. Engl. J. Med. 2005; 352:1899912). Была показана корреляция аберрантной иммунной реакции типа 1 с патогенезом псориаза, и цитокины, которые вызывают такую реакцию, такие как IL-12 и IL-23, могут оказаться подходящими терапевтическими объектами. Экспрессия IL-12 и IL-23, которые разделяют субъединицу р 40, значительно повышена в псориазных бляшках, и доклинические исследования продемонстрировали роль этих цитокинов в патогенезе псориаза. Недавно лечение моноклональными антителами анти-IL-12 и IL-23 пациентов, страдающих псориазом, показало себя эффективным в улучшении признаков развития и тяжести заболевания и позднее усилило роль IL-12 и IL-23 в патофизиологии псориаза. Болезнь Крона является хронической воспалительной патологией пищеварительной системы и может воздействовать на любую ее область от рта до ануса. Типично она поражает конечный тракт подвздошной кишки и строго определенные зоны толстой кишки. Она часто связана с системными аутоиммунными расстройствами, такими как язвы во рту и ревматический артрит. Болезнь Крона затрагивает более 500000 человек в Европе и 600000 человек в США. Болезнь Крона является патологией, связанной с индуцируемой клетками Th1 чрезмерной активностью цитокинов. IL-12 является ключевым цитокином в инициировании воспалительной реакции посредством клеток Th1. Болезнь Крона отличается повышенной продукцией IL-12 клетками, имеющими антиген в кишечных тканях, гамма-интерферона (IFN-) и TNF лимфоцитов и кишечными макрофагами. Эти цитокины вызывают и поддерживают воспалительный процесс и утолщают кишечные стенки,что является характерными признаками патологии. Доклинические и клинические данные продемонстрировали, что ингибирование IL-12 эффективно в контроле воспалительной реакции на моделях кишечных воспалений и/или на пациентах, страдающих от болезни Крона. Связь между раком и воспалением теперь является установленным фактом. Многие формы опухолей возникают в месте воспаления, и медиаторы воспаления часто продуцируются в опухолях.IL-23 был идентифицирован как цитокин, связанный с раком, в частности экспрессия IL-23 существенно выше в образцах карциномы человека по сравнению с нормальными соседними тканями. Кроме того, отсутствие существенной экспрессии IL-23 в нормальных соседних тканях предполагает перерегулирование IL-23 в опухолях, усиливая его роль в возникновении опухоли. Европейский патент EP-B-0382276 описывает ряд производных 1-бензил-3-гидроксиметилиндазола,обладающих анальгетической активностью. В свою очередь, европейский патент EP-B-0510748 описывает, с другой стороны, применение этих производных для получения фармацевтической композиции, которая эффективна для лечения аутоиммунных заболеваний. Наконец, европейский патент EP-B-1005332 описывает применение этих производных для получения фармацевтической композиции, которая эффективна в лечении заболеваний, обусловленных продуцированием МСР-1. Считается, что 2-метил-2-[1(фенилметил)-1 Н-индазол-3-ил]метоксипропановая кислота способна ингибировать, в зависимости от дозы, продукцию МСР-1 и TNF-, индуцированную in vitro в моноцитах из LPS и Candida albicans, тогда как это же соединение не обнаруживает никакого влияния на продуцирование цитокинов IL-1 и IL-6 и хемокинов IL-8, MIP-1 и RANTES (Sironi М. et al., "A small synthetic molecule capable of preferentiallyVol. 10, No. 3, 437-41, сентябрь 1999). Европейская патентная заявка EP-A-1185528 относится к применению производных триазина для получения IL-12. Европейские патентные заявки EP-A-1188438 и EP-A-1199074 относятся к применению ингибиторов фермента PDE4, например, ролипрама, арифло и производных диазепининдола, для лечения и профилактики заболеваний, связанных с избыточной продукцией IL-12. Европейская патентная заявкаEP-A-1369119 относится к применению гиалуронана с молекулярным весом от 600000 до 3000000 дальтон для контроля и ингибирования экспрессии IL-12. Европейская патентная заявка EP-A-1458687 относится к применению производных пиримидина для лечения заболеваний, связанных с перепроизводством IL-12. Европейская патентная заявка EP-A-1819341 относится к применению азотных гетероциклических соединений, например производных пиридина, пиримидина и триазина, для ингибирования продуцирования IL-12 (или других цитокинов, таких как IL-23 и IL-27, которые стимулируют продукцию IL12). Европейская патентная заявка ЕР-А-1827447 относится к применению производных пиримидина для лечения заболеваний, связанных с перепроизводством IL-12, IL-23 и IL-27. Европейские патентные заявки EP-A-1869055, EP-A-1869056 и EP-A-1675862 описывают производные 1,3-тиазоло-4,5-пиримидина, которые способны действовать как антагонисты рецептора CX3CR1. Получение соединения [1-(2,4-дихлорбензил)-1 Н-индазол-3-ил]метанол описано в патентных заявках US 2007/0015771 и US 2007/0043057 (соединение 58). Соединение 58 используется как промежуточный продукт для синтеза альдегидных производных и не связано с какой-либо фармакологической активностью. Получение соединения (1-бензил-1 Н-индазол-3-ил)метанол описано в Henke B.R. et al.; "Optimization of 3-(1H-Indazol-3-ylmethyl)-1,5-benzodiazepines as Potent, Orally Active CCK-A Agonists", Journal ofMedicinal Chemistry (1997), 40(17), 2706-2725 (соединение 59). Соединение 59 используется как промежуточный продукт для синтеза бензодиазепина и не связывается с какой-либо фармакологической активностью. Получение соединения [1-(4-хлорбензил)-1 Н-индазол-3-ил]метанол описано в Corsi G., Palazzo G.;Chemistry (1976), 19(6), 778-783 (соединение 46). Соединение 46 используется как промежуточный продукт для синтеза карбоксильных производных и не связывается с какой-либо фармакологической активностью. Несмотря на проявленную до сих пор активность все еще ощущается потребность в новых фарма-3 018976 цевтических композициях и соединениях, которые эффективны для лечения заболеваний, основанных на экспрессии МСР-1, CX3CR1 и р 40. Авторы настоящей заявки неожиданно обнаружили новые производные 1-бензил-3 гидроксиметилиндазола с фармакологической активностью. Авторы настоящей заявки неожиданно обнаружили, что производные 1-бензил-3 гидроксиметилиндазола формулы (I) согласно настоящему изобретению способны снижать продуцирование хемокина МСР-1. Более неожиданно, авторы заявки нашли, что производные 1-бензил-3-гидроксиметилиндазола согласно формуле (I) настоящего изобретения способны снижать экспрессию хемокина МСР-1. Что еще более неожиданно, авторы заявки нашли, что производные 1-бензил-3 гидроксиметилиндазола согласно формуле (I) настоящего изобретения способны снижать экспрессию субъединицы p40, участвующей в продуцировании цитокинов IL-12 и IL-23, и экспрессию рецепторовCX3CR1. Таким образом, в первом аспекте настоящее изобретение относится к соединению формулы (I) в которой А может быть связью , -X1 или -X1-O-Х 2-, гдеX1 и X2, которые могут быть одинаковыми или отличаться друг от друга, могут быть алкильной группой, содержащей от 1 до 5 атомов углерода, возможно замещенных одной или более алкильными группами, содержащими от 1 до 5 атомов углерода, или одной или более алкоксигруппами с 1-3 атомами углерода,Y означает Н, когда А является связью , или Y может означать Н, -ОН или -N(R11)(R12), когда А есть -Х 1- или -X1-O-Х 2-, гдеR11 может быть водородом, алкильной группой, содержащей от 1 до 5 атомов углерода, или R11 вместе с R12 образует 4-7-звенный гетероцикл,R12 может быть водородом, алкильной группой, содержащей от 1 до 5 атомов углерода, или R12 вместе с R11 образуют 4-7-звенный гетероцикл,R1 и R2, которые могут быть одинаковыми или отличаться друг от друга, могут означать водород,алкильную группу, содержащую от 1 до 5 атомов углерода,R3, R4 и R8, которые могут быть одинаковыми или отличаться друг от друга, могут означать водород, алкильную группу, содержащую от 1 до 5 атомов углерода, алкоксигруппу с 1-3 атомами углерода,атом галогена, -ОН, -N(R')(R"), -N(R')COR", -CN, -CONR'R", -SO2NR'R", -SO2R', нитро и трифторметил; причем R' и R", которые могут быть одинаковыми или отличаться друг от друга, означают водород и алкильную группу, содержащую от 1 до 5 атомов углерода,R5 может быть водородом, алкильной группой, содержащей от 1 до 5 атомов углерода, алкоксигруппой с 1-3 атомами углерода, атомом галогена, -ОН, -N(R')(R"), -N(R')COR", нитро и трифторметилом, или R5 вместе с одним из R6 и R7 образуют цикл, содержащий 5 или 6 атомов углерода; с R' и R",которые могут быть одинаковыми или отличаться друг от друга, означающими водород и алкильную группу, содержащую от 1 до 5 атомов углерода,R6 и R7, которые могут быть одинаковыми или отличаться друг от друга, могут означать водород,алкильную группу, содержащую от 1 до 5 атомов углерода, или вместе образуют группу С=O, или один из R6 и R7 вместе с R5 образуют цикл, содержащий 5 или 6 атомов углерода, при условии, что когда А есть связь , и Y, R1, R2, R6 и R7 означают атомы водорода, то если R8 означает атом водорода, то группа, связанная с атомом азота в положении 1 индазольного кольца, не является бензильной группой, 4-хлорбензильной группой или 2-4-дихлорбензильной группой,если R8 означает атом фтора в положении 5 индазольного цикла, то группа, соединенная с атомом азота в положении 1 индазольного цикла, отлична от 5-хлоро-2-метоксибензильной группы, и если R8 означает трифторметильную группу в положении 6 индазольного цикла, то группа, соединенная с атомом азота в положении 1 индазольного цикла, не является 2-4-дихлорбензильной группой. Во втором аспекте настоящее изобретение относится к фармацевтической композиции, содержащей новые производные 1-бензил-3-гидроксиметилиндазола согласно формуле (I) или его фармацевтически приемлемую соль, вместе с по меньшей мере одним фармацевтически приемлемым наполнителем. Перерегулирование и/или повышение экспрессии вышеупомянутых МСР-1, CX3CR1 и p40, причем последний приводит в результате к экспрессии/продуцированию IL-12 и/или IL-23, что приводит к раз-4 018976 витию патологии и/или заболевания, часто называется в данной области термином "сверхэкспрессия". Для целей настоящего изобретения предполагается, что термин "экспрессия" включает сверхэкспрессию,как известно в данной области. Неожиданно авторы заявки обнаружили, что производные 1-бензил-3-гидроксиметилиндазола согласно формуле (I) настоящего изобретения могут применяться для получения фармацевтической композиции, которая эффективна в лечении заболеваний, основанных на экспрессии хемокина МСР-1, субъединицы p40 и, следовательно, цитокинов IL-12 и IL-23, и рецептора CX3CR1. Таким образом, в третьем аспекте настоящее изобретение относится к применению соединения формулы (I) в которой А может быть связью , -Х 1- или -Х 1-O-Х 2-, гдеX1 и Х 2, которые могут быть одинаковыми или отличаться друг от друга, могут означать алкильную группу, содержащую от 1 до 5 атомов углерода, возможно замещенных одной или более алкильными группами, содержащими от 1 до 5 атомов углерода, или одной или более алкоксигруппами с 1-3 атомами углерода,Y означает Н, когда А является связью , или Y может быть Н, -ОН или -N(R11)(R12), когда А означает -X1- или -X1-O-X2-, гдеR11 может быть водородом, алкильной группой, содержащей от 1 до 5 атомов углерода, или R11 вместе с R12 образуют 4-7-звенный гетероцикл,R12 может быть водородом, алкильной группой, содержащей от 1 до 5 атомов углерода, или R12 вместе с R11 образуют 4-7-звенный гетероцикл,R1 и R2, которые могут быть одинаковыми или отличаться друг от друга, могут быть водородом, алкильной группой, содержащей от 1 до 5 атомов углерода,R3, R4 и R8, которые могут быть одинаковыми или отличаться друг от друга, могут означать водород, алкильную группу, содержащую от 1 до 5 атомов углерода, алкоксигруппу с 1-3 атомами углерода,атом галогена, -ОН, -N(R')(R"), -N(R')COR", -CN, -CONR'R", -SO2NR'R", -SO2R', нитро и трифторметил,причем R' и R", которые могут быть одинаковыми или отличаться друг от друга, означают водород и алкильную группу, содержащую от 1 до 5 атомов углерода,R5 может быть водородом, алкильной группой, содержащей от 1 до 5 атомов углерода, алкоксигруппой с 1-3 атомами углерода, атомом галогена, -ОН, -N(R')(R"), -N(R')COR", нитро и трифторметилом, или R5 вместе с одним из R6 и R7 образуют цикл, содержащий 5 или 6 атомов углерода; причем R' иR", которые могут быть одинаковыми или отличаться друг от друга, означают водород и алкильную группу, содержащую от 1 до 5 атомов углерода,R6 и R7, которые могут быть одинаковыми или отличаться друг от друга, могут означать водород,алкильную группу, содержащую от 1 до 5 атомов углерода, или вместе образуют группу C=O, или один из R6 и R7 вместе с R5 образуют цикл, содержащий 5 или 6 атомов углерода, для получения фармацевтической композиции для лечения заболеваний, основанных на экспрессии МСР-1, CX3CR1 и p40. Кроме того, в четвертом аспекте настоящее изобретение относится к способу лечения или предупреждения заболеваний, основанных на экспрессии МСР-1, CX3CR1 и p40, отличающемуся введением нуждающемуся в этом лицу эффективного количества описанного выше соединения формулы (I). Подробное описание изобретения В описанной выше формуле (I) остаток А представляет собой связь , группу -X1- или группу -Х 1 О-Х 2-. Предпочтительно в описанной выше формуле (I) X1 и Х 2 независимо друг от друга означают алкильную группу, содержащую от 1 до 4 атомов углерода, возможно замещенных одной или более алкильными группами, содержащими от 1 до 3 атомов углерода, или одной или более алкоксигруппами с 1 или 2 атомами углерода. Более предпочтительно X1 означает группу СН 2, группу СН 2 СН 2, группу С(СН 3)2 или группу С(СН 3)2 СН 2, и Х 2 означает группу СН 2, группу СН 2 СН 2 или группу СН 2 СН 2 СН 2. Предпочтительно в описанной выше формуле (I) остаток А представляет собой связь , группу СН 2 СН 2, группу СН 2 СН 2 СН 2, группу С(СН 3)2 СН 2, группу СН 2 СН 2 ОСН 2, группу СН 2 СН 2 ОСН 2 СН 2, группу С(СН 3)2 СН 2 ОСН 2 и группу С(СН 3)2 СН 2 ОСН 2 СН 2. В описанной выше формуле (I), когда А означает связь , то Y означает атом водорода, а когда А означает -X1- или -X1-O-Х 2-, то Y может быть водородом, -ОН или -N(R11)(R12). Предпочтительно R11 означает атом водорода, алкильную группу с 1-3 атомами углерода, или R11 вместе с R12 образуют 5-или 6-звенный гетероцикл. Предпочтительно R12 означает атом водорода, алкильную группу с 1-3 атомами углерода, или R12 вместе с R11 образуют 5-или 6-звенный гетероцикл. Предпочтительно R1 и R2, которые могут быть одинаковыми или разными, означают атом водорода,алкильную группу с 1-3 атомами углерода. Предпочтительно R3, R4 и R8, которые могут быть одинаковыми или разными, означают атом водорода, алкильную группу с 1-3 атомами углерода, алкоксигруппу, содержащую 1 или 2 атома углерода,атом Br, Cl или F, ОН-группу, нитрогруппу, трифторметильнуюю группу или группу N(R')(R"),-N(R')COR"; -CN, -CONR'R", -SO2NR'R", -SO2R', где R' и R", которые могут быть одинаковыми или разными, означают атом водорода и алкильную группу с 1-3 атомами углерода. Предпочтительно R5 означает атом водорода, алкильную группу с 1-3 атомами углерода, алкоксигруппу, содержащую 1 или 2 атома углерода, атом галогена, ОН-группу, или R5 вместе с одним из R6 иR7 образует цикл, содержащий 5 или 6 атомов углерода. Предпочтительно R6 и R7, которые могут быть одинаковыми или разными, означают атом водорода,алкильную группу с 1-3 атомами углерода, или вместе образуют группу C=O, или один из R6 и R7 вместе с R5 образует цикл, содержащий 5 или 6 атомов углерода. В случае определенных заместителей, соединение формулы (I) согласно настоящему изобретению может иметь асимметричный атом углерода и, следовательно, может находиться в форме стереоизомеров и энантиомеров. В зависимости от природы заместителей соединение формулы (I) может образовывать соли присоединения с физиологически приемлемыми органическими или неорганическими кислотами или основаниями. Типичными примерами подходящих физиологически приемлемых неорганических кислот являются соляная кислота, бромисто-водородная кислота, серная кислота, фосфорная кислота и азотная кислота. Типичными примерами подходящих физиологически приемлемых органических кислот являются уксусная кислота, аскорбиновая кислота, бензойная кислота, лимонная кислота, фумаровая кислота, молочная кислота, малеиновая кислота, метансульфоновая кислота, щавелевая кислота, паратолуолсульфоновая кислота, бензолсульфоновая кислота, янтарная кислота, дубильная кислота и винная кислота. Типичными примерами подходящих физиологически приемлемых неорганических оснований являются гидроксиды, карбонаты и гидрокарбонаты аммония, кальция, магния, натрия и калия, например гидроксид аммония, гидроксид кальция, карбонат магния, гидрокарбонат натрия, гидрокарбонат калия. Типичными примерами подходящих физиологически приемлемых органических оснований являются аргинин, бетаин, кофеин, холин, N,N-дибензилэтилендиамин, диэтиламин, 2-диэтиламиноэтанол, 2 диметиламиноэтанол,этаноламин,этилендиамин,N-этилморфолин,N-этилпиперидин,Nметилглюкамин,глюкамин,глюкозамин,гистидин,N-(2-гидроксиэтил)пиперидин,N-(2 гидроксиэтил)пирролидин, изопропиламин, лизин, метилглюкамин, морфолин, пиперазин, пиперидин,теобромин, триэтиламин, триметиламин, трипропиламин и трометамин. В зависимости от природы заместителей соединение формулы (I) может образовывать сложные эфиры с физиологически приемлемыми органическими кислотами. Типичными примерами подходящих физиологически приемлемых органических кислот являются уксусная кислота, аскорбиновая кислота,бензойная кислота, лимонная кислота, фумаровая кислота, молочная кислота, малеиновая кислота, метансульфоновая кислота, щавелевая кислота, пара-толуолсульфоновая кислота, бензолсульфоновая кислота, янтарная кислота, дубильная кислота и винная кислота. Соединения по настоящему изобретению могут также включать и фармацевтически приемлемые соли соединений, представленных формулой (I), описанной в формуле изобретения. Подразумевается, что термины "фармацевтически приемлемый" и "физиологически приемлемый" определяют, без каких-либо особых ограничений, любой материал, подходящий для приготовления фармацевтической композиции для введения живому существу. Соединения согласно формуле (I) настоящего изобретения могут применяться для получения фармацевтической композиции, которая эффективна для лечения заболеваний (или патологий), основанных на экспрессии хемокина МСР-1, цитокина p40, субъединицы p40 (участвующей в продуцировании цитокинов IL-12 и IL-23) и рецептора CX3CR1. Предпочтительно патологии, связанные с экспрессией МСР-1 и CX3CR1, представляют собой заболевания суставов, заболевания почек, сердечно-сосудистые заболевания, метаболический синдром, ожирение, диабет и резистентность к инсулину. В частности, патологиями, связанными с экспрессией МСР-1, являются ревматоидный артрит, артрит, вызванный вирусными инфекциями, псориатический артрит, артроз, люпус-нефрит, диабетическая нефропатия, гломерулонефрит, поликистоз почек, интерстициальные заболевания легких, фиброз, рассе-6 018976 янный склероз, болезнь Альцгеймера, деменция, связанная с ВИЧ, атопический дерматит, псориаз, васкулит, рестеноз, атеросклероз, инфаркт миокарда, стенокардия, острые коронарные заболевания, аденомы, карциномы и метастазы, метаболические заболевания и осложнения после хирургических вмешательств, таких, например, как пластика сосудов, артерэктомия, методы восстановления кровообращения,трансплантанты, замещения органов, замещения ткани и вживление протезов. В частности, патологиями, связанными с экспрессией CX3CR1, являются ревматоидный артрит,люпус-нефрит, диабетическая нефропатия, болезнь Крона, неспецифический язвенный колит, коронарные нарушения,рестеноз, атеросклероз, инфаркт миокарда, стенокардия и осложнения после хирургических вмешательств, таких, например, как пластика сосудов, артерэктомия и методы восстановления кровообращения. Предпочтительно патологиями, связанными с экспрессией р 40 и, таким образом, IL-12 и IL-23, являются аутоиммунные заболевания, такие как хронические дегенеративные воспалительные заболевания. В частности, патологиями, связанными с экспрессией р 40, являются ревматоидный артрит, псориаз,гломерулонефрит, диабет, красная волчанка, болезнь Крона. Предпочтительно фармацевтические композиции по настоящему изобретению готовят в подходящей лекарственной форме, содержащей эффективную дозу по меньшей мере одного соединения формулы (I) или его фармацевтически приемлемой соли, сложного эфира или пролекарства, и по меньшей мере один фармацевтически приемлемый наполнитель. Примерами фармацевтически приемлемых наполнителей, известных в уровне техники, являются,например, регуляторы сыпучести, связующие, агенты дезинтеграции, наполнители, разбавители, вкусовые добавки, красители, флюидизаторы, смазки, консерванты, увлажнители, абсорбенты и подсластители. Подходящими примерами фармацевтически приемлемых эксципиентов являются сахара, такие как лактоза, глюкоза или сахароза, крахмалы, такие как кукурузный крахмал и картофельный крахмал, целлюлоза и ее производные, например натрийкарбоксиметилцеллюлоза, этилцеллюлоза и ацетат целлюлозы, трагакантовая камедь, солод, желатин, тальк, масло какао, воски, масла, такие как арахисовое масло,хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло, гликоли, такие как пропиленгликоль, полиолы, такие как глицерин, сорбит, маннитол и полиэтиленгликоль, сложные эфиры, такие как этилолеат и этиллаурат, агар-агар и т.п. Примерами подходящих лекарственных форм являются таблетки, капсулы, таблетки с покрытием,гранулы, растворы и сиропы для введения через рот; медицинские пластыри, растворы, пасты, кремы и мази для чрескожного введения; суппозитории для ректального введения и стерильные растворы для инъекций или для введения в виде аэрозоля. Другими подходящими лекарственными формами являются формы пролонгированного действия и формы на основе липосом как для перорального введения, так и для инъекций. Лекарственные формы могут также содержать другие обычные компоненты, такие как консерванты, стабилизаторы, ПАВы, буферы, регуляторы осмотического давления, эмульгаторы, подсластители,красители, вкусовые добавки и т.п. Если это необходимо для конкретного лечения, фармацевтическая композиция по настоящему изобретению может содержать другие фармакологически активные ингредиенты, одновременное введение которых полезно. Количество соединения формулы (I) или его фармацевтически приемлемой соли, сложного эфира или пролекарства в фармацевтической композиции по настоящему изобретению может варьироваться в широком диапазоне в зависимости от известных факторов, например типа патологии, которую требуется лечить, тяжести заболевания, веса тела пациента, лекарственной формы, выбранного способа введения,числа ежедневных приемов и эффективности выбранного соединения формулы (I). Однако оптимальное количество может быть определено специалистом в данной области просто и стандартными методами. Типично, количество соединений формулы (I) или их фармацевтически приемлемой соли, сложного эфира или пролекарства в фармацевтической композиции по настоящему изобретению будет таким, чтобы оно обеспечивало уровень введения от 0,001 до 100 мг/кг/сутки. Предпочтительный уровень введения составляет от 0,05 до 50 мг/кг/сутки, еще более предпочтительно от 0,1 до 10 мг/кг/сутки. Лекарственные формы фармацевтической композиции по настоящему изобретению могут быть приготовлены в соответствии с методами, хорошо известными химикам-фармацевтам, включая смешение, гранулирование, уплотнение, растворение, стерилизацию и подобное. Активность соединений по настоящему изобретению по отношению к МСР-1 и CX3CR1 было продемонстрировано in vitro на человеческих моноцитах методами анализа генной экспрессии путем анализа в "реальном времени" продуцирования RT-PCR и по анализу продукции белков в иммуноферментном тесте. Как известно специалистам в данной области, вышеупомянутые экспериментальные модели считаются полезными для проверки активности соединения в отношении экспрессии и продукции МСР-1 и экспрессии CX3CR1. Следовательно, вышеназванные модели могут считаться предсказательными в отношении активности на человеке для лечения патологий, характеризующихся экспрессией и продуцированием МСР-1, экспрессией CX3CR1 и воспалительными состояниями в присутствии инфильтратов,-7 018976 обогащенных моноцитами и макрофагами. Активность соединений по настоящему изобретению в отношении p40 была продемонстрирована invitro на человеческих моноцитах методами анализа в реальном времени экспрессии посредством RTPCR. Как известно специалистам в данной области, вышеуказанные экспериментальные модели полезны для проверки активности соединений в отношении экспрессии p40 и могут считаться предсказательными в отношении активности для лечения у человека патологий, характеризующихся экспрессией р 40. Получение соединений общей формулы (I) может быть осуществлено согласно одной из следующих процедур. Способ (А) применяется, когда заместитель А в формуле (I) означает связь . Способы(В), (С) и (D) применимы, когда заместитель А в формуле (I) отличен от связи . Способ (А): В способе (А) сложные эфиры индазолкарбоновой кислоты общей формулы (II), в которой Alk означает алкильную группу, содержащую от 1 до 5 атомов углерода, восстанавливают до соответствующих спиртов общей формулы (III). Заместители R1-R8 имеют значения, указанные ранее для соединений формулы (I). Способ (А) может быть осуществлен в соответствии с традиционными методиками. Например, восстановление сложных эфиров карбоновой кислоты формулы (II) может проводиться с помощью восстановителей, таких как гидрид литий-алюминия, боргидрид натрия, или металлоорганические агенты, такие как реагент Гриньяра. Обычно реакция проводится в подходящих апротонных растворителях, таких, например, как тетрагидрофуран, диэтиловый эфир и 1,4-диоксан. Реакции обычно проводятся при температуре, которая может варьироваться от примерно 0 С до температуры обратного стекания растворителя, причем они могут длиться от 1-2 до 24 ч. Способ (В): В способе (В) продукты общей формулы (IV), в которой Q означает уходящую группу, выбранную из группы, содержащей галоген, CH3SO3- и p-CH3PhSO3-, приводятся в реакцию со спиртами общей формулы (V). Заместители R1-R8, А и Y имеют значения, указанные выше для соединений формулы (I). Способ (В) может быть осуществлен обычными методами. Например, спирты формулы (V) приводятся в реакцию с производными формулы (IV). Предпочтительно Q означает уходящую группу, выбранную из группы, содержащей атом хлора, атом брома и метансульфонильную группу. Реакция проводится в присутствии подходящего основания и в подходящем растворителе. Основаниями, которые могут использоваться, являются NaH, бутиллитий и диизопропиламид лития, а подходящими растворителями для этого типа реакции являются обычно полярные апротонные растворители,такие, например, как тетрагидрофуран, диэтиловый эфир и 1,4-диоксан. Обычно реакция проводится при температуре от комнатной температуры и до температуры кипения с обратным стеканием используемого растворителя. Реакции этого типа могут длиться от нескольких часов до нескольких дней. Способ (С): В способе (С) продукты общей формулы (VI), в которых Q означает уходящую группу, выбранную из группы, содержащей галоген, CH3SO3- и p-CH3PhSO3-, приводятся в реакцию со спиртами и аминами общей формулы (VII). Заместители R1-R8, А и Y имеют значения, указанные ранее для соединений формулы (I). Способ (С) может быть осуществлен согласно традиционным методам. Например, амины общей формулы (VII) приводятся в реакцию с производными формулы (VI) в присутствии подходящего основания и в подходящем растворителе. Предпочтительно Q является уходящей группой, предпочтительно выбранной из группы, состоящей из атома хлора, атома брома и метансульфонильной группы. Предпочтительно используемыми основаниями являются карбонат натрия, карбонат калия и алифатические амины, такие как триэтиламин, диизопропилэтиламин или тот же реакционноспособный амин (VII). Предпочтительно используемые растворители являются полярными апротонными растворителями, такими как N,N-диметилформамид, тетрагидрофуран и дихлорметан. Обычно реакция проводится при температуре от комнатной температуры и до температуры кипения используемого растворителя с обратным стеканием. Реакции этого типа могут длиться от нескольких часов до нескольких дней. Когда соединения формулы (VII) являются спиртами, стандартные методики реакции могут использовать сильные основания, такие как NaH, бутиллитий или диизопропиламид лития, и подходящие полярные апротонные растворители, такие как тетрагидрофуран, диэтиловый эфир или 1,4-диоксан. Обычно реакция проводится при температуре от комнатной температуры и до температуры кипения используемого растворителя с обратным стеканием. Реакции этого типа могут длиться от нескольких часов до нескольких дней. Способ (D): В способе (D) сложные эфиры или амиды общей формулы (VIII) восстанавливают соответственно до спиртов или аминов общей формулы (I). Заместители R1-R8, А и Y имеют значения, указанные ранее для соединений формулы (I), причем группа В-СН 2 имеет те же значения, что и А. Способ (D) может быть осуществлен в соответствии со стандартными методами. Например, восстановление карбонильных соединений формулы (VIII) может проводиться с помощью восстановителей,таких как гидрид литий-алюминия, боргидрид натрия или металлоорганические агенты, как реагент Гриньяра. Обычно реакция проводится в подходящих апротонных растворителях, например тетрагидрофуране, диэтиловом эфире и 1,4-диоксане. Реакции обычно проводятся при температуре в диапазоне от примерно 0 С то точки кипения растворителя, а длительность реакции может варьироваться от 1-2 до 24 ч. Следующие примеры предназначены для иллюстрации настоящего изобретения, однако никоим образом не ограничивают его. Примеры получения Соединения формулы (I), перечисленные ниже в табл. А, были получены с использованием описанных ранее способов получения. Таблица А Ниже приводятся детали получения соединений 1-18. Соединения 19-39 были получены близкими методами, используя подходящие исходные продукты и реагенты. Получение соединения 1. 1-Бензил-3-гидроксиметилиндазол Получение продукта 1 проводилось, как описано в примере 1 а патента ЕР 0382276 А 2. Получение соединения 2.[1-(4-Метоксибензил)-1 Н-индазол-3-ил]метанол К суспензии 60% NaH (2,7 г; 0,07 моль) в толуоле (200 мл) добавляли 1-бензил-3 гидроксиметилиндазол (10 г; 0,07 моль). Смесь доводили до температуры кипения и оставляли перемешиваться при обратном стекании 1 ч. Затем добавляли 4-метоксибензилхлорид (14 г; 0,09 моль). Затем смесь перемешивали 4 ч при температуре обратного холодильника. Реакцию завершали охлаждением смеси до комнатной температуры и добавлением воды (50 мл). Органическую фазу отделяли и промывали соответственно 2 н HCl (50 мл) и водой (550 мл). Растворитель выпаривали при пониженном давлении. Полученный так необработанный остаток очищали флеш-хроматографией на силикагеле, используя в качестве элюента смесь 3/2 гексан/этилацетат. Полученный продукт кристаллизовали из смеси 5/1 гексан/этилацетат, получая 5,1 г [1-(4-метоксибензил)-1 Н-индазол-3-ил]метанола с температурой плавления 95-97C. 1[1-(4-Метилбензил)-1 Н-индазол-3-ил]метанол Продукт получали, используя способ, описанный для получения соединения 2, но используя в качестве реагента 4-метилбензилхлорид (0,09 моль) вместо 4-метоксибензилхлорида. Полученный продукт очищали кристаллизацией из смеси 5/1 гексан/этилацетат. Т. плавл. = 90-92C 1[1-(4-Хлорбензил)-1 Н-индазол-3-ил]метанол Продукт получали, используя способ, описанный для получения соединения 2, но используя в качестве реагента 4-хлорбензил (0,09 моль) вместо 4-метоксибензилхлорида. Полученный продукт очищали кристаллизацией из смеси 5/1 гексан/этилацетат. Т-ра плавл. = 102-104C 1[1-(3,4-Дихлорбензил)-1 Н-индазол-3-ил]метанол Продукт получали, используя способ, описанный для получения соединения 2, но используя в качестве реагента 3,4-дихлорбензилхлорид (0,09 моль) вместо 4-метоксибензилхлорида. Полученный продукт очищали кристаллизацией из смеси 1/1 гексан/этилацетат. Т.плавл. = 118-120C 1[1-(2,4-Дихлорбензил)-1 Н-индазол-3-ил]метанол Продукт получали, используя способ, описанный для получения соединения 2, но используя в качестве реагента 2,4-дихлорбензилхлорид (0,09 моль) вместо 4-метоксибензилхлорида. Полученный продукт очищали кристаллизацией из смеси 7/3 этанол/вода. Т.плавл. = 105-106C 1[1-(4-Фторбензил)-1 Н-индазол-3-ил]метанол Продукт получали, используя способ, описанный для получения соединения 2, но используя в качестве реагента 4-фторбензилхлорид (0,09 моль) вместо 4-метоксибензилхлорида. Продукт очищали кристаллизацией из гексана. Т.плавл. = 80-81C 1[1-(4-Хлор-2-метилбензил)-1 Н-индазол-3-ил]метанол Продукт получали, используя способ, описанный для получения соединения 2, но используя в качестве реагента 4-хлор-2-метилбензилхлорид (0,09 моль) вместо 4-метоксибензилхлорида. Продукт очищали кристаллизацией из абсолютного этанола. Т.плавл. = 109-110C 1 Н-ЯМР (DMSO-d6,ppm): 2,34 (с, 3H), 4,78 (д, J=5,70 Гц, 2H), 5,26 (тройной д, J=5,77; 0,88 Гц,1H), 5,58 (с, 2H), 6,74 (д, J=8,18 Гц, 1H), 7,09-7,18 (м, 2H), 7,29 (д, J=2,05 Гц, 1H), 7,37 (тройной д, J=8,33; 7,02; 1,02 Гц, 1H), 7,59 (д, J=8,48 Гц, 1H), 7,88 (д, J=8,04 Гц, 1H). Получение соединения 9. (1-Бензил-5-метокси-1 Н-индазол-3-ил)метанол 9 а) Бензил 1-бензил-5-метокси-1 Н-индазол-3-карбоксилат Суспензию 5-метокси-1 Н-индазол-3-карбоновой кислоты (21,5 г; 0,11 моль) и 60% NaH (10,5 г; 0,44 моль) в N,N-диметилформамиде (ДМФ) (200 мл) перемешивали 1 ч при 70C. Затем медленно добавляли бензилхлорид (32,9 г; 0,26 моль) и смесь перемешивали при 70C 4 ч. Реакцию завершали охлаждением смеси до комнатной температуры и выливанием смеси в воду и лед. Продукт экстрагировали этилацетатом (3250 мл). Объединенные органические фазы концентрировали при пониженном давлении. Полученный так необработанный остаток очищали последовательной кристаллизацией из 95-го этанола, получая 18 г бензил 1-бензил-5-метокси-1 Н-индазол-3-карбоксилата с температурой плавления 107-109C. 1H-ЯМР (CDCl3,ppm): 3,78 (с, 3H), 5,51 (с, 2H), 6,9-7,6 (м, 13H). 9b) (1-Бензил-5-метокси-1 Н-индазол-3-ил)метанол К раствору бензил 1-бензил-5-метокси-1 Н-индазол-3-карбоксилата (17,7 г; 0,05 моль), диэтилового эфира (100 мл) и тетрагидрофурана (ТГФ) (170 мл), перемешиваемому при комнатной температуре, медленно добавляли LiAlH4 (3,8 г; 0,1 моль). После окончания добавления суспензию перемешивали 24 ч при температуре обратного холодильника. Реакцию завершали разрушением избыточного LiAlH4 путем добавления воды (40 мл) и 5 н NaOH (10 мл). Органическую фазу отделяли и растворитель выпаривали при пониженном давлении. Полученный необработанный остаток очищали кристаллизацией из 95-ного этанола, получая 14 г (1-бензил-5-метокси-1 Н-индазол-3-ил)метанола с температурой плавления 97-98C. 1 Н-ЯМР (CDCl3,ppm): 3,3 (шир.с, 1H), 3,80 (с, 3H), 4,92 (с, 2H), 5,47 (с, 2H), 6,9-7,5 (м, 8H). Получение соединения 10. 2-[1-(4-Хлор-2-метилбензил)-1 Н-индазол-3-ил]пропан-2-ол 10 а) Этил 1-(4-хлор-2-метилбензил)-1 Н-индазол-3-карбоксилат К суспензии 1-(4-хлор-2-метилбензил)-1 Н-индазол-3-карбоновой кислоты, полученной, как описано в J. Med. Chem. (1976) 19, 778-783, (120 г; 0,4 моль) в абсолютном этаноле (850 мл), перемешиваемой при комнатной температуре, осторожно добавляли концентрированную H2SO4 (15 мл). Затем смесь кипятили с обратным холодильником 9 ч. Затем реакцию завершали охлаждением смеси до комнатной температуры. Образованную так твердую фазу отфильтровывали в холодных условиях (10C) и тщательно промывали на фильтре водой. Так было получено 126 г этил 1-(4-хлор-2-метилбензил)-1 Н-индазол-3- 11018976 карбоксилата, который использовали в дальнейшей реакции без дополнительной очистки. Т. плавл. = 120-122C 1(д, J=8,20 Гц, 1H), 7,0-7,4 (м, 5H), 8,1-8,3 (м, 1H). 10b) 2-[1-(4-Хлор-2-метилбензил)-1 Н-индазол-3-ил]пропан-2-ол К раствору, образованному из магниевой стружки (2,4 г; 0,1 моль) и метилиодида (6,1 мл; 0,1 моль) в диэтиловом эфире (100 мл), перемешиваемому при примерно 5C, добавляли этил 1-(4-хлор-2 метилбензил)-1 Н-индазол-3-карбоксилат (13,2 г; 0,04 моль). Смесь перемешивали в холодных условиях 24 ч. Реакцию завершали добавлением насыщенного раствора хлорида аммония (50 мл) и отделенную органическую фазу промывали водой (250 мл). Затем органическую фазу концентрировали при пониженном давлении и необработанный остаток очищали кристаллизацией из петролейного эфира при 4060C. Таким образом было получено 6 г 2-[1-(4-хлор-2-метилбензил)-1 Н-индазол-3-ил]пропан-2-ола. Т.плавл. = 72-74C 1H-ЯМР (DMSO-d6,ppm): 1,60 (с, 6H), 2,38 (с, 3H), 5,24 (с, 1H), 5,56 (с, 2H), 6,66 (д, J=8,18 Гц, 1H),7,04-7,16 (м, 2H), 7,25-7,36 (м, 2H), 7,52 (д, J=8,48 Гц, 1H), 8,05 (д, J=8,33 Гц, 1H). Получение соединения 11. 2-[1-(2,4-Дихлорбензил)-1 Н-индазол-3-ил]пропан-2-ол 11 а) Этил 1-(2,4-дихлорбензил)-1 Н-индазол-3-карбоксилат Продукт получали, используя способ, описанный для получения соединения 10 а, но используя в качестве реагента 1-(2,4-дихлорбензил)-1 Н-индазол-3-карбоновую кислоту (0,4 моль), полученную, как описано в J. Med. Chem. (1976) 19, 778-783, вместо 1-(4-хлор-2-метилбензил)-1 Н-индазол-3-карбоновой кислоты. Продукт очищали флеш-хроматографией на силикагеле, используя в качестве элюента смесь 7/3 гексан/этилацетат. 1H-ЯМР (CDCl3,ppm): 1,47 (т, J=7,24 Гц, 3H), 5,42 (квинтет, J=7,24 Гц, 2H), 5,75 (с, 2H), 6,68 (д,J=8,75 Гц, 1H), 6,9-7,5 (м, 5H), 8,1-8,4 (м, 1H). 11b) 2-[1-(2,4-Дихлорбензил)-1 Н-индазол-3-ил]пропан-2-ол Продукт получали, используя способ, описанный для получения соединения 10b, но используя в качестве исходного материала соединение 11 а (0,4 моль) вместо соединения 10 а. Продукт очищали двукратной кристаллизацией из гексана. Т. плавл.=76-78C 1H-ЯМР (DMSO-d6,ppm): 1,60 (с, 6H), 5,26 (с, 1H), 5,65 (с, 2H), 6,72 (д, J=8,33 Гц, 1H), 7,11 (т,J=7,45 Гц, 1H), 7,27-7,40 (м, 2H), 7,54 (д, J=8,48 Гц, 1H), 7,66 (д, J=2,19 Гц, 1H), 8,07 (д, J=8,18 Гц, 1H). Получение соединения 12. 1-[1-(4-Хлор-2-метилбензил)-1 Н-индазол-3-ил]этанол 12 а) 1-(4-Хлор-2-метилбензил)-1 Н-индазол-3-карбоксальдегид Смесь, образованную из 1-(4-хлор-2-метилбензил)-1 Н-индазол-3-карбоновой кислоты (250 г; 0,83 моль) и тионилхлорида (450 мл), перемешивали при 50C, пока не растворится исходный материал (30 мин), и затем грели при 80C 5 ч. Реакцию завершали охлаждением раствора до комнатной температуры и удалением растворителя путем перегонки при пониженном давлении. Затем остаток обрабатывали гексаном (300 мл), и полученную так твердую фазу отфильтровывали и сушили в вакууме, получая 240 г промежуточного ацилхлорида, который суспендировали в толуоле (2,5 л) и добавляли к этому Nметиланилин (88 г; 0,82 моль) при комнатной температуре. Затем смесь перемешивали 6 ч при 80C. Затем реакцию завершали добавлением толуола (1,5 л) к смеси и промывкой раствора водой до нейтральности. Органическую фазу концентрировали до 50% при пониженном давлении. Затем раствор охлаждали до 0C и полученную твердую субстанцию отфильтровывали, получая примерно 230 г анилина, который растворяли в диэтиловом эфире (2,7 л) и ТГФ (400 мл). Полученный раствор перемешивали при 0C. К раствору медленно добавляли LiAlH4 (10,8 г; 0,29 моль). После завершения добавления суспензию перемешивали при комнатной температуре 24 ч. Реакцию завершали осторожным добавлением в смесь воды (20 мл), 2 н NaOH (20 мл) и снова воды (35 мл). Затем смесь фильтровали и растворитель концентрировали при пониженном давлении. Остаток вводили в метанол (3,5 л) и перемешивали при 50C. К этому раствору добавляли раствор NaHSO3 (228 г; 2,19 моль) в воде (650 мл). Смесь перемешивали 30 мин и затем охлаждали до 0C, образованную так твердую фазу отфильтровывали и затем добавляли в водный 10%-ный раствор Na2CO3 (3 л), перемешиваемый при комнатной температуре. Через 3 ч смесь фильтровали и твердую фазу очищали кристаллизацией, сначала из смеси 1/1 этанол/этилацетат, затем из 95-ного этанола. Таким образом получали 98 г 1-(4-хлор-2-метилбензил)-1 Н-индазол-3-карбоксальдегида. Т.плавл. = 107-109C 1 12b) 1-[1-(4-хлор-2-метилбензил)-1 Н-индазол-3-ил]этанол Продукт получали, используя способ, описанный для получения соединения 10b, но используя как исходный материал соединение 12 а (0,4 моль) вместо соединения 10 а. Продукт очищали путем кристаллизации из гексана. Т.плавл. = 82-84C 1 Н-ЯМР (DMSO-d6,ppm): 1,54 (д, J=6,58 Гц, 3H), 2,36 (с, 3H), 5,10 (дв.квинтет, J=6,53; 4,82 Гц,1H), 5,34 (д, J=4,82 Гц, 1H), 5,56 (с, 2H), 6,70 (д, J=8,18 Гц, 1H), 7,06-7,17 (м, 2H), 7,29 (д, J=1,90 Гц, 1H),7,34 (тройной д, J=8,33; 7,02; 1,02 Гц, 1H), 7,56 (д, J=8,48 Гц, 1H), 7,95 (д, J=8,18 Гц, 1H). Получение соединения 13. 2-[(1-Бензил-1 Н-индазол-3-ил)метокси]этанол К раствору NaOH (2,8 г; 0,07 моль) в этиленгликоле (150 мл), перемешиваемому при комнатной температуре, добавляли 1-бензил-3-хлорметилиндазол (17,6 г; 0,07 моль), полученный, как описано в примере 2 а патента ЕР 382276. Раствор грели 4 ч при 130C и затем охлаждали до комнатной температуры, и растворитель выпаривали при пониженном давлении. Остаток вводили в воду (100 мл) и продукт экстрагировали этилацетатом (3100 мл). Соединенные органические фазы концентрировали при пониженном давлении и полученный необработанный остаток очищали кристаллизацией из смеси гексан/этилацетат приблизительно 1/1. Таким образом было получено 13,8 г 2-[(1-бензил-1 Н-индазол-3-ил)метокси]этанола. Т.плавл.=67-69C 1H-ЯМР (CDCl3,ppm): 2,15 (шир.с, 1H), 3,61-3,82 (м, 4H), 4,97 (с, 2H), 5,57 (с, 2H), 7,11-7,38 (м,8H), 7,81 (дв.т, J=8,15; 0, 97 Гц, 1H). Получение соединения 14. 2-[(1-Бензил-1 Н-индазол-3-ил)метокси]-N,N-диметилэтанамина гидрохлорид К раствору (1-бензил-1 Н-индазол-3-ил)метанола (20 г; 0,084 моль) в толуоле (200 мл), перемешиваемому при комнатной температуре, добавляли 55%-ный NaH (3,6 г; 0,082 моль). Через 30 мин после окончания добавления добавляли раствор 2-хлор-N,N-диметилэтанамина (9,2 г; 0,082 моль) в толуоле(200 мл). Смесь перемешивали 7 ч при температуре обратного холодильника. Реакцию завершали добавлением воды (200 мл). Органическую фазу промывали водой (3100 мл) и затем экстрагировали разбавленной H2SO4 (3100 мл). Соединенные кислотные фазы промывали толуолом (350 мл) и затем доводили до основного рН добавлением 10 н NaOH. Затем продукт экстрагировали этилацетатом (3200 мл) и объединенные органические фазы промывали водой до нейтральности. Затем растворитель концентрировали при пониженном давлении и полученный необработанный остаток очищали перегонкой при давлении 0,4 мм Hg и температуре 182-185C. Так было получено 16 г 2-[(1-бензил-1 Н-индазол-3-ил)метокси]-N,N-диметилэтанамина (масло). Часть этого продукта (13,1 г; 0,042 моль) растворяли в изобутаноле (150 мл) и обрабатывали концентрированной HCl (3,5 мл; 0,045 моль) при комнатной температуре в течение 1 ч. После обработки растворитель выпаривали при пониженном давлении. Полученный так твердый продукт очищали кристаллизацией из изопропанола. Таким путем было получено 10 г 2-[(1-бензил-1 Н-индазол-3-ил)метокси]-N,N-диметилэтанамина гидрохлорида. Т.плавл. = 138-140C 1 Н-ЯМР (DMSO-d6,ppm): 2,72 (с, 6H), 3,28 (т, J=5,10 Гц, 2H), 3,85 (т, J=5,10 Гц, 2H), 4,88 (с, 2H),5,65 (с, 2H), 7,17 (тройной д, J=7,97; 7,06; 0,66 Гц, 1H), 7,21-7,35 (м, 5H), 7,41 (тройной д, J=8,38; 6,98; 0,99 Гц, 1H), 7,72 (д, J=8,42 Гц, 1H), 7,88 (д, J=8,09 Гц, 1H), 10,68 (шир.с, 1H). Получение соединения 15. 3-[(1-Бензил-1 Н-индазол-3-ил)метокси]-N,N-диметилпропан-1-амина гидрохлорид Продукт получали, используя способ, описанный для получения соединения 14, но используя в качестве реагента 3-хлор-N,N-диметилпропан-1-амин (0,08 моль) вместо 2-хлор-N,N-диметилэтанамина. Продукт очищали двукратной кристаллизацией из изопропанола. Т.плавл.=119-121C 1H-ЯМР (DMSO-d6,ppm): 1,86-2,02 (м, 2H), 2,68 (с, 6H), 2,99-3,09 (м, 2H), 3,55 (т, J=6,03 Гц, 2H),4,81 (с, 2H), 5,63 (с, 2H), 7,16 (тройной д, J=7,97; 6,98; 0,74 Гц, 1H), 7,20-7,34 (м, 5H), 7,39 (тройной д,J=8,34; 7,02; 0,99 Гц, 1H), 7,69 (д, J=8,59 Гц, 1H), 7,83 (дв.т, J=8,13; 0,89 Гц, 1H), 10,75 (шир.с, 1H). Получение соединения 16. 3-[(1-Бензил-1 Н-индазол-3-ил)метокси]пропан-1-ол Продукт получали, используя способ, описанный для получения соединения 13, но используя в качестве реагента 1,3-пропандиол (150 мл) вместо этиленгликоля. Продукт очищали флеш-хроматографией на силикагеле, используя в качестве элюента смесь 1/1 гексан/этилацетат. 1 Получение соединения 17. 2-[(1-Бензил-1 Н-индазол-3-ил)метокси]-2-метилпропан-1-ол К суспензии LiAlH4 (4,48 г; 0,118 моль) в диэтиловом эфире (100 мл), перемешиваемой при комнатной температуре, медленно добавляли раствор метил-2-[(1-бензил-1 Н-индазол-3-ил)метокси]-2 метилпропаноата, полученного в соответствии со способом, описанным в ЕР 0382276 (20 г; 0,06 моль), в диэтиловом эфире (200 мл) и ТГФ (50 мл). По окончании добавления смесь перемешивали 30 мин при комнатной температуре и реакцию завершали добавлением 10 н NaOH (20 мл) и воды (40 мл). Растворитель выпаривали при пониженном давлении и маслянистый остаток очищали перегонкой при давлении 0,01 ммНд при 190C. Полученный так твердый продукт выкристаллизовывали из изопропанола. Так было получено 11 г 2-[(1-бензил-1 Н-индазол-3-ил)метокси]-2-метилпропан-1-ола. Т.плавл.= 52-53C 1(тройной д, J=8,04; 6,21; 1,68 Гц, 1H), 7,17-7,38 (м, 7H), 7,78 (дв.т, J=8,08; 1,00 Гц, 1H). Получение соединения 18. 1-Бензил-3-[(1,1-диметил-2-морфолин-4-илэтокси)метил]-1 Н-индазола малеат 18 а) 1-бензил-3-[(1,1-диметил-2-морфолин-4-ил-2-оксиэтокси)метил]-1 Н-индазол 72 г (0,222 моль) 2-[(1-бензил-1 Н-индазол-3-ил)метокси]-2-метилпропановой кислоты обрабатывали 10 мин при комнатной температуре 30%-ным метоксидом натрия в метаноле (39 мл; 0,222 моль), затем растворитель выпаривали при пониженном давлении и полученный остаток суспендировали в безводном толуоле (750 мл). К суспензии, перемешиваемой при комнатной температуре, добавляли морфолин (77,6 мл; 0,888 моль) с последующим медленным добавлением раствора тионилхлорида (19,3 мл; 0,266 моль) в толуоле (150 мл). Смесь перемешивали 24 ч и затем реакцию завершали отфильтровыванием полученного так твердого продукта. Раствор концентрировали при пониженном давлении и полученный необработанный остаток очищали кристаллизацией из изопропанола. Было получено 14 г 1-бензил-3-[(1,1-диметил-2-морфолин-4-ил-2-оксиэтокси)метил]-1 Н-индазола. 1H-ЯМР (DMSO-d6,ppm): 1,47 (с, 6H), 3,1-4,0 (2 шир.с, 8H), 4,73 (с, 2H), 5,83 (с, 2H), 7,0-7,9 (м,9H). 18b) 1-бензил-3-[(1,1-диметил-2-морфолин-4-илэтокси)метил]-1 Н-индазола малеат К суспензии LiAlH4 (5,16 г; 0,136 моль) в диэтиловом эфире (100 мл), перемешиваемой при комнатной температуре, добавляли раствор 1-бензил-3-[(1,1-диметил-2-морфолин-4-ил-2-оксиэтокси)метил]1 Н-индазола (27 г; 0,068 моль) в ТГФ (180 мл). Затем смесь кипятили с обратным холодильником 1 ч. После кипячения реакцию завершали добавлением 10 н NaOH (25 мл) и воды (50 мл). Затем отделяли органическую фазу и экстрагировали 1 н HCl (250 мл). Соединенные кислотные фазы доводили до основного рН добавлением 1 н NaOH и затем экстрагировали диэтиловым эфиром (3150 мл). Соединенные органические фазы концентрировали при пониженном давлении и необработанный остаток очищали кристаллизацией из изопропанола, получая 6 г 1-бензил-3-[(1,1-диметил-2-морфолин-4-илэтокси)метил]1 Н-индазола. Затем 1-бензил-3-[(1,1-диметил-2-морфолин-4-илэтокси)метил]-1 Н-индазол растворяли в чистом этаноле (50 мл) и обрабатывали при комнатной температуре малеиновой кислотой (1,75 г; 0,016 моль). Полученный твердый продукт отфильтровывали и очищали путем кристаллизации из изопропанола. Так было получено 5,4 г 1-бензил-3-[(1,1-диметил-2-морфолин-4-илэтокси)метил]-1 Н-индазола. Т. плавл.=87-88C 1 Н-ЯМР (DMSO-d6,ppm): 1,38 (с, 6H), 3,09 (шир.с, 8H), 3,71 (шир.с, 4H), 4,80 (с, 2H), 5,61 (с, 2H),6,09 (с, 2H), 7,09-7,44 (м, 7H), 7,70 (д, J=8,59 Гц, 1H), 7,82 (д, J=8,09 Гц, 1H). Пример 1. Анализ генной экспрессии МСР-1 в линии моноцитов человека Оценивалась способность соединений ингибировать экспрессию МСР-1 МоnоМас 6-клетками, стимулированными липополисахаридом (LPS). Клетки помещали в 96-луночные планшеты при концентрации 50000 клеток на лунку. Соединения тестировали при максимальной растворимой концентрации, указанной в табл. 1 (в диапазоне 30-300 мкМ), и инкубировали 1 ч. Затем клетки стимулировали LPS (100 нг/мл) в течение 4 ч. Всю РНК экстрагировали из клеточной массы, используя мини-набор RNeasy (Qiagen), обратнотранскрибированный набором реагентов обратной транскрипции TaqMan (Applied Biosystems), полученную сДНК использовали для PCR-реакции в реальном времени. Амплификацию получали в 96-луночных планшетах, применяя систему обнаружения последовательности ABI Prism 7000 (Applied Biosystems),используя следующий температурный режим: 50C в течение 2 мин, 95C в течение 10 мин и 45 циклов при 95C в течение 15 с и 60C в течение 1 мин. Для амплификации использовался набор праймеров и зонд, специфичный для человеческого МСР-1 (Applied Biosystems, эталонная последовательностьNM002982.3). Набор праймеров и зонд для -актина использовался в отдельных лунках как внутренний контроль проб в целях нормализации. После того как реакция прошла, данные по флуоресценции анализировали, используя программу ABI Prism 7000 SDS, рассчитывая пороговый цикл (Ct) для каждой пробы и проводя позднее относительную квантификацию способом Ct. Как показывают полученные результаты и приведено в табл. 1, соединения способны значительно ингибировать вызванную LPS экспрессию МСР-1 в линии человеческих моноцитов, они обнаруживают снижение уровня специфической mPHK от 30 до 72%. Пример 2. Измерение продуцирования МСР-1 в линии моноцитов человека. Оценивали способность соединений ингибировать экспрессию белка МСР-1 MonoMac6-клетками,стимулированными липополисахаридом (LPS). Клетки помещали в 96-луночные планшеты в концентрации 50000 клеток на лунку. Соединения тестировали при максимальной растворимой концентрации, указанной в табл. 2 (в диапазоне 30-300 мкМ), и инкубировали 1 ч. Затем клетки стимулировали LPS (100 нг/мл) в течение 20 ч. Количество полученных МСР-1 измеряли в супернатантах, подходящим образом разбавленных буфером, с помощью иммуноферментного теста (ELISA), используя покупной набор (ELISA MCP-1/JE,RD Systems). Полученные результаты, выраженные как процент ингибирования, сведены в табл. 2 ниже. Таблица 2 Как показано полученными результатами и указано в табл. 2, соединения были способны значительно ингибировать индуцированную LPS экспрессию МСР-1 в линии моноцитов человека и показывают снижение уровней образованного белка от 44 до 88%. Пример 3. Анализ экспрессии генов CX3CR1 в линии моноцитов человека Оценивали способность соединений ингибировать экспрессию CX3CR1 MonoMac6-клетками, стимулированными липополисахаридом (LPS). Клетки помещали в 96-луночные планшеты в концентрации 50000 клеток на лунку. Соединения тестировали при максимальной растворимой концентрации, указанной в табл. 3 (в диапазоне 30-300 мкМ), и инкубировали 1 ч. Затем клетки стимулировали LPS (100 нг/мл) в течение 20 ч. Всю РНК экстрагировали из клеточной массы, используя мини-набор RNeasy (Qiagen), обратнотранскрибированный набором реагентов обратной транскрипции TaqMan (Applied Biosystems), и полученную сДНК использовали для PCR-реакции в реальном времени. Амплификацию получали в 96 луночных планшетах, применяя систему обнаружения последовательности ABI Prism 7000 (Applied Biosystems), используя следующий температурный режим: 50C в течение 2 мин, 95C в течение 10 мин и 45 циклов при 95C в течение 15 с и 60C в течение 1 мин. Для амплификации использовался набор праймеров и зонд, специфичный для человеческого CX3CR1 (Applied Biosystems, эталонная последовательностьNM001337.3). Набор праймеров и зонд для -актина использовался в отдельных лунках как внутренний контроль проб для целей нормализации. После того как реакция прошла, данные по флуоресценции анализировали, используя программу ABI Prism 7000 SDS, рассчитывая пороговый цикл (Ct) для каждой пробы и проводя позднее относительную квантификацию способом Ct. Полученные результаты, выраженные как процент ингибирования, сведены в табл. 3 ниже. Таблица 3 Как показывают полученные результаты и приведено в табл. 3, соединения способны значительно ингибировать вызванную LPS экспрессию CX3CR1 в линии человеческих моноцитов, они обнаруживают снижение уровня специфической mPHK от 72 до 96%. Пример 4. Анализ экспрессии генов р 40 в линии человеческих моноцитов Оценивали способность соединений ингибировать экспрессию р 40 MonoMac6-клетками, стимулированными липополисахаридом (LPS). Клетки помещали в 96-луночные планшеты в концентрации 50000 клеток на лунку. Соединения тестировали при максимальной растворимой концентрации, указанной в табл. 4 (в диапазоне 30-300 мкМ), и инкубировали 1 ч. Затем клетки стимулировали LPS (100 нг/мл) в течение 4 ч. Всю РНК экстрагировали из клеточной массы, используя мини-набор RNeasy (Qiagen), обратнотранскрибированный набором реагентов обратной транскрипции TaqMan (Applied Biosystems), и полученную сДНК использовали для PCR-реакции в реальном времени. Амплификацию получали в 96 луночных планшетах, применяя систему обнаружения последовательности ABI Prism 7000 (Applied Biosystems), используя следующий температурный режим: 50C в течение 2 мин, 95C в течение 10 мин и 45 циклов при 95C в течение 15 с и 60C в течение 1 мин. Для амплификации использовался набор праймеров и зонд, специфичный для человеческого р 40 (Applied Biosystems, эталонная последовательностьNM002187.2). Набор праймеров и зонд для -актина использовался в отдельных лунках как внутренний контроль проб для целей нормализации. После того как реакция прошла, данные по флуоресценции анализировали, используя программу ABI Prism 7000 SDS, рассчитывая пороговый цикл (Ct) для каждой пробы и проводя позднее относительную квантификацию способом Ct. Полученные результаты, выраженные как процент ингибирования, сведены в табл. 4 ниже. Таблица 4 Как показывают полученные результаты и приведено в табл. 4, соединения способны значительно ингибировать вызванную LPS экспрессию p40 в линии человеческих моноцитов, они обнаруживают снижение уровня специфической mPHK от 32 до 65%. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I) в которой А может быть связью , -X1 или -X1-O-X2-, где Х 1 и Х 2, которые могут быть одинаковыми или отличаться друг от друга, могут быть алкильной группой, содержащей от 1 до 5 атомов углерода, возможно замещенных одной или более алкильными группами, содержащими от 1 до 5 атомов углерода, или одной или более алкоксигруппами с 1-3 атомами углерода,Y означает Н, когда А является связью , или Y может означать Н, -ОН или -N(R11)(R12), когда АR11 может быть водородом, алкильной группой, содержащей от 1 до 5 атомов углерода, или R11 вместе с R12 образует 4-7-звенный гетероцикл,R12 может быть водородом, алкильной группой, содержащей от 1 до 5 атомов углерода, или R12 вместе с R11 образуют 4-7-звенный гетероцикл,R1 и R2, которые могут быть одинаковыми или отличаться друг от друга, могут означать водород,алкильную группу, содержащую от 1 до 5 атомов углерода,R3, R4 и R8, которые могут быть одинаковыми или отличаться друг от друга, могут означать водород, алкильную группу, содержащую от 1 до 5 атомов углерода, алкоксигруппу с 1-3 атомами углерода,атом галогена, -ОН, -N(R')(R"), -N(R')COR", -CN, -CONR'R", -SO2NR'R", -SO2R', нитро и трифторметил; сR' и R", которые могут быть одинаковыми или отличаться друг от друга, означающими водород и алкильную группу, содержащую от 1 до 5 атомов углерода,R5 может быть водородом, алкильной группой, содержащей от 1 до 5 атомов углерода, алкоксигруппой с 1-3 атомами углерода, атомом галогена, -ОН, - N(R')(R"), -N(R')COR", нитро и трифторметилом, или R5 вместе с одним из R6 и R7 образуют цикл, содержащий 5 или 6 атомов углерода; с R' и R",которые могут быть одинаковыми или отличаться друг от друга, означающими водород и алкильную группу, содержащую от 1 до 5 атомов углерода,R6 и R7, которые могут быть одинаковыми или отличаться друг от друга, могут означать водород,алкильную группу, содержащую от 1 до 5 атомов углерода, или вместе образуют группу C=O, или один из R6 и R7 вместе с R5 образуют цикл, содержащий 5 или 6 атомов углерода,при условии, что когда А означает связьи Y, R1, R2, R6 и R7 означают атомы водорода, то если R8 означает атом водорода, то группа, связанная с атомом азота в положении 1 индазольного кольца, не является бензильной группой, 4-хлорбензильной группой или 2-4-дихлорбензильной группой,если R8 означает атом фтора в положении 5 индазольного цикла, то группа, соединенная с атомом азота в положении 1 индазольного цикла, отлична от 5-хлоро-2-метоксибензильной группы, и если R8 означает трифторметильную группу в положении 6 индазольного цикла, то группа, соединенная с атомом азота в положении 1 индазольного цикла, не является 2-4-дихлорбензильной группой,или его фармацевтически приемлемая соль. 2. Соединение по п.1, отличающееся тем, что X1 и Х 2 независимо друг от друга означают алкильную группу, содержащую от 1 до 4 атомов углерода, возможно замещенных одной или более алкильными группами с 1-3 атомами углерода или одной или более алкоксигруппами, содержащими 1 или 2 атома углерода. 3. Соединение по п.1, отличающееся тем, что Х 1 выбран из группы, содержащей группу СН 2, группу СН 2 СН 2, группу С(СН 3)2 и группу С(СН 3)2 СН 2, и Х 2 выбран из группы, содержащей группу СН 2,группу СН 2 СН 2 и группу СН 2 СН 2 СН 2. 4. Соединение по п.1, отличающееся тем, что остаток А выбран из группы, содержащей связь ,группу СН 2 СН 2, группу СН 2 СН 2 СН 2, группу С(СН 3)2 СН 2, группу СН 2 СН 2 ОСН 2, группу СН 2 СН 2 ОСН 2 СН 2, группу С(СН 3)2 СН 2 ОСН 2 и группу С(СН 3)2 СН 2 ОСН 2 СН 2. 5. Соединение по п.1, отличающееся тем, что R11 и R12, которые могут быть одинаковыми или отличаться друг от друга, означают атом водорода, алкильную группу с 1-3 атомами углерода или вместе образуют 5- или 6-звенный гетероцикл. 6. Соединение по п.1, отличающееся тем, что R1 и R2, которые могут быть одинаковыми или отличаться друг от друга, означают атом водорода или алкильную группу с 1-3 атомами углерода. 7. Соединение по п.1, отличающееся тем, что R3, R4 и R8, которые могут быть одинаковыми или отличаться друг от друга, выбраны из группы, содержащей атом водорода, алкильную группу с 1-3 атомами углерода, алкоксигруппу, содержащую 1 или 2 атома углерода, атом Br, Cl или F, ОН-группу, нитрогруппу, трифторметильную группу или группу N(R')(R"), -N(R')COR", -CN, -CONR'R", -SO2NR'R",-SO2R', причем R' и R", которые могут быть одинаковыми или отличаться друг от друга, означают атом водорода и алкильную группу с 1-3 атомами углерода. 8. Соединение по п.1, отличающееся тем, что R5 выбран из группы, содержащей атом водорода, алкильную группу с 1-3 атомами углерода, алкоксигруппу, содержащую 1 или 2 атома углерода, атом галогена, ОН-группу, или R5 вместе с одним из R6 и R7 образуют цикл, содержащий 5 или 6 атомов углерода. 9. Соединение по п.1, отличающееся тем, что R6 и R7, которые могут быть одинаковыми или отличаться друг от друга, выбраны из группы, содержащей атом водорода, алкильную группу с 1-3 атомами углерода, или вместе образуют группу C=O, или один из R6 и R7 вместе с R5 образуют цикл, содержащий 5 или 6 атомов углерода. 10. Фармацевтическая композиция для лечения заболеваний, основанных на экспрессии МСР-1,CX3CR1 и р 40, содержащая соединение формулы (I) по любому из предыдущих пунктов или его фармацевтически приемлемую соль и по меньшей мере один фармацевтически приемлемый наполнитель. 11. Фармацевтическая композиция по п.10, отличающаяся тем, что указанная фармацевтически приемлемая соль является солью присоединения к физиологически приемлемым органическим или неор- 17018976 ганическим кислотам или основаниям. 12. Фармацевтическая композиция по п.11, отличающаяся тем, что указанные физиологически приемлемые кислоты выбраны из группы, содержащей соляную кислоту, бромисто-водородную кислоту,серную кислоту, фосфорную кислоту, азотную кислоту, уксусную кислоту, аскорбиновую кислоту, бензойную кислоту, лимонную кислоту, фумаровую кислоту, молочную кислоту, малеиновую кислоту, метансульфоновую кислоту, щавелевую кислоту, паратолуолсульфоновую кислоту, бензолсульфоновую кислоту, янтарную кислоту, дубильную кислоту и винную кислоту. 13. Фармацевтическая композиция по п.11, отличающаяся тем, что указанные физиологически приемлемые основания выбраны из группы, содержащей гидроксид аммония, гидроксид кальция, карбонат магния, гидрокарбонат натрия, гидрокарбонат калия, аргинин, бетаин, кофеин, холин, N,Nдибензилэтилендиамин, диэтиламин, 2-диэтиламиноэтанол, 2-диметиламиноэтанол, этаноламин, этилендиамин, N-этилморфолин, N-этилпиперидин, N-метилглюкамин, глюкамин, глюкозамин, гистидин, N-(2 гидроксиэтил)пиперидин, N-(2-гидроксиэтил)пирролидин, изопропиламин, лизин, метилглюкамин, морфолин, пиперазин, пиперидин, теобромин, триэтиламин, триметиламин, трипропиламин и трометамин. 14. Фармацевтическая композиция по любому из пп.10-13, отличающаяся тем, что указанный фармацевтически приемлемый наполнитель выбран из группы, содержащей регуляторы сыпучести, связующие, агенты, вызывающие дезинтеграцию, наполнители, разбавители, вкусовые добавки, красители,флюидизаторы, смазки, консерванты, увлажнители, абсорбенты и подсластители. 15. Применение соединения формулы (I) в которой А может быть связью , -Х 1- или -Х 1-O-Х 2-, гдеX1 и Х 2, которые могут быть одинаковыми или отличаться друг от друга, могут означать алкильную группу, содержащую от 1 до 5 атомов углерода, возможно замещенных одной или более алкильными группами, содержащими от 1 до 5 атомов углерода, или одной или более алкоксигруппами с 1-3 атомами углерода,Y означает Н, когда А является связью , или Y может означать Н, -ОН или -N(R11)(R12), когда А означает -Х 1,- или -Х 1-О-Х 2-, гдеR11 может быть водородом, алкильной группой, содержащей от 1 до 5 атомов углерода, или R11 вместе с R12 образует 4-7-звенный гетероцикл,R12 может быть водородом, алкильной группой, содержащей от 1 до 5 атомов углерода, или R12 вместе с R11 образуют 4-7-звенный гетероцикл,R1 и R2, которые могут быть одинаковыми или отличаться друг от друга, могут означать водород,алкильную группу, содержащую от 1 до 5 атомов углерода,R3, R4 и R8, которые могут быть одинаковыми или отличаться друг от друга, могут означать водород, алкильную группу, содержащую от 1 до 5 атомов углерода, алкоксигруппу с 1-3 атомами углерода,атом галогена, -ОН, -N(R')(R"), -N(R')COR", -CN, -CONR'R", -SO2NR'R", -SO2R', нитро и трифторметил; причем R' и R", которые могут быть одинаковыми или отличаться друг от друга, означают водород и алкильную группу, содержащую от 1 до 5 атомов углерода,R5 может быть водородом, алкильной группой, содержащей от 1 до 5 атомов углерода, алкоксигруппой с 1-3 атомами углерода, атомом галогена, -ОН, -N(R')(R"), -N(R')COR", нитро и трифторметилом, или R5 вместе с одним из R6 и R7 образуют цикл, содержащий 5 или 6 атомов углерода; причем R' иR", которые могут быть одинаковыми или отличаться друг от друга, означают водород и алкильную группу, содержащую от 1 до 5 атомов углерода,R6 и R7, которые могут быть одинаковыми или отличаться друг от друга, могут означать водород,алкильную группу, содержащую от 1 до 5 атомов углерода, или вместе образуют группу C=O, или один из R6 и R7 вместе с R5 образуют цикл, содержащий 5 или 6 атомов углерода,для получения фармацевтической композиции для лечения заболеваний, основанных на экспрессии МСР-1, CX3CR1 и р 40, где указанные заболевания, основанные на экспрессии МСР-1 и CX3CR1, выбраны из группы, содержащей заболевания суставов, заболевания почек, сердечно-сосудистые заболевания,метаболический синдром, ожирение, диабет и резистентность к инсулину, и указанные заболевания, основанные на экспрессии p40, выбраны из группы, содержащей аутоиммунные заболевания и хронические дегенеративные воспалительные заболевания. 16. Применение по п.15, отличающееся тем, что указанные заболевания, основанные на экспрессии МСР-1, выбраны из группы, содержащей ревматоидный артрит, артрит, вызванный вирусными инфекциями, псориатический артрит, артроз, люпус-нефрит, диабетическую нефропатию, гломерулонефрит,поликистоз почек, интерстициальные заболевания легких, фиброз, рассеянный склероз, болезнь Альцгеймера, деменцию, связанную с ВИЧ, атопический дерматит, псориаз, васкулит, рестеноз, атеросклероз,инфаркт миокарда, стенокардию, острые коронарные заболевания, метаболические заболевания и осложнения после хирургических вмешательств. 17. Применение по п.15, отличающееся тем, что указанные заболевания, основанные на экспрессииCX3CR1, выбраны из группы, содержащей ревматоидный артрит, люпус-нефрит, диабетическую нефропатию, болезнь Крона, неспецифический язвенный колит, коронарные расстройства, рестеноз, атеросклероз, инфаркт миокарда, стенокардию и осложнения после хирургических вмешательств. 18. Применение по п.15, отличающееся тем, что указанные заболевания, основанные на экспрессииp40, выбраны из группы, содержащей ревматоидный артрит, псориаз, гломерулонефрит, диабет, красную волчанку и болезнь Крона. 19. Способ лечения или предупреждения заболеваний, основанных на экспрессии МСР-1, CX3CR1 и p40, характеризующийся введением нуждающемуся в этом лицу эффективного количества соединения формулы (I) в которой А может быть связью , -Х 1- или -X1-O-X2-, гдеX1 и Х 2, которые могут быть одинаковыми или отличаться друг от друга, могут означать алкильную группу, содержащую от 1 до 5 атомов углерода, возможно замещенных одной или более алкильными группами, содержащими от 1 до 5 атомов углерода, или одной или более алкоксигруппами с 1-3 атомами углерода,Y означает Н, когда А является связью , или Y может означать Н, -ОН или -N(R11)(R12), когда А есть -X1- или -Х 1-О-Х 2-, гдеR11 может быть водородом, алкильной группой, содержащей от 1 до 5 атомов углерода, или R11 вместе с R12 образует 4-7-звенный гетероцикл,R12 может быть водородом, алкильной группой, содержащей от 1 до 5 атомов углерода, или R12 вместе с R11 образуют 4-7-звенный гетероцикл,R1 и R2, которые могут быть одинаковыми или отличаться друг от друга, могут означать водород,алкильную группу, содержащую от 1 до 5 атомов углерода,R3, R4 и R8, которые могут быть одинаковыми или отличаться друг от друга, могут означать водород, алкильную группу, содержащую от 1 до 5 атомов углерода, алкоксигруппу с 1-3 атомами углерода,атом галогена, -ОН, -N(R')(R"), -N(R')COR", -CN, -CONR'R", -SO2NR'R", -SO2R', нитро и трифторметил; причем R' и R", которые могут быть одинаковыми или отличаться друг от друга, означают водород и алкильную группу, содержащую от 1 до 5 атомов углерода,R5 может быть водородом, алкильной группой, содержащей от 1 до 5 атомов углерода, алкоксигруппой с 1-3 атомами углерода, атомом галогена, -ОН, -N(R')(R"), -N(R')COR", нитро и трифторметилом, или R5 вместе с одним из R6 и R7 образуют цикл, содержащий 5 или 6 атомов углерода; причем R' иR", которые могут быть одинаковыми или отличаться друг от друга, означают водород и алкильную группу, содержащую от 1 до 5 атомов углерода,R6 и R7, которые могут быть одинаковыми или отличаться друг от друга, могут означать водород,алкильную группу, содержащую от 1 до 5 атомов углерода, или вместе образуют группу C=O, или один из R6 и R7 вместе с R5 образуют цикл, содержащий 5 или 6 атомов углерода, где указанные заболевания, основанные на экспрессии МСР-1 и CX3CR1, выбраны из группы, содержащей заболевания суставов, заболевания почек, сердечно-сосудистые заболевания, метаболический синдром, ожирение, диабет и резистентность к инсулину, и указанные заболевания, основанные на экспрессии р 40, выбраны из группы, содержащей аутоиммунные заболевания и хронические дегенеративные воспалительные заболевания. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2
МПК / Метки
МПК: C07D 401/12, A61P 9/00, C07D 231/54, A61K 31/416, A61P 13/00, A61P 3/10, A61K 31/435
Метки: экспрессии, основанных, лечения, применение, производные, мср-1, заболеваний, 1-бензил-3-гидроксиметилиндазола, сх3сr1
Код ссылки
<a href="https://eas.patents.su/20-18976-proizvodnye-1-benzil-3-gidroksimetilindazola-i-ih-primenenie-dlya-lecheniya-zabolevanijj-osnovannyh-na-ekspressii-msr-1-sh3sr1-i-r40.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 1-бензил-3-гидроксиметилиндазола и их применение для лечения заболеваний, основанных на экспрессии мср-1, сх3сr1 и р40</a>
Предыдущий патент: Состав медленного высвобождения на основе ассоциации гликогена и альгината
Следующий патент: Волокно-предшественник углеродного волокна, способ его получения и способ получения углеродного волокна
Случайный патент: Некоторые производные 1-(d-циклопропилглицинил)-4-(пиперидин-4-ил) пиперазина в качестве ингибиторов серинпротеазы фактора ха