Способ получения эстетрола
Формула / Реферат
1. Способ получения соединения формулы (I) или его сольватов:
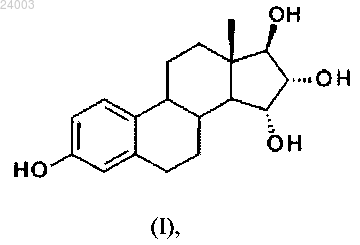
включающий следующие стадии:
а) реакция соединения формулы (II) с силилирующим средством с получением соединения формулы (III):
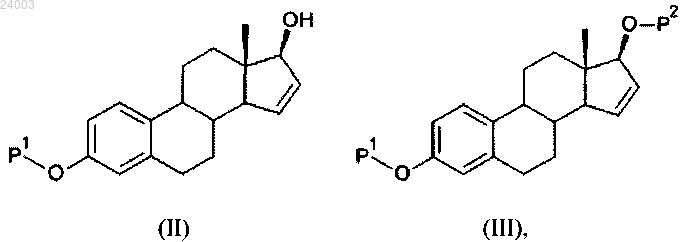
в которой Р1 представляет собой защитную группу, выбранную из R1CO- или R2Si(R3)(R4)-;
Р2 представляет собой защитную группу (R2)Si(R3)(R4)-, где
R1 представляет собой группу, выбранную из C1-6алкила или С3-6циклоалкила, причем каждая группа необязательно замещена одним или несколькими заместителями, независимо выбранными из фтора или С1-4алкила;
каждый R2, R3 и R4 независимо представляет собой группу, выбранную из С1-6алкила или фенила, причем каждая группа необязательно замещена одним или несколькими заместителями, независимо выбранными из фтора или С1-4алкила;
b) реакция соединения формулы (III) в присутствии по меньшей мере одного окисляющего средства, выбранного из перманганатной соли, оксида осмия, пероксида водорода, с получением соединения формулы (IV):
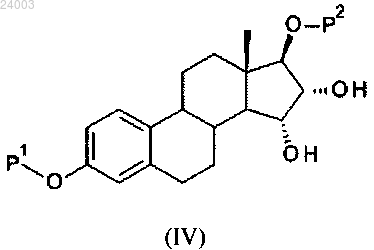
с) снятие защитных групп соединения формулы (IV) с получением соединения формулы (I).
2. Способ по п.1, отличающийся тем, что соединение формулы (I) представляет собой гидрат.
3. Способ по п.1 или 2, отличающийся тем, что Р1 представляет собой R2Si(R3)(R4)- и Р2 представляет собой (R2)Si(R3)(R4)-.
4. Способ по любому из пп.1-3, отличающийся тем, что силилирующее средство выбирают из группы, содержащей C1-6алкилсилилхлорид, С1-6алкилсилилтрифлат, С6-арилсилилхлорид, С6-арилсилилтрифлат, С1-6алкил-С6-арилсилилхлорид, С1-6алкил-С6-арилсилилтрифлат, причем каждая группа необязательно замещена одним или несколькими заместителями, независимо выбранными из фтора или С1-4алкила.
5. Способ по любому из пп.1-4, отличающийся тем, что на стадии (b) указанное окисляющее средство представляет собой перманганат калия.
6. Способ по п.5, отличающийся тем, что стадию (b) проводят в присутствии кислоты.
7. Способ по любому из пп.1-6, отличающийся тем, что соединение формулы (II) получают способом, включающим следующие стадии:
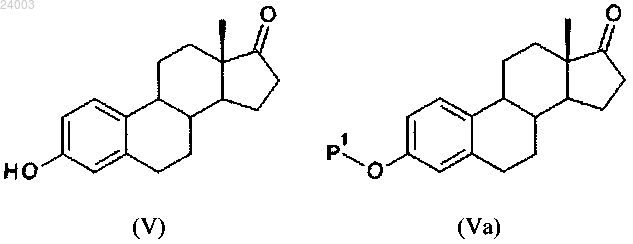
i) реакция соединения формулы (V) с ацилирующим или силилирующим средством с получением соединения формулы (VI):
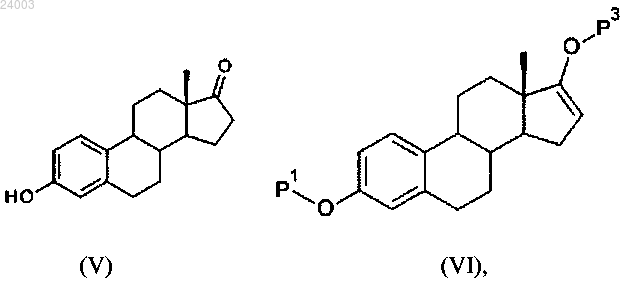
в которой Р3 представляет собой защитную группу, выбранную из R9CO- или R10Si(R11)(R12)-, где
R9 представляет собой группу, выбранную из С1-6алкила или С3-6циклоалкила, причем каждая группа необязательно замещена одним или несколькими заместителями, независимо выбранными из фтора или С1-4алкила;
каждый R10, R11 и R12 независимо представляет собой группу, выбранную из С1-6алкила или фенила, причем каждая группа необязательно замещена одним или несколькими заместителями, независимо выбранными из фтора или С1-4алкила;
ii) реакция соединения формулы (VI) в присутствии ацетата палладия или его производного или частиц йода (V) с получением соединения формулы (VII):
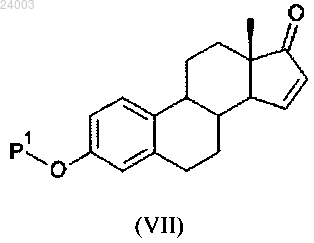
iii) реакция соединения формулы (VII) с восстанавливающим средством с получением соединения формулы (II).
8. Способ по п.7, отличающийся тем, что Р3 представляет собой R9CO-.
9. Способ по п.8, отличающийся тем, что стадия (i) включает следующие стадии:
(i1) защита гидроксила соединения формулы (V) силилирующим средством с получением соединения формулы (Va), где Р1 имеет такое же значение, как определено в п.1:
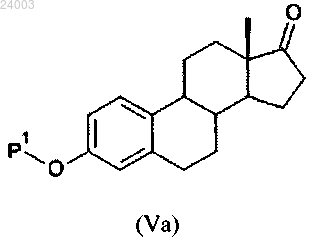
(i2) защита кетона соединения формулы (Va) в присутствии ацилирующего средства с получением соединения формулы (VI).
10. Способ по любому из пп.1-6, отличающийся тем, что соединение формулы (II) получают способом, предусматривающим следующие стадии:
1) реакция соединения формулы (V) с силилирующим или ацилирующим средством с получением соединения формулы (Va), где Р1 имеет такое же значение, как в п.1:
2) галогенирование или сульфинилирование соединения формулы (Va) с получением соединения формулы (Vb):
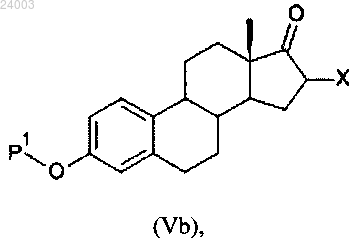
в которой X представляет собой галоген или -SO-R20, где R20 представляет собой группу, выбранную из С6-10арила или гетероарила, причем каждая группа необязательно замещена одним или несколькими заместителями, независимо выбранными из хлора или С1-4алкила;
3) дегалогенирование или десульфинилирование соединения формулы (Vb) с получением соединения формулы (VII):
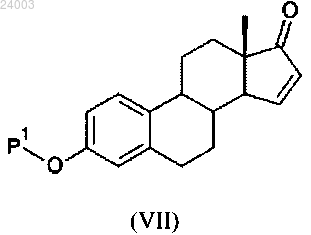
4) реакция соединения формулы (VII) с восстанавливающим средством с получением соединения формулы (II).
11. Способ по п.10, отличающийся тем, что стадия (2) представляет собой сульфинилирование и сульфинилирование проводят реакцией соединения формулы (Va) с основанием и с реагентом сульфинилирования.
12. Способ по п.10, отличающийся тем, что стадия (2) представляет собой галогенирование и галогенирование проводят реакцией соединения формулы (Va) с галогенирующим реагентом.
13. Способ по любому из пп.7 и 10, отличающийся тем, что стадию (iii) и стадию (4) проводят с использованием восстанавливающего средства, выбранного из группы металлогидридных соединений.
14. Способ по любому из пп.7-13, отличающийся тем, что силилирующее средство выбирают из группы, содержащей С1-6алкилсилилхлорид, С1-6алкилсилилтрифлат, С6-арилсилилхлорид, С6-арилсилилтрифлат, С1-6алкил-С6-арилсилилхлорид, С1-6алкил-С6-арилсилилтрифлат, причем каждая группа необязательно замещена одним или несколькими заместителями, независимо выбранными из фтора или С1-4алкила.
15. Способ по любому из пп.7-13, отличающийся тем, что ацилирующее средство выбирают из группы, содержащей С2-6алкенил-С1-6алканоаты, С2-6алкенил-С3-6циклоалканоат, ацилхлориды и ангидриды.
Текст
причем указанный способ включает стадии а) реакции соединения формулы (II) с ацилирующим или силилирующим средством с получением соединения формулы (III): где Р 1 представляет собой защитную группу, выбранную из R1CO- или R2Si(R3)(R4)-, Р 2 представляет собой защитную группу, выбранную из (R6R5R7)C-CO- или (R2)Si(R3)(R4)-, где R1 представляет собой группу,выбранную из С 1-6 алкила или С 3-6 циклоалкила, причем каждая группа необязательно замещена одним или несколькими заместителями, независимо выбранными из фтора или С 1-4 алкила; каждый R2, R3 и R4 независимо представляет собой группу, выбранную из С 1-6 алкила или фенила, причем каждая группа необязательно замещена одним или несколькими заместителями, независимо выбранными из фтора или С 1-4 алкила; R5 представляет собой группу, выбранную из C1-6 алкила или фенила, каждая группа необязательно замещена одним или несколькими заместителями, независимо выбранными из фтора или С 1-4 алкила; каждый R6 и R7 независимо представляет собой водород или группу, выбранную из С 1-6 алкила или фенила, причем каждая группа необязательно замещена одним или несколькими заместителями,независимо выбранными из фтора или С 1-4 алкила; b) реакции соединения формулы (III) в присутствии по меньшей мере одного окисляющего средства, выбранного из перманганатной соли, оксида осмия, пероксида водорода или йода и ацетата серебра, с получением соединения формулы (IV): с) снятия защитных групп соединения формулы (IV) с получением соединения формулы (I). Настоящее изобретение относится к способу получения соединения формулы (I), его гидратов или сольватов: Область техники, к которой относится настоящее изобретение Настоящее изобретение относится к новому способу синтеза эстетрола. Предшествующий уровень техники настоящего изобретения Эстрогенные вещества обычно используют в способах гормонозаместительной терапии (ГЗТ) и способах женской контрацепции. Эстетрол представляет собой биогенный эстроген, который эндогенно продуцируется печенью плода во время беременности у человека. В последнее время эстетрол, как обнаружили, является эффективным в качестве эстрогенного вещества для использования в ГЗТ. Другие важные применения эстетрола находятся в областях контрацепции, терапии аутоиммунных заболеваний,предотвращения и терапии опухолей молочной железы и толстой кишки, увеличения либидо, ухода за кожей и заживления ран. Синтез эстетрола и его производных известен в данной области техники. J. Fishman и H. Guzik (J. ненасыщенного производного диоксолана формулы А, где Ас представляет собой ацетил: Тетраоксид осмия использовали для цис-гидроксилирования соединения (А) и получали 17,17-этилендиоксиэстра-1,3,5(10)-триен-3,15 а,16-триол 3-ацетат в качестве основного продукта. Однако попытки удалить диоксолановую группу полностью провалились. Карбонильную группу на С 17 3-гидроксиэстетра-1,3,5(10),15-тетраен-17-она восстанавливалиLiAlH4 до эстра-1,3,5(10),15-тетраен-3,17-диола, который выделяли в виде диацетата (соединение В). Соединение В подвергали цис-гидроксилированию двойной связи кольца D при помощи тетраоксида осмия, что приводило к образованию эстра-1,3,5(10)-триен-3,15,16,17-тетраол-3,17-диацетата (соединение С) в качестве основного продукта, связанного с эстра-1,3,5(10)-триен-3,15,16,17-тетрол-3,17 диацетатом. Эти соединения выделяли тонкослойной хроматографией. Соединение С при нагревании сK2CO3 в метаноле дает эстетрол (соединение D) (схема 1). Общий выход этого трехстадийного способа составлял, начиная с эстрон 3-гидроксиэстетра-1,3,5(10),15-тетраен-17-она, только приблизительно 7%. Схема 1Verhaar М.Т. et al. (WO 2004/041839) описали способ получения эстетрола цис-гидроксилированием 17-ацетилокси-3-бензилокси-эстра-1,3,5(10),15-тетраена при помощи тетраоксида осмия и N-оксида триметиламина в THF при 50 С. Полученное 15,16-дигидроксилированное сырое производное получали с выходом 84%, но несколько кристаллизации были необходимыми для очистки этого промежуточного вещества. Наконец, выход после этих очисток составлял приблизительно 43%.Chemistry (1972-1999), (2), 241-51;1990 описали цис-гидроксилирование при помощи тетраоксида осмия на 14,17-этановом производном формулы (Е), где Pa представляет собой метальную группу и Pb представляет собой ацетильную группу. Смесь получали с содержанием приблизительно 56% Кроме слабой селективности катализируемого осмием дигидроксилирования этих 17-ацетилоксипроизводных, необходимы полные очистки. Остается потребность в улучшенном синтезе эстра-1,3,5(10)-15,16,17-тетрола (эстетрол). Таким образом, целью настоящего изобретения является обеспечение способа получения эстра 1,3,5(10)-триен-15,16,17-тетрола, который преодолевает по меньшей мере один недостаток предшествующего уровня техники. Краткое раскрытие настоящего изобретения Авторы настоящего изобретения обнаружили, что данный объект можно получить при помощи способа, который определен в приложенной формуле изобретения. Согласно настоящему изобретению обеспечивается способ получения соединения формулы (I) (эстра-1,3,5(10)-триен-3,15,16,17-тетрол): включающий следующие стадии: а) реакция соединения формулы (II) с ацилирующим или силилирующим средством с получением соединения формулы (III): где Р 1 представляет собой защитную группу, выбранную из R1CO- или R2Si(R3)(R4)-; Р 2 представляет собой защитную группу, выбранную из (R6R5R7)C-CO- или (R2)Si(R3)(R4)-, гдеR1 представляет собой группу, выбранную из С 1-6 алкила или С 3-6 циклоалкила, причем каждая группа необязательно замещена одним или несколькими заместителями, независимо выбранными из фтора или С 1-4 алкила; каждый R2, R3 и R4 независимо представляет собой группу, выбранную из С 1-6 алкила или фенила,причем каждая группа необязательно замещена одним или несколькими заместителями, независимо выбранными из фтора или С 1-4 алкила;R5 представляет собой группу, выбранную из С 1-6 алкила или фенила, причем каждая группа необязательно замещена одним или несколькими заместителями, независимо выбранными из фтора или С 1-4 алкила; каждый R6 и R7 независимо представляет собой водород или группу, выбранную из С 1-6 алкила или фенила, причем каждая группа необязательно замещена одним или несколькими заместителями, независимо выбранными из фтора или С 1-4 алкила;b) реакция соединения формулы (III) в присутствии по меньшей мере одного окисляющего средства, выбранного из перманганатной соли, оксида осмия, пероксида водорода или йода и ацетата серебра, с получением соединения формулы (IV): с) снятие защитных групп соединения формулы (IV) с получением соединения формулы (I). Настоящее изобретение обеспечивает улучшенный способ получения соединения формулы (I) со значительно более высоким выходом и/или с более низкой стоимостью, чем это возможно, с помощью ранее известных синтезов. В частности,настоящий способ позволяет получить эстра-1,3,5(10)-триен-3,15,16,17-тетрол в качестве основного продукта с незначительным количеством или без изомера эстра-1,3,5(10)-триен-3,15,16,17-тетрол. Согласно второму аспекту настоящее изобретение также охватывает эстетрол, полученный непосредственно способом по настоящему изобретению, для использования в способе, выбранном из способа гормонозаместительной терапии, способа лечения вагинальной сухости, способа контрацепции, способа повышения либидо, способа лечения кожи, способа ускорения заживления ран и способа лечения или предотвращения расстройства, выбранного из группы, состоящей из аутоиммунных заболеваний, опухолей молочной железы и опухолей колоректальной зоны. Вышеуказанные и другие характеристики, признаки и преимущества настоящего изобретения станут очевидными из следующего подробного описания, которое показывает посредством примера принципы настоящего изобретения. Подробное раскрытие настоящего изобретения Также следует понимать, что терминология, используемая в настоящем документе, не предназначена для ограничения, поскольку объем настоящего изобретения будет ограничен только приложенной формулой изобретения. При использовании в настоящем документе формы единственного числа включают ссылки как на единственное число, так и множественное число, если контекст явно не указывает иное. Выражения "содержащий", "содержит" и "состоит из" при использовании в настоящем документе являются синонимами "включающий", "включает" или "содержащий в себе", "содержит в себе", являются включающими или открытыми и не исключают дополнительные, не перечисленные члены, элементы или стадии способов. Следует иметь в виду, что выражения "содержащий", "содержит" и "состоит из" при использовании в настоящем документе включают выражения "состоящий из", "состоит" и "состоит из". Перечисление числовых диапазонов при помощи конечных точек включает все числа и части, находящиеся в пределах соответствующих диапазонов, а также перечисленные конечные точки. Все ссылки, цитируемые в настоящем описании, таким образом, включены ссылкой во всей их полноте. В частности, идеи из всех ссылок в настоящем документе, которые конкретно упоминаются, включены ссылкой. Если иное не определено, все выражения, используемые при раскрытии настоящего изобретения,включая технические и научные термины, имеют значение, которое обычно понимается специалистом в данной области техники, к которой настоящее изобретение относится. Посредством дальнейших указаний определения терминов включены для лучшей оценки идеи настоящего изобретения. В следующих утверждениях различные аспекты настоящего изобретения определены более подробно. Каждый аспект, определенный таким образом, может быть объединен с любым другим аспектом или аспектами, если иное явно не указано. В частности, любой признак, указанный как предпочтительный или преимущественный, может быть объединен с любым другим признаком или признаками, указанными как предпочтительные или преимущественные. Ссылка по всему настоящему описанию на "один вариант осуществления" или "вариант осуществления" означает, что конкретный признак, структура или характеристика, описанная в связи с вариантом осуществления, включена по меньшей мере в один вариант осуществления настоящего изобретения. Таким образом, появление фраз "согласно одному варианту осуществления" или "согласно варианту осуществления" в различных местах в настоящем описании необязательно все относятся к одному и тому же варианту осуществления, но могут. Кроме того, конкретные признаки, структуры или характеристики можно объединять любым подходящим образом, что будет очевидным специалисту в данной области техники из настоящего раскрытия, согласно одному или нескольким вариантам осуществления. Кроме того, хотя некоторые варианты осуществления, описанные в настоящем документе, включают некоторые, но не все, признаки, включенные в другие варианты осуществления, комбинациипризнаков различных вариантов осуществления подразумеваются включенными в объем настоящего изобретения и образуют различные варианты осуществления, что будет понятно специалистам в данной области техники. Например, в приложенной формуле изобретения любой из заявленных вариантов осуществления можно использовать в любой комбинации. Выражение "алкил", сам по себе или как часть другого заместителя, относится к неразветвленной или разветвленной насыщенной углеводородной группе, соединенной при помощи простых углеродуглеродных связей, имеющей 1-6 атомов углерода, например 1-5 атомов углерода, например 1-4 атома углерода, предпочтительно 1-3 атома углерода. Когда нижний индекс используют в настоящем документе следом за атомом углерода, нижний индекс относится к числу атомов углерода, которое названная группа может содержать. Таким образом, например, С 1-6 алкил означает алкил из 1-6 атомов углерода. Примеры алкильных групп представляют собой метил, этил, пропил, изопропил, бутил, изобутил, втор-3 024003 бутил, трет-бутил, 2-метилбутил, пентил, изоамил и его изомеры, гексил и его изомеры. Выражение "С 3-6 циклоалкил", как группа или часть группы, относится к насыщенному или частично насыщенному циклическому алкильному радикалу, содержащему от приблизительно 3 до приблизительно 6 атомов углерода. Примеры моноциклических С 3-6 циклоалкильных радикалов включают циклопропил, циклобутил, циклопентил или циклогексил. Выражение "С 2-6 алкенил", само по себе или как часть другого заместителя, относится к ненасыщенной гидрокарбильной группе, которая может быть линейной или разветвленной, содержащей одну или несколько углерод-углеродных двойных связей. Примеры С 2-6 алкенильных групп представляют собой этенил, 2-пропенил, 2-бутенил, 3-бутенил, 2-пентенил и его изомеры, 2-гексенил и его изомеры,2,4-пентадиенил и подобные. Выражение "С 6-10 арил", само по себе или как часть другого заместителя, как группа или часть группы, относится к полиненасыщенной, ароматической гидрокарбильной группе с одним кольцом (т.е. фенил) или множеством колец, слитых вместе (например, нафталин) или связанных ковалентно, обычно содержащей 6-10 атомов; причем по меньшей мере одно кольцо является ароматическим. Неограничивающие примеры С 6-10 арила включают фенил (С 6-арил), нафтил, инданил или 1,2,3,4-тетрагидронафтил. Выражение "С 1-6 алкилкарбонил", как группа или часть группы, представляет собой группу формулы -CO-Ra, где Ra представляет собой C1-6 алкил, как определено в настоящем документе. Выражение "С 3-6 циклоалкилкарбонил", как группа или часть группы, представляет собой группу формулы -CO-Rc, где Rc представляет собой С 3-6 циклоалкил, как определено в настоящем документе. Выражение "С 2-6 алкенил-С 1-6 алканоат" относится к соединению с формулой Rb-O-CO-Ra, гдеR представляет собой С 3-6 циклоалкил, как определено в настоящем документе, и Rb представляет собой С 2-6 алкенил, как определено в настоящем документе. Выражение "C1-6 алкиленкарбонат" относится к соединению с формулой Rb-O-CO-O-Ra, где Ra представляет собой С 1-6 алкил, как определено в настоящем документе, и Rb представляет собой С 2-6 алкенил,как определено в настоящем документе. Выражение "гетероарил", само по себе или как часть другого заместителя, относится к ароматическому моноциклическому или полициклическому гетероциклу, имеющему предпочтительно 5-7 кольцевых атомов и более предпочтительно 5-6 кольцевых атомов, который содержит один или несколько гетероатомных кольцевых членов, выбранных из азота, кислорода или серы. Неограничивающие примеры гетероарила включают пиридинил, пирролил, фуранил, тиофенил, пиразолил, имидазолил, оксазолил,изоксазолил, тиазолил, изотиазолил, тиазолил, оксадиазолил, тиадиазолил, тетразолил, оксатриазолил,тиатриазолил, пиримидил, пиразинил, пиридазинил, оксазинил, диоксинил, тиазинил, триазинил. Предпочтительно гетероарил выбирают из группы, содержащей пиридинил, пирролил, фуранил, тиофенил,имидазолил, пиразолил, оксазолил, тиазолил и пиразинил. Более предпочтительно гетероарил представляет собой пиридинил. Настоящее изобретение относится к способу получения соединения формулы (I), включающему следующие стадии: а) реакция соединения формулы (II) с ацилирующим или силилирующим средством с получением соединения формулы (III): где Р 1 представляет собой защитную группу, выбранную из R1CO- или R2Si(R3)(R4)-; Р 2 представляет собой защитную группу, выбранную из (R6R5R7)C-CO- или (R2)Si(R3)(R4)-, гдеR1 представляет собой группу, выбранную из С 1-6 алкила или С 3-6 циклоалкила, причем каждая группа необязательно замещена 1, 2 или 3 заместителями, независимо выбранными из фтора или С 1-4 алкила; предпочтительно R1 выбран из группы, содержащей метил, этил, пропил, изопропил, бутил, изобутил,трет-бутил, циклопропил, циклобутил, циклопентил или циклогексил, причем каждая группа необязательно замещена 1, 2 или 3 заместителями, независимо выбранными из фтора или С 1-4 алкила; более предпочтительно R1 представляет собой метил, этил, пропил, изопропил, циклопентил или циклогексил,еще более предпочтительно R1 представляет собой метил или этил; каждый R2, R3 и R4 независимо представляет собой группу, выбранную из C1-6 алкила или фенила,причем каждая группа необязательно замещена одним или несколькими заместителями, независимо выбранными из фтора или С 1-4 алкила;-4 024003 предпочтительно каждый R2, R3 и R4 независимо выбран из группы, содержащей метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил и фенил, причем каждая группа необязательно замещена 1,2 или 3 заместителями, каждый независимо выбран из фтора или С 1-4 алкила; предпочтительно каждый R2, R3 и R4 независимо выбран из группы, содержащей метил, этил, пропил, изопропил или трет-бутил и фенил, причем каждая группа необязательно замещена 1, 2 или 3 заместителями, каждый независимо выбран из фтора или С 1-2 алкила;R5 представляет собой группу, выбранную из С 1-6 алкила или фенила, причем каждая группа необязательно замещена одним или несколькими заместителями, независимо выбранными из фтора или С 1-4 алкила; предпочтительно R5 выбран из группы, содержащей метил, этил, пропил, изопропил, бутил,изобутил, трет-бутил и фенил, причем каждая группа необязательно замещена 1, 2 или 3 заместителями,каждый независимо выбран из фтора или С 1-4 алкила; предпочтительно R5 выбран из группы, содержащей метил, этил, пропил, изопропил или трет-бутил и фенил, причем каждая группа необязательно замещена 1, 2 или 3 заместителями, каждый независимо выбран из фтора или С 1-2 алкила; каждый R6 и R7 независимо представляет собой водород или группу, выбранную из С 1-6 алкила или фенила, причем каждая группа необязательно замещена одним или несколькими заместителями, независимо выбранными из фтора или С 1-4 алкила; предпочтительно каждый R6 и R7 независимо представляет собой водород или выбран из группы,содержащей метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил и фенил, причем каждая группа необязательно замещена 1, 2 или 3 заместителями, каждый независимо выбран из фтора или С 1-4 алкила; предпочтительно каждый R6 и R7 независимо представляет собой водород или группу, выбранную из метила, этила, пропила, изопропила или трет-бутила и фенила, причем каждая группа необязательно замещена 1, 2 или 3 заместителями, каждый независимо выбран из фтора или C1-2 алкила;b) реакция соединения формулы (III) в присутствии по меньшей мере одного окисляющего средства, выбранного из перманганатной соли, оксида осмия, пероксида водорода или йода и ацетата серебра, с получением соединения формулы (IV); предпочтительно указанное окисляющее средство представляет собой перманганат калия: с) снятие защитных групп соединения формулы (IV) с получением соединения формулы (I). Согласно варианту осуществления Р 1 представляет собой R2Si(R3)(R4)-. Предпочтительно Р 1 выбран из группы, содержащей трет-бутилдиметилсилил, дифенилметилсилил, диметилфенилсилил, триметилсилил, триэтилсилил и триизопропилсилил, причем каждая группа необязательно замещена одним или несколькими заместителями, независимо выбранными из фтора или С 1-4 алкила; более предпочтительно Р 1 представляет собой трет-бутилдиметилсилил. Согласно настоящему изобретению стадия (а) включает реакцию соединения формулы (II) с ацилирующим или силилирующим средством с получением соединения формулы (III). Согласно варианту осуществления соединение формулы (II) может реагировать с силилирующим средством и Р 2 представляет собой R2Si(R3)(R4)-. Предпочтительно Р 2 выбран из группы, содержащей трет-бутилдиметилсилил, дифенилметилсилил, диметилфенилсилил, триметилсилил, триэтилсилил и триизопропилсилил, причем каждая группа необязательно замещена одним или несколькими заместителями, независимо выбранными из фтора или C1-4 алкила; более предпочтительно Р 2 представляет собой трет-бутилдиметилсилил. Согласно варианту осуществления каждый Р 1 и Р 2 независимо представляет собой R2Si(R3)(R4)-. Неограничивающие примеры подходящего силилирующего средства можно выбрать из группы, содержащей C1-6 алкилсилилхлорид, С 1-6 алкилсилилтрифлат, С 6-арилсилилхлорид, С 6-арилсилилтрифлат,C1-6 алкил-С 6-арилсилилхлорид и С 1-6 алкил-С 6-арилсилилтрифлат, причем каждая группа необязательно замещена одним или несколькими заместителями, независимо выбранными из фтора или С 1-4 алкила. Например, образование защищенного соединения формулы (III) можно проводить реакцией соединения формулы (II) с силилирующим средством, таким как трет-бутилдиметилсилилхлорид, дифенилметилсилилхлорид, диметилфенилсилилхлорид, триметилсилилхлорид, триэтилсилилхлорид или триизопропилсилилхлорид или таким как трет-бутилдиметилсилилтрифлат, дифенилметилсилилтрифлат, диметилфенилсилилтрифлат, триметилсилилтрифлат, триэтилсилилтрифлат или триизопропилсилилтрифлат. Реакцию можно проводить в присутствии подходящего основания, такого как имидазол, 2,6-лютидин,коллидин, триэтиламин или 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU). Реакцию можно проводить при комнатной температуре или при кипении с обратным холодильником. Реакцию можно проводить в присутствии подходящего растворителя, такого как диметилформамид, дихлорметан или толуол или их смесь. Согласно варианту осуществления соединение формулы (II) может реагировать с силилирующим средством и Р 2 представляет собой (R6R5R7)C-CO-. Предпочтительно Р 2 представляет собой трет-бутил-СО. Согласно варианту осуществления каждый Р 1 и Р 2 независимо представляет собой (R6R5R7)C-CO-. Неограничивающие примеры подходящего ацилирующего средства можно выбирать из группы, со держащей, где R5, R6, R7 8 имеют такое же значение, как определено в п.1 формулы изобретения; R представляет собой группу,выбранную из C1-6 алкила или С 2-6 алкенила, причем каждая группа необязательно замещена одним или несколькими заместителями, независимо выбранными из фтора или С 1-4 алкила. Предпочтительно ацилирующее средство можно выбирать из группы, содержащей пивалоилхлорид,пивалоилангидрид и подобное. Ацилирование при проведении с ацилирующим средством, таким как С 2-6 алкенил-трет-бутират,можно проводить в присутствии кислоты, такой как в присутствии серной кислоты или в присутствии С 6-10 арилсульфоновой кислоты, необязательно замещенной одним или несколькими хлорзаместителями. Неограничивающие примеры подходящей кислоты включают паратолуолсульфоновую кислоту и серную кислоту., можно проводить в присутствии оргаАцилирование при проведении с нического основания, такого как имидазол, триэтиламин и подобное. Стадия (b) может предусматривать реакцию соединения формулы (III) в присутствии по меньшей мере одного окисляющего средства, выбранного из перманганатной соли, оксида осмия, или пероксида водорода, или йода и ацетата серебра, или соли рутения с получением соединения формулы (IV). Предпочтительно стадия (b) предусматривает реакцию соединения формулы (III) в присутствии по меньшей мере одного окисляющего средства, выбранного из перманганатной соли, оксида осмия или пероксида водорода, или йода и ацетата серебра с получением соединения формулы (IV). Данную реакцию можно проводить в присутствии соокислителя, такого как N-оксид триметиламина, N-оксид хинукледина, N-оксид N-метилморфолина, феррицианид калия, трет-бутилгидропероксид,или катализатора фазового переноса, такого как соли тетралкиламмония. Предпочтительно стадию (b) проводят в присутствии перманганатной соли, такой как перманганат калия. Реакцию можно проводить в присутствии подходящей кислоты, такой как муравьиная кислота. Реакцию можно проводить при низкой температуре, такой как температура ниже 10 С, предпочтительно ниже 5 С, предпочтительно около 0 С. Реакцию можно проводить в присутствии подходящего растворителя, такого как ацетон. Согласно настоящему изобретению стадия (с) включает снятие защитных групп соединения формулы (IV) с получением соединения формулы (I). Подходящие способы и условия для снятия защитных групп соединения формулы (IV) будут ясны для специалиста в данной области техники и обычно описаны в стандартных справочниках по органической химии, таких как Greene and Wuts, "Protective groups in organic synthesis", 3rd Edition, WileySons,1999, который включен в настоящий документ ссылкой во всей своей полноте. Например, если каждый Р 1 и Р 2 независимо представляет собой R2Si(R3)(R4)-, снятие защитных групп можно проводить в присутствии подходящей кислоты, такой как соляная кислота, уксусная кислота и подобные, или при помощи использования стехиометрического количества производного тетраалкиламмония фторида в растворителе. Например, если каждый Р 1 и Р 2 независимо представляет собой (R6R5R7)C-CO-, снятие защитных групп можно проводить в присутствии подходящей кислоты, основания или восстанавливающих средств. Предпочтительно снятие защитных групп можно проводить при помощи подходящего основания, такого как карбонат калия, например, в метаноле. Соединение формулы (II) можно получить согласно способу, известному специалисту в данной области техники. Согласно варианту осуществления соединение формулы (II) можно получить способом, включающим следующие стадии:i) реакция соединения формулы (V) с ацилирующим или силилирующим средством с получением соединения формулы (VI): где Р 3 представляет собой защитную группу, выбранную из R9CO- или R10Si(R11)(R12)-;R9 представляет собой группу, выбранную из С 1-6 алкила или С 3-6 циклоалкила, причем каждая группа необязательно замещена одним или несколькими заместителями, независимо выбранными из фтора или С 1-4 алкила; предпочтительно R9 представляет собой группу, выбранную из С 1-6 алкила или С 3-6 циклоалкила,причем каждая группа необязательно замещена 1, 2 или 3 заместителями, независимо выбранными из фтора или С 1-4 алкила; предпочтительно R9 выбран из группы, содержащей метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, циклопропил, циклобутил, циклопентил или циклогексил, причем каждая группа необязательно замещена 1, 2 или 3 заместителями, независимо выбранными из фтора или С 1-4 алкила; более предпочтительно R9 представляет собой метил, этил, пропил, изопропил, циклопенгил или циклогексил; еще более предпочтительно R9 представляет собой метил или этил; каждый R10, R11 и R12 независимо представляет собой группу, выбранную из С 1-6 алкила или фенила,причем каждая группа необязательно замещена одним или несколькими заместителями, независимо выбранными из фтора или С 1-4 алкила; предпочтительно каждый R10, R11 и R12 независимо представляет собой группу, выбранную изC1-6 алкила или С 6-арила, причем указанный C1-6 алкил или С 6-арил необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из фтора или C1-6 алкила; предпочтительно каждый R10, R11 и R12 независимо выбран из группы, содержащей метил, этил,пропил, изопропил, бутил, изобутил, трет-бутил и фенил, причем каждая группа необязательно замещена 1, 2 или 3 заместителями, каждый независимо выбран из фтора или С 1-4 алкила; предпочтительно каждый R10, R11 и R12 независимо выбран из группы, содержащей метил, этил,пропил, изопропил или трет-бутил и фенил, причем каждая группа необязательно замещена 1, 2 или 3 заместителями, каждый независимо выбран из фтора или С 1-2 алкила;ii) реакция соединения формулы (VI) в присутствии ацетата палладия или его производного или частиц йода (V) с получением соединения формулы (VII):iii) реакция соединения формулы (VII) с восстанавливающим средством с получением соединения формулы (II). Предпочтительно соединение формулы (II) можно получить способом, включающим следующие стадии:i) реакция соединения формулы (V) с ацилирующим или силилирующим средством с получением соединения формулы (VI): где Р 3 представляет собой защитную группу, выбранную из R9CO- или R10Si(R11)(R12)-,R9 представляет собой группу, выбранную из С 1-6 алкила или С 3-6 циклоалкила, причем каждая группа необязательно замещена одним или несколькими заместителями, независимо выбранными из фтора или С 1-4 алкила; предпочтительно R9 представляет собой группу, выбранную из С 1-6 алкила или С 3-6 циклоалкила,причем каждая группа необязательно замещена 1, 2 или 3 заместителями, независимо выбранными из фтора или С 1-4 алкила; предпочтительно R9 выбран из группы, содержащей метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, циклопропил, циклобутил, циклопентил или циклогексил, причем каждая группа необязательно замещена 1, 2 или 3 заместителями, независимо выбранными из фтора или С 1-4 алкила; более предпочтительно R9 представляет собой метил, этил, пропил, изопропил, циклопентил или циклогексил; еще более предпочтительно R9 представляет собой метил или этил; каждый R10, R11 и R12 независимо представляет собой группу, выбранную из С 1-6 алкила или фенила,причем каждая группа необязательно замещена одним или несколькими заместителями, независимо выбранными из фтора или С 1-4 алкила; предпочтительно каждый R10, R11 и R12 независимо представляет собой группу, выбранную изC1-6 алкила или С 6-арила, причем указанный С 1-6 алкил или С 6-арил необязательно замещен 1, 2 или 3 заместителями, независимо выбранными из фтора или C1-6 алкила; предпочтительно каждый R10, R11 и R12 независимо выбран из группы, содержащей метил, этил,пропил, изопропил, бутил, изобутил, трет-бутил и фенил, причем каждая группа необязательно замещена 1, 2 или 3 заместителями, каждый независимо выбран из фтора или С 1-4 алкила; предпочтительно каждый R10, R11 и R12 независимо выбран из группы, содержащей метил, этил,пропил, изопропил или трет-бутил и фенил, причем каждая группа необязательно замещена 1, 2 или 3 заместителями, каждый независимо выбран из фтора или С 1-2 алкила;ii) реакция соединения формулы (VI) в присутствии ацетата палладия или его производного с получением соединения формулы (VII):iii) реакция соединения формулы (VII) с восстанавливающим средством с получением соединения формулы (II). Согласно варианту осуществления Р 1 представляет собой R1CO-; предпочтительно Р 1 представляет собой группу, выбранную из С 1-4 алкилкарбонила или С 4-6 циклоалкилкарбонила, причем каждая группа необязательно замещена 1, 2 или 3 заместителями, независимо выбранными из фтора или С 1-4 алкила; более предпочтительно Р 1 представляет собой группу, выбранную из С 1-2 алкилкарбонила или С 5-6 циклоалкилкарбонила, причем каждая группа необязательно замещена 1, 2 или 3 заместителями, независимо выбранными из фтора или С 1-2 алкила; например, Р 1 выбран из ацетила, трет-бутил-СО- или циклогексилкарбонила, предпочтительно Р 1 представляет собой ацетил. Согласно варианту осуществления Р 3 представляет собой R9CO-; предпочтительно Р 3 представляет собой группу, выбранную из С 1-4 алкилкарбонила или С 4-6 циклоалкилкарбонила, причем каждая группа необязательно замещена 1, 2 или 3 заместителями, независимо выбранными из фтора или С 1-4 алкила; более предпочтительно Р 3 представляет собой группу, выбранную из С 1-2 алкилкарбонила или С 5-6 циклоалкилкарбонила, причем каждая группа необязательно замещена 1, 2 или 3 заместителями, независимо выбранными из фтора или С 1-4 алкила; например, Р 3 выбран из ацетила или циклогексилкарбонила, предпочтительно Р 3 представляет собой ацетил. Согласно варианту осуществления Р 1 представляет собой R1CO- и Р 3 представляет собой R9CO-. Согласно другому варианту осуществления Р 1 представляет собой R2Si(R3)(R4)-. Предпочтительно Р 1 выбран из группы, содержащей трет-бутилдиметилсилил, дифенилметилсилил, диметилфенилсилил, триметилсилил, триэтилсилил и триизопропилсилил, причем каждая группа необязательно замещена одним или несколькими заместителями, независимо выбранными из фтора или С 1-4 алкила; более предпочтительно Р 1 представляет собой трет-бутилдиметилсилил. Согласно варианту осуществления стадия (i) включает следующие стадии:(i1) защита гидроксила соединения формулы (V) силилирующим средством с получением соединения формулы (Va), где Р 1 имеет такое же значение, которое определено в настоящем документе выше,предпочтительно, где Р 1 представляет собой R2Si(R3)(R4)-:(i2) защита кетона соединения формулы (Va) в присутствии ацилирующего средства с получением соединения формулы (VI), предпочтительно, где Р 3 представляет собой R9CO-. Согласно варианту осуществления Р 3 представляет собой R10Si(R11)(R12)-; предпочтительно Р 3 выбран из группы, содержащей трет-бутилдиметилсилил, дифенилметилсилил, диметилфенилсилил, триметилсилил, триэтилсилил и триизопропилсилил, причем каждая группа необязательно замещена одним или несколькими заместителями, независимо выбранными из фтора или С 1-4 алкила, более предпочтительно Р 3 представляет собой трет-бутилдиметилсилил. Согласно варианту осуществления Р 1 представляет собой R2Si(R3)(R4)- и Р 3 представляет собой 10R Si(R11)(R12)-. Согласно другому варианту осуществления Р 1 представляет собой R2Si(R3)(R4)- и Р 3 представляет собой R9CO-. Предпочтительно Р 1 выбран из группы, содержащей трет-бутилдиметилсилил, дифенилметилсилил, диметилфенилсилил, триметилсилил, триэтилсилил или триизопропилсилил, причем каждая группа необязательно замещена одним или несколькими заместителями, независимо выбранными из фтора или С 1-4 алкила; более предпочтительно Р 1 представляет собой трет-бутилдиметилсилил; и предпочтительно Р 3 представляет собой группу,выбранную из С 1-6 алкилкарбонила или С 3-6 циклоалкилкарбонила, причем каждая группа необязательно замещена 1, 2 или 3 заместителями, независимо выбранными из фтора или С 1-4 алкила; предпочтительно Р 3 представляет собой группу, выбранную из С 1-4 алкилкарбонила или C5-6 циклоалкилкарбонила; каждая группа необязательно замещена 1, 2 или 3 заместителями, независимо выбранными из фтора или С 1-2 алкила; более предпочтительно Р 3 представляет собой С 1-2 алкилкарбонил или С 5-6 циклоалкилкарбонила, например, Р 3 представляет собой ацетил или циклогексилкарбонил, предпочтительно ацетил. Подходящие силилирующие средства и условия являются такими же, как описано в настоящем документе выше для стадии (а) способа по настоящему изобретению. Согласно варианту осуществления, где Р 1 представляет собой R1 СО- и Р 3 представляет собой 9R CO, эстрон может реагировать с ацилирующим средством. Предпочтительно указанное ацилирующее средство представляет собой С 2-6 алкенил-С 1-6 алканоат или С 2-6 алкенил-С 3-6 циклоалканоат. Предпочтительно ацилирующее средство выбрано из группы, содержащей С 2-6 алкенилпропаноат,С 2-6 алкенилбутаноат,С 2-6 алкенилпентаноат,С 2-6 алкенилгексаноат,С 2-6 алкенилциклопропаноат,С 2-6 алкенилциклобутаноат, С 2-6 алкенилциклопентаноат и С 2-6 алкенилциклогексаноат. Более предпочтительно ацилирующее средство выбрано из группы, содержащей изопропенилацетат, изопропенилпропионат,изопропенилбутират,изопропенилизобутират,винилацетат,винилпропионат,проп-2-енилциклогексанкарбоксилат, этенилциклопентанкарбоксилат и винилциклогексаноат. Более предпочтительно ацилирующее средство выбрано из группы, содержащей изопропенилацетат, изопропенилпропионат, изопропенилбутират, изопропенилизобутират, винилацетат и винилпропионат. Ацилирование можно проводить в присутствии кислоты, такой как в присутствии серной кислоты или в присутствии С 6-10 арилсульфоновой кислоты, необязательно замещенной одним или несколькими хлорзаместителями. Неограничивающие примеры подходящей кислоты включают паратолуолсульфоновую кислоту и серную кислоту. Например, эстрон формулы (V) может реагировать с изопропенилацетатом в присутствии серной кислоты или паратолуолсульфоновой кислоты с получением эстра-1,3,5(10),16-тетраен 3,17-диол 3,17-диацетата. Реакцию можно проводить при кипении с обратным холодильником, необязательно в инертной атмосфере, такой как атмосфера азота. Продукт можно использовать сам по себе на следующей стадии или можно дополнительно очищать техниками, известными в данной области, такими как хроматография, например, на диоксиде кремния, с подходящим элюантом, таким как метиленхлорид/гексан или этилацетат/гексан. Согласно варианту осуществления, где Р 1 представляет собой R2Si(R3)(R4)- и Р 3 представляет собой 10R Si(R11)(R12)-, эстрон формулы (V) может реагировать с силилирующим средством. Силилирующее средство можно выбирать из группы, содержащей C1-6 алкилсилилтрифлат, С 6-арилсилилтрифлат,С 1-6 алкил-С 6-арилсилилтрифлат, причем каждая группа необязательно замещена одним или несколькими заместителями, независимо выбранными из фтора или С 1-4 алкила. Например, образование защищенного силильного эфира эстрона можно проводить реакцией силилирующего средства, такого как третбутилдиметилсилилтрифлат, дифенилметилсилилтрифлат, диметилфенилсилилтрифлат, триметилсилилтрифлат, триэтилсилилтрифлат или триизопропилсилилтрифлат. Реакцию можно проводить в присутст-9 024003 вии подходящего основания, такого как имидазол, 2,6-лютидин, коллидин, триэтиламин или 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU). Реакцию можно проводить при комнатной температуре или при кипении с обратным холодильником. Реакцию можно проводить в присутствии подходящего растворителя, такого как дихлорметан, толуол или диметилформамид или их смесь. Стадия (ii) способа получения соединения формулы (II) предусматривает реакцию соединения формулы (VI) в присутствии ацетата палладия или его производного, такого как хлорид палладия, с получением соединения формулы (VII). Согласно варианту осуществления указанный ацетат палладия может находиться в стехиометрических количествах или достехиометрических каталитических количествах. Например, реакцию стадии (ii) можно проводить при помощи стехиометрических количеств ацетата палладия, предпочтительно в подходящем растворителе, таком как бензонитрил. Данную реакцию можно проводить при комнатной температуре. Согласно другому примеру указанную стадию (ii) можно проводить при помощи достехиометрических каталитических количеств ацетата палладия в присутствии C1-6 алкиленкарбоната, такого как аллилкарбонат, и в присутствии оловоорганического соединения в качестве катализатора. Предпочтительно оловоорганическое соединение представляет собой метоксид три-бутилолова. ПредпочтительноC1-6 алкиленкарбонат представляет собой аллилметилкарбонат. Реакцию можно проводить при условиях кипения с обратным холодильником, необязательно в инертной атмосфере, такой как атмосфера азота или аргона. Согласно другому примеру указанную стадию (ii) можно проводить при помощи нестехиометрических каталитических количеств ацетата палладия в атмосфере кислорода. Альтернативно, стадия (ii) способа получения соединения формулы (II) предусматривает реакцию соединения формулы (VI) в присутствии частиц йода (V). Предпочтительно указанные частицы йода (V) выбирают из о-йодбензойной кислоты (IBX, также известной как 1-гидрокси-1,2-бензйодоксал-3(1 Н)-он-1-оксид) или комплексов IBX, таких как комплексыIBXN-оксид. Неограничивающие примеры подходящих комплексов IBX включают комплексChem. Int. Ed. 2002, 41, 996-1000 и Angew. Chem. Int. Ed. 2002, 41, 993-995, таким образом включенных ссылкой во всей их полноте. Согласно другому, более предпочтительному варианту осуществления частицы йода (V) выбирают из HIO3 или/и ее ангидрида I2O5. Эти частицы йода (V) имеют преимущество, так как являются слабыми,безопасными и хемоселективными реагентами, доступными за небольшую плату для промышленных применений. Предпочтительно окисление частицами йода (V) проводят в присутствии лиганда, такого как тетрагидрофуран (THF), диметилсульфоксид (DMSO) или N-оксидные производные, такие какN-метилморфолин-N-оксид, 4-метоксипиридин-N-оксид, триметиламин-N-оксид. Предпочтительно реакцию проводят в присутствии растворителя, такого как DMSO. Согласно варианту осуществления реакцию выдерживают при 45-65 С. Предпочтительно реакцию проводят при температуре в диапазоне от 45 до 65 С в присутствии DMSO. Следующая стадия (iii) в способе включает восстановление соединения формулы (VII) при помощи восстанавливающего средства с получением соединения формулы (II). Предпочтительно указанное восстанавливающее средство представляет собой металлогидридное соединение. Например, металлогидридное соединение можно выбрать из группы, содержащей LiAlH4, NaBH4, NaBH(OAc)3, ZnBH4 иNaBH4/CeCl3. Предпочтительно указанное восстанавливающее средство представляет собойNaBH4/CeCl3. Например, указанное восстановление можно проводить в подходящем растворителе или его смеси, таком как в тетрагидрофуране или смеси метанола и тетрагидрофурана. Реакцию можно проводить при низких температурах, таких как ниже 15 С, например ниже 10 С. Согласно варианту осуществления соединение формулы (VII) не выделяют, а непосредственно восстанавливают в спирт при помощи указанного восстанавливающего средства. Согласно данному варианту осуществления стадию (ii) и (iii) проводят в одной емкости. Эта двухстадийная процедура в одной емкости является самым кратким химическим путем, описанным для получения соединения формулы(II). Согласно другому варианту осуществления стадию (i) можно проводить в две стадии:(i1) защита гидроксила соединения формулы (V) при помощи силилирующего средства с получением соединения формулы (Va), где Р 1 представляет собой R2Si(R3)(R4)-:(i2) превращение кетона соединения формулы (Va) в его еноловый эфир в присутствии ацилирующего средства с получением соединения формулы (VI). Согласно данному варианту осуществления, где Р 1 независимо представляет собой R2Si(R3)(R4)- и 3 Р представляет собой R9CO-, эстрон формулы (V) реагирует с силилирующим средством с получением соединения формулы (Va). Силилирующее средство можно выбрать из группы, содержащейC1-6 алкилсилилхлорид, С 6-арилсилилхлорид, С 1-6 алкил-С 6-арилсилилхлорид; причем каждая группа необязательно замещена одним или несколькими заместителями, независимо выбранными из фтора или С 1-4 алкила. Например, образование защищенного силильного эфира эстрона можно проводить реакцией силилирующего средства, такого как трет-бутилдиметилсилилхлорид, дифенилметилсилилхлорид, диметилфенилсилилхлорид, триметилсилилхлорид, триэтилсилилхлорид или триизопропилсилилхлорид. Реакцию можно проводить в присутствии основания, такого как имидазол, 2,6-лютидин, коллидин,триэтиламин или 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU). Следующая стадия предусматривает превращение кетона соединения формулы (Va) в присутствии ацилирующего средства с получением соединения формулы (VI), где Р 3 представляет собой ацил. Подходящие ацилирующие средства и условия являются такими же, как описано в настоящем документе выше. Следующая стадия может предусматривать реакции формулы (VI), где Р 3 представляет собой ацил, в присутствии ацетата палладия или его производного с получением соединения формулы (VII),где Р 1 представляет собой R2Si(R3)(R4)-. Данную реакцию можно проводить, как описано в настоящем документе выше. Следующая стадия в способе предусматривает восстановление соединения формулы(VII) при помощи восстанавливающего средства с получением соединения формулы (II), где Р 1 представляет собой R2Si(R3)(R4)-. Данную реакцию можно проводить, как описано в настоящем документе выше. Согласно другому варианту осуществления соединение формулы (II) можно получить способом,включающим следующие стадии: 1) реакция соединения формулы (V) с силилирующим или ацилирующим средством с получением соединения формулы (Va), где Р 1 имеет такое же значение, как в п.1 формулы изобретения: 2) галогенирование или сульфинилирование соединения формулы (Va) с получением соединения формулы (Vb): где X представляет собой галоген или -O-SO-R20, R20 представляет собой группу, выбранную из С 6-10 арила или гетероарила, причем каждая группа необязательно замещена одним или несколькими заместителями, независимо выбранными из хлора или С 1-4 алкила; 3) дегалогенирование или десульфинилирование соединения формулы (Vb) с получением соединения формулы (VII): 4) реакция соединения формулы (VII) с восстанавливающим средством с получением соединения формулы (II). Согласно стадии (I) данного варианта осуществления гидроксил эстрона формулы (V) защищают с получением соединения формулы (Va). Согласно варианту осуществления эстрон формулы (V) может реагировать с силилирующим средством. Неограничивающие примеры подходящих силилирующих средств и условий являются такими же, как описано в настоящем документе выше для стадии (а) способа настоящего изобретения. Например, образование защищенного силильного эфира эстрона можно проводить реакцией силилирующего средства, такого как трет-бутилдиметилсилилхлорид, дифенилметилсилилхлорид, диметилфенилсилилхлорид, триметилсилилхлорид, триэтилсилилхлорид или триизопропилсилилхлорид или такого как трет-бутилдиметилсилилтрифлат, дифенилметилсилилтрифлат, диметилфе- 11024003 нилсилилтрифлат, триметилсилилтрифлат, триэтилсилилтрифлат или триизопропилсилилтрифлат. Реакцию можно проводить в присутствии подходящего основания, такого как имидазол, 2,6-лютидин, коллидин, триэтиламин или 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU). Реакцию можно проводить при комнатной температуре или при кипении с обратным холодильником. Реакцию можно проводить в присутствии подходящего растворителя, такого как дихлорметан, толуол или диметилформамид или их смесь. Согласно другому варианту осуществления эстрон формулы (V) может реагировать с ацилирующим средством. Согласно варианту осуществления указанное ацилирующее средство можно выбрать из группы, содержащей С 2-6 алкенил-С 1-6 алканоат, С 2-6 алкенил-С 3-6 циклоалканоат, ацилхлорид и ангидриды. Предпочтительно ацилирующее средство выбрано из группы, содержащей С 2-6 алкенилпропаноат,С 2-6 алкенилбутаноат,С 2-6 алкенилпентаноат,С 2-6 алкенилгексаноат,С 2-6 алкенилциклопропаноат,С 2-6 алкенилциклобутаноат, С 2-6 алкенилциклопентаноат и С 2-6 алкенилциклогексаноат, ацилхлорид и ангидриды. Более предпочтительно ацилирующее средство выбрано из группы, содержащей изопропенилацетат, изопропенилпропионат, изопропенилбутират, изопропенилизобутират, винилацетат, винилпропионат, проп-2-енилциклогексанкарбоксилат, этенилциклопентанкарбоксилат, винилциклогексаноат,ацетилхлорид, пропионилхлорид, бутирилхлорид, уксусный ангидрид и подобное. Более предпочтительно ацилирующее средство выбрано из группы, содержащей изопропенилацетат, изопропенилпропионат,изопропенилбутират, изопропенилизобутират, винилацетат, винилпропионат, ацетилхлорид, пропионилхлорид, бутирилхлорид, уксусный ангидрид и подобное. Ацилирование при проведении при помощи С 26 алкенил-С 1-6 алканоата или С 2-6 алкенил-С 3-6 циклоалканоата можно проводить в присутствии кислоты,такой как в присутствии серной кислоты или в присутствии С 6-10 арилсульфоновой кислоты, необязательно замещенной одним или несколькими хлорзаместителями. Неограничивающие примеры подходящей кислоты включают паратолуолсульфоновую кислоту и серную кислоту. Ацилирование при его проведении с ацилхлоридом или ангидридом можно проводить в присутствии органического основания, такого как имидазол, триэтиламин и подобное. Стадия (2) способа предусматривает галогенирование или сульфинилирование соединения формулы (Va) с получением соединения формулы (Vb), где X представляет собой галоген или -O-SO-R20,R20 представляет собой группу, выбранную из С 6-10 арила или гетероарила, причем каждая группа необязательно замещена одним или несколькими заместителями, независимо выбранными из хлора или С 1-4 алкила; предпочтительно R20 представляет собой фенил или пиридинил. Согласно варианту осуществления стадия (2) представляет собой галогенирование, и галогенирование проводят реакцией соединения формулы (Va) с галогенирующим реагентом. Предпочтительно стадия (2) представляет собой бромирование, и X представляет собой бром. Согласно варианту осуществления бромирующий реагент можно выбрать из группы, содержащей бромид меди(II), бром, пербромид пиридинийбромида и подобное. Согласно другому варианту осуществления стадия (2) представляет собой сульфинилирование, и сульфинилирование проводят реакцией соединения формулы (Va) с основанием и с реагентом сульфинилирования. Неограничивающие примеры реагента сульфинилирования включают метил 2-пиридинсульфинат,метилбензолсульфинат,метил-4-метилбензолсульфинат и метил-4 хлорбензолсульфинат. Основание, используемое на стадии сульфинилирования, можно выбрать из группы, содержащей гидрид калия, трет-бутилат калия, гидрид натрия, трет-бутилат натрия и их смесь. Неограничивающие примеры подходящих экспериментальных условий для сульфинилирования описаныBarry M. Trost et al. в Journal of Organic Chemistry, 1993, 58, 1579-81; таким образом, включенном ссылкой. Следующая стадия (3) включает дегалогенирование или десульфинилирование соединения формулы (Vb) с получением соединения формулы (V). Согласно варианту осуществления стадия (2) представляет собой галогенирование и стадия (3) включает стадию дегалогенирования, которую можно проводить в присутствии основания. Основание можно выбрать из группы, содержащей имидазол, коллидин, 2,6-лютидин, триэтиламин или 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU). Реакцию дегалогенирования можно проводить при температуре от 30 до 130 С. Предпочтительно реакцию дегалогенирования проводят в апротонном растворителе. Согласно другому варианту осуществления стадия (2) представляет собой сульфинилирование и стадия (3) включает десульфинилирование, которое можно проводить при нагревании, необязательно в присутствии сульфата меди. Температура стадии десульфинилирования может составлять от 80 до 130 С, предпочтительно от 90 до 120 С, предпочтительно от 100 до 115 С. Следующая стадия (4) в способе включает восстановление соединения формулы (Vb) при помощи восстанавливающего средства с получением соединения формулы (II). Предпочтительно указанное восстанавливающее средство представляет собой металлогидридное соединение. Например, металлогидридное соединение можно выбрать из группы, содержащей LiAlH4, NaBH4, NaBH(OAc)3, ZnBH4 иNaBH4/CeCl3. Предпочтительно указанное восстанавливающее средство представляет собой NaBH4/CeCl3 Например, указанное восстановление можно проводить в подходящем растворителе или их смеси, таком как в тетрагидрофуране или смеси метанола и тетрагидрофурана. Реакцию можно проводить при низких температурах, таких как ниже 15 С, например ниже 10 С. Способ настоящего изобретения для получения соединения (I) обеспечивает получение эстра 1,3,5(10)-триен-3,15,16,17-тетрола (стерол) в качестве основного продукта с незначительным количеством или без образования изомера эстра-1,3,5(10)-триен-3,15,16,17-тетрол. При использовании в настоящем документе незначительное количество относится к получению более 90% эстетрола и менее 10% 15,16,17-тетрольного изомера, предпочтительно менее 5% 15,16,17-тетрольного изомера,более предпочтительно менее 1% 15,16,17-тетрольного изомера. Способ согласно настоящему изобретению имеет преимущество в том, что эстетрол можно получить при помощи уменьшенного числа стадий по сравнению со способами предшествующего уровня техники, что является более целесообразным с точки зрения экономики и промышленного синтеза. Настоящее изобретение также охватывает применение эстетрола, непосредственно полученного способом по настоящему изобретению, для производства фармацевтической композиции, предпочтительно для применения в способе, выбранном из способа гормонозаместительной терапии, способа лечения вагинальной сухости, способа контрацепции, способа повышения либидо, способа лечения кожи,способа ускорения заживления ран и способа лечения или предотвращения расстройства, выбранного из группы, состоящей из аутоиммунных заболеваний, опухолей молочной железы и опухолей колоректальной зоны. Настоящее изобретение проиллюстрировано, но не ограничено, следующими примерами. Примеры Пример 1. Получение соединения формулы (I) при помощи трет-бутилдиметилсилильной группы в качестве защитной группы для Р 1 и Р 2 согласно варианту осуществления настоящего изобретения. Стадия 1. бис-(Диметил-трет-бутилсилильный)эфир эстра-1,3,5(10),15-тетраен-3,17-диола. Исходный материал 3-трет-бутилдиметилсилокси-эстра-1,3,5(10)-15-тетраен-17-ол можно получить, как описано в примерах 3 и 4. В раствор 3-трет-бутилдиметилсилокси-эстра-1,3,5(10)-15-тетраен 17-ола (10 г, 0,025 моль) в 100 мл диметилформамида добавили имидазол (4,4 г, 0,065 моль) и диметилтрет-бутилсилилхлорид (1,5 экв.) и позволили отстояться при комнатной температуре в течение 6 ч. Полученный раствор разбавляли этилацетатом, промывали водой и выпаривали. Остаток кристаллизовали из метанола с получением (10 г) бис-(диметил-трет-бутилсилильного) эфира эстра-1,3,5(10),15-тетраен 3,17-диола. 1H-ЯМР (CDC13): 0,08 (6H, c, 17-OSi(CH3)2), 0,18 (6H, 3-OSi(CH3)2), 0,81 (3 Н, с, 18-СН 3), 0,91 (9H,17-OSi-трет-Bu), 0,97 (9H, c, 3-OSi-трет-Bu), 4,33 (1H, широкий с, 17aH), 5,60 (1 Н, м, 15-Н), 5,95 (1 Н, широкий д, 16 Н), 6,45-6,75 (2 Н, 2- и 4 Н), 7,12 (1 Н, д, J=8 Гц, 1 Н). Т.пл.: 89-91 С. Стадия 2. Эстра-1,3,5(10),15,16,17-тетрол. В перемешанный раствор бис-(диметил-трет-бутилсилильного)эфира эстра-1,3,5(10),15-тетраен 3,17-диола (10 г, 0,02 моль) и муравьиной кислоты (0,06 моль, 2,3 мл) в ацетоне (100 мл) при 0 С добавляли постепенно раствор перманганата калия (3,15 г, 0,02 моль) в воде (20 мл) и ацетоне (100 мл). После завершения реакции реакцию гасили 10% водным раствором KHSO3. Ацетон частично удаляли и экстрагировали этилацетатом, промывали водой. Этилацетат концентрировали под пониженным давлением и разбавляли гептаном. Осадок собирали фильтрованием и растворяли в ацетоне (100 мл). В раствор добавляли 5 н. соляную кислоту (20 мл). После завершения реакции полученный раствор разбавляли водой. Твердое вещество собирали фильтрованием, промывали гептаном и кристаллизовали из смеси метанола и воды с получением титульного соединения. Пример 2. Получение соединения формулы (I) при помощи трет-бутилдиметилсилильной группы в качестве защитной группы для Р 1 и пивалоила для Р 2 согласно варианту осуществления настоящего изобретения. Исходный материал 3-трет-бутилдиметилсилокси-эстра-1,3,5(10)-15-тетраен-17-ол можно получить, как описано в примерах 3 и 4. В раствор 3-трет-бутилдиметилсилокси-эстра-1,3,5(10)-15-тетраен 17-ола (30 г, 0,078 моль) в 300 мл дихлорметана и 11 мл триэтиламина добавляли по каплям 10,36 г(0,086 моль) пивалоилхлорида в 50 мл метиленхлорида при 0 С. В конце добавления раствор перемешивали при комнатной температуре в течение 1 ч. Воду добавляли и органический слой промывали два раза 100 мл воды. Гептан добавляли и продукт собирали фильтрованием и использовали на следующей стадии без какой-либо другой очистки. 3-трет-Бутилдиметилсилилокси-эстра-1,3,5(10)-15-тетраен-17-пивалоат превращали в его 15,16-производное, следуя процедуре, описанной в примере 1 для стадии 1. Затем этот 3-трет-бутилдиметилсилилокси-эстра-1,3,5(10)-15,16-диолтриен-17-пивалоат (10 г,0,02 моль) и K2CO3 (2,76 г, 0,02 моль) суспендировали в метаноле 200 мл и перемешивали в течение 4 ч при комнатной температуре. Воду 300 мл добавляли и смесь нейтрализовали 0,1 н. HCl. Продукт собирали фильтрованием и сушили с получением 7,5 г (выход 90%) 3-трет-бутилдиметилсилилокси-эстра 1,3,5(10)-триен-15,16,17-триола. Снятие в кислой среде силильной защитной группы проводили при помощи таких же условий, как описано в примере 1 для стадии 2, и позволяли этому соединению превратиться в эстетрол с выходом 90%. Пример 3. Получение соединения формулы(II),где Р 1 представляет собой трет-бутилдиметилсилил, согласно варианту осуществления настоящего изобретения. Стадия 1. 3,17-Ди-трет-бутилдиметилсилокси-эстра-1,3,5(10)-16-тетраен-17-ол. В раствор эстрона (50 г, 0,185 моль) и 2,6-лютидина (62 г, 0,58 моль) в дихлорметане 400 мл добавляли по каплям трет-бутилдиметилсилилтрифлат (102,6 г, 0,39 моль). Раствор перемешивали при комнатной температуре в течение 6 ч. Воду (300 мл) добавляли и органический слой промывали разбавленным раствором карбоната натрия. Раствор дихлорметана частично выпаривали и добавляли этилацетат. Диизопропиловый эфир добавляли в этот раствор. Смесь перемешивали в течение 2 ч при 0 С. Осадок собирали фильтрованием и сушили. Получали 83 г титульного соединения (выход 90%). Стадия 2. 3-трет-Бутилдиметилсилокси-эстра-1,3,5(10)-15-тетраен-17-он. В раствор 3,17-ди-трет-бутилдиметилсилокси-эстра-1,3,5(10)-16-тетра-17-ол 83 г (0,166 моль) в 400 мл ацетонитрила добавляли Pd(OAc)2 3,8 г (0,017 моль) в атмосфере кислорода. Смесь перемешивали при 40 С в течение 12 ч, затем отфильтровывали через загрузку из целита. Добавляли разбавленный раствор карбоната натрия и смесь экстрагировали этилацетатом. После концентрирования добавляли диизопропиловый эфир и смесь перемешивали при 0 С в течение 1 ч. Продукт (54,7 г, выход 86%) собирали фильтрованием и использовали на следующей стадии без дополнительной очистки. Стадия 3. 3-трет-Бутилдиметилсилокси-эстра-1,3,5(10)-15-тетраен-17-ол. Собранный материал (54,7 г, 0,143 моль) растворяли в THF 300 мл и добавляли раствор гептагидрата хлорида церия (53,3 г, 0,143 моль) в метаноле (300 мл). Смесь охлаждали до 0 С, порционно добавляли борогидрит натрия (8,12 г, 0,213 моль, 1,5 экв.), выдерживая температуру ниже 9 С. В конце этого добавления смесь хранили в течение 1 ч, затем гасили добавлением раствора 2 н. HCl (100 мл). Раствор частично выпаривали in situ и добавляли воду (4 л). Осадок собирали фильтрованием и сушили. После кристаллизации из смеси этанола/диизопропилового эфира продукт собирали фильтрованием и сушили. Он весил 46,6 г (выход 85%). Пример 4. Получение соединения формулы (II), где Р 1 представляет собой третбутилдиметилсилил, согласно варианту осуществления настоящего изобретения. Стадия 1. 3-трет-Бутилдиметилсилокси-эстра-1,3,5(10)-триен-17-он. В раствор эстрона (100 г, 0,37 моль) в 400 мл дихлорметана добавляли имидазол (50,36 г, 0,74 моль) и трет-бутилдиметилсилилхлорид (61,3 г, 0,41 моль). Раствор перемешивали при комнатной температуре в течение 24 ч. Затем добавляли воду (200 мл). Органический слой частично выпаривали и добавляли диизопропиловый эфир. Образовавшееся белое твердое вещество собирали фильтрованием и сушили. Оно весило 135,2 г, выход 95%, т.пл. 172 С. 1H-ЯМР (200 МГц): 7,12 (d, J=7,9 Гц, 1 Н), 6,61 (м, 2 Н), 2,84 (м, 3 Н), 2,06-1,45 (м, 12 Н), 0,97 (с, 9 Н),0,91 (с, 3 Н), 0,18 (с, 6 Н). Стадия 2. 3-трет-Бутилдиметилсилокси-эстра-1,3,5(10)-16-тетраен-17-ацетат. 3-трет-Бутилдиметилсилокси-эстра-1,3,5(10)-триен-17-он 135 г (0,351 моль) выливали в 600 мл изопропенилацетата и 12 г паратолуолсульфоновой кислоты. Смесь кипятили с обратным холодильником. Ацетон и изопропенилацетат непрерывно отгоняли до тех пор, пока внутренняя температура не достигла 98 С. Затем смесь охлаждали до 0 С и добавляли карбонат калия. Через 1 ч отстаивания при 0 С смесь отфильтровывали. Полученный раствор частично концентрировали и добавляли диизопропиловый эфир. Осадок собирали фильтрованием и кристаллизовали из смеси этилацетата и гептана. Продукт собирали фильтрованием и сушили. Он весил 119,5 г (выход 80%). Стадия 3. 3-трет-Бутилдиметилсилокси-эстра-1,3,5(10)-15-тетраен-17-он. В раствор 3-трет-бутилдиметилсилокси-эстра-1,3,5 (10)-16-тетраен-17-ацетата 119,5 г (0,280 моль) в ацетонитриле (1500 мл) добавляли 27,2 г (0,085 моль метоксида трибутилолова, 11,2 г (0,05 моль) ацетата палладия и 64 мл (0,560 моль) аллилметилкарбоната. Смесь кипятили с обратным холодильником в течение 2 ч, затем охлаждали до комнатной температуры и отфильтровывали через загрузку из силикагеля. Смесь разбавляли водой и экстрагировали этилацетатом. После концентрирования до одной трети начального объема добавляли диизопропиловый эфир и раствор охлаждали при 0 С в течение 1 ч. Продукт собирали фильтрованием. Он весил 91 г (выход 85%) и использовался на следующей стадии без дополнительной очистки. Стадия 4. 3-трет-Бутилдиметилсилокси-эстра-1,3,5(10)-15-тетраен-17-ол. Стадию восстановления проводили, как описано для стадии 3 примера 2: собранный материал растворяли в THF и добавляли раствор гептагидрата хлорида церия (1 экв.) в метаноле. Смесь охлаждали до 0 С, добавляли борогидрид натрия (1,5 экв.) порционно, выдерживая температуру ниже 9 С. В конце добавления смесь хранили в течение 1 ч, затем гасили добавлением раствора 2 н. HCl. Раствор частично выпаривали in situ и добавляли воду. Осадок собирали фильтрованием и сушили. После кристаллизации из смеси этанола/диизопропилового эфира продукт собирали фильтрованием и сушили. Пример 5. Получение соединения формулы (II), где Р 1 представляет собой третбутилдиметилсилил, согласно варианту осуществления настоящего изобретения. Стадия 1. 3-трет-Бутилдиметилсилилокси-эстра-1,3,5(10)-триен-17-он. В раствор 3-гидрокси-эстра-1,3,5(10)-триен-17-она (100 г, 0,370 моль) в 500 мл дихлорметана добавляли трет-бутилдиметилсилилхлорид (58,3 г, 0,388 моль) и имидазол (26,4 г, 0,388 моль). Смесь перемешивали в течение 24 ч при комнатной температуре. Добавляли воду (300 мл) и органический слой промывали 200 мл воды. После концентрирования продукт кристаллизовали из смеси этанола/диизопропилового эфира, собирали фильтрованием и сушили. Он весил 145 г (выход 95%). Стадия 2. 3-трет-Бутилдиметилсилилокси-эстра-1,3,5(10)-15-тетраен-17-он. Раствор трет-бутилата калия (50 г, 0,45 моль) в 800 мл тетрагидрофурана обрабатывали 3-третбутилдиметилсилилокси-эстра-1,3,5(10)-триен-17-оном (86,5 г, 0,225 моль) в азоте и перемешивали в течение 1 ч, затем добавляли метилбензолсульфинат (70,2 г, 0,45 моль) и триэтиламин. После перемешивания в течение 2 ч раствор выливали в 1000 мл воды и 70 мл соляной кислоты, поддерживая температуру ниже 5 С. 1000 мл толуола добавляли, фазы разделяли и раствор нагревали для отгонки растворителя до тех пор, пока температура не достигла 115 С Кипячение с обратным холодильником поддерживали в течение 5 ч. Толуол промывали два раза водой и затем частично концентрировали. Добавляли гептан. После 1 ч выдерживания при 5 С твердое вещество собирали фильтрованием и использовали на стадии восстановления без дополнительной очистки. Стадия 3. 3-трет-Бутилдиметилсилилокси-эстра-1,3,5(10)-15-тетраен-17-ол. Материал, собранный на стадии 2, растворяли в THF 300 мл и добавляли раствор гептагидрата хлорида церия (123 г, 0,33 моль) в метаноле (300 мл). Смесь охлаждали до 0 С и борогидрид натрия (17,8 г,0,47 моль, 1,5 экв.) добавляли порционно, выдерживая температуру ниже 9 С. В конце данного добавления смесь перемешивали в течение 1 ч, затем гасили добавлением раствора 2 н. HCl (100 мл), экстрагировали этилацетатом и промывали водой. Органический слой частично выпаривали, затем добавляли диизопропиловый эфир. Осадок собирали фильтрованием и сушили. После кристаллизации из смеси этанола/диизопропилового эфира титульное соединение выделяли с выходом 90% в виде беловатого твердого вещества. Пример 6. Получение соединения формулы (II), где Р 1 представляет собой третбутилдиметилсилил, согласно варианту осуществления настоящего изобретения. Стадия 1. 3-трет-Бутилдиметилсилилокси-эстра-1,3,5(10)-триен-17-он. 3-трет-Бутилдиметилсилилокси-эстра-1,3,5(10)-триен-17-он получали, как описано для стадии 1 примера 5. Стадия 2. 3-трет-Бутилдиметилсилилокси-эстра-1,3,5(10)-15-тетраен-17-он (при помощи X=Br). Бромид меди(II) (100 г, 0,45 моль) добавляли в теплый раствор 3-трет-бутилдиметилсилилоксиэстра-1,3,5(10)-триен-17-она (86,4 г, 0,225 моль) в метаноле (500 мл) и смесь нагревали с обратным холодильником в течение 2 ч. Горячую смесь отфильтровывали и выливали в смесь дихлорметана (1000 мл) и воды (800 мл). Органический слой промывали водой. В этот раствор добавляли имидазол (18,3 г,0,27 моль) и нагревали с обратным холодильником в течение 6 ч. После охлаждения добавляли воду(500 мл) и органический слой концентрировали. Остаток кристаллизовали из смеси этилацетата и гептана. Стадия 3. 3-трет-Бутилдиметилсилилокси-эстра-1,3,5(10)-15-тетраен-17-ол. Стадию восстановления проводили, как описано для стадии 3 примера 1. Материал, собранный на стадии 2 примера 2, растворяли в THF и раствор гептагидрата хлорида церия (приблизительно 1 экв.) в метаноле добавляли. Смесь охлаждали до 0 С и борогидрид натрия (1,5 экв.) добавляли порционно, выдерживая температуру ниже 9 С. В конце этого добавления смесь перемешивали в течение 1 ч, затем гасили добавлением раствора 2 н. HCl, экстрагировали этилацетатом и промывали водой. Органический слой частично выпаривали, затем добавляли диизопропиловый эфир. Осадок собирали фильтрованием и сушили. После кристаллизации из смеси этанола/диизопропилового эфира титульное соединение выделяли в виде беловатого твердого вещества. Пример 7. Получение соединения формулы (II), где Р 1 представляет собой третбутилдиметилсилил, согласно варианту осуществления настоящего изобретения. Стадия 1. 3-трет-Бутилдиметилсилилокси-эстра-1,3,5(10)-триен-17-он. 3-трет-Бутилдиметилсилилокси-эстра-1,3,5(10)-триен-17-он получали, как описано на стадия 1 примера 5. Стадия 2. 3-трет-Бутилдиметилсилилокси-эстра-1,3,5(10)-15-тетраен-17-он(при помощи Х=пиридинсульфиновый). 3-трет-Бутилдиметилсилилокси-эстра-1,3,5(10)-триен-17-он (8,64 г, 0,0225 моль) добавляли в суспензию гидрида калия (3 экв. 35% дисперсия в масле) в тетрагидрофуране 100 мл. Добавляли метил-2-пиридинсульфинат (5,3 г, 0,034 моль, 1,5 экв.). Через 30 мин при комнатной температуре реакцию выливали в сульфатный буфер. Водную фазу нейтрализовали водным раствором карбоната натрия,- 15024003 затем экстрагировали толуолом. Раствор нагревали до 110 С в течение 1 ч. После охлаждения до комнатной температуры раствор промывали разбавленным раствором гидроксида натрия, затем водой. Органический слой частично концентрировали с последующим добавлением гептана. 3-третбутилдиметилсилилокси-эстра-1,3,5(10)-15-тетраен-17-он собирали фильтрованием. Стадия 3. 3-трет-Бутилдиметилсилилокси-эстра-1,3,5(10)-15-тетраен-17-ол. Стадию восстановления проводили, как описано для стадии 3 примера 1. Материал, собранный на стадии 2 примера 3, растворяли в THF и добавляли раствор гептагидрата хлорида церия в метаноле. Смесь охлаждали до 0 С и порционно добавляли борогидрид натрия (1,5 экв.), выдерживая температуру ниже 9 С. В конце этого добавления смесь перемешивали в течение 1 ч, затем гасили добавлением раствора 2 н. HCl, экстрагировали этилацетатом и промывали водой. Органический слой частично выпаривали, затем добавляли диизопропиловый эфир. Осадок собирали фильтрованием и сушили. После кристаллизации из смеси этанола/диизопропилового эфира титульное соединение выделяли в виде беловатого твердого вещества. Следует понимать, что, хотя предпочтительные варианты осуществления и/или материалы обсуждались для обеспечения вариантов осуществления согласно настоящему изобретению, различные модификации или изменения можно сделать без отклонения от объема и сущности настоящего изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы (I) или его сольватов: включающий следующие стадии: а) реакция соединения формулы (II) с силилирующим средством с получением соединения формулы (III): в которой Р 1 представляет собой защитную группу, выбранную из R1CO- или R2Si(R3)(R4)-; Р 2 представляет собой защитную группу (R2)Si(R3)(R4)-, гдеR1 представляет собой группу, выбранную из C1-6 алкила или С 3-6 циклоалкила, причем каждая группа необязательно замещена одним или несколькими заместителями, независимо выбранными из фтора или С 1-4 алкила; каждый R2, R3 и R4 независимо представляет собой группу, выбранную из С 1-6 алкила или фенила,причем каждая группа необязательно замещена одним или несколькими заместителями, независимо выбранными из фтора или С 1-4 алкила;b) реакция соединения формулы (III) в присутствии по меньшей мере одного окисляющего средства, выбранного из перманганатной соли, оксида осмия, пероксида водорода, с получением соединения формулы (IV): с) снятие защитных групп соединения формулы (IV) с получением соединения формулы (I). 2. Способ по п.1, отличающийся тем, что соединение формулы (I) представляет собой гидрат. 3. Способ по п.1 или 2, отличающийся тем, что Р 1 представляет собой R2Si(R3)(R4)- и Р 2 представляет собой (R2)Si(R3)(R4)-. 4. Способ по любому из пп.1-3, отличающийся тем, что силилирующее средство выбирают из группы,содержащейC1-6 алкилсилилхлорид,С 1-6 алкилсилилтрифлат,С 6-арилсилилхлорид,С 6-арилсилилтрифлат, С 1-6 алкил-С 6-арилсилилхлорид, С 1-6 алкил-С 6-арилсилилтрифлат, причем каждая группа необязательно замещена одним или несколькими заместителями, независимо выбранными из фтора или С 1-4 алкила. 5. Способ по любому из пп.1-4, отличающийся тем, что на стадии (b) указанное окисляющее средство представляет собой перманганат калия. 6. Способ по п.5, отличающийся тем, что стадию (b) проводят в присутствии кислоты. 7. Способ по любому из пп.1-6, отличающийся тем, что соединение формулы (II) получают способом, включающим следующие стадии:i) реакция соединения формулы (V) с ацилирующим или силилирующим средством с получением соединения формулы (VI): в которой Р 3 представляет собой защитную группу, выбранную из R9CO- или R10Si(R11)(R12)-, гдеR9 представляет собой группу, выбранную из С 1-6 алкила или С 3-6 циклоалкила, причем каждая группа необязательно замещена одним или несколькими заместителями, независимо выбранными из фтора или С 1-4 алкила; каждый R10, R11 и R12 независимо представляет собой группу, выбранную из С 1-6 алкила или фенила,причем каждая группа необязательно замещена одним или несколькими заместителями, независимо выбранными из фтора или С 1-4 алкила;ii) реакция соединения формулы (VI) в присутствии ацетата палладия или его производного или частиц йода (V) с получением соединения формулы (VII):iii) реакция соединения формулы (VII) с восстанавливающим средством с получением соединения формулы (II). 8. Способ по п.7, отличающийся тем, что Р 3 представляет собой R9CO-. 9. Способ по п.8, отличающийся тем, что стадия (i) включает следующие стадии:(i1) защита гидроксила соединения формулы (V) силилирующим средством с получением соединения формулы (Va), где Р 1 имеет такое же значение, как определено в п.1:(i2) защита кетона соединения формулы (Va) в присутствии ацилирующего средства с получением соединения формулы (VI). 10. Способ по любому из пп.1-6, отличающийся тем, что соединение формулы (II) получают способом, предусматривающим следующие стадии: 1) реакция соединения формулы (V) с силилирующим или ацилирующим средством с получением соединения формулы (Va), где Р 1 имеет такое же значение, как в п.1: 2) галогенирование или сульфинилирование соединения формулы (Va) с получением соединения формулы (Vb): в которой X представляет собой галоген или -SO-R20, где R20 представляет собой группу, выбранную из С 6-10 арила или гетероарила, причем каждая группа необязательно замещена одним или несколькими заместителями, независимо выбранными из хлора или С 1-4 алкила; 3) дегалогенирование или десульфинилирование соединения формулы (Vb) с получением соединения формулы (VII): 4) реакция соединения формулы (VII) с восстанавливающим средством с получением соединения формулы (II). 11. Способ по п.10, отличающийся тем, что стадия (2) представляет собой сульфинилирование и сульфинилирование проводят реакцией соединения формулы (Va) с основанием и с реагентом сульфинилирования. 12. Способ по п.10, отличающийся тем, что стадия (2) представляет собой галогенирование и галогенирование проводят реакцией соединения формулы (Va) с галогенирующим реагентом. 13. Способ по любому из пп.7 и 10, отличающийся тем, что стадию (iii) и стадию (4) проводят с использованием восстанавливающего средства, выбранного из группы металлогидридных соединений. 14. Способ по любому из пп.7-13, отличающийся тем, что силилирующее средство выбирают из группы,содержащей С 1-6 алкилсилилхлорид,С 1-6 алкилсилилтрифлат,С 6-арилсилилхлорид,С 6-арилсилилтрифлат, С 1-6 алкил-С 6-арилсилилхлорид, С 1-6 алкил-С 6-арилсилилтрифлат, причем каждая группа необязательно замещена одним или несколькими заместителями, независимо выбранными из фтора или С 1-4 алкила. 15. Способ по любому из пп.7-13, отличающийся тем, что ацилирующее средство выбирают из группы, содержащей С 2-6 алкенил-С 1-6 алканоаты, С 2-6 алкенил-С 3-6 циклоалканоат, ацилхлориды и ангидриды.
МПК / Метки
МПК: C07J 75/00
Метки: эстетрола, способ, получения
Код ссылки
<a href="https://eas.patents.su/19-24003-sposob-polucheniya-estetrola.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения эстетрола</a>
Предыдущий патент: Полиацетальный нанокомпозит
Следующий патент: Способ получения (1-циклопропил-6-фтор-1,4-дигидро-8-метокси-7-[(4as,7as)-октагидро-6h-пирроло[3,4-b]пиридин-6-ил]-4-оксо-3-хинолинкарбоновой кислоты
Случайный патент: Способ нанесения тонкого слоя и получаемый с использованием этого способа продукт












