Способ получения интермедиатов эстетрола
Формула / Реферат
1. Способ получения соединения формулы (I)
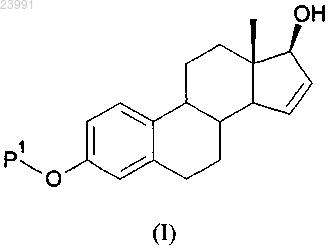
включающий следующие стадии, на которых:
а) соединение формулы (II) вводят в реакцию с ацилирующим или с силилирующим агентом с получением соединения формулы (III), в которой Р1 и Р2, каждый независимо, представляют собой защитную группу, выбранную из R2-Si-R3R4 или R1CO-, где R1 представляет собой группу, выбранную из С1-6алкильной или С3-6циклоалкильной группы, каждая из которых может быть необязательно замещена одним или несколькими заместителями, независимо выбранными из фтора или С1-4алкильной группы; R2, R3 и R4, каждый независимо, представляют собой группу, выбранную из С1-6алкильной или фенильной группы, каждая из которых может быть необязательно замещена одним или несколькими заместителями, независимо выбранными из фтора или С1-4алкильной группы
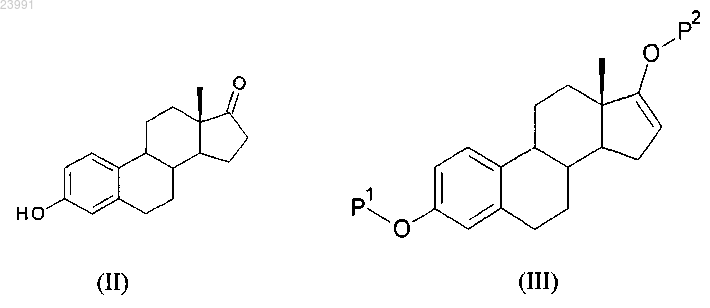
b) соединение формулы (III) вводят в реакцию в присутствии ацетата палладия или его производного с получением соединения формулы (IV)
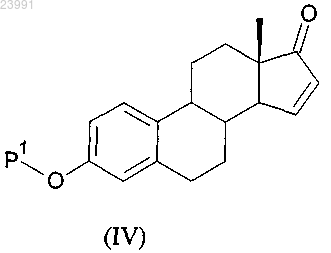
с) соединение формулы (IV) вводят в реакцию с восстановителем с получением соединения формулы (I).
2. Способ по п.1, в котором Р1 представляет собой R1CO-.
3. Способ по п.1, в котором Р1 представляет собой R2-Si-R3R4.
4. Способ по п.3, в котором Р2 представляет собой R2-Si-R3R4.
5. Способ по любому из пп.1-3, в котором Р2 представляет собой R1CO-.
6. Способ по п.5, в котором стадия (а) включает следующие стадии:
(a1) гидроксильное соединение формулы (II) защищают силилирующим агентом с получением соединения формулы (IIa), в которой Р1 имеет то же значение, что и в п.3

(а2) кетон формулы (IIa) защищают в присутствии ацилирующего агента с получением соединения формулы (III).
7. Способ по любому из пп.1-3, 5 и 6, в котором ацилирующий агент представляет собой С2-6алкенил-С1-6алканоат или С2-6алкенил-С3-6циклоалканоат.
8. Способ по любому из пп.1, 3-7, в котором силилирующий агент выбирают из группы, включающей С1-6алкилсилилхлорид, C1-6алкилсилилтрифлат, фенилсилилхлорид, фенилсилилтрифлат, С1-6алкилфенилсилилхлорид, C1-6алкилфенилсилилтрифлат, каждый из которых может быть необязательно замещен одним или несколькими заместителями, которые независимо выбирают из фтора или С1-4алкильной группы.
9. Способ по любому из пп.1-8, в котором стадию (b) осуществляют в присутствии C1-6алкиленкарбоната и оловоорганического соединения.
10. Способ по любому из пп.1-9, в котором указанный ацетат палладия присутствует в стехиометрическом количестве.
11. Способ по любому из пп.1-9, в котором указанную реакцию осуществляют с ацетатом палладия, присутствующим в каталитическом или субстехиометрическом количестве, и в котором реакцию предпочтительно проводят в атмосфере кислорода.
12. Способ по любому из пп.1-11, в котором восстановитель на стадии (с) выбирают из группы соединений типа гидридов металлов.
13. Способ по п.12, в котором соединение типа гидридов металлов выбирают из группы, включающей NaBH4/CeCl3, LiAlH4, NaBH4, NaBH(OAc)3 и ZnBH4.
14. Способ получения эстетрола, включающий стадии, на которых а) соединение формулы (I) получают способом по любому из пп.1-13 и b) соединение формулы (I) затем вводят в реакцию или реакции для получения эстетрола.
Текст
СПОСОБ ПОЛУЧЕНИЯ ИНТЕРМЕДИАТОВ ЭСТЕТРОЛА Изобретение относится к способу получения соединения формулы (I) включающему следующие стадии: а) взаимодействие соединения формулы (II) с ацилирующим или с силилирующим агентом с получением соединения формулы (III), где Р 1 и Р 2, каждый независимо, представляют собой защитную группу,выбранную из R2-Si-R3R4 или R1CO-, где R1 представляет собой группу, выбранную из C1-6 алкильной или С 3-6 циклоалкильной группы, каждая из которых может быть необязательно замещена одним или несколькими заместителями,независимо выбранными из фтора или С 1-4 алкильной группы; R2, R3 и R4, каждый независимо, представляют собой группу, выбранную из С 1-6 алкильной или фенильной группы, каждая из которых может быть необязательно замещена одним или несколькими заместителями, независимо выбранными из фтора или С 1-4 алкильной группы;b) взаимодействие соединения формулы (III) в присутствии ацетата палладия или его производного с получением соединения формулы (IV) с) взаимодействие соединения формулы (IV) с восстановителем с получением соединения Область техники, к которой относится изобретение Настоящее изобретение относится к новому способу синтеза ключевого интермедиата в синтезе эстетрола. Уровень техники Эстрогенные соединения обычно используются в способах заместительной гормональной терапии(HRT) и в способах женской контрацепции. Эстетрол представляет собой биогенный эстроген, который продуцируется эндогенно в печени плода во время беременности у людей. Недавно было обнаружено,что эстетрол эффективен в качестве эстрогенного соединения, используемого в HRT. Другие важные области применения эстетрола лежат в областях контрацепции, терапии аутоиммунных заболеваний,профилактики и терапии опухолей молочной железы и толстой кишки, усиления либидо, ухода за кожей и заживления ран. Синтез эстетрола и его производных известен в данной области техники. Verhaar М.Т. et al.(WO 2004/041839) описали способ получения эстетрола, начиная с 3-А-окси-эстра-1,3,5(10),15-тетраен 17-она, в котором А представляет собой C1-C5-алкильную группу или C7-C12-бензильную группу. В этом документе 3-А-окси-эстра-1,3,5(10),15-тетраен-17-ол получали в 6 стадий из эстрона, в котором А представлял собой бензильную группу, а указанные стадии включали защиту 3-ОН группы бензильной группой, последующее превращение 17-кето-группы в 17,17-этилендиоксильное производное, которое галогенировали по C16 положению с использованием бромида пербромида пиридиния. Дегидрогалогенирование осуществляли с помощью трет-бутоксида калия в диметилсульфоксиде. Снятие защиты с 17-кетогруппы осуществляли с помощью моногидрата n-толуол-сульфоновой кислоты в водном растворе ацетона. Восстановление 17-кето-группы приводит к производному 17-ола. Одним из недостатков способа, описанного в WO 2004/041839, является защита функциональной 3 ОН бензильной группой, которая может быть удалена только путем гидрирования с использованиемPd/C в качестве катализатора на последних стадиях синтеза эстетрола. Кроме того, необходимо измерять уровень данного катализатора в конечном активном веществе, и этот уровень должен соответствовать требованиям ICH. Другим недостатком синтеза, описанного в WO 2004/041839, является двухстадийная защита/снятие защиты функциональной 17-кето-группы с целью получения 15-16 двойной связи. Таким образом, существует потребность в усовершенствованном синтезе 3-защищенного-оксиэстра-1,3,5(10), 15-тетраен-17-ола. Как следствие, цель настоящего изобретения заключается в получении способа синтеза 3 защищенного-окси-эстра-1,3,5(10),15-тетраен-17-ола, который позволил бы преодолеть по меньшей мере один из недостатков известного уровня техники. Раскрытие изобретения Авторы настоящего изобретения обнаружили, что данная цель может быть достигнута с помощью способа, описанного в прилагаемой формуле изобретения. В соответствии с первым аспектом настоящего изобретения раскрывается способ получения соединения, имеющего формулу (I) (3-Р 1-окси-эстра-1,3,5(10),15-тетраен-17-ол) включающий следующие стадии: а) взаимодействие соединения, имеющего формулу (II), с ацилирующим или с силилирующим агентом с получением соединения, имеющего формулу (III), в которой Р 1 и Р 2, каждый независимо, представляют собой защитную группу, выбранную из R1CO- или R2-Si-R3R4, где R1 представляет собой группу,выбранную из C1-6 алкильной или С 3-6 циклоалкильной группы, каждая группа может быть необязательно замещена одним или несколькими заместителями, независимо выбранными из фтора или С 1-4 алкильной группы; R2, R3 и R4, каждый независимо, представляют собой группу, выбранную из С 1-6 алкильной или фенильной группы, и каждая группа может быть необязательно замещена одним или несколькими заместителями, независимо выбранными из фтора или С 1-4 алкильной группыb) взаимодействие соединения формулы (III) в присутствии ацетата палладия или его производного с получением соединения формулы (IV) с) взаимодействие соединения, имеющего формулу (IV), с восстановителем с получением соединения, имеющего формулу (I). Предпочтительно настоящее изобретение охватывает способ получения соединения формулы (I),включающий следующие стадии:a) взаимодействие соединения формулы (II) с ацилирующим или с силилирующим агентом с получением соединения формулы (III), в которой Р 1 и Р 2, каждый независимо, представляют собой защитную группу, выбранную из R2-Si-R3R4 или R1CO-, где R1 представляет собой группу, выбранную изC1-6 алкильной или С 3-6 циклоалкильной группы, и каждая группа может быть необязательно замещена одним или несколькими заместителями, независимо выбранными из фтора или С 1-4 алкильной группы; R2,R3 и R4, каждый независимо, представляют собой группу, выбранную из C1-6 алкильной или фенильной группы, и каждая группа может быть необязательно замещена одним или несколькими заместителями,независимо выбранными из фтора или С 1-4 алкильной группы;b) взаимодействие соединения формулы (III) в присутствии ацетата палладия, присутствующего в каталитических или субстехиометрических количествах, в атмосфере кислорода с получением соединения формулы (IV); иc) взаимодействие соединения, имеющего формулу (IV), с восстановителем с получением соединения, имеющего формулу (I). Настоящее изобретение относится к усовершенствованному способу получения 3-Р 1-окси-эстра 1,3,5(10),15-тетраен-17-ола, имеющего формулу (I), со значительно более высоким выходом и/или с меньшими затратами, чем это возможно при использовании предыдущих известных методов синтеза. В соответствии со вторым аспектом настоящее изобретение также охватывает способ получения эстетрола, включающий получение соединения формулы (I) способом, соответствующим первому аспекту изобретения и дополнительное взаимодействие соединения формулы (I) с получением эстетрола. В соответствии с третьим аспектом настоящее изобретение также охватывает применение эстетрола, непосредственно полученного способом, соответствующим второму аспекту настоящего изобретения,в способе, который выбирают из способа осуществления заместительной гормональной терапии, способа лечения вагинальной сухости, способа контрацепции, способа повышения либидо, способа лечения кожи, способа стимуляции заживления ран и способа лечения или предупреждения нарушения, выбранного из группы, состоящей из аутоиммунных заболеваний, опухолей молочной железы и колоректальных опухолей. Приведенные выше, а также другие характеристики, признаки и преимущества настоящего изобретения будут понятны из приведенного ниже подробного описания, которое на примерах иллюстрирует принципы настоящего изобретения. Осуществление изобретения Кроме того, следует понимать, что терминология, используемая в настоящем документе, не предназначена для ограничения объема настоящего изобретения, который определяется лишь прилагаемой формулой изобретения. В настоящем изобретении единственная форма включает отсылки как к единственному, так и к множественному числу, если из контекста явно не следует иное. Термины "включающий" и "включает" в настоящем изобретении представляют собой включительные или неограничивающие термины, которые не исключают возможности использования дополнительных, неперечисленных членов, элементов или стадий. Следует понимать, что термины "включающий" и"включает" в настоящем изобретении включают в себя термины "состоящий из", "состоит" и "состоит из". Перечисление интервалов численных значений с указанием краевых значений интервала включает в себя все числа и дроби, входящие в соответствующий диапазон, а также указанные краевые значения. Все ссылки, процитированные в настоящем описании, в полном объеме включены в настоящий документ посредством ссылки. В частности, посредством ссылки в настоящий документ включаются все раскрытия из документов по приведенным ссылкам. Если не указано иное, все термины, использованные при раскрытии настоящего изобретения, включая технические и научные термины, имеют те значения, которые обычно используются специалистами в той области техники, к которой принадлежит данное изобретение. С помощью приведенных далее указаний, определения терминов включены в настоящий текст для лучшего понимания сути настоящего изобретения. В следующих параграфах будут более подробно описаны различные аспекты настоящего изобретения. Каждый аспект, определенный таким образом, может комбинироваться с любым другим аспектом или аспектами, если явно не указано обратное. В частности, любой признак, указанный как предпочтительный или выгодный, может быть скомбинирован с любым другим признаком или признаками, указанными как предпочтительные или выгодные. В настоящем описании отсылки к "одному из воплощений" или к "одному воплощению" означают,что данный признак, структура или характеристика, описанные в связи с указанным воплощением,включены по меньшей мере в одно из воплощений настоящего изобретения. Таким образом, использование фраз "в одном из воплощений" или "в одном воплощении" в разных местах данного описания не обязательно отсылает к одному и тому же воплощению, хотя они могут пониматься в том числе и таким образом. Кроме того, конкретные признаки, структуры или характеристики могут комбинироваться любым подходящим образом, понятным специалисту в данной области техники из данного раскрытия, в одном или нескольких воплощениях. Кроме того, поскольку некоторые воплощения, описанные в настоящем документе, включают одни, но не включают другие признаки, включенные в другие воплощения, комбинации признаков из разных воплощений также должны находиться в пределах объема изобретения и образовывать разные воплощения, что должно быть очевидно специалистам в данной области техники. Например, в прилагаемой формуле изобретения любые из заявленных воплощений могут применяться в любых комбинациях. Термин "алкильная группа", сам по себе или как часть другого заместителя, относится к линейной или разветвленной насыщенной углеводородной группе, соединенной одиночными углеродуглеродными связями и имеющей от 1 до 6 атомов углерода, например от 1 до 5 атомов углерода, например от 1 до 4 атомов углерода, предпочтительно от 1 до 3 атомов углерода. Если в настоящем документе применен подстрочный индекс, следующий за атомом углерода, то этот подстрочный индекс относится к числу атомов углерода, которое может содержать указанная группа. Таким образом, например,C1-6 алкильная группа означает алкильную группу размером от 1 до 6 атомов углерода. Метильная, этильная, пропильная, изопропильная, бутильная, изобутильная, втор-бутильная, трет-бутильная, 2 метилбутильная, пентильная группы, изоамиловая группа и ее изомеры, гексильная группа и ее изомеры представляют собой примеры алкильных групп. Термин "С 3-6 циклоалкильная группа", как самостоятельная группа или часть группы, относится к насыщенному циклическому алкильному радикалу, содержащему от примерно 3 до примерно 6 атомов углерода. Примеры моноциклических С 3-6 циклоалкильных радикалов включают циклопропильный, циклобутильный, циклопентильный или циклогексильный радикал. Термин "С 2-6 алкенил", сам по себе или как часть другого заместителя, относится к ненасыщенной гидрокарбильной группе, которая может быть линейной или разветвленной, включающей одну или несколько двойных углерод-углеродных связей. Примеры С 2-6 алкенильных группы включают этенильную,2-пропенильную, 2-бутенильную, 3-бутенильную группы, 2-пентенильную группы и ее изомеры, 2 гексенильную группу и ее изомеры, 2,4-пентадиенильную группу и т.п. Термин "С 6-10 арильная группа", сам по себе или как часть другого заместителя, относится к полиненасыщенной, ароматической гидрокарбильной группе, имеющей единственное кольцо (т.е. фенильная группа) или множество ароматических колец, соединенных вместе (например, нафтильная группа), или связанных ковалентно, обычно содержащей от 6 до 10 атомов углерода, в которой по меньшей мере одно кольцо представляет собой ароматическое кольцо. Предполагается, что термин С 6-10 арильная группа также включает частично гидрированные производные карбоциклических систем, перечисленных в настоящем документе. Неограничивающие примеры С 6-10 арильной группы включают фенильную, нафтильную, инданильную или 1,2,3,4-тетрагидронафтильную группы. Термин "С 6-10 арил-С 1-6 алкильная группа", сам по себе или как часть другого заместителя, относится к C1-6 алкильной группе, как она определена в настоящем документе, в которой один или несколько атомов водорода замещены одной или несколькими С 6-10 арильными группами, как они определены в настоящем документе. Примеры аралкильных радикалов включают бензильный, фенэтильный, дибензилметильный, метилфенилметильный, 3-(2-нафтил)бутильный и т.п. радикалы. Термин "С 1-6 алкилкарбонильная группа", как самостоятельная группа или часть группы, представляет собой группу, имеющую формулу -CO-Ra, где Ra представляет собой C1-6 алкильную группу, как она определена в настоящем документе. Термин "С 3-6 циклоалкилкарбонильная группа", как самостоятельная группа или часть группы,представляет собой группу, имеющую формулу -CO-Rc, где Ra представляет собой С 3-6 циклоалкильную группу, как она определена в настоящем документе. Термин "С 2-6 алкенил-С 1-6 алканоат" относится к соединению, имеющему формулу Rb-O-CO-Ra, в которой Ra представляет собой C1-6 алкильную группу, как она определена в настоящем документе, a Rb представляет собой С 2-6 алкенильную группу, как она определена в настоящем документе. Термин "С 2-6 алкенил-С 3-6 циклоалканоат" относится к соединению, имеющему формулу Rb-O-CO-Rc,в которой Rc представляет собой С 3-6 циклоалкильную группу, как она определена в настоящем документе, a Rb представляет собой С 2-6 алкенильную группу, как она определена в настоящем документе. Термин "C1-6 алкиленкарбонат" относится к соединению, имеющему формулу Rb-O-CO-O-Ra, в которой Ra представляет собой C1-6 алкильную группу, как она определена в настоящем документе, a Rb представляет собой С 2-6 алкенильную группу, как она определена в настоящем документе. Настоящее изобретение относится к способу получения 3-Р 1-окси-эстра-1,3,5(10),15-тетраен-17-ола,имеющего формулу (I), в которой Р 1 представляет собой защитную группу, выбранную из R1CO-, R2SiR3R4; гдеR1 представляет собой группу, выбранную из C1-6 алкильной или С 3-6 циклоалкильной группы, каждая из которых может быть необязательно замещена 1, 2 или 3 заместителями, независимо выбранных из фтора или С 1-4 алкильной группы; предпочтительно R1 выбирают из группы, включающей метильную, этильную, пропильную, изопропильную, бутильную, изобутильную, трет-бутильную, циклопропильную, циклобутильную, циклопентильную или циклогексильную группы, каждая из которых может быть необязательно замещена 1, 2 или 3 заместителями, независимо выбранными из фтора или С 1-4 алкильной группы; более предпочтительно R1 представляет собой метильную, этильную, пропильную, изопропильную,циклопентильную или циклогексильную группы, еще более предпочтительно R1 представляет собой метильную или этильную группу;R2, R3 и R4, каждый независимо, представляют собой группу, выбранную из С 1-6 алкильной или фенильной группы, где указанная C1-6 алкильная или фенильная группа необязательно замещены 1, 2 или 3 заместителями, независимо выбранными из фтора или C1-6 алкильной группы; предпочтительно R2, R3 и R4, каждый независимо, выбирают из группы, включающей метильную,этильную, пропильную, изопропильную, бутильную, изобутильную, трет-бутильную и фенильную группы, каждая из которых может быть необязательно замещена 1, 2 или 3 заместителями, каждый из которых независимо выбирают из фтора или С 1-4 алкильной группы; предпочтительно каждый из R2, R3 и R4 независимо выбирают из группы, включающей метильную, этильную, пропильную, изопропильную или трет-бутильную и фенильную группы, каждая из которых может быть необязательно замещена 1, 2 или 3 заместителями, каждый из которых независимо выбирают из фтора или С 1-2 алкильной группы, причем указанный способ включает следующие стадии: а) защита карбоксильной и кетоновой группы эстрона формулы (II) с получением соединения формулы (III), в которой Р 1 такой, как определено выше, и Р 2 представляет собой защитную группу, выбранную из R1CO-, R2-Si-R3R4,b) взаимодействие соединения формулы (III) в присутствии ацетата палладия или его производного,такого как хлорид палладия или трис-(дибензилиденацетон)дипалладий (Pd2(dba)3) с получением соединения формулы (IV), предпочтительно в присутствии атмосферы кислорода с) взаимодействие соединения, имеющего формулу (IV), с восстановителем с получением соединения, имеющего формулу (I); и при необходимости любую защитную группу, использованную в описанных выше реакциях, расщепляют непосредственно в ходе способа или после него; и если необходимо, соединение формулы (I) затем превращают в другое соединение с использованием общепринятых способов, подходящих для превращения функциональных групп,если необходимо, полученное данным способом соединение формулы (I) разделяют на стереоизомеры. В одном воплощении Р 1 представляет собой R1CO-; предпочтительно Р 1 представляет собой группу,выбранную из С 1-4 алкилкарбонильной или С 4-6 циклоалкилкарбонильной группы, каждая из которых может быть необязательно замещена 1, 2 или 3 заместителями, независимо выбранными из фтора или С 1-4 алкильной группы; более предпочтительно Р 1 представляет собой группу, выбранную из С 1-2 алкилкарбонильной или С 5-6 циклоалкилкарбонильной группы, каждая из которых может быть необязательно замещена 1, 2 или 3 заместителями, независимо выбранными из фтора или С 1-2 алкильной группы; например Р 1 выбирают из ацетильной или циклогексилкарбонильной группы, предпочтительно Р 1 представляет собой ацетильную группу. В одном воплощении Р 2 представляет собой R1CO-; предпочтительно Р 2 представляет собой группу,выбранную из С 1-4 алкилкарбонильной или С 4-6 циклоалкилкарбонильной группы, каждая из которых может быть необязательно замещена 1, 2 или 3 заместителями, независимо выбранными из фтора или С 1-4 алкильной группы; более предпочтительно Р 2 представляет собой группу, выбранную изC1-2 алкилкарбонильной или С 5-6 циклоалкилкарбонильной группы, каждая из которых может быть необязательно замещена 1, 2 или 3 заместителями, независимо выбранными из фтора или С 1-4 алкильной группы; например Р 2 выбирают из ацетильной или циклогексилкарбонильной группы, предпочтительно Р 2 представляет собой ацетильную группу. В одном воплощении Р 1 и Р 2, каждый независимо, представляют собой R1 СО-. В одном воплощении Р 1 представляет собой R2-Si-R3R4. Предпочтительно Р 1 выбирают из группы,включающей трет-бутилдиметилсилильную, дифенилметилсилильную, диметилфенилсилильную, триметилсилильную, триэтилсилильную и триизопропилсилильную группу, каждая из которых может быть необязательно замещена одним или несколькими заместителями, независимо выбранных из фтора илиC1-4 алкильной группы; более предпочтительно Р 1 представляет собой трет-бутилдиметилсилильную группу. В одном воплощении стадия (а) включает следующие стадии:(a1) защита гидроксильного соединения формулы (II) силилирующим агентом для получения соединения формулы (IIa), в которой Р 1 представляет собой R2-Si-R3R4(а 2) защита кетона соединения формулы (IIa) в присутствии ацилирующего агента для получения соединения формулы (III), в которой Р 2 представляет собой R1CO-. В одном воплощении Р 2 представляет собой R2-Si-R3R4; предпочтительно Р 2 выбирают из группы,включающей трет-бутилдиметилсилильную, дифенилметилсилильную, диметилфенилсилильную, триметилсилильную, триэтилсилильную и триизопропилсилильную группу, каждая из которых может быть необязательно замещена одним или несколькими заместителями, независимо выбранными из фтора или С 1-4 алкильной группы, более предпочтительно Р 2 представляет собой трет-бутилдиметилсилильную группу. В одном воплощении Р 1 и Р 2, каждый независимо, представляют собой R2-Si-R3R4. В одном воплощении Р 1 представляет собой R2-Si-R3R4; a P2 представляет собой R1CO-. Предпочтительно Р 1 выбирают из группы, включающей трет-бутилдиметилсилильную, дифенилметилсилильную,диметилфенилсилильную, триметилсилильную, триэтилсилильную или триизопропилсилильную группу,-5 023991 каждая из которых может быть необязательно замещена одним или несколькими заместителями, независимо выбранными из фтора или С 1-4 алкильной группы; более предпочтительно Р 1 представляет собой трет-бутилдиметилсилильную группу; и предпочтительно Р 2 представляет собой группу, выбранную из С 1-6 алкилкарбонильной или С 3-6 циклоалкилкарбонильной группы, каждая из которых может быть необязательно замещена 1, 2 или 3 заместителями, независимо выбранными из фтора или С 1-4 алкильной группы; предпочтительно Р 2 представляет собой группу, выбранную из С 1-4 алкилкарбонильной или С 5-6 циклоалкилкарбонильной группы; причем каждая группа может быть необязательно замещена 1, 2 или 3 заместителями, независимо выбранными из фтора или С 1-2 алкильной группы; более предпочтительно Р 2 представляет собой С 1-2 алкилкарбонильную или С 5-6 циклоалкилкарбонильную группу, например Р 2 представляет собой ацетильную или циклогексилкарбонильную группу, предпочтительно ацетильную группу. В одном воплощении силилирующий агент может быть выбран из группы, включающейC1-6 алкилсилилтрифлат,фенилсилилхлорид,фенилсилилтрифлат,C1-6 алкилсилилхлорид,С 1-6 алкилфенилсилилхлорид, C1-6 алкилфенилсилилтрифлат, каждый из которых может быть необязательно замещен одним или несколькими заместителями, которые независимо выбирают из фтора или С 1-4 алкильной группы. В одном воплощении способ получения 3-Р 1-эстра-1,3,5(10),15-тетраен-17-ола формулы (I) из эстрона формулы (II) может быть осуществлен в 3 стадии, как показано на схеме 1. Затем соединение формулы (I) может дополнительно вступать в реакцию с получением эстетрола. Схема 1 В соответствии со схемой 1 и гидроксильную, и кетонную группы эстрона формулы (II) защищают,предпочтительно в одну стадию, для получения соединения формулы (III). В одном воплощении, в котором Р 1 и Р 2, каждый независимо, представляют собой R1CO-, эстрон вступает в реакцию с ацилирующим агентом. Предпочтительно указанное ацилирующий агент представляет собой С 2-6 алкенил-С 1-6 алканоат или С 2-6 алкенил-С 3-6 циклоалканоат. Предпочтительно ацилирующий агент выбирают из группы, включающей С 2-6 алкенилпропаноат, С 2-6 алкенилбутаноат, С 2-6 алкенилпентаноат, С 2-6 алкенилгексаноат, С 2-6 алкенилциклопропаноат, С 2-6 алкенилциклобутаноат, С 2-6 алкенилциклопентаноат и С 2-6 алкенилциклогексаноат. Более предпочтительно ацилирующий агент выбирают из группы, включающей изопропенилацетат, изопропенилпропионат, изопропенилбутират, изопропенилизобутират,винилацетат,винилпропионат,проп-2-енил-циклогексанкарбоксилат,этенилциклопентанкарбоксилат и винилциклогексаноат. Более предпочтительно ацилирующий агент выбирают из группы, включающей изопропенилацетат, изопропенилпропионат, изопропенилбутират, изопропенилизобутират, винилацетат и винилпропионат. Ацилирование может быть осуществлено в присутствии кислоты, например в присутствии серной кислоты, или в присутствии С 6-10 арилсульфоновой кислоты, необязательно замещенной одним или несколькими заместителями, представляющими собой хлор. Неограничивающие примеры подходящих кислот включают пара-толуолсульфоновую кислоту и серную кислоту. Например, эстрон формулы (II) может вступать в реакцию с изопропенилацетатом в присутствии серной кислоты или пара-толуолсульфоновой кислоты с образованием эстра-1,3,5(10),16-тетраен-3,17-6 023991 диол 3,17-диацетата. Реакция может быть осуществлена с обратным холодильником, необязательно в атмосфере инертного газа, например в атмосфере азота. Продукт может использоваться на следующей стадии как таковой или может дополнительно очищаться способами, известными в данной области техники, например с помощью хроматографии, например на силикагеле, с подходящим элюентом, таким как метиленхлорид/гексан или этилацетат/гексан. В одном воплощении, в котором Р 1 и Р 2, каждый независимо, представляют собой R2-Si-R3R4, эстрон формулы (II) вступает в реакцию с силилирующим агентом. Силилирующий агент может быть выбран из группы,включающей С 1-6 алкилсилилтрифлат,фенилсилилтрифлат,С 1-6 алкилфенилсилилтрифлат, С 1-6 алкилсилилхлорид, С 1 фенилсилилхлорид, C1-6 алкилфенилсилилхлорид, каждый из которых может быть необязательно замещен одним или несколькими заместителями, которые независимо выбирают из фтора или С 1-4 алкильной группы. Например, защищенный силилиловый эфир эстрона можно получать в реакции с силилирующим агентом, таким как трет-бутилдиметилсилилтрифлат, дифенилметилсилилтрифлат, диметилфенилсилилтрифлат, триметилсилилтрифлат, триэтилсилилтрифлат или триизопропилсилилтрифлат. Реакция может быть осуществлена в присутствии подходящего основания, такого как имидазол, 2,6-лутидин, коллидин,триэтиламин или 1,8-диазабицикло[5,4,0]ундек-7-ен (DBU). Реакция может быть осуществлена при комнатной температуре или с обратным холодильником. Реакция может быть осуществлена в присутствии подходящего растворителя, такого как дихлорметан, толуол или диметилформамид или их смеси. Образование защищенного силилилового эфира эстрона также может быть осуществлено в реакции с силилирующим агентом, таким как трет-бутилдиметилсилилхлорид, дифенилметилсилилхлорид, диметилфенилсилилхлорид, триметилсилилхлорид, триэтилсилилхлорид или триизопропилсилилхлорид в присутствии подходящего основания, такого как диизопропиламид лития (LDA), трет-бутил лития, бис(триметилсилил)амид натрия или калия (NaHMDS, KHMDS) или тетраметилпиперидин литий. Стадия (b) настоящего способа включает взаимодействие соединения формулы (III) в присутствии ацетата палладия или его производного, такого как хлорид палладия или трис(дибензилиденацетон)дипалладия (Pd2dba)3), предпочтительно в присутствии ацетата палладия или хлорида палладия, более предпочтительно ацетата палладия, для получения соединения, имеющего формулу (IV). В одном воплощении указанный ацетат палладия или его производное могут присутствовать в стехиометрических количествах или субстехиометрических каталитических количествах. Например, реакция стадии (b) может быть проведена с использованием стехиометрических количеств ацетата палладия, хлорида палладия или трис-(дибензилиденацетон)дипалладия, предпочтительно стехиометрических количеств ацетата палладия, предпочтительно в подходящем растворителе таком как ацетонитрил, бензонитрил или диметилсульфоксид, предпочтительно бензонитрил. Данная реакция может быть осуществлена при комнатной температуре. В другом примере указанная стадия (b) может быть осуществлена с применением субстехиометрических каталитических количеств ацетата палладия,хлорида палладия или трис(дибензилиденацетон)дипалладия, предпочтительно субстехиометрических каталитических количеств ацетата палладия, в присутствии C1-6 алкиленкарбоната, такого как аллилкарбонат, и в присутствии оловоорганического соединения в качестве катализатора. Предпочтительно оловоорганическое соединение представляет собой три-бутилолово-метоксид. Предпочтительно C1-6 алкиленкарбонат представляет собой аллилметилкарбонат. Реакция может быть проведена в условиях нагревания с обратным холодильником, необязательно в атмосфере инертного газа, например в атмосфере азота или аргона. В другом примере указанная стадия (b) может быть осуществлена с применением субстехиометрических каталитических количествах ацетата палладия в атмосфере кислорода. В другом примере указанная стадия (b) может быть осуществлена с применением субстехиометрических каталитических количеств хлорида палладия в атмосфере кислорода. В другом примере указанная стадия (b) может быть осуществлена с применением субстехиометрических каталитических количеств трис(дибензилиденацетон)дипалладия в атмосфере кислорода. Предпочтительно указанная атмосфера кислорода представляет собой чистый молекулярный кислород или атмосферный кислород (воздух или циркулирующий воздух или возобновляемый воздух). Предпочтительно на стадии (b) количество ацетата палладия, хлорида палладия или трис(дибензилиденацетон)дипалладия не превышает 0,50 экв., предпочтительно не превышает 0,40 экв., более предпочтительно не превышает 0,30 экв., еще более предпочтительно не превышает 0,2 экв., еще более предпочтительно не превышает 0,10 экв., еще более предпочтительно не превышает 0,05 экв., еще более предпочтительно не превышает 0,03 экв. на 1 экв. соединения, имеющего формулу (III). В предпочтительном воплощении стадию (b) осуществляют не более чем с 0,10 экв. ацетата палладия, предпочтительно не более чем с 0,05 экв., предпочтительно не более чем с 0,03 экв. на 1 экв. соединения формулы (III), в присутствии чистого молекулярного кислорода или атмосферного кислорода. Следующая стадия в описываемом способе включает восстановление соединения формулы (IV) с восстановителем для получения соединения формулы (I). Предпочтительно указанный восстановитель представляет собой соединение гидрида металла. Например, соединение гидрида металла может быть выбрано из группы, включающей LiAlH4, NaBH4, NaBH(OAc)3, ZnBH4 и NaBH4/CeCl3. Предпочтительно указанный восстановитель представляет собой NaBH4/CeCl3. Например, указанное восстановление может быть осуществлено в подходящем растворителе или в их смеси, например в тетрагидрофуране или в смеси метанола и тетрагидрофурана. Реакция может быть осуществлена при пониженных температурах, таких как ниже 15 С, например ниже 10 С. В одном воплощении соединение формулы (IV) не выделяют, а непосредственно восстанавливают до спирта с использованием указанного восстановителя. В этом воплощении стадии (b) и (с) осуществляют в одном сосуде. Данная проводимая в одном сосуде двухстадийная процедура представляет собой самый короткий химический путь среди путей, описанных для получения соединения формулы (I). Данный способ имеет то преимущество, что функциональная 17-гидроксильная группа соединения формулы (I) также может быть защищена защитной группой, такой как ацильная группа, более предпочтительно ацетильная группа, которая может быть удалена одновременно с защитной группой в 3-м положении, такой как 3-ацетильная группа, предпочтительно 3-ацетоксильная группа, что позволяет провести никогда ранее не описанный синтез эстетрола в 6 стадий. Функциональная 17-гидроксильная группа соединения формулы (I) также может быть защищена силильной группой, которая может быть удалена одновременно с защитной силильной группой в 3-м положении, что позволяет провести никогда ранее не описанный синтез эстетрола в 6 стадии. В соответствии с другим воплощением стадия (а) может быть проведена в две стадии и включает следующие стадии:(a1) защита гидроксильного соединения формулы (II) с использованием силилирующего агента для получения соединения формулы (IIa), в которой Р 1 R2-Si-R3R4(а 2) превращение кетона формулы (IIa) в его енольный эфир в присутствии ацилирующего агента с получением соединения формулы (III). В соответствии с данным воплощением способ получения 3-Р 1-эстра-1,3,5(10),15-тетраен-17-ола формулы (I) из эстрона формулы (II) может быть осуществлен, как показано на схеме 2. Схема 2 В данном воплощении, проиллюстрированном на схеме 2, в котором Р 1 независимо представляет собой R2-Si-R3R4 и Р 2 представляет собой CO-R1, эстрон формулы (II) вступает в реакцию с силилирую-8 023991 щим агентом для получения соединения формулы (IIa). Силилирующий агент может быть выбран из группы, включающей С 1-6 алкилсилилхлорид, фенилсилилхлорид, C1-6 алкилфенилсилилхлорид; и каждая из перечисленных групп может быть необязательно замещена одним или несколькими заместителями,независимо выбранными из фтора или С 1-4 алкильной группы. Например, образование защищенного силилового эфира эстрона может быть осуществлено в реакции с силилирующим агентом, таким как трет-бутил-диметилсилилхлорид, дифенилметилсилилхлорид,диметилфенилсилилхлорид, триметилсилилхлорид, триэтилсилилхлорид или триизопропилсилилхлорид. Эта реакция может быть проведена в присутствии основания, такого как имидазол, 2,6-лутидин, коллидин, триэтиламин или 1,8-диазабицикло[5,4,0]ундек-7-ен (DBU). Следующая стадия включает реакцию кетона формулы (IIa) в присутствии ацилирующего агента с получением соединения формулы (II), в котором Р 2 представляет собой ацильную группу (соединение формулы (IIIa. Подходящие ацилирующие агенты и условия являются теми же, что описаны выше в настоящем документе. Следующая стадия в способе по схеме 2 включает взаимодействие соединения формулы (IIIa) в присутствии ацетата палладия или его производного, такого как хлорид палладия или трис(дибензилиденацетон)дипалладия (Pd2(dba)3), с получением соединения формулы (IV), в котором Р 1 представляет собой R2-Si-R3R4 (соединение формулы (IVa. Данная реакция может быть проведена, как описано выше в настоящем документе. Следующая стадия в описываемом способе включает восстановление соединения формулы (IVa) с восстановителем для получения соединения формулы (I) в котором Р 1 представляет собой R2-Si-R3R4(соединение формулы (Ia. Данная реакция может быть проведена, как описано выше в настоящем документе. Способы по настоящему изобретению имеют то преимущество, что защитная группа может быть удалена in situ в конце синтеза традиционными способами, такими как удаление силильной защитной группы с помощью ионов фтора, например фторидом тетра-н-бутиламмония; как описано в работе Coppola, G.M. Org Prep Proced, 2007, 39 (2), 199-292, включенной в настоящий документ посредством ссылки; или как удаление силильной защитной группы с помощью 2,3-дихлор-5,6-дициано-n-бензохинона,как описано в работе Tanemura, K. J. Chem Soc., Perkin Trans 1, 1992 (22), 2997-2998; включенной в настоящий документ посредством ссылки. Описываемый способ имеет то преимущество, что 3-Р 1-окси-эстра-1,3,5(10),15-тетраен-17-ол формулы (I), и в дальнейшем эстетрол, могут быть получены из эстрона за меньшее число стадий по сравнению со способами из известного уровня техники, что более удобно с точки зрения рентабельности синтеза, осуществляемого в промышленных масштабах. Настоящее изобретение также охватывает способ получения эстетрола, включающий получение соединения формулы (I) с использованием способа по изобретению и дополнительное взаимодействие соединения формулы (I) с получением эстетрола. Настоящее изобретение также охватывает применение эстетрола, непосредственно полученного способом по изобретению, для производства фармацевтической композиции, предпочтительно для применения в способе, выбранном из способа осуществления заместительной гормональной терапии, способа лечения вагинальной сухости, способа контрацепции, способа повышения либидо, способа лечения кожи, способа стимуляции заживления ран и способа лечения или предупреждения нарушения, выбранного из группы, состоящей из аутоиммунных заболеваний, опухолей молочной железы и колоректальных опухолей. Настоящее изобретение проиллюстрировано следующими примерами, но не ограничивается ими. Примеры Пример 1. Получение соединения формулы (I), в которой Р 1 представляет собой ацетильную группу, в соответствии с одним из воплощений настоящего изобретения. Стадия 1. Эстра-1,3,5(10),16-тетраен-3,17-диол 3,17-диацетат. 100 г 3-гидрокси-эстра-1,3,5(10)-триен-17-она (0,370 моль) приливали к 500 мл изопропенилацетата и 10 г пара-толуол-сульфоновой кислоты. Смесь нагревали с обратным холодильником. Ацетон и изопропенилацетат непрерывно отгоняли до тех пор, пока температура не достигала 98 С. Затем смесь охлаждали до 0 С и добавляли K2CO3. После 1 ч инкубации при 0 С смесь фильтровали, полученный раствор концентрировали и добавляли диизопропиловый эфир. Осадок собирали фильтрованием и высушивали. Он весил 111,5 г (выход: 85%). 1(s,3H,CH3 ацетат), 2,30-2,50 (m, 2H), 5,54 (широкий s, 1H, 6,80 (широкий s, 1 Н, Н 4), 6,82 (dd, 1H, Н 2),7,27 (d, 1H, H1); т.пл. =148,3 С. Стадия 2. 3-Ацетокси-эстра-1,3,5(10),15-тетраен-17-он. К раствору 115,5 г (0,315 моль) эстра-1,3,5(10)-тетраен-3,17-диол 3,17-диацетата в 1500 мл ацетонитрила добавляли 30,4 г (0,095 моль) метоксида три-н-бутилолова и 11,2 г (0,05 моль) ацетата палладия(II) и 20 мл аллилметилкарбоната. Смесь нагревали с обратным холодильником в течение 2 ч, затем охлаждали до комнатной температуры и фильтровали через слой силикагеля. Реакционную смесь затем разбавляли водой и экстрагировали этилацетатом. После концентрирования до одной трети первоначального объема медленно добавляли 1000 мл диизопропилового эфира. Осадок собирали фильтрованием,промывали диизопропиловым эфиром и использовали на следующей стадии без дополнительной очистки. 1(m, 2 Н), 6,00-6,15 (m, 1H, Н 15), 6,80 (широкий s, 1H, Н 4), 6,85 (dd, 1H, Н 2), 7,29 (d, 1H, H1), 7,60 (d, 1 Н,Н 16); т.пл.: 177,7 С. Стадия 3. 3-Ацетокси-эстра-1,3,5(10),15-тетраен-17-ол. Собранный материал растворяли в 300 мл тетрагидрофурана (THF) и добавляли раствор церия хлорида гептагидрата (123 г, 0,33 моль) в метаноле (300 мл). Смесь охлаждали до 0 С и порциями добавляли натрия борогидрид (17,8 г, 0,47 моль, 1,5 экв.), поддерживая температуру ниже 5 С. Завершив данное добавление, смесь перемешивали в течение 1 ч, затем реакцию прерывали добавлением раствора 2 н. HCl(100 мл). Раствор частично выпаривали in situ и добавляли воду (4 л). Осадок собирали фильтрованием и высушивали. После кристаллизации из смеси этанол/диизопропиловый эфир выделяли 3-ацетокси-эстра 1,3,5(10),15-тетраен-17-ол с 75%-ным выходом. 1(m, 2 Н), 4,40 (широкий s, 1 Н, H17), 5,75 (широкий s, 1H), 6,04 (широкий s, 1H), 6,80 (широкий s, 1H, Н 4),6,84 (широкий s, 1 Н, Н 2), 7,29 (d, 1 Н, H1); т.пл.: 120,7 С. Пример 2. Получение соединения формулы (I), в которой Р 1 представляет собой третбутилдиметилсилильную группу, в соответствии с одним из воплощений настоящего изобретения. Стадия 1. 3,17-Ди-трет-бутилдиметилсилокси-эстра-1,3,5(10)-16-тетраен-17-ол. К раствору эстрона (50 г, 0,185 моль) и 2,6-лутидина (62 г, 0,58 моль) в 400 мл дихлорметана добавляли по каплям трет-бутил-диметилсилил-трифлат (102,6 г, 0,39 моль). Раствор перемешивали при комнатной температуре в течение 6 ч. Добавляли воду (300 мл) и органический слой промывали разбавленным раствором карбоната натрия. Раствор в дихлорметане частично выпаривали и добавляли этилацетат. К данному раствору добавляли диизопропиловый эфир. Смесь перемешивали в течение 2 ч при 0 С. Осадок собирали фильтрованием и высушивали. Получали 83 г указанного в подзаголовке соединения(s, 9 Н, (CH3)3-C-Si-), 1,20-2,40 (m, 11H), 2,75-2,95 (m, 2H), 4,48 (m, 1H, H16), 6,58 (широкий s, 1H, H4),6,62 (dd, 1H, H2), 7,12 (d, 1H, H1); т.пл.: 97,6 С. Стадия 2. 3-трет-Бутилдиметилсилокси-эстра-1,3,5(10)-15-тетраен-17-он. К раствору 3,17-ди-трет-бутилдиметилсилокси-эстра-1,3,5(10)-16-тетраен-17-ола 83 г (0,166 моль) в 400 мл ацетонитрила добавляли 3,8 г (0,017 моль) Pd(OAc)2 в атмосфере кислорода. Смесь перемешивали при 40 С в течение 12 ч, а затем фильтровали через слой целита. Добавляли разбавленный раствор карбоната натрия и смесь экстрагировали этилацетатом. После концентрирования добавляли диизопропиловый эфир и смесь перемешивали при 0 С в течение 1 ч. Продукт (54,7 г, выход 86%) собирали фильтрованием и использовали на следующей стадии без дополнительной очистки. 1H NMR (CDCl3)0,20 (s, 6 Н, (CH3)2-Si-), 1,00 (s, 9 Н, (CH3)3-C-Si-), 1,13 (s, 3H, CH3 при С-18), 1,202,70 (m, 11 Н), 2,80-3,00 (m, 2 Н), 6,10 (dd, 1 Н, Н 15), 6,58 (широкий s, 1H, Н 4), 6,62 (dd, 1H, Н 2), 7,11 (d,1H, Н 1), 7,63 (dd, 1 Н, Н 16); т.пл.: 165 С. Стадия 3. 3-трет-Бутилдиметилсилокси-эстра-1,3,5(10)-15-тетраен-17-ол. Собранный материал (54,7 г, 0,143 моль) растворяли в 300 мл THF и добавляли раствор гептагидрата хлорида церия (53,3 г, 0,143 моль) в метаноле (300 мл). Смесь охлаждали до 0 С, добавляли порциями натрия борогидрид (8,12 г, 0,213 моль, 1,5 экв.), поддерживая температуру ниже 9 С. После окончания добавления смесь инкубировали в течение 1 ч, а затем реакцию останавливали добавлением раствора 2 н.HCl (100 мл). Раствор частично выпаривали in situ, и добавляли воду (4 л). Осадок собирали фильтрованием и высушивали. После кристаллизации из смеси этанол/диизопропиловый эфир продукт собирали фильтрованием и высушивали. Он весил 46,6 г (выход 85%). 1H NMR (CDCl3)0,20 (s, 6H, (CH3)2-Si-), 0,89 (s, 3 Н, СН 3 при С-18), 1,00 (s, 9H, (CH3)3-C-Si-), 1,202,40 (m, 10 Н), 2,75-2,95 (m, 2H), 4,40 (широкий s, 1H, Н 17), 5,65-5,75 (m, 1H), 5,95-6,10 (m, 1 Н), 6,57 (широкий s, 1 Н, Н 4), 6,60 (dd, 1H, Н 2), 7,13 (d, 1 Н, H1); т.пл.: 107,5 С. Пример 3. Получение соединения формулы (I), в которой Р 1 представляет собой третбутилдиметилсилил, в соответствии с одним из воплощений настоящего изобретения. Стадия 1. 3-трет-Бутилдиметилсилокси-эстра-1,3,5(10)-триен-17-он. К раствору эстрона (100 г, 0,37 моль) в 400 мл дихлорметана добавляли имидазол (50,36 г, 0,74 моль) и трет-бутил-диметилсилилхлорид (61,3 г, 0,41 моль). Раствор перемешивали при комнатной температуре в течение 24 ч. Затем добавляли воду (200 мл). Органический слой частично выпаривали и до- 10023991 бавляли диизопропиловый эфир. Образовавшийся белый твердый осадок собирали фильтрованием и высушивали. Он весил 135,2 г, выход 95%, т.пл. 172 С. 1H NMR (CDCl3)0,20 (s, 6H, (CH3)2-Si-), 0,90 (s, 3 Н, СН 3 при С-18), 1,00 (s, 9H, (CH3)3-C-Si-), 1,202,60 (m, 13 Н), 2,75-2,95 (m, 2 Н), 5,65-5,75 (m, 1 Н), 6,58 (широкий s, 1H, H4), 6,63 (dd, 1H, H2), 7,12 (d, 1H,H1); т.пл.: 171,6 С. Стадия 2. 3-трет-Бутилдиметилсилокси-эстра-1,3,5(10)-16-тетраен-17-ацетат. 3-трет-Бутилдиметилсилокси-эстра-1,3,5(10)-триен-17-он 135 г (0,351 моль) приливали к 600 мл изопропенилацетата и 12 г пара-толуол-сульфоновой кислоты. Смесь нагревали с обратным холодильником. Ацетон и изопропенилацетат непрерывно отгоняли до тех пор, пока внутренняя температура не достигала 98 С. Затем смесь охлаждали до 0 С и добавляли карбонат калия. После 1 ч инкубации при 0 С смесь фильтровали. Полученный раствор частично концентрировали и добавляли диизопропиловый эфир. Осадок собирали фильтрованием и кристаллизовали из смеси этилацетата и гептана. Продукт собирали фильтрованием и высушивали. Он весил 119,5 г (выход 80%). Стадия 3. 3-трет-Бутилдиметилсилокси-эстра-1,3,5(10)-15-тетраен-17-он. К раствору 3-трет-бутилдиметилсилокси-эстра-1,3,5(10)-16-тетраен-17-ацетата 119,5 г (0,280 моль) в ацетонитриле (1500 мл) добавляли 27,2 г (0,085 моль) метоксида трибутилолова, 11,2 г (0,05 моль) ацетата палладия и 64 мл (0,560 моль) аллилметилкарбоната. Смесь нагревали с обратным холодильником в течение 2 ч, затем охлаждали до комнатной температуры и фильтровали через слой силикагеля. Смесь разбавляли водой и экстрагировали этилацетатом. После концентрирования до одной трети первоначального объема добавляли диизопропиловый эфир, и раствор охлаждали при 0 С в течение 1 ч. Продукт собирали фильтрованием. Он весил 91 г (выход 85%) и его использовали на следующей стадии без дополнительной очистки. 1H NMR (CDCl3)0,20 (s, 6 Н, (CH3)2-Si-), 1,00 (s, 9 Н, (CH3)3-C-Si-), 1,13 (s, 3H, CH3 при С-18), 1,202,70 (m, 11 Н), 2,80-3,00 (m, 2 Н), 6,10 (dd, 1 Н, Н 15), 6,58 (широкий s, 1H, Н 4), 6,62 (dd, 1 Н, Н 2), 7,11 (d,1 Н, Н 1), 7,63 (dd, 1 Н, Н 16); т.пл.: 165 С. Стадия 4. 3-трет-Бутилдиметилсилокси-эстра-1,3,5(10)-15-тетраен-17-ол. Стадию восстановления осуществляли, как описано на стадии 3 примера 2: собранный материал растворяли в THF и добавляли раствор гептагидрата хлорида церия (1 экв.) в метаноле. Смесь охлаждали до 0 С, добавляли порциями борогидрид натрия (1,5 экв.), поддерживая температуру ниже 9 С. После окончания добавления смесь инкубировали в течение 1 ч, после чего реакцию останавливали добавлением раствора 2 н. HCl. Раствор частично выпаривали in situ и добавляли воду. Осадок собирали фильтрованием и высушивали. После кристаллизации из смеси этанол/диизопропиловый эфир продукт собирали фильтрованием и высушивали. 1H NMR (CDCl3)0,20 (s, 6H, (CH3)2-Si-), 0,89 (s, 3 Н, СН 3 при С-18), 1,00 (s, 9H, (СН 3)3-C-Si-), 1,202,40 (m, 10 Н), 2,75-2,95 (m, 2 Н), 4,40 (широкий s, 1H, Н 17), 5,65-5,75 (m, 1 Н), 5,95-6,10 (m, 1 Н), 6,57 (широкий s, 1 Н, Н 4), 6,60 (dd, 1 Н, Н 2), 7,13 (d, 1H, H1); т.пл.: 107,5 С. Пример 4. Стадию 2 примера 1 повторяли с использованием других реагентов и реакционных условий, как указано в табл. 1. Получали 3-ацетокси-эстра-1,3,5(10),15-тетраен-17-он. Выходы и скорости превращения приведены в табл. 1. Таблица 1DMSO: диметилсульфоксид; ND: не определялось. Пример 5. Стадию 2 примера 2 повторяли с использованием других реагентов и реакционных условий, как указано в табл. 2. Получали 3-трет-бутилдиметилсилокси-эстра-1,3,5(10)-15-тетраен-17-он. Выходы и скорости превращения приведены в табл. 2.DMSO: диметилсульфоксид; ND: не определялось. Следует понимать, что хотя для описанных воплощений настоящего изобретения были приведены предпочтительные воплощения и/или материалы, тем не менее, можно осуществить различные модификации или изменения без отступления от объема и сути настоящего изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения соединения формулы (I) включающий следующие стадии, на которых: а) соединение формулы (II) вводят в реакцию с ацилирующим или с силилирующим агентом с получением соединения формулы (III), в которой Р 1 и Р 2, каждый независимо, представляют собой защитную группу, выбранную из R2-Si-R3R4 или R1CO-, где R1 представляет собой группу, выбранную из С 1-6 алкильной или С 3-6 циклоалкильной группы, каждая из которых может быть необязательно замещена одним или несколькими заместителями, независимо выбранными из фтора или С 1-4 алкильной группы; R2,R3 и R4, каждый независимо, представляют собой группу, выбранную из С 1-6 алкильной или фенильной группы, каждая из которых может быть необязательно замещена одним или несколькими заместителями,независимо выбранными из фтора или С 1-4 алкильной группыb) соединение формулы (III) вводят в реакцию в присутствии ацетата палладия или его производного с получением соединения формулы (IV) с) соединение формулы (IV) вводят в реакцию с восстановителем с получением соединения формулы (I). 2. Способ по п.1, в котором Р 1 представляет собой R1CO-. 3. Способ по п.1, в котором Р 1 представляет собой R2-Si-R3R4. 4. Способ по п.3, в котором Р 2 представляет собой R2-Si-R3R4. 5. Способ по любому из пп.1-3, в котором Р 2 представляет собой R1CO-. 6. Способ по п.5, в котором стадия (а) включает следующие стадии:(a1) гидроксильное соединение формулы (II) защищают силилирующим агентом с получением соединения формулы (IIa), в которой Р 1 имеет то же значение, что и в п.3(а 2) кетон формулы (IIa) защищают в присутствии ацилирующего агента с получением соединения формулы (III). 7. Способ по любому из пп.1-3, 5 и 6, в котором ацилирующий агент представляет собой С 2-6 алкенил-С 1-6 алканоат или С 2-6 алкенил-С 3-6 циклоалканоат. 8. Способ по любому из пп.1, 3-7, в котором силилирующий агент выбирают из группы, включающей С 1-6 алкилсилилхлорид,C1-6 алкилсилилтрифлат,фенилсилилхлорид,фенилсилилтрифлат,С 1-6 алкилфенилсилилхлорид, C1-6 алкилфенилсилилтрифлат, каждый из которых может быть необязательно замещен одним или несколькими заместителями, которые независимо выбирают из фтора или С 1-4 алкильной группы. 9. Способ по любому из пп.1-8, в котором стадию (b) осуществляют в присутствииC1-6 алкиленкарбоната и оловоорганического соединения. 10. Способ по любому из пп.1-9, в котором указанный ацетат палладия присутствует в стехиометрическом количестве. 11. Способ по любому из пп.1-9, в котором указанную реакцию осуществляют с ацетатом палладия,присутствующим в каталитическом или субстехиометрическом количестве, и в котором реакцию предпочтительно проводят в атмосфере кислорода. 12. Способ по любому из пп.1-11, в котором восстановитель на стадии (с) выбирают из группы соединений типа гидридов металлов. 13. Способ по п.12, в котором соединение типа гидридов металлов выбирают из группы, включающей NaBH4/CeCl3, LiAlH4, NaBH4, NaBH(OAc)3 и ZnBH4. 14. Способ получения эстетрола, включающий стадии, на которых а) соединение формулы (I) получают способом по любому из пп.1-13 и b) соединение формулы (I) затем вводят в реакцию или реакции для получения эстетрола.
МПК / Метки
МПК: C07J 51/00, A61P 5/30, C07J 13/00, C07J 1/00, A61K 31/565
Метки: способ, получения, эстетрола, интермедиатов
Код ссылки
<a href="https://eas.patents.su/14-23991-sposob-polucheniya-intermediatov-estetrola.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения интермедиатов эстетрола</a>
Предыдущий патент: Разветвленные производные 3-фенилпропионовой кислоты и их применение
Следующий патент: Трехосная тележка для рельсового транспортного средства
Случайный патент: Приводное устройство и способ эксплуатации приводного устройства для рабочей машины с двумя двигателями внутреннего сгорания












