Агонисты gpr119
Номер патента: 20540
Опубликовано: 28.11.2014
Авторы: Лю Бинь, Буэно Мелендо Ана Белен, Такеути Кумико, Барретт Дэвид Джин, Франсискович Джеффри Бернард
Формула / Реферат
1. Соединение формулы
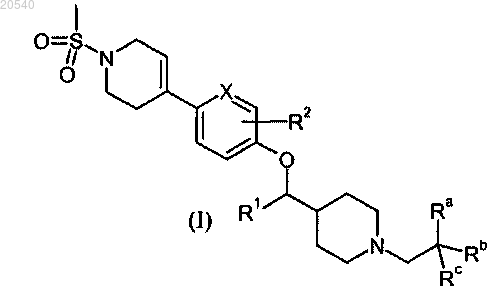
где X выбран из N и CH;
Ra выбран из F и CF3;
Rb и Rc независимо выбраны из F и метила или объединены с образованием С3-5-циклоалкильного кольца;
R1 выбран из H и метила;
R2 выбран из H и F,
или его фармацевтически приемлемая соль.
2. Соединение по п.1 или его фармацевтически приемлемая соль, где Rb и Rc независимо выбраны из F и метила или объединены с образованием C3-циклоалкила.
3. Соединение по любому из пп.1 или 2 или его фармацевтически приемлемая соль, где Rb и Rc представляют собой метил или объединены с образованием C3-циклоалкила.
4. Соединение по любому из пп.1-3 или его фармацевтически приемлемая соль, где Ra представляет собой CF3.
5. Соединение по любому из пп.1-4 или его фармацевтически приемлемая соль, где R2 представляет собой H.
6. Соединение по п.1 или его фармацевтически приемлемая соль, выбранное из 5-[1-(2-фтор-2-метилпропил)пиперидин-4-илметокси]-1'-метансульфонил-1',2',3',6'-тетрагидро[2,4']бипиридинила и 1-метансульфонил-4-{4-[1-(1-трифторметилциклопропилметил)пиперидин-4-илметокси]фенил}-1,2,3,6-тетрагидропиридина.
7. Фармацевтическая композиция, содержащая соединение по любому из пп.1-6 или его фармацевтически приемлемую соль и фармацевтически приемлемый разбавитель или носитель.
8. Фармацевтическая композиция по п.7, дополнительно содержащая метформин или ингибитор дипептидилпептидазы IV (DPPIV).
9. Фармацевтическая композиция по п.8, где ингибитор DPPIV представляет собой ситаглиптин.
10. Применение соединения по любому из пп.1-6 или его фармацевтически приемлемой соли в терапии для лечения диабета или ожирения.
11. Применение по п.10 для лечения диабета II типа.
Текст
Барретт Дэвид Джин (US),Буэно Мелендо Ана Белен (ES),Франсискович Джеффри Бернард, Лю Бинь, Такеути Кумико (US) Медведев В.Н. (RU) и фармацевтические композиции для лечения диабета и ожирения.(71)(73) Заявитель и патентовладелец: ЭЛИ ЛИЛЛИ ЭНД КОМПАНИ (US)GPR119 представляет собой рецептор, сопряженный с G-белком, локализованный в основном в тканях поджелудочной железы (-клетках) и кишечника (энтероэндокринных клетках) у людей; указанный рецептор был исследован и описан под различными названиями, включая SNORF25, RUP3, GPCR2,19AJ, OSGPR116 и глюкозозависимый инсулинотропный рецептор. Фармакология и терапевтический потенциал GPR119 обсуждались в недавнем обзоре (Br. J. Pharmacol. 2008, 153, S76-S81), где GPR119 описан в качестве интересной мишени для лечения диабета и ожирения. Описан ряд синтетических агонистов GPR119 для лечения диабета и ожирения, например агонисты,предложенные в WO 09/038974. По-прежнему существует потребность в альтернативных агонистахGPR119 в качестве терапевтических агентов против диабета и ожирения. Пероральное введение, как правило, является предпочтительным способом введения для терапевтических агентов против диабета и ожирения. Соединения, проявляющие хорошую пероральную биодоступность, должны обладать достаточной растворимостью в воде для обеспечения всасывания и достаточной метаболической стабильностью для минимизации пресистемного метаболизма в печени. Было обнаружено, что соединения формулы (I) являются агонистами GPR119 in vitro. Было показано, что конкретные соединения согласно настоящему изобретению стимулируют секрецию гастроингибиторного пептида (GIP) in vivo. Конкретные соединения согласно настоящему изобретению проявляют более высокую активность по сравнению с существующими агонистами. Конкретные соединения согласно настоящему изобретению обладают хорошей пероральной биодоступностью. Настоящее изобретение относится к соединениям формулы (I), которые являются агонистами сопряженного с G-белком рецептора GPR119, фармацевтическим композициям, содержащим указанные соединения в качестве активного ингредиента, и их применению для лечения или предотвращения диабета или ожирения, в частности диабета II типа. В настоящем изобретении предложено соединение формулыRb и Rc независимо выбраны из F и метила или объединены с образованием C3-5-циклоалкильного кольца;R2 выбран из H и F,или его фармацевтически приемлемая соль. В настоящем изобретении предложена фармацевтическая композиция, содержащая соединение формулы (I) или его фармацевтически приемлемую соль и фармацевтически приемлемый разбавитель или носитель. В настоящем изобретении предложено соединение формулы (I) или его фармацевтически приемлемая соль для применения в терапии. В настоящем изобретении также предложено соединение формулы(I) или его фармацевтически приемлемая соль для применения для лечения диабета и ожирения. Согласно другому аспекту настоящего изобретения предложено применение соединения формулы (I) или его фармацевтически приемлемой соли для получения лекарственного средства для лечения диабета и ожирения. В настоящем изобретении также предложен способ лечения диабета и ожирения, который включает введение эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли человеку или животному, нуждающемуся в этом. Предпочтительным является применение соединений согласно настоящему изобретению для лечения диабета или ожирения, в частности диабета II типа. Предпочтительными представителями соединений формулы (I) являются соединения формулы или их фармацевтически приемлемые соли, где X, Ra, Rb и Rc определены выше в настоящем описании. Предпочтительными представителями соединений формулы (I) являются соединения формулы или их фармацевтически приемлемые соли, где X, Ra, Rb и Rc определены выше в настоящем описании. Конкретные группы соединений формул (I), (II) или (III) являются предпочтительными. В следующей пронумерованной выборке описаны такие предпочтительные группы: 1) X представляет собой N; 2) X представляет собой CH; 3) R2 представляет собой Н; 4) Ra представляет собой F; 5) Ra представляет собой CF3; 6) Rb и Rc независимо выбраны из F и метила или объединены с образованием C3-циклоалкила; 7) Rb и Rc представляют собой метил или объединены с образованием C3-циклоалкила; 8) X представляет собой N, a Rb и Rc представляют собой метил или объединены с образованием C3 циклоалкила; 9) X представляет собой CH, a Rb и Rc представляют собой метил или объединены с образованиемC3-циклоалкила; 10) Rb и Rc представляют собой метил, a Ra представляет собой F; 11) Rb и Rc объединены с образованием C3-циклоалкила, a Ra представляет собой CF3. Фармацевтически приемлемые соли каждого из соединений согласно настоящему изобретению находятся в объеме настоящей заявки. Предпочтительные соединения согласно настоящему изобретению включают 5-[1-(2-фтор-2 метилпропил)пиперидин-4-илметокси]-1'-метансульфонил-1',2',3',6'-тетрагидро[2,4']бипиридинил и 1 метансульфонил-4-4-[1-(1-трифторметилциклопропилметил)пиперидин-4-илметокси]фенил-1,2,3,6 тетрагидропиридин. Следует понимать, что если в настоящем описании группа охарактеризована как "определенная в настоящем описании" или "указанная в настоящем описании", то указанная группа включает приведенное первым и наиболее широкое определение, а также каждое из конкретных определений указанной группы. Используемые выше и далее в настоящем описании следующие термины, если не указано иное,имеют следующие значения. В настоящем описании под термином "C3-C5 циклоалкил" понимают циклопропил, циклобутил и циклопентил. Предпочтительные C3-C5 циклоалкильные группы включают циклопропил и циклобутил; другой предпочтительной группой является циклопропил. Используемые в настоящем описании термины "изомер 1" и "изомер 2" относятся к конкретным энантиомерам конечных соединений или промежуточных веществ, при этом "изомер 1" относится к первому соединению, элюируемому в ходе описанного хроматографического процесса, а "изомер 2" - ко второму. Если термины "изомер 1" или "изомер 2" впервые употребляют по отношению к промежуточному веществу, то указанный термин распространяется и на конечное соединение. Используемый в настоящем описании термин "фармацевтически приемлемые соли" относится к солям соединений согласно настоящему изобретению, которые являются, по существу, нетоксичными для живых организмов. Указанные соли и общепринятые способы их получения хорошо известны в данной области техники; см., например, П. Шталь с соавт. (P. Stahl, et al.), Handbook of Pharmaceutical Salts: Properties Selection and Use (VCHA/Wiley-VCH, 2002) и J. Pharm. Sci. 66, 2-19 (1977). Предпочтительные фармацевтически приемлемые соли включают гидрохлорид, мезилат и фумарат; более предпочтительными солями являются гидрохлорид и мезилат. Соединения согласно настоящему изобретению предпочтительно входят в состав фармацевтических композиций, вводимых различными способами. Более предпочтительно указанные композиции предназначены для перорального введения. Такие фармацевтические композиции и способы их получения известны в данной области техники; см., например, Remington: The Science and Practice of Pharmacy(под ред. А. Дженнаро с соавт. (A. Gennaro, et al.), 19th ed., Mack Publishing Co., 1995). Предпочтительные фармацевтические композиции содержат соединение согласно настоящему изобретению в смеси с носителем, выбранным из группы, состоящей из 0,5 М фосфорной кислоты (максимальная концентрация 100 мг/мл); гидроксиэтилцеллюлозы (1% (мас./об., полисорбата 80 (0,25% (об./об., противопенного средства (0,05% (об./об. и деионизованной воды (максимальная концентрация 110 мг/мл); витамина Е TPGS(сукцинат d-альфа-токоферилполиэтиленгликоля 1000) (10% (об./об. и деионизованной воды (максимальная концентрация 250 мг/мл). Согласно другому аспекту изобретения предложенные соединения вводят в комбинации с одним или более терапевтическим ингредиентом. Указанные терапевтические ингредиенты включают, например, метформин или ингибитор DPPIV, например ситаглиптин. Введение комбинации включает одновременное, раздельное или последовательное введение. В случае комбинированного введения для лечения диабета предпочтительным является введение соединений согласно настоящему изобретению одновременно, раздельно или последовательно с метформином. В случае комбинированного введения для лечения ожирения предпочтительным является введение соединений согласно настоящему изобретению одновременно, раздельно или последовательно с ситаглиптином. Следующие схемы, примеры получения и примеры приведены для более подробного пояснения реализации настоящего изобретения. Подходящие условия проведения реакций на стадиях, представленных на указанных схемах, в примерах получения и примерах, хорошо известны в данной области техники, и специалисты в данной области техники способны подходящим образом модифицировать условия проведения реакции, включая замену растворителей или применяемых совместно реагентов. Температуры, указанные в следующих примерах получения и примерах, соответствуют температуре внешней бани,если не указано иное. Кроме того, для опытного специалиста в данной области техники очевидно, что в некоторых случаях порядок введения фрагментов не имеет решающего значения. Конкретная очередность стадий, требуемая для получения соединения формулы (I), зависит от конкретного синтезируемого соединения, исходного соединения и относительной лабильности замещенных фрагментов и является очевидной для специалиста в области химии. Специалистам в данной области техники очевидно, что не все заместители совместимы с условиями проведения реакций. Указанные соединения могут быть защищены или модифицированы в подходящий момент синтеза при помощи способов, известных в данной области техники. Подходящие защитные группы включают группы, описанные Т.В. Грином (T.W. Greene) в "Protective Groups in Organic Synthesis", John Wiley and Sons, New York, N.Y., 1991, далее называемой "Greene". Грином указаны подходящие условия для введения и удаления подходящих защитных групп, применяемые специалистами в данной области техники. Промежуточные вещества и конечные продукты согласно настоящему изобретению можно дополнительно очистить, при необходимости, при помощи общепринятых способов, таких как перекристаллизация или хроматография на твердой подложке, такой как силикагель или оксид алюминия. Названия соединений в примерах настоящего изобретения получали при помощи AutoNom 2000. В настоящем описании применяют следующие сокращения:"ч" означает часы; "мин" означает минуты; "цАМФ (cAMP)" означает циклический аденозинмонофосфат; "DMEM" означает модифицированную по способу Дульбекко среду Игла; "HTRF" означает гомогенную флуоресценцию, разрешенную во времени; "ФБР" означает фосфатный буферный солевой раствор; "IMBX" означает изобутилметилксантин; "БСА" означает альбумин бычьей сыворотки; "ЭБС" означает эмбриональную сыворотку теленка; "EBSS" означает сбалансированный солевой раствор Эрла;"ЭДТА" означает этилендиаминтетрауксусную кислоту; "НАДФН" означает никотинамидаденозиндинуклеотидфосфат; "ГЭЦ" означает гидроксиэтилцеллюлозу; ЖХ-ESI/MC означает жидкостную хроматографию - масс-пектрометрию с ионизацией электрораспылением; "Pg" означает защитную группу; "Tf" означает трифторметилсульфонил; "Ts" означает пара-толуолсульфонил и "Ms" означает метилсульфонил. Схема A Исходный гидроксил (а) подвергают взаимодействию с мезилатсодержащим пиперидином с соответствующей защитной группой, например трет-бутиловым эфиром карбоновой кислоты, и подходящим основанием, например карбонатом калия, в подходящем растворителе, например ацетонитриле, при повышенной температуре. Снимают защиту с выделенного продукта в условиях, хорошо известных специалистам, с получением соединения (b). Соединение (b) подвергают взаимодействию с альдегидом в стандартных условиях восстановительного аминирования с подходящим восстановителем, таким как триацетоксиборгидрид натрия, в подходящем растворителе, таком как дихлорметан, с получением конечного соединения (I). В качестве альтернативы соединение (b) подвергают взаимодействию с соответствующей замещенной кислотой в присутствии агента сочетания, такого как тетрафторборат обензотриазол-1-ил-N,N,N',N'-тетраметилурония, и подходящего основания, такого как диизопропилэтиламин, в подходящем растворителе, таком как диметилформамид, при повышенной температуре. Выделенный продукт подвергают взаимодействию с подходящим восстановителем, таким как алюмогидрид лития, с получением конечного соединения (I). В качестве альтернативы соединение (b) подвергают взаимодействию с R'OY и подходящим основанием, например с карбонатом калия, в подходящем растворителе, например в ацетонитриле, при повышенной температуре с получением конечного соединения (I). В качестве альтернативы в случае, если Ra представляет собой F, a Rb и Rc, оба, представляют собой метил, соединения (I') можно получать согласно схеме B, приведенной ниже. Схема B Исходный пиперидин (b) подвергают взаимодействию с 2,2-диметилоксираном в инертной среде,например в атмосфере азота, в подходящем растворителе, таком как метанол. Выделенный продукт подвергают взаимодействию с подходящим фторирующим агентом, таким как трифторид бис-(2 метоксиэтил)аминосеры в подходящем растворителе, например в дихлорметане, с получением конечного соединения (I'). Целевой гидроксил (a) можно получать согласно схеме C, приведенной ниже. Схема С Исходный пиперидин-4-ол (c) подвергают взаимодействию с метансульфонилхлоридом и подходящим основанием, таким как триэтиламин или пиридин, в подходящем растворителе, например дихлорметане или тетрагидрофуране, с получением соединения (d). Соединение (d) подвергают взаимодействию с п-толуолсульфокислотой в подходящем растворителе, таком как толуол, при повышенной температуре с получением тетрагидропиридина (e). Соединение (e) подвергают взаимодействию согласно способу, описанному в J. Am. Chem. Soc. 2006, 128, 10694-10695, с гидроксидом калия, 2-ди-третбутилфосфино-2',4',6'-триизопропил-1,1'-бифенилом и трис-(дибензилиденацетон)дипалладием в подходящем растворителе, таком как диоксан/вода, при повышенной температуре с получением тетрагидропиридинового соединения (a). В качестве альтернативы целевое бромсодержащее соединение (e) и гидроксил (a) можно получать согласно описаниям схем D и E. Схема D Исходный пиперидон (f) смешивают с подходящим основанием, например диизопропиламидом лития, в подходящем растворителе, таком как тетрагидрофуран, при пониженной температуре и подвергают взаимодействию с N-фенил-бис-(трифторметансульфонимидом) с получением соединения (g). Тетрагидропиридиновое соединение (g) взаимодействует с бис-(пинаколато)дибором, хлоридом (1,1'-бис(дифенилфосфино)ферроцен)палладия(II), 1,1'-бис-(дифенилфосфино)ферроценом и ацетатом калия в подходящем растворителе, например в 1,4-диоксане, при повышенной температуре с получением соединения (h). Схема E Исходный бромид взаимодействует с боронатным соединением (h), содержащим соответствующую защитную группу, такую как трет-бутиловый эфир карбоновой кислоты, подходящим палладиевым катализатором, таким как тетракис(трифенилфосфин)палладий, и подходящим основанием, например с карбонатом цезия, в подходящем растворителе, таком как диоксан/вода, при повышенной температуре. Снимают защиту с выделенного продукта в условиях, хорошо известных специалистам, с получением соединения (i). Соединение (i) подвергают взаимодействию с метансульфонилхлоридом и подходящим основанием, таким как триэтиламин, в подходящем растворителе, например в дихлорметане, с получением соединения (j). Если заместитель Y представляет собой OCH3, то для получения соединения (j) требуется проведение дополнительной стадии снятия защиты в условиях, хорошо известных специалистам. В качестве альтернативы соединения, в которых R1 представляет собой Н, можно получать согласно описанию схемы F, приведенной ниже. Схема F Соответствующим образом замещенную кислоту подвергают взаимодействию с 1,1'карбонилдиимидазолом в подходящем растворителе, таком как тетрагидрофуран, к которому добавляют этиловый эфир пиперидин-4-карбоновой кислоты. Выделенный продукт подвергают взаимодействию с подходящим восстановителем, таким как алюмогидрид лития, в подходящем растворителе, например в тетрагидрофуране, с получением соединения (k). Соединение (k) подвергают взаимодействию с соединением (a) в стандартных условиях реакции Мицунобу, например с диизопропилазодикарбоксилатом и трифенилфосфином, при пониженной температуре в подходящем растворителе, таком как тетрагидрофуран, с получением конечного соединения (I). Пример получения 1. 4-(1-Метансульфонил-1,2,3,6-тетрагидропиридин-4-ил)фенол. 1. 4-(4-Бромфенил)-1-метансульфонилпиперидин-4-ол. Метансульфонилхлорид (21,91 г, 14,81 мл, 191,30 ммоль) медленно добавляли (10 мин) к раствору 4-(4-бромфенил)-4-пиперидинола (50,00 г, 191,30 ммоль) и триэтиламина (29,04 г, 40,00 мл, 286,95 ммоль) в тетрагидрофуране (575 мл) при 23C (внутренняя температура) в атмосфере азота. Смесь перемешивали при 23C в течение 30 мин. Добавляли 500 мл 1 М водной хлористо-водородной кислоты и смесь перемешивали в течение 10 мин. Смесь экстрагировали этилацетатом (2500 мл), органические слои объединяли, сушили над безводным сульфатом натрия, фильтровали и удаляли растворитель с получением 60,0 г соединения, указанного в заголовке, в виде белого твердого вещества. MC m/e (79Br/81Br) 333, 335 (M+1). 2. 4-(4-Бромфенил)-1-метансульфонил-1,2,3,6-тетрагидропиридин. Смесь 4-(4-бромфенил)-1-метансульфонилпиперидин-4-ола (60,00 г, 179,51 ммоль) и птолуолсульфокислоты (9,37 г, 53,85 ммоль) в толуоле (1,08 л) перемешивали при 100C в течение 16 ч. Реакционную смесь охлаждали до 23C и последовательно промывали 2 М водным гидроксидом натрия до pH 10 и водой. Фазы разделяли, органический слой сушили над безводным сульфатом натрия, фильтровали и растворитель удаляли. Добавляли метил-трет-бутиловый эфир (200 мл), твердое вещество отфильтровывали и промывали метил-трет-бутиловым эфиром с получением 35,0 г соединения, указанного в заголовке, в виде светло-коричневого твердого вещества. MS m/e (79Br/81Br) 315, 317 (M+1). 3. 4-(1-Метансульфонил-1,2,3,6-тетрагидропиридин-4-ил)фенол. Смесь 4-(4-бромфенил)-1-метансульфонил-1,2,3,6-тетрагидропиридина (23,50 г, 74,32 ммоль), гидроксида калия (14,72 г, 222,95 ммоль), 2-ди-трет-бутилфосфино-2',4',6'-триизопропил-1,1'-бифенила (2,52 г, 5,95 ммоль) и трис-(дибензилиденацетон)дипалладия(0) (1,36 г, 1,49 ммоль) продували азотом, затем добавляли не содержащий кислород 1,4-диоксан (150 мл) и не содержащую кислород воду (150 мл). Смесь перемешивали при 100C в течение 1 ч. Смесь охлаждали до 23C и добавляли 1 М водную хлористо-водородную кислоту до pH 2-3. Водный слой экстрагировали этилацетатом. Органические слои объединяли, сушили над безводным сульфатом натрия, фильтровали и растворитель удаляли с получением красного твердого вещества. Добавляли диэтиловый эфир и фильтровали твердое вещество с получением 16 г указанного в заголовке соединения в виде беловатого твердого вещества. МС (m/z) 254 (M+1). Пример получения 2. 1-Метансульфонил-4-[4-(пиперидин-4-илметокси)фенил]-1,2,3,6 тетрагидропиридин. 1. трет-Бутиловый эфир 4-метансульфонилоксиметилпиперидин-1-карбоновой кислоты. Метансульфонилхлорид (29,26 г, 19,77 мл, 255,47 ммоль) медленно добавляли (10 мин) в атмосфере азота к раствору трет-бутил 4-(гидроксиметил)пиперидин-1-карбоксилата (50,00 г, 232,24 ммоль) и триэтиламина (35,25 г, 48,56 мл, 348,36 ммоль) в безводном дихлорметане (700 мл) при 9C (внутренняя температура). Смесь перемешивали при 23C в течение 16 ч. Реакционную смесь последовательно промывали 1 М водной хлористо-водородной кислотой, водой и солевым раствором. Органический слой сушили над безводным сульфатом натрия, фильтровали и растворитель удаляли с получением 60 г указанного в заголовке соединения в виде белого твердого вещества. МС (m/z) 316 (M+23). 2. трет-Бутиловый эфир 4-[4-(1-метансульфонил-1,2,3,6-тетрагидропиридин-4 ил)феноксиметил]пиперидин-1-карбоновой кислоты. Смесь трет-бутилового эфира 4-метансульфонилоксиметилпиперидин-1-карбоновой кислоты (17,95 г, 61,19 ммоль), соединения по примеру получения 1 (15,50 г, 61,19 ммоль) и карбоната калия (16,91 г,122,37 ммоль) в ацетонитриле (120 мл) кипятили с обратным холодильником в течение 18 ч. Реакционную смесь охлаждали до 23C и растворитель удаляли. Остаток растворяли в смеси 1 л дихлорметана и 500 мл воды и фазы разделяли. Органический слой промывали солевым раствором, сушили над сульфатом натрия, фильтровали и выпаривали. Полученное твердое вещество обрабатывали 250 мл метил-трет-бутилового эфира с получением 22,0 г указанного в заголовке продукта. МС (m/z) 473(M+23). 3. 1-Метансульфонил-4-[4-(пиперидин-4-илметокси)фенил]-1,2,3,6-тетрагидропиридин. Трифторуксусную кислоту (2,98 г, 1,97 мл, 26,10 ммоль) добавляли к раствору трет-бутилового эфира 4-[4-(1-метансульфонил-1,2,3,6-тетрагидропиридин-4-ил)феноксиметил]пиперидин-1-карбоновой кислоты (1,20 г, 2,61 ммоль) в дихлорметане (13 мл). Смесь перемешивали при 23C в течение 30 мин. Добавляли 2 М водный раствор гидроксида натрия. Полученный белый осадок отфильтровывали и промывали водой. Маточный раствор экстрагировали в дихлорметане. Объединенные органические слои сушили над безводным сульфатом натрия, фильтровали и растворитель удаляли с получением белого твердого вещества, которое объединяли с первоначальным осадком и сушили в глубоком вакууме в течение 16 ч. Добавляли диэтиловый эфир и твердое вещество отфильтровывали и промывали этилацетатом с получением 0,810 г беловатого твердого вещества. МС (m/z) 351 (M+1). Пример получения 3. трет-Бутиловый эфир 4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-3,6 дигидро-2H-пиридин-1-карбоновой кислоты. 1. трет-Бутиловый эфир 4-трифторметансульфонилокси-3,6-дигидро-2H-пиридин-1-карбоновой кислоты. В 3-горлой колбе, снабженной капельной воронкой, датчиком температуры и магнитной мешалкой,раствор диизопропиламина (32,30 г, 44,93 мл, 319,20 ммоль) в тетрагидрофуране (160 мл) охлаждали до-10C (внутренняя температура). По каплям добавляли н-бутиллитий (133,0 мл, 332,50 ммоль, 2,5 М в гексане) (10 мин, температура изменялась от -10 до 1C). Смесь перемешивали при -10C в течение 10 мин, затем охлаждали до -60C (внутренняя температура, баня -75C). Раствор N-трет-бутоксикарбонил 4-пиперидона (53,00 г, 266,00 ммоль) в тетрагидрофуране (160 мл) добавляли по каплям (10 мин). Смесь перемешивали при -60C в течение 1,5 ч, раствор N-фенил-бис-(трифторметансульфонимида) (99,78 г,279,30 ммоль) в тетрагидрофуране (160 мл) добавляли по каплям при -60C (5 мин). Дополнительно добавляли тетрагидрофуран (40 мл) и смесь оставляли нагреваться до 23C в течение 16 ч. К смеси добавляли насыщенный водный бикарбонат натрия (400 мл), затем экстрагировали этилацетатом (3400 мл). Объединенные органические слои промывали солевым раствором, сушили над безводным сульфатом магния, фильтровали и концентрировали. Полученную смесь пропускали через колонку с силикагелем,элюируя смесью гексан:этилацетат 4:1 с получением 78,00 г указанного в заголовке соединения в виде желтой маслянистой жидкости. Вещество применяли на следующей стадии без дополнительной очистки. 1(6,53 г, 11,77 ммоль), хлорид (1,1'-бис-(дифенилфосфино)ферроцен)палладия(II) (9,61 г, 11,77 ммоль) и ацетат калия (69,32 г, 706,28 ммоль) и смесь перемешивали в атмосфере азота при 85C в течение 3 ч. Смесь охлаждали до 23C и перемешивали в течение 16 ч. Смесь фильтровали через диатомитовую землю, промывали этилацетатом и концентрировали в вакууме. Неочищенный продукт очищали с помощью флэш-хроматографии на силикагеле, элюент гексан:этилацетат (от 12:1 до 4:1) с получением 72,00 г указанного в заголовке соединения, которое применяли на следующей стадии без дополнительной очистки. МС (m/z) 254 (M-55). Пример получения 4. трет-Бутиловый эфир 4-(1-метансульфонилоксиэтил)пиперидин-1-карбоновой кислоты. 1. трет-Бутиловый эфир 4-(1-гидроксиэтил)пиперидин-1-карбоновой кислоты. К раствору N-трет-бутоксикарбонил-4-пиперидинкарбоксальдегида (32,20 г, 151,45 ммоль) в тетрагидрофуране при -78C добавляли бромид метилмагния (2 М в диэтиловом эфире, 100,96 мл, 302,89 ммоль). Реакционную смесь перемешивали при -78C в течение 4,5 ч, затем нагревали до -50C в течение 30 мин. Реакцию гасили водой при -50C и оставляли нагреваться до комнатной температуры в течение 16 ч. Растворители удаляли и вещество разделяли в диэтиловом эфире и 0,1 М хлористо-водородной ки-6 020540 слоте. Смесь экстрагировали в диэтиловом эфире. Объединенные органические слои промывали 0,1 М хлористо-водородной кислотой, насыщенным водным бикарбонатом натрия и солевым раствором, сушили над сульфатом магния, фильтровали и концентрировали досуха. Неочищенное вещество очищали с помощью флэш-хроматографии на силикагеле с получением 16,90 г указанного в заголовке соединения в виде бесцветной маслянистой жидкости. МС (m/z) 229 (M+1). 2. трет-Бутиловый эфир 4-(1-метансульфонилоксиэтил)пиперидин-1-карбоновой кислоты. К раствору трет-бутилового эфира 4-(1-гидроксиэтил)пиперидин-1-карбоновой кислоты (18,24 г,79,54 ммоль) в дихлорметане (400 мл) и триэтиламине (12,20 мл, 87,49 ммоль) при 0C добавляли метилсульфонилхлорид (9,23 мл, 119,30 ммоль). Реакционную смесь оставляли нагреваться до комнатной температуры в течение 16 ч. Смесь промывали 0,1 М хлористо-водородной кислотой, насыщенным водным бикарбонатом натрия, водой и солевым раствором. Вещество сушили над сульфатом магния, фильтровали и концентрировали досуха. Неочищенное вещество очищали с помощью флэш-хроматографии на силикагеле с получением 22,65 г указанного в заголовке соединения в виде бесцветной маслянистой жидкости. 1H ЯМР (CDCl3)(м.д.): 1,19-1,30 (м, 2H), 1,39 (д, 3H), 1,44 (с, 9H), 1,6-1,8 (м, 3H), 2,66 (м, 2H), 2,99 (с, 3H), 4,16 (м, 2H), 4,62 (т, 1H). Пример получения 5. 4-1-[4-(1-Метансульфонил-1,2,3,6-тетрагидропиридин-4-ил)фенокси]этилпиперидин. 1. трет-Бутиловый эфир 4-1-[4-(1-метансульфонил-1,2,3,6-тетрагидропиридин-4-ил)фенокси]этилпиперидин-1-карбоновой кислоты. К раствору соединения по примеру получения 1 (2,35 г, 9,27 ммоль) и соединения по примеру получения 4 (2,85 г, 9,27 ммоль) в ацетонитриле (93,00 мл) добавляли карбонат цезия (3,02 г, 9,27 ммоль) и 18-краун-6 (0,49 г, 1,85 ммоль). Смесь нагревали до 80C в течение 72 ч. Смесь концентрировали в вакууме и оставшееся вещество разделяли в этилацетате и воде. Органический слой промывали 1 М гидроксидом натрия и солевым раствором. Вещество сушили над сульфатом магния, фильтровали и концентрировали досуха. Полученное вещество разбавляли 10 мл диэтилового эфира, обрабатывали ультразвуком в течение 3 мин, оставшееся твердое вещество отфильтровывали и сушили в вакууме с получением 2,02 г указанного в заголовке продукта в виде белого твердого вещества. МС (m/z) 487 (M+32), 365 (М 55). 2. 4-1-[4-(1-Метансульфонил-1,2,3,6-тетрагидропиридин-4-ил)фенокси]этилпиперидин. К раствору трет-бутилового эфира 4-1-[4-(1-метансульфонил-1,2,3,6-тетрагидропиридин-4 ил)фенокси]этилпиперидин-1-карбоновой кислоты (1,16 г, 2,50 ммоль) в дихлорметане (25 мл) добавляли трифторуксусную кислоту (1,32 мл, 17,48 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 18 ч. Смесь концентрировали в вакууме и разбавляли 3 мл этилацетата. Добавляли 2 М водный гидроксид натрия с получением белого твердого вещества. Твердое вещество отфильтровывали и сушили с получением 0,86 г указанного в заголовке соединения. МС (m/z) 365 (M+1). Указанное в заголовке соединение (0,320 г, 0,88 ммоль) разделяли на энантиомеры с применением элюента 0,2% диметилэтиламина в 2:3 ацетонитрил:метанол на колонке 4,6150 мм Chiralcel AD-H при 1 мл/мин с получением 0,115 г изомера 1 (100% э.и., RT=5,27 мин), МС (m/z) 365 (M+1) и 0,112 г изомера 2 (100% э.и.,RT=8,59 мин), МС (m/z) 365 (M+1). Пример получения 6. Дигидрохлоридная соль 4-(1'-метансульфонил-1',2',3',6'тетрагидро[2,4']бипиридинил-5-илоксиметил)пиперидиния. 1. трет-Бутиловый эфир 5-бром-3',6'-дигидро-2'H-[2,4']бипиридинил-1'-карбоновой кислоты. Смесь 2,5-дибромпиридина (50,00 г, 211,07 ммоль), соединения по примеру получения 3 (71,79 г,232,17 ммоль), 2 М водного карбоната натрия (158,30 мл, 316,60 ммоль) и тетракис(трифенилфосфин)палладия(0) (7,32 г, 6,33 ммоль) в 1,4-диоксане (633 мл) нагревали при 100C в атмосфере азота в течение ночи. Реакционную смесь оставляли охлаждаться до комнатной температуры,фильтровали через диатомитовую землю и промывали этилацетатом. Органический слой промывали 500 мл воды, сушили над сульфатом магния, фильтровали и выпаривали. Неочищенное вещество очищали с помощью хроматографии на силикагеле, элюируя смесью гексан:этилацетат 6:1, с получением 55 г белого твердого вещества. МС m/e (79Br/81Br) 339, 341 (M+1 для обоих изотопов). 2. Дигидрохлоридная соль 5-бром-1',2',3',6'-тетрагидро[2,4']бипиридинил-1'-ия. 4 М хлористый водород (170,24 г, 162,13 мл, 648,52 ммоль) в 1,4-диоксане добавляли к раствору трет-бутилового эфира 5-бром-3',6'-дигидро-2'Н-[2,4']бипиридинил-1'-карбоновой кислоты (55,00 г,162,13 ммоль) в дихлорметане (810 мл). Смесь перемешивали при комнатной температуре в течение 12 ч и нагревали при 40C в течение 6 ч. Смесь выпаривали, а твердое вещество отфильтровывали и промывали метил-трет-бутиловым эфиром. Твердое вещество сушили в сушильном шкафу при 40C в течение 12 ч с получением 50 г указанного в заголовке соединения. МС m/e (79Br/81Br) 238/240 (M+1). 3. 5-Бром-1'-метансульфонил-1',2',3',6'-тетрагидро[2,4']бипиридинил. Указанные в заголовке соединение получали, по существу, согласно способу примера получения 1(стадия 1) с применением дигидрохлоридной соли 5-бром-1',2',3',6'-тетрагидро[2,4']бипиридинил-1'-ия в качестве исходного вещества. МС m/e (79Br/81Br) 316/318 (M+1). 4. 1'-Метансульфонил-1',2',3',6'-тетрагидро[2,4']бипиридинил-5-ол. Указанное в заголовке соединение получали, по существу, согласно способу примера получения 1(стадия 3) с применением 5-бром-1'-метансульфонил-1',2',3',6'-тетрагидро[2,4']бипиридинила в качестве исходного вещества. МС (m/z) 255 (M+1). 5. трет-Бутиловый эфир 4-(1'-метансульфонил-1',2',3',6'-тетрагидро[2,4']бипиридинил-5 илоксиметил)пиперидин-1-карбоновой кислоты. Указанное в заголовке соединение получали, по существу, согласно способу примера получения 2 1. 1-Оксаспиро[2.4]гептан-2-карбонитрил. 1 М раствор трет-бутоксида калия в трет-бутиловом спирте (184,4 мл, 184,4 ммоль) медленно добавляли к раствору хлорацетонитрила (10,8 мл, 167,6 ммоль) и циклопентанона (15,0 мл, 167,6 ммоль) в безводном трет-бутиловом спирте (33 мл). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Смесь фильтровали через диатомитовую землю, растворитель удаляли, а остаток разбавляли водой. Смесь нейтрализовали 30% водным раствором дигидрофосфата натрия и экстрагировали в диэтиловом эфире. Органические слои объединяли, сушили над безводным сульфатом натрия, фильтровали и растворитель удаляли. Остаток очищали с помощью флэш-хроматографии на силикагеле с получением 14,1 г указанного в заголовке соединения в виде бесцветной маслянистой жидкости. 1H ЯМР(CDCl3)(м.д.): 3,46 (с, 1H), 1,65-2,20 (м, 8H). 2. (1-Фторциклопентил)гидроксиацетонитрил. Безводный дихлорметан (3 мл) и 70% (мас./мас.) раствор фтористого водорода (2,68 мл, 20,44 ммоль) в пиридине перемешивали в полиэтиленовом сосуде при 0C в атмосфере азота. Медленно добавляли раствор 1-оксаспиро[2.4]гептан-2-карбонитрила (3,30 г, 26,76 ммоль) в безводном дихлорметане(3,2 мл). Реакционную смесь перемешивали при 0C в течение 1 ч и при комнатной температуре в течение 1 ч. Смесь охлаждали до 0C и осторожно добавляли насыщенный раствор карбоната натрия. Водный слой экстрагировали в диэтиловом эфире. Органические слои объединяли, промывали водой и солевым раствором, сушили над безводным сульфатом натрия, фильтровали и растворитель удаляли. Остаток очищали с помощью хроматографии на картридже с 20 г силикагеля, элюируя смесью гексан:диэтиловый эфир (от 100:0 до 80:20) с получением 1,7 г целевого соединения в виде бесцветной маслянистой жидкости. 1H ЯМР (CDCl3)(м.д.): 4,47 (д, 1H), 3,50 (уш.с, 1H), 2,12-1,67 (м, 8H). 3. 1-Фторциклопентанкарбальдегид. Раствор 25% гидроксида натрия (7,00 мл, 72,8 ммоль) в воде добавляли к раствору (1 фторциклопентил)гидроксиацетонитрила (0,50 г, 3,5 ммоль) в этаноле (10 мл) и реакционную смесь перемешивали при комнатной температуре в течение 15 мин. Смесь разбавляли водой и диэтиловым эфиром, водный слой экстрагировали диэтиловым эфиром. Органические слои объединяли, промывали водой и солевым раствором, сушили над безводным сульфатом натрия, фильтровали, растворитель удаляли в вакууме с получением 430 мг желтой маслянистой жидкости, которую применяли без дополнительной очистки. 4. 4-4-[1-(1-Фторциклопентилметил)пиперидин-4-илметокси]фенил-1-метансульфонил-1,2,3,6 тетрагидропиридин. Уксусную кислоту (0,024 мл, 0,42 ммоль) и 1-фторциклопентанкарбальдегид (0,367 мл, 3,70 ммоль) добавляли к суспензии соединения по примеру получения 2 (150 мг, 0,427 ммоль) в дихлорметане (4 мл) и смесь перемешивали при 40C в течение 45 мин. Добавляли триацетоксиборгидрид натрия (236,22 мг,1,07 ммоль) и смесь перемешивали при 40C в течение 1,5 ч. Добавляли насыщенный водный раствор бикарбоната натрия и смесь экстрагировали этилацетатом. Органические слои объединяли, промывали водой и солевым раствором, сушили над безводным сульфатом натрия, фильтровали и растворитель удаляли. Остаток хроматографировали на картридже с 10 г силикагеля, элюируя смесью дихлорметан:этилацетат 20, 50 и 100%, с получением светло-желтого твердого вещества. Соединение растирали с диэтиловым эфиром и фильтровали с получением 25 мг указанного в заголовке соединения в виде белого твердого вещества. МС (m/z) 451 (M+1). 1. 2-Фтор-1-4-[4-(1-метансульфонил-1,2,3,6-тетрагидропиридин-4-ил)феноксиметил]пиперидин-1 ил-2-метилпропан-1-он. Диизопропилэтиламин (1,60 г, 2,16 мл, 12,40 ммоль) добавляли к суспензии соединения по примеру получения 2 (1,60 г, 4,13 ммоль), тетрафторбората о-бензотриазол-1-ил-N,N,N',N'-тетраметилурония (1,99 г, 6,20 ммоль) и 2-фтор-2-метилпропионовой кислоты (0,48 г, 0,54 мл, 4,55 ммоль) в безводном диметилформамиде (20 мл) и смесь перемешивали при 40C в течение 1 ч. Реакционную смесь разбавляли этилацетатом и последовательно промывали 1 М водной хлористо-водородной кислотой, водой и 2 М водным гидроксидом натрия. Органический слой сушили над безводным сульфатом натрия, фильтровали и растворитель удаляли. Остаток очищали с помощью хроматографии на картридже с силикагелем, элюируя смесью дихлорметан:этилацетат 0, 5%, затем 10%, с получением 1,0 г указанного в заголовке соединения в виде светло-коричневого твердого вещества. МС (m/z) 439 (M+1). 2. 4-4-[1-(2-Фтор-2-метилпропил)пиперидин-4-илметокси]фенил-1-метансульфонил-1,2,3,6-тетрагидропиридин. К раствору 2-фтор-1-4-[4-(1-метансульфонил-1,2,3,6-тетрагидропиридин-4-ил)феноксиметил]пиперидин-1-ил-2-метилпропан-1-она (1,00 г, 2,28 ммоль) в тетрагидрофуране (23 мл) при КТ через шприц добавляли 1 М раствор алюмогидрида лития в тетрагидрофуране (7,18 г, 7,98 мл, 7,98 ммоль). Через 1 ч осторожно добавляли декагидрат сульфата натрия. Смесь перемешивали в течение 15 мин, твердое вещество отфильтровывали и промывали дихлорметаном. Растворитель удаляли, остаток очищали с помощью хроматографии на силикагеле, элюируя смесью дихлорметан:этилацетат от 5,6:1 до 2:1 с получением твердого вещества. Добавляли диэтиловый эфир и твердое вещество отфильтровывали и промывали диэтиловым эфиром и этилацетатом с получением 0,245 г указанного в заголовке соединения в виде белого твердого вещества. МС (m/z) 425 (M+1). Следующие соединения получали, по существу, согласно способу, представленному в примере 2. 1. 4-(1'-Метансульфонил-1',2',3',6'-тетрагидро[2,4']бипиридинил-5-илоксиметил)пиперидин. Соединение примера получения 6 (47 г, 114,5 ммоль) растворяли в 2 М водном растворе гидроксида натрия (500 мл) и экстрагировали в дихлорметане (2500 мл). Органический слой сушили над сульфатом магния, фильтровали и выпаривали с получением 40 г указанного в заголовке соединения в виде светложелтого твердого вещества. МС (m/z) 352 (M+1). 2. 1-[4-(1'-Метансульфонил-1',2',3',6'-тетрагидро[2,4']бипиридинил-5-илоксиметил)пиперидин-1-ил]2-метилпропан-2-ол. К раствору 4-(1'-метансульфонил-1',2',3',6'-тетрагидро[2,4']бипиридинил-5-илоксиметил)пиперидина (40 г, 113,81 ммоль) в метаноле (230 мл) при 25C в атмосфере азота добавляли 2,2 диметилоксиран (15,18 мл, 170,71 ммоль) за один раз и реакционную смесь перемешивали при 25C в течение 16 ч. Добавляли воду (500 мл), осадок отфильтровывали, промывали метил-трет-бутиловым эфиром (250 мл) и сушили с получением 33 г указанного в заголовке соединения в виде светло-желтого твердого вещества. МС (m/z) 424 (M+1). 3. 5-[1-(2-Фтор-2-метилпропил)пиперидин-4-илметокси]-1'-метансульфонил-1',2',3',6'-тетрагидро[2,4']бипиридинил. К раствору 2-метил-1-[4-6-(1-метилсульфонил-3,6-дигидро-2 Н-пиридин-4-ил)-3-пиридил]оксиметил]-1-пиперидил]пропан-2-ола (33 г; 77,91 ммоль) в дихлорметане (155 мл) добавляли трифторид бис-(2-метоксиэтил)аминосеры (16,63 мл, 85,70 ммоль) при внутренней температуре, равной 2223C. Реакционную смесь перемешивали при 25C в течение 2 ч. Добавляли водный насыщенный раствор бикарбоната натрия для достижения pH 7. Слои разделяли, водный слой экстрагировали в дихлорметане (2500 мл), объединенные органические слои сушили над сульфатом магния, фильтровали и концентрировали. Неочищенное вещество очищали с помощью хроматографии на силикагеле, элюируя смесью 98:2 дихлорметан:метанол. Твердое вещество растирали с 500 мл метил-трет-бутилового эфира и фильтровали. Твердое вещество сушили в сушильном шкафу при 40C в течение 3 дней с получением 24 г указанного в заголовке соединения в виде белого твердого вещества. МС (m/z) 426 (M+1). Альтернативный способ получения соединения по примеру 6 представлен далее. 1. трет-Бутиловый эфир 4-[4-(1-метансульфонил-1,2,3,6-тетрагидропиридин-4-ил)феноксиметил]пиперидин-1-карбоновой кислоты. В 3-горлую колбу, снабженную механической мешалкой, добавляли трет-бутиловый эфир 4-(1 гидроксиметил)пиперидин-1-карбоновой кислоты (350 г, 1,63 моль), триэтиламин (247 г, 2,44 моль) и дихлорметан (1750 мл). Раствор перемешивали при 0C в течение 30 мин. Медленно добавляли метансульфонилхлорид (223,5 г, 1,95 моль) при 05C. Смесь перемешивали при 5C в течение 1,5 ч. К смеси по каплям добавляли 1050 мл 0,5 N раствора водного хлористового водорода при 015C, полученный раствор перемешивали в течение 30 мин. Слои разделяли, органический слой промывали 1050 мл воды и концентрировали досуха. Добавляли 700 мл метил-трет-бутилового эфира и смесь кипятили с обратным холодильником в течение 0,5 ч, после чего смесь медленно охлаждали до 5C, суспензию фильтровали. Твердое вещество перемешивали с 500 мл метил-трет-бутилового эфира и фильтровали досуха с получением 434 г беловатого твердого вещества, чистота 98,6%, определена ВЭЖХ. 2. трет-Бутиловый эфир 4-(1'-метансульфонил-1',2',3',6'-тетрагидро[2,4']бипиридинил-5 илоксиметил)пиперидин-1-карбоновой кислоты. В 3-горлую колбу добавляли 1'-метансульфонил-1',2',3',6'-тетрагидро[2,4']бипиридин-5-ол (254,3 г,1,0 моль), затем трет-бутиловый эфир 4-(1-метансульфонилоксиэтил)пиперидин-1-карбоновой кислоты(396,1 г, 1,34 моль) и карбонат калия (248,8 г, 1,8 моль). Добавляли диметилформамид (3800 мл) и смесь нагревали при 8090C в течение 6 ч. По каплям добавляли 3810 мл воды при 7080C. Смесь медленно охлаждали до 2030C и фильтровали. Осадок суспендировали в 1000 мл воды, концентрировали и сушили в вакууме с получением 407 г твердого вещества, чистота 97,13%, определена ВЭЖХ. 3. 4-(1'-Метансульфонил-1',2',3',6'-тетрагидро[2,4']бипиридинил-5-илоксиметил)пиперидин. В 3-горлую колбу, снабженную механической мешалкой, добавляли трет-бутиловый эфир 4-(1'метансульфонил-1',2',3',6'-тетрагидро[2,4']бипиридинил-5-илоксиметил)пиперидин-1-карбоновой кислоты (407 г, 0,90 моль) и по каплям добавляли 6 N водный хлористый водород (2000 мл, 12,0 моль) при 25C. Смесь механически перемешивали при 25C в течение 0,5 ч. При 25C добавляли 1000 мл дихлорметана, смесь перемешивали в течение 2030 мин. Слои разделяли и по каплям добавляли водный NaOH(1500 мл, 11,6 моль) к водному раствору до рН 910 при 25C. Добавляли 3200 мл дихлорметана и смесь перемешивали при 2530C в течение 40 мин. По каплям добавляли водный раствор NaOH (300 мл, 2,3 моль) до рН 14, до полного растворения твердого вещества, раствор перемешивали в течение 20-30 мин,слои разделяли. Водный слой экстрагировали в 1700 мл дихлорметана. Объединенные органические слои промывали 900 мл воды и концентрировали. Остаток применяли на следующей стадии без дополнительной очистки. 4. 1-[4-(1'-Метансульфонил-1',2',3',6'-тетрагидро[2,4']бипиридинил-5-илоксиметил)пиперидин-1 ил]метилпропан-2-ол. 4-(1'-Метансульфонил-1',2',3',6'-тетрагидро[2,4']бипиридинил-5-илоксиметил)пиперидин суспендировали в 800 мл метанола и добавляли в автоклав с механической мешалкой. Добавляли 1500 мл метанола, затем добавляли диметилоксиран (117 г, 1,62 моль). Смесь перемешивали при 6070C в течение 88 ч,охлаждали до 2530C и концентрировали до 1000 мл. Смесь нагревали при 6070C и добавляли 4200 мл воды. Полученную смесь перемешивали при 6070C в течение 30 мин и медленно охлаждали до 05C в течение 1,52 ч. Смесь перемешивали при указанной температуре в течение 30 мин и фильтровали. Осадок суспендировали в смеси Н 2 О:MeOH=3:1 (600 мл), предварительно охлажденной до 05C, и концентрировали (2). Продукт сушили в вакууме при 4050C с получением 320 г беловатого твердого вещества, чистота 98,3%, определена ВЭЖХ. 5. 5-[1-(2-Фтор-2-метилпропил)пиперидин-4-илметокси]-1'-метансульфонил-1',2',3',6'-тетрагидро[2,4']бипиридинил. 1-[4-(1'-Метансульфонил-1',2',3',6'-тетрагидро[2,4']бипиридинил-5-илоксиметил)пиперидин-1-ил]метилпропан-2-ол (300 г, 0,58 моль) растворяли в 3000 мл дихлорметана, раствор концентрировали до объема 1 л при 35C. Указанный процесс повторяли с объемом дихлорметана, равным 500 мл, а затем с объемом дихлорметана, равным 1000 мл. После концентрирования до объема 1 л при 35C раствор разбавляли 1000 мл дихлорметана. В другой колбе Deoxofluor (173 г, 0,74 моль) растворяли в 1250 мл дихлорметана и охлаждали до -30-40C. К указанному раствору добавляли раствор 1-[4-(1'метансульфонил-1',2',3',6'-тетрагидро[2,4']бипиридинил-5-илоксиметил)пиперидин-1-ил]метилпропан-2 ола в дихлорметане, поддерживая температуру смеси при -30-40C. Реакционную смесь медленно нагревали до 2030C и перемешивали при указанной температуре в течение 16 ч. Смесь охлаждали до 010C и по каплям добавляли насыщенный раствор бикарбоната натрия до рН 6,06,5. Смесь перемешивали в течение 30 мин, слои разделяли. Водный слой экстрагировали в 1000 мл дихлорметана. Объединенные органические слои промывали 1000 мл воды и концентрировали до 1 л смеси при 50C. Добавляли 1750 мл ацетонитрила и смесь концентрировали до 1 л смеси при 50C. Добавляли 500 мл ацетонитрила и смесь нагревали при 8082C в течение 30 мин с получением прозрачного раствора. По каплям добавляли 1250 мл воды при 8082C и медленно охлаждали смесь до 2030C. Полученную суспензию фильтровали. Осадок суспендировали в 500 мл 1:1 смеси ацетонитрила и воды и концентрировали. Остаток сушили в вакууме с получением 210 г неочищенного твердого вещества. Неочищенное вещество очищали с помощью хроматографии на силикагеле, элюируя смесью дихлорметан/метанол 98/2 с получением 165 г указанного в заголовке соединения с 98% чистотой. (ДМСО-d6, 400 МГц),8,23 (дд,1 Н, J=2,8 Гц), 7,49 (д, 1 Н, J=8,8 Гц), 7,36 (дд, 1 Н, J=8,8, 2,8 Гц), 6,56 (уш.с, 1H), 3,89-3,86 (м, 4H), 3,373,33 (м, 4H), 2,91 (с, 3H), 2,90-2,88 (м, 2H), 2,65-2,63 (м, 2H), 2,42-2,39 (м, 1H), 2,38-2,36 (м, 1H), 2,08-2,03 1. трет-Бутиловый эфир 4-(3-фтор-4-метоксифенил)-3,6-дигидро-2H-пиридин-1-карбоновой кислоты. 4-Бром-2-фторанизол (2,68 г, 12,94 ммоль), соединение по примеру получения 3 (4,40 г, 14,23 ммоль) и хлорид (1,1'-бис-(дифенилфосфино)ферроцен)палладия(II) (528,40 мг, 0,647 ммоль) помещали в подходящую для повторной герметизации пробирку и продували азотом. Добавляли диметилформамид(40 мл) и 2 М водный раствор карбоната натрия (23,71 мл, 38,82 ммоль), пробирку герметизировали и перемешивали при 90C в течение 1 ч. Реакционную смесь разделяли в этилацетате и воде. Водный слой экстрагировали этилацетатом. Объединенные органические слои промывали водой и солевым раствором,сушили над сульфатом магния, фильтровали и концентрировали досуха. Остаток очищали с помощью хроматографии с применением картриджа с 20 г силикагеля, элюируя смесью гексан:этилацетат (8:1), с получением 2,6 указанного в заголовке соединения в виде белой маслянистой жидкости. МС (m/z) 252(M-55). 2. Гидрохлоридная соль 4-(3-фтор-4-метоксифенил)-1,2,3,6-тетрагидропиридина. Получали, по существу, согласно примеру получения 6 (стадия 2) с применением трет-бутилового эфира 4-(3-фтор-4-метоксифенил)-3,6-дигидро-2H-пиридин-1-карбоновой кислоты в качестве исходного вещества. МС (m/z) 208 (M+1). 3. 4-(3-Фтор-4-метоксифенил)-1-метансульфонил-1,2,3,6-тетрагидропиридин. Гидрохлоридную соль 4-(3-фтор-4-метоксифенил)-1,2,3,6-тетрагидропиридина (462,00 мг, 1,90 ммоль) суспендировали в дихлорметане (10 мл). Добавляли триэтиламин (479,58 мг, 660,57 мкл, 4,74 ммоль) и метансульфонилхлорид (260,59 мг, 176,07 мкл, 2,27 ммоль), реакционную смесь закрывали и перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь разделяли в дихлорметане и воде. Водный слой экстрагировали дихлорметаном. Объединенные органические слои промывали солевым раствором, сушили над сульфатом магния, фильтровали и концентрировали досуха. Неочищенное вещество очищали с помощью хроматографии с применением картриджа с 5 г силикагеля, элюируя дихлорметаном с получением 349 мг указанного в заголовке соединения в виде белого твердого вещества. МС (m/z) 286 (M+1). 4. 4-(3-Фтор-4-гидроксифенил)-1-метансульфонилпиперидин-4-ол. 4-(3-Фтор-4-метоксифенил)-1-метансульфонил-1,2,3,6-тетрагидропиридин (1,12 г, 3,93 ммоль) растворяли в сухом дихлорметане (20 мл) в атмосфере азота. Раствор охлаждали до -78C и через шприц добавляли трифторид бора (11,52 г, 7,85 мл, 7,85 ммоль). Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 1 ч, затем добавляли 5% водный бикарбонат натрия и дихлорметан. Образовывалось нерастворимое твердое вещество, которое фильтровали с получением 729 мг указанного в заголовке соединения в виде розового твердого вещества. 1H ЯМР (CDCl3)(м.д.): 7,21 (дд,1H), 7,09 (м, 1H), 6,89 (т, 1H), 3,30 (м, 2H), 3,18 (тд, 2H), 2,88 (м, 3H), 2,06 (м, 2H), 1,80 (м, 2H). 5. 2-Фтор-4-(1-метансульфонил-1,2,3,6-тетрагидропиридин-4-ил)фенол. 4-(3-Фтор-4-гидроксифенил)-1-метансульфонилпиперидин-4-ол (726,00 мг, 2,51 ммоль) растворяли в 1,4-диоксане (10,36 г, 10,04 мл, 117,57 ммоль). Добавляли п-толуолсульфокислоту (43,65 мг, 250,93 мкмоль) и смесь нагревали при 60C. Добавляли твердый карбонат натрия и реакционную смесь концентрировали. Остаток разделяли в воде и этилацетате, pH доводили до 7 при помощи 1 М хлористого водорода и экстрагировали этилацетатом. Органический слой промывали солевым раствором, сушили над сульфатом магния, фильтровали и концентрировали досуха с получением 714 мг указанного в заголовке соединения в виде белого твердого вещества. МС (m/z) 272 (M+1). 6. трет-Бутиловый эфир 4-[2-фтор-4-(1-метансульфонил-1,2,3,6-тетрагидропиридин-4-ил)феноксиметил]пиперидин-1-карбоновой кислоты. Получали, по существу, согласно примеру получения 2 (стадия 2) с применением трет-бутилового эфира 4-метансульфонилоксиметилпиперидин-1-карбоновой кислоты и 2-фтор-4-(1-метансульфонил 1,2,3,6-тетрагидропиридин-4-ил)фенола в качестве исходных веществ. МС (m/z) 414 (M-55). 7. Гидрохлоридная соль 4-[3-фтор-4-(пиперидин-4-илметокси)фенил]-1-метансульфонил-1,2,3,6 тетрагидропиридина. Получали, по существу, согласно примеру получения 6 (стадия 2) с применением трет-бутилового эфира 4-[2-фтор-4-(1-метансульфонил-1,2,3,6-тетрагидропиридин-4-ил)феноксиметил]пиперидин-1 карбоновой кислоты в качестве исходного вещества. МС (m/z) 369 (M+1). 8. 4-3-Фтор-4-[1-(2-фтор-2-метилпропил)пиперидин-4-илметокси]фенил-1-метансульфонил 1,2,3,6-тетрагидропиридин. Получали, по существу, согласно примеру 2, применяя в качестве исходных веществ гидрохлоридную соль 4-[3-фтор-4-(пиперидин-4-илметокси)фенил]-1-метансульфонил-1,2,3,6-тетрагидропиридина и 2-фтор-2-метилпропионовую кислоту. МС (m/z) 443 (M+1). Пример 8. 4-(4-1-[1-(2-Фтор-2-метилпропил)пиперидин-4-ил]этоксифенил)-1-метансульфонил 1,2,3,6-тетрагидропиридин Получали, по существу, согласно примеру 2 с применением соединения по примеру получения 5(рацемат) в качестве исходного вещества с получением указанного в заголовке соединения. Указанное в заголовке соединение (0,194 г) разделяли на энантиомеры с применением элюента 0,2% диметилэтиламина в 100% метаноле на 420250 мм Chiralpak OJ при 8 мл/мин с получением 77 мг изомера 1 (96% э.и.,RT=10,7 мин). Пример 9. 4-4-[1-(2,2-Дифторпропил)пиперидин-4-илметокси]фенил-1-метансульфонил-1,2,3,6 тетрагидропиридин 1. 2,2-Дифторпропиловый эфир толуол-4-сульфокислоты. К раствору 2,2-дифторпропанола (0,50 г, 5,20 ммоль) в дихлорметане (52,0 мл) и триэтиламине (0,50 г, 0,73 мл, 5,20 ммоль) при 0C добавляли п-толуолсульфонилхлорид (0,99 г, 5,20 ммоль). Смесь оставляли медленно нагреваться до комнатной температуры в течение 24 ч. Смесь концентрировали и разделяли в диэтиловом эфире и воде. Органический слой промывали водой и солевым раствором, сушили над сульфатом магния, фильтровали и концентрировали досуха. Вещество очищали на силикагеле с получением 1,0 г указанного в заголовке соединения в виде прозрачных кристаллов. МС (m/z) 250 (M+1). 2. 4-4-[1-(2,2-Дифторпропил)пиперидин-4-илметокси]фенил-1-метансульфонил-1,2,3,6-тетрагидропиридин. К смеси соединения по примеру получения 2 (0,25 г, 0,71 ммоль) и 2,2-дифторпропилового эфира толуол-4-сульфокислоты (0,25 г, 0,91 ммоль) добавляли 1,3-диметил-2-имидазолидинон (7 мл). Смесь помещали в микроволновый реактор Biotage и нагревали до 175C в течение 1 ч, а затем до 180C в течение 1 ч. Смесь разделяли в этилацетате и воде. Органический слой промывали водой и солевым раствором, сушили над сульфатом магния, фильтровали и концентрировали досуха. Неочищенное вещество очищали на силикагеле с получением 0,03 г указанного в заголовке соединения в виде белого твердого(77,36 г,467,52 ммоль) добавляли к раствору 1(трифторметил)циклопропанкарбоновой кислоты (72,04 г, 467,52 ммоль) в тетрагидрофуране (600 мл),поддерживая внутреннюю температуру менее 30C. Через 10 мин добавляли этиловый эфир пиперидин 4-карбоновой кислоты (50 г, 311,68 ммоль), реакционную смесь перемешивали в атмосфере азота при комнатной температуре в течение 16 ч. Растворитель удаляли в управляемом вакууме, остаток разделяли в 2 М водном растворе гидроксида натрия (200 мл) и дихлорметане (300 мл). Органический слой промывали солевым раствором (100 мл), сушили над сульфатом магния, фильтровали и концентрировали с получением 93,45 г указанного в заголовке соединения. МС (m/z) 294 (M+1). 2. [1-(1-Трифторметилциклопропилметил)пиперидин-4-ил]метанол. Этиловый эфир 1-(1-трифторметилциклопропанкарбонил)пиперидин-4-карбоновой кислоты (50 г,170,48 ммоль) в тетрагидрофуране (350 мл) добавляли к раствору 1 М алюмогидрида лития (170,48 мл,170,48 ммоль) в тетрагидрофуране. Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 1 ч. Реакционную смесь охлаждали до 0C и последовательно добавляли воду/2 М раствор гидроксида натрия/воду (1:3:1) (8,5:12:8,5 мл). Полученную суспензию фильтровали через подложку Celite и промывали тетрагидрофураном (200 мл). Органический слой концентрировали в управляемом вакууме с получением 17 г летучего указанного в заголовке соединения в виде бесцветной маслянистой жидкости. Неочищенное вещество применяли без дополнительной очистки. МС (m/z) 238 (M+1). 3. 1-Метансульфонил-4-4-[1-(1-трифторметилциклопропилметил)пиперидин-4-илметокси]фенил 1,2,3,6-тетрагидропиридин. Диизопропилазодикарбоксилат (27,43 г, 128,87 ммоль) добавляли к раствору трифенилфосфина(33,80 г, 128,87 ммоль) в сухом тетрагидрофуране (330 мл) при 0C. Реакционную смесь перемешивали в течение 20 мин. По каплям добавляли суспензию [1-(1-трифторметилциклопропилметил)пиперидин-4 ил]метанола (24 г, 99,13 ммоль), соединения по примеру получения 1 (25,89 г, 99,13 ммоль) в сухом тетрагидрофуране (200 мл). Реакционную смесь перемешивали при 0C в течение 10 мин и оставляли на ночь нагреваться до комнатной температуры и для прохождения реакции. Растворитель выпаривали, полученную суспензию разбавляли дихлорметаном (350 мл) и промывали 2 М водным раствором гидроксида натрия (230 мл) и солевым раствором (230 мл), сушили над сульфатом магния, фильтровали и концентрировали. Розовое твердое вещество очищали на силикагеле, элюируя смесью гексан/ацетон: 100%; 95:5; 90:10; 80:20 и 70:30 с получением 16 г указанного в заголовке соединения, чистота примерно 80%. Твердое вещество обрабатывали 2 N водным хлористым водородом. Осаждалось белое твердое вещество, которое фильтровали и сушили. Твердое вещество растворяли в воде (150 мл) и подщелачивали до pH 12 гранулами гидроксида натрия. Полученное твердое вещество фильтровали, сушили и кристаллизовали с помощью метил-трет-бутилового эфира (100 мл), фильтровали и сушили в сушильном шкафу при 50C с получением 8 г указанного в заголовке соединения. МС (m/z) 473 (M+1). Альтернативный способ получения соединения по примеру 10 представлен далее. 1. Этиловый эфир 1-(1-трифторметилциклопропанкарбонил)пиперидин-4-карбоновой кислоты. 1-(Трифторметил)циклопропанкарбоновую кислоту (400 г, 2,6 моль) растворяли в 3,2 л тетрагидрофурана и охлаждали до 1020C. По частям добавляли карбонилдиимидазол (462,4 г, 1,1 экв.). Смесь перемешивали при 25-30C в течение 20 мин. Затем по каплям добавляли метиловый эфир пиперидин-4 карбоновой кислоты (445,6 г, 1,2 экв.) при 30C. Смесь перемешивали при 25-30C в течение 1820 ч. По каплям добавляли 3,2 л воды при 30C, раствор концентрировали до объема 1 л для удаления значительного количества тетрагидрофурана. Полученный раствор экстрагировали в дихлорметане (2). Объединенные органические слои промывали 3 об. 0,5 М хлористо-водородной кислоты и концентрировали. Добавляли 500 мл метил-трет-бутилового эфира и раствор концентрировали. Указанную процедуру проводили 2 раза. Органический слой концентрировали с получением 567 г указанного в заголовке соединения, чистота 95%. 2. [1-(1-Трифторметилциклопропилметил)пиперидин-4-ил]метанол. Алюмогидрид лития (208 г, 5,0 экв.) суспендировали в 3,9 л метил-трет-бутилового эфира, суспензию перемешивали в течение 10 мин. Добавляли по каплям раствор этилового эфира 1-(1 трифторметилциклопропанкарбонил)пиперидин-4-карбоновой кислоты (260 г, 0,93 моль) в 1,3 л метилтрет-бутилового эфира при 30C. Смесь кипятили с обратным холодильником в течение 20 ч и охлаждали до 010C. Добавляли 500 мл воды при 010C, смесь перемешивали в течение 30 мин. Суспензию фильтровали, осадок промывали 1,8 л метил-трет-бутилового эфира. Фильтрат концентрировали до объ- 13020540 ема 3 л при 35C в вакууме. Растворитель заменяли на тетрагидрофуран (1,0 л 2) и концентрировали с получением 212 г указанного в заголовке соединения, чистота 96,8%. 3. 1-Метансульфонил-4-4-[1-(1-трифторметилциклопропилметил)пиперидин-4-илметокси]фенил 1,2,3,6-тетрагидропиридин.[1-(1-Трифторметилциклопропилметил)пиперидин-4-ил]метанол (371 г, 1,56 моль) растворяли в 1,85 л дихлорметана и триэтиламине (237,3 г, 2,34 моль) и смесь охлаждали до 010C. По каплям добавляли метансульфонилхлорид (215 г, 1,2 экв.). Реакционную смесь нагревали до 2025C и перемешивали в течение 1 ч. По каплям добавляли 1,85 л воды. Слои разделяли, водный слой экстрагировали в 1 л дихлорметана. Объединенные органические слои промывали 1,85 л воды, сушили над безводным сульфатом натрия и концентрировали с получением 491 г маслянистой жидкости, которую применяли на следующей стадии в двух различных партиях. Соединение согласно примеру получения 1 (197,8 г, 0,781 моль) растворяли в 1,8 л диметилформамида и охлаждали до 010C. Раствор трет-бутоксида калия (87,6 г, 0,781 моль), растворенного в 1,6 л диметилформамида, добавляли по каплям к раствору, смесь перемешивали при 2030C в течение 30 мин. Раствор [1-(1-трифторметилциклопропилметил)пиперидин-4-ил]метанола (246 г, 0,781 моль) в 0,5 л диметилформамида по каплям добавляли к раствору. Смесь нагревали при 60C и перемешивали в течение 1,5 ч, охлаждали до 3040C и по каплям добавляли 4,4 л воды. Смесь перемешивали при 30C в течение 1 ч и фильтровали. Указанный процесс проводили с двумя навесками [1-(1 трифторметилциклопропилметил)пиперидин-4-ил]метанола, полученные осадки объединяли для очистки. Осадок промывали 800 мл 1:1 смеси диметилформамида и воды. Твердое вещество перемешивали с 4 л дихлорметана и фильтровали. Фильтрат концентрировали и очищали с помощью хроматографии, элюируя дихлорметаном с получением 180 г указанного в заголовке соединения, чистота 99%. (CDCl3, 400 МГц)7,31 (д, 2 Н, J=8,8 Гц), 6,88 (д, 2 Н, J=8,8 Гц), 6,00-5,98 (м, 1H), 3,97 (с, 2H), 3,82 (с, 2H), 3,55-3,52 1. (1-(Трифторметил)циклопропил)метанол. В ледяную суспензию алюмогидрида лития (33,91 ммоль, 1,29 г) в диэтиловом эфире (90 мл) добавляли по каплям в течение 25 мин метил 1-(трифторметил)циклопропанкарбоксилат (16,95 ммоль, 3,00 г) в 30 мл диэтилового эфира. Реакционную смесь перемешивали при 0C в течение 2 ч. Смесь гасили путем медленного добавления 7,5 мл воды, затем 15 мл 5 М гидроксида натрия и 9 мл воды. Густую суспензию интенсивно перемешивали при комнатной температуре в течение 3 ч. Смесь переносили в делительную воронку, разбавляли водой и экстрагировали диэтиловым эфиром. Объединенные органические слои промывали солевым раствором, сушили над сульфатом магния, фильтровали и концентрировали досуха. Получали 2,37 г указанного в заголовке соединения в виде бесцветной маслянистой жидкости. 2,37 г. 1H ЯМР (CDCl3)(м.д.): 0,762-0,807 (м, 2H), 1,018-1,055 (м, 2H), 3,732 (с, 2H). 2. (1-(Трифторметил)циклопропил)метилметансульфонат. Получали, по существу, согласно примеру получения 2 (стадия 1), применяя (1 трифторметилциклопропил)метанол в качестве исходного вещества. 1H ЯМР (CDCl3)(м.д.): 0,921-0,975(м, 2H), 1,182-1,223 (м, 2H), 3,057 (с, 3H), 4,296 (с, 2H). 3. 1-(Метилсульфонил)-4-(4-(1-(1-1-(трифторметил)циклопропил)метил)пиперидин-4-ил)этокси)фенил)-1,2,3,6-тетрагидропиридин. К соединению по примеру получения 5 (изомер 2) (62 мг, 0,169 ммоль), карбонату калия (70 мг,0,506 ммоль) и ацетонитрилу (1,12 мл, 21,46 ммоль) в ампулу добавляли (1(трифторметил)циклопропил)метилметансульфонат (147 мг, 0,675 ммоль). Ампулу герметизировали и нагревали при 110C в течение 16 ч. Реакционную смесь разбавляли дихлорметаном и водой. Органический слой отделяли и промывали солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали в вакууме с получением беловатого твердого вещества. Твердое вещество очищали с помощью флэш-хроматографии на силикагеле с получением 0,057 г белого твердого вещества. МС (m/z) 487,2 (M+1). Пример 12. 2-(1-(Метилсульфонил)-1,2,3,6-тетрагидропиридин-4-ил)-5-1-1-(трифторметил)циклопропил)метил)пиперидин-4-ил)метокси)пиридин К соединению по примеру получения 6 (206 мг, 0,586 ммоль), карбонату калия (243 мг, 1,76 ммоль) и ацетонитрилу (2,93 мл, 56 ммоль) в ампулу, стойкую к микроволновому излучению, добавляли (1(трифторметил)циклопропил)метил метансульфонат (256 мг, 1,17 ммоль). Ампулу, стойкую к микроволновому излучению, герметизировали и нагревали при 140C в течение 2 ч, затем при 150C в течение 30 мин в микроволновом реакторе Biotage. Реакционную смесь разбавляли дихлорметаном и водой. Органический слой отделяли и промывали солевым раствором, сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Остаток растирали с диэтиловым эфиром, собирали указанный в заголовке продукт с помощью вакуумного фильтрования с получением 0,181 г указанного в заголовке соединения. МС (m/z) 474 (M+1). Пример 13. 2-(1-(Метилсульфонил)-1,2,3,6-тетрагидропиридин-4-ил)-5-1-(2,2,2-трифторэтил)пиперидин-4-ил)метокси)пиридин К раствору соединения по примеру получения 6 (0,05 г, 0,14 ммоль) в ацетонитриле (1,50 мл) добавляли карбонат калия (0,07 г, 0,56 ммоль) и 2,2,2-трифторэтилтрифторметансульфонат (0,06 г, 0,28 ммоль). Реакционную смесь нагревали при 85C в течение 1 ч в микроволновом реакторе, охлаждали до комнатной температуры и разбавляли водой. Смесь экстрагировали в этилацетате, объединенные органические экстракты сушили над сульфатом натрия, фильтровали и концентрировали. Остаток очищали с помощью колоночной флэш-хроматографии на силикагеле с получением 30 мг указанного в заголовке соединения в виде беловатого твердого вещества. МС (m/z) 433 (M+1). Исследование активности GPR119 человека. Клеточную линию, стабильно экспрессирующую GPR119 человека в отсутствие индуцирующего промотора, получали из 293 T-REx клеток (Invitrogen). Клеточная линия T-REx (тетрациклинрегулируемая экспрессия) стабильно экспрессирует белок-репрессор тетрациклина и, тем самым, обеспечивает индуцируемую экспрессию исследуемого гена (GPR119) доксициклином. Агонисты рецептораGPR119 человека характеризовали путем измерения увеличения содержания цАМФ в 293 T-REx клетках, экспрессирующих hGPR119. 10000 клеток/лунку помещали в 96-луночный планшет и культивировали в течение 24 ч в DMEM, содержащей 10% эмбриональной сыворотки теленка, 15 мкг/мл Blasticidin и 200 мкг/мл Hygromycin В. На следующий день клетки стимулировали 1 нг/мл Doxycycline в DMEM, не содержащей дополнительно Hygromycin В и Blasticidin. Исследование цАМФ проводили после 18 часового инкубирования с доксициклином. цАМФ определяли путем исследования cAMP HiRange HTRF(Cisbo International). Клетки промывали ФБР и предварительно инкубировали в течение 15 мин с ФБР,содержащим 2 мМ глюкозу, 0,25 мМ IBMX и 0,1% БСА. Добавляли исследуемые соединения, разбавленные в буфере для предварительного инкубирования, и клетки дополнительно инкубировали при комнатной температуре в течение 1 ч. Инкубирование прекращали путем добавления реагентов HTRF, разбавленных в лизисном буфере, затем инкубировали в течение 1 ч и проводили измерения флуоресценции при 620 и 655 нм. Активность агонистов определяли в виде концентрации агониста, которая приводила к 50% активации опосредованного hGPR119 увеличения цАМФ (EC50). Все представленные в примерах соединения исследовали, по существу, согласно представленному выше описанию, как показано, каждое указанное соединение имеет значение EC50 10 нМ. Соединение по примеру 1 имеет значение EC50, равное 4,61 нМ; соединение по примеру 6 имеет значение EC50, равное 0,95 нМ; соединение по примеру 7 имеет значение EC50, равное 2,13 нМ; соединение по примеру 8 имеет значение EC50, равное 1,10 нМ; и соединение по примеру 10 имеет значение EC50, равное 0,95 нМ. Таким образом, показано, что конкретные соединения согласно настоящему изобретению действуют в качестве агонистов GPR119 in vitro. Секреция глюкагон-подобного пептида 1 в клетках GLUTag. Влияние агонистов GPR119 на секрецию глюкагон-подобного пептида 1 (ГПП-1, GLP-1) определяли in vitro в клетках GLUTag. Клетки GLUTag представляют собой энтероэндокринную клеточную линию кишечника умерщвленных мышей, которая управляемо экспрессирует ген препроглюкагон и секрет ГПП-1 (П.Л. Брубакер, Дж. Схлоос, Д.Дж. Друкер (Brubaker P.L., Schloos J., Drucker D.J.) Regulation ofglucagon-like peptide-1 synthesis and secretion in the GLUTag enteroendocrine cell line, Endocrinology, 1998,139:4108-14). Для измерения секреции ГПП-1 15000 клеток/лунку помещали в 96-луночный планшет и инкубировали в течение 3 дней в DMEM, содержащей 10% ЭБС и 1% глутамина. В день эксперимента клетки дважды промывали буфером для инкубирования, EBSS, содержащим 5 мМ глюкозу и 0,1% БСА. 150 мкл буфера для инкубирования, содержащего исследуемые соединения, добавляли в каждую лунку и клетки инкубировали при 37C в течение 2 ч. После инкубирования собирали надосадочную жидкость и фильтровали при помощи 96-луночных фильтрующих планшетов. Содержание ГПП-1 в фильтрате определяли при помощи Mouse/Rat Total GLP-1 Assay (Meso Scale Discovery). Активность агонистов GPR119 при стимуляции секреции ГПП-1 определяли в виде концентрации агониста, которая приводила к 50% увеличению ГПП-1 (EC50). Соединения по примерам 6 и 9 исследовали, по существу, согласно представленному выше описанию и, как показано, указанные соединения имеют соответствующие значения EC50, равные 62,7 и 36,8 нМ. Таким образом, показано, что конкретные соединения согласно настоящему изобретению имеют функциональную активность в качестве агонистов GPR119 in vitro. Биодоступность. Способы определения пероральной биодоступности хорошо изучены в данной области техники. Одной из подобных ссылок является Medicinal Research Reviews, vol. 21 No. 5382-396 (2001). Пероральную биодоступность соединений согласно настоящему изобретению можно оценить, по существу, как показано далее. Применяли группы из трех самцов крыс линии Спраг-Доули массой 250-400 г или собак породы бигль (самцов или самок) массой, равной примерно 10 кг. Животных не требуется подвергать голоданию для "внутривенной" (IV) части исследования. Собакам вводили IV соединения через канюлированную головную вену, образцы крови собирали через яремную вену. Животным сначала вводили IV дозировку 1 мг/кг, затем собирали образцы крови (от 0,1 до 0,2 мл), применяя ЭДТА в качестве антикоагулянта,через 0,0830, 0,25, 0,50, 1, 2, 4, 8, 12 и 24 ч. По меньшей мере через два дня и после ночи голодания животным через зонд перорально вводили дозу 3 мг/кг. Затем собирали образцы крови (от 0,1 до 0,2 мл),применяя ЭДТА в качестве антикоагулянта, через 0,25, 0,50, 1, 2, 4, 6, 8, 12 и 24 ч. В течение исследования общее количество собранной крови (мл) не превышало 1% от общей массы тела в граммах. Концентрации соединения в плазме измеряли с помощью ЖХ/МС/МС исследований. Затем данные анализировали путем стандартного некомпартментного фармакокинетического анализа. Пероральную биодоступность рассчитывали как(AUC0-беск., перор./AUC0-беск., IV)(доза, IV/доза, перор.)100%. Соединение по примеру 6 исследовали, по существу, согласно представленному выше описанию,как показано, указанное соединение имеет пероральную биодоступность, равную 90%, у собак породы бигль. Соединение по примеру 10 исследовали, по существу, согласно представленному выше описанию,как показано, указанные соединения имеют пероральную биодоступность, равную 53%, у крыс линии Спраг-Доули. Таким образом, показано, конкретные соединения согласно настоящему изобретению имеют хорошую пероральную биодоступность. Исследование гастроингибиторного полипептида (ГИП) мышей. Самцов мышей C57BL/6 (возраст 8-10 недель, n=20/уровень дозировки, n=5/момент времени) подвергали голоданию в течение ночи (16 ч), взвешивали на следующее утро, а затем перорально дозировали носитель (1% ГЭЦ) или различные дозы исследуемых веществ, равные 5 мл/кг. Животных умерщвляли путем удушения CO2 в течение 1 мин, затем собирали кровь путем пункции сердца через различные временные интервалы (через 0,5, 1,5, 3 и 6 ч после введения дозы) в пробирки ЭДТА-плазма, содержащие 10 мкл/мл ингибитора DPP4 (Millipore, DPP4-010) и 1,1105 KIU/мл апротинина. Образцы крови выдерживали во льду до отделения плазмы путем центрифугирования при 3000g в течение 5 мин. Полученные образцы плазмы помещали в 96-луночные планшеты и хранили при -20C до проведения анализа. Измерения общего содержания ГИП (проводимые с применением набора Millipore EZRMGIP-55K) проводили для каждого момента времени. Для каждой группы лечения определяли AUC ГИП путем применения формулы трапеции к среднему содержанию ГИП в конкретный момент времени. Активность оценивали путем кусочно-линейной интерполяции выборки рассчитанных AUC ГИП относительно носителя в исследовании влияния дозы. Активность соединения определяли как дозу и/или концентрацию соединения, которая приводит к увеличению, равному 350 пгч/мл относительно AUC ГИП носителя в течение эксперимента. В результате применения способа, по существу, соответствующего описанному выше, доза 10 мг/кг соединения по примеру 3 приводила к увеличению AUC ГИП по сравнению с носителем, равному 762 пгч/мл; доза 10 мг/кг соединения по примеру 10 приводила к увеличению AUC ГИП по сравнению с носителем, равному 762 пгч/мл; и доза 1,6 мг/кг соединения по примеру 6 приводила к увеличению AUC ГИП по сравнению с носителем, равному 422 пгч/мл. Показано, что конкретные соединения согласно настоящему изобретению стимулируют секрецию ГИП in vivo, которая индуцирует секрецию инсулина, представленные данные показывают потенциал применения соединений согласно настоящему изобретению для лечения диабета. Пероральный тест на толерантность к глюкозе (ПТТГ) у мышей. Нормальных мышей C57BL/6 подвергали голоданию в течение ночи, рандомизировали в группы(n=6) и вводили перорально дозу носителя (1% ГЭЦ, 0,25% Tween 80, 0,05% противопенного средства) или 0,9, 2, 6 и 18 мг/кг агониста GPR119, суспендированного в носителе. Через 30 мин после введения соединения мышам перорально вводили 50% раствор декстрозы в дозировке 3 г/кг. Через различное вре- 16020540 мя (0, 20, 40 или 60 мин) мышей удерживали в хлопковых перчатках или бумажных полотенцах и отрезали 1 мм или менее хвоста. Небольшую каплю крови помещали в глюкометры Accu-Chek (модельRoche 22-044217) для измерения глюкозы. Для определения содержания глюкозы в каждом собранном образце применяли три глюкометра, среднее значение представляли в виде конечного значения содержания глюкозы. Площадь под кривой содержания глюкозы в плазме (AUC глюкозы) рассчитывали для каждой группы и процентное снижение AUC глюкозы относительно контрольной группы применяли в качестве меры эффективности соединения для снижения содержанию глюкозы в плазме. Соединение по примеру 6 исследовали, по существу, согласно представленному выше описанию; как показано, указанное соединение имеет улучшенную толерантность к глюкозе. Соединение по примеру 6 не влияло на концентрацию глюкозы в плазме натощак, но значительно снижало концентрацию глюкозы в плазме после приема пищи. Данные показывают, что доза соединения по примеру 6, которая приводит к 50% снижению площади под кривой глюкозы (ED50), равна 0,4 мг/кг. Таким образом, показано, что соединение согласно настоящему изобретению снижает содержание глюкозы в плазме in vivo, что определяет потенциал применения соединений согласно настоящему изобретению для лечения диабета. Длительное лечение мышей с алиментарным ожирением (DIO). Самцов мышей C57/BL6 с DIO держали на высококалорийной диете, самцы имели свободный доступ к еде и воде в течение по меньшей мере 2 недель перед рандомизацией на группы по весу (n=8) и лечением. Животных помещали в отдельные клетки с контролируемой температурой (24C) с циклом 12 ч свет/12 ч темнота. Массы тела находились в диапазоне 34-40 г. Мышам вводили один раз в день носитель (1% ГЭЦ), 30 мг/кг агониста GPR119, 30 мг/кг ингибитора DPPIV или комбинации 30 мг/кг агонистаGPR119 и 30 мг/кг ингибитора DPPIV. Лечение продолжали в течение 3 недель. Массу пищи и тела измеряли ежедневно перед началом периода темноты. Для каждого животного рассчитывали суммарное изменение массы тела в виде масса тела в каждый день минус масса тела перед началом лечения и представляли в виде среднего значения для группы. Количество потребляемой пищи измеряли ежедневно для каждого животного и складывали с количеством пищи, употребленной данным животным за все предыдущие дни, для получения суммарного потребления пищи, которое затем усредняли по группе. В конце исследования ПТТГ проводили после ночного голодания. Соединение по примеру 6 исследовали, по существу, согласно представленному выше описанию,при этом ингибитор DPPIV представлял собой ситаглиптин. Ситаглиптин индивидуально не изменял массу тела или потребление пищи в указанном исследовании. Соединение по примеру 6 приводило к умеренному снижению потребления пищи и массы тела, наблюдаемому только в течение первой недели лечения. Комбинация ситаглиптина и соединения по примеру 6 приводила к значительному снижению массы тела и потребления пищи, которое сохранялось на протяжении всего исследования. Соединение по примеру 6 индивидуально или в комбинации с ситаглиптином незначительно изменяло содержание глюкозы в плазме в указанной модели. Таким образом, показано, что соединение согласно настоящему изобретению снижает потребление пищи и массу тела, что определяет потенциал для применения соединений согласно настоящему изобретению для лечения ожирения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулыRb и Rc независимо выбраны из F и метила или объединены с образованием С 3-5-циклоалкильного кольца;R2 выбран из H и F,или его фармацевтически приемлемая соль. 2. Соединение по п.1 или его фармацевтически приемлемая соль, где Rb и Rc независимо выбраны из F и метила или объединены с образованием C3-циклоалкила. 3. Соединение по любому из пп.1 или 2 или его фармацевтически приемлемая соль, где Rb и Rc представляют собой метил или объединены с образованием C3-циклоалкила. 4. Соединение по любому из пп.1-3 или его фармацевтически приемлемая соль, где Ra представляет собой CF3. 5. Соединение по любому из пп.1-4 или его фармацевтически приемлемая соль, где R2 представляет собой H. 6. Соединение по п.1 или его фармацевтически приемлемая соль, выбранное из 5-[1-(2-фтор-2 метилпропил)пиперидин-4-илметокси]-1'-метансульфонил-1',2',3',6'-тетрагидро[2,4']бипиридинила и 1 метансульфонил-4-4-[1-(1-трифторметилциклопропилметил)пиперидин-4-илметокси]фенил-1,2,3,6 тетрагидропиридина. 7. Фармацевтическая композиция, содержащая соединение по любому из пп.1-6 или его фармацевтически приемлемую соль и фармацевтически приемлемый разбавитель или носитель. 8. Фармацевтическая композиция по п.7, дополнительно содержащая метформин или ингибитор дипептидилпептидазы IV (DPPIV). 9. Фармацевтическая композиция по п.8, где ингибитор DPPIV представляет собой ситаглиптин. 10. Применение соединения по любому из пп.1-6 или его фармацевтически приемлемой соли в терапии для лечения диабета или ожирения. 11. Применение по п.10 для лечения диабета II типа.
МПК / Метки
МПК: A61K 31/4427, C07D 401/12, C07D 401/14, A61P 3/10
Код ссылки
<a href="https://eas.patents.su/19-20540-agonisty-gpr119.html" rel="bookmark" title="База патентов Евразийского Союза">Агонисты gpr119</a>
Следующий патент: Адсорбционная сушильная машина и способ ее эксплуатации
Случайный патент: Источник бесперебойного питания.












