Гетероциклические соединения и их применение
Номер патента: 17389
Опубликовано: 28.12.2012
Авторы: Хао Сяолинь, Гонзалес Лопез Де Турисо Феликс, Рзаса Роберт М., Чжан Давей, Кашинг Тимоти Д., Чэнь И., Лукас Брайан, Хе Сяо, Райкельт Андреас, Шинь Янгсук, Макги Лоуренс Р., Дюкетт Джейсон А., Сеганиш Дженнифер
Формула / Реферат
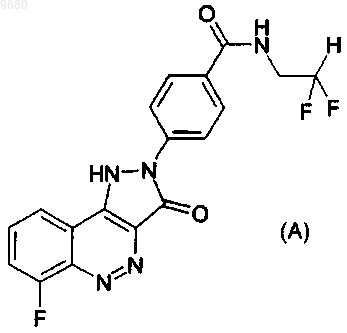
1. Соединение, имеющее структуру
или его фармацевтически приемлемая соль.
2. Фармацевтическая композиция, содержащая соединение по п.1 и фармацевтически приемлемый разбавитель или носитель.
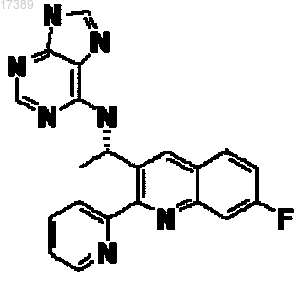
3. Соединение, имеющее структуру
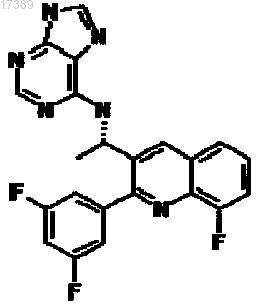
или его фармацевтически приемлемая соль.
4. Фармацевтическая композиция, содержащая соединение по п.3 и фармацевтически приемлемый разбавитель или носитель.
5. Соединение, имеющее структуру
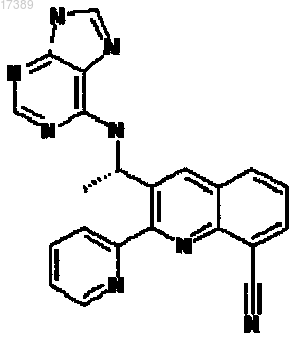
или его фармацевтически приемлемая соль.
6. Фармацевтическая композиция, содержащая соединение по п.5 и фармацевтически приемлемый разбавитель или носитель.
Текст
Изобретение относится к соединениям с приведенными ниже формулами или их фармацевтически приемлемым солям, а также фармацевтическим композициям, содержащим эти соединения и фармацевтически приемлемый разбавитель или носитель. Соединения настоящего изобретения полезны для лечения общего воспаления, артрита, ревматизма,остеоартрита, воспалительных заболеваний кишечника, воспалительных заболеваний глаз,воспалений или нестабильных заболеваний мочевого пузыря, псориаза, заболеваний кожи с воспалительными элементами, хронических воспалительных заболеваний, включающих,но не ограничивающихся этим, аутоиммунные заболевания, такие как системная красная волчанка (SLE), кинестезия, ревматоидный артрит, острый рассеянный энцефаломиелит,идиопатическая тромбоцитопеническая пурпура, болезнь Шарко-Вюльпиана, синдром Шегрена и аутоиммунная гемолитическая анемия, аллергических состояний, включающих все формы гиперчувствительности, раковых заболеваний, опосредованных, зависящих или связанных сp110 активностью, которые включают, но не ограничиваются этим, лейкемии, такие как острая лейкемия, миелоидную лейкемию (AML), миелодиспластический синдром (MDS),миелопролиферативные заболевания (MPD), хроническую миелоидную лейкемию (CML), Тклеточный острый лимфобластный лейкоз (T-ALL), В-клеточную лимфобластную лейкемию (BALL), неходжкинскую лимфому (NHL), В-клеточную лимфому и твердые опухоли, такие как рак молочной железы. Чэнь И., Кашинг Тимоти Д., Дюкетт Джейсон А., Гонзалес Лопез Де Турисо Феликс, Хао Сяолинь, Хе Сяо, Лукас Брайан, Макги Лоуренс Р., Райкельт 017389 Область техники, к которой относится изобретение Настоящее изобретение в целом относится к ферменту фосфатидилинозитол-3-киназе (PI3K), в частности к селективным ингибиторам активности PI3K, и применению таких соединений. Сведения о предшествующем уровне техники Клеточная сигнализация через 3'-фосфорилированные фосфоинозитиды вовлечена во множество клеточных процессов, например в малигнизацию, передачу сигналов факторов роста, воспаление и иммунитет (для обзора см. Rameh et al., J. Biol. Chem., 274:8347-8350 (1999. Фермент, ответственный за генерирование этих фосфорилированных сигнальных продуктов, фосфатидилинозитол-3-киназа (PI3 киназа; PI3K), первоначально идентифицировался как активность, связанная с вирусными онкобелками и тирозинкиназным рецептором фактора роста, который фосфорилирует гидроксильную группу фосфатидилинозитола (PI) и его фосфорилированные производные в положении 3 кольца инозитола (Pnayotou etal., Trends Cell. Biol. 2:358-60 (1992. Уровни фосфатидилинозитол-3,4,5-трифосфата (PIP3), начального продукта активации PI3-киназы,возрастают при воздействии на клетки разных стимулов. Это включает сигнализацию через рецепторы для большинства факторов роста и много воспалительных стимулов, гормонов, нейротрансмиттеров и антигенов, и, таким образом, активация PI3Ks является одним, если не самым важным, элементом передачи сигнала, связанным с активацией рецептора на клеточной поверхности млекопитающего (Cantley,Science, 296:1655-1657 (2002); Vanhaesebroeck et al. Annu. Rev. Biochem., 70:535-602 (2001. АктивацияPI3-киназы, следовательно, является вовлеченной в широкий диапазон клеточных ответов, включающих рост клетки, миграцию, дифференциацию и апоптоз (Parker et al., Current. Biology, 5:577-99 (1995); Yao etal., Science, 267:2003-05 (1995. Хотя нижележащие мишени фосфорилированных липидов, генерирующих последующую активацию PI3-киназы, изучены не полностью, известно, что белки, содержащие плекстрин-гомологичный РН-домен и FYVE-finger домен, активируются при связывании с различными фосфатидилинозитольными липидами (Sternmark et al., J. Cell. Sci., 112:4175-83 (1999); Lemmon et al.,Trends Cell. Biol., 7:237-42 (1997. Две группы РН-домена, содержащие эффекторы PI3K, были изучены в отношении сигнализации иммунных клеток, членов Tec семейства тирозинкиназ и серин/треонин киназ(3,4,5)Р 3, включают Tec, Btk, Itk и Etk. Связывание PH с PIP3 является критическим для тирозинкиназной активности членов Тес семейства (Schaeffer and Schwartzberg, Curr. Opin. Immunol. 12:282-288 (2000. Члены AGC семейства, которые регулируются PI3K, включают фосфоинозитид-зависимую киназу(PDK1), AKT (также называемую как PKB) и определенные изоформы протеин киназы С (PKC) и S6 киназы. Существует три изоформы AKT, и активирование AKT тесно связано с PI3K-зависимой пролиферацией и сигналами для выживания. Активирование AKT зависит от фосфорилирования PDK1, которая также имеет 3-фосфоинозитид-селективный РН-домен для привлечения ее в мембрану, где она взаимодействует с AKT. Другими важными PDK1 субстратами являются PKC и S6 киназа (Deane and Fruman,Annu. Rev. Immunol. 22, 563-598 (2004. In vitro некоторые изоформы протеинкиназы С (PKC) непосредственно активируются PIP3 (Burgering et al., Nature, 376:599-602 (1995. В настоящее время семейство PI3-киназ разделено на три класса на основе их субстратных специфичностей. Класс I PI3Ks может фосфорилировать фосфатидилинозитол (PI), фосфатидилинозитол-4 фосфат и фосфатидилинозитол-4,5-бифосфат (PIP2) для получения фосфатидилинозитол-3-фосфата(PIP), фосфатидилинозитол-3,4-бифосфата и фосфатидилинозитол-3,4,5-трифосфата соответственно. Класс II PI3Ks фосфорилирует PI и фосфатидилинозитол-4-фосфат, в то время как класс III PI3Ks может фосфорилировать только PI. Начальная очистка и молекулярное клонирование PI3-киназы показали, что она является гетеродимером, состоящим из р 85 и р 110 субъединиц (Otsu et al., Cell, 65:91-104 (1991); Hiles et al., Cell, 70:419-29(1992. Позже были идентифицированы четыре отдельных PI3Ks класса I, обозначенные как PI3K , ,и , при этом каждая из них состоит из отдельной 110 kDa каталитической субъединицы и регуляторной субъединицы. В частности, каждая из трех каталитических субъединиц, а именно p110, p110 и p110,взаимодействует с одной и той же регуляторной субъединицей, р 85; тогда как р 110 взаимодействует с отдельной регуляторной субъединицей, р 101. Как было описано выше, картины экспрессии каждой из этих PI3Ks в человеческих клетках и тканях также являются индивидуальными. Хотя в недавнем прошлом было накоплено много информации по клеточным функциям PI3-киназ в целом, роли, выполняемые индивидуальными изоформами, остаются до сих пор не полностью изученными. Было описано клонирование бычьей р 110. Этот белок был идентифицирован как относящийся к белку дрожжей Saccharomyces cerevisiae: Vps34p, белку, вовлеченному в процессинг вакуолярного белка. Рекомбинантный р 110 продукт также показал связывание с р 85 для достижения активности PI3K в трансфицированных COS-1 клетках. См. Hiles et al., Cell, 70, 419-29 (1992). Клонирование второй человеческой р 110 изоформы, обозначенной как р 110, описано в Hu et al.,Mol. Cell Biol., 13:7677-88 (1993). Считается, что эта изоформа связывается с р 85 в клетках и является убиквитарно экспрессированной, поскольку p110 mRNA был обнаружен в многочисленных тканях человека и мыши, а также в эндотелиальных клетках пупочной вены человека, лейкозных Т-клеточных-1 017389 линиях Jurkat, клетках эмбриональной почки человека линии 293, фибробласте мыши линии 3 Т 3, клеткахHeLa и клетках NBT2 злокачественной опухоли мочевого пузыря крысы. Такая широкая экспрессия предполагает, что эта изоформа является очень важной в путях сигнализации. Идентификация изоформы p110 PI3-киназы описана в Chantry et al., J. Biol. Chem., 272:19236-41(1997). Наблюдалось, что человеческая изоформа p110 экспрессирована ограничивающим ткани образом. Она экспрессирована на высоком уровне в лимфоцитах и лимфоидных тканях и играет ключевую роль в опосредованной киназой сигнализации в иммунной системе (AI-Alwan et al. JI 178:2328-2335(2007); Okkenhaug et al. JI, 177:5122-5128 (2006); Lee et al. PNAS, 103:1289-1294 (2006. Также было доказано, что p110 экспрессируется на низких уровнях в клетках молочной железы, меланоцитах и эндотелиальных клетках (Vogt et al. Virology, 344:131-138 (2006) и, следовательно, является вовлеченной в наделение раковых клеток молочной железы селективными миграционными свойствами (Sawyer et al.Cancer Res. 63:1667-1675 (2003. Подробности, касающиеся p110 изоформы, также можно найти в Американском патенте 568586753; 5822910 и 5985589. См. также Vanhaesebroeck et al., Proc Nat. Acad. Sci.USA, 94:4330-5 (1997) и международную публикацию WO 97/46688. В каждой из PI3K,исубъединиц р 85 субъединица способствует локализации PI3-киназы к плазматической мембране путем взаимодействия ее SH2 домена с фосфорилированными тирозиновыми остатками (присутствующими в соответствующих аминокислотных последовательностях) в белкахмишенях (Rameh et al., Cell, 83:821-30 (1995. Было идентифицировано пять изоформ р 85 (р 85, р 85,р 55, р 55 и р 50), кодируемых тремя генами. Альтернативные транскрипты гена Pik3rl кодируют белки р 85, р 55 и р 50 (Deane and Fruman, Annu. Rev. Immunol. 22:563-598 (2004. р 85 является убиквитарно экспрессированным, в то время как р 85 изначально был обнаружен в мозге и лимфоидных тканях(Volinia et al., Oncogene, 7:789-93 (1992. Связывание р 85 субъединицы с каталитическими субъединицами PI3-киназы p110,илиоказалось необходимым для каталитической активности и стабильности этих энзимов. К тому же, связывание Ras белков также повышающе регулировало активность PI3 киназы. Клонирование p110 выявило сложность внутри семейства PI3K энзимов (Stoyanov et al., Science,269:690-93 (1995. Изоформа p110 является близкородственной с р 110 и p110 (45-48% идентичности в каталитическом домене), но, как отмечается, не использует р 85 в качестве поставляющей субъединицы. Вместо этого, p110 связывает р 101 регуляторную субъединицу, которая также связывается ссубъединицами гетеротримерных G протеинов. р 101 регуляторная субъединица для PI3K была изначально клонирована у свиней и человеческий ортолог был идентифицирован впоследствии (Krugmann et al., J.Biol. Chem., 274:17152-8 (1999. Известно, что взаимодействие между N-концевой областью p101 сN-концевой областью p101 активирует PI3K через G. Недавно был идентифицирован p101-гомолог,р 84 или p87PIKAP (PI3K адаптерный белок 87 kDa), который связывает p110 (Voigt et al. JBC, 281:99779986 (2006), Suire et al. Curr. Biol. 15:566-570 (2005. p87PIKAP является гомологичным p101 в областях,которые связывают p110 и G, и также опосредует активацию p110 в направлении сопряженных с Gбелком рецепторов. В отличие от р 101, p87PIKAP является высокоэкспрессированным в сердце и может быть решающим для PI3K сердечной функции. Описание конститутивно активного полипептида PI3K представлено в международной публикацииWO 96/25488. Эта публикация раскрывает приготовление химерного белка, в котором 102-остататочный фрагмент р 85, известный как интер-SH2 (iSH2) область, является слитой через линкерную область сN-концом р 110 мыши. iSH2 домен р 85 очевидно способен активировать PI3K активность, сравнимую с интактной р 85 (Klippel et al., Mol. Cell Biol., 14:2675-85 (1994. Таким образом, PI3-киназы могут быть определены по их аминокислотной идентичности или по их активности. Дополнительные члены этого растущего семейства генов включают более дальние родственные липидные и протеиновые киназы, включающие Vps34 TOR1 и TOR2 дрожжей SaccharomycesPI3-киназа также вовлечена в ряд аспектов активации лейкоцитов. р 85-ассоциированная PI3 киназная активность показала физическую связь с цитоплазменным доменом CD28, который является важной костимулирующей молекулой для активации Т-клеток в ответ на антиген (Pages et al., Nature,369:327-29 (1994); Rudd, Immunity, 4:527-34 (1996. Активация T-клеток через CD28 понижает порог для активации антигеном и увеличивает интенсивность и продолжительность пролиферативного ответа. Эти эффекты связаны с увеличениями в считывании количества генов, включая интерлейкин-2 (IL-2), важный фактор роста T-клетки (Fraser et al., Science, 251:313-16 (1991. Мутация CD28, при которой он не может более взаимодействовать с PI3-киназой, приводит к неудаче в инициировании производства IL-2,предполагая решающую роль PI3-киназы в активации Т-клеток.-2 017389 Специфические ингибиторы в отношении индивидуальных членов семейства энзимов обеспечивают действенные инструменты для расшифровки функций каждого энзима. Два соединения, LY294002 и вортманнин, широко использовались в качестве ингибиторов PI3-киназы. Эти соединения, тем не менее,являются неспецифическими ингибиторами PI3K, поскольку они не различаются среди четырех членов класса I PI3-киназ. Например, величины IC50 для вортманнина в отношении каждой из разных PI3-киназ класса I находятся в диапазоне 1-10 нМ. Аналогично, значения IC50 для LY294002 в отношении каждой из этих PI3-киназ составляют примерно 1 мкМ (Fruman et al., Ann. Rev. Biochem., 67:481-507 (1998. Поэтому использование этих соединений в изучении роли индивидуальных PI3-киназ класса I является ограниченным. На основании исследования с использованием вортманнина можно предположить, что функция PI3 киназы также требуется для некоторых аспектов сигнализирования лейкоцитов через рецепторы, сопряженные с G-белком (Thelen et al., Proc. Natl. Acad. Sci. USA, 91:4960-64 (1994. Более того, было показано, что вортманнин и LY294002 блокируют миграцию нейтрофилов и супероксидное высвобождение. Однако, поскольку все эти соединения не различаются среди разных изоформ PI3K, из этих исследований остается не ясно, какая конкретная изоформа PI3K или изоформы вовлечены в эти процессы и какие функции в целом выполняют разные энзимы класса I PI3K как в нормальных, так и пораженных тканях. До недавнего времени коэкспрессия нескольких изоформ PI3K в большинстве тканей мешала усилиям по выделению активности каждого энзима. Разделение активностей разных изоферментов PI3K было недавно успешно проведено благодаря развитию генетически модифицированной мыши, что позволило изучить изоформ-специфичные нокаутные и kinase-dead (KD) трансгенные мыши, а также разработать более селективные ингибиторы для некоторых разных изоформ. p110 и p110 нокаутных мышей были генерированы и являются эмбрионально летальными, и из этих мышей может быть получено мало информации относительно экспрессии и функций p110 и(Bi et al. Mamm. Genome, 13:169-172 (2002); Bi et al. J. Biol. Chem. 274:10963-10968(1999. Позднее, p110 kinase-dead (KD) трансгенных мышей были генерированы с помощью простой мутации в DFG мотиве АТР связывающего "кармана" (p110D933A), который уменьшает киназную активность, но сохраняет экспрессию мутантной p110 киназы. В отличие от нокаутной мыши, принцип нокин сохраняет стехиометрию сигнальных комплексов, поддерживающие функции и имитирует приближение маленьких молекул более реалистично, чем нокаутные мыши. Аналогично, p110 нокаутной мыши, p110D933A гомозиготной мыши являются эмбрионально летальными. Однако гетерозиготные мыши являются жизнеспособными и детородными, но проявляют ослабленное сигнализирование через белки IRS (субстрат инсулинового рецептора), ключевые медиаторы инсулина, инсулин-подобный фактор роста-1 и действие лептина. Нарушенная отвечаемость на эти гормоны приводит к гиперинсулинемии, толерантности к глюкозе, булимии, увеличению ожирения и снижению общего роста у гетерозигот(Foukas, et al. Nature, 441:366-370 (2006. Эти исследования показали определенную, не избыточную роль p110 в качестве промежуточного продукта в IGF-1, инсулиновой и лептиновой сигнализации, который не замещен другими изоформами. Надлежит рассмотреть описание p110 kinase-dead (KD) трансгенной мыши для дальнейшего понимания функции этой изоформы (мышь была приготовлена, но еще не опубликована; Vanhaesebroeck).p110 нокаутной и kinase-dead (KD) трансгенной мыши были генерированы и в целом показали аналогичные и мягкие фенотипы с начальными дефектами в миграции клеток врожденной иммунной системы и дефектом в развитии тимусных Т-клеток (Li et al. Science, 287:1046-1049 (2000), Sasaki et al. Science,287:1040-1046 (2000), Patrucco et al. Cell, 118:375-387 (2004. Аналогично, p110, PI3K дельта нокаутные и kinase-dead (KD) трансгенные мыши были приготовлены и были жизнеспособными с мягкими и похожими фенотипами. p110D910A мутантной трансгенной мыши показала важную роль дельта в B-клеточном развитии и функционировании, с практически необнаруженными B-клетками маргинальной зоны и CD5+ В 1-клетками и сигнализированием через В- и Т-клеточные рецепторы для антигена (Clayton et al. J. Exp. Med. 196:753-763 (2002); Okkenhaug et al.Science, 297:1031-1034 (2002. p110D910A мыши была тщательно изучена и выявила иную роль дельты в иммунной системе. Т-клеточно-зависимый и Т-клеточно-независимый иммунные отклики являются значительно ослабленными в p110D910A и секреция ТН 1 (INF-) и ТН 2 цитокина (IL-4, IL-5) являются нарушенными (Okkenhaug et al. J. Immunol. 177:5122-5128 (2006. Недавно было представлено описание пациента с мутацией p110. Тайваньский мальчик с первичным В-клеточным иммунодефицитом и гаммагипоглобулинемией ранее неизвестной этиологии, представленной заменой одной пары нуклеотидов,m.3256G на А в 1021 кодоне 24 экзона p110. Эта мутация вызывала миссенс аминокислотное замещение(от Е к K) в кодоне 1021, который расположен в высококонсервативном каталитическом домене белкаp110. Пациент не имеет других выявленных мутаций, и, насколько было изучено, его фенотип согласуется с дефицитом p110 у мыши (Jou et al. Int. J. Immunogenet. 33:361-369 (2006.-3 017389 Изоформ-селективные низкомолекулярные соединения были разработаны с переменным успехом для всех изоформ киназ класса I PI3 (Ito et al. J. Pharm. Exp. Therapeut., 321:1-8 (2007. Ингибиторы альфа являются предпочтительными, потому что мутации р 110 были идентифицированы в нескольких твердых опухолях; например, амплификационная система для выявления мутации альфы связана с 50% овариальным, цервикальным, легочным раком и раком молочной железы, и активированная мутация была описана в более чем 50% колоректального рака и 25% рака молочной железы (Hennessy et al. NatureReviews, 4:988-1004 (2005. Yamanouchi было разработано соединение YM-024, которое равносильно ингибирует альфа и дельта и является 8- и 28-кратно селективным по отношению к бета и гамма соответственно (Ito et al. J. Pharm. Exp. Therapeut, 321:1-8 (2007.(2005, и специфичные для этой изоформы низкомолекулярные ингибиторы могут использоваться впоследствии для показателя, включающего нарушения свертывания крови (TDX-221:0.007 uM на бета; в 14 раз селективнее дельта и более чем в 500 раз селективнее гамма и альфа) (Ito et al. J. Pharm. Exp.Therapeut., 321:1-8 (2007. Селективные соединения для р 110 разработаны в виде нескольких групп иммуннодепрессивных препаратов для аутоиммунных заболеваний (Rueckle et al. Nature Reviews, 5:903-918 (2006. Следует отметить, что AS 605240 проявил эффективность при моделировании на мышах ревматоидного артрита(Camps et al. Nature Medicine, 11:936-943 (2005 и задержал начало заболевания при моделировании системной красной волчанки (Barber et al. Nature Medicine, 11:933-935 (205. Дельта-селективные ингибиторы также были недавно описаны. Самые селективные соединения включают хиназолиноновые пуриновые ингибиторы (PIK39 и IC 87114). IC 87114 ингибирует p110 в высоком наномолекулярном диапазоне (трехзначный) и имеет более чем 100-кратную селективность относительно р 110, 52-кратную селективность относительно p110, но имеет недостаточную селективность относительно p110 (примерно 8-кратную). Это свидетельствует об отсутствии активности относительно любых тестированных протеинкиназ (Knight et al. Cell, 125:733-747 (2006. С помощью дельта-селективных соединений или генетически модифицированной мыши(p110D910A) было доказано, что дополнительно к ключевой роли в В- и T-клеточной активации дельта является также частично вовлеченной в миграцию нейтрофилов и в начальный нейтрофильный окислительный всплеск и приводит к частичной блокировке антиген/IgE-опосредованной дегрануляции тучных клеток (Condliffe et al. Blood, 106:1432-1440 (2005); Ali et al. Nature, 431:1007-1011 (2002. Поэтому р 110 выступает как важный медиатор многих ключевых воспалительных ответов, которые также участвуют в аберрантных воспалительных состояниях, включающих, но не ограничивающихся этим, аутоиммунные заболевания и аллергию. В поддержку этой идеи существует большое количество данных целевой проверки p110, полученных в результате исследования с использованием как генетических инструментов, так и фармакологических агентов. Таким образом, использование дельта-селективного соединения IC 87114 и p110D910A мыши, Ali et al. (Nature, 431:1007-1011 (2002 показало, что дельта играет критическую роль в мышиной модели аллергических заболеваний. В отсутствие функциональной дельты пассивная кожная анафилаксия (РСА) является значительно сниженной и может быть приписана снижению аллергена-IgE, индуцирующего активацию тучных клеток и дегрануляцию. К тому же, ингибирование дельты с помощью IC 87114 показало значительное подавление воспаления и заболевания в мышиной модели астмы, использующей овальбумин-индуцированное воспаление дыхательных путей (Lee etp110D910A мутантной мыши с помощью той же модели аллергического воспаления дыхательных путей разными группами (Nashed et al. Eur. J. Immunol. 37:416-424 (2007. Существует потребность в дальнейшем исследовании функции PI3K в воспалительных и аутоиммунных ситуациях. Более того, для понимания PI3K требуется дальнейшее исследование структурных взаимодействий р 110 как с его регуляторной субъединицей, так и с другими белками в клетке. Также остается потребность в более активных и селективных или специфических ингибиторах PI3K для того,чтобы избежать возможной токсикации, связанной с активностью на изомерах р 110 (инсулиновая сигнализация) и(активация тромбоцитов). В частности, селективные или специфические ингибиторыPI3K являются желательными для выполнения роли этого изофермента в дальнейшем и для развития отличных фармацевтических препаратов для моделирования активности изофермента.-4 017389 Сущность изобретения Настоящее изобретение относится к соединениям, представленным приведенными ниже формулами, или их фармацевтически приемлемым солям, которые являются эффективными для ингибирования биологической активности человеческой PI3K: Другим аспектом изобретения является обеспечение соединений, которые ингибируют PI3K селективно, несмотря на то, что имеют относительно низкий ингибирующий потенциал по сравнению с другими изоформами PI3K. Другим аспектом изобретения являются фармацевтические композиции, содержащие указанные выше соединения. Другие аспекты и преимущества изобретения будут очевидны для среднего специалиста данной области. Сведения, подтверждающие возможность осуществления изобретения Один аспект изобретения относится к соединению, имеющему структуру или его любой фармацевтически приемлемой соли. Другой аспект изобретения относится к соединению, имеющему следующую структуру: или его любой фармацевтически приемлемой соли. Другой аспект изобретения относится к соединению, имеющему следующую структуру: или его фармацевтически приемлемой соли. Другой аспект изобретения относится к фармацевтической композиции, включающей соединение согласно любому из приведенных выше вариантов и фармацевтически приемлемый разбавитель или носитель. Изобретение относится к лечению PI3K-опосредованных состояний и нарушений. В определенных вариантах PI3K-опосредованные состояния или нарушения являются выбранными из ревматоидного артрита, анкилозирующего спондилита, остеоартрита, псориатического артрита, псориаза, воспалительных заболеваний и аутоиммунных заболеваний. В других вариантах PI3K-опосредованное состояние или нарушение выбрано из сердечно-сосудистых заболеваний, атеросклероза, гипертонии, глубокого венозного тромбоза, инсульта, инфаркта миокарда, нестабильной стенокардии, тромбоэмболизма, эмболии легких, тромболитических заболеваний, острой артериальной непроходимости, тромботической окклюзии и болезни коронарных артерий. В еще других вариантах PI3K-опосредованное состояние или нарушение является выбранным из рака, рака толстой кишки, глиобластомы, эндометриального рака, печеночно-клеточного рака, рака легких, меланомы, рака почки, рака щитовидной железы, клеточной лим-5 017389 фомы, лимфопролиферативных заболеваний, мелкоклеточного рака легкого, плоскоклеточного рака легкого, глиомы, рака молочной железы, рака предстательной железы, рака яичников, рака шейки матки и лейкемии. В еще других вариантах PI3K-опосредованные состояния или нарушения являются выбранными из диабета II типа. В еще других вариантах PI3K-опосредованные состояния или нарушения являются выбранными из респираторных заболеваний, бронхита, астмы и хронического обструктивного заболевания легких. В определенных вариантах объектом является человек. Изобретение также относится к лечению ревматоидного артрита, анкилозирующего спондилоартрита, остеоартрита, псориатического артрита, псориаза, воспалительных заболеваний или аутоиммунных заболеваний, включающему этап введения компонента согласно любому вышеприведенному варианту. Изобретение также относится к лечению ревматоидного артрита, анкилозирующего спондилоартрита, остеоартрита, псориатического артрита, псориаза, воспалительных заболеваний и аутоиммунных заболеваний, воспалительных заболеваний кишечника, воспалительных заболеваний глаз, воспалительных или нестабильных мочеиспусканий, заболеваний кожи с воспалительными составляющими, хронических воспалительных состояний, аутоиммунных заболеваний, системной красной волчанки (SLE),миастении, ревматоидного артрита, острого рассеянного энцефаломиелита, идиопатической тромбоцитопенической пурпуры, болезни Шарко-Вюльпиана, синдрома Шегрена и аутоиммунной гемолитической анемии, аллергических состояний и гиперчувствительности, включающему этап введения соединения согласно любому из приведенных выше или ниже вариантов. Изобретение также относится к лечению раковых заболеваний, которые являются опосредованными, зависимыми или связанными с p110 активностью, включающему этап введения соединения согласно любому из приведенных выше или ниже вариантов. Изобретение также относится к лечению раковых заболеваний, выбранных из острого миелолейкоза, миелодиспластического синдрома, миелопролиферативных заболеваний, хронического миелолейкоза,Т-клеточного острого лимфобластного лейкоза, В-клеточного острого лимфобластного лейкоза, неходжкинской лимфомы, В-клеточной лимфомы, твердых опухолей и рака молочной железы, включающему этап введения соединения согласно любому из приведенных выше или ниже вариантов. Соединения настоящего изобретения могут иметь в целом несколько асимметричных центров и обычно изображаются в виде рацемических смесей. Настоящее изобретение охватывает рацемические смеси, частично рацемические смеси и отдельные энантиомеры и диастереомеры."Фармацевтически приемлемая соль" означает соль, приготовленную обычными и хорошо известными опытным в данной области специалистам способами. "Фармакологически приемлемые соли" включают основные соли неорганических и органических кислот, включающих, но не ограничивающихся этим, соляную, серную, фосфорную, метансульфоновую, этансульфоновую, оксиянтарную, уксусную,щавелевую, винную, лимонную, молочную, фумаровую, янтарную, малеиновую, салициловую, бензойную, фенилуксусную, миндальную кислоты и подобные. Когда соединения изобретения включают кислотную функцию, такую как карбоксильная группа, в этом случае пригодные фармацевтически приемлемые пары катионов для карбоксильной группы являются хорошо известными опытным в данной области специалистам и включают щелочные, щелочно-земельные, аммониевые, четвертичные аммониевые катионы и подобные. Дополнительные примеры "фармакологически приемлемых солей" см. ниже иBerge et al., J. Pharm. Sci. 66:1 (1977). Следует отметить, что соединения изобретения могут содержать группы, которые могут существовать в таутометрических формах, таких как циклические или ациклические амидиновые и гуанидиновые группы, замещенные гетероатомами гетероарильные группы (Y'=О, S, NR), и подобные, которые проиллюстрированы в следующих примерах: и хотя в качестве примера приведена, описана, изображена и/или заявлена здесь одна форма, все таутометрические формы могут быть включены в такое название, описание, изображение и/или формулу.-6 017389 Экспериментальная часть Используются следующие сокращения: водн. - водный;EtOAc - этиловый эфир уксусной кислоты;THF - тетрагидрофуран. Общая информация. Реагенты и растворители, использующиеся ниже, могут быть получены коммерческим путем. Спектры 1 Н-ЯМР регистрировали на спектрометре ЯМР фирмы Bruker частотой 400 и 500 МГц. Значительные пики группировали в следующем порядке: мультиплетность (s, синглет; d, дуплет; t, триплет; q,квартет; m, мультиплет; br s, широкий синглет), константа(ы) взаимодействия в герцах (Гц) и число протонов. Результаты масс-спектрометрии представлены в виде соотношения массы к заряду с относительно большим содержанием каждого йона (в скобках ESI масс-спектрометрический анализ с ионизацией электрораспылением выполнялся на масс-спектрометре Agilent 1100 Series LC/MSD). Все соединения могут быть проанализированы в режиме ESI положительных ионов с использованием мобильной фазы ацетонитрил:вода, содержащая 0,1% муравьиной кислоты. Аналитическую обращенно-фазовую ВЭЖХ выполняли на жидкостном хроматографе Agilent 1200 серии на колонке Agilent Eclipse XDB-C18 5 мкм(4,6150 мм) в качестве неподвижной фазы и элюировали смесью ацетонитрил:H2O с 0,1% TFA. Обращенно-фазовая полупрепаративная ВЭЖХ проводилась на Agilent 1100 Series на колонке С 18Phenomenex Gemini 10 мкм (25021,20 мм) в качестве неподвижной фазы и элюировали смесью ацетонитрил:Н 2 О с 0,1% TFA. Способ А. Смесь 2-хлорхинолин-3-карбальдегида (1 экв.), арилбориновой кислоты (1,1 экв.), тетракис(трифенилфосфин)палладия (5 мол.%) и карбоната натрия (2 М водн. р-р, 5,0 экв.) в CH3CN-вода (3:1, 0,1 М) нагревали при 100 С в атмосфере N2 в течение нескольких часов. Смесь разделяли между EtOAc иH2O, органический слой отделяли и водный слой экстрагировали EtOAc. Объединенные органические слои высушивали над Na2SO4, фильтровали, концентрировали при пониженном давлении и очищали колоночной хроматографией на силикагеле, используя градиент от 0 до 25% EtOAc в гексане для получения 2-арилхинолин-3-карбальдегидов. Способ В. Твердый борогидрид натрия (1,5 экв.) добавляли к раствору 2-арилхинолин-3-карбальдегида (1 экв.) в тетрагидрофуране THF (0,5 M) при 0 С и смесь перемешивали при 0 С в течение 2 ч. Реакционную смесь охлаждали добавлением воды. Водный слой экстрагировали EtOAc (3 раза). Объединенные органические слои высушивали над Na2SO4, фильтровали и концентрировали при пониженном давлении. Осадок очищали колоночной хроматографией на силикагеле, используя 50% EtOAc в гексане для получения (2-арилхинолин-3-ил)метанолов.(2-Арилхинолин-3-ил)метанол (1 экв.) в CHCl3 (0,25 М) обрабатывали SOCl2 (5 экв.) при комнатной температуре в течение 2 ч. Растворители удаляли при пониженном давлении и остаток разделяли междуEtOAc и насыщенным водным раствором NaHCO3. Органический слой отделяли, отмывали водой и солевым раствором, высушивали над Na2SO4, фильтровали и концентрировали при пониженном давлении. Сырой продукт очищали колоночной хроматографией на колонке Redi-Sep, используя градиент от 0 до 100% EtOAc в гексане для получения 3-(хлорметил)-2-арилхинолинов. Способ D. К раствору 3-(хлорметил)-2-арилхинолина (1 экв.) в DMSO (0,25 М) добавляли NaN3 (3 экв.) при комнатной температуре и смесь перемешивали в течение 4 ч при комнатной температуре. Смесь разбавляли водой, экстрагировали EtOAc (2 раза) и объединенные органические слои отмывали водой (2 раза),высушивали над Na2SO4, фильтровали и концентрировали при пониженном давлении. Осадок растворяли в MEOH и обрабатывали 10% Pd-C (5 мас.%) и смесь затем перемешивали в атмосфере H2 из баллона в течение ночи. Смесь фильтровали через слой Celite с последующим удалением растворителей для получения (2-арилхинолин-3-ил)метанаминов. Способ Е.NaN3 (2 экв.) при комнатной температуре. Смесь перемешивали при комнатной температуре в течение 1 ч. Смесь разделяли между EtOAc и H2O. Органический слой высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении для получения 3-(азидометил)-2-арилхинолинов. Сырой продукт использовали без очистки на следующей стадии. К перемешивающемуся раствору 3(азидометил)-2-арилхинолина в THF-H2O (4:1, 0,21 М) добавляли по каплям РМе 3 (1,0 М раствор в THF,1,2 экв.) при комнатной температуре и смесь перемешивали при комнатной температуре в течение 1 ч. К смеси добавляли EtOAc и смесь экстрагировали 1 н. HCl (2 раза). Объединенные экстракты нейтрализовали твердым бикарбонатом натрия и экстрагировали EtOAc (2 раза). Объединенные органические экстракты высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении для получения темного сиропа. Сырой продукт очищали колоночной хроматографией на колонках Redi-Sep, используя в качестве элюента градиент от 0 до 100% CH2Cl2:MEOH:NH4OH (89:9:1) в CH2Cl2 для получения (2-арилхинолин-3-ил)метанаминов. Способ F.PMBNH2 (1,5 экв.) перемешивали при комнатной температуре. Через 1 ч к смеси добавили триацетоксиборогидрид натрия NaBH(ОАс)3 (3 экв.) и смесь перемешивали при 50 С в течение 2 ч. К смеси добавили насыщенный водный раствор NaHCO3 и смесь перемешивали в течение 15 мин. Органический слой отделяли и водный слой экстрагировали CH2Cl2 (2 раза). Объединенные органические слои отмывали солевым раствором, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали колоночной хроматографией на колонке Redi-Sep, используя градиент от 0 до 100%EtOAc в гексане для получения N-(4-метоксибензил)(2-арилхинолин-3-ил)метанаминов.(3,5 экв.) в CH3CN-H2O (2:1, 0,22 М) перемешивали при комнатной температуре в течение 24 ч. К смеси добавляли 0,5 М HCl (12 экв.) и смесь отмывали CH2Cl2 (3 раза) для удаления полученного 4-метоксибензальдегида. Органическую фракцию экстрагировали 0,5 М HCl (2 раза). Объединенные кислые водные слои подщелачивали 2 н. NaOH до рН 9,0. Полученный осадок собирали фильтрацией. Сырой продукт очищали колоночной хроматографией на колонке Redi-Sep, используя в качестве элюента градиент от 0 до 100% CH2Cl2:MEOH:NH4OH (89:9:1) в CH2Cl2 для получения (2-арилхинолин-3 ил)метанаминов. Способ Н.(1,2 экв.) и затем 6-хлоруридином (1 экв.) при 80 С в течение 8 ч. Реакционную смесь концентрировали и очищали колоночной хроматографией на колонке Redi-Sep, используя в качестве элюента градиент от 0 до 100% CH2Cl2:MEOH:NH4OH (89:9:1) в CH2Cl2 для получения N-2-арилхинолин-3-ил)метил)-9 Нпурин-6-аминов. Способ K. К смеси 2-фенилхинолин-3-карбальдегида (1,0 экв.) в тетрагидрофуране THF (0,28 M) при 0 С добавляли по каплям раствор реагента Grignard (3 М, 2 экв.) и реакционную смесь перемешивали в течение ночи перед резким охлаждением насыщенным раствором NH4Cl. Смесь экстрагировали EtOAc (210 мл) и объединенные органические слои высушивали (Na2SO4) и концентрировали при пониженном давлении. Осадок очищали колоночной хроматографией на силикагеле (элюент: EtOAc/гексан, 1/1) для получения 1-(2-фенилхинолин-3-ил)спиртов. Способ L. Смесь 4-хлор-7 Н-пирроло[2,3-d]пиримидина (2,0 экв.) и 1,4-диазабицикло[2.2.2]октана (4,0 экв.) в безводном DMSO (0,69 M) перемешивали при комнатной температуре в течение 5 ч и затем добавляли посредством канюли в смесь 1-(2-фенилхинолин-3-ил)спирта (1 экв.) и гидрида натрия в виде 60% дисперсии в минеральном масле (3 экв.) в DMSO (0,5 M), который перемешивали в течение 30 мин при комнатной температуре и в течение 30 мин при 50 С перед добавлением. Смесь перемешивали при комнатной температуре в течение 6 ч перед добавлением воды и экстрагировали EtOAc (4 раза). Объединенные органические слои отмывали водой, солевым раствором, высушивали (MgSO4) и концентрировали при пониженном давлении. Осадок очищали колоночной хроматографией на силикагеле (элюент:CH2Cl2/MEOH, 50/1) для получения требуемого продукта. Смесь N-S)-1-(8-хлор-2-(пиридин-2-ил)хинолин-3-ил)этил-9 Н-пурин-6-амина (80 мг, 0,2 ммоль),Pd(PPh3)4 (23 мг, 0,1 экв.) и Zn(CN)2 (117 мг, 5,0 экв.) в DMF (5 мл) продували N2 в течение 5 мин перед нагреванием до 130 С. Через 3 ч LCMS показала образование следового количества 2. Реакционную смесь затем нагревали до 165 С в течение ночи. После охлаждения до комнатной температуры реакционную смесь фильтровали через Celite и очищали обращенно-фазовой ВЭЖХ (MeCN/H2O, 0,1% TFA) для получения твердого белого вещества. 1 Н-ЯМР (400 Гц, DMSO-d6):8,83 (s, 1H), 8,72 (s, 1 Н), 8,52 (s, 1H), 8,42-8,37 (m, 2H), 8,14 (d,J=8,0 Гц, 1H), 8,08 (t, J=8,0 Гц, 1H), 7,79 (t, J=8,0 Гц, 1H), 7,55 (t, J=8,0 Гц, 1H), 6,24 (s, 1H), 1,72 (d,J=8,0 Гц, 3H). Масс-спектр (ESI) m/e=393 (M+1). Общие методики для аналогов 8-фторхинолина. Методика BSL-1. В колбу с круглым дном добавили (S)-3-(1-азидоэтил)-2-хлор-8-фторхинолин (1 экв.), тетракистрифенилфосфин палладия(0) (0,04 экв.), карбонат натрия (5 экв.) и арилбороновую кислоту (1,5 экв.). Колбу продували азотом и добавляли смесь MeCN:H2O в соотношении 3:1 для обеспечения концентрации 0,1 М по отношению к исходному азиду. Реакционную смесь нагревали до 80 С до завершения реакции. Растворитель удаляли и остаток заново растворяли в этилацетате и воде. Слои разделяли и органический слой отмывали солевым раствором, высушивали над MgSO4, фильтровали и концентрировали. Сырую реакционную смесь очищали колоночной хроматографией (этилацетат в гексане, градиент) для получения (S)-3-(1-азидоэтил)-8-фтор-2-арилхинолина. Методика BSL-2.(S)-3-(1-Азидоэтил)-8-фтор-2-арилхинолин растворяли в THF (для получения 0,1 М раствора) и добавляли трифенилфосфин (1,1 экв.) и воду (2 экв.). Реакционную смесь нагревали до 60 С в течение ночи. После охлаждения до комнатной температуры растворитель удаляли под вакуумом и остаток заново растворяли в этиловом эфире. Слой эфира экстрагировали 3 раза с помощью 1 н. HCl. Водный слой доводили до рН 10-12 путем добавления 15% NaOH и щелочной водный слой экстрагировали дважды этиловым эфиром. Слои эфира отмывали солевым раствором, высушивали над MgSO4, фильтровали и концентрировали для получения (S)-1-(8-фтор-2-арилхинолин-3-ил)этанамина. Методика BSL-3. В колбу с круглым дном добавляли (S)-1-(8-фтор-2-арилхинолин-3-ил)этанамин (1 экв.),6-бромпурин (1,2 экв.) и диизопропилэтиламин (3 экв.). Достаточное количество н-бутанола добавляли для приготовления 0,1 М раствора по отношению к (S)-1-(8-фтор-2-арилхинолин-3-ил)этанамину. Смесь нагревали до 100-115 С в течение 24 ч, охлаждали до комнатной температуры и растворитель удаляли под вакуумом. Очистка обращенно-фазовой ВЭЖХ позволила получить (S)-N-1-(8-фтор-2-арилхинолин 3-ил)этил)-9 Н-пурин-6-амин. Продукты растворяли в DCM/NaHCO3 и органический слой разделяли, высушивали над MgSO4, фильтровали и концентрировали для получения (S)-N-(1-(8-фтор-2-фенилхинолин 3-ил)этил)-9 Н-пурин-6-амина в виде свободных оснований.(ddd, J=10,6, 7,8, 1,6 Гц, 1H), 6,90 (tt, J=9,0, 2,4 Гц, 1H), 6,50 (br s, 1H), 1,53 (d, J=6,4 Гц, 3H). Масс-спектр (ESI) m/e =420,9 (M+1). Определение биологической активности. Рекомбинантная экспрессия PI3Ks. Субъединицы p110 полной длины PI3K ,и , маркированные на N-конце меткой poly-His, были коэкспрессированы с р 85 экспрессирующими векторами на основе вируса Baculo в клетках sf9 насекомого. Гетеродимеры p110/р 85 были очищены последовательно Ni-NTA, Q-HP, Superdex-100 хроматографией. Очищенные ,иизомеры хранились при -20 С в 20 мМ Трис, рН 8, 0,2 М NaCl, 50% глицерина,5 мМ DTT, 2 мМ холата натрия. Процессированная PI3K, остатки 114-1102, маркированные на N-конце меткой poly-His, была экспрессирована вирусом Baculo в Hi5 клетки насекомого, -изозим был очищен последовательно Ni-NTA, Q-HP, Superdex-100 хроматографией, -изозим хранился замороженным при 80 С в NaH2PO4, рН 8, 0,2 М NaCl, 1% этиленгликоле, 2 мМ -меркаптоэтаноле. Ферментный анализ in vitro. Анализы проводились в 25 мкл с вышеуказанными конечными концентрациями компонентов в белых полипропиленовых планшетах (Costar 3355). Фосфоакцептор фосфатидилинозитол, PtdIns(4,5)P2P4508 был получен от Echelon Biosciences. Активность АТФазы альфа и гамма изоферментов не была сильно стимулирована PtdIns(4,5)P2 в этих условиях и была, следовательно, исключена из анализа этих изоферментов. Тестируемые соединения были растворены в диметилсульфоксиде и разбавлены трехкратным серийным разведением. Соединение в DSMO (1 мкл) было добавлено в каждую тест-ячейку и было определено ингибирование по отношению к реакциям, не содержащим соединение, с энзимом и без него. После выдерживания проб при комнатной температуре реакция была остановлена, и остаточный АТР определялся путем добавления равного объема коммерческого АТР биолюминесцентного набора(Perkin Elmer EasyLite) согласно инстукциям производителя и регистрировался с помощью AnalystGT люминометра. Пролиферация человеческих В-клеток стимулированная анти-IGM. Изоляция человеческих В-клеток. Изолирование PBMCs от Leukopac или от человеческой свежей крови. Изолирование человеческихB-клеток с помощью Miltenyi протокола и изолирующего B-клетки комплекта II. Человеческие B-клетки были очищены с помощью колонок autoMACS Columns. Активация человеческих B-клеток. Использование 96-луночного планшета с плоским дном, планшет из расчета 50000/лунка очищенных B-клеток в среде пролиферации B-клеток (DMEM+5% FCS, 10 мМ Hepes, 50 мкмоль 2-меркаптоэтанола); 150 мкл среды, содержащей 250 нг/мл CD40L-LZ рекомбинантного белка (Amgen) и 2 мкг/мл античеловеческого IgM антитела (Jackson ImmunoReseach Lab.109-006-129), смешивали с 50 мкл B-клеточной средой, содержащей ингибиторы PI3K, и инкубировали в течение 72 ч при 37 С инкубатора. Через 72 ч B-клетки были импульсно мечены 0,5-1 uCi/лунка 3 Н-тимидином в течение ночи 18 ч и собирали клетки с помощью TOM Harvester.- 11017389 Соединение IC50 N-1S)-1-(7-фтор-2-(2-пиридинил)-3-хинолинил)этил)-9 Н-пурин-6-амин 0.009416. Пролиферация человеческих B-клеток стимулированная IL-4. Изолирование человеческих B-клеток. Изолирование человеческих PBMCs от Leukopac или от человеческой свежей крови. Изолирование человеческих B-клеток с помощью Miltenyi протокола - изолирующего B-клетки комплекта II. Человеческие B-клетки были очищены с помощью колонок autoMACS Columns. Активация человеческих B-клеток. Использование 96-луночного планшета с плоским дном, планшет из расчета 50000/лунка очищенных B-клеток в среде пролиферации B-клеток (DMEM+5% FCS, 10 мМ Hepes, 50 мкмоль 2-меркаптоэтанола). Среду (150 мкл), содержащую 250 нг/мл CD40L-LZ рекомбинантного белка (Amgen) и 10 нг/мл IL-4 (RD system204-IL-025), смешивали с 50 мкл B-клеточной среды, содержащей соединения, и инкубировали в течение 72 ч при 37 С инкубатора. Через 72 ч B-клетки были импульсно мечены 0,5-1 uCi/лунка 3 Н-тимидином в течение ночи 18 ч и собирали клетки с помощью ТОМ Harvester. Анализ индуцированной специфическим T-антигеном (столбнячный токсин) пролиферации человеческих РВМС. Человеческие РВМС приготовили из замороженных запасов или их выделили из свежей человеческой крови с помощью градиента Ficoll. Используют 96-луночный планшет с круглым дном и высевают 2105 РВМС/лунка с культурной средой (RPMI1640+10% FCS, 50uM 2-меркаптоэтанол, 10 мМ Hepes). Для определения IC50 ингибиторы PI3K тестировали в концентрации от 10 до 0,001 мкМ, с инкементом в половину логарифма и в тройной повторности. Столбнячный токсин, Т-клеточный специфичный антиген(University of Massachusetts Lab) добавляли в количестве 1 мкг/мл и инкубировали в течение 6 дней при 37 С инкубирования. Надосадочную жидкость собрали через 6 дней для проведения анализа IL-2 ELISA,затем импульсно метили 3 Н-тимидином в течение 18 ч для определения пролиферации.GFP анализ для определения ингибирования класса Ia и класса III PI3K.AKT1 (PKBa) регулируется классом Ia PI3K, активированной митогенными факторами (IGF-1,PDGF, инсулин, тромбин, NGF и т.п.). В ответ на митогенный стимул AKT1 перемещается из гиалоплазмы в клеточную мембрану.Forkhead (FKHRL1) является субстратом для AKT1. Он является цитоплазматическим при фосфорилировании AKT (выживаемость/рост). Ингибирование AKT (задержка роста/апоптоз)-транслокацияFYVE домены связываются с РО(3)Р. Большинство генерируется конститутивным действием PI3K класса III. Анализ активных перемещений AKT в мембрану клетки (CHO-IR-AKTI-EGFP клетки/GEHealthcare). Отмывали клетки буфером анализа. Обрабатывали соединениями в буфере анализа в течение 1 ч. Добавляли 10 нг/мл инсулина. Закрепляли через 10 мин при комнатной температуре и делали снимок. Анализ транслокации Forkhead (MDA MB468 Forkhead-DiversaGFP cells). Клетки обрабатывали соединением в среде для выращивания в течение 1 ч. Фиксировали и делали снимок. Анализ класса III PI(3)P (U2OS EGFP-2XFYVE cells/GE Healthcare). Отмывали клетки буфером анализа. Обрабатывали соединениями в буфере анализа в течение 1 ч. Фиксировали и делали снимок. Контролем для всех 3 анализов является 10 uM Wortmannin.AKT является цитоплазматическим; Forkhead является ядерным; PI(3)Р не содержат эндосом Биомаркерный анализ. Стимулирование экспрессии CD69 или B7.2(CD86) B-клеточных рецепторов. Гепаринизированную человеческую цельную кровь стимулировали 10 мг/мл анти-IgD(Southern Biotech, 9030-01). Затем 90 мкл стимулированной крови аликвотировали в каждую лунку 96 луночного планшета и обрабатывали 10 мкл разных концентраций блокирующего соединения (от 10 до 0,0003 мкМ), разбавленных в IMDM+10% FBS (Gibco). Образцы инкубировали вместе в течение от 4 ч(для CD69 экспрессии) до 6 ч (для В 7.2 экспрессии) при 37 С. Обработанную кровь (50 мкл) переносили на 96-луночный глубокий планшет (Nunc) для окрашивания антителами с помощью 10 мкл каждого изBiosciences, 341652). Следующие 50 мкл обработанной крови переносили на второй 96-луночный глубокий планшет для окрашивания антителами с помощью 10 мкл каждым из CD19-FITC (BD Biosciences,340719) и CD86-PeCy5 (BD Biosciences, 555666). Все окрашивание выполнялось в течение 15-30 мин в темноте при комнатной температуре. Кровь затем лизировали и закрепляли с помощью 450 мкл FACS лизирующего раствора (BD Biosciences, 349202) в течение 15 мин при комнатной температуре. Образцы затем отмывали 2 Х PBS+2% FBS перед проведением FACS-анализа. Образцы гейтировали либо поCD45/CD19 двойным положительным клеткам для CD69 окрашивания или CD19 положительными клетками для CD86 окрашивания.- 12017389 Гамма-радиометрия: стимулирование человеческих моноцитов для экспрессии фосфопротеинкиназы. Человеческая клеточная линия моноцитов, ТНР-1, сохранялась в RPMI + 10% FBS (Gibco). За один день перед стимулированием клетки подсчитывали с помощью исключения трипанового синего на гемоцитометре и суспендировали при концентрации 1106 клеток на 1 мл среды. 100 мкл клеток плюс среда(1105 клеток) аликвотировали в каждую лунку 4-96-луночного глубокого планшета (Nunc) для тестирования восьми разных соединений. Клетки выдерживали в течение ночи перед обработкой разными концентрациями (от 10 до 0,0003 мкМ) блокирующего соединения. Соединение, разбавленное в среде(12 мкл), добавляли в клетки в течение 10 мин при 37 С. Человеческий МСР-1 (12 мкл, RD Diagnostics,279-MC) разбавляли в среде и добавляли в каждую лунку при конечной концентрации 50 нг/мл. Стимулирование продолжали в течение 2 мин при комнатной температуре. Предварительно нагретый FACsPhosflow Lyse/Fix буфер (1 мл при 37 С) (BD Biosciences, 558049) добавляли в каждую лунку. Планшеты затем инкубировали при 37 С дополнительно в течение 10-15 мин. Планшеты центрифугировали при 1500 об/мин в течение 10 мин, супернатант аспирировали и добавляли 1 мл ледяного 90% МеОН в каждую лунку при интенсивном встряхивании. Планшеты затем инкубировали в течение ночи при 70 С или на льду в течение 30 мин перед окрашиванием антителами. Планшеты центрифугировали и отмывали 2 Х в PBS+2% FBS (Gibco). Раствор для промывания аспирировали и клетки суспендировали в оставшемся буфере. Кроличью pAKT (50 мкл, Cell Signaling, 4058L) в соотношении 1:100 добавляли в каждый образец в течение 1 ч при комнатной температуре при встряхивании. Клетки отмывали и центрифугировали при 1500 об/мин в течение 10 мин. Супернатант аспирировали и клетки суспендировали в оставшемся буфере. Вторичное антитело, козий антикроличий Alexa 647 (50 мкл, Invitrogen, А 21245) в соотношении 1:500 добавляли в течение 30 мин при комнатной температуре при встряхивании. Клетки затем отмывали 1X в буфере и суспендировали в 150 мкл буфера для проведения FACS-анализа. Клетки следует тщательно диспергировать пипетированием перед проведением анализа на проточном цитометре. Клетки анализировали на LSR II (Becton Dickinson) и гейтировали на рассеяние вперед и боковое рассеивание для определения уровней экспрессии pAKT в популяции моноцитов. Гамма-радиометрия: Стимулирование моноцитов для экспрессии фосфо-AKT в костном мозге мыши. Бедренные кости мышей препарировали у пяти женских особей мышей BALB/c (Charles RiverLabs.) и собрали в RPMI + 10% FBS среде (Gibco). Костный мозг мыши удаляли путем разрезания концов бедренной кости и промыванием 1 мл среды с помощью иглообразного датчика (25 gauge needle). Костный мозг затем диспергировали в среде с помощью иглообразного датчика (21 gauge needle). Объем среды увеличивали до 20 мл и клетки подсчитывали методом исключения трипанового синего на гемоцитометре. Концентрацию клеток в суспензии затем увеличивали до 7,5106 клеток на 1 мл среды и 100 мкл(7,5105 клеток) аликвотировали в каждую лунку 4-96-луночного глубокого планшета (Nunc) для тестирования восьми разных соединений. Клетки выдерживали при 37 С в течение 2 ч перед обработкой разными концентрациями (от 10 до 0,0003 мкМ) блокирующего соединения. Соединение, разбавленное в среде (12 мкл), добавляли в клетки костного мозга в течение 10 мин при 37 С. Мышиный МСР-1 (12 мкл,RD Diagnostics, 479-JE) разбавляли в среде и добавляли в каждую лунку при конечной концентрации 50 нг/мл. Стимулирование продолжали в течение 2 мин при комнатной температуре. 1 мл предварительно нагретого до 37 С FACS Phosflow Lyse/Fix буфера (BD Biosciences, 558049) добавляли в каждую лунку. Планшеты затем инкубировали при 37 С в течение дополнительных 10-15 мин. Планшеты центрифугировали при 1500 об/мин в течение 10 мин. Супернатант аспирировали и 1 мл ледяного 90% раствора МеОН добавляли в каждую лунку при интенсивном встряхивании. Планшеты инкубировали в течение ночи при -70 С или на льду в течение 30 мин перед окрашиванием антителами. Планшеты центрифугировали и отмывали 2 Х в PBS+2% FBS(Gibco). Промывающую жидкость аспирировали и клетки суспендировали в оставшемся буфере. Fc блокатор (2 мкл, BD Pharmingen, 553140) затем добавляли в каждую лунку в течение 10 мин при комнатной температуре. После блокировки 50 мкл исходных антител разбавляли в буфере; CD11b-Alexa488 (BDBiosciences, 557672) в соотношении 1:50, CD64-PE (BD Biosciences, 558455) в соотношении 1:50 и кроличью pAKT (Cell Signaling, 4058L) в соотношении 1:100 добавляли в каждый образец в течение 1 ч при комнатной температуре при встряхивании. Промывающий буфер добавили к клеткам и центрифугировали при 1500 об/мин в течение 10 мин. Супернатант аспирировали и клетки суспендировали в оставшемся буфере. Вторичное антитело; козий антикроличий Alexa 647 (50 мкл, Invitrogen, A21245) в соотношении 1:500 добавляли в течение 30 мин при комнатной температуре при встряхивании. Клетки затем отмывали 1X в буфере и суспендировали в 100 мкл буфера для проведения FACS-анализа. Клетки анализировали на LSR II (Becton Dickinson) и гейтировали по CD11b/CD64 двойным положительным клеткам для определения уровней экспрессии pAKT в популяции моноцитов.Park, NY) в мышь (Transgenic Line 3751, женскую особь, 10-12 wks Amgen Inc, Thousand Oaks, CA) за 15 мин до внутривенного введения (0,2 мл) анти-IgM FITC (50 ug/мышь) (Jackson Immuno Research, WestGrove, PA). Через 45 мин мышь умерщвляли в камере с CO2. Кровь забирали путем пункции сердца(Nalge/Nunc International, Denmark). Кровь немедленно фиксировали с помощью 6,0 мл BD PhosflowLyse/Fix Buffer (BD Bioscience, San Jose, CA), инвертировали 3 Х' и помещали в водяную ванну при температуре 37 С. Половину селезенки удаляли и переносили в трубку Eppendorf, содержащую 0,5 мл PBS(Invitrogen Corp, Grand Island, NY). Селезенку разрушали с помощью гомогенизатора ткани (Pellet Pestle,Kimble/Kontes, Vineland, NJ) и немедленно фиксировали с помощью 6,0 мл BD Phosflow Lyse/Fix буфера,инвертировали 3 Х' и помещали в водяную ванну при температуре 37 С. Как только ткани были собраны,мышь декапитировали и тушку уничтожали. Через 15 мин 15 мл конические пробирки удаляли с водяной ванны с температурой 37 С и помещали на лед до тех пор, пока ткани продолжали разлагаться. Разрушенные селезенки фильтровали через 70 мкм клеточный фильтр (BD Bioscience, Bedford, MA) в другую 15 мл коническую пробирку и отмывали 9 мл PBS. Спленоциты и кровь центрифугировали при 2,000 об/мин в течение 10 мин (холод) и буфер аспирировали. Клетки ресуспендировали в 2,0 мл холодного (-20 С) 90% метилового спирта (Mallinckrodt Chemicals, Phillipsburg, NJ). Метанол медленно добавляли во время быстрого вращения конической пробирки. Ткани затем хранили при -20 С до тех пор, пока клетки не могли быть фильтрованы для проведения FACS- анализа. Иммунизация мультидозой тринитрофенола (TNP). Кровь собирали путем ретроорбитальных глазных кровопусканий из мышей женских особей в возрасте 7-8 недель BALB/c (Charles River Labs.) в день 0 перед иммунизацией. Свертывание крови происходило в течение 30 мин и производили центрифугирование при 10,000 об/мин в пробирках Mictotainer для исследования сыворотки (Becton Dickinson) в течение 10 мин. Сыворотку собирали, аликвотировали в пробирки Matrix (Matrix Tech Corp.) и хранили при -70 С до проведения анализа ELISA. Мышам орально вводили соединение перед иммунизацией и через последовательные интервалы времени, основанные на времени жизни молекулы. Мышей затем иммунизировали либо 50 мкг TNP-LPS (BioscienceTech., T-5065), 50 мкг TNP-Ficoll (Bioscience Tech., F-1300), либо 100 мкг TNP-KLH (Bioscience Tech.,T-5060) плюс 1% раствор квасцов (Brenntag, 3501) в PBS. TNP-KLH плюс раствор квасцов готовили осторожным переворачиванием 3-5 раз смеси каждые 10 мин в течение 1 ч перед иммунизацией. На 5 день после обработки мышей умерщвляли СО 2 и делали пункцию сердца. Кровь свертывалась в течение 30 мин и производили центрифугирование при 10,000 об/мин в пробирках Mictotainer для исследования сыворотки в течение 10 мин. Сыворотку собирали, аликвотировали в пробирки Matrix (Matrix TechCorp.) и хранили при -70 С до проведения анализа ELISA. TNP-специфичные уровни иммуноглобулиновIgGl, IgG2a, IgG3 и IgM в сыворотке затем измеряли методом твердофазного иммуноферментного анализа (ELISA). TNP-BSA (Biosearch Tech., T-5050) использовали для захвата TNP-специфичных антител.TNP-BSA (10 мкг/мл) использовали для покрытия 384-ячеечных плат ELISA (Corning Costar) в течение ночи. Платы затем промывали и блокировали в течение 1 ч с помощью 10% BSA ELISA блокирующего раствора (KPL). После блокирования платы ELISA отмывали и образцы сыворотки/стандарты серийно разбавляли и оставляли для связывания с платами на 1 ч. Планшеты отмывали и вторичные антитела,меченные Ig-HRP (козьи антимышиные IgG1, Southern Biotech 1070-05, козьи антимышиные IgG2a,Southern Biotech 1080-05, козьи антимышиные IgM, Southern Biotech 1020-05, козьи антимышиныеIgG3, Southern Biotech 1100-05) разбавляли в соотношении 1:5000 и инкубировали на платах в течение 1 ч. Раствор ТМВ пероксидазы (SureBlue Reserve ТМВ от KPL) использовали для обнаруживания антител. Планшеты отмывали и образцы оставляли в ТМВ растворе примерно на 5-20 мин в зависимости от анализируемого Ig. Реакцию останавливали с помощью 2 М раствора серной кислоты и на ридере считывали OD (оптическую плотность) при длине волны 450 нм. Для лечения заболеваний опосредованных PI3K, таких как ревматоидный артрит, болезнь Бехтерева, остеоартрит, псориатический артрит, псориаз, воспалительные заболевания и аутоиммунные заболевания, соединения настоящего изобретения могут вводиться орально, парентерально, ингаляционным распылением, ректально или местно в стандарных лекарственных формах, содержащих обычно используемые фармацевтически приемлемые носители, адъюванты или наполнители. Использующийся здесь термин "парентеральный" включает подкожные, внутривенные, внутримышечные, надчревные техники введения или интраперитонеально. Лечение заболеваний и нарушений также предполагает включение профилактического введения соединений изобретения, их фармацевтических солей или их фармацевтических композиций пациенту (а именно животному, предпочтительно млекопитающему, более предпочтительно человеку), которому необходимо провести превентативное лечение, например, ревматоидного артрита, болезни Бехтерева,остеоартрита, псориатического артрита, псориаза, воспалительных заболеваний и аутоиммунных заболеваний и подобных.- 14017389 Режим дозирования для лечения опосредованных PI3K заболеваний рака и/или гипергликемии соединениями изобретения и/или композиции этого изобретения основан на множестве факторов, включающих тип заболевания, возраст, вес, пол, медицинские показания пациента, серьезность состояния,режим введения и в особенности использующееся соединение. Таким образом, режим дозирования может колебаться в широких пределах, но может быть определен обычным способом с помощью стандартных методов. Уровни доз примерно порядка от 0,01 до 30 мг на 1 кг веса тела в день, предпочтительно от 0,1 до 10 мг/кг, более предпочтительно от 0,25 до 1 мг/кг являются пригодными для всех раскрытых здесь способов применения. Фармацевтически активные соединения настоящего изобретения могут подвергаться обработке в соответствии с традиционными фармацевтическими методами производства медицинских препаратов для введения пациентам, включая людей и других млекопитающих. Для орального введения фармацевтическая композиция может быть в форме, например, капсулы,таблетки, суспензии или жидкости. Фармацевтическая композиция предпочтительно является изготовленной в форме стандартной лекарственной формы, содержащей заданное количество активного ингредиента. Например, такие формы могут содержать количество активного ингредиента примерно от 1 до 2000 мг, предпочтительно от 1 до 500 мг и более предпочтительно от 5 до 150 мг. Пригодная ежедневная доза для человека или другого млекопитающего может широко различаться в зависимости от состояния пациента и других факторов, но может быть определена с помощью обычных способов. Активный компонент может быть также введен инъекцией в виде композиции с пригодными носителями, включающими раствор хлорида натрия, декстрозу или воду. Ежедневный парентеральный дозированный режим будет составлять примерно от 0,1 до 30 мг/кг общего веса тела, предпочтительно примерно от 0,1 до 10 мг/кг и более предпочтительно от 0,25 до 1 мг/кг. Препараты для инъекций, такие как стерильные впрыскиваемые водные или масляные суспензии могут быть приготовлены в соответствии с известными использующимися пригодными диспергирующими или смачивающими агентами и суспендирующими агентами. Стерильные препараты для впрыскивания могут также быть стерильным раствором для инъекций или суспензией в нетоксичном, приемлемом для парентерального введения разбавителе или растворителе, например растворе 1,3-бутандиола. Приемлемые носители и растворители, которые могут использоваться, включают воду, раствор Рингера и изотонический раствор хлорида натрия. К тому же, определенные масла обычно применяются в виде растворителя или суспендирующей среды. Для этой цели может использоваться любое нелетучее масло,включая синтетические моно- или диглицериды. К тому же, жирные кислоты, такие как олеиновая кислота, находят применение в приготовлении препаратов для инъекций. Суппозитории для ректального введения лекарства могут быть приготовлены путем смешивания лекарства с подходящим нераздражающим наполнителем, таким как масло какао или полиэтиленгликоли, которые являются твердыми при обычных температурах, но при ректальных температурах будут жидкими и, следовательно, будут растворяться в прямой кишке и высвобождать лекарство. Пригодная местная доза активного компонента соединения изобретения составляет от 0,1 до 150 мг и вводится от одного до четырех, предпочтительно от одного до двух раз в день. Для местного введения активный компонент может включать от 0,001 до 10% отношения масс, например от 1 до 2 мас.% лекарственной формы, хотя оно может включать до 10% отношения масс, но предпочтительно не более 5% отношения масс и более предпочтительно от 0,1 до 1% лекарственной формы. Лекарственный состав для местного введения включает жидкие или полужидкие препараты, пригодные для проникновения через кожу (например, линименты, лосьоны, мази, кремы или пасты) и пригодные для введения капли в глаза, уши или нос. Для введения соединения настоящего изобретения обычно соединяют с одним или более адъювантом, пригодным для показанного курса введения. Соединения могут быть смешаны с лактозой, сахарозой, крахмальным порошком, эфирами целлюлозы алкановых кислот, стеариновой кислотой, тальком,стеаратом магния, оксидом магния, натриевыми и кальциевыми солями фосфорной и серной кислот, камедью, желатином, альгинатом натрия, поливинилпирролидином и/или поливиниловым спиртом и таблетированы или капсулированы для удобного введения. Или же соединения настоящего изобретения могут быть растворены в салине, воде, полиэтиленгликоле, пропиленгликоле, этаноле, кукурузном масле,арахисовом масле, кунжутном масле, смоле трагаканта и/или разных буферах. Другие адъюванты и способы введения хорошо известны в области фармацевтики. Носитель или наполнитель может включать замедляющий материал, такой как глицерил моностеарат или глицерил дистеарат по отдельности или с пластичным материалом, или другие материалы, хорошо известные в данной области. Фармацевтические композиции могут быть изготовлены в твердой форме (включая гранулы, порошки или свечи) или в жидкой форме (например, растворы, суспензии или эмульсии). Фармацевтические композиции могут подвергаться обычным фармацевтическим операциям, таким как стерилизация,и/или могут содержать обычно используемые адъюванты, такие как консерванты, стабилизаторы, смачивающие агенты, эмульгаторы, буферы и т.д.- 15017389 Твердые стандартные лекарственные формы для орального введения могут включать капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых лекарственных формах активное соединение может быть смешано по меньшей мере с одним инертным наполнителем, таким как сахароза, лактоза или крахмал. Такие лекарственные формы могут также включать, как в обычной практике, дополнительные субстанции, отличающиеся от инертных наполнителей, например лубриканты, такие как стеарат магния. В случае капсул, таблеток и пилюль лекарственная форма может также включать буферные вещества. Таблетки и пилюли могут быть дополнительно приготовлены с энтеросолюбильными покрытиями. Жидкие лекарственные формы для орального введения могут включать фармацевтически приемлемые эмульсии, растворы, суспензии, сиропы и эликсиры, содержащие инертные наполнители, широко использующиеся в данной области техники, такие как вода. Такие композиции могут также включать адъюванты, такие как смачивающие, подслащивающие, вкусовые и ароматизирующие добавки. Соединения настоящего изобретения могут обладать одним или более асимметричными атомами углерода и таким образом быть способными существовать в форме оптических изомеров, а также в форме их рацемических или нерацемических смесей. Оптические изомеры могут быть получены с помощью расщепления рацемических смесей в соответствии с обычными способами, например путем образования диастереоизомерических солей, путем обработки оптически активными кислотами или основаниями. Примерами соответствующих кислот являются винная кислота, диацетилвинная, дибензоилвинная, дитолуолвинная и камфорсульфокислота и затем разделение смеси диастереоизомеров путем кристаллизации с последующим освобождением оптически активных оснований из этих солей. Различные способы разделения оптических изомеров включают использование хиральной хроматографической колонки, оптимально выбранной для максимального увеличения разделения энантиомеров. Еще другой доступный способ включает синтез ковалентных диастереоизомерических молекул путем взаимодействия соединений изобретения с оптически чистой кислотой в активированной форме или оптически чистым изоцианатом. Синтезированные диастереоизомеры могут быть разделены обычными средствами, такими как хроматография, дистилляция, кристаллизация или сублимация, и затем гидролизированы для получения энантиметрически чистого соединения. Оптически активные соединения изобретения могут быть также получены путем использования активных исходных материалов. Эти изомеры могут быть в форме свободной кислоты, свободного основания, эфира или соли. Также соединения этого изобретения могут существовать как изомеры, которые являются соединениями такой же молекулярной формулы, но в которой атомы относительно друг друга располагаются поразному. В частности, алкиленовые заместители соединений настоящего изобретения обычно и предпочтительно расположены и включены в молекулы, как указано в определениях для каждой из этих групп,читаемых слева направо. Однако в определенных случаях опытному специалисту в данной области следует учесть, что возможно приготовление соединений настоящего изобретения, в которых эти заместители являются обращенными по ориентации относительно к другим атомам в молекуле. То есть внедренный заместитель может быть таким же, как отмечено выше, за исключением того, что он внедрен в молекулу в обратной ориентации. Опытному специалисту в данной области следует учесть, что эти изомерические формы соединений настоящего изобретения должны истолковываться как включенные в рамки настоящего изобретения. Соединения настоящего изобретения могут использоваться в форме солей, извлеченных из неорганических или органических кислот. Соли включают, но не ограничиваются этим, следующие: ацетат,адипинат, цитрат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, камфорат, камфорсульфонат,диглюконат, циклопентанпропионат, додецилсульфат, этансульфонат, глюкогептаноат, глицерофосфат,гемисульфат,гептаноат,гаксаноат,фумарат,гидрохлорид,гидробромид,гидроиодид,2-гидроксиэтансульфонат, лактат, малеат, метансульфонат, никотинат, 2-нафталенсульфонат, оксалат,пальмоат, пектинат, персульфат, 2-фенилпропионат, пикрат, пивалат, пропионат, сакцинат, тартрат, тиоцианат, тосилат, месилат и андеканоат. Также основные азотосодержащие группы могут быть кватернизированными такими агентами, как низшие галоидные алкилы, такие как метил, этил, пропил и хлористый бутил, бромиды и йодиды; диалкилсульфаты, такие как диметил, диэтил, дибутил и диамилсульфаты, длинноцепные алкилгалогениды, такие как децил, лаурил, миристил и стеарилхлорид, бромиды и йодиды, аралкилгалогениды, такие как бензилбромиды и фенетилбромиды и др. Следовательно, могут быть получены растворимые или диспергируемые в воде или в масле продукты. Примеры кислот, которые могут использоваться для образования фармацевтически приемлемых солей, включают такие неорганические кислоты, как соляная, серная и фосфорная кислоты, и такие органические кислоты, как оксалиновая, малеиновая, янтарная и лимонная кислоты. Другие примеры включают соли щелочных металлов или щелочно-земельных металлов, таких как натрий, калий, кальций или магний или органические основания. Также рамками настоящего изобретения предусмотрены фармацевтически приемлемые эфиры карбоновой кислоты или содержащие гидроксил группы, включающие метаболически меченый эфир или пролекарственную форму соединения настоящего изобретения. Метаболически меченый эфир является таким, уровень которого в крови, например, увеличивается и пролонгирует эффективность соответствующей неэфирной формы соединения. Пролекарственная форма является формой, которая не является- 16017389 активной формой молекулы при введении, но которая становится терапевтически активной после некоторой in vivo активности или биотрансформации, такой как метаболизм, например ферментативное или гидролитическое расщепление. Для общего обсуждения пролекарств, включающих эфиры, см. Svenssonand Tunek Drug Metabolism Revies 165 (1988) и Bundgaard Design of Prodrugs, Elsevier (1985). Примеры замаскированного карбоксилатного аниона включают разные эфиры, такие как алкил (например, метил,этил), циклоалкил (например, циклогексил), аралкил (например, бензил, р-метоксибензил) и алкилкарбонилоксиалкил (например, пивалоилоксиметил). Амины были замаскированы как арилкарбонилоксиметил замещенные производные, которые расщепляются эстеразами in vivo, высвобождая свободное лекарство и формальдегид (Bungaard J. Med. Chem. 2503 (1989. Также лекарства, содержащие кислую NH группу,такие как имидазол, имид, индол и подобные, были замаскированы N-ацилоксиметильными группами(Bundgaard Design of Prodrugs, Elsevier (1985. Гидроксильные группы были замаскированы как сложные эфиры и простые эфиры. ЕР 039051 (Sloan and Little, 4/11/81) раскрывает пролекарства на основе гидроксамовой кислоты основания Манниха, их приготовление и использование. Сложные эфиры соединения настоящего изобретения могут включать, например, метил, этил, пропил и эфиры бутила, а также другие пригодные сложные эфиры, образованные между кислой группой и группой, содержащей гидроксил. Метаболически меченые сложные эфиры могут включать, например, метоксиметил, этоксиметил, изопропоксиметил, альфа-метоксиэтил, группы, такие как -C1-C4)алкилокси)этил, например метоксиэтил,этоксиэтил, пропоксиэтил, изопропоксиэтил и т.п.; 2-оксо-1,3-диоксолен-4-илметильные группы, такие как 5-метил-2-оксо-1,3, диоксолен-4-илметил и т.п.; C1-C3-алкилтиометильные группы, например метилтиометил, этилтиометил, изопропилтиометил и т.п.; ацилоксиметильные группы, например пивалоилоксиметил, альфа-ацетоксиметил и т.п.; этоксикарбонил-1-метил или альфа-ацилокси-альфа-замещенные метильные группы, например альфа-ацетоксиэтил. Кроме того, соединения изобретения могут существовать в виде кристаллических твердых веществ,которые могут быть кристаллизованы из обычно применяемых растворителей, таких как этанол,N,N-диметилформамид, вода и подобных. Таким образом, кристаллические формы соединений изобретения могут существовать в виде полиморфов, сольватов и/или гидратов родительских соединений или их фармацевтически приемлемых солей. Все такие формы также рассматриваются как включенные в рамки изобретения. Несмотря на то что соединения изобретения могут вводиться как единственный активный фармацевтический агент, они также могут использоваться в комбинации с одним или более соединений изобретения или другими агентами. При введении в виде комбинации терапевтические агенты могут быть приготовлены как отдельные композиции, которые вводятся одновременно или в разное время, или терапевтические агенты могут вводиться как одна композиция. Перечисленное выше является иллюстрацией изобретения и не предполагает ограничивать изобретение раскрытыми соединениями. Вариации и изменения, которые являются очевидными опытным в данной области специалистам, находятся в рамках изобретения, которые определены в его формуле. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, имеющее структуру или его фармацевтически приемлемая соль. 2. Фармацевтическая композиция, содержащая соединение по п.1 и фармацевтически приемлемый разбавитель или носитель. 3. Соединение, имеющее структуру или его фармацевтически приемлемая соль. 4. Фармацевтическая композиция, содержащая соединение по п.3 и фармацевтически приемлемый разбавитель или носитель. 5. Соединение, имеющее структуру или его фармацевтически приемлемая соль. 6. Фармацевтическая композиция, содержащая соединение по п.5 и фармацевтически приемлемый разбавитель или носитель.
МПК / Метки
МПК: A61K 31/52, C07D 473/30, C07D 473/34, A61K 31/519, A61P 29/00, A61P 35/00, C07D 487/04
Метки: применение, гетероциклические, соединения
Код ссылки
<a href="https://eas.patents.su/19-17389-geterociklicheskie-soedineniya-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Гетероциклические соединения и их применение</a>