Замещенные карбоксамиды
Номер патента: 14233
Опубликовано: 29.10.2010
Авторы: Каклиш Стивен Ли, Фишер Мэттью Джозеф, Такеути Кумико, Смит Эдвард К.Р., Холлиншед Шон Патрик, Бэйкер Райан Томас
Формула / Реферат
1. Соединение формулы I
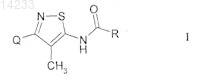
или его фармацевтически приемлемая соль,
где Q представляет собой фенильную группу формулы QA
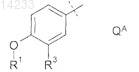
в которой R1 представляет собой метил или этил, a R3 представляет собой водород или фтор; или
Q представляет собой фенильную группу формулы QB

в которой R3 представляет собой водород или фтор, a R4 представляет собой водород, фтор, хлор или бром; или каждый из R3 и R4 представляет собой хлор; или R3 представляет собой водород, a R4 представляет собой метилтио или 1,1-дифторэтил; а
R-CO представляет собой (R,R)-транс-2-метилциклопропанкарбонил.
2. Соединение по п.1, в котором Q представляет собой 4-метоксифенил, 3-фтор-4-метоксифенил, 4-этоксифенил, фенил, 4-фторфенил, 4-хлорфенил, 4-бромфенил, 3,4-дихлорфенил, 4-(метилтио)фенил или 4-(1,1-дифторэтил)фенил.
3. Соединение по п.1, в котором Q представляет собой QA.
4. Соединение по п.1, в котором Q представляет собой QB.
5. Соединение по п.4, в котором R4 представляет собой хлор.
6. Соединение по любому из пп.1 и 3, 4, в котором R3 представляет собой водород.
7. Соединение по п.1, представляющее собой (R,R)-N-[3-(4-хлорфенил)-4-метилизотиазол-5-ил]-2-метилциклопропанкарбоксамид или его фармацевтически приемлемую соль.
8. Фармацевтическая композиция, содержащая соединение формулы I или его фармацевтически приемлемую соль по любому из пп.1-7, а также фармацевтически приемлемый разбавитель, наполнитель или носитель.
9. Применение соединения формулы I по любому из пп.1-7 или его фармацевтически приемлемой соли для лечения боли.
10. Применение соединения формулы I по любому из пп.1-7 или его фармацевтически приемлемой соли для изготовления лекарственного средства для лечения боли.
Текст
Настоящее изобретение относится к замещенному карбоксамиду формулы I или его фармацевтически приемлемой соли, содержащей его фармацевтическую композицию, и применению такого соединения для лечения боли.(71)(73) Заявитель и патентовладелец: ЭЛИ ЛИЛЛИ ЭНД КОМПАНИ (US) 014233 Настоящая заявка испрашивает приоритет согласно временной предварительной заявке на патент США 60/811839, поданной 8 июня 2006 года. Изобретение относится к некоторым замещенным карбоксамидам, в частности к некоторым N-ацилированным замещенным производным 5-амино-4-метилизотиазола, а также к способам их получения,фармацевтическим композициям, содержащим замещенные карбоксамиды, и способам их применения.L-Глутамат представляет собой основной возбуждающий нейротрансмиттер центральной нервной системы, возбуждающий аминокислоту. Рецепторы глутамата подразделяются на два основных подтипа: ионотропные рецепторы, включающие лигандзависимые ионные каналы, и сопряженные с G-белками метаботропные рецепторы глутамата, состоящие из семи трансмембранных доменов (mGluRs). Семейство метаботропных рецепторов состоит из восьми членов и подразделяется на три группы по подобию последовательностей, механизмам передачи сигнала и фармакологическим особенностям. Рецепторы I группы (mGluR1 и mGluR5 и их сплайсированные варианты) положительно связаны с гидролизом инозитол фосфата и генерацией внутриклеточного кальциевого сигнала. Рецепторы II группы (mGluR2 иmGluR3) и III группы (mGluR4, mGluR6, mGluR7 и mGluR8) отрицательно связаны с аденилилциклазой и регулируют содержание циклического AMP (аденозин монофосфата) путем непрямого ингибирования активности аденилилциклазы. Рецепторы I группы локализованы в основном в постсинаптических структурах и увеличивают нейрональное возбуждение, в то время как рецепторы группы II и группы III локализированы в основном в пресинаптических структурах и функционируют как ауторецепторы,уменьшающие избыточное высвобождение глутамата. Таким образом, подтипы рецепторов mGlu обладают уникальными профилями экспрессии в центральной нервной системе и могут стать мишенями для новых и селективных агентов. См., например, Augelli-Szafran, С.Е.; Schwarz, R.D. Annual Reports in Medicinal Chemistry (2003) 38, 21-30, где антагонисты mGluR1 описаны как полезные в качестве нейропротекторных агентов в моделях церебрального инфаркта у животных, в моделях невропатической боли(наложение лигатуры на спинальный нерв), в моделях боли, индуцированной формалином, и в моделях мигрени. Кроме того, полезность антагонистов mGluR1 была показана в моделях эпилепсии (припадки) и моделях тревожности. В тканях, где обнаружены рецепторы mGluR1, они, возможно, вовлечены в процесс передачи боли. Глутамат представляет собой основной возбуждающий нейротрансмиттер, передающий сенсорную информацию нейронам спинного мозга и ЦНС при состояниях, сопровождающихся постоянной болью. Считается, что хроническая клиническая или постоянная боль зависит, по меньшей мере отчасти, от длительного повышения эффективности глуматергических сигналов в соматосенсорных нейронах спинного мозга и супраспинальных ноцицептивных центрах, следующего за интенсивными периферическими стимулами, повреждением ткани или нерва. Усиление синаптической передачи ведет к снижению болевого порога, усилению болевых ответов и распространению болевой чувствительности на неповрежденные области. Иммуноцитохимические данные показывают, что экспрессия рецепторов mGlu1 происходит в нескольких зонах восходящих глутаматергических ноцицептивных путей. Существуют свидетельства того, что стимуляция рецепторов mGlu1 стимулирует усиление возбуждения нейронов и быстрой глутаматергической синаптической передачи. Длительное действие механизмов передачи внутриклеточных сигналов, вызванное стимуляцией рецепторов mGlu1, способствует поддержанию данными рецепторами центральной сенсибилизации как на спинальном, так и на супраспинальном уровнях. Таким образом,ожидается, что уменьшение возбуждения при помощи антагониста рецептора mGlu1 будет успешным способом терапии состояний постоянной боли. Другое подтверждение возможности применения антагониста рецептора mGlu1 для облегчения выраженности ноцицептивных ответов, индуцируемых хроническими воспалительными и невоспалительными ноцицептивными стимулами, обнаружили в поведенческих исследованиях: селективный антагонист рецептора mGlu1 LY456236 может уменьшать защитный (болевой) ответ в формалиновом тесте и механическую аллодинию в модели невропатической боли с перевязкой спинального нерва L5/L6. См.,Varty, G.B. et al. Psychopharmacology (Berl.) (2005), 179, 207-217. Соединения согласно настоящему изобретению являются селективными антагонистами метаботропных рецепторов группы I, в частности рецептора mGluR1 (mGluR1), особенно рецепторов mGluR2,mGluR3 и mGluR4; кроме того, они, возможно, являются селективными относительно mGluR5. Благодаря этим свойствам соединения согласно настоящему изобретению полезны в лечении состояний, связанных с активностью метаботропных рецепторов глутамата, таких как боль, в частности хроническая боль (или длительная боль), например хроническая невропатическая боль; боль, связанная с хроническим воспалением суставов или хроническая невоспалительная/не невропатическая боль (NINN боль), а также при лечении мигрени или эпилепсии. Таким образом, согласно настоящему изобретению предложено соединение формулы I или его фармацевтически приемлемая соль,-1 014233 где Q представляет собой фенильную группу формулы QA в которой R1 представляет собой метил или этил, a R3 представляет собой водород или фтор; илиQ представляет собой фенильную группу формулы QB в которой R3 представляет собой водород или фтор, a R4 представляет собой водород, фтор, хлор или бром; или каждый из R3 и R4 представляет собой хлор; или R3 представляет собой водород, а R4 представляет собой метилтио или 1,1-дифторэтил; аR-CO представляет собой (R,R)-транс-2-метилциклопропанкарбонил. Выражение соединение формулы I или соединение согласно изобретению в настоящей заявке включает как само соединение, так и фармацевтически приемлемую соль указанного соединения. Следующие термины, используемые в данной заявке, означают (если не указано иное): галоген - фтор,хлор, бром или йод. Термины алкил, алкокси и т.п. обозначают прямые и разветвленные группы; однако конкретное наименование радикала, например пропил, относится лишь к прямым (нормальным) радикалам, а изомер с разветвленной цепью называют специальным термином, таким как, например, изопропил. Если группа R-CO является хиральной, соединение формулы I может существовать в виде смеси энантиомеров, например в виде рацемической смеси, и/или в смеси с любым из цис-диастереомеров. Предпочтительно соединение согласно настоящему изобретению представляет собой, по существу, чистый (R,R)-изомер с избытком энантиомера, составляющим, например, 95% или более. Как показано ниже, соединение формулы I или его фармацевтически приемлемая соль могут проявлять полиморфизм и/или могут образовывать сольваты с водой или органическим растворителем. Настоящее изобретение охватывает также любую из подобных полиморфных форм, любые сольваты или любую их смесь. В частности, группа Q может представлять собой 4-метоксифенил, 3-фтор-4-метоксифенил, 4 этоксифенил, фенил, 4-фторфенил, 4-хлорфенил, 4-бромфенил, 3,4-дихлорфенил, 4-(метилтио)фенил или 4-(1,1-дифторэтил)фенил. Примером соединения формулы I является соединение, где Q представляет собой QA. Другим примером соединения формулы I является соединение, где Q представляет собой QB, и, в частности, R4 представляет собой хлор. Для всех упомянутых выше соединений примером R3 является водород. Если Q представляет собой QB, R4 представляет собой хлор, а R представляет собой водород, то соединение формулы I представляет собой (R,R)-N-[3-(4-хлорфенил)-4-метилизотиазол-5-ил]-2-метилциклопропанкарбоксамид (или его фармацевтически приемлемую соль). Предпочтительным соединением формулы I является (R,R)-N-[3-(4-метоксифенил)-4-метилизотиазол-5-ил]-2-метилциклопропанкарбоксамид (или его фармацевтически приемлемая соль). Фармацевтически приемлемой солью соединения согласно изобретению является соль присоединения кислоты соединения формулы I и органической или неорганической кислоты с физиологически приемлемым анионом. Согласно дополнительному аспекту изобретения предложена фармацевтическая композиция, содержащая соединение формулы I или его фармацевтически приемлемую соль в соответствии с данным описанием, вместе с фармацевтически приемлемым разбавителем, наполнителем или носителем. Далее предложена фармацевтическая композиция для лечения боли, в частности хронической боли,содержащая в качестве активного ингредиента соединение формулы I или его фармацевтически приемлемую соль в соответствии с данным описанием. Фармацевтическую композицию, содержащую соединение формулы I, можно получить традиционным способом, включающим контроль за размерами частиц, такой как микронизация или применение нанодисперсии. Предпочтительно фармацевтическая композиция представляет собой композицию, пригодную для перорального введения. Соединение формулы I можно получить стандартным способом, включающим методики, известные специалистам в области синтеза соединений - структурных аналогов, или же описанным в настоящей заявке новым способом. Описанный в настоящей заявке новый способ получения соединения формулы I или его фармацевтически приемлемой соли, а также новых промежуточных соединений для получения соединения формулы I представляет собой еще один аспект изобретения; далее представлены иллюстративные способы, значения радикалов совпадают с определенными выше, если не указано иное. Таким образом, предложен способ получения соединения формулы I или его фармацевтически при-2 014233 емлемой соли, соответствующего любому из приведенных выше описаний, включающий стадию, выбранную из:(А) ацилирования амина формулы II с использованием кислоты формулы HOOC-R или ее активированного производного;(В) для соединения формулы I, где Q представляет собой QA, алкилирования кислорода фенола соединения формулы III в которой R3 представляет собой водород или фтор, с применением реагента формулы R1-Y, где Y представляет собой обычную уходящую группу при нуклеофильном замещении; и(С) метилирования соответствующего соединения формулы VI в которой X представляет собой бром или йод; после чего, для любой из описанных выше методик, в случае необходимости получить фармацевтически приемлемую соль соединения формулы I, ее получают путем проведения реакции основной формы соединения формулы I с кислотой с получением физиологически приемлемого противоиона или любым другим традиционным способом; и где, если не указано иное, Q, R-CO и R1 имеют любое из описанных выше значений. Таким образом, согласно одному аспекту изобретения предложено соединение, выбранное из группы: в которой R3 представляет собой водород или фтор, и в которой X представляет собой бром или йод, где, если не указано иное, Q и R-CO могут иметь любое из определенных выше значений. Для кислоты формулы HOOC-R типичные активированные производные включают сложный эфир(в частности, сложный эфир низшего алкила, такой как метиловый или этиловый эфир, или бензиловый эфир), галогенангидрид (в частности, хлорангидрид) и активированный эфир или ангидрид (включая 4 нитрофениловый сложный эфир и активированный сложный эфир или ангидрид, полученный из связывающего реагента). В случае сложного эфира низшего алкила или бензилового эфира ацилирование можно осуществить при помощи, например, триметилалюминия или т-бутоксида калия. Уходящая группа Y в настоящей заявке представляет собой фрагмент, замещаемый в ходе реакции нуклеофильного замещения, например галогеновую группу (такую как бром или йод), сульфонатную эфирную группу (такую как метилсульфонилокси, п-толуилсульфонилокси или трифторметилсульфонилокси, и, в частности, для метилирования, метоксисульфонилокси), или реагенты для реакции Мицунобу,-3 014233 такие как производные, полученные при обработке спирта трифенилфосфином, диэтиловым азодикарбоксилатом и триэтиламином. Для метилирования соединения формулы VI, где X представляет собой бром или йод, можно применять реакцию сочетания Штилле с использованием, например, тетраметилтина и катализатора Штилле(Stille), такого как бис-(трифенилфосфин)палладия(II) хлорид, в диметилформамиде; или в качестве альтернативы трансметаллирования - метилирования с использованием, например, бутиллития с последующим взаимодействием с метилйодидом в тетрагидрофуране. Кислоту формулы HOOC-R можно получить способом, известным из литературы. Обычно кислоту формулы HOOC-R получают способом, описанным ниже. Обычно кислоту формулы HOOC-R выделяют в виде соли, предпочтительно в виде соли (S)-2-амино-3-фенил-1-пропанол (R,R)-2-метилциклопропанкарбоновой кислоты (1:1) предпочтительно в кристаллической форме, которая составляет следующий аспект изобретения. Таким образом, предложен способ, в котором кислоту формулы HOOC-R, или ее активированное производное соединение, получают традиционным способом из соли (S)-2-амино-3 фенил-1-пропанол (R,R)-2-метилциклопропанкарбоновой кислоты (1:1). Амин формулы II легко получить способом, описанным ниже. В общем, бензонитрил формулы Q-CN конденсируют с пропионитрилом с образованием нитрила формулы IV с применением тиоацетамида. Окисление тиоамида формулы V удобно осуществлять путем взаимодействия с перекисью водорода, при этом образуется 5-аминоизотиазол формулы II. Соединение формулы III в которой R-CO представляет собой (R,R)-транс-2-метилциклопропанкарбонил и R3 представляет собой водород или фтор, составляет другой аспект изобретения. Данное соединение можно получить путем ацилирования соответствующего аминофенола формулы IIa с использованием кислоты формулы HOOC-R или ее активированного производного. Соединение формулы IIa можно получить путем удаления защитной группы О из соответствующего соединения, в котором кислород фенола защищен O-защитной группой. Соединение формулы IIa можно без труда приготовить путем О-деметилирования соответствующего метоксисоединения формулы II. Пример соединения формулы III: -(R,R)-N-[3-(4-гидроксифенил)-4-метилизотиазол-5-ил]-2-метилциклопропанкарбоксамид. Соединение формулы VI, где X представляет собой бром или йод, можно получить путем бромирования или йодирования соответствующего соединения формулы VII-4 014233 Соединение формулы VII можно получить путем ацилирования соответствующего амина формулы с использованием кислоты формулы HOOC-R или ее активированного производного. Амин формулы VIII можно получить способом, аналогичным описанному способу получения амина формулы II, с тем отличием, что в качестве исходного реагента берут бензонитрил формулы Q-CN и ацетонитрил, в результате чего получают нитрил формулы IX и после окислительной циклизации получают амин формулы VIII. В качестве альтернативы тиоамид формулы X можно привести во взаимодействие с 2 экв. (или несколько большим количеством, приблизительно 2,2 экв.) брома, что обеспечивает циклизацию и бромирование с образованием амина формулы VIIIa который ацилируют с использованием кислоты формулы HOOC-R или ее активированного производного, с получением соответствующего соединения формулы VI, где X представляет собой бром. Кроме того, существует следующий альтернативный способ получения соединения формулы VI,где X представляет собой бром. При ацилировании 3,4-дибромизотиазол-5-иламина формулы XI с использованием кислоты формулы HOOC-R или ее активированного производного образуется соответствующее соединение формулы XII из которого при кросс-сочетании с бороновой кислотой формулы Q-B(OH)2 получают соединение формулы VI, где X представляет собой бром. Относительная эффективность и селективность соединений согласно настоящему изобретению в отношении рецепторов mGlu1 оценивали с использованием устойчивых клонированных линий клеток,экспрессирующих рекомбинантные рецепторы mGlu1, 2, 3, 4, 5 или 8, трансфецированных в линии клетокAV12, содержащие клетки с транспортерами глутамата (RGT) EAAT1 крысы. Например, оценивали эффект воздействия соединения согласно настоящему изобретению на индуцированный глутаматом ответ - изменение потока кальция в клетках линии AV-12, экспрессирующих рекомбинантный белок-рецептор mGlu1a человека (см., Kingston et al. Neuropharmacology, 37(1):1-12,1998). Реакцию, опосредуемую рецептором mGlu1, оценивают по изменению внутриклеточных концентраций кальция, измеряемых при помощи чувствительного к кальцию флуоресцентного красителя Fluo-3. Клетки собирают и высевают в 96-луночный микротитрационный планшет. После 48-часовой инкубации в инкубаторе с увлажнением при 37 С клетки обрабатывают 10 мкМ красителем Fluo-3 AM и выдерживают в течение 60 мин при 25 С. Не поглощенный клетками краситель удаляют из лунок путем промывания буферным раствором, затем планшеты переносят в 96-канальное устройство для считывания флуоресценции (FLIPR-Molecular Devices Corporation, La Jolla, Калифорния, США). Фоновое значение флуресценции измеряли в течение 10 с перед добавлением тестируемых соединений при помощи автоматической пипетки, встроенной в аппарат FLIPR. После 20 с выдерживания в лунки добавили глутамат в концентрации ЕС 90% (90% эффективной концентрации, 10 мкМ); в течение 60 с проводили мониторинг изменения флуоресценции. Ингибирующее действие соединений определяют путем сравнения пика-5 014233 флуоресценции в ответ на введение глутамата в присутствии и в отсутствие соединений. Величины IC50 рассчитывали при помощи программы анализа четырехпараметрической логистической кривой (GraphPad Prism V4 or Activity Base V5.3 software). Величина IC50, рассчитанная для соединений, представленных здесь в качестве примеров, составляет менее 100 нМ. Например, для каждого из соединений примеров 1 и 6 величина IC50, измеренная в ходе описанного выше скрининга, составила менее 20 нМ. Для выявления дополнительных характеристик соединений в связи можно, помимо in vivo исследований на крысах, провести аналогичный тест с использованием рецептора mGlu1 крысы. Показано, что соединения согласно настоящему изобретению демонстрируют активность в моделях боли in vivo у крыс. Ниже представлен обзор хорошо известных моделей боли. Например, в дозах, при которых не наблюдалось поведенческого дефицита в тесте на аппарате Rotorod, описанном ниже, для соединения из примера 1 продемонстрировали зависимость активности от дозы на крысах-самцах HarlanSprague Dawley (HSD, 200-250 г), не получавших пищу, моделях с применением формалина, каррагенана,каспаицина, а также в модели отдергивания хвоста; а для получавших пищу крыс HSD (300-350 г) - в модели перевязки спинального нерва L5/L6. Если не указано иное, все данные анализировали методом анализа вариации (ANOVA) и при помощи t-критерия Даннета с применением программного обеспечения JMPv4.1 (SAS Institute Inc., Cary, NC). Данные выражены в виде средних величин SEM (стандартная ошибка среднего). Для каждой модели кратко описаны специфические условия. Формалиновая модель Лекарство вводят перед подкожной инъекцией формалина (50 мкл, 5%) в дорсолатеральную область правой задней лапы. Автоматизированным способом регистрируют эпизоды лизания лапы в виде количества событий в период от 0 до 50 мин после введения формалина. Данные выражают в количестве поведенческих событий - лизания лапы - в ранней фазе (0-5 мин) или поздней фазе (15-40 мин). В данной модели соединение из примера 1 продемонстрировало дозозависимое затухание болевого поведения в поздней фазе у крыс, не получавших пищи, при введении дозы от 3 до 60 мг/кг перорально перед инъекцией формалина, а соединение из примера 6 демонстрирует дозозависимое затухание при введении в дозу от 1 до 30 мг/кг. Модель перевязки L5/L6 спинального нерва Накладывают лигатуру на L5 и L6 спинальные нервы (только на одну сторону). Через две недели измеряют болевое поведение по механической аллодинии с помощью нитей фон Фрея с возрастанием изгибающей силы (0,5-15 г) в различные моменты времени после введения лекарства. Модель каррагенанового воспаления Через два часа после инъекции каррагенана (100 мкл, 3%) в поверхность подошвы правой задней лапы вводят тестируемое лекарственное средство. При помощи терморадиационного источника измеряют чувствительность к температуре с 30-секундными интервалами, чтобы предотвратить повреждение тканей. Измеряют задержку отдергивания конечности в виде разности между временем отдергивания для воспаленной лапы и невоспаленной левой лапы. Капсаициновая модель Лекарственное средство вводят перед инъекцией капсаицина (25 мкл, 30 мкг) в оливковом масле в поверхность подошвы правой задней лапы. Измеряют болевое поведение по механической аллодинии с помощью нитей фон Фрея (0,5-15 г). Измерения проводят через 15 мин и 1 ч после введения капсаицина. Модель отдергивания хвоста Для оценки времени ответа - отдергивания хвоста - использовали терморадиационный источник у основания хвоста; воздействие производили с 10-секундными интервалами в различные моменты времени после введения лекарства. Тест с Rotorod Для этого теста использовали самцов крыс Sprague Dawley (180-230 г, Harlan labs, Indianapolis). В ходе исследования изучали способность антагонистов mGlu1 индуцировать седативный эффект/атаксию с помощью автоматического вращающегося с ускорением устройства Rotorod (Omnitech Electronics Inc.,Columbus, ОН), подключенного к компьютеру IBM PC, как описано в литературе (Simmons et al., Neuropharmacol (1998) 37, 25-36). Исследование на аппарате Rotorod проводили перед введением лекарственного средства и повторяли через 1, 2, 3 и 4 ч после перорального введения, например, 60 мг/кг лекарственного средства крысам, не получавшим пищи. Выбранные временные точки соответствуют тестированию поведения в моделях боли. Животные, сохраняющие положение тела и не упавшие с Rotorod'а, получают максимальную оценку - 40 с. Данные анализируют методом анализа вариации (ANOVA) и с использованием t-критерия Даннета с использованием программного обеспечения JMPv4.1 (SAS InstituteInc., Cary, NC). Данные выражены в виде средних величин SEM. Таким образом, ожидается, что соединения согласно настоящему изобретению могут быть полезны в случае, когда показано применение антагониста рецептора mGlu1. В частности, полагают, что соединения согласно настоящему изобретению полезны для лечения боли, в частности хронической (или длительной) боли, например хронической невропатической боли, хронической воспалительной/связанной с заболеваниями суставов боли, или хронической невоспалительной боли, или боли, не связанной с невропатическими состояниями (NINN), а также для лечения мигрени или эпилепсии. Соответственно, один из-6 014233 частных аспектов изобретения относится к лечению хронической невропатической боли; другой частный аспект относится к лечению хронической воспалительной/связанной с заболеваниями суставов боли; еще один частный аспект изобретения относится к лечению хронической невоспалительной боли или боли,не связанной с невропатическими состояниями. Невропатическая боль включает боль, связанную с периферической диабетической невропатией и постгерпетической невралгией. Кроме того, соединение согласно настоящему изобретению можно применять для лечения эпилептических судорог или в качестве агента, уменьшающего тревожность, а также в качестве нейропротектора после церебрального инфаркта. Таким образом, согласно другому аспекту изобретения предложен способ лечения боли, в частности хронической боли, у млекопитающих, в частности у человека, нуждающегося в лечении, включающий введение млекопитающему эффективного количества соединения формулы I или его фармацевтически приемлемой соли, где значения Q и R определены выше. Млекопитающее, нуждающееся в лечении,может представлять собой домашнее животное, такое как лошадь, или животное-компаньон, такое как кошка или собака. Также предложено применение соединения формулы I согласно любому из представленных здесь определений или его фармацевтически приемлемой соли в качестве медикамента. Далее предложено также применение соединения формулы I или согласно любому из данных в настоящей заявке определений или его фармацевтически приемлемой соли, где значения Q и R определены выше, для лечения боли, в частности хронической боли. Кроме того, предложено также применение соединения формулы I или его фармацевтически приемлемой соли, где значения Q и R определены выше, для изготовления медикамента для лечения боли, в частности хронической боли. Во всех утверждениях настоящей заявки формой хронической боли является невропатическая боль. Другой формой хронической боли является хроническая воспалительная/связанная с заболеваниями суставов боль. Еще одной частной формой хронической боли является хроническая невоспалительная боль/боль, не связанная с невропатическими состояниями (NINN). Конкретную дозу соединения согласно настоящему изобретению для введения пациенту определяют, разумеется, в зависимости от обстоятельств конкретного случая, включая, например, вводимое соединение, скорость введения и состояние пациента. Обычная дневная доза, которую вводят (предпочтительно, перорально) либо в один прием, либо разделив на две или более доз, для лечения хронической боли может составлять от 1 до 300 мг/день, в частности от 5 до 200 мг/день. Таким образом, соединение согласно настоящему изобретению можно применять для лечения боли или для профилактики боли. Согласно следующим иллюстративным примерам и способам в описании используют следующие обозначения и сокращения: R-CO представляет собой (R,R)-транс-2-метилциклопропанкарбонил; ДМФдиметилформамид; ДМСО-диметилсульфоксид (пердейтерированный [-d6] для ЯМР); экв. - эквивалент(ы); ES-MS, масс-спектрометрия с ионизацией в электроспрее; EtOAc - этилацетат; FID, ПИДдетектор ионизации в пламени; GC, ГХ-газовая хроматография; HPLC, ВЭЖХ - жидкостная хроматография высокого давления; LCMS - жидкостная хроматография-масс спектрометрия; МеОН - метанол; МТВЕ - метил т-бутиловый эфир; ЯМР - ядерно-магнитная резонансная спектроскопия или спектрометрия; TEA - триэтиламин; TFA - трифторуксусная кислота; THF, ТГФ - тетрагидрофуран; TLC - тонкослойная хроматография; UV, УФ - ультрафиолет (детекция); са. - приблизительно; ее - энантиомерный избыток; Ph - фенил; насыщ. - насыщенный. Реактивы приобретали в различных коммерческих источниках. Растворители обычно удаляли (отгоняли) при пониженном давлении. В некоторых описаниях синтеза указанные выходы относятся к выходам неочищенных продуктов, выделенных выпариванием или фильтрованием, и использованных непосредственно без дополнительной очистки. Синтез бензил (R,R)-2-метилциклопропанкарбоксилата Приготовили раствор 2,0 М оксалилхлорида в дихлорметане с добавлением 98% оксалилхлорида(110,0 мл) к безводному дихлорметану (600,0 мл) при перемешивании. Полученный раствор оксалилхлорида (1,20 моль) в течение 1 ч добавили по каплям при перемешивании к раствору 2-метилциклопропанкарбоновой кислоты (продукт, предлагаемый на рынке, представляет собой смесь цис-транс-изомеров,120,0 г, 1,20 моль) в толуоле (800,0 мл), содержащем ДМФ (0,6 мл, 7,8 ммоль). Смесь перемешивали в течение 2 ч при комнатной температуре; затем добавили по каплям к раствору бензилового спирта(114,0 мл, 1,10 моль), безводного ТГФ (800,0 мл) и пиридина (194,0 мл, 2,41 моль) в течение 1,5 ч. По окончании добавления реагентов смесь перемешивали в течение еще 1 ч, затем разделили между этилацетатом (2 л) и 10% водным карбонатом калия (2 л); органическую фазу промыли (10% водным карбонатом калия (2 л) и солевым раствором (2 л, высушили (MgSO4) и выпарили до образования жидкого остатка. После хроматографии на силикагеле (элюент - 5% этилацетат в гексане) получили основной продукт, рацемический бензил транс-2-метилциклопропанкарбоксилат в виде прозрачной, бесцветной жидкости (193,8 г, 93%). 1 Н ЯМР (ДМСО-d6):7,38 (м, 5 Н), 5,05 (с, 2 Н), 1,42 (м, 1 Н), 1,30 (м, 1 Н), 1,06 (д, J=6,0 Гц, 3 Н), 1,04(м, 1 Н), 0,74 (м, 1 Н). Рацемический сложный эфир (189 г) разделили методом хиральной ВЭЖХ. Условия синтеза: ста-7 014233 ционарный способ с повторением цикла. Колонка: Chiralcel OJ, 832 см; элюент: 10/90 изопропанол/гептан; скорость потока: 375 мл/мин; визуализация: УФ на 220 нм; время цикла: около 7,1 мин; загрузка: приблизительно 21 мл/на ввод (0,5 г загрузка), пробу растворяют в элюенте - 0,025 мг/мл; в результате получили бензил (R,R)-транс-2-метилциклопропанкарбоксилат (73 г) - более 99,7% методом хиральной ВЭЖХ, условия анализа: Chiralcel OJ. 4,6250 мм; элюент: 10/90 изопропанол/гептан; скорость потока 1,0 мл/мин; визуализация: УФ при 220 нм; время удерживания: 6,5 мин и 7,2 мин. Альтернативный способ синтеза бензил (R,R)-2-метилциклопропанкарбоксилата Смесь 2-метилциклопропанкарбоновой кислоты (продукт, предлагаемый на рынке, представляет собой смесь цис-транс-изомеров, 75,0 г, 0,75 моль) и 1 N NaOH (900 мл, 0,90 моль) нагревали и перемешивали при 45 С. К раствору добавили при перемешивании бензилбромид (131,0 мл, 1,10 моль) и метилтриалкил (С 8-С 10) хлорида аммония (Adogen 464, 37,5 г). Смесь перемешивали при 40-45 С в течение 4 ч, охладили до комнатной температуры и экстрагировали этиловым эфиром (800 мл). Органическую фазу высушили (MgSO4) и выпарили до образования жидкого остатка. После хроматографии на силикагеле (элюент - гексан, градиентное 5% этилацетата в гексане), получили рацемический бензил транс-2 метилциклопропанкарбоксилат в виде жидкости (132,2 г, 93%); 1 Н ЯМР (ДМСО-d6):7,40 (м, 5 Н), 5,05(с, 2 Н), 1,43 (м, 1 Н), 1,30 (м, 1 Н), 1,06 (д, J=6,0 Гц, 3 Н), 1,02 (м, 2 Н), 0,74 (м, 1 Н). (Примечание: если ЯМР выявляет наличие небольшого количества цис-изомера, его удаляют путем разделения методом хиральной ВЭЖХ согласно описанному выше способу). Синтез (R,R)-2-метилциклопропанкарбоновой кислоты, называемой также (R,R)-транс-2 метилциклопропанкарбоновой кислотой А. Синтез рацемической 2-метилциклопропанкарбоновой кислоты.i. Диметилоксосульфония метилид (раствор в ДМСО). В атмосфере азота к суспензии триметилсульфоксония йодида (2,47 кг, 1,05 экв.) в ДМСО (8,00 л) при перемешивании добавили гидроксид калия (90 вес.%, 0,69 кг, 1,05 экв.) порциями - по 100 г на порцию. (В качестве альтернативы основание можно добавить в один прием, в этом случае наблюдается экзотермический эффект). Дополнительно добавили ДМСО (4,00 л) и перемешивали реакционную смесь при комнатной температуре до получения гомогенной смеси (возможно наличие нерастворенных гранулKOH, которые не добавляют на следующем этапе), при этом процесс образования илида завершаетсяii. Этил 2-метилциклопропанкарбоксилат. К раствору этил транскротоната (1,20 кг, 1,31 л, 1,00 экв.) в ДМСО (3,00 л) при температуре окружающего воздуха в течение 30 мин добавляли раствор илида, полученный на предыдущем этапе, при этом температуру реакционной смеси поддерживали на уровне приблизительно 15-20 С. Мониторинг протекания реакции осуществляли методом газовой хроматографии (ГХ, условия описаны ниже); реакцию прекращали, когда оставалось лишь малое количество остаточного кротоната относительно 2-метилциклопропанкарбоксилата (приблизительно 20-24 ч). Для обработки реакционную смесь разделяли на две равные порции (8,5 л); каждую порцию обрабатывали следующим образом: добавили метил т-бутиловый эфир (МТВЕ, 6 л), двухфазную смесь охладили до 15 С, затем по каплям добавили воду (6 л) приблизительно за 45 мин, поддерживая температуру ниже 23 С. После разделения фаз органическую фазу промыли дважды 10% солевым раствором; растворитель удалили под вакуумом в мягких условиях(400 мбар, температура бани 35 С); получили этил 2-метилциклопропанкарбоксилат (1,00 кг, 26,8%),содержащий приблизительно 3,3 экв. МТВЕ. Условия ГХ: колонка: Varian VF-1ms, длина: 60 м, диаметр 320 мкм, толщина: 1 мкм; газ: гелий; Т: от 80 до 300 С в течение 35 мин; время цикла: 35 мин; детекция: ДИП; пробу непосредственно разводили в метаноле.iii. 2-метилциклопропанкарбоновая кислота. Описанную выше смесь, содержащую этил 2-метилциклопропанкарбоксилат (1,00 кг, 1,00 моль,1,00 экв.), объединяют с водой (4,00 л) и 10,4 М раствором гидроксида натрия (0,32 л, 1,20 экв.), смесь нагревают до 46 С, при этом происходила постепенная дистилляция МТВЕ. (Если эфир обнаруживается во фракции дистиллята МТВЕ при газохроматографическом анализе, его возвращают в реакционную смесь; а МТВЕ вновь перегоняют.) Когда данные газохроматографического анализа продемонстрировали отсутствие эфира в реакционной смеси (приблизительно 1-4 ч), смесь охладили до 20 С, добавили дистиллят и дополнительное количество МТВЕ (2 л), затем слои разделили. Водную фазу подкислили 12,18 М соляной кислотой и экстрагировали МТВЕ (34 л). МТВЕ осторожно удалили под вакуумом(например, 400 мбар, далее 200 мбар, температура бани 35 С) из объединенных органических экстрактов,в результате получили рацемическую 2-метилциклопропанкарбоновую кислоту, содержащую остаточное количество МТВЕ, которую непосредственно использовали для разделения. (Анализ продукта, полученного в результате описанного синтеза, методами газовой хроматографии и ЯМР показал, что выход составил 0,99 экв. рацемической 2-метилциклопропанкарбоновой кислоты, содержащей 1,7% цис-изомера и 0,3 экв. МТВЕ.) В. Синтез соли (S)-2-амино-3-фенил-1-пропанол (R,R)-2-метилциклопропанкарбоновой кислоты(1:1), называемой также (S)-фенилаланиноловой (1:1) солью (R,R)-2-метилциклопропанкарбоновой кислоты. Рацемическую транс-2-метилциклопропанкарбоновую кислоту (20 г, 0,2 моль) растворили в этилацетате (200 мл). Добавили в один прием (S)-2-амино-3-фенил-1-пропанол (называемый также (S)-фенилаланинолом) (15,6 г, 0,103 моль, 0,51 экв) и нагрели смесь до 65-70 С. По окончании кристаллизации,которую можно ускорить внесением затравки, суспензию перемешивали при комнатной температуре в течение 20 ч, затем фильтровали и промыли кристаллы этилацетатом (215 мл). Кристаллы сушили при 40 С под вакуумом в течение 3 ч: масса продукта 18,4 г (37% молярный выход, энантиомерный состав после хиральной ГХ=85/15, условия хиральной ГХ описаны ниже). Кристаллы ресуспендировали в 370 мл этилацетата; суспензию нагревали с обратным холодильником в течение 1 ч, охлаждали до комнатной температуры в течение ночи, кристаллы отфильтровали, промыли и высушили описанным выше способом: масса 16,7 г (91% выход, хиральный состав 96/4). После повторной очистки в этилацетате(170 мл) вышеописанным способом получили соль (S)-2-амино-3-фенил-1-пропанол (R,R)-2-метилциклопропанкарбоновой кислоты (1:1) (16,12 г, 96,5% выход, хиральный состав 99/1=98% ее; 32% - общий выход из рацемической транс-2-метилциклопропанкарбоновой кислоты). 1 Н ЯМР (400 МГц, ДМСО):0,47 (м, 1 Н), 0,84 (м, 1 Н), 1,01 (д, 3 Н), 1,07 (м, 2 Н), 2,5 (м, 1 Н), 2,7 (м,1 Н), 3,0 (м, 1 Н), 3,25 (дд, 1 Н), 3,35 (д, 2 Н), 5,0-5,2 (ушир., 4 Н), 7,2 (м, 3 Н), 7,3 (дд, 2 Н); т.пл. соли (98% ее) 130-131 С. Условия хиральной ГХ: колонка: Hydrodex B-PM; газ-носитель: гелий; температура инжектора Т: 200 С; давление: 30 фунтов на кв.дюйм; отношение потоков 1/100; детекция: ДИП, 230 С; поток: 50 мл/мин; объем вводимой пробы: 1 мкл: начальная Т: 130 С. Время удерживания R,R-энантиомера: 8,3 мин (8,08 мин для S,S-энантиомера). Подготовка пробы: соль (са. 10 мг) растворили в 1 N HCl (са. 1 мл) и свободную кислоту экстрагировали этилацетатом (са. 1 мл). Экстракт, содержащий этилацетат, вводят непосредственно в газохроматографическую систему. С. Синтез (R,R)-2-метилциклопропанкарбоновой кислоты. К соли (S)-2-амино-3-фенил-1-пропанол (R,R)-2-метилциклопропанкарбоновой кислоты (1:1)(12,6 г, 0,05 моль) добавили 1 N водн. HCl (100 мл, 0,1 моль). После перемешивания в течение 10 мин раствор экстрагировали этилацетатом (250 мл). Органические экстракты высушили (MgSO4) и сконцентрировали под вакуумом (40-45 С/200 мбар); получили (R,R)-2-метилциклопропанкарбоновую кислоту (5 г, 100%) в виде бесцветного масла. 1 Н ЯМР (400 МГц, CDCl3):0,75 (м, 1 Н), 1,1 (д, 3 Н), 1,2 (м, 1 Н), 1,3 (м, 1 Н), 1,42 (м, 1 Н), 11,0i. Диметилоксония метилид (раствор в ДМСО). К суспензии йодида триметилсульфоксония (1,18 экв.) в ДМСО (около 3,3 мл на г йодида) в атмосфере азота добавили при перемешивании т-бутоксид калия (1,05 экв.) в один прием; при этом наблюдался экзотермический эффект. Реакционную смесь перемешивали при 20-35 С до получения гомогенной смеси и завершения образования илида.ii. Этил 2-метилциклопропанкарбоксилат. Раствор этилтранскротоната (1,00 экв.) в ДМСО (3 мл на г эфира) нагрели до 80 С. К этому раствору медленно добавили раствор илида, полученный описанным выше способом, поддерживая температуру реакционной смеси на уровне 80 С. По окончании добавления/реакции (обычно около 1 ч) анализ методом газовой хроматографии (описанный выше) показал наличие лишь остаточного количества этил кротоната относительно этил 2-метилциклопропанкарбоксилата.iii. 2-метилциклопропанкарбоновая кислота. Описанную реакционную смесь охладили до 20 С, добавили за 15 мин водный KOH (5% вес./вес.,около 1,14 экв. KOH), поддерживая в реакционной смеси температуру 20-30 С. Дополнительно перемешивали реакционную смесь 2-3 ч (до исчезновения остаточного эфира (по данным описанного г анализа методом газовой хроматографии). Полученный раствор (рН около 12 по рН-индикаторной бумаге) подкислили до рН 2-3 при 20-30 С медленным добавлением 1,5 N HCl; затем смесь экстрагировали тремя порциями изопропилацетата (каждая порция 5 мл на грамм исходного этил транскротоната). Объединенные органические фазы промыли 15% солевым раствором и частично перегнали под вакуумом(100-300 мбар), температура бани 45 С (и при необходимости еще раз растворили в изопропилацетате); получили раствор, соответствующий приблизительно 10 мл на грамм (согласно вычислениям) 2-метилциклопропанкарбоновой кислоты для использования в процессе разделения способом, аналогичным описанному выше. Альтернативный способ синтеза (R,R)-2-метилциклопропанкарбоновой кислоты К триэтилфосфоноацетату (4,5 г, 19,67 ммоль) в безводном 2-метилтетрагидрофуране (40 мл) в ат-9 014233 мосфере азота добавили по каплям гексиллитий (2,3 М в гексане, 8 мл, 18,4 ммоль) в течение 20 мин,поддерживая температуру между 19 и 25 С. Через 30 мин добавили (S)-пропилен оксид (1,17 г, 20,15 ммоль) и перенесли смесь в реактор емкостью 160 мл, изготовленный из нержавеющей стали реактор высокого давления (Парра). Смесь нагревали до 150 С в течение 15 мин и перемешивали при данной температуре в течение 16 ч (ЯМР-анализ неочищенного вещества показал 95% конверсию в этил(R,R)-2-метилциклопропанкарбоксилат). Добавили воду (50 мл) и 30% водный NaOH (25 мл) и перемешивали двухфазную смесь при нагревании с обратным холодильником в течение 5 ч. Слои разделили и отделили органическую фазу. 37% водную HCl (25 мл) добавили в водный слой и экстрагировали смесь изопропилацетатом (250 мл). Органический слой, содержащий (R,R)-2-метилциклопропанкарбоновую кислоту, промыли 10% воднымNaCl (325 мл) и частично перегнали под вакуумом до общей массы 14,5 г, затем в один прием добавили (S)-2-амино-3-фенил-1-пропанол (называемый также (S)-фенилаланинолом) (3,01 г, 19,91 ммоль), что вызвало спонтанную кристаллизацию соли (S)-2-амино-3-фенил-1-пропанол (R,R)-2-метилциклопропанкарбоновой кислоты (1:1). Суспензию перемешивали в течение ночи. Кристаллы отфильтровали, промыли изопропилацетатом (4 мл) и высушили при 40 С под вакуумом; получили соль (S)-2-амино-3-фенил 1-пропанол (R,R)-2-метилциклопропанкарбоновой кислоты (1:1) (3,4 г, 69% общий выход). Хиральная ГХ: 99,5% ее, 98% de. (В качестве альтернативы кислоту можно без труда выделить в виде соли дициклогексиламина (1:1).) Соль можно преобразовать в (R,R)-2-метилциклопропанкарбоновую кислоту способом, аналогичным описанному выше. Синтез нитрила формулы IV Если не указано иное, нитрил формулы IV с указанным значением Q получали из соответствующего бензонитрила формулы Q-CN и пропионитрила способом, аналогичным описанному ниже, в синтезеNaHCO3 и экстрагировали EtOAc. Перегнали органический раствор и провели кристаллизацию из смеси гексан/EtOAc; получили 3-амино-3-(4-метоксифенил)-2-метилакрилонитрил. Выход: 35,1%. ES-MS: m/e 189,2 (m+1). Синтез IV-6, Q=4-хлорфенил. В круглодонную колбу емкостью 2 л (снабженную резиновой перегородкой, со слоем азота и приспособлением для перемешивания) поместили 4-хлорбензонитрил (60,0 г, 1,00 экв., 432 ммоль), пропионитрил (61,2 мл, 2,00 экв., 864 ммоль), тетрагидрофуран (43,2 мл) и 1,0 М т-бутоксид калия в т-бутаноле(трет-бутиловый спирт, производное калия, 475 мл, 1,10 экв., 475 ммоль) и перемешивали в течение 24 ч. Погасили водн. NaHCO3 и экстрагировали этилацетатом. Дважды промыли органическую фазу солевым раствором, высушили (K2CO3), профильтровали и сконцентрировали до сухого состояния. Очистили методом флэш-хроматографии на силикагеле (элюент - этилацетат/гексан от 15:85 до 50:50), получили 3 амино-3-(4-хлорфенил)-2-метилакрилонитрил (в виде неопределенной Е-/Z-смеси). Выход: 49,5%.LCMS: 193,0 (m+1). Синтез IV-7, Q=4-бромфенил: 3-амино-3-(4-бромфенил)-2-метилакрилонитрил Синтез тиоамида формулы V Если не указано иное, тиоамид формулы V, с указанным значением Q, получали из соответствующего нитрила формулы IV способом, аналогичным описанному ниже, в синтезе V-1. Синтез V-1, Q=4-метоксифенил. К раствору 3-амино-3-(4-метоксифенил)-2-метилакрилонитрила (24,8 г, 132 ммоль), тиоацетамида(19,8 г, 264 ммоль) и диоксана (132 мл) в атмосфере безводного азота добавили HCl (4 N в диоксане,659 мл, 2,640 ммоль). Перемешивали в течение 2 ч. Удалили растворитель, разбавили твердые вещества диоксаном (20 мл) и добавили безводный TEA (40 мл). Добавили нас. K2CO3 и экстрагировали EtOAc. Выпарили органический растворитель и провели кристаллизацию из смеси СНС 13/гексан (95/5); затем рекристаллизацию из MeOH/H2O для удаления избытка тиоацетамида; получили 3-амино-3-(4-метоксифенил)-2-метилтиоакриламид. Выход: 90,8%.- 10014233 Синтез V-6, Q=4-хлорфенил. Добавили хлористый водород (4 M в 1,4-диоксане, 858 мл, 16,0 экв; 3,43 моль) к E-/Z-смеси 3-амино-3-(4-хлорфенил)-2-метилакрилонитрила (41,3 г, 1,00 экв., 214,4 ммоль) и тиоацетамида (32,71 г,2 экв., 2,00 экв., 428,8 ммоль) в круглодонную колбу емкостью 2 л (со слоем азота, снабженную резиновой перегородкой, приспособлением для перемешивания и охлаждающей баней). До окончания добавления реагентов поддерживали температуру раствора на уровне ниже 30 С при помощи ледяной бани. Убрали ледяную баню, перемешивали в течение 2 ч и медленно добавили смесь к 1,5 л 30% водн. NH4OH на ледяной бане при перемешивании. Дважды экстрагировали смесь этилацетатом. Дважды промыли органическую фазу солевым раствором, высушили (K2CO3), профильтровали и сконцентрировали до сухого состояния. Смесь подвергли кристаллизации из смеси гексана и хлороформа (10/90). Полученное твердое вещество растирали с этанолом и водой (10/90); после перекристаллизации получили 3-амино-3-(4 хлорфенил)-2-метилтиоакриламид (в виде неопределенной Е-/Z-смеси). Выход: 82,3%. 1 Н ЯМР (CD3OD):9,95 (с, 2 Н), 8,74 (с, 1 Н), 8,29 (д, J=6, 0 Гц, 2 Н), 8,25 (с, 1 Н), 8,11 (д, J=6,0 Гц, 2 Н), 4,099 (с, 3 Н). Синтез V-7, Q=4-бромфенил: 3-амино-3-(4-бромфенил)-2-метилтиоакриламид. Синтез амина формулы II Если не указано иное, амин формулы II с указанным значением Q получали из соответствующего тиоамида формулы V способом, аналогичным описанному ниже, в синтезе II-1. Синтез II-1, Q=4-метоксифенил. К раствору 3-амино-3-(4-метоксифенил)-2-метилтиоакриламида (7,800 г, 35,135 ммоль) в метаноле(703 мл) добавили перекись водорода (30 вес.%, 2,39 г, 70,3 ммоль). Перемешивали в течение 3 ч. Погасили реакцию добавлением Na2S2O3 (20% водн.) и выпарили до объема 10 мл. Разбавили EtOAc (500 мл) и промыли органическую фазу солевым раствором (3100 мл), выпарили и провели кристаллизацию из смеси EtOAc/гексан, получили 3-(4-метоксифенил)-4-метилизотиазол-5-иламин. Выход: 88,2%. ES-MS:m/e 221,0 (m+1). Синтез II-6, Q=4-хлорфенил. В круглодонную колбу объемом 2 л (снабженную приспособлением для перемешивания) поместили(E/Z)-3-амино-3-(4-хлорфенил)-2-метилтиоакриламид (40,0 г, 1,00 экв., 176 ммоль), метанол (882 мл,21,80 моль) и перекись водорода (30 вес.%, 14,2 мл, 1,40 экв., 247 ммоль). Перемешивали в течение 2 ч,затем погасили реакцию добавлением Na2O3S2 (20% водн.) и разбавили водой (1 л). Сконцентрировали водную смесь под вакуумом до объема 1 л. Добавили гексан и этилацетат 95/5 (500 мл), интенсивно перемешивали в течение 20 мин. Смесь профильтровали, промыли водой, затем гексаном; высушили образовавшийся осадок под вакуумом; получили 3-(4-хлорфенил)-4-метилизотиазол-5-иламин. Выход: 64,1%.(m+1). Синтез фенола формулы III Фенол формулы III, в которой R3 имеет указное значение, а R-CO представляет собой (R,R)-2 метилциклопропанкарбонил, получили из соответствующего соединения формулы II, в которой R1 представляет собой метил, способом, аналогичным описанному ниже, в синтезе III-1. Синтез III-1, R3=H: (R,R)-N-[3-(4-гидроксифенил)-4-метилизотиазол-5-ил]-2-метилциклопропанкарбоксамид.(5 мл) при -20 С добавили трибромидбора (0,227 г, 0,909 ммоль). Перемешали и выдержали для нагревания до комнатной температуры. Перемешивали в течение 4 ч, погасили смесь 1 N HCl. Экстрагировали смесь EtOAc (2 раза по 50 мл). Высушили (MgSO4) и выпарили растворитель. Продукт использовали на следующем этапе синтеза без дополнительной очистки. Выход: 106,8% ES-MS: m/e 207,0 (m+1).B. (R,R)-N-[3-(4-гидроксифенил)-4-метилизотиазол-5-ил]-2-метилциклопропанкарбоксамид. К раствору (R,R)-2-метилциклопропанкарбоновой кислоты (0,06 г, 0,58 ммоль) и ДМФ (1 капля для катализа) в толуоле (1 мл) добавили при перемешивании оксалилхлорид 2 М в дихлорметане, (0,291 мл,0,583 ммоль). Перемешивали в течение 3 ч и добавили образовавшийся хлорангидрид к раствору 4-(5- 11014233 амино-4-метилизотиазол-3-ил)фенола (0,060 г, 0,291 ммоль) и пиридина (0,07 г, 0,87 ммоль) в ТГФ (1 мл) при перемешивании. Перемешивали в течение 1 ч, разбавили EtOAc (300 мл), промыли 1 N NaOH (2 раза по 100 мл), затем водой (100 мл), высушили (MgSO4) и выпарили. Провели кристаллизацию из смеси хлороформа и гексана. Выход: 64,6%. ES-MS: m/e 289,0 (m+1). Синтез нитрила формулы IX Если не указано иное, нитрил формулы IX с указанным значением Q получили из соответствующего бензонитрила формулы Q-CN и ацетонитрила способом, аналогичным описанному ниже, в синтезеIX-2. Синтез IX-2, Q=3-фтор-4-метоксифенил. Смешали 3-фтор-4-метоксибензонитрил (25,000 г, 165,563 ммоль), ацетонитрил (13,576 г,331,126 ммоль) и ТГФ (33 мл). Добавили т-бутоксид калия в ТГФ (1 М, 182,1 мл, 182,1 ммоль) при перемешивании. Перемешивали в течение ночи. Разбавили насыщ. NaHCO3 и экстрагировали EtOAc. Выпарили органический раствор и провели кристаллизацию из смеси гексан/EtOAc, получили 3-амино-3-(3 фтор-4-метоксифенил)акрилонитрил. Выход: 78,6%. ES-MS: m/е 193,0 (m+1). Синтез IX-4, Q=фенил: 3-амино-3-фенилакрилонитрил. Синтез IX-8, Q=3,4-дихлорфенил. Способом, аналогичным описанному в синтезе IX-2, но с использованием 1,5 экв. т-бутоксида калия и 1,5 экв. ацетонитрила на 1 экв. 3,4-дихлорбензонитрила, получили 3-амино-3-(3,4-дихлорфенил)акрилонитрил. Синтез IX-9, Q=4-(метилтио)фенил. Способом, аналогичным описанному в синтезе IX-2, но с использованием 1,5 экв. т-бутоксида калия и 1,5 экв. ацетонитрила на 1 экв. 4-(метилтио)бензонитрила, приготовили 3-амино-3-[4-(метилтио)фенил]акрилонитрил. Синтез IX-10, Q=4-(1,1-дифторэтил)фенил: 3-амино-3-[4-(1,1-дифторэтил)фенил]акрилонитрил. Исходный реагент 4-(1,1-дифторэтил)бензонитрил для синтеза IX-10 получили следующим способом: К 4-ацетилбензонитрилу (10,000 г, 68,966 ммоль) добавили бис-(2-метоксиэтил)аминотиотрифторид(30,516 г, 137,931 ммоль) и перемешивали в атмосфере азота в тефлоновой колбе в течение 24 ч. Разбавили дихлорметаном, затем погасили реакцию путем добавления избытка насыщенного NaHCO3. Экстрагировали EtOAc, высушили (MgSO4) и выпарили. После хроматографии на силикагеле(элюент - гексан и EtOAc градиент 3-30%), получили 4-(1,1-дифторэтил)бензонитрил. Выход: 68,6%. Синтез тиоамида формулы X Если не указано иное, тиоамид формулы X с указанным значением Q получали из соответствующего нитрила формулы IX способом, аналогичным описанному ниже в синтезе Х-2. Синтез Х-2, Q=3-фтор-4-метоксифенил. К 3-амино-3-(3-фтор-4-метоксифенил)акрилонитрилу (25,0 г, 130 ммоль) и тиоацетамиду (19,5 г,260 ммоль) добавили диоксан (65 мл); затем добавили 4 N HCl в диоксане (650 мл, 2,600 ммоль) и перемешивали реакционную смесь в течение 4-8 ч до завершения реакции (контроль по TLC). Реакционную смесь выпарили до сухого состояния; затем добавили диоксан (200 мл); медленно добавили TEA (высушенный при помощи K2CO3, 1000 мл); затем добавили насыщенный K2CO3 (1000 мл) и экстрагировали смесь EtOAc (2000 мл). Высушили органическую фазу (K2CO3) и выпарили растворитель; получили 3-амино-3-(3-фтор-4-метоксифенил)тиоакриламид. Выход: 98,5%. ES-MS: m/е 227,0 (m+1). Синтез Х-4, Q=фенил: 3-амино-3-(фенил)тиоакриламид. Синтез Х-8, Q=3,4-дихлорфенил: 3-амино-3-(3,4-дихлорфенил)тиоакриламид. Синтез Х-9, Q=4-(метилтио)фенил: 3-амино-3-[4-(метилтио)фенил]тиоакриламид. Синтез Х-10, Q=4-(1,1-дифторэтил)фенил. К раствору 3-амино-3-[4-(1,1-дифторэтил)фенил]акрилонитрил (5,50 г, 26,4 ммоль) в пропан-2-оле(264 мл) добавили дифенилфосфиндитикислоты (13,2 г, 52,9 ммоль). Нагревали до 45 С в течение 4 ч. Разбавили EtOAc (400 мл), промыли солевым раствором 3(100 мл) и выпарили растворитель. Провели кристаллизацию из смеси EtOAc/гексан, получили 3-амино-3-[4-(1,1-дифторэтил)фенил]тиоакриламид. Выход: 67,2%. ES-MS: m/e 243,0 (m+1). Синтез амина формулы VIII- 12014233 Если не указано иное, амин формулы VIII с указанным значением Q получали из соответствующего тиоамида формулы X способом, аналогичным описанному ниже, в синтезе VIII-2. Синтез VIII-2, Q=3-фтор-4-метоксифенил. К 3-амино-3-(3-фтор-4-метоксифенил)тиоакриламиду (29,0 г, 128 ммоль) в метаноле (1,283 мл) добавили перекись водорода (30% в воде, 8,73 г, 257 ммоль) и перемешивали реакционную смесь при комнатной температуре. Погасили реакцию добавлением Na2S2O3 (20% в воде) и сконцентрировали до сухого состояния. Разбавили EtOAc (900 мл) и водой (900 мл), собрали органическую фазу и выпарили растворитель. После кристаллизации из смеси EtOAc/гексан получили 3-(3-фтор-4-метоксифенил)изотиазол-5-иламин (1 г). Хроматографией маточного раствора (25 г) на силикагеле, элюент-25-50% EtOAc в гексане, получили дополнительный продукт. (В одном из циклов при введении материала в колонку произошла потеря 1/2 исходного материала; но дополнительный очищенный материал был получен при помощи хроматографии (1 г).) Выход: 12,2%. ES-MS: m/e 225,0 (m+1). Синтез VIII-4, Q=фенил: 3-фенилизотиазол-5-иламин. ES-MS: m/e 177,2 (m+1). Синтез VIII-8, Q=3,4-дихлорфенил: 3-(3,4-дихлорфенил)изотиазол-5-иламин. ES-MS: m/e 247,0(m+1). Синтез VIII-10, Q=4-(1,1-дифторэтил)фенил: 3-[4-(1,1-дифторэтил)фенил]изотиазол-5-иламин. ESMS: m/e 241,2 (m+1). Синтез изотиазола формулы VII Если не указано иное, амид формулы VII с указанным значением Q получали из соответствующего амина формулы VIII способом, аналогичным описанному ниже в синтезе VII-2. Синтез VII-1, Q=4-метоксифенил. Используемые вещества: бензиловый эфир и триметилалюминий. К суспензии 3-(4-метоксифенил)изотиазол-5-иламина (5,0 г, 24,3 ммоль) в безводном дихлорметане(230 мл), охлажденной до 0-5 С, при перемешивании с помощью шприца добавили триметилалюминий(R,R)-2-метилциклопропанкарбоксилат (4,6 г, 24,21 ммоль) в безводном дихлорметане (10 мл). Затем смесь нагрели до 40-45 С в потоке N2 (игольчатый перепускной клапан) для медленного удаления растворителя. Через 2 ч большую часть дихлорметана удалили, при этом внутренняя температура поднялась приблизительно до 50 С. Раствор перемешивали в течение еще 3 ч, охладили и осторожно погасили реакцию добавлением по каплям воды с последующим добавлением 0,1 N HCl в интенсивном потоке N2. Остаток разделили между этилацетатом (400 мл) и 0,1 N HCl (400 мл). Органическую фазу высушили над карбонатом калия, профильтровали и выпарили до малого объема. Полученную суспензию разбавили гексаном и отфильтровали твердое вещество. В результате получили 5,9 г неочищенного продукта, который ресуспендировали в МТВЕ (100 мл), нагревали в условиях мягкого дефлегмирования в течение 1 ч и охладили до комнатной температуры. После выдерживания в течение 1 ч твердое вещество отфильтровали и высушили (20 мм Hg, 40 С); получили (R,R)-N-[3-(4-метоксифенил)изотиазол-5-ил]-2-метилциклопропанкарбоксамид (5,2 г, 75%). 1 Н ЯМР (ДМСО-d6):7,86 (д, J=8,8 Гц, 2 Н), 7,20 (с, 1 Н), 7,00 (д, J=8,8 Гц, 2 Н), 3,78 (с, 3 Н), 1,62 (м, 1 Н), 1,34 (м, 1 Н), 1,10 (д, J=6,0 Гц, 3 Н), 1,09 (м, 1 Н), 0,80 (м, 1 Н); ES-MS m/е 289 (m+Н). Синтез VII-2, Q=3-фтор-4-метоксифенил. С использованием бензилового эфира и триметилалюминия. К раствору 3-(3-фтор-4-метоксифенил)изотиазол-5-иламина (0,59 г, 2,63 ммоль) и триметилалюминия (2,0 М в толуоле, 5,26 ммоль) в дихлорметане (5 мл) добавили бензил (R,R)-2-метилциклопропанкарбоксилат (0,55 г, 2,89 ммоль) при 0 С и выдерживали реакционную смесь для естественного нагревания до комнатной температуры. Нагрели реакционную смесь до 40 С и перемешивали в течение ночи. Разбавили реакционную смесь EtOAc (100 мл), 1 N HCl (40 мл) и водой (100 мл), собрали органическую фазу и выпарили растворитель. После хроматографии на силикагеле, элюент 25-50% EtOAc в гексане,получили (R,R)-N-[3-(3-фтор-4-метоксифенил)изотиазол-5-ил]-2-метилциклопропанкарбоксамид. Выход: 55,9%. ES-MS: m/e 307,0 (m+1). Синтез VII-4, Q=фенил: (R,R)-2-метил-N-(3-фенилизотиазол-5-ил)циклопропанкарбоксамид. ESMS: m/e 259,2 (m+1). Синтез VII-8, Q=3,4-дихлорфенил: (R,R)-N-[3-(3,4-дихлорфенил)изотиазол-5-ил]-2-метилциклопропанкарбоксамид. ES-MS : m/e 328,0 (m+1). Синтез VII-9, Q=4-(метилтио)фенил: (R,R)-N-[3-[4-(метилтио)фенил]изотиазол-5-ил]-2-метилциклопропанкарбоксамид. ES-MS: m/e 305,2 (m+1).- 13014233 Синтез VII-10, Q=4-(1,1-дифторэтил)фенил. С использованием бензилового эфира и т-бутоксида калия смешивали 3-[4-(1,1-дифторэтил)фенил]изотиазол-5-иламин (0,200 г, 0,833 ммоль), бензил (R,R)-2-метилциклопропанкарбоксилат (0,238 г,1,250 ммоль) и т-бутоксида калия (0,190 г, 1,667 ммоль) в течение 1 ч. Разбавили насыщ. NaHCO3 и экстрагировали EtOAc. Промыли органическую фазу солевым раствором, высушили (MgSO4) и выпарили растворитель. После хроматографии на силикагеле, элюент 10% EtOAc в CHCl3, получили (R,R)-N-[3-[4(1,1-дифторэтил)фенил]изотиазол-5-ил]-2-метилциклопропанкарбоксамид. Выход: 50,3%. ES-MS: m/e 323,3 (m+1). Синтез 4-бромизотиазола формулы VI, Х=Br Если не указано иное, амид формулы VI, где X представляет собой бром, a Q имеет указанное значение, получали из соответствующего амида формулы VII способом, аналогичным описанному ниже, в синтезе VI-2. Синтез VI-2, Q=3-фтор-4-метоксифенил. К (R, R)-N-[3-(3-фтор-4-метоксифенил)изотиазол-5-ил]-2-метилциклопропанкарбоксамиду (0,45 г,1,47 ммоль) в дихлорметане (3 мл) по каплям добавили бром (0,15 мл, 0,47 г, 2,94 ммоль). Добавление брома прекратили, когда мониторинг методом TLC показал завершение реакции. Разбавили реакционную смесь EtOAc (100 мл) и вылили в водный Na2S2O3 (1 N). Органическую фазу собрали, промыли солевым раствором (50 мл) и водой (80 мл), растворитель выпарили. После хроматографии на силикагеле(элюент - 10-50% EtOAc в гексане) получили (R,R)-N-[4-бром-3-(3-фтор-4-метоксифенил)изотиазол-5 ил]-2-метилциклопропанкарбоксамид. Выход: 97,1%. ES-MS: m/e 387,0 (m+1). Синтез VI-4, Q=фенил: (R,R)-N-[4-бром-3-фенилизотиазол-5-ил]-2-метилциклопропанкарбоксамид. К раствору 2-цианотиоацетамида (39,5 г, 0,395 моль) в дихлорметане (700 мл) при 0 С добавили при перемешивании ледяную уксусную кислоту (79 мл). Затем по каплям добавили раствор брома(43,0 мл, 0,840 моль) в дихлорметане (395 мл) за 2 ч, поддерживая в смеси температуру 0 С. Смесь перемешивали в течение еще 1 ч на холоде, реакцию погасили путем добавления 10% водного бисульфита натрия (300 мл). Водный слой обработали 2 N водным карбонатом натрия до рН 9, довели до комнатной температуры, двухфазную смесь профильтровали через диатомитовый фильтр, промытый дихлорметаном. После разделения слоев темную органическую фазу высушили (Na2SO4) и выпарили до образования темного твердого осадка, который вновь растворили в дихлорметане, добавили непосредственно в колонку с силикагелем, затем подвергли хроматографии (элюент - 20% этилацетат в гексане; получили 3,4 дибромизотиазол-5-иламин в виде белесого твердого вещества (12 г, 12%). ES-MS: m/e 259 (m+1). Синтез 3,4-дибромизотиазола формулы XII К (R,R)-2-метилциклопропанкарбоновой кислоте (5,4 г, 36 ммоль) в дихлорметане (100 мл) добавили ДМФ (две капли, затем 98% оксалилхлорид (4,8 мл, 54 ммоль). Смесь перемешивали в течение 3 ч при комнатной температуре. В отдельной колбе растворили 3,4-дибромизотиазол-5-иламин (9,3 г, 36,05 ммоль) в ТГФ (200 мл) и,после охлаждения раствора ТГФ до 0 С, триэтиламин (30 мл, 215 ммоль). Добавили полученный описанный выше раствор хлорангидрида по каплям при 0 С, довели температуру смеси до комнатной и перемешивали в течение ночи (16 ч). Темный раствор обработали солевым раствором (800 мл) и этилацета- 14014233 том (800 мл). Органическую фазу высушили (Na2SO4) и выпарили до образования темного масла. После хроматографии на силикагеле (flash 65, 10% этилацетат в толуоле) получили неочищенный продукт в виде твердого вещества, которое подвергли рекристаллизации из смеси дихлорметан/гексан, получили(R,R)-N-[3,4-дибромизотиазол-5-ил]-2-метилциклопропанкарбоксамид (4,0 г, 33%). 1 Н ЯМР (ДМСО-d6):11,90 (с, 1 Н), 2,09 (м, 1 Н), 1,40 (м, 1 Н), 1,12 (м, 1 Н), 1,11 (д, J=6,0 Гц, 3 Н),0,85 (м, 1 Н). ES-MS: m/e 339 (m-H). Альтернативный способ синтеза 4-бромизотиазола формулы VI, Х=Br Если не указано иное, амид формулы VI, где X представляет собой бром, с указанным значением Q получали из соответствующей бороновой кислоты Q-B(OH)2, амида формулы XII и (R,R)-N-[3,4-дибромизотиазол-5-ил]-2-метилциклопропанкарбоксамида, способом, описанным ниже в альтернативном способе синтеза VI-3. Альтернативный способ синтеза VI-3, Q=4-этоксифенил. Дегазировали раствор(29 мл) азотом. Добавили карбонат натрия (2 М) (4,41 ммоль) и Pd(PPh3)4 (0,255 г, 0,221 ммоль); затем герметизировали в атмосфере азота. Нагревали до 60 С в течение ночи. Добавили 100 мг Pd(PPh3)4 и нагревали дополнительно в течение 1 суток. Разбавили EtOAc и промыли солевым раствором. Разделили и выпарили растворитель. После хроматографии на силикагеле (элюент - 15-50% EtOAc в гексане) провели кристаллизацию из смеси EtOAc и гексана и получили (R,R)-N-[4-бром-3-(4-этоксифенил)изотиазол-5 ил]-2-метилциклопропанкарбоксамид. Выход: 53,5%. ES-MS: 380,0 (m+1). Альтернативный способ синтеза VI-5, Q=4-фторфенил. Способом, аналогичным описанному в синтезе VI-3, но с использованием 1,3 экв. 4-фторфенилбороновой кислоты на 1 экв. (R,R)-N-[3,4-дибромизотиазол-5-ил]-2-метилциклопропанкарбоксамида,реакционную смесь перемешивали при 70 С в течение 1 суток; в результате получили (R,R)-N-[4-бром-3(4-фторфенил)изотиазол-5-ил]-2-метилциклопропанкарбоксамид. ES-MS: m/e 357,0 (m+1). Примеры соединений формулы I Если не указано иное, амид формулы I с указанным значением Q получали из соответствующего амина формулы II способом, аналогичным описанному ниже, в примере 1. Пример 1. Q=4-Метоксифенил, способ (А). С использованием бензилового эфира и триметилалюминия. К раствору 3-(4-метоксифенил)-4-метилизотиазол-5-иламина (10,0 г, 45,5 ммоль) в дихлорметане(455 мл) при 0 С добавили триметилалюминий (2 М в толуоле, 3,59 г, 45,5 ммоль). Перемешивали в течение 5 мин, добавили бензил (R,R)-2-метилциклопропанкарбоксилат (8,64 г, 45,5 ммоль). Нагревали до 50 С в потоке азота для удаления растворителя. Полученное масло нагревали до 50 С в течение 3 ч. Реакцию погасили водой, разбавили смесь EtOAc (300 мл). Промыли 0,1 N HCl, высушили (K2CO3), выпарили, после кристаллизации из смеси гексан/EtOAc получили (R,R)-N-[3-(4-метоксифенил)-4 метилизотиазол-5-ил]-2-метилциклопропанкарбоксамид. Выход: 80,4%. ES-MS: m/e 303,0 (m+1). (Маточный раствор можно использовать в следующих циклах перекристаллизации). С использованием хлорангидрида. К раствору (R,R)-2-метилциклопропанкарбоновой кислоты (150 г, 1,06 экв.) и ДМФ (катализатор,0,03 экв.) в дихлорметане (1,30 л) при 21 С добавили по каплям оксалилхлорид (170 г, 120 мл, 1,05 экв.) приблизительно за 1,5 ч, за это время температура смеси понизилась приблизительно до 16 С в результате эндотермической реакции. Реакционную смесь перемешивали при температуре окружающего воздуха в течение 30 мин; затем нагревали с обратным холодильником в течение 30 мин; получили раствор (R,R)2-метилциклопропанкарбонил хлорида, который охладили до 25 С для использования в следующем этапе. К раствору 3-(4-метоксифенил)-4-метилизотиазол-5-иламина (280 г, 1,00 экв.) и пиридина (катализатор, 0,03 экв.) в безводном ТГФ (350 мл) добавили по каплям описанный выше раствор хлорангидрида за 30 мин при температуре 6-13 С; реакционную смесь перемешивали при комнатной температуре в течение 1 ч. (Мониторинг хода реакции осуществляли методом ВЭЖХ, добавление хлорангидрида прекратили, когда согласно данным мониторинга амин прореагировал полностью.) Добавили воду (2,5 л), фазы- 15014233 разделили, водную фазу повторно экстрагировали дихлорметаном. Объединенные органические фазы промыли (водн. NaOH (1 л), затем водой (1 л, частично выпарили приблизительно до 1 кг, затем разбавили ТГФ (2 л) до образования гомогенного раствора, из которого отделилось некоторое количество воды. Смесь выдерживали в течение ночи при комнатной температуре, при этом произошло разделение двух фаз, причем водная фаза оказалась поверх органической фазы. Фазы разделили, к каждой фазе добавили ТГФ, к верхней (органической) фазе добавили воду, каждый слой вновь привели в равновесие; процесс разделения фаз протекал очень медленно, органическая фаза представляла собой верхний слой. Органическую фазу налили в роторный испаритель (колба объемом 10 л) через очищающую мембрану(5 мкм), добавили толуол (4 л), при этом смесь помутнела, и выпарили ТГФ/воду (160 мбар, темп. бани 45 С). По мере выпаривания ТГФ/воды происходило образование кристаллов. После удаления 2 л смеси добавили толуол (2 л) и продолжали удаление (85 мбар, темп. бани 45 С). После удаления еще 2 л растворителя давление в системе довели до атмосферного, охладили до температуры окружающего воздуха и через 1 ч полученную суспензию профильтровали. Осадок с фильтра вновь растворили в толуоле (1 л),профильтровали и промыли толуолом (1 л), затем сушили в течение ночи; в результате получили (R,R)N-[3-(4-метоксифенил)-4-метилизотиазол-5-ил]-2-метилциклопроланкарбоксамид. Выход: 357 г, 92%. Условия мониторинга реакции (метод ВЭЖХ): колонка: XTerra MS C18 2,5 мкм; 4,650 мм; элюент А, 0,1% TFA в воде; элюент В, ацетонитрил; скорость потока 1,50 мл/мин; приблизительный градиент А/В: 0-0,5 мин при 85/15, 1,5-7 мин при 85/15-5/95, 7-7,5 мин при 5/95, 7,5-8 мин 5/95-85/15, 8-10 мин при 85/15; время цикла - 10 мин; детекция-UV, 210 нм; проба согласно синтезу, разбавленная в смеси 70:30:1 ацетонитрил-вода-TFA. Энантиомерный избыток (ее) и стереохимическую чистоту карбоксамида можно определить методом ВЭЖХ: стационарная фаза (колонка): Chiralcel OJ (2404,6 мм, i.d.) колонка Daicel; подвижная фаза: метанол:диэтиламин (100:0,1 об./об.); детекция: УФ при 280 нм; объем вводимой пробы: 5 мкл; темп. пробы: 20 С; темп. колонки: комнатная; время цикла: 20 мин; растворитель пробы, концентрация пробы: около 5 мг/мл в метаноле. На типичной хроматограмме (R,R)-N-[3-(4-метоксифенил)-4-метилизотиазол 5-ил]-2-метилциклопропанкарбоксамида время удерживания составляло 10,519 мин, время удерживания(S,S)-изомера составило 12,981 мин, время удерживания следовых количеств двух цис-2-метил изомеров составило 14,189 мин и 14,980 мин. Величины ее и процентного содержания цис-примесей в продукте,приготовленном обычным способом синтеза, зависит от величины ее и процентного содержания циспримесей в исходной кислоте, а также от степени дальнейшей очистки путем (пере)кристаллизации. Описанный выше обычный способ синтеза обеспечивает ее больше 97%, и содержание цис-примесей приблизительно от 0,5 до 1%. В общем, соединение согласно примеру 1, полученное и выделенное согласно представленным здесь примерам, как показывают данные микроскопии, порошковой рентгенодиффракции (XRPD) и/или дифференциальной сканирующей калориметрии (DSC), представляет собой кристаллическое твердое вещество. Для продуктов описанных синтезов, проанализированных способом XRPD, характерно поглощение при (2, относительная интенсивность): 5,944, 1,00; 13,856, 0,01; 15,445, 0,01; 17,806, 0,06; 19,797,0,02; 22,718, 0,02; 23,812, 0,01; и, в частности, поглощение при (2, относительная интенсивность): 5,944, 1,00; 17,806, 0,06; 19,797, 0,02; 22,718, 0,02; такая структура обозначена как безводная форма I. При суспендировании соединения в смесях метанол/вода образуется вторая форма - безводная форма II,для которой характерно поглощение при (2, относительная интенсивность): 6,727, 1,00; 11,371, 0,04; 18,159, 0,04; 20,220, 0,12; 22,782, 0,09; 30,026, 0,04; 36,818, 0,02; 25,482; 0,03; и, в частности, поглощение при (2, относительная интенсивность): 6,727, 1,00; 20,220, 0,12; 22,782, 0,09, данные получены в условиях низкой активности воды (aw), например при активности воды aw, меньшей или равной 0,66; и моногидратная форма, обозначенная как моногидрат I, для которой характерно поглощение при (2, относительная интенсивность): 5,193, 0,07; 10,336, 0,82; 14,005, 0,77; 20,686, 0,19; 22,907, 1,00; 24,716, 0,53; 26,375, 0,29; и, в частности, поглощение при (2, относительная интенсивность): 10,336, 0,82; 14,005,0,77; 22,907, 1,00; 24,716, 0,53, данные получены в условиях высокой активности воды, например при aw,большей или равной 0,91. Дифракционные картины (XRPD) получили на рентгеновском дифрактометре Bruker D8 Advance с источником CuK (=1,54056 ) и электронным детектором Sol-X, работающим при минимальных параметрах 30 кВ и 40 мА. Каждую пробу сканировали при комнатной температуре (25 С) между 4 и 40 в 29, величина шага - 0,02 в 2, максимальная скорость сканирования - 3 с/шаг, с регулируемой переменной (v 12) дивергенцией и регулируемой приемной щелью, щель детектора - 0,1 мм. Пример 1. Q=4-Метоксифенил, получение способом (В). В сухую колбу, содержащую (R,R)-N-[3-(4-гидроксифенил)-4-метилизотиазол-5-ил]-2-метилциклопропанкарбоксамид (100 мг, 0,347 ммоль), добавили безводный ацетон (2 мл), K2CO3 (50 мг,0,347 ммоль) и метилйодид (19 мкл, 0,313 ммоль). Реакционную смесь нагревали в течение 16 ч при 45 С, затем обработали дополнительно метилйодидом (19 мкл, 0,313 ммоль). После дополнительного нагревания в течение 6 ч растворитель выпарили, остаток разделили между этилацетатом и водой. Раствор этилацетата промыли (нас. водн. K2CO3 (дважды) и солевой раствор), высушили (MgSO4), раствори- 16014233 тель выпарили. После хроматографии на силикагеле элюент-EtOAc/гексан получили (R,R)-N-[3-(4 метоксифенил)-4-метилизотиазол-5-ил]-2-метилциклопропанкарбоксамид (35 мг, 33%) в виде твердого вещества белого цвета. 1 Н ЯМР; ES-MS: m/e 303 (m+1). Пример 2. Q=3-Фтор-4-метоксифенил, способ (С) - сочетание с соединением формулы VI, Х=Br. К (R,R)-N-[4-бром-3-(3-фтор-4-метоксифенил)изотиазол-5-ил]-2-метилциклопропанкарбоксамиду(0,55 г, 1,43 ммоль) в ДМФ (3 мл) добавили PdCl2(PPh3)2 (0,15 г, 0,21 ммоль) и Sn(CH3)4 (0,79 мл, 1,02 г,5,71 ммоль), реакционную смесь перемешивали при 130 С в герметизированном реакционном сосуде в течение ночи. Разбавили EtOAc (100 мл) и солевым раствором (100 мл). Собрали органическую фазу,высушили (K2CO3) и выпарили. Полученное масло соединили с 1:1 МТВЕ:KF (водн., 15%) (50 мл) и перемешивали при нагревании с обратным холодильником в течение 1 ч. Фильтровали полученный раствор через диатомитовый фильтр с МТВЕ (100 мл). Собрали органическую фазу, высушили (K2CO3) и выпарили. После хроматографии на силикагеле (элюент - 10-30% ТГФ в гексане) получили (R,R)-N-[3-(3 фтор-4-метоксифенил)-4-метилизотиазол-5-ил]-2-метилциклопропанкарбоксамид. Выход: 49,2%. ES-MS:m/e 321,0 (m+1). Пример 3. Q=4-Этоксифенил, способ (С) - сочетание с соединением формулы VI, Х=Br. К (R,R)-N-[4-бром-3-(4-этоксифенил)изотиазол-5-ил]-2-метилциклопропанкарбоксамиду (0,24 г,0,62 ммоль) в ДМФ (1 мл) добавили PdCl2(PPh3)2 (0,07 г, 0,09 ммоль) и Sn(CH3)4 (0,34 мл, 0,44 г,2,48 ммоль), реакционную смесь перемешивали при 130 С в герметизированном реакционном сосуде в течение ночи. Разбавили EtOAc (100 мл) и солевым раствором (100 мл). Собрали органическую фазу,высушили (MgSO4), выпарили растворитель. Профильтровали через силикагель и промыли EtOAc. Выпарили растворитель, провели кристаллизацию из смеси EtOAc/гексан, получили (R,R)-N-[3-(4-этоксифенил)-4-метилизотиазол-5-ил]-2-метилциклопропанкарбоксамид. Выход: 81,7%. ES-MS: m/e 317,0(m+1). Пример 4. Q=Фенил, способ (С) - металлирование-метилирование при взаимодействии с соединением формулы VI, Х=Br. К (R,R)-N-[4-бром-3-фенилизотиазол-5-ил]-2-метилциклопропанкарбоксамиду (0,50 г, 1,48 ммоль) в ТГФ (3 мл), охлажденному до -78 С, добавили 1,1 экв. n-бутиллития (n-BuLi) (1,6 М в гексане, 0,204 мл,3,26 ммоль). Внутри смеси поддерживали температуру ниже -68 С. После добавления реагента реакционную смесь перемешивали в течение 1 ч. Затем добавили дополнительно 1,1 экв. n-BuLi (1,6 М в гексане, 0,204 мл, 3,26 ммоль), поддерживая внутри смеси температуру ниже -66 С. После перемешивания в течение 2 ч реакционную смесь нагрели до -40 С за 15 мин; затем вновь охладили до -78 С. Затем добавили метилйодид (0,10 мл, 1,63 ммоль). Реакционную смесь выдерживали при комнатной температуре и перемешивали в течение нескольких дней на выходных, затем реакцию погасили нас. NH4Cl и разбавилиEtOAc. Органическую фазу промыли солевым раствором, смесь высушили (K2CO3) и выпарили. После хроматографии на силикагеле (элюент - 5-35% EtOAc в гексане) получили (R,R)-2-метил-N-(4-метил-3 фенилизотиазол-5-ил)циклопропанкарбоксамид. Выход: 16,4%. ES-MS: 273,2 (m+1). Пример 5. Q=4-Фторфенил, способ (С) - сочетание с соединением формулы VI, Х=Br. Способом, аналогичным описанному в примере 3, из (R,R)-N-[4-бром-3-(4-фторфенил)изотиазол-5 ил]-2-метилциклопропанкарбоксамида получили (R,R)-N-[3-(4-фторфенил)-4-метилизотиазол-5-ил]-2 метилциклопропанкарбоксамид. ES-MS: m/e 291,0 (m+1). Пример 6. Q=4-Хлорфенил, способ (A): (R,R)-N-[3-(4-хлорфенил)-4-метилизотиазол-5-ил]-2 метилциклопропанкарбоксамид. ES-MS: m/е 307,0 (m+1). С применением хлорангидрида. К раствору (R,R)-2-метилциклопропанкарбоновой кислоты (765 мл, 7,83 г, 1,00 экв.) в дихлорметане (очищ. для HPLC, 39,2 мл, 5 мл/г кислоты) добавили диметилформамид (30 мкл, 390 мкмоль,0,005 моль/моль кислоты) с последующим медленным добавлением оксалилхлорида (6,85 мл,77,4 ммоль, 0,99 моль/моль кислоты) при 0 С (на ледяной бане) в атмосфере азота. Через 30 мин ледяную баню убрали и нагрели смесь до 40 С в течение 30 мин. Смесь выдерживают для охлаждения до комнатной температуры и используют на следующем этапе без дополнительной очистки. К раствору 3-(4-хлорфенил)-4-метилизотиазол-5-иламина (17,1 г, 75,9 ммоль, 1 экв.), пиридина(12,3 мл, 152 ммоль, 2 моль/на моль амина) и дихлорметана (75,9 мл с образованием 1 М амина) в круглодонной колбе емкостью 500 мл (со слоем азота, приспособлением для перемешивания и охлаждающей баней), добавили ранее полученный раствор (R,R)-2-метилциклопропанкарбонилхлорида (1,00 экв.; 75,9 ммоль). Перемешивали в течение 30 мин; затем ледяную баню убрали и перемешивали в течение 3 ч. Сконцентрировали реакционную смесь под вакуумом и разбавили этилацетатом. Дважды промыли разбавленной HCl и дважды водным NaHCO3, высушили (K2CO3), профильтровали и выпарили растворитель до образования сухого остатка. Провели кристаллизацию из гексана и этилацетата; получили твердое вещество белого цвета, получили вторую порцию продукта повторной кристаллизацией; в результате получили (R,R)-N-[3-(4-хлорфенил)-4-метилизотиазол-5-ил]-2-метилциклопропанкарбоксамид. Выход: 92,2%. LCMS: 307,0 (m+1). 1 Н ЯМР (ДМСО-d6, 300 МГц):11,26 (с, 1 Н), 7,62 (д, 2 Н, J=8,8 Гц),7,50 (д, 2 Н, J=8,8 Гц), 2,28 (с, 3 Н), 1,90 (м, 1 Н), 1,32 (м, 1 Н), 1,11 (м, 4 Н), 0,79 (м, 1 Н). Пример 7. Q=4-Бромфенил, способ (A): (R,R)-N-[3-(4-бромфенил)-4-метилизотиазол-5-ил]-2- 17014233 метилциклопропанкарбоксамид. ES-MS: m/е 353,0 (m+1). Пример 8. Q=3,4-Дихлорфенил, получение способом (С) сочетания с соединением формулы VI,Х=Br. Способом, аналогичным описанному в примере 2, из (R,R)-N-[4-бром-3-(3,4-дихлорфенил)изотиазол-5-ил]-2-метилциклопропанкарбоксамида получили (R,R)-N-[3-(3,4-дихлорфенил)-4 метилизотиазол-5-ил]-2-метилциклопропанкарбоксамид. ES-MS: m/e 341,0 (m+1). Пример 9. Q=4-(Метилтио)фенил, приготовление способом (С) - сочетания с соединением формулы или его фармацевтически приемлемая соль,где Q представляет собой фенильную группу формулы QA в которой R1 представляет собой метил или этил, a R3 представляет собой водород или фтор; илиQ представляет собой фенильную группу формулы QB в которой R3 представляет собой водород или фтор, a R4 представляет собой водород, фтор, хлор или бром; или каждый из R3 и R4 представляет собой хлор; или R3 представляет собой водород, a R4 представляет собой метилтио или 1,1-дифторэтил; аR-CO представляет собой (R,R)-транс-2-метилциклопропанкарбонил. 2. Соединение по п.1, в котором Q представляет собой 4-метоксифенил, 3-фтор-4-метоксифенил, 4 этоксифенил, фенил, 4-фторфенил, 4-хлорфенил, 4-бромфенил, 3,4-дихлорфенил, 4-(метилтио)фенил или 4-(1,1-дифторэтил)фенил. 3. Соединение по п.1, в котором Q представляет собой QA. 4. Соединение по п.1, в котором Q представляет собой QB. 5. Соединение по п.4, в котором R4 представляет собой хлор. 6. Соединение по любому из пп.1 и 3, 4, в котором R3 представляет собой водород. 7. Соединение по п.1, представляющее собой (R,R)-N-[3-(4-хлорфенил)-4-метилизотиазол-5-ил]-2 метилциклопропанкарбоксамид или его фармацевтически приемлемую соль. 8. Фармацевтическая композиция, содержащая соединение формулы I или его фармацевтически приемлемую соль по любому из пп.1-7, а также фармацевтически приемлемый разбавитель, наполнитель или носитель. 9. Применение соединения формулы I по любому из пп.1-7 или его фармацевтически приемлемой соли для лечения боли. 10. Применение соединения формулы I по любому из пп.1-7 или его фармацевтически приемлемой соли для изготовления лекарственного средства для лечения боли. Евразийская патентная организация, ЕАПВ Россия, 109012, Москва, Малый Черкасский пер., 2
МПК / Метки
МПК: A61K 31/425, A61P 25/04, C07D 275/03
Метки: замещенные, карбоксамиды
Код ссылки
<a href="https://eas.patents.su/19-14233-zameshhennye-karboksamidy.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные карбоксамиды</a>























