Новые композиции для местной доставки
Номер патента: 11244
Опубликовано: 27.02.2009
Авторы: Сихоркар Ваибхав, Сингх Сукхджит, Джаин Раджеш, Джиндал Коур Чанд
Формула / Реферат
1. Фармацевтическая композиция для топического введения, характеризующаяся усиленной локализацией активного ингредиента, причем указанная композиция содержит по меньшей мере один активный ингредиент, его соли, сложные эфиры, гидраты или производные; гелеобразующую систему, состоящую из смеси сурфактантов, растворяющую систему, содержащую по меньшей мере один масляный компонент; водную фазу, содержащую один или несколько стабилизирующих агентов и необязательно другие фармацевтически приемлемые эксципиенты, где смесь сурфактантов действует как гелеобразователи масляного компонента, присутствующего в растворяющей системе, формируя трехмерную сеть, которая иммобилизирует растворяющую систему, таким образом, что сурфактант, желатинизирующий масляную фазу, может распределять водную фазу без изменения липидного микроокружения и гелевой структуры композиции.
2. Фармацевтическая композиция по п.1, где активным ингредиентом является или гидрофобный, или амфифильный по своей природе агент.
3. Фармацевтическая композиция по п.1, где активный ингредиент выбран из группы, содержащей противогрибковые агенты, антибактериальные агенты, иммуномодуляторы, стероиды, анальгетики, противовоспалительные агенты, кератинизирующие агенты, противомикробные агенты, питающие кожу агенты или сенсибилизирующие агенты, антипсориатические и антиэкземные лекарственные средства, используемые индивидуально или в комбинации.
4. Фармацевтическая композиция по п.3, где активным ингредиентом является тербинафин, его соли, сложные эфиры, гидраты или производные.
5. Фармацевтическая композиция по п.3, где активным ингредиентом является иммуномодулятор, выбранный из такролимуса или циклоспорина, или его соли, сложные эфиры, гидраты или производные.
6. Фармацевтическая композиция по п.3, где активным ингредиентом является стероид, выбранный из тестостерона или гидрокортизона, или его соли, сложные эфиры, гидраты или производные.
7. Фармацевтическая композиция по пп.1-6, где гелеобразующая система, состоящая из смеси сурфактантов, содержит по меньшей мере два сурфактанта, где по меньшей мере один является гидрофильным сурфактантом, имеющим значение HLB, большее или равное примерно 10; и липофильный сурфактант имеет значение HLB меньше, чем примерно 10, причем указанный липофильный сурфактант присутствует в количестве, достаточном для достижения требуемого соотношения концентрации смеси сурфактантов, вызывающего желатинизирование одного или нескольких масляных компонентов, присутствующих в растворяющей системе.
8. Фармацевтическая композиция по пп.1-7, где гелеобразующая система, состоящая из смеси сурфактантов, содержит по меньшей мере два сурфактанта, где оба сурфактанта являются неионными.
9. Фармацевтическая композиция по пп.1-8, где гелеобразующая система присутствует в количестве от примерно 5 до примерно 50 мас.% от общей массы композиции.
10. Фармацевтическая композиция по пп.1-9, где гидрофильный сурфактант выбран из группы, содержащей эфиры полиоксиэтилен сорбитана и жирной кислоты, натрия докузат, сукцинилированные моноглицериды, лаурил сульфаты, таурохолаты, каприлаты, капраты, олеаты, полоксамер или их смеси.
11. Фармацевтическая композиция по пп.1-9, где липофильный сурфактант выбран из группы, содержащей эфиры сорбитана и жирной кислоты, алкиловые эфиры полиоксиэтилена, эфиры жирной кислоты, глицериды полиоксиэтилена, трансэтерифицированные растительные масла, полиоксиэтилированные гидрированные растительные масла или их смеси.
12. Фармацевтическая композиция по пп.1-9, где гелеобразующая система, состоящая из смеси сурфактантов, содержит липофильный сурфактант, который представляет собой эфир сорбитана и жирной кислоты, выбранный из группы, включающей сорбитан монолаурат, сорбитан монопальмитат, сорбитан моноолеат и сорбитан моностеарат; и гидрофильный сурфактант, который представляет собой эфир полиоксиэтилен сорбитана и жирной кислоты, выбранный из группы, включающей полиоксиэтилен сорбитан монолаурат, полиоксиэтилен сорбитан монопальмитат, полиоксиэтилен сорбитан моноолеат и полиоксиэтилен сорбитан моностеарат.
13. Фармацевтическая композиция по пп.7-12, где отношение гидрофильного сурфактанта к липофильному сурфактанту составляет от примерно 1:20 до примерно 20:1.
14. Фармацевтическая композиция по п.1, где растворяющая система включает по меньшей мере один масляный компонент и один или несколько других компонентов, выбранных из группы, включающей метанол, этанол, изопропанол, триэтил цитрат, ацетил бутил цитрат или триацетин; или другие гидрофильные растворители, выбранные из группы, включающей этиленгликоль, пропиленгликоль, глицерин, полиэтиленгликоль и сложные эфиры полиэтиленгликоля.
15. Фармацевтическая композиция по п.14, где по меньшей мере один масляный компонент растворяющей системы выбран из группы, включающей природные масла, минеральное масло, моно-, ди- или триглицеридные эфиры масел, выбранные из группы, включающей среднецепочечные триглицериды, олеиновую кислоту, этил олеат, этил каприлат, этил бутират, изопропил миристат, соевое масло, каноловое масло или их моно- и диглицериды, алюминия моностеарат, алюминия дистеарат, алюминия тристеарат, микрокристаллический воск, нефтяной воск и смеси, используемые индивидуально или в комбинации.
16. Фармацевтическая композиция по пп.14 и 15, где по меньшей мере одним масляным компонентом растворяющей системы является среднецепочечный триглицерид.
17. Фармацевтическая композиция по п.1, где водная фаза содержит воду, алифатические или ароматические спирты, гликоли или их смеси.
18. Фармацевтическая композиция по п.1, где стабилизирующим агентом является природный, синтетический или полусинтетический полимер, который действует как структурообразователь и стабилизатор в топических составах, которые находятся в форме эмульсии, крема, лосьона или геля по своей консистенции и структуре, выбранный из группы, включающей хитозан, полоксамер, целлюлозные полимеры, камеди и альгинаты.
19. Фармацевтическая композиция по п.18, где стабилизирующим агентом является полоксамер.
20. Фармацевтическая композиция по пп.18 и 19, где стабилизатор добавляют или в масляную фазу, или в водную фазу, или добавляют в водный раствор до концентрации в диапазоне 0,1-20% от общей массы композиции.
21. Фармацевтическая композиция по п.1, где другие фармацевтически приемлемые эксципиенты выбраны из группы, включающей консерванты, рецептурные добавки, антиоксиданты, разбавители, регулирующие рН агенты, забуферивающие агенты, модификаторы тоничности, красители и т.п. или их смеси.
22. Способ получения фармацевтической композиции по п.1, который включает следующие стадии:
i) получение масляной фазы, содержащей гелеобразующую систему;
ii) включение активного ингредиента(ов) в масляную фазу;
iii) получение водной фазы, содержащей стабилизатор;
iv) смешивание масляной и водной фазы при длительном перемешивании с получением желаемой композиции.
23. Способ лечения грибковых инфекций, включающий введение пациенту фармацевтически эффективного количества фармацевтической композиции по п.4.
Текст
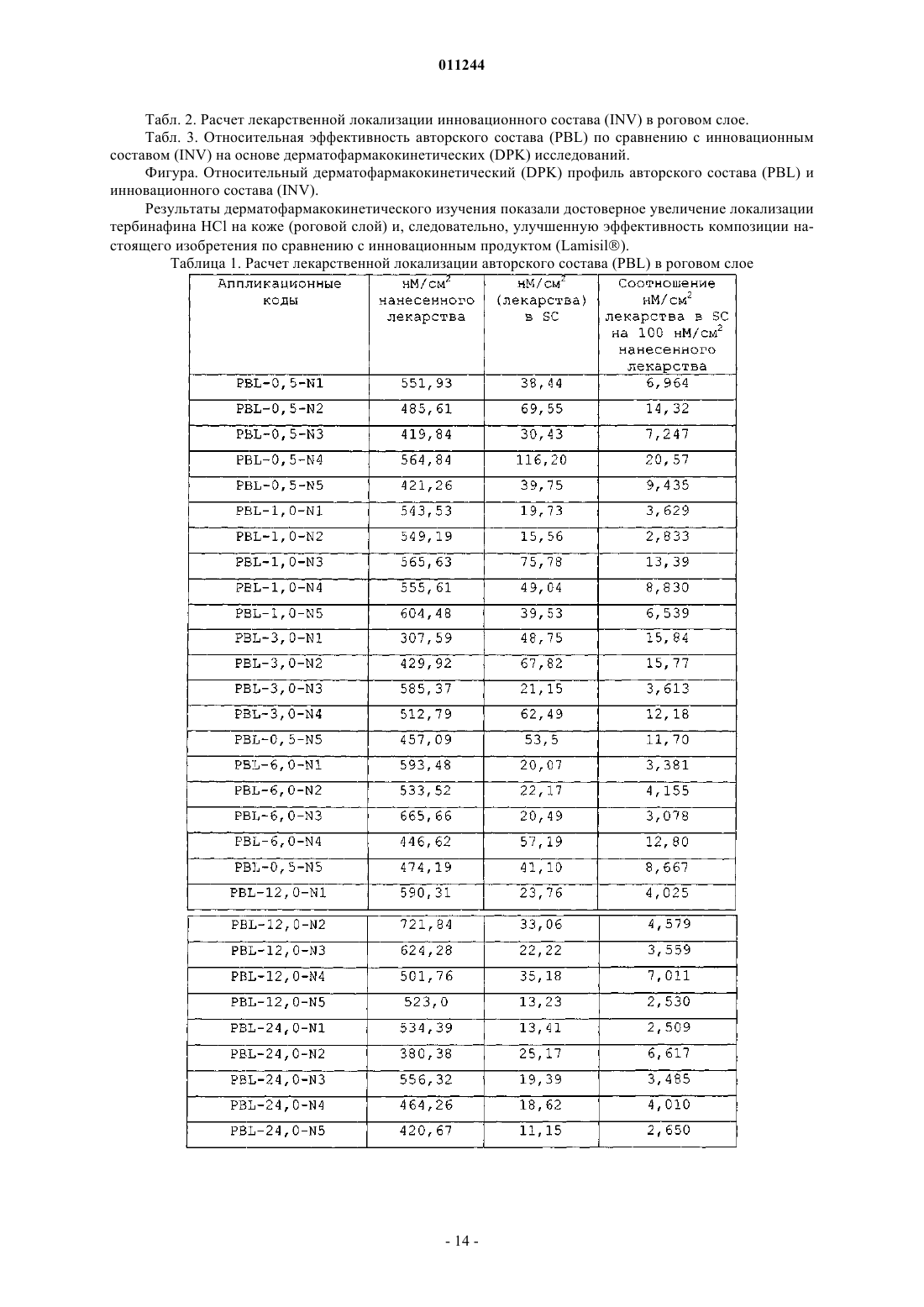
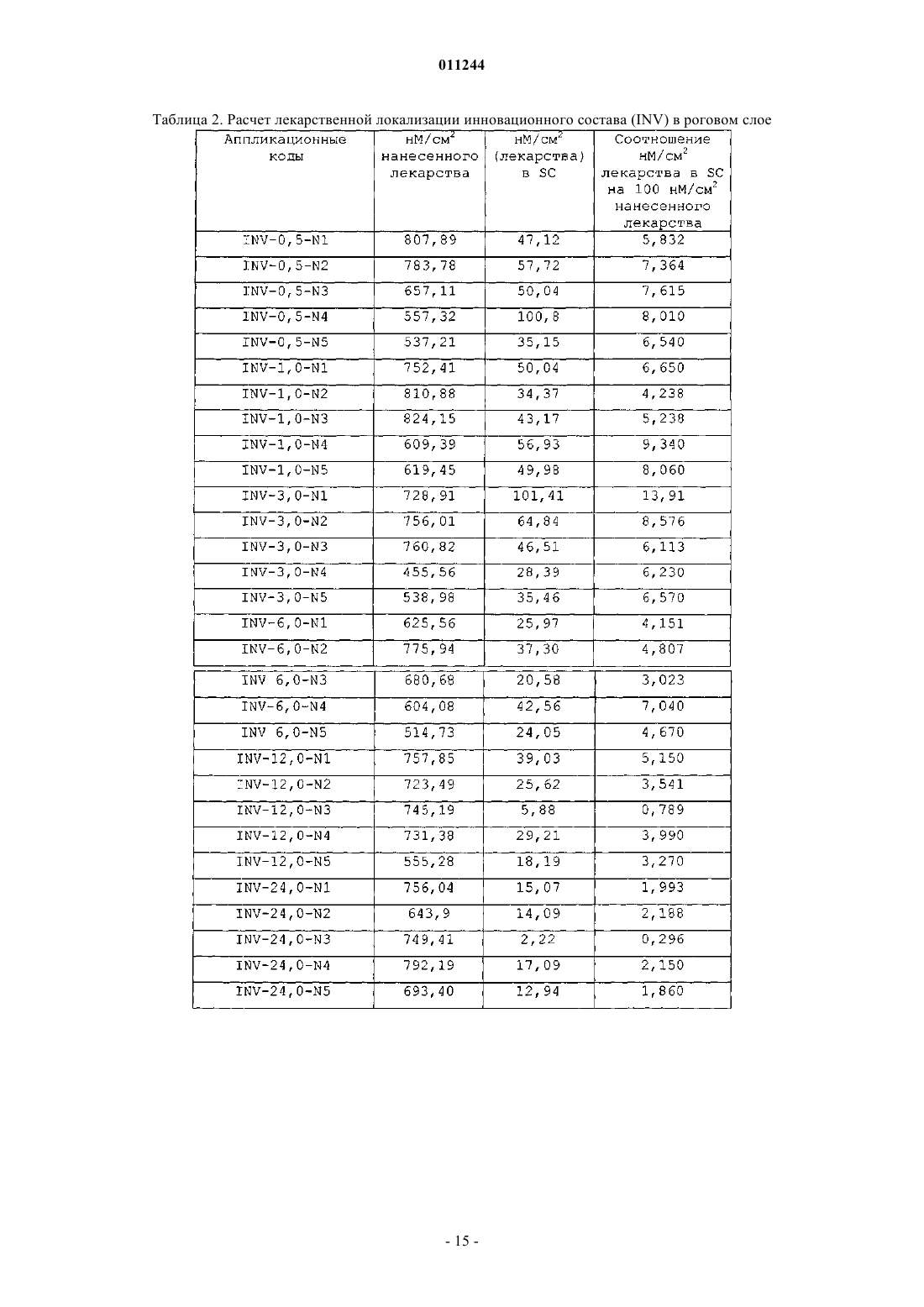
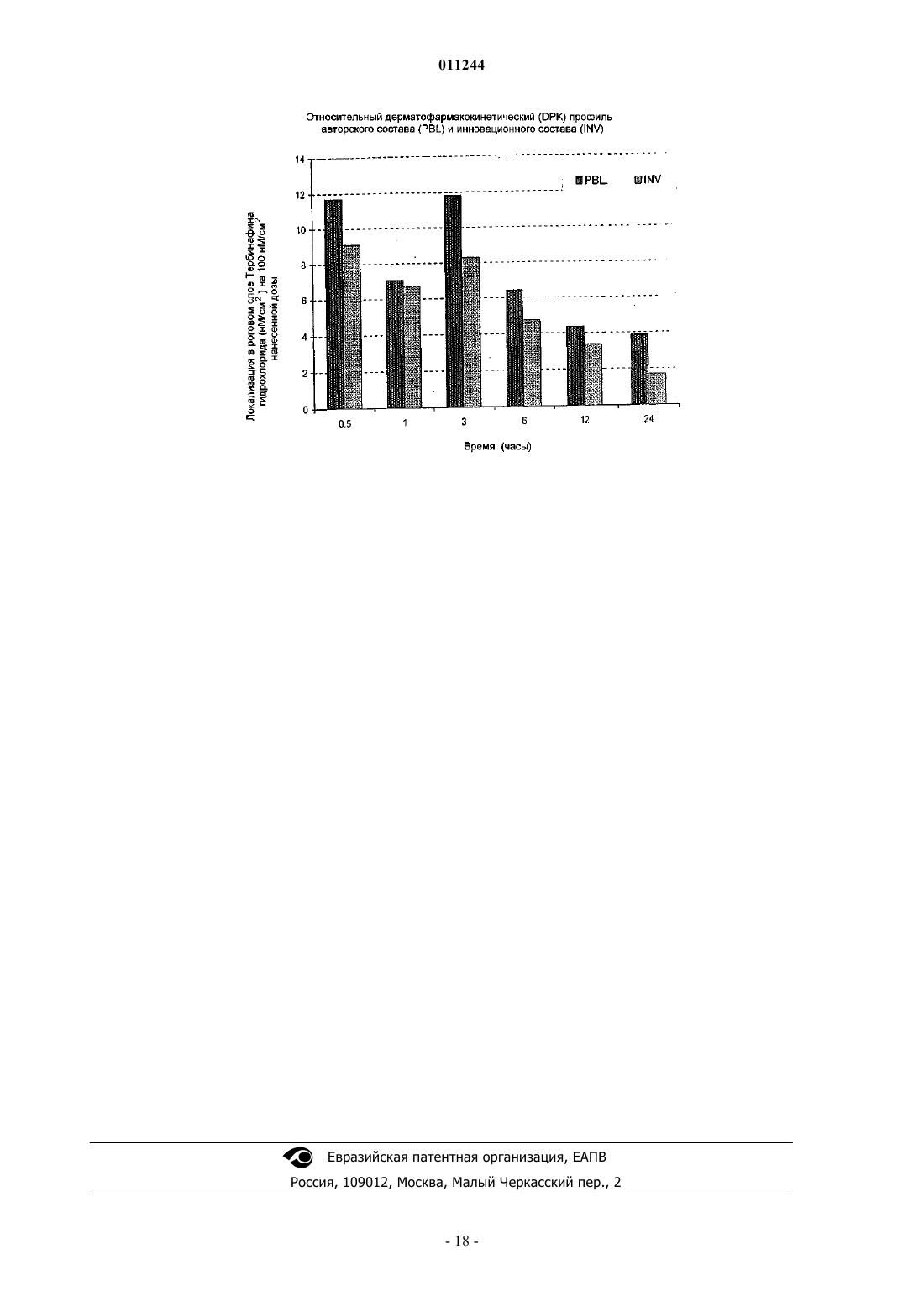
011244 Область техники, к которой относится изобретение Настоящее изобретение относится к фармацевтическим композициям местного применения, к способу получения таких композиций и к способу лечения микробных и/или грибковых инфекций слоев кожи, воспалений, аутоиммунных состояний или гормональных нарушений с использованием таких композиций. Предпочтительно настоящее изобретение относится к композициям местного применения,содержащим активный ингредиент(ы), индивидуально или в комбинации, которые являются высокоэффективными для лечения микробных и/или грибковых инфекций верхних слоев кожи, особенно эпидермиса и дермы, аутоиммунных состояний или гормональных нарушений. Предшествующий уровень техники Некоторые составы местного применения, особенно содержащие антигрибковые, антибактериальные или антимикробные лекарства, иммуномодуляторы или стероиды, встречаются в литературе, но большинство из них имеет такие недостатки, как нестабильность, слабое удержание на кожной поверхности, неэстетичность и трудность удаления с поверхности кожи. Тербинафина гидрохлорид является синтетическим аллиламинным производным, используемым в качестве антигрибкового агента местного применения. Тербинафина гидрохлорид проявляет свое антигрибковое действие путем ингибирования скваленэпоксидазы, ключевого фермента биосинтеза стерола у грибков. Это действие приводит к нехватке эргостерола и соответствующему накоплению стерола в грибковой клетке. Тербинафин раскрыт в патенте США 4755538, в котором сообщается ряд способов его получения. Было опубликовано несколько статей, подчеркивающих фармацевтические свойства Тербинафина; см. Petranyl, G. с сотр.; Science, 1984, 24, 1239; Stutz. А. с сотр., J. Med. Chem., 1984, 27, 1539. Составы местного применения, содержащие иммуносупрессорные лекарственные средства, такие как циклоспорин, такролимус и т.п., и стероиды, такие как тестостерон и т.п., которые являются высокоабсорбируемыми, обладают приемлемым эстетическим видом и удобны для больного в плане легкости применения и удаления с кожной поверхности, но трудны в получении, особенно вследствие большого размера лекарственной молекулы или слабой абсорбции через кожу. Такролимус является макролидным иммуносупрессантом, продуцируемым видами Streptomyces. Циклоспорин является циклическим полипептидным иммуносупрессорным агентом, состоящим из 11 аминокислот. Он продуцируется как метаболит видами грибков Beauveria nlyea. Отсутствует композиция местного применения, содержащая циклоспорин, доступная на рынке. В патенте США 6383471 описаны композиции и способы улучшенной доставки ионизируемых гидрофобных терапевтических агентов. Однако эти композиции не требуют комбинации сурфактантов как важной особенности изобретения. Также отсутствует указание на гелеобразование, то есть формирование в этом случае структурированного геля масляных компонентов с использованием смеси сурфактантов для местной доставки лекарств. В патентах США 6451339, 6294192 и 6309663 раскрыты фармацевтические составы для введения гидрофобного липидрегулирующего агента, содержащего терапевтически эффективное количество липидрегулирующего агента и носитель, где носитель формируется из комбинации гидрофильного сурфактанта и гидрофобного сурфактанта. В композициях используют смесь сурфактантов; указанные композиции при разведении водным растворителем формируют светлую водную дисперсную систему сурфактантов, содержащую терапевтический агент. Однако эти композиции не имеют отношения к гелеобразующим свойствам растворителя при использовании смесей сурфактантов, которые не предназначены для местного применения. В патенте США 6455592 раскрыто применение смачивающих агентов в дерматологических композициях для лечения онихомикоза и соответствующих композиций с фармацевтически эффективным количеством тербинафина гидрохлорида, растворяющей среды, содержащей воду,и по меньшей мере одной прямой или разветвленной цепи C2-С 8 алканола и гидрофильного смачивающего агента. В патенте США 6309663 заявлены не содержащие триглицеридов фармацевтические композиции для усиленной абсорбции гидрофильного терапевтического агента, содержащего гидрофильные и гидрофобные сурфактанты. В патенте США 6761903 описана фармацевтическая композиция, содержащая носитель, содержащий триглицерид, и по меньшей мере два сурфактанта, из которых по меньшей мере один сурфактант является гидрофильным; и терапевтически эффективное количество полисахаридного лекарства, где триглицерид и сурфактанты присутствуют в таком количестве, что при смешивании с водной средой в водной среде соотношение носителя составляет около 100:1 по массе, носитель формирует светлую водную дисперсию, имеющую спектральную поглощающую способность менее чем примерно 0,3-400 нм. Однако ни в одном из указанных патентов не описаны композиции, которые содержат гелеобразующую систему, состоящую из смеси сурфактантов, растворяющую систему, содержащую по меньшей мере один масляный компонент; водную фазу; необязательно содержащие один или несколько стабилизирующих агентов и другие фармацевтически пригодные эксципиенты, где смесь сурфактантов действует как гелеобразователи масляного компонента, присутствующего в растворяющей системе, и приводит к формированию высокоструктурированной гелевой композиции, которая обеспечивает равномерное и локализованное высвобождение на коже активного ингредиента. В патенте США 5446070 раскрыты композиции и способы местного применения фармацевтически активных агентов. Однако это относится к биоадгезивной композиции для местного применения и не-1 011244 содержит, в основном, липофильные растворители и/или сурфактанты. В патенте США 5593680 раскрыты косметические или дермофармацевтические композиции в форме водных гелей, модифицированных добавлением пористых микросфер. В патентах США 5660839 и 5939083 раскрыта нежирная неклейкая композиция, содержащая по меньшей мере одно жирное вещество и некоторое количество деформирующихся полых частиц, эффективных для избежания ощущения жирности и/или клейкости, обычно свойственных указанному по меньшей мере одному жирному веществу, причем указанные деформирующиеся полые частицы содержат сополимер винилиден хлорида, акрилонитрила и (мет)акрилового сомономера. В патенте США 5665386 раскрыто применение эфирных масел для повышения биодоступности пероральных фармацевтических соединений, но не раскрыто применение специфической смеси сурфактантов для стимуляции гелеобразования таких масел. В патентах США 5681849 и 5856355 раскрыты фармацевтические композиции местного применения, содержащие тербинафин в форме свободного основания или в форме кислой добавочной соли, воду, низший алканол и водорастворимый или смешивающийся с водой неионный сурфактант, где отсутствует анионный сурфактант и где указанная композиция является эмульсионным гелем или лосьоном, далее содержащая масляную фазу и загуститель. Однако это изобретение не имеет отношения к применению сурфактантных смесей для гелеобразования растворителей как носителя гидрофобных лекарств. В патенте США 5385907 описана мазь, состоящая, в основном, из трициклического соединения,такого как такролимус, агента, стимулирующего растворение и/или абсорбцию, выбранного из группы,содержащей низший алкандиол, низший алкилен карбонат, алкан дикарбоновый эфир, высший алкан карбоновый глицериновый эфир, высший алкен карбоновый глицериновый эфир, высший алкан карбоновый алкиловый эфир, высший ненасыщенный спирт и азациклоалкан, и мазевой основы, выбранной из группы, содержащей масляную или жировую основу. Однако такие препараты являются жирными и прилипают к коже, и с трудом удаляются при промывании водой. В патенте США 6022852 раскрыт фармацевтический препарат, содержащий циклоспорин А, токоферол полиэтиленгликоль 1000 сукцинат и, необязательно, эмульгатор за исключением растительного масла или жира. Патент США 6113921 имеет отношение к фармацевтической композиции местного или трансдермального усиленного действия, которая содержит капельки в диапазоне субмикронного размера водонерастворимого лекарства в водной дисперсионной системе, где капельки состоят, в основном, из примерно 0,5-30% первого компонента масляной жидкости, содержащего лекарство, примерно 0,1-10% второго компонента эмульгатора и примерно 0,05-5% третьего компонента неионного сурфактанта, где второй и третий компоненты являются различными. В патенте США 5891846 заявлена циклоспоринсодержащая эмульсионная композиция, типа масло в воде, содержащая циклоспорин, полиалкиловый эфир поликарбоновой кислоты в форме жидкости при температуре окружающей среды, по меньшей мере один масляный компонент, сурфактант и кротамитон. В патенте США 5807820 описана фармацевтическая композиция местного применения для дермального введения, содержащая циклоспорин, C12-24 моно- или полиненасыщенный жирный спирт и приемлемые для дермы местные носители или разбавители. В патенте США 5504068 описан препарат местного применения, содержащий циклоспорин; органический растворитель и усилитель смачивания кожи, причем указанный усилитель смачивания кожи представляет собой по меньшей мере одно вещество, выбранное из группы, содержащей алканоламины и одновалентные спиртовые эфиры миристиновой кислоты, адипиновой кислоты и себациновой кислоты. Ни в одним из литературных источников, доступных в данной области, не раскрыты композиции, которые содержат терапевтический агент(ы) и смесь сурфактантов, для продуцирования гелеобразования растворяющего компонента(ов), содержащего терапевтический агент(ы) в качестве существенных ингредиентов, которые приведут к высокоэффективным и локализованным препаратам местного применения для увеличения продолжительности активности. Следовательно, существует неудовлетворенная потребность в разработке высокоэффективных композиций местного применения для лечения микробных, грибковых инфекций, аутоиммунных состояний или гормональных нарушений, которые могут продуцировать желательные эффекты, протяженные периоды времени с минимальной системной абсорбцией для избежания, таким образом, чрезмерного токсического эффекта лекарственных средств. Сущность изобретения Целью настоящего изобретения является разработка фармацевтической композиции для местного применения, обеспечивающей усиленную локализацию активного ингредиента, содержащей по меньшей мере один активный ингредиент, его соли, эфиры, гидраты или производные; гелеобразующую систему,содержащую смесь сурфактантов, растворяющую систему, содержащую по меньшей мере один масляный компонент; водную фазу, содержащую один или несколько стабилизирующих агентов, и необязательно другие фармацевтически пригодные эксципиенты, где смесь сурфактантов действует как гелеобразователи масляного компонента, присутствующего в растворяющей системе, формируя трехмерную сеть, которая иммобилизирует растворяющую систему, характеризующаяся тем, что сурфактант, желатинизирующий масляную фазу, может распределять водную фазу без изменения липидного микроокружения и гелевой структуры композиции. Также целью настоящего изобретения является разработка способа получения фармацевтической-2 011244 композиции для местного применения, обеспечивающей усиленную локализацию активного ингредиента, содержащей по меньшей мере один активный ингредиент, его соли, эфиры, гидраты или производные; гелеобразующую систему, содержащую смесь сурфактантов, растворяющую систему, содержащую по меньшей мере один масляный компонент; водную фазу, содержащую один или несколько стабилизирующих агентов, и необязательно другие фармацевтически пригодные эксципиенты, где смесь сурфактантов действует как гелеобразователи масляного компонента, присутствующего в растворяющей системе, формируя трехмерную сеть, которая иммобилизирует растворяющую систему, характеризующаяся тем, что сурфактант, желатинизирующий масляную фазу, может распределять водную фазу без изменения липидного микроокружения и гелевой структуры композиции, который включает следующие стадии: 1) получение масляной фазы, содержащей гелеобразующую систему; 2) включение активного ингредиента в масляную фазу; 3) получение водной фазы, содержащей стабилизатор; 4) смешивание как масляной, так и водной фазы при длительном перемешивании до получения желательной композиции. Далее целью настоящего изобретения является разработка способа лечения грибковых, бактериальных или микробных инфекций, воспалений, аутоиммунных состояний или гормональных нарушений,включающего введение фармацевтически эффективного количества такой фармацевтической композиции пациенту. Композиции согласно настоящему изобретению обеспечивают усиленную локализацию гидрофобных и/или амфифильных активных ингредиентов для лечения микробных и/или грибковых инфекций кожи или лечения аутоиммунных или гормональных нарушений. Другой целью настоящего изобретения является разработка существенно нежирных и легко смываемых водой фармацевтических композиций, предназначенных для местного применения. Подробное описание изобретения Настоящее изобретение относится к фармацевтической композиции для топического введения, характеризующейся усиленной локализацией активного ингредиента, причем указанная композиция содержит по меньшей мере один активный ингредиент, его соли, сложные эфиры, гидраты или производные; гелеобразующую систему, состоящую из смеси сурфактантов, растворяющую систему, содержащую по меньшей мере один масляный компонент; водную фазу, содержащую один или несколько стабилизирующих агентов и необязательно другие фармацевтически приемлемые эксципиенты. Смесь сурфактантов, присутствующая в фармацевтической композиции по изобретению, действует как гелеобразователи масляного компонента, присутствующего в растворяющей системе, формируя трехмерную сеть, которая иммобилизирует растворяющую систему, таким образом, что сурфактант, желатинизирующий масляную фазу, может распределять водную фазу без изменения липидного микроокружения и гелевой структуры композиции. Фармацевтические композиции по изобретению являются предпочтительно гелеобразующей топической системой с обогащенным липидным микроокружением, но легко смываемой водой. В основном варианте осуществления настоящего изобретения преодолеваются проблемы, связанные с локализацией лекарственного средства в верхних слоях кожи путем обеспечения уникального, основанного на гелеобразователе липидного микроокружения. Термин гелеобразование, используемый в настоящем описании, относится к желатинизированию масляного компонента смесью сурфактантов, используемых в композиции по изобретению, приводящего к формированию высокоструктурированной системы. Настоящее изобретение относится к фармацевтическим композициям, содержащим гидрофобный или амфифильный активный ингредиент, выбранный, но не ограниченный ими, из группы, содержащей антигрибковые агенты, такие как тербинафин, бутенафин, гризеофульвин и т.п.; антибактериальные агенты, такие как сертаконазол, миноциклин и т.п.; иммуномодуляторы, такие как циклоспорин, такролимус и т.п.; стероиды, такие как тестостерон, гидрокортизон и т.п.; анальгетики, противовоспалительные агенты, такие как нимесулид, диклофенак, ибупрофен, напроксен и т.п.; кератинизирующие агенты,такие как салициловая кислота; антимикробные агенты, питающие кожу агенты или сенсибилизирующие агенты, антипсориатические и антиэкземные лекарства, используемые индивидуально или в комбинации. В предпочтительном варианте осуществления настоящего изобретения активным ингредиентом является тербинафин, такролимус, циклоспорин, тестостерон, гидрокортизон, их соли, эфиры, гидраты или производные. В варианте осуществления фармацевтическая композиция по изобретению включает гелеобразующую систему, состоящую из смеси сурфактантов, содержащей по меньшей мере два сурфактанта, где по меньшей мере один является гидрофильным сурфактантом, имеющим значение HLB, большее или равное примерно 10; и липофильного сурфактанта, имеющего значение HLB, меньше, чем примерно 10. Липофильный сурфактант присутствует в количестве, достаточном для достижения требуемого соотношения концентрации смеси сурфактантов, вызывающей желатинизирование одного или нескольких масляных компонентов, присутствующих в растворяющей системе. В другом варианте осуществления гелеобразующая система по изобретению присутствует в коли-3 011244 честве от примерно 5% до примерно 50% по массе от общей массы композиции. Гидрофильный сурфактант гелеобразующей системы по изобретению выбран, но не ограничен ими,из группы, содержащей полиоксиэтилен алкиловые эфиры; полиоксиэтилен сорбитан жирнокислотные эфиры, известные как полисорбаты; полиоксиэтилен алкиловые фенолы; полиэтиленгликоль жирнокислотные эфиры; полиглицерин жирнокислотные эфиры; полиоксиэтилен глицериды; полиоксиэтилен стеролы; полиоксиэтилен растительные масла; полиоксиэтилен гидрогенизированные растительные масла; пропиленгликоль альгинат; лецитины и гидрогенизированные лецитины; лизолецитин и гидрогенизированные лизолецитины; лизофосфолипиды и их производные; фосфолипиды и их производные; соли жирных кислот; лаурил макроглицериды или их смеси. Липофильный сурфактант по изобретению выбран, но не ограничен ими, из группы, содержащей жирные кислоты: сорбитан жирнокислотные эфиры; ацетилированные глицерин жирнокислотные эфиры; жирнокислотные эфиры низших спиртов; трансэтерифицированные продукты жирных кислот, глицериды, растительные масла, гидрогенизированные растительные масла, триглицериды и полиалкилен полиолы; стеролы и стероловые производные; пентаэритриол жирнокислотные эфиры и полиалкиленгликолевые эфиры; моноглицериды и ацетилированные, например, моно- и диацетилированные моноглицериды; или их смеси. Предпочтительно гелеобразующая система по изобретению состоит из смеси сурфактантов, содержащих липофильный сурфактант, который является сорбитан жирнокислотным эфиром, выбранным из группы, содержащей сорбитан монолаурат (SPAN 20), сорбитан монопальмитат (SPAN 40), сорбитан моноолеат (SPAN 60) и сорбитан моностеарат (SPAN 80); и гидрофильный сурфактант, который является полиоксиэтилен сорбитан жирнокислотным эфиром, выбранным из группы, содержащей полиоксиэтилен сорбитан монолаурат (TWEEN 20), полиоксиэтилен сорбитан монопальмитат (TWEEN 40),полиоксиэтилен сорбитан моноолеат (TWEEN 60) и полиоксиэтилен сорбитан моностеарат (TWEEN 80). Более предпочтительно липофильным сурфактантом является SPAN 80 и гидрофильным сурфактантом является TWEEN 80. В варианте осуществления настоящего изобретения отношение гидрофильного сурфактанта к липофильному сурфактанту составляет примерно от 1:20 до примерно 20:1. Растворяющая система по изобретению включает по меньшей мере один масляный компонент и один или несколько других компонентов, выбранных из группы, содержащей, но не ограничиваясь ими,липофильные растворители и гидрофильные растворители, такие как метанол, этанол, изопропанол, триэтил цитрат, ацетил бутил цитрат или триацетин, этиленгликоль, пропиленгликоль, глицерин, полиэтиленгликоль и полиэтиленгликолевые эфиры. Масляные компоненты растворяющей системы выбраны, но не ограничены ими, из природные масел, моно-, ди- или триглицеридных эфиров масел, выбранных из группы, содержащей среднецепочечные триглицериды, олеиновую кислоту, этил олеат, этил каприлат, этил бутурат, изопропил миристат,соевое масло, каноловое масло или их моно- и диглицериды, алюминия моностеарат, алюминия дистеарат, алюминия тристеарат, микрокристаллический парафин, петролейный парафин и смеси, применяемые или отдельно, или в комбинации. Предпочтительно по меньшей мере одним масляным компонентом растворяющей системы является среднецепочечный триглицерид. В другом варианте фармацевтической композиции по изобретению водная фаза содержит воду,алифатические или ароматические спирты, гликоли или их смеси. Липофильные растворители включают триэтил цитрат, ацетил бутил цитрат или триацетин, триглицерид, выбранные, но не ограниченные ими, из группы, содержащей растительные масла, рыбий жир,животные жиры, гидрогенизированные растительные масла, частично гидрогенизированные растительныемасла, синтетические триглицериды, модифицированные триглицериды, фракционированные триглицериды и их смеси, используемые индивидуально или в комбинации. Гидрофильные растворители выбраны, но не ограничены ими, из группы, содержащей воду, гликоли, например, пропиленгликоль, бутиленгликоль, гексиленгликоль, этиленгликоль и полиэтиленгликоли и их смеси, используемые индивидуально или в комбинации. В варианте осуществления настоящего изобретения растворяющая система содержит по меньшей мере один масляный компонент(ы) и/или по меньшей мере один липофильный растворитель(и) и необязательно гидрофильный растворитель(и); указанная композиция может далее содержать 1-30% по массе водной фазы относительно общей массы композиции. В варианте осуществления композиция по изобретению необязательно содержит стабилизирующий агент(ы), где стабилизирующим агентом является природный, синтетический или полусинтетический полимер, который действует как структурообразователь и стабилизатор в составах местного применения,которые находятся в интервале от эмульсии, крема, лосьона до геля по их консистенции и структуре. Стабилизирующий агент(ы), используемый в настоящем изобретении, выбран из группы природных и синтетических полимеров и углеводородов, таких как хитозан, альгинаты, караген, целлюлозные производные, пектин, крахмал, ксантановая камедь, альбумин, альгинат, желатин, гуммиарабик, целлюлозный декстран, гидроксиэтилцеллюлоза, гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза,-4 011244 коллоидный диоксид кремния, гиалуроновая кислота, карбоксиэтилцеллюлоза, карбоксиметилцеллюлоза, полоксамер (полиэтилен-пропилен гликолевый сополимер), карбопол (карбомер), полимеры на основе акриловой кислоты и их производные. Предпочтительным стабилизирующим агентом по изобретению является полоксамер. В другом варианте осуществления стабилизатор добавляют или в масляную фазу, или в водную фазу, или добавляют в водный раствор до концентрации в диапазоне 0,1-20% от общей массы композиции. В варианте осуществления настоящего изобретения другие фармацевтически пригодные эксципиенты выбраны, но не ограничены ими, из группы, содержащей консерванты, рецептурные добавки, антиоксиданты, разбавители, регулирующие рН агенты, забуферивающие агенты, тонизирующие модификаторы, красители и т.п. или их смеси. В варианте осуществления настоящего изобретения консервант и антиоксиданты выбраны из группы, содержащей парабены, такие как метилпарабена натрий, пропилпарабена натрий, бензалкония хлорид, бензиловый спирт, натрия метабисульфит, бутилированный гидрокситолуол, бутилированный гидроксианизол, серные соединения и т.п. и их смеси. В варианте осуществления настоящего изобретения рецептурная добавка может быть выбрана из группы, содержащей полоксамер, карбопол, целлюлозные полимеры, полимеры на основе акриловой кислоты и т.п. или их смеси. В варианте осуществления настоящего изобретения рецептурная добавка может быть выбрана из группы, содержащей лимонную кислоту, винную кислоту и т.п. В варианте осуществления композиции по изобретению находятся в форме крема, геля, желе, лосьона, мази, раствора местного применения и т.п., предпочтительно в форме крема или геля. В другом варианте осуществления композиции по изобретению предназначены для высоколокализованного топического введения гидрофобного и/или амфифильного активного ингредиента(ов), включая, но не ограничиваясь ими, противобактериальные, противогрибковые, антипаразитарные, антимикотические агенты, антибиотики, противовоспалительные, аналгетики (наркотические и не наркотические),антисептики, дезинфектанты, антипсориатические, антиэкземные, противодействующие старению, антигистаминные, противозудные, кератолитические, антисеборейные агенты, глюкокортикоиды, стероиды,иммуномодуляторы, мышечные релаксанты, антивирусные агенты, анестетики, антиаллергенные агенты или их соли, сложные эфиры, гидраты или производные, используемые индивидуально или в комбинации. В другом варианте осуществления аналгетик и/или противовоспалительный агент выбран, но не ограничен ими, из группы, содержащей нимесулид, ацетаминофен, ацетанилид, ацетилсалицилаты, ацетилсалициловую кислоту, аминопрофен, аспирин, беноксапрофен, карбамазепин, дифлунисал, энфенамовую кислоту, этодолак, фенопрофен, флуфенамовую кислоту, флурбипрофен, диклофенак, ибуфенак, пироксикам, индометацин, индопрофен, кетопрофен, кеторолак, миропрофен, морфолина салицилат, напроксен, фенацетин, фенила салицилат, хинина салицилат, салициламид, салициловую кислоту, салицилаты и их производные, теноксикам, толфенамовую кислоту, трамадол и т.п. или их соли, сложные эфиры, гидраты или производные. Авторы изобретения неожиданно обнаружили, что композиции, содержащие комбинацию липофильного и гидрофильного сурфактанта, могут желатинизировать комбинацию масляных и липофильных растворителей (совместно названную как растворяющая система), и включить достаточное количество водной фазы без изменения липидного микроокружения и гелевой структуры. Применение этих комбинаций приводит к усиленной локализации гидрофобного и/или амфифильного активного ингредиента(ов), существенного для лечения микробных и/или грибковых инфекций кожных слоев, или аутоиммунных или гормональных нарушений. В настоящем изобретении гелеобразующие компоненты (комбинация сурфактантов) обеспечивают желатинизирование растворяющей системы и, таким образом, формируют трехмерную сеть. Это происходит вследствие того, что молекулы сурфактанта имеют тенденцию ассоциировать с растворяющей окружающей средой, что приводит к формированию агрегатов. Далее они ассоциируют с другими через контактные точки и, таким образом, создается трехмерная сеть, которая иммобилизирует растворяющую систему и действует как гель. Добавление водных компонентов не генерирует разрыва этих трубчатых и тороидальных структур и, кроме того, стабилизирующий агент(ы) эмульгирует избыток масла, которое не желатинизируется в процессе гелеобразования. Также предлагается косметический внешний вид композиции. Далее, это высоколипофильное микроокружение для взаимодействия с кожными липидами предназначено для формирования депо в кожных слоях, через которые захваченное гидрофобное лекарство может быть высвобождено в течение длительного периода времени в локализованной области. В предпочтительном варианте осуществления терапевтический агент(ы), присутствующий в фармацевтической композиции по изобретению, составляет примерно от 0,1% до примерно 10% по массе, в расчете на общую массу фармацевтической композиции. В другом варианте осуществления настоящее изобретение относится к способу получения фармацевтической композиции для топического введения, характеризующейся усиленной локализацией активного ингредиента, причем указанная композиция содержит по меньшей мере один активный ингредиент,-5 011244 его соли, сложные эфиры, гидраты или производные; гелеобразующую систему, состоящую из смеси сурфактантов, растворяющую систему, содержащую по меньшей мере один масляный компонент; водную фазу, содержащую один или несколько стабилизирующих агентов и необязательно другие фармацевтически приемлемые эксципиенты, где смесь сурфактантов действует как гелеобразователи масляного компонента, присутствующего в растворяющей системе, формируя трехмерную сеть, которая иммобилизирует растворяющую систему, таким образом, что сурфактант, желатинизирующий масляную фазу,может распределять водную фазу без изменения липидного микроокружения и гелевой структуры композиции. В другом варианте осуществления способ получения композиций по изобретению включает получение масляной фазы путем смешивания ингредиентов при нагревании и перемешивании с последующим введением активного ингредиента(ов) при перемешивании; получение водной фазы путем смешивания ингредиентов при нагревании и перемешивании; и смешивание масляной и водной фазы при нагревании и перемешивание до получения желательного продукта. Настоящее изобретение также относится к способу лечения грибковых инфекций, включающему введение пациенту фармацевтически эффективного количества фармацевтической композиции, как описано в настоящем описании. Для того, чтобы проиллюстрировать настоящее изобретение, предлагаются следующие примеры. Однако эти примеры не ограничивают объем изобретения. Примеры Пример 1. Состав местного применения готовили следующим образом. Взяли заранее определенное взвешенное количество сорбитана моностеарата, полисорбата 20,среднецепочечного триглицерида и бензилового спирта. Содержимое нагревали при непрерывном перемешивании с постоянной температурой водяной бани для поддержания температуры массы 60-65 С. Тербинфина гидрохлорид добавили в расплав, продолжая перемешивание до получения гомогенной смеси. Приготовили водную фазу. Заранее определенное взвешенное количество полоксамера 188 смешали с дистиллированной водой (7%). Для этого добавили натрия метабисульфит в заранее определенном количестве. Смесь перемешали и затем нагревали, поддерживая температуру массы 60-65 С. Масляную фазу и водную фазу поддерживали при 60-65 С и объем водной фазы добавили в масляную фазу, поддерживая такую же температуру (60-65 С) при непрерывном перемешивании до получения желательного продукта. Пример 2 Состав местного применения готовили следующим образом. Взяли заранее определенное взвешенное количество сорбитана моностеарата, полисорбата 20,среднецепочечного триглицерида и бензилового спирта. Содержимое нагревали при непрерывном перемешивании с постоянной температурой водяной бани для поддержания температуры массы 60-65 С. Тербинфина гидрохлорид добавили в расплав, продолжая перемешивание до получения гомогенной смеси. Приготовили водную фазу. Заранее определенное взвешенное количество карбопола 971 Р и триэта-6 011244 ноламина смешали с дистиллированной водой (2%). Для этого добавили натрия метабисульфит в заранее определенном количестве и смесь перемешали, поддерживая температуру массы 60-65 С. Масляную фазу и водную фазу поддерживали при 60-65 С и объем водной фазы добавили в масляную фазу, поддерживая такую же температуру (60-65 С) при непрерывном перемешивании до получения желательного продукта. Пример 3. Взяли заранее определенное взвешенное количество сорбитана моностеарата, полисорбата 20,среднецепочечного триглицерида и бензилового спирта. Содержимое нагревали при непрерывном перемешивании с постоянной температурой водяной бани для поддержания температуры массы 60-65 С. Бутенафина гидрохлорид добавили в расплав, продолжая перемешивание до получения гомогенной смеси. Приготовили водную фазу. Заранее определенное взвешенное количество натрия альгината и триэтаноламина смешали с дистиллированной водой (2%). Для этого добавили натрия метабисульфит в заранее определенном количестве и смесь перемешали, поддерживая температуру массы 60-65 С. Масляную фазу и водную фазу поддерживали при 60-65 С и объем водной фазы добавили в масляную фазу, поддерживая такую же температуру (60-65 С) при непрерывном перемешивании до получения желательного продукта. Пример 4. Состав местного применения готовили следующим образом. Взяли заранее определенное взвешенное количество глицерил моностеарата, полисорбата 20, среднецепочечного триглицерида и бензилового спирта. Содержимое нагревали при непрерывном перемешивании с постоянной температурой водяной бани для поддержания температуры массы 60-65 С. Тербинафина гидрохлорид добавили в расплав, продолжая перемешивание до получения гомогенной смеси. Приготовили водную фазу. Заранее определенное взвешенное количество натрия альгината и триэтаноламина смешали с дистиллированной водой(2%). Для этого добавили натрия метабисульфит в заранее определенном количестве и смесь перемешали, поддерживая температуру массы 60-65 С. Масляную фазу и водную фазу поддерживали при 60-65 С и объем водной фазы добавили в масляную фазу, поддерживая такую же температуру (60-65 С) при непрерывном перемешивании до получения желательного продукта. Пример 5 Состав местного применения готовили следующим образом. Взяли заранее определенное взвешенное количество глицерил моностеарата, полисорбата 20, изо-7 011244 пропил миристата и бензилового спирта. Содержимое нагревали при непрерывном перемешивании с постоянной температурой водяной бани для поддержания температуры массы 60-65 С. Тербинафина гидрохлорид добавили в расплав, продолжая перемешивание до получения гомогенной смеси. Приготовили водную фазу. Заранее определенное взвешенное количество полоксамера 188 и триэтаноламина смешали с дистиллированной водой (10%). Для этого добавили натрия метабисульфит в заранее определенном количестве и смесь перемешали поддерживая температуру массы 60-65 С. Масляную фазу и водную фазу поддерживали при 60-65 С и объем водной фазы добавили в масляную фазу, поддерживая такую же температуру (60-65 С) при непрерывном перемешивании до получения желательного продукта. Пример 6. Состав местного применения готовили следующим образом. Взяли заранее определенное взвешенное количество сорбитана моностеарата, полисорбата 20,среднецепочечного триглицерида, пропиленгликоля, изопропил миристата и бензилового спирта. Содержимое нагревали при непрерывном перемешивании с постоянной температурой водяной бани для поддержания температуры массы 60-65 С. Тербинафина гидрохлорид добавили в расплав, продолжая перемешивание до получения гомогенной смеси. Полученный таким образом состав от белого цвета с желтоватым или сероватым оттенком до кремового цвета мог храниться в плотно закрытом HDPE контейнере. Пример 7. Состав местного применения готовили следующим образом. Масляную фазу приготовили первой. Взяли заранее определенное взвешенное количество сорбитана моностеарата, полисорбата 20, среднецепочечного триглицерида, пропиленгликоля и бензилового спирта; жидкие ингредиенты пропустили через нейлоновую ткань и перенесли в S.S. контейнер с рубашкой. Твердые ингредиенты добавили к содержимому S.S. контейнера и перемешали. Эту смесь нагревали при непрерывном перемешивании путем циркуляции горячей воды в рубашке, поддерживая температуру массы 60-65 С. Тербинафина гидрохлорид добавили в вышеупомянутый расплав, продолжая перемешивание до получения гомогенной смеси. Затем приготовили водную фазу. Заранее определенное взвешенное количество хитозана и лимонной кислоты смешали с достаточно дистиллированной водой и смесь нагревали при непрерывном перемешивании, поддерживая температуру массы 60-65 С. Масляную фазу и водную фазу поддерживали при 6065 С и объем водной фазы добавили в масляную фазу, поддерживая такую же температуру (60-65 С) при непрерывном перемешивании до получения желательного состава. Пример 8. Состав местного применения готовили следующим образом. Взяли заранее определенное взвешенное количество глицерил моностеарата, полисорбата 20, изопропил миристата, пропиленгликоля и бензилового спирта. Содержимое нагревали при непрерывном перемешивании с поддержанием температуры массы 60-65 С. Тербинафина гидрохлорид и нимесулид-8 011244 добавили в расплав, продолжая перемешивание до получения гомогенной смеси. Полученный таким образом состав от белого цвета с желтоватым или сероватым оттенком до кремового цвета мог храниться в плотно закрытом HDPE контейнере. Пример 9. Состав местного применения готовили следующим образом. Масляную фазу приготовили первой. Взяли заранее определенное взвешенное количество полиэтиленгликоля дистеарата, полисорбата 20,среднецепочечного триглицерида, минерального масла и бензилового спирта; жидкие ингредиенты пропустили через нейлоновую ткань и перенесли в S.S. контейнер с рубашкой. Твердые ингредиенты добавили к содержимому S.S. контейнера и перемешали. Эту смесь нагревали при непрерывном перемешивании путем циркуляции горячей воды в рубашке, поддерживая температуру массы 60-65 С. Клотримазол добавили в вышеупомянутый расплав, продолжая перемешивание до получения гомогенной смеси. Затем приготовили водную фазу. Заранее определенное взвешенное количество хитозана и лимонной кислоты смешали с достаточно дистиллированной водой, и смесь нагревали при непрерывном перемешивании,поддерживая температуру массы 60-65 С. Масляную фазу и водную фазу поддерживали при 60-65 С и объем водной фазы добавили в масляную фазу, поддерживая такую же температуру (60-65 С) при непрерывном перемешивании до получения желательного продукта. Пример 10. Состав местного применения готовили следующим образом. Масляную фазу приготовили первой. Взяли заранее определенное взвешенное количество полиэтиленгликоля дистеарата, полисорбата 20,изопропил миристата и бензилового спирта; жидкие ингредиенты пропустили через нейлоновую ткань и перенесли в S.S. контейнер с рубашкой. Твердые ингредиенты добавили к содержимому S.S. контейнера и перемешали. Эту смесь нагревали при непрерывном перемешивании путем циркуляции горячей воды в рубашке, поддерживая температуру массы 60-65 С. Миконазол и гентамицина сульфат добавили в вышеупомянутый расплав, продолжая перемешивание до получения гомогенной смеси. Приготовили водную фазу. Заранее определенное взвешенное количество хитозана и лимонной кислоты смешали с достаточно дистиллированной водой и смесь нагревали при непрерывном перемешивании, поддерживая температуру массы 60-65 С. Масляную фазу и водную фазу поддерживали при 60-65 С и объем водной фазы добавили в масляную фазу, поддерживая такую же температуру (60-65 С) при непрерывном перемешивании до получения желательного продукта. Пример 11. Состав местного применения готовили следующим образом. Масляную фазу приготовили первой. Взяли заранее определенное взвешенное количество сорбитана моностеарата, полисорбата 20, среднеце-9 011244 почечного триглицерида, пропиленгликоля и бензилового спирта; жидкие ингредиенты пропустили через нейлоновую ткань и перенесли в S.S. контейнер с рубашкой. Твердые ингредиенты добавили к содержимому S.S. контейнера и перемешали. Эту смесь нагревали при непрерывном перемешивании путем циркуляции горячей воды в рубашке, поддерживая температуру массы 60-65 С. Сертаконазол добавили в вышеупомянутый расплав, продолжая перемешивание до получения гомогенной смеси. Затем приготовили водную фазу. Заранее определенное взвешенное количество хитозана и лимонной кислоты смешали с достаточно дистиллированной водой, и смесь нагревали при непрерывном перемешивании, поддерживая температуру массы 60-65 С. Масляную фазу и водную фазу поддерживали при 60-65 С и объем водной фазы добавили в масляную фазу, поддерживая такую же температуру (60-65 С) при непрерывном перемешивании до получения желательного состава. Пример 12 Состав местного применения готовили следующим образом. Масляную фазу приготовили первой. Взяли заранее определенное взвешенное количество сорбитана моностеарата, полисорбата 20, среднецепочечного триглицерида, бутилированного гидрокситолуола и бутилированного гидроксианизола; жидкие ингредиенты пропустили через нейлоновую ткань и перенесли в S.S. контейнер с рубашкой. Твердые ингредиенты добавили к содержимому S.S. контейнера и перемешали. Эту смесь нагревали при непрерывном перемешивании путем циркуляции горячей воды в рубашке, поддерживая температуру массы 50-55 С. Тербинафина гидрохлорид растворили в метаноле и добавили в вышеупомянутый расплав, продолжая перемешивание до получения гомогенной смеси. Затем приготовили водную фазу. Заранее определенное взвешенное количество полоксамера и триэтаноламина смешали с достаточно дистиллированной водой и добавили бензиловый спирт и смесь нагревали при непрерывном перемешивании, поддерживая температуру массы 50-55 С. Масляную фазу и водную фазу поддерживали при 60-б 5 С и объем водной фазы добавили в масляную фазу, поддерживая такую же температуру (60-65 С) при непрерывном перемешивании до получения желательного состава. Пример 13. Состав местного применения готовили следующим образом. Масляную фазу приготовили первой. Взяли заранее определенное взвешенное количество сорбитана моностеарата, полисорбата 20, среднецепочечного триглицерида, пропилпарабен натрия, бутилированного гидрокситолуола и бутилированного гидроксианизола; жидкие ингредиенты пропустили через нейлоновую ткань и перенесли в S.S. контейнер с рубашкой. Твердые ингредиенты добавили к содержимому S.S. контейнера и перемешали. Эту смесь нагревали при непрерывном перемешивании путем циркуляции горячей воды в рубашке, поддер- 10011244 живая температуру массы 50-55 С. Тербинафина гидрохлорид растворили в метаноле и добавили в вышеупомянутый расплав, продолжая перемешивание до получения гомогенной смеси. Затем приготовили водную фазу. Заранее определенное взвешенное количество полоксамера и метилпарабен натрия смешали с достаточно дистиллированной водой и добавили пропиленгликоль и смесь нагревали при непрерывном перемешивании, поддерживая температуру массы 50-55 С. Масляную фазу и водную фазу поддержизали при 60-65 С и объем водной фазы добавили в масляную фазу, поддерживая такую же температуру (60-65 С) при непрерывном перемешивании до получения желательного состава. Пример 14. Состав местного применения готовили следующим образом. Масляную фазу приготовили первой. Взяли заранее определенное взвешенное количество сорбитана моностеарата, полисорбата 20, среднецепочечного триглицерида, бутилированного гидрокситолуола и бутилированного гидроксианизола; жидкие ингредиенты пропустили через нейлоновую ткань и перенесли в S.S. контейнер с рубашкой. Твердые ингредиенты добавили к содержимому S.S. контейнера и перемешали. Эту смесь нагревали при непрерывном перемешивании путем циркуляции горячей воды в рубашке, поддерживая температуру массы 50-55 С. Такролимус растворили в метаноле и добавили в вышеупомянутый расплав, продолжая перемешивание до получения гомогенной смеси. Затем приготовили водную фазу. Заранее определенное взвешенное количество полоксамера и триэтаноламина смешали с достаточно дистиллированной водой и добавили бензиловый спирт и смесь нагревали при непрерывном перемешивании, поддерживая температуру массы 50-55 С. Масляную фазу и водную фазу поддерживали при 60-65 С и объем водной фазы добавили в масляную фазу, поддерживая такую же температуру (60-65 С) при непрерывном перемешивании до получения желательного состава. Пример 15. Состав местного применения готовили следующим образом. Масляную фазу приготовили первой. Взяли заранее определенное взвешенное количество сорбитана моностеарата, полисорбата 20, среднецепочечного триглицерида, пропилпарабен натрия, бутилированного гидрокситолуола и бутилированного гидроксианизола; жидкие ингредиенты пропустили через нейлоновую ткань и перенесли в S.S. контейнер с рубашкой. Твердые ингредиенты добавили к содержимому S.S. контейнера и перемешали. Эту смесь нагревали при непрерывном перемешивании путем циркуляции горячей воды в рубашке, поддерживая температуру массы 50-55 С. Такролимус растворили в метаноле и добавили в вышеупомянутый расплав, продолжая перемешивание до получения гомогенной смеси. Затем приготовили водную фазу. Заранее определенное взвешенное количество полоксамера и метилпарабен натрия смешали с достаточно дистиллированной водой и добавили пропиленгликоль и смесь нагревали при непрерывном переме- 11011244 шивании, поддерживая температуру массы 50-55 С. Масляную фазу и водную фазу поддерживали при 60-65 С и объем водной фазы добавили в масляную фазу, поддерживая такую же температуру (60-65 С) при непрерывном перемешивании до получения желательного состава. Пример 16. Состав местного применения готовили следующим образом. Масляную фазу приготовили первой. Взяли заранее определенное взвешенное количество сорбитана моностеарата, полисорбата 20, среднецепочечного триглицерида, бутилированного гидрокситолуола и бутилированного гидроксианизола; жидкие ингредиенты пропустили через нейлоновую ткань и перенесли в S.S. контейнер с рубашкой. Твердые ингредиенты добавили к содержимому S.S. контейнера и перемешали. Эту смесь нагревали при непрерывном перемешивании путем циркуляции горячей воды в рубашке, поддерживая температуру массы 50-55 С. Циклоспорин растворили в метаноле и добавили в вышеупомянутый расплав, продолжая перемешизание до получения гомогенной смеси. Затем приготовили водную фазу. Заранее определенное взвешенное количество полоксамера и триэтаноламина смешали с достаточно дистиллированной водой и добавили бензиловый спирт и смесь нагревали при непрерывном перемешивании, поддерживая температуру массы 50-55 С. Масляную фазу и водную фазу поддерживали при 60-65 С и объем водной фазы добавили в масляную фазу, поддерживая такую же температуру (60-65 С) при непрерывном перемешивании до получения желательного состава. Пример 17. Состав местного применения готовили следующим образом. Масляную фазу приготовили первой. Взяли заранее определенное взвешенное количество сорбитана моностеарата, полисорбата 20, среднецепочечного триглицерида, пропилпарабен натрия, бутилированного гидрокситолуола и бутилированного гидроксианизола; жидкие ингредиенты пропустили через нейлоновую ткань и перенесли в S.S. контейнер с рубашкой. Твердые ингредиенты добавили к содержимому S.S. контейнера и перемешали. Эту смесь нагревали при непрерывном перемешивании путем циркуляции горячей воды в рубашке, поддерживая температуру массы 50-55 С. Циклоспорин растворили в метаноле и добавили в вышеупомянутый расплав, продолжая перемешивание до получения гомогенной смеси. Затем приготовили водную фазу. Заранее определенное взвешенное количество полоксамера и метилпарабен натрия смешали с достаточно дистиллированной водой и добавили пропиленгликоль и смесь нагревали при непрерывном перемешивании, поддерживая температуру массы 50-55 С. Масляную фазу и водную фазу поддерживали при 60-65 С и объем водной фазы добавили в масляную фазу, поддерживая такую же температуру (60-65 С)- 12011244 при непрерывном перемешивании до получения желательного состава. Дерматофармакокинетическое исследование Дерматофармакокинетические (DPK) исследования по настоящему изобретению применяли для имитации клинических испытаний как средство документального обоснования биодоступности и эквивалентности лекарственных продуктов местного применения. Для терапевтической классификации антигрибковых лекарств участком воздействия является сам роговой слой (stratum corneum). Например, при грибковых инфекциях кожи грибки остаются в роговом слое и, поэтому, DPK измерение антигрибкового лекарства в роговом слое представляет прямое измерение лекарственной концентрации в участке воздействия. Нет более подходящего анализа биоэквивалентности, который может подходить для этого класса соединений, чем прямой анализ адресной ткани. Применяемый способ Ленточного отслаивания способен продемонстрировать различия в локализации в роговом слое (SC) по указанному изобретению при сравнении конкурентных продуктов. Их определяют путем нанесения различных композиций указанного изобретения на кожную поверхность в течение определенного времени экспозиции, адгезивные пленки помещают на обработанную кожу и снова отслаивают спустя определенное время аппликации, и анализируют локализованное количество в роговом слое с применением валидизированного аналитического способа измерения индекса локализации в роговом слое на единицу поверхности использованной площади. Дерматофармакокинетическое (DPK) исследование провели для определения сравнительной эффективности составов инновационного продукта тербинафина HCl местного применения (Lamisil, в данном описании упоминается как INV) и Panacea Biotec Ltd. (DDR-FRD-Fl, в данном описании упоминается как PBL). Композиция, описанная в примере 2, была зашифрована как DDR-FRD-Fl и применялась в указанном исследовании. Анализ концентраций композиций, применяемых для исследования, показал следующее: Lamisil содержал 0,099 мг тербинафина HCl на мг состава крема, и DDR-FRD-Fl (зашифрован для примера 2) содержал 0,090 мг тербинафина HCl на мг состава крема. Эксперимент с ленточным отслаиванием провели по следующему составленному руководству США FDA (Руководство для индустрии: дерматологический лекарственный продукт местного применения NDA и ANDA - in vitro биодоступность, биоэквивалентность, in vitro высвобождение и ассоциированные исследования). Обычная процедура тестирования в упомянутой работе состоит в следующем: сначала шерсть экспериментального животного (морская свинка) удаляли путем выщипывания (предпочтительно) и затем животных обрабатывали в комнате с кондиционером, поддерживающем 20 С, 60%RH. Эти условия поддерживали в течение всего экспериментального периода. Дорсальную сторону морских свинок (22,5 см 2) маркировали на левый и правый дорсальные участки. Контроль проводили одновременно с проверкой данных базовой линии. Примерно 65,0-125,0 мг составов (1% крем местного применения, то есть 100,0 мг составов, содержит 1 мг активного лекарства, тербинафина гидрохлорида) наносили на роговой слой 5 морских свинок (N=5, обозначенных как N1, N2, N3, N4 и N5) . Неокклюдированное защитное ограждение размещали для покрытия области аппликации (применяли неокклюдированную алюминиевую фольгу). Избыток состава удаляли через 15 мин с участка аппликации путем трехкратного осторожного вытирания ватным тампоном. Начальную и конечную массу ватного тампона измеряли для точной регистрации нанесенного количества на квадратный метр кожи. Через соответствующие временные интервалы образцы собирали после отслаивания ленты с использованием адгезивной ленты. Ленту Transpore (Модель 1527-1, площадь поверхности 2,5 см 3, 3M) применяли в качестве адгезивной ленты. Адгезивную ленту накладывали, применяя равномерное надавливание, и удаляли через разные интервалы времени, применяя постоянное усилие при снятии. Продолжительность исследования составляла 24 ч со следующими интервалами: 0,5; 1,0; 3,0; 6,0; 12,0 и 24,0 ч. Тупоконечный пинцет применяли для наложения отдельной адгезивной пленки с постоянным усилием каждый раз с помощью одного и того же исследователя. Как тестируемые, так и эталонные продукты накладывали на одну и ту же сторону для нейтрализации вариаций между субъектами. Процедуру повторяли для каждого участка в обозначенные временные точки. Лекарство экстрагировали из комбинированных восьми ленточных отслаиваний, и концентрацию определяли с помощью валидизированного аналитического способа. Первые две ленточные полоски удаляли и не включали для валидизации с помощью аналитического способа (для учета остаточного продукта инфицирования). Далее брали 8 ленточных полосок и объединяли для каждого интервала времени, и анализировали с использованием валидизированного способа оценки тербинафина гидрохлорида. Образцы отслоенных лент хранили в полипропиленовой пробирке на 10 мл с 7,0 мл 80:20 об./об. ацетонитрила и TEA (0,72 мМ) при рН 2,5 и подвергали перемешиванию в течение 16 ч. В случае задержки образцы хранили при -70 С до обработки. Супернатант пропускали через 0,45 мкм фильтр и определяли достоверность данных с помощью аналитического способа (HPLC). Результаты исследования выражали как концентрацию лекарства(нМ), рассчитанную для рогового слоя (SC) на см 2 обработанной поверхности (то есть рассчитывают на 100 нМ на см 2 наложенного крема). Результаты исследования представлены в табл. 1-3 и на фигуре, как упомянуто ниже. Табл. 1. Расчет лекарственной локализации авторского состава (PBL) в роговом слое.- 13011244 Табл. 2. Расчет лекарственной локализации инновационного состава (INV) в роговом слое. Табл. 3. Относительная эффективность авторского состава (PBL) по сравнению с инновационным составом (INV) на основе дерматофармакокинетических (DPK) исследований. Фигура. Относительный дерматофармакокинетический (DPK) профиль авторского состава (PBL) и инновационного состава (INV). Результаты дерматофармакокинетического изучения показали достоверное увеличение локализации тербинафина HCl на коже (роговой слой) и, следовательно, улучшенную эффективность композиции настоящего изобретения по сравнению с инновационным продуктом (Lamisil). Таблица 1. Расчет лекарственной локализации авторского состава (PBL) в роговом слое- 14011244 Таблица 2. Расчет лекарственной локализации инновационного состава (INV) в роговом слое- 15011244 Таблица 3. Относительная эффективность авторского состава (PLB) по сравнению с инновационным составом (INV) на основе дерматофармакокинетических (DPK) исследований- число животных (N=5, морские свинки), использованные в исследовании, обозначенные как N1,N2, N3, N4 и N5; 0,5; 1,0; 3,0; 6,0; 12,0 и 24,0 обозначают временные интервалы в часах. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Фармацевтическая композиция для топического введения, характеризующаяся усиленной локализацией активного ингредиента, причем указанная композиция содержит по меньшей мере один активный ингредиент, его соли, сложные эфиры, гидраты или производные; гелеобразующую систему, состоящую из смеси сурфактантов, растворяющую систему, содержащую по меньшей мере один масляный компонент; водную фазу, содержащую один или несколько стабилизирующих агентов и необязательно другие фармацевтически приемлемые эксципиенты, где смесь сурфактантов действует как гелеобразователи масляного компонента, присутствующего в растворяющей системе, формируя трехмерную сеть,которая иммобилизирует растворяющую систему, таким образом, что сурфактант, желатинизирующий масляную фазу, может распределять водную фазу без изменения липидного микроокружения и гелевой структуры композиции. 2. Фармацевтическая композиция по п.1, где активным ингредиентом является или гидрофобный,или амфифильный по своей природе агент. 3. Фармацевтическая композиция по п.1, где активный ингредиент выбран из группы, содержащей противогрибковые агенты, антибактериальные агенты, иммуномодуляторы, стероиды, анальгетики, противовоспалительные агенты, кератинизирующие агенты, противомикробные агенты, питающие кожу агенты или сенсибилизирующие агенты, антипсориатические и антиэкземные лекарственные средства,используемые индивидуально или в комбинации. 4. Фармацевтическая композиция по п.3, где активным ингредиентом является тербинафин, его соли, сложные эфиры, гидраты или производные. 5. Фармацевтическая композиция по п.3, где активным ингредиентом является иммуномодулятор,выбранный из такролимуса или циклоспорина, или его соли, сложные эфиры, гидраты или производные. 6. Фармацевтическая композиция по п.3, где активным ингредиентом является стероид, выбранный из тестостерона или гидрокортизона, или его соли, сложные эфиры, гидраты или производные. 7. Фармацевтическая композиция по пп.1-6, где гелеобразующая система, состоящая из смеси сурфактантов, содержит по меньшей мере два сурфактанта, где по меньшей мере один является гидрофильным сурфактантом, имеющим значение HLB, большее или равное примерно 10; и липофильный сурфактант имеет значение HLB меньше, чем примерно 10, причем указанный липофильный сурфактант присутствует в количестве, достаточном для достижения требуемого соотношения концентрации смеси сурфактантов, вызывающего желатинизирование одного или нескольких масляных компонентов, присутствующих в растворяющей системе.- 16011244 8. Фармацевтическая композиция по пп.1-7, где гелеобразующая система, состоящая из смеси сурфактантов, содержит по меньшей мере два сурфактанта, где оба сурфактанта являются неионными. 9. Фармацевтическая композиция по пп.1-8, где гелеобразующая система присутствует в количестве от примерно 5 до примерно 50 мас.% от общей массы композиции. 10. Фармацевтическая композиция по пп.1-9, где гидрофильный сурфактант выбран из группы, содержащей эфиры полиоксиэтилен сорбитана и жирной кислоты, натрия докузат, сукцинилированные моноглицериды, лаурил сульфаты, таурохолаты, каприлаты, капраты, олеаты, полоксамер или их смеси. 11. Фармацевтическая композиция по пп.1-9, где липофильный сурфактант выбран из группы, содержащей эфиры сорбитана и жирной кислоты, алкиловые эфиры полиоксиэтилена, эфиры жирной кислоты, глицериды полиоксиэтилена, трансэтерифицированные растительные масла, полиоксиэтилированные гидрированные растительные масла или их смеси. 12. Фармацевтическая композиция по пп.1-9, где гелеобразующая система, состоящая из смеси сурфактантов, содержит липофильный сурфактант, который представляет собой эфир сорбитана и жирной кислоты, выбранный из группы, включающей сорбитан монолаурат, сорбитан монопальмитат, сорбитан моноолеат и сорбитан моностеарат; и гидрофильный сурфактант, который представляет собой эфир полиоксиэтилен сорбитана и жирной кислоты, выбранный из группы, включающей полиоксиэтилен сорбитан монолаурат, полиоксиэтилен сорбитан монопальмитат, полиоксиэтилен сорбитан моноолеат и полиоксиэтилен сорбитан моностеарат. 13. Фармацевтическая композиция по пп.7-12, где отношение гидрофильного сурфактанта к липофильному сурфактанту составляет от примерно 1:20 до примерно 20:1. 14. Фармацевтическая композиция по п.1, где растворяющая система включает по меньшей мере один масляный компонент и один или несколько других компонентов, выбранных из группы, включающей метанол, этанол, изопропанол, триэтил цитрат, ацетил бутил цитрат или триацетин; или другие гидрофильные растворители, выбранные из группы, включающей этиленгликоль, пропиленгликоль, глицерин, полиэтиленгликоль и сложные эфиры полиэтиленгликоля. 15. Фармацевтическая композиция по п.14, где по меньшей мере один масляный компонент растворяющей системы выбран из группы, включающей природные масла, минеральное масло, моно-, ди- или триглицеридные эфиры масел, выбранные из группы, включающей среднецепочечные триглицериды,олеиновую кислоту, этил олеат, этил каприлат, этил бутират, изопропил миристат, соевое масло, каноловое масло или их моно- и диглицериды, алюминия моностеарат, алюминия дистеарат, алюминия тристеарат, микрокристаллический воск, нефтяной воск и смеси, используемые индивидуально или в комбинации. 16. Фармацевтическая композиция по пп.14 и 15, где по меньшей мере одним масляным компонентом растворяющей системы является среднецепочечный триглицерид. 17. Фармацевтическая композиция по п.1, где водная фаза содержит воду, алифатические или ароматические спирты, гликоли или их смеси. 18. Фармацевтическая композиция по п.1, где стабилизирующим агентом является природный, синтетический или полусинтетический полимер, который действует как структурообразователь и стабилизатор в топических составах, которые находятся в форме эмульсии, крема, лосьона или геля по своей консистенции и структуре, выбранный из группы, включающей хитозан, полоксамер, целлюлозные полимеры, камеди и альгинаты. 19. Фармацевтическая композиция по п.18, где стабилизирующим агентом является полоксамер. 20. Фармацевтическая композиция по пп.18 и 19, где стабилизатор добавляют или в масляную фазу,или в водную фазу, или добавляют в водный раствор до концентрации в диапазоне 0,1-20% от общей массы композиции. 21. Фармацевтическая композиция по п.1, где другие фармацевтически приемлемые эксципиенты выбраны из группы, включающей консерванты, рецептурные добавки, антиоксиданты, разбавители, регулирующие рН агенты, забуферивающие агенты, модификаторы тоничности, красители и т.п. или их смеси. 22. Способ получения фармацевтической композиции по п.1, который включает следующие стадии:iv) смешивание масляной и водной фазы при длительном перемешивании с получением желаемой композиции. 23. Способ лечения грибковых инфекций, включающий введение пациенту фармацевтически эффективного количества фармацевтической композиции по п.4.
МПК / Метки
МПК: A61K 47/14, A61K 9/00, A61K 47/10
Метки: доставки, композиции, местной, новые
Код ссылки
<a href="https://eas.patents.su/19-11244-novye-kompozicii-dlya-mestnojj-dostavki.html" rel="bookmark" title="База патентов Евразийского Союза">Новые композиции для местной доставки</a>
Предыдущий патент: Композиция, обладающая ноотропными свойствами, и способ ее получения
Следующий патент: Амиды карбоновых кислот в качестве ингибиторов фактора ха
Случайный патент: Фармацевтические композиции, содержащие ингибиторы агрегации тромбоцитов