Стабильная кристаллическая форма бифепрунокс мезилата монометансульфоната (7-[4-( [ 1,1`-бифенил]-3-илметил)-1- пиперазинил]-2 (3н)-бензоксазолона)
Номер патента: 8182
Опубликовано: 27.04.2007
Авторы: Эйгендаль Ирене, Клейн Геррит, Звир Клас, Тер Хорст-Ван Амстел Мария Й.Л.
Формула / Реферат
1. Кристаллический полиморф монометансульфоната 7-[4-([1,1'-бифенил]-3-илметил)-1-пиперазинил]-2(3Н)-бензоксазолона, имеющий порошковую рентгенограмму с характеристическими пиками, выраженными в градусах 2q, при приблизительно 7,0, 9,3, 10,0, 12,5, 15,4, 16,7, 17,2, 17,4, 17,7, 18,7, 21,3, 22,2, 25,2, 27,2, 28,3, 28,8 и 30,1.
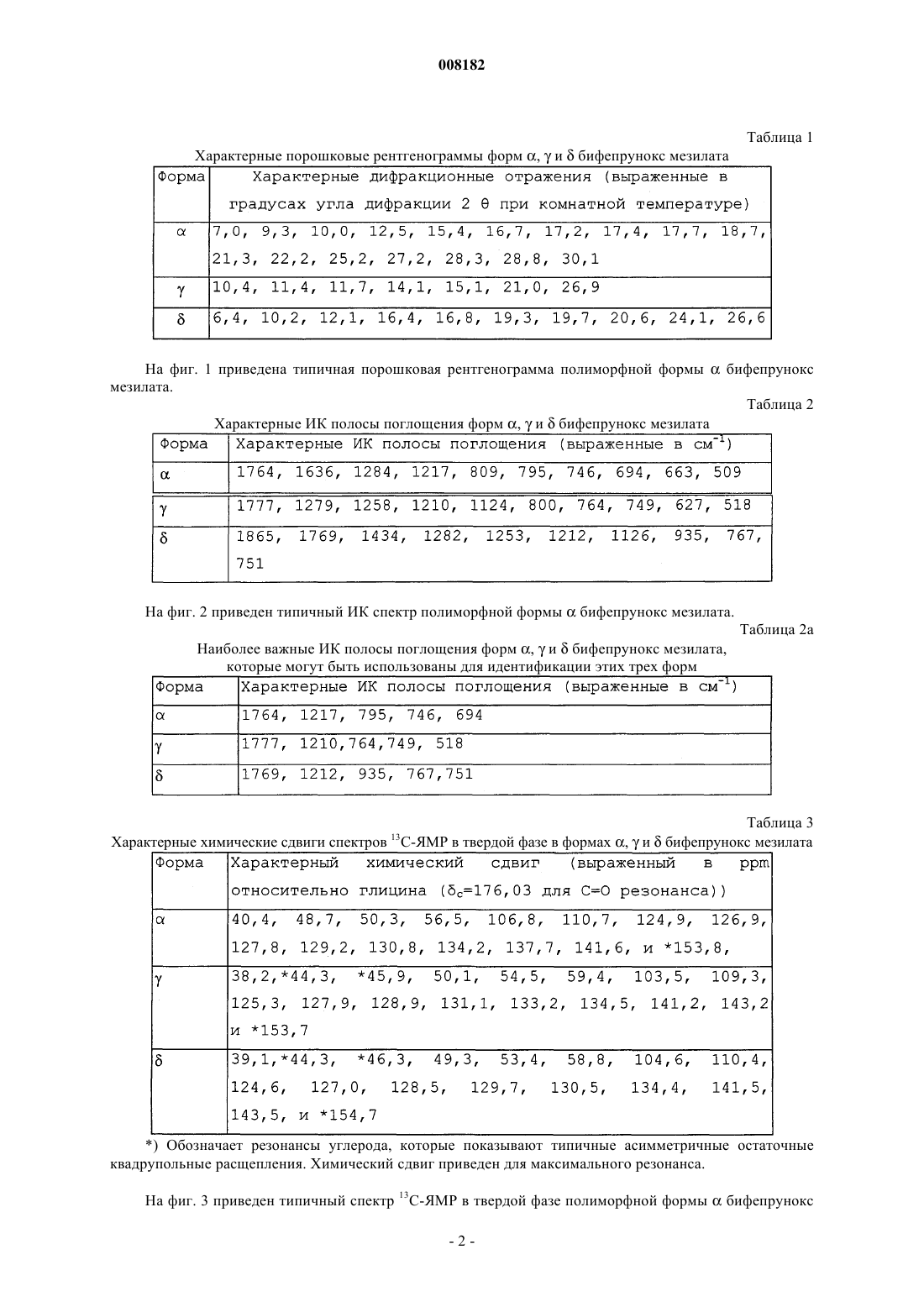
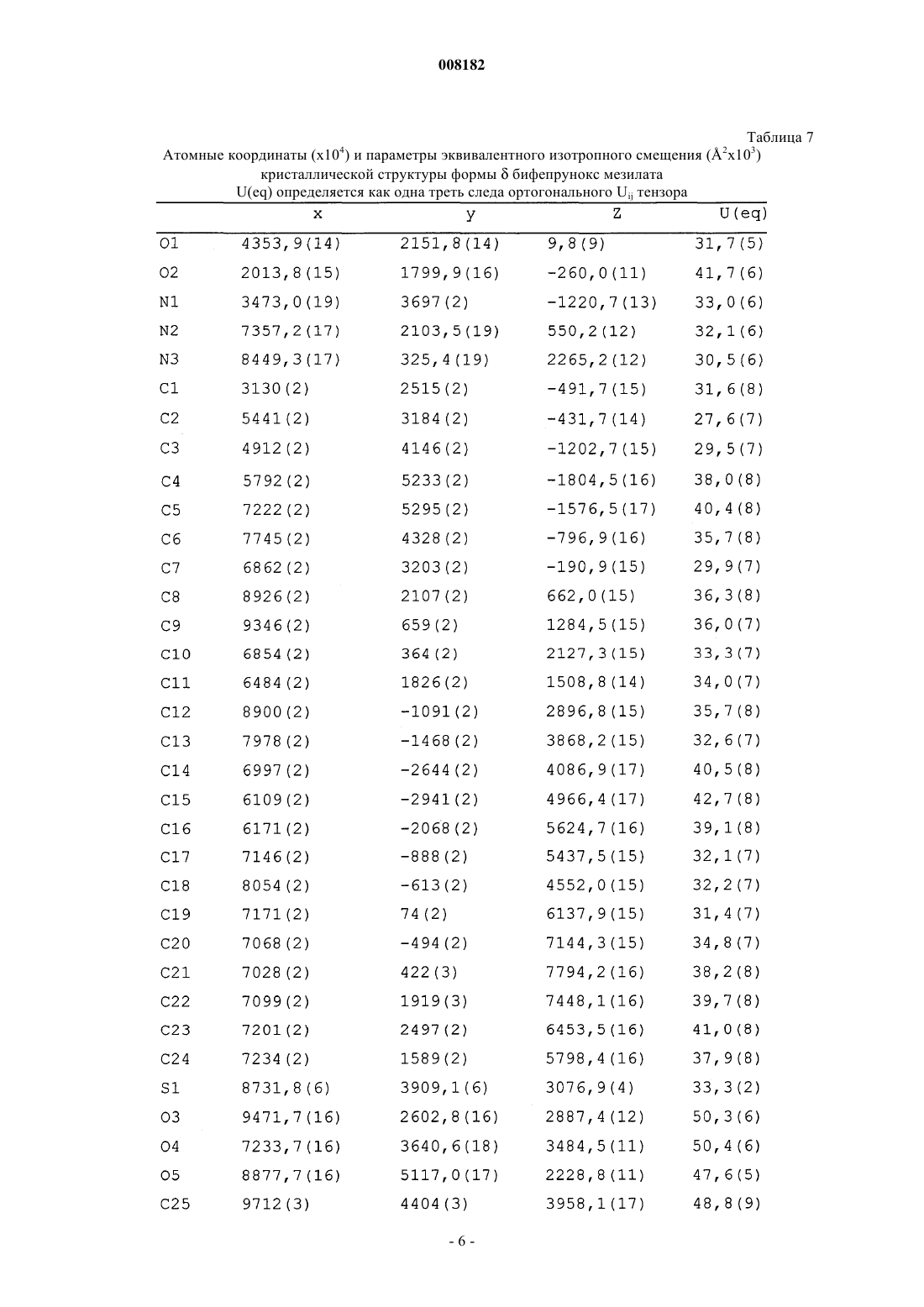
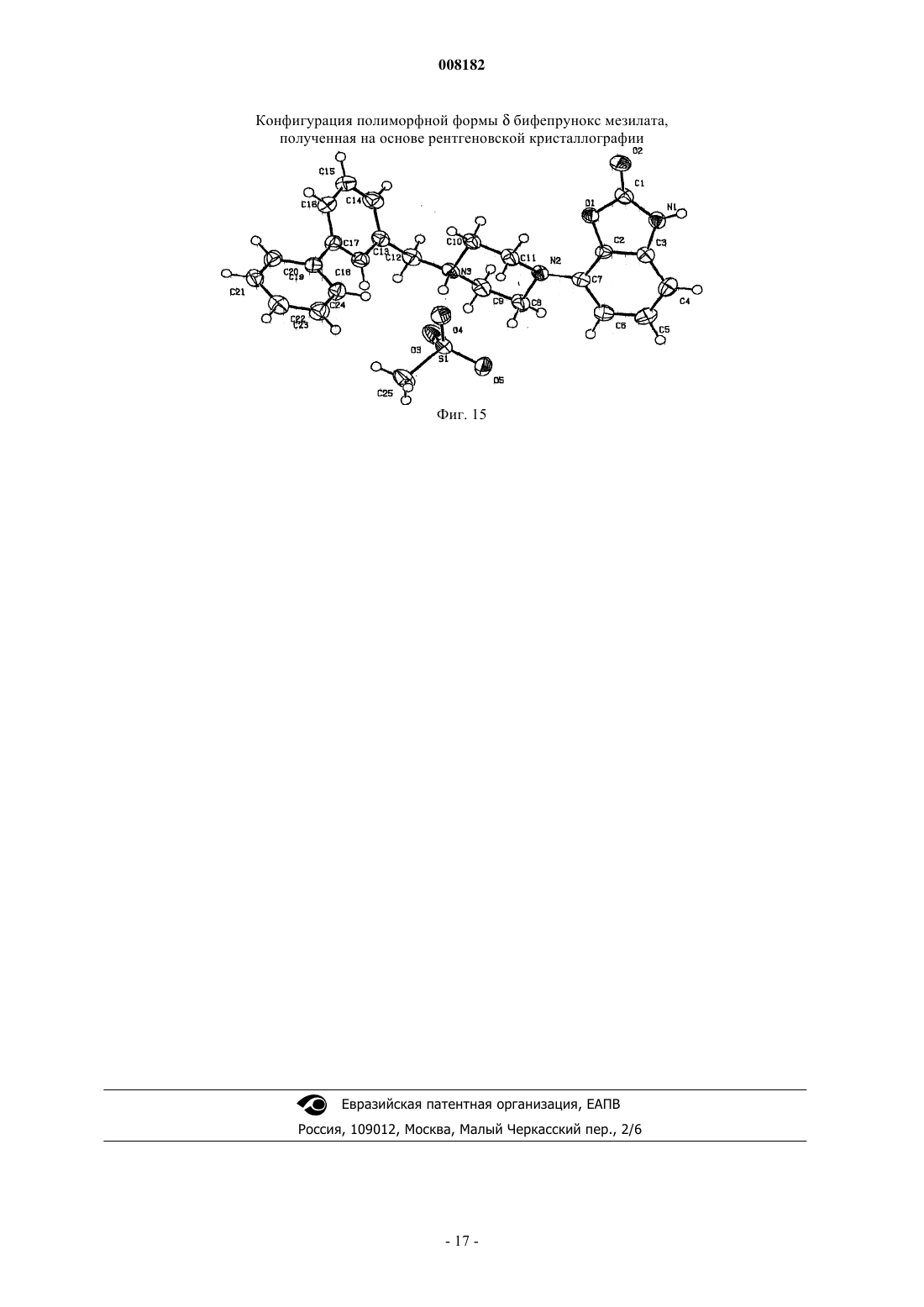
2. Кристаллический полиморф монометансульфоната 7-[4-([1,1'-бифенил]-3-илметил)-1-пиперазинил]-2(3Н)-бензоксазолона, характеризующийся порошковой рентгенограммой (=РПД), как показано на фиг. 1.
3. Кристаллический полиморф монометансульфоната 7-[4-([1,1'-бифенил]-3-илметил)-1-пиперазинил]-2(3Н)-бензоксазолона, имеющий температуру плавления около 277шС.
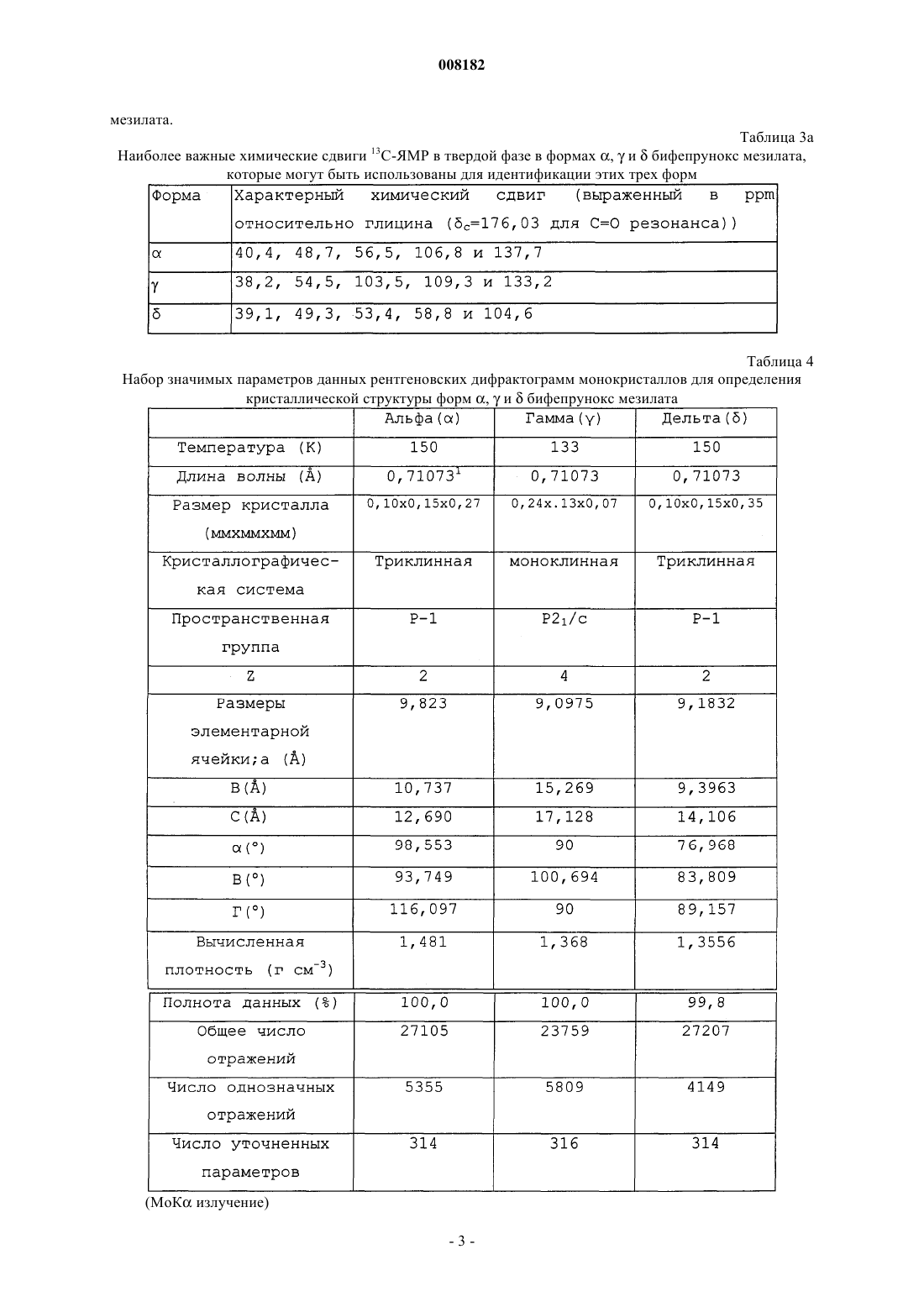
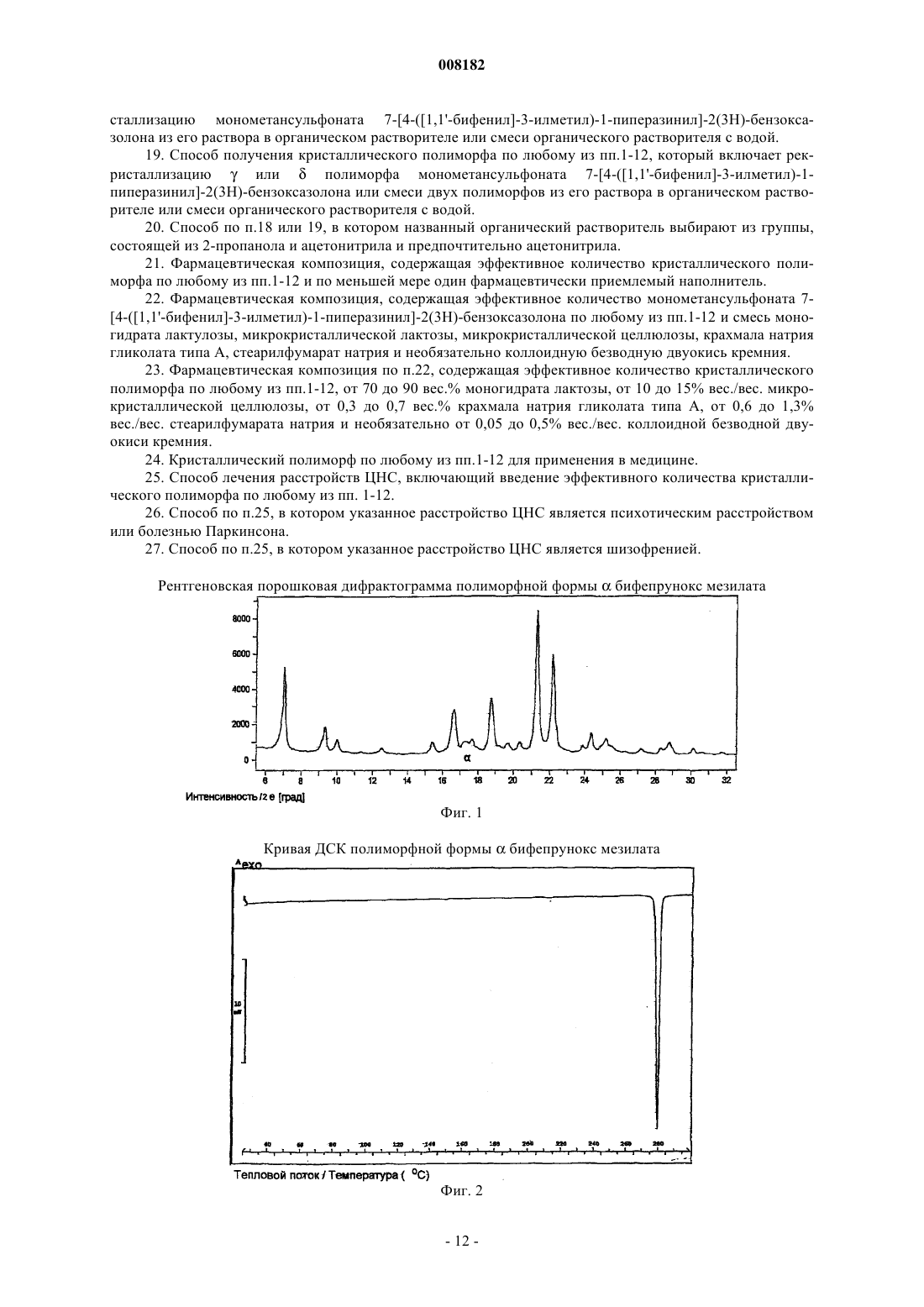
4. Кристаллический полиморф монометансульфоната 7-[4-([1,1'-бифенил]-3-илметил)-1-пиперазинил]-2(3Н)-бензоксазолона, характеризующийся полной кривой ДСК, как показано на фиг. 2.
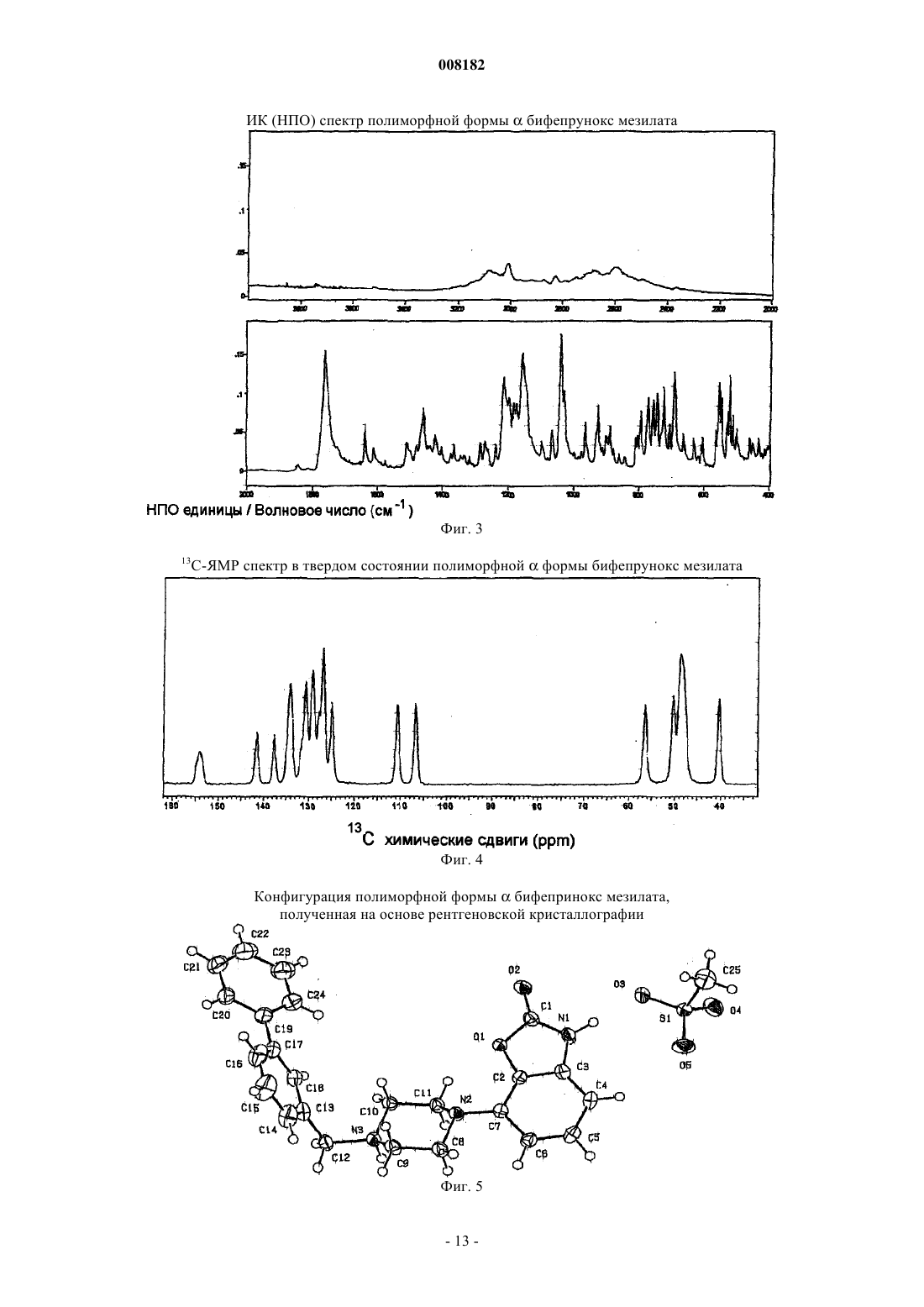
5. Кристаллический полиморф монометансульфоната 7-[4-([1,1'-бифенил]-3-илметил)-1-пиперазинил]-2(3Н)-бензоксазолона, имеющий инфракрасный спектр с ослабленной общей отражательной способностью, имеющий характерные полосы поглощения, выраженные в обратных сантиметрах, приблизительно при 1764, 1217, 795, 746 и 694.
6. Кристаллический полиморф монометансульфоната 7-[4-([1,1'-бифенил]-3-илметил)-1-пиперазинил]-2(3Н)-бензоксазолона по п.5, имеющий инфракрасный спектр с ослабленной общей отражательной способностью, имеющий характерные полосы поглощения, выраженные в обратных сантиметрах, приблизительно при 1754, 1636, 1284, 1217, 809, 795, 746, 694, 663 и 509.
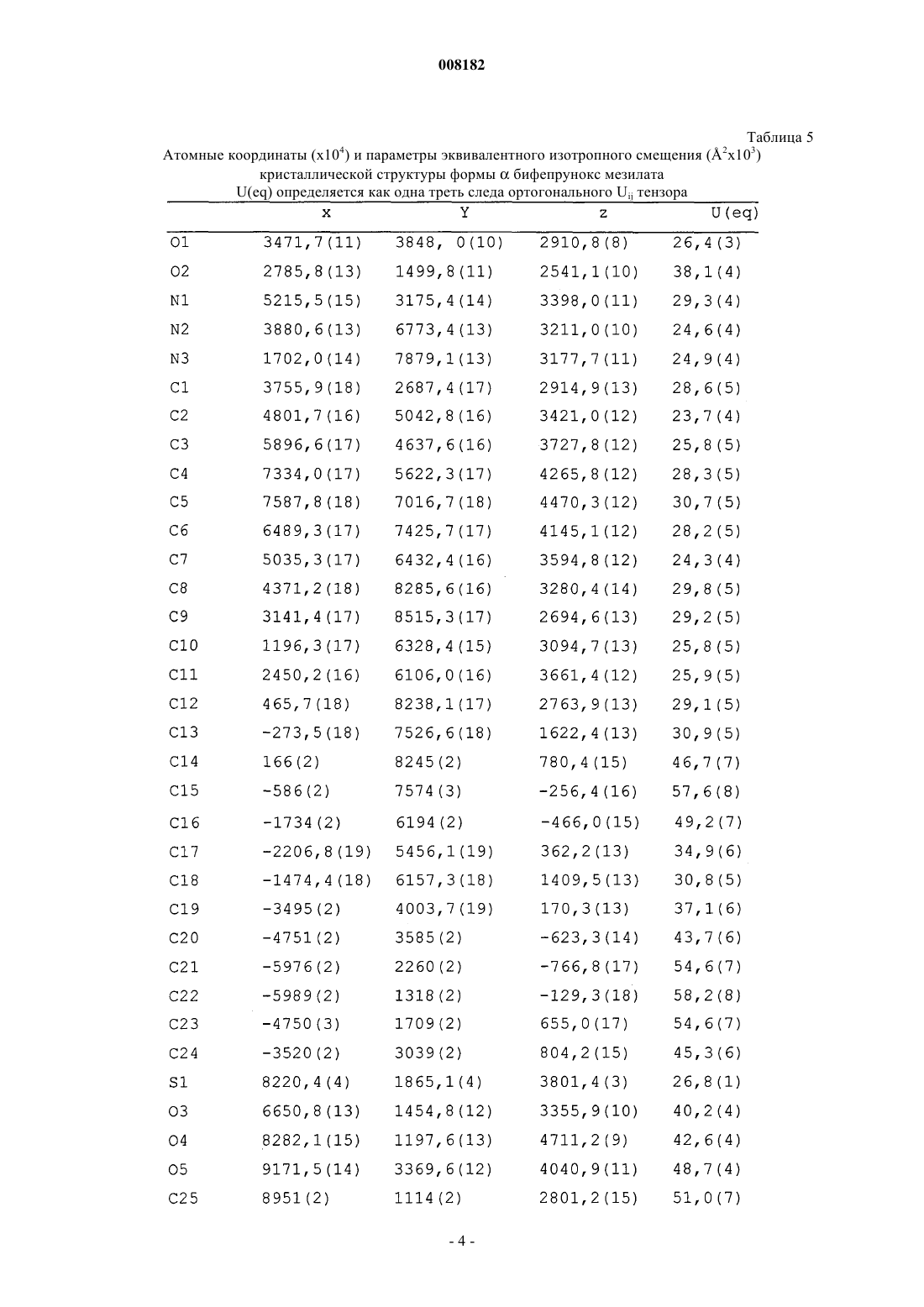
7. Кристаллический полиморф монометансульфоната 7-[4-([1,1'-бифенил]-3-илметил)-1-пиперазинил]-2(3Н)-бензоксазолона, характеризующийся полным ИК спектром, как показано на фиг. 3.
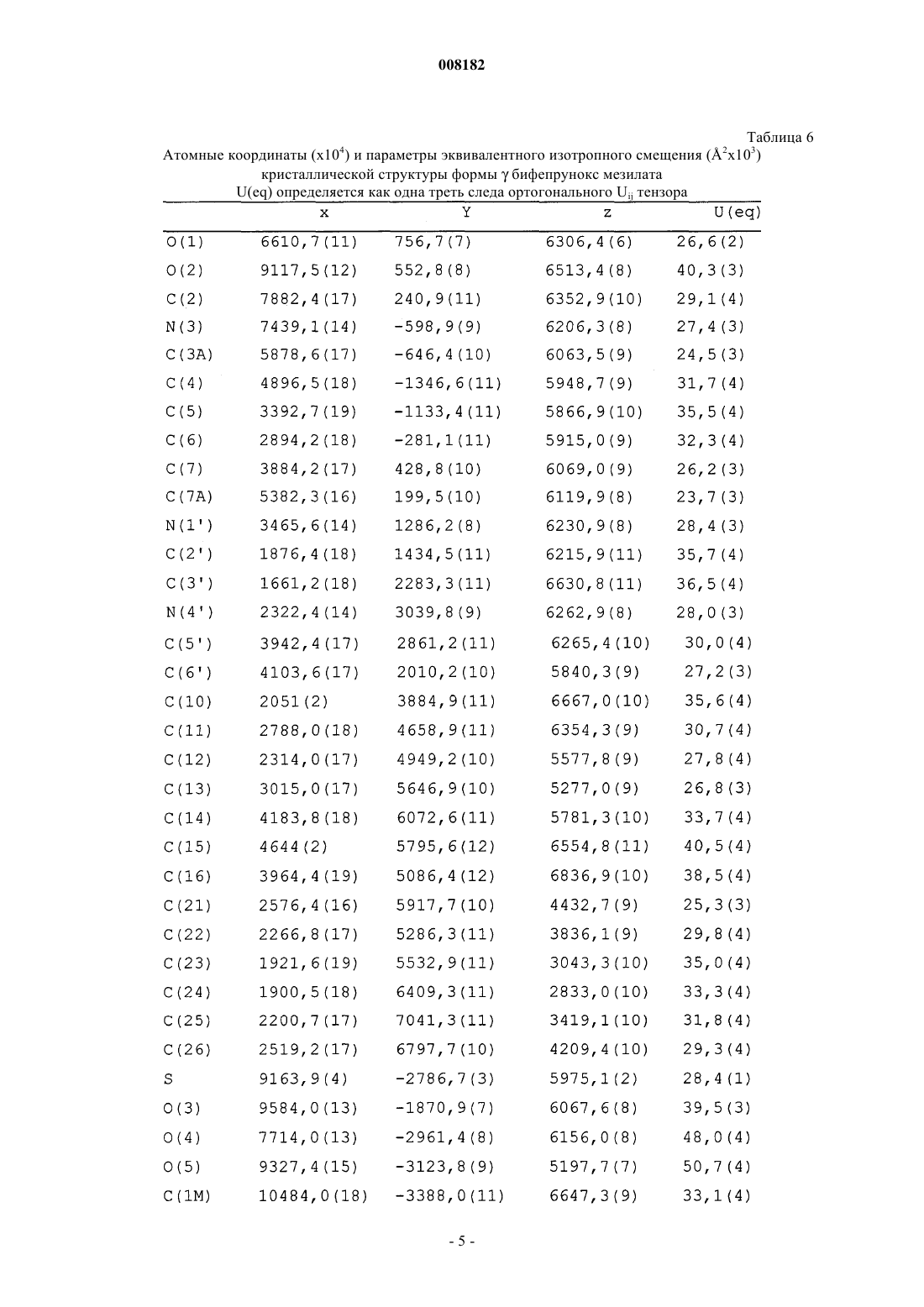
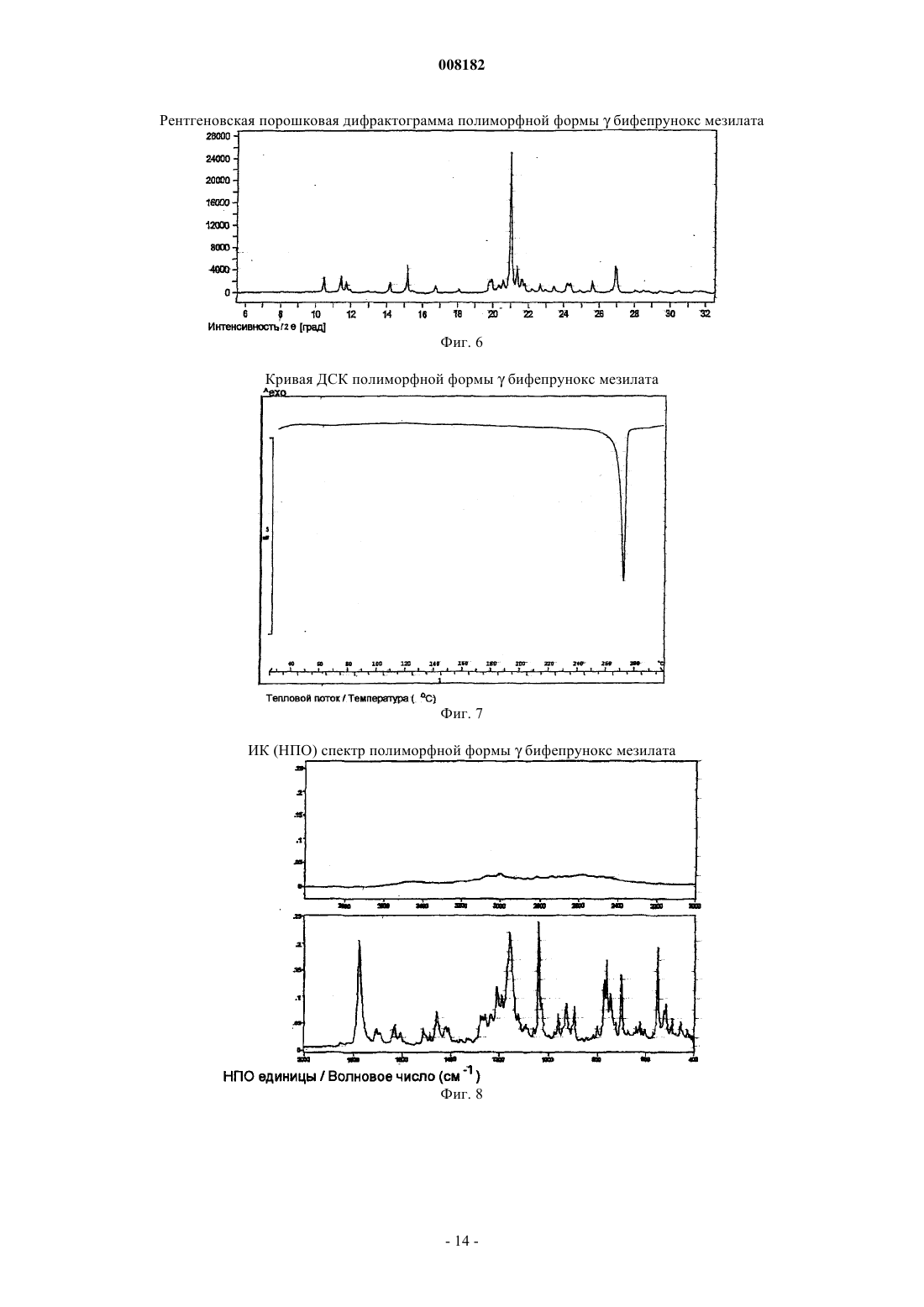
8. Кристаллический полиморф монометансульфоната 7-[4-([1,1'-бифенил]-3-илметил)-1-пиперазинил]-2(3Н)-бензоксазолона по п.5, имеющий химические сдвиги 13С ЯМР в твердом состоянии, выраженные относительно глицина (dс=176,03 для С=O резонанса) приблизительно при 40,4, 48,7, 56,5, 106,8 и 137,7 м.д.
9. Кристаллический полиморф монометансульфоната 7-[4-([1,1'-бифенил]-3-илметил)-1-пиперазинил]-2(3Н)-бензоксазолона по п.8, имеющий химический сдвиг 13С ЯМР в твердом состоянии относительно глицина (dc=176,03 для С=O резонанса) приблизительно при 40,4, 48,7, 50,3, 56,5, 106,8, 110,7, 124,9, 126,9, 127,8, 129,2, 130,8, 134,2, 137,7, 141,6 и 153,8 м.д.
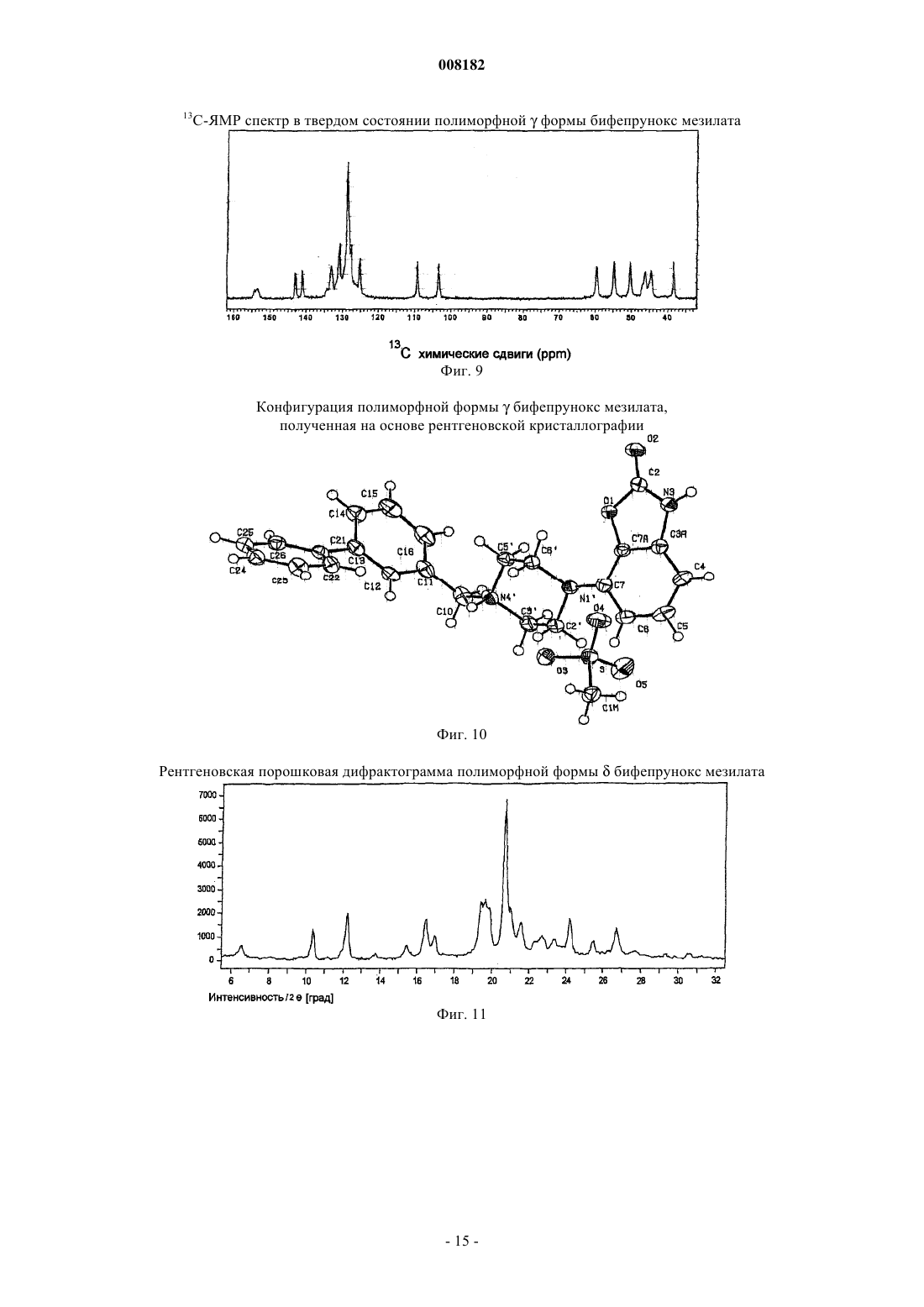
10. Кристаллический полиморф монометансульфоната 7-[4-([1,1'-бифенил]-3-илметил)-1-пиперазинил]-2(3Н)-бензоксазолона, характеризующийся развернутым спектром 13С ЯМР в твердом состоянии, как показано на фиг. 4.
11. Кристаллический полиморф монометансульфоната 7-[4-([1,1'-бифенил]-3-илметил)-1-пиперазинил]-2(3Н)-бензоксазолона, имеющий при рентгено-структурном анализе монокристалла при 150К
(а) следующие кристаллические параметры:
| Параметры ячейки | а=9,283 Е |
| b=10,737 Е | |
| с=12,690 Е | |
| a=98,553ш | |
| b=93,749ш | |
| g=116,097ш | |
| Кристаллическая система | Триклинная |
| Пространственная группа | Р-1 |
| Молекулы/единичная ячейка | 2 |
| Плотность, г/см3 | 1,481 |
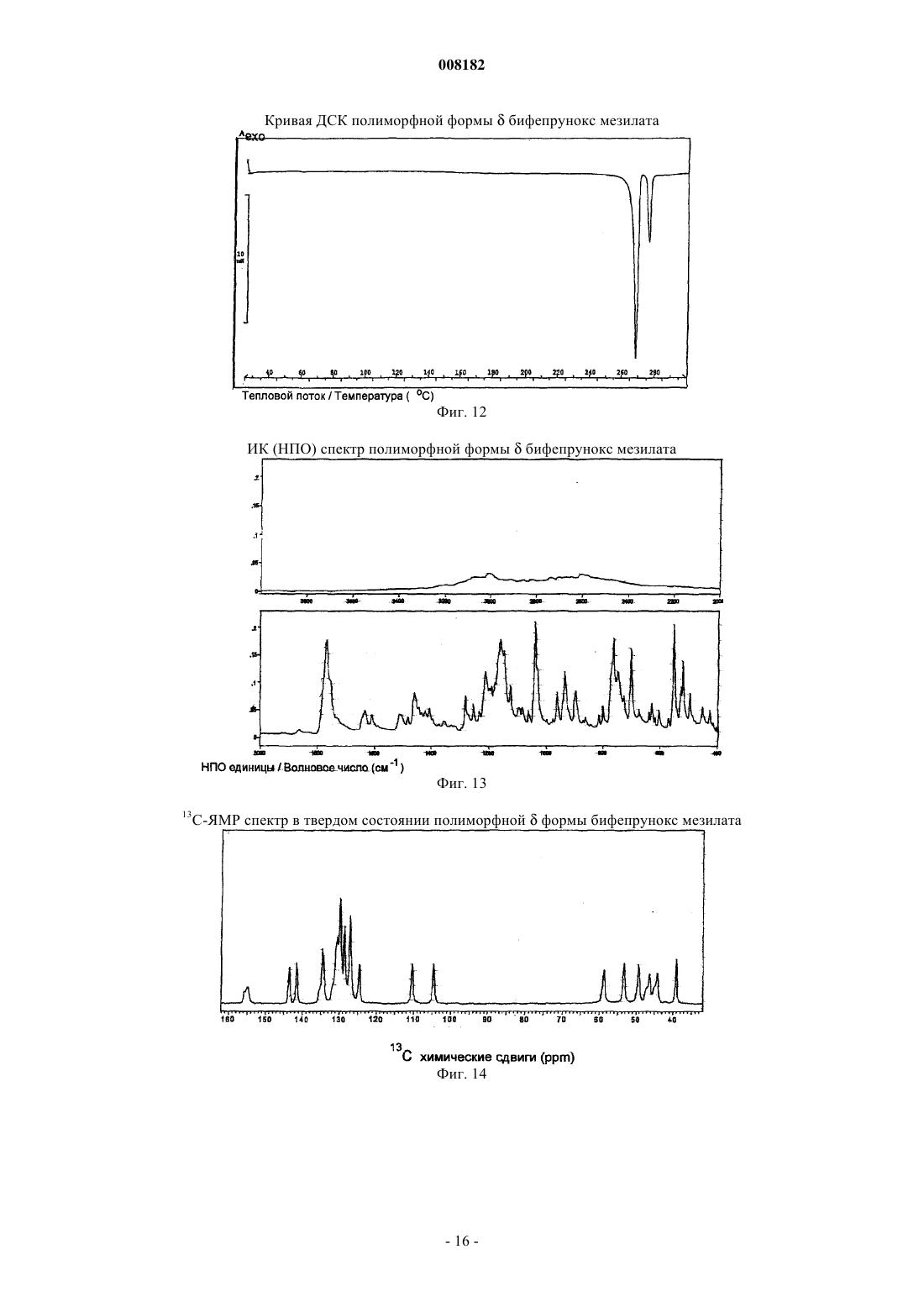
и (b) атомные позиции всех атомов относительно начала координат единичной ячейки, как перечислено в табл. 5.
12. Кристаллический полиморф монометансульфоната 7-[4-([1,1'-бифенил]-3-илметил)-1-пиперазинил]-2(3Н)-бензоксазолона, характеризующийся рентгеновской дифракцией, как показано на фиг. 5.
13. Монометансульфонат 7-[4-([1,1'-бифенил]-3-илметил)-1-пиперазинил]-2(3Н)-бензоксазолона, в котором по меньшей мере около 50 мас.% соединения находится в кристаллической полиморфной форме по любому из пп.1-12.
14. Монометансульфонат по п.13, характеризующаяся тем, что по меньшей мере около 60 мас.% соединения находится в кристаллической полиморфной форме по любому из пп. 1-8.
15. Монометансульфонат по п.14, характеризующаяся тем, что по меньшей мере около 80 мас.% соединения находится в кристаллической полиморфной форме по любому из пп. 1-8.
16. Монометансульфонат по п.15, характеризующаяся тем, что по меньшей мере около 90 мас.% соединения находится в кристаллической полиморфной форме по любому из пп. 1-8.
17. Монометансульфонат по п.16, характеризующаяся тем, что по меньшей мере 95 мас.% соединения находится в кристаллической полиморфной форме по любому из пп. 1-8.
18. Способ получения кристаллического полиморфа по любому из пп.1-12, который включает кристаллизацию монометансульфоната 7-[4-([1,1'-бифенил]-3-илметил)-1-пиперазинил]-2(3Н)-бензокса-золона из его раствора в органическом растворителе или смеси органического растворителя с водой.
19. Способ получения кристаллического полиморфа по любому из пп.1-12, который включает рекристаллизацию g или d полиморфа монометансульфоната 7-[4-([1,1'-бифенил]-3-илметил)-1-пиперазинил]-2(3Н)-бензоксазолона или смеси двух полиморфов из его раствора в органическом растворителе или смеси органического растворителя с водой.
20. Способ по п.18 или 19, в котором названный органический растворитель выбирают из группы, состоящей из 2-пропанола и ацетонитрила и предпочтительно ацетонитрила.
21. Фармацевтическая композиция, содержащая эффективное количество кристаллического полиморфа по любому из пп.1-12 и по меньшей мере один фармацевтически приемлемый наполнитель.
22. Фармацевтическая композиция, содержащая эффективное количество монометансульфоната 7-[4-([1,1'-бифенил]-3-илметил)-1-пиперазинил]-2(3Н)-бензоксазолона по любому из пп.1-12 и смесь моногидрата лактулозы, микрокристаллической лактозы, микрокристаллической целлюлозы, крахмала натрия гликолата типa А, стеарилфумарат натрия и необязательно коллоидную безводную двуокись кремния.
23. Фармацевтическая композиция по п.22, содержащая эффективное количество кристаллического полиморфа по любому из пп.1-12, от 70 до 90 вес.% моногидрата лактозы, от 10 до 15% вес./вес. микрокристаллической целлюлозы, от 0,3 до 0,7 вес.% крахмала натрия гликолата типа А, от 0,6 до 1,3% вес./вес. стеарилфумарата натрия и необязательно от 0,05 до 0,5% вес./вес. коллоидной безводной двуокиси кремния.
24. Кристаллический полиморф по любому из пп.1-12 для применения в медицине.
25. Способ лечения расстройств ЦНС, включающий введение эффективного количества кристаллического полиморфа по любому из пп. 1-12.
26. Способ по п.25, в котором указанное расстройство ЦНС является психотическим расстройством или болезнью Паркинсона.
27. Способ по п.25, в котором указанное расстройство ЦНС является шизофренией.
Текст
008182 Настоящее изобретение относится к стабильной полиморфной форме соединения монометансульфонату 7-[4-([1,1'-бифенил]-3-илметил)-1-пиперазинил]-2(3 Н)-бензоксазолона, способу получения названной полиморфной формы и ее применению в фармацевтических продуктах, особенно в фармацевтических продуктах для лечения психотических расстройств и болезни Паркинсона. Мезилат соединения монометансульфоната 7-[4-([1,1'-бифенил]-3-илметил)-1-пиперазинил]-2(3 Н)бензоксазолон (INNM бифепрунокс мезилат) имеет формулу Солянокислая соль соединения монометансульфонат (7-[4-([1,1'-бифенил]-3-илметил)-1-пиперазинил]-2(3 Н)-бензоксазолона (бифепрунокс) описана и заявлена в патентной заявке WO 97/36893, а монометансульфонатная соль описана и заявлена в патентной заявке WO 02/066449. Во второй патентной публикации раскрыто непосредственное получение монометансульфонатной соли реакцией между химически активным сложным эфиром и мезилата N,N,N-биc(2-этанол)-м-фенилбензиламина и 7-амино 2(3 Н)-бензоксазолоном. Изобретатели обнаружили, что с помощью способа, описанного в патентной заявке WO 02/066449,бифепрунокс мезилат получают обычно в виде неочищенного продукта (указанный в заявке WO 02/7066449 интервал температур плавления 263-275C) в полиморфной форме, которую далее в этой заявке обозначали как полиморф(дельта). Далее после очистки получали продукт в двух различных кристаллических модификациях или смесь этих двух модификаций. Первой из названных двух модификаций является уже упомянутый полиморф(дельта), температура плавления которого в чистом виде составляет 265 С. Вторая модификация далее обозначается как полиморф(гамма). Когда получается, в основном,полиморф, почти во всех случаях получается смесь названного полиморфас полиморфом, при этом эта смесь имеет температуру плавления около 273 С. В процессе дальнейших исследований оказалось, что полиморфыиявляются метастабильными и поэтому могут обладать серьезными недостатками при использовании в фармацевтическом составе. Непредсказуемое образование одного из двух полиморфовиили их смеси также нежелательно. Поэтому целью настоящего изобретения является разработка стабильной кристаллической формы монометансульфоната 7-[4-([1,1'-бифенил]-3-илметил)-1-пиперазинил]-2(3 Н)-бензоксазолона для фармацевтического применения, которую можно получать воспроизводимым способом. Неожиданно было обнаружено, что монометансульфонат 7-[4-([1,1'-бифенил]-3-илметил)-1 пиперазинил]-2(3 Н)-бензоксазолона имеет также и другую кристаллическую полиморфную форму (называемую ниже как полиморф(альфа, которая не имеет недостатков ранее упомянутых полиморфов. Эта кристаллическая форма бифепрунокс мезилата более термодинамически стабильна. С полиморфной формойне происходит превращений даже при высокой атмосферной влажности или более высокой температуре. Кроме того, эта кристаллическая форма кристаллизуется в виде крупных кристаллов, которые легко отфильтровываются и имеют высокую чистоту. Поэтому полиморфособенно подходит для твердой лекарственной формы бифепрунокс мезилата, при желании после уменьшения размера частиц. Кристаллическая полиморфная форма бифепрунокс мезилата согласно настоящему изобретению определяется следующими физико-химическими параметрами рентгеновских дифрактограмм (табл. 1 и фиг. 1). Температура плавления полиморфной формы равняется 277 С (скорость нагревания ДСК 10 К/мин)(см. ДСК термограмму, фиг. 2). ИК спектры (табл. 2 и фиг. 3). Наиболее важные полосы ИК поглощения формыбифепрунокс мезилата, которые могут быть использованы для отличия этой формы от форми , приведены в табл. 2 а. Спектры 13 С-ЯМР в твердой фазе (табл. 3 и фиг. 4). Самые важные 13 С-ЯМР сдвиги для формыбифепрунокс мезилата, которые могут быть использованы для отличия этой формы от форми , приведены в табл. 3 а. Рентгеноструктурный анализ монокристалла (табл. 4 и 5 и фиг. 5). Подразумевается, что все приведенные данные были аппроксимированы и для них определялись нормальные ошибки, зависящие, например, от используемого прибора и других параметров, влияющих на положения пика и его интенсивность. Таблица 1 Характерные порошковые рентгенограммы форм ,ибифепрунокс мезилата На фиг. 1 приведена типичная порошковая рентгенограмма полиморфной формыбифепрунокс мезилата. Таблица 2 Характерные ИК полосы поглощения форм ,ибифепрунокс мезилата На фиг. 2 приведен типичный ИК спектр полиморфной формыбифепрунокс мезилата. Наиболее важные ИК полосы поглощения форм ,ибифепрунокс мезилата,которые могут быть использованы для идентификации этих трех форм Таблица 3 Характерные химические сдвиги спектров 13 С-ЯМР в твердой фазе в формах ,ибифепрунокс мезилата) Обозначает резонансы углерода, которые показывают типичные асимметричные остаточные квадрупольные расщепления. Химический сдвиг приведен для максимального резонанса. На фиг. 3 приведен типичный спектр 13 С-ЯМР в твердой фазе полиморфной формыбифепрунокс-2 008182 мезилата. Таблица 3 а Наиболее важные химические сдвиги 13 С-ЯМР в твердой фазе в формах ,ибифепрунокс мезилата,которые могут быть использованы для идентификации этих трех форм Таблица 4 Набор значимых параметров данных рентгеновских дифрактограмм монокристаллов для определения кристаллической структуры форм ,ибифепрунокс мезилата Таблица 5 Атомные координаты (х 104) и параметры эквивалентного изотропного смещения (2 х 103) кристаллической структуры формыбифепрунокс мезилатаU(eq) определяется как одна треть следа ортогонального Uij тензора Таблица 6 Атомные координаты (х 104) и параметры эквивалентного изотропного смещения (2 х 103) кристаллической структуры формыбифепрунокс мезилатаU(eq) определяется как одна треть следа ортогонального Uij тензора Таблица 7 Атомные координаты (х 104) и параметры эквивалентного изотропного смещения (2 х 103) кристаллической структуры формыбифепрунокс мезилатаU(eq) определяется как одна треть следа ортогонального Uij тензора-6 008182 Полиморфная формасущественно отличается от формисвоими физико-химическими параметрами: ДСК поведением при плавлении, рентгеновской дифрактограммой, ИК спектром и спектром 13 С-ЯМР в твердой фазе. Физико-химические параметры формиприведены в табл. 1-4, 6 и 7 и фиг. 6-15. Настоящее изобретение также относится к бифепрунокс мезилату, в котором по меньшей мере около 50 мас.% бифепрунокс мезилата, предпочтительно по меньшей мере около 60 мас.%, более предпочтительно по меньшей мере около 80 мас.%, более выгодно по меньшей мере около 90 мас.% и еще более предпочтительно по меньшей мере около 95 мас.% бифепрунокс мезилата находится в полиморфной форме и,в основном, не включает любую из егоилиполиморфных форм. Выражение "в основном, не включает" означает количество меньше чем 10%, предпочтительно меньше чем 5 мас.%. Еще более предпочтительно, чтобы по меньшей мере около 99 мас.% бифепрунокс мезилата находилось в полиморфнойформе. Получение полиморфной формысогласно изобретению осуществляют рекристаллизацией из органического растворителя или смеси органического растворителя с водой, предпочтительно смеси (C1-С 6) спирта и воды или смеси ацетонитрила и воды. Более предпочтительной является смесь 2-пропанола и воды или смесь ацетонитрила и воды. Наиболее предпочтительной является смесь ацетонитрила и воды. Полиморфная формаможет быть приготовлена в результате получения свободного основания бифепрунокса с последующим непосредственным добавлением метансульфоновой кислоты и кристаллизацией из метилэтилкетона. Полиморфная формаисогласно изобретению может быть введена в форме разовых доз, в которых кристаллическое действующее вещество присутствует в твердой форме, известными в технике способами. Примерами названных форм разовой дозы являются (необязательно с покрытием) таблетки, капсулы, гранулированные аэрозоли, суппозитории и суспензии, которые могут быть приготовлены смешением полиморфной формыидействующего вещества с инертными, приемлемыми с фармацевтической точки зрения наполнителями и носителями. Наиболее предпочтительными формами разовой дозы являются таблетки и капсулы. В предпочтительном составе полиморфных формисогласно изобретению композиция содержит, не считая измельченного и просеянного действующего вещества, моногидрат лактозы, микрокристаллическую целлюлозу, крахмала натрия гликолат типа А, стеарилфумарат натрия и необязательно коллоидную безводную двуокись кремния. Количество лактозы составляет от 20 до 90% от суммарного веса ядра таблетки, предпочтительно от 70 до 90 мас.% и наиболее предпочтительно от 75 до 85 мас.%. Количество микрокристаллической целлюлозы составляет от 5 до 90% от суммарного веса ядра таблетки, предпочтительно от 10 до 15 мас.% и наиболее предпочтительно от 11 до 12 мас.%. Количество крахмала натрия гликолата типа А составляет от 0,1 до 2,5% от суммарного веса ядра таблетки, предпочтительно от 0,3 до 0,7% и наиболее предпочтительно около 0,5 мас.%. Количество стеарилфумарата натрия составляет от 0,1 до 1,5% от суммарного веса ядра таблетки, предпочтительно от 0,6 до 1,3% и наиболее предпочтительно около 1,0 мас.%. Коллоидную безводную двуокись кремния необязательно добавляют в состав для улучшения реологических свойств порошка. При добавлении двуокиси кремния предпочтительно вводить ее в количестве от 0,05 до 0,5% от суммарного веса ядра таблетки, предпочтительно около 0,4 мас.%. Количество покрытия составляет от 2,0 до 5,0% от суммарного веса ядра таблетки, предпочтительно от 3,0 до 4,2% и наиболее предпочтительно около 3,5 мас.%. С точки зрения еще одной особенности, изобретение относится к способу получения вышеописанного состава, в котором действующее вещество, имеющее полиморфную формуи , согласно изобретению измельчают и затем смешивают при помощи соответствующего смесителя (например, орбитальный шнековый смеситель (смеситель Наута) или комбинация диффузионного смесителя (бункерного смесителя) с мельницей с вращающейся импеллерной мешалкой (quadra co-mill с моногидратом лактозы, микрокристаллической целлюлозой, крахмала натрия гликолатом типа А, стеарилфумаратом натрия и необязательно с коллоидной безводной двуокисью кремния, и прессуют в таблетки с желаемой дозой. При таблетировании давление составляет от 200 до 400 МПа, предпочтительно от 250 до 350 и наиболее предпочтительно около 300 МПа. На продукт наносят окрашенное и имеющее вкус покрытие путем напыления суспензии покрытия на ядро таблетки в соответствующем оборудовании для нанесения покрытий (например, в котле с перфорацией для нанесения покрытий или установке для напыления в псевдоожиженном слое). Полиморфная формаисогласно изобретению может быть использована путем введения в живой организм. Бифепрунокс мезилат особенно полезен для лечения людей, страдающих психотическими расстройствами или болезнью Паркинсона. Следующие примеры предназначены только для дальнейшей более детальной иллюстрации изобретения, и поэтому предполагается, что эти примеры ни в коей мере не ограничивают объем изобретения. Пример 1. Получение бифепрунокс мезилата. Пример 1 а. Получение N-(5-хлор-2-гидроксифенил)ацетамида. 143,6 г (1 моль) 2-амино-4-хлорфенола суспендировали в 550 мл метилтретбутилового эфира в условиях умеренной продувки азотом. Смесь нагревали с обратным холодильником до тех пор, пока материал не растворялся. Через 40 мин добавляли 112,3 г уксусного ангидрида. После добавления смесь через 1 ч охлаждали до 20-25 С. После перемешивания в течение дополнительного часа смесь охлаждали до 05 С при перемешивании и выдерживали при этой температуре в течение дополнительного часа. Продукт отфильтровывали, дважды промывали 200 мл метилтретбутилового эфира и сушили при 50 С и 100 мбар-7 008182 в небольшом токе азота до сухого состояния. Выход составлял 92%. Пример 1b. Получение N-(5-хлор-2-гидрокси-3-нитрофенил)ацетамида. 224,5 г серной кислоты (50 вес.%) растворяли в 300 мл воды и охлаждали до 25 С при перемешивании в условиях умеренной продувки азотом. 185,1 г (1 моль) N-(5-хлор-2-гидроксифенил)ацетамида, полученного согласно примеру 1 а, добавляли к разбавленной серной кислоте и интенсивно перемешивали. 4 мл азотной кислоты 65 мас.% добавляли к пене, образовавшейся на поверхности реакционной смеси,при низкой скорости перемешивания. Скорость перемешивания повышали и 75 мл 65 мас.% азотной кислоты добавляли через 45 мин, поддерживая температуру от 23 до 26 С. Смесь интенсивно перемешивали в течение дополнительного 1 ч при 23-26 С. Затем смесь охлаждали до 0-5 С и интенсивно перемешивали при этой температуре в течение 1 ч. Твердое вещество быстро отфильтровывали, промывали 3 раза 300 мл холодной воды, отсасывали на фильтре по меньшей мере 30 мин и сушили при 50 С и 100 мбар в небольшом токе азота до сухого состояния. Неочищенный продукт суспендировали в 2000 мл 96% этанола, нагревали до кипения с обратным холодильником при перемешивании в течение около 15 мин до тех пор, пока не получали прозрачный раствор. Примерно через 1 ч раствор охлаждали до 25-30 С при медленном перемешивании, далее охлаждали до 0-5 С и перемешивали при этой температуре в течение дополнительного часа. Твердое вещество отфильтровывали, промывали дважды 250 мл холодного 96% этанола и сушили при 50 С и 100 мбар в небольшом токе азота до сухого состояния. Выход составлял 78%. Пример 1 с. Получение 6-амино-4-хлор-2-нитрофенола. 230,5 г (1 моль) N-(5-хлор-2-гидрокси-3-нитрофенил)ацетамида, полученному согласно примеру 1b,суспендировали в смеси 950 мл воды и 100 мл 2-пропанола в условиях умеренной продувки азотом. Добавляли 345 мл 36 мас.% соляной кислоты и затем 25 мл воды. Смесь нагревали с обратным холодильником при температуре около 30 С при интенсивном перемешивании в течение 2 ч. Примерно через 1 ч смесь охлаждали до 0-5 С и перемешивали в течение дополнительного часа при 0-5 С. Твердое вещество отфильтровывали, дважды промывали 250 мл воды и сушили при 50 С и 100 мбар в небольшом токе азота до сухого состояния. Выход составлял 91%. Пример 1d. Получение 5-хлор-7-нитро-2(3 Н)-бензоксазолона. 188,6 г (1 моль) 6-амино-4-хлор-2-нитрофенола, полученного согласно примеру 1 с, суспендировали в 1000 мл этилацетата в условиях умеренной продувки азотом и необязательно присутствующую воду удаляли азеотропной дистилляцией 250 мл растворителя. Смесь охлаждали до 20-25 С и добавляли 224 г карбонилдиимидазола в виде суспензии в 650 мл этилацетата. Добавляли дополнительно 100 мл этилацетата и смесь интенсивно перемешивали в течение 2 ч без применения охлаждения. Добавляли 1000 мл воды и смесь перемешивали в течение 15 мин. Отгоняли 1450-1500 мл этилацетата при 200 мбар и 50 С. Смесь охлаждали до 0-5 С, добавляли 225 мл 36% НСl и смесь снова охлаждали до 0-5 С и перемешивали при этой температуре в течение 15 мин. Твердое вещество отфильтровывали, промывали 400 мл 1NHCl, промывали дважды 500 мл холодной воды и 1 раз 500 мл холодной смеси вода/этанол (4/1) и сушили при 50 С и 100 мбар в небольшом токе азота до сухого состояния. Выход составлял 99%. Пример 1 е. Получение 7-амино-2(3 Н)-бензоксазолона. 107,5 г (1 моль) 5-хлор-7-нитро-2(3 Н)-бензоксазалона, полученного согласно примеру 1d, суспендировали в 1000 мл этанола. Добавляли 9,25 г 5% Pd/C и 50 мл этанола и смесь гидрировали при давлении водорода 4 бар в течение от 4 до 6 ч при 60-65 С при интенсивном перемешивании. Когда гидрирование заканчивалось, смесь охлаждали до 45 С и фильтровали через фильтр марки Hyflo. Фильтр Hyflo промывали дважды 175 мл метанола. Отгоняли 500 мл растворителя при пониженном давлении и 50 С,затем добавляли 250 мл воды и удаляли 300 мл растворителя дистилляцией при пониженном давлении и 50 С. Последнюю процедуру повторяли дважды и, наконец, добавляли 250 мл воды и отгоняли 400 мл растворителя. Примерно через 1 ч образующуюся смесь охлаждали до 0-5 С. Твердое вещество отфильтровывали и промывали 3 раза 125 мл холодной воды и сушили при 50 С и 100 мбар в небольшом токе азота до сухого состояния. Выход составлял 94%. Пример 1f. Получение 3-бис(2-гидроксиэтил)амино]метил]-1,1'-бифенила. Готовили смесь 123,4 г диэтаноламина, 100 мл воды и 100 мл метилэтилкетона (МЭК), и 500 мл метилтретбутилового эфира при перемешивании в условиях умеренной продувки азотом. Добавляли 124,75 г 3-(бромметил)-1,1'-бифенила вместе с 750 мл метилтретбутилового эфира. Смесь нагревали до кипения с обратным холодильником в течение 18 ч, затем охлаждали до комнатной температуры. После этого смесь отмывали 1 раз 375 мл 2N NaOH и 4 раза 375 мл воды. Объединенные слои 2N NaOH и воды экстрагировали 750 мл метилтретбутилового эфира. Объединенные слои метилтретбутилового эфира промывали 250 мл воды и затем отгоняли как можно более полно метилтретбутиловый эфир из органического слоя. Добавляли 1350 мл метилэтилкетона и отгоняли 600 мл растворителя при атмосферном давлении. Раствор охлаждали до комнатной температуры и сохраняли для использования на следующей стадии. Выход по данным количественного анализа составил 97%. Пример 1g. Получение бифепрунокс мезилата (неочищенного). Раствор 123,9 г 3-бис(2-гидроксиэтил)амино]метил]-1,1'-бифенила в приблизительно 750 мл метилэтилкетона, полученного согласно примеру 1f, перемешивали в условиях умеренной продувки азотом. В делительном сосуде растворяли 202 г метансульфонового ангидрида в 600 мл метилэтилкетона при 10-8 008182 20 С. К раствору 3-бис(2-гидроксиэтил)амино]метил]-1,1'-бифенила в метилэтилкетоне добавляли 212,8 г триэтиламина и 60 мл метилэтилкетона. Приблизительно через 45-60 мин добавляли раствор метансульфонового ангидрида к раствору 3-бис(2-гидроксиэтил)амино]метил]-1,1'-бифенила в триэтиламине при поддержании температуры ниже 10 С. Добавляли 60 мл метилэтилкетона и смесь перемешивали в течение еще 15 мин, затем осторожно по каплям добавляли 109,7 г метансульфоновой кислоты и затем добавляли 60 мл метилэтилкетона для ополаскивания дополнительного сосуда. 71,3 г 7-амино-2(3 Н)-бензоксазалона, полученного согласно примеру 1 е, суспендировали в 100 мл метилэтилкетона и добавляли к реакционной смеси, к которой затем добавляли 60 мл метилэтилкетона. Реакционную смесь нагревали до кипения с обратным холодильником в течение 20-24 ч. После 20-24 ч нагревания с обратным холодильником добавляли 48 мл воды и смесь снова нагревали с обратным холодильником в течение часа. Добавляли 420 мл метилэтилкетона и отгоняли 490 мл смеси метилэтилкетон/вода. Эту последнюю стадию повторяли 3 раза. Добавляли 46,1 г метансульфоновой кислоты, смесь нагревали с обратным холодильником в течение дополнительного часа и через час охлаждали до комнатной температуры. Затем смесь охлаждали до 0-5 С и перемешивали при этой температуре в течение еще 1 ч. Твердое вещество отфильтровывали, промывали дважды 75 мл холодного метилэтилкетона и сушили при 50 С и 100 мбар в небольшом токе азота до сухого состояния. Выход составлял 76%. Пример 2. Получение полиморфных форм бифепрунокс мезилата в 2-пропаноле. 10,06 г неочищенного бифепрунокс мезилата, полученного, как описано в примере 1g, суспендировали в смеси 200 мл 2-пропанола и 40 мл воды в условиях продувки азотом. Суспензию нагревали с обратным холодильником до кипения и охлаждали до комнатной температуры через 120 мин при перемешивании. Образовавшуюся суспензию далее охлаждали при перемешивании до 0 С и перемешивали при этой температуре в течение еще 120 мин. Кристаллы отфильтровывали и сушили при 50 С и 100 мбар. Пример 3. Получение полиморфной формыбифепрунокс мезилата в ацетонитриле. 50 г бифепрунокс мезилата, полученного внеочищенном виде, как описано в примере 1g, суспендировали в смеси 875 мл ацетонитрила и 250 мл воды в условиях продувки азотом. Добавляли 375 мл ацетонитрила и реакционную смесь нагревали до кипения с обратным холодильником. Отгоняли 500 мл растворителя и добавляли 500 мл ацетонитрила и эту процедуру повторяли второй раз. После отгонки еще 500 мл растворителя через 120 мин смесь охлаждали до комнатной температуры. Далее смесь охлаждали до 5-0 С и перемешивали в течение 120 мин при этой температуре. Образовавшиеся кристаллы отфильтровывали и дважды промывали ацетонитрилом. Выделенные кристаллы сушили при 50 С и 100 мбар в небольшом токе азота. Выход составлял 85,6%. Пример 4. Получение полиморфной формыбифепрунокс мезилата. К суспензии 12,50 г бифепрунокс мезилата (неочищенного), полученного, как описано в примере 1g, в 150 мл метилэтилкетона (МЭК) примерно через 10-15 мин добавляли 75 мл 5% NаНСО 3 раствора. После 5-10 мин перемешивания суспензию отфильтровывали на фильтре Hyflo или Celite в другой сосуд, где слои разделяли. Водный слой экстрагировали 125 и 75 мл метилэтилкетона. Слои метилэтилкетона объединяли и промывали смесью 50 мл воды и 10 мл этанола 96%. Слой метилэтилкетона фильтровали через фильтр с размером пор 1 мкм в чистый сосуд, после чего фильтр ополаскивали 25 мл метилэтилкетона. Метилэтилкетон отгоняли до тех пор, пока его объем не достигал 130 мл, добавляли 200 мл метилэтилкетона и снова отгоняли метилэтилкетон до тех пор, пока его объем не достигал 175 мл. Затем примерно через 30 мин добавляли раствор 3,00 г метансульфоновой кислоты в 50 мл метилэтилкетоне. После охлаждения до 5 С и перемешивании в течение полутора часов при этой температуре продукт отфильтровывали и дважды промывали 50 мл холодного метилэтилкетона. После сушки при 50 С и 100 мбар в небольшом токе азота получалиполиморф бифепрунокс мезилата с выходом около 80%. Пример 5. Получение 10 мг инкапсулированного состава полиморфной формыбифепрунокс мезилата. 2,227 кг лактозы просеивали и загружали в смеситель с высоким сдвигом. Просеивали и добавляли 125 г бифепрунокс мезилата в его полиморфной форме . Эту композицию смешивали в смесителе с высоким сдвигом (например, марки Collette Gral 10 или Collette Gal 75) до тех пор, пока она не становилась гомогенной (приблизительно 4 мин). Добавляли 24 г вещества, вызывающего дезинтеграцию (например,крахмала натрия гликолат USP-NF, такой как Primojel), и 24 г смазочного материала (например, стеарилфумарат натрия, такой как PRUV) и композицию опять перемешивали до тех пор, пока она не становилась гомогенной (приблизительно 1 мин). Порошок засыпали в капсулы размером 0,240 мг на капсулу с помощью капсулонаполняющей машины (например, Zanasi LZ 64 или Zanasi RM63 plug filler). Было получено около 10000 наполненных капсул. Пример 6. Получение 10 мг таблетированного состава полиморфной формыбифепрунокс мезилата. Таблетки с дозой 10 мг получали согласно следующим методикам (требуемые количества приведены в табл. 8). Одну треть требуемого количества моногидрата лактозы просеивали, и засыпали в смеситель с высоким сдвигом, и перемешивали в течение 5 мин. Требуемое количество измельченного бифепрунокс мезилата в его полиморфной формедобавляли к смеси вместе с 0,100 кг крахмала натрия гликолата типа А, 2,32 кг микрокристаллической целлюлозы и оставшимся количеством моногидрата лакту-9 008182 лозы. Композицию смешивали в смесителе с высоким сдвигом (например, Collette Gral 10 или ColletteGal 75) до тех пор, пока она не становилась гомогенной (приблизительно 10 мин). Просеивали через сито размером 0,42 мм, и добавляли требуемое количество стеарилфумарата натрия (например, PRUV), и композицию снова перемешивали до тех пор, пока она не становилась гомогенной (приблизительно 5 мин). Конечный продукт прессовали в таблетки при 300 МПа. На продукт наносили покрытие до 3,5% от веса ядра, используя 15 мас.% водную суспензию указанного Opadry II HP. Таблица 8 Требуемое количество действующего ингредиента и вспомогательных материалов для крупномасштабного производства таблеток с дозой 10 мг бифепрунокс мезилата Пример 7. Аналитические методы. Рентгеновские порошковые дифрактограммы измеряли на дифрактометре с использованием монохроматического излучения СuK (напряжение на трубке 40 кВ, сила тока 40 мА) при комнатной температуре. ИК спектры регистрировались на ИК-Фурье спектрометре с нарушенным полным внутренним отражением (кристалл кремния) со спектральным разрешением 2 см-1 с использованием детектора на основе теллурида кадмия и ртути. Температуры плавления определяли на дифференциальном сканирующем калориметре как начальные температуры эндотермы плавления с использованием алюминиевых тиглей объемом 40 мкл с отверстиями в крышке. Температурная программа: нагревание от 25 до 300 С со скоростью 10 К/мин-1. Атмосфера азота при скорости потока 80 мл/мин-1. Спектры 13 С-ЯМР в твердой фазе получали с использованием метода кросс-поляризации с вращением под "магическим углом" (CP/MAS) на приборе Bruker AM300 (время контакта 4 мс, время задержки между импульсами 3 с, ширина спектра 30 кГц, 1 Н 90 импульс 6 мкс, скорость вращения около 8,5 кГц). Использовали стандартную 4 мм ампулу для Bruker CP/MAS. Химические сдвиги относили к глицину(с=176,03 ррm для С=O резонанса). Анализы дляикристаллических форм проводили в Центре биомолекулярных исследований Биджовет Университета Утрехта, Нидерланды (Bijvoet Centre for Biomolecular Research, Utrecht University). Анализыкристаллической формы проводили в Лаборатории Питера Джонса Института Неорганической и аналитической химии Университета Брауншвейга, Германия (Peter Jones' lab in Institute of Inorganic andAnalytical Chemistry, University of Braunsweig). Кристаллыформы выглядели под микроскопом в виде брусков,кристаллической формы в виде пластинок и палочек, в то время как кристаллыкристаллической формы выглядели как бруски с закругленными краями. Кристалл каждой кристаллической формы помещали в поток охлажденного азота в дифрактометре с вращающимся анодом. Кристаллические структуры расшифровывались автоматически прямыми методами. Атомы водорода, связанные с азотом, были локализованы на карте электронной плотности и их координаты были уточнены. Позиции других водородных атомов вычисляли, основываясь на связанных с ними атомах, и также уточняли. Все неводородные атомы были уточнены в анизотропном приближении. Атомам водорода были даны фиксированные параметры смещения, отнесенные к параметрам смещения связанных с ними атомов. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Кристаллический полиморф монометансульфоната 7-[4-([1,1'-бифенил]-3-илметил)-1 пиперазинил]-2(3 Н)-бензоксазолона, имеющий порошковую рентгенограмму с характеристическими- 10008182 пиками, выраженными в градусах 2, при приблизительно 7,0, 9,3, 10,0, 12,5, 15,4, 16,7, 17,2, 17,4, 17,7,18,7, 21,3, 22,2, 25,2, 27,2, 28,3, 28,8 и 30,1. 2. Кристаллический полиморф монометансульфоната 7-[4-([1,1'-бифенил]-3-илметил)-1 пиперазинил]-2(3 Н)-бензоксазолона, характеризующийся порошковой рентгенограммой (=РПД), как показано на фиг. 1. 3. Кристаллический полиморф монометансульфоната 7-[4-([1,1'-бифенил]-3-илметил)-1 пиперазинил]-2(3 Н)-бензоксазолона, имеющий температуру плавления около 277 С. 4. Кристаллический полиморф монометансульфоната 7-[4-([1,1'-бифенил]-3-илметил)-1 пиперазинил]-2(3 Н)-бензоксазолона, характеризующийся полной кривой ДСК, как показано на фиг. 2. 5. Кристаллический полиморф монометансульфоната 7-[4-([1,1'-бифенил]-3-илметил)-1 пиперазинил]-2(3 Н)-бензоксазолона, имеющий инфракрасный спектр с ослабленной общей отражательной способностью, имеющий характерные полосы поглощения, выраженные в обратных сантиметрах,приблизительно при 1764, 1217, 795, 746 и 694. 6. Кристаллический полиморф монометансульфоната 7-[4-([1,1'-бифенил]-3-илметил)-1 пиперазинил]-2(3 Н)-бензоксазолона по п.5, имеющий инфракрасный спектр с ослабленной общей отражательной способностью, имеющий характерные полосы поглощения, выраженные в обратных сантиметрах, приблизительно при 1754, 1636, 1284, 1217, 809, 795, 746, 694, 663 и 509. 7. Кристаллический полиморф монометансульфоната 7-[4-([1,1'-бифенил]-3-илметил)-1 пиперазинил]-2(3 Н)-бензоксазолона, характеризующийся полным ИК спектром, как показано на фиг. 3. 8. Кристаллический полиморф монометансульфоната 7-[4-([1,1'-бифенил]-3-илметил)-1 пиперазинил]-2(3 Н)-бензоксазолона по п.5, имеющий химические сдвиги 13 С ЯМР в твердом состоянии,выраженные относительно глицина (с=176,03 для С=O резонанса) приблизительно при 40,4, 48,7, 56,5,106,8 и 137,7 м.д. 9. Кристаллический полиморф монометансульфоната 7-[4-([1,1'-бифенил]-3-илметил)-1 пиперазинил]-2(3 Н)-бензоксазолона по п.8, имеющий химический сдвиг 13 С ЯМР в твердом состоянии относительно глицина (c=176,03 для С=O резонанса) приблизительно при 40,4, 48,7, 50,3, 56,5, 106,8,110,7, 124,9, 126,9, 127,8, 129,2, 130,8, 134,2, 137,7, 141,6 и 153,8 м.д. 10. Кристаллический полиморф монометансульфоната 7-[4-([1,1'-бифенил]-3-илметил)-1 пиперазинил]-2(3 Н)-бензоксазолона, характеризующийся развернутым спектром 13 С ЯМР в твердом состоянии, как показано на фиг. 4. 11. Кристаллический полиморф монометансульфоната 7-[4-([1,1'-бифенил]-3-илметил)-1 пиперазинил]-2(3 Н)-бензоксазолона, имеющий при рентгено-структурном анализе монокристалла при 150 К=116,097 Кристаллическая система Триклинная Пространственная группа Р-1 Молекулы/единичная ячейка 2 Плотность, г/см 3 1,481 и (b) атомные позиции всех атомов относительно начала координат единичной ячейки, как перечислено в табл. 5. 12. Кристаллический полиморф монометансульфоната 7-[4-([1,1'-бифенил]-3-илметил)-1 пиперазинил]-2(3 Н)-бензоксазолона, характеризующийся рентгеновской дифракцией, как показано на фиг. 5. 13. Монометансульфонат 7-[4-([1,1'-бифенил]-3-илметил)-1-пиперазинил]-2(3 Н)-бензоксазолона, в котором по меньшей мере около 50 мас.% соединения находится в кристаллической полиморфной форме по любому из пп.1-12. 14. Монометансульфонат по п.13, характеризующаяся тем, что по меньшей мере около 60 мас.% соединения находится в кристаллической полиморфной форме по любому из пп. 1-8. 15. Монометансульфонат по п.14, характеризующаяся тем, что по меньшей мере около 80 мас.% соединения находится в кристаллической полиморфной форме по любому из пп. 1-8. 16. Монометансульфонат по п.15, характеризующаяся тем, что по меньшей мере около 90 мас.% соединения находится в кристаллической полиморфной форме по любому из пп. 1-8. 17. Монометансульфонат по п.16, характеризующаяся тем, что по меньшей мере 95 мас.% соединения находится в кристаллической полиморфной форме по любому из пп. 1-8. 18. Способ получения кристаллического полиморфа по любому из пп.1-12, который включает кри- 11008182 сталлизацию монометансульфоната 7-[4-([1,1'-бифенил]-3-илметил)-1-пиперазинил]-2(3 Н)-бензоксазолона из его раствора в органическом растворителе или смеси органического растворителя с водой. 19. Способ получения кристаллического полиморфа по любому из пп.1-12, который включает рекристаллизациюилиполиморфа монометансульфоната 7-[4-([1,1'-бифенил]-3-илметил)-1 пиперазинил]-2(3 Н)-бензоксазолона или смеси двух полиморфов из его раствора в органическом растворителе или смеси органического растворителя с водой. 20. Способ по п.18 или 19, в котором названный органический растворитель выбирают из группы,состоящей из 2-пропанола и ацетонитрила и предпочтительно ацетонитрила. 21. Фармацевтическая композиция, содержащая эффективное количество кристаллического полиморфа по любому из пп.1-12 и по меньшей мере один фармацевтически приемлемый наполнитель. 22. Фармацевтическая композиция, содержащая эффективное количество монометансульфоната 7[4-([1,1'-бифенил]-3-илметил)-1-пиперазинил]-2(3 Н)-бензоксазолона по любому из пп.1-12 и смесь моногидрата лактулозы, микрокристаллической лактозы, микрокристаллической целлюлозы, крахмала натрия гликолата типa А, стеарилфумарат натрия и необязательно коллоидную безводную двуокись кремния. 23. Фармацевтическая композиция по п.22, содержащая эффективное количество кристаллического полиморфа по любому из пп.1-12, от 70 до 90 вес.% моногидрата лактозы, от 10 до 15% вес./вес. микрокристаллической целлюлозы, от 0,3 до 0,7 вес.% крахмала натрия гликолата типа А, от 0,6 до 1,3% вес./вес. стеарилфумарата натрия и необязательно от 0,05 до 0,5% вес./вес. коллоидной безводной двуокиси кремния. 24. Кристаллический полиморф по любому из пп.1-12 для применения в медицине. 25. Способ лечения расстройств ЦНС, включающий введение эффективного количества кристаллического полиморфа по любому из пп. 1-12. 26. Способ по п.25, в котором указанное расстройство ЦНС является психотическим расстройством или болезнью Паркинсона. 27. Способ по п.25, в котором указанное расстройство ЦНС является шизофренией. Рентгеновская порошковая дифрактограмма полиморфной формыбифепрунокс мезилата Фиг. 1 Кривая ДСК полиморфной формыбифепрунокс мезилата- 12008182 ИК (НПО) спектр полиморфной формыбифепрунокс мезилата С-ЯМР спектр в твердом состоянии полиморфнойформы бифепрунокс мезилата Фиг. 4 Конфигурация полиморфной формыбифепринокс мезилата,полученная на основе рентгеновской кристаллографии- 13008182 Рентгеновская порошковая дифрактограмма полиморфной формыбифепрунокс мезилата Фиг. 6 Кривая ДСК полиморфной формыбифепрунокс мезилата Фиг. 7 ИК (НПО) спектр полиморфной формыбифепрунокс мезилата С-ЯМР спектр в твердом состоянии полиморфнойформы бифепрунокс мезилата Фиг. 9 Конфигурация полиморфной формыбифепрунокс мезилата,полученная на основе рентгеновской кристаллографии Фиг. 10 Рентгеновская порошковая дифрактограмма полиморфной формыбифепрунокс мезилата- 15008182 Кривая ДСК полиморфной формыбифепрунокс мезилата Фиг. 12 ИК (НПО) спектр полиморфной формыбифепрунокс мезилата С-ЯМР спектр в твердом состоянии полиморфнойформы бифепрунокс мезилата- 16008182 Конфигурация полиморфной формыбифепрунокс мезилата,полученная на основе рентгеновской кристаллографии
МПК / Метки
МПК: C07D 263/58, A61K 31/42, A61P 25/16
Метки: кристаллическая, 1,1`-бифенил]-3-илметил)-1, мезилата, форма, 7-[4, монометансульфоната, пиперазинил]-2, 3н)-бензоксазолона, стабильная, бифепрунокс
Код ссылки
<a href="https://eas.patents.su/18-8182-stabilnaya-kristallicheskaya-forma-bifeprunoks-mezilata-monometansulfonata-7-4-11-bifenil-3-ilmetil-1-piperazinil-2-3n-benzoksazolona.html" rel="bookmark" title="База патентов Евразийского Союза">Стабильная кристаллическая форма бифепрунокс мезилата монометансульфоната (7-[4-( [ 1,1`-бифенил]-3-илметил)-1- пиперазинил]-2 (3н)-бензоксазолона)</a>
Предыдущий патент: Способ получения солей гидроксиламмония
Следующий патент: Устройство и способ шифрования и дешифрования блока данных
Случайный патент: Дифосфатная соль n-[6-(цис-2,6-диметилморфолин-4-ил)пиридин-3-ил]-2-метил-4'-(трифторметокси)[1,1'-дифенил]-3-карбоксамида и фармацевтическая композиция