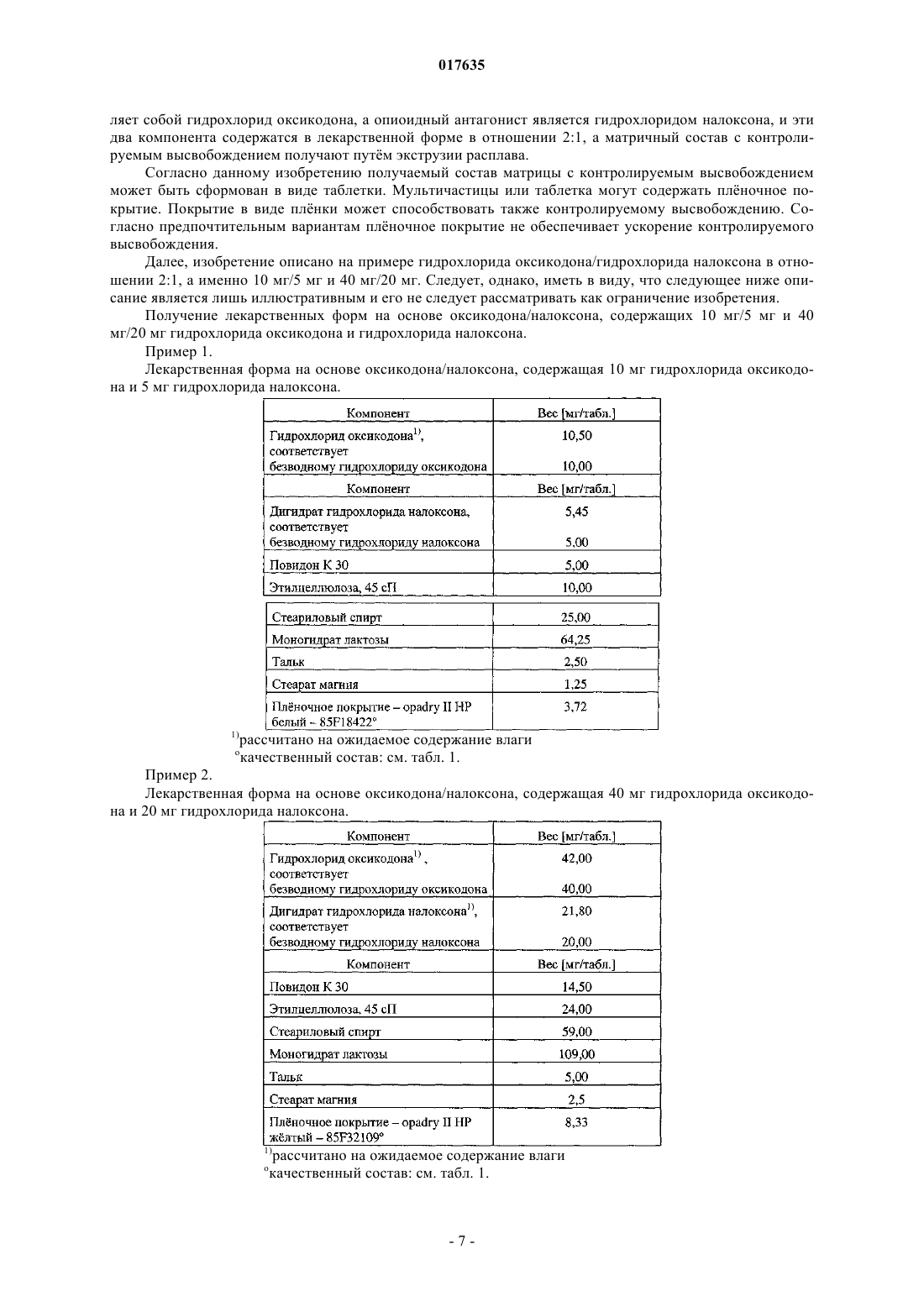
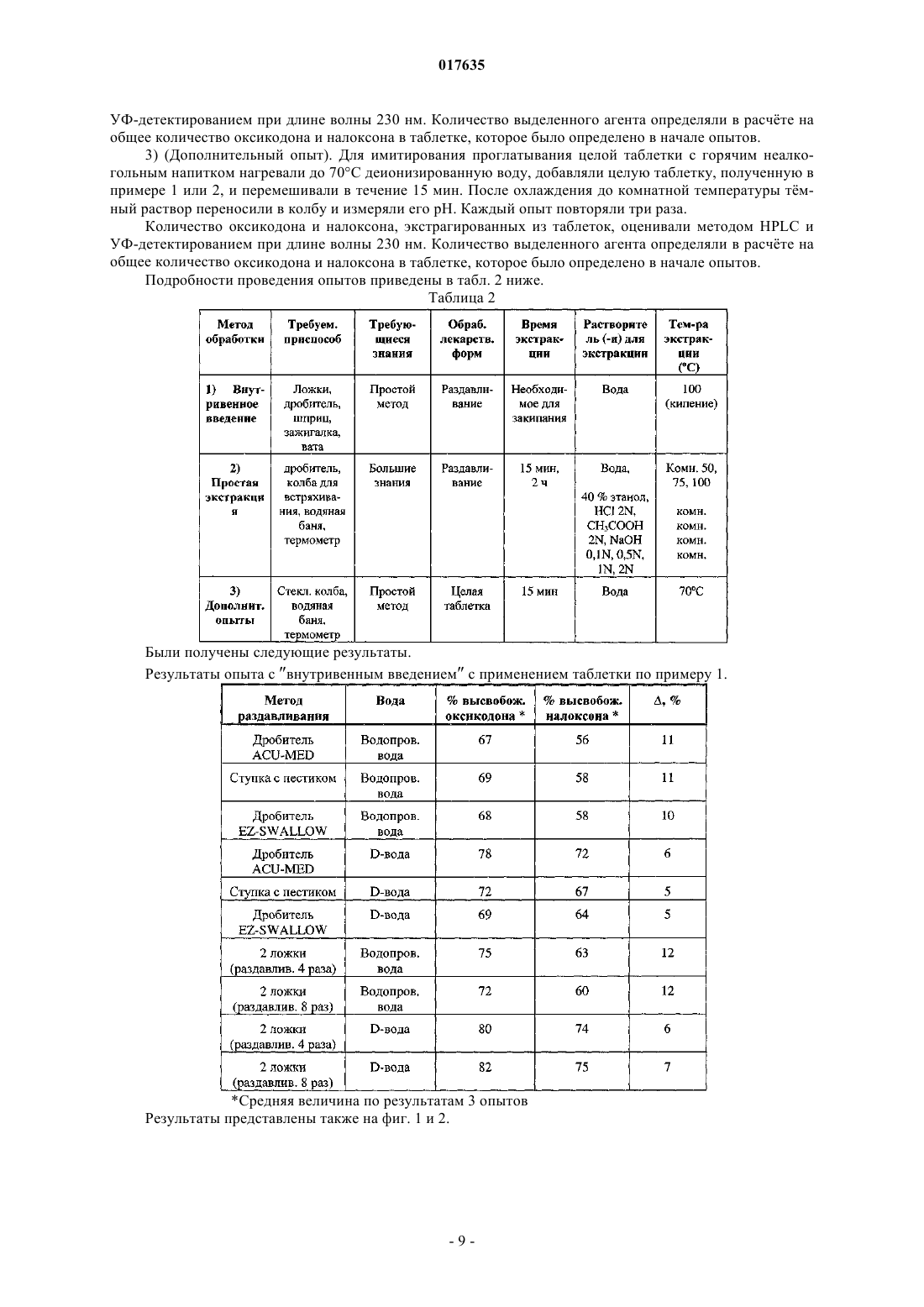
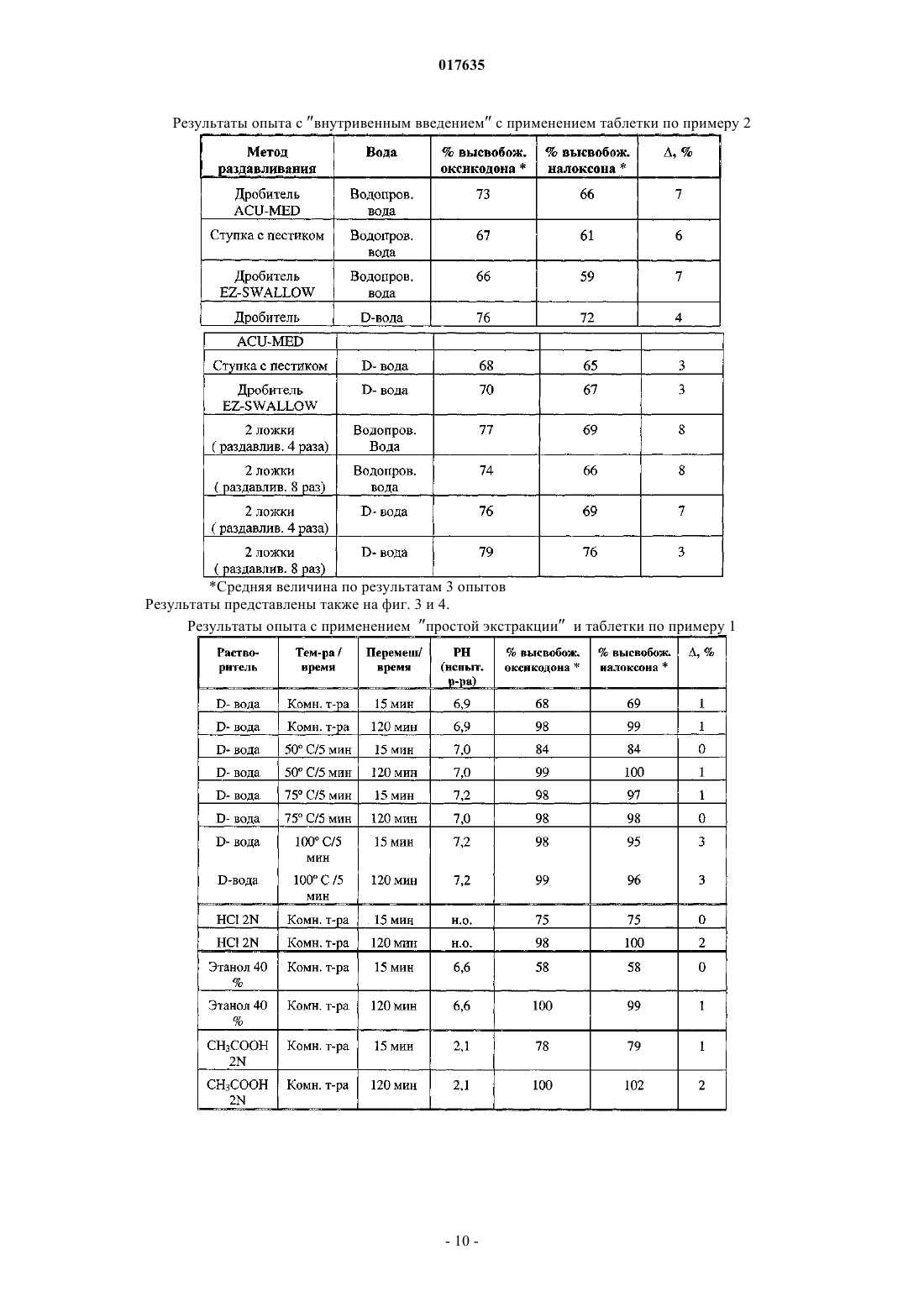
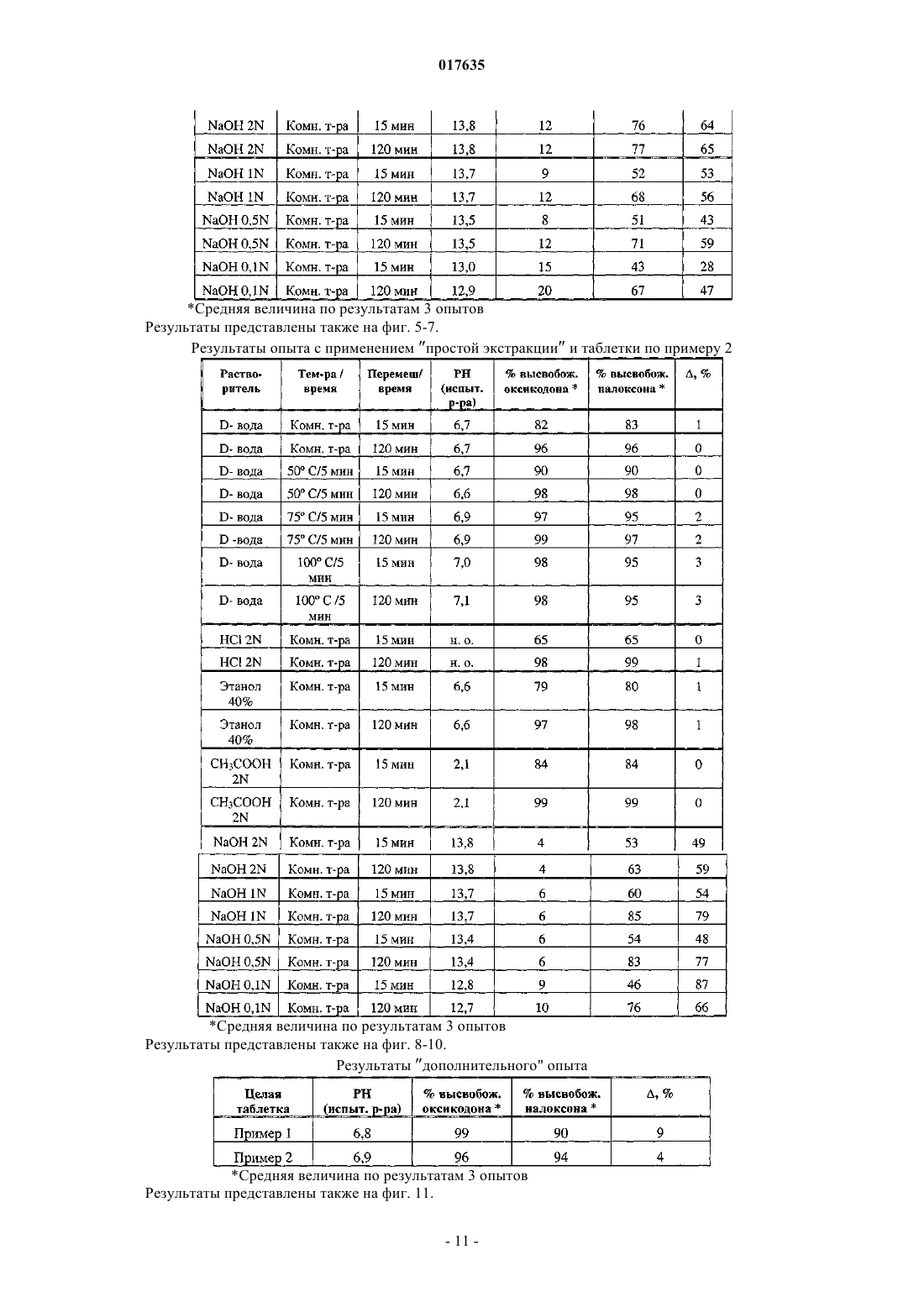
Применение опиоидного антагониста
Номер патента: 17635
Опубликовано: 28.02.2013
Авторы: Леунер Кристиан, Флеишер Вольфганг, Шерер Сабин
Формула / Реферат
1. Применение опиоидного антагониста в количестве, по меньшей мере, достаточном для существенного проявления антагонизма в отношении терапевтического количества опиоидного агониста, когда и опиоидный агонист, и опиоидный антагонист вводятся внутривенно в одно и то же время в виде лекарственной формы с контролируемым высвобождением, содержащей гомогенную матрицу с контролируемым высвобождением, включающую гидрофобный материал, представляющий собой по меньшей мере один гидрофобный полимер, который представляет собой алкилцеллюлозу и по меньшей мере один жирный спирт или жирную кислоту, выбранные из С12-С36 алифатических спиртов или кислот, и терапевтическое количество опиоидного агониста и указанное количество опиоидного антагониста, для предотвращения селективной экстракции опиоидного агониста при получении экстракта из матрицы с контролируемым высвобождением, путём одностадийной экстракции, включающей стадии:
а) раздавливания (растирания) одной лекарственной формы при помощи дробилки для пилюль или ступки с пестиком для таблеток, или при помощи двух ложек, причём раздавливание при помощи двух ложек осуществляют по меньшей мере 4 раза;
б) экстракции раздавленной лекарственной формы в ложке с использованием 2 мл кипящей воды в качестве экстрагирующего агента и зажигалки в качестве средства для нагрева в течение времени, необходимого для закипания воды; и
в) фильтрации раствора через вату,
при этом опиоидный антагонист содержится в указанном экстракте в весовом количестве, в расчёте на общее количество опиоидного антагониста в лекарственной форме, которое более чем на 20% меньше весового количества опиоидного агониста, содержащегося в экстракте, в расчёте на общее количество опиоидного агониста в лекарственной форме, причем опиоидный агонист представляет собой гидрохлорид оксикодона и опиоидный антагонист представляет собой гидрохлорид налоксона, при их соотношении 2:1.
2. Применение по п.1, отличающееся тем, что опиоидный антагонист содержится в указанном экстракте в расчёте на общее весовое количество опиоидного антагониста в лекарственной форме в количестве, которое более чем на 15%, предпочтительно более чем на 12% меньше весового количества опиоидного агониста, содержащегося в экстракте, в расчёте на общее количество опиоидного агониста в лекарственной форме.
3. Применение опиоидного антагониста в количестве, по меньшей мере, достаточном для существенного проявления антагонизма в отношении терапевтического количества опиоидного агониста, когда и опиоидный агонист, и опиоидный антагонист вводятся внутривенно в одно и то же время в виде лекарственной формы с контролируемым высвобождением, содержащей гомогенную матрицу с контролируемым высвобождением, включающую гидрофобный материал, представляющий собой по меньшей мере один гидрофобный полимер, который представляет собой алкилцеллюлозу и по меньшей мере один жирный спирт или жирную кислоту, выбранные из С12-С36 алифатических спиртов или кислот, и терапевтическое количество опиоидного агониста и указанное количество опиоидного антагониста, для предотвращения селективной экстракции опиоидного агониста при получении экстракта из матрицы с контролируемым высвобождением, путём одностадийной экстракции, включающей стадии:
а) раздавливания (растирания) одной лекарственной формы при помощи дробилки для пилюль или ступки с пестиком для таблеток, или при помощи двух ложек, причём раздавливание при помощи двух ложек осуществляют по меньшей мере 4 раза;
б) экстракции раздавленной лекарственной формы в ложке с использованием 2 мл кипящей воды в качестве экстрагирующего агента и зажигалки в качестве средства для нагрева в течение времени, необходимого для закипания воды; и
в) фильтрации раствора через вату,
при этом опиоидный антагонист содержится в указанном экстракте в весовом количестве, в расчёте на общее количество опиоидного антагониста в лекарственной форме, которое более чем на 15% меньше весового количества опиоидного агониста, содержащегося в экстракте, в расчёте на общее количество опиоидного агониста в лекарственной форме, причем опиоидный агонист представляет собой гидрохлорид оксикодона и опиоидный антагонист представляет собой гидрохлорид налоксона, при их соотношении 2:1.
4. Применение по п.3, отличающееся тем, что опиоидный антагонист содержится в указанном экстракте в расчёте на общее весовое количество опиоидного антагониста в лекарственной форме в количестве, которое более чем на 10% меньше, предпочтительно более чем на 7% меньше весового количества опиоидного агониста, содержащегося в экстракте, в расчёте на общее количество опиоидного агониста в лекарственной форме.
5. Применение опиоидного антагониста в количестве, по меньшей мере, достаточном для существенного проявления антагонизма в отношении терапевтического количества опиоидного агониста, когда и опиоидный агонист, и опиоидный антагонист вводятся внутривенно в одно и то же время в виде лекарственной формы с контролируемым высвобождением, содержащей гомогенную матрицу с контролируемым высвобождением, включающую гидрофобный материал, представляющий собой по меньшей мере один гидрофобный полимер, который представляет собой алкилцеллюлозу и по меньшей мере один жирный спирт или жирную кислоту, выбранные из С12-С36 алифатических спиртов или кислот, и терапевтическое количество опиоидного агониста и указанное количество опиоидного антагониста для предотвращения селективной экстракции опиоидного агониста при получении экстракта из матрицы с контролируемым высвобождением, путём одностадийной экстракции, включающей стадии:
а) раздавливания 10 лекарственных форм с применением дробителя пилюль,
б) экстракции раздавленного состава в стеклянном сосуде с применением 100 мл растворителя для экстракции, выбранного из группы, содержащей деионизированную воду, соляную кислоту (2N), уксусную кислоту (2N), раствор гидроокиси натрия (0,1N, 0,5N, 1N или 2N) и этанол (40%), и встряхивания в течение по меньшей мере 15 мин, по меньшей мере, при комнатной температуре,
при этом опиоидный антагонист содержится в указанном экстракте в весовом количестве в расчёте на общее количество опиоидного антагониста в лекарственной форме, которое более чем на 10% меньше весового количества опиоидного агониста, содержащегося в экстракте, в расчёте на общее количество опиоидного агониста в лекарственной форме, причем опиоидный агонист представляет собой гидрохлорид оксикодона и опиоидный антагонист представляет собой гидрохлорид налоксона при их соотношении 2:1.
6. Применение по п.5, отличающееся тем, что опиоидный антагонист содержится в указанном экстракте в расчёте на общее весовое количество опиоидного антагониста в лекарственной форме в количестве, которое более чем на 5% или более чем на 3% меньше, чем весовое количество опиоидного агониста, содержащегося в экстракте, в расчёте на общее количество опиоидного агониста в лекарственной форме.
7. Применение по п.5 или 6, отличающееся тем, что встряхивание осуществляют в течение 120 мин.
8. Применение по любому из пп.5-7, отличающееся тем, что в качестве растворителя для экстракции применяют деионизированную воду и во время экстракции деионизированную воду нагревают до 50°С, предпочтительно до 75°С и наиболее предпочтительно до 100°С в течение 5 мин.
9. Применение опиоидного антагониста в количестве, по меньшей мере, достаточном для существенного проявления антагонизма в отношении терапевтического количества опиоидного агониста, когда и опиоидный агонист, и опиоидный антагонист вводятся внутривенно в одно и то же время в виде лекарственной формы с контролируемым высвобождением, содержащей гомогенную матрицу с контролируемым высвобождением, включающую гидрофобный материал, представляющий собой по меньшей мере один гидрофобный полимер, который представляет собой алкилцеллюлозу и по меньшей мере один жирный спирт или жирную кислоту, выбранные из С12-С36 алифатических спиртов или кислот, и терапевтическое количество опиоидного агониста и указанное количество опиоидного антагониста, для предотвращения селективной экстракции опиоидного агониста при получении экстракта из матрицы с контролируемым высвобождением, путём одностадийной экстракции, включающей стадии:
а) нагревания деионизированной воды до 70°С,
б) добавления одной целой (не раздавленной) лекарственной формы и перемешивания в течение 15 мин,
в) отделения экстракта,
при этом опиоидный антагонист содержится в указанном экстракте в расчёте на общее количество опиоидного антагониста в лекарственной форме в количестве, которое более чем на 15% меньше, чем весовое количество опиоидного агониста, содержащегося в экстракте, в расчёте на общее количество опиоидного агониста в лекарственной форме, причем опиоидный агонист представляет собой гидрохлорид оксикодона и опиоидный антагонист представляет собой гидрохлорид налоксона, при их соотношении 2:1.
10. Применение по п.9, отличающееся тем, что опиоидный антагонист содержится в указанном экстракте в расчёте на общее весовое количество опиоидного антагониста в лекарственной форме в количестве, которое более чем на 10% меньше, чем весовое количество опиоидного агониста, содержащегося в экстракте, в расчёте на общее количество опиоидного агониста в лекарственной форме.
11. Применение по любому из предыдущих пунктов, отличающееся тем, что состав получают на стадии экструзии расплава с целью образования гомогенной матрицы.
12. Применение по любому из предыдущих пунктов, отличающееся тем, что гидрофобный полимер представляет собой этилцеллюлозу.
13. Применение по любому из предыдущих пунктов, отличающееся тем, что количество алкилцеллюлозы меньше 20 вес.%, предпочтительно меньше 15 вес.%, наиболее предпочтительно меньше 10 вес.%, но больше 5 вес.% в расчёте на состав матрицы.
14. Применение по любому из предыдущих пунктов, отличающееся тем, что жирный спирт или жирная кислота выбраны из стеарилового спирта, цетилового спирта, цетостеарилового спирта, стеариновой кислоты, пальмитиновой кислоты и их смесей.
15. Применение по п.14, отличающееся тем, что количество спирта или кислоты составляет по меньшей мере 5%, более предпочтительно по меньшей мере 10 вес.%, более предпочтительно по меньшей мере 15 вес.% и наиболее предпочтительно 20-25 вес.% в расчёте на состав матрицы.
16. Применение по п.12, отличающееся тем, что количество этилцеллюлозы меньше 10 вес.% в расчёте на состав матрицы, который дополнительно содержит стеариловый спирт в количестве между 20 и 25 вес.%.
Текст
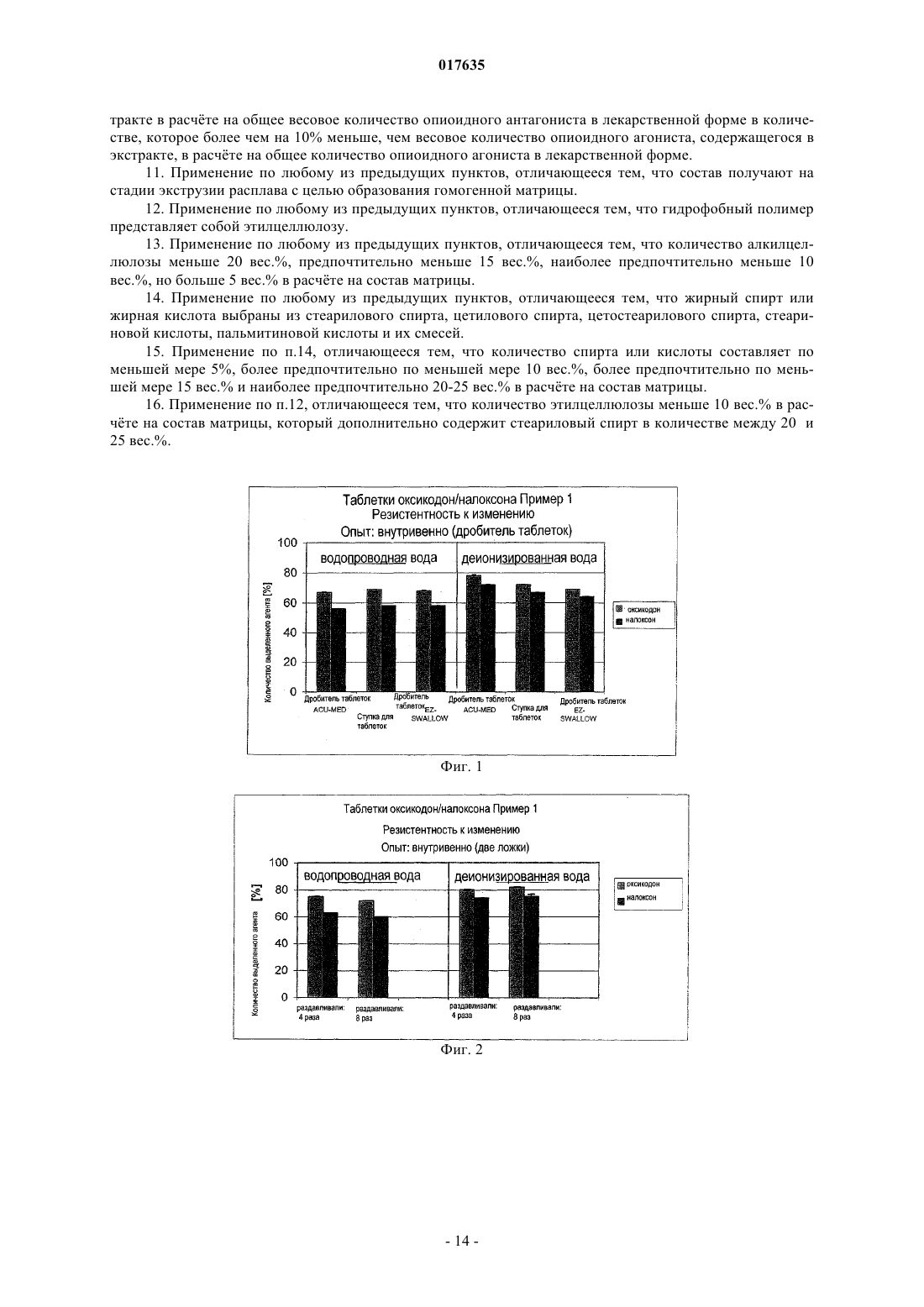
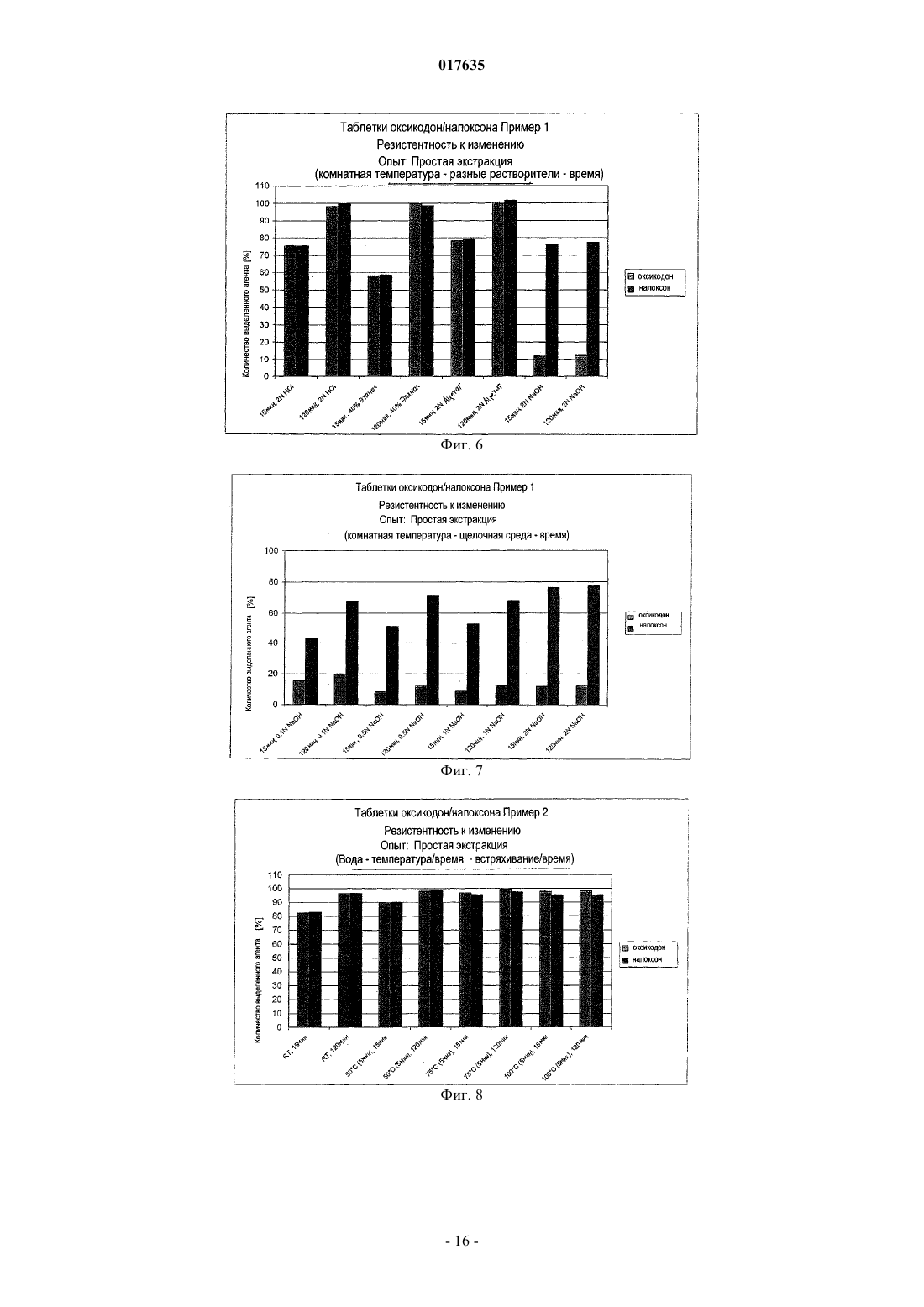
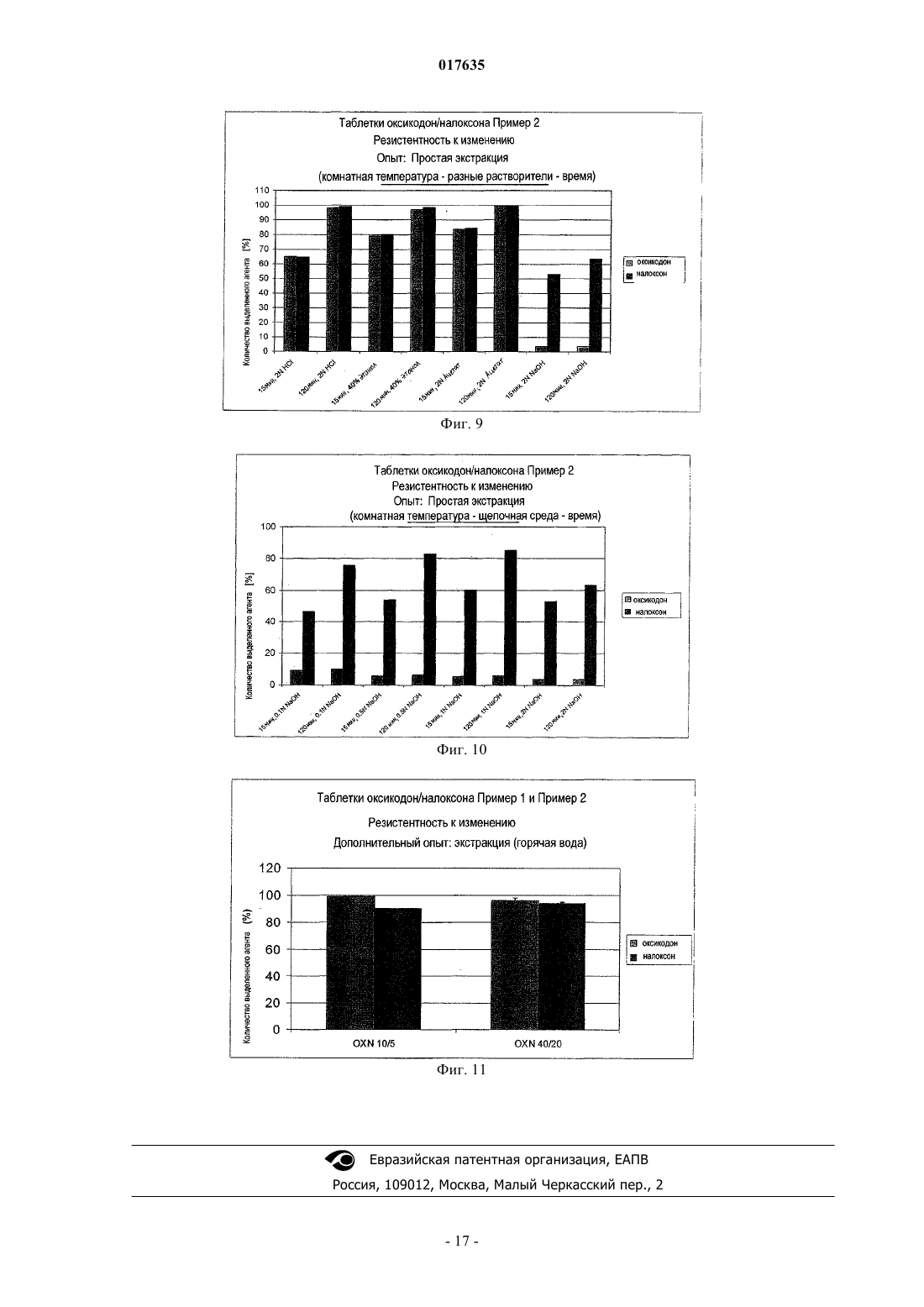
Изобретение относится к применению опиоидного антагониста для предотвращении селективной экстракции опиоидного агониста из лекарственной формы, содержащей опиоидный агонист и опиоидный антагонист. При этом опиоидный агонист представляет собой гидрохлорид оксикодона и опиоидный антагонист представляет собой гидрохлорид налоксона при их соотношении 2:1. 017635 Область техники, к которой относится изобретение Данное изобретение относится к предотвращению незаконного применения лекарственных форм на основе опиоидных агонистов. Настоящее изобретение, в особенности, направлено на предотвращение незаконного использования лекарственных форм на основе оксикодона. Предпосылки создания изобретения Фармацевтические препараты иногда становятся объектом злоупотребления. Например, конкретная доза опиоидного агониста может быть более активной при парентеральном введении по сравнению с той же дозой, введнной перорально. Некоторые составы могут быть самовольно изменены с целью получения опиоидного агониста, содержащегося в них, для незаконного применения. Наркоманы иногда пытаются достичь состояния эйфории, манипулируя лекарственными составами для ускорения начала их действия. Составы на основе опиоидных агонистов с контролируемым высвобождением наркоманы иногда раздавливают или подвергают экстракции при помощи растворителей для получения опиоида, содержащегося в них, с целью его немедленного высвобождения при оральном или парентеральном введении. Наиболее элементарно это можно сделать путм раздавливания лекарственной формы с получением тонкодисперсного порошка с целью обеспечения более доступного активного ингредиента. Наркоманы пережвывают и/или проглатывают этот продукт или же вдыхают через нос раздавленный препарат. Помимо вышеупомянутого непосредственного изменения более активные наркоманы могут также применять различные виды химии на кухне, пытаясь полностью выделить активный ингредиент из матрицы состава. Один из методов включает одностадийную экстракцию в доступной среде, такой как вода или этанол или их смеси. Для получения резистентности к изменению лекарственных форм на основе опиоидных агонистов может быть применено эффективное количество опиоидного антагониста. Опиоидные антагонисты являются антагонистами действия опиоидных агонистов. Терапевтически эффективные, но устойчивые к самовольному изменению оральные лекарственные формы должны быть эффективными при правильном применении и в достаточной степени неэффективными, то есть без существенного действия опиоидного агониста, при незаконном применении, например при раздавливании или экстрагировании с целью получения экстракта опиоидного агониста для парентерального введения. Для предотвращения незаконного применения лекарственной формы, содержащей опиоидный агонист и опиоидный антагонист для придания устойчивости к самовольному изменению, нужно предотвратить разделение опиоидного агониста и опиоидного антагониста при экстракции лекарственной формы. Налоксон является примером известного опиоидного антагониста, пригодного для антагонизации действия оксикодона. Оральное введение комбинации оксикодон/налоксон приводит к высвобождению и абсорбции обоих активных веществ. Благодаря высокой степени метаболизма при первом проходе налоксон обладает только низкой оральной биодоступностью, в то время как оксикодон является активным и системно доступным. Лекарственная форма является эффективной при предназначенном применении, а именно, при оральном применении в виде, например, лекарственной формы с контролируемым высвобождением. В случае назального или внутривенного злоупотребления не происходит метаболизма при первом проходе. Оба активных компонента системно доступны, и налоксон противодействует действию оксикодона. Следовательно, эта комбинация препятствует внутривенному и назальному злоупотреблению. Для противодействия незаконному использованию комбинированных лекарственных форм, содержащих опиоидный агонист и опиоидный антагонист, необходимо предотвратить отделение опиоидного агониста от опиоидного антагониста с использованием обычных для наркоманов методов экстракции, а именно, химических методов на кухне. Сущность изобретения Настоящее изобретение относится к предотвращению отделения опиоидного агониста от опиоидного антагониста в лекарственных формах, содержащих опиоидный агонист и опиоидный антагонист, путм простой экстракции, обычно используемойнаркоманами. Из-за незаконного характера этих поступков нет стандартных методов для злоупотребления фармацевтическими препаратами. Опытные методы, используемые в данной заявке, предназначены для имитации общеизвестных способов злоупотребления. Наиболее простым методом достижения доступности активного ингредиента является растирание лекарственной формы для получения мелкодисперсного порошка. Предпочтительными методами самовольного изменения оральных лекарственных форм, содержащих опиоиды, являются незаконное введение в вену и простой метод одностадийной экстракции. Цель данного изобретения состоит в предотвращении отделения опиоидного агониста от опиоидного антагониста в лекарственной форме, содержащей опиоидный агонист и опиоидный антагонист, которое достаточно для того, чтобы сделать злоупотребление непривлекательным. Цель настоящего изобретения заключается в предотвращении селективной экстракции опиоидного агониста из лекарственной формы, содержащей опиоидный агонист и опиоидный антагонист. Данное изобретение предусматривает применение опиоидного антагониста в количестве, по мень-1 017635 шей мере, достаточном для существенного противодействия терапевтическому количеству опиоидного агониста, когда и опиоидный агонист, и опиоидный антагонист вводят внутривенно в одно и тоже время в виде лекарственной формы с контролируемым высвобождением, содержащей гомогенный матричный состав с контролируемым высвобождением, включающий гидрофобный материал, содержащий по меньшей мере один гидрофобный полимер и по меньшей мере один жирный спирт или одну жирную кислоту и указанное терапевтическое количество опиоидного агониста, и указанное достаточное количество опиоидного антагониста. Разница в относительных количествах опиоидного агониста и опиоидного антагониста, экстрагированных в процессе экстракции, основанная на количествах агентов, содержащихся в лекарственной форме до экстракции, полезна для описания отделяемости опиоидного агониста от опиоидного антагониста при экстракции. Эта разница ( % относительных количеств, экстрагированных в процессе экстракции) должна быть небольшой для предотвращения возникновения эйфории, которое ожидается обычно наркоманом в случае внутривенного введения экстракта, или же не должно быть этой разницы, или относительное количество экстрагированного антагониста должно быть больше относительного количества экстрагированного агониста. Согласно одному из вариантов изобретение относится к применению опиоидного антагониста в количестве, по меньшей мере, достаточном для существенного проявления антагонизма в отношении терапевтического количества опиоидного агониста, когда и опиоидный агонист, и опиоидный антагонист вводятся внутривенно в одно и то же время в виде лекарственной формы с контролируемым высвобождением, содержащей гомогенную матрицу с контролируемым высвобождением, включающую гидрофобный материал, представляющий собой по меньшей мере один гидрофобный полимер и по меньшей мере один жирный спирт или жирную кислоту, и указанное терапевтическое количество опиоидного агониста и указанное количество опиоидного антагониста для предотвращения получения экстракта из матрицы с контролируемым высвобождением, содержащего опиоидный агонист путм одностадийной экстракции, включающей стадии: а) раздавливания (растирания) одной лекарственной формы при помощи дробилки для пилюль или ступки с пестиком для таблеток, или при помощи двух ложек, причм раздавливание при помощи двух ложек осуществляют по меньшей мере 4 раза; б) экстракции раздавленной лекарственной формы в ложке с использованием 2 мл кипящей воды в качестве экстрагирующего агента и зажигалки в качестве средства для нагрева в течение времени, необходимого для закипания воды; и в) фильтрации раствора через вату, при этом опиоидный антагонист содержится в указанном экстракте в весовом количестве, в расчте на общее количество опиоидного антагониста в лекарственной форме,которое более чем на 20% меньше количества опиоидного агониста, содержащегося в экстракте, в расчте на общее количество опиоидного агониста в лекарственной форме. Согласно другому варианту данного изобретения оно относится к применению опиоидного антагониста в количестве, по меньшей мере, достаточном для существенного проявления антагонизма в отношении терапевтического количества опиоидного агониста, когда и опиоидный агонист, и опиоидный антагонист вводятся внутривенно в одно и то же время в виде лекарственной формы с контролируемым высвобождением, содержащей гомогенную матрицу с контролируемым высвобождением, включающую гидрофобный материал, представляющий собой по меньшей мере один гидрофобный полимер и по меньшей мере один жирный спирт или жирную кислоту, и указанное терапевтическое количество опиоидного агониста и указанное количество опиоидного антагониста для предотвращения получения экстракта из матрицы с контролируемым высвобождением, содержащего опиоидный агонист путм одностадийной экстракции, включающей стадии: а) раздавливания (растирания) одной лекарственной формы при помощи дробилки для пилюль или ступки с пестиком для таблеток, или при помощи двух ложек,причм раздавливание при помощи двух ложек осуществляют по меньшей мере 4 раза; б) экстракции раздавленной лекарственной формы в ложке с использованием 2 мл кипящей воды в качестве экстрагирующего агента и зажигалки в качестве средства для нагрева в течение времени, необходимого для закипания воды; и в) фильтрации раствора через вату, при этом опиоидный антагонист содержится в указанном экстракте в весовом количестве, в расчте на общее количество опиоидного антагониста в лекарственной форме, которое более чем на 15% меньше количества опиоидного агониста, содержащегося в экстракте, в расчте на общее количество опиоидного агониста в лекарственной форме. Согласно ещ одному варианту данное изобретение относится к применению опиоидного антагониста в количестве, по меньшей мере, достаточном для существенного проявления антагонизма в отношении терапевтического количества опиоидного агониста, когда и опиоидный агонист, и опиоидный антагонист вводятся внутривенно в одно и то же время в виде лекарственной формы с контролируемым высвобождением, содержащей гомогенную матрицу с контролируемым высвобождением, включающую гидрофобный материал, представляющий собой по меньшей мере один гидрофобный полимер и по меньшей мере один жирный спирт или жирную кислоту, и указанное терапевтическое количество опиоидного агониста и указанное количество опиоидного антагониста для предотвращения получения экстракта из матрицы с контролируемым высвобождением, содержащего опиоидный агонист путм одностадийной экстракции, включающей стадии раздавливания 10 лекарственных форм с применением дробителя пилюль, экстракции раздавленного состава в стеклянном сосуде с применением 100 мл раствори-2 017635 теля для экстракции, выбранного из группы, содержащей деионизированную воду, соляную кислоту(2N), уксусную кислоту (2N), раствор гидроокиси натрия (0,1N, 0,5N, 1N или 2N) и этанол (40 %), и встряхивания в течение по меньшей мере 15 мин, по меньшей мере, при комнатной температуре, при этом опиоидный антагонист содержится в указанном экстракте в весовом количестве, в расчте на общее количество опиоидного антагониста в лекарственной форме, которое более чем на 10% меньше количества опиоидного агониста, содержащегося в экстракте, в расчте на общее количество опиоидного агониста в лекарственной форме. Согласно ещ одному варианту данное изобретение относится к применению опиоидного антагониста в количестве, по меньшей мере, достаточном для существенного проявления антагонизма в отношении терапевтического количества опиоидного агониста, когда и опиоидный агонист, и опиоидный антагонист вводятся внутривенно в одно и то же время в виде лекарственной формы с контролируемым высвобождением, содержащей гомогенную матрицу с контролируемым высвобождением, включающую гидрофобный материал, представляющий собой по меньшей мере один гидрофобный полимер и по меньшей мере один жирный спирт или жирную кислоту, и указанное терапевтическое количество опиоидного агониста и указанное количество опиоидного антагониста для предотвращения получения экстракта из матрицы с контролируемым высвобождением, содержащего опиоидный агонист путм одностадийной экстракции, включающей стадии нагрева деионизированной воды до 70 С, добавления одной целой (не раздавленной) лекарственной формы и перемешивания в течение 15 мин, отделения экстракта,при этом опиоидный антагонист содержится в указанном экстракте в расчте на общее количество опиоидного антагониста в лекарственной форме в количестве, которое более чем на 15% меньше, чем весовое количество опиоидного агониста, содержащегося в экстракте, в основе на общее количество опиоидного агониста в лекарственной форме. Выражение достаточное для существенного проявления антагонизма в отношении терапевтического количества опиоидного агониста, когда и опиоидный агонист, и опиоидный антагонист вводятся внутривенно в одно и то же время означает, что указанное комбинированное внутривенное введение обычному наркоману не вызывает у него эйфории. Термин состав матрицы с контролируемым высвобождением относится к композиции, содержащей материалы с контролируемым высвобождением и опиоид. Термин практически гомогенный состав матрицы с контролируемым высвобождением, используемый в данном описании, относится к составу матрицы, в котором соединения, составляющие матрицу, включающую опиоидный агонист и опиоидный антагонист, образуют однородную смесь веществ. Термин лекарственная форма с контролируемым высвобождением относится к форме, содержащей состав матрицы с контролируемым высвобождением. Лекарственная форма может быть в виде таблетки, возможно, содержащей добавочные адъюванты, или в виде капсулы, содержащей указанный состав в виде мультичастиц, возможно, содержащий добавочные адъюванты. Данное изобретение, раскрытое в данной заявке, охватывает применение любой фармацевтически приемлемой соли опиоида. Термин соль опиоида относится к фармацевтически приемлемой соли опиоида. Любой вариант изобретения, относящийся к опиоиду, относится также и к соли опиоида. Фармацевтически приемлемые соли включают, но без ограничения, соли металлов, такие как соль натрия, соль калия, соль цезия и т.п.; соли щлочно-земельных металлов, такие как соль кальция, соль магния и т.п.; соли органических аминов, такие как соль триэтиламина, соль пиридина, соль пиколина,соль этаноламина, соль триэтаноламина, соль дициклогексиламина, соль N,N'-ди-бензилэтилендиамина и т.п.; соли неорганических кислот, такие как формиат, ацетат, трифторацетат, малеат, тартрат и т.п.; сульфонаты, такие как метансульфонат, бензолсульфонат, п-толуолсульфонат и т.п.; соли аминокислот,такие как аргинат, аспаргинат, глутамат и т.п. Опиоиды, применяемые согласно данному изобретению, могут содержать один или более асимметричных центров и могут быть в виде энантиомеров, диастереомеров или других стереоизомерных форм. Данное изобретение охватывает также применение всех таких возможных форм, а также их рацемических и разрешнных форм и их смесей. Когда соединения, описанные в данной заявке, содержат олефиновые двойные связи или другие центры геометрической асимметрии, изобретение охватывает и Е- и Zгеометрические изомеры. Данное изобретение охватывает также все таутомеры. Краткое описание фигур Фиг. 1-11 отражают результаты экстракции составов по примерам 1 и 2. Подробное описание изобретения Согласно одному варианту данное изобретение относится к применению опиоидного антагониста в количестве, по меньшей мере, достаточном для существенного проявления антагонизма в отношении терапевтического количества опиоидного агониста, когда и опиоидный агонист, и опиоидный антагонист вводятся внутривенно в одно и то же время в виде лекарственной формы с контролируемым высвобождением, содержащей гомогенную матрицу с контролируемым высвобождением, включающую гидро-3 017635 фобный материал, представляющий собой по меньшей мере один гидрофобный полимер и по меньшей мере один жирный спирт или жирную кислоту, и указанное терапевтическое количество опиоидного агониста и указанное количество опиоидного антагониста для предотвращения получения экстракта из матрицы с контролируемым высвобождением, содержащего опиоидный агонист путм одностадийной экстракции, включающей стадии: А) раздавливания (растирания) одной лекарственной формы при помощи дробилки для пилюль или ступки с пестиком для таблеток, или при помощи двух ложек, причм раздавливание при помощи двух ложек осуществляют по меньшей мере 4 раза; Б) экстракции раздавленной лекарственной формы в ложке с использованием 2 мл кипящей воды в качестве экстрагирующего агента и зажигалки в качестве средства для нагрева в течение времени, необходимого для закипания воды; и В) фильтрации раствора через вату,при этом опиоидный антагонист содержится в указанном экстракте в весовом количестве, в расчте на общее количество опиоидного антагониста в лекарственной форме, которое более чем на 20 %, предпочтительно, более чем на 15 %, более предпочтительно, более чем на 12 % меньше, чем весовое количество опиоидного агониста, содержащееся в экстракте, в расчте на общее количество опиоидного агониста в лекарственной форме. Согласно другому варианту данного изобретения оно относится к применению опиоидного антагониста в количестве, по меньшей мере, достаточном для существенного проявления антагонизма в отношении терапевтического количества опиоидного агониста, когда и опиоидный агонист, и опиоидный антагонист вводятся внутривенно в одно и то же время в виде лекарственной формы с контролируемым высвобождением, содержащей гомогенную матрицу с контролируемым высвобождением, включающую гидрофобный материал, представляющий собой по меньшей мере один гидрофобный полимер и по меньшей мере один жирный спирт или жирную кислоту, и указанное терапевтическое количество опиоидного агониста, и указанное количество опиоидного антагониста для предотвращения получения экстракта из матрицы с контролируемым высвобождением, содержащего опиоидный агонист путм одностадийной экстракции, включающей стадии:A) раздавливания (растирания) одной лекарственной формы при помощи дробилки для пилюль или ступки с пестиком для таблеток, или при помощи двух ложек, причм раздавливание при помощи двух ложек осуществляют по меньшей мере 4 раза; Б) экстракции раздавленной лекарственной формы в ложке с использованием 2 мл кипящей воды в качестве экстрагирующего агента и зажигалки в качестве средства для нагрева в течение времени, необходимого для закипания воды; иB) фильтрации раствора через вату,при этом опиоидный антагонист содержится в указанном экстракте в весовом количестве, в расчте на общее количество опиоидного антагониста в лекарственной форме, которое более чем на 15% меньше,предпочтительно, более чем на 10% меньше, более предпочтительно более чем на 7% меньше, чем весовое количество опиоидного агониста, содержащееся в экстракте, в расчте на общее количество опиоидного агониста в лекарственной форме. Согласно ещ одному варианту данное изобретение относится к применению опиоидного антагониста в количестве, по меньшей мере, достаточном для существенного проявления антагонизма в отношении терапевтического количества опиоидного агониста, когда и опиоидный агонист, и опиоидный антагонист вводятся внутривенно в одно и то же время в виде лекарственной формы с контролируемым высвобождением, содержащей гомогенную матрицу с контролируемым высвобождением, включающую гидрофобный материал, представляющий собой по меньшей мере один гидрофобный полимер и по меньшей мере один жирный спирт или жирную кислоту, и указанное терапевтическое количество опиоидного агониста, и указанное количество опиоидного антагониста для предотвращения получения экстракта из матрицы с контролируемым высвобождением, содержащего опиоидный агонист путм одностадийной экстракции, включающей стадии: а) раздавливания 10 лекарственных форм с применением дробителя пилюль,б) экстракции раздавленного состава в стеклянном сосуде с применением 100 мл растворителя для экстракции, выбранного из группы, содержащей деионизированную воду, соляную кислоту (2N), уксусную кислоту (2N), раствор гидроокиси натрия (0,1N, 0,5N, 1N или 2N) и этанол (40 %) и встряхивания в течение по меньшей мере 15 мин, по меньшей мере, при комнатной температуре,при этом опиоидный антагонист содержится в указанном экстракте в весовом количестве, в расчте на общее количество опиоидного антагониста в лекарственной форме, которое более чем на 10% меньше,предпочтительно более чем на 5% меньше и более предпочтительно более чем на 3% меньше, чем весовое количество опиоидного агониста, содержащегося в экстракте, в расчте на общее количество опиоидного агониста в лекарственной форме. Предпочтительно, предотвращать получение указанного экстракта, когда в качестве растворителя для экстракции применяют деионизированную воду и когда во время экстракции деионизированную воду нагревают до 50 С, предпочтительно до 75 С и наиболее предпочтительно до 100 С в течение 5 мин.-4 017635 Согласно ещ одному варианту данное изобретение относится к применению опиоидного антагониста в количестве, по меньшей мере, достаточном для существенного проявления антагонизма в отношении терапевтического количества опиоидного агониста, когда и опиоидный агонист, и опиоидный антагонист вводятся внутривенно в одно и то же время в виде лекарственной формы с контролируемым высвобождением, содержащей гомогенную матрицу с контролируемым высвобождением, включающую гидрофобный материал, представляющий собой по меньшей мере один гидрофобный полимер и по меньшей мере один жирный спирт или жирную кислоту, и указанное терапевтическое количество опиоидного агониста, и указанное количество опиоидного антагониста для предотвращения получения экстракта из матрицы с контролируемым высвобождением, содержащего опиоидный агонист путм одностадийной экстракции, включающей стадии: а) нагревания деионизированной воды до 70 С,б) добавления одной целой (не раздавленной) лекарственной формы и перемешивания в течение 15 мин,в) отделения экстракта,при этом опиоидный антагонист содержится в указанном экстракте в расчте на общее количество опиоидного антагониста в лекарственной форме в количестве, которое более чем на 15% меньше, предпочтительно более чем на 10% меньше, чем весовое количество опиоидного агониста, содержащегося в экстракте, в расчте на общее количество опиоидного агониста в лекарственной форме. В соответствии с данным изобретением опиоидный агонист выбирают из алфентанила, аллилпродина, альфапродина, анилеридина, бензилморфина, безитрамида, бупренорфина, буторфанола, клонитазена, кодеина, десоморфина, декстроморамида, дезоцина, диампромида, диаморфона, дигидрокодеина,дигидроморфина, дименоксадола, димефептанола, диметилтиамбутена, диоксафетилбутирата, дипипанона, эптазоцина, этогептазина, этилметилтиамбутена, этилморфина, этонитазена, эторфина, дигидроэторфина, фентанила и его производных, героина, гидрокодона, гидроморфона, гидроксипетидина, изометадона, кетобемидона, леворфанола, левофенацилморфана, лофентанила, липеридина, мептазинола, метазоцина, метадона, метопона, морфина, мирофина, нарцеина, никоморфина, норлеворфанола, норметадона, налорфина, налбуфена, норморфина, норпипанона, опиума, оксикодона, оксиморфона, папаверетума,пентазоцина, фенадоксона, феноморфона, феназоцина, феноперидина, пиминодина, пиритрамида, профептазина, промедола, проперидина, пропоксифена, суфентанила, тилидина, трамадола, фармацевтически приемлемых солей любого из указанных выше веществ и смесей любых указанных выше веществ и т.п., предпочтительно, из фармацевтически приемлемых солей любого соединения из кодеина, морфина,оксикодона, гидрокодона, гидроморфона или оксиморфона. Согласно данному изобретению опиоидный антагонист выбирают из группы, состоящей из налоксона, налтрексона и налорфина. Согласно предпочтительному варианту изобретения опиоидный агонист представляет собой гидрохлорид оксикодона и опиоидный антагонист представляет собой гидрохлорид налоксона, которые берутся в отношении 2:1. Согласно изобретению лекарственная форма включает гомогенную матрицу с контролируемым высвобождением, содержащую гидрофобный материал, включающий по меньшей мере один гидрофобный полимер и по меньшей мере один жирный спирт или жирную кислоту, а также указанное терапевтическое количество опиоидного агониста и указанное достаточное количество опиоидного антагониста. Предпочтительным гидрофобным материалом является алкилцеллюлоза, в особенности, этилцеллюлоза. Предпочтительно, чтобы количество гидрофобного материала, предпочтительно алкилцеллюлозы, более предпочтительно этилцеллюлозы, было менее 20% (вес.), предпочтительно менее 15% (вес.),наиболее предпочтительно менее 10% (вес.), но более 5% (вес.) в расчте на матричный состав с контролируемым высвобождением. Алкилцеллюлоза может быть применена в виде частиц или водных дисперсий алкилцеллюлозы. В случае этилцеллюлозы в виде частиц она предпочтительно имеет вязкость в пределах от 3 до 110 сП, измеренную для 5%-ного раствора в растворителе, состоящем из 80% толуола и 20% спирта, при температуре 25 С в вискозиметре Убеллоде. Предпочтительно, чтобы вязкость была в пределах от 18 до 110 сП и более предпочтительно в пределах от 41 до 49 сП. Подходящей является этилцеллюлоза, поставляемая Dow Chemical Company под торговым названием Ethocel Standard 45. В случае применения водных дисперсий этилцеллюлозы предпочтительной является дисперсия этилцеллюлозы с вязкостью 20 сП, содержащая дибутилсебацинат, гидроокись аммония, олеиновую кислоту и коллоидную безводную двуокись кремния, которая доступна с торговым названием Surlease E7-7050. Согласно данному изобретению гидрофобный полимер применяют в сочетании по меньшей мере с одним вторым материалом с контролируемым высвобождением в составе матрицы, выбранной из C12-C36 алифатических спиртов и соответствующих алифатических кислот, предпочтительно стеарилового спирта, цетилового спирта и цетостеарилового спирта и соответствующих стеариновой и пальмитиновой кислот и их смесей, при этом количество С 12-С 36 алифатического спирта или алифатической кислоты пред-5 017635 почтительно равно по меньшей мере 5%, более предпочтительно по меньшей мере 10% (вес.), ещ более предпочтительно по меньшей мере 15% (вес.) и наиболее предпочтительно 20-25% (вес.) от состава матрицы с контролируемым высвобождением. Лекарственная форма помимо гидрофобного полимера, предпочтительно, алкил-(этил)целлюлозы и алифатического спирта или алифатической кислоты может содержать наполнители и дополнительные вещества/адюъюванты, такие как добавки, способствующие гранулированию, смазочные агенты, красители, агенты, способствующие текучести, и пластификаторы. В качестве наполнителей можно применять лактозу, глюкозу или сахарозу, крахмалы и их гидролизаты, микрокристаллическую целлюлозу, целлатозу, сахарные спирты, такие как сорбит или маннит, растворимые соли кальция, такие как кислый фосфат кальция, дикальций- или трикальцийфосфаты. В качестве добавки, способствующей гранулированию, можно применять повидон. В качестве добавок, повышающих текучесть, предпочтительно применять высокодисперсную двуокись кремния (Aerosil), тальк, кукурузный крахмал, окись магния и стеарат магния или стеарат кальция. В качестве смазочных агентов можно применять предпочтительно стеарат магния и/или стеарат кальция. В соответствии с такими некоторыми вариантами особенно предпочтительным является состав, который включает этилцеллюлозу, стеариловый спирт, стеарат магния в качестве смазочного агента, лактозу в качестве наполнителя и повидон в качестве добавки, способствующей гранулированию. Согласно изобретению особенно предпочтительным является получение гомогенного состава с контролируемым высвобождением или осуществление предварительных стадий процесса получения путм экструзии. Согласно одному предпочтительному варианту фармацевтические составы или их части получают путм экструзии расплава в экструдерах, содержащих два шнека с параллельным вращением или противовращением. Другой такой предпочтительный вариант предусматривает экструзию в экструдерах, содержащих один или более шнеков. Эти экструдеры могут также содержать пластифицирующие элементы. Экструзия представляет собой хорошо известный специалистам в области фармацевтики способ получения составов. Специалистам хорошо известно, что во время экструзии для получения продуктов с желательными характеристиками можно менять различные параметры, такие как скорость подачи исходных веществ, скорость шнека, температура в различных зонах экструдера (если это доступно), содержание воды и т.д. Указанные выше параметры зависят от конкретного вида применяемого экструдера. Во время экструзии температура в зонах нагрева, в которых расплавляются компоненты состава по изобретению, может составлять от 40 до 120 С, предпочтительно от 50 до 100 С, более предпочтительно от 50 до 90 С,ещ более предпочтительно от 50 до 70 С и наиболее предпочтительно от 50 до 65 С, особенно, если применяются двухшнековые экструдеры с противовращением (такие как Leistritz Micro 18 GGL). Специалистам хорошо известно, что нагревать нужно не каждую зону нагрева. Может быть необходимо охлаждение до температуры около 25 С, особенно в зоне после питателя. Скорость шнека может меняться между 100 и 500 оборотами в минуту (об./мин), предпочтительно между 100 и 250 об./мин, более предпочтительно между 100 и 200 об./мин и наиболее предпочтительно может составлять примерно 150 об./мин, особенно, если применяются двухшнековые экструдеры с противовращением (такие как LeistritzMicro 18 GGL). Геометрия и диаметр сопла могут быть выбраны в соответствии с требованиями. Диаметр сопла в обычно применяемых экструдерах обычно составляет от 1 до 10 мм, предпочтительно от 2 до 8 мм и наиболее предпочтительно от 3 до 5 мм. Отношение длины к диаметру шнека в экструдерах,которые можно применять для получения препаратов по изобретению, обычно равно примерно 40:1. Обычно температуры в зонах нагрева должны быть выбраны таким образом, чтобы они не могли привести к разложению фармацевтически активных соединений. Скорость подачи исходных материалов и скорость шнека должны быть выбраны таким образом, чтобы фармацевтически активные соединения высвобождались из препаратов, полученных путм экструзии, пролонгированным, независимым и неизменным образом. Если, например, скорость подачи возрастает, скорость шнека должна быть соответственно увеличена, чтобы обеспечить то же замедление высвобождения. Специалисту в данной области известно, что все указанные выше параметры зависят от конкретных условий получения состава (типа экструдера, геометрии шнека, количества компонентов и т.д.) и могут быть адаптированы таким образом, чтобы препараты, полученные путм экструзии, обладали требуемой скоростью высвобождения. Предпочтительно, чтобы для обеспечения гомогенности С 12-С 36 алифатический спирт или алифатическая кислота расплавлялись, а этилцеллюлоза растворялась в указанных С 12-С 36 алифатическом спирте или алифатической кислоте во время экструзии расплава. Согласно предпочтительному варианту изобретения этилцеллюлозу применяют в количестве менее 10% (вес.), но более 5% (вес.) в расчте на состав матрицы, С 12-С 36 алифатический спирт представляет собой стеариловый спирт, применяемый в количестве от 20 до 25% (вес.), опиоидный агонист представ-6 017635 ляет собой гидрохлорид оксикодона, а опиоидный антагонист является гидрохлоридом налоксона, и эти два компонента содержатся в лекарственной форме в отношении 2:1, а матричный состав с контролируемым высвобождением получают путм экструзии расплава. Согласно данному изобретению получаемый состав матрицы с контролируемым высвобождением может быть сформован в виде таблетки. Мультичастицы или таблетка могут содержать плночное покрытие. Покрытие в виде плнки может способствовать также контролируемому высвобождению. Согласно предпочтительным вариантам плночное покрытие не обеспечивает ускорение контролируемого высвобождения. Далее, изобретение описано на примере гидрохлорида оксикодона/гидрохлорида налоксона в отношении 2:1, а именно 10 мг/5 мг и 40 мг/20 мг. Следует, однако, иметь в виду, что следующее ниже описание является лишь иллюстративным и его не следует рассматривать как ограничение изобретения. Получение лекарственных форм на основе оксикодона/налоксона, содержащих 10 мг/5 мг и 40 мг/20 мг гидрохлорида оксикодона и гидрохлорида налоксона. Пример 1. Лекарственная форма на основе оксикодона/налоксона, содержащая 10 мг гидрохлорида оксикодона и 5 мг гидрохлорида налоксона. рассчитано на ожидаемое содержание влаги качественный состав: см. табл. 1. Пример 2. Лекарственная форма на основе оксикодона/налоксона, содержащая 40 мг гидрохлорида оксикодона и 20 мг гидрохлорида налоксона. рассчитано на ожидаемое содержание влаги качественный состав: см. табл. 1.-7 017635 Таблица 1. Качественный состав плночного покрытия Указанные выше лекарственные формы были получены путм экструзии в расплаве. Гидрохлорид оксикодона и гидрохлорид налоксона смешивали с повидоном, этилцеллюлозой, стеариловым спиртом и лактозой, смесь просеивали для удаления агломератов и затем перемешивали. Эту смесь экструдировали из расплава, используя нагретый двухшнековый экструдер и получая нити, которые затем измельчали с получением гранул. Гранулы смешивали с тальком и стеаратом магния, формовали таблетки, на которые затем наносили плночное покрытие. Определение возможности самовольного изменения Используемые материалы: Определение экстрагируемости 1) (Внутривенно). Методы включали раздавливание таблеток, полученных в примере 1 или 2, и последующую экстракцию небольшим количеством воды. Полученный раствор помещали в шприц для инсулина. Размельчение таблеток осуществляли с применением различных дробителей таблеток и ложек из нержавеющей стали. Используя метод экстракции с нагревом, экстрагировали из измельчнных продуктов опиоиды. Это потребовало 2 мл воды, водопроводной или деионизированной (D-вода), зажигалки для нагревания раствора в ложке, ваты для фильтрования раствора, шприцов для инсулина для переноса фильтрата в колбу для анализа. Каждый опыт повторяли три раза. Количество оксикодона и налоксона, экстрагированных из таблеток, оценивали методом HPLC и УФ-детектированием при длине волны 230 нм. Количество выделенного агента определяли в расчте на общее количество оксикодона и налоксона в таблетке, которое было определено в начале опытов. 2) (Простая экстракция). Для имитации самовольного изменения препарата простой экстракцией лекарственную форму раздавливали (10 таблеток по примеру 1 или 2) при помощи дробителя, соединяли со 100 мл растворителя (D-вода, подкисленная, щелочная и среда, содержащая 40% этанола), нагревали до определнной температуры, встряхивали в течение 15 и 120 мин и анализировали на экстрагируемость. Каждый опыт повторяли три раза. Количество оксикодона и налоксона, экстрагированных из таблеток, оценивали методом HPLC и-8 017635 УФ-детектированием при длине волны 230 нм. Количество выделенного агента определяли в расчте на общее количество оксикодона и налоксона в таблетке, которое было определено в начале опытов. 3) (Дополнительный опыт). Для имитирования проглатывания целой таблетки с горячим неалкогольным напитком нагревали до 70 С деионизированную воду, добавляли целую таблетку, полученную в примере 1 или 2, и перемешивали в течение 15 мин. После охлаждения до комнатной температуры тмный раствор переносили в колбу и измеряли его рН. Каждый опыт повторяли три раза. Количество оксикодона и налоксона, экстрагированных из таблеток, оценивали методом HPLC и УФ-детектированием при длине волны 230 нм. Количество выделенного агента определяли в расчте на общее количество оксикодона и налоксона в таблетке, которое было определено в начале опытов. Подробности проведения опытов приведены в табл. 2 ниже. Таблица 2 Были получены следующие результаты. Результаты опыта с внутривенным введением с применением таблетки по примеру 1. Средняя величина по результатам 3 опытов Результаты представлены также на фиг. 1 и 2.-9 017635 Результаты опыта с внутривенным введением с применением таблетки по примеру 2 Средняя величина по результатам 3 опытов Результаты представлены также на фиг. 3 и 4. Результаты опыта с применением простой экстракции и таблетки по примеру 1 Средняя величина по результатам 3 опытов Результаты представлены также на фиг. 5-7. Результаты опыта с применением простой экстракции и таблетки по примеру 2 Средняя величина по результатам 3 опытов Результаты представлены также на фиг. 8-10. Результаты дополнительного" опыта Средняя величина по результатам 3 опытов Результаты представлены также на фиг. 11.- 11017635 Результаты всех опытов подтверждают, что типичное злоупотребление на улице, а именно, отделение оксикодона от налоксона из таблеток на основе оксикодона/налоксона невозможно. Разница в относительных количествах оксикодона и налоксона, экстрагированных в опытах, в расчте на их количество в таблетках ( %) невелика в случаях, когда экстрагируется довольно большое количество оксикодона. Невозможно также отделить оксикодон и налоксон друг от друга методом простой экстракции и/или с применением других методов раздавливания таблеток. Скорость выделения обоих веществ сравнима во всех опытах, за исключением простой экстракции в основной среде. В этих опытах можно наблюдать, что концентрация экстрагированного оксикодона значительно меньше, чем концентрация налоксона. После фильтрации оставшуюся массу нельзя применять для любого манипулирования наркоманами в незаконных целях. Она также содержит матрицу таблетки, а оксикодон пропитан сильным каустиком. Очистка на улице, по - видимому, будет непрактичной,так как это будет зависеть от возможности провести экстракцию, являющуюся непростой в уличных условиях. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение опиоидного антагониста в количестве, по меньшей мере, достаточном для существенного проявления антагонизма в отношении терапевтического количества опиоидного агониста, когда и опиоидный агонист, и опиоидный антагонист вводятся внутривенно в одно и то же время в виде лекарственной формы с контролируемым высвобождением, содержащей гомогенную матрицу с контролируемым высвобождением, включающую гидрофобный материал, представляющий собой по меньшей мере один гидрофобный полимер, который представляет собой алкилцеллюлозу и по меньшей мере один жирный спирт или жирную кислоту, выбранные из С 12-С 36 алифатических спиртов или кислот, и терапевтическое количество опиоидного агониста и указанное количество опиоидного антагониста, для предотвращения селективной экстракции опиоидного агониста при получении экстракта из матрицы с контролируемым высвобождением, путм одностадийной экстракции, включающей стадии: а) раздавливания (растирания) одной лекарственной формы при помощи дробилки для пилюль или ступки с пестиком для таблеток, или при помощи двух ложек, причм раздавливание при помощи двух ложек осуществляют по меньшей мере 4 раза; б) экстракции раздавленной лекарственной формы в ложке с использованием 2 мл кипящей воды в качестве экстрагирующего агента и зажигалки в качестве средства для нагрева в течение времени, необходимого для закипания воды; и в) фильтрации раствора через вату,при этом опиоидный антагонист содержится в указанном экстракте в весовом количестве, в расчте на общее количество опиоидного антагониста в лекарственной форме, которое более чем на 20% меньше весового количества опиоидного агониста, содержащегося в экстракте, в расчте на общее количество опиоидного агониста в лекарственной форме, причем опиоидный агонист представляет собой гидрохлорид оксикодона и опиоидный антагонист представляет собой гидрохлорид налоксона, при их соотношении 2:1. 2. Применение по п.1, отличающееся тем, что опиоидный антагонист содержится в указанном экстракте в расчте на общее весовое количество опиоидного антагониста в лекарственной форме в количестве, которое более чем на 15%, предпочтительно более чем на 12% меньше весового количества опиоидного агониста, содержащегося в экстракте, в расчте на общее количество опиоидного агониста в лекарственной форме. 3. Применение опиоидного антагониста в количестве, по меньшей мере, достаточном для существенного проявления антагонизма в отношении терапевтического количества опиоидного агониста, когда и опиоидный агонист, и опиоидный антагонист вводятся внутривенно в одно и то же время в виде лекарственной формы с контролируемым высвобождением, содержащей гомогенную матрицу с контролируемым высвобождением, включающую гидрофобный материал, представляющий собой по меньшей мере один гидрофобный полимер, который представляет собой алкилцеллюлозу и по меньшей мере один жирный спирт или жирную кислоту, выбранные из С 12-С 36 алифатических спиртов или кислот, и терапевтическое количество опиоидного агониста и указанное количество опиоидного антагониста, для предотвращения селективной экстракции опиоидного агониста при получении экстракта из матрицы с контролируемым высвобождением, путм одностадийной экстракции, включающей стадии: а) раздавливания (растирания) одной лекарственной формы при помощи дробилкидля пилюль или ступки с пестиком для таблеток, или при помощи двух ложек, причм раздавливание при помощи двух ложек осуществляют по меньшей мере 4 раза; б) экстракции раздавленной лекарственной формы в ложке с использованием 2 мл кипящей воды в качестве экстрагирующего агента и зажигалки в качестве средства для нагрева в течение времени, необходимого для закипания воды; и в) фильтрации раствора через вату,- 12017635 при этом опиоидный антагонист содержится в указанном экстракте в весовом количестве, в расчте на общее количество опиоидного антагониста в лекарственной форме, которое более чем на 15% меньше весового количества опиоидного агониста, содержащегося в экстракте, в расчте на общее количество опиоидного агониста в лекарственной форме, причем опиоидный агонист представляет собой гидрохлорид оксикодона и опиоидный антагонист представляет собой гидрохлорид налоксона, при их соотношении 2:1. 4. Применение по п.3, отличающееся тем, что опиоидный антагонист содержится в указанном экстракте в расчте на общее весовое количество опиоидного антагониста в лекарственной форме в количестве, которое более чем на 10% меньше, предпочтительно более чем на 7% меньше весового количества опиоидного агониста, содержащегося в экстракте, в расчте на общее количество опиоидного агониста в лекарственной форме. 5. Применение опиоидного антагониста в количестве, по меньшей мере, достаточном для существенного проявления антагонизма в отношении терапевтического количества опиоидного агониста, когда и опиоидный агонист, и опиоидный антагонист вводятся внутривенно в одно и то же время в виде лекарственной формы с контролируемым высвобождением, содержащей гомогенную матрицу с контролируемым высвобождением, включающую гидрофобный материал, представляющий собой по меньшей мере один гидрофобный полимер, который представляет собой алкилцеллюлозу и по меньшей мере один жирный спирт или жирную кислоту, выбранные из С 12-С 36 алифатических спиртов или кислот, и терапевтическое количество опиоидного агониста и указанное количество опиоидного антагониста для предотвращения селективной экстракции опиоидного агониста при получении экстракта из матрицы с контролируемым высвобождением, путм одностадийной экстракции, включающей стадии: а) раздавливания 10 лекарственных форм с применением дробителя пилюль,б) экстракции раздавленного состава в стеклянном сосуде с применением 100 мл растворителя для экстракции, выбранного из группы, содержащей деионизированную воду, соляную кислоту (2N), уксусную кислоту (2N), раствор гидроокиси натрия (0,1N, 0,5N, 1N или 2N) и этанол (40%), и встряхивания в течение по меньшей мере 15 мин, по меньшей мере, при комнатной температуре,при этом опиоидный антагонист содержится в указанном экстракте в весовом количестве в расчте на общее количество опиоидного антагониста в лекарственной форме, которое более чем на 10% меньше весового количества опиоидного агониста, содержащегося в экстракте, в расчте на общее количество опиоидного агониста в лекарственной форме, причем опиоидный агонист представляет собой гидрохлорид оксикодона и опиоидный антагонист представляет собой гидрохлорид налоксона при их соотношении 2:1. 6. Применение по п.5, отличающееся тем, что опиоидный антагонист содержится в указанном экстракте в расчте на общее весовое количество опиоидного антагониста в лекарственной форме в количестве, которое более чем на 5% или более чем на 3% меньше, чем весовое количество опиоидного агониста, содержащегося в экстракте, в расчте на общее количество опиоидного агониста в лекарственной форме. 7. Применение по п.5 или 6, отличающееся тем, что встряхивание осуществляют в течение 120 мин. 8. Применение по любому из пп.5-7, отличающееся тем, что в качестве растворителя для экстракции применяют деионизированную воду и во время экстракции деионизированную воду нагревают до 50 С, предпочтительно до 75 С и наиболее предпочтительно до 100 С в течение 5 мин. 9. Применение опиоидного антагониста в количестве, по меньшей мере, достаточном для существенного проявления антагонизма в отношении терапевтического количества опиоидного агониста, когда и опиоидный агонист, и опиоидный антагонист вводятся внутривенно в одно и то же время в виде лекарственной формы с контролируемым высвобождением, содержащей гомогенную матрицу с контролируемым высвобождением, включающую гидрофобный материал, представляющий собой по меньшей мере один гидрофобный полимер, который представляет собой алкилцеллюлозу и по меньшей мере один жирный спирт или жирную кислоту, выбранные из С 12-С 36 алифатических спиртов или кислот, и терапевтическое количество опиоидного агониста и указанное количество опиоидного антагониста, для предотвращения селективной экстракции опиоидного агониста при получении экстракта из матрицы с контролируемым высвобождением, путм одностадийной экстракции, включающей стадии: а) нагревания деионизированной воды до 70 С,б) добавления одной целой (не раздавленной) лекарственной формы и перемешивания в течение 15 мин,в) отделения экстракта,при этом опиоидный антагонист содержится в указанном экстракте в расчте на общее количество опиоидного антагониста в лекарственной форме в количестве, которое более чем на 15% меньше, чем весовое количество опиоидного агониста, содержащегося в экстракте, в расчте на общее количество опиоидного агониста в лекарственной форме, причем опиоидный агонист представляет собой гидрохлорид оксикодона и опиоидный антагонист представляет собой гидрохлорид налоксона, при их соотношении 2:1. 10. Применение по п.9, отличающееся тем, что опиоидный антагонист содержится в указанном экс- 13017635 тракте в расчте на общее весовое количество опиоидного антагониста в лекарственной форме в количестве, которое более чем на 10% меньше, чем весовое количество опиоидного агониста, содержащегося в экстракте, в расчте на общее количество опиоидного агониста в лекарственной форме. 11. Применение по любому из предыдущих пунктов, отличающееся тем, что состав получают на стадии экструзии расплава с целью образования гомогенной матрицы. 12. Применение по любому из предыдущих пунктов, отличающееся тем, что гидрофобный полимер представляет собой этилцеллюлозу. 13. Применение по любому из предыдущих пунктов, отличающееся тем, что количество алкилцеллюлозы меньше 20 вес.%, предпочтительно меньше 15 вес.%, наиболее предпочтительно меньше 10 вес.%, но больше 5 вес.% в расчте на состав матрицы. 14. Применение по любому из предыдущих пунктов, отличающееся тем, что жирный спирт или жирная кислота выбраны из стеарилового спирта, цетилового спирта, цетостеарилового спирта, стеариновой кислоты, пальмитиновой кислоты и их смесей. 15. Применение по п.14, отличающееся тем, что количество спирта или кислоты составляет по меньшей мере 5%, более предпочтительно по меньшей мере 10 вес.%, более предпочтительно по меньшей мере 15 вес.% и наиболее предпочтительно 20-25 вес.% в расчте на состав матрицы. 16. Применение по п.12, отличающееся тем, что количество этилцеллюлозы меньше 10 вес.% в расчте на состав матрицы, который дополнительно содержит стеариловый спирт в количестве между 20 и 25 вес.%.
МПК / Метки
МПК: A61K 9/22, A61K 31/485
Метки: опиоидного, применение, антагониста
Код ссылки
<a href="https://eas.patents.su/18-17635-primenenie-opioidnogo-antagonista.html" rel="bookmark" title="База патентов Евразийского Союза">Применение опиоидного антагониста</a>
Предыдущий патент: Модульное переносное огнестрельное оружие
Следующий патент: Устройство для пеногашения (варианты), способ и установка, включающие это устройство
Случайный патент: Упаковка для битума