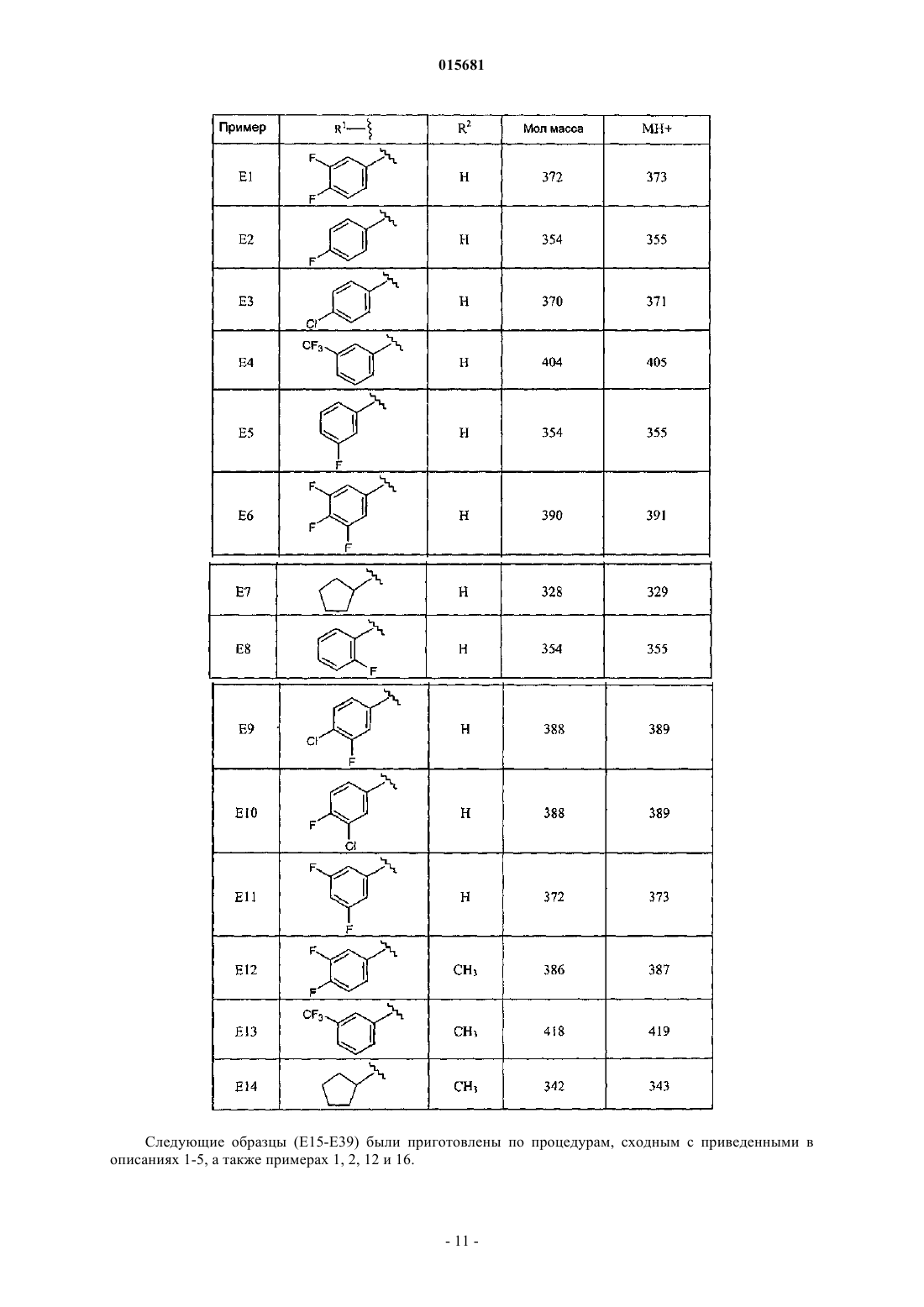
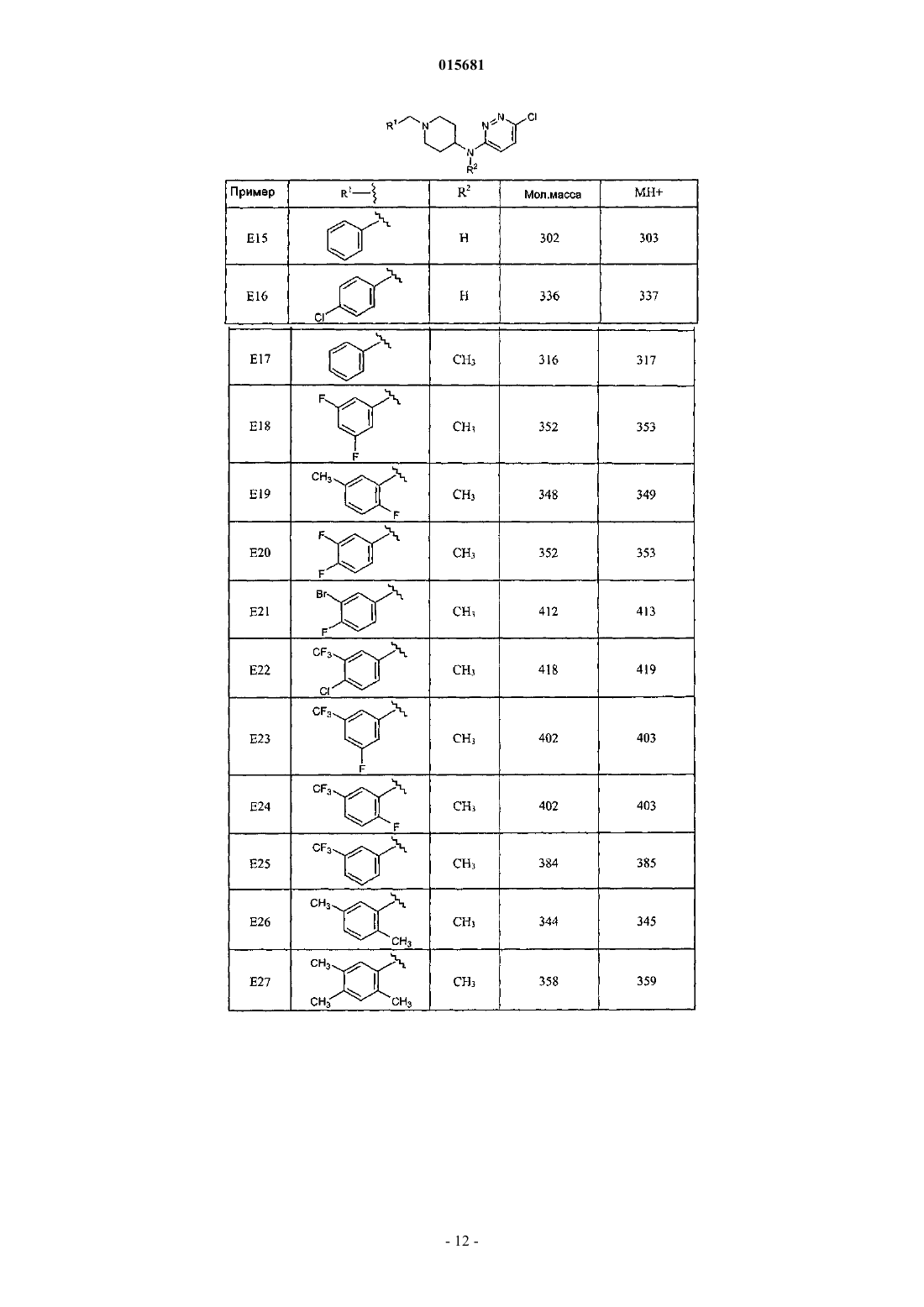
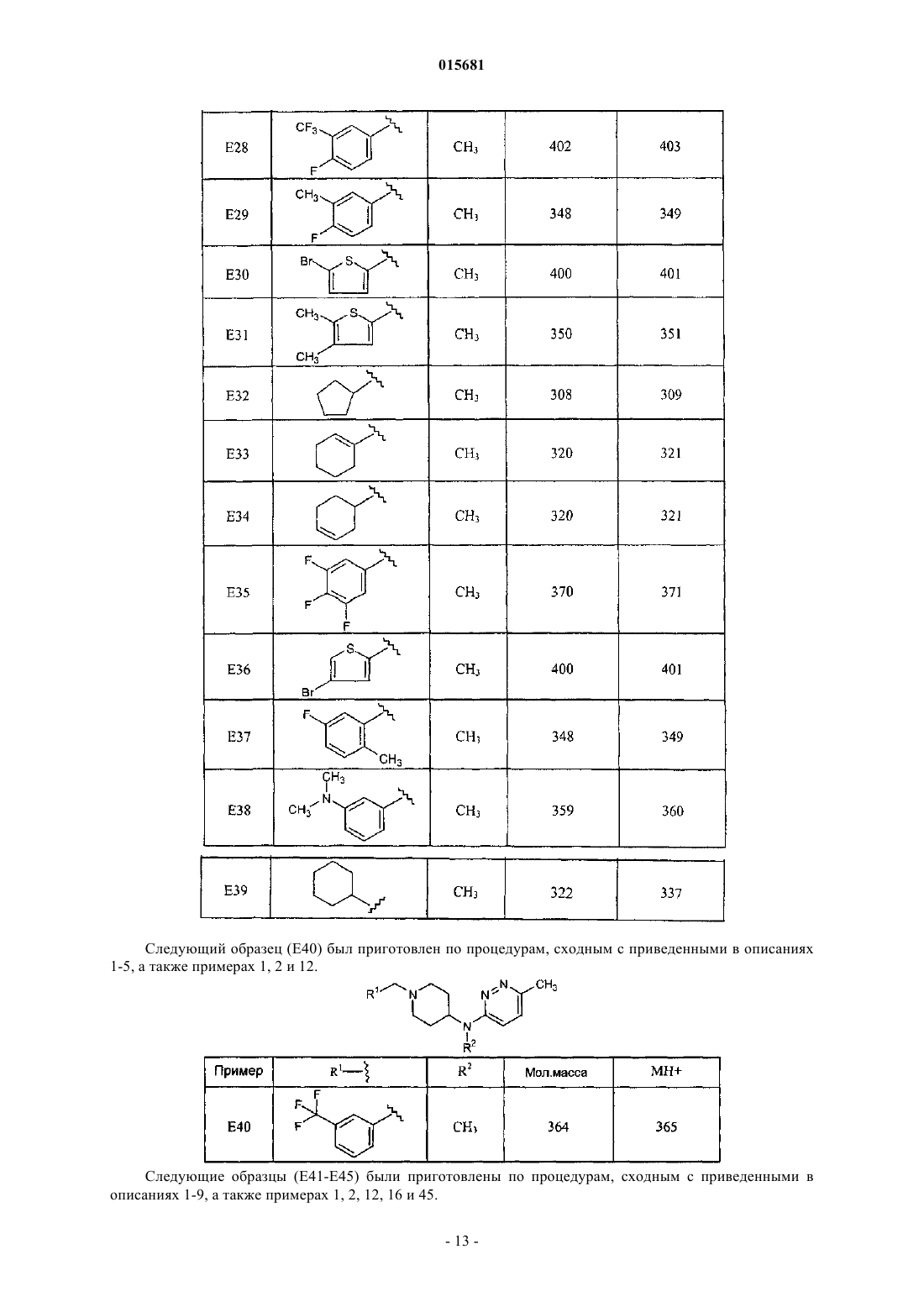
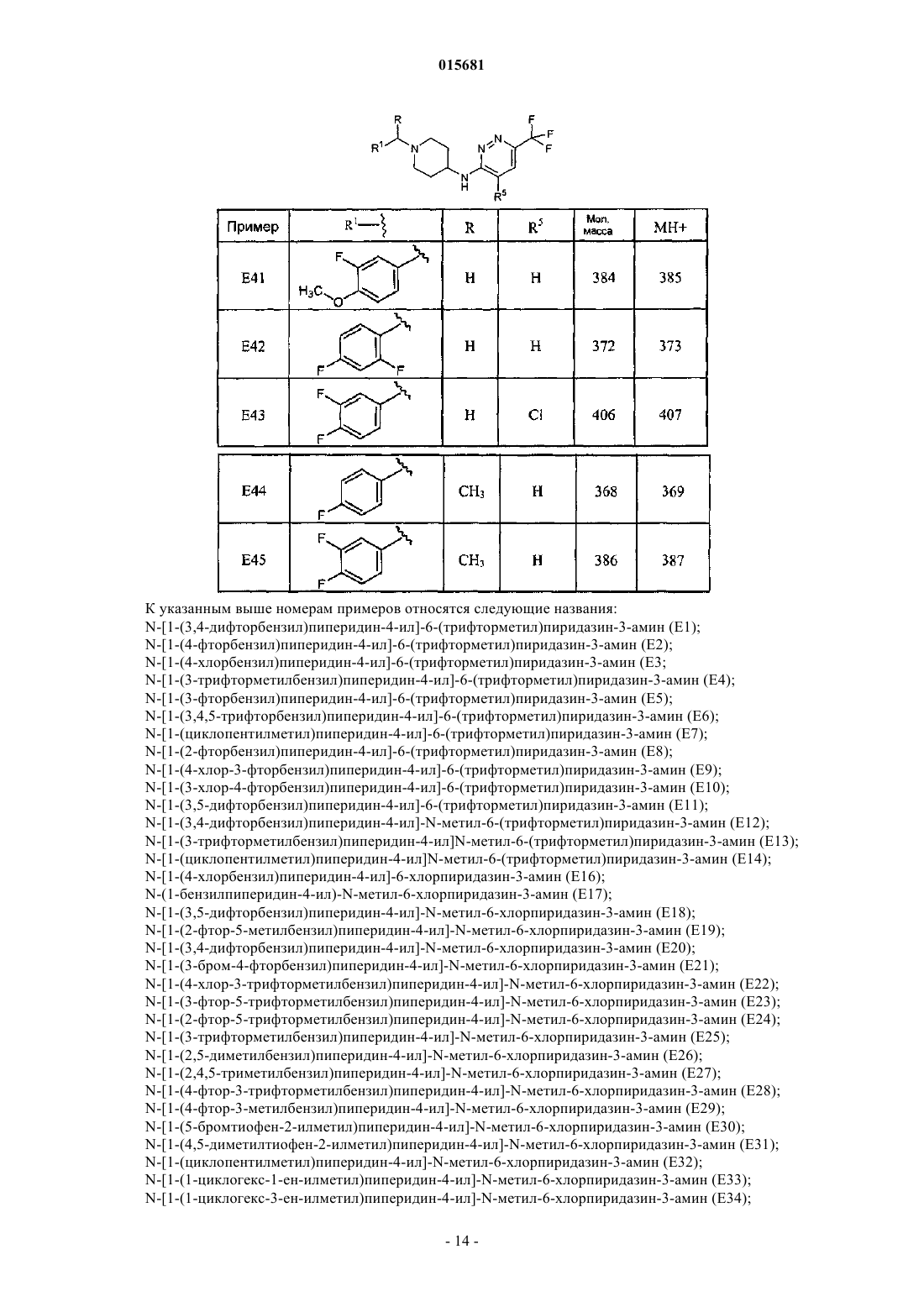
Производные пипередин-4-ил-пиридазин-3-иламина как быстро диссоциирующие антагонисты рецептора дофамина 2
Номер патента: 15681
Опубликовано: 31.10.2011
Авторы: Макдональд Грегор Джеймс, Ланглуа Ксавье Жан Мишель, Ван Росбрук Ив Эмиль Мария, Кенни Людо Эдмон Жозефин, Ван Ден Кейбюс Франц Альфонс Мария, Де Брюин Марсель Франс Леопольд
Формула / Реферат
1. Соединение формулы (I)
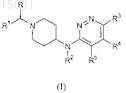
либо его фармацевтически приемлемая соль, гидрат или сольват, или его стереоизомерная форма, в которой
R означает водород или C1-6алкил;
R1 означает фенил, фенил, замещенный 1, 2 или 3 заместителями, каждый из которых независимо от других выбирается из группы, состоящей из водорода, галогена, циано, С1-4алкила, С1-4алкилокси, перфторС1-4 алкила, диС1-4алкиламино; тиенил, тиенил, замещенный 1 или 2 заместителями, выбранными из группы, которая состоит из галогена и С1-4алкила; С3-8циклоалкил или С5-7циклоалкенил;
R2 означает водород или C1-6алкил;
R3 означает галоген, С1-4алкил или перфторС1-4алкил, а
R4 и R5, каждый, означают независимо друг от друга водород или галоген.
2. Соединение по п.1, в котором R3 означает трифторметил, a R, R4и R5 означают водород.
3. Соединение по п.1, в котором R2 означает водород или метил.
4. Соединение по п.1, в котором R1 означает 4-фторфенил или 3,4-дифторфенил.
5. Соединение по п.1, которое представляет собой соединение N-[1-(4-фторбензил)пиперидин-4-ил]-6-(трифторметил)пиридазин-3-амин.
6. Соединение по п.1, которое представляет собой соединение N-[1-(3,4-дифторбензил)пиперидин-4-ил]-6-(трифторметил)пиридазин-3-амин.
7. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по п.1.
8. Применение соединения по п.1 для использования в качестве лекарственного средства.
9. Применение соединения по п.8 для использования в качестве антипсихотика.
10. Применение соединения по п.8 для использования в качестве лекарственного средства для лечения или предупреждения шизофрении, шизофреноподобного расстройства, шизоаффективного расстройства, бредового расстройства, короткого психотического расстройства, общего психотического расстройства, психотического расстройства вследствие общего соматического заболевания, психотического расстройства, индуцированного (лекарственными) веществами, недифференцированного психотического расстройства, психоза, связанного с деменцией, большого депрессивного расстройства, дистимического расстройства, предменструального дисфорического расстройства, недифференцированного депрессивного расстройства, биполярного расстройства I, биполярного расстройства II, циклотимического расстройства, недифференцированного биполярного расстройства, расстройства настроения вследствие общего медицинского состояния больного, расстройства настроения, индуцированного (лекарственными) веществами, недифференцированного расстройства настроения, генерализованного тревожного расстройства, обсессивно-компульсивного расстройства, панического расстройства, острого стрессового расстройства, посттравматического стрессового расстройства, умственной отсталости, общих расстройств психического развития, расстройства с дефицитом внимания, расстройства с дефицитом внимания/гиперактивностью, расстройств с агрессивным поведением, расстройств личности параноидного типа, расстройств личности шизоидного типа, расстройств личности шизотипического типа, расстройств, сопровождающихся тиками, синдрома Туретта, лекарственной (наркотической) зависимости, злоупотребления алкоголем или наркотиками, синдрома отмены лекарств (наркотиков), трихотилломании.
11. Способ получения соединения формулы (I)
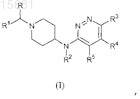
в котором R, R1-R5определены в п.1, причем этот способ включает:
(а) взаимодействие промежуточного соединения формулы (II)
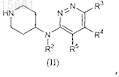
в котором R2-R5определены в п.1, с промежуточным соединением формулы R1-C(=O)-R, в котором R и R1определены в п.1, в присутствии восстанавливающего агента и кислого катализатора в инертном по отношению к реакционной смеси растворителе;
или (b) взаимодействие промежуточного продукта, соответствующего формуле (V)

в котором R3-R5определены в п.1, с промежуточным соединением формулы (VII)

в котором R, R1 и R2определены в п.1, в присутствии основания в инертном по отношению к реакционной смеси растворителе.
Текст
Дата публикации и выдачи патента Номер заявки ПРОИЗВОДНЫЕ ПИПЕРЕДИН-4-ИЛ-ПИРИДАЗИН-3-ИЛАМИНА КАК БЫСТРО ДИССОЦИИРУЮЩИЕ АНТАГОНИСТЫ РЕЦЕПТОРА ДОФАМИНА 2 Изобретение относится к соединениям, которые представляют собой быстродиссоциирующие антагонисты рецептора дофамина 2, к способам получения этих соединений и к фармацевтическим композициям, содержащим эти соединения в качестве активного ингредиента. Эти соединения находят полезное применение в качестве лекарственных средств для лечения или предупреждения заболеваний центральной нервной системы, например шизофрении, проявляя антипсихотический эффект без побочных моторных эффектов. Де Брюин Марсель Франс Леопольд,Макдональд Грегор Джеймс, Кенни Людо Эдмон Жозефин, Ланглуа Ксавье Жан Мишель, Ван Ден Кейбюс Франц Альфонс Мария, Ван Росбрук Ив Эмиль Мария (BE) Медведев В.Н. (RU) 015681 Область техники, к которой относится изобретение Настоящее изобретение относится к соединениям, которые представляют собой быстро диссоциирующие антагонисты рецепторов дофамина 2, к способам получения этих соединений и к фармацевтическим композициям, содержащим эти соединения в качестве активного ингредиента. Эти соединения находят применение в качестве лекарственных средств для лечения или предупреждения заболеваний центральной нервной системы, например шизофрении, проявляя антипсихотический эффект без побочных моторных эффектов. Известный уровень техники изобретения Публикация в J. Med. Chem. (1999), 42(4), 730-741 раскрывает 6-фенил-N-[1-(фенилметил)-4 пиперидинил]-3-пиридазинамин и аналогичные соединения как ингибиторы ацетилхолинэстеразы. Публикация в журнале Farmaco, том 35,11, 1980, стр. 951-964 раскрывает, что замещенные N-[4 пиперидинил]-2-аминопиримидины, обладающие дофаминергической активностью, т.е. большинство раскрытых соединений, являются агонистами рецептора дофамина D2. Поскольку ни одно из соединений при тестировании не проявляло антагонизма к стереотипному поведению, индуцированному последующей дозой апоморфина, их также можно рассматривать как вещества, лишенные свойства блокировать дофаминовый рецептор. Соединения, рассматриваемые в настоящем изобретении, отличаются присутствием пиридазина вместо пиримидина и неожиданным свойством антагонистического действия в отношении рецептор дофамина D2. Описание изобретения Шизофрения - это тяжелое и хроническое психическое заболевание, которым страдает приблизительно 1% населения. Клинические симптомы очевидны в относительно раннем возрасте и обычно проявляются у подростков или молодых людей. Симптомы шизофрении принято подразделять на так называемые позитивные (дополнительные), включая галлюцинации, бред и дезорганизованное мышление, и так называемые негативные (связанные с утратами), включая социальную самоизоляцию, включая обеднение эмоций, скупость речи и неспособность испытывать удовольствие. Кроме того, больные шизофренией страдают когнитивными (познавательными) нарушениями, такими как расстройство внимания и памяти. Этиология этого заболевания до сих пор неизвестна, однако существует предположение о том,что в основе симптомов шизофрении лежат нарушения действия нейротрансмиттеров. Одна из наиболее обоснованных и часто рассматриваемых дофаминергическая гипотеза построена на том предположении,что за позитивные симптомы, наблюдаемые у больных шизофренией, отвечает перенос дофамина. В основе этой гипотезы лежат наблюдение о том, что лекарства и наркотики, усиливающие действие дофамина, например, амфетамин или кокаин, могут индуцировать психоз, и существующая корреляция между клиническими дозами антипсихотиков и их мощностью в блокировании рецепторов дофамина D2. Терапевтическая эффективность всех выпущенных на фармацевтический рынок антипсихотиков против позитивных симптомов шизофрении опосредована блокированием рецептора дофамина D2. При выходе за рамки клинической эффективности оказывается, что основные побочные эффекты антипсихотиков, например экстрапирамидальные симптомы (EPS) и поздняя дискинезия, также связаны с антагонизмом к дофамину. Эти ослабляющие больных побочные эффекты чаще всего проявляются при использовании типичных антипсихотиков первого поколения, например галоперидола. Они выражены в меньшей степени при использовании атипичных антипсихотиков второго поколения, например рисперидона, оланзапина, и даже практически отсутствуют при лечении клозапином, который принято считать прототипом атипичных антипсихотиков. Среди разных теорий, предложенных для объяснения пониженной частотыEPS при лечении атипичными антипсихотиками, надо выделить мультирецепторную гипотезу, которая в последние пятнадцать лет привлекает к себе огромное внимание. Она вытекает из результатов исследований по рецепторному связыванию, в которых было показано, что многие атипичные антипсихотики помимо рецепторов дофамина D2 взаимодействуют с другими рецепторами нейротрансмиттеров, особенно с рецепторами серотонина 5-НТ 2, тогда как типичные антипсихотики вроде галоперидола более избирательно связываются с рецепторами D2. В последние годы эта теория поставлена под сомнение,поскольку все основные атипичные антипсихотики в клинически приемлемых дозах полностью занимают рецепторы серотонина 5-НТ 2, но все-таки отличаются друг от друга по индуцированию побочных моторных эффектов. В качестве альтернативы мультирецепторной гипотезе в статье Kapur и Seemanhypothesis", Am. J. Psychiatry 2001, 158:3 p.360-369) было выдвинуто предположение о том, что атипичные антипсихотики могут отличаться от типичных антипсихотиков по скорости, с которой они отсоединяются от рецепторов дофамина D2. Быстрая диссоциация с рецептором D2 делает антипсихотики более приспособленными к физиологическому переносу дофамина, т.е. создает потенциал для реализации антипсихотического эффекта без побочных моторных эффектов. Эта гипотеза выглядит особенно убедительно при рассмотрении клозапина и кветиапина. Для этих двух лекарственных средств характерна самая высокая скорость диссоциации с рецепторами дофамина D2, и они сопряжены с самым низким риском индуцирования EPS у человека. И наоборот, типичные антипсихотики, проявляющие статистическую ассоциацию с высокой частотой EPS, являются наиболее медленно диссоциирующими антагонистами рецептора дофамина D2. Следовательно, идентификация новых лекарственных средств, основан-1 015681 ная на скорости их диссоциации с рецептором D2, представляется надежной перспективной стратегией для создания новых атипичных антипсихотиков. Дополнительная цель поиска заключается в комбинировании свойств быстрой диссоциации с избирательностью к рецепторам D2. Считается, что многорецепторный профиль современных атипичных антипсихотиков служит причиной других побочных эффектов,например прибавки веса и развития сахарного диабета. Поиск селективных антагонистов D2 некоторое время игнорировался в качестве подхода, но авторы изобретения убеждены в том, что применение в клинике более селективных (к этим рецепторам) соединений поможет снизить частоту метаболических расстройств, связанных с современными атипичными антипсихотическими лекарственными средствами. Задача настоящего изобретения заключается в том, чтобы предложить новые соединения, представляющие собой быстро диссоциирующие антагонисты рецептора дофамина D2, для которых характерен благоприятный фармакологический профиль (это объяснялось выше), особенно пониженный уровень побочных моторных эффектов и умеренно выраженные или пренебрежимо малые взаимодействия с другими рецепторами, что приводит к низкому риску развития метаболических расстройств. Поставленная задача решается представленными здесь новыми соединениями, которые соответствуют формуле (I) их фармацевтически приемлемыми солями, гидратами и сольватами, а также их стереоизомерными формами, гдеR означает водород или С 1-6 алкил;R1 означает фенил; фенил, замещенный 1, 2 или 3 заместителями, каждый из которых независимо от других выбирается из группы, состоящей из водорода, галогена, циано, С 1-4 алкила, С 1-4 алкилокси, перфторС 1-4 алкила, диС 1-4 алкиламино; тиенил, замещенный 1 или 2 заместителями, выбранными из группы,которая состоит из галогена и С 1-4 алкила; С 3-8 циклоалкил или С 5-7 циклоалкенил;R2 означает водород или C1-6 алкил;R3 означает галоген, С 1-4 алкил или перфторС 1-4 алкил, а R4 и R5, каждый, означают независимо друг от друга водород или галоген. Согласно изобретению указанные соединения являются быстро диссоциирующими антагонистами рецептора D2, активность которых не приписывается ни каким-либо производным 6-фенил-N-[4 пиперидинил]-3-пиридазинамина, описанным в J. Med. Chem. (1999), 42 (4), 730-741, ни каким-либо замещенным N-[4-пиперидинил]-2-аминопиримидинам, описанным в Farmaco, том 35,11, 1980, стр. 951-964. Согласно изобретению это свойство делает указанные соединения особенно пригодными для медицинского применения в целях лечения или профилактики шизофрении, шизофреноподобного расстройства, шизоаффективного расстройства, бредового расстройства, короткого психотического расстройства, общего психотического расстройства, психотического расстройства вследствие общего медицинского состояния больного, психотического расстройства, индуцированного веществами (лекарственными), недифференцированного психотического расстройства, психоза, связанного с деменцией, большого депрессивного расстройства, дистимического расстройства, предменструального дисфорического расстройства, недифференцированного депрессивного расстройства, биполярного расстройства I, биполярного расстройства II, циклотимического расстройства, недифференцированного биполярного расстройства, расстройства настроения вследствие общего медицинского состояния больного, расстройства настроения, индуцированного (лекарственными) веществами, недифференцированного расстройства настроения, генерализованного тревожного расстройства, обсессивно-компульсивного расстройства, панического расстройства, острого стрессового расстройства, посттравматического стрессового расстройства,умственной отсталости, общих расстройств психического развития, расстройства с дефицитом внимания,расстройства с дефицитом внимания/гиперактивностью, расстройств с агрессивным поведением, расстройств личности параноидного типа, расстройств личности шизоидного типа, расстройств личности шизотипического типа, расстройств, сопровождающихся тиками, синдрома Туретта, лекарственной (наркотической) зависимости, злоупотребления алкоголем или наркотиками, синдрома отмены лекарств(наркотиков), трихотилломании. Опытный специалист может осуществить выбор соединений, основываясь на экспериментальных данных, которые представлены ниже в экспериментальной части. Любой выбор соединений проводится в пределах понятий, охваченных настоящим изобретением. Например, изобретение в особой степени относится к соединениям, соответствующим формуле (I),в которых R3 означает трифторметил, a R, R4 и R5 означают водород. Другие представляющие интерес соединения, описанные формулой (I), - это вещества, в которых радикал R2 представлен водородом или метилом.-2 015681 Особый интерес представляют соединения, описанные формулой (I), в которых R1 означает 4 фторфенил или 3,4-дифторфенил. Среди соединений, описанных формулой (I), наибольший интерес представляют N-[1-(4 фторбензил)пиперидин-4-ил]-6-(трифторметил)пиридазин-3-амин и N-[1-(3,4-дифторбензил)пиперидин 4-ил]-6-(трифторметил)пиридазин-3-амин. Во всем тексте этой заявки термин "С 1-4 алкил", если он использован изолированно или в таких сочетаниях как "C1-4 алкилокси", "перфторС 1-4 алкил", "диС 1-4 алкиламино", включает, например, метил, этил,пропил, бутил, 1-метилпропил, 1,1-диметилэтил; термин "С 1-6 алкил" включает метил, этил, пропил, бутил, 1-метилпропил, 1,1-диметилэтил, пентил и гексил; термин "перфторС 1-4 алкил" включает, например,трифторметил, пентафторэтил, гептафторпропил и нонафторбутил; термин "С 3-8 циклоалкил" включает циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил; термин "С 57 циклоалкенил" включает циклопентенил, циклогексенил и циклогептенил. Фармацевтически приемлемые соли определяют по содержанию терапевтически активных и нетоксичных добавочных солевых форм, которые способны образовывать соединения, описанные формулой(I). Указанные соли можно получить, обрабатывая базисную форму соединений, описанных формулой(I), соответствующими кислотами, например неорганическими кислотами, например галоген-водородной кислотой, особенно соляной кислотой, бромисто-водородной кислотой, серной кислотой, азотной кислотой и фосфорной кислотой, а также органическими кислотами, например уксусной кислотой, гидроксиуксусной кислотой, пропионовой кислотой, молочной кислотой, пировиноградной кислотой, щавелевой кислотой, малоновой кислотой, янтарной кислотой, малеиновой кислотой, миндальной кислотой, фумаровой кислотой, яблочной кислотой, винной кислотой, лимонной кислотой, метансульфоновой кислотой,этансульфоновой кислотой, бензолсульфоновой кислотой, п-толуолсульфоновой кислотой, цикламовой кислотой, салициловой кислотой, п-аминосалициловой кислотой, памовой кислотой и миндальной кислотой. И наоборот, указанные солевые формы можно преобразовать в свободные формы при их обработке соответствующим основанием. Термин сольваты относится к гидратам и алкоголятам, которые могут образовывать соединения,описанные формулой (I). Термин "стереохимически изомерные формы" при использовании в этом документе означает все возможные изомерные формы соединений, описанных формулой (I). Если нет других упоминаний или указаний, то химическое название соединений означает смесь всех возможных стереохимически изомерных форм, причем такие смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры. Предпочтительно стереогенные центры могут иметь R- или S-конфигурацию, а замещающие группы двухвалентных циклических (частично) насыщенных радикалов могут иметь цис- или трансконфигурацию. Соединения с внутренними двойными связями могут иметь в указанных двойных связях Е- или Z-стереохимию. В сферу этого изобретения входят все стереохимически изомерные формы соединений, описанных формулой (I). Соединения, описанные формулой (I) и полученные в описанных ниже процессах, могут быть синтезированы в виде рацемических смесей или энантиомеров, которые можно отделять друг от друга с помощью известных в данной области знаний методов разделения. Рацемические соединения, описанные формулой (I), могут быть преобразованы в соответствующие диастереомерные солевые формы при помощи реакции с соответствующей хиральной кислотой. Указанные диастереомерные солевые формы впоследствии разделяют, например, селективной или фракционной кристаллизацией, а энантиомеры высвобождают оттуда при помощи щелочей. Альтернативный способ разделения энантиомерных форм соединений, описанных формулой (I), включает жидкостную хроматографию с применением хиральной стационарной фазы. Указанные чистые стереохимически изомерные формы можно также получать из соответствующих чистых стереохимически изомерных форм подходящих исходных материалов при условии, что реакция проходит стереоспецифически. Предпочтительно, если нужен специфический стереоизомер, то указанное соединение следует синтезировать, используя стереоспецифические способы изготовления. В этих способах преимущественно используются энантиомерически чистые исходные материалы. Фармакология Для того чтобы найти антипсихотические соединения, активные против позитивных симптомов шизофрении и обладающие улучшенным профилем безопасности (низкой частотой EPS и отсутствием метаболических расстройств), авторы изобретения провели скрининг в группе соединений, избирательно взаимодействующих с рецептором дофамина D2 и быстро отсоединяющихся от этого рецептора. Соединения были, прежде всего, скринированы на их аффинность к D2 в анализе связывания с использованием[3 Н]спиперона и рецепторов клеточных мембран человека D2L. Соединения, демонстрирующие IC50 менее 1 мкМ, для оценки скорости их диссоциации были протестированы в непрямом анализе, адаптированном к нашим целям, исходя из методики, описанной в публикации Josee E. Leysen and Walter Gommeren, Journal of Receptor Research, 1984, 4(7), 817-845. Далее испытуемые соединения были скринированы в панели, которая состояла более чем из 50 распространенных рецепторов, связывающихся с G-протеином (CEREP), и продемонстрировали ровный-3 015681 профиль с низкой аффинностью к этим рецепторам. Некоторые соединения были дополнительно протестированы в моделях in vivo, например в "тесте на собаках с индуцированной апоморфином рвотой", в "тесте с апоморфином на крысах", и продемонстрировали биологическую доступность при пероральном поступлении в организм. Из вышеупомянутых фармакологических свойств соединений, описанных формулой (I), следует,что они пригодны для использования в качестве лекарственных средств, особенно антипсихотических. В более специфичном понимании указанные соединения пригодны для медицинского применения в целях лечения или предупреждения шизофрении, шизофреноподобного расстройства, шизоаффективного расстройства, бредового расстройства, короткого психотического расстройства, общего психотического расстройства, психотического расстройства вследствие общего соматического заболевания, психотического расстройства, индуцированного (лекарственными) веществами, недифференцированного психотического расстройства, психоза, связанного с деменцией, большого депрессивного расстройства, дистимического расстройства, предменструального дисфорического расстройства, недифференцированного депрессивного расстройства, биполярного расстройства I, биполярного расстройства II, циклотимического расстройства, недифференцированного биполярного расстройства, расстройства настроения вследствие общего медицинского состояния больного, расстройства настроения, индуцированного (лекарственными) веществами, недифференцированного расстройства настроения, генерализованного тревожного расстройства,обсессивно-компульсивного расстройства, панического расстройства, острого стрессового расстройства,посттравматического стрессового расстройства, умственной отсталости, общих расстройств психического развития, расстройства с дефицитом внимания, расстройства с дефицитом внимания/гиперактивностью, расстройств с агрессивным поведением, расстройств личности параноидного типа, расстройств личности шизоидного типа, расстройств личности шизотипического типа, расстройств, сопровождающихся тиками, синдрома Туретта, лекарственной (наркотической) зависимости, злоупотребления алкоголем или наркотиками, синдрома отмены лекарств (наркотиков), трихотилломании. Для оптимизации лечения больных, страдающих упомянутыми в предыдущем параграфе заболеваниями, соединения, описанные формулой (I), можно применять вместе с другими психотропными соединениями. Таким образом, применительно к шизофрении, лечение можно направить также на негативные и когнитивные симптомы. Настоящее изобретение также предлагает способ лечения теплокровных животных, страдающих такими заболеваниями, причем указанный способ включает системное введение терапевтического количества соединения, описанного формулой (I), которое эффективно для лечения вышеописанных заболеваний. Настоящее изобретение также относится к применению соединений, описанных формулой (I), как это было определено выше, для приготовления лекарственных средств, особенно антипсихотических лекарственных средств, в более специфичном понимании лекарственных средств для лечения или предупреждения шизофрении, шизофреноподобного расстройства, шизоаффективного расстройства, бредового расстройства, короткого психотического расстройства, общего психотического расстройства, психотического расстройства вследствие общего соматического заболевания, психотического расстройства,индуцированного (лекарственными) веществами, недифференцированного психотического расстройства,психоза, связанного с деменцией, большого депрессивного расстройства, дистимического расстройства,предменструального дисфорического расстройства, недифференцированного депрессивного расстройства, биполярного расстройства I, биполярного расстройства II, циклотимического расстройства, недифференцированного биполярного расстройства, расстройства настроения вследствие общего медицинского состояния больного, расстройства настроения, индуцированного (лекарственными) веществами, недифференцированного расстройства настроения, генерализованного тревожного расстройства, обсессивно-компульсивного расстройства, панического расстройства, острого стрессового расстройства, посттравматического стрессового расстройства, умственной отсталости, общих расстройств психического развития, расстройства с дефицитом внимания, расстройства с дефицитом внимания/гиперактивностью,расстройств с агрессивным поведением, расстройств личности параноидного типа, расстройств личности шизоидного типа, расстройств личности шизотипического типа, расстройств, сопровождающихся тиками, синдрома Туретта, лекарственной (наркотической) зависимости, злоупотребления алкоголем или наркотиками, синдрома отмены лекарств (наркотиков), трихотилломании. Специалисты, имеющие опыт в лечении указанных заболеваний, могут определить ежедневное терапевтически эффективное количество таких лекарств, опираясь на результаты описанных ниже обследований. Ежедневное терапевтически эффективное количество обычно составляет от приблизительно 0,01 мг/кг до приблизительно 10 мг/кг веса тела, предпочтительнее от приблизительно 0,05 мг/кг до приблизительно 1 мг/кг веса тела. Изобретение также относится к фармацевтическим композициям, содержащим фармацевтически приемлемый носитель, а также в качестве активного ингредиента терапевтически эффективное количество соединения, соответствующего формуле (I). Для простоты применения соединения, являющиеся предметом изобретения, могут быть представлены в различных фармацевтических формах (в целях введения). Соединения, рассматриваемые изобре-4 015681 тением, особенно соединения, соответствующие формуле (I), их фармацевтически приемлемые дополнительные кислые или щелочные соли, их стереохимически изомерные формы, их N-оксидные формы и их пролекарственные предшественники или любая их подгруппа либо комбинация могут быть представлены в различных фармацевтических формах (в целях введения). В качестве подходящих композиций можно сослаться на все композиции, обычно применяемые для системного введения лекарств. Для приготовления фармацевтических композиций, соответствующих этому изобретению, эффективное количество конкретного соединения, необязательно в форме соли, в качестве активного ингредиента объединяют с фармацевтически приемлемым носителем, причем такой носитель может быть представлен широким спектром веществ в зависимости от нужной формы препарата и способа его введения. Желательно,чтобы эти фармацевтические композиции были доступны в стандартных дозированных формах, в частности для перорального, ректального, чрескожного, парентерального (инъекционного) или ингаляционного введения. Например, при изготовлении композиций в пероральной дозированной форме можно использовать любые обычно применяемые фармацевтические среды, такие как, например, вода, гликоли,масла, спирты и т.п. (в случае жидких препаратов, например суспензий, сиропов, эликсиров, эмульсий и растворов), или твердые носители, например крахмалы, сахара, каолин, растворители, скользящие вещества, связующие вещества, распадающиеся агенты и т.п. (в случае порошков, пилюль, капсул и таблеток). В связи с простотой введения таблетки и капсулы представляют собой наиболее преимущественные стандартные дозированные формы для перорального применения, для которых очевидно применимы твердые фармацевтические носители. Носитель для парентеральных композиций обычно содержит стерильную воду, составляющую, по меньшей мере, его основной объем, хотя, например, для усиления растворимости могут быть включены и другие ингредиенты. Например, можно приготовить инъекционные растворы, в которых носитель содержит солевой (физиологический) раствор, раствор глюкозы или смесь этих растворов. Например, можно приготовить инъекционные растворы, в которых носитель содержит солевой (физиологический) раствор, раствор глюкозы или смесь этих растворов. Инъекционные растворы, содержащие соединения, описанные формулой (I), могут быть приготовлены в масляной форме (для пролонгированного действия). Подходящими маслами для этой цели являются, например, арахисовое масло, кунжутное масло, хлопковое масло, кукурузное масло, соевое масло, синтетические глицериновые эфиры длинноцепочечных жирных кислот, их смеси, а также другие масла. Можно также изготовить инъекционные суспензии, для которых используются подходящие жидкие носители, суспендирующие агенты и подобные им вещества. Сюда же можно отнести препараты в твердой форме, которые предназначены для преобразования в жидкие препараты непосредственно перед применением. В композициях, пригодных для чрескожного введения, носитель по выбору содержит средство, усиливающее проникновение лекарства, и/или подходящий смачивающий агент, которые по выбору можно комбинировать с подходящими добавками любого происхождения, используемыми в небольшом количестве, которые не наносят существенного вреда коже. Указанные добавки могут облегчать введение лекарственного средства через кожу и/или могут быть полезными для приготовления желательных композиций. Такие композиции можно вводить разными способами, например через трансдермальный пластырь, точечную накладку (spot-on) или кожную мазь. Кислые или щелочные дополнительные соли соединений, описанных формулой (I), вследствие их повышенной водорастворимости по сравнению с исходной кислой или щелочной формой более пригодны для приготовления водных композиций. Особенно полезно составлять вышеупомянутые фармацевтические композиции в стандартной дозированной форме для простоты введения и единообразия доз. Стандартная дозированная форма при использовании в этом тексте означает физически дискретные единицы лекарства, изготовленные с его стандартной дозой, т.е. каждая единица препарата содержит заранее определенное количество активного ингредиента, рассчитанное таким образом, чтобы произвести желательный лечебный эффект (в сочетании с необходимым фармацевтическим носителем). Примерами таких стандартных дозированных форм являются таблетки (включая рифленые или покрытые оболочкой), капсулы, пилюли, пакетики с порошками, облатки, суппозитории, инъекционные растворы или суспензии и т.п., а также их разделенные на порции комбинации. Поскольку соединения, предлагаемые изобретением, принадлежат к разряду соединений, проявляющих мощный эффект при пероральном введении, особенно полезны фармацевтические композиции,содержащие указанные соединения, которые предназначены именно для перорального введения. Для того чтобы усилить растворимость и/или стабильность соединений, описанных формулой (I), в фармацевтических композициях полезно использовать альфа-, бета- или гамма-циклодекстрины или их производные, особенно гидроксиалкилзамещенные циклодекстрины, например 2-гидроксипропил-бетациклодекстрин. Кроме того, растворимость и/или стабильность соединений, предлагаемых изобретением, в фармацевтических композициях можно улучшить вспомогательными (добавочными) растворителями, например спиртами. где R, R1, R2, R3, R4 и R5, определены выше, были получены взаимодействием промежуточного соединения формулы (II), где R2, R3, R4 и R5 имеют значения, указанные для формулы (I), с промежуточным соединением формулы R1-C(=O)-R, где R и R1 были определены выше, в присутствии подходящего восстанавливающего агента, например триацетоксиборогидрида натрия, подходящего кислого катализатора, например уксусной кислоты, в подходящем инертном к реакционной среде растворителе, например 1,2 дихлорэтане. Промежуточные продукты, соответствующие формуле (II), были получены в результате реакции защищенного производного пиперидина, соответствующего формуле (IV) где Р представляет подходящую защитную группу, например трет-бутилоксикарбонил, с 3 хлорпиридазином по формуле (V) в присутствии подходящего катализатора, например йодистого калия, в подходящих для реакции условиях, например в расплавленном состоянии, с последующим снятием защиты в защитной группе на промежуточном этапе (VI) в подходящих условиях, например в соляной кислоте с метанолом для трет-бутилоксикарбонильной группы. Промежуточные продукты, соответствующие формуле (V), можно приобрести или получить самостоятельно на основе процедур, аналогичных описанным в химической литературе (для R3=CF3, см. Tetrahedron, 1999, 55 (52), 15067-15070). Соединения, соответствующие формуле (I), можно также получить путем взаимодействия 3 хлорпиридазина (формула V) с производным пиперидина (формула VII) в присутствии подходящего основания, например диизопропиламина, в подходящем растворителе,например в алканоле (в частности, в 1-бутаноле), при повышенной температуре. Промежуточные соединения, соответствующие формуле (VII), были получены в результате реакции 4,4-этилендиоксипиперидина (VIII) с промежуточным продуктом по формуле R1-C(=O)-R в присутствии подходящего восстанавливающего агента, например триацетоксиборогидрида натрия, подходящего кислого катализатора, например уксусной кислоты, в подходящем инертном по отношению к реакционной-6 015681 среде растворителе, например 1,2-дихлорэтане. С полученного в результате этой реакции промежуточного продукта по формуле (IX) была снята защита при его обработке кислотой, например соляной, с получением следующего промежуточного продукта по формуле (X) который затем реагирует с амином, имеющим формулу R2-NH2 (XI), в присутствии подходящего восстанавливающего агента, например водорода, подходящего катализатора, например палладия или углерода, в подходящем инертном к реакционной среде растворителе, например в этаноле. Промежуточные продукты соответствуют формуле (II), в которой R5 означает хлор, и были получены в результате реакции пиперидина (формула XII) где радикал R3 был определен ранее, в присутствии подходящего основания, например гидрида натрия, в апротонном растворителе, например в диметилформамиде, с последующим снятием защиты с защитной группы в промежуточном продукте (формула VI) при наличии подходящих условий, например в соляной кислоте с метанолом для трет-бутилоксикарбонильной группы. Промежуточные продукты (формула XIII) можно получить из пиридазинов (формула V) посредством аминирования и последующего галогенирования. Экспериментальная часть Химия Конечную очистку в примерах (Е 1-Е 45) проводили или колоночной хроматографией на силикагеле с использованием описанного элюента, или обращенно-фазовой препаративной ВЭЖХ (HPLC) в колонкеHyperprep RP 18 BDS (Shandon) (8 мкм, 200 мм, 250 г). Для запуска градиентного метода были использованы три мобильные фазы (мобильная фаза А: 90% 0,5% ацетата аммония +10% ацетонитрила; мобильная фаза В: метанол; мобильная фаза С: ацетонитрил), начиная с 75% А и 25% В при скорости потока 40 мл/мин, с задержкой на 0,5 мин в тех же условиях, последующим увеличением скорости потока до 80 мл/мин в течение 0,01 мин, до 50% В и 50% С в течение 41 мин, до 100% С в течение 20 мин с задержкой этих условий на 4 мин. Спектры 1 Н были записаны спектрометром Bruker DPX 360. Химические сдвиги выражали в м.д. по отношению к тетраметилсилану. Описание 1. трет-Бутил-4-[6-(трифторметил)пиридазин-3-ил]аминопиперидин-1-карбоксилат (D1). Смесь 3-хлор-6-трифторметилпиридазина (4,4 г, 24,1 ммоль) (приготовленного по процедуре, аналогичной описанию в Tetrahedron, 1999, 55 (52), 15067-15070), 4-амино-1-трет-бутилоксикарбонилпиперидина (9,63 г, 48,1 ммоль) и йодистого калия (кат.) нагревали в расплавленном состоянии при 150 С в течение 30 мин. По истечении этого времени реакционную смесь разбавляли водой и экстрагировали дихлорметаном. Органический слой отделяли и высушивали, выпаривая растворитель в вакууме. Неочищенный продукт очищали хроматографией (кремнезем; 1-4% аммиака в метаноле (7 М)/дихлорметане), получая D1 (7,06 г, 85%). Рассчитано для C15H21F3N4O2 346; найдено 347 (МН+). Раствор D1 (7,06 г, 20,4 ммоль) и соляной кислоты/изопропанола (6 Н, 100 мл) в метаноле (100 мл) перемешивали при комнатной температуре в течение 2 ч. По истечении этого времени растворители выпаривали в вакууме, а остаток растирали в порошок с ацетонитрилом. Твердый продукт отфильтровывали и высушивали, получая D2 в виде дигидрохлоридной соли (6,05 г, 95%). Рассчитано для C10H13F3N4 246; найдено 247 (МН+). Дигидрохлоридная соль (D2) была или непосредственно использована в последующем приготовлении соединений, или альтернативно преобразована в свободное основание перед практическим применением. Свободное основание получали, растворяя дигидрохлоридную соль в воде, превращая ее в основание карбонатом натрия и экстрагируя дихлорметаном. После высушивания (MgSO4) растворители выпаривали в вакууме, получая свободное основание (D2a). Описание 3. 8-(3,4-Дифторбензил)-1,4-диокса-8-азаспиро [4.5]декан (D3). Раствор 3,4-дифторбензальдегида (4,40 г, 30,9 ммоль), 4,4-этилендиоксипиперидина (4,40 г, 30,9 ммоль), триацетоксиборогидрида натрия (6,40 г, 30,2 ммоль) и уксусной кислоты (1,8 г, 30,0 ммоль) в дихлорэтане (200 мл) перемешивали при комнатной температуре в течение 18 ч. По истечении этого времени реакционную смесь отмывали 1 Н гидроксидом натрия. Органический слой отделяли, высушивали (MgSO4), а растворители выпаривали в вакууме, получая D3 (7,9 г, 98%). Рассчитано для Раствор D3 (7,9 г, 29,4 ммоль) в соляной кислоте (5 Н, 150 мл) нагревали при 50 С в течение 2 ч. По истечении этого времени реакционную смесь отмывали диизопропиловым эфиром (100 мл), а затем насыщенным раствором бикарбоната натрия (100 мл). Затем смесь экстрагировали дихлорметаном, экстракты высушивали (MgSO4), а растворители выпаривали в вакууме, получая D4 (5,4 г, 82%). Рассчитано для C15H13F2NO 225; найдено 226 (МН+). Описание 5. 1-(3,4-Дифторбензил)-N-метилпиперидин-4-амин (D5). Суспензию D4 (5,4 г, 24 ммоль), раствор тиофена (4% в диизопропиловом эфире, 2 мл), раствор метиламина (40% в воде, 10 мл) и 10% палладий на угле (2 г) в метаноле (150 мл) гидрогенизировали при атмосферном давлении и температуре окружающего воздуха до насыщения 1 экв. (600 мл) водорода. По истечении этого времени реакционную смесь фильтровали, а фильтрат выпаривали в вакууме. Неочищенный продукт очищали колоночной хроматографией (кремнезем; 5-10% аммиака в метаноле/дихлорметане), получая D5 (4,7 г, 81%). Рассчитано для C13H18F2N2 240; найдено 241 (МН+). Описание 6. 6-Трифторметил-3-пиридазинамин (D6). Смесь 3-хлор-6-трифторметилпиридазина (1,6 г, 8,8 ммоль) (приготовленного по процедуре, аналогичной описанию в Tetrahedron, 1999, 55 (52), 15067-15070) и гидроксида аммония (30 мл) в ТГФ (10 мл) нагревали при 100 С в микроволновом реакторе (Emrys Optimizer, 0-9 Barr) в течение 1 ч. По истечении этого времени реакционную смесь выпаривали, а остаток экстрагировали дихлорметаном. Объединенные экстракты высушивали (MgSO4), фильтровали, а растворители выпаривали в вакууме, получая D6 (1,3 г,93%). Рассчитано для C5H4F3N3 163; найдено 164 (МН+). Описание 7. 4-Хлор-6-трифторметил-3-пиридазинамин (D7). Смесь D6 (4,0 г, 24,5 ммоль) и N-хлорсукцинимида (3,3 г, 24,5 ммоль) в ацетонитриле (160 мл) нагревали при 70 С в течение 18 ч. По истечении этого времени реакцию охлаждали до комнатной темпе-8 015681 ратуры, а растворители выпаривали в вакууме. Неочищенный остаток очищали колоночной хроматографией (кремнезем; 3-5% метанола/дихлорметана), получая D7 (1,6 г, 33%). Рассчитано для C5H3ClF3N3 197; найдено 198(МН+). Описание 8. трет-Бутил 4-[4-хлор-6-(трифторметил)пиридазин-3-ил]аминопиперидин-1-карбоксилат (D8). К перемешанному раствору D7 (1,6 г, 8,1 ммоль) в диметилформамиде (50 мл) при 0 С под азотом добавляли NaH (60% в масле, 390 мг, 8,1 ммоль) порциями. Реакционную смесь перемешивали в течение 1 часа, после чего по каплям добавляли трет-бутиловый эфир 4-(толуол-4-сульфонилокси)-пиперидин-1 карбоновой кислоты (2,9 г, 8,1 ммоль), растворенный в диметилформамиде (10 мл). Затем реакционную смесь нагревали в диапазоне температур 80-90 С в течение 6 ч. После охлаждения до комнатной температуры растворители выпаривали в вакууме. Остаток растворяли в дихлорметане и отмывали водой. Органический слой высушивали (MgSO4), фильтровали, а растворители выпаривали в вакууме. Неочищенный продукт очищали колоночной хроматографией (силикагель; 3% метанола в дихлорметане), получая Раствор D8 (1,1 г, 2,9 ммоль) и соляной кислоты/изопропанола (6 Н, 20 мл) в метаноле (100 мл) перемешивали при комнатной температуре в течение 18 ч. По истечении этого времени реакционную смесь выпаривали в вакууме, остаток повторно растворяли в метаноле, и раствор подщелачивали метаноловым аммиаком. Реакционную смесь концентрировали в вакууме, а остаток очищали колоночной хроматографией (силикагель; 5-15% метанолового аммиака в дихлорметане), получая D9 (70 мг, 9%). Рассчитано для C10H12ClF3N4 280; найдено 281 (МН+). Пример 1. N-[1-(3,4-Дифторбензил)пиперидин-4-ил]-6-(трифторметил)пиридазин-3-амин (Е 1). К перемешанному раствору D2a (2,61 г, 10,6 ммоль) и уксусной кислоты (0,64 г, 10,6 ммоль) в дихлорэтане (200 мл) добавляли 3,4-дифторбензальдегид (1,52 г, 10,6 ммоль) и триацетоксиборогидрид натрия (2,24 г, 10,6 ммоль) при комнатной температуре. После перемешивания в течение 18 ч реакционную смесь гасили 1 Н гидроксидом натрия, органический слой удаляли, высушивали, а растворители выпаривали в вакууме. Неочищенный продукт очищали хроматографией (кремнезем, 2-5% аммиака в метаноле(1,37 г, 10,6 ммоль) и триацетоксиборогидрида на смоле (Argonaut Technologies, 2,2 ммоль/г; 3 экв.) в дихлорэтане (10 мл) перемешивали при комнатной температуре в течение 18 ч. По истечении этого времени реакционную смесь фильтровали, а растворители выпаривали в вакууме. Неочищенный продукт очищали хроматографией (кремнезем, 2-6% аммиака в метаноле (7 М)/дихлорметане, получая Е 2 (0,79 г,42%). Рассчитано для C17H18F4N4 354; найдено 355 (МН+); т. пл.: 163,3-165,3 С. 1H ЯМР (DMSO-D6)1,48 (кв., J=10,8 Гц, 2 Н), 1,95 (ушир.д, J=12,5 Гц, 2 Н), 2,09 (т, J=11,1 Гц, 2 Н), 2,78 (ушир.д, J=11,3 Гц, 2 Н),3,47 (с, 2 Н), 3,89 (ушир.с, 1 Н), 6,94 (д, J=9,4 Гц, 1 Н), 7,15 (т, J=8,8 Гц, 2 Н), 7,34 (дд, J=8,3, 5,7 Гц, 2 Н),7,53 (ушир.д, J=7,3 Гц, 1 Н), 7,63 (д, J=9,4 Гц, 1 Н). Пример 12. N-[1-(3,4-Дифторбензил)пиперидин-4-ил]-N-метил-6-(трифторметил)пиридазин-3-аминOptimizer, 0-9 Barr) в течение 2 ч. По истечении этого времени реакционную смесь выпаривали в вакууме, а остаток экстрагировали дихлорметаном. Органический слой отмывали насыщенным раствором бикарбоната натрия, высушивали (MgSO4), а растворители выпаривали в вакууме. Очищение обращеннофазовой ВЭЖХ (HPLC) в условиях, которые были описаны выше, давало Е 12 (210 мг, 54%). Рассчитано для C18H19F5N4 386; найдено 387 (МН+). 1H ЯМР (CDCl3)1,74 (ушир.д, J=12,0 Гц, 2 Н), 1,88 (кв.д, J=12,0,3,9 Гц, 2 Н), 2,17 (тд, J=11,8, 2,5 Гц, 2 Н), 2,96 (ушир.д, J=11,6 Гц, 2 Н), 3,00 (с, 3 Н), 3,47 (с, 2 Н), 4,85 (т,J=12,1 Гц, 1 Н), 6,78 (д, J=9, б Гц, 1 Н), 6,99-7,05 (м, 1 Н), 7,10 (дт, J=10,2, 8,1 Гц, 1 Н), 7,20 (ддд, J=11,4, 7,8,2,1 Гц, 1 Н), 7,46 (д, J=9,6 Гц, 1 Н). Пример 16. N-[1-(4-Хлорбензил)пиперидин-4-ил]-6-хлорпиридазин-3-амин (Е 16).Optimizer; 0-9 Barr) в течение 40 мин. По истечении этого времени реакционную смесь разбавляли водой и экстрагировали дихлорметаном. Органический слой высушивали (MgSO4), фильтровали, а растворители выпаривали в вакууме. Очищение обращенно-фазовой ВЭЖХ (HPLC) в условиях, которые были описаны выше, давало Е 16 (228 мг, 15%). Рассчитано для C16H18Cl2N4 336; найдено 337 (МН+). 1H ЯМР (360 МГц, CDCl3)1,52 (кв.д, J=11,5, 3,5 Гц, 2 Н), 2,08 (д, J=12,5 Гц, 2 Н), 2,16 (т, J=11,3 Гц, 2 Н), 2,82 (д, J=11,5 Гц, 2 Н), 3,48 (с, 2 Н), 3,77-3,87 (м, 1 Н), 4,55 (д, J=7,8 Гц, 1 Н), 6,59 (д, J=9,3 Гц, 1 Н), 7,14 (д, 7=9,3 Гц, 1 Н),7,25 (д, J=7,7 Гц, 2H), 7,29 (д, J=7,7 Гц, 2 Н). Пример 45. (R,S)-N-[1-(3,4-дифторметилбензил)пиперидин-4-ил]-6-(трифторметил)пиридазин-3 амин (E45). Раствор D2a (123 мг, 0,5 ммоль), 3,4-дифторацетофенона (186 мг, 1,25 ммоль) и изопропоксида титана (875 мг, 3 ммоль) перемешивали при комнатной температуре в течение 1 ч, после чего добавляли этанол (0,7 мл), а реакционную смесь продолжали перемешивать еще 1 ч. По истечении этого времени добавляли цианоборогидрид натрия (68 мг, 1,1 ммоль), а реакционную смесь перемешивали при комнатной температуре в течение ночи. Затем реакционную смесь разводили дихлорэтаном (30 мл), добавляли воду (1 мл), смесь перемешивали и фильтровали. Фильтрат выпаривали в вакууме, а остаток еще раз растворяли в дихлорметане (30 мл), отмывали 10% раствором карбоната натрия и высушивали (MgSO4). Смесь фильтровали, а растворитель выпаривали в вакууме. Очищение обращенно-фазовой ВЭЖХ(HPLC) в условиях, которые были описаны выше, давало Е 45 (106 мг, 55%). Рассчитано для C18H20F4N4 368; найдено 369 (МН+). 1 Н ЯМР (360 МГц, CDCl3)1,33 (д, J=6,7 Гц, 3 Н), 1,45-1,62 (м, 2 Н), 2,00-2,08 (м,1 Н), 2,09-2,21 (м, 3 Н), 2,70-2,78 (м, 1 Н), 2,90-3,00 (м, 1 Н), 3, 42 (кв., J=6,7 Гц, 1 Н), 3,85 (ушир.с, 1 Н), 4,97(д, J=7,3 Гц, 1 Н), 6,65 (д, J=9,3 Гц, 1 Н), 6,99-7,05 (м, 1 Н), 7,09 (дт, J=10,l, 8,2 Гц, 1 Н), 7,18 (ддд, J=11,7,7,8, 2,1 Гц, 1 Н), 7,42 (д, J=9,3 Гц, 1 Н). Следующие образцы (Е 3-Е 11) были приготовлены из D2 или D2a и соответствующего бензальдегида по процедуре, аналогичной примерам 1 и 2. Образцы (Е 13-Е 14) были приготовлены из соответствующего бензальдегида по процедуре, аналогичной примеру 12. Следующие образцы (Е 15-Е 39) были приготовлены по процедурам, сходным с приведенными в описаниях 1-5, а также примерах 1, 2, 12 и 16. Следующий образец (Е 40) был приготовлен по процедурам, сходным с приведенными в описаниях 1-5, а также примерах 1, 2 и 12. Следующие образцы (Е 41-Е 45) были приготовлены по процедурам, сходным с приведенными в описаниях 1-9, а также примерах 1, 2, 12, 16 и 45. К указанным выше номерам примеров относятся следующие названия:N-[1-(3,4-дифтор-альфа-метилбензил)пиперидин-4-ил]-6-(трифторметил)пиридазин-3-амин (Е 45). Фармакология Аффинность связывания с рецепторами D2L человека in vitro Замороженные мембраны клеток СНО, трансфицированных дофаминовыми рецепторами D2L человека, оттаивали, непродолжительно гомогенизировали в гомогенизаторе Ultra-Turrax Т 25 и разбавляли аналитическим буфером трис-HCl, содержавшим NaCl, CaCl2, MgCl2, KCl (50, 120, 2, 1 и 5 ммоль, соответственно, с доведением рН до 7,7 при помощи HCl) для получения нужной концентрации белков, оптимизированной для специфического и неспецифического связывания. Радиолиганд [3 Н]спиперон (NEN,специфическая активность 70 Ки/ммоль) разбавляли в аналитическом буфере до концентрации 2 нмоль/л. Затем приготовленный радиолиганд (50 мкл) вместе с 50 мкл либо контрольного раствора 10% ДМСО, бутакламола (конечная концентрация 10-6 моль/л), либо испытуемого соединения инкубировали(30 мин, 37 С) с 400 мкл приготовленного раствора мембран. Связанные мембраны отфильтровывали с использованием устройства Packard Filtermate в планшеты GF/B Unifilter и отмывали охлажденным на льду буфером трис-HCl (50 ммоль, рН 7,7, 60,5 мл). Фильтрам давали высохнуть перед добавлением сцинтилляционной жидкости и проведением подсчета в сцинтилляционном счетчике Topcount. Процентный показатель специфического связывания и кривые конкурентного связывания рассчитывали при помощи компьютерной программы S-Plus (Insightful). Все соединения имели показатель pIC506,0 за исключением Е 8, Е 25, Е 41, Е 42, Е 44 и Е 45 (pIC505,2). Быстрая диссоциация Соединения, демонстрирующие IC50 выше 1 мкм, для оценки скорости их диссоциации были протестированы с использованием методики, описанной в публикации Josee E. Leysen and Walter Gommeren,Journal of Receptor Research, 1984, 4(7), 817-845. Соединения, концентрация которых в 4 раза превосходила их IC50, сначала инкубировали в течение одного часа с клеточными мембранами, несущими рецептор D2L человека в объеме 2 мл при температуре 25 С, затем фильтровали через стекловолоконный фильтр под отсасыванием, используя 40-луночный фильтрационный аппарат multividor. Сразу же после фильтрации вакуум сбрасывали. Затем на фильтр добавляли 0,4 мл предварительно подогретого до 25 С буфера, содержащего 1 нмоль [3 Н]спиперона, в течение 5 мин. Инкубацию останавливали, инициируя вакуум, и немедленно промывали материал 25 мл охлажденным на льду буфером. Связанную с фильтром радиоактивность измеряли в жидкостном сцинтилляционном спектрометре. Принцип анализа основан на допущении о том, что, чем быстрее соединение отсоединяется от рецептора D2, тем быстрее[3 Н]спиперон связывается с этим рецептором. Например, если рецепторы D2 инкубируют с клозапином в концентрации 1850 нмоль (4IC50), связывание [3 Н]спиперона эквивалентно 60-70% его общей связывающей способности (измеряемой в отсутствие лекарства) после 5-минутной инкубации на фильтре. При инкубации с другими антипсихотиками связывание [3 Н]спиперона варьируется в диапазоне от 20 до 50%. Поскольку клозапин включали в каждый сеанс фильтрования, испытуемые соединения расценивали как быстро диссоциирующие антагонисты рецептора D2 в том случае, если они диссоциировали так же быстро, как клозапин, или еще быстрее. Все проверенные соединения демонстрировали скорость диссоциации выше, чем у клозапина, т.е. превосходили клозапин по этому параметру более чем на 50%. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I) либо его фармацевтически приемлемая соль, гидрат или сольват, или его стереоизомерная форма, в которойR означает водород или C1-6 алкил;R1 означает фенил, фенил, замещенный 1, 2 или 3 заместителями, каждый из которых независимо от- 15015681 других выбирается из группы, состоящей из водорода, галогена, циано, С 1-4 алкила, С 1-4 алкилокси, перфторС 1-4 алкила, диС 1-4 алкиламино; тиенил, тиенил, замещенный 1 или 2 заместителями, выбранными из группы, которая состоит из галогена и С 1-4 алкила; С 3-8 циклоалкил или С 5-7 циклоалкенил;R2 означает водород или C1-6 алкил;R3 означает галоген, С 1-4 алкил или перфторС 1-4 алкил, аR4 и R5, каждый, означают независимо друг от друга водород или галоген. 2. Соединение по п.1, в котором R3 означает трифторметил, a R, R4 и R5 означают водород. 3. Соединение по п.1, в котором R2 означает водород или метил. 4. Соединение по п.1, в котором R1 означает 4-фторфенил или 3,4-дифторфенил. 5. Соединение по п.1, которое представляет собой соединение N-[1-(4-фторбензил)пиперидин-4 ил]-6-(трифторметил)пиридазин-3-амин. 6. Соединение по п.1, которое представляет собой соединение N-[1-(3,4-дифторбензил)пиперидин 4-ил]-6-(трифторметил)пиридазин-3-амин. 7. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по п.1. 8. Применение соединения по п.1 для использования в качестве лекарственного средства. 9. Применение соединения по п.8 для использования в качестве антипсихотика. 10. Применение соединения по п.8 для использования в качестве лекарственного средства для лечения или предупреждения шизофрении, шизофреноподобного расстройства, шизоаффективного расстройства, бредового расстройства, короткого психотического расстройства, общего психотического расстройства, психотического расстройства вследствие общего соматического заболевания, психотического расстройства, индуцированного (лекарственными) веществами, недифференцированного психотического расстройства, психоза, связанного с деменцией, большого депрессивного расстройства, дистимического расстройства, предменструального дисфорического расстройства, недифференцированного депрессивного расстройства, биполярного расстройства I, биполярного расстройства II, циклотимического расстройства, недифференцированного биполярного расстройства, расстройства настроения вследствие общего медицинского состояния больного, расстройства настроения, индуцированного (лекарственными) веществами, недифференцированного расстройства настроения, генерализованного тревожного расстройства,обсессивно-компульсивного расстройства, панического расстройства, острого стрессового расстройства,посттравматического стрессового расстройства, умственной отсталости, общих расстройств психического развития, расстройства с дефицитом внимания, расстройства с дефицитом внимания/гиперактивностью, расстройств с агрессивным поведением, расстройств личности параноидного типа, расстройств личности шизоидного типа, расстройств личности шизотипического типа, расстройств, сопровождающихся тиками, синдрома Туретта, лекарственной (наркотической) зависимости, злоупотребления алкоголем или наркотиками, синдрома отмены лекарств (наркотиков), трихотилломании. 11. Способ получения соединения формулы (I) в котором R, R1-R5 определены в п.1, причем этот способ включает:(а) взаимодействие промежуточного соединения формулы (II) в котором R2-R5 определены в п.1, с промежуточным соединением формулы R1-C(=O)-R, в которомR и R1 определены в п.1, в присутствии восстанавливающего агента и кислого катализатора в инертном по отношению к реакционной смеси растворителе; или в котором R3-R5 определены в п.1, с промежуточным соединением формулы (VII) в котором R, R1 и R2 определены в п.1, в присутствии основания в инертном по отношению к реакционной смеси растворителе.
МПК / Метки
МПК: A61K 31/501, C07D 409/14, C07D 401/12, A61P 25/00
Метки: рецептора, диссоциирующие, быстро, антагонисты, пипередин-4-ил-пиридазин-3-иламина, дофамина, производные
Код ссылки
<a href="https://eas.patents.su/18-15681-proizvodnye-piperedin-4-il-piridazin-3-ilamina-kak-bystro-dissociiruyushhie-antagonisty-receptora-dofamina-2.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пипередин-4-ил-пиридазин-3-иламина как быстро диссоциирующие антагонисты рецептора дофамина 2</a>
Предыдущий патент: Противоопухолевое средство, способ его получения и способ его стабилизации
Следующий патент: Фармацевтическая композиция
Случайный патент: Схема умножения для устройства измерения мощности и способ измерения мгновенного значения мощности