Производные 5-пиридинил-1-азабицикло [3.2.1] октана, их получение и их применение в терапии
Номер патента: 14023
Опубликовано: 30.08.2010
Авторы: Ваше Жюльен, Галли Фредерик, Леклерк Одиль, Локхед Элистер
Формула / Реферат
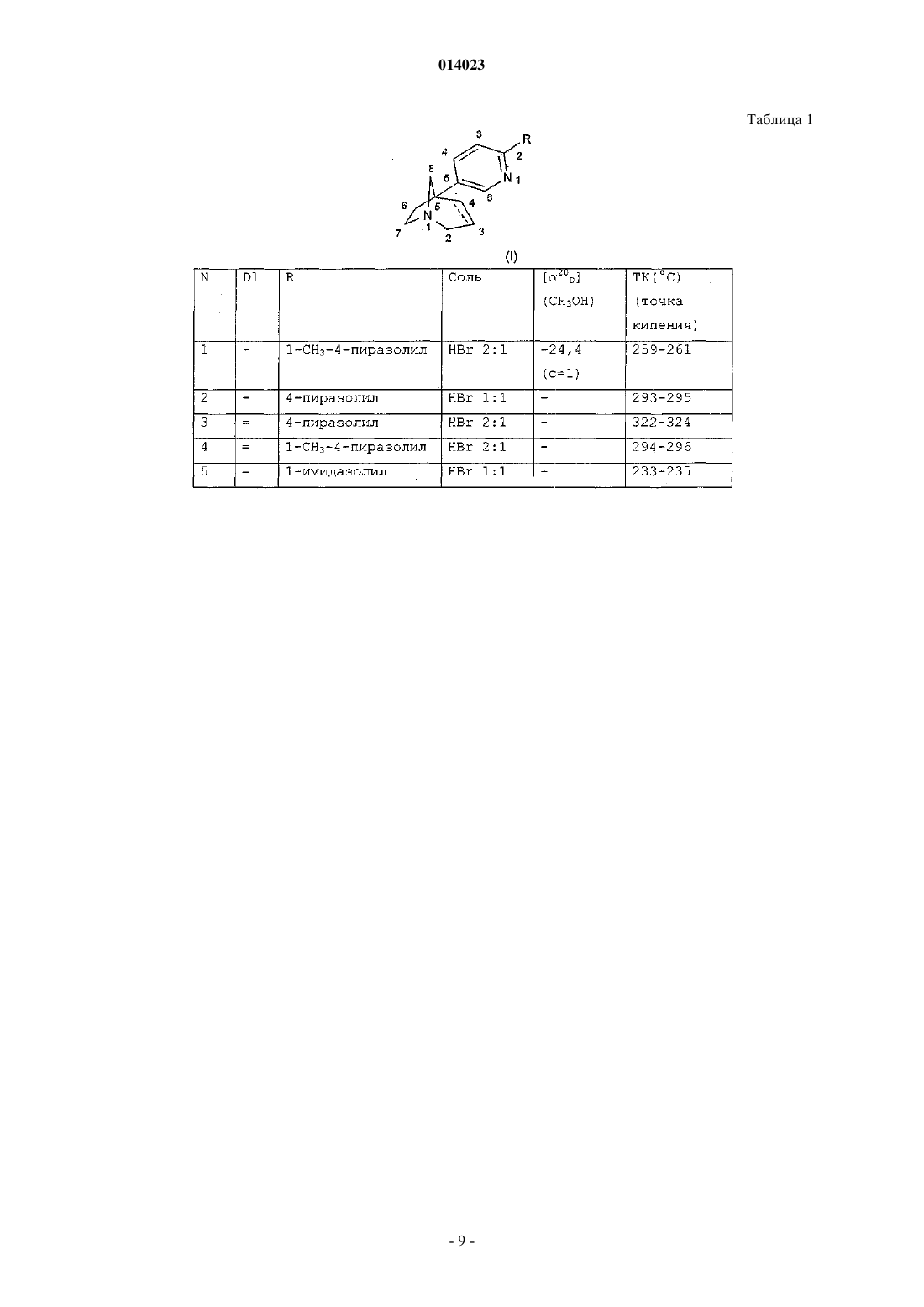
1. Соединение общей формулы (I)
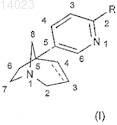
в которой R обозначает группу, выбранную из пиразолила, имидазолила, триазолила, оксазолила, оксадиазолила, тиазолила, изотиазолила, тиадиазолила, тетразолила, причем указанная группа, возможно, замещена одной или несколькими группами, выбранными из галогенов, (C1-C6)алкила, (C1-C6)алкокси, трифторметокси, трифторметила, нитро, циано, гидрокси, амино, (C1-C6)алкиламино или ди(C1-C6)алкиламино;
связь углерод-углерод между положениями 3 и 4 азабициклооктанового кольца является простой или двойной,
в виде основания или аддитивной соли с кислотой, а также в виде гидрата или сольвата.
2. Соединение формулы (I) по п.1, отличающееся тем, что
R обозначает группу, выбранную из пиразолила, имидазолила, триазолила, оксазолила, оксадиазолила, тиазолила, изотиазолила, тиадиазолила, тетразолила, причем эта группа может быть замещена одной или несколькими группами (C1-C6)алкила; и
связь углерод-углерод между положениями 3 и 4 азабициклооктанового кольца является простой или двойной,
в виде основания или аддитивной соли с кислотой, а также в виде гидрата или сольвата.
3. Соединение формулы (I) по п.1, отличающееся тем, что
R обозначает группу, выбранную из пиразолила, имидазолила, триазолила, оксазолила, оксадиазолила, тиазолила, тетразолила, причем эта группа может быть замещена одной или несколькими группами, выбранными из галогенов (C1-C6)алкила, (C1-C6)алкокси, трифторметокси, трифторметила, нитро, циано, гидрокси, амино, (C1-C6)алкиламино или ди(C1-C6)алкиламино; и
связь углерод-углерод между положениями 3 и 4 азабициклооктанового кольца является простой или двойной,
в виде основания или аддитивной соли с кислотой, а также в виде гидрата или сольвата.
4. Соединение формулы (I) по п.1 или 3, отличающееся тем, что
R обозначает группу, выбранную из пиразолила, имидазолила, триазолила, оксазолила, оксадиазолила, тиазолила, тетразолила, причем эта группа может быть замещена одной или несколькими (C1-C6)алкильными группами; и
связь углерод-углерод между положениями 3 и 4 азабициклооктанового кольца является простой или двойной,
в виде основания или аддитивной соли с кислотой, а также в виде гидрата или сольвата.
5. Соединение формулы (I) по п.1 или 2, отличающееся тем, что
R обозначает группу пиразолила, возможно, замещенную одной или несколькими группами (C1-C6)алкила, (C1-C6)алкокси, трифторметокси, трифторметила, нитро, циано, гидрокси, амино, (C1-C6)алкиламино или ди(C1-C6)алкиламино; и
связь углерод-углерод между положениями 3 и 4 азабициклооктанового кольца является простой или двойной,
в виде основания или аддитивной соли с кислотой, а также в виде гидрата или сольвата.
6. Соединение формулы (I) по любому из пп.1-5, отличающееся тем, что
R обозначает группу пиразолила, возможно замещенную одной или несколькими (C1-C6)алкильными группами; и
связь углерод-углерод между положениями 3 и 4 азабициклооктанового кольца является простой или двойной,
в виде основания или аддитивной соли с кислотой, а также в виде гидрата или сольвата.
7. Соединение формулы (I) по любому из пп.1-6, отличающееся тем, что
R обозначает группу пиразолила, возможно, замещенную одной или несколькими (C1-C6)алкильными группами; и
связь углерод-углерод между положениями 3 и 4 азабициклооктанового кольца является простой,
в виде основания или аддитивной соли с кислотой, а также в виде гидрата или сольвата.
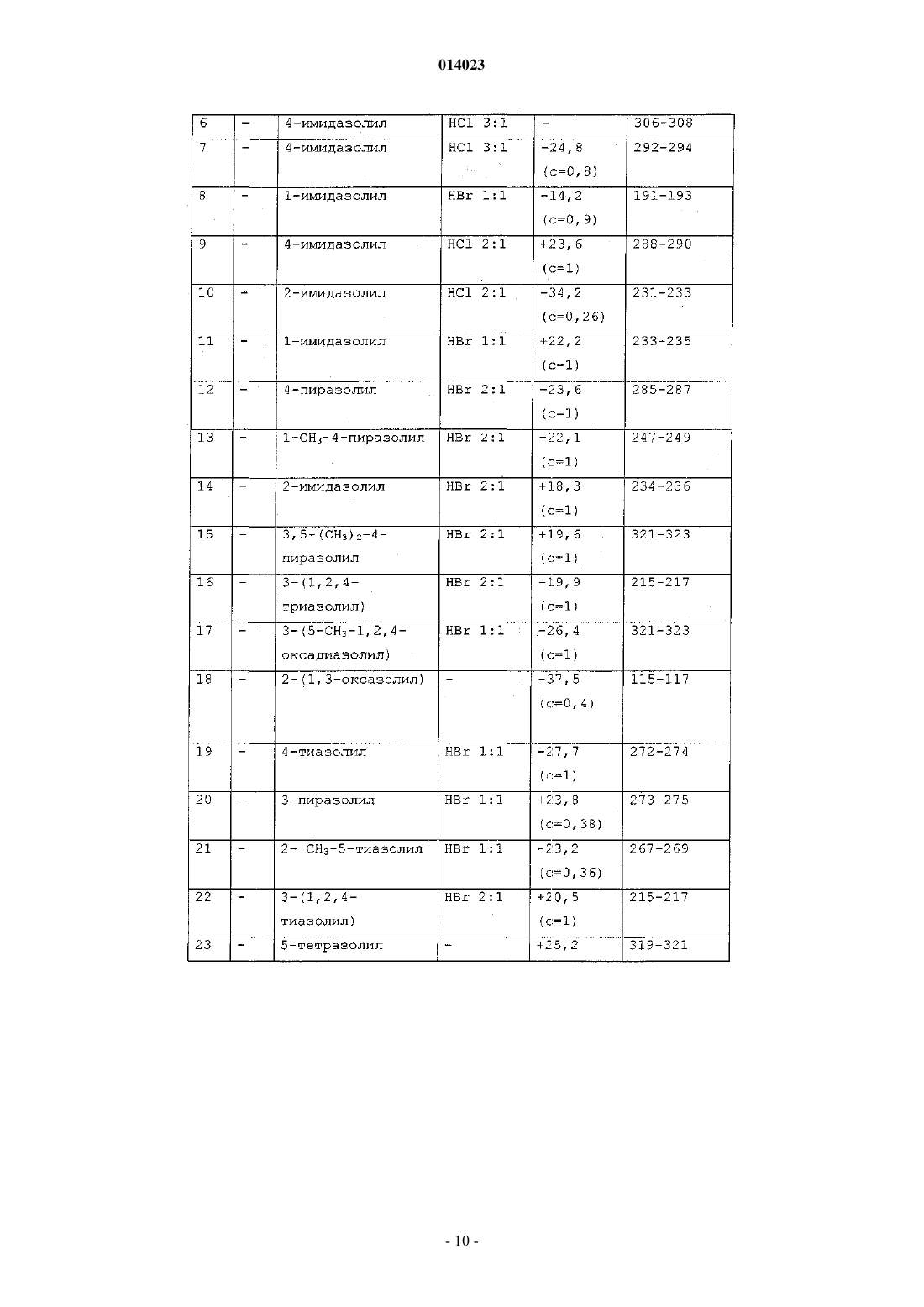
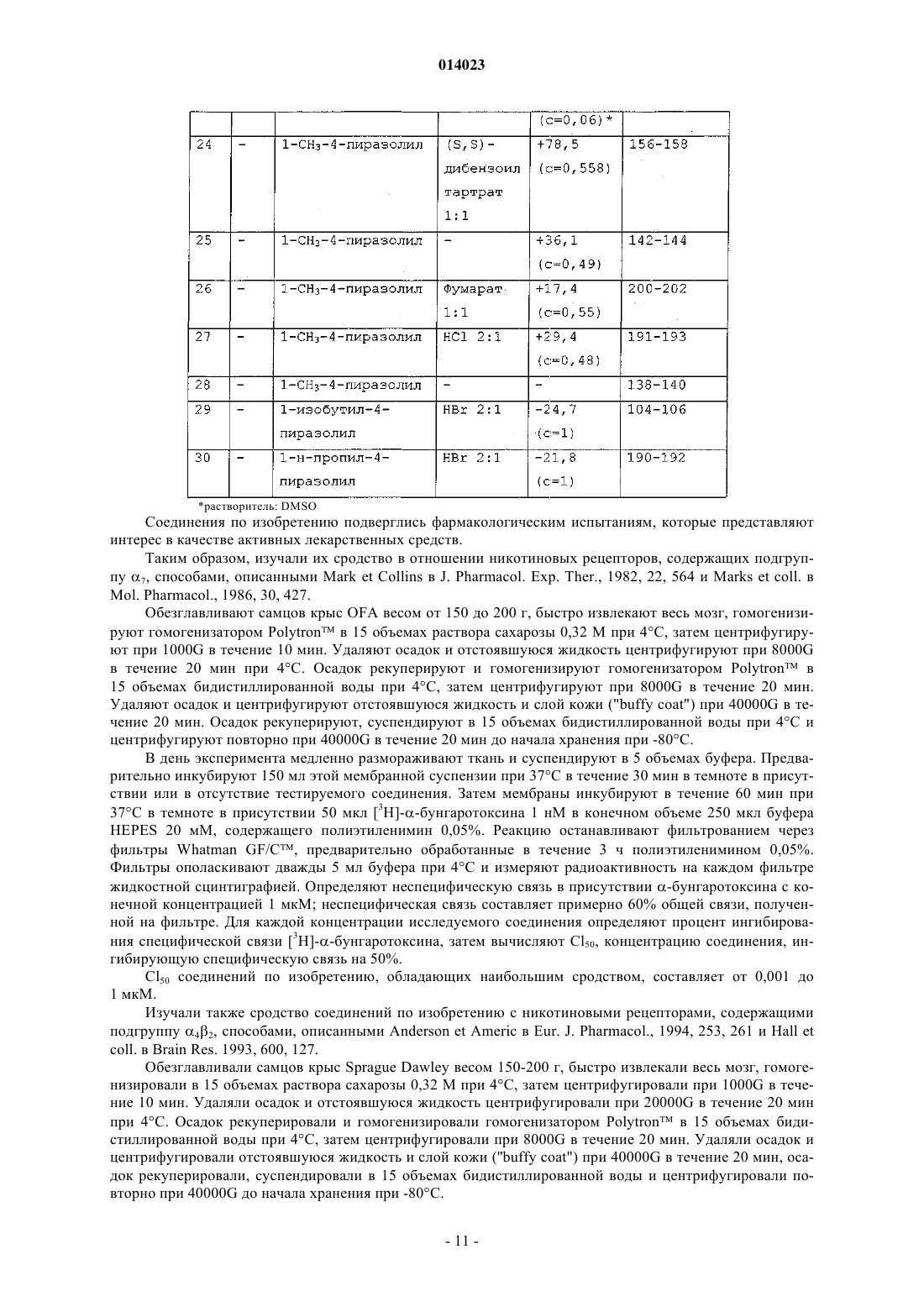
8. Соединение формулы (I) по любому из пп.1-4, отличающееся тем, что его выбирают из следующих соединений:
5-[2-(1-метил-1Н-пиразол-4-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октан;
5-[2-(1Н-пиразол-4-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октан;
5-[2-(1Н-пиразол-4-ил)пиридин-5-ил]-1-азабицикло[3.2.1]окт-3-ен;
5-[2-(1-метил-1Н-пиразол-4-ил)пиридин-5-ил]-1-азабицикло[3.2.1]окт-3-ен;
5-[2-(1Н-имидазол-1-ил)пиридин-5-ил]-1-азабицикло[3.2.1]окт-3-ен;
5-[2-(1Н-имидазол-4-ил)пиридин-5-ил]-1-азабицикло[3.2.1]окт-3-ен;
5-[2-(1Н-имидазол-4-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октан;
5-[2-(1Н-имидазол-1-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октан;
5-[2-(1Н-имидазол-2-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октан;
5-[2-(3,5-диметил-1Н-пиразол-4-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октан;
5-[2-(1Н-1,2,4-триазол-3-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октан;
5-[2-(5-метил-1,2,4-оксадиазол-3-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октан;
5-[2-(1,3-оксазол-2-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октан;
5-[2-(тиазол-4-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октан;
5-[2-(пиразол-3-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октан;
5-[2-(2-метилтиазол-5-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октан;
5-[2-(тетразол-5-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октан;
5-[2-(1-изобутил-1Н-пиразол-4-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октан;
5-[2-(1-н-пропил-1Н-пиразол-4-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октан;
в виде основания или аддитивной соли с кислотой, а также в виде гидрата или сольвата;
в виде чистого энантиомера или смеси энантиомеров.
9. Способ получения соединения формулы (I) по любому из пп.1-8, отличающийся тем, что подвергают взаимодействию соединение формулы (V) или (VI)
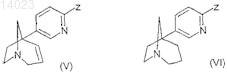
в которой Z обозначает атом брома,
или с бороновой кислотой формулы R-B(OH)2, в которой R является таким, как определено для общей формулы (I), в присутствии катализатора, содержащего палладий,
или с соединением формулы R-H, в которой R является таким, как определено для общей формулы (I), в присутствии сильного основания в растворителе,
или с содержащим двухвалентное олово производным формулы R-Sn[(СН2)3СН3)]3, в которой R является таким, как определено для общей формулы (I), в присутствии катализатора, содержащего палладий,
или с соединением формулы R-H, в которой R является таким, как определено для общей формулы (I), в присутствии н-бутиллития, хлорида цинка и катализатора, содержащего палладий.
10. Способ получения соединения формулы (I)
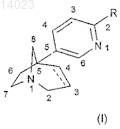
в которой R обозначает группу, выбранную из триазолила, оксазолила, оксадиазолила, тетразолила, причем эта группа может быть, возможно, замещена одной или несколькими группами, выбранными из галогенов (C1-C6)алкила, (C1-C6)алкокси, трифторметокси, трифторметила, нитро, циано, гидрокси, амино, (C1-C6)алкиламино или ди(C1-C6)алкиламино; и
связь углерод-углерод между положениями 3 и 4 азабициклооктанового кольца является простой,
отличающийся тем, что подвергают взаимодействию соединение формулы (VI)
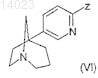
в которой Z обозначает атом брома,
в присутствии цианида калия и тетракис(трифенилфосфино)палладия в растворителе,
для получения формулы (VII)
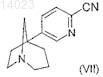
затем
если R обозначает триазолил, подвергают взаимодействию соединение формулы (VII) в присутствии сильного основания с муравьиным гидразином в растворителе;
если R обозначает оксадиазолил, преобразуют соединение формулы (VII) в N-гидроксикарбоксамидин формулы (VIII)
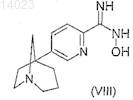
в присутствии гидроксиламинхлоргидрата в щелочной среде,
затем подвергают взаимодействию соединение формулы (VIII) с уксусным ангидридом в растворителе,
если R обозначает тетразолил, подвергают взаимодействию соединение формулы (VII) с азидом натрия в присутствии хлорида аммония в растворителе.
11. Соединение формулы (VII)

12. Соединение формулы (VIII)

13. Лекарственное средство, отличающееся тем, что содержит соединение формулы (I) по любому из пп.1-8, или аддитивную соль этого соединения с фармацевтически приемлемой кислотой, или гидрат, или сольват.
14. Фармацевтическая композиция, отличающаяся тем, что содержит соединение формулы (I) по любому из пп.1-8, или фармацевтически приемлемую соль, гидрат или сольват указанного соединения, а также по меньшей мере один фармацевтически приемлемый эксципиент.
15. Применение соединения формулы (I) по любому из пп.1-8 для получения лекарственного средства, предназначенного для лечения и профилактики когнитивных изменений, нарушения внимания, нарушений функций исполнения, связанных с болезнью Альцгеймера, патологическим или нормальным старением, с синдромом Паркинсона, с трисомией 21, с психическими патологиями, корсаковским алкогольным синдромом, сосудистой деменцией, черепно-мозговыми травмами, двигательных нарушений, наблюдаемых при болезни Паркинсона, или других неврологических заболеваний, или анатомо-гистопатологических поражений, связанных с вышеуказанными нейродегенеративными заболеваниями.
16. Применение соединения формулы (I) по любому из пп.1-8 для получения лекарственного средства, предназначенного для лечения и профилактики нарушения мозгового кровообращения, приступов церебральной гипоксии, психиатрических патологий.
17. Применение соединения формулы (I) по любому из пп.1-8 для получения лекарственного средства, предназначенного для профилактики симптомов, связанных с табакокурением, алкоголизмом, различными веществами, вызывающими зависимость.
18. Применение соединения формулы (I) по любому из пп.1-8 для получения лекарственного средства, предназначенного для лечения боли.
19. Применение соединения формулы (I) по любому из пп.1-8 для получения лекарственного средства, предназначенного для лечения ишемии нижних конечностей, облитерирующего артрита нижних конечностей, ишемической болезни сердца, инфаркта миокарда, сердечной недостаточности, недостаточной заживляемости кожного покрова у больных диабетом, варикозных язв при венозной недостаточности.
20. Применение соединения формулы (I) по любому из пп.1-8 для получения лекарственного средства, предназначенного для лечения воспалительных процессов.
Текст
Изобретение относится к соединению общей формулы (I) в которой R обозначает группу, выбранную из пиразолила, имидазолила, триазолила, оксазолила,оксадиазолила, тиазолила, изотиазолила, тиадиазолила, тетразолила, причем указанная группа,возможно, замещена одной или несколькими группами, выбранными из галогенов (C1-C6)алкила,(C1-C6)алкокси, трифторметокси, трифторметила, нитро, циано, гидрокси, амино,(C1-C6)алкиламино или ди(C1-C6)алкиламино; связь углерод-углерод между положениями 3 и 4 азабициклооктанового кольца является простой или двойной; в виде основания или аддитивной соли с кислотой, а также в виде гидрата или сольвата. Способ получения и применение в терапии. 014023 Настоящее изобретение относится к производным 5-пиридинил-1-азабицикло[3.2.1]октана, их получению и применению в терапии. Из уровня техники известны производные 5-пиридинил-1-азабицикло[2.3.1]октана, описанные в документе WO 03/057697, обладающие in vitro сродством с никотиновыми рецепторами типа 4 2 и 7. Но, по-прежнему, существует потребность в поиске и разработке продуктов, обладающих сродством с никотиновыми рецепторами и являющихся селективными в отношении никотиновых рецепторов,содержащих подгруппу 7. Цель изобретения состоит в предложении новых соединений, обладающих сродством с никотиновыми рецепторами и селективностью в отношении никотиновых рецепторов, содержащих подгруппу 7. Объектом настоящего изобретения являются соединения общей формулы (I) в которой R обозначает группу, выбранную из пиразолила, имидазолила, триазолила, оксазолила,оксадиазолила, тиазолила, изотиазолила, тиадиазолила, тетразолила, причем указанная группа, возможно,замещена одной или несколькими группами, выбранными из галогенов, (C1-С 6)алкила, (C1-С 6)алкокси, трифторметокси, трифторметила, нитро, циано, гидрокси, амино, (C1-С 6)алкиламино или ди(C1-C6)алкиламино; связь углерод-углерод между положениями 3 и 4 азабициклооктанового кольца является простой или двойной. К тому же атом углерода в положении 5 азабицикло[3.2.1]октанового кольца является асимметрическим, так что соединения по изобретению могут иметь форму двух энантиомеров или их смеси. Эти энантиомеры, а также их смеси, включая рацемические смеси, являются частью изобретения. Соединения формулы (I) могут также быть в виде оснований или аддитивных солей с кислотами. Такие аддитивные соли являются частью изобретения. Эти соли можно получать при помощи фармацевтически приемлемых кислот, но соли других кислот, пригодных, например, для очистки или выделения соединений формулы (I), также являются частью изобретения. Соединения формулы (I) могут также быть в виде гидратов или сольватов, а именно в виде ассоциаций или комбинаций с одной или несколькими молекулами воды или с растворителем. Такие гидраты или сольваты также являются частью изобретения. В объеме настоящего изобретения понимают под атомом галогена: атом фтора, хлора, брома или йода; алкильной группой: алифатическую насыщенную группу, линейную или разветвленную; в качестве примеров можно назвать группы: метил, этил, пропил, изопропил, бутил, изобутил, трет-бутил, пентил и т.д.; группой алкокси: радикал -О-алкил, алкильная группа которого является такой, как определена выше. Из соединений формулы (I), являющихся объектом изобретения, первая подгруппа соединений состоит из соединений, в которыхR обозначает группу, выбранную из пиразолила, имидазолила, триазолила, оксазолила, оксадиазолила, тиазолила, изотиазолила, тиадиазолила, тетразолила, причем эта группа может быть замещена одной или несколькими группами (C1-C6)алкила, более конкретно - метила; и связь углерод-углерод между положениями 3 и 4 азабициклооктанового кольца является простой или двойной. Из соединений формулы (I) согласно изобретению вторая подгруппа соединений состоит из соединений, в которыхR обозначает группу, выбранную из пиразолила, имидазолила, триазолила, оксазолила, оксадиазолила, тиазолила, изотиазолила, тиадиазолила, тетразолила, причем эта группа может быть замещена одной или несколькими группами (C1-C6)алкила, более конкретно - метила, изобутила и н-пропила; и связь углерод-углерод между положениями 3 и 4 азабициклооктанового кольца является простой или двойной. Из соединений формулы (I) согласно изобретению третья подгруппа соединений состоит из соединений, в которыхR обозначает группу, выбранную из пиразолила, имидазолила, триазолила, оксазолила, оксадиазолила, тиазолила, тетразолила, причем эта группа может быть замещена одной или несколькими группами, выбранными из галогенов, (C1-C6)алкила, (C1-C6)алкокси, трифторметокси, трифторметила, нитро,-1 014023 циано, гидрокси, амино, (C1-C6)алкиламино или ди(C1-C6)алкиламино; и связь углерод-углерод между положениями 3 и 4 азабициклооктанового кольца является простой или двойной. Из соединений формулы (I) согласно изобретению четвертая подгруппа соединений состоит из соединений, в которыхR обозначает группу, выбранную из пиразолила, имидазолила, триазолила, оксазолила, оксадиазолила, тиазолила, тетразолила, причем эта группа может быть замещена одной или несколькими группами(C1-C6)алкила, более конкретно - метила; и связь углерод-углерод между положениями 3 и 4 азабициклооктанового кольца является простой или двойной. Из соединений формулы (I) согласно изобретению пятая подгруппа соединений состоит из соединений, в которыхR обозначает группу, выбранную из пиразолила, имидазолила, триазолила, оксазолила, оксадиазолила, тиазолила, тетразолила, причем эта группа может быть замещена одной или несколькими группами(C1-C6)алкила, более конкретно - метила, изобутила и н-пропила; и связь углерод-углерод между положениями 3 и 4 азабициклооктанового кольца является простой или двойной. Из соединений формулы (I) согласно изобретению шестая подгруппа соединений состоит из соединений, в которыхR обозначает группу пиразолила, возможно замещенную одной или несколькими группами (C1-C6)алкила,(C1-C6)алкокси, трифторметокси, трифторметила, нитро, циано, гидрокси, амино, (C1-C6)алкиламино или ди(C1C6)алкиламино; и связь углерод-углерод между положениями 3 и 4 азабициклооктанового кольца является простой или двойной. Из соединений формулы (I) согласно изобретению седьмая подгруппа соединений состоит из соединений, в которыхR обозначает группу пиразолила, возможно замещенную одной или несколькими группами(C1-C6)алкила, более конкретно - метила, изобутила или н-пропила; и связь углерод-углерод между положениями 3 и 4 азабициклооктанового кольца является простой или двойной. Из соединений формулы (I) согласно изобретению восьмая подгруппа соединений состоит из соединений, в которыхR обозначает группу пиразолила, возможно замещенную одной или несколькими группами (C1C6)алкила, более конкретно метила, изобутила или н-пропила; и связь углерод-углерод между положениями 3 и 4 азабициклооктанового кольца является простой. Из соединений формулы (I) согласно изобретению можно назвать соединения формулы 5-[2-(1-метил-1 Н-пиразол-4-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октан; 5-[2-(1 Н-пиразол-4-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октан; 5-[2-(1 Н-пиразол-4-ил)пиридин-5-ил]-1-азабицикло[3.2.1]окт-3-ен; 5-[2-(1-метил-1 Н-пиразол-4-ил)пиридин-5-ил]-1-азабицикло[3.2.1]окт-3-ен; 5-[2-(1 Н-имидазол-1-ил)пиридин-5-ил]-1-азабицикло[3.2.1]окт-3-ен; 5-[2-(1 Н-имидазол-4-ил)пиридин-5-ил]-1-азабицикло[3.2.1]окт-3-ен; 5-[2-(1 Н-имидазол-4-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октан; 5-[2-(1 Н-имидазол-1-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октан; 5-[2-(1 Н-имидазол-2-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октан; 5-[2-(3,5-диметил-1 Н-пиразол-4-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октан; 5-[2-(1 Н-1,2,4-триазол-3-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октан; 5-[2-(5-метил-1,2,4-оксадиазол-3-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октан; 5-[2-(1,3-оксазол-2-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октан; 5-[2-(тиазол-4-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октан; 5-[2-(пиразол-3-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октан; 5-[2-(2-метилтиазол-5-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октан; 5-[2-(тетразол-5-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октан; 5-[2-(1-изобутил-1 Н-пиразол-4-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октан; 5-[2-(1-н-пропил-1 Н-пиразол-4-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октан; в виде основания или аддитивной соли с кислотой, а также в виде гидрата или сольвата; в виде чистого энантиомера или смеси энантиомеров. Далее в тексте под защитной группой понимают группу, которая позволяет, с одной стороны, защищать реакционноспособную функциональную группу, такую как гидрокси или амин во время синтеза,и, с другой стороны, регенерировать инертную функциональную группу в конце синтеза. Примеры защитных групп, а также способы защиты и снятия защиты приведены в "Protective Groups in Organic Synthesis", Green et al., 2 изд. (John WileySons, Inc. New York), 1991.-2 014023 Далее в тексте под уходящей группой понимают группу, которая может легко отщипляться от молекулы гетеролитическим разрывом связи с отделением электронной пары. Таким образом, эту группу можно легко заменить другой группой, например, по реакции замещения. Такими уходящими группами,например, являются галогены или активированные гидроксигруппы, такие как метансульфонат, бензолсульфонат, п-толуолсульфонат, трифлат, ацетат и т.д. Примеры уходящих групп, а также ссылки на их получение приведены в "Advances in Organic Chemistry", J. March, 3 изд., Wiley Interscience, 1985, с. 310316. Соединения формулы (I) можно получать способом, приведенным на нижеследующей схеме. Проводят реакцию присоединения к литийсодержащему аниону гетероциклического соединения общей формулы (III), в которой Z обозначает атом брома и W обозначает атом галогена в присутствии 3-оксо-1-азабицикло[2.2.2]октана формулы (II). Литийсодержащий анион гетероциклического соединения общей формулы (III) получают обменом галоген-металл с производным алкиллития. Получают соединение формулы (IV), из которого обработкой в кислой среде при нагревании получают соединение формулы (V). Каталитическое гидрирование двойной связи приводит к соединению формулы (VI). Соединения общей формулы (I), в которой связь углерод-углерод между положениями 3 и 4 азабициклооктанового цикла является двойной и R обозначает группу: пиразолил, имидазолил, триазолил,оксазолил, оксадиазолил, тиазолил, изотиазолил, тиадиазолил или тетразолил, возможно замещенную,получают из соединения формулы (V), в которой Z обозначает атом брома. Соединения общей формулы (I), в которой связь углерод-углерод между положениями 3 и 4 азабициклооктанового цикла является простой и R обозначает группу: пиразолил, имидазолил, триазолил, оксазолил, оксадиазолил, тиазолил, изотиазолил, тиадиазолил или тетразолил, возможно замещенную, получают из соединения формулы (VI), в которой Z обозначает атом брома. Заместитель R можно, таким образом, вводить в соединение формулы (V) или (VI), в которой Z обозначаем атом брома, любыми известными специалисту способами, например: с использованием бороновой кислоты формулы R-B(OH)2, в которой R является таким, как определено для общей формулы (I), в присутствии катализатора, содержащего палладий, например тетракистрифенилфосфинпалладия; с использованием соединения формулы R-H, в которой R является таким, как определено для общей формулы (I), в присутствии сильного основания, например гидрида натрия, в растворителе, например диметилформамиде;-3 014023 с использованием содержащего двухвалентное олово производного формулы R-Sn[(СН 2)3 СН 3)]3, в которой R является таким, как определено для общей формулы (I), в присутствии катализатора, содержащего палладий, например бис-(трифенилфосфино)дихлорпалладия; с использованием соединения формулы R-H, в которой R является таким, как определено для общей формулы (I), в присутствии н-бутиллития, хлорида цинка и катализатора, содержащего палладий,например тетракистрифенилфосфинпалладия; Соединения общей формулы (I), в которой связь углерод-углерод между положениями 3 и 4 азабициклооктанового цикла является простой и R обозначает группу: триазолил, оксадиазолил или тетразолил, возможно замещенную, получают из соединения формулы (VII) Например, если R обозначает триазолил, соединение формулы (I) можно получить из соединия формулы (VII) в присутствии такого сильного основания, как раствор метилата натрия, и муравьиного гидразина в растворителе, таком как метанол; если R обозначает оксадиазолил, соединение формулы (I) можно получить в две стадии из соединения формулы (VII),сначала преобразованием в N-гидроксикарбоксамидин формулы (VIII) например, в присутствии гидроксиламинхлоргидрата в щелочной среде,с последующим взаимодействием полученного таким образом соединения формулы (VIII) с уксусным ангидридом в таком растворителе, как пиридин, для получения целевого соединения формулы (I),если R обозначает тетразолил, соединение формулы (I) можно получить из соединения формулы(VII) в присутствии азида натрия и хлорида аммония в таком растворителе, как диметилформамид. Соединение формулы (VII) получают из соединения формулы (VI), в которой Z обозначает атом брома, в присутствии, например, цианида калия и тетракистрифенилфосфинопалладия в таком растворителе, как диметилформамид. Получение соединения формулы (V), в которой R обозначает атом брома, описано в WO 03057697. 3-оксо-1-азабицикло[2.2.2]октан формулы (II) коммерчески доступен. Соединения формулы (III) коммерчески доступны, или их можно получить способами, описанными в литературе. На схеме представлены исходные соединения и реагенты, если способ их получения не описан, они являются коммерчески доступными, или описаны в литературе, или их можно получить способами, известными специалисту. В соответствии с другим из аспектов изобретения объектом изобретения являются также соединения формул (IV), (V), (VI), (VII) и (VIII). Эти соединения пригодны в качестве промежуточных продуктов синтеза соединений общей формулы (I). В следующих примерах описано получение некоторых соединений по изобретению. Эти примеры не имеют цели ограничить настоящее изобретение, а представлены только в иллюстративных целях. Номера соединений, приведенные в скобках в названиях, соответствуют номерам в первой колонке приведенной ниже таблицы, в которой представлены химические структуры и физические свойства некоторых соединений по изобретению. Пример 1 (соединение 1). (-)-Бромгидрат (2:1) 5-[2-(1-метил-1 Н-пиразол-4-ил)пиридин-5-ил]-1 азабицикло[3.2.1]октана. 1.1. Бромгидрат (1:1) 5-(2-бромпиридин-5-ил)-1-азабицикло[3.2.1]октана. В колбу для проведения гидрирования вносят 1,95 г (7,354 ммоль) 5-(2-бромпиридин-5-ил)-1 азабицикло[3.2.1]окт-3-ена (WO 03057697) в 40 мл метанола, затем 195 мг оксида платины суспендируют. Среду перемешивают при комнатной температуре и давлении водорода 26 psi в течение 45 мин. Фильтруют реакционную среду через диатомит и растворитель удаляют выпариванием при пониженном давлении. Полученный осадок очищают хроматографией на колонке силикагеля, элюируя смесью хлороформа, метанола и аммиака в пропорциях 95/5/0,5. Получают 1,4 г 5-(2-бромпиридин-5-ил)-1 азабицикло[3.2.1]октана в виде воскообразного масла. Затем получают соль бромгидрата (1:1) 5-(2-бромпиридин-5-ил)-1-азабицикло[3.2.1]октана добавлением 1 экв. раствора 5,7 N бромисто-водородной кислоты в уксусной кислоте. Получают 1,82 г целевого продукта.-4 014023 1.2. (+) и (-)-Бромгидраты (1:1) 5-(2-бромпиридин-5-ил)-1-азабицикло[3.2.1]октана. Рацемическую смесь бромгидрата (1:1) 5-(2-бромпиридин-5-ил)-1-азабицикло[3.2.1]октана, полученную на стадии 1.1, разделяют жидкостной хроматографией на хиральном носителе до получения правовращающихся и левовращающихся энантиомеров соответственно, (+)-бромгидрат (1:1) 5-(2-бромпиридин-5-ил)-1-азабицикло[3.2.1]октана и (-)-бромгидрат (1:1) 5-(2-бромпиридин-5-ил)-1-азабицикло[3.2.1]октана.(-)-Бромгидрат (1:1) 5-(2-бромпиридин-5-ил)-1-азабицикло[3.2.1]октана: [20D]=-23,1 (с=1, СН 3 ОН). 1.3. (-)-Бромгидрат (2:1) 5-[2-(1-метил-1 Н-пиразол-4-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октана. В трехгорлую колбу объемом 10 мл последовательно вносят 0,162 г (0,78 ммоль) 1-метил-4 пиразолилбороновой кислоты, 0,160 г (0,6 ммоль) (-)5-(2-бромпиридин-5-ил)-1-азабицикло[3.2.1]октана(полученного взаимодействием (-)-бромгидрата (1:1) 5-(2-бромпиридин-5-ил)-1-азабицикло[3.2.1]октана,полученного на стадии 1.2, с насыщенным водным раствором карбоната натрия) в растворе в 3 мл толуола и 0,3 мл этанола. Затем добавляют 0,035 г (0,03 ммоль) тетракис(трифенилфосфино)палладия и 0,6 мл водного раствора 2 М карбоната натрия и нагревают смесь до 105 С в течение 18 ч. Охлаждают до комнатной температуры, выпаривают растворитель при пониженном давлении, остаток обрабатывают в 10 мл хлороформа и фильтруют через диатомит. Концентрируют растворитель при пониженном давлении и остаток очищают хроматографией на колонке силикагеля, элюируя смесью хлороформа, метанола и аммиака в пропорциях 95/5/0,5. Получают 0,15 г (-)5-[2-(1-метил-1 Н-пиразол-4-ил)пиридин-5-ил]-1 азабицикло[3.2.1]октана, который растворяют в 2 мл изопропилового спирта, и добавляют 0,196 мл раствора 5,7 N бромисто-водородной кислоты в уксусной кислоте. Полученные кристаллы собирают фильтрованием и сушат в вакууме. Получают 0,163 г продукта. Температура плавления: 259-261 С. 1 Н-ЯМР (DMSO)(ч./млн): 8,50 (1 Н, с); 8,45 (1H, с); 8,15 (1H, с); 8,10 (1 Н, д); 7,95 (1 Н, д); 4,00 (3 Н,с); 3,85-3,10 (6H, м); 2,50-1,80 (6 Н, м).[20D]=-24,4 (c=1, CH3OH). Соединение 2 было получено способом, описанным в примере 1. Соединения 3 и 4 были получены способом, описанным в примере 1, из 5-(2-бромпиридин-5-ил)-1 азабицикло[3.2.1]окт-3-ена (WO 03057697). Соединения 12, 13 и 15 были получены способом, описанным в примере 1, из (+)-5-(2 бромпиридин-5-ил)-1-азабицикло[3.2.1]октана, полученного на стадии 1.2. Пример 2 (соединение 24). (+)-(S,S)-Дибензоилтартрат (1:1) 5-[2-(1-метил-1 Н-пиразол-4 ил)пиридин-5-ил]-1-азабицикло[3.2.1]октана. 2.1. (+/-)-5-[2-(1-Метил-1 Н-пиразол-4-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октан (соединение 28). В трехгорлую колбу объемом 250 мл последовательно вносят 7,08 г (34,06 ммоль) 1-метил-4 пиразолилбороновой кислоты, 7,0 г (26,20 ммоль) (+/-)-5-(2-бромпиридин-5-ил)азабицикло[3.2.1]октана,полученного на стадии 1.1 примера 1, в растворе в 140 мл толуола и 14 мл этанола. Затем добавляют 1,82 г (1,57 ммоль) тетракис(трифенилфосфино)палладия и 26,20 мл (52,40 ммоль) водного раствора 2 М карбоната натрия и нагревают смесь до 90 С в течение 12 ч. Реакционную среду охлаждают до комнатной температуры, выливают в 50 мл воды, дважды экстрагируют хлороформом и объединенные органические фазы сушат над сульфатом натрия, фильтруют и выпаривают в вакууме. Полученный остаток очищают хроматографией на колонке силикагеля, элюируя смесью хлороформа, метанола и аммиака в пропорциях 95/5/0,5. Получают 5,30 г целевого продукта в виде порошка светло-желтого цвета. Температура плавления: 138-140 С. 1(3 Н, с); 3,09-2,60 (6H, м); 2,21-1,31 (6H, м). 2.2. (+)-(S,S)-Дибензоилтартрат (1:1) 5-[2-(1-метил-1 Н-пиразол-4-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октан. В колбе объемом 250 мл растворяют 9,70 г (36,15 ммоль) (+/-)-5-[2-(1-метил-1 Н-пиразол-4 ил)пиридин-5-ил]-1-азабицикло[3.2.1]октана, полученного на стадии 2.1, в 100 мл этанола, добавляют 13,08 г (36,51 ммоль) (S,S)-дибензоилвинной кислоты, реакционную среду перемешивают при комнатной температуре в течение 5 мин и концентрируют при пониженном давлении. Полученное твердое вещество растворяют в 50 мл этанола, затем нагревают с обратным холодильником до полного растворения. Среду медленно доводят до комнатной температуры. Полученные кристаллы фильтруют, затем сушат в вакууме и получают 7,10 г целевого продукта с оптической чистотой 95,4%. Эти кристаллы перекристаллизовывают в описанных выше условиях в 25 мл этанола и получают 5,54 г (+)-(S,S)-дибензоилтартрат (1:1) 5-[2-(1-метил-1 Н-пиразол-4-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октана в виде кристаллов белого цвета с оптической чистотой 98,8%. Температура плавления: 156-158 С.H-ЯМР (DMSO)(ч./млн): 8,39 (с, 1H,); 8,22 (с, 1 Н,); 7,92 (с, 1 Н,); 7,90-7,78 (м, 4 Н); 7,65-7,35(м,8 Н); 5,60 (с, 2 Н); 3,86 (с, 3 Н); 3,62-2,96 (м, 8 Н); 2,54-1,65 (м, 6 Н). Пример 3 (соединение 5). Бромгидрат (1:1) 5-[2-(1 Н-имидазол-1-ил)пиридин-5-ил]-1-азабицикло[3.2.1]окт-3-ена. В трехгорлую колбу объемом 10 мл вводят 0,64 г (9,42 ммоль) имидазола в растворе в 3 мл диметилформамида. Затем добавляют 0,415 г (10,4 ммоль) 60%-ной дисперсии гидрида натрия в масле и перемешивают при комнатной температуре в течение 1 ч. Затем в смесь вводят раствор 5-(2-бромпиридин 5-ил)-1-азабицикло[3.2.1]окт-3-ена (WO 03057697) (0,5 г, 1,89 ммоль) в диметилформамиде и реакционную среду нагревают до 85 С в течение 15 ч, затем до 110 С в течение 24 ч и растворитель выпаривают при пониженном давлении. Остаток обрабатывают в 10 мл хлороформа и 10 мл насыщенного водного раствора карбоната натрия. Водную фазу вновь экстрагируют 10 мл хлороформа и объединенные органические фазы промывают насыщенным водным раствором хлорида натрия, сушат над сульфатом натрия, фильтруют и концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке силикагеля, элюируя смесью хлороформа, метанола и аммиака в пропорциях 95/5/0,5. Получают 0,235 г 5-[2-(1 Н-имидазол 1-ил)пиридин-5-ил]-1-азабицикло[3.2.1]окт-3-ена, который растворяют в 3 мл изопропилового спирта и добавляют 0,327 мл раствора бромисто-водородной кислоты 5,7 N в уксусной кислоте. Образовавшиеся кристаллы собирают фильтрованием и сушат в вакууме. Температура плавления: 233-235 С. 1 Н-ЯМР (DMSO)(ч./млн): 8,55 (1 Н, с); 8,50 (1 Н, с); 8,05 (1 Н, д); 7,95 (1 Н, с); 7,85 (1 Н, д); 7,15 (1 Н,с); 6,15 (1 Н, д); 5,75 (1 Н, д); 4,20-4,10 (1 Н, д); 4,00-3,40 (5 Н, м); 2,80-2,60 (1 Н, т); 2,45-2,30 (1 Н, т). Соединение 8 было получено способом, описанным в примере 3 из (-)-5-(2-бромпиридин-5-ил)-1 азабицикло[3.2.1]октана, полученного на стадии 1.2 примера 1. Соединение 11 было получено методом, описанным в примере 3 из (+)-5-(2-бромпиридин-5-ил)-1 азабицикло[3.2.1]октана, полученного на стадии 1.2 примера 1. Пример 4 (соединение 6). Хлоргидрат (3:1) 5-[2-(1 Н-имидазол-4-ил)пиридин-5-ил]-1-азабицикло[3.2.1]окт-3-ена. 4.1. 5-[2-(1-Трифенилметилимидазол-4-ил)пиридин-5-ил]-1-азабицикло[3.2.1]окт-3-ен. В трехгорлую колбу объемом 10 мл последовательно вносят 0,25 г (0,94 ммоль) 5-(2-бромпиридин 5-ил)-1-азабицикло[3.2.1]окт-3-ена (WO 03057697) в растворе в 3 мл тетрагидрофурана, 1,24 г(2,07 ммоль) 1-трифенилметил-4-трибутилстаннилимидазола и 0,06 г (0,08 ммоль) бис-(трифенилфосфино)дихлорпалладия. Смесь нагревают до 85 С в течение 15 ч, затем разбавляют 10 мл хлороформа и 10 мл насыщенного водного раствора карбоната натрия. Водную фазу вновь экстрагируют 10 мл хлороформа и объединенные органические фазы промывают насыщенным водным раствором хлорида натрия, сушат над сульфатом натрия, фильтруют и концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке силикагеля, элюируя смесью хлороформа, метанола и аммиака в пропорциях 97/3/0,3. Получают 0,36 г целевого продукта в виде твердого аморфного вещества. 4.2. Хлоргидрат (3:1) 5-[2-(1 Н-имидазол-1-ил)пиридин-5-ил]-1-азабицикло[3.2.1]окт-3-ена. В трехгорлую колбу объемом 10 мл вносят 0,36 г (0,733 ммоль) 5-[2-(1-трифенилметилимидазол-4 ил)пиридин-5-ил]-1-азабицикло[3.2.1]окт-3-ена, полученного на стадии 4.1, в растворе в 4 мл метанола. Затем добавляют 0,8 мл раствора 6 N соляной кислоты в изопропиловом спирте и реакционную среду нагревают до 80 С в течение 3 ч. Растворитель концентрируют при пониженном давлении и остаток растирают в простом диэтиловом эфире. Полученные кристаллы собирают фильтрованием и сушат в вакууме. Температура плавления: 306-308 С. 1(1 Н, д); 6,20 (1 Н, д); 5,75 (1 Н, дт); 4,15 (1 Н, д); 3,95-3,35 (5 Н, м); 2,80-2,60 (1 Н, т); 2,45-2,30 (1 Н, т). Соединение 7 было получено способом, описанным в примере 4, из (-)-5-(2-бромпиридин-5-ил)-1 азабицикло[3.2.1]октана, полученного на стадии 1.2 примера 1. Соединение 9 было получено способом, описанным в примере 4, из (+)-5-(2-бромпиридин-5-ил)-1 азабицикло[3.2.1]октана, полученного на стадии 1.2 примера 1. Пример 5 (соединение 10). (-)-Хлоргидрат (2:1) 5-[2-(1 Н-имидазол-2-ил)пиридин-5-ил]-1 азабицикло[3.2.1]октана. 5.1. (-)-5-[2-(1 Н-Имидазол-2-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октан. В трехгорлую колбу объемом 25 мл вводят 1 г (5,7 ммоль) 1-(диметиламиносульфонил)имидазола в растворе в 9 мл тетрагидрофурана. Реакционную среду охлаждают до -78 С и добавляют в течение 20 мин по каплям 4 мл раствора 1,6 М н-бутиллития в гексане. Затем добавляют 0,73 г (5,4 ммоль) хлорида цинка в растворе в 4 мл тетрагидрофурана. Перемешивают, при этом температура поднимается до 20 С, затем добавляют последовательно 1,5 г (11,1 ммоль) хлорида цинка, 0,1 г (0,09 ммоль) тетракис(трифенилфосфино)палладия и 0,56 г (2,1 ммоль) (-)-5-(2-бромпиридин-5-ил)-1-азабицикло[3.2.1]октана (полученного способом, описанным на стадии 1.2 примера 1) в растворе в 5 мл тетрагидрофурана.-6 014023 Затем смесь нагревают с обратным холодильником в течение 24 ч, после чего охлаждают до комнатной температуры. Добавляют 30 мл 30%-ного водного раствора гидроксида натрия и 50 мл хлороформа. Водную фазу экстрагируют хлороформом, затем объединенные органические фазы промывают насыщенным водным раствором хлорида натрия, сушат над сульфатом натрия, фильтруют и концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке силикагеля, элюируя смесью хлороформа, метанола и аммиака в пропорциях 95/5/0,5 и используют на следующей стадии. 5.2. (-)-Хлоргидрат (2:1) 5-[2-(1 Н-имидазол-2-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октана. Продукт, полученный на стадии 5.1, растворяют в 10 мл диоксана и 1,5 мл водного раствора соляной кислоты 2 N. Среду перемешивают в течение 2 ч при комнатной температуре, затем растворитель выпаривают при пониженном давлении. Остаток обрабатывают 30 мл хлороформа и 30 мл насыщенного водного раствора карбоната натрия. Водную фазу экстрагируют хлороформом и объединенные органические фазы сушат над сульфатом натрия, фильтруют и концентрируют при пониженном давлении. Полученный остаток растворяют в 5 мл изопропилового спирта и обрабатывают избыточным количеством соляной кислоты в растворе в изопропиловом спирте. Полученные кристаллы собирают фильтрованием и сушат в вакууме. Получают 0,23 г продукта. Температура плавления: 231-233 С. 1 Н-ЯМР (DMSO)(ч./млн): 11,45 (1 Н, с); 8,75 (1 Н, с); 8,55 (1 Н, д); 8,05 (1 Н, д); 7,80 (2H, с); 3,75[20D]=-34,2 (c=0,26, CH3OH). Соединение 19 получают способом, описанным в примере 5. Соединение 20 получают способом, описанным на стадии 5.1 в примере 5, с последующей стадией снятия защиты в щелочной среде в присутствии 35%-ного водного раствора изохорного гидроксида натрия и диоксана при комнатной температуре. Соединения 18 и 21 получают способом, описанным на стадии 5.1 в примере 5. Соединение 14 получают способом, описанным в примере 5, из (+)-5-(2-бромпиридин-5-ил)-1 азабицикло[3.2.1]октана, полученного на стадии 1.2 примера 1. Пример 6 (соединение 16). (-)-Бромгидрат(2:1) 5-[2-(1 Н-1,2,4-триазол-3-ил)пиридин-5-ил]-1 азабицикло[3.2.1]октана. 6.1. (-)-(1-Азабицикло[3.2.1]окт-5-ил)пиридин-2-карбонитрил. В реактор объемом 25 мл последовательно вводят 1,5 г (4,3 ммоль) бромгидрата (-)-5-(2 бромпиридин-5-ил)-1-азабицикло[3.2.1]октана (полученного способом, описанным на стадии 1.2 в примере 1) в растворе в 12 мл диметилформамида, 0,42 г (6,46 ммоль) цианида калия и 5 г (4,3 ммоль) тетракис(трифенилфосфино)палладия. Затем смесь нагревают в течение 3 ч до 90 С, после чего нейтрализуют насыщенным водным раствором карбоната натрия. Водную фазу экстрагируют хлороформом и объединенные органические фазы сушат над сульфатом натрия, фильтруют и концентрируют при пониженном давлении. Остаток очищают хроматографией на колонке силикагеля, элюируя смесью хлороформа, метанола и аммиака в пропорциях 95/5/0,5, получают, таким образом, 0,705 г целевого продукта в виде твердого аморфного вещества. 6.2. (-)-Бромгидрат (2:1) 5-[2-(1 Н-1,2,4-триазол-3-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октана. В реактор объемом 10 мл последовательно вводят 0,22 г (1,03 ммоль) (-)-(1-азабицикло[3.2.1]окт-5 ил)пиридин-2-карбонитрила, полученного на стадии 6.1, в растворе в 3 мл метанола. Продувают аргоном и затем добавляют 0,04 мл (0,26 ммоль) раствора 5,25 N метилата натрия в метаноле и перемешивают в течение 15 мин при комнатной температуре, добавляют 0,065 г (1,08 ммоль) муравьиного гидразида. Затем среду нагревают до 85 С в течение 24 ч и растворитель выпаривают. Остаток очищают хроматографией на колонке силикагеля, элюируя смесью хлороформа, метанола и аммиака в пропорциях 85/15/1,5. Получают, таким образом, 0,155 г (-)-5-[2-(1H-1,2,4-триазол-3-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октана, который обрабатывают 0,19-мл раствором 5,7 N бромисто-водородной кислоты в уксусной кислоте. Полученные кристаллы собирают фильтрованием и сушат в вакууме. Температура плавления: 215-217 С. 1 Н ЯМР (DMSO)(ч./млн): 10,15 (1 Н, с); 8,65 (1 Н, с); 8,40 (1 Н, с); 8,10 (1 Н, д); 7,95 (1 Н, д); 3,803,10 (6 Н, м); 2,30-1,75 (6 Н, м).[20D]=-19,9 (c=1, CH3OH). Соединение 22 получают способом, описанным в примере 6, из (+)-(1-азабицикло[3.2.1]окт-5 ил)пиридин-2-карбонитрила, полученного из (+)-5-(2-бромпиридин-5-ил)-1-азабицикло[3.2.1]октана (полученного способом, описанным на стадии 1.2 в примере 1). Пример 7 (соединение 17). (-)-Бромгидрат (1:1) 5-[2-(5-метил-1,2,4-оксадиазол-3-ил)пиридин-5-ил]1-азабицикло[3.2.1]октана. 7.1. (-)-5-(1-Азабицикло[3.2.1]окт-5-ил)-N-гидроксипиридин-2-карбоксамидин. В реактор объемом 10 мл последовательно вводят 0,3 г (1,4 ммоль) (-)-(1-азабицикло[3.2.1]окт-5 ил)пиридин-2-карбонитрила, полученного способом, описанным на стадии 6.1 в примере 5, 0,39 г (5,63 ммоль) гидроксиламинхлоргидрата, 0,78 г (5,65 ммоль) карбоната калия и 5 мл этилового спирта. Смесь-7 014023 нагревают с обратным холодильником в течение 3 ч, затем фильтруют. Фильтрат концентрируют при пониженном давлении, остаток обрабатывают 10 мл воды. Водную фазу экстрагируют хлороформом и объединенные органические фазы промывают насыщенным водным раствором карбоната натрия, сушат над сульфатом натрия и выпаривают в вакууме. Получают таким образом 0,29 г продукта в виде твердого аморфного вещества. 7.2. (-)-Бромгидрат (1:1) 5-[2-(5-метил-1,2,4-оксадиазол-3-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октана. В реактор объемом 10 мл вводят 0,28 г (1,14 ммоль) (-)-5-(азабицикло[3.2.1]окт-5-ил)-Nгидроксипиридин-2-карбоксимидамида, полученного на стадии 7,1, в растворе в 10 мл пиридина. Затем добавляют 0,1 мл (1,13 ммоль) уксусного ангидрида и среду перемешивают при комнатной температуре в течение 15 ч, затем нагревают до 110 С в течение 5 ч. Растворитель концентрируют при пониженном давлении и остаток обрабатывают насыщенным водным раствором карбоната натрия. Водную фазу экстрагируют хлороформом и объединенные органические фазы сушат над сульфатом натрия, фильтруют и выпаривают в вакууме. Остаток очищают хроматографией на колонке силикагеля, элюируя смесью хлороформа, метанола и аммиака в пропорциях 96/4/0,4. Получают таким образом 0,077 г (-)-5-[2-(5-метил 1,2,4-оксадиазол-3-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октана, который растворяют в 1 мл изопропилового спирта и вводят 0,05 мл раствора бромисто-водородной кислоты 5,7 N в уксусной кислоте. Полученные кристаллы собирают фильтрованием и сушат при пониженном давлении. Температура плавления: 321-323 С. 1[20D]=-26,4 (c=1, CH3OH). Пример 8 (соединение 23). (+)-5-[2-(2 Н-Тетразол-5-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октан. В реактор объемом 10 мл последовательно вводят 0,350 г (4,64 ммоль) (+)-(1-азабицикло[3.2.1]окт 5-ил)пиридин-2-карбонитрила, (полученного способом, аналогичным описанному на стадии 6.1 в примере 6, из (+)-5-(2-бромпиридин-5-ил)-1-азабицикло[3.2.1]октана, полученного на стадии 1.2 примера 1),0,117 г (1,80 ммоль) азида натрия, 0,022 г (0,4 ммоль) хлорида аммония и 2 мл диметилформамида. Затем смесь нагревают до 80 С в течение 15 ч, затем растворитель выпаривают при пониженном давлении. Остаток обрабатывают метанолом при комнатной температуре. Образовавшееся нерастворенное вещество отфильтровывают и фильтрат концентрируют при пониженном давлении. Остаток подвергают хроматографии на колонке силикагеля, элюируя смесью хлороформа, метанола и аммиака в пропорциях 80/20/2. Получают таким образом 0,368 г продукта в виде кристаллов. Температура плавления: 319-321 С. 1 Н ЯМР (DMSO)(ч./млн): 8,45 (1 Н, с); 7,95 (1 Н, д); 7,70 (1 Н, д); 3,60-3,10 (6 Н, м); 2,45-1,70 (6 Н,м).[20D]=+25,2 (c=0,06, DMSO). В табл. 1 представлены химические структуры и физические свойства нескольких примеров по изобретению. На этой таблице в колонке "DL" "=" означает, что связь углерод-углерод между положениями 3 и 4 азабициклооктанового кольца является двойной и, "-" означает, что связь углерод-углерод между положениями 3 и 4 азабициклооктанового кольца является простой; в колонке "Соль" "-" обозначает соединение в виде основания, "HBr" обозначает бромгидрат и"HCl" обозначает хлоргидрат. Молярные отношения кислота к основанию указаны в колонке "Соль" напротив кислоты; в колонке [20D] (CH3OH) указанная величина обозначает способность соединения к вращению,причем концентрация в г/100 мл в метаноле, при которой это измерение было выполнено, указана в скобках; соединения, в отношении которых в этой колонке сделан прочерк, являются рацематами. Соединения по изобретению подверглись фармакологическим испытаниям, которые представляют интерес в качестве активных лекарственных средств. Таким образом, изучали их сродство в отношении никотиновых рецепторов, содержащих подгруппу 7, способами, описанными Mark et Collins в J. Pharmacol. Exp. Ther., 1982, 22, 564 и Marks et coll. вMol. Pharmacol., 1986, 30, 427. Обезглавливают самцов крыс OFA весом от 150 до 200 г, быстро извлекают весь мозг, гомогенизируют гомогенизатором Polytron в 15 объемах раствора сахарозы 0,32 М при 4 С, затем центрифугируют при 1000G в течение 10 мин. Удаляют осадок и отстоявшуюся жидкость центрифугируют при 8000G в течение 20 мин при 4 С. Осадок рекуперируют и гомогенизируют гомогенизатором Polytron в 15 объемах бидистиллированной воды при 4 С, затем центрифугируют при 8000G в течение 20 мин. Удаляют осадок и центрифугируют отстоявшуюся жидкость и слой кожи ("buffy coat") при 40000G в течение 20 мин. Осадок рекуперируют, суспендируют в 15 объемах бидистиллированной воды при 4 С и центрифугируют повторно при 40000G в течение 20 мин до начала хранения при -80 С. В день эксперимента медленно размораживают ткань и суспендируют в 5 объемах буфера. Предварительно инкубируют 150 мл этой мембранной суспензии при 37 С в течение 30 мин в темноте в присутствии или в отсутствие тестируемого соединения. Затем мембраны инкубируют в течение 60 мин при 37 С в темноте в присутствии 50 мкл [3H]бунгаротоксина 1 нМ в конечном объеме 250 мкл буфераHEPES 20 мМ, содержащего полиэтиленимин 0,05%. Реакцию останавливают фильтрованием через фильтры Whatman GF/C, предварительно обработанные в течение 3 ч полиэтиленимином 0,05%. Фильтры ополаскивают дважды 5 мл буфера при 4 С и измеряют радиоактивность на каждом фильтре жидкостной сцинтиграфией. Определяют неспецифическую связь в присутствии -бунгаротоксина с конечной концентрацией 1 мкМ; неспецифическая связь составляет примерно 60% общей связи, полученной на фильтре. Для каждой концентрации исследуемого соединения определяют процент ингибирования специфической связи [3 Н]бунгаротоксина, затем вычисляют Cl50, концентрацию соединения, ингибирующую специфическую связь на 50%.Cl50 соединений по изобретению, обладающих наибольшим сродством, составляет от 0,001 до 1 мкМ. Изучали также сродство соединений по изобретению с никотиновыми рецепторами, содержащими подгруппу 42, способами, описанными Anderson et Americ в Eur. J. Pharmacol., 1994, 253, 261 и Hall etcoll. в Brain Res. 1993, 600, 127. Обезглавливали самцов крыс Sprague Dawley весом 150-200 г, быстро извлекали весь мозг, гомогенизировали в 15 объемах раствора сахарозы 0,32 М при 4 С, затем центрифугировали при 1000G в течение 10 мин. Удаляли осадок и отстоявшуюся жидкость центрифугировали при 20000G в течение 20 мин при 4 С. Осадок рекуперировали и гомогенизировали гомогенизатором Polytron в 15 объемах бидистиллированной воды при 4 С, затем центрифугировали при 8000G в течение 20 мин. Удаляли осадок и центрифугировали отстоявшуюся жидкость и слой кожи (buffy coat") при 40000G в течение 20 мин, осадок рекуперировали, суспендировали в 15 объемах бидистиллированной воды и центрифугировали повторно при 40000G до начала хранения при -80 С.- 11014023 В день эксперимента медленно размораживали ткань и суспендировали в 3 объемах буфера. Инкубировали 150 мл этой мембранной суспензии при 4C в течение 120 мин в присутствии 100 мкл[3 Н]-цитизина 1 нМ в конечном объеме 500 мкл буфера, в присутствии или в отсутствие тестируемого соединения. Реакцию останавливали фильтрованием через фильтры Whatman GF/B, предварительно обработанные полиэтиленимином, фильтры ополаскивали дважды 5 мл буфера при 4 С и измеряли радиоактивность на каждом фильтре жидкостной сцинтиграфией. Определяли неспецифическую связь в присутствии (-)-никотина 10 мкМ; неспецифическая связь составляла примерно от 75 до 85% общей связи, полученной на фильтре. Для каждой концентрации исследуемого соединения определяли процент ингибирования специфической связи [3 Н]-цитизина в дозах 1 и 10 мкМ. Для соединений по изобретению,обладающих наибольшим сродством, вычисляли Cl50, концентрацию соединения, ингибирующую специфическую связь на 50%.Cl50 соединений по изобретению, обладающих наибольшим сродством, составляет от 0,2 до 10 мкМ. Экспериментальные данные по нескольким специфическим соединениям указаны в следующей табл. 2. Таблица 2 Исследовали также сродство соединений по изобретению в отношении периферических никотиновых рецепторов узлового типа способом, описанным Houghtling et coll. в Mol. Pharmacol., 1995, 48, 280. Размораживали бычьи надпочечники, хранившиеся при -80 С, и гомогенизировали гомогенизатором Polytron в 20 объемах буфера Tris-HCl 50 мМ, рН 7,4 при 4 С, затем центрифугировали при 35000G в течение 10 мин. Удаляли отстоявшуюся жидкость и суспендировали осадок в 30 объемах буфера Tris-HCl 50 мМ при 4 С и повторно гомогенизировали прежде, чем повторно центрифугировать при 35000G в течение 10 мин. Последний осадок помещали в 10 объемов буфера Tris-HCl при 4 С. Инкубировали 100 мкл мембраны, т.е. 10 мг свежей ткани при 24 С в течение 3 ч в присутствии 50 мкл[3 Н]-эпибатидина в конечной концентрации 0,66 нМ в конечном объеме 250 мкл буфера в присутствии или в отсутствие тестируемого соединения. Реакцию останавливали разбавлением образцов буферомTris-HCl 50 мМ, рН 7,4 при 4 С, затем фильтровали через фильтры Whatman GF/C, предварительно обработанные в течение 3 ч 0,5%-ным полиэтиленимином. Фильтры ополаскивали дважды 5 мл буфера при 4 С и измеряли радиоактивность на каждом фильтре жидкостной сцинтиграфией. Определяли неспецифическую связь в присутствии (-)-никотина в конечной концентрации 2 мМ; неспецифическая связь составляла примерно от 30 до 40% общей связи, полученной на фильтре. Для каждой концентрации исследуемого продукта определяли процент ингибирования специфической связи [3 Н]-эпибатидина, затем вычисляли Cl50, концентрацию соединения, ингибирующую специфическую связь на 50%.Cl50 соединений по изобретению составляет от 1 до 10 мкМ. Полученные результаты показывают, что некоторые соединения по изобретению являются селективными лигандами для подгруппы 7 никотинового рецептора, а другие являются смешанными 42 и 7. Эти результаты показывают, что соединения по изобретению можно использовать для лечения или предупреждения расстройств, связанных с дисфункцией никотиновых рецепторов, в частности центральной нервной системы. К этим расстройствам относятся когнитивные изменения, более конкретно - мнезические (восприимчивость, консолидация, отклик), а также нарушение внимания и нарушения функций исполнения, связанные с болезнью Альцгеймера, патологическим (Age Associated Memory Impairment, AAMI) или нормальным (старческая деменция) старением, с синдромом Паркинсона, трисомией 21 (синдром Дауна), с психическими патологиями (в частности, с когнитивными нарушениями, ассоциированными с шизофренией), корсаковским алкогольным синдромом, сосудистой деменцией (multi-infarct dementia, MDI), черепно-мозговыми травмами. Соединения по изобретению могут также применяться в лечении двигательных нарушений, наблюдаемых при болезни Паркинсона, или других неврологических заболеваний, таких как хорея Гентингтона, синдром Туретта, поздняя дискинезия и гиперкинезия. Они могут также обладать терапевтической нейрозащитной активностью в отношении анатомогистопатологических поражений, связанных с указанными нейродегенеративными заболеваниями. Соединения по изобретению могут также применяться при терапевтическом или симптоматическом- 12014023 лечении нарушения мозгового кровообращения и приступов церебральной гипоксии. Их можно применять в случае психиатрических патологий: шизофрении (позитивные и/или негативные симптомы), биполярных нарушений, депрессии, тревоги, панических атак, нарушений внимания, сопровождающихся гиперактивностью, компульсивных и навязчивых состояний. Они могут предупреждать симптомы, связанные с табакокурением, алкоголизмом, различными веществами, вызывающими зависимость, такими как кокаин, ЛСД, конопля, бензодиазепины. Они могут быть полезны при лечении болей различного происхождения (включая боли хронического, неврологического и воспалительного характера). К тому же соединения по изобретению можно использовать при лечении ишемии нижних конечностей, облитерирующего артрита нижних конечностей (PAD: peripheral arterial disease), ишемической болезни сердца (устойчивая стенокардия), инфаркта миокарда, сердечной недостаточности, варикозных язв при венозной недостаточности. Соединения согласно изобретению могут также быть применены для лечения воспалительных состояний различного происхождения, в частности для состояний, связанных с центральной нервной системой. Соединения по изобретению можно использовать для получения лекарственных средств, в частности лекарственных средств, пригодных для лечения и предупреждения нарушений, связанных с дисфункцией никотиновых рецепторов, в частности нарушений, указанных выше. Так, в соответствии с одним из аспектов настоящее изобретение относится к лекарственным средствам, содержащим соединение формулы (I), или аддитивную соль этого соединения с фармацевтически приемлемой кислотой, или гидрат, или сольват соединения формулы (I). Эти лекарственные средства применяются в терапии, в частности, для лечения или профилактики нарушений, связанных с дисфункцией никотиновых рецепторов, в частности нарушений, указанных выше. В соответствии с другим из аспектов настоящее изобретение относится к фармацевтическим композициям, содержащим в качестве активного вещества соединение по изобретению. Эти фармацевтические композиции содержат эффективную дозу по меньшей мере одного соединения по изобретению, или фармацевтически приемлемую соль, или гидрат, или сольват указанного соединения, а также по меньшей мере один фармацевтически приемлемый эксципиент. Указанные эксципиенты выбирают в зависимости от фармацевтически приемлемой формы и требуемого способа введения из традиционных эксципиентов,известных специалисту. В фармацевтических композициях по настоящему изобретению для орального, сублингвального,подкожного, внутримышечного, внутривенного, местного, локального, интратрахеального, через нос,чрескожного или ректального введения активное вещество указанной выше формулы (I) или, возможно,его соль, сольват или гидрат можно вводить в разовой форме в смеси с классическими фармацевтическими эксципиентами животным или людям для профилактики или лечения нарушений или заболеваний,указанных выше. Соответствующие разовые формы введения содержат формы перорального введения, такие как таблетки, мягкие или твердые желатиновые капсулы, порошки, гранулы, растворы или суспензии для перорального введения; формы введения: сублингвальную, через рот, интратрахеальную, через глаза, через нос, путем ингаляции, формы введения: местную, чрескожную, подкожную, внутримышечную или внутривенную; формы введения: ректальную и имплантаты. Для местного применения можно использовать соединения по изобретению в составе кремов, гелей, мазей и лосьонов. В качестве примера форма для разового введения соединения по изобретению в виде таблетки может содержать следующие компоненты: Соединение по изобретению 50,0 мг Маннит 223,75 мг Натриевую кроскармеллозу 6,0 мг Кукурузный крахмал 15,0 мг Гидроксипропилметилцеллюлозу 2,25 мг Стеарат магния 3,0 мг Указанные разовые формы имеют дозировку, обеспечивающую суточное введение от 0,01 до 20 мг активного вещества на кг веса тела в зависимости от галеновой формы. В отдельных частных случаях может потребоваться увеличить или уменьшить дозировку, что не выходит за рамки изобретения. В соответствии с обычной практикой дозировку для каждого пациента определяет врач в зависимости от способа введения, веса тела и ответа данного пациента. В соответствии с одним из аспектов настоящее изобретение относится также к методу лечения указанных выше патологий, включающему введение пациенту эффективной дозы соединения по изобретению, или одной из его фармацевтически приемлемых солей, или гидратов, или сольватов.- 13014023 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение общей формулы (I) в которой R обозначает группу, выбранную из пиразолила, имидазолила, триазолила, оксазолила,оксадиазолила, тиазолила, изотиазолила, тиадиазолила, тетразолила, причем указанная группа, возможно, замещена одной или несколькими группами, выбранными из галогенов, (C1-C6)алкила, (C1C6)алкокси, трифторметокси, трифторметила, нитро, циано, гидрокси, амино, (C1-C6)алкиламино или ди(C1-C6)алкиламино; связь углерод-углерод между положениями 3 и 4 азабициклооктанового кольца является простой или двойной,в виде основания или аддитивной соли с кислотой, а также в виде гидрата или сольвата. 2. Соединение формулы (I) по п.1, отличающееся тем, чтоR обозначает группу, выбранную из пиразолила, имидазолила, триазолила, оксазолила, оксадиазолила, тиазолила, изотиазолила, тиадиазолила, тетразолила, причем эта группа может быть замещена одной или несколькими группами (C1-C6)алкила; и связь углерод-углерод между положениями 3 и 4 азабициклооктанового кольца является простой или двойной,в виде основания или аддитивной соли с кислотой, а также в виде гидрата или сольвата. 3. Соединение формулы (I) по п.1, отличающееся тем, чтоR обозначает группу, выбранную из пиразолила, имидазолила, триазолила, оксазолила, оксадиазолила, тиазолила, тетразолила, причем эта группа может быть замещена одной или несколькими группами, выбранными из галогенов (C1-C6)алкила, (C1-C6)алкокси, трифторметокси, трифторметила, нитро,циано, гидрокси, амино, (C1-C6)алкиламино или ди(C1-C6)алкиламино; и связь углерод-углерод между положениями 3 и 4 азабициклооктанового кольца является простой или двойной,в виде основания или аддитивной соли с кислотой, а также в виде гидрата или сольвата. 4. Соединение формулы (I) по п.1 или 3, отличающееся тем, чтоR обозначает группу, выбранную из пиразолила, имидазолила, триазолила, оксазолила, оксадиазолила, тиазолила, тетразолила, причем эта группа может быть замещена одной или несколькими (C1C6)алкильными группами; и связь углерод-углерод между положениями 3 и 4 азабициклооктанового кольца является простой или двойной,в виде основания или аддитивной соли с кислотой, а также в виде гидрата или сольвата. 5. Соединение формулы (I) по п.1 или 2, отличающееся тем, чтоR обозначает группу пиразолила, возможно, замещенную одной или несколькими группами (C1C6)алкила, (C1-C6)алкокси, трифторметокси, трифторметила, нитро, циано, гидрокси, амино, (C1C6)алкиламино или ди(C1-C6)алкиламино; и связь углерод-углерод между положениями 3 и 4 азабициклооктанового кольца является простой или двойной,в виде основания или аддитивной соли с кислотой, а также в виде гидрата или сольвата. 6. Соединение формулы (I) по любому из пп.1-5, отличающееся тем, чтоR обозначает группу пиразолила, возможно замещенную одной или несколькими (C1C6)алкильными группами; и связь углерод-углерод между положениями 3 и 4 азабициклооктанового кольца является простой или двойной,в виде основания или аддитивной соли с кислотой, а также в виде гидрата или сольвата. 7. Соединение формулы (I) по любому из пп.1-6, отличающееся тем, чтоR обозначает группу пиразолила, возможно, замещенную одной или несколькими (C1C6)алкильными группами; и связь углерод-углерод между положениями 3 и 4 азабициклооктанового кольца является простой,в виде основания или аддитивной соли с кислотой, а также в виде гидрата или сольвата. 8. Соединение формулы (I) по любому из пп.1-4, отличающееся тем, что его выбирают из следующих соединений: 5-[2-(1-метил-1 Н-пиразол-4-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октан;- 14014023 5-[2-(1 Н-пиразол-4-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октан; 5-[2-(1 Н-пиразол-4-ил)пиридин-5-ил]-1-азабицикло[3.2.1]окт-3-ен; 5-[2-(1-метил-1 Н-пиразол-4-ил)пиридин-5-ил]-1-азабицикло[3.2.1]окт-3-ен; 5-[2-(1 Н-имидазол-1-ил)пиридин-5-ил]-1-азабицикло[3.2.1]окт-3-ен; 5-[2-(1 Н-имидазол-4-ил)пиридин-5-ил]-1-азабицикло[3.2.1]окт-3-ен; 5-[2-(1 Н-имидазол-4-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октан; 5-[2-(1 Н-имидазол-1-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октан; 5-[2-(1 Н-имидазол-2-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октан; 5-[2-(3,5-диметил-1 Н-пиразол-4-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октан; 5-[2-(1 Н-1,2,4-триазол-3-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октан; 5-[2-(5-метил-1,2,4-оксадиазол-3-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октан; 5-[2-(1,3-оксазол-2-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октан; 5-[2-(тиазол-4-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октан; 5-[2-(пиразол-3-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октан; 5-[2-(2-метилтиазол-5-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октан; 5-[2-(тетразол-5-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октан; 5-[2-(1-изобутил-1 Н-пиразол-4-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октан; 5-[2-(1-н-пропил-1 Н-пиразол-4-ил)пиридин-5-ил]-1-азабицикло[3.2.1]октан; в виде основания или аддитивной соли с кислотой, а также в виде гидрата или сольвата; в виде чистого энантиомера или смеси энантиомеров. 9. Способ получения соединения формулы (I) по любому из пп.1-8, отличающийся тем, что подвергают взаимодействию соединение формулы (V) или (VI) в которой Z обозначает атом брома,или с бороновой кислотой формулы R-B(OH)2, в которой R является таким, как определено для общей формулы (I), в присутствии катализатора, содержащего палладий,или с соединением формулы R-H, в которой R является таким, как определено для общей формулы(I), в присутствии сильного основания в растворителе,или с содержащим двухвалентное олово производным формулы R-Sn[(СН 2)3 СН 3)]3, в которой R является таким, как определено для общей формулы (I), в присутствии катализатора, содержащего палладий,или с соединением формулы R-H, в которой R является таким, как определено для общей формулы(I), в присутствии н-бутиллития, хлорида цинка и катализатора, содержащего палладий. 10. Способ получения соединения формулы (I) в которой R обозначает группу, выбранную из триазолила, оксазолила, оксадиазолила, тетразолила,причем эта группа может быть, возможно, замещена одной или несколькими группами, выбранными из галогенов (C1-C6)алкила, (C1-C6)алкокси, трифторметокси, трифторметила, нитро, циано, гидрокси, амино, (C1-C6)алкиламино или ди(C1-C6)алкиламино; и связь углерод-углерод между положениями 3 и 4 азабициклооктанового кольца является простой,отличающийся тем, что подвергают взаимодействию соединение формулы (VI) в которой Z обозначает атом брома,в присутствии цианида калия и тетракис(трифенилфосфино)палладия в растворителе,- 15014023 для получения формулы (VII) затем если R обозначает триазолил, подвергают взаимодействию соединение формулы (VII) в присутствии сильного основания с муравьиным гидразином в растворителе; если R обозначает оксадиазолил, преобразуют соединение формулы (VII) в N-гидроксикарбоксамидин формулы (VIII) в присутствии гидроксиламинхлоргидрата в щелочной среде,затем подвергают взаимодействию соединение формулы (VIII) с уксусным ангидридом в растворителе,если R обозначает тетразолил, подвергают взаимодействию соединение формулы (VII) с азидом натрия в присутствии хлорида аммония в растворителе. 11. Соединение формулы (VII) 13. Лекарственное средство, отличающееся тем, что содержит соединение формулы (I) по любому из пп.1-8, или аддитивную соль этого соединения с фармацевтически приемлемой кислотой, или гидрат,или сольват. 14. Фармацевтическая композиция, отличающаяся тем, что содержит соединение формулы (I) по любому из пп.1-8, или фармацевтически приемлемую соль, гидрат или сольват указанного соединения, а также по меньшей мере один фармацевтически приемлемый эксципиент. 15. Применение соединения формулы (I) по любому из пп.1-8 для получения лекарственного средства, предназначенного для лечения и профилактики когнитивных изменений, нарушения внимания, нарушений функций исполнения, связанных с болезнью Альцгеймера, патологическим или нормальным старением, с синдромом Паркинсона, с трисомией 21, с психическими патологиями, корсаковским алкогольным синдромом, сосудистой деменцией, черепно-мозговыми травмами, двигательных нарушений,наблюдаемых при болезни Паркинсона, или других неврологических заболеваний, или анатомогистопатологических поражений, связанных с вышеуказанными нейродегенеративными заболеваниями. 16. Применение соединения формулы (I) по любому из пп.1-8 для получения лекарственного средства, предназначенного для лечения и профилактики нарушения мозгового кровообращения, приступов церебральной гипоксии, психиатрических патологий. 17. Применение соединения формулы (I) по любому из пп.1-8 для получения лекарственного средства, предназначенного для профилактики симптомов, связанных с табакокурением, алкоголизмом, различными веществами, вызывающими зависимость. 18. Применение соединения формулы (I) по любому из пп.1-8 для получения лекарственного средства, предназначенного для лечения боли. 19. Применение соединения формулы (I) по любому из пп.1-8 для получения лекарственного средства, предназначенного для лечения ишемии нижних конечностей, облитерирующего артрита нижних конечностей, ишемической болезни сердца, инфаркта миокарда, сердечной недостаточности, недостаточной заживляемости кожного покрова у больных диабетом, варикозных язв при венозной недоста- 16014023 точности. 20. Применение соединения формулы (I) по любому из пп.1-8 для получения лекарственного средства, предназначенного для лечения воспалительных процессов.
МПК / Метки
МПК: A61P 25/00, A61K 31/439, C07D 471/18
Метки: производные, 5-пиридинил-1-азабицикло, терапии, 3.2.1, получение, октана, применение
Код ссылки
<a href="https://eas.patents.su/18-14023-proizvodnye-5-piridinil-1-azabiciklo-321-oktana-ih-poluchenie-i-ih-primenenie-v-terapii.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 5-пиридинил-1-азабицикло [3.2.1] октана, их получение и их применение в терапии</a>