Арилвинилазациклоалкановые соединения и способы их получения и применения
Номер патента: 10870
Опубликовано: 30.12.2008
Авторы: Далл Гари Морис, Шев Мишель, Шмитт Джеффри Дэниел, Капе Марк, Женевуа-Борелла Ариель
Формула / Реферат
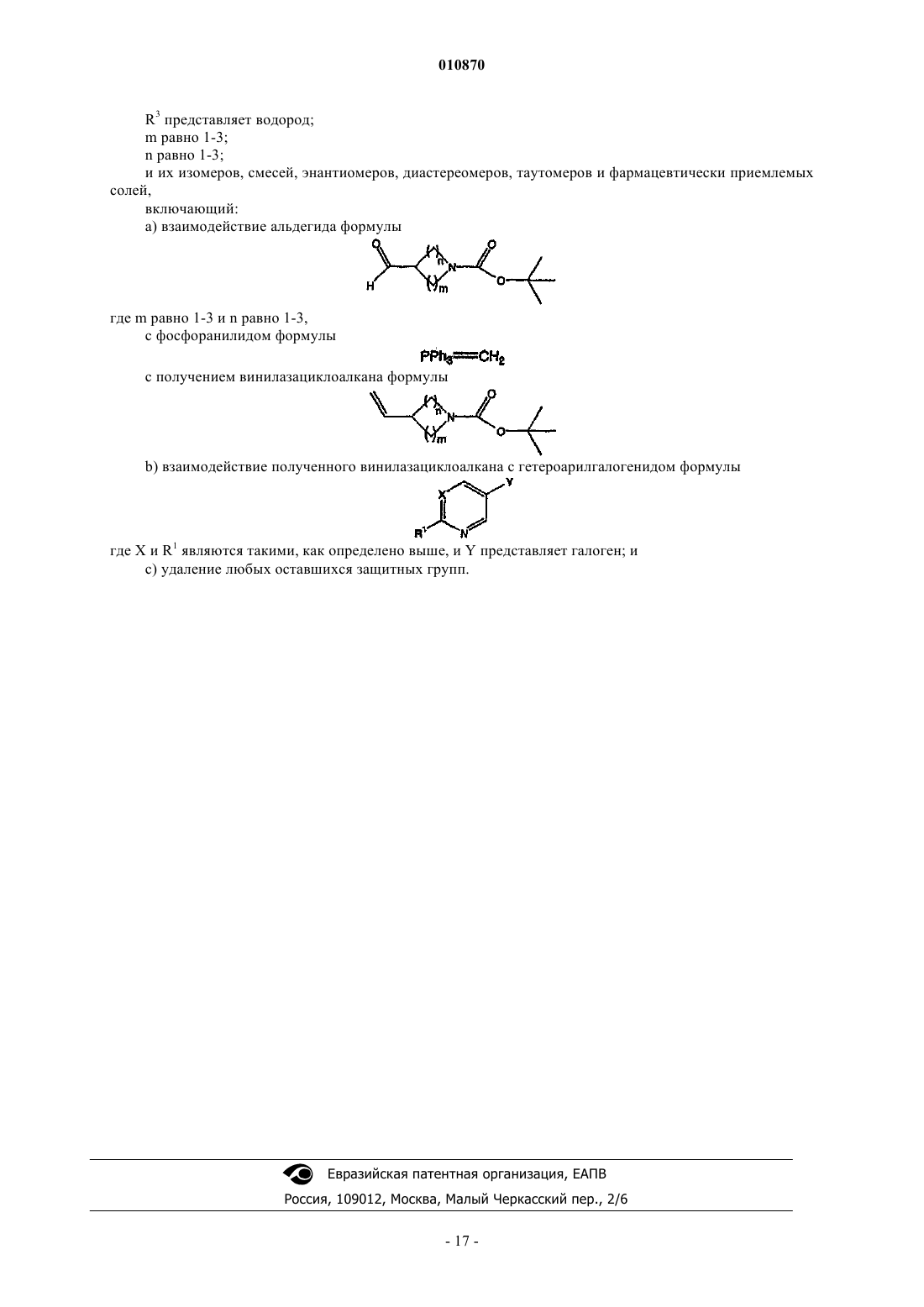
1. Арилвинилазациклоалкановые соединения формулы

где волнистая линия представляет различные возможные геометрии (Е или Z) двойной связи;
X представляет азот;
R1 представляет водород или галоген;
R3 представляет водород;
m равно 1-3;
n равно 1-3;
и их изомеры, смеси, энантиомеры, диастереомеры, таутомеры и фармацевтически приемлемые соли.
2. Соединение по п.1, где R1 представляет водород.
3. Соединение по п.1, где n=1.
4. Соединение по п.1, где m=2.
5. Соединение, выбранное из группы, состоящей из
(R)- и (S)-5-((Е)-2-пирролидин-3-илвинил)пиримидина;
5-((Е)-2-пиперидин-4-илвинил)пиримидина;
5-((Е)-2-азетидин-3-илвинил)пиримидина;
их изомеров, их смесей, включая рацемические смеси, энантиомеров, и их таутомеров, и их фармацевтически приемлемых солей.
6. Способ лечения нейродегенеративных расстройств, включающий введение пациенту, нуждающемуся в таком лечении, эффективного количества арилвинилазациклоалканового соединения формулы
где волнистая линия представляет различные возможные геометрии (Е или Z) двойной связи;
X представляет азот;
R1 представляет водород или галоген;
R3 представляет водород;
m равно 1-3;
n равно 1-3;
и его изомеров, смесей, энантиомеров, диастереомеров, таутомеров и фармацевтически приемлемых солей.
7. Способ по п.6, где R1 представляет водород.
8. Способ по п.6, где n=1.
9. Способ по п.6, где m=2.
10. Способ по п.6, где нейродегенеративные расстройства возникают из-за несоответствующих уровней высвобождения нейротрансмиттера, несоответствующих свойств рецепторов нейротрансмиттеров и/или несоответствующих взаимодействий между нейротрансмиттерами и рецепторами нейротрансмиттеров.
11. Способ по п.10, где расстройства возникают из-за дефицита ацетилхолина, допамина, норэпинефрина и/или серотонина.
12. Способ по п.6, где расстройство выбирается из группы, состоящей из пресенильного слабоумия (ранняя стадия болезни Альцгеймера), сенильного слабоумия (слабоумие типа Альцгеймера), преждевременной амнезии и когнитивных расстройств, которые связаны с возрастом или последствиями алкоголизма, микроинфарктного слабоумия и сосудистого слабоумия, слабоумия, связанного со СПИДом, болезни Кройцфельда-Якоба, болезни Пика, болезни Паркинсона, слабоумия с тельцами Леви, прогрессирующего надъядерного паралича, хореи Хантингтона, поздней дискинезии, гиперкинезии, мании, эпилепсии, расстройств дефицита внимания, беспокойства, дислексии, шизофрении, депрессии, обсессивно-компульсивных расстройств, синдрома Туретта, амиотропного латерального склероза, множественного склероза, периферической нейротрофии, и травм головного или спинного мозга, и лекарственной зависимости.
13. Способ обезболивания и/или лечения воспалительных желудочно-кишечных расстройств, включающий введение пациенту, нуждающемуся в таком лечении, эффективного количества арилвинилазациклоалканового соединения формулы

где волнистая линия представляет различные возможные геометрии (Е или Z) двойной связи;
X представляет азот;
R1 представляет водород или галоген;
R3 представляет водород;
m равно 1-3;
n равно 1-3;
и его изомеров, смесей, энантиомеров, диастереомеров, таутомеров и фармацевтически приемлемых солей.
14. Способ по п.13, где R1 представляет водород.
15. Способ по п.13, где n=1.
16. Способ по п.13, где m=2.
17. Способ по п.13, где воспалительное расстройство выбирается из группы, состоящей из диареи, болезни Крона, беспокоящего кишечного синдрома и язвенного колита.
18. Способ обезболивания и/или лечения воспалительных расстройств, включающий введение пациенту, нуждающемуся в таком лечении, эффективного противовоспалительного количества соединения, выбранного из группы, состоящей из
(R)- и (S)-5-((Е)-2-пирролидин-3-илвинил)пиримидина;
5-((Е)-2-пиперидин-4-илвинил)пиримидина;
5-((Е)-2-азетидин-3-илвинил)пиримидина;
их изомеров, их смесей, включая рацемические смеси, их энантиомеров, и таутомеров, и их фармацевтически приемлемых солей, пациенту, нуждающемуся в лечении ими.
19. Способ получения арилвинилазациклоалкановых соединений формулы

где волнистая линия представляет различные возможные геометрии (Е или Z) двойной связи;
X представляет азот;
R1 представляет водород или галоген;
R3 представляет водород;
m равно 1-3;
n равно 1-3;
и их изомеров, смесей, энантиомеров, диастереомеров, таутомеров и фармацевтически приемлемых солей,
включающий:
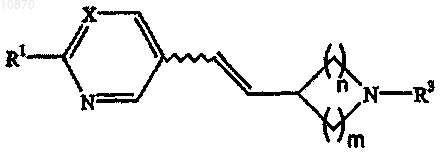
а) взаимодействие альдегида формулы

где m равно 1-3 и n равно 1-3,
с фосфоранилидом формулы
![]()
с получением винилазациклоалкана формулы
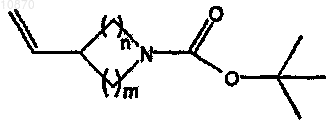
b) взаимодействие полученного винилазациклоалкана с гетероарилгалогенидом формулы
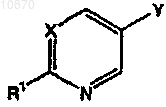
где X и R1 являются такими, как определено выше, и Y представляет галоген; и
с) удаление любых оставшихся защитных групп.
Текст
010870 Настоящее изобретение относится к фармацевтическим композициям, содержащим соединения,способные воздействовать на никотиновые ацетилхолинэргические рецепторы (nAChR), например, в качестве модуляторов конкретных подтипов никотиновых рецепторов. Настоящее изобретение также относится к способам лечения различных состояний и расстройств, в частности расстройств, связанных с дисфункцией центральной и периферической нервной системы. Никотин, как полагают, обладает рядом фармакологических воздействий. См., например, Pullan etal., N. Engl. J. Med., 330: 811-815 (1994). Некоторые из этих воздействий могут быть связаны воздействиями при высвобождении нейротрансмиттеров. Сообщается о высвобождении ацетилхолина, допамина,норэпинефрина, серотонина и глютамата при введении никотина (Rowell et al., J. Neurochem., 43: 1593Ther., 296: 91 (1977); и Toth et al., Neurochem Res., 17: 265 (1992. Подтверждающие сообщения и недавние дополнительные исследования включают модуляцию в центральной нервной системе (CNS) глютамата, окиси азота, GABA, тахикининов, цитокинов и пептидов (обзор Brioni et al., Adv. Pharmacol., 37: 153 (1997. В дополнение к этому, согласно сообщениям никотин усиливает фармакологические свойства определенных фармацевтических композиций, используемых для лечения определенных расстройств. См., например, Sanberg et al., Pharmacol. Biochem.Beliavior, 46: 303 (1993); Harsing et al., J. Neurochem.,59: 48 (1993) и Hughes, Proceedings from Intl. Symp. Nic. S40 (1994). Кроме того, предлагаются нейропротекторные воздействия никотина, см., например, Sjak-shie et al., Brain Res., 624: 295 (1993). Также предлагаются различные иные фармакологические воздействия. См., например, Decina et al., Biol. Psychiatry,28: 502 (1990); Wagner et al., Pharmacopsychiatry, 21: 301 (1988); Pomerleau et al., Addictive Behaviors, 9: 265 (1984); Onaivi et al., Life Sci., 54 (3): 193 (1994); Tripathi et al., J. Pharmacol. Exp. Ther., 221: 91 (1982) иHamon, Trends в Pharmacol. Res., 15: 36 (1994). Сообщается, что различные соединения, мишенью которых являются nAChR, являются полезными для лечения большого количества состояний и расстройств. См., например, Williams et al., DNP, 7 (4): 205 (1994); Arneric et al., CNS Drug Rev., 1 (1): 1 (1995); Arneric et al., Exp. Opin. Invest. Drug, 5 (1): 79(28): 4169 (1997); Bannon et al., Science, 279: 77 (1998); PCT WO 94/08992, заявки на международные патенты WO 96/31475, WO 96/40682 и патенты США 5583140, Bencherif et al., 5597919, Dull et al.,5604231, Smith et al. и 5852041, Cosford et al. Никотиновые соединения, как сообщается, являются особенно полезными для лечения большого количества расстройств CNS. Известно, что большое количество никотиновых соединений имеют терапевтические свойства. См., например, Bencherif and Schmitt, CurrentDisorders, 1 (4): 399-411 (2002), патенты США 51871166, Kikuchi et al., 5672601, Cignarella, заявки на международные патенты WO 99/21834 и WO 97/40049, заявку на патент Великобритании 2295387 и заявку на европейский патент 297858. Расстройства CNS представляют тип неврологического расстройства. Расстройства CNS могут вызываться лекарственными средствами; могут быть связаны с генетической предрасположенностью, инфекцией или травмой или могут иметь неизвестную этиологию. Расстройства CNS включают невропсихиатрические расстройства, неврологические заболевания и ментальные заболевания и включают нейродегенеративные заболевания, нарушения поведения, когнитивные расстройства и когнитивные аффективные расстройства. Существует несколько расстройств CNS, клинические проявления которых приписывают дисфункции CNS (например, расстройства, возникающие из-за несоответствующих уровней высвобождения нейротрансмиттера, несоответствующих свойств рецепторов нейротрансмиттеров и/или несоответствующих взаимодействий между нейротрансмиттерами и рецепторами нейротрансмиттеров). Несколько расстройств CNS может быть приписано дефициту ацетилхолина, допамина, норэпинефрина и/или серотонина. Относительно распространенные расстройства CNS включают пресенильное слабоумие (ранняя стадия болезни Альцгеймера), сенильное слабоумие (слабоумие типа Альцгеймера), слабоумие при микроинфаркте, слабоумие, связанное со СПИДом, сосудистое слабоумие, болезнь Кройцфельда-Якоба, болезнь Пика, паркинсонизм, включая болезнь Паркинсона, слабоумие с тельцами Леви, прогрессирующий надъядерный паралич, хорею Хантингтона, позднюю дискинезию, гиперкинезию, эпилепсию, манию,расстройство дефицита внимания, беспокойство, дислексию, шизофрению, депрессию, обсессивнокомпульсивные расстройства и синдром Туретта. Подтипы nAChR существуют как в центральной, так и в периферической нервной системе, но распределение подтипов является гетерогенным. Например, подтипы, которые преобладают в спинном мозге, представляют 42, 7 и 32, в то время как подтипы, которые преобладают в автономных ганглиях, представляют 34, а подтипы нервно-мышечного соединения представляют 11 и 11 (см.,-1 010870 например, Dwoskin et al., Exp. Opin. Ther. Patents 10: 1561 (2000) и Schmitt and Bencherif, Annual Reports вMed. Client. 35: 41 (2000. Ограничение некоторых никотиновых соединений заключается в том, что они оказывают различные нежелательные фармакологические воздействия вследствие их взаимодействия сnAChR в периферийных тканях (например, стимулируя мышечные и ганглиозные подтипы nAChR). Было бы желательным получение соединений, композиций и способов для профилактики и/или лечения различных состояний или расстройств (например, расстройств CNS), включая облегчение симптомов этих расстройств, где соединения проявляют никотиновую фармакологию с преимущественным воздействием на nAChR CNS (например, при функционировании CNS), но без значительных сопутствующих воздействий на периферические nAChR (соединения, специфичные к nAChR CNS). Кроме того, было бы очень желательно создание соединений, композиций и способов, которые воздействуют на функционирование CNS без значительного воздействия на те подтипы рецепторов, которые обладают потенциальной возможностью к индуцированию нежелательных побочных воздействий (например, заметной активности активных центров сердечно-сосудистых и скелетных мышц). Настоящее изобретение предусматривает такие соединения, композиции и способы. Настоящее изобретение относится к винилазациклоалкановым соединениям формулы (I) где волнистая линия представляет различные возможные геометрии (Е или Z) двойной связи;X представляет азот или C-R2;R1 представляет водород или галоген;S или О, или -OR6, каждый из которых может быть дополнительно замещен галогеном, -CN и С 1-6 алкилом;R6 представляет C1-6 алкил, который может быть замещен С 3-6 циклоалкилом; фенил, который может быть замещен -CN или -OR8; или 6-членный гетероциклил, содержащий в качестве гетероатома О;R8 представляет C1-6 алкил; и их изомерам, смесям, энантиомерам, диастереомерам, таутомерам и фармацевтически приемлемым солям. Также включаются изомеры, смеси, включая рацемические смеси, энантиомеры, диастереомеры и таутомеры этих соединений, а также их фармацевтически приемлемые соли. Более конкретно настоящее изобретение относится к производным формулы (I), в которой геометрия двойной связи представляет Е;R6 представляет C1-6 алкил, арил(фенил) или 6-членный гетероциклил; и к их изомерам, их смесям, включая их рацемические смеси, энантиомеры, диастереомеры, и их таутомеры, и их фармацевтически приемлемые соли, и к их использованию в качестве лигандов nAChR. Соединения формулы (I) и их фармацевтически приемлемые соли могут использоваться для лечения заболеваний, связанных с дисфункцией nAChR, в частности, в центральной нервной системе или в желудочно-кишечной системе. Термин "лечить" включает благоприятные воздействия как на симптомы,так и/или на протекание рассматриваемого заболевания. Примерами типов расстройств, которые могут лечиться, являются нейродегенеративные расстройства, включая расстройства центральной нервной системы, такие как болезнь Альцгеймера и другие виды слабоумия, двигательные расстройства, такие как болезнь Паркинсона, лекарственную зависимость,нарушения поведения и воспалительные расстройства в желудочно-кишечной системе. Соединения могут также служить в качестве анальгетиков, например, при лечении острой, хронической или рецидивной боли. Подробное описание изобретения Соединения и способы, описанные в описании, будут лучше понятны со ссылками на следующие далее предпочтительные варианты осуществления. Следующие далее определения будут полезны при определении объема настоящего изобретения. Как указано в описании, C1-6 алкильные радикалы (низшие алкильные радикалы) содержат от 1 до 6 ато-2 010870 мов углерода в прямой или разветвленной цепи и также включают С 3-6 циклоалкильные остатки и алкильные радикалы, которые содержат С 3-6 циклоалкильные остатки. Как указано в описании, C1-6 алкоксирадикалы содержат от 1 до 6 атомов углерода в прямой или разветвленной цепи и также включают С 3-6 циклоалкильные и алкоксирадикалы, которые содержат С 3-6 циклоалкильные остатки. Как указано в описании, гетероарильные радикалы являются 5-членными, включая 1 или несколько гетероатомов, выбранных из кислорода или серы. Примеры соответствующих 5-членных кольцевых гетероарильных остатков включают фурил, тиофенил, оксазолил, тиазолил, тиенил. Термин "галоген" включает хлор, йод, фтор или бром. Как указано в описании, гетероциклические радикалы являются 6-членными, содержат 1 гетероатом, выбранный из кислорода. Как указано в описании, циклоалкильные радикалы содержат от 3 до 6 атомов углерода. Примеры соответствующих циклоалкильных радикалов включают, не ограничиваясь, циклопропил,циклобутил, циклопентил, циклогексил. Примеры пригодных для использования фармацевтически приемлемых солей включают кислотноаддитивные соли неорганических кислот, такие как хлорид, бромид, сульфат, фосфат и нитрат; кислотноаддитивные соли органических кислот, такие как ацетат, галактарат, пропионат, сукцинат, лактат, гликолят, малат, тартрат, цитрат, малеат, фумарат, метансульфонат, п-толуолсульфонат и аскорбат; соли кислотных аминокислот, такие как аспартат и глютамат; соли щелочных металлов, такие как соль натрия и соль калия; соли щелочно-земельных металлов, такие как соль магния и соль кальция; соль аммония; органические основные соли, такие как соль триметиламина, соль триэтиламина, соль пиридина, соль пиколина, соль дициклогексиламина и соль N,N'-дибензилэтилендиамина; и соли основных аминокислот,такие как соль лизина и соль аргинина. Соли могут представлять собой в некоторых случаях гидраты или сольваты в этаноле. Репрезентативные соли приводятся, как описано, в патентах США 5597919, Dullet al., 5616716, Dull et al. и 5663356, Ruecroft et al. Термин "агонист" означает вещество, которое стимулирует его партнера по связыванию, как правило, рецептор. Стимулирование определяется в контексте конкретного анализа или может быть очевидным из литературы, в которой сравнивается с фактором или веществом, которое принимается в качестве агониста или антагониста конкретного партнера по связыванию в подобных, по существу, обстоятельствах,как ясно специалистам в данной области. Стимулирование может определяться по отношению к увеличению конкретного воздействия или функции, которая индуцируется посредством взаимодействия агониста или частичного агониста с партнером по связыванию и может включать аллостерические эффекты. Термин "антагонист" означает вещество, которое ингибирует своего партнера по связыванию, как правило, рецептор. Ингибирование определяется в контексте конкретного анализа или может быть очевидным из литературы, в которой осуществляется сравнение с фактором или веществом, которое принимается в качестве агониста или антагониста конкретного партнера по связыванию в сходных, по существу,обстоятельствах, как очевидно специалистам в данной области. Ингибирование может определяться по отношению к уменьшению конкретного воздействия или функции, которое индуцируется посредством взаимодействия антагониста с партнером по связыванию, и может включать аллостерические эффекты. Термин "частичный агонист" означает вещество, которое обеспечивает уровень стимулирования своего партнера по связыванию, который является промежуточным между полным или абсолютным антагонистом и агонистом, определяемый с помощью любого принятого стандарта активности агониста. Будет ясно, что стимулирование, а, следовательно, и ингибирование, определяется изначально для каждого вещества или категории веществ, которые должны определяться в качестве агонистов, антагонистов или частичных агонистов. Как указывается в описании, "изначальная активность" или "эффективность" относится к некой мере биологической эффективности комплекса с партнером по связыванию. Что касается фармакологии рецепторов, контекст, в котором должна определяться изначальная активность или эффективность, будет зависеть от контекста партнера по связыванию в комплексе (например, рецептор/лиганд) и рассмотрения активности, важной для конкретного биологического результата. Например,в некоторых обстоятельствах изначальная активность может изменяться в зависимости от конкретной вовлеченной второй сигнальной системы. См. Hoyer, D. and Boddeke, H., Trends Pharmacol. Sci., 14 (7): 270-5 (1993). Где именно такие специфичные к контексту оценки являются важными и как они могут быть важны в контексте настоящего изобретения, будет ясно специалисту в данной области. Как указано в описании, нейротрансмиттеры, высвобождение которых опосредовано соединениями,описанными в описании, включают, но не ограничиваясь этим, ацетилхолин, допамин, норэпинефрин,серотонин и глютамат, и соединения, описанные в описании, функционируют в качестве агонистов или частичных агонистов для одного или нескольких nAChR CNS.I. Соединения. Соединения формулы (I) имеют один или несколько асимметричных атомов углерода и поэтому могут существовать в форме изомеров, рацемических смесей, энантиомеров и диастереомеров. Эти индивидуальные соединения и их смеси, как предполагается, находятся в объеме настоящего изобретения. Следующее далее представляют репрезентативные соединения формулы (I):(R)- и (S)-3-циклопропилметокси-5-Е)-2-пиперидин-3-илвинил)пиридин; 5-Е)-2-пиперидин-4-илвинил)пиримидин; 2-хлор-5-Е)-2-пиперидин-4-илвинил)пиридин; 5-Е)-2-азетидин-3-илвинил)пиримидин; 3-фенокси-5-Е)-2-пиперидин-4-илвинил)пиридин; 3-фенокси-5-Е)-2-(1-метилпиперидин-4-ил)винил)пиридин; 3-фенокси-5-Е)-2-азетидин-3-илвинил)пиридин и 3-фенокси-5-Е)-2-(1-метилазетидин-3-ил)винил)пиридин. В каждом из этих соединений их индивидуальные изомеры, их смеси, включая их рацемические смеси, энантиомеры, диастереомеры и их таутомеры, и их фармацевтически приемлемые соли, как предполагается, включены в объем настоящего изобретения.II. Получение соединений. В то время, как другие стратегии синтеза будут очевидны специалистам в данной области, соединения формулы (I), где R3 представляет водород, могут быть получены из соединения общей формулы (II) в соответствии со следующей общей схемой синтеза: Общая схема синтеза представляет следующее:a) альдегид общей формулы (II) взаимодействует с фосфоранилидом (III);b) винилазациклоалкан общей формулы (IV) взаимодействует с гетероарилгалогенидом общей формулы (V) (где Y=галоген);c) трет-бутоксикарбонильная группа исключается из соединения общей формулы (VI); и продукт выделяется и необязательно преобразуется в фармацевтически приемлемую соль. Взаимодействие (а) между альдегидом общей формулы (II) и фосфоранилидом (III) преимущественно проводится в инертной атмосфере (например, в азоте или аргоне), в инертном растворителе, таком как тетрагидрофуран, при температуре, находящейся в пределах между -10 С и температурой кипения реакционной смеси, предпочтительно при температуре от примерно -5 до примерно 22 С. Взаимодействие (b) между винилазациклоалканом общей формулы (IV) и соответствующим гетероарилгалогенидом общей формулы (V) преимущественно проводят в инертной атмосфере, в присутствии катализатора, такого как ацетат палладия, основания, такого как диизопропилэтиламин, и неорганической соли, такой как хлорид лития, в инертном растворителе, таком как диметилфомамид, при температуре от 20 С до температуры кипения реакционной смеси. В идеале, температура реакционной смеси составляет примерно 110 С. В другом варианте осуществления взаимодействие (b) между винилазациклоалканом общей формулы (IV) и соответствующим гетероарилгалогенидом общей формулы (V) предпочтительно может осуществляться в инертной атмосфере (например, в азоте или аргоне) в присутствии катализатора, такого как ацетат палладия, и фосфина, такого как трифенилфосфин, в основной среде, например в присутствии основания, такого как триэтиламин, при температуре от 20 С до температуры кипения реакционной смеси, предпочтительно при температуре около 110 С. Реакция (с) проводится, как правило, в соответствии с традиционными способами, которые не влияют отрицательно на остальную часть молекулы, в частности посредством использования способов, описан-4 010870 ных T.W. Greene and P.G.M. Wuts, Protective Groups in Organic Synthesis (2nd ed.), A. Wiley - IntersciencePublication (1991). Например, реакция (с) удаления трет-бутоксикарбонильной группы из соединения общей формулы (VI) предпочтительно проводится в инертной атмосфере (например, в азоте или аргоне),в присутствии кислоты, такой как трифторуксусная кислота, в инертном растворителе, таком как дихлорметан, при температуре от -10 С до температуры кипения реакционной смеси, предпочтительно при температуре от -5 С до температуры около 22 С. Альтернативно, реакция (с) удаления трет-бутоксикарбонильной группы из соединения общей формулы (VI) предпочтительно может осуществляться в инертной атмосфере (например, в азоте или аргоне), под действием триметилсилилйодида, в инертном растворителе, таком как дихлорметан, при температуре от -10 С до температуры кипения реакционной смеси, предпочтительно при температуре около 22 С. Производные общей формулы (I), в которых R3 не представляет водород, могут быть получены из соединения общей формулы (I), в которой R3 представляет атом водорода, в соответствии с традиционными способами алкилирования аминов, которые не влияют отрицательно на остальную часть молекулы,посредством применения способов, описанных R.C. Larock, Comprehensive Organic Transformations, VCHPublishers (1989). Альтернативно, производные общей формулы (I), в которой R3 представляет метил, могут быть получены посредством взаимодействия соединения общей формулы (I), в которой R3 представляет водород,с раствором формальдегида в муравьиной кислоте при температуре от 22 С до температуры кипения реакционной смеси. Соединения общей формулы (II), которые не являются коммерчески доступными, могут быть получены посредством использования или адаптирования способов, описанных Peschke В. et al., Ear. J. Med.Chem., 34: 363-380 (1999), содержание которой включается в описание в качестве ссылки. Соединения общей формулы (V), которые не являются коммерчески доступными, могут быть получены посредством использования или адаптирования способов, описанных в заявке на международный патент WO 00/75110, содержание которой включается в описание в качестве ссылки. Альтернативно,соединения общей формулы (V), в которых X представляет C-R2; R2 представляет -OR6 и R6 представляетC1-6 алкил, который может быть замещен С 3-6 циклоалкилом, фенил, который может быть замещен -CN или -OR8, или 6-членный гетероциклил, содержащий в качестве гетероатома О, могут быть получены из гетероарилгалогенида общей формулы (VII), где Y представляет галоген, a R1 является таким, как определено ранее, и спирта общей формулы (VIII), где R6 является таким, как определено ранее, в соответствии с следующей общей схемой синтеза: Взаимодействие (d) между гетероариловым спиртом общей формулы (VII) и соответствующим спиртом общей формулы (VIII) предпочтительно проводится в инертной атмосфере, в присутствии диазена, такого как диэтилазодикарбоксилат, и фосфина, такого как трифенилфосфин, в инертном растворителе, таком как толуол, при температуре от 0 С до температуры кипения реакционной смеси, предпочтительно при температуре от около 22 С до температуры кипения растворителя. Соединения общей формулы (I) могут выделяться и очищаться с использованием способов, хорошо известных специалистам в данной области, включая, например, кристаллизацию, хроматографию и/или экстракцию. В указанных выше схемах, когда одна или несколько R-групп представляют или содержат химически активные группы, которые являются потенциально реакционноспособными в условиях реакции, специалистам в данной области будет очевидно, что эти функциональные группы могут потребовать применения соответствующих "защитных групп" во время взаимодействий, чтобы "блокировать" реакционную способность R-группы. Эти "защитные" группы могут выбираться, вводиться и отщепляться в соответствии с T.W. Greene and P.G.M. Wuts (Protective Groups in Organic Synthesis (2nd ed.), A. Wiley - IntersciencePublication (1991. Соединения общей формулы (I) и соединения общей формулы (IV) могут быть получены в оптически чистой форме посредством разделения их рацематов в соответствии с традиционными способами(например, разрешения энантиомеров) или путем использования оптически чистых исходных материалов. Соединения общей формулы (I) необязательно могут преобразовываться в аддитивные соли минеральной или органической кислоты под действием такой кислоты в соответствующем растворителе, например в органическом растворителе, таком как спирт, кетон, простой эфир или хлорированный растворитель. Эти соли также составляют часть настоящего изобретения. Репрезентативные фармацевтически приемлемые соли включают, но не ограничиваясь этим, бензолсульфонатные, бромидные, хлоридные, цитратные, этансульфонатные, фумаратные, глюконатные,-5 010870 йодатные, малеатные, изетионатные, метансульфонатные, метилен-бис(-оксинафтоатные), нитратные,оксалатные, пальмоатные, фосфатные, салицилатные, сукцинатные, сульфатные, тартратные, теофиллинацетатные, п-толуолсульфонатные, гемигалактаратные и галактаратные соли.III. Способы лечения. Соединения, описанные в описании, являются пригодными для лечения тех типов состояний и расстройств, для которых в качестве терапевтических средств были предложены другие типы никотиновых соединений. См., например, Williams et al., DNP, 7 (4): 205-227 (1994), Arneric et al., CNS Drug Rev., 1 (1): 1-26 (1995), Arneric et al., Exp. Opin. Invest. Drugs, 5 (1): 79-100 (1996), Bencherif et al., J. Pharmacol. Exp.(1997), Holladay et al., J. Med. Chem., 40 (28): 4169-4194 (1997), Bannon et al., Science, 279: 77-80 (1998),заявки на международные патенты WO 94/08992, WO 96/31475 и патенты США 5583140, Bencherifet al., 5597919, Dull et al., и 5604231, Smith et al. Соединения также могут использоваться в качестве вспомогательной терапии в сочетании с существующими видами терапии при лечении указанных выше типов заболеваний и расстройств. В таких ситуациях является предпочтительным введение активных ингредиентов способом, который сводит к минимуму воздействия на подтипы nAChR, такие как те, которые связаны с мышцами и ганглиями. Это может достигаться посредством направленной доставки лекарственных средств и/или посредством подбора дозировки таким образом, чтобы желаемое воздействие получалось без приближения к пороговой дозе, необходимой для достижения значительных побочных воздействий. Фармацевтические композиции могут использоваться для ослабления любых симптомов, связанных с этими состояниями, заболеваниями и расстройствами. Примеры состояний и расстройств, которые могут лечиться, включают неврологические расстройства, нейродегенеративные расстройства, в частности расстройства CNS, и воспалительные расстройства. Расстройства CNS могут быть вызваны лекарственными средствами; могут приписываться генетическому предрасположению, инфекции или травме или могут иметь неизвестную этиологию. РасстройстваCNS включают невропсихиатрические расстройства, неврологические заболевания и психические заболевания и включают нейродегенеративные заболевания, нарушения поведения, когнитивные расстройства и когнитивные аффективные расстройства. Имеется несколько расстройств CNS, клинические проявления которых могут быть приписаны дисфункции CNS (то есть расстройства, возникающие в результате несоответствующих уровней высвобождения нейротрансмиттера, несоответствующих свойств рецепторов нейротрансмиттеров и/или несоответствующего взаимодействия между нейротрансмиттерами и рецепторами нейротрансмиттеров). Несколько расстройств CNS могут быть приписаны дефициту холина, допамина, норэпинефрина и/или серотонина. Примеры расстройств CNS, которые могут лечиться с использованием соединений формулы (I), и их фармацевтически приемлемых солей, и фармацевтических композиций, содержащих эти соединения,включают пресенильное слабоумие (раннее проявление болезни Альцгеймера), сенильное слабоумие(слабоумие типа Альцгеймера), слабоумие с тельцами Леви, микроинфарктное слабоумие, слабоумие,связанное со СПИДом, слабоумие, связанное с ВИЧ, множественные церебральные инфаркты, паркинсонизм, включая болезнь Паркинсона, болезнь Пика, прогрессирующий надъядерный паралич, хорею Хантингтона, позднюю дискинезию, гиперкинезию, эпилепсию, манию, расстройство дефицита внимания, беспокойство, депрессию, дислексию, шизофрению, депрессию, обсессивно-компульсивные расстройства, синдром Туретта, небольшое когнитивное ослабление (MCI), возрастное ослабление памяти(AAMI), преждевременную амнезию и когнитивные расстройства, которые связаны с возрастом или последствиями алкоголизма или синдрома иммунодефицита или связанные с сосудистыми расстройствами,с генетическими изменениями (такие, например, как трисомия 21), или с дефицитами внимания, или дефицитами обучаемости, острые или хронические нейродегенеративные состояния, такие как амиотропный латеральный склероз, множественный склероз, периферические нейротрофии, и травмы головного или спинного мозга. В дополнение к этому соединения могут использоваться для лечения никотиновой зависимости и/или других нарушений поведения, связанных с веществами, которые приводят к зависимости (например, алкоголь, кокаин, героин и опиаты, психостимуляторы, бензодиазепины и барбитураты). Соединения могут также использоваться для лечения патологий, проявляющих воспалительный характер, в желудочно-кишечной системе, такие как болезнь Крона, синдром изъязвления желудка и язвенный колит, и при диареях. Способ, которым вводятся соединения, может изменяться. Соединения могут вводиться посредством ингаляции (например, в форме аэрозоля, либо через нос, либо с использованием для доставки изделий того типа, который описан в патенте США 4922901, Brooks et al.); местным образом (например, в форме примочки); перорально (например, в жидкой форме, в растворителе, таком как водная или неводная жидкость, или в твердом носителе); внутривенно (например, в растворе декстрозы или солевом растворе); в виде вливания или инъекции (например, в виде суспензии или эмульсии в фармацевтически приемлемой жидкости или смеси жидкостей); интраректально; интрацеребровентрикулярно или трансдермально (например, с использованием трансдермального пластыря). Хотя является возможным введение соединений в форме объемного активного химикалия, предпочтительно представлять каждое соеди-6 010870 нение в форме фармацевтической композиции или препарата для эффективного и действенного введения. Примерные способы введения таких соединений будут ясны специалисту в данной области. Например, соединения могут вводиться в форме таблетки, твердой желатиновой капсулы или в виде капсулы с замедленным высвобождением. В качестве другого примера соединения могут доставляться трансдермально с использованием тех типов технологий на основе пластырей, которые доступны от Novartis andAlza Corporation. Введение фармацевтических композиций по настоящему изобретению может быть дробным или постепенным, непрерывным, с постоянной или контролируемой скоростью, представлять введение теплокровному животному (например, млекопитающему, такому как мышь, крыса, кот, кролик,собака, свинья, корова или обезьяна); но преимущественно они вводятся человеку. В дополнение к этому, время дня и количество раз в день, которое вводится фармацевтический препарат, может изменяться. Введение предпочтительно является таким, что активные ингредиенты фармацевтического препарата взаимодействуют с активными центрами рецепторов в организме субъектов, что влияет на функционирование CNS или желудочно-кишечного (GI) тракта. Более конкретно, при лечении расстройств CNS введение предпочтительно является таким, чтобы оптимизировать воздействие на те важные подтипы рецепторов, которые обладают воздействием на функционирование CNS, в то же время сводя к минимуму воздействия на подтипы рецепторов мышечного типа. Другие способы, пригодные для введения соединений по настоящему изобретению, описаны в патенте США 5604231, Smith et al., описание которого включается в описание в качестве ссылки. Соответствующая доза соединения представляет такое количество, которое эффективно при предотвращении появления симптомов расстройства или при лечении некоторых симптомов расстройства,от которого страдает пациент. Под "эффективным количеством", "терапевтическим количеством" или"эффективной дозой" подразумевается то количество, которое является достаточным для оказания желаемых фармакологических или терапевтических воздействий, таким образом приводя к эффективной профилактике или лечению расстройства. Таким образом, при лечении расстройства CNS эффективное количество соединения представляет количество, достаточное для прохождения через мозговой барьер кровяного давления субъекта, для связывания важных активных центров рецепторов в мозгу субъекта и для активирования важных подтипов никотиновых рецепторов (например, чтобы обеспечить секрецию нейротрансмиттера, таким образом приводя к эффективной профилактике или лечению расстройства). Предотвращение расстройства проявляется посредством замедления возникновения симптомов расстройства. Лечение расстройства проявляется посредством уменьшения симптомов, связанных с расстройством, или ослабления рецидивов симптомов расстройства. Эффективная доза может изменяться в зависимости от таких факторов, как состояние пациента, тяжесть симптомов расстройства, и от способа, которым вводится фармацевтическая композиция. Для пациентов-людей эффективная доза типичных соединений, как правило, требует введения соединения в количестве, достаточном для активирования важных рецепторов, для осуществления высвобождения нейротрансмиттера (например, допамина), но количество должно быть недостаточным для индуцирования воздействий на скелетные мышцы и ганглии до какой-либо значительной степени. Эффективная доза соединений будет, разумеется, изменяться от пациента к пациенту, но, как правило, включает количества,начинающиеся там, где происходят воздействия на CNS или другие желаемые терапевтические воздействия, но являющиеся меньшими, чем количество, при котором наблюдаются мышечные воздействия. Дозы зависят от желаемого воздействия, продолжительности лечения и используемого способа введения; как правило, они находятся в пределах между 0,05 и 100 мг активного вещества в день, перорально, для взрослого. Лечащий врач определит соответствующую дозировку как функцию возраста, массы и всех других факторов, специфичных для пациента. Предпочтительно соединения обладают способностью к прохождению через гематоэнцефалический барьер пациента. Как таковые, такие соединения обладают способностью проникать в центральную нервную систему пациента. Значения log P типичных соединений, которые являются пригодными при осуществлении настоящего изобретения, как правило, являются большими, чем примерно 0, часто являются большими, чем примерно 0,5, и зачастую являются большими, чем примерно 1. Значения log P для таких типичных соединений, как правило, являются меньшими, чем примерно 3,5, часто являются меньшими, чем примерно 3, а иногда являются меньшими, чем примерно 2,5. Значения log P обуславливают меру способности соединения к прохождению через диффузионный барьер, такой как биологическая мембрана. См., Hansch, et al., J. Med. Chem., 11: 1 (1968). Соединения обладают способностью к связыванию и, в большинстве ситуаций, вызывать активирование nAChR мозга пациента (например, таких, как те рецепторы, которые модулируют высвобождение допамина). Как таковые, такие соединения обладают способностью к осуществлению никотиновой фармакологии, и в частности действовать в качестве никотиновых агонистов или частичных агонистов. Константы связывания с рецептором у типичных соединений, пригодных при осуществлении настоящего изобретения, как правило, превышают примерно 0,1 нМ, часто превышают примерно 1 нМ и зачастую превышают примерно 10 нМ. Константы связывания с рецептором у таких типичных соединений, как правило, являются меньшими, чем примерно 1 мкМ, часто являются меньшими, чем примерно 100 нМ, и-7 010870 зачастую являются меньшими, чем примерно 50 нМ. Константы связывания с рецептором обуславливают меру способности соединения к связыванию половины важных активных центров рецепторов определенных клеток мозга пациента. См. Cheng, et al., Biochem. Pharmacol., 22: 3099 (1973). Соединения, пригодные для использования в соответствии со способом по настоящему изобретению, обладают способностью к демонстрации никотиновой функции, эффективно осуществляя поток ионов через препараты нервных окончаний (например, таламических или стриарных синаптосом) и/или секрецию нейротрансмиттера из них. Как таковые, такие соединения обладают способностью заставлять важные нейроны становиться активированными и высвобождать или секретировать ацетилхолин, допамин или другие нейротрансмиттеры. Как правило, типичные соединения, пригодные для осуществления настоящего изобретения, эффективно обеспечивают активирование важного рецептора в количествах по меньшей мере примерно на 30%, часто по меньшей мере примерно на 50%, а зачастую по меньшей мере примерно на 75%, от того количества, что максимально обеспечивается (S)-(-)-никотином. Как правило,типичные соединения, пригодные для осуществления настоящего изобретения, являются более сильнодействующими, чем (S)-(-)-никотин, при осуществлении активирования важного рецептора. Как правило,типичные соединения, пригодные для осуществления настоящего изобретения, эффективно обеспечивают секрецию допамина в количествах по меньшей мере примерно на 50%, часто по меньшей мере примерно на 75% и зачастую по меньшей мере примерно на 100%, от того количества, что максимально обеспечивается (S)-(-)-никотином. Определенные соединения по настоящему изобретению могут обеспечить секрецию допамина в количестве, которое может превышать то, которое максимально обеспечивается (S)-(-)-никотином. Как правило, типичные соединения, пригодные для осуществления настоящего изобретения, являются менее сильнодействующими, чем (S)-(-)-никотин, при осуществлении секреции нейротрансмиттера, такой как секреция допамина. Соединения по настоящему изобретению, когда они используются в эффективных количествах в соответствии со способом по настоящему изобретению, лишены способности к активированию nAChR мышц человека до какой-либо значительной степени. В этом отношении, соединения по настоящему изобретению демонстрируют плохую способность к индуцированию потока иона изотопов рубидия через nAChR в препаратах клеток, экспрессирующих никотиновые ацетилхолиновые рецепторы мышечного типа. Таким образом, такие соединения демонстрируют константы активирования рецептора или значения ЕС 50 (то есть значения, которые обуславливают меру концентрации соединения, необходимую для активирования половины активных центров важных рецепторов скелетных мышц пациента), которые являются исключительно высокими (то есть большими, чем примерно 100 мкМ). Как правило, типичные предпочтительные соединения, пригодные для осуществления настоящего изобретения, активируют поток ионов изотопов рубидия менее чем на 10%, часто менее чем на 5%, от того значения, что максимально обеспечивает S-(-)-никотин. Соединения по настоящему изобретению, когда они используются в эффективных количествах, в соответствии со способом по настоящему изобретению лишены способности к активированию nAChR ганглий человека до какой-либо значительной степени. Эта селективность соединений по настоящему изобретению по отношению к тем nAChR, которые ответственны за сердечно-сосудистые побочные воздействия, демонстрируется отсутствием способности этих соединений к активированию никотинового функционирования адренальных хромаффинных тканей. Как таковые, такие соединения обладают плохой способностью к индуцированию потока ионов изотопов рубидия через nAChR в препаратах клеток,полученных из надпочечника. Как правило, типичные предпочтительные соединения, пригодные для осуществления настоящего изобретения, максимально активируют поток ионов изотопов рубидия менее чем на 10%, часто менее чем на 5%, от того значения, что максимально обеспечивает S-(-)-никотин. Соединения являются эффективными в отношении обеспечения некоторой степени профилактики развития расстройств CNS, ослабления симптомов расстройств CNS и ослабления до некоторой степени рецидивов расстройств CNS. Однако такие эффективные количества этих соединений являются недостаточными для индуцирования любых заметных нежелательных никотиновых воздействий, как демонстрируется с помощью пониженных воздействий на препараты, которые, какпредполагается, отражают воздействия на сердечно-сосудистую систему или воздействия на скелетные мышцы. Как таковое, введение соединений по настоящему изобретению обеспечивает терапевтическое окно, в котором обеспечивается лечение определенных расстройств CNS и исключаются нежелательные периферические никотиновые воздействия/побочные воздействия. То есть эффективная доза соединения по настоящему изобретению является достаточной для обеспечения желаемых воздействий на CNS, но является недостаточной(то есть не находится на достаточно высоком уровне) для обеспечения нежелательных побочных воздействий. Предпочтительно эффективное введение соединения по настоящему изобретению, приводящее к лечению расстройства CNS, происходит при введении менее чем 1/3, часто менее чем 1/5 и зачастую менее чем 1/10, от количества, достаточного для индуцирования любых побочных воздействий до значительной степени. Примеры синтеза Следующие далее примеры синтеза предусматриваются для иллюстрации настоящего изобретения и не должны рассматриваться в качестве примеров, ограничивающих его. В этих примерах все доли и про-8 010870 центы являются массовыми, если не указано иного. Выходы реакций приводятся в молярных процентах. Пример 1. Рацемический 3-Е)-2-пирролидин-3-илвинил)-5-(тетрагидропиран-4-илокси)пиридин гемигалактарат. Трифторуксусную кислоту (0,91 см 3, 11,7 ммоль) добавляют по каплям в раствор 0,44 г (1,17 ммоль) рацемического сложного трет-бутилового эфира 3-(Е)-2-[5-(тетрагидропиран-4-илокси)пиридин-3 ил]винилпирролидин-1-карбоновой кислоты в 4,5 см 3 дихлорметана, который находится в атмосфере аргона, и охлаждают до 0 С. Реакционную смесь перемешивают при этой температуре в течение 0,5 ч, а затем при температуре около 22 С в течение 20 ч и концентрируют досуха при пониженном давлении(2,7 кПа). Масляный остаток извлекают в 5 см 3 воды и полученный раствор делают основным (рН 8) путем добавления 28% водного раствора аммония, а затем экстрагируют 3 раза 25 см 3 дихлорметана. Объединенные органические фазы промывают 25 см 3 воды, сушат над сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении (2,7 кПа) с получением 0,225 г масла оранжевого цвета,которое очищают с помощью хроматографии на силикагеле (элюент: дихлорметан/метанол (9/1, затем 8/2 по объему. Концентрация фракций при пониженном давлении (2,7 кПа) дает 0,1 г (0,36 ммоль) масла оранжевого цвета. Галактаровую кислоту (0,038 г, 0,18 ммоль) добавляют в раствор этого масла в 2 см 3 метанола, в который добавляют 0,5 см 3 воды. Смесь нагревают с обратным холодильником и охлаждают до температуры около 22 С и выделенный материал удаляют путем фильтрования. Фильтрат концентрируют досуха при пониженном давлении (2,7 кПа) и масляный остаток извлекают в 2 см 3 этанола. Преципитированный твердый продукт отфильтровывают, промывают 2 см 3 изопропилацетата и 2 см 3 простого диизопропилового эфира, затем сушат при 40 С в вакууме (2,7 кПа) с получением 0,088 г рацемического 3-Е)-2-пирролидин-3-илвинил)-5-(тетрагидропиран-4-илокси)пиридин гемигалактарата в форме бежевого твердого продукта. Масс-спектр (EI): m/z 274 (М+), m/z 232. Спектр 1 Н-ЯМР (300 МГц, (CD3)2SO d6 с несколькими каплями CD3COOD d4,в м.д.): 1,61 (м, 2 Н); 1,82 (м, 1 Н); 1,98 (м, 2 Н); 2,17 (м, 1 Н); 2,96 (дд, J=10,5 и 8,5 Гц, 1 Н); 3,07 (м, 1 Н); 3,10-3,40 (м, 2 Н); 3,41(дд, J=10,5 и 7,5 Гц, 1 Н); 3,50 (ддд, J=12-9,5 и 3 Гц, 2 Н); 3,79 (с, 1 Н); 3,87 (дт, J=12 и 4,5 Гц, 2 Н); 4,24 (с,1 Н); 4,69 (м, 1 Н); 6,43 (дд, J=16 и 7 Гц, 1 Н); 6,56 (д, J=16 Гц, 1 Н); 7,49 (м, 1 Н); 8,20 (м, 2 Н). Рацемический сложный трет-бутиловый эфир 3-(Е)-2-[5-(тетрагидропиран-4-илокси)пиридин-3 ил]винилпирролидин-1-карбоновой кислоты может быть приготовлен следующим образом. Палладий ацетат (0,117 г, 0,52 ммоль), 0,678 г (16 ммоль) хлорида лития и 7,25 см 3 (42 ммоль) этилдиизопропиламина последовательно добавляют в раствор, в атмосфере аргона, 1,33 г (5,17 ммоль) 3 бром-5-(тетрагидропиран-4-илокси)пиридина и 1,2 г (5,17 ммоль) рацемического сложного трет-бутилового эфира 3-винилпирролидин-1-карбоновой кислоты в 15 см 3 диметилформамида. После 3 ч нагрева при 110 С с перемешиванием реакционную смесь перемешивают в течение 2 ч при температуре около 22 С, а затем концентрируют досуха при пониженном давлении (2,7 кПа). Масляный остаток извлекают в 50 см 3 этилацетата и полученный раствор последовательно промывают 2 раза 25 см 3 воды, 25 см 3 насыщенного раствора бикарбоната, 2 раза 25 см 3 воды и 25 см 3 насыщенного раствора хлористого натрия,а затем сушат над сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении(2,7 кПа) с получением 1,4 г коричневого масла. Этот остаток очищают с помощью хроматографии на силикагеле (элюент: циклогексан/этилацетат (8/2 по объему. Концентрирование фракций при пониженном давлении (2,7 кПа) дает 0,44 г желтого масла, которое используют без дополнительной очистки в остальном синтезе. 3-Бром-5-(тетрагидропиран-4-илокси)пиридин может быть приготовлен следующим образом. Диэтилазодикарбоксилат (7,1 см 3, 45 ммоль) добавляют по каплям в раствор в атмосфере аргона 5,22 г (30 ммоль) 5-бромпиридин-3-ола, 4,69 г (45 ммоль) тетрагидропиран-4-ола (45 ммоль) и 11,8 г (45 ммоль) трифенилфосфина в 150 см 3 толуола. После 20 ч нагрева с обратным холодильником с перемешиванием реакционную смесь доводят до температуры в около 22 С, а затем последовательно промывают 2 раза 75 см 3 воды, 2 раза 75 см 3 насыщенного раствора бикарбоната, 2 раза 75 см 3 воды и 75 см 3 насыщенного раствора хлорида натрия, а затем органический раствор сушат над сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении (2,7 кПа) с получением масла оранжевого цвета. Это остаток смешивают с 100 см 3 простого диизопропилового эфира и полученный твердый продукт отфильтровывают и промывают с 2 раза 25 см 3 простого диизопропилового эфира. Фильтрат концентрируют досуха при пониженном давлении (2,7 кПа) с получением 10 г масла оранжевого цвета. Это остаток очищают с помощью хроматографии на силикагеле (элюент: циклогексан/этилацетат (8/2 по объему. Концентрирование фракций при пониженном давлении (2,7 кПа) дает 7,3 г 3-бром-5-(тетрагидропиран-4-илокси)пиридина в форме желтого масла. Спектр 1H-ЯМР (300 МГц, (CD3)2SO d6,в м.д.): 1,59 (м, 2 Н); 1,99 (м, 2 Н); 3,49 (ддд, J=12,5-9,5 и 3 Гц,2 Н); 3,87 (дт, J=12,5 и 4,5 Гц, 2 Н); 4,75 (м, 1 Н); 7,82 (дд, J=2,5 и 2 Гц, 1 Н); 8,28 (д, J=2 Гц, 1 Н); 8,33 (д,J=2,5 Гц, 1 Н). Рацемический сложный трет-бутиловый эфир 3-винилпирролидин-1-карбоновой кислоты может быть получен следующим образом. н-Бутиллитий в гексане (44 см 3 1,6 н. раствора) добавляют по каплям в суспензию 25,5 г (71 ммоль)-9 010870 трифенилметилфосфоний бромида в 300 см 3 тетрагидрофурана, в атмосфере аргона, и охлаждают до 0 С. Реакционную смесь перемешивают при 0 С в течение 0,5 ч, а затем смешивают с раствором 7,1 г (35,6 ммоль) рацемического сложного трет-бутилового эфира 3-формилпирролидин-1-карбоновой кислоты в 100 см 3 тетрагидрофурана. Через 2,5 ч взаимодействия при температуре около 22 С смесь выливают в 600 см 3 насыщенного водного раствора хлорида аммония. После добавления этилацетата органическую фазу извлекают посредством декантирования, промывают дважды водой и насыщенным раствором хлорида натрия, а затем сушат над сульфатом магния и концентрируют досуха при пониженном давлении (2,7 кПа). Полученное масло очищают с помощью хроматографии на силикагеле (элюент: циклогексан/этилацетат(95/5, затем 9/1 по объему. Концентрирование фракций при пониженном давлении (2,7 кПа) дает 6,3 г рацемического сложного трет-бутилового эфира 3-винилпирролидин-1-карболовой кислоты в форме бесцветного масла. Масс-спектр (ES): m/z 198 (МН+), m/z 142. Пример 2. Рацемический 5-Е)-2-пирролидин-3-илвинил)пиримидин гемигалактарат. Трифторуксусную кислоту (1,2 см 3, 15,6 ммоль) добавляют по каплям в раствор 0,43 г (1,56 ммоль) рацемического сложного трет-бутилового эфира 3-Е)-2-пиримидин-5-илвинил)пирролидин-1-карбоновой кислоты в 6 см 3 дихлорметана в атмосфере аргона и охлаждают до 0 С. Реакционную смесь перемешивают при этой температуре в течение 0,5 ч, затем при температуре около 22 С в течение 20 ч и концентрируют ее досуха при пониженном давлении (2,7 кПа). Масляный остаток извлекают в 5 см 3 воды и полученный раствор делают основным (рН 8) путем добавления 28% водного раствора аммония, а затем экстрагируют 3 раза 25 см 3 дихлорметана. Объединенные органические фазы промывают 25 см 3 воды,сушат над сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении (2,7 кПа) с получением 0,126 г масла оранжевого цвета, которое очищают с помощью хроматографии на силикагеле(элюент: дихлорметан/метанол (9/1, затем 8/2 по объему. Концентрирование фракций при пониженном давлении (2,7 кПа) дает 0,1 г (0,57 ммоль) масла оранжевого цвета. Галактаровую кислоту (0,06 г, 0,28 ммоль) добавляют в раствор этого масла в 2 см 3 метанола, к которому добавляют 0,5 см 3 воды. Смесь нагревают с обратным холодильником и охлаждают до температуры около 22 С и нерастворимый материал удаляют посредством фильтрования. Фильтрат концентрируют досуха при пониженном давлении (2,7 кПа) и масляный остаток извлекают в 2 см 3 этанола. Преципитировавший твердый продукт отфильтровывают,промывают 2 см 3 изопропилацетата и 2 см 3 простого диизопропилового эфира, затем сушат при 40 С в вакууме (2,7 кПа) с получением 0,1 г рацемического 5-Е)-2-пирролидин-3-илвинил)пиримидин гемигалактарата в форме твердого продукта цвета охры. Масс-спектр (DCI): m/z 176 (МН+). Спектр 1 Н ЯМР (300 МГц, (CD3)2SO d6 с несколькими каплями CD3COOD d4,в м.д.): 1,82 (м, 1 Н); 2,18 (м, 1 Н); 2,98 (дд, J=11 и 8,5 Гц, 1 Н); 3,10 (м, 1 Н); 3,20 (м, 1 Н); 3,33 (м, 1 Н); 3,42 (дд, J=11 и 7,5 Гц,1 Н); 3,79 (с, 1 Н); 4,24 (с, 1 Н); 6,55 (ограничение АВ, 2 Н); 8,87 (с, 2 Н); 9,04 (с, 1 Н). Рацемический сложный трет-бутиловый эфир 3-Е)-2-пиримидин-5-илвинил)пирролидин-1-карбоновой кислоты может быть получен следующим образом. Палладий ацетат (0,117 г, 0,52 ммоль), 0,678 г (16 ммоль) хлорида лития и 7,25 см 3 (42 ммоль) этилдиизопропиламина последовательно добавляют в раствор в атмосфере аргона 0,822 г (5,17 ммоль) 5 бромпиримидина и 1,2 г (5,17 ммоль) рацемического сложного трет-бутилового эфира 3-винилпирролидин-1-карбоновой кислоты в 15 см 3 диметилфомамида. После 3 ч нагрева при 110 С при перемешивании реакционную смесь перемешивают в течение 2 ч при температуре около 22 С, а затем концентрируют досуха при пониженном давлении (2,7 кПа). Масляный остаток извлекают в 50 см 3 этилацетата и полученный раствор последовательно промывают 2 раза 25 см 3 воды, 25 см 3 насыщенного раствора бикарбоната, 2 раза 25 см 3 воды и 25 см 3 насыщенного раствора хлорида натрия, а затем сушат над сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении (2,7 кПа) с получением 1,1 г коричневого масла. Этот остаток очищают с помощью хроматографии на силикагеле (элюент: циклогексан/ этилацетат (8/2 по объему. Концентрирование фракций при пониженном давлении (2,7 кПа) дает 0,43 г рацемического сложного трет-бутилового эфира 3-Е)-2-пиримидин-5-илвинил)пирролидин-1-карбоновой кислоты в форме масла. Спектр 1 Н ЯМР (300 МГц, (CD3)2SO d6,в м.д.): 1,42 (с, 9 Н); 1,78 (м, 1 Н); 2,05 (м, 1 Н); 2,90-3,15 (м,2 Н); 3,15-3,60 (м, 3 Н); 6,51 (д, J=16,5 Гц, 1 Н); 6,64 (дд, J=16,5 и 7 Гц, 1 Н); 8,89 (с, 2 Н); 9,04 (с, 1 Н). Пример 3. (+)-5-Е)-2-Пирролидин-3-илвинил)пиримидин галактарат. Триметилсилил йодид (0,2 см 3, 1,4 ммоль) добавляют при температуре около 22 С в раствор в атмосфере аргона 0,26 г (0,944 ммоль) сложного трет-бутилового эфира (+)-3-Е)-2-пиримидин-5-илвинил) пирролидин-1-карбоновой кислоты в 10 см 3 дихлорметана. После 2 ч перемешивания при этой температуре реакционную смесь смешивают с 15 см 3 5% водного раствора аммония, и перемешивают в течение 1 ч при температуре около 22 С, и оставляют осаждаться. Водную фазу отделяют и экстрагируют дихлорметаном. Объединенные органические фазы дважды промывают водой и насыщенным водным раствором хлорида натрия, а затем сушат над сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении (2,7 кПа) с получением 0,06 г масла оранжевого цвета. Галактаровую кислоту (0,035 г,0,16 ммоль) добавляют в раствор этого масла в 6 см 3 метанола, в который добавляют 0,6 см 3 воды. Смесь нагревают с обратным холодильником, охлаждают до температуры около 22 С и концентрируют досуха- 10010870 при пониженном давлении (2,7 кПа). Масляный остаток перетирают в присутствии 5 см 3 простого диизопропилового эфира и полученный твердый продукт отфильтровывают, затем сушат при 45 С в вакууме(2,7 кПа) с получением 0,072 г (+)-5-Е)-2-пирролидин-3-илвинил)пиримидин галактарата в форме твердого желтого продукта. Масс-спектр (DCI): m/z 176 (MH+). Спектр 1 Н ЯМР (300 МГц, (CD3)2SO d6 с несколькими каплями CD3COOD d4,в м.д.): 1,81 (м, 1 Н); 2,19 (м, 1 Н); 2,98 (дд, J=11 и 9 Гц, 1 Н); 3,10 (м, 1 Н); 3,21 (м, 1 Н); 3,33 (м, 1 Н); 3,43 (дд, J=11 и 8 Гц, 1 Н); 3,79 (с, 2 Н); 4,25 (с, 2 Н); 6,56 (ограничение АВ, 2 Н); 8,88 (с, 2 Н); 9,05 (с, 1 Н). Сложный трет-бутиловый эфир (+)-3-Е)-2-пиримидин-5-илвинил)пирролидин-1-карбоновой кислоты может быть получен следующим образом. Рацемическую смесь сложного трет-бутилового эфира 3-Е)-2-пиримидин-5-илвинил)пирролидин 1-карбоновой кислоты (0,5 г) инжектируют двумя частями в колонку диаметром 8 см, содержащую 1,2 кг хиральной неподвижной фазы Chiralpak AS 20 мкм (поток: 130 мл/мин, элюент: гептан/метанол/этанол(98/1/1 по объему. Концентрирование фракций при пониженном давлении (2,7 кПа) дает 0,24 г сложного трет-бутилового эфира (+)-Е)-2-пиримидин-5-илвинил)пирролидин-1-карбоновой кислоты и 0,27 г сложного трет-бутилового эфира (-)-Е)-2-пиримидин-5-илвинил)пирролидин-1-карбоновой кислоты. Сложный трет-бутиловый эфир (+)-Е)-2-пиримидин-5-илвинил)пирролидин-1-карбоновой кислоты элюируют в первой фракции со временем удерживания 14,2 мин на 20 мкм колонке Chiralpak AS диаметром 4,6 мм и длиной 250 мм (поток: 1 мл/мин, элюент: гептан/метанол/этанол (98/1/1 по объему. Спектр 1 Н ЯМР (300 МГц, (CD3)2SO d6,в м.д.): 1,43 (с, 9 Н); 1,79 (м, 1 Н); 2,06 (м, 1 Н); 2,95-3,15 (м,2 Н); 3,20-3,35 (м, 1 Н); 3,44 (ддд, J=11-8,5 и 3 Гц, 1 Н); 3,53 (ушир.дд, J=10 и 7,5 Гц, 1 Н); 6,52 (д, J=16,5 Гц,1 Н); 6,63 (дд, J=16,5 и 7 Гц, 1 Н); 8,89 (с, 2 Н); 9,04 (с, 1 Н). Сложный трет-бутиловый эфир (-)-Е)-2-пиримидин-5-илвинил)пирролидин-1-карбоновой кислоты элюируют во второй фракции со временем удерживания 17 мин на 20 мкм колонке Chiralpak AS диаметром 4,6 мм и длиной 250 мм (поток: 1 мл/мин, элюент: гептан/метанол/этанол (98/1/1 по объему. Спектр 1 Н ЯМР (300 МГц, (CD3)2SO d6,в м.д.): 1,43 (с, 9 Н); 1,79 (м, 1 Н); 2,06 (м, 1 Н); 2,95-3,15 (м,2 Н); 3,20-3,35 (м, 1 Н); 3,44 (ддд, J=11-8,5 и 3 Гц, 1 Н); 3,53 (ушир.дд, J=10 и 7,5 Гц, 1 Н); 6,52 (д, J=16,5 Гц,1 Н); 6,63 (дд, J=16,5 и 7 Гц, 1 Н); 8,89 (с, 2 Н); 9,04 (с, 1 Н). Пример 4. (-)-5-Е)-2-Пирролидин-3-илвинил)пиримидин галактарат. Триметилсилил йодид (0,2 см 3, 1,4 ммоль) добавляют при температуре около 22 С к раствору в атмосфере аргона 0,29 г (1,053 ммоль) сложного трет-бутилового эфира (-)-3-Е)-2-пиримидин-5-илвинил) пирролидин-1-карбоновой кислоты в 10 см 3 дихлорметана. После 2 ч перемешивания при этой температуре реакционную смесь смешивают с 15 см 3 5% водного раствора аммония, перемешивают в течение 1 ч при температуре около 22 С и оставляют осаждаться. Водную фазу отделяют и экстрагируют дихлорметаном. Объединенные органические фазы дважды промывают водой и насыщенным водным раствором хлорида натрия, а затем сушат над сульфатом магния, фильтруют и концентрируют досуха при пониженном давлении (2,7 кПа) с получением 0,1 г масла оранжевого цвета. Галактаровую кислоту (0,06 г,0,28 ммоль) добавляют к раствору этого масла в 10 см 3 метанола, к которому добавляют 1 см 3 воды. Смесь нагревают с обратным холодильником, охлаждают до температуры около 22 С и концентрируют досуха при пониженном давлении (2,7 кПа). Масляный остаток перетирают в присутствии 5 см 3 простого диизопропилового эфира и полученный твердый продукт фильтруют, а затем сушат при 45 С в вакууме(2,7 кПа) с получением 0,094 г (-)-5-Е)-2-пирролидин-3-илвинил)пиримидин галактарата в форме желтого твердого продукта. Масс-спектр (DCI): m/z 176 (МН+). Спектр 1 Н ЯМР (300 МГц, (CD3)2SO d6 с несколькими каплями CD3COOD d4,в м.д.): 1,82 (м, 1 Н); 2,19 (м, 1 Н); 2,98 (дд, J=11 и 9 Гц, 1 Н); 3,10 (м, 1 Н); 3,21 (м, 1 Н); 3,32 (м, 1 Н); 3,43 (дд, J=11 и 7,5 Гц, 1 Н); 3,79 (с, 2 Н); 4,24 (с, 2 Н); 6,57 (ограничение АВ, 2 Н); 8,88 (с, 2 Н); 9,05 (с, 1 Н). Сложный трет-бутиловый эфир (-)-3-Е)-2-пиримидин-5-илвинил)пирролидин-1-карбоновой кислоты может быть приготовлен, как описано в примере 3. Пример 5. Определение значения log P. Значения log P, которые используют для оценки относительных способностей соединений к прохождению через гематоэнцефалический барьер (Hansch, et al., J. Med. Chem., ii: 1 (1968, вычисляют с использованием пакета программного обеспечения Cerius2, Version 3,5, от Molecular Simulations, Inc. Пример 6. Оценка различных свойств репрезентативных соединений. Следующие далее анализы используют для определения способности к связыванию и других фармакологических свойств определенных соединений, приводимых в описании, и их можно использовать,как правило, для оценки других соединений, как приводится в описании. Связывание радиоактивных лигандов на н-ацетилхолиновых рецепторах центральной нервной системы (nAChR CNS) Подтип 42. Крыс (самки, Sprague-Dawley) массой 150-250 г оставляют при 12-часовом цикле свет/темнота и дают возможность для свободного доступа к воде и пище, поставляемой PMI Nutrition International, Inc. Животных анестезируют 70% СО 2, затем подвергают декапитации. Мозг удаляют и помещают на плат- 11010870 форму, охлаждаемую льдом. Церебральный кортекс удаляют и помещают в 20 объемов (масса:объем) охлаждаемого льдом препаративного буфера (NaCl, 137 мМ; KCl, 10,7 мМ; KH2PO4, 5,8 мМ; Na2HPO4, 8 мМ;HEPES (свободная кислота), 20 мМ; йодацетамид, 5 мМ; EDTA, 1,6 мМ; рН 7,4); добавляют PMSF, растворенный в метаноле до конечной концентрации 100 мкМ, и гомогенизируют суспензию с помощьюPolytron. Гомогенат центрифугируют при 18000g в течение 20 мин при 4 С и полученную лепешку повторно суспендируют в 20 объемах охлаждаемой льдом воды. После 60 мин инкубирования на льду новую лепешку собирают посредством центрифугирования при 18000g в течение 20 мин при 4 С. Конечную лепешку повторно суспендируют в 10 объемах буфера и хранят при -20 С. В день анализа ткань оттаивают, центрифугируют при 18000g в течение 20 мин, затем повторно суспендируют в охлаждаемом льдом PBS (фосфатном буферном солевом растворе Дульбекко, NaCl, 138 мМ; KCl, 2,67 мМ; KH2PO4,1,47 мМ; Na2HPO4, 8,1 мМ; CaCl2, 0,9 мМ; MgCl2, 0,5 мМ; Invitrogen/Gibco; рН 7,4) до конечной концентрации приблизительно 4 мг белка/мл. Белок определяют по способу Lowry et al., J. Biol. Chem., 193: 265275 (1951) с использованием сыворотки бычьего альбумина в качестве стандарта. Связывание [3 Н]никотина измеряют с использованием модификации способов Romano et al, Science 210: 647-650 (1980) и Marks et al., Mol. Pharmacol. 30: 427-436 (1986). [3H]Никотин (удельная активность=81,5 Ки/ммоль) получают от NEN Research Products. Связывание [3 Н]никотина измеряют с использованием 3-часового инкубирования при 4 С. Инкубирование осуществляют в 48-луночных микротитровальных планшетах и включают в него примерно 400 мкг белка на лунку при конечном объеме инкубирования 300 мкл. Буфер для инкубирования представляет PBS, и конечная концентрация [3 Н]никотина составляет 5 нМ. Реакция связывания прекращается посредством фильтрования белка, содержащего связанный лиганд, на стекловолоконных фильтрах (GF/B, Brandel) с использованием харвестера для тканейBrandel при 4 С. Фильтры пропитывают деионизированной водой, содержащей 0,33% полиэтиленимина,для уменьшения неспецифичного связывания. Каждый фильтр промывают 3 раза 1 мл охлаждаемого льдом буфера. Неспецифичное связывание определяют посредством включения в выбранные лунки по 10 мкМ нерадиоактивного L-никотина (Acros Organics). Ингибирование связывания [3 Н]никотина посредством исследуемых соединений определяют посредством включения в него семи различных концентраций исследуемых соединений в выбранных лунках. Каждая концентрация воспроизводится по 3 раза. Значения IC50 оценивают как концентрацию соединения, которая ингибирует 50% специфичного связывания [3 Н]никотина. Константы ингибирования(значения Ki), приводимые в нМ, вычисляют по значениям IC50 с использованием способа Cheng et al.,Biochem. Pharmacol. 22: 3099-3108 (1973). Подтип 7. Крысы (самки, Sprague-Dawley) массой 150-250 г поддерживаются при 12-часовом цикле свет/темнота, и им предоставляется свободный доступ к воде и корму, поставляемому PMI Nutrition International,Inc. Животных анестезируют 70% СО 2, затем подвергают декапитации. Мозг удаляют и помещают на платформу, охлаждаемую льдом. Гиппокамп удаляют и помещают в 10 объемов (масса:объем) охлаждаемого льдом препаративного буфера (NaCl, 137 мМ; KCl, 10,7 мМ; KH2PO4, 5,8 мМ; Na2HPO4, 8 мМ;HEPES (свободная кислота), 20 мМ; йодацетамид, 5 мМ; EDTA, 1,6 мМ; рН 7,4); добавляют PMSF, растворенный в метаноле до конечной концентрации 100 мкМ, и суспензию ткани гомогенизируют с помощью Polytron. Гомогенат центрифугируют при 18000g в течение 20 мин при 4 С и полученную лепешку повторно суспендируют в 10 объемах воды, охлаждаемой льдом. После 60 мин инкубирования на льду новую лепешку собирают посредством центрифугирования при 18000g в течение 20 мин при 4 С. Конечную лепешку повторно суспендируют в 10 объемах буфера и хранят при -20 С. В день анализа ткани оттаивают, центрифугируют при 18000g в течение 20 мин, затем повторно суспендируют в охлаждаемом льдом PBS (фосфатный солевой буфер Дульбекко, NaCl, 138 мМ; KCl, 2,67 мМ; KH2PO4, 1,47 мМ;Na2HPO4, 8,1 мМ; CaCl2, 0,9 мМ; MgCl2, 0,5 мМ; Invitrogen/Gibco; pH 7,4) до конечной концентрации приблизительно 2 мг белка/мл. Белок определяют по способу Lowry et al., J. Biol. Chem., 193: 265-275(1951), используя бычий сывороточный альбумин в качестве стандарта. Связывание [3H]MLA измеряют с использованием модификации способов Davies et al., Neuropharmacol., 38: 679-690, 1999. [3H]MLA (удельная активность=25-35 Ки/ммоль) получают от Tocris. Связывание [3H]MLA определяют с использованием 2-часового инкубирования при 21 С. Инкубирование осуществляют в 48-луночных микротитровальных планшетах, содержащих 300 мкг белка на лунку при конечном объеме инкубирования примерно 200 мкл. Инкубационный буфер представляет PBS, и конечная концентрация [3H]MLA составляет 5 нМ. Реакция связывания прекращается посредством фильтрования белка, содержащего связанный лиганд, на стекловолоконных фильтрах (GF/B, Brandel) с использованием харвестера тканей Brandel при комнатной температуре. Фильтры пропитываются деионизированной водой, содержащей 0,33% полиэтиленимина, для уменьшения неспецифичного связывания. Каждый фильтр промывают 3 раза 1 мл PBS при комнатной температуре. Неспецифичное связывание определяют посредством включения 50 мкМ нерадиоактивной MLA в выбранные клетки. Ингибирование связывания [3H]MLA исследуемыми соединениями определяют посредством включения семи различных концентраций исследуемого соединения в выбранные лунки. Каждую концентрацию- 12010870 воспроизводят по 3 раза. Значения IC50 оценивают как концентрацию соединения, которая ингибирует 50% специфичного связывания [3H]MLA. Константы ингибирования (значения Ki), выраженные в нМ,вычисляют по значениям IC50, используя способ Cheng et al., Biochem. Pharmacol., 22: 3099-3108 (1973). Определение высвобождения допамина Высвобождение допамина измеряют с использованием стриарных синаптосом, полученных из мозга крысы, в соответствии с процедурами, приведенными Rapier et al., J. Neurochem., 54: 937-45 (1990). Крысы (самки, Sprague-Dawley) массой 150-250 г поддерживаются при 12-часовом цикле свет/темнота, и им предоставляется свободный доступ к воде и корму, поставляемому PMI Nutrition International, Inc. Животных анестезируют 70% СО 2, затем подвергают декапитации. Мозг быстро удаляют и иссекают стриату. Стриарную ткань от 2 крыс объединяют и гомогенизируют в 5 мл 0,32 М сахарозы, охлаждаемой льдом, содержащей 5 мМ HEPES, рН 7,4, с использованием гомогенизатора стекло/стекло. Затем ткань центрифугируют при 1000g в течение 10 мин. Лепешку удаляют, а супернатант центрифугируют при 12000g в течение 20 мин Полученную лепешку повторно суспендируют в перфузионном буфере, содержащем ингибиторы моноаминоксидазы (128 мМ NaCl, 1,2 мМ KH2PO4, 2,4 мМ KCl, 3,2 мМ CaCl2, 1,2 мМMgSO4, 25 мМ HEPES, 1 мМ аскорбиновой кислоты, 0,02 мМ паргилина HCl и 10 мМ глюкозы, рН 7,4),и центрифугируют в течение 15 мин при 25000g. Для непосредственного использования конечную лепешку повторно суспендируют в 1,4 мл перфузионного буфера. Синаптосомальную суспензию инкубируют в течение 10 мин при 37 С для восстановления метаболической активности. [3 Н]Допамин ([3H]DA, удельная активность=28,0 Ки/ммоль, NEN Research Products) добавляют при конечной концентрации 0,1 мкМ и суспензию инкубируют при 37 С в течение дополнительных 10 мин. 50 мкл аликвоты ткани+100 мкл перфузионного буфера загружают в перфузионные камеры Brandel Suprafusion System (серия 2500, Gaithersburg, MD). Перфузионный буфер (комнатная температура) закачивают в камеры со скоростью 3 мл/мин в течение периода промывки 8 мин. Затем исследуемое соединение (10 мкМ) или никотин (10 мкМ) вводят в перфузионный поток в течение 40 с. Фракции (по 12 с каждая) непрерывно собирают из каждой камеры в течение эксперимента для регистрации фонового высвобождения, пика высвобождения, индуцируемого агонистом, и повторного установления фоновой линии после применения агониста. Перфузат собирают непосредственно в сцинтилляционные флаконы, в которые добавляют сцинтилляционную текучую среду. Высвобождаемый [3 Н]DA количественно определяют с помощью подсчета сцинтилляций. Для каждой камеры интегральная площадь пика нормируется на его базовую линию. Высвобождение выражают как процент высвобождения, полученный при равной концентрации Lникотина. В каждом анализе каждое исследуемое соединение воспроизводится с использованием 2-3 камер; воспроизведения усредняются. Когда возможно, определяют кривые реакции на дозу исследуемого соединения. Максимальное активирование для индивидуальных соединений (Emax) определяют как процент от максимального активирования, индуцируемого L-никотином. Также определяют концентрацию соединения, приводящую к половинному максимальному активированию конкретного потока ионов (ЕС 50). Селективность по отношению к периферическим nAChR Взаимодействие для мышечного подтипа человека Активирование nAChR мышечного типа устанавливается на клональной линии человека TE671/RD,которую получают от эмбриональной рабдомиосаркомы (Stratton et al., Carcinogen, 10: 899-905, 1989). Эти клетки экспрессируют рецепторы, которые имеют фармакологические (Lukas et al., J. Pharmacol. Exp.Ther., 251: 175-182, 1989), электрофизиологические (Oswald et al., Neurosci. Lett., 96: 207-212; 1989) и молекулярно-биологические свойства (Luther et al., J. Neurosci., 9: 1082-1096, 1989), подобные nAChR мышечного типа. Клетки TE671/RD поддерживают в фазе пролиферативного роста в соответствии с рутинными протоколами (Bencherif et al., Mol. Cell. Neurosci., 2: 52-65 (1991) и Bencherif et al., J. Pharmacol Exp. Ther.,257: 946-953 (1991. Клетки культурируют в среде Игла, модифицированной Дульбекко (Gibco/BRL), с 10% сыворотки лошади (Gibco BRL), 5% фетальной сыворотки теленка (HyClone, Logan UT), 1 мМ пирувата натрия, 4 мМ L-глютамина, 50000 ед. пенициллина-стрептомицина (Irvine Scientific). Когда конфлюентность клеток составляет 80%, их высаживают на 6-луночные полистирольные планшеты (Costar). Эксперименты осуществляют, когда клетки достигают 100% конфлюентности. Функционирование никотинового ацетилхолинового рецептора (nAChR) анализируют с использованием поступления 86Rb+ в соответствии со способом, описанным Lukas et al., Anal. Biochem., 175: 212218 (1988). В день эксперимента ростовые среды осторожно удаляют из лунки, а ростовые среды, содержащие 86 рубидий хлорид (106 Ки/мл), добавляют в каждую лунку. Клетки инкубируют при 37 С в течение минимум 3 ч. После периода наполнения избыток 86Rb удаляют и клетки дважды промывают не содержащим метки фосфатным солевым буфером Дульбекко (NaCl, 138 мМ; KCl, 2,67 мМ; KH2PO4, 1,47 мМ;Na2HPO4, 8,1 мМ; CaCl2, 0,9 мМ; MgCl2, 0,5 мМ; Invitrogen/Gibco, pH 7,4), соблюдая осторожность, чтобы не потревожить клетки. Затем клетки экспонируют для 100 мкМ исследуемого соединения или 100 мкМL-никотина (Acros Organics), или одного лишь буфера в течение 4 мин. После периода экспонирования супернатант, содержащий высвобожденный 86Rb, удаляют и переносят в сцинтилляционные флаконы.- 13010870 Добавляют сцинтилляционную текучую среду и высвобожденную радиоактивность измеряют с помощью подсчета сцинтилляций в жидкости. В каждом анализе каждая точка имеет 2 воспроизведения, которые усредняются. Количество высвобождаемого 86Rb сравнивают как с положительным контролем (100 мкМ L-никотина), так и с отрицательным контролем (только лишь один буфер) для определения процента высвобождения по отношению к L-никотину. Когда возможно, определяют кривые реакции на дозу исследуемого соединения. Максимальное активирование для индивидуальных соединений (Emax) определяют как процент от максимального активирования, индуцируемого L-никотином. Также определяют концентрацию соединения, приводящую к половинному максимальному активированию конкретного потока ионов (ЕС 50). Взаимодействие при подтипе ганглий крысы Активирование nAChR ганглий крысы устанавливают на клональной линии феохромоцитомы РС 12, которая представляет непрерывную клональную линию клеток от ганглионарной пластинки, полученных от опухоли мозгового вещества надпочечника крысы. Эти клетки экспрессируют нейронныеTher., 251: 175-182 (1989); Whiting et al., Mol. Brain Res., 10: 61-70 (1990. Клетки крысы РС 12 поддерживают в фазе пролиферативного роста в соответствии с рутинными протоколами (Bencherif et al., Mol. Cell. Neurosci., 2: 52-65 (1991) и Bencherif et al., J. Pharmacol. Exp.(Gibco/BRL), с 10% сыворотки лошади (Gibco BRL), 5% фетальной сыворотки теленка (HyClone, LoganUT), 1 мМ пирувата натрия, 4 мМ L-глютамина, 50000 ед. пенициллина-стрептомицина (Irvine Scientific). Когда конфлюентность клеток составляет 80%, их пересаживают в 6-луночные планшеты Nunc(Nunclon), покрытые 0,03% поли-L-лизина (Sigma, растворенного в 100 мМ борной кислоты). Эксперименты осуществляют, когда клетки достигают конфлюентности 80%. Функционирование никотинового ацетилхолинового рецептора (nAChR) анализируют с использованием введения 86Rb+ в соответствии со способом, описанным Lukas et al., Anal. Biochem., 175: 212-218(1988). В день эксперимента ростовые среды осторожно удаляют из лунки и ростовые среды, содержащие 86 рубидий хлорид (106 Ки/мл), добавляют в каждую лунку. Клетки инкубируют при 37 С в течение минимум 3 ч. После периода наполнения избыток 86Rb удаляют и клетки промывают дважды фосфатным солевым буфером Дульбекко, не содержащим метки (NaCl, 138 MM; KCl, 2,67 мМ; KH2PO4, 1,47 мМ;Na2HPO4, 8,1 мМ; CaCl2, 0,9 мМ; MgCl2, 0,5 мМ; Invitrogen/Gibco, pH 7,4), соблюдая осторожность, чтобы не потревожить клетки. Затем клетки экспонируют для 100 мкМ исследуемого соединения, или 100 мкМ никотина, или одного лишь буфера в течение 4 мин. После периода экспонирования супернатант, содержащий высвобожденный 86Rb+, удаляют и переносят в сцинтилляционные флаконы. Добавляют сцинтилляционную текучую среду и высвобожденную радиоактивность измеряют посредством подсчета сцинтилляций в жидкости. В каждом анализе каждая точка имеет 2 воспроизведения, которые усредняются. Количество высвобождаемого 86Rb сравнивают как с положительным контролем (100 мкМ никотина), так и с отрицательным контролем (только лишь один буфер) для определения процента высвобождения по отношению к L-никотину. Когда возможно, определяют кривые реакции на дозу исследуемого соединения. Максимальное активирование для индивидуальных соединений (Emax) определяют как процент от максимального активирования, индуцируемого L-никотином. Также определяют концентрацию соединения, приводящую к половинному максимальному активированию конкретного потока ионов (ЕС 50). Взаимодействие при подтипе ганглий человека Линия клетки SH-SY5Y представляет непрерывную линию, полученную посредством последовательного субклонирования родительской линии клеток, SK-N-SH, которую исходно получают из периферической нейробластомы человека. Клетки SH-SY5Y экспрессируют nAChR ганглийного типа (Lukaset al., Mol. Cell. Neurosci., 4: 1-12, 1993). Клетки человека SH-SY5Y поддерживают в фазе пролиферативного роста в соответствии с рутинными протоколами (Bencherif et al., Mol. Cell. Neurosci., 2: 52-65 (1991) и Bencherif et al., J. Pharmacol.(Gibco/BRL), с 10% сыворотки лошади (Gibco BRL), 5% фетальной сыворотки теленка (HyClone, LoganUT), 1 мМ пирувата натрия, 4 мМ L-глютамина, 50000 ед. пенициллина-стрептомицина (Irvine Scientific). Когда конфлюентность клеток составляет 80%, их высаживают в 6-луночные полистироловые планшеты(Costar). Эксперименты осуществляют, когда клетки достигают конфлюентности 100%. Функционирование никотинового ацетилхолинового рецептора (nAChR) оценивают с использованием введения 86Rb+ в соответствии со способом, описанным Lukas et al., Anal. Biochem., 175: 212-218(1988). В день эксперимента ростовые среды осторожно удаляют из лунки и ростовые среды, содержащие 86 рубидий хлорид (106 (проверено) Ки/мл), добавляют в каждую лунку. Клетки инкубируют при 37 С в течение минимум 3 ч. После периода наполнения избыток Rb+ удаляют и клетки дважды промы- 14010870 вают фосфатным солевым буфером Дульбекко, не содержащим метки (NaCl, 138 мМ; KCl, 2,67 мМ;KH2PO4, 1,47 мМ; Na2HPO4, 8,1 мМ; CaCl2, 0,9 мМ; MgCl2, 0,5 мМ; Invitrogen/Gibco, pH 7,4), соблюдая осторожность, чтобы не потревожить клетки. Затем клетки экспонируют для 100 мкМ исследуемого соединения, или 100 мкМ никотина, или только лишь буфера в течение 4 мин. После периода экспонирования супернатант, содержащий высвобожденный 86Rb, удаляют и переносят в сцинтилляционные флаконы. Добавляют сцинтилляционную текучую среду и высвобожденную радиоактивность измеряют посредством подсчета сцинтилляций в жидкости. В каждом анализе каждая точка имеет 2 воспроизведения, которые усредняются. Количество высвобождаемого 86Rb сравнивают как с положительным контролем (100 мкМ никотина), так и с отрицательным контролем (только лишь один буфер) для определения процента высвобождения по отношению к L-никотину. Когда возможно, определяют кривые реакции на дозу исследуемого соединения. Максимальное активирование для индивидуальных соединений (Emax) определяют как процент от максимального активирования, индуцируемого L-никотином. Также определяют концентрацию соединения, приводящую к половинному максимальному активированию потока конкретных ионов (ЕС 50). Репрезентативные соединения оценивают с использованием анализов, описанных в описании. Результаты показывают, что соединения по настоящему изобретению селективно связываются с nAChR 42 и, как следствие, вызывают высвобождение допамина. Как правило, значения Ki для связывания с 42 находятся в пределах 1-100 нМ, а значения Emax для высвобождения допамина достигают 100% от того, что дает никотин. В противоположность этому, соединения по настоящему изобретению не связываются, как следует, с теми подтипами nAChR, которые являются характерными для периферической нервной и мышечной систем. Таким образом, соединения по настоящему изобретению обладают терапевтическим потенциалом при лечении расстройств центральной нервной системы, не вызывая побочных воздействий, связанных со взаимодействием с периферической нервной системой. Исходя из описания настоящего изобретения, должно быть понятно, что возможны множество модификаций, замен и вариантов настоящего изобретения. Настоящее изобретение может осуществляться иначе, чем конкретно описано. Такие модификации, замены и варианты, как предполагается, находятся в объеме настоящего изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Арилвинилазациклоалкановые соединения формулы где волнистая линия представляет различные возможные геометрии (Е или Z) двойной связи;R1 представляет водород или галоген;(R)- и (S)-5-Е)-2-пирролидин-3-илвинил)пиримидина; 5-Е)-2-пиперидин-4-илвинил)пиримидина; 5-Е)-2-азетидин-3-илвинил)пиримидина; их изомеров, их смесей, включая рацемические смеси, энантиомеров, и их таутомеров, и их фармацевтически приемлемых солей. 6. Способ лечения нейродегенеративных расстройств, включающий введение пациенту, нуждающемуся в таком лечении, эффективного количества арилвинилазациклоалканового соединения формулы где волнистая линия представляет различные возможные геометрии (Е или Z) двойной связи;R1 представляет водород или галоген;n равно 1-3; и его изомеров, смесей, энантиомеров, диастереомеров, таутомеров и фармацевтически приемлемых солей. 7. Способ по п.6, где R1 представляет водород. 8. Способ по п.6, где n=1. 9. Способ по п.6, где m=2. 10. Способ по п.6, где нейродегенеративные расстройства возникают из-за несоответствующих уровней высвобождения нейротрансмиттера, несоответствующих свойств рецепторов нейротрансмиттеров и/или несоответствующих взаимодействий между нейротрансмиттерами и рецепторами нейротрансмиттеров. 11. Способ по п.10, где расстройства возникают из-за дефицита ацетилхолина, допамина, норэпинефрина и/или серотонина. 12. Способ по п.6, где расстройство выбирается из группы, состоящей из пресенильного слабоумия(ранняя стадия болезни Альцгеймера), сенильного слабоумия (слабоумие типа Альцгеймера), преждевременной амнезии и когнитивных расстройств, которые связаны с возрастом или последствиями алкоголизма, микроинфарктного слабоумия и сосудистого слабоумия, слабоумия, связанного со СПИДом,болезни Кройцфельда-Якоба, болезни Пика, болезни Паркинсона, слабоумия с тельцами Леви, прогрессирующего надъядерного паралича, хореи Хантингтона, поздней дискинезии, гиперкинезии, мании, эпилепсии, расстройств дефицита внимания, беспокойства, дислексии, шизофрении, депрессии, обсессивнокомпульсивных расстройств, синдрома Туретта, амиотропного латерального склероза, множественного склероза, периферической нейротрофии, и травм головного или спинного мозга, и лекарственной зависимости. 13. Способ обезболивания и/или лечения воспалительных желудочно-кишечных расстройств,включающий введение пациенту, нуждающемуся в таком лечении, эффективного количества арилвинилазациклоалканового соединения формулы где волнистая линия представляет различные возможные геометрии (Е или Z) двойной связи;R1 представляет водород или галоген;n равно 1-3; и его изомеров, смесей, энантиомеров, диастереомеров, таутомеров и фармацевтически приемлемых солей. 14. Способ по п.13, где R1 представляет водород. 15. Способ по п.13, где n=1. 16. Способ по п.13, где m=2. 17. Способ по п.13, где воспалительное расстройство выбирается из группы, состоящей из диареи,болезни Крона, беспокоящего кишечного синдрома и язвенного колита. 18. Способ обезболивания и/или лечения воспалительных расстройств, включающий введение пациенту, нуждающемуся в таком лечении, эффективного противовоспалительного количества соединения,выбранного из группы, состоящей из(R)- и (S)-5-Е)-2-пирролидин-3-илвинил)пиримидина; 5-Е)-2-пиперидин-4-илвинил)пиримидина; 5-Е)-2-азетидин-3-илвинил)пиримидина; их изомеров, их смесей, включая рацемические смеси, их энантиомеров, и таутомеров, и их фармацевтически приемлемых солей, пациенту, нуждающемуся в лечении ими. 19. Способ получения арилвинилазациклоалкановых соединений формулы где волнистая линия представляет различные возможные геометрии (Е или Z) двойной связи;R1 представляет водород или галоген;b) взаимодействие полученного винилазациклоалкана с гетероарилгалогенидом формулы где X и R1 являются такими, как определено выше, и Y представляет галоген; и с) удаление любых оставшихся защитных групп.
МПК / Метки
МПК: A61P 25/00, A61K 31/506, A61K 31/505, A61K 31/44, C07D 239/26, C07D 405/12
Метки: способы, применения, получения, арилвинилазациклоалкановые, соединения
Код ссылки
<a href="https://eas.patents.su/18-10870-arilvinilazacikloalkanovye-soedineniya-i-sposoby-ih-polucheniya-i-primeneniya.html" rel="bookmark" title="База патентов Евразийского Союза">Арилвинилазациклоалкановые соединения и способы их получения и применения</a>
Предыдущий патент: Производные 4-(2-фенилсульфанилфенил)пиперидина в качестве ингибиторов повторного поглощения серотонина
Следующий патент: Трансдермальные составы и способы лечения тромбоцитемии
Случайный патент: Армирующая ткань с однонаправленным армированием, прикрепляемая к механической армируемой структуре