Nα-ацильные производные аминоацил-2-цианопирролидина – ингибиторы пролилэндопептидазы и дипептидилпептидазы-iv, обладающие гипогликемическим, противогипоксическим, нейропротекторным и улучшающим когнитивные функции действием
Номер патента: 21236
Опубликовано: 29.05.2015
Авторы: Колясникова Ксения Николаевна, Капица Инга Геннадиевна, Воронина Татьяна Александровна, Позднев Владимир Федорович, Золотов Николай Николаевич
Формула / Реферат
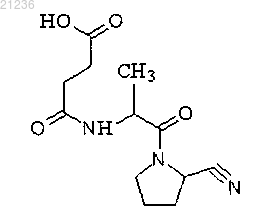
1. Соединение формулы
2. Применение соединения по п.1 в качестве ингибитора пролилэндопептидазы и дипептидилпептидазы-IV.
3. Применение соединения п.1 в качестве средства для лечения сахарного диабета второго типа.
4. Применение соединения по п.1 в качестве средства для лечения заболеваний, сопровождающихся гипоксией, нейродегенерацией и нарушением когнитивных функций.
5. Лекарственная форма, содержащая в качестве действующего вещества соединение по п.1 для лечения сахарного диабета второго типа или лечения заболеваний, сопровождающихся гипоксией, нейродегенерацией и нарушением когнитивных функций.
Текст
N-АЦИЛЬНЫЕ ПРОИЗВОДНЫЕ АМИНОАЦИЛ-2-ЦИАНОПИРРОЛИДИНА ИНГИБИТОРЫ ПРОЛИЛЭНДОПЕПТИДАЗЫ И ДИПЕПТИДИЛПЕПТИДАЗЫIV, ОБЛАДАЮЩИЕ ГИПОГЛИКЕМИЧЕСКИМ, ПРОТИВОГИПОКСИЧЕСКИМ,НЕЙРОПРОТЕКТОРНЫМ И УЛУЧШАЮЩИМ КОГНИТИВНЫЕ ФУНКЦИИ ДЕЙСТВИЕМ Предметом настоящего изобретения цианопирролидина формулы Золотов Николай Николаевич,Позднев Владимир Федорович,Колясникова Ксения Николаевна,Капица Инга Геннадиевна, Воронина Татьяна Александровна (RU) Ермакова Е.А. (RU)- ингибитор пролилэндопептидазы и дипептидилпептидазы-iv, обладающее гипогликемическим,противогипоксическим, нейропротекторным и улучшающим когнитивные функции действием. Изобретение относится к области биологически активных соединений для лечения сахарного диабета второго типа, а также заболеваний, протекающих с нейродегенерацией и нарушением когнитивных функций. Предпосылки создания изобретения Сахарный диабет является одной из самых актуальных проблем медицины. В России по официальным данным сахарным диабетом страдает 3 млн человек, из них более 2,7 млн - пациенты с сахарным диабетом 2-го типа, однако, по данным эпидемиологических исследований, реальное число пациентов с сахарным диабетом 2-го типа в России в 3-4 раза выше; по данным Минздравсоцразвития, смертность от сахарного диабета составляет 6,7 случаев на 100000 населения (Аметов А.С. Сахарный диабет 2 типа. Проблемы и решение, изд. ГЭОТАР - Медиа, 2011, с. 704; Дедов И.И., Шестакова М.В. Сахарный диабет,М., 2003; Шестакова М.В., Дедов И.И. Сахарный диабет и хроническая болезнь почек, изд. Медицинское информационное агентство, 2009). Сахарный диабет 2-го типа (инсулин-независимый диабет) метаболическое заболевание, характеризующееся хронической гипергликемией, развивающейся в результате нарушения секреции инсулина или механизмов его взаимодействия с клетками тканей (Аметов А.С. Сахарный диабет 2 типа. Основы патогенеза и терапии; М., 2003). Этот тип заболевания обусловлен снижением чувствительности тканей к действию инсулина (инсулинорезистентность), который на начальных стадиях заболевания синтезируется в нормальных или даже повышенных количествах. Диета и снижение массы тела пациента в некоторых случаях помогают нормализовать углеводный обмен и снизить синтез глюкозы в печени из неуглеводистого (неуглеводного) сырья. Со временем избыточная секреция инсулина истощает -клетки поджелудочной железы, что делает необходимыми инъекции инсулина (Балаболкин М.И., Клебанова Е.М.,Креминская В.М. Лечение сахарного диабета и его осложнений. Руководство для врачей. - М.: Медицина, 2005, с.18-21). Диабет 2-го типа составляет 85-90% от всех типов сахарного диабета и наиболее часто развивается у людей старше 40 лет, и, как правило, ассоциирован с ожирением. Заболевание прогрессирует медленно. Для него характерны второстепенные симптомы, кетоацидоз развивается редко. С течением времени развиваются осложнения: микро- и макроангиопатия, нефро- и нейропатия, ретинопатия и др. (Остапова В.В. Сахарный диабет. М., 1994; Дедов И.И., Сунцов Ю.И., Кудрякова С.В. Эпидемиология сахарного диабета. Сахарный диабет. Руководство для врачей. Универсум Паблишинг. М., 2003, с. 75-93). Доступные способы лечения диабета 2-го типа за многие годы существенно не изменились, но выявили ряд ограничений. Несмотря на то что физические упражнения и снижение калорий в пищевом рационе могут эффективно улучшить диабетическое состояние, соблюдение такого лечения является очень сложным из-за прочно укрепившегося малоподвижного образа жизни и избытка потребления пищи. Увеличение уровня инсулина в плазме путем введения стимуляторов секреции инсулина - препаратов сульфонилмочевины (толбутамида, глипизида) или меглитинида, которые стимулируют клетки поджелудочной железы для секреции большего количества инсулина, и/или путем инъекции инсулина, могут привести к концентрациям инсулина выше достаточной для стимуляции особенно инсулин-резистентных тканей. Бигуаниды увеличивают чувствительность к инсулину, приводящую к некоторой коррекции гипергликемии, но при этом фенформин и метформин (бигуаниды) могут индуцировать лактоцидоз и тошноту/диарею. Глитазоны (производные 5-бензилтиазолидин-2,4-диона) представляют собой недавно описанный класс соединений с потенциалом улучшения многих симптомов диабета 2-го типа. Глитазоны увеличивают чувствительность к инсулину в мышцах, печени и жировой ткани и приводят к частичной или полной коррекции повышенных уровней глюкозы в плазме без случаев гипогликемии. Однако некоторые глитазоны (троглитазон) вызывают серьезные побочные эффекты (например, гепатотоксичность). В последние годы показана роль гормонов желудочно-кишечного тракта в регуляции секреции инсулина, а следовательно, и в регуляции гомеостаза глюкозы в организме человека. Из них наиболее значительную роль играют глюкагоноподобный пептид 1 (GLP-1, ГПП-1) и гастроингибирующий кишечный пептид (глюкозозависимый инсулинотропный полипептид, ГИП, GIP), которые получили название инкретины - гормоны желудочно-кишечного тракта, вырабатываемые в ответ на прием пищи и вызывающие стимуляцию секреции инсулина (Orskov С., Jeppesen J., Madsbad S., Holst J.J. Proglucagon products in plasma of noninsulin-dependent diabetics and nondiabetic controls in the fasting state and after oral glucose and intravenous arginine. J Clin Invest: 1991, 87, 415-423; Аметов А.С. Регуляция секреции инсулина в норме и при сахарном диабете 2 типа: роль инкретинов. Русский медицинский журнал. 14.12.2006, т. 14, 26). Поскольку период полужизни ГПП-1 очень короткий, его невозможно использовать в клинической практике в качестве натурального препарата. В связи с этим, перспективным направлением представляется ингибирование фермента дипептидилпептидазы-4 (ДПП-IV), разрушающего инкретины в организме. Основная функция фермента ДПП-IV заключается в быстрой инактивации олигопептидов в разных тканях и органах путем отщепления двух аминокислот от N-концевой части. Пептиды-мишени для ДППIV находятся в кишечнике - ГПП-1 и ГИП и показано, что фермент ДПП-IV быстро инактивирует ГПП-1 и ГИП сразу после их секреции в кишечнике. Однако при ингибировании ДПП-IV уровень и активность инкретинов повышается, а их действие продлевается. При ингибировании ДПП-IV существенно повы-1 021236 шается уровень активных инкретинов и в крови. В результате этого дисбаланс соотношения инсулин/глюкагон нормализуется: глюкозозависимая инсулиновая секреция -клетками повышается, а секреция глюкагона -клетками подавляется. Это позволяет эффективно контролировать уровень глюкозы на фоне значительного снижения риска гипогликемии, особенно тяжелых эпизодов, за счет глюкозочувствительного действия. Улучшение функции островковых клеток приводит к улучшению гликемического контроля. Поскольку инкретины продуцируются только при приеме пищи, ингибирование ДПП-IV не увеличивает уровень инсулина между приемами пищи, что могло бы привести к чересчур низкому уровню сахара в крови (гипогликемии). Поэтому ингибирование ДПП-IV увеличивает инсулин без увеличения риска гипогликемии, которая представляет собой опасный побочный эффект, связанный с использованием стимуляторов секреции инсулина (Анциферов М.Б., Дорофеева Л.Г. Новые подходы в лечении сахарного диабета типа 2: глюкагоноподобный пептид-1 и эксенатид (Баета). Фарматека.11 (145) 2007, с. 14-19). Таким образом, ингибиторы ДПП-IV являются новым классом сахароснижающих препаратов, основное действие которых нацелено на повышение активности собственных инкретинов организма, что обеспечивает лучшее соотношение преимущество/риск по сравнению с другими классами препаратов для лечения сахарного диабета 2-го типа. Данные многочисленных международных исследований подтвердили, что препараты на основе ингибиторов ДПП-IV повышают уровень эндогенного инсулина,снижают уровень глюкагона в плазме крови и подавляют глюконеогенез в печени, уменьшают инсулинорезистентность, обеспечивая полноценный гликемический контроль. Наиболее известными препаратами данного класса являются ситаглиптин (Янувия) и вилдаглиптин (Галвус) - препараты, добившиеся огромного коммерческого успеха на фармацевтическом рынке (Aschner P., Kipnes M.S., Luncefort J.K., etal. Effect of dipeptidyl peptidase-4 inhibitor sitagliptin as monotherapy on glycemic control in patients with type 2 diabetes. Diabetes Care: 2006, 29, 2632-2637; Bosi E., Camisasca R.P., Collober C., et al. Effects of vildagliptin on glucose control over 24 weeks in patients with type 2 diabetes inadequately controlled with metformin. Diabetes Care: 2007, 30, c. 890-895; Дедов И.И., Шестакова М.В. Алгоритмы специализированной медицинской помощи больным сахарным диабетом. М., 2007). Поиск новых препаратов для лечения сахарного диабета 2-го типа среди ингибиторов ДПП-IV активно продолжаются и в настоящее время. В частности, можно упомянуть производные гексагидродиазепинона по патенту RU 2301803, N-замещенные-2-цианопирролидины по патенту RU 2180901, ингибиторы DPP-IV для лечения нейродегенерации и когнитивных расстройств по патенту RU 2394570, а также лечение диабета типа 2 ингибиторами дипептидилпептидазы согласно патенту RU 2328283. Задача, решаемая настоящей группой изобретений, состоит в получении нового подхода к созданию средств лечения сахарного диабета второго типа, конкретно к соединениям из группы N-ацильных производных аминоацил-2-цианопирролидина, у которых в качестве заместителей могут быть использованы моно и дикарбоновые кислоты - предпочтительно глутаровая, малеиновая и янтарная. Результат, получаемый при решении такой задачи, состоит в получении вещества, увеличивающего активность ингибирования дипептидилпептидазы-IV, а также обладающего более выраженным противогликемическим действием. Заявленная группа веществ сочетает свойства ингибиторов ПЭП и пролекарств - ингибитора ДДПIV (одного из ключевых ферментов патогенеза диабета 2-го типа), образующегося в ходе метаболических превращений, и оказывает гипогликемическое, противогипоксическое, нейропротекторное и улучшающее когнитивные функции действие. Для достижения поставленного результата предлагается N-ацильное производное аминоацил-2 цианопирролидина формулы Соединение может обладать, в частности, ингибирующим пролилэндопептидазу и дипептидилпептидазу-IV действием, либо гипогликемическим, нейропротекторным, противогипоксическим действием и улучшающим когнитивные функции эффектами. Для достижения поставленного результата предлагается также применение соединения формулы (1) в качестве средств для лечения сахарного диабета второго типа, либо в качестве средств для лечения заболеваний, сопровождающихся гипоксией, нейродегенерацией и нарушением когнитивных функций. Кроме того, предлагается лекарственная форма, содержащая в качестве действующего вещества соединение формулы (1).N-ацильные производные аминоацил-2-цианопирролидина могут быть введены в организм любым подходящим путем, включая пероральное, буккальное, сублингвальное, ректальное, интравагинальное и трансдермальное введение, а также внутривенную, подкожную и внутримышечную инъекцию. Предпочтительным является пероральное введение в виде таблеток или капсулы. Доза может быть установлена наблюдающим врачом, принимая во внимание все существенные факторы. Обычно разовая доза может включать от 1 до 500 мг, предпочтительно от 5 до 150 мг. Изобретение иллюстрируется чертежом, где показано влияние различных концентраций соединенияAlaPrdN и ситаглиптина на активность очищенной дипептидилпептидазы IV. Синтез соединений В синтезе использованы оптически активные аминокислоты L-ряда. Состав реакционных смесей и индивидуальность полученных соединений контролировали методом ТСХ на стеклянных пластинках с силикагелем (Kieselgel 60F254, Merck). Вещества детектировали окрашиванием нингидрином (5% раствор в н-бутиловом спирте, 110C) и бензидиновым реактивом после хлорирования. Оптическое вращение []D определяли на поляриметре Perkin-Elmer 241 в кюветах длиной 10 см при комнатной температуре (18C). ИК-спектры записаны на спектрофотометре Perkin Elmer (Англия). Температуры плавления определяли на приборе Боэтиус. Принятые сокращения (помимо стандартных): Вос 2 О - ди-трет-бутилпирокарбонат; Prd - Sпирролидин-2; DMF - диметилформамид; Pfp - пентафторфенил. Этапы синтеза хлоргидрата аланил-2-циано-пирролидина (Ala-Prd-CN, соединение I) и N-3 карбоксипропионил-аланил-2-циано-пирролидина (HOCOCH2CH2CO-Ala-Prd-CN, соединение II) 1) Boc-Ala-Pro-OH. 2) Boc-Ala-Pro-NH2. 3) Boc-Ala-Prd-CN. 4) HCl Ala-Prd-CN. 5) HOCOCH2CH2CO-Ala-Prd-CN. Способ получения основан на взаимодействии активированного эфира N-защищенного аланина с солями пролина с последующим выделением N-защищенного дипептида и переводом его в амид, который затем превращали в N-защищенный нитрил, удаляли защитную группу и выделяли целевой продукт в виде хлоргидрата. Экспериментальная часть 1. Boc-Ala-Pro-OH Суспензию 1,3 г (11 ммоль) пролина, 1,6 г (11 ммоль) K2CO3 и 0,1 г тетрабутиламмоний гидроксида в 10 мл диоксана перемешивают 15 мин, добавляют 2,9 г (10 ммоль) N-оксисукцинимидного эфира третбутилоксикарбонил-L-аланина и перемешивают 10 ч. Разбавляют водой (25 мл), перемешивают 1 ч, экстрагируют смесью гексана с эфиром (1:1, 15 мл), водный раствор подкисляют 1 М соляной кислотой до pH 2-3,экстрагируют этилацетатом (50 + 20 мл), экстракт промывают рассолом, высушивают сульфатом магния и упаривают. Получают 2,3 г (80%) хроматографически чистого трет-бутилоксикарбонилаланилпролина с т. пл. 155-156C, Rf 0,47 (толуол-ацетон-уксусная кислота 100:50:1), который без дополнительной очистки используют для получения амида на следующей стадии. 2. Boc-Ala-Pro-NH2 Суспензию 2,2 г (7,7 ммоль) N-трет-бутилоксикарбонилаланилпролина, 1 г (13 ммоль) бикарбоната аммония, 0,3 мл пиридина и 2 мл (9 ммоль) ди-трет-бутилпирокарбоната в 10 мл ацетонитрила перемешивают 16 ч, разбавляют водой (30 мл), экстрагируют смесью эфира с гексаном (1:1, 15 мл) и затем смесью хлороформа с н-пропанолом (9:1; 50 + 20 мл). Экстракты объединяют, промывают рассолом и высушивают. Растворитель упаривают, остаток растирают в смеси эфира с гексаном и получают 2,0 г (73%) амида трет-бутилоксикарбонилаланилпролина в виде белого кристаллического порошка с т. пл. 112113 С, []D - 10,5 (с 1, этанол). Rf 0,35 (Б). Найдено %: С 54,3; Н 7,6; N 14,5. C13H23N3O4. Вычислено %: С 54,73; Н 8,13; N 14,72. 3. Boc-Ala-Prd-CN К охлажденному до 5 С раствору Boc-Ala-Pro-NH2 (2,0 г, 7,0 ммоль) в 10 мл пиридина добавляют порциями бензолсульфохлорид (2,5 мл, 19 ммоль), перемешивают при комнатной температуре 16 ч и упаривают в вакууме. Остаток растворяют в этилацетате, промывают водой, 5% раствором серной кислоты, водой, рассолом и высушивают MgSO4. Растворитель упаривают, остаток кристаллизуют из эфира, получают 1,5 г (80%) целевого продукта в виде белого кристаллического порошка с т. пл. 78-79C,[]D - 163 (с 0,5, метанол), Rf 0,25 (гептан-ацетон 1:1); ИК-спектр (KCl): 2226 см-1 CN-группа. Найдено %: С 58,2; Н 8,1; N 15,4. C13H21N3O3. Вычислено %: С 58,41; Н 7,93; N 15,71. 4. H-Ala-Prd-CN HCl (I) К раствору Boc-Ala-Prd-CN (1,3 г, 5 ммоль) в 5 мл дихлорметана приливают 5 мл трифторуксусной кислоты и выдерживают при комнатной температуре до исчезновения пятна исходного продукта на ТСХ(около 1 ч). Раствор упаривают в вакууме до прекращения отгонки трифторуксусной кислоты, к остатку приливают 10 мл 1 М раствора HCl в органическом растворителе (в диоксане, в спирте или в уксусной кислоте) и снова упаривают досуха. Остаток кристаллизуют растиранием в эфире. Осадок отфильтровы-3 021236 вают, промывают эфиром и высушивают в вакууме. Получают 0,7 г хроматографически гомогенного,белого кристаллического вещества с т. пл. 162-164 С, Rf 0,42 (хлороформ-метанол, 4:1, []D - 142,1 (с 1,этанол). Найдено%: С 47,3; Н 7,1; N 20,5. C8H13N3OHCl. Вычислено %: С 47,18; Н 6,93; N 20,63. 5. HOCOCH2CH2CO-Ala-Prd-CN К раствору H-Ala-Prd-CN HCl (0,41 г, 2 ммоль) в 3 мл дихлорметана приливают раствор 0,22 г (2,2 ммоль) янтарного ангидрида в 3 мл дихлорметана, добавляют 0,25 мл триэтиламина и смесь выдерживают при комнатной температуре 3-5 ч (контроль ТСХ). Реакционную смесь промывают 5%-м раствором лимонной кислоты, водой, рассолом, высушивают сульфатом магния и упаривают. В остатке получают целевой продукт в виде смолы. Остаток растирают в эфире, эфир сливают и оставшуюся смолу кристаллизуют из смеси этилацетата с гексаном. Получают 0,4 г 75% целевого продукта в виде белого кристаллического порошка с т. пл. 90-92 С, Rf 0,27 (хлороформ-метанол, 9:1), []D -(103) (с 1, этанол). НайденоN-3-карбоксипропионил-аланил-2-цианопирролидина и ингибирующая дипептидилпептидазу-IV активность хлоргидрата Ala-Prd-CN (соединение I), его антидиабетическое, противогликемическое, нейропротекторное, улучшающее когнитивные функции действие и преимущества нового соединения перед эталонным препаратом ситаглиптином представлены в следующих примерах. Пример 1. Влияние соединений Suc-Ala-Prd-CN, Ala-Prd-CN и ситаглиптина на активность дипептидилпептидазы-IV (ДПП-IV) и родственных ДПП-IV ферментов из неочищенной плазмы крови больных диабетом типа 2, здоровых добровольцев и экспериментальных животных. Материалы и методы исследования Использовали субстанции соединений хлоргидрат Ala-Prd-CN и N-3-карбоксипропионил-аланил-2 цианопирролидин. В качестве образца сравнения выбран коммерческий препарат ситаглиптин(ЯНУВИЯ фирмы Merck). Действующее начало ситаглиптина из лекарственной формы получали экстракцией водой в ультразвуковом дезинтеграторе УЗДГН-01 с последующей очисткой жидкостной хроматографией с обращенной фазой на колонке Luna-2 (С 18, Phenomenex). Полученный препарат был гомогенным при тонкослойной хроматографии на пластинах силикагеля (Kieselgel UV254, Merck) при проявлении в парах йода. Раствор высушивали в потоке газообразного азота и использовали для исследования влияния на активность дипептидилпептидаз IV и II, пролилэндопептидазы и пролидазы. Кровь собирали из локтевой вены здоровых добровольцев и пациентов с диабетом 2-го типа, а также у белых беспородных половозрелых крыс-самцов, используя в качестве антикоагулянта 0,109 М трехзамещенный цитрат натрия. Плазму получали центрифугированием цельной крови на холоде в течение 30 мин при 2500g на центрифуге J6-B (Beckman-Coulter, США). Плазму аккуратно отделяли от осевших клеток и использовали для очистки ДПП-IV. До начала выделения плазму хранили при -80C. Получение ферментных препаратов Все работы по получению ферментных препаратов проводили при 4C. Получение дипептидилпептидазы-IV. Плазму крови разводили в 5 раз 0,02 М трис-HCl буфером сpH 7,5, содержащим 0,1 мМ дитиотреитола и 1,0 мМ ЭДТА. К разбавленной плазме при перемешивании добавляли кристаллический (NH4)2SO4 до 70% насыщения (560 г/л). Преципитат собирали центрифугированием, осадок растворяли в 0,05 М Na-фосфатном буфере с pH 7,0, содержащем 1,5 М (NH4)2SO4 и наносили на колонку (2,615 см) фенилсефарозы (Amersham-Pharmacia). Белки элюировали понижающимся градиентом (NH4)2SO4 в фосфатном буфере. Фракции, содержащие активность ДПП-4, собирали,концентрировали добавлением (NH4)2SO4, а полученный осадок растворяли в 0,02 М трис-HCl буфере сpH 7,5, содержащем 0,1 мМ дитиотреитола и 1,0 мМ ЭДТА и наносили на колонку (2,690 см) с сефадексом G-100 (Amersham-Pharmacia). Белки элюировали тем же буфером со скоростью 30 мл/ч. Активные фракции собирали, концентрировали ультрафильтрацией на мембране UM-30 (Amicon) и хроматографировали на колонке конканавалин-А-сефарозы (Amersham-Pharmacia). Окончательную очистку проводили ионообменной хроматографией на колонке MonoQ (Amersham-Pharmacia). Полученный препарат ДППIV представлял собой димер с молекулярной массой при гель-хроматографии на ультрагеле АсА-34 220Kd. Фермент был гомогенен при электрофорезе в геле полиакриламида в присутствии додецилсульфатаNa и имел значение молекулярной массы для мономера около 110 Kd. Очищенную ДПП-IV концентрировали методом ультрафильтрации и хранили при -80C. Получение дипептидилпептидазы-II Фермент получали из плаценты крупного рогатого скота. Разделение активностей ДПП-II и ДПП-IV в процессе выделения контролировали по гидролизу субстрата Lys-Ala-AMC при pH 5,5 (специфично для ДПП-II) в отличие от гидролиза Gly-Pro-AMC, расщепляемого с оптимумом pH при 7,5. Для выделения ДПП-II использовали модифицированную, по сравнению с описанной для плаценты человека процедуру. Частичную очистку ДПП-2 из гомогената проводили фракционированием сульфатом аммония,хроматографией на DEAE-целлюлозе (Wathman) и фенилсефарозе (Amesham-Pharmacia). Полученный препарат фермента хранили при -80C. Получение пролилэндопептидазы (ПЭП) Очистку пролилэндопептидазы из эритроцитов крови человека проводили методом ионообменной хроматографии на DEAE-сефадексе А-50 (Amersham-Phamacia), гель-хроматографии на сефадексе G-75(Amersham-Phamacia) и высокоэффективной хроматографии на колоне MonoQ (Amersham-Phamacia) в системе FPLC. Полученный препарат ПЭП представлял собой мономер и был гомогенен при элетрофорезе в геле полиакриламида в присутствии додецилсульфата Na и имел значение молекулярной массы 75Kd. Очищенную ПЭП концентрировали методом ультрафильтрации и хранили при -80C. Определение активности протеиназ За единицу активности фермента принимали его количество, расщепляющее 1 мкмоль субстрата за 1 мин. Активность дипептидилпептидазы-IV (КФ 3.4.14.5, CD26, ДПП-IV) определяли по гидролизу субстрата Gly-Pro-7-амино-4-метилкумарина (Bachem) флуорометрически. Протокол измерения Последовательно смешивали 20 мкл раствора фермента (от 0,5 до 5 мкг фермента) с 760 мкл 0,02 М Трис-HCl буфера pH 8,0 и 20 мкл раствора Gly-Pro-AMC (1 мг/мл в DMSO) (всего v=800 мкл), энергично перемешивали и инкубировали при 37C в течение 20 мин. Реакцию останавливали 200 мкл 20% уксусной кислоты. Флуоресценцию 4-метил-кумарил-7-амида измеряли при длине волны возбуждения 380 нм и флуоресценции 460 нм. Удельную активность определяли по формуле где Е - флуоресценция пробы (380/460 нм); С - флуоресценция смеси, содержащей по 20 мкл субстрата и фермента, 760 мкл буфера (pH 6,0), и 200 мкл 20% уксусной кислоты; В - флуоресценция смеси,содержащей 20 мкл субстрата, 780 мкл буфера и 200 мкл уксусной кислоты; S - флуоресценция смеси,содержащей 20 мкл субстрата, 780 и 200 мкл уксусной кислоты и 1 мкл раствора 7-амино-4 метилкумарина (1 нмоль). Активность дипептидилпептидазы-II (КФ 3.4.14.2, ДПП-II) определяли по гидролизу субстрата LysAla-7-амино-4-метилкумарина (Bachem) флуорометрически при pH 5,5 (для гидролиза субстрата Gly-ProAMC оптимум наблюдали при pH 8). Протокол измерения Последовательно смешивали 20 мкл раствора фермента (от 0,5 до 5 мкг фермента) с 760 мкл 0,1 МNa-фосфатного буфера pH 5,5 и 20 мкл раствора Lys-Ala-AMC (1 мг/мл в DMSO) (всего v=800 мкл),энергично перемешивали и инкубировали при t=37C в течение 20 мин. Реакцию останавливали 200 мкл 20% уксусной кислоты. Флуоресценцию 4-метил-кумарил-7-амида измеряли при длине волны возбуждения 380 нм и флуоресценции 460 нм. Удельную активность определяли по формуле где Е - флуоресценция пробы (380/460 нм); С - флуоресценция смеси, содержащей по 20 мкл субстрата и фермента, 760 мкл буфера (pH 5,5) и 200 мкл 20% уксусной кислоты; В - флуоресценция смеси,содержащей 20 мкл субстрата, 780 мкл буфера и 200 мкл уксусной кислоты; S - флуоресценция смеси,содержащей 20 мкл субстрата, 780 мкл и 200 мкл уксусной кислоты и 1 мкл раствора 7-амино-4 метилкумарина (1 нмоль). Определение дипептидилпептидазы-I (КФ 3.4.14.1; катепсин С, ДПП-I) проводили в эксперименте с использованием препарата катепсина С из селезенки быка (С-8511, Sigma-Aldrich) с удельной активностью 5 ед./мг белка. Активность ДПП-I измеряли двумя способами - спектрофотометрически с субстратом His-Ser-p-нитроанилидом (His-Ser-pNA, Bachem, Heidelberg, Germany) и флуорометрически с субстратом Gly-Arg-7-амино-4-метилкумарином (Gly-Arg-АМС, Bachem). Спектрофотометрический метод определения активности ДПП-I состоял в том, что от 0,25 до 10 мкг ферментного препарата ДПП-I инкубировали в течение 5 мин при 37C в 500 мкл активационного буфера (100 мМ Na2HPO4 с pH 6,0, содержащего 20 мМ NaCl, 1 мМ EDTA и 4 мМ цистеина), добавляли 400 мкл субстратного буфера (100 мМ Na-фосфатный буфер с pH 6, содержащий 20 мМ NaCl, 1 мМEDTA, 125 мМ His-Ser-pNA и 1% DMSO). Освобождение p-нитроанилина регистрировали в течение 10 мин на спектрофотометре DU-50 (Beckman, USA) при 410 нм. Количество р-нитроанилина определяли на основании коэффициента молярной экстинкции 8800 М-1 л-1 см-1. При флуорометрическом методе определения активности ДПП-I в качестве субстрата использовали Gly-Arg-7-амино-4-метилкумарином (GlyArg-AMC, Bachem). Освобождение 4-метил-кумарил-7-амина регистрировали на спектрофлуорометреLS-5-B (Perkin-Elmer). Протокол измерения Последовательно смешивали 20 мкл раствора фермента (от 0,5 до 5 мкг фермента) с 760 мкл 0,1 МNa-фосфатного буфера pH 6,0 и 20 мкл раствора Gly-Arg-AMC (1 мг/мл в DMSO) (всего v=800 мкл),энергично перемешивали и инкубировали при t=37C в течение 20 мин. Реакцию останавливали 200 мкл 20% уксусной кислоты. Флуоресценцию 4-метил-кумарил-7-амида измеряли при длине волны возбужде-5 021236 ния 380 нм и флуоресценции 460 нм. Удельную активность определяли по формуле где Е - флуоресценция пробы (380/460 нм); С - флуоресценция смеси, содержащей по 20 мкл субстрата и фермента, 760 мкл буфера (pH 6,0) и 200 мкл 20% уксусной кислоты; В - флуоресценция смеси,содержащей 20 мкл субстрата, 780 мкл буфера и 200 мкл уксусной кислоты; S - флуоресценция смеси,содержащей 20 мкл субстрата, 780 и 200 мкл уксусной кислоты и 1 мкл раствора 7-амино-4 метилкумарина (1 нмоль). Для определения активности дипептидилпептидазы 8/9 использовали так называемый желатиназный метод, что отличает ее от других дипептидилпептидаз, которые желатин не гидролизуют. Ферментный препарат получали из лейкоцитов периферической крови человека различными хроматографическими процедурами. Активность пролилэндопептидазы (КФ 3.4.21.26, ПЭП) определяли аналогично определению ДППIV с использованием флуорогенного субстрата Z-Ala-Pro-AMC, где Z=бензилоксикарбонил). В эксперименте использовали очищенный из эритроцитов человека фермент. При определении пролидазы (КФ 3.4.13.9) использовали очищенную из почек свиньи пролидазу(Sigma-Aldrich, P6675). Фермент избирательно гидролизует дипептиды типа Хаа-Pro (частично Хаа-Нур) и не гидролизует дипептид Pro-Pro. Принцип определения фермента основан на мониторинге катализируемого ферментом расщепления субстрата Gly-L-Pro при 40C и pH 8,0 в кювете спектрофотометра при длине волны 242 нм в 1-см кварцевой кювете. За 1 единицу активности принимали количество фермента,гидролизующее 1 мкмоль Gly-Pro за 1 мин. В определении использованы следующие реактивы фирмы Sigma-Aldrich: А) 50 мМ трис-HCl буфер, pH 8,0 (готовится 100 мл из Trizma base (T-1503), доводится 1 н HCl доpH 8,0 при 40C); Б) 30 мМ раствор глутатиона (GSH) (готовится непосредственно перед использованием 5 мл на деионизованной воде из восстановленного глутатиона (G-4251; В) 20 мМ раствор MnCl2 (готовится 10 мл раствора на деионизованной воде (MnCl24H2O, М-3634; Г) 25 мМ Gly-L-Pro (готовится 30 мл на растворе А, используя Gly-L-Рго (G-3002). Значение pH доводят до 8,0 при 40C, используя при необходимости 1 н HCl или NaOH); Д) раствор пролидазы (готовится непосредственно перед использованием раствор с содержанием фермента около 5 мг/мл в холодном растворе А). Протокол измерения Готовили активированный фермент, смешивая (в мл) следующие растворы точно в перечисленном порядке: раствор А (буфер) - 2,40; Раствор В (MnCl2) - 0,40; раствор Б (GSH) - 0,10; раствор Д (пролидаза) - 0,20. Затем перемешивают и инкубируют при 40C в течение 20, 25 и 30 мин. Сразу после окончания активации помещают в кварцевую кювету спектрофотометра DU-50 (Beckman-Coulter): раствор Г (GlyPro, мл) в опыте =2,70, в контроле =2,70; раствор В (MnCl2, мл) в опыте =0,20, в контроле =0,20. Перемешивают и нагревают до 40C. Регистрируют оптическую плотность при 242 нм до стабильного значения. Затем добавляют активационную смесь с ферментом - 0,50 и активационную смесь без фермента - 0,50. Быстро перемешивают и регистрируют снижение оптической плотности около 5 мин. Вычисления где 3,1 - объем (в мл) активационной смеси; 3,4 - объем (в мл) реакционной смеси; 0,0254 - миллимолярный коэффициент экстинкции для Gly-Pro при 242 нм; 0,5 - объем (в мл) использованного в определении фермента; 0,2 - объем (в мл) использованного при активации фермента. Определение степени ингибирования (IC50) пептидаз В эксперименте использовали препараты ингибиторов в концентрации 0,1, 1, 10 и 100 мкМ. Для каждой концентрации измерения проводили в присутствии различных концентраций Gly-Pro-AMC(0,006, 0,024, 0,10, 0,39, 1,56, 1,25, 6,25, 25 и 100 nM. Было проведены эксперименты в трех параллельных измерениях. Параметры ингибирования определяли в программе Prism-4 (GraphPad Software Inc., SanDiego, CA, USA). Протокол измерения К 20 мл раствора фермента (около 5 мг/мл белка) или неочищенной плазмы крови от больных диабетом типа 2 и здоровых добровольцев добавляли 740 мкл 0,02 М Трис-HCl с pH 8,0, 20 мкл раствораAlaPrdN или ситаглиптина и преинкубировали при 37C в течение 30 мин. Затем к смеси добавляли 20 мкл раствора субстрата в DMSO и продолжали инубировать в тех же условиях в течение 20 мин. Реакцию останавливали добавлением 200 мкл 20% раствора уксусной кислоты. Флуоресценцию освободившегося в процессе ферментативной реакции 4-метилкумарил-7-амида измеряли при длине волны возбуждения 380 нм и флуоресценции 460 нм. Статистический анализ и графическое представление полученных результатов проводился при использовании пакета программ Prizm 4 (GraphPad Software, Inc.). Достоверность различий с контролем оценивали с использованием критерия Манна-Уитни. Результаты исследования 1. Влияние соединения Ala-Prd-CN и ситаглиптина на активность дипептидилпептидазы-IV (ДППIV) и родственных ДПП-IV ферментов из неочищенной плазмы крови больных диабетом 2-го типа и здоровых добровольцев. Установлено, что значение активности дипептидилпептидазы-IV (ДПП-IV) в плазме крови здоровых добровольцев (n=17) составляло 2,170,07 нмоль/мин/мл. В плазме крови от пациентов с диабетом 2 го типа (n=9) этот показатель составил 3,740,21 нмоль/мин/мл. Эти цифры были приняты за 100% и показатели по оценке влияния препаратов рассчитывались как процент по отношению к контролю, т.е. определяли остаточную активность дипептидилпептидазы-IV в % (табл. 1). Результаты по изучению влияния веществ на активность ДПП-IV в образцах плазмы крови представлены в табл. 1. Концентрации Ala-Prd-CN HCl и ситаглиптина для определения ингибирования дипептидилпептидазы-IV (ДПП-4) в плазме составляли 1, 10 и 100 нмоль. Показано, что активность ДПП-IV в плазме крови от здоровых добровольцев и больных диабетом типа 2 угнеталась Ala-Prd-CN HCl и ситаглиптином в диапазоне концентраций от 1 до 100 нмоль. Ингибиторная активность соединения AlaPrd-CN HCl достоверно (Р 0,05) превышала таковую для используемого в качестве препарата сравнения ситаглиптина. Таблица 1. Влияние Ala-Prd-CN, Suc-Ala-Prd-CN и ситаглиптина на активность дипептидилпептидазы-IV в плазме крови больных диабетом типа 2 (n=9) и здоровых добровольцев (n=17) Изучение влияния Ala-Prd-CN и ситаглиптина на активность родственных ДПП-IV ферментов: дипептидилпептидазы-I (ДПП-I), дипептидилпептидазы-II (ДПП-II), дипептидилпептидазы-8/9 (ДПП-8/9),пролидазы и пролилэндопептидазы (ПЭП) - проводили с использованием плазмы крови здоровых добровольцев. Установлено, что Ala-Prd-CN HCl и ситаглиптин не обладали ингибирующей активностью по отношению к дипептидилпептидазе-I (ДПП-I), дипептидилпептидазе-II (ДПП-II), дипептидилпептидазе-8/9(ДПП-8/9), пролидазе и пролилэндопептидазе (ПЭП) (табл. 2). Таблица 2. Сравнительная ингибиторная эффективность Suc-Ala-Prd-CN, Ala-Prd-CN и ситаглиптина на активность родственных ДПП-IV ферментов (дипептидилпептидазы-I (ДПП-I), дипептидилпептидазы-II Таким образом, полученные данные показали, что соединение Ala-Prd-CN HCl обладает высокой ингибирующей активностью по отношению к очищенной из плазмы крови человека дипептидилпептидазе-IV, как у здоровых добровольцев, так и у больных диабетом 2-го типа. Известный препарат сравнения для лечения диабета 2-го типа - ситаглиптин (ЯНУВИЯ) также показал высокую ингибиторную активность. Значения IC50 для ингибирования ДПП-IV в исследованиях у человека, рассчитанные из уравнения Ченга-Пруссофа, находились для соединения Ala-Prd-CN HCl в диапазоне 2,00,3 нмоль/л, а для ситаг-7 021236 липтина 25,09,0 нмоль/л, что соответствует данным по ситаглиптину, известным из литературы (Discovery of JANUVIA (Sitagliptin), a Selective Dipeptidyl Peptidase IV Inhibitor for the Treatment of Type2Ala-Prd-CN и ситаглиптин не проявили ингибирующих свойств по отношению к другим протеиназам - дипептидилпептидазам I, II, 8/9, пролилэндопептидазе и пролидазе. 2. Влияние Suc-Ala-Prd-CN и Ala-Prd-CN на активность дипептидилпептидазы-IV (ДПП-IV) и пролилэндопептидазы в плазме крови экспериментальных животных. Исследования проводили на белых беспородных половозрелых крысах-самцах массой 250-280 г(n=6) согласно методикам, описанным выше. Suc-Ala-Prd-CN вводили однократно, внутрибрюшинно в дозе 5 мг/кг. Ala-Prd-CN HCl вводили однократно, внутрибрюшинно в дозах 1 и 2 мг/кг (n=6). Контрольным животным (n=6) в аналогичном объеме внутрибрюшинно вводили дистиллированную воду. Регистрацию активности ПЭП и ДПП-IV проводили через различные интервалы времени после введения веществ. Установлено, что Suc-Ala-Prd-CN (5 мг/кг) при однократном внутрибрюшинном введении статистически значимо в несколько раз снижает активность пролилэндопептидазы (ПЭП) в течение 5-ти ч. Максимальное угнетение активности фермента наблюдается через 1-2 ч после введения Suc-Ala-Prd-CN и затем ингибирующий ПЭП эффект постепенно уменьшается, хотя и сохраняется на достоверном уровне в течение 5-ти ч.Suc-Ala-Prd-CN (5 мг/кг) при однократном внутрибрюшинном введении статистически значимо снижает активность ДПП-IV. Уменьшение активности ДПП-IV под влиянием Suc-Ala-Prd-CN наблюдается постепенно, достигая статистически значимого снижения через 3 ч после введения вещества, и затем эффект постепенно усиливается и достигает максимума через 5-6 ч. Как видно из табл. 3, активность ДПП-IV в плазме крови крыс под влиянием Ala-Prd-CN HCl (2 мг/кг) существенно и статистически значимо снижается. Эффект вещества выявляется уже через 1 ч после введения вещества и сохраняется на протяжении 6 ч наблюдения. Ala-Prd-CN HCl не влияет на активность ПЭП в течение 6 ч наблюдения. Таблица 3. Влияние Suc-Ala-Prd-CN и Ala-Prd-CN HCl на активность дипептидилпептидазы-IV Таким образом, Suc-Ala-Prd-CN (5 мг/кг) при однократном внутрибрюшинном введении снижает активность пролилэндопептидазы (ПЭП) уже через 1 ч после введения и этот эффект сохраняется в течение 5-ти ч, тогда как активность ДПП-IV под влиянием Suc-Ala-Prd-CN снижается постепенно и достоверный результат наблюдается только через 3 ч после введения и затем эффект усиливается, достигая максимума через 5-6 ч. В противоположность Suc-Ala-Prd-CN соединение Ala-Prd-CN HCl не влияет на активность ПЭП, но оказывает достоверный и продолжительный (6 ч) ингибирующий эффект на активность ДПП-IV. Дополнительно, известно, что ацилированные пептиды в процессе метаболизма в организме млекопитающих деацилируются ферментативным путем (Published in Enzyme Nomenclature 1992 [Academic(1993), Supplement 2 (1994), Supplement 3 (1995), Supplement 4 (1997) and Supplement 5 (in Eur. J. Biochem. 1994, 223, 1-5; Eur. J. Biochem. 1995, 232, 1-6; Eur. J. Biochem. 1996, 237, 1-5; Eur. J. Biochem. 1997, 250; 16, and Eur. J. Biochem. 1999, 264, 610-650; respectively) [Copyright IUBMB]). Подобное указывает на то,что в процессе метаболизма Suc-Ala-Prd-CN деацилируется до Ala-Prd-CN. Пример 2. Антидиабетическая, гипогликемическая активность Suc-Ala-Prd-CN в сравнении с AlaPrd-CN и ситаглиптином на стрептозотоциновой модели сахарного диабета в эксперименте. Исследование проводили на крысах-самцах линии Вистар массой 290-320 г. Использовали экспериментальную модель сахарного диабета 2-го типа, индуцированного повторным введением крысам преддиабетогенных доз токсина стрептозотоцина (Новиков В.И., Молотков О.В., Подчеко А.П. Протективный эффект Т-активина при экспериментальном сахарном диабете. Сахарный диабет.2, 1999, с. 37-40. Колесник Ю.М., Василенко Г.В., Абрамов А.В. Состояние островкового аппарата поджелудочной железы при экспериментальном сахарном диабете различной степени тяжести у крыс. Арх. патологии,-8 021236 1992, т. 54,12, с. 24-27). Стрептозотоцин (СТЗ) вводили внутрибрюшинно в дозе 30 мг/кг 3 раза с интервалом 24 ч (суммарно животное получало 90 мг/кг СТЗ). Глюкометрию проводили через 24 ч и через 7 суток после последнего (3-го) введения СТЗ. Уровень глюкозы в крови измеряли глюкометром: сначала после 12 ч голодания, а затем через 1 ч после нагрузки глюкозой, которую осуществляли путем внутрибрюшинного введения раствора глюкозы в дозе 1 г/кг, внутрибрюшинно. Наряду с этим, определяли прирост веса животных в первый день введения СТЗ и на 4-й день после введения СТЗ.Sue Ala-Prd-CN вводили внутрибрюшинно в дозе 3 мг/кг трехкратно за 4 ч до введения СТЗ в течение 3 дней с интервалом 24 ч. В качестве вещества сравнения использовали Ala-Prd-CN, который вводили внутрибрюшинно в дозе 3 мг/кг трехкратно за 10 мин до введения СТЗ в течение 3 дней с интервалом 24 ч. В качестве препарата сравнения использовали ситаглиптин (Янувия фирмы Merck), который является наиболее широко применяемым препаратом при лечении диабета 2-го типа. Ситаглиптин вводили внутрибрюшинно в дозе 5 мг/кг трехкратно за 10 мин до введения СТЗ в течение 3 дней с интервалом 24 ч. Установлено, что у контрольных животных через 24 ч после последнего (3-го) введения стрептозотоцина (СТЗ, 30 мг/кг, (внб наблюдается статистически достоверное увеличение уровня глюкозы в крови крыс по сравнению с показателями контрольных животных, как при измерении после 12 ч голодания,так и через 1 и 2 ч после глюкозной нагрузки (табл. 4). Высокий уровень глюкозы в крови, достоверно превышающий показатели контрольных животных,сохраняется и через 7 дней после последнего (3-го) введения СТЗ, как при измерении после 12 ч голодания, так и через 1 и 2 ч после нагрузки глюкозой. Таблица 4. Влияние Suc-Ala-Prd-CN в сравнении с Ala-Prd-CN и ситаглиптином на уровень глюкозы в крови на стрептозотоциновой (СТЗ) модели сахарного диабета у крыс- Р 0,05 достоверность различий по критерию Манна-Уитни в сравнении с группой контроля (дистиллированная вода).- Р 0,05 достоверность различий по критерию Манна-Уитни в сравнении с группой СТЗ.- Р 0,05 достоверность различий по парному критерию Стьюдента по сравнению со значениями на фоне 12 ч голодания. Установлено, что Suc-Ala-Prd-CN (3 мг/кг трехкратно за 4 ч до введения СТЗ в течение 3-х дней с интервалом 24 ч) также статистически достоверно уменьшает повышенный уровень сахара в крови животных. Через 24 ч после последнего введения СТЗ и после глюкозной нагрузки Suc-Ala-Prd-CN статистически достоверно снижает уровень сахара в 2 раза. Через 7 дней после последнего введения СТЗ SucAla-Prd-CN также статистически достоверно снижает уровень глюкозы как на фоне 12-часового голодания (в 2,2 раз), так и после нагрузки глюкозой (в 1,4 раза) по сравнению с группой животных, получавших СТЗ (табл. 4).Ala-Prd-CN (3 мг/кг трехкратно за 10 мин до введения СТЗ в течение 3-х дней с интервалом 24 ч) обладает выраженной способностью уменьшать повышенный уровень сахара в крови животных. Через 24 ч после последнего введения СТЗ и после глюкозной нагрузки Ala-Prd-CN HCl статистически достоверно снижает (в 2,1 раза) уровень сахара. Через 7 дней после последнего введения СТЗ Ala-Prd-CN HCl также статистически достоверно снижает уровень глюкозы как на фоне 12-часового голодания (в 1,8 раз), так и после нагрузки глюкозой (в 1,7 раза) по сравнению с группой животных, получавших СТЗ(табл. 4). Ситаглиптин (5 мг/кг трехкратно за 10 мин до введения СТЗ в течение 3 дней с интервалом 24 ч) статистически достоверно снижает (в 1,5 раза) уровень глюкозы только на фоне 12 часового голодания через 7 дней после последнего введения СТЗ, но не уменьшает повышенный СТЗ уровень глюкозы через 24 ч и 7 суток после последнего введения СТЗ и глюкозной нагрузки (табл. 4). Полученные данные свидетельствуют о том, что Suc-Ala-Prd-CN (введение за 4 ч до СТЗ), также как и Ala-Prd-CN (введение за 10 мин до СТЗ), в дозе 3 мг/кг обладают выраженной, гипогликемической активностью на модели диабета 2-го типа, индуцированного стрептозотоцином у крыс, что выражается в их способности статистически достоверно снижать уровень глюкозы в крови животных через 24 ч и 7 суток после последнего введения СТЗ как после голодания, так и на фоне нагрузки глюкозой.Suc-Ala-Prd-CN и Ala-Prd-CN значительно превосходят по гипогликемической активности известный препарат ситаглиптин, который при аналогичной схеме введения в большей дозе (5 мг/кг) снижает уровень глюкозы только при одном измерении - после 12-часового голодания через 7 дней после последнего введения СТЗ, и не влияет на повышенный СТЗ уровень глюкозы через 24 ч и 7 суток на фоне нагрузки глюкозой. Таким образом, Suc-Ala-Prd-CN и Ala-Prd-CN в дозе 3 мг/кг обладают выраженной, гипогликемической активностью на модели диабета 2-го типа, индуцированного стрептозотоцином у крыс и значительно превосходят по активности известный препарат ситаглиптин, применяемый для лечения диабета 2-го типа. В отличие от Ala-Prd-CN и ситаглиптина, которые оказывают гипогликемический эффект через короткий латентный период (введение за 10 мин до СТЗ), Suc-Ala-Prd-CN имеет отсроченный гипогликемический эффект, который проявляется через 4 ч после введения вещества. Отсроченный гипогликемический эффект Suc-Ala-Prd-CN связан с его метаболизмом и механизмом действия, а именно с его способностью превращаться в Ala-Prd-CN и приобретать свойства ингибитора дипептидилпептидазы-IV. Пример 3. Влияние Suc-Ala-Prd-CN на нарушенные когнитивные функции. Изучение влияния Suc-Ala-Prd-CN на нарушенные когнитивные функции проводили в опытах на белых беспородных половозрелых крысах самцах массой 250-280 г. Использовали методику скополаминовой амнезии условного рефлекса пассивного избегания (УРПИ) согласно Методическим указаниям по изучению активности веществ, обладающих ноотропной активностью (Воронина Т.А., Островская Р.У.,2005), изложенных в Руководстве по экспериментальному (доклиническому) изучению новых фармакологических веществ (Федеральная служба по надзору в сфере здравоохранения и социального развития,Федеральное государственное учреждение научный центр экспертизы средств медицинского применения, изд. Медицина, ред. Хабриев Р.У., М., 2005, с. 308-320). Исследование проводили в сертифицированной установке Lafayette Instrument Co (США). Установка представляет собой темную камеру размером 400400400 мм с электродным полом. Темная камера соединена через квадратную гильотинную дверцу размером 6060 мм с навесной платформой размером 25070 мм. Навесная платформа освещена лампой 60 Вт, расположенной на высоте 400 мм. Темная камера располагается на лабораторном столе, а платформа висит над полом на высоте 800 мм. Крыс помещали на освещенную платформу перед входом в темную камеру установки хвостом к входному отверстию и регистрировали латентное время рефлекса. Затем в темной камере крыса получала однократное болевое раздражение электрическим током (0,3 мА) продолжительностью 10 с (обучение). Для нарушения когнитивных функций (амнезия обученного УРПИ) крысам за 30 мин до обучения условному рефлексу пассивного избегания (УРПИ) вводили блокатор М-холинергических рецепторов скополамин в дозе 1,15 мг/кг внутрибрюшинно, затем проводили процедуру обучения УРПИ и через 24 ч воспроизводили рефлекс УРПИ. Тест на воспроизведение обученного и наличие амнезии проводили при повторном помещении животного в установку через 24 ч после обучения с регистрацией в течение 3 мин латентного периода первого захода крысы в темную экспериментальную камеру, где она ранее получала болевое раздражение, и количества животных, не зашедших в темный отсек камеры, в %.Suc-Ala-Prd-CN вводили в дозе 2 мг/кг однократно внутрибрюшинно за 40 мин до обучения. В качестве препарата сравнения использовали известный ноотропный препарат пирацетам в дозе 500 мг/кг(однократно, внутрибрюшинно, за 40 мин до обучения). Статистическая обработка результатов была осуществлена с помощью статистических пакетовBioStat для Windows. Использовали критерий Манна-Уитни и критерий х 2. Результаты исследования Контроль без амнезии. При помещении на освещенную платформу крысы с коротким латентным периодом заходят в темную камеру и получают там болевое раздражение через электродный пол (обучение). При воспроизведении рефлекса через 24 ч после обучения крысы помнят обученное и при помещении их на освещенную платформу животные остаются там основное время эксперимента и мало заходят в темную опасную камеру, где они накануне получили болевое раздражение (обучение) (табл. 5). Контроль с амнезией. Введение скополамина перед обучением вызывает амнезию, которая выражается в статистически достоверном (Р 0,05) существенном укорочении (в 4,6 раза) длительности латент- 10021236 ного периода захода в темную опасную камеру при воспроизведении УРПИ и достоверном (Р 0,05) уменьшении (полном отсутствии) животных, совсем не зашедших в темный опасный отсек камеры при воспроизведении, т.е. помнящих о нанесенном там накануне болевом раздражении (табл. 5). Полученные данные свидетельствуют о выраженном амнезирующем действии скополамина.Suc-Ala-Prd-CN в дозе 2 мг/кг (однократно, внутрибрюшинно) статистически достоверно (Р 0,05) увеличивает (в 2,54 раза) длительность латентного периода захода в темную опасную камеру при воспроизведении УРПИ и число животных без амнезии, совсем не зашедших в темный отсек камеры при воспроизведении, т.е. помнящих о нанесенном там накануне болевом раздражении (в контроле с амнезией - 0%, а после введения SucAla-Prd-CN у 33,3%) (табл. 5). Аналогичным антиамнестическим эффектом обладает пирацетам в дозе 500 мг/кг (однократно, внутрибрюшинно) (табл. 5). Таблица 5. Влияние Suc-Ala-Prd-CN в дозе 2 мг/кг (однократно, внутрибрюшинно) и пирацетама в дозе 500 мг/кг (однократно, внутрибрюшинно) на амнезию условного рефлекса пассивного избегания- достоверность отличий от контроля без амнезии при Р 0,05 по критерию МаннаУитни;- достоверность отличий от контроля без амнезии при Р 0,05 по критерию по критерию х 2.- достоверность отличий от контроля с амнезией (скополамин) при Р 0,05 по критерию Манна-Уитни;- достоверность отличий от контроля с амнезией (скополамин) при Р 0,05 по критерию х 2. Таким образом, Suc-Ala-Prd-CN в дозе 2 мг/кг обладает способностью восстанавливать нарушенные когнитивные функции, оказывая отчетливое антиамнестическое действие в тесте амнезии условного рефлекса пассивного избегания, вызванной блокатором М-холинорецепторов скополамином в сертифицированной установке Lafayette Instrument Co (США). По выраженности антиамнестического эффектаSuc-Ala-Prd-CN в дозе 2 мг/кг не уступает эталонному ноотропному препарату пирацетаму (500 мг/кг). Пример 4. Изучение нейропротекторного действия Suc-Ala-Prd-CN. Нейропротекторное действие Suc-Ala-Prd-CN оценивали по способности вещества устранять нейродегенеративные, нейротоксические изменения, вызванные максимальным электрошоком (Воронина Т.А., Неробкова Т.Н. Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. Федеральная служба по надзору в сфере здравоохранения и социального развития, Федеральное государственное учреждение научный центр экспертизы средств медицинского применения, изд. Медицина, ред. Хабриев Р.У., М., 2005). Эксперимент выполняли на белых беспородных крысах-самцах массой 250-280 г. С целью получения нейродегенеративных поражений мозга использовали максимальный электросудорожный шок(МЭШ). Животным через корнеальные электроды наносился электрический стимул (50 Гц, 150 мА) длительностью 0,2 с. Нейропротекторный эффект Suc-Al-Prd-CN оценивали по влиянию на следующие показатели: продолжительность комы (о наступлении которой судили по утрате рефлекса переворачивания с развитием полной адинамии, тотальной мышечной гипотонии, отсутствием корнеальных рефлексов и болевой чувствительности), латентный период активных движений (время от момента выхода животного из комы и восстановления рефлекса переворачивания до появления спонтанной двигательной активности), общая продолжительность судорог, продолжительность тонической и клонической фаз судорожных проявлений. Неврологические дефициты по нарушению локомоторной и ориентировочно-исследовательской активности после максимального электрошока оценивали в тесте Открытого поля. Тест Отрытое поле выполнялся дважды: первый раз - за 48 ч до электрошока и через 30 мин после введения Suc-Ala-Prd-CN и второй раз - через 3 ч после проведения электрошока. Данная схема позволяла оценить как влияние вещества на спонтанное поведение животных (введение до электрошока), так и оценить протективный эффект Suc-Ala-Prd-CN в условиях нейродегенеративного повреждения мозга (введение вещества после электрошока). Кроме того, неврологический дефицит по нарушению координации движений оценивали в тесте Вращающегося стержня в установке Rota Rod (фирма Ugo Basile, Италия). Suc-Ala-Prd-CN вводили в дозе 3 мг/кг однократно внутрибрюшинно за 40 мин до начала экспериментов. О наличии нейропротекторного эффекта у изучаемого вещества судили также по его способности уменьшать выраженность постсудорожных психоневрологических нарушений, а именно амнезии условного рефлекса пассивного избегания (УРПИ). Исследование проводили в сертифицированной установкеLafayette Instrument Co (США). Установка представляет собой темную камеру размером 400400400 мм с электродным полом. Темная камера соединена через квадратную гильотинную дверцу размером 6060 мм с навесной платформой размером 25070 мм. Навесная платформа освещена лампой 60 Вт,расположенной на высоте 400 мм. Темная камера располагается на лабораторном столе, а платформа висит над полом на высоте 800 мм. Сначала проводили обучение крыс. Животное помещали на освещенную платформу перед входом в темную камеру установки хвостом к входному отверстию и регистрировали латентное время рефлекса. Затем в темной камере крыса получала однократное болевое раздражение электрическим током (0,3 мА) продолжительностью 10 с (обучение). Тест на воспроизведение обученного УРПИ проводили через 48 ч после обучения, регистрируя в течение 3 мин латентный период первого захода крысы в темную опасную камеру, где она ранее получала болевое раздражение, и количество животных, совсем не зашедших в темный отсек камеры, в %. Затем после теста на сохранность обученного, для получения амнезии, которая сопровождается нейродегенеративными нарушениями мозга,крысы получали максимальный электрошок и через 3 ч у них регистрировали амнезию по показателям латентного периода первого захода крысы в темную опасную камеру, где она ранее получала болевое раздражение, и количества животных, совсем не зашедших в темный отсек камеры, в %. Suc-Ala-Prd-CN вводили в дозе 3 мг/кг внутрибрюшинно дважды: за 30 мин до обучения и за 30 мин до воспроизведения. Статистическая обработка результатов была осуществлена с помощью статистических пакетов(продолжительность комы и латентный период начала активных двигательных движений после комы),выраженность судорожного синдрома и двигательное поведение в открытом поле после проведения максимального электрошока у крыс. Установлено, что Suc-Ala-Prd-CN обладает выраженной способностью уменьшать неврологические нарушения, вызванные максимальным электрошоком (МЭШ). Нейропротекторный эффект Suc-Ala-PrdCN выражался в способности вещества статистически достоверно по сравнению с контролем уменьшать(в 1,8 раз) продолжительность комы, а также уменьшать (в 6 раз) время от момента восстановления рефлекса переворачивания (показатель комы) до появления спонтанной двигательной активности (табл. 6). Таблица 6. Влияние Suc-Ala-Prd-CN (3 мг/кг, однократно, внутрибрюшинно) на неврологические показатели (продолжительность комы и латентный период начала активных двигательных движений после комы) и выраженность судорожного синдрома после проведения максимального электрошока- Р 0,05 достоверность различий относительно контроля по критерию МаннаУитни.Suc-Ala-Prd-CN в дозе 3 мг/кг несколько уменьшал процент гибели животных после максимального электрошока: в контроле - гибель у 20% крыс; после Suc-Ala-Prd-CN - гибель 0% крыс. Suc-Ala-Prd-CN не влиял на интенсивность и продолжительность судорог, вызванных максимальным электрошоком, как тонической, так и клонической фаз (табл. 6). При тестировании крыс после введения Suc-Ala-Prd-CN на вращающемся стержне (Rota Rod) с постоянной скоростью вращения 15 об/мин изменения поведения по сравнению с контролем выявлено не было: в группе контроля время удержания на барабане составило 83,0+29,12 с, а в опытной группе 106,5+26,32 с. Ориентировочно-исследовательская и двигательная активности в Открытом поле у крыс, которым однократно вводили Suc-Ala-Prd-CN в дозе 3 мг/кг (внб), не отличались от параметров, регистрируемых в группе контроля (табл. 7). Таблица 7. Влияние Suc-Ala-Prd-CN (3 мг/кг, однократно, внутрибрюшинно) на двигательную активность крыс в открытом поле до и после проведения максимального электрошока (МЭШ)- Р 0,05 достоверность различий по парному критерию Стьюдента относительно параметров, полученных до предъявления МЭШ. Через 3 ч после максимального электрошока (МЭШ) животные, получавшие Ala-Prd-CN HCl, демонстрировали снижение числа пересечений квадратов, вертикальных стоек и заглядываний в отверстия(норковый рефлекс) по сравнению с фоновыми показателями, полученными при первом тестировании в Открытом поле. Учитывая положительный эффект Ala-Prd-CN HCl на обучение и амнезию УРПИ, вызванную МЭШ, снижение ориентировочно-исследовательского поведения при повторном тестировании в условиях методики Открытое поле возможно интерпретировать как габитуацию (привыкание), которая наблюдается для веществ, обладающих ноотропным действием. 2. Влияние Suc-Ala-Prd-CN (3 мг/кг, однократно, внутрибрюшинно) на обучение УРПИ и амнезию УРПИ, вызванную максимальным электросудорожным припадком. Контрольные и опытные (после введения Suc-Ala-Prd-CN) животные при помещении их на освещенную платформу с коротким латентным периодом заходят в темную камеру и получают там болевое раздражение через электродный пол (обучение). При воспроизведении рефлекса через 48 ч после обучения контрольные и опытные крысы помнят обученное и при помещении их на освещенную платформу животные остаются там основное время эксперимента и мало заходят в темную опасную камеру, где они накануне получили болевое раздражение (обучение). Установлено, что крысы, получившие Suc-Ala-Prd-CN, лучше обучаются и помнят о полученном болевом раздражении, чем контрольные животные, что выражается в более высоком показателе латентного времени выполнения УРПИ при воспроизведении (различия с контролем статистически недостоверны и в статистически достоверном (Р 0,05) увеличении по сравнению с контролем числа животных,совсем не зашедших в темный опасный отсек (табл. 8). После проведения максимального электрошока у контрольных животных наблюдается выраженная амнезия, которая выражается в статистически достоверном увеличении (Р 0,05) длительности латентного периода захода в темную опасную камеру, при воспроизведении УРПИ и достоверном (Р 0,05) уменьшении числа животных, совсем не зашедших в темный опасный отсек камеры при воспроизведении, т.е. помнящих о нанесенном там накануне болевом раздражении (табл. 8). Suc-Ala-Prd-CN в дозе 3 мг/кг статистически достоверно (Р 0,05) увеличивает (в 1,4 раза) длительность латентного периода захода в темную опасную камеру при воспроизведении УРПИ и уменьшает (в 1,8 раза) число животных без амнезии, совсем не зашедших в темный отсек камеры при воспроизведении (табл. 8). Таблица 8. Влияние Suc-Ala-Prd-CN (3 мг/кг, внутрибрюшинно) на обучение условного рефлекса пассивного избегания (УРПИ) и амнезию УРПИ, вызванную максимальным электросудорожным припадком (МЭШ)- Р 0,05 достоверность различий по критерию Манна-Уитни относительно показателя до МЭШ.- Р 0,05 достоверность различий по критерию Манна-Уитни относительно контроля.- Р 0,05 достоверность различий по критерию х 2 относительно показателя до МЭШ.- Р 0,05 достоверность различий по критерию х 2 относительно контроля. ЛВ 1 - латентное время при обучении. ЛВ 2 - латентное время при воспроизведении УРПИ. ЛП 3 - латентное время при амнезии УРПИ. Полученные данные свидетельствуют о том, что Suc-Ala-Prd-CN обладает выраженной нейропротекторной активностью, что выражается в его способности уменьшать неврологические дефициты, вызванные максимальным электрошоком, а именно в достоверном уменьшении (в 1,8 раз) продолжительности комы и времени (в 6 раз) с момента выхода из комы до появления спонтанной двигательной активности, а также в способности вещества улучшать обучение животных и уменьшать амнезию рефлекса при нейродегенерации мозга, вызванной максимальным электрошоком. Пример 5. Изучение противогипоксического действия Suc-Ala-Prd-CN, Ala-Prd-CN. Исследование противогипоксической активности было проведено согласно Методическим рекомендациям по экспериментальному изучению препаратов, предлагаемых для клинического изучения в качестве антигипоксических средств (составители Лукьянова Л.Д., Гацура В.В., Пастушенков Л.В., Урюпов О.Ю., Лесновская Е.В., М., МЗ СССР, Фармкологический Комитет, 1990) по двум методикам: нормобарической гипоксии с гиперкапнией в гермообъеме и гипобарической гипоксии в проточновытяжной барокамере. Исследование выполнено на белых беспородных половозрелых мышах самцах массой 23-28 г. Согласно методике нормобарической гипоксии с гиперкапнией (баночная гипоксия) мышей одинакового веса (разброс не более 2-х г на группу) помещали по одному животному в герметически закрываемые банки объемом 230 см 3. Регистрировали время выживания (резервное время) животных в условиях гипоксии. Гипобарическую гипоксию создавали в проточно-вытяжной барокамере с поглотителем CO2. Мышей поднимали на высоту 11000 м (198,7-185 мм рт.ст.) со скоростью 25-50 м/с. В барокамеру одновременно помещали 2 мыши - одна из которых являлась контрольной, а другая - опытной с введенным веществом. Регистрировали время выживания (резервное время) животных в условиях гипоксии. Вещества вводили однократно внутрибрюшинно за 10 мин до помещения животного в банку. Животным контрольной группы вводили дистиллированную воду. Контрольные животные, помещенные в условия нормобарической гипоксии с гиперкапнией, погибают в среднем в течение 33-х мин (табл. 9). Таблица 9. Противогипоксическое действие веществ в условиях нормобарической гипоксии- Р 0,05 достоверность различий по критерию Манна-Уитни по сравнению с группой контроля. Установлено, что Ala-Prd-CN в дозе 1 мг/кг и Suc-Ala-Prd-CN в дозе 2 мг/кг обладают выраженным противогипоксическим действием в условиях нормобарической гипоксии с гиперкапнией в гермообъеме,что выражалось в статистически достоверном увеличении времени выживания при гипоксии (табл. 9).Ala-Prd-CN в дозе 1 мг/кг и Suc-Ala-Prd-CN в дозе 2 мг/кг в дозе 1 мг/кг обладают выраженным противогипоксическим действием в условиях гипобарической гипоксии, что выражалось в статистически достоверном увеличении времени выживания при гипобарической гипоксии (табл. 10). Таблица 10. Противогипоксическое действие веществ в условиях гипобарической гипоксии- Р 0,05 достоверность различий по критерию Манна-Уитни по сравнению с группой контроля. Таким образом, соединения Ala-Prd-CN, Suc-Ala-Prd-CN и Gln-Prd-CN обладают прротивогипоксическим эффектом в условиях нормобарической гипоксии с гиперкапнией в гермообъеме и гипобарической гипоксии. Пример 6. Изучение побочных эффектов и острой токсичности соединения Suc-Ala-Prd-CN. Изучение побочных эффектов и острой токсичности Suc-Ala-Prd-CN проведено согласно Методическим указаниям по изучению острой токсичности, изложенным в Руководстве по экспериментальному (доклиническому) изучению новых фармакологических веществ (Федеральная служба по надзору в сфере здравоохранения и социального развития, Федеральное государственное учреждение научный центр экспертизы средств медицинского применения, изд. Медицина, ред. Хабриев Р.У., М., 2005, 832 с.). Для изучения возможных побочных эффектов и острой токсичности Suc-Ala-Prd-CN вводили мышам однократно внутрибрюшинно в дозах 30 и 60 мг/кг, т.е. в дозах, превышающих терапевтическую дозу (2 и 3 мг/кг) соответственно в 10-15 раз и в 20-30 раз. Наблюдение за животными осуществляли в течение 14 дней. Контрольным животным однократно, внутрибрюшинно, в том же объеме вводили дистиллированную воду. Установлено, что у животных после введения Suc-Ala-Prd-CN не отмечалось изменения слизистых и состояния шерстяного покрова; количество уринаций и дефекаций оставалось в норме; не выявлено птоза, саливации, пилоэрекции, анормального отряхивания, чихания, потягивания, сокращения жевательных мышц; эмоциональный статус, груминг, локомоция оставались на уровне нормы; не отмечалось агрессии, не наблюдалось пассивного поведения, активации и стереотипии; не отмечалось изменений реакции на звук или прикосновение, не изменилось ориентировочно-исследовательское поведение, болевой, пинеальный и роговичный рефлексы, сохранился тонус мышц; отсутствовали парезы, судороги, подергивания (табл. 11). Под влиянием соединения Suc-Ala-Prd-CN не наблюдается нарушения координации движений в тесте вращающегося стержня (Rota Rod Ugo Basile, Италия), не нарушается способность животных удерживаться на перевернутой сетчатой платформе и на рефлекс перелезания на верх сетчатой платформы. Гибели животных не наблюдалось ни через 24 ч после введения Suc-Ala-Prd-CN, ни в течение всего 14 дневного периода наблюдения (табл. 11). Таблица 11. Изучение побочных эффектов и острой токсичности Suc-Ala-Prd-CN у мышей при наблюдении в течение 14-ти суток Таким образом, при изучении возможных побочных эффектов и острой токсичности Suc-Ala-PrdCN установлено, что после однократного внутрибрюшинного введения Suc-Ala-Prd-CN в дозах 30 и 60 мг/кг (т.е. в дозах, превышающих терапевтическую дозу в 10-30 раз) не выявлены отклонения от нормы в общем состоянии животных, в их поведении, в реакциях на раздражители, в выполнении элементарных рефлексов, локомоторных реакций, в эмоциональном статусе, в неврологическом статусе и не наблюдается признаков интоксикации и гибели животных ни через 24 ч после введения Suc-Ala-Prd-CN, ни в течение 14-дневного периода регистрации. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы 2. Применение соединения по п.1 в качестве ингибитора пролилэндопептидазы и дипептидилпептидазы-IV. 3. Применение соединения п.1 в качестве средства для лечения сахарного диабета второго типа. 4. Применение соединения по п.1 в качестве средства для лечения заболеваний, сопровождающихся гипоксией, нейродегенерацией и нарушением когнитивных функций. 5. Лекарственная форма, содержащая в качестве действующего вещества соединение по п.1 для лечения сахарного диабета второго типа или лечения заболеваний, сопровождающихся гипоксией, нейродегенерацией и нарушением когнитивных функций.
МПК / Метки
МПК: A61K 31/401, C07D 207/16, A61P 3/10, A61P 25/00
Метки: аминоацил-2-цианопирролидина, когнитивные, улучшающим, функции, дипептидилпептидазы-iv, производные, nα-ацильные, нейропротекторным, гипогликемическим, действием, противогипоксическим, обладающие, ингибиторы, пролилэндопептидазы
Код ссылки
<a href="https://eas.patents.su/17-21236-nalpha-acilnye-proizvodnye-aminoacil-2-cianopirrolidina-ingibitory-prolilendopeptidazy-i-dipeptidilpeptidazy-iv-obladayushhie-gipoglikemicheskim-protivogipoksicheskim-nejjroprotekt.html" rel="bookmark" title="База патентов Евразийского Союза">Nα-ацильные производные аминоацил-2-цианопирролидина – ингибиторы пролилэндопептидазы и дипептидилпептидазы-iv, обладающие гипогликемическим, противогипоксическим, нейропротекторным и улучшающим когнитивные функции действием</a>
Предыдущий патент: Гербицидная композиция
Следующий патент: Производные бензамида и их применение в качестве ингибиторов hsp90
Случайный патент: Способ получения обогащенного экстракта из листьев растения vitis vinifera l.