Пиридилсодержащие ингибиторы передачи сигнала через белок hedgehog
Номер патента: 20192
Опубликовано: 30.09.2014
Авторы: Лалонд Ребекка Л., Рейнолдс Марк И., Ван Шумэй, Стэнли Марк С., Сатерлин Даниэл П., Сэвидж Скотт Дж., Кастанедо Джорджетт, Бао Лян, Гунцнер Джанет Л., Дайна Майкл С., Малески Кимберли
Формула / Реферат
1. Соединение формулы
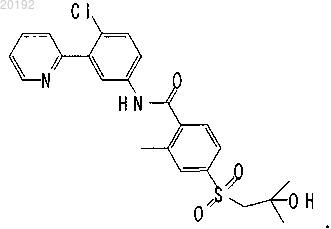
2. Композиция, содержащая соединение по п.1 и фармацевтически приемлемый носитель.
3. Способ лечения ракового заболевания у млекопитающего, включающий введение указанному млекопитающему эффективного количества соединения по п.1.
4. Способ по п.3, отличающийся тем, что указанное раковое заболевание связано с нарушенной передачей сигнала с участием белка Hedgehog.
5. Способ по п.3, отличающийся тем, что указанное раковое заболевание представляет собой базально-клеточную карциному, медуллобластому, аденокарциному поджелудочной железы, мелкоклеточную карциному легкого, карциному молочной железы, рабдомиосаркому, рак пищевода, рак желудка или рак желчных путей.
6. Способ по п.3, отличающийся тем, что указанное раковое заболевание представляет собой нейроэктодермальную опухоль, такую как менингиома, гемангиома, глиобластома, сквамозноклеточную карциному легкого, немелкоклеточную карциному легкого, хондросаркому, карциному почки или карциному щитовидной железы.
7. Способ по п.3, отличающийся тем, что указанное раковое заболевание представляет собой солидную опухоль, такую как солидная опухоль толстого кишечника, легкого, поджелудочной железы, яичника, молочной железы или глиома.
8. Способ подавления ангиогенеза у млекопитающего, включающий введение указанному млекопитающему эффективного количества соединения по п.1.
9. Способ ингибирования пути передачи сигнала с участием белка Hedgehog в клетке, включающий приведение указанной клетки в контакт с эффективным количеством соединения по п.1.
10. Способ лечения дегенерации желтого пятна, такой как "мокрая" возрастная дегенерация желтого пятна, воспалительных/иммунных заболеваний, таких как болезнь Крона, воспалительное заболевание кишечника, синдром Шегрена, астма, отторжение трансплантата органа, системная красная волчанка, ревматоидный артрит, псориатический артрит, псориаз или рассеянный склероз, или осуществления депиляции, включающий введение соединения по п.1.
Текст
ПИРИДИЛСОДЕРЖАЩИЕ ИНГИБИТОРЫ ПЕРЕДАЧИ СИГНАЛА ЧЕРЕЗ БЕЛОК Согласно изобретению предложен новый ингибитор передачи сигнала с участием белка hedgehog,который можно применять в качестве терапевтического агента для лечения злокачественных новообразований, причем указанное соединение имеет следующую формулу: Область техники Настоящее изобретение относится к органическому соединению, которое можно применять для терапии и/или профилактики у млекопитающих, в частности к пиридилсодержащему соединению, которое ингибирует путь передачи сигнала через белок Hedgehog и пригодно при лечении гиперпролиферативных заболеваний и заболеваний, опосредуемых ангиогенезом. Уровень техники Белок Hedgehog (Hh) был впервые обнаружен у Drosophila melanogaster как ген, определяющий полярность сегментов, который участвует в морфогенезе эмбриона (Nusslein-Volhard et al., Roux. Arch. Dev.Biol. 193: 267-282 (1984. Позже были идентифицированы три ортолога белка Hedgehog дрозофилы(Sonic, Desert и Indian), которые встречаются у всех позвоночных, включая рыб, птиц и млекопитающих. Белок Desert Hedgehog (DHh) экспрессируется в основном в яичках как у эмбрионов мышей в процессе развития, так и у взрослых грызунов и людей; белок Indian Hedgehog (IHh) участвует в развитии костей в ходе эмбриогенеза и в образовании костей у взрослых; белок Sonic Hedgehog (SHh) экспрессируется на высоких уровнях в хорде и вентральной пластинке развивающихся эмбрионов позвоночных. В тестах с эксплантатами in vitro, a также в исследованиях эктопической экспрессии SHh в трансгенных мышах показано, что SHh играет ключевую роль в морфогенезе нервной трубки (Echelard et al., выше; Ericson et al.,Cell 81: 747-56 (1995); Marti et al., Nature 375: 322-5 (1995); Krauss et al., Cell 75, 1432-44 (1993); Riddle etal., Cell 75: 1401-16 (1993); Roelink et al., Cell 81: 445-55 (1995); Hynes et al., Neuron 19: 15-26 (1997. Hh также играет роль в развитии суставов (Krauss et al., Cell 75: 1431-44 (1993); Laufer et al., Cell 79, 9931003 (1994, сомитов (Fan and Tessier-Lavigne, Cell 79, 1175-86 (1994); Johnson et al., Cell 79: 1165-73SHh человека синтезируется в форме белка-предшественника с молекулярной массой 45 кДа, из которого после автокаталитического расщепления образуется N-концевой фрагмент с молекулярной массой 20 кДа, который отвечает за нормальную сигнальную активность белка Hedgehog, и С-концевой фрагмент с молекулярной массой 25 кДа, который отвечает за аутопроцессинг, в ходе которого Nконцевой фрагмент присоединяется к молекуле холестерола (Lee, J.J., et al. (1994) Science 266, 1528-1536;Bumcrot, D.A., et al. (1995), Mol. Cell Biol. 15, 2294-2303; Porter, J.A., et al. (1995) Nature 374, 363-366). Nконцевой фрагмент состоит их остатков аминокислот 24-197 последовательности полноразмерного предшественника, которые остаются связанными с мембраной С-концом через холестерин (Porter, J.A., etal. (1996) Science 274, 255-258; Porter, J.A., et al. (1995) Cell 86, 21-34). Конъюгация с холестерином отвечает за локализацию в тканях сигнального белка Hedgehog. Считают, что на поверхности клетки сигнал Hh передают белок Patched, состоящий из 12 трансмембранных доменов (Ptc) (Hooper and Scott, Cell 59: 751-65 (1989); Nakano et al., Nature 341: 508-13den Heuvel and Ingham, Nature 382: 547-551 (1996. Существуют генетические и биохимические свидетельства в поддержку рецепторной модели, в которой Ptc и Smo представляют собой часть многокомпонентного рецепторного комплекса (Chen and Struhl, Cell 87: 553-63 (1996); Marigo et al., Nature 384: 176-9(1996); Stone et al., Nature 384: 129-34 (1996. После связывания Hh с Ptc снимается обычное ингибирующее воздействие Ptc на Smo, в результате чего Smo передает сигнал на Hh через плазматическую мембрану. Однако точный механизм, по которому Ptc контролирует активность Smo, еще предстоит выяснить. Сигнальный каскад, инициируемый Smo, приводит к активации факторов транскрипции Gli, которые перемещаются в ядро, где контролируют транскрипцию целевых генов. Было показано, что Gli оказывают влияние на транскрипцию ингибиторов пути Hh, таких как Ptc и Hipl по механизму отрицательной обратной связи, что указывает на то, что жесткий контроль активности пути Hh необходим для правильной дифференцировки клеток и формирования органов. Неконтролируемая активация пути передачи сигнала Hh связана со злокачественными новообразованиями, в частности с новообразованиями в мозге,коже и мышцах, а также с ангиогенезом. Это объясняется тем, что путь Hh, как было показано, регулирует пролиферацию клеток у взрослых путем активации генов, участвующих в протекании клеточного цикла, таких как циклин D, который участвует в переносе G1-S. Также SHh блокирует остановку клеточного цикла, опосредуемую р 21, ингибитором циклинзависимых киназ. Кроме того полагают, что передача сигнала через Hh участвует в развитии рака путем стимуляции компонентов пути EGFR (рецепторов эпидермального фактора роста, EGF, Her2), который вовлечен в пролиферацию, а также компонентов путей PDGF (тромбоцитарного фактора роста, PDGF) и VEGF (фактора роста эндотелия сосудов), участвующих в ангиогенезе. Потеря функции или мутации в гене Ptc были выявлены у пациентов с синдромом базально-клеточного невуса (BCNS), наследственного заболевания, характеризующегося множественными карциномами базальных клеток (ВСС). Дисфункциональные мутации гена Ptc также связывают с большой долей спорадических базально-клеточных карцином (Chidambaram et al., Cancer Research 56: 4599-601 (1996); Gailani et al., Nature Genet. 14: 78-81 (1996); Hahn et al., Cell 85: 841-51 (1996); Johnson etal., Science 272: 1668-71 (1996); Unden et al., Cancer Res. 56: 4562-5; Wicking et al., Am. J. Hum. Genet. 60: 21-6 (1997. Считают, что потеря функции Ptc вызывает неконтролируемую передачу сигнала Smo при базально-клеточной карциноме. Активирующие мутации Smo также были выявлены в спорадических опухолях ВСС (Xie et al., Nature 391: 90-2 (1998, что подчеркивает роль Smo как сигнальной субъединицы в рецепторном комплексе SHh. Были исследованы различные ингибиторы передачи сигнала Hedgehog, такие как циклопамин, природный алкалоид, который, как было показано, блокирует клеточный цикл на стадии G0-G1 и вызывает апоптоз при SCLC. Считается, что циклопамин ингибирует Smo, связываясь с его семиспиральной структурой. Было показано, что форсколин ингибирует путь Hh ниже Smo путем активации протеинкиназы А(PKA), которая поддерживает факторы транскрипции Gli в неактивном состоянии. Несмотря на успехи указанных и других соединений, остается потребность в эффективных ингибиторах сигнального путиHedgehog. Краткое описание изобретения Согласно одному аспекту настоящего изобретения предложен новый ингибитор белка Hedgehog,имеющий формулу Согласно другому аспекту настоящего изобретения предложена композиция, содержащая соединение вышеуказанной формулы и носитель, разбавитель или наполнитель. Согласно другому аспекту настоящего изобретения предложен способ лечения ракового заболевания, включающий введение эффективного количества соединения вышеуказанной формулы нуждающемуся в этом млекопитающему. Согласно другому аспекту настоящего изобретения предложен способ ингибирования пути передачи сигнала через белок Hedgehog в клетке, включающий приведение указанной клетки в контакт с соединением вышеуказанной формулы. Согласно другому аспекту настоящего изобретения предложен способ лечения заболевания или состояния, связанного с передачей сигнала через белок Hedgehog, у млекопитающего, включающий введение указанному млекопитающему эффективного количества соединения вышеуказанной формулы. Подробное описание предпочтительных вариантов реализации"Ацил" означает карбонил, содержащий заместитель, представленный формулой -C(O)-R, где R представляет собой Н, алкил, карбоцикл, гетероцикл, содержащий в качестве заместителя карбоцикл алкил или содержащий в качестве заместителя гетероцикл алкил, где алкил, алкокси, карбоцикл и гетероцикл определены в настоящем описании. Ацил включает алканоил (например, ацетил), ароил (например,бензоил) и гетероароил."Алкил" означает разветвлнную или неразветвлнную, насыщенную или ненасыщенную (например, алкенил, алкинил) алифатическую углеводную группу, содержащую до 12 атомов углерода, если не указано другое. Когда используется в составе другого термина, например "алкиламино", алкил предпочтительно представляет собой насыщенную углеводную цепь, однако также включает ненасыщенные углеводные цепи, такие как "алкениламино" и "алкиниламино". "Алкилфосфинат" означает группу-Р(О)R-алкила, в которой R представляет собой Н, алкил, карбоцикл-алкил или гетероцикл-алкил. Примеры предпочтительных алкилов включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, вторбутил, трет-бутил, н-пентил, 2-метилбутил, 2,2-диметилпропил, н-гексил, 2-метилпентил, 2,2 диметилбутил, н-гептил, 3-гептил, 2-метилгексил и им подобные. Термины "низший алкил", "С 1-С 4 алкил" и "алкил, содержащий от 1 до 4 атомов углерода" являются синонимами и используются взаимозаменяемо для обозначения метила, этила, 1-пропила, изопропила, циклопропила, 1-бутила, втор-бутила или трет-бутила. Если не указано другое, замещнный алкил может содержать один (предпочтительно),два, три или четыре заместителя, которые могут быть одинаковыми или различными. Примеры упомянутых замещнных алкилов включают перечисленные, но не ограничиваются ими: цианометил, нитрометил, гидроксиметил, тритилоксиметил, пропионилоксиметил, аминометил, карбоксиметил, карбоксиэтил,карбоксипропил, алкилоксикарбонилметил, аллилоксикарбониламинометил, карбамоил-оксиметил, метоксиметил, этоксиметил, трет-бутоксиметил, ацетоксиметил, хлорметил, бромметил, иодметил, трифторметил, 6-гидроксигексил, 2,4-дихлор-(н-бутил), 2-амино-(изопропил), 2-карбамоилоксиэтил и им подобные. Алкил может содержать в качестве заместителя карбоцикл. Примеры включают циклопропилметил, циклобутилметил, циклопентилметил и циклогексилметил так же, как и соответствующие-этил, -пропил, -бутил, -пентил, -гексил и т.д. Предпочтительные замещнные алкилы содержат в качестве заместителей метильные группы, например метил, содержащий в качестве заместителя те же заместители, что и "замещнный Cn-Cm-алкил". Примеры замещнных метильных групп включают такие группы,-2 020192"Амидин" или "амидино" означают группу -C(NH)-NRR, где каждый R представляет собой независимо Н, ОН, алкил, алкокси, карбоцикл, гетероцикл, содержащий в качестве заместителя карбоцикл алкил или содержащий в качестве заместителя гетероцикл алкил; или обе группы R вместе образуют гетероцикл. Предпочтительный амидин представляет собой группу -C(NH)-NH2."Амино" означает первичные (например, -NH2), вторичные (например, -NRH) и третичные (например, -NRR) амины, где R независимо представляет собой алкил, карбоцикл (например, арил), гетероцикл(например, гетероарил), содержащий в качестве заместителя карбоцикл алкил (например, бензил) или содержащий в качестве заместителя гетероцикл алкил или, альтернативно, две группы R вместе с атомом азота, с которым они составляют гетероцикл. В частности, вторичные и третичные амины представляют собой алкиламин, диалкиламин, ариламин, диариламин, аралкиламин и диаралкиламин. В частности,вторичные и третичные амины представляют собой метиламин, этиламин, пропиламин, изопропиламин,фениламин, бензиламин диметиламин, диэтиламин, дипропиламин и диизопропиламин. Термин "защитная группа для амина" в данном описании относится к производным групп, используемых в общей практике для блокирования или защиты аминогруппы, пока реакция проводится над другой функциональной группой соединения. Примеры таких защитных групп включают карбаматы,амиды, алкильные и арильные группы, имины, а также многие производные N-гетероатомов, которые можно удалить, чтобы получить желаемую группу амина. Примеры защитных групп для амина представляют собой Boc, Fmoc и Cbz. Больше примеров этих групп можно найти в Т.W. Greene и P.G.M.Wuts, "Protective Groups in Organic Synthesis", 2nd ed., John WileySons, Inc., New York, NY, 1991, chapter 7; E. Haslam, "Protective Groups in Organic Chemistry", J.G.W. McOmie, Ed., Plenum Press, New York, NY,1973, Chapter 5 и Т.W. Greene, "Protective Groups in Organic Synthesis", John Wiley и Sons, New York, NY,1981. Термин "защищенная аминогруппа" означает аминогруппу, имеющую в качестве заместителя одну из описанных выше защитных групп для аминов. Термин "арил", используемый отдельно или в составе другого термина, означает карбоциклическую ароматическую группу, конденсированную или неконденсированную, имеющую заданное количество атомов углерода, или, если это число не задано, содержащую до 14 атомов углерода. Арилы включают фенил, нафтил, бифенил, фенантренил, нафтаценил и им подобные (см., например, Lang's Handbook ofChemistry (Dean, J.A., ed) 13th ed. Table 7-2 [1985]). В конкретном варианте реализации арил может представлять собой фенил. Замещнный фенил или замещнный арил означает группу фенила или группу арила, имеющую в качестве заместителя один, два, три, четыре или пять, например 1-2, 1-3 или 1-4, заместителей, выбранных, если не указано другое, из нижеперечисленных: галоген (F, Cl, Br, I), гидрокси,защищенная гидроксигруппа, циано, нитро, алкил (например, C1-C6-алкил), алкокси (например, C1-C6 алкокси), бензилокси, карбокси, защищенная карбоксигруппа, карбоксиметил, защищенный карбоксиметил, гидроксиметил, защищенный гидроксиметил, аминоэтил, защищенный аминоэтил, трифторметил,алкилсульфониламино, арилсульфониламино, гетероциклилсульфониламино, гетероциклил, арил или другие указанные группы. Одна или более метановых (СН) и/или метиленовых (СН 2) групп в этих заместителях могут быть, в свою очередь, замещены группой, схожей с указанными выше. Примеры термина"замещнный фенил" включают перечисленные далее, не ограничиваясь ими: моно- или ди(гало)фенил,такой как 2-хлорфенил, 2-бромфенил, 4-хлорфенил, 2,6-дихлорфенил, 2,5-дихлорфенил, 3,4 дихлорфенил, 3-хлорфенил, 3-бромфенил, 4-бромфенил, 3,4-дибромфенил, 3-хлор-4-фторфенил, 2 фторфенил и им подобные; моно- или ди(гидрокси)фенил, такой как 4-гидроксифенил, 3-гидроксифенил,2,4-дигидроксифенил, их защищнные гидроксипроизводные и им подобные; нитрофенил, такой как 3 или 4-нитрофенил; цианофенил, например 4-цианофенил; моно- или ди(низший алкил)фенил, такой как 4-метилфенил, 2,4-диметилфенил, 2-метилфенил, 4-(изопропил)фенил, 4-этилфенил, 3-(н-пропил)фенил и им подобные; моно- или ди(алкокси)фенил, например 3,4-диметоксифенил, 3-метокси-4 бензилоксифенил, 3-метокси-4-(1-хлорметил)бензилоксифенил, 3-этоксифенил, 4-(изопропокси)фенил,4-(трет-бутокси)фенил, 3-этокси-4-метоксифенил и им подобные; 3- или 4-трифторметилфенил; моноили дикарбоксифенил или (защищенный карбокси)фенил, такой как 4-карбоксифенил; моно- или ди(гидроксиметил)фенил или (защищенный гидроксиметил)фенил, такой как 3-(защищнный гидроксиметил)фенил или 3,4-ди(гидроксиметил)фенил; моно- или ди(аминоэтил)фенил или (защищенный аминоэтил)фенил, такой как 2-(аминоэтил)фенил или 2,4-(защищнный аминоэтил)фенил; или моно- или ди(N(метилсульфониламинофенил, такой как 3-(N-метилсульфониламино)фенил. Также термин "замещнный фенил" означает двухзамещнный фенил, в котором заместители различны, например 3-метил-4 гидроксифенил, 3-хлор-4-гидроксифенил, 2-метокси-4-бромфенил, 4-этил-2-гидроксифенил, 3-гидрокси 4-нитро-фенил, 2-гидрокси-4-хлорфенил и им подобные, а также трехзамещнный фенил, в котором заместители различны, например 3-метокси-4-бензилокси-6-метилсульфониламино, 3-метокси-4 бензилокси-6-фенилсульфониламино и четырхзамещнный фенил, в котором заместители различны,например 3-метокси-4-бензилокси-5-метил-6-фенилсульфониламино. Замещнные фенилы включают 2 хлорфенил, 2-аминофенил, 2-бромфенил, 3-метоксифенил, 3-этоксифенил, 4-бензилоксифенил, 4 метоксифенил, 3-этокси-4-бензилоксифенил, 3,4-диэтоксифенил, 3-метокси-4-бензилоксифенил, 3-3 020192 метокси-4-(1-хлорометил)бензилоксифенил,3-метокси-4-(1-хлорметил)бензилокси-6-метилсульфониламинофенил. Конденсированные арильные кольца могут также содержать в качестве заместителя любой (например, 1, 2 или 3) из заместителей, указанных в данном описании точно так же, как и замещнный алкил.-C(O)N(R)2, в которой R представляет собой Н, гидроксил, алкокси, алкил, карбоцикл, гетероцикл, содержащий в качестве заместителя карбоцикл алкил или алкокси или содержащий в качестве заместителя гетероцикл алкил или алкокси, где алкил, алкокси, карбоцикл и гетероцикл такие, как определено в данном описании. Карбамоил включает алкиламиноекарбонил (например, этиламинокарбонил, Et-NH-CO-),ариламинокарбонил (например, фениламинокарбонил), аралкиламинокарбонил (например, бензоиламинокарбонил), гетероцикламинокарбонил (например, пиперизиниламинокарбонил) и, в частности, гетероариламинокарбонил (например, пиридиламинокарбонил). Термины "карбоциклил", "карбоциклический", "карбоцикл" и "карбоцикло", использованные отдельно или в составе сложной группы, такой как карбоциклоалкил, относятся к моно-, би- или трициклическому алифатическому кольцу, имеющему от 3 до 14 атомов углерода и предпочтительно от 3 до 7 атомов углерода, которые могут быть насыщенными или ненасыщенными, ароматическими или не ароматическими. Предпочтительные насыщенные карбоциклические группы включают циклопропил, циклобутил, циклопентил и циклогексил, а более предпочтительными являются циклопропил и циклогексил и наиболее предпочтительным является циклогексил. Предпочтительные ненасыщенные карбоциклы являются ароматическими, например арилы, описанные выше; самым предпочтительным является фенил. Термины "замещнный карбоциклил", "замещнный карбоцикл" и "замещнный карбоцикло", если не указано другое, означают такие группы, содержащие в качестве заместителя те же заместители, которые содержит "замещнный алкил". Термин "карбоксизащитная группа" в данном описании относится к одному из эфирных производных группы карбоновой кислоты, используемых в общей практике для блокирования или защиты группы карбоновой кислоты, пока реакция проводится над другой функциональной группой соединения. Примеры таких защитных групп для карбоновой кислоты включают 4-нитробензил, 4-метоксибензил, 3,4 диметоксибензил, 2,4-диметоксибензил, 2,4,6-триметоксибензил, 2,4,6-триметилбензил, пентаметилбензил, 3,4-метилендиоксибензил, бензгидрил, 4,4'-диметоксибензгидрил, 2,2',4,4'-тетраметоксибензгидрил,алкил, такой как трет-бутил или трет-амил, тритил, 4-метокситритил, 4,4'-диметокситритил, 4,4',4"триметокситритил, 2-фенилпроп-2-ил, триметилсилил, трет-бутилдиметилсилил, фенацил, 2,2,2 трихлорэтил, бета-(триметилсилил)этил, бета-(ди(н-бутил)метилсилил)этил, п-толуолсульфонилэтил, 4 нитробензилсульфонилэтил, аллил, циннамил, 1-(триметилсилилметил)проп-1-ен-3-ил и подобные вещества. Конкретные виды используемых защитных групп для карбоновой кислоты не важны, поскольку дериватизированная карбоновая кислота стабильна по отношению к условиям последующей(их) реакции(й), проводимой(ых) над другими частями молекулы, и может быть удалена в нужный момент без разрушения оставшейся части молекулы. В частности, важно не подвергать карбоксизащищнную молекулу воздействию сильных нуклеофильных оснований, таких как лития гидроксид или NaOH, или восстановительной среды, содержащей высокоактивированные гидриды металлов, такие как LiAlH4. (Таких жестких условий удаления следует также избегать при описанном ниже удалении защитной группы для аминов и гидроксизащитных групп.) Предпочтительными группами защиты для карбоновой кислоты являются алкил (например, метил, этил, трет-бутил), аллил, бензил и п-нитробензил. Сходные карбоксизащитные группы, используемые при работе с цефалоспорином, пенициллином и пептидом, также подходят для защиты карбоксигруппы заместителя. Больше примеров этих групп можно найти в Т.W.Press, New York, N. Y., 1973, Chapter 5, и Т.W. Greene, "Protective Groups in Organic Synthesis", John Wiley и Sons, New York, NY, 1981, Chapter 5. Термин "защищенная карбоксигруппа" относится к карбоксигруппе, содержащей в качестве заместителя одну из описанных выше защитных групп для карбоновой кислоты."Гуанидин" означает группу вида -NH-C(NH)-NHR, где R представляет собой Н, алкил, карбоцикл,гетероцикл, содержащий в качестве заместителя карбоцикл алкил или содержащий в качестве заместителя гетероцикл алкил. В частности, гуанидином является -NH-C(NH)-NH2. Термины "гетероциклическая группа", "гетероциклический", "гетероцикл", "гетероциклил" или "гетероцикло", использованные отдельно или в составе сложной группы, такой как гетероциклоалкил, используются взаимозаменяемо для обозначения любого моно-, би- или трициклического, насыщенного или ненасыщенного, ароматического (гетероарил) или неароматического кольца, имеющего заданное количество атомов углерода, в общем случае от 5 до примерно 14 атомов в кольце, где атомы кольца представляют собой углерод и по крайней мере один гетероатом (азот, серу или кислород), и предпочтительно от 1 до 4 гетероатомов. "Гетероциклосульфонил" означает -SO2-гетероцикл; "гетероциклосульфинил" означает -SO-гетероцикл. Как правило, 5-членный цикл имеет от 0 до 2 двойных связей, а 6- или 7 членный цикл имеет от 0 до 3 двойных связей, а гетероатомы азота или серы могут необязательно быть оксидизированы (например, SO, SO2) и любой гетероатом азота может необязательно быть в четвертичной форме. Предпочтительные неароматические гетероциклы включают морфолинил (морфолино), пирролидинил, оксиранил, оксетанил, тетрагидрофуранил, 2,3-дигидрофуранил, 2 Н-пиранил, тетрагидропиранил, тииранил, тиэтанил, тетрагидротиэтанил, азиридинил, азетидинил, 1-метил-2-пирролил, пиперазинил и пиперидинил. "Гетероциклоалкил" представляет собой группу гетероцикла, такую, как описано выще, связанную ковалентной связью с алкилом, таким как описано выше. Предпочтительные 5-членные гетероциклы, содержащие атом серы или кислорода и от одного до трх атомов азота, включают тиазолил, в частности тиазол-2-ил и тиазол-2-ил N-оксид, тиадиазолил, в частности 1,3,4-тиадиазол-5-ил и 1,2,4-тиадиазол-5-ил, оксазолил, предпочтительно оксазол-2-ил, и оксадиазолил, такой как 1,3,4 оксадиазол-5-ил и 1,2,4-оксадиазол-5-ил. Предпочтительные 5-членные гетероциклы, содержащие от 2 до 4 атомов азота, включают имидазолил, предпочтительно имидазол-2-ил; триазолил, предпочтительно 1,3,4-триазол-5-ил; 1,2,3-триазол-5-ил, 1,2,4-триазол-5-ил и тетразолил, предпочтительно 1 Н-тетразол-5 ил. Предпочтительными бензоконденсированными 5-членными гетероциклами являются бензоксазол-2 ил, бензтиазол-2-ил и бензимидазол-2-ил. Предпочтительные 6-членные гетероциклы содержат от одного до трх атомов азота и необязательно атом серы или атом кислорода, например пиридил, такой как пирид-2-ил, пирид-3-ил и пирид-4-ил; пиримидил, предпочтительно пиримид-2-ил и пиримид-4-ил; триазинил, предпочтительно 1,3,4-триазин-2-ил и 1,3,5-триазин-4-ил; пиридазинил, в частности пиридазин-3 ил, и пиразинил. Пиридин N-оксиды и пиридазин N-оксиды и пиридил, пиримид-2-ил, пиримид-4-ил,пиридазинил и 1,3,4-триазин-2-ил являются предпочтительными группами. Информацию о заместителях для необязательно замещнных гетероциклов и другие примеры 5- и 6-членных циклических систем,описанных выше, можно найти в W. Druckheimer et al., U.S. Patent No. 4278793. Термин "гетероарил", использованный отдельно или в составе сложной группы, такой как гетероаралкил, относится к любой моно-, би- или трициклической ароматической системе циклов, имеющей заданное число атомов, причем по крайней мере один цикл представляет собой 5-, 6- или 7-членный цикл, содержащий от одного до четырх гетероатомов, выбранных из группы, содержащей азот, кислород и серу, и предпочтительно по крайней мере один из гетероатомов является азотом (Lang's Handbookof Chemistry, supra). В определение входят любые бициклические группы, в которых любой из описанных выше циклов гетероарила конденсирован до бензольного цикла. Гетероарилы, в которых гетероатомом является азот или кислород, являются предпочтительными. Следующие системы циклов являются примерами гетероарилов (и замещнных, и незамещнных), обозначенных термином "гетероарил": тиенил, фурил, имидазолил, пиразолил, тиазолил, изотиазолил, оксазолил, изоксазолил, триазолил, тиадиазолил, оксадиазолил, тетразолил, тиатриазолил, оксатриазолил, пиридил, пиримидил, пиразинил, пиридазинил, тиазинил, оксазинил, триазинил, тиадиазинил, оксадиазинил, дитиазинил, диоксазинил, оксатиазинил, тетразинил, тиатриазинил, оксатриазинил, дитиадиазинил, имидазолинил, дигидропиримидил,тетрагидро-пиримидил, тетразоло[1,5-b]пиридазинил и пуринил, а также бензоконденсированные производные, например бензоксазолил, бензофурил, бензотиазолил, бензотиадиазолил, бензотриазолил, бензоимидазолил и индолил. Особенно предпочтительные "гетероарилы" включают 1,3-тиазол-2-ил, 4(карбоксиметил)-5-метил-1,3-тиазол-2-ил, 4-(карбоксиметил)-5-метил-1,3-тиазол-2-ил натрия соль, 1,2,4 тиадиазол-5-ил, 3-метил-1,2,4-тиадиазол-5-ил, 1,3,4-триазол-5-ил, 2-метил-1,3,4-триазол-5-ил, 2 гидрокси-1,3,4-триазол-5-ил, 2-карбокси-4-метил-1,3,4-триазол-5-ил натрия соль, 2-карбокси-4-метил 1,3,4-триазол-5-ил,1,3-оксазол-2-ил,1,3,4-оксадиазол-5-ил,2-метил-1,3,4-оксадиазол-5-ил,2(гидроксиметил)-1,3,4-оксадиазол-5-ил, 1,2,4-оксадиазол-5-ил, 1,3,4-тиадиазол-5-ил, 2-тиол-1,3,4 тиадиазол-5-ил, 2-(метилтио)-1,3,4-тиадиазол-5-ил, 2-амино-1,3,4-тиадиазол-5-ил, 1 Н-тетразол-5-ил, 1 метил-1 Н-тетразол-5-ил,1-(1-(диметиламино)-эт-2-ил)-1 Н-тетразол-5-ил,1-(карбоксиметил)-1 Нтетразол-5-ил, 1-(карбоксиметил)-1 Н-тетразол-5-ил натрия соль, 1-(метилсульфонокислота)-1H-тетразол 5-ил, 1-(метилсульфонокислота)-1 Н-тетразол-5-ил натрия соль, 2-метил-1 Н-тетразол-5-ил, 1,2,3-триазол 5-ил, 1-метил-1,2,3-триазол-5-ил, 2-метил-1,2,3-триазол-5-ил, 4-метил-1,2,3-триазол-5-ил, пирид-2-ил Nоксид, 6-метокси-2-(н-оксид)пиридаз-3-ил, 6-гидроксипиридаз-3-ил, 1-метилпирид-2-ил, 1-метилпирид 4-ил,2-гидроксипиримид-4-ил,1,4,5,6-тетрагидро-5,6-диоксо-4-метил-ас-триазин-3-ил,1,4,5,6 тетрагидро-4-(формилметил)-5,6-диоксо-ас-триазин-3-ил, 2,5-дигидро-5-оксо-6-гидрокси-ас-триазин-3 ил, 2,5-дигидро-5-оксо-6-гидрокси-ас-триазин-3-ил натрия соль, 2,5-дигидро-5-оксо-6-гидрокси-2-метилас-триазин-3-ил натрия соль, 2,5-дигидро-5-оксо-6-гидрокси-2-метил-ас-триазин-3-ил, 2,5-дигидро-5 оксо-6-метокси-2-метил-ас-триазин-3-ил, 2,5-дигидро-5-оксо-ас-триазин-3-ил, 2,5-дигидро-5-оксо-2 метил-ас-триазин-3-ил, 2,5-дигидро-5-оксо-2,6-диметил-ас-триазин-3-ил, тетразоло[1,5-b]пиридазин-6-ил и 8-аминотетразоло[1,5-b]-пиридазин-6-ил. Альтернативные ло[1,5-b]пиридазин-6-ил и 8-аминотетразоло[1,5-b]пиридазин-6-ил. Термин "гидроксизащитная группа" используется здесь для производной гидроксигруппы, часто используемой для блокирования или защиты гидроксигруппы, пока реакция проводится над другой функциональной группой соединения. Примеры таких защитных групп включают тетрагидропиранилокси, бензоил, ацетокси, карбамоилокси, бензил и силилэфиры (например, TBS, TBDPS). Больше примеров этих групп можно найти в Т.W. Greene и P.G.M. Wuts, "Protective Groups in Organic Synthesis", 2nd ed.,John WileySons, Inc., New York, NY, 1991, chapters 2-3; E. Haslam, "Protective Groups in Organic Chemistry", J.G.W. McOmie, Ed., Plenum Press, New York, NY, 1973, Chapter 5, и Т.W. Greene, "Protective Groupsin Organic Synthesis", John Wiley и Sons, New York, NY, 1981. Термин "защищенная гидроксигруппа" относится к гидроксигруппе, содержащей в качестве заместителя одну из описанных выше гидроксизащитных групп."Фармацевтически приемлемые соли" включают как соли присоединения кислоты, так и соли присоединения основания. Термин "фармацевтически приемлемая соль присоединения кислоты" относится к тем солям, которые сохраняют биологическую эффективность и свойства свободных оснований и которые не являются нежелательными с биологической или другой точки зрения, образованные с неорганическими кислотами, такими как соляная кислота, бромисто-водородная кислота, серная кислота, азотная кислота, угольная кислота, фосфорная кислота и им подобные, и органические кислоты, которые могут быть выбраны из алифатических, циклоалифатических, ароматических, аралифатических, гетероциклических, карбоновой и сульфоновой органических кислот, таких как муравьиная кислота, уксусная кислота, пропионовая кислота, гликолевая кислота, глюконовая кислота, молочная кислота, пировиноградная кислота, щавелевая кислота, яблочная кислота, малеиновая кислота, малоновая кислота, янтарная кислота, фумаровая кислота, винная кислота, лимонная кислота, аспарагиновая кислота, аскорбиновая кислота,глутаминовая кислота, антраниловая кислота, бензойная кислота, коричная кислота, миндальная кислота,эмбоновая кислота, фенилуксусная кислота, метансульфонокислота, этансульфонокислота, птолуолсульфонокислота, салициловая кислота и им подобные."Фармацевтически приемлемые соли присоединения основания" включают соли, полученные из неорганических оснований, такие как соли натрия, калия, лития, аммония, кальция, магния, железа, цинка, меди, марганца, алюминия и им подобные. В особенности предпочтительными являются соли аммония, калия, натрия, кальция и магния. Соли, полученные из фармацевтически приемлемых органических нетоксичных оснований, включают соли первичных, вторичных и третичных аминов, замещнных аминов, в т.ч. природные замещнные амины, циклические амины и основные ионообменные смолы, такие как изопропиламин, триметиламин, диэтиламин, TEA, трипропиламин, этаноламин, 2 диэтиламиноэтанол, триметамин, дициклогексиламин, лизин, аргинин, гистидин, кофеин, прокаин, гидрабамин, холин, бетаин этилендиамин, глюкозаамин, метилглюкамин, теобромин, пурины, пиперизин,пиперидин, N-этил пиперидин, полиаминовые смолы и им подобные. В особенности предпочтительными органическими нетоксичными основаниями являются изопропиламин, диэтиламин, этаноламин, триметамин, дициклогексиламин, холин и кофеин. Термин "фосфинат" означает -P(O)R-OR, где каждый R независимо представляет собой Н, алкил,карбоцикл, гетероцикл, карбоциклоалкил или гетероциклоалкил. В частности, фосфинатом является алкилфосфинат (например, -Р(О)R-О-алкил), например -P(O)Me-OEt. Термин "сульфамоил" означает -SO2-N(R)2, где каждый R независимо представляет собой Н, алкил,карбоцикл, гетероцикл, карбоциклоалкил или гетероциклоалкил. В частности, сульфамоилом является алкилсульфамоил, например метилсульфамоил (-SO2-NHMe); арилсульфамоил, например фенилсульфамоил; аралкилсульфамоил, например бензилсульфамоил. Термин "сульфинил" означает -SO-R, где R представляет собой алкил, карбоцикл, гетероцикл, карбоциклоалкил или гетероциклоалкил. В частности, сульфинилами являются алкилсульфинил (например,-SO-алкил), например метилсульфинил; арилсульфинил (например, -SO-арил), например фенилсульфинил; аралкилсульфинил, например бензилсульфинил. Термин "сульфонамид" означает -NR-SO2-R, где каждый R независимо представляет собой Н, алкил, карбоцикл, гетероцикл, карбоциклоалкил или гетероциклоалкил, карбоцикл или гетероцикл. В частности, сульфонамидом является алкилсульфонамид (например, -NH-SO2-алкил), например метилсульфонамид; арилсульфонамид (например, -NH-SO2-арил), например фенилсульфонамид; аралкилсульфонамид, например бензилсульфонамид."Сульфонил" означает -SO2-R, где R представляет собой алкил, карбоцикл, гетероцикл, карбоциклоалкил или гетероциклоалкил. В частности, сульфонилом является алкилсульфонил (например, -SO2 алкил), например метилсульфонил; арилсульфонил, например фенилсульфонил; аралкилсульфонил, например бензилсульфонил. Фраза "и их соли и сольваты" в данном описании означает, что соединение согласно данному изобретению может существовать в форме одной или смеси солей и сольватов. Например, соединение согласно данному изобретению может представлять собой практически полностью одну определнную соль или сольват или представлять собой смесь двух или более солей и сольватов. Согласно настоящему изобретению предложено соединение, имеющее формулу Соединение согласно настоящему изобретению может содержать один или более асимметричных атомов углерода. Соответственно, такое соединение может существовать в форме диастереомеров, энантиомеров и их смесей. Синтез соединения может включать рацематы, диастереомеры и энантиомеры в качестве исходных соединений. Диастереомерные соединения могут быть разделены методами хроматографии или кристаллизации. Аналогично, смеси энантиомеров могут быть разделены при помощи тех же или других известных в данной области методик. Каждый асимметричный атом углерода может иметь конфигурацию R или S, причем каждая из указанных конфигураций включена в объем настоящего изобретения. Настоящее изобретение также охватывает пролекарства соединения, описанного выше. Пригодные пролекарства включают известные аминозащищенные и карбоксизащищенные группы, которые отделяются в физиологических условиях, например, путем механизма гидролиза с получением исходных соединений. Одним из примеров классов пролекарств являются соединения, в которых атом азота в амино-,амидино-, аминоалкиленамино-, иминоалкиленамино- или гуанидино-группе замещен гидроксигруппой(ОН), алкилкарбонильной группой (-CO-R), алкоксикарбонильной группой (-CO-OR), ацилоксиалкилалкоксикарбонильной группой (-CO-O-R-O-CO-R), в которой R представляет собой моновалентную или бивалентную группу или группу, имющую формулу -С(О)-О-СР 1 Р 2-галоалкил, где Р 1 и Р 2 могут быть одинаковыми или разными и представляют собой Н, низший алкил, низший алкокси, циано, низший галоалкил или арил. Пролекарства могут быть получены путем осуществления реакции соединения согласно настоящему изобретению с активированным ацильным соединением, что обеспечивает связывание атома азота в соединении согласно настоящему изобретению с карбонильной группой активированного ацилсодержащего соединения. Подходящие активированные карбонилсодержащие соединения содержат легко отделяющуюся группу, связанную с атомом углерода карбонильной группы, и включают ацилгалиды, ациламины, соли ацилпиридиния, ацилалкоксиды, в частности ацилфеноксиды, такие как пнитрофеноксиацил, динитрофеноксиацил, фторфеноксиацил, фторфеноксиацил и дифторфеноксиацил. Реакции обычно являются экзотермическими, их проводят в инертных растворителях при пониженных температурах, таких как от -78 до приблизительно 50 С. Реакции обычно проводят в присутствии неорганического основания, такого как карбонат калия или бикарбонат натрия, или органического основания,такого как амин, включая пиридин, TEA и т.д. Один из способов получения описан в заявке USSN 08/843,369, поданной 15 апреля 1997 (соответствующая публикация РСТ WO 9846576), содержание которой полностью включено в настоящее описание посредством ссылки. Соединение согласно настоящему изобретению ингибирует передачу сигнала с участием белкаHedgehog и может применяться для лечения раковых заболеваний, связанных с нарушенной передачей сигнала с участием белка Hedgehog, например, в случаях, когда белок Patched не подавляет или неадекватно подавляет белок Smoothened (фенотип с недостаточностью функции Ptc) и/или в случае, когда белок Smoothened активируется, несмотря на подавление белком Patched (фенотип повышенной функцииSmo). Примеры таких раковых заболеваний включают базально-клеточную карциному, нейроэктодермальные опухоли, такие как медуллобластома, менингиома, гемангиома, глиобластома, аденокарциному поджелудочной железы, сквамозноклеточную карциному, мелкоклеточную карциному легкого, немелкоклеточную карциному легкого, хондросаркому, карциному молочной железы, рабдомиосаркому, рак пищевода, рак желудка, рак желчных путей, карциному почки, карциному щитовидной железы. Соединение согласно настоящему изобретению можно вводить до, одновременно с или после применения других средств противораковой терапии, таких как радиотерапия или химиотерапия. Подходящие средства цитостатической химиотерапии включают перечисленные, но не ограничиваются ими: (i) антиметаболиты,такие как ситарабин, флударабин, 5-фтор-2'-деоксиуридин, гемицитабин, гидроксимочевину или метотрексат; (ii) ДНК-разрушающие агенты, такие как блеомицин, (iii) ДНК-сшивающие агенты, такие как хлорамбуцил, цисплатин, циклофосфамид или азотистый иприт; (iv) интеркалирующие агенты, такие как адриамицин (доксорубицин) или митоксантрон; (v) ингибиторы синтеза белка, такие как L-аспарагиназа,циклогексимид, пуромицин или дифтерийный токсин; (vi) токсины топоизомеразы I, такие как камптотецин или топотекан; (vii) токсины топоизомеразы II, такие как этопозид (VP-16) или тенипозид; (viii) агенты, воздействующие на микротрубочки, такие как колцемид, колхицин, паклитаксел, винбластин или винкристин; (ix) ингибиторы киназ, такие как флафипиридол, сатуроспорин, STI571 (CPG 57148 В) илиUCN-01 (7-гидроксисатуроспорин); (х) различные агенты, проходящие стадию исследований, такие как тиоплатин, PS-341, фенилбутират, ЕТ-18-ОСН 3, или ингибиторы фарнестилтрансферазы (L-739749, L744832); полифенолы, такие как кверцетин, ресвератрол, пицеаттанол (piceatannol), эпигаллокатехин гал-7 020192 лат, теафлавины, флаванолы, процианиды, бетулиновая кислота и их производные; (xi) гормоны, такие как глюкокортикоиды или фенретенид; (xii) антагонисты гормонов, такие как тамоксифен, финастерид или антагонисты релизинг-фактора лютеинизирующего гормона LHRH. Другой класс активных соединений, которые можно применять в настоящем изобретении, составляют соединения, способные сенсибилизировать к апоптозу или вызывать апоптоз путем связывания с рецепторами гибели ("агонисты рецепторов гибели"). Такие агонисты включают лиганды рецепторов гибели, такие как фактор некроза опухоли (TNF-),фактор некроза опухоли(TNF-, лимфотоксин-), LT- (лимфотоксин-), TRAIL (лиганд Apo2L, DR4),лиганд CD95 (Fas, APO-I), лиганд TRAMP (DR3, Аро-3), лиганд DR6, а также фрагменты и производные любого из указанных лигандов. В конкретном варианте реализации лиганд рецептора представляет собойTNF-. В другом конкретном варианте реализации лиганд рецептора гибели представляет собойApo2L/TRAIL. Дополнительно, агонисты рецепторов гибели включают агонистические антитела к рецепторам гибели, такие как анти-CD95 антитело, анти-TRAIL-R1 (DR4) антитело, анти-TRAIL-R2 (DR5) антитело, анти-TRAIL-R3 антитело, анти-TRAIL-R4 антитело, анти-DR6 антитело, анти-TNF-R1 антитело и анти-TRAMP (DR3) антитело, а также фрагменты и производные указанных антител. Для сенсибилизации к апоптозу соединение согласно настоящему изобретению можно также использовать в комбинации с лучевой терапией. Фраза "радиотерапия" относится к использованию электромагнитного облучения или облучения частицами в лечении новообразований. Радиотерапия основана на том, чтобы высокая доза облучения, доставленная в целевой участок, вызывала гибель размножающихся клеток как в опухоли, так и в нормальной ткани. Режимы дозирования облучения обычно определяют в единицах поглощенной дозы излучения (rad), времени и фракционирования. Дозы должны тщательно подбираться онкологом. Количество излучения, получаемого пациентом, будет зависеть от различных факторов, включая локализацию опухоли относительно других органов в организме и степень распространения опухоли. Примеры радиотерапевтических средств известны из существующих описаний радиотерапии, но не ограничены ими (Hellman, Principles of Radiation Therapy, Cancer, in Principles Iand Practice of Oncology, 24875 (Devita et al., 4th ed., vol. 1, 1993). Недавние успехи в области радиотерапии включают лучевую терапию с трехмерным планированием, лучевую терапию с модулируемой интенсивностью (IMRT), стереостатическую радиохирургию и брахитерапию (внутритканевую радиотерапию), причем последняя включает размещение источника излучения непосредственно в ткани в виде имплантируемых "зерен". Более современные средства лечения доставляют более высокие дозу излучения в опухоль, что обуславливает их повышенную эффективность по сравнению со стандартными средствами внешней лучевой терапии. Считается, что ионизирующее облучение бета-испускающими радионуклидами наилучшим образом подходит для процедур благодаря умеренному линейному переносу энергии (LET) ионизирующей частицы (электрона) и промежуточному диапазону действия (обычно несколько миллиметров в ткани). Гамма-лучи доставляют более низкие уровни дозы на значительно большие расстояния. Альфа-частицы представляют другую крайность - они доставляют очень высокую дозу LET, но обладают исключительно ограниченным радиусом действия и соответственно должны находиться в близком контакте с клетками обрабатываемой ткани. Кроме того, источники альфа-частиц обычно являются тяжелыми металлами, что ограничивает возможные используемые реагенты и обуславливает ненужную опасность утечки из обрабатываемой области. В объем настоящего изобретения входит использование любых типов источников, в зависимости от опухоли, которую лечат. Кроме того, настоящее изобретение охватывает неионизирующие типы излучения, например, такие как ультрафиолетовое излучение (УФ), видимый свет высокой энергии, микроволновое излучение (гипертермическое лечение), инфракрасное излучение (ИК) и лазеры. Соединение согласно настоящему изобретению подавляет ангиогенез и соответственно его можно применять для лечения заболеваний или состояний, опосредуемых ангиогенезом, таких как опухоли, в частности солидные опухоли, такие как солидные опухоли толстой кишки, легкого, поджелудочной железы, яичников, молочной железы и глиомы. Кроме того, соединение согласно настоящему изобретению можно применять для лечения дегенерации желтого пятна, например "мокрой" возрастной дегенерации желтого пятна. Соединением согласно настоящему изобретению также можно лечить воспалительные/иммунные заболевания, такие как болезнь Крона, воспалительное заболевание кишечника, синдром Шегрена, астма, отторжение трансплантата органа, системная красная волчанка, ревматоидный артрит,псориатический артрит, псориаз и рассеянный склероз. Соединение согласно настоящему изобретению можно также использовать в качестве средства для депиляции. Настоящее изобретение включает фармацевтические композиции и лекарственные средства, содержащие соединение согласно настоящему изобретению и терапевтически инертный носитель, разбавитель или наполнитель, а также способы применения соединения согласно настоящему изобретению для приготовления таких композиций и лекарственных средств. Обычно составы соединения согласно настоящему изобретению получают путем смешивания при комнатной температуре и соответствующем рН, а также при желаемой степени чистоты, с физиологически приемлемыми носителями, т.е. носителями, которые являются нетоксичными для реципиента в дозах и концентрациях, используемых в обычных ле-8 020192 карственных формах. рН состава зависит в основном от конкретного применения и концентрации соединения, но может варьировать от примерно 3 до примерно 8. Примером состава является ацетатный буфер с рН 5. Соединение для применения согласно настоящему изобретению может быть изготовлено в форме стерильной композиции. Соединение можно хранить в виде твердой композиции, но также приемлемы лиофилизированные или водные растворы. Соединение согласно настоящему изобретению можно изготавливать, дозировать и вводить образом, согласующимся с принятой медицинской практикой. Факторы, которые необходимо учесть в связи с этим, включают конкретное нарушение, которое лечат, конкретное млекопитающее, которое лечат, клиническое состояние конкретного пациента, причину нарушения, область доставки агента, путь введения и режим введения, а также другие факторы, известные практикующему врачу. "Эффективное количество" вводимого соединения определяется такими факторами, как минимальное количество, достаточное для снижения передачи сигнала с участием белка Hedgehog, либо представляет собой количество, необходимое для того, чтобы вызвать уменьшение размера, объема или массы опухоли, чувствительной к передаче сигнала с участием белка Hedgehog, или уменьшение размера, объема или массы такой опухоли относительно увеличению в отсутствие введения соединения согласно настоящему изобретению. В альтернативном варианте "эффективное количество" соединения означает количество, необходимое для снижения количества опухолевых клеток. В альтернативном варианте "эффективное количество" соединения означает количество соединения согласно настоящему изобретению, необходимое для увеличения выживания среди пациентов с опухолями, чувствительными к воздействию на путь передачи сигнала с участием белка Hedgehog. Такое количество может быть ниже количества, токсичного для нормальных клеток или млекопитающего в целом. В отношении незлокачественных состояний "эффективное количество" означает количество соединения, необходимое для снижения тяжести конкретных состояний или их симптомов. Обычно начальное фармацевтически эффективное количество соединения согласно настоящему изобретению при парентеральном введении составляет (на дозу) от примерно 0,01 до примерно 100 мг/кг, например от примерно 0,1 до примерно 20 мг/кг массы тела пациента в день, например от примерно 0,3 до примерно 15 мг/кг/день. Дозированные лекарственные формы для орального применения, такие как таблетки и капсулы, могут содержать от примерно 25 до примерно 1000 мг соединения согласно настоящему изобретению. Соединение согласно настоящему изобретению можно вводить любыми подходящими путями,включая пероральное, топическое, чрескожное, парентеральное, подкожное, ректальное, внутрибрюшинное введение, а также введение в легкие или интраназальное введение, и, если это желательно, для местного лечения, введение в поврежденный участок. Парентеральные инфузии включают внутримышечное, внутриартериальное, внутривенное, интраперитонеальное (внутрибрюшинное) или подкожное введение. Примером лекарственной формы для перорального введения является таблетка, содержащая примерно 25, 50, 100, 250 или 500 мг соединения согласно настоящему изобретению в комбинации с 9030 мг безводной лактозы, примерно 5-40 мг натрия кроскармеллозы, примерно 5-30 мг поливинилпирролидона (PVP) K30 и примерно 1-10 мг стеарата магния. Сначала ингредиенты в форме порошка смешивают друг с другом, а затем смешивают с раствором PVP. Полученная композиция может быть высушена, гранулирована, смешана со стеаратом магния и спрессована в таблетку с использованием соответствующего оборудования. Составы в форме аэрозоля могут быть приготовлены путем растворения соединения согласно настоящему изобретению, например, в количестве 5-400 мг, в подходящем буферном растворе, например в фосфатном буфере, добавления агента, регулирующего тоничность, например, соли, такой как хлорид натрия, если желательно. Раствор обычно фильтруют, например, с использованием фильтра с размером пор 0,2 мкм, чтобы удалить примеси и загрязняющие вещества. Формы для топического применения включают притирания, кремы, лосьоны, порошки, растворы, пессарии, спреи, аэрозоли и капсулы. Притирания и кремы могут быть изготовлены с водной или масляной основой с добавлением подходящего загустителя, и/или желирующих агентов, и/или растворителей. Такие основы могут включать воду и/или масло, такое как жидкий парафин или растительное масло, такое как арахисовое масло или растворитель, такой как полиэтиленгликоль. Пригодные загустители включают парафин, стеарат алюминия, цетостеариловый спирт, полиэтиленгликоли, микрокристаллический воск и пчелиный воск. Лосьоны могут быть изготовлены на водной или масляной основе и могут содержать один или более эмульгирующих агентов, стабилизирующих агентов, диспергирующих агентов и загустителей. Порошки для наружного применения могут быть изготовлены с использованием любой подходящей основы для порошка, например талька, лактозы или крахмала. Капли могут быть изготовлены на водной или неводной основе, также с содержанием одного или более диспергирующих агентов, солюбилизирующих агентов или суспендирующих агентов. Примеры Более полное понимание данного изобретения можно получить на основе следующих примеров. Однако их не следует истолковывать как ограничивающие объм изобретения. Используемые в настоящем описании аббревиатуры расшифровываются следующим образом:HPLC: жидкостная хроматография высокого давления;MPLC: жидкостная хроматография среднего давления;L: микролитр. Если не указано другое, все реагенты приобретали в коммерческих источниках. Реакции проводили в стеклянной посуде, подвергнутой горячей сушке в атмосфере азота. Чувствительные к воздуху и влаге жидкости и растворы переносили при помощи шприца или канюли из нержавеющей стали. Органические растворы концентрировали при пониженном давлении (примерно 15 мм рт. ст.) ротационным выпариванием. Если не указано другое, все использованные растворители приобретали в коммерческих источниках. Очистку продуктов путем хроматографии осуществляли на приборе Isco CombiFlash Companion с использованием сред Isco. Время реакций приведено исключительно для иллюстрации. За протеканием реакций следили методом тонкослойной хроматографии (ТСХ) и жидкостной хроматографии с масс-спектрометрией (ЖХ-МС). Тонкослойную хроматографию (ТСХ) осуществляли на пластинах силикагеля ЕМ Science 60 F254 (250 мкм). Визуализацию полученных хроматограмм осуществляли методом гашения флюоресценции. ЖХ-МС осуществляли на приборе Shimadzu 1OAD LC с колонкой Phenomenex(504,6 мм, 5 мкм) в режиме 3 мл/мин. Использовался детектор Shimadzu SPD-10A, контролирующий уровни при 214 и 254 нм. Анализ методом одноквадрупольной масс-спектрометрии осуществляли на масс-спектрометре Applied Biosystems. Спектры ядерного магнитного резонанса (ЯМР) получали на спектрометре Varian Inova, работающем на частоте 400 МГц для 1 Н, и приводили относительно тетраметилсилана (TMS) в миллионных долях (ppm). Данные для 1H ЯМР записывали следующим образом: химический сдвиг (, ppm), мультиплетность (s, синглет; bs, широкий синглет; d, дуплет; t, триплет; q,квартет; quint, квинтет; sext, секстет; hept, гептет; m, мультиплет; bm, широкий мультиплет) и интегрирование. Структуру и чистоту всех конечных продуктов оценивали по меньшей мере одним из следующих методов: ЖХ-МС, ЯМР, ТСХ. Пример 1. Общие процедуры. Соединение согласно настоящему изобретению получали согласно следующим общим процедурам.G. Образование амидной связи с использованием HATU Анилин (1,0 экв.) добавляли к смеси карбоновой кислоты (1,1 экв.), HATU (1,1 экв.) и DIPEA (2 экв.) в ДМФ (0,1-0,2 М). После перемешивания в течение ночи реакционную смесь разбавляли 0,1 N гидроксидом натрия или насыщенным NaHCO3, экстрагировали в этилацетате и объединнную органическую фазу промывали солевым раствором. Органическую фазу сушили (MgSO4), концентрировали и сырую смесь очищали путем ВЭЖХ с обращенной фазой. Полученный тиол (1 экв.) растворяли в МеОН, в то время как оксон (2 экв.) независимо растворяли в половине количества воды. После полного растворения оксона раствор сразу добавляли к раствору тиола в МеОН и перемешивали до завершения реакции. МеОН испаряли под вакуумом и оставшуюся воду экстрагировали дважды в этилацетате. Органическую фазу сушили над сульфатом магния и концентрировали с получением сульфона. Этап 1. Приготовление метил 4-бромо-2-метилбензоата. В трхгорлый сосуд объмом 1 л, оборудованный механической мешалкой, обратным холодильником, внутренним термощупом и барботажным устройством для азота, помещали 4-бром-2 метилбензойную кислоту (50,35 г, 1 экв., Hongda) и метанол (350 мл) и содержимое реактора охлаждали до 0 С. Медленно добавляли ацетил хлорид (27,6 г, 1 экв.) так, чтобы поддерживать внутреннюю температуру ниже 30 С. Реакционную смесь нагревали с обратным холодильником в течение 16 ч до тех пор,пока присутствие исходного материала больше не определялось путем жидкостной хроматографии. После завершения реакции содержимое реактора охлаждали до комнатной температуры и реакционную смесь концентрировали в роторном испарителе с получением масла. Масло затем разбавляли дихлорметаном (100 мл) и промывали насыщенным раствором бикарбоната натрия (100 мл). Органическую фазу концентрировали в роторном испарителе с получением метил 4-бром-2-метилбензоата (51,22 г, 95,5%) в виде желтого масла. Этап 2. 4-(2-Гидрокси-2-метилпропилтио)-2-метилбензойная кислота. В трхгорлый сосуд объмом 12 л с механической мешалкой, обратным холодильником, внутренним термощупом и барботажным устройством для азота помещали метил 4-бром-2-метилбензоат (500 г),толуол (4000 мл), 2-этилгексил 3-мепкаптопропаноат (715 г) и диизопропилэтиламин (564 г). Содержимое реактора дегазировали, повторив цикл вакуум/азот 3 раза. Затем в реактор помещали Pd2(dba)3 (59,97 г) и Xantphos (63,15 г) и дегазировали, повторяя цикл вакуум/азот 1 раз. Содержимое реактора затем нагревали до 95-100 С в течение 16 ч до тех пор, пока присутствие исходного материала больше не определялось путем жидкостной хроматографии. По завершении реакции содержимое реактора охлаждали до 45 С. В реактор затем помещали Флоризил (1000 г) и содержимое реактора перемешивали при 50 С в течение 2 ч до тех пор, пока присутствие промежуточного материала больше не определялось путем жидкостной хроматографии. После завершения реакции содержимое реактора охлаждали до комнатной температуры и фильтровали через целитную пластину. Осадок с фильтра промывали этилацетатом (4000 мл) и концентрировали фильтрат в роторном испарителе с получением масла. Масло затем возвращали в реактор с метанолом (9000 мл) и помещали в реактор натрия метоксид (327 г). (Экзотермическое добавление, Т 10 С). Содержимое реактора затем нагревали до 50 С в течение 1 ч до тех пор, пока присутствие промежуточного материала больше не определялось путем жидкостной хроматографии. Затем в реактор помещали 2,2-диметилоксиран (236 г), (экзотермическое добавление, T 10 С) и продолжали нагревать содержимое при 50 С в течение 1 ч до тех пор, пока присутствие промежуточного материала больше не определялось путем жидкостной хроматографии. Затем в реактор помещали воду (500 мл) и лития гидроксид моногидрат (91 г) и нагревали до 60 С в течение 12 ч до тех пор, пока присутствие промежуточного материала больше не определялось путем жидкостной хроматографии. После завершения реакции содержимое реактора охлаждали до комнатной температуры и концентрировали с получением масла в роторном испарителе, после чего разбавляли водой (18 л), дихлорметаном (24 л), промывали водную фракцию гептаном (24 л), окисляли водную фракцию концентрированной HCl (поддерживая температуру менее 35 С) и экстрагировали в дихлорметане (216 л). Каждую органическую фракцию промывали водой (18 л) и концентрировали с получением сухого вещества, содержащего 4-(2-гидрокси 2-метилпропилтио)-2-метилбензойную кислоту (472 г, 90 % выход) в виде твердого желтого вещества. Этап 3. Синтез 4-(2-гидрокси-2-метилпропилсульфонил)-2-метилбензойной кислоты. В реактор объемом 2000 мл, оснащенный механической мешалкой, внутренним термощупом и барботажным устройством для азота, помещали 4-(2-гидрокси-2-метилпропилтио)-2-метилбензойную кислоту (52 г), метанол (370 мл), воду (370 мл) и оксон (146 г) (наблюдали небольшой экзотермический эффект, T 15C) и перемешивали при комнатной температуре в течение 18 ч до тех пор, пока наличие исходного материала больше не определялось путем жидкостной хроматографии. Метанол удаляли роторным испарителем и содержимое реактора растворяли в 5% растворе бикарбоната натрия (3 л), затем добавляли этилацетат (2 л), после чего окисляли концентрированной HCl до уровня рН 1. Органические составляющие концентрировали в роторном испарителе с получением сухого вещества, с получением 4-(2-гидрокси-2-метилпропилсульфонил)-2-метилбензойной кислоты (52 г, 88% вы- 11020192 ход, 96,47% (площадь) - определялось методом ЖХ) в виде белого твердого вещества. Пример 20. Общую процедуру G осуществляли с использованием 4-(этилтио)бензойной кислоты и 4-хлоро-3(пиридин-2-ил)анилина с получением N-(4-хлоро-3-(пиридин-2-ил)фенил)-4-(этилтио)бензамида. Раствор N-(4-хлоро-3-(пиридин-2-ил)фенил)-4-(этилтио)бензамида (40 мг, 0,11 ммоль) в МеОН (3 мл) охлаждали до 0 С, обрабатывали оксоном (133 мг, 0,22 ммоль) и убирали ледяную ванну. После 1 ч помешивания реакционную смесь концентрировали и остаток растворяли в этилацетате. Органический раствор промывали водой, сушили (MgSO4) и концентрировали. Сырую реакционную смесь очищали путем ВЭЖХ с обращенной фазой с получением N-(4-хлоро-3-(пиридин-2-ил)фенил)-4(этилсульфонил)бензамида. MS (Q1) 401,0 (М)+. 2-Хлоро-5-нитройодбензол. Используемый реактор продували азотом и поддерживали атмосферу азота на протяжении всего процесса синтеза. В реактор помещали воду, очищенную в соответствии со стандартами фармакопеи США (400,0 л), встряхивали и добавляли 2-хлор-5-нитроанилин (50,0 кг), а затем содержимое охлаждали до 0-5 С. К перемешиваемому содержимому реактора добавляли концентрированную уксусную кислоту(40,0 л), поддерживая температуру 10 С (дополнительное время 3-4 ч) и перемешивали содержимое при 0-5 С как минимум в течение 15 мин. В отдельном сосуде приготовляли раствор натрия нитрита(25,0 кг) и воды, очищенной в соответствии со стандартами фармакопеи США (100,0 л). Раствор натрия нитрита медленно помещали в реактор при перемешивании, поддерживая температуру 5 С (экзотермический эффект и вынужденное выделение газа, дополнительное время 2 ч), и затем содержимое перемешивали при температуре 5 С по крайней мере 1 ч. В отдельном сосуде приготовляли раствор калия иодида (60,0 кг) и воды, очищенной в соответствии со стандартами фармакопеи США (240,0 л), и медленно добавляли в реактор при помешивании, поддерживая температуру 5 С (экзотермический эффект,вынужденное выделение газа и вспенивание, дополнительное время 7 ч). Охлаждение постепенно прекращали, позволяя реакционной смеси достигнуть комнатной температуры (20 С), и затем содержимое перемешивали по крайней мере 18 ч при 15-25 С, после чего брали образец реакционной смеси для анализа путем ВЭЖХ (растворяли образец в ацетонитриле) и когда оставалось 5% 2-хлор-5-нитроанилина,переходили к следующему этапу; однако, если количество исходного материала было 5%, пробы брали каждый час до завершения реакции. В отдельном сосуде приготовляли раствор натрия тиосульфата (30,0 кг) и воды, очищенной в соответствии со стандартами фармакопеи США (600,0 л), а затем медленно добавляли в реактор 1/2 раствора натрия тиосульфата при помешивании, поддерживая температуру 2030 С, и перемешивали содержимое реактора при 20-30 С по крайней мере 20 мин. Циклогексан (300,0 л) помещали в реактор, нагревали содержимое до 55-60 С и перемешивали по крайней мере 20 мин при 5560 С. Перемешивание прекращали, чтобы дать фазам стабилизироваться по крайней мере 10 мин, затем слои разделяли (органические слои на время оставляли) и возвращали водный слой обратно в реактор. Циклогексан (200,0 л) помещали в реактор и перемешивали при 55-60 С по крайней мере 20 мин, затем помешивание прекращали, давали фазам стабилизироваться по крайней мере 10 мин, после чего разделяли слои (водный слой использовали для анализа выхода) и смешивали оба органических слоя, полученные на предыдущих этапах, поместив их обратно в реактор. Оставшуюся 1/2 раствора натрия тиосульфата помещали в реактор при помешивании, поддерживая температуру 55-60 С и перемешивали по крайней мере 20 мин при 55-60 С. Перемешивание прекращали, чтобы дать фазам стабилизироваться по крайней мере 10 мин, и удаляли водный слой из реактора. Воду, очищенную в соответствии со стандартами фармакопеи США (300,0 л), затем помещали в реактор и перемешивали по крайней мере 20 мин при 55-60 С, затем помешивание прекращали, давали фазам стабилизироваться по крайней мере 10 мин,- 12020192 после чего водный слой отделяли и выбрасывали. Содержимое реактора нагревали при 45 С и удаляли 65% раствора методом вакуумной дистилляции. Содержимое реактора затем охлаждали до 0-5 С и допускалось помешивать его по крайней мере 5 ч, после чего тврдое вещество фильтровали и промывали продукт холодным циклогексаном (100,0 л). Продукт собирали и сушили в горячей воздушной сушилке при 45 +/-5 С до достижения LOD 1,0%. В результате процесса получали 50,0 кг (61% выход) 2-хлор-5 нитройодбензола в виде желтого тврдого вещества. Сырой 2-(2-пиридил)-4-нитрохлорбензол. Реактор продували азотом и держали в атмосфере азота на протяжении всего процесса синтеза. Толуол (3750 л) помещали в реактор, начинали встряхивание и добавляли в реактор цинка хлорид (19,56 кг). Методом атмосферной перегонки содержимое реактора десорбировали до 50% от первоначального объма и затем охлаждали до 30 С. В реактор медленно добавляли ТГФ (100,0 л) (наблюдали дополнительный экзотермический эффект). Приготовление реактива Гриньяра в реакторе 2. Реактор продували азотом и держали в атмосфере азота на протяжении всего процесса синтеза. Начинали встряхивание и добавляли в реактор ТГФ (50,0 л). Изопропилмагний хлорид (89,0 кг, корр. после титрования) перемешивали в вальцевом смесителе, а затем медленно добавляли, поддерживая температуру 30 С (наблюдали экзотермический эффект, дополнительное время 30-40 мин). 2-Бромпиридин(22,3 кг) медленно помещали в реактор, поддерживая температуру 30 С (наблюдали экзотермический эффект, дополнительное время 50-60 мин). Содержимое реактора затем нагревали до 50 +/-5 С и поддерживали температуру по крайней мере 1 ч. Раствор Гриньяра (из реактора 2) медленно добавляли в реактор (использованный на предыдущем этапе), поддерживая температуру 55 С (экзотермическое добавление вызывало вспенивание, дополнительное время 20 мин). Содержимое реактора затем перемешивали при 50 +/-5 С по крайней мере 1 ч, поддерживая температуру постоянной. Дихлорбистрифенилфосфин палладий (2,0 кг) помещали в реактор и перемешивали в течение 15 мин. Трифенилфосфин(2,75 кг) помещали в реактор и перемешивали в течение 15 мин. 2-Хлор-5-нитройодбензол (25,0 кг) медленно добавляли в реактор при перемешивании (время добавления 15 мин). Содержимое реактора нагревали до 60 +/-5 С и перемешивали по крайней мере 14 ч при 60 +/-5 С, затем брали образец реакционной смеси для анализа путем ВЭЖХ. Когда количество исходного материала было 4%, продолжали нагрев и затем брали пробу каждый час до тех пор, пока количество исходного материала не станет менее 4%. Реакционную смесь охлаждали до 55 С, затем содержимое реактора нагревали с обратным холодильником под вакуумом и удаляли 75-90 л растворителя. Толуол (120,0 л) добавляли в реактор при помешивании. В отдельном резервуаре растворяли аммония хлорид (25,0 кг) в воде, очищенной в соответствии со стандартами фармакопеи США (250,0 л), раствор медленно помещали в реактор и перемешивали по крайней мере 30 мин. Смесь фильтровали через нутч-фильтр (приготовленный с целитом(6,25 кг) и водой, очищенной в соответствии со стандартами фармакопеи США (12,5 л, промывали фильтровый осадок толуолом (75,0 л), добавляли фильтрат и смывали в чистый реактор. Слоям давали осесть по крайней мере 10 мин, затем слои разделяли (продукт содержался в органическом слое) и возвращали водный слой в реактор. Толуол (75,0 л) помещали в реактор и перемешивали по крайней мере 15 мин, затем давали фазам стабилизироваться по крайней мере 10 мин перед разделением (продукт содержался в органическом слое). Органические слои, полученные на предыдущих стадиях, помещали в чистый реактор. В реактор помещали воду, очищенную в соответствии со стандартами фармакопеи США(125,0 л), перемешивали по крайней мере 15 мин и затем давали фазам стабилизироваться по крайней мере 10 мин, после чего водный слой сливали и использовали для анализа выхода. В отдельном резервуаре приготовляли 3 N раствор соляной кислоты, смешивая концентрированную соляную кислоту (127,5 л) и воду, очищенную в соответствии со стандартами фармакопеи США (272,5 л). Приблизительно 1/3 от 3 N соляной кислоты (133,3 л) помещали в реактор и перемешивали по крайней мере 30 мин. Слоям давали осесть по крайней мере 15 мин и затем водный слой отделяли и перемещали в отдельный сосуд (продукт содержался в водном слое). Приблизительно 1/3 от 3 N соляной кислоты (133,3 л) помещали в реактор и перемешивали по крайней мере 30 мин. Слоям давали осесть по крайней мере 15 мин, затем водный слой отделяли и перемещали в отдельный сосуд (продукт содержался в водном слое). Приблизительно 1/3 от 3 N соляной кислоты (133,3 л) помещали в реактор и перемешивали по крайней мере 30 мин. Слоям давали осесть по крайней мере 15 мин и затем водный слой отделяли и перемещали в отдельный сосуд (продукт содержался в водном слое). Водные слои, полученные на предыдущих этапах, перемещали в чистый реактор, содержащий активированный уголь (1,0 кг), и затем нагревали до 50 +/-С и перемешивали по крайней мере 30 мин. Смесь фильтровали через нутч-фильтр(приготовленный с целитом (5,0 кг) и воду, очищенную в соответствии со стандартами фармакопеи США (12,5 л и промывали фильтровый осадок 3 N соляной кислотой (40,0 л), после чего добавляли фильтрат и смывали в чистый реактор. Объединнные водные растворы фильтровали через фильтр тонкой фильтрации толщиной 1 мкм в чистый реактор и охлаждали до температуры 10 С. Аммония гидроксид (115,0 л) медленно помещали в реактор, поддерживая уровень рН между 8,5 и 9,0 (время добавления 4,25 ч). Температуру реакции поддерживали в диапазоне 25-30 С, смесь допускалось помешивать в течение 30 мин. Затем реакционную смесь центрифугировали и продукт промывали водой, очищенной в соответствии со стандартами фармакопеи США (300,0 л), и сушили в горячей воздушной сушилке при 50-60 С. В результате процесса получали 15,0 кг (72%) сырого 2-(2-пиридил)-4-нитрохлорбензола. Очистка 2-(2-пиридил)-4-нитрохлорбензола. Реактор продували азотом и держали в атмосфере азота на протяжении всего процесса синтеза. Дихлорметан (400,0 л) помещали в реактор и начинали помешивание. Сырой 2-(2-пиридил)-4 нитрохлорбензол (40,0 кг) помещали в реактор, перемешивали при 20-30 С по крайней мере 30 мин и проверяли, все ли тврдые вещества растворились. Силикагель (20,0 кг) помещали в реактор и перемешивали по крайней мере 2 ч. Смесь фильтровали через нутч-фильтр (приготовленный с целитом (14,8 кг) и дихлорметаном (14,8 л и промывали фильтровый осадок дихлорметаном (80,0 л), после чего добавляли фильтрат и смывали в чистый реактор. Содержимое реактора нагревали с обратным холодильником под вакуумом и удаляли 80-90% растворителя, охлаждали до 20-30 С, после чего н-гексан (240,0 л) помещали в реактор при перемешивании по крайней мере 2 ч при 20-30 С. Реакционную смесь фильтровали, промывали н-гексаном (80,0 л) и сушили продукт в горячей воздушной сушилке при 50-55 С. В результате процесса получали 34,5 кг (86% выход) 2-(2-пиридил)-4-нитрохлорбензола в виде бежевого тврдого вещества. 4-Хлор-3-(пиридин-2-ил)анилин. 2-(2-Пиридил)-4-нитрохлорбензол помещали в реактор подходящего размера в атмосфере азота. При перемешивании добавляли платину на угле (5%, -50% влаж.) (0,10 вес.ч.), после чего добавляли тетрагидрофуран (9,68 вес.ч.). В реакторе нагнетали давление до 40 psi, затем давление стравливали. Этот процесс повторяли дополнительно два раза. Затем в реактор пускали водород, нагнетая давление до 50psi, поддерживая внутреннюю температуру в диапазоне 20-26 С. После того как поглощение водорода начинало ослабевать (1-2 ч), давление поддерживали на уровне 50 psi и нагревали реактор до 50 С в течение 2-3 ч. Реакционную смесь анализировали методом ВЭЖХ и по завершении реакции охлаждали до 30 С. Затем в реактор пускали азот, нагнетая давление до 40 psi, после чего давление стравливали. Этот процесс повторяли дополнительно два раза. В отдельный резервуар добавляли целит (0,1 вес.ч.) и тетрагидрофуран (0,9 вес.ч.). Полученную суспензию помещали в реактор и перемешивали по крайней мере 30 мин. Реакционную смесь фильтровали через фильтр-пресс и фильтр толшиной 0,2 мкм, фильтровый осадок промывали тетрагидрофураном (2,2 вес.ч.) и объединяли все органические составляющие. Тиолсиликагель (0,05 вес.ч.) помещали в реактор и перемешивали по крайней мере 30 мин. Полученную смесь затем фильтровали через фильтр-пресс в использованный на предыдущем этапе продутый азотом реактор. Фильтровый осадок промывали тетрагидрофураном (2,2 вес.ч.) и сливали обратно в реактор. При перемешивании в реактор добавляли гептаны (6,8 вес.ч.) и содержимое нагревали с обратным холодильником под вакуумом. Приблизительно две трети растворителя удаляли методом вакуумной дистилляции. Реактор охлаждали до 20-26 С и перемешивали в течение 2-3 ч. Содержимое реактора центрифугировали и промывали гептанами (1,0 вес.ч.), сушили в вакуумной печи при 20-25 С, пока не будет получена постоянная масса 4-хлор-3-(пиридин-2-ил)анилина (характерный выход 80%).N-(4-Хлор-3-(пиридин-2-ил)фенил)-4-(метилпропилсульфонил)бензамид. Тетрагидрофуран (10,24 вес.ч.) помещали в реактор подходящего размера в атмосфере азота. При перемешивании добавляли 4-(2-гидрокси-2-метилпропилсульфонил)-2-метилбензойную кислоту (1,265 вес.ч.) и 2-хлор-4,6-диметокси-1,3,5-триазин (0,815 вес.ч.) и перемешивали до полного растворения. 4 метилморфолин (0,564 вес.ч.) медленно помещали в реактор, поддерживая внутреннюю температуру 30 С. Смесь оставляли при перемешивании при комнатной температуре по крайней мере на 30 мин,после чего брали пробу на анализ методом ТСХ. Когда 4-(2-гидрокси-2-метилпропилсульфонил)-2 метилбензойная кислота была поглощена, добавляли 4-хлор-3-(пиридин-2-ил)анилин (1,0 вес.ч.). Реактор нагревали до 50C и перемешивали по крайней мере 6 ч, во время которых брали пробы реакционной смеси на анализ путем ВЭЖХ. По завершении реакции согласно результату анализа путем ВЭЖХ раствор бикарбоната натрия (натрия бикарбонат (0,506 вес.ч.) и вода, очищенная в соответствии со стандартами фармакопеи США (24,8 вес.ч. перемешивали до полного растворения тврдого вещества и добавляли к реакционной смеси. Реакционную смесь нагревали с обратным холодильником (-70 С) и удаляли раствор (5,7 вес.ч.) из реактора методом дистилляции. Реактор охлаждали до 30 С и перемешивали по крайней мере 20 ч. Содержимое реактора центрифугировали, промывали водой, очищенной в соответствии со стандартами фармакопеи США (3,47 вес.ч.), и сушили в вакуумной печи при 45 С с получением постоянной массы сырого N-(4-хлор-3-(пиридин-2-ил)фенил)-4-(метилпропилсульфонил)бензамида (характерный выход 90%). Метилизобутилкетон (20,0 вес.ч.) помещали в реактор подходящего размера в атмосфере азота. При перемешивании добавляли сыройN-(4-хлор-3-(пиридин-2-ил)фенил)-4-(метилпропилсульфонил)бензамид (1,0 вес.ч.) и нагревали реактор до 60 С, после чего перемешивали по крайней мере 1 ч. Раствор фильтровали через фильтр-пресс в использованный на предыдущем этапе продутый азотом реактор и промывали фильтровальный осадок метилизобутилкетоном (2,56 вес.ч.). Профильтрованный раствор затем нагревали с обратным холодильником (-115 С) и подвергали перегонке, чтобы удалить 2/3 растворителя (14,5 вес.ч.). Реактор охлаждали до 100 С и перемешивали по крайней мере 15 мин. Реактор затем охлаждали до 80C и устанавливали максимальную окружную скорость устройства для потряхивания на 2,0 м/с. Смешивали N-(4-хлор-3-(пиридин-2-ил)фенил)-4-(метилпропилсульфонил)бензамид,форма А (0,001 вес.ч.) и метилизобутилкетон (0,008 влаж.) с получением затравочной пасты. Полученную затравочную пасту добавляли в реактор при 80 С и перемешивали по крайней мере 2,5 ч. Температуру бани устанавливали на 70 С и перемешивали содержимое до тех пор, пока внутренняя температура не достигнет 70 С. Температуру бани устанавливали на 50 С и перемешивали содержимое до тех пор,пока внутренняя температура не достигнет 50 С. Температуру бани устанавливали на 25C и перемешивали содержимое до тех пор, пока внутренняя температура не достигнет 15-30 С. По достижении этой температуры смесь перемешивали по крайней мере 12 ч. В отдельном резервуаре приготовляли раствор метилизобутилкетона (3,0 вес.ч.) и гептанов (2,6 вес.ч.). Содержимое реактора центрифугировали, промывали смесью метилизобутилкетона/гептанов (всю) и сушили в вакуумной печи при 60 С с получением постоянной массы очищенного N-(4-хлор-3-(пиридин-2-ил)фенил)-4-(метилпропилсульфонил)бензамида. Тврдые вещества перемалывали, используя измельчитель Fitzmill с грохотом 18 меш, в прямом режиме на низкой скорости (характерный выход 80%). Пример 320. Исследование ингибирования передачи сигнала Hedgehog. Репортерные линии клеток мышей - 10T1/2-GHLuc [S12] (получены из линии клеток С 3 Н 10 Т 1/2 АТСС CCL-226); фибробласты эмбрионов мыши); среда для выращивания: среда Дульбекко, модифицированная по Иглу (DMEM), дополненная 10% фетальной бычьей сыворотки (FBS), 10 ед./мл пенициллина, 100 мкг/мл стрептомицина, 2 мМ глутамина и 10 мМ HEPES. Репортерные линии клеток человека - клетки HEPM-GliLuc [MZ24] (получены из клеток мезенхимы неба эмбриона человека НЕРМ, АТСС CRL-1486). Среда для выращивания: минимальная необходимая среда (MEM; с солями Игла), дополненная 1020% фетальной бычьей сыворотки (FBS), 10 ед./мл пенициллина, 100 мкг/мл стрептомицина, 2 мМ глутамина и 10 мМ HEPES рН 7,2.Sonic Hedgehog - рекомбинантный конъюгат человеческого SHh, октилированного на N-конце. Микротитрационные планшеты (МТР) - для анализа с люциферазой клетки высевают в 96 луночные микротитрационные планшеты (белые, с плоским дном, прозрачные). Среда для анализа с люциферазой - DMEM, дополненная 0,5% FBS, 10 ед./мл пенициллина, 100 мкг/мл стрептомицина, 2 мМ глутамина и 10 мМ HEPES рН 7,2. ФБР/Ca/Mg микс-фосфатный буферный раствор (ФБР), дополненный 0,5 мМ CaCl2 и 1 мМ MgCl2. Процедура анализа. Клетки S12 и MZ24, генетически модифицированные репортерным геном люциферазы под контролем чувствительного к белку Hedgehog промотора Gli, поддерживали в чашках для тканевых структур в среде для выращивания при 37 С и 5% СО 2. Культуры клеток пересевали до достижения непрерывного слоя 3-4 дня (1:20 до 1:40 для sl2; 1:3 до 1:10 для MZ24). Клетки собирали и разбавляли средой для выращивания для высевания в микротитрационные планшеты в количестве 10000-20000 клеток (sl2) или 20000-30000 клеток (MZ24) в 100 мкл на лунку. Затем клетки инкубировали в течение 24-48 ч при 37 С и 5% СО 2. После 24-48-часового инкубирования среду для выращивания в микротитрационных планшетах заменяли на среду для анализа с люциферазой (100 мкл на 1 лунку) с конъюгатом Sonic Hedgehog-октил или без него при концентрации 0,1-0,3 мкг/мл (S12) или 0,5-1,0 мкг/мл (MZ24) и исследуемыми соединениями. Затем клетки инкубировали еще 24 ч. Затем микротитрационные планшеты анализировали с использованием набора для анализа репортерного гена люциферазы (LucLite). Процедуру изготовителя модифицировали: среду удаляли и разбавляли субстрат в смесь 1:1 ФБР/Ca/Mg: лизирующий буфер, вместо чистого лизирующего буфера. Вкратце, PBS/Ca/Mg смешивали в пропорции 1:1 с лизирующим буфером, добавляли по 10 мл в каждый сосуд с субстратом (набора на 1000 тестов). Затем выбрасывали среду для анализа из микротитрационного планшета и добавляли 100 мкл смеси субстрата в каждую лунку. Планшеты инкубировали при комнатной температуре в течение 20-30 мин, после чего измеряли количество относительных световых единиц (RLUS), являющееся меткой экспрессии репортерного гена люциферазы, на приборе Topcount (Packard) или Analyst (Molecular Devices). Исследованное соединение согласно настоящему изобретению демонстрировало пониженную экспрессию GLi в репортерных клетках, что указывает на ингибирование сигнального пути Hedgehog. 2. Композиция, содержащая соединение по п.1 и фармацевтически приемлемый носитель. 3. Способ лечения ракового заболевания у млекопитающего, включающий введение указанному млекопитающему эффективного количества соединения по п.1. 4. Способ по п.3, отличающийся тем, что указанное раковое заболевание связано с нарушенной передачей сигнала с участием белка Hedgehog. 5. Способ по п.3, отличающийся тем, что указанное раковое заболевание представляет собой базально-клеточную карциному, медуллобластому, аденокарциному поджелудочной железы, мелкоклеточную карциному легкого, карциному молочной железы, рабдомиосаркому, рак пищевода, рак желудка или рак желчных путей. 6. Способ по п.3, отличающийся тем, что указанное раковое заболевание представляет собой нейроэктодермальную опухоль, такую как менингиома, гемангиома, глиобластома, сквамозноклеточную карциному легкого, немелкоклеточную карциному легкого, хондросаркому, карциному почки или карциному щитовидной железы. 7. Способ по п.3, отличающийся тем, что указанное раковое заболевание представляет собой солидную опухоль, такую как солидная опухоль толстого кишечника, легкого, поджелудочной железы, яичника, молочной железы или глиома. 8. Способ подавления ангиогенеза у млекопитающего, включающий введение указанному млекопитающему эффективного количества соединения по п.1. 9. Способ ингибирования пути передачи сигнала с участием белка Hedgehog в клетке, включающий приведение указанной клетки в контакт с эффективным количеством соединения по п.1. 10. Способ лечения дегенерации желтого пятна, такой как "мокрая" возрастная дегенерация желтого пятна, воспалительных/иммунных заболеваний, таких как болезнь Крона, воспалительное заболевание кишечника, синдром Шегрена, астма, отторжение трансплантата органа, системная красная волчанка,ревматоидный артрит, псориатический артрит, псориаз или рассеянный склероз, или осуществления депиляции, включающий введение соединения по п.1.
МПК / Метки
МПК: C07D 213/06, C07D 403/06, C07D 403/14
Метки: hedgehog, ингибиторы, пиридилсодержащие, передачи, сигнала, белок
Код ссылки
<a href="https://eas.patents.su/17-20192-piridilsoderzhashhie-ingibitory-peredachi-signala-cherez-belok-hedgehog.html" rel="bookmark" title="База патентов Евразийского Союза">Пиридилсодержащие ингибиторы передачи сигнала через белок hedgehog</a>
Предыдущий патент: Разделительное устройство
Следующий патент: Комбинации, включающие метотрексат и ингибиторы дигидрооротатдегидрогеназы (dhodh)
Случайный патент: Способ и устройство для создания рисунков в литых материалах












