Новые производные 4-бензилиденпиперидина
Номер патента: 11241
Опубликовано: 27.02.2009
Авторы: Галгоци Корнел, Колок Шандор, Саги Каталин, Борза Иштван, Фаркаш Шандор, Хорват Чилла, Надь Йожеф, Дьертьян Иштван
Формула / Реферат
1. Производные 4-бензилиденпиперидина, соответствующие формуле (I)

в которой значение X и Y независимо соответствуют водороду, С1-С4 алкилсульфонамидо или C1-C4 алканоиламидо; либо
соседние X и Y группы вместе с одним либо более идентичным или отличным дополнительным гетероатомом и -СН= и/или -CH2-группами могут сформировать 5-6-членное гетероциклическое кольцо, предпочтительно морфолиновое, оксопирролидиновое, оксоимидазолидиновое, оксо- или тиоксооксазолидиновое, оксотиазолидиновое кольцо;
Z соответствует водороду, атому галогена С1-С4 алкильной или С1-С4 алкоксигруппе,
а также их оптические изомеры, рацемические соединения и соли.
2. Соединение по п.1, выбранное из группы производных 4-бензилиденпиперидина,
2-(4-бензилиденпиперидин-1-ил)-2-оксо-N-(2-оксо-2,3-дигидробензооксазол-6-ил)ацетамид,
2-(4-бензилиденпиперидин-1-ил)-2-оксо-N-(2-оксо-2,3-дигидробензотиазол-6-ил)ацетамид,
2-[4-(4-хлорбензилиден)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензооксазол-6-ил)ацетамид,
2-[4-(4-хлорбензилиден)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензоимидазол-5-ил)ацетамид,
2-[4-(4-хлорбензилиден)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензотиазол-6-ил)ацетамид,
2-[4-(4-метилбензилиден)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензоимидазол-5-ил)ацетамид,
2-[4-(4-метилбензилиден)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензотиазол-6-ил)ацетамид,
2-[4-(4-метилбензилиден)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензотиазол-6-ил)ацетамид,
2-[4-(4-метоксибензилиден)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензоимидазол-5-ил)ацетамид,
2-[4-(4-метоксибензилиден)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензотиазол-6-ил)ацетамид,
N-(4-метансульфониламинофенил)-2-[4-(4-метоксибензилиден)пиперидин-1-ил]-2-оксоацетамид,
2-[4-(4-фторбензилиден)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензооксазол-6-ил)ацетамид и их оптические изомеры, рацемические соединения и соли.
3. Фармацевтическая композиция, содержащая в своем составе эффективное количество производных 4-бензилиденпиперидина, соответствующих формуле (I), в которой значения X, Y, Z определены в п.1, либо их соли в качестве активных веществ и вспомогательные вещества, широко применяемые в фармацевтической практике, такие как носители, формообразующие вещества, растворители, стабилизаторы, смачивающие либо эмульгирующие агенты, вещества, влияющие на рН- и осмотическое давление, отдушки или ароматизирующие вещества, равно как и активирующие композицию и доставляющие композицию добавки.
4. Способ получения производных 4-бензилиденпиперидина, соответствующих формуле (I), в которой значения X, Y, Z определены в п.1, характеризующийся реакцией вторичного амина, соответствующего формуле (II)
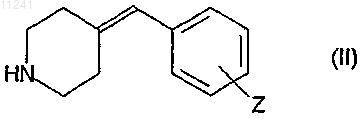
где Z имеет то же значение, которое определено в случае формулы (I), с этилоксалилхлоридом в соответствующем подходящем растворителе в присутствии основания, омылением сложноэфирного соединения, соответствующее формуле (III)
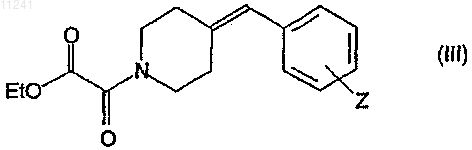
где Z имеет то же значение, которое определено в случае формулы (I), под действием щелочной гидроокиси и реакцией полученной оксаламидной кислоты, соответствующей формуле (IV)

в которой Z имеет то же значение, которое определено в случае формулы (I), или ее химически активного производного, с анилином, соответствующим формуле (V)
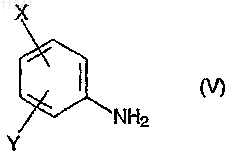
в которой значения X и Y соответствуют тем значениям, которые были определены ранее в случае формулы (I), в дихлорметане,
с последующей при необходимости трансформацией полученных производных 4-бензилиденпиперидина, соответствующих формуле (I), в которых значения X, Y, Z соответствуют тем значениям, которые были определены в п.1, в другие соединения, соответствующие формуле (I), посредством введения новых замещающих групп, и/или модификации, или удаления групп, присутствующих изначально, и/или посредством образования соли, и/или выделения соединений, соответствующих формуле (I) из состава солей с применением известных методов.
5. Способ по п.4, характеризующийся реакцией активного производного карбоновой кислоты, соответствующего формуле (IV), в которой Z имеет то же значение, которое определено в п.1, с анилином, соответствующим формуле (V), в которой значения X и Y соответствуют тем значениям, которые были определены в п.1, в присутствии основания.
6. Способ по п.4, характеризующийся реакцией карбоновой кислоты, соответствующей формуле (IV), в которой Z имеет то же значение, которое определено в п.1 (I), с анилином, соответствующим формуле (V), в которой значения X и Y соответствуют тем значениям, которые были определены в п.1, в присутствии триэтиламина и O-бензотриазол-1-ил-N,N,N',N'-тетраметилурониумгексафторфосфата (HBTU) в диметилформамиде.
7. Способ производства фармацевтических композиций, обладающих эффектом NR2B селективного антагониста рецептора NMDA, характеризующийся смешиванием производных 4-бензилиденпиперидина, соответствующих формуле (I), в которой значения X, Y, Z определены в п.1, их оптических изомеров, рацемических соединений, либо их фармацевтически приемлемых солей в качестве активных веществ, и вспомогательных веществ, широко применяемых в фармацевтической практике, таких как носителей, формообразующих веществ, растворителей, стабилизаторов, смачивающих либо эмульгирующих агентов, веществ, влияющих на рН- и осмотическое давление, отдушки или ароматизирующих веществ, равно как и активирующих композицию и доставляющих композицию добавок.
8. Способ лечения и смягчения симптомов следующих заболеваний млекопитающих, включая человека, таких как травматические повреждения мозга или спинного мозга, нервные повреждения, связанные с вирусом иммунодефицита человека, боковой амиотрофический склероз (болезнь Шарко), толерантность и/или зависимость к лечению болей с применением синтетических наркотических препаратов (опиоидов), абстинентные синдромы по причине, например, алкоголя, синтетических наркотических препаратов (опиоидов) или кокаина, ишемических расстройствах ЦНС, таких как, например, болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, болей и хронических болевых состояний, таких как, например, невропатическая боль, или боль, связанная с раковым заболеванием, эпилепсия, тревога, депрессия, мигрень, психоз, мышечные спазмы, слабоумие различного происхождения, гипогликемия, дегенеративные расстройства сетчатки, глаукома, астма, звон в ушах, потеря слуха, вызванная применением аминогликозидных антибиотиков, характеризующийся введением нуждающимся в лечении млекопитающим эффективного количества/количеств производного 4-бензилиденпиперидина, соответствующего формуле (I), в которой значения X, Y, Z определены в п.1, его оптических изомеров, рацемических соединений, либо его фармацевтически приемлемых солей как самих по себе, так и в комбинации с носителями, наполнителями и тому подобным, традиционно применяемыми в фармацевтической практике.
9. Применение производного 4-бензилиденпиперидина, соответствующего формуле (I), в которой значения X, Y, Z определены в п.1, его оптических изомеров, рацемических соединений, либо его фармацевтически приемлемых солей для производства фармацевтических композиций, предназначенных для лечения и смягчения симптомов следующих заболеваний млекопитающих, включая человека, таких как травматические повреждения мозга или спинного мозга, нервные повреждения, связанные с вирусом иммунодефицита человека, боковой амиотрофический склероз (болезнь Шарко), толерантность и/или зависимость к лечению болей с применением синтетических наркотических препаратов (опиоидов), абстинентные синдромы по причине, например, алкоголя, синтетичесъшх наркотических препаратов (опиоидов) или кокаина, ишемических расстройствах ЦНС, таких как, например, болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, болей и хронических болевых состояний, таких как, например, невропатическая боль, или боль, связанная с раковым заболеванием, эпилепсия, тревога, депрессия, мигрень, психоз, мышечные спазмы, слабоумие различного происхождения, гипогликемия, дегенеративные расстройства сетчатки, глаукома, астма, звон в ушах, потеря слуха, вызванная применением аминогликозидных антибиотиков.
Текст
011241 Область техники, к которой относится изобретение Настоящее изобретение касается новых производных 4-бензилиденпиперидина, которые являютсяNR2B селективными антагонистами рецептора NMDA с улучшенным in vivo профилем, либо представляют собой промежуточные соединения для производства последних. Уровень техники Рецепторы N-метил-D-аспарагиновой кислоты (NMDA) представляют собой катионные каналы,управляемые лигандами, широко представленные в центральной нервной системе. Рецепторы NMDA вовлечены в рост, развитие и адаптационные изменения нейронов. Сверхактивация рецепторов NMDA глутаминовой кислотой, их естественным лигандом, может приводить к кальциевой перегрузке клеток. Это запускает каскад внутриклеточных процессов, которые изменяют функционирование клеток и, в конечном счете, могут привести к гибели нейронов. Антагонисты рецепторов NMDA могут быть использованы для лечения множества расстройств, которые сопровождаются избыточным высвобождением глутаминовой кислоты, либо сверхактивацией рецепторов NMDA по любой другой причине [Curr Opin Investig Drugs. 2003 4: 826-32]. Рецепторы NMDA представляют собой гетеромерные комплексы, состоящие по меньшей мере из одной субъединицы NR1 и одной или более из четырех субъединиц NR2 (NR2A - D). Как пространственное распределение в центральной нервной системе (ЦНС), так и фармакологическая чувствительность рецепторов NMDA, имеющих в своем составе различные NR2 субъединицы, являются различными. В связи с этим, особенно интересной является NR2B субъединица в связи с ее ограниченным распределением (наивысшие плотности в переднем мозгу и студенистом веществе спинного мозга) [Neuropharmacology, 38, 611-623 (1999)]. Соединения, селективные для данного подтипа, являются доступными, и их эффективность была показана на животных моделях инсульта [Stroke, 28, 2244-2251 (1997)], травматических повреждений мозга [Brain Res., 792, 291-298 (1998)], болезни Паркинсона [Exp. Neurol., 163,239-243 (2000)], невропатической и воспалительной боли [Neuropharmacology, 38, 611-623 (1999)]. Кроме того, NR2B подтип селективные антагонисты рецепторов NMDA могут обеспечивать терапевтическое преимущество по сравнению с неселективными антагонистами рецепторов NMDA. Неселективные антагонисты рецепторов NMDA, действующие по типу блокатора канала, фенциклидин и кетамин, индуцируют психодислептические эффекты, галлюцинации, дисфорию, кататонию и амнезию у человека. Эти серьезные неблагоприятные эффекты затрудняют их клиническое использование в качестве потенциально возможного препарата. Соединения, принадлежащие к данному классу, также обуславливают аномальное поведение у животных, например возбуждают двигательную активность, индуцируют амнезию и ухудшают координацию движений. Серьезность (тяжесть) данных эффектов у животных рассматривается как предиктивная в отношении серьезности клинических побочных эффектов. Предполагается, что NR2B подтип селективные антагонисты лишены большей части этих побочных эффектов. По итогам экспериментов по изучению поведения животных, сообщалось о том, что некоторые NR2B селективные соединения [Ro 63-1908 in J. Pharmacol. Exp. Ther., 302 (2002) 940-948 и Ro 25-6981 inBehav. Pharmacol., 14 (2003) 477-487] увеличивают двигательную активность, в то время как такой эффект не наблюдался в случае СР-101,606, другого NR2B селективного антагониста, и Ro 256981 из другой группы [Neuropharmacology, 38, 611-623 (1999)]. Отсутствие эффекта стимулирования двигательной активности в случае СР-101,606 вплоть до уровня 56 мг/кг подкожно и 100 мг/кг внутрибрюшинно было также подтверждено другими данными [Soc.Neurosc.Abstr. 21, 439.9. 1995.]. Таким образом, согласно нашим лучшим данным, СР-101,606 является единственным NR2B селективным антагонистом, который,согласно единообразным сообщениям, не обладает эффектом стимулирования двигательной активности. Поскольку СР-101,606 имеет невысокую эффективность при пероральном приеме и, согласно опубликованным данным, был исследован только посредством внутривенного способа введения человеку, кроме того, он имеет полиморф CYP2D6 опосредованный метаболизм [Drug Metabolism and Disposition 31: 7687], сохраняется огромная необходимость в новых NR2B антагонистах, обладающих низкой тяжестью побочных эффектов (высокий терапевтический индекс), хорошей эффективностью в случае перорального приема (биодоступностью) и хорошей способностью перспективного усовершенствования в терапевтических целях, в особенности с целью перорального применения. Насыщенные аналоги соединений, являющихся предметом настоящего изобретения, описаны в WO 2003010159 как NR2B подтип селективные антагонисты NMDA. Однако, другие структурно близкие аналоги производных 4-бензилиден-пиперидина, соответствующие формуле (I), в литературе неизвестны. Сущность изобретения Было обнаружено, что новые производные 4-бензилиденпиперидина, соответствующие формуле (I),являющиеся предметом настоящего изобретения, представляют собой функционально активные антагонисты NMDA, селективные для рецепторов, содержащих субъединицу NR2B. Авторы также обнаружили, что бензилиденпиперидины обладают анальгетическими свойствами in vivo, сходными с теми, которыми обладают их насыщенные бензилперидиновые аналоги. Удивительно следующее: в то время как последние обуславливают повышение двигательной активности на уровне, соответствующем, либо немного превышающем их максимально эффективную анальгетическую дозу, соединения, являющиеся-1 011241 предметом настоящего изобретения, не обладают эффектом повышения двигательной активности до уровня, достигающего 40-60-кратного превышения их анальгетической дозы. Это свойство может обеспечить терапевтическое преимущество перед NR2B селективными антагонистами NMDA, имеющими более низкий терапевтический индекс. Подробное описание изобретения Таким образом, настоящее изобретение касается, в первую очередь, новых производных 4 бензилиденпиперидина, соответствующих формуле (I) в которой значение X и Y независимо соответствуют водороду С 1-С 4 алкилсульфонамидо, С 1-С 4 алканоиламидо, либо соседние X и Y группы вместе с одним либо более идентичным или отличным дополнительным гетероатомом и -СН= и/или -CH2- группами могут сформировать 5-6-членное гетероциклическое кольцо, предпочтительно морфолиновое, оксопирролидиновое, оксоимидазолидиновое, оксоили тиоксооксазолидиновое, оксотиазолидиновое кольцо, Z соответствует водороду либо атому галогена,С 1-С 4 алкильной, С 1-С 4 алкоксигруппе, а также их оптических изомеров, рацемических соединений и солей. Кроме того, объектами настоящего изобретения являются фармацевтические композиции, содержащие в своем составе, в качестве активных компонентов, новые производные 4-бензилиденпиперидина, соответствующие формуле (I), или их оптические изомеры, рацемические соединения, либо их соли. Следующими объектами настоящего изобретения являются способы производства новых производных 4-бензилиденпиперидина, соответствующих формуле (I), и фармацевтического изготовления медикаментов, содержащих в своем составе данные соединения, равно как и способы лечения с применением данных соединений, что включает в себя введение препаратов в организм млекопитающего, включая человека, нуждающегося в лечении, эффективное количество/количества новых производных бензилиденпиперидина, соответствующих формуле (I), являющихся объектом настоящего изобретения, как самих по себе, так и в составе медикамента. Согласно настоящему изобретению, соединения - амиды карбоновых кислот, соответствующие формуле (I), могут быть приготовлены следующим способом. Для производства соединения, соответствующего формуле (I), где X, Y и Z такие, которые определены в соответствии с формулой (I), вторичный амин, соответствующий формуле (II) где Z имеет то же значение, которое определено в случае формулы (I), вступает в реакцию с этилоксалилхлоридом в соответствующем подходящем растворителе в присутствии основания,полученное сложноэфирное соединение, соответствующее формуле (III) где Z имеет то же значение, которое определено в случае формулы (I), подвергается омылению под действием щелочной гидроокиси и полученная оксаламидная кислота, соответствующая формуле (IV) в которой Z имеет то же значение, которое определено в случае формулы (I), или ее химически активное производное вступает в реакцию с анилином, соответствующим формуле (V) в которой значения X и Y соответствуют тем значениям, которые были определены ранее в случае формулы (I),после чего полученные производные 4-бензилиденпиперидина, соответствующие формуле (I), в которых значения X, Y, Z соответствуют тем значениям, которые были определены в случае формулы (I),-2 011241 трансформируются в другие соединения, соответствующие формуле (I), посредством введения новых замещающих групп, и/или модификации, или удаления групп, присутствующих изначально, и/или посредством образования соли, и/или выделения соединения из состава солей, и/или разложения полученных рацемических соединений с использованием оптически активных кислот либо оснований с применением известных методов. Реакция карбоновой кислоты, соответствующей формуле (II), и анилина, соответствующего формуле (V), то есть формирование амидной связи, осуществляется предпочтительно путем образования активного производного из карбоновой кислоты, соответствующей формуле (II), которое и реагирует с анилином, соответствующим формуле (V), предпочтительно в присутствии основания. Превращение карбоновой кислоты в химически активное производное происходит in situ в процессе формирования амидной связи в растворителе (например, диметилформамиде, ацетонитриле, хлорированных углеводородах или углеводородах). Химически активные производные могут представлять собой хлориды кислот (полученные, например, из карбоновой кислоты и тионилхлорида), смешанные ангидриды (полученные, например, из карбоновой кислоты и изобутилхлороформата в присутствии основания,такого как, например, триэтиламин), химически активные сложные эфиры (полученные, например, из карбоновой кислоты и гидроксибензтриазола и дициклогексилкарбодиимида либо O-бензотриазол-1-илN,N,N',N'-тетраметилурониумгексафторфосфата (HBTU) в присутствии основания, такого как, например,триэтиламин). Химически активные производные образуются в диапазоне температур от комнатной температуры до 0 С. Необходимое время реакции составляет 6-20 ч. Реакционная смесь очищается с применением колоночной хроматографии с использованием Kieselgel 60 (Merck) в качестве адсорбента и соответствующего элюента. Подходящие фракции концентрируются с целью получения чистого продукта. Качество и количество продукта определяются с использованием метода высокоэффективной жидкостной хроматографии совмещенной с масс-селекцией (HPLC-MS method). Анилины, соответствующие формуле (V), являются как коммерчески доступными, так и могут быть синтезированы с применением различных известных методов. Способы синтеза некоторых коммерчески недоступных анилинов, соответствующих формуле (V), и карбоновых кислот, соответствующих формуле(IV), описаны в разделе Примеры. Как было сказано, новые производные 4-бензилиденпиперидина, соответствующие формуле (I), являющиеся объектом настоящего изобретения, представляют собой высокоэффективные и высокоселективные антагонисты рецепторов NMDA, и, более того, большая часть соединений представляет собой селективные антагонисты NR2B подтипа рецепторов NMDA. Для определения эффективности соединений как NR2B селективных антагонистов NMDA мы использовали культивируемые нейроны коры головного мозга, экспрессирующие преимущественно рецепторы NMDA, содержащие субъединицу NR2B Для подтверждения их селективности использовались клетки HEK-293, трансфецированные комбинацией NR1/NR2A субъединиц. Для измерения анальгетической эффективности in vivo и ответственности за побочные эффекты сильных NR2B селективных антагонистов авторы использовали мышиный формалиновый тест и тест на двигательную активность, соответственно. Экспериментальные протоколы Экспрессия рекомбинантных рецепторов NMDA Для подтверждения NR2B селективности соединений, что означает исследование их действия наNR2A содержащие рецепторы NMDA, авторы тестировали наиболее сильные из них на клеточных линиях, устойчиво экспрессирующих рекомбинантные рецепторы NMDA с композициями NR1/NR2A субъединиц. кДНК человеческих NR1 и NR2A субъединиц, субклонированные в индуцибельные экспрессионные векторы млекопитающих, были интродуцированы в HEK 293 клетки, не содержащие рецепторыNMDA, с использованием катионного опосредованного липидами метода трансфекции [Biotechniques,22, 982-987 (1997); Neurochemistry International, 43, 19-29 (2003)]. Устойчивость к неомицину и гигромицину использовалась для отбора клонов, содержащих оба вектора, и, на основе клонов, были получены моноклональные клеточные линии, обеспечивающие наибольший ответ на взаимодействие с NMDA. Соединения тестировались на их ингибиторную активность в отношении NMDA, вызываемую внутриклеточным кальцием, которая выражалась в увеличении сигнала при флуоресцентных измерениях содержания кальция. Исследования проводились по истечении 48-72 ч после добавления индуцирующего агента. Кетамин (500 мкМ) также присутствовал в ходе индукции с целью не допущения цитотоксичности. Определение активности антагониста NMDA in vitro посредством измерения внутриклеточной концентрации кальция в культуре корковых клеток крысы с использованием сканирующего флуориметра для прочтения планшетов Измерения внутриклеточной концентрации кальция были произведены с использованием культур первичных клеток новой коры головного мозга, полученных из 17-дневных эмбрионов крыс CharlesRiver (подробное описание получения культуры клеток коры головного мозга смотри в Johnson, M.I.;Bunge, R.P. (.1992): Культуры клеток первичных периферических и центральных нейронов и нейроглии. В: Protocols for Neural Cell Culture, eds: Fedoroff, S.; Richardson A., The Humana Press Inc., 51-75.) После выделения клетки были рассеяны на стандартные 96-луночные микропланшеты, после чего культуры-3 011241 инкубировались в атмосфере 95% воздуха, 5% CO2 при 37 С до проведения измерений концентрации кальция. Культуры клеток использовались для измерения внутриклеточной концентрации кальция по истечении 3-7 дней in vitro. Считается, что, на данной стадии, клетки in vitro экспрессируют преимущественно NR2B содержащие рецепторы NMDA [Mol. Pharmacol. 45, 846-853. (1994)]. Перед измерениями в клетки вводился флуоресцентный Са 2+ - чувствительный краситель, Fluo-4/AM (2 мкМ). Для остановки введения красителя в клетки клетки дважды промывались раствором, использовавшимся в ходе измерений (140 мМ NaCI, 5 мМ KCl, 2 мМ CaCl2, 5 мМ HEPES, 5 мМ HEPES-Na, 20 мМ глюкозы, 10 мкМ глицина, рН=7,4). После промывки к культурам клеток добавлялись тестируемые соединения, растворенные в указанном выше растворе (90 мкл/лунку). Измерения внутриклеточной концентрации кальция производились с использованием сканирующего флуориметра для прочтения планшетов: увеличение Fluo-4 флуресценции, которое соответствовало увеличению внутриклеточной концентрации кальция, индуцировалось посредством введением 40 мкМ NMDA. Ингибиторная активность тестируемых соединений определялась посредством измерения снижения роста концентрации кальция в присутствии различных концентраций данных соединений. Кривые зависимости доза - эффект и значения IC50 определялись с применением данных, полученных по меньшей мере в трех независимых экспериментах. Ингибиторная активность соединения в одной концентрационной точке выражалась как процент ингибирования (ослабления) ответа NMDA. В качестве результатов были получены сигмовидные кривые концентрация - ингибирование, после чего значенияIC50 определялись как концентрация соединения, обеспечивающая ингибирование, равное половине максимального ингибирования, обеспечивающегося данным соединением. В табл. 1 приведены активности большинства эффективных соединений, являющихся объектом настоящего изобретения, как антагонистов NR2B, определенные в данном эксперименте. В табл. 2 приведены результаты для нескольких известных NR2B специфичных антагонистов и неспецифичного антагониста рецептора NMDA MK-801. Таблица 1. Активность соединений как антагонистов NMDA, измеренная с применением флуориметрического метода с использованием клеток коры головного мозга (NR2B активность) либо с использованием трансформированных клеток HEK293 (NR2A активность)N.E.: не эффективна, то есть ингибирование менее 30% Таблица 2. Активность соединений как антагонистов NMDA, измеренная с применением флуориметрического метода с использованием клеток коры головного мозга (NR2B активность) либо с использованием трансформированных клеток HEK293 (NR2A активность) Соответствующие соединения являются следующими:MK-801: (+)-5-Метил-10,11-дигидро-5 Н-дибензо[а,d]циклогептен-5,10-имин. Мышиный формалиновый тест для измерения in vivo эффективности Известно, что инъекция разбавленного формалина в заднюю лапу крысы или мыши обуславливает появление и развитие двухфазного поведения, связанного с болью, интенсивность которой измеряется как время, затраченное на зализывание/кусание раненной лапы. Вторая фаза, как правило, определяется как связанные с болью события, детектируемые в 15-60-минутном интервале после инъекции формалина,максимальная интенсивность которых наблюдается во временной точке около 30 мин. Известно, что рецепторы NMDA вовлечены во вторую фазу ответа на инъекцию формалина, и этот поведенческий ответ чувствителен к блокированию рецепторов NMDA [Dickenson, A. and Besson J.-M. (Editors): Chapter 1, pp. 6-7: Animal models of Analgesia; and Chapter 8, pp. 180-183: Mechanism of Central Hypersensitivity: Excitatory Amino Acid Mechanisms and Their Control - In Pharmacology of Pain. Springer-Verlag (Berlin) 1997.] Таким образом, авторы использовали вторую фазу формалинового теста для определения эффективности соединений in vivo. Считается, что ингибирование второй фазы ответа отражает анальгетический эффект против продолжительной химически-индуцированной боли [Hunker, S., et al.: Formalin Test in Mice, aUseful Technique for Evaluating Mild Analgesics, Journal of Neuroscience Methods, 14 (1985) 69-76.] Использовались самцы мышей линии NMRI (20-25 г). Животные не получали никакой твердой пищи на протяжении приблизительно 16 ч перед экспериментом, но имели свободный доступ к 20% раствору глюкозы. Далее животные получали 1-часовой период акклиматизации (привыкания) в стеклянном цилиндре (сс. 15 см в диаметре), затем помещались в такой же цилиндр с расположенным сзади зеркалом для облегчения наблюдения. Тестируемые соединения суспендировались в 5% tween-80 (10 мл на кг массы тела) и вводились перорально путем кормления за 15 мин до инъекции формалина (20 мкл 1% формалина в 0,9% растворе хлорида натрия в воде (физиологическом растворе) инъецировалось подкожно в дорзальную поверхность правой задней лапы). Время, потраченное на зализывание и кусание раненой лапы, при проведении измерений составляло от 20 до 25 мин после инъекции формалина. Для определения величины ED50, различные дозы (по меньшей мере пять различных доз) тестируемых соединений давались группам по 5 мышей и результаты выражались как проценты уменьшения времени, потраченного на зализывание, по сравнению с контрольной группой, которой давался только растворитель, наблюдавшейся в тот же день. Величины ED50 (то есть дозы, вызывающие уменьшение на 50%) были посчитаны с применением метода подбора сигмоидальной кривой по Больцману (Boltzman's sigmoidal curvefitting). Измерения самопроизвольной двигательной активности у мышей В экспериментах использовались самцы мышей линии NMRI, весящие 20-22 г. Самопроизвольная двигательная активность измерялась с использованием четырехканального контролера активности. Установка, состоящая из четырех акриловых клеток (43 см 43 см 32 см), оборудованная 216 парами фотоэлементов вдоль всей нижней оси клетки. Дополнительный набор фотоэлементов (16 пар) помещал-5 011241 ся вдоль двух противоположных сторон клетки на высоте 10 см с целью фиксировать ответ в виде подъема на задние лапы. Экспериментальные группы состояли из 10 животных. Спустя тридцать минут после перорального приема тестируемого соединения или растворителя (tween-80) животные помещались индивидуально в одну из четырех клеток на один час. Горизонтальные и вертикальные передвижения определялись как число прерываний луча внутри 15-минутных интервалов на протяжении 1 ч. Для каждой группы были посчитаны средниестандартная ошибка данные горизонтальной и вертикальной двигательной активности, после чего были определены отклонения от контрольной (получавшей растворитель) группы, выраженные в процентах. Считалось, что соединение вызывает стимуляцию двигательной активности, когда его эффект превышает 50% увеличения количества прерываний луча. Следовательно, дозы, определенные как не обладающие стимулирующим эффектом (LMAfree), вызывали менее чем 50% увеличение. Табл. 3 иллюстрирует результаты, полученные для некоторых выбранных соединений, являющихся объектом настоящего изобретения, (верхняя таблица) и для их близких бензилпиперидиновых аналогов(нижняя таблица) в ходе анальгетического теста и теста на двигательную активность. [А = 2-(4-бензилпиперидин-1-ил)-2-оксо-N-(2-оксо-2,3-дигидробензоксазол-6-ил)ацетамид и В = 2-[4-[4-метилбензил) пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидро-1H-индол-5-ил)-ацетамид]. Таким образом, пары 1 - А и 24 - В отличаются только наличием двойной связи вместо одинарной. Таблица 3. Характеризация двух типов антагонистов NR2B в ходе формалинового теста и теста на двигательную активность (LMA test). Вычисление терапевтических индексов (TI) Менее чем 50% считается как отсутствие побочных эффектов. В табл. 4 приведены данные анальгетического теста и теста на двигательную активность для неселективного антагониста рецептора NMDA МК-801 и NR2B селективных антагонистов CI-1041 (Soc Neurosci Abst 2000, 26(Part 2): Abst 527.4.), CP-101,606 и Ro-256981. Таблица 4. Характеризация соответствующих соединений антагонистов NMDA в ходе формалинового теста и теста на двигательную активность (LMA test). Вычисление терапевтических индексов (TI)-6 011241 Можно видеть, что неселективный антагонист рецептора NMDA, MK-801, приводит к увеличению двигательной активности в фармакологически активном диапазоне дозировок. Этот LMA стимулирующий эффект является крайне тяжелым побочным эффектом. Определенные NR2B селективные антагонисты, такие как соответствующее соединение CI-1041, либо бензилпиперидиновые соединения [А = 2-(4 бензил-пиперидин-1-ил)-2-оксо-N-(2-оксо-2,3-дигидробензоксазол-6-ил)-ацетамид и В = 2-[4-[4-метилбензил)-пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидро-1H-индол-5-ил)-ацетамид], описанные в заявкеWO 2003010159, также показывают небольшое различие в дозах, обеспечивающих обезболивание(анальгетический эффект), и дозах, стимулирующих двигательную активность. Удивительно то, что бензилиденпиперидиновые аналоги этих соединений, то есть соединения, являющиеся предметом настоящего изобретения, не вызывают повышенной активности вплоть до очень высоких доз (табл. 3). В то время как терапевтические индексы (TI) протестированных бензилпиперидинов с высокой in vivo эффективностью лежат в пределах от 1 до 8, терапевтические индексы (TI) их бензилиденпиперидиновых аналогов лежат в значительно более высокой области, между 46 и 64, или даже выше. Не ожидалось, что результатом, казалось бы, незначительных структурных изменений окажется такое поразительное различие.NR2B антагонисты с высоким TI могут, в частности, быть полезны при медикаментозном лечении болезней, которые могут быть вылечены антагонистами NR2B. Среди бензилпиперидинов существуют соединения с высокой эффективностью и с высоким терапевтическим индексом на модели продолжительной боли. Соединения, являющиеся объектом настоящего изобретения, обладают намного более подходящими характеристиками, касающимися терапевтического использования, по сравнению с ранее запатентованными соединениями. Расстройства, которые могут быть успешно вылечены антагонистами рецепторов NMDA, действующими по сайтам, содержащим NR2B, как это было недавно описано Loftis [PharmacologyTherapeutics, 97, 55-85(2003)], включают в себя шизофрению, болезнь Паркинсона, болезнь Хантингтона, усиленную цитотоксичность, вызываемую гипоксией и ишемией, припадки, лекарственную зависимость и боль,в особенности невропатическую, воспалительную и внутреннюю боль любой природы [Eur. J.Pharmacol., 429, 71-78(2001). Благодаря малой тяжести их побочных эффектов, по сравнению с неселективными антагонистамиNMDA, NR2B селективные антагонисты могут приносить пользу при тех заболеваниях, при которых могут быть эффективными антагонисты NMDA, таких как боковой амиотрофический склероз (болезнь Шарко) [Neurol. Res., 21, 309-12 (1999)], абстинентные синдромы по причине, например, алкоголя, синтетических наркотических препаратов (опиоидов) или кокаина [Drug and Alcohol Depend., 59, 115.(2000)], мышечные спазмы [Neurosci. Lett., 73, 143-148 (1987)], слабоумие различного происхождения[Expert Opin. Investig. Drags, 9, 1397-406 (2000)], тревога, депрессия, мигрень, гипогликемия, дегенеративные расстройства сетчатки (например, CMV ретинит), глаукома, астма, звон в ушах, потеря слуха[Drug News Perspect 11, 523-569 (1998) и международная заявка на патент WO 00/00197]. Таким образом, эффективные количества соединений, являющихся объектом настоящего изобретения, могут с успехом применяться при лечении травматических повреждений мозга или спинного мозга,толерантности и/или зависимости к лечению болей с применением синтетических наркотических препаратов (опиоидов), абстинентных синдромов лекарственной зависимости, зависимости от, например, алкоголя, синтетических наркотических препаратов (опиоидов) или кокаина, ишемических расстройствах ЦНС, хронических нейродегенеративных расстройствах, таких как, например, болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, болей и хронических болевых состояний, таких как, например,невропатическая боль. Соединения, являющиеся объектом настоящего изобретения, также как и их фармацевтически приемлемые соли, могут использоваться как сами по себе, так и, соответственно, в составе фармацевтических композиций. Данные композиции (лекарства) могут быть в твердой, жидкой, либо полужидкой формах, кроме того, в них могут входить фармацевтические вспомогательные лекарственные вещества и вспомогательные материалы, которые широко используются на практике, такие как носители, формообразующие вещества, разжижители, стабилизаторы, увлажняющие или эмульгирующие агенты, вещества,влияющие на рН- и осмотическое давление, отдушки или ароматизирующие вещества, равно как и активирующие композицию и доставляющие композицию добавки. Дозировка, необходимая для обеспечения терапевтического эффекта, может варьироваться внутри широких пределов и будет оптимизироваться под индивидуальные требования в каждом конкретном случае в зависимости от стадии заболевания, состояния и массы тела нуждающегося в лечении пациента,так же, как и от чувствительности пациента к активному веществу, способа введения и ежедневной частоты приема препарата. Точная доза активного вещества, необходимая и подходящая для применения,может быть безошибочно определена лечащим врачом, опытным в данной области техники и имеющим полную информацию о нуждающемся в лечении пациенте. Фармацевтические композиции, содержащие активное вещество, в соответствии с настоящим изобретением содержат, как правило, от 0,01 до 100 мг активного вещества в единичной лекарственной единице. Само собой возможно, что количество активного вещества в некоторых композициях выходит за верхние либо нижние пределы указанного выше диапазона.-7 011241 Твердые формы фармацевтических композиций могут представлять собой, например, таблетки,драже, капсулы, пилюли или ампулы, содержащие лиофилизированные порошки, пригодные для приготовления инъекций. Жидкие композиции представляют собой пригодные для инъекций и вливаний композиции, жидкие медикаменты, капсулы с жидким содержимым (packing fluids) и капли. Полужидкие композиции могут представлять собой мази, бальзамы, крема, взбалтываемые микстуры и суппозитории. Исходя из соображений удобства применения, является пригодным, если фармацевтические композиции включают в себя дозировочные единицы, содержащие в своем составе такое количество активного вещества, которое пригодно для однократного приема, либо нескольких повторных приемов их половины, трети, либо четвертой части. Такими лекарственными единицами могут являться, например, таблетки, которые могут быть покрыты бороздками, позволяющими разламывать их пополам или на четыре части с целью приема строго необходимого количества активного вещества. Таблетки могут быть покрыты кислоторастворимым слоем, что гарантирует высвобождение содержащегося в таблетке активного вещества после прохождения таблетки через желудок. Такие таблетки являются покрытыми энтеросолюбильной оболочкой. Такой же эффект может быть также достигнут при инкапсулировании активного вещества. Фармацевтические композиции, пригодные для перорального применения, могут содержать, например, лактозу или крахмал в качестве формообразующих веществ, натриевую соль карбоксиметилцеллюлозы, метилцеллюлозу, поливинил пирролидон либо крахмальую пасту в качестве связующих веществ или гранулирующих агентов. Картофельный крахмал или микрокристаллическая целлюлоза добавляются как дезинтегрирующие агенты, но также могут добавляться ультраамилопектин либо формальдегидказеин. Тальк, коллоидная кремниевая кислота, стеарин, стеараты кальция или магния могут применяться в качестве антиадгезивных и смазывающих веществ. Таблетки могут быть изготовлены, например, посредством влажного гранулирования с последующим спрессовыванием. Смешанные активные вещества и наполнители, так же как и, в данном случае,часть дезинтегрирующих веществ, подвергаются гранулированию с применением водного, спиртового,либо водно-спиртового раствора связующих веществ, с использованием соответствующего оборудования, после чего гранулят подвергается высушиванию. К высушенному грануляту добавляются другие дезинтегрирующие вещества, смазывающие вещества и антиадгезивные агенты, после чего смесь спрессовывается в таблетку. В данном случае таблетки изготавливаются с бороздкой посередине, что облегчает прием препарата. Таблетки могут быть изготовлены непосредственно из смеси активного вещества и подходящих вспомогательных веществ путем спрессовывания. В данном случае, таблетки могут покрываться дополнительными веществами, широко применяющимися в фармакологической практике, такими как, например, стабилизаторы, ароматизаторы, красители, такие как сахар, производные целлюлозы (метил- или этилцеллюлоза, натриевая соль карбоксиметилцеллюлозы, и т.д.), поливинилпирролидон, фосфат кальция, карбонат кальция, пищевые красители, пищевые добавки, ароматизирующие вещества, пигменты на основе окиси железа, и т.д. В случае капсул, смесь активного вещества и вспомогательных веществ заключается внутрь капсул. Жидкие композиции, предназначенные для перорального применения, такие как, например, суспензии, сиропы, эликсиры могут приготавливаться с применением воды, гликолей, масел, спиртов, красителей и ароматизирующих веществ. Композиции, предназначенные для ректального применения, изготавливаются в виде суппозиториев или растворов для клизм. Суппозитории, помимо активного вещества, могут содержать в своем составе носитель, так называемые основы для суппозиториев (adeps pro suppository). Носителями могут являться растительные масла, такие как гидрированные растительные масла, триглицериды С 12-С 18 жирных кислот (предпочтительно носители, имеющие торговое название Witepsol). Активное вещество гомогенно смешивается с измельченной основой для суппозиториев, после чего формуются суппозитории. Композиция, предназначенная для парентерального применения, приготовлена в виде раствора для инъекций. Для приготовления раствора для инъекций активные вещества растворяются в дистиллированной воде и/или в различных органических растворителях, таких как гликолиевые эфиры, в данном случае, в присутствии солюбилизаторов, таких как, например полиоксиэтиленсорбитан-монолаурат, моноолеат, либо моностеарат (Tween 20, Tween 60, Tween 80). Раствор для инъекций может также содержать различные вспомогательные вещества, такие как консервирующие агенты, например этилендиаминтетраацетат, так же как и рН регулирующие агенты и буферы, и, в данном случае, местное анестезирующее вещество, такое как, например, лидокаин. Раствор для инъекций, содержащий активное вещество, являющееся объектом настоящего изобретения, перед заключением в ампулы подвергается фильтрованию и стерилизуется после заключения в ампулу. Если активное вещество является гигроскопическим, в таком случае оно может быть стабилизировано посредством лиофилизации. Характеристический метод Соединения, являющиеся объектом настоящего изобретения, были охарактеризованы с применением высокоэффективной жидкостной хроматографии, совмещенной с масс-селективным детектором (massselective detector) (LC/MS) с использованием HP 1100 бинарно-градиентной хроматографической системы с устройством отбора проб из микропланшета (Agilent, Waldbronn), управляемой компьютерной программой ChemStation software. HP диодный лучевой детектор (diode array detector) использовался для регистрации ультрафиолетовых (UV) спектров при 225 и 240 нм. Все эксперименты были проведены с использованием HP MSD (Agilent, Waldbronn) однолучевого четырехканального спектрометра (singlequadruple spectrometer), оборудованного источником для электрорассеивающей ионизации (electrosprayionization source) для установления структуры. Синтезированные продукты были растворены в 1 мл DMSO (Aldrich, Germany). 100 мкл каждого раствора было разбавлено DMSO до объема 1000 мкл. Эксперименты по аналитической хроматографии были произведены на колонке Discovery RP С-16 Amide, 5 см 4,6 мм 5 мкм фирмы Supelco (Bellefonte, Pennsylvania) при скорости потока, равной 1 мл/минуту для хорошего разрешения. Полученные соединения были охарактеризованы по величине их k' фактора (чистота, коэффициент емкости). Факторы k' вычислялись в соответствии со следующей формулой: где k'= коэффициент емкости, tR = время удержания и t0 = время удержания элюента. В качестве элюента А использовалась трифторацетиловая кислота (TFA) (Sigma, Germany), содержащая 0,1% воды, в качестве элюента В использовался 95% ацетонитрил (Merck, Germany), содержащий 0,1% TFA и 5% элюента А. Использовалась градиентная элюция, начинавшаяся со 100% элюента А и продолжавшаяся до 100% элюента В, длившаяся в течение 5 мин. Нижеследующие примеры иллюстрируют настоящее изобретение, никоим образом его не ограничивая. Пример 1. 2-(4-Бензилиденпиперидин-1-ил)-2-оксо-N-(2-оксо-2,3-дигидробензооксазол-6-ил)-ацетамид. 1 а) 1-Бензил-4-бензилиденпиперидин. В атмосфере аргона, к перемешиваемому раствору 133,2 г (704 ммоль) N-бензил-4-пиперидона (Aldrich) и 161 г (705 ммоль) диэтилового эфира бензилфосфоновой кислоты (Aldrich) в 1350 мл диметилформамида при 0 С добавляется 40,5 г (60%, 37,5 ммоль) гидрида натрия. Реакционная смесь перемешивается в течение 2 ч при 20 С, затем в нее по каплям добавляется 100 мл этилового спирта, смесь выливается в 1500 мл воды и экстрагируется диэтиловым эфиром. Органический слой высушивается над сульфатом натрия и концентрируется. Неочищенный продукт используется на следующей стадии. Точка плавления: масло. 1b) 4-Бензилиденпиперидин гидрохлорид. К перемешиваемому раствору ранее полученного неочищенного 1-бензил-4-бензилиденпиперидина(704 ммоль) в 2 л дихлорэтана при 0 С по каплям добавляется 80 мл (741 ммоль) 1-хлорэтилхлороформата. Реакционная смесь перемешивается при 0 С в течение 1 ч и подвергают перегонке с обратным холодильником в течение 1 ч, после чего смесь концентрируется и осадок растворяется в 1 л метанола, подвергшегося перегонке с обратным холодильником в течение 1 ч. Реакционная смесь концентрируется и осадок выкристаллизовывается в присутствии ацетона до достижения выхода, соответствующего 103,25 г (70,1%) титульного соединения. Точка плавления: 186 С (ацетон). 1 с) этиловый эфир (4-бензилиденпиперидин-1-ил)оксоуксусной кислоты. К перемешиваемому раствору 103,25 г (0,492 моль) 4-бензилиденпиперидин гидрохлорида и 144,55 мл (1,039 моль) триэтиламина в 1 л хлороформа при температуре ниже 10 С по каплям добавляется 55,75 мл (0,499 моль) этилоксалилхлорида и реакционная смесь перемешивается в течение 1 ч при комнатной температуре. Затем к смеси добавляется 200 мл воды и 200 мл 8% раствора гидрокарбоната натрия, органический слой отделяется, высушивается над сульфатом натрия и концентрируется. Неочищенный продукт используется на следующей стадии. Точка плавления: масло. 1d) (4-Бензилиденпиперидин-1-ил)оксоуксусная кислота. К перемешиваемому раствору ранее полученного неочищенного этилового эфира (4-бензилиденпиперидин-1-ил)оксоуксусной кислоты (0,492 моль) в 200 мл этилового спирта добавляется раствор 27,6 г (0,69 моль) гидроксида натрия в 300 мл воды и 500 мл этилового спирта. Реакционная смесь перемешивается в течение 1 ч при комнатной температуре, после чего охлаждается и подкисляется хлористоводородной кислотой. Твердый осадок собирается, промывается водой до достижения выхода, соответствующего 107,32 г (88,9%) титульного соединения. Точка плавления: 125 С (этанол-вода). 1 е) 2-(4-Бензилиденпиперидин-1-ил)-2-оксо-N-(2-оксо-2,3-дигидробензооксазол-6-ил)ацетамид. Смесь, состоящая из 49 мг (0,2 ммоль) (4-бензилиденпиперидин-1-ил)оксоуксусной кислоты, 33 мкл(0,24 ммоль)триэтиламина, 30 мг (0,2 ммоль) 6-амино-3 Н-бензоксазол-2-она [J. Chem. Soc, 321. (1938)],79,6 мг (0,21 ммоль) HBTU [0-бензотриазол-1-ил-N,N,N',N'-тетраметилурониумгексафторфосфата (Advanced Chem. Tech.)] и 1 мл диметилформамида перемешивается в течение 24 ч при комнатной температуре. Реакционная смесь очищается с помощью хроматографии на колонке с использованием Kieselgel 60(Merck) в качестве абсорбента и смеси толуол:метиловый спирт = 4:1 в качестве элюента. Качество и количество продукта определяются с использованием метода высокоэффективной жидкостной хромато-9 011241 графии совмещенной с масс-селекцией (HPLC-MS method), как это было описано выше, k' = 9,66. Применяя описанную выше процедуру, авторы синтезировали следующие соединения, соответствующие формуле (I) Пример 2. Приготовление фармацевтических композиций. а) Таблетки. 0,01-50% активного вещества, соответствующего формуле (I), 15-50% лактозы, 15-50% картофельного крахмала, 5-15% поливинил пирролидона, 1-5% талька, 0,01-3% стеарата магния, 1-3% коллоидной двуокиси кремния и 2-7% ультраамилопектина смешивается, после чего гранулируется методом мокрого гранулирования и спрессовывается в таблетки.b) Драже, таблетки с пленочным покрытием. Таблетки, изготовленные описанным выше способом, покрываются слоем, состоящим из энтеролибо гастросолюбильной пленки, либо из сахара и талька. Драже натираются смесью воска с карнаубским воском.c) Капсулы. 0,01-50% активного вещества, соответствующего формуле (I), 1-5% лаурилсульфата натрия, 15-50% крахмала, 15-50% лактозы, 1-3% коллоидной двуокиси кремния и 0,01-3% стеарата магния тщательно перемешиваются, смесь пропускается сквозь сито и заключается внутри капсул из твердого желатина.d) Суспензии. Ингредиенты: 0,01-15% активного вещества, соответствующего формуле (I), 0,1-2% гидроксида натрия, 0,1-3% лимонной кислоты, 0,05-0,2% нипагина (метил 4-гидроксибензоата натрия), 0,005-0,02% нипазола, 0,01-0,5% карбопола (полиакрилата), 0,1-5% 96% этанола, 0,1-1% ароматизирующего агента,20-70% сорбитола (70% водный раствор) и 30-50% дистиллированной воды. К раствору нипагина и лимонной кислоты в 20 мл дистиллированной воды, в малых количествах при сильном перемешивании добавляется карбопол и раствор оставляется для отстаивания на 10-12 ч. Затем, при перемешивании, добавляются гидроксид натрия в 1 мл дистиллированной воды, водный раствор сорбитола и, в последнюю очередь, малиновый ароматизатор на основе этилового спирта. К данному носителю в малых количествах добавляется активное вещество, после чего суспендируется при по- 13011241 мощи погружающегося гомогенизатора. В конце, суспензия доводится дистиллированной водой до желательного финального объема и суспензионный раствор пропускается сквозь оборудование типа коллоидной мельницы.e) Суппозитории. Для изготовления каждого суппозитория тщательно перемешивается 0,01-15% активного вещества,соответствующего формуле (I), и 1-20% лактозы, после чего измельчается 50-95% основа для суппозиториев (adeps pro suppository) (например, Witepsol 4), охлаждается до 35 С и смесь активного вещества и лактозы смешивается с применением гомогенизатора. Полученная смесь отливается в охлажденные формы.f) Композиции в виде лиофилизированного порошка, заключенного в ампулу: приготавливается 5% раствор маннитола или лактозы на бидистиллированной воде, предназначенной для применения при инъекциях, после чего данный раствор фильтруется для получения стерильного раствора. 0,01-5% раствор активного вещества, соответствующего формуле (I), также приготавливается на бидистиллированной воде, предназначенной для использования при инъекциях, после чего данный раствор фильтруется для получения стерильного раствора. Два данных раствора смешиваются в стерильных условиях, помещаются в ампулы в аликвотах, равных 1 мл, содержимое ампул лиофилизируется и ампулы запаиваются в атмосфере азота. Перед введением пациенту содержимое ампул растворяется стерильной водой или 0,9%(физиологическим) стерильным водным раствором хлорида натрия. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Производные 4-бензилиденпиперидина, соответствующие формуле (I) в которой значение X и Y независимо соответствуют водороду, С 1-С 4 алкилсульфонамидо или C1-C4 алканоиламидо; либо соседние X и Y группы вместе с одним либо более идентичным или отличным дополнительным гетероатомом и -СН= и/или -CH2-группами могут сформировать 5-6-членное гетероциклическое кольцо,предпочтительно морфолиновое, оксопирролидиновое, оксоимидазолидиновое, оксо- или тиоксооксазолидиновое, оксотиазолидиновое кольцо;Z соответствует водороду, атому галогена С 1-С 4 алкильной или С 1-С 4 алкоксигруппе,а также их оптические изомеры, рацемические соединения и соли. 2. Соединение по п.1, выбранное из группы производных 4-бензилиденпиперидина,2-(4-бензилиденпиперидин-1-ил)-2-оксо-N-(2-оксо-2,3-дигидробензооксазол-6-ил)ацетамид,2-(4-бензилиденпиперидин-1-ил)-2-оксо-N-(2-оксо-2,3-дигидробензотиазол-6-ил)ацетамид,2-[4-(4-хлорбензилиден)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензооксазол-6-ил)ацетамид,2-[4-(4-хлорбензилиден)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензоимидазол-5 ил)ацетамид,2-[4-(4-хлорбензилиден)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензотиазол-6-ил)ацетамид,2-[4-(4-метилбензилиден)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензоимидазол-5 ил)ацетамид,2-[4-(4-метилбензилиден)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензотиазол-6 ил)ацетамид,2-[4-(4-метилбензилиден)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензотиазол-6 ил)ацетамид,2-[4-(4-метоксибензилиден)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензоимидазол-5 ил)ацетамид,2-[4-(4-метоксибензилиден)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензотиазол-6 ил)ацетамид,N-(4-метансульфониламинофенил)-2-[4-(4-метоксибензилиден)пиперидин-1-ил]-2-оксоацетамид,2-[4-(4-фторбензилиден)пиперидин-1-ил]-2-оксо-N-(2-оксо-2,3-дигидробензооксазол-6-ил)ацетамид и их оптические изомеры, рацемические соединения и соли. 3. Фармацевтическая композиция, содержащая в своем составе эффективное количество производных 4-бензилиденпиперидина, соответствующих формуле (I), в которой значения X, Y, Z определены в п.1, либо их соли в качестве активных веществ и вспомогательные вещества, широко применяемые в фармацевтической практике, такие как носители, формообразующие вещества, растворители, стабилизаторы, смачивающие либо эмульгирующие агенты, вещества, влияющие на рН- и осмотическое давление,отдушки или ароматизирующие вещества, равно как и активирующие композицию и доставляющие композицию добавки. 4. Способ получения производных 4-бензилиденпиперидина, соответствующих формуле (I), в кото- 14011241 рой значения X, Y, Z определены в п.1, характеризующийся реакцией вторичного амина, соответствующего формуле (II) где Z имеет то же значение, которое определено в случае формулы (I), с этилоксалилхлоридом в соответствующем подходящем растворителе в присутствии основания, омылением сложноэфирного соединения, соответствующее формуле (III) где Z имеет то же значение, которое определено в случае формулы (I), под действием щелочной гидроокиси и реакцией полученной оксаламидной кислоты, соответствующей формуле (IV) в которой Z имеет то же значение, которое определено в случае формулы (I), или ее химически активного производного, с анилином, соответствующим формуле (V) в которой значения X и Y соответствуют тем значениям, которые были определены ранее в случае формулы (I), в дихлорметане,с последующей при необходимости трансформацией полученных производных 4 бензилиденпиперидина, соответствующих формуле (I), в которых значения X, Y, Z соответствуют тем значениям, которые были определены в п.1, в другие соединения, соответствующие формуле (I), посредством введения новых замещающих групп, и/или модификации, или удаления групп, присутствующих изначально, и/или посредством образования соли, и/или выделения соединений, соответствующих формуле (I) из состава солей с применением известных методов. 5. Способ по п.4, характеризующийся реакцией активного производного карбоновой кислоты, соответствующего формуле (IV), в которой Z имеет то же значение, которое определено в п.1, с анилином,соответствующим формуле (V), в которой значения X и Y соответствуют тем значениям, которые были определены в п.1, в присутствии основания. 6. Способ по п.4, характеризующийся реакцией карбоновой кислоты, соответствующей формуле(IV), в которой Z имеет то же значение, которое определено в п.1 (I), с анилином, соответствующим формуле (V), в которой значения X и Y соответствуют тем значениям, которые были определены в п.1, в присутствии триэтиламина и O-бензотриазол-1-ил-N,N,N',N'-тетраметилурониумгексафторфосфата(HBTU) в диметилформамиде. 7. Способ производства фармацевтических композиций, обладающих эффектом NR2B селективного антагониста рецептора NMDA, характеризующийся смешиванием производных 4-бензилиденпиперидина, соответствующих формуле (I), в которой значения X, Y, Z определены в п.1, их оптических изомеров, рацемических соединений, либо их фармацевтически приемлемых солей в качестве активных веществ, и вспомогательных веществ, широко применяемых в фармацевтической практике, таких как носителей, формообразующих веществ, растворителей, стабилизаторов, смачивающих либо эмульгирующих агентов, веществ, влияющих на рН- и осмотическое давление, отдушки или ароматизирующих веществ, равно как и активирующих композицию и доставляющих композицию добавок. 8. Способ лечения и смягчения симптомов следующих заболеваний млекопитающих, включая человека, таких как травматические повреждения мозга или спинного мозга, нервные повреждения, связанные с вирусом иммунодефицита человека, боковой амиотрофический склероз (болезнь Шарко), толерантность и/или зависимость к лечению болей с применением синтетических наркотических препаратов(опиоидов), абстинентные синдромы по причине, например, алкоголя, синтетических наркотических препаратов (опиоидов) или кокаина, ишемических расстройствах ЦНС, таких как, например, болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, болей и хронических болевых состояний, таких как, например, невропатическая боль, или боль, связанная с раковым заболеванием, эпилепсия, тревога, депрессия, мигрень, психоз, мышечные спазмы, слабоумие различного происхождения, гипогликемия, дегенеративные расстройства сетчатки, глаукома, астма, звон в ушах, потеря слуха, вызванная применением аминогликозидных антибиотиков, характеризующийся введением нуждающимся в лечении млекопитающим эффективного количества/количеств производного 4-бензилиденпиперидина, соответствующего формуле (I), в которой значения X, Y, Z определены в п.1, его оптических изомеров, рацеми- 15011241 ческих соединений, либо его фармацевтически приемлемых солей как самих по себе, так и в комбинации с носителями, наполнителями и тому подобным, традиционно применяемыми в фармацевтической практике. 9. Применение производного 4-бензилиденпиперидина, соответствующего формуле (I), в которой значения X, Y, Z определены в п.1, его оптических изомеров, рацемических соединений, либо его фармацевтически приемлемых солей для производства фармацевтических композиций, предназначенных для лечения и смягчения симптомов следующих заболеваний млекопитающих, включая человека, таких как травматические повреждения мозга или спинного мозга, нервные повреждения, связанные с вирусом иммунодефицита человека, боковой амиотрофический склероз (болезнь Шарко), толерантность и/или зависимость к лечению болей с применением синтетических наркотических препаратов (опиоидов), абстинентные синдромы по причине, например, алкоголя, синтетических наркотических препаратов (опиоидов) или кокаина, ишемических расстройствах ЦНС, таких как, например, болезнь Альцгеймера, болезнь Паркинсона, болезнь Хантингтона, болей и хронических болевых состояний, таких как, например,невропатическая боль, или боль, связанная с раковым заболеванием, эпилепсия, тревога, депрессия, мигрень, психоз, мышечные спазмы, слабоумие различного происхождения, гипогликемия, дегенеративные расстройства сетчатки, глаукома, астма, звон в ушах, потеря слуха, вызванная применением аминогликозидных антибиотиков.
МПК / Метки
МПК: A61P 25/28, C07D 413/12, A61K 31/445, C07D 417/12, C07D 401/12
Метки: новые, 4-бензилиденпиперидина, производные
Код ссылки
<a href="https://eas.patents.su/17-11241-novye-proizvodnye-4-benzilidenpiperidina.html" rel="bookmark" title="База патентов Евразийского Союза">Новые производные 4-бензилиденпиперидина</a>
Следующий патент: Производные имидазола
Случайный патент: Способ обезболивания












