Производные глюкопиранозилоксибензилбензола и содержащие их лекарственные композиции
Номер патента: 5994
Опубликовано: 25.08.2005
Авторы: Нисимура Тосихиро, Татани Казуйа, Исадзи Масайуки, Фудзикура Хидеки, Фусими Нобухико
Формула / Реферат
1. Производное глюкопиранозилоксибензилбензола, представленное общей формулой

где P представляет собой C2-7ацильную группу, C2-7ацильную группу, замещенную C1-6алкоксигруппой, C2-7ацильную группу, замещенную C2-7алкоксикарбонильной группой, C2-7алкоксикарбонильную группу или C2-7алкоксикарбонильную группу, замещенную C1-6алкоксигруппой, и
R представляет собой C1-6алкильную группу, C1-6алкоксигруппу, C1-6алкилтиогруппу, C1-6алкильную группу, замещенную C1-6алкоксигруппой, C1-6алкоксигруппу, замещенную C1-6алкоксигруппой, или C1-6алкилтиогруппу, замещенную C1-6 алкоксигруппой.
2. Производное глюкопиранозилоксибензилбензола по п.1, представленное общей формулой
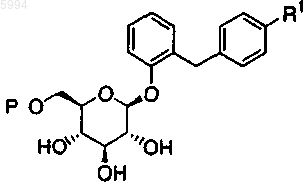
где R1 представляет собой C1-6алкильную группу или C1-6алкоксигруппу и
P представляет собой C2-7ацильную группу, C2-7ацильную группу, замещенную C1-6алкоксигруппой, C2-7ацильную группу, замещенную C2-7алкоксикарбонильной группой, C2-7алкоксикарбонильную группу или C2-7алкоксикарбонильную группу, замещенную C1-6алкоксигруппой.
3. Производное глюкопиранозилоксибензилбензола по п.1, представленное общей формулой
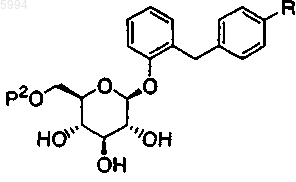
где R представляет собой C1-6алкильную группу, C1-6алкоксигруппу, C1-6алкилтиогруппу, C1-6алкильную группу, замещенную C1-6алкоксигруппой, C1-6алкоксигруппу, замещенную C1-6алкоксигруппой, или C1-6алкилтиогруппу, замещенную C1-6алкоксигруппой, и
P2 представляет собой C2-7ацильную группу или C2-7алкоксикарбонильную группу.
4. Производное глюкопиранозилоксибензилбензола по п.2 или 3, представленное общей формулой
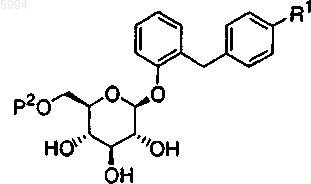
где R1 представляет собой C1-6алкильную группу или C1-6алкоксигруппу и
P2 представляет собой C2-7ацильную группу или C2-7алкоксикарбонильную группу.
5. Производное глюкопиранозилоксибензилбензола по п.4, представленное общей формулой
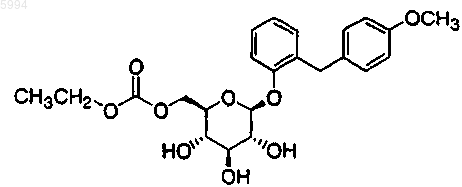
6. Производное глюкопиранозилоксибензилбензола по п.4, представленное общей формулой
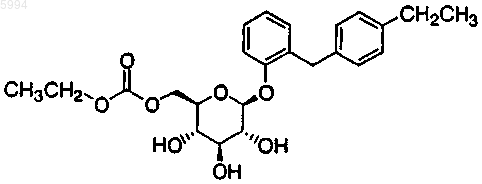
7. Фармацевтическая композиция, включающая в качестве активного ингредиента производное глюкопиранозилоксибензилбензола по пп.1-6.
8. Фармацевтическая композиция по п.7, где композиция является ингибитором SGLT2 (Na+/глюкозы котранспортера 2) человека.
9. Фармацевтическая композиция по п.8, где композиция является средством для предупреждения или лечения заболевания, связанного с гипергликемией.
10. Фармацевтическая композиция по п.9, где заболеванием, связанным с гипергликемией, является сахарный диабет или осложнения сахарного диабета.
11. Фармацевтическая композиция по п.9, где заболеванием, связанным с гипергликемией, является ожирение.
12. Фармацевтическая композиция по пп.7-11, где композиция представлена в форме для перорального применения.
13. Способ предупреждения или лечения заболевания, связанного с гипергликемией, включающий введение терапевтически эффективного количества производного глюкопиранозилоксибензилбензола по пп.1-6.
14. Применение производного глюкопиранозилоксибензилбензола по пп.1-6 для изготовления фармацевтической композиции для предупреждения или лечения заболевания, связанного с гипергликемией.
Текст
005994 Область техники Настоящее изобретение относится к производным глюкопиранозилоксибензилбензола, которые применяются в качестве лекарственных средств, и к содержащим их фармацевтическим композициям. Более конкретно, настоящее изобретение относится к производным глюкопиранозилоксибензилбензола, которые применяются в качестве средств для профилактики или лечения заболевания, связанного с гипергликемией, такого как сахарный диабет, осложнений сахарного диабета или ожирения, представленным общей формулойC1-6 алкоксигруппой,из которых производные глюкопиранозилоксибензилбензола, обладающие ингибирующей активностью по отношению к SGLT2 человека, представленные общей формулой где R представляет собой C1-6 алкильную группу, C1-6 алкоксигруппу, C1-6 алкилтиогруппу, C1-6 ал-кильную группу, замещенную C1-6 алкоксигруппой, C1-6 алкоксигруппу, замещенную C1-6 алкоксигруппой, или C1-6 алкилтиогруппу, замещенную C1-6 алкоксигруппой, являются активными формами, и относятся к содержащим их фармацевтическим композициям. Предпосылки изобретения Сахарный диабет является одним из заболеваний, связанных с образом жизни с предпосылками в виде неправильного питания и недостаточной физической активности. Следовательно, для лечения больных сахарным диабетом применяют диету и физические упражнения. Более того, в том случае если достаточный контроль за ним и непрерывный эффект затруднен, одновременно проводится медикаментозное лечение. В настоящее время в качестве противодиабетических средств применяются бигуаниды,сульфонилмочевины и средства для снижения резистентности к инсулину. Однако для бигуанидов и сульфонилмочевин изредка наблюдаются побочные эффекты, такие как молочнокислый ацидоз и гипогликемия, соответственно. В случае применения средств для снижения резистентности к инсулину изредка наблюдаются побочные эффекты, такие как отеки, и это также приводит к усилению ожирения. Поэтому для решения этих проблем требовалось разработать противодиабетические средства с новым механизмом действия. В последние годы велась активная разработка нового типа противодиабетических средств, усиливающих выведение глюкозы с мочой и снижающих содержание глюкозы в крови путем предотвращения реабсорбции избытка глюкозы в почках (J.Clin.Invest., Vol.79, pp.1510-1515 (1987. Дополнительно сообщалось, что в сегменте S1 проксимальных почечных канальцев содержится SGLT2 (котранспортерNа+/глюкозы 2), участвующий главным образом в реабсорбции отфильтрованной клубочком глюкозы(J. Clin. Invest., Vol.93, pp.397-404 (1994. Соответственно, ингибирование активности SGLT2 человека предотвращает реабсорбцию избытка глюкозы в почках, впоследствии усиливая выведение избытка глюкозы с мочой и нормализуя содержание глюкозы в крови. Поэтому требовалась быстрая разработка противодиабетических средств, обладающих высокой ингибирующей активностью по отношению к SGLT2 человека и действующих по новому механизму. Кроме того, поскольку такие агенты способствуют выведению избытка глюкозы с мочой и, следовательно, снижению накопления глюкозы в организме, также предполагается их профилактическая активность при ожирении. Раскрытие изобретения Авторы настоящего изобретения настойчиво занимались изысканием соединений, обладающих ингибирующей активностью по отношению к SGLT2 человека. В результате было показано, что соединения, представленные выше общей формулой I, превращаются in vivo в их активные формы, производные глюкопиранозилоксибензилбензола, представленные выше общей формулой II, и обладают, как упомя-1 005994 нуто ниже, отличной ингибирующей активностью по отношению к SGLT2 человека, образуя тем самым основу настоящего изобретения. Настоящее изобретение относится к следующим производным глюкопиранозилоксибензилбензола,обладающим ингибирующей активностью по отношению к SGLT2 человека in vivo и обладающим отличным гипогликемическим эффектом за счет выведения избытка глюкозы с мочой путем предотвращения реабсорбции глюкозы в почках, и к содержащим их фармацевтическим композициям. Таким образом, настоящее изобретение относится к производному глюкопиранозилоксибензилбензола, представленному общей формулойC1-6 алкилтиогруппу, замещенную C1-6 алкоксигруппой. Настоящее изобретение относится к фармацевтической композиции, включающей в качестве активного ингредиента производное глюкопиранозилоксибензилбензола, представленное выше общей формулой I. Настоящее изобретение относится к ингибитору SGLT2 человека, включающему в качестве активного ингредиента производное глюкопиранозилоксибензилбензола, представленное выше общей формулой I. Настоящее изобретение относится к средству для профилактики или лечения заболевания, связанного с гипергликемией, включающему в качестве активного ингредиента производное глюкопиранозилоксибензилбензола, представленное выше общей формулой I. Настоящее изобретение относится к способу профилактики или лечения заболевания, связанного с гипергликемией, включающему введение терапевтически эффективного количества производного глюкопиранозилоксибензилбензола, представленного выше общей формулой I. Настоящее изобретение относится к применению производного глюкопиранозилоксибензилбензола, представленного выше общей формулой I, для производства фармацевтической композиции для профилактики или лечения заболевания, связанного с гипергликемией. В настоящем изобретении термин "пролекарство" означает соединение, которое превращается в производное глюкопиранозилоксибензилбензола, представленное выше общей формулой II, в качестве его активной формы in vivo. В качестве примеров групп, образующих пролекарства, представлены обычно применяемые в качестве пролекарства гидроксизащитные группы, такие как С 2-7 ацильная группа, С 2-7 ацильная группа, замещенная C1-6 алкоксигруппой, С 2-7 ацильная группа, замещенная С 2-7 алкоксикарбонильной группой, С 2-7 алкоксикарбонильная группа или С 2-7 алкоксикарбонильная группа, замещенная C1-6 алкоксигруппой. Также в настоящем изобретении термин "C1-6 алкильная группа" означает содержащую от 1 до 6 атомов углерода алкильную группу с неразветвленной или разветвленной цепью, такую как метильную группу, этильную группу, пропильную группу, изопропильную группу, бутильную группу, изобутильную группу, втор-бутильную группу, трет-бутильную группу, пентильную группу, изопентильную группу, неопентильную группу, трет-пентильную группу, гексильную группу и тому подобное; термин "C1-6 алкоксигруппа" означает содержащую от 1 до 6 атомов углерода алкоксигруппу с неразветвленной или разветвленной цепью, такую как метоксигруппу, этоксигруппу, пропоксигруппу, изопропоксигруппу,бутоксигруппу, изобутоксигруппу, втор-бутоксигруппу, трет-бутоксигруппу, пентилоксигруппу, изопентилоксигруппу, неопентилоксигруппу, трет-пентилоксигруппу, гексилоксигруппу и тому подобное; и термин "C1-6 алкилтиогруппа" означает содержащую от 1 до 6 атомов углерода алкилтиогруппу с неразветвленной или разветвленной цепью, такую как метилтиогруппу, этилтиогруппу, пропилтиогруппу,изопропилтиогруппу, бутилтиогруппу, изобутилтиогруппу, втор-бутилтиогруппу, трет-бутилтиогруппу,пентилтиогруппу, изопентилтиогруппу, неопентилтиогруппу, трет-пентилтиогруппу, гексилтиогруппу, и тому подобное. Термин "C1-6 алкильная группа, замещенная C1-6 алкоксигруппой" означает указанную выше C1-6 лкильную группу, замещенную указанной выше C1-6 алкоксигруппой; термин "C1-6 алкоксигруппа, замещенная C1-6 алкоксигруппой" означает указанную выше C1-6 алкоксигруппу, замещенную указанной выше C1-6 алкоксигруппой; и термин "C1-6 алкилтиогруппа, замещенная C1-6 алкоксигруппой" означает указанную выше C1-6 алкилтиогруппу, замещенную указанной выше C1-6 алкоксигруппой. Термин"С 2-7 ацильная группа" означает содержащую от 2 до 7 атомов углерода ацильную группу с неразветвленной, разветвленной цепью или циклическую ацильную группу, такую как ацетильную группу, пропионильную группу, бутирильную группу, изобутирильную группу, пивалоильную группу, гексаноильную группу и циклогексилкарбонильную группу; и термин "С 2-7 ацильная группа, замещенная C1-6 алкоксигруппой", означает указанную выше С 2-7 ацильную группу, замещенную указанной выше C1-6 алкоксигруппой. Термин "С 2-7 алкоксикарбонильная группа" означает содержащую от 2 до 7 атомов углерода алкоксикарбонильную группу с неразветвленной, разветвленной цепью или циклическую алкоксикарбонильную группу, такую как метоксикарбонильная группа, этоксикарбонильная группа, изопропилоксикарбонильная группа, изобутилоксикарбонильная группа и циклогексилоксикарбонильная группа; термин "С 2-7 ацильная группа, замещенная С 2-7 алкоксикарбонильной группой", означает указанную выше С 2-7 ацильную группу, замещенную указанной выше С 2-7 алкоксикарбонильной группой, такой как 3-(этоксикарбонил)пропионильная группа; и термин "С 2-7 алкоксикарбонильная группа, замещенная C1-6 алкоксигруппой", означает указанную С 2-7 алкоксикарбонильную группу, замещенную указанной выше C1-6 алкоксигруппой, такой как 2-метоксиэтоксикарбонильной группой. В заместителе R предпочтительными являются C1-6 алкильная группа и C1-6 алкоксигруппа, более предпочтительными являются содержащая от 1 до 4 атомов углерода алкильная группа с неразветвленной или разветвленной цепью и содержащая от 1 до 3 атомов углерода алкоксигруппа с неразветвленной или разветвленной цепью и наиболее предпочтительными являются этильная группа и метоксигруппа. В заместителе Р предпочтительными являются С 2-7 ацильная группа и С 2-7 алкоксикарбонильная группа. В качестве С 2-7 ацильной группы предпочтительной является содержащая от 4 до 6 атомов углерода ацильная группа с неразветвленной или разветвленной цепью и более предпочтительными являются бутирильная группа и гексаноильная группа. В качестве С 2-7 алкоксикарбонильной группы предпочтительной является содержащая от 2 до 5 атомов углерода алкоксикарбонильная группа с неразветвленной или разветвленной цепью и более предпочтительными являются метоксикарбонильная группа и этоксикарбонильная группа. Соединения по настоящему изобретению могут быть получены путем введения обычным способом гидроксизащитной группы, пригодной для обычного применения в пролекарствах, в гидроксигруппу производного глюкопиранозилоксибензилбензола, представленного выше общей формулой II. Например,соединения по настоящему изобретению, представленные выше общей формулой I, могут быть получены с применением производного глюкопиранозилоксибензилбензола, представленного выше общей формулой II, в соответствие со следующей методикой где X представляет собой уходящую группу, такую как атом брома и атом хлора; и R и Р имеют те же самые значения, что и указанные выше. Пролекарство, представленное выше общей формулой I, может быть получено путем защиты гидроксигруппы производного глюкопиранозилоксибензилбензола, представленного выше общей формулойII, защитным реагентом, представленным выше общей формулой III, в присутствие основания, такого как пиридин, триэтиламин, N,N-диизопропилэтиламин, пиколин, лутидин, коллидин, хинуклидин, 1,2,2,6,6 пентаметилпиперидин или 1,4-диазабицикло[2.2.2]октан, в инертном растворителе или в отсутствие любого растворителя. В качестве примеров применяемых растворителей могут быть представлены дихлорметан, ацетонитрил, этилацетат, диизопропиловый эфир, хлороформ, тетрагидрофуран, 1,2 диметоксиэтан, 1,4-диоксан, ацетон, трет-бутанол, смесь этих растворителей и тому подобное. Температура реакции обычно составляет от -40 С до температуры перегонки, а время реакции обычно составляет от 30 мин до 2 суток в зависимости от применяемых исходных материалов, растворителя и температуры реакции. Например, соединения по настоящему изобретению, представленные выше общей формулой II,применяемые в качестве сырья в упомянутом выше способе получения, могут быть получены в соответствие со следующей методикой где М представляет собой гидроксизащитную группу; X представляет собой уходящую группу, такую как трихлорацетоимидоилоксигруппу, ацетоксигруппу, атом брома или атом фтора; один из Y и Z представляет собой MgBr, MgCl, Mgl или атом лития, тогда как другие представляют собой формильную группу; и R имеет те же самые значения, что и указанные выше. Процесс 1. Соединение, представленное выше общей формулой VI, может быть получено путем конденсирования производного бензальдегида, представленного выше общей формулой IV, с реактивом Гриньяра или с литиевым реагентом, представленным выше общей формулой V, или путем конденсирования реактива Гриньяра или литиевого реагента, представленного выше общей формулой IV, с производным бензальдегида, представленным выше общей формулой V, в инертном растворителе. В качестве примеров применяемых растворителей могут быть представлены тетрагидрофуран, диэтиловый эфир, смесь этих растворителей и тому подобное. Температура реакции обычно составляет от -78 С до температуры перегонки, а время реакции обычно составляет от 10 мин до 1 суток, в зависимости от применяемого сырья,растворителя и температуры реакции. Процесс 2. Соединение, представленное выше общей формулой VII, может быть получено путем окисления соединения, представленного выше общей формулой VI, с применением реактива Десса-Мартина в инертном растворителе. В качестве примеров применяемых растворителей могут быть представлены дихлорметан, хлороформ, ацетонитрил, смесь этих растворителей и тому подобное. Температура реакции обычно составляет от 0 С до температуры перегонки, а время реакции обычно составляет от 1 ч до 1 суток, в зависимости от применяемого сырья, растворителя и температуры реакции. Процесс 3. Соединение, представленное выше общей формулой VIII, может быть получено путем каталитического гидрирования соединения, представленного выше общей формулой VI, с применением палладиевого катализатора, такого как палладий-углеродного порошка, в присутствие или в отсутствие кислоты,такой как соляная кислота, в инертном растворителе и удаления защитной группы обычным путем, если это требуется. В качестве примеров применяемых при каталитическом гидрировании растворителей могут быть представлены метанол, этанол, тетрагидрофуран, этилацетат, уксусная кислота, изопропанол,-4 005994 смесь этих растворителей и тому подобное. Температура реакции обычно составляет от комнатной температуры до температуры перегонки, а время реакции обычно составляет от 30 мин до 1 суток, в зависимости от применяемого сырья, растворителя и температуры реакции. Соединение, представленное выше общей формулой VIII, может быть обычным способом преобразовано в его соль, такую как натриевая соль или калиевая соль. Процесс 4. Соединение, представленное выше общей формулой VIII, может быть получено путем удаления обычным способом защитной группы М соединения, представленного выше общей формулой VII, конденсируя полученное вещество с метилхлороформатом в присутствие основания, такого как триэтиламин, диизопропилэтиламин или 4-(N,N-диметиламино)пиридин в инертном растворителе и восстанавливая полученное карбонатное соединение с применением восстановителя, такого как боргидрид натрия. В качестве примеров применяемых в реакции конденсации растворителей могут быть представлены тетрагидрофуран, дихлорметан, ацетонитрил, этилацетат, диэтиловый эфир, смесь этих растворителей и тому подобное. Температура реакции обычно составляет от 0 С до температуры перегонки, а время реакции обычно составляет от 30 мин до 1 суток, в зависимости от применяемого сырья, растворителя и температуры реакции. В качестве примера применяемого в реакции восстановления растворителя может быть представлена смесь тетрагидрофурана и воды и тому подобное. Температура реакции обычно составляет от 0 С до температуры перегонки, а время реакции обычно составляет от 1 ч до 1 суток, в зависимости от применяемого сырья, растворителя и температуры реакции. Соединение, представленное выше общей формулой VIII, может быть обычным способом преобразовано в его соль, такую как натриевая соль или калиевая соль. Процесс 5. Глюкозид, представленный выше общей формулой X, может быть получен путем гликозилирования производного бензилфенола, представленного выше общей формулой VIII, или его соли, с применением гликозил-донора, представленного выше общей формулой IX, такого как 2,3,4,6-тетра-O-ацетил-1O-трихлорацетоимидоилD-глюкопираноза, 1,2,3,4,6-пента-O-ацетилD-глюкопираноза, 2,3,4,6 тетра-О-ацетилD-глюкопиранозилбромид и 2,3,4,6-тетра-O-ацетилD-глюкопиранозилфторид в присутствие активирующего реагента, такого как комплекс трифторида бора и диэтилового эфира, трифторметансульфоната серебра, хлорида олова(IV) или триметисилилтрифторметансульфоната в инертном растворителе. В качестве примеров применяемых растворителей могут быть представлены дихлорметан,толуол, ацетонитрил, нитрометан, этилацетат, диэтиловый эфир, хлороформ, смесь этих растворителей и тому подобное. Температура реакции обычно составляет от -30 С до температуры перегонки, а время реакции обычно составляет от 10 мин до 1 суток в зависимости от применяемого сырья, растворителя и температуры реакции. Процесс 6. Для удаления гидрокси-защитных групп производное глюкопиранозилоксибензилбензола, представленное выше общей формулой II, может быть получено путем щелочного гидролиза глюкозида,представленного выше общей формулой X. В качестве примеров применяемых растворителей могут быть представлены вода, метанол, этанол, тетрагидрофуран, смесь этих растворителей и тому подобное,а в качестве щелочных реагентов могут применяться гидроксид натрия, метоксид натрия, этоксид натрия, и тому подобное. Температура обработки обычно составляет от 0 С до температуры перегонки, а время обработки обычно составляет от 30 мин до 6 ч в зависимости от применяемого сырья, растворителя и температуры обработки. Соединения по настоящему изобретению, полученные при помощи описанного выше способа получения, могут быть выделены и очищены путем традиционных способов разделения, таких как фракционная перекристаллизация, очищение при помощи хроматографии, экстракция растворителем и экстракция твердой фазой. Пролекарства по настоящему изобретению, представленные выше общей формулой I, включают их гидраты и их сольваты с фармацевтически приемлемыми растворителями, таким как этанол. Пролекарство по настоящему изобретению, представленное выше общей формулой I, преобразовывается в производное глюкопиранозилоксибензилбензола, представленное выше общей формулой II, в качестве его активной формы in vivo и может обладать отличной ингибирующей активностью по отношению к SGLT2 человека. Дополнительно пролекарства по настоящему изобретению, представленные выше общей формулой I, обладают улучшенным всасыванием при пероральном введении, и фармацевтические композиции, включающие пролекарство в качестве активного ингредиента, являются пригодными в виде препаратов для перорального применения. Поэтому пролекарства по настоящему изобретению являются особенно полезными в качестве средств для профилактики или лечения заболевания, связанного с гипергликемией, такого как сахарный диабет, осложнений сахарного диабета, ожирения, и тому подобное. В случае использования в практике фармацевтических композиций по настоящему изобретению в зависимости от их применения применяются различные дозированные формы. В качестве примеров до-5 005994 зированных форм могут быть представлены порошки, гранулы, мелкие гранулы, сухие сиропы, таблетки,капсулы, инъекционные растворы, растворы, мази, свечи, припарки и тому подобное, которые вводятся перорально или парентерально. В зависимости от их дозированных форм данные фармацевтические композиции могут быть получены путем смешивания или путем разбавления и растворения с различными фармацевтическими добавками, такими как наполнители, разрыхлители, связующие вещества, смазки, разбавители, буферные растворы, агенты, обеспечивающие изотоничность, антисептики, увлажнители, эмульгаторы, диспергирующие агенты, стабилизаторы, вспомогательные растворяющие средства и тому подобное, и приготовления смеси в соответствии с фармацевтически традиционными способами в зависимости от их дозированных форм. В случае использования в практике фармацевтических композиций по настоящему изобретению дозировка соединения по настоящему изобретению в качестве активного ингредиента определяется соответствующим образом в зависимости от возраста, пола, массы тела, степени выраженности симптомов и лечения каждого пациента и приблизительно находится в диапазоне от 0,1 до 1000 мг в сутки для взрослого человека в случае перорального введения и приблизительно в диапазоне от 0,01 до 300 мг в сутки для взрослого человека в случае парентерального введения, а дневная доза может быть однократной или разделена на несколько приемов в течение суток и вводиться подходящим образом. ПРИМЕРЫ Настоящее изобретение дополнительно более детально иллюстрируется посредством следующих ссылочных примеров, примеров и примеров испытаний. Однако настоящее изобретение этим не ограничивается. Ссылочный пример 1. 2-(4-Изобутилбензил)фенол. Реактив Гриньяра получали обычным способом из 2-бензилокси-1-бромбензола (0,20 г), магния(0,026 г), каталитического количества йода и тетрагидрофурана (1 мл). Полученный реактив Гриньяра добавляли к раствору 4-изобутилбензальдегида (0,16 г) в тетрагидрофуране (2 мл) и перемешивали смесь при комнатной температуре в течение 30 мин. Реакционную смесь очищали методом колоночной хроматографии на аминопропиловом силикагеле (элюент: тетрагидрофуран) с получением соединения дифенилметанола (0,23 г). Полученное соединение дифенилметанола растворяли в этаноле (3 мл) и концентрированной соляной кислоте (0,1 мл). К раствору добавляли каталитическое количество 10% палладийуглеродного порошка и перемешивали смесь в атмосфере водорода при комнатной температуре в течение ночи. Катализатор удаляли путем фильтрации и концентрировали фильтрат при пониженном давлении. Остаток очищали методом колоночной хроматографии на силикагеле (элюент:дихлорметан/гексан = 1/1) с получением 2-(4-изобутилбензил)фенола (0,1 г). 1 Н-ЯМР (CDCl3)ppm: 0,89 (6 Н, д, J=6,6 Гц), 1,75-1,90 (1 Н, м) , 2,43 (2 Н, д, J=7,2 Гц), 3,97 (2 Н, с), 4,66 (1 Н, с), 6,75-6,85(1 Н, м), 6,85-6,95 (1 Н, м), 7,00-7,20 (6 Н, м). Ссылочный пример 2. 2-(4-Изопропоксибензил)фенол. Указанное в заголовке соединение получали способом, сходным с описанным в ссылочном примере 1, используя 4-изопропоксибензальдегид вместо 4-изобутилбензальдегида. 1 Н-ЯМР (CDC13)ppm: 1,31 (6 Н, д, J=6,l Гц), 3,93 (2 Н, с), 4,50 (1 Н, гептет, J=6,1 Гц), 4,72 (1 Н, с), 6,75-6,85 (3H, м), 6,85-6,95(1 Н, м), 7,05-7,20 (4 Н, м). Ссылочный пример 3. 2-(4-Этоксибензил)фенол. Реактив Гриньяра получали обычным способом из 1-бром-4-этоксибензола (1,5 г), магния (0,19 г),каталитического количества йода и тетрагидрофурана (2 мл). К полученному раствору реактива Гриньяра по каплям добавляли раствор 2-бензилоксибензальдегида (1,1 г) в тетрагидрофуране (15 мл) и перемешивали смесь при комнатной температуре в течение 30 мин. К реакционной смеси добавляли насыщенный водный раствор хлорида аммония (10 мл) и воду (20 мл) и экстрагировали смесь этилацетатом(100 мл). Экстракт промывали водой (20 мл) и насыщенным солевым раствором (20 мл) и сушили над безводным сульфатом натрия. После этого растворитель выпаривали при пониженном давлении. Остаток очищали методом колоночной хроматографии на силикагеле (элюент:гексан/этилацетат = 5/1) с получением соединения дифенилметанола (1,7 г). Полученное соединение дифенилметанола (1,7 г) растворяли в метаноле (25 мл). К раствору добавляли концентрированную соляную кислоту (0,42 мл) и каталитическое количество 10% палладий-углеродного порошка и перемешивали смесь в атмосфере водорода при комнатной температуре в течение 18 ч. Катализатор удаляли путем фильтрации и концентрировали фильтрат при пониженном давлении. К остатку добавляли этилацетат (100 мл) и промывали раствор насыщенным водным раствором гидрокарбоната натрия (30 мл) и насыщенным солевым раствором (30 мл). Органический слой сушили над безводным сульфатом натрия и выпаривали растворитель при пониженном давлении. Остаток очищали методом колоночной хроматографии на силикагеле (элюент:гексан/ этилацетат = 8/1) с получением 2-(4-этоксибензил)фенола (0,85 г). 1 Н-ЯМР (CDCl3)ppm:(1 Н, м), 7,05-7,20 (4 Н, м). Ссылочный пример 4. 2-(4-Этилтиобензил)фенол. Реактив Гриньяра получали обычным способом из 1-бром-4-этилтиобензола (1,1 г), магния (0,12 г),каталитического количества йода и тетрагидрофурана (5 мл). К полученному раствору реактива Гриньяра добавляли раствор 2-(метоксиметокси)бензальдегида (0,56 г) в тетрагидрофуране (12 мл) и перемешивали смесь при 65 С в течение 10 мин. После охлаждения до температуры окружающей среды к реакционной смеси добавляли насыщенный водный раствор хлорида аммония (5 мл) и воду (20 мл) и экстрагировали смесь этилацетатом (80 мл). Экстракт промывали водой (20 мл) и насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия, затем выпаривали растворитель при пониженном давлении. Остаток очищали методом колоночной хроматографии на силикагеле (элюент:гексан/этилацетат = 4/1) с получением соединения дифенилметанола (0,91 г). Полученное соединение дифенилметанола (0,90 г) растворяли в дихлорметане (15 мл). К раствору добавляли реактив ДессаМартина (1/1/1-трис(ацетилокси)-1,1-дигидро-1,2-бензиодоксол-3-(1 Н)-он) (1,5 г) и перемешивали смесь при 25 С в течение 26 ч. К реакционной смеси добавляли диэтиловый эфир (75 мл) и водный раствор гидроксида натрия (1 моль/л, 30 мл), энергично перемешивали смесь и отделяли органический слой. Органический слой промывали водным раствором гидроксида натрия (1 моль/л, 30 мл), водой (30 мл, трижды) и насыщенным солевым раствором (30 мл), сушили над безводным сульфатом натрия и выпаривали растворитель при пониженном давлении. Остаток очищали методом колоночной хроматографии на силикагеле (элюент:гексан/этилацетат = 15/1-9/1) с получением кетонового соединения (0,82 г). Смесь полученного кетонового соединения (0,81 г), моногидрата пара-толуолсульфоновой кислоты (0,1 г) и метанола (14 мл) перемешивали при 60 С в течение 4 ч. После охлаждения до температуры окружающей среды реакционную смесь концентрировали при пониженном давлении. Остаток очищали методом колоночной хроматографии на силикагеле (элюент:гексан/этилацетат = 15/1) с получением соединения со снятой защитой (0,69 г). Полученное соединение со снятой защитой (0,68 г) растворяли в тетрагидрофуране (11 мл), добавляли к раствору триэтиламин (0,41 мл) и метилхлороформат (0,22 мл) и перемешивали смесь при 25 С в течение 1 ч. Затем к реакционной смеси дополнительно добавляли триэтиламин(0,11 мл) и метилхлороформат (0,061 мл) и перемешивали смесь в течение 30 мин. Реакционную смесь фильтровали и концентрировали фильтрат при пониженном давлении. Остаток растворяли в тетрагидрофуране (14 мл) и воде (7 мл), добавляли к раствору боргидрид натрия (0,40 г) и перемешивали смесь при 25 С в течение 7 ч. К реакционной смеси по каплям добавляли соляную кислоту (1 моль/л, 15 мл) и экстрагировали смесь этилацетатом (75 мл). Экстракт промывали водой (20 мл), насыщенным водным раствором гидрокарбоната натрия (20 мл) и насыщенным солевым раствором (20 мл), сушили над безводным сульфатом натрия и выпаривали растворитель при пониженном давлении. Остаток очищали методом колоночной хроматографии на силикагеле (элюент:гексан/этилацетат = 8/1) с получением 2-(4 этилтиобензил)фенола (0,62 г). 1 Н-ЯМР (CDCl3)ppm: 1,29 (3H, т, J=7,3 Гц), 2,90 (2 Н, кв, J=7,3 Гц), 3,96 (2 Н, с), 4,62 (1 Н, с), 6,75-6,80 (1 Н, м) , 6,85-6,95(1 Н, м), 7,05-7,20 (4 Н, м), 7,20-7,30 (2 Н, м). Ссылочный пример 5. 2-(4-Метоксибензил)фенил-2,3,4,6-тетра-О-ацетилD-глюкопиранозид. К раствору 2-(4-метоксибензил)фенола (46 мг) и 2,3,4,6-тетра-O-ацетил-1-O-трихлорацетоимидоил-D-глюкопиранозы (0,13 г) в дихлорметане (2 мл) добавляли комплекс трифторида бора и диэтилового эфира (0,033 мл) и перемешивали смесь при комнатной температуре в течение 1 ч. Реакционную смесь очищали методом колоночной хроматографии на аминопропиловом силикагеле (элюент: дихлорметан) с получением 2-(4-метоксибензил)фенил-2,3,4,6-тетра-О-ацетилD-глюкопиранозида (0,11 г). 1 Н-ЯМР (CDCl3)ppm: 1,91 (3H, с), 2,03 (3H, с), 2,05 (3H, с), 2,08 (3H, с), 3,77 (3H, с), 3,80-3,95 (3H, м), 4,17 (1 Н, ДД, J=2,5,12,2 Гц), 4,29 (1 Н, дд, J=5,5, 12,2 Гц), 5,11 (1 Н, д, J=7,5 Гц), 5,10-5,25 (1 Н, м), 5,25-5,40 (2 Н, м), 6,75-6,85(2 Н, м), 6,95-7,10 (5 Н, м), 7,10-7,25 (1 Н, м). Ссылочный пример 6. 2-(4-Метилбензил)фенил-2,3,4,6-тетра-О-ацетилD-глюкопиранозид. Указанное в заголовке соединение получали способом, сходным с описанным в ссылочном примере 5, используя 2-(4-метилбензил)фенол вместо 2-(4-метоксибензил)фенола. 1 Н-ЯМР (CDCl3)ppm: 1,89 (3H, с), 2,03 (3H, с), 2,05 (3H, с), 2,07 (3H, с), 2,30 (3H, с), 3,80-3,95 (3H, м), 4,17 (1 Н, дд, J=2,5,12,3 Гц), 4,28 (1 Н, дд, J=5,5, 12,3 Гц), 5,11 (1 Н, д, J=7,5 Гц), 5,10-5,25 (1 Н, м), 5,25-5,40 (2 Н, м) , 6,90-7,20(8 Н, м). Ссылочный пример 7. 2-(4-Этилбензил)фенил-2,3,4,6-тетра-О-ацетилD-глюкопиранозид. Указанное в заголовке соединение получали способом, сходным с описанным в ссылочном примере 5, используя 2-(4-этилбензил)фенол вместо 2-(4-метоксибензил)фенола. 1-7 005994 1,20 (3H, т, J=7,6 Гц), 1,87 (3H, с), 2,03 (3H, с), 2,05 (3H, с), 2,08 (3H, с), 2,60 (2 Н, кв, J=7,6 Гц), 3,804,00 (3H, м), 4,18 (1 Н, дд, J=2,3, 12,2 Гц), 4,28 (1 Н, дд, J=5,4, 12,2 Гц), 5,11 (1 Н, д, J=7,5 Гц), 5,10-5,25 (1 Н,м), 5,25-5,40 (2 Н, м), 6,90-7,25 (8 Н, м). Ссылочный пример 8. 2-(4-Изобутилбензил)фенил-2,3,4,6-тетра-О-ацетилD-глюкопиранозид. Указанное в заголовке соединение получали способом, сходным с описанным в ссылочном примере 5, используя 2-(4-изобутилбензил)фенол вместо 2-(4-метоксибензил)фенола. 1H-ЯМР (CDCl3)ppm: 0,88 (6 Н, д, J=6,6 Гц), 1,75-1,90 (1 Н, м) , 1,87 (3H, с), 2,03 (3H, с), 2,05 (3H, с), 2,08 (3H, с), 2,42 (2 Н,д, J=7,2 Гц), 3,80-3,95 (3H, м), 4,18 (1 Н, дд, J=2,4, 12,3 Гц), 4,29 (1 Н, дд, J=5,5, 12,3 Гц), 5,11 (1 Н, д, J=7,6 Гц), 5,10-5,25 (1 Н, м), 5,25-5,40 (2 Н, м), 6,90-7,25 (8 Н, м). Ссылочный пример 9. 2-(4-Этоксибензил)фенил-2,3,4,6-тетра-О-ацетилD-глюкопиранозид. Указанное в заголовке соединение получали способом, сходным с описанным в ссылочном примере 5, используя 2-(4-этоксибензил)фенол вместо 2-(,4-метоксибензил) фенола. 1 Н-ЯМР (CDCl3)ppm: 1,39 (3H, т, J=7,0 Гц), 1,91 (3H, с), 2,03 (3H, с), 2,05 (3H, с), 2,07 (3H, с), 3,80-3,95 (3H, м), 3,99 (2 Н,кв, J=7,0 Гц), 4,18 (1 Н, дд, J=2,5, 12,3 Гц), 4,28 (1 Н, дд, J=5, 6, 12,3 Гц), 5,10 (1 Н, д, J=7,7 Гц), 5,15-5,25(1 Н, м), 5,25-5,40 (2 Н, м), 6,75-6,85 (2 Н, м), 6,95-7,10 (5 Н, м), 7,10-7,20 (1 Н, м). Ссылочный пример 10. 2-(4-изопропоксибензил)фенил-2,3,4,6-тетра-О-ацетилD-глюкопиранозид. Указанное в заголовке соединение получали способом, сходным с описанным в ссылочном примере 5, используя 2-(4-изопропоксибензил)фенол вместо 2-(4-метоксибензил)фенола. 1 Н-ЯМР (CDCl3)ppm: 1,30 (6 Н, д, J=6,0 Гц), 1,90 (3H, с), 2,03 (3H, с), 2,05 (3H, с), 2,08 (3H, с), 3,80-3,90 (3H, м), 4,18 (1 Н,дд, J=2,3, 12,3 Гц), 4,28 (1 Н, дд, J=5,5, 12,3 Гц), 4,48 (1 Н, гептет, J=6, 0 Гц), 5,10 (1 Н, д, J=7,7 Гц), 5,105,25 (1 Н, м), 5,25-5,40 (2 Н, м), 6,70-6,85 (2 Н, м), 6,90-7,10 (5 Н, м), 7,10-7,20 (1 Н, м). Ссылочный пример 11. 2-(4-метоксибензил)фенилD-глюкопиранозид. Метоксид натрия (28% раствор в метаноле; 0,12 мл) добавляли к раствору 2-(4-метоксибензил) фенил-2,3,4,6-тетра-О-ацетилD-глюкопиранозида (0,11 г) в метаноле (4 мл) и перемешивали смесь при комнатной температуре в течение 30 мин. Выпаривали растворитель при пониженном давлении. Остаток очищали методом колоночной хроматографии на силикагеле (элюент:дихлорметан/метанол = 10/1) с получением 2-(4-метоксибензил) фенилD-глюкопиранозида (65 мг). 1 Н-ЯМР (CD3OD)ppm: 3,35-3,55 (4 Н, м), 3,69 (1 Н, дд, J=5,l, 12,1 Гц), 3,73 (3H, с), 3,80-4,00 (2 Н, м) , 4,03 (1 Н, д, J=15,l Гц),4,91 (1 Н, д, J=7,4 Гц), 6,75-6,85 (2 Н, м), 6,85-6,95 (1 Н, м), 6,95-7,10 (1 Н, м), 7,10-7,20 (4 Н, м). Ссылочный пример 12. 2-(4-Метилбензил)фенилD-глюкопиранозид. Указанное в заголовке соединение получали способом, сходным с описанным в ссылочном примере 11, используя 2-(4-метилбензил)фенил-2,3,4,6-тетра-О-ацетилD-глюкопиранозид вместо 2-(4-метоксибензил)фенил-2,3,4,6-тетра-О-ацетилD-глюкопиранозида. 1 Н-ЯМР (CD3OD)ppm: 2,27 (3H, с), 3,35-3,55 (4 Н, м), 3,69 (1 Н, дд, J=5,2, 12,0 Гц), 3,80-3,90 (1 Н, м), 3,94 (1 Н, д, J=15,0 Гц),4,05 (1 Н, д, J=15,0 Гц), 4,85-4,95 (1 Н, м), 6,85-6,95 (1 Н, м), 6,95-7,20 (7 Н, м). Ссылочный пример 13. 2-(4-этилбензил)фенилD-глюкопиранозид. Указанное в заголовке соединение получали способом, сходным с описанным в ссылочном примере 11, используя 2-(4-этилбензил)фенил-2,3,4,6-тетра-O-ацетилD-глюкопиранозид вместо 2-(4-метоксибензил) фенил-2,3,4,6-тетра-О-ацетилD-глюкопиранозида. 1H-ЯМР (CD3OD)ppm: 1,15-1,25 (3H, м), 2,50-2,65 (2 Н, м), 3,35-3,55 (4 Н, м), 3,65-3,75 (1 Н, м), 3,80-4,00 (2 Н, м), 4,06 (1 Н, д,J=14,9 Гц), 4,85-5,00 (1 Н, м), 6,85-7,00 (1 Н, м), 7,00-7,20 (7 Н, м). Ссылочный пример 14. 2-(4-Изобутилбензил)фенилD-глюкопиранозид. Указанное в заголовке соединение получали способом, сходным с описанным в ссылочном примере 11, используя 2-(4-изобутилбензил)фенил-2,3,4,6-тетра-О-ацетилD-глюкопиранозид вместо 2-(4-метоксибензил)фенил-2,3,4,6-тетра-О-ацетилD-глюкопиранозида. 1H-ЯМР (CD3OD)ppm: 0,80-0,95 (6 Н, м), 1,70-1,90 (1 Н, м), 2,41 (2 Н, д, J=7,l Гц), 3,30-3,55 (4 Н, м), 3,60-3,75 (1 Н, м), 3,803,95 (1 Н, м), 3,95 (1 Н, д, J=15,0 Гц), 4,06 (1 Н, д, J=15,0 Гц), 4,85-4,95 (1 Н, м), 6,80-7,20 (8 Н, м). Ссылочный пример 15. 2-(4-Этоксибензил)фенилD-глюкопиранозид. Указанное в заголовке соединение получали способом, сходным с описанным в ссылочном примере 11, используя 2-(4-этоксилбензил)фенил-2,3,4,6-тетра-О-ацетилD-глюкопиранозид вместо 2-(4-метоксибензил)фенил-2,3,4,6-тетра-О-ацетилD-глюкопиранозида. 1 Н-ЯМР (CD3OD)ppm:-8 005994 1,35 (3H, т, J=6,8 Гц), 3,35-3,55 (4 Н, м), 3,60-3,75 (1 Н, м), 3,80-4,10 (5 Н, м), 4,90 (1 Н, д, J=7,l Гц),6,70-6,85 (2 Н, м), 6,85-6,95 (1 Н, м), 7,00-7,20 (5 Н, м). Ссылочный пример 16. 2-(4-изопропоксибензил)фенилD-глюкопиранозид. Указанное в заголовке соединение получали способом, сходным с описанным в ссылочном примере 11, используя 2-(4-изопропоксилбензил)фенил-2,3,4,6-тетра-О-ацетилD-глюкопиранозид вместо 2-(4 метоксибензил)фенил-2,3,4,6-тетра-О-ацетилD-глюкопиранозида. 1(2,4 г) в толуоле (6,3 мл) и дихлорметане (2,7 мл) добавляли комплекс трифторида бора и диэтилового эфира (0,78 мл) и перемешивали смесь при комнатной температуре в течение 9 ч. К реакционной смеси добавляли этилацетат (70 мл) и насыщенный водный раствор гидрокарбоната натрия (25 мл) и отделяли органический слой. Органический слой промывали насыщенным солевым раствором (25 мл), сушили над безводным сульфатом натрия и выпаривали растворитель при пониженном давлении. Остаток растворяли в метаноле (10,5 мл), добавляли к раствору метоксид натрия (28% раствор в метаноле; 0,08 мл) и перемешивали смесь при 25 С в течение 18 ч. К реакционной смеси добавляли этилацетат (75 мл) и воду(20 мл) и отделяли органический слой. Органический слой промывали насыщенным солевым раствором(20 мл), сушили над безводным сульфатом натрия и выпаривали растворитель при пониженном давлении. Остаток очищали методом колоночной хроматографии на силикагеле (элюент:дихлорметан/метанол= 10/1). Выпаривали растворитель при пониженном давлении, добавляли к остатку диэтиловый эфир и собирали полученный осадок путем фильтрации. Полученное бесцветное твердое вещество промывали диэтиловым эфиром и сушили при пониженном давлении с получением 2-(4-этилтиобензил) фенилDглюкопиранозида (0, 51 г). 1(2 мл) добавляли этилхлороформат (0,04 мл) при комнатной температуре. После перемешивания смеси при комнатной температуре в течение 16 ч к ней добавляли насыщенный водный раствор лимонной кислоты и экстрагировали смесь этилацетатом. Экстракт промывали водой, сушили над безводным сульфатом магния и выпаривали растворитель при пониженном давлении. Остаток очищали методом препаративной тонкослойной хроматографии на силикагеле (элюент:дихлорметан/метанол = 10/1) с получением аморфного 2-(4-метоксибензил) фенил-6-О-этоксикарбонилD-глюкопиранозида (0,032 г). 1 Н-ЯМР (CD3OD)ppm: 1,23 (3H, т, J=7,l, Гц), 3,30-3,65 (4 Н, м), 3,74 (3H, с), 3,93 (1 Н, д, J=15,l Гц), 4,02 (1 Н, д, J=15,l Гц),4,05-4,20 (2 Н, м), 4,29 (1 Н, дд, J=6,4, 11,7 Гц), 4,45 (1 Н, дд, J=2,2, 11,7 Гц), 4,89 (1 Н, д, J=7,4 Гц), 6,75-6,85(2 Н, м), 6,85-7,05 (2 Н, м), 7,05-7,2 (4 Н, м). Пример 2. 2-(4-метоксибензил) фенил-6-О-метоксикарбонилD-глюкопиранозид. Указанное в заголовке соединение получали способом, сходным с описанным в примере 1, используя метилхлороформат вместо этилхлороформата. 1H-ЯМР (CD3OD)ppm: 3,30-3,65 (4 Н, м), 3,71 (3H, с), 3,74 (3H, с), 3,93 (1 Н, д, J=15,l Гц), 4,01 (1 Н, д, J=15,l Гц), 4,30 (1 Н, дд,J=6,4, 11,7 Гц), 4,45 (1 Н, дд, J=2,l, 11,7 Гц), 4,89 (1 Н, д, J=7,4 Гц), 6,75-6,85 (2 Н, м), 6,85-7,05 (2 Н, м),7,05-7,20 (4 Н, м). Пример 3. 2-(4-Метоксибензил)фенил-6-О-[2-(метокси)этилоксикарбонил]D-глюкопиранозид. Указанное в заголовке соединение получали способом, сходным с описанным в примере 1, используя 2-(метокси)этилхлороформат вместо этилхлороформата. 1 Н-ЯМР (CD3OD)ppm: 3,30-3,65 (9 Н, м), 3,74 (3H, с), 3,92 (1 Н, д, J=15,1 Гц), 4,02 (1 Н, д, J=15,1 Гц), 4,10-4,25 (2 Н, м), 4,30(2 мл) добавляли гексаноилхлорид (0,072 г) при 0 С и перемешивали смесь в течение 3 ч. К реакционной смеси добавляли 10% водный раствор лимонной кислоты и экстрагировали смесь этилацетатом. Органи-9 005994 ческий слой промывали 10% водным раствором лимонной кислоты и насыщенным солевым раствором. Органический слой сушили над безводным сульфатом магния и выпаривали растворитель при пониженном давлении. Остаток очищали методом препаративной тонкослойной хроматографии на силикагелеH-ЯМР (CD3OD)ppm: 0,80-0,95 (3H, м), 1,20-1,35 (4 Н, м), 1,50-1,65 (2 Н, м), 2,25-2,35 (2 Н, м), 3,30-3,65 (4 Н, м), 3,74 (3H,с), 3,93 (1 Н, д, J=15,l Гц), 4,01 (1 Н, д, J=15,l Гц), 4,22 (1 Н, дд, J=6,7, 11,8 Гц), 4,42 (1 Н, дд, J=2,2, 11,8 Гц),4,85-4,95 (1 Н, м), 6,75-6,85 (2 Н, м), 6,85-7,05 (2 Н, м), 7,05-7,20 (4 Н, м). Пример 5. 2-(4-метоксибензил)фенил-6-О-пропионилD-глюкопиранозид. Указанное в заголовке соединение получали способом, сходным с описанным в примере 4, используя пропионилхлорид вместо гексаноилхлорида. 1H-ЯМР (CD3OD)ppm: 1,08 (3H, т, J=7,6 Гц), 2,25-2,40 (2 Н, м), 3,30-3,55 (3H, м), 3,55-3,65 (1 Н, м), 3,74 (3H, с), 3,93 (1 Н, д,J=15,1 Гц), 4,01 (1 Н, д, J=15,l Гц), 4,23 (1 Н, дд, J=6,7, 11,8 Гц), 4,40 (1 Н, дд, J=2,l, 11,8 Гц), 4,85-4,95 (1 Н,м), 6,75-6,85 (2 Н, м), 6,85-7,05 (2 Н, м), 7,05-7,20 (4 Н, м). Пример 6. 2-(4-Метоксибензил)фенил-6-О-бутирилD-глюкопиранозид. Указанное в заголовке соединение получали способом, сходным с описанным в примере 4, используя бутирилхлорид вместо гексаноилхлорида. 1H-ЯМР (CD3OD)ppm: 0,90 (3H, т, J=7,4 Гц), 1,50-1,70 (2 Н, м), 2,20-2,35 (2 Н, м), 3,30-3,65 (4 Н, м), 3,74 (3H, с), 3,93 (1 Н, д,J=15, 1 Гц), 4,01 (1 Н, д, J=15,l Гц), 4,22 (1 Н, дд, J=6,7, 11,8 Гц), 4,42 (1 Н, дд, J=2,2, 11,8 Гц), 4,85-4,95 (1 Н,м), 6,75-6,85 (2 Н, м), 6,85-7,05 (2 Н, м), 7,05-7,20 (4 Н, м). Пример 7. 2-(4-Метоксибензил)фенил-6-О-ацетилD-глюкопиранозид. Указанное в заголовке соединение получали способом, сходным с описанным в примере 4, используя ацетилхлорид вместо гексаноилхлорида. 1H-ЯМР (CD3OD)ppm: 2,02 (3H, с), 3,30-3,65 (4 Н, м), 3,74 (3H, с), 3,93 (1 Н, д, J=15,l Гц), 4,01 (1 Н, д, J=15,l Гц), 4,24 (1 Н, дд,J=6,5, 11,9 Гц), 4,38 (1 Н, дд, J=2,2, 11,9 Гц), 4,85-4,95 (1 Н, м), 6,75-6,85 (2 Н, м), 6,85-7,05 (2 Н, м), 7,057,20 (4 Н, м). Пример 8. 2-(4-Метоксибензил)фенил-6-О-изобутирилD-глюкопиранозид. Указанное в заголовке соединение получали способом, сходным с описанным в примере 4, используя изобутирилхлорид вместо гексаноилхлорида. 1 Н-ЯМР (CD3OD)ppm: 1,11 (3H, д, J=7,0 Гц), 1,12 (3H, д, J=7,0 Гц), 2,45-2,60 (1 Н, м), 3,30-3,65 (4 Н, м), 3,74 (3H, с), 3,93(1 Н, д, J=15, 1 Гц), 4,00 (1 Н, д, J=15,l Гц), 4,19 (1 Н, дд, J=6,9, 11,8 Гц), 4,43 (1 Н, дд, J=2,l, 11,8 Гц), 4,854,95 (1 Н, м), 6,75-6,85 (2 Н, м), 6,85-7,05 (2 Н, м), 7,05-7,20 (4 Н, м). Пример 9. 2-(4-метоксибензил) фенил-6-О-зтилсукцинилD-глюкопиранозид. Указанное в заголовке соединение получали способом, сходным с описанным в примере 4, используя этилсукцинилхлорид вместо гексаноилхлорида. 1 Н-ЯМР (CD3OD)ppm: 1,19 (3H, т, J=7,1 Гц), 2,50-2,70 (4 Н, м), 3,30-3,65 (4 Н, м), 3,74 (3H, с), 3,93 (1 Н, д, J=15,l Гц), 4,02(1 Н, д, J=15, 1 Гц), 4,08 (2 Н, кв, J=7,l Гц), 4,22 (1 Н, дд, J=6,7, 11,8 Гц), 4,44 (1 Н, дд, J=2,l, 11,8 Гц), 4,854,95 (1 Н, м), 6,75-7,25 (8 Н, м). Пример 10. 2-(4-метоксибензил)фенил-6-О-изопропилоксикарбонилD-глюкопиранозид. К раствору изопропанола (0,12 г) в 2,4,6-триметилпиридине (2 мл) добавляли трифосген (0,022 г) при 0 С и перемешивали смесь в течение 1 ч. После этого к реакционной смеси добавляли 2-(4 метоксибензил)фенилD-глюкопиранозид (0,075 г) и перемешивали смесь при комнатной температуре в течение ночи. К реакционной смеси добавляли 10% водный раствор лимонной кислоты и экстрагировали смесь этилацетатом. Органический слой промывали 10% водным раствором лимонной кислоты и водой, сушили над сульфатом магния и выпаривали растворитель при пониженном давлении. Остаток очищали методом препаративной тонкослойной хроматографии на силикагеле (элюент:дихлорметан/ метанол = 10/1) с получением 2-(4-метоксибензил)фенил-6-О-изопропилоксикарбонилD-глюкопиранозида (0,024 г). 1 Н-ЯМР (CD3OD)ppm: 1,21 (3H, д, J=6,3 Гц), 1,23 (3H, д, J=6,3 Гц), 3,30-3,65 (4 Н, м), 3,74 (3H, с), 3,93 (1 Н, д, J=15,l Гц),4,02 (1 Н, д, J=15,l Гц), 4,28 (1 Н, дд, J=6,4, 11,7 Гц), 4,43 (1 Н, дд, J=2,2, 11,7 Гц), 4,70-4,85 (1 Н, м) , 4,854,95 (1 Н, м), 6,75-7,20 (8 Н, м). Примеры 11-22. Соединения в табл. 1 получали способами, сходными с описанными в примерах 1 или 2, используя соединение, полученное в ссылочных примерах 12-17. Пример испытаний 1. Анализ эффекта ингибирования активности SGLT2 человека 1) Конструирование плазмидного вектора, экспрессирукщего SGLT2 человека Получение библиотеки кДНК для ПЦР-амплификации осуществляли методом обратной транскрипции общей РНК из почки человека (Ori gene) с oligo dT в качестве праймера, используя SUPERSCRIPTPreamplification System (Gibco-BRL : LIFE TECHNOLOGIES). Фрагмент ДНК, кодирующий SGLT2 человека, амплифицировали при помощи ПЦР с применением ДНК-полимеразы Pfu (Stratagene), в которой описанная выше библиотека кДНК почки человека применялась в качестве матрицы, а следующие олигонуклеотиды 0702F и 0712R, представленные как последовательности с номерами 1 и 2 соответственно,использовались в качестве праймеров. Амплифицированный фрагмент ДНК сшивали с вектором для клонирования pCR-Blunt (Invitrogen) в соответствии со стандартной методикой. Компетентную клетку,Escherichia coli НВ 101 (Toyobo), трансформировали обычным способом и проводили выбор трансформантов на LB-arape, содержащем 50 мкг/мл канамицина. После экстракции и очистки плазмидной ДНК из одного из трансформантов при помощи ПЦР с применением ДНК-полимеразы Pfu проводили амплификацию кодирующего SGLT2 человека фрагмента ДНК, используя следующие олигонуклеотиды 0714F и 0715R, представленные как последовательности с номерами 3 и 4 соответственно, в качестве праймеров. Амплифицированный фрагмент ДНК расщепляли при помощи рестриктаз Xho I и Hind III и затем очищали при помощи Wizard Purification System (Promega). Полученный очищенный фрагмент ДНК вставляли в соответственные мультиклонирующие сайты вектора для экспрессии слитого белкаpcDNA3.1 (-) Myc/His-B (Invitrogen). Компетентную клетку, Escherichia coli HB101 (Toyobo), трансформировали обычным способом и проводили выбор трансформантов на LB-arape, содержащем 100 мкг/мл ампициллина. После экстракции и очистки плазмидной ДНК из одного из трансформантов анализировали последовательность фрагмента ДНК, вставленного в мультиклонирующие сайты pcDNA3.1 (-) Myc/His-B. Данный клон содержал одну замену (кодирующая изолейцин-433 АТС была замещена на GTC) по сравнению с SGLT2 человека, как было показано Wells et al. (Am. J. Physiol., Vol. 263, pp.459-465 (1992. После этого был получен клон, в котором изолейцин-433 был замещен валином. Данный экспрессирующий SGLT2 человека плазмидный вектор, в котором пептид, представленный как последовательность с номером 5,пришит к карбоксильному концевому остатку аланина, был обозначен как KL29. Последовательность 1AACCTCGAGATGGAGGAGCACACAGAGGC Последовательность 4 AACAAGCTTGGCATAGAAGCCCCAGAGGA Последовательность 5 KLGPEQKLISEEDLNSAVDHHHHHH 2) Получение клеток, транзиентно экспрессирукщих SGLT2 человека Клетки COS-7 (RIKEN CELL BANK RCB0539) трансфицировали кодирующей SGLT2 человека плазмидой KL29 методом электропорации. Электропорацию осуществляли при помощи GENE PULSER- 11005994 После переноса гена клетки собирали путем центрифугирования и ресуспендировали в среде OPTIMEM I (1 мл/кювету). В каждую лунку 96-луночного планшета добавляли 125 мкл этой клеточной суспензии. После культивирования при 37 С в присутствие 5% СО 2 в каждую лунку добавляли 125 мкл среды DMEM, содержащей 10% фетальной бычьей сыворотки (Sanko Jyunyaku), 100 единиц/мл натрийпенициллина G (Gibco-BRL : LIFE TECHNOLOGIES) и 100 мкг/мл сульфата стрептомицина (Gibco-BRL:LIFE TECHNOLOGIES). После культивирования в течение последующих суток данные клетки использовались для измерения ингибирующей активности относительно потребления метилD-глюкопиранозида. 3) Измерение ингибирукщей активности относительно потребления метилD-глюкопиранозида После растворения тестируемого соединения в диметилсульфоксиде и разбавления обеспечивающим поглощение буферным раствором (буферный раствор со значением рН = 7,4, содержащий 140 мМ хлорида натрия, 2 мМ хлорида калия, 1 мМ хлорида кальция, 1 мМ хлорида магния, 5 мМ метилDглюкопиранозида, 10 мМ 2-[4-(2-гидроксиэтил)-1-пиперазинил]этансульфоновой кислоты и 5 мМ трис(гидроксиметил)аминометана), каждый разбавитель был использован в качестве тестового образца для измерения ингибирующей активности. После удаления среды из суспензии клеток COS-7, транзиентно зкспрессирующих SGLT2 человека, в каждую лунку добавляли 200 мкл буферного раствора для предобработки (буферный раствор со значением рН = 7,4, содержащий 140 мМ холинхлорида, 2 мМ хлорида калия, 1 мМ хлорида кальция, 1 мМ хлорида магния, 10 мМ 2-[4-(2-гидроксиэтил)-1 пиперазинил]этансульфоновой кислоты и 5 мМ трис(гидроксиметил)аминометана) и инкубировали клетки при 37 С в течение 10 мин. После удаления буферного раствора для предобработки снова добавляли 200 мкл того же самого буферного раствора и инкубировали клетки при 37 С в течение 10 мин. Буферный раствор для измерений приготавливали путем добавления 7 мкл метилD-(U-14C)глюкопиранозида (Amersham Pharmacia Biotech) к 525 мкл полученного тестового образца. Для контроля приготавливали буферный раствор без тестируемого соединения. Для определения исходного уровня потребления в отсутствие тестируемого соединения и натрия сходным путем приготавливали буферный раствор для определения исходного уровня потребления, который содержал 140 мМ холинхлорида вместо хлорида натрия. После удаления буферного раствора для предобработки в каждую лунку добавляли 75 мкл буфера для измерения и инкубировали клетки при 37 С в течение 2 ч. После удаления буферного раствора для измерения в каждую лунку добавляли и немедленно удаляли 200 мкл промывающего буферного раствора (буферный раствор со 3Hачением рН = 7,4, содержащий 140 мМ холинхлорида, 2 мМ хлорида калия, 1 мМ хлорида кальция, 1 мМ хлорида магния, 10 мМ метилD-глюкопиранозида,10 мМ 2-[4-(2-гидроксиэтил)-1-пиперазинил]этансульфоновой кислоты и 5 мМ трис(гидроксиметил)аминометана). После дополнительного двухкратного промывания клетки солюбилизировали путем добавления в каждую лунку 75 мкл 0,2 н гидроксида натрия. После переноса лизата клеток в PicoPlate (Packard) и добавления 150 мкл MicroScint-40 (Packard) измеряли радиоактивность при помощи микроплашечного сцинтилляционного счетчика TopCount (Packard). За 100% разницы в потреблении принимали величину разности радиоактивности между исходным уровнем потребления и контролем и затем, исходя из кривой зависимости ингибирования от концентрации, методом наименьших квадратов рассчитывали концентрации, при которых ингибировалось 50% потребления (значение IC50). Результаты представлены в следующей табл. 2. Таблица 2 Пример испытаний 2. Анализ абсорбционной способности при пероральном введении 1) Приготовление образцов для измерения концентрации лекарства после внутривенной инъекции в хвостовую вену В качестве экспериментальных животных использовались не получавшие в течение ночи корма крысы SD (CLEA JAPAN, INC., самцы, в возрасте 5 недель, 140-170 г). Для приготовления 3,3 мг/мл раствора 60 мг тестируемого соединения суспендировали или растворяли в 1,8 мл этанола и затем растворяли путем добавления 7,2 мл полиэтиленгликоля 400 и 9 мл солевого раствора. Крыс взвешивали и затем внутривенно вводили раствор тестируемого соединения в дозе 3 мл/кг (10 мг/кг) в хвостовую вену не подвергшихся наркозу крыс. Внутривенную инъекцию в хвост осуществляли с применением инъекционной иглы 26 G и шприца на 1 мл. Отбор проб крови осуществляли через 2, 5, 10, 20, 30, 60 и 120 мин по- 12005994 сле внутривенной инъекции в хвостовую вену. Кровь центрифугировали и использовали плазму в качестве образца для измерения концентрации лекарства в крови. 2) Приготовление образцов для измерения концентрации лекарства после перорального введения В качестве экспериментальных животных использовались не получавшие в течение ночи корма крысы SD (CLEA JAPAN, INC., самцы, в возрасте 5 недель, 140-170 г). Тестируемое соединение суспендировали или растворяли в 0,5% растворе натрийкарбоксиметилцеллюлозы в концентрации 1 мг/мл активной формы. После взвешивания крыс перорально вводили жидкость, содержащую описанное выше тестируемое соединение, в дозе 10 мл/кг (10 мг/кг в виде активной формы). Пероральное введение осуществляли при помощи желудочной трубки для крыс и шприца на 2,5 мл. Отбор крови осуществляли через 15, 30, 60, 120 и 240 мин после перорального введения. Кровь центрифугировали и использовали плазму в качестве образца для измерения концентрации лекарства в крови. 3) Измерение концентрации лекарства В качестве внутреннего стандарта к 0,1 мл плазмы, полученной в описанных выше пунктах 1) и 2),добавляли 1 мкг 2-(4-этоксибензил)фенилD-глюкопиранозида, описанного в ссылочном примере 15 и затем извлекали белки путем добавления 1 мл метанола. После центрифугирования метанольную фазу упаривали досуха под струей азота. Остаток растворяли в 300 мкл подвижной фазы и наносили аликвоту раствора (30 мкл) для ВЭЖХ. Концентрацию лекарства в плазме анализировали при помощи метода ВЭЖХ в следующих условиях. Колонка: Inertsil ODS-2 (4,6 х 250 мм) Подвижная фаза: Ацетонитрил/10 мМ фосфатный буферный раствор (рН =3,0) = 25:75 (об/об) Температура колонки: 50 С Скорость потока: 1,0 мл/мин Длина волны измерения: УФ 232 нм После добавления 1 мкг описанного в ссылочном примере 15 2-(4-этоксибензил)фенилDглюкопиранозида в качестве внутреннего стандарта и каждой концентрации (1,0, 0,5, 0,2, 0,1, 0,05 и 0,02 мкг) описанного в ссылочном примере 11 2-(4-метоксибензил)фенилD-глюкопиранозида к 0,1 мл чистой плазмы проводили сходные с описанными выше манипуляции и затем строили стандартную кривую. После внутривенной инъекции в хвостовую вену и перорального введения исходя из полученных методом ВЭЖХ концентраций в плазме в каждый момент времени при помощи WinNonlin Standard(Pharsight Corporation) определяли площадь под кривой временной зависимости концентрации тестируемого соединения в плазме крови и затем рассчитывали биологическую доступность (%) по формуле следующим образом. Биологическая доступность (%) = [(площадь под кривой временной зависимости концентрации тестируемого соединения в плазме крови после перорального введения)/(площадь под кривой временной зависимости концентрации тестируемого соединения в плазме крови после внутривенной инъекции в хвостовую вену)] х 100. Результаты представлены в следующей табл. 3. Таблица 3 Пример испытаний 3. Анализ эффекта облегчения выведения глюкозы с мочой. В качестве экспериментальных животных использовались не получавшие корма крысы SD (SLCInc., самцы, в возрасте 8 недель, 270-320 г). Тестируемое соединение суспендировали в 0,5% растворе карбоксиметила и приготавливали 0,3, 1 и 3 мг/мл суспензии. После взвешивания крыс перорально вводили тестируемую суспензию в дозе 10 мл/кг (3, 10 и 30 мг/кг). Для контроля перорально вводили только 0,5% раствор натрийкарбоксиметилцеллюлозы в дозе 10 мл/кг. Пероральное введение осуществляли при помощи желудочной трубки для крыс и шприца на 2,5 мл. Количество животных в группе составляло 5 или 6. Мочу собирали в камеру для исследования метаболизма после окончания перорального введения. Мочу собирали через 24 ч после перорального введения. После окончания сбора мочи регистрировали объем мочи и измеряли концентрацию глюкозы в моче. Концентрацию глюкозы измеряли при помощи набора для лабораторного тестирования Glucose B-Test WAKO (Wako Pure Chemical Industries, Ltd.). Количество выделяемой за 24 ч с мочой глюкозы на 200 г массы тела рассчитывали исходя из объема мочи,концентрации глюкозы в моче и массы тела. Результаты представлены в следующей табл. 4. Пример испытаний 4. Тест на острую токсичность. Мышей ICR в возрасте 4 недель (CLEA JAPAN, INC., 22-28 г, 5 животных в каждой группе) кормили в течение 4 ч и перорально вводили 60 мг/мл суспензию тестируемого соединения в 0,5% растворе карбоксиметилцеллюлозы в дозе 10 мл/кг (600 мг/кг). Как показано в следующей табл. 5 спустя 24 ч после введения летального эффекта не наблюдалось. Таблица 5 Тестируемое соединение Промышленная применимость Производные глюкопиранозилоксибензилбензола по настоящему изобретению, представленные выше общей формулой I, обладают улучшенным всасыванием при пероральном введении и могут обладать отличной ингибирующей активностью по отношению к SGLT2 человека путем превращения в производные глюкопиранозилоксибензилбензола, представленные выше общей формулой II, в качестве их активных форм in vivo после перорального введения. Настоящее изобретение относится к средствам для профилактики или лечения заболевания, связанного с гипергликемией, такого как сахарный диабет, осложнений сахарного диабета, ожирения и тому подобное, которые также приемлемы в виде препаративных форм для перорального применения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Производное глюкопиранозилоксибензилбензола, представленное общей формулой где Р представляет собой С 2-7 ацильную группу, С 2-7 ацильную группу, замещенную C1-6 алкоксигруппой,С 2-7 ацильную группу, замещенную С 2-7 алкоксикарбонильной группой, С 2-7 алкоксикарбонильную группу или С 2-7 алкоксикарбонильную группу, замещенную C1-6 алкоксигруппой, иR представляет собой C1-6 алкильную группу, C1-6 алкоксигруппу, C1-6 алкилтиогруппу, C1-6 алкильную группу, замещенную C1-6 алкоксигруппой, C1-6 алкоксигруппу, замещенную C1-6 алкоксигруппой,или C1-6 алкилтиогруппу, замещенную C1-6 алкоксигруппой. 2. Производное глюкопиранозилоксибензилбензола по п.1, представленное общей формулой где R1 представляет собой C1-6 алкильную группу или C1-6 алкоксигруппу и Р представляет собой С 2-7 ацильную группу, С 2-7 ацильную группу, замещенную C1-6 алкоксигруппой,С 2-7 ацильную группу, замещенную С 2-7 алкоксикарбонильной группой, С 2-7 алкоксикарбонильную группу или С 2-7 алкоксикарбонильную группу, замещенную C1-6 алкоксигруппой. 3. Производное глюкопиранозилоксибензилбензола по п.1, представленное общей формулой- 14005994 где R представляет собой C1-6 алкильную группу, C1-6 алкоксигруппу, C1-6 алкилтиогруппу, C1-6 алкильную группу, замещенную C1-6 алкоксигруппой, C1-6 алкоксигруппу, замещенную C1-6 алкоксигруппой, или C1-6 алкилтиогруппу, замещенную C1-6 алкоксигруппой, и Р 2 представляет собой С 2-7 ацильную группу или С 2-7 алкоксикарбонильную группу. 4. Производное глюкопиранозилоксибензилбензола по п.2 или 3, представленное общей формулой где R1 представляет собой C1-6 алкильную группу или C1-6 алкоксигруппу и Р 2 представляет собой С 2-7 ацильную группу или С 2-7 алкоксикарбонильную группу. 5. Производное глюкопиранозилоксибензилбензола по п.4, представленное общей формулой 6. Производное глюкопиранозилоксибензилбензола по п.4, представленное общей формулой 7. Фармацевтическая композиция, включающая в качестве активного ингредиента производное глюкопиранозилоксибензилбензола по пп.1-6. 8. Фармацевтическая композиция по п.7, где композиция является ингибитором SGLT2(Na+/глюкозы котранспортера 2) человека. 9. Фармацевтическая композиция по п.8, где композиция является средством для предупреждения или лечения заболевания, связанного с гипергликемией. 10. Фармацевтическая композиция по п.9, где заболеванием, связанным с гипергликемией, является сахарный диабет или осложнения сахарного диабета. 11. Фармацевтическая композиция по п.9, где заболеванием, связанным с гипергликемией, является ожирение. 12. Фармацевтическая композиция по пп.7-11, где композиция представлена в форме для перорального применения. 13. Способ предупреждения или лечения заболевания, связанного с гипергликемией, включающий введение терапевтически эффективного количества производного глюкопиранозилоксибензилбензола по пп.1-6. 14. Применение производного глюкопиранозилоксибензилбензола по пп.1-6 для изготовления фармацевтической композиции для предупреждения или лечения заболевания, связанного с гипергликемией.
МПК / Метки
МПК: A61K 31/7034, C07H 15/203, A61P 43/00
Метки: лекарственные, содержащие, производные, глюкопиранозилоксибензилбензола, композиции
Код ссылки
<a href="https://eas.patents.su/16-5994-proizvodnye-glyukopiranoziloksibenzilbenzola-i-soderzhashhie-ih-lekarstvennye-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Производные глюкопиранозилоксибензилбензола и содержащие их лекарственные композиции</a>
Предыдущий патент: Улучшенный способ получения меламина высокой чистоты с высоким выходом
Следующий патент: Смеси полисахаридов на основе гепарина, их получение и фармацевтические композиции, их содержащие
Случайный патент: Композиции 24-c-метилтрансферазы стерина leishmania для профилактики, лечения и диагностики лейшманиоза












