Галогензамещённые производные 4-фенил-1-пиперазина, -пиперидина и -тетрагидропиридина
Формула / Реферат
1. Соединение формулы I
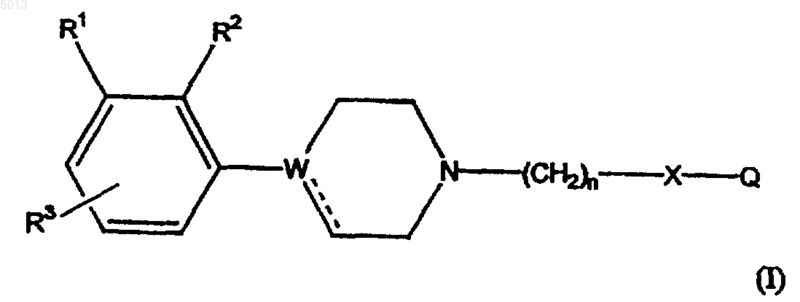
где W является C, CH или N и пунктирная линия, исходящая от W, обозначает связь, если W является C; и отсутствие связи, если W является N или CH;
R1 и R2 независимо выбраны из водорода и галогена, при условии, что по крайней мере один из R1 и R2 является атомом галогена;
R3 выбран из водорода, галогена, C1-6-алкила, C2-6-алкенила, C2-6-алкинила, трифторметила, C1-6-алкокси, арилокси, аралкокси, гидрокси, амино, C1-6-алкиламино, ди(C1-6-алкил)амино, нитро и циано;
n равно 2, 3, 4 или 5;
X является CH2, CO, CS, SO или SO2 и
Q является необязательно замещенной 1-индолинильной группой формулы

где R4, R5, R6, R7, R8 и R9 независимо выбраны из водорода, галогена, трифторметила, нитро, циано, C1-6-алкила, C2-6-алкенила, C2-6-алкинила, C1-6-алкокси, C1-6-алкилтио, C1-6-алкилсульфонила, гидрокси, гидрокси-C1-6-алкила, амино, C1-6-алкиламино, ди(C1-6-алкил)амино, ацила, аминокарбонила, C1-6-алкиламинокарбонила и ди(C1-6-алкил)аминокарбонила,
и любой из его энантиомеров, и их кислотно-аддитивные соли.
2. Соединение по п.1, в котором R1 и R2 оба являются галогеном.
3. Соединение по п.2, в котором R1 и R2 оба являются хлором.
4. Соединение по п.1, в котором один из R1 и R2 является галогеном, а другой является водородом.
5. Соединение по п.4, в котором R2 является галогеном.
6. Соединение по п.4, в котором R1 является галогеном.
7. Соединение по п.1, в котором R1 и R2 независимо выбраны из водорода или хлора.
8. Соединение по пп.1-7, в котором W является N.
9. Соединение по пп.1-8, в котором X является CO или CH2.
10. Соединение по п.9, в котором 1-индолинильная группа является незамещенной или замещена галогеном.
11. Соединение по п.1, в котором R3 является водородом или R3 присоединен в пара-положении фенильного кольца.
12. Соединение по п.11, в котором R3 является галогеном.
13. Фармацевтическая композиция, отличающаяся тем, что она содержит соединение по любому из пп.1-12 в терапевтически эффективном количестве вместе с одним или более фармацевтически приемлемым носителем или разбавителем.
14. Применение соединения по любому из пп.1-12 для получения лекарственного средства, полезного для лечения психоза, включая положительные и отрицательные симптомы шизофрении, аффективные расстройства, такие как общее состояние тревоги, паника и навязчивое компульсивное расстройство, депрессию, агрессию, расстройство познавательной способности и дискинезию, вызванную лечением с помощью L-допы.
15. Способ лечения психоза, включая положительные и отрицательные симптомы шизофрении, аффективные расстройства, такие как общее состояние тревоги, паника и навязчивое компульсивное расстройство, депрессию, агрессию, расстройство познавательной способности и дискинезию, вызванную лечением с помощью L-допы, включающий введение терапевтически приемлемого количества соединения по любому из пп.1-12.
Текст
1 Область техники Данное изобретение относится к новому классу галогензамещенных производных 4 фенил-1-пиперазина, -пиперидина и -тетрагидропиридина, имеющих сродство к допаминовым рецепторам D4 и D3. Соединения в соответствии с данным изобретением считаются полезными для лечения определенных психических и неврологических расстройств, включая психоз. Уровень техники Патент США 3188313 относится к определенным 1-(1-, 2- и 3-индолилалкил)пиперазинам, для которых описаны действия в качестве супрессоров ЦНС и транквилизаторов. Указано, что в данной области известны другие соединения, родственные соединениям в соответствии с данным изобретением, взаимодействующие с допаминовой и/или серотониновой системами. Так, например, в ЕР-В 1-496222 описаны соединения, имеющие формулу где Аr является фенильной группой, которая может быть замещена галогеном, алкилом, циано, гидрокси, и т.д., и Ind является 3-индолилом,который может быть замещен циано, аминокарбонилом и аминокарбониламино. Соединения,описанные в ЕР-В 1-496222, являются антагонистами и агонистами серотонина. Также отмечено, что соединения оказывают влияние на аккумуляцию допамина в полосатом теле и аккумуляцию 5-НТР в N. Raphe. Указано, что соединения пригодны в качестве анксиолитиков, антидепрессантов, нейролептиков и гипотензивных средств. В WO 99/09025 описаны определенные производные 2-(4-арилпиперазин-1-ил)метил 1 Н-индола. Соединения являются агонистами допаминового рецептора D4. Далее, в WO 94/24105 описаны производные 2-(2-4 арилпиперазин-1-ил)этил-1 Н-индола, которые имеют селективное сродство к подтипу допаминового рецептора D4. В ЕР-В 1-354094 описаны определенные оксиндолы, имеющие формулу где R1 является водородом, галогеном или алкилом, R2 является водородом или алкилом, R3 является водородом, алкилом или -S-алкилом и Аr может быть хлорфенилом и другими замещенными арильными группами. Соединения связываются с рецептором 5-НТ 1A и являются агонистами, частичными агонистами или антагонистами допаминового рецептора. Опреде 005013 2 ленные соединения оказывают действие на рецепторы 5-НТ 2. В WO 98/08816 также описаны оксиндолы,которые являются психотропными лекарственными средствами, и заявка включает данные,показывающие действие определенных соединений на рецептор D4. В Pharmazie, 1997, 52, 423-428 описаны N-[3(4-арил-1-пиперазинил)алкил] производные индолин-2(1 Н)-она, хинолин-2(1 Н)-она и изохинолин 1(2 Н)-она и их рецепторное сродство к рецепторам 5-НТ 1 А и 5-НТ 2A. Соединение 1-(3-(4-фенил-1 пиперазинил)пропил)индолин-2(1 Н)-он описано как антагонист 5-НТ 2 А со слабыми агонистическими свойствами в отношении 5-HT1A. Данное соединение считается потенциальным антидепрессантом и/или анксиолитическим агентом.Subramanian et al., в Heterocyclic Communications 1999, 5, 63-68 описаны определенные пиперазинилиндолилпропаноны,демонстрирующие антагонизм по отношению к допаминовым рецепторам D1/D2. Далее, Bottcher et al., в J. Med. Chem. 1992,35, 4020-4026 описаны определенные 3-(1,2,3,6 тетрагидро-1-пиридилалкил)ндолы, имеющие допаминэргическую активность. Наконец, в Pol. J. Pharmacol. Pharm. 1984,36, 697-703 описано соединение 1-(3-(4-(3 хлорфенил)-1-пиперазинил)пропил)индан,имеющее серотинолитические свойства. Допаминовые рецепторы D4 относятся к подсемейству допаминовых рецепторов D2, которые считаются ответственными за антипсихотическое действие нейролептиков. Побочные эффекты нейролептических лекарственных средств, которые, в первую очередь, оказывают свое действие через антагонизм к рецепторам D2, известны из-за антагонизма рецептора D2 в областях полосатого тела головного мозга. Однако допаминовые рецепторы D4 в первую очередь расположены в областях головного мозга, не относящихся к полосатому телу, из чего можно сделать вывод, что антагонисты допаминового рецептора D4 не будут иметь экстрапирамидальных побочных эффектов. Данный вывод подтверждается антипсихотическим агентом клозапином, который выказывает большее сродство к рецепторам D4, чем к рецепторам D2, и не имеет экстрапирамидальных побочных эффектов (Van Tol et al., Nature 1991, 350,610; Hadley Medicinal Research Reviews 1996, 16,507-526 и Sanner Exp. Opin. Ther. Patents 1998, 8,383-393). Несколько лигандов D4, которые постулированы как селективные антагонисты рецептораD4 (L-745,879 и U-101958), обладают антипсихотическим потенциалом (Mansbach et al., Psychopharmacology 1998, 135, 194-200). Однако недавно было сообщено, что такие соединения являются частичными агонистами рецептора D4 в различных in vitro исследованиях (Gazi et al.,Br. J. Pharmacol. 1998, 124, 889-896 и Gazi et al.,Br. J. Pharmacol. 1999, 128, 613-620). Более того, 3 было показано, что клозапин, который является эффективным антипсихотическим средством,является скрытым антагонистом (Gazi et al., Br.J. Pharmacol. 1999, 128, 613-620). Следовательно, лиганды D4, которые являются частичными агонистами или антагонистами рецептора D4, могут оказывать положительное действие на психозы. Антагонисты допамина D4 также могут использоваться для лечения нарушения познавательной способности (Jentsch et al., Psychopharmacology 1999, 142, 78-84). Также было предположено, что антагонисты допамина D4 могут быть полезны для снижения дискинезии, возникшей в результате лечения болезни Паркинсона с помощью введенияL-допа (Tahar et al., Eur. J. Pharmacol. 2000, 399,183-186). Допаминовые рецепторы D3 также относятся к подсемейству допаминовых рецепторов D2, и они преимущественно находятся в лимбических областях мозга (Sokoloff et al., Nature 1990, 347,146-151), таких как околоядерные, где блокада допаминового рецептора связана с антипсихотическим действием (Willner Int. Clinical Psychopharmacology 1997, 12, 297-308). Более того, было описано повышение уровня рецепторов D3 в лимбической части шизофренического мозга (Gurevich et al., Arch. Gen. Psychiatry 1997, 54, 225-32). Поэтому антагонисты рецепторов D3 могут иметь потенциал для эффективной антипсихотической терапии, не вызывающей экстрапирамидальных побочных эффектов, присущих классическим антипсихотическим лекарственным средствам, которые, преимущественно, оказывают действие через блокаду рецепторов D2 (Shafer et al. Psychopharmacology 1998, 135, 1-16; Schwartz et al. Brain Research Reviews 2000, 31, 277-287). Более того, блокада рецептора D3 дает незначительное стимулирование в префронтальной области коры головного мозга (Merchant etal. Cerebral Cortex 1996, 6, 561-570), что весьма благоприятно для лечения отрицательных симптомов и нарушения познавательной способности, связанных с шизофренией. Кроме того, антагонисты допамина D3 могут восстанавливатьal. Eur. J. Pharmacol. 1997, 321, R7-R9), и не вызывать изменений в пролактине (Reavill et al. J.Pharnacol. Exp. Ther. 2000, 294, 1154-1165). Следовательно, антагонистические свойства антипсихотических лекарственных средств в отношении D3 снижают отрицательные симптомы и нарушение познавательной способности и вызывают менее выраженные побочные эффекты в отношении к EPS и гормональных изменений. Агонисты допамина D3 также считаются пригодными для лечения шизофрении (Wustow etal. Current Pharmaceutical Design 1997, 3, 391-404). Согласно данному изобретению представлен новый класс лигандов допаминового рецептора D4. Большинство соединений в соответст 005013 4 вии с данным изобретением также имеют высокую степень сродства к допаминовому рецептору D3 и, как отмечено выше, антагонистические свойства к допамину D3 антипсихотических лекарственных средств могут снижать отрицательные симптомы и нарушения познавательной способности при шизофрении и приводить к менее выраженным побочным эффектам. Более того, определенные соединения в соответствии с данным изобретением обладают таким преимуществом, как незначительное действие на адренергические альфа-1-рецепторы,что означает практическое отсутствие предрасположенности к ортостатической гипотензии. Краткое описание изобретения Данное изобретение относится к новым замещенным галогеном производным 4-фенил 1-пиперазина, -пиперидина и тетрагидропиридина формулы IR1 и R2 независимо выбраны из водорода и галогена, при условии, что по крайней мере один из R1 и R2 является атомом галогена;Q является необязательно замещенной 1 индолинильной группой формулы где R4, R5, R6, R7, R8 и R9 независимо выбраны из водорода, галогена, трифторметила, нитро,циано, C1-6-алкила, С 2-6-алкенила, С 2-6-алкинила,C1-6-алкокси, С 1-6-алкилтио, C1-6-алкилсульфонила, гидрокси, гидрокси-C1-6-алкила, амино,C1-6-алкиламино, ди(C1-6-алкил) амино, ацила,аминокарбонила, C1-6-алкиламинокарбонила и ди (С 1-6-алкил)аминокарбонила,и любому из их энантиомеров и их кислотно-аддитивным солям. В одном варианте изобретения R1 и R2 оба являются галогеном. В предпочтительном варианте R1 и R2 оба являются хлором. В другом варианте один из R1 и R2 является галогеном, а другой является водородом. В следующем варианте R2 является галогеном. Согласно другому варианту изобретения R1 и R независимо выбраны из водорода или хлора. В другом конкретном варианте данного изобретения W является N. В предпочтительном варианте изобретенияX является СО или СН 2. В другом предпочтительном варианте изобретения 1-индолинильная группа является незамещенной или замещена галогеном. В следующем варианте изобретения R3 является водородом или R3 присоединен в параположении фенильного кольца. Предпочтительно R3 является галогеном. Было обнаружено, что соединения в соответствии с данным изобретением обладают высоким сродством к допаминовым рецепторам D4 и D3, в определенных случаях в совокупности с очень незначительным действием на адренергические альфа-1-рецепторы. Соединения в соответствии с данным изобретением считаются полезными для лечения психоза, включая положительные и отрицательные симптомы шизофрении. Более того, определенные соединения также обладают тем преимуществом, что оказывают очень слабое действие на адренергические альфа-1-рецепторы, что подразумевает практическое отсутствие предрасположенности к ортостатической рипотензии. Некоторые из соединений взаимодействуют с центральными серотонергическими рецепторами, например рецепторами 5-HT1A или 5-НТ 2A и/или они действуют как ингибиторы повторного поглощения 5-НТ. Поэтому данные соединения в соответствии с данным изобретением могут использоваться также для лечения расстройств, вызываемых дисбалансом в серотонергической системе, включая аффективные расстройства, такие как общее состояние тревоги, паника и навязчивое компульсивное расстройство, депрессия и агрессия. В частности, соединения в совокупности с действием на допаминовые рецепторы D4 и рецепторы 5-НТ и/или транспортер 5-НТ обладают преимуществом улучшенного действия на другие психиатрические симптомы, связанные с шизофренией, такие как симптомы депрессии и тревоги. Таким образом, в другом аспекте, данное изобретение представляет фармацевтическую композицию, содержащую, по крайней мере, одно соединение формулы I, как определено выше, или его фармацевтически приемлемую кислотноаддитивную соль в сочетании с одним или более фармацевтически приемлемыми носителями или разбавителями. Данное изобретение также относится к использованию соединения в соответствии с данным изобретением для получения лекарственного средства, используемого для лечения психоза,включая положительные и отрицательные сим 2 6 птомы шизофрении, аффективные расстройства,такие как общее состояние тревоги, паника и навязчивое компульсивное расстройство, депрессию,агрессию, расстройство познавательной способности и дискинезию, вызванную лечением с использованием L-допа. Подробное описание изобретения Некоторые соединения формулы I существуют в виде оптических изомеров, и такие оптические изомеры также включены в объем данного изобретения. Термин C1-6-алкил относится к разветвленным или неразветвленным алкильным группам,содержащим от одного до шести атомов углерода,таким как метил, этил, 1-пропил, 2-пропил, 1 бутил, 2-бутил, 2-метил-2-пропил и 2-метил-1 пропил. Термины C1-6-алкокси, C1-6-алкилтио, С 1-6 алкиламино, ди(C1-6-алкил)амино и т.д. обозначают указанные группы, в которых алкильная группа является C1-6-алкилом, таким как определено выше. Термин арил относится к карбоциклическим ароматическим группам, таким как фенил, нафтил,в частности фенил, включая замещенный метилом нафтил или фенил. Термин аралкил означает арил-С 1-6-алкил,где арил и C1-6-алкил, такие как определено выше. Термины аралкокси и арилокси означают арил-С 1-6-алкил-О- и арил-О-, где арил и C1-6 алкил такие, как определено выше. Галоген означает фтор, хлор, бром или йод. Группа Q , в которой Z такой, как определено выше, включает такие группы, как 7 где R4 - R9, такие как определено выше, и пунктирная линия означает необязательную связь. Предпочтительными соединениями в соответствии с данным изобретением являются соединения, выбранные из 3-[4-(2,3-дихлорфенил)пиперазин-1-ил]-1(2,3-дигидро-1 Н-индол-1-ил)пропан-1-она,4-[4-(2,3-дихлорфенил)пиперазин-1-ил]-1(2,3-дигидро-1 Н-индол-1-ил)бутан-1-она,5-[4-(2,3-дихлорфенил)пиперазин-1-ил]-1(2,3-дигидро-1 Н-индол-1-ил)пентан-1-она,4-[4-(2-хлорфенил)пиперазин-1-ил]-1-(2,3 дигидро-1 Н-индол-1-ил)бутан-1-она,4-[4-(3-хлорфенил)пиперазин-1-ил]-1-(2,3 дигидро-1 Н-индол-1-ил)бутан-1-она,1-3-[4-(2,3-дихлорфенил)пиперазин-1-ил] пропил-2,3-дигидро-1 Н-индола,1-4-[4-(2,3-дихлорфенил)пиперазин-1-ил] бутил-2,3-дигидро-1 Н-индола,1-5-[4-(2,3-дихлорфенил)пиперазин-1-ил] пентил-2,3-дигидро-1 Н-индола,1-4-[4-(2-хлорфенил)пиперазин-1-ил]бутил-2,3-дигидро-1 Н-индола,1-4-[4-(3-хлорфенил)пиперазин-1-ил]бутил-2,3-дигидро-1 Н-индола,1-(2,3-дихлорфенил)-4-[4-(индан-1-ил)бутил]пиперазина,6-хлор-3-2-[4-(2,3-дихлорфенил)пиперазин-1-ил]этилсульфанил-1 Н-индола,3-3-[4-(2,3-дихлорфенил)пиперазин-1-ил] пропил-1 Н-индола,3-4-[4-(2,3-дихлорфенил)пиперазин-1-ил] бутил-1 Н-индола,3-3-[4-(2,3-дихлорфенил)пиперазин-1-ил] пропил-5-фтор-1 Н-индола,3-4-[4-(2,3-дихлорфенил)пиперазин-1-ил] бутил-5-фтор-1 Н-индола,6-хлор-3-3-[4-(2,3-дихлорфенил)пиперазин-1-ил]пропил-1 Н-индола,1-4-[4-(2,3-дихлорфенил)пиперазин-1-ил] бутил-3,4-дигидрохинолин-2(1 Н)-она,3-[4-(2,3-дихлорфенил)пиперазин-1-ил]-1(5-фтор-2,3-дигидро-1 Н-индол-1-ил)пропан-1 она,4-[4-(2,3-дихлорфенил)пиперазин-1-ил]-1(5-фтор-2,3-дигидро-1 Н-индол-1-ил)бутан-1 она,5-[4-(2,3-дихлорфенил)пиперазин-1-ил]-1(5-фтор-2,3-дигидро-1 Н-индол-1-ил)пентан-1 она,3-[4-(2,3-дихлорфенил)пиперазин-1-ил]-1(3,4-дигидро-1 Н-изохинолин-2-ил)пропан-1-она,4-[4-(2,3-дихлорфенил)пиперазин-1-ил]-1(3,4-дигидро-1 Н-изохинолин-2-ил)бутан-1-она,5-[4-(2,3-дихлорфенил)пиперазин-1-ил]-1(3,4-дигидро-1 Н-изохинолин-2-ил)пентан-1-она,3-[4-(2-хлорфенил)пиперазин-1-ил]-1-(2,3 дигидро-1 Н-индол-1-ил)пропан-1-она,5-[4-(2-хлорфенил)пиперазин-1-ил]-1-(2,3 дигидро-1 Н-индол-1-ил)пентан-1-она,3-[4-(3-хлорфенил)пиперазин-1-ил]-1-(2,3 дигидро-1 Н-индол-1-ил)пропан-1-она, 005013 8 5-[4-(3-хлорфенил)пиперазин-1-ил]-1-(2,3 дигидро-1 Н-индол-1-ил)пентан-1-она,3-[4-(3-хлорфенил)пиперазин-1-ил]-1-(5 фтор-2,3-дигидро-1 Н-индол-1-ил)пропан-1-она,5-[4-(3-хлорфенил)пиперазин-1-ил]-1-(5 фтор-2,3-дигидро-1 Н-индол-1-ил)пентан-1-она,3-[4-(2-хлорфенил)пиперазин-1-ил]-1-(5 фтор-2,3-дигидро-1 Н-индол-1-ил)пропан-1-она,4-[4-(2-хлорфенил)пиперазин-1-ил]-1-(5 фтор-2,3-дигидро-1 Н-индол-1-ил)бутан-1-она,3-[4-(3-хлорфенил)пиперазин-1-ил]-1-(3,4 дигидро-1 Н-изохинолин-2-ил)пропан-1-она,5-[4-(3-хлорфенил)пиперазин-1-ил]-1-(3,4 дигидро-1 Н-изохинолин-2-ил)пентан-1-она,3-[4-(2-хлорфенил)пиперазин-1-ил]-1-(3,4 дигидро-1 Н-изохинолин-2-ил)пропан-1-она,4-[4-(2-хлорфенил)пиперазин-1-ил]-1-(3,4 дигидро-1 Н-изохинолин-2-ил)бутан-1-она,1-(2,3-дигидро-1 Н-индол-1-ил)-3-[4-(2 фторфенил)пиперазин-1-ил]пропан-1-она,1-(2,3-дигидро-1 Н-индол-1-ил)-4-[4-(2 фторфенил)пиперазин-1-ил]бутан-1-она,1-(2,3-дигидро-1 Н-индол-1-ил)-5-[4-(2 фторфенил)пиперазин-1-ил]пентан-1-она,1-(5-фтор-2,3-дигидро-1 Н-индол-1-ил)-3[4-(2-фторфенил)пиперазин-1-ил]пропан-1-она,1-(5-фтор-2,3-дигидро-1 Н-индол-1-ил)-4[4-(2-фторфенил)пиперазин-1-ил]бутан-1-она,1-(5-фтор-2,3-дигидро-1 Н-индол-1-ил)-5[4-(2-фторфенил)пиперазин-1-ил]пентан-1-она,3-[4-(2,4-дифторфенил)пиперазин-1-ил]-1(2,3-дигидро-1 Н-индол-1-ил)пропан-1-она,4-[4-(2,4-дифторфенил)пиперазин-1-ил]-1(2,3-дигидро-1 Н-индол-1-ил)бутан-1-она и 5-[4-(2,4-дифторфенил)пиперазин-1-ил]-1(2,3-дигидро-1 Н-индол-1-ил)пентан-1-она и их фармацевтически приемлемых кислотно-аддитивных солей. Кислотно-аддитивными солями соединений в соответствии с данным изобретением могут быть фармацевтически приемлемые соли,полученные с нетоксичными кислотами. Примерами таких органических солей являются соли с малеиновой, фумаровой, бензойной, аскорбиновой, янтарной, щавелевой, бис-метиленсалициловой, метансульфоновой, этандисульфоновой, уксусной, пропионовой, винной, салициловой, лимонной, глюконовой, молочной,яблочной, миндальной, коричной, цитраконовой, аспаргиновой, стеариновой, пальмитиновой, итаконовой, гликолевой, п-аминобензойной, глутаминовой, бензолсульфоновой и теофиллинуксусной кислотами, а также с 8-галотеофиллинами, например, 8-бромтеофиллином. Примерами таких неорганических солей являются соли с хлористо-водородной, бромисто-водородной, серной, сульфаминовой, фосфорной и азотной кислотами. Соединения в соответствии с данным изобретением могут быть получены следующим образом: 9 а) восстановлением карбонильной группы соединения формулы III 10 гидной, либо активированной группой карбоновой кислоты;f) катализируемым кислотой Льюиса расщеплением полимер-связанного сложного эфира формулы X с использованием амина формулы где R1, R2, R3, W, n, Q и пунктирная линия, такие как определено выше;b) алкилированием амина формулы IV реагентом формулы V где R1, R2, R3, Q', W, n и пунктирная линия такие, как определено выше, илиg) восстановлением двойной связи в соединении формулы XI где R1, R2, R3, X, W, n, Q и пунктирная линия,такие как определено выше, и G является подходящей уходящей группой, такой как галоген,мезилат или тозилат; с) восстановительным алкилированием амина формулы IV реагентом формулы VII где R1, R2, R3, X, n, W, Q и пунктирная линия такие, как определено выше, и Е является либо альдегидной, либо активированной группой карбоновой кислоты;d) восстановлением амидной группы соединения формулы VIII где R1, R2, R3, X, n, W, Q и пунктирная линия,такие как определено выше; е) ацилированием или восстановительным алкилированием амина формулы II' где Z1 является 3-4 членной цепью, где указанные члены выбраны из С, СН, СН 2, СО и NH,при условии, что один из членов цепи являетсяNH, и где указанная цепь необязательно содержит одну или две двойные связи, реагентом формулы IX где R1, R2, R3, n, W и пунктирная линия, такие как определено выше, и Е является либо альде где R1, R2, R3, n, X и Q такие, как определено выше, после чего соединение формулы I выделяют в виде свободного основания или кислотно-аддитивной соли. Восстановление способом а) предпочтительно проводят в инертном органическом растворителе, таком как диэтиловый эфир или тетрагидрофуран, в присутствии алана или алюмогидрида лития, при температуре от 0 С до температуры кипения с обратным холодильником. Способ b) может быть использован для получения исходного вещества формулы III. Алкилирование способом b) предпочтительно проводят в инертном растворителе, таком как спирт или кетон с подходящей температурой кипения, предпочтительно в присутствии органического или неорганического основания(карбоната калия, диизопропилэтиламина или триэтиламина), при температуре кипения с обратным холодильником. Альтернативно, алкилирование может быть проведено при фиксированной температуре, которая отличается от температуры кипения, в одном из указанных выше растворителей или в диметилформамиде(ДМФ), диметилсульфоксиде (ДМСО) или Nметилпирролидин-2-оне (NMP), предпочтительно в присутствии основания. Амины формулы IV либо коммерчески доступны, либо известны из литературы (например, Oshiro et al. J. Med. Chem. 1991, 34,2014-2023, Oshiro et al. J. Med. Chem. 1998, 41,658-667 и Oshiro et al. J. Med. Chem. 2000, 43,177-189). Алкилирующие агенты формулы V известны из литературы, или они могут быть получены способами, очевидными для специалиста в данной области, в аналогичной синтетической последовательности. Таким образом,ключевые промежуточные соединения, такие как галоген-(2,3-дигидро-1 Н-индол-1-ил)алкан 1-он получают добавлением галогеналканоил 11 хлорида к 2,3-дигидро-1 Н-индолу в присутствии основания. Также галоген-(3,4-дигидро-1 Низохинолин-2-ил)алкан-1-он может быть получен из галогеналканоилхлорида и 3,4-дигидро 1 Н-изохинолина. 2,3-Дигидро-1 Н-индолы являются либо коммерчески доступными, либо их получают из соответствующих 1 Н-индолов восстановлением 1 Н-индола, например цианборгидридом натрия в уксусной кислоте или в трифторуксусной кислоте, в то время как 3,4 дигидро-1 Н-изохинолины являются коммерчески доступными или описаны в литературе. Алкилирующие галгеноалкил-1 Н-индолы получают способами, известными из литературы (Benghiat et al. J. Med. Chem. 1983, 26, 1470-1477),или аналогично способам, описанным в литературе (Brodfuehrer et al. J. Оrg. Chem. 1997, 62,9192 и WO 00/35872). Алкилирующие 3 галогеналкилинданы или другие типы алкилирующих алкилинданов могут быть получены из известных инданилалканкарбоновых кислот(Mukhopadhyay et al. J. Indian. Chem. Soc. 1985,62, 690-692 и Tanaka et al. J. Med. Chem. 1994,31, 2071-2078) по известным методикам. Алкилирующий 1-(галогеналкил)-3,4-дигидрохинолин-1(1 Н)-он может быть получен как описано в ЕР-В 1-512525. Восстановительное алкилирование способами с) и е) может быть проведено в две стадии,например конденсацией аминов формул VI/II' с реагентами формул VII/IX стандартными способами с использованием хлорангидрида карбоновой кислоты, активированных сложных эфиров или с использованием карбоновых кислот в сочетании с конденсирующими агентами, такими как дициклогексилкарбодиимид, с последующим восстановлением полученного амида алюмогидридом лития или аланом. Данная реакция также может быть проведена стандартным способом в одном сосуде, например при использовании восстановительного аминирования аминов формул VI/II' альдегидами формул VII/IX. Карбоновые кислоты или альдегиды формулыVII либо являются коммерчески доступными,либо описаны в литературе. Таким образом, в литературе описаны ключевые промежуточные соединения, такие как инданилалканкарбоновые кислоты (Mukhopadhyay et al. J. Indian. Chem.(WO 98/28293 и Ly et al. Tetrahedron Lett. 1999,40, 2533-2536). Другие замещенные (1 Н-индол 3-ил)алканкарбоновые кислоты могут быть получены удлинением цепи легко доступных 3 индолглиоксилилхлоридов (Speeter et al. J. Am.Synthesis. 1999, 6, 935-938). 3-Индолглиоксилилхлориды могут быть получены из коммерчески доступных 1 Н-индолов. Различные заме 005013(1 Н-индол-3-илсульфанил)алканкарбоновые кислоты могут быть получены способом, аналогично описанному для аминоалкилсульфанил-1 Н-индолов (Zelesko et al. J. Med.situ алкилированием замещенного 3-индолилтиолата натрия алкилгалогеналканоатами и последующим гидролизом эфирной группы. Восстановление амидных групп способомd) наиболее предпочтительно проводят с использованием алюмогидрида лития или алана в инертном органическом растворителе, таком как, например, тетрагидрофуран или диэтиловый эфир, при температуре от 0 С до температуры кипения с обратным холодильником. Ацилирование по способу е) может быть проведено по стандартной методике, описанной в литературе, например конденсацией аминов формулы Q' с реагентом формулы IX стандартными способами с использованием хлорангидрида карбоновой кислоты, активированных сложных эфиров или с использованием карбоновых кислот в сочетании с конденсирующими агентами, такими как дициклогексилкарбодиимид. Катализируемое кислотой Льюиса превращение сложного эфира в амид способом f) может быть проведено стандартными способами, описанными в литературе (Barn et al. Tet.Lett. 1996, 37, 3213-3216). Полимер-связанный сложный эфир X также может быть синтезирован способом, описанным в литературе (см.,например, Barn et al. Tet. Lett. 1996, 37, 32133216). Восстановление двойной связи способомg) обычно проводят каталитическим гидрированием при низком давлении ( 3 атм.) в аппарате Парра или с использованием восстанавливающего агента, такого как диборан или бористоводородное производное, получаемое in situ из(ТГФ), диоксан или диэтиловый эфир. Экспериментальная часть Температуры плавления определены на приборе Buchi B-535 и являются нескорректированными. Масс-спектр получают на приборе системы Quattro MS-MS (VG Biotech, FisonsInstruments) или Sciex API 150EX (Perkin Elmer). Спектры получают при двух вариантах условий работы при использовании либо электрораспылительной ионизации, либо ACPI: один вариант для получения информации о молекулярной массе и другой вариант для индуцирования моделей фрагментации. 1 Н ЯМР спектр записывают при 250,13 МГц на Bruker АС 250 или при 500,13 МГц на Bruker DRX 500. Дейтерированный хлороформ (99,8% D) или диметилсульфоксид (99,9% D) используют в качестве растворителей. В качестве внутреннего стандарта используют ТМС. Химические сдвиги выражают в миллионных долях (м.д.). Следующие аббревиа 13 туры используют для мультиплетности сигналов ЯМР: с - синглет, д - дублет, т - триплет, к квартет, кв - квинтет, г - гептет, дд - дублет дублетов, дт - дублет триплетов, дк - дублет квартетов, тт - триплет триплетов, м - мультиплет, ш широкий. ЯМР сигналы соответствующие протонам кислоты до некоторой степени пропущены. Содержание воды в кристаллических соединениях определяют титрованием по Карлу Фишеру. Для хроматографии на колонке используют силикагель типа Kieselgel 60, 40-60 мешASTM. Получение промежуточных соединений А. Алкилирующие реагенты 3-Хлор-1-(2,3-дигидро-1 Н-индол-1-ил)пропан-1-он Смесь 2,3-дигидро-1 Н-индола (50 г), триэтиламина (132 г) и тетрагидрофурана (1000 мл) охлаждают до температуры 10 С с последующим добавлением (в течение 60 мин) раствора 3-хлорпропаноилхлорида (55 г) в тетрагидрофуране (400 мл). Смесь фильтруют и оставшийся раствор выпаривают в вакууме досуха. Остаток очищают флэш-хроматографией (элюент: этилацетат/гептан 1:3) с получением указанного в заголовке соединения в виде кристаллического белого вещества (31 г). Аналогичным способом получают следующие соединения: 4-хлор-1-(2,3-дигидро-1 Н-индол-1-ил)бутан-1-он из 2,3-дигидро-1 Н-индола и 4 хлорбутаноилхлорида; 5-бром-1-(2,3-дигидро-1 Н-индол-1-ил)пентан-1-он из 2,3-дигидро-1 Н-индола и 5 бромпентаноилхлорида. Следующие два соединения получают, как описано в Benghiat et al. J. Med. Chem. 1983, 26,1470-1477: 3-(3-бромпропил)-lH-индол,3-(4-бромбутил)-1 Н-индол,3-(3-хлорпропил)-5-фтор-1 Н-индол. 5-Хлорпентан-1-ол (16,2 мл) растворяют в холодном 5 мМ 2,2,6,6-тетраметилпиперидин-1 илоксисоединение (быстро) в дихлорметане(240 мл) и охлаждают до температуры 0 С на ледяной бане. Добавляют бромид калия (0,5 М в воде, 24 мл), затем добавляют (одной порцией при температуре 5 С при энергичном перемешивании) раствор гидрокарбоната натрия (24 г) в водном гипохлорите натрия (0,3 М, 500 мл). Полученную смесь перемешивают при температуре 5 С в течение 20 мин и фазы разделяют. Водную фазу экстрагируют дихлорметаном (200 мл) и объединенные органические фазы выпаривают в вакууме с получением 5-хлорпентаналя в виде чистого масла (16 г). Далее, 5 хлорпентаналь суспендируют в воде (100 мл) с последующим добавлением гидрохлорида 4 фторфенилгидразина (19,5 г) и толуола (800 мл) и смесь перемешивают при комнатной температуре в течение 15 мин. Добавляют фосфорную кислоту (85%, 100 мл) и смесь кипятят с обрат 005013 14 ным холодильником в течение 2 ч. Смесь охлаждают до комнатной температуры и фазы разделяют. Органическую фазу промывают насыщенным водным гидрокарбонатом натрия, сушат (MgSO4) и выпаривают в вакууме с получением оранжевого масла. Неочищенный продукт очищают флэш-хроматографией на силикагеле(элюент:этилацетат/гептан 1:4) с получением указанного в заголовке соединения в виде оранжевого масла (14 г). Аналогичным способом получают следующее соединение: 3-(4-Хлорбутил)-5-фтор 1 Н-индол из 6-хлоргексан-1-ола и гидрохлорида 4-фторфенилгидразина. 6-Хлор 3-(3-йодпропил)-1H-индол 2-(6-хлор-1 Н-индол-3-ил)этанол (25 г, получен аналогично соединениям, описанным вDemerson et al. J. Med. Chem. 1976, 19, 391-395 из 6-хлор-1 Н-индола и оксалилхлорида) растворяют в тетрагидрофуране (300 мл) с последующим добавлением триэтиламина (17,7 мл). Полученную смесь охлаждают до температуры 56 С с последующим добавлением раствора хлорангидрида метансульфокислоты (14,6 г) в тетрагидрофуране (100 мл). Смесь перемешивают при комнатной температуре в течение 2 ч,фильтруют и выпаривают досуха в вакууме. Остаток растворяют в ацетоне с последующим добавлением йодида натрия (96,2 г) и полученную смесь кипятят с обратным холодильником в течение 4 ч. Смесь выливают в насыщенный раствор соли и водную фазу экстрагируют этилацетатом. Объединенные органические фазы сушат (MgSO4), фильтруют и концентрируют в вакууме (38,2 г). Остаток (30 г) растворяют в диметилсульфоксиде (ДМСО, 200 мл) и по каплям добавляют суспензию NaCN (15 г) и ДМСО(250 мл) при температуре 80 С. Полученную смесь перемешивают при температуре 100 С в течение 1 ч, охлаждают до комнатной температуры и выливают в насыщенный раствор соли. Водную фазу экстрагируют диэтиловым эфиром и объединенные органические фазы сушат(MgSO4), фильтруют и концентрируют в вакууме с получением неочищенного промежуточного соединения (22,5 г). Остаток растворяют в метаноле (750 мл) и добавляют смесьHCl/метанол с получением объединенного раствора, содержащего около 1 М НСl в метаноле. Смесь перемешивают при комнатной температуре в течение 24 ч с последующим нагреванием при температуре 40 С в течение еще 3 ч. Растворитель удаляют в вакууме и остаток растворяют в смеси диэтилового эфира и воды. Полученную смесь перемешивают при комнатной температуре в течение 30 мин и фазы разделяют. Водную фазу экстрагируют еще два раза диэтиловым эфиром и объединенные органические фазы промывают насыщенным раствором соли, сушат (MgSO4), фильтруют и концентрируют в вакууме (18,2 г). Остаток растворяют в тетрагидрофуране (300 мл) и по каплям добав 15 ляют суспензию LiAlН 4 (11,6 г) в тетрагидрофуране (1000 мл). Полученную смесь кипятят с обратным холодильником в течение 3 ч, охлаждают до температуры 10 С и обрабатывают эквивалентным количеством воды. Органическую фазу сушат (MgSO4), фильтруют и концентрируют в вакууме (16,6 г). Остаток (8 г) растворяют в тетрагидрофуране (100 мл) и триэтиламине (3,9 г) и охлаждают до температуры 10 С с последующим добавлением раствора хлорангидрида метансульфокислоты (4,4 г) в тетрагидрофуране(50 мл). Смесь перемешивают при комнатной температуре в течение 2 ч и затем выпаривают досуха в вакууме. Остаток растворяют в ацетоне с последующим добавлением NaI (28,6 г) и полученную смесь кипятят с обратным холодильником в течение 3 ч. Смесь выливают в насыщенный раствор соли и водную фазу экстрагируют тетрагидрофураном. Объединенные органические фазы сушат (MgSO4), фильтруют и концентрируют в вакууме (17,4 г). Аналогичным способом получают следующее соединение: 4-(индан-1 ил)бутилметансульфонат из 4-(индан-1 ил)бутановой кислоты, полученной методом,описанным в Mukhopadhyay et al. J. Indian.Chem. Soc. 1985, 62, 690-692. 1-(4-Бромбутил)-3,4-дигидрохинолин 2(1H)-он Суспензию гидрида натрия (6,8 г, 60% дисперсия в минеральном масле) и диметилформамид (200 мл) выдерживают при температуре 20-30 С с последующим добавлением раствора 3,4-дигидрохинолин-2(1 Н)-она (25 г) в диметилформамиде (100 мл). Полученную смесь перемешивают при комнатной температуре в течение 30 мин с последующим добавлением раствора 1,4-дибромбутана (184 г) в диметилформамиде (200 мл) при температуре 20-40 С. Реакционную смесь перемешивают при комнатной температуре в течение 30 мин и выпаривают в вакууме. Оставшееся масло выливают в ледяную воду и экстрагируют этилацетатом. Объединенные органические фазы промывают водой и насыщенным раствором соли, обрабатывают углем, сушат (MgSO4) и выпаривают в вакууме. Оставшееся масло очищают флэшхроматографией (элюент: этилацетат/гептан 1:1) с получением указанного в заголовке соединения в виде красного масла (36 г). В. Ацилирующие реагенты(7,6 г) растворяют в метаноле (150 мл) с последующим добавлением раствора йод/йодид калия(1 М, 100 мл) при перемешивании. Раствор перемешивают при комнатной температуре в течение 2 ч и затем выпаривают в вакууме с получением масла. Добавляют гидроксид натрия (1,5 М, 200 мл) и раствор нагревают до температуры 16 90 С в течение 90 мин. Раствор охлаждают до комнатной температуры и экстрагируют диэтиловым эфиром (отбрасывают). В водную фазу добавляют диэтиловый эфир (100 мл) и этилхлорацетат (10 мл) и полученную смесь перемешивают при комнатной температуре в течение 16 ч. Фазы разделяют и водную фазу экстрагируют диэтиловым эфиром. Объединенные органические фазы собирают и сушат (MgSO4). Суспензию фильтруют и органическую фазу выпаривают досуха с получением коричневого масла (18,1 г). Масло растворяют в этаноле (50 мл) с последующим добавлением раствора гидроксида калия (4,0 г) в воде (50 мл). Полученную смесь кипятят с обратным холодильником в течение 2 ч и охлаждают до комнатной температуры. рН смеси доводят до 3-4 добавлением хлористо-водородной кислоты (1 М). Добавляют воду (100 мл) и водную фазу экстрагируют этилацетатом. Объединенные органические фазы сушат (MgSO4), фильтруют и выпаривают в вакууме с получением указанного в заголовке соединения в виде масла (12,3 г). Получение соединений в соответствии с данным изобретением Пример 1. 1 а,3-[4-(2,3-Дихлорфенил)пиперазин-1-ил]-1-(2,3-дигидро-1 Н-индол-1-ил)пропан-1-он. Смесь гидрохлорида 1-(2,3-дихлорфенил) пиперазина (8,0 г) и карбоната калия (15 г) в смеси бутанона (50 мл) и диметилформамида (5 мл) нагревают до температуры 50 С с последующим добавлением 3-хлор-1-(2,3-дигидро 1 Н-индол-1-ил)пропан-1-она (6,0 г). Полученную смесь кипятят с обратным холодильником в течение 40 ч и фильтруют горячей. Оставшуюся органическую фазу оставляют кристаллизоваться, белое кристаллическое вещество отфильтровывают и промывают ацетоном (8,5 г). Т. пл. 157-158 С. 1 Н ЯМР (ДMCO-d6): 2,60 (с, 4 Н); 2,60-2,80(м, 4 Н); 3,00 (с, 4 Н); 3,15 (т, 2 Н); 4,10 (т, 2 Н); 6,95 (т, 1 Н); 7,10-7,15 (м, 2 Н); 7,20 (д, 1 Н); 7,257,35 (м, 2 Н); 8,10 (д, 1 Н). МС m/z: 404(МН+), 243. 1b,4-[4-(2,3-Дихлорфенил)пиперазин-1 ил]-1-(2,3-дигидро-1 Н-индол-1-ил)бутан-1-он Смесь гидрохлорида 1-(2,3-дихлорфенил) пиперазина (8,0 г) и диизопропилэтиламина (10 мл) в диметилформамиде (50 мл) нагревают до температуры 45 С с последующим добавлением 4-хлор-1-(2,3-дигидро-1 Н-индол-1-ил)бутан-1 она (6,7 г). Полученную смесь нагревают до температуры 100 С в течение 6 ч, охлаждают до комнатной температуры и выливают в воду. Водную фазу экстрагируют диэтиловым эфиром и объединенные органические фазы сушат(MgSO4), фильтруют и выпаривают в вакууме с получением черного масла (14,2 г). Масло кристаллизуют из ацетона и полученные кристаллы перекристаллизовывают из этанола с получени 17 ем белого кристаллического вещества (3,8 г). Т. пл. 134-136 С. 1(15 мл) в бутаноне (50 мл) нагревают до температуры 45 С с последующим добавлением 5 бром-1-(2,3-дигидро-1 Н-индол-1-ил)пентан-1 она (5,4 г). Полученную смесь кипятят с обратным холодильником в течение 40 ч и фильтруют горячей. Оставшуюся органическую фазу оставляют кристаллизоваться, белое кристаллическое вещество отфильтровывают и промывают ацетоном (3,8 г). Т. пл. 121-123 С. 1 Н ЯМР (ДМСО-d6): 1,50-1,70 (м, 4 Н); 2,30-2,65 (м, 8 Н); 3,00 (с, 4 Н); 3,15 (т, 2 Н); 4,10(т, 2 Н); 6,95 (т, 1 Н); 7,10-7,15 (м, 2 Н); 7,20 (д,1 Н); 7,25-7,35 (м, 2 Н); 8,10 (д, 1 Н). МС m/z: 432(МН+), 315, 202. Аналогичным способом получают следующие соединения. 1d,4-[4-(2-Хлорфенил)пиперазин-1-ил]-1(2,3-дигидро-1 Н-индол-1-ил)бутан-1-он из гидрохлорида 1-(2-хлорфенил)пиперазина и 4-хлор 1-(2,3-дигидро-1 Н-индол-1-ил)бутан-1-она. Т. пл. 119-121 С. 1 Н ЯМР (ДMCO-d6): 1,75-1,85 (м, 2 Н); 2,35-2,50 (м, 4 Н); 2,55 (с, 4 Н); 3,95 (с, 4 Н); 3,15(д, 1 Н). МС m/z: 384(МН+), 265, 188. Пример 2. 2 а, Гидрохлорид 1-3-[4-(2,3 дихлорфенил)пиперазин-1-ил]пропил-2,3-дигидро-1 Н-индола. Алюмогидрид лития (1,8 г) суспендируют в тетрагидрофуране (30 мл) при температуре 0 С и суспензию добавляют к раствору трихлорида алюминия (1,8 г) в тетрагидрофуране (30 мл) при температуре 0-5 С в течение 15 мин. К смеси добавляют раствор 1 а,3-[4-(2,3 дихлорфенил)пиперазин-1-ил]-1-(2,3-дигидро 1 Н-индол-1-ил)пропан-1-она (5 г) в тетрагидрофуране (50 мл) при температуре 0-10 С. Полученную смесь перемешивают в течение 30 мин 18 при температуре 5 С и затем в течение 2 ч при комнатной температуре. Реакционную смесь гасят водой и гидроксидом натрия (28%) и фильтруют. Органическую фазу выпаривают досуха в вакууме и указанное в заголовке соединение осаждают в виде гидрохлорида и перекристаллизовывают из этанола (3,8 г). Т. пл. 214-226 С. 1 Н ЯМР (ДМСО-d6): 2,05-2,20 (м, 2 Н); 2,95(д, 2 Н); 6,70 (ш.с, 2 Н); 7,05 (т, 1 Н); 7,10 (д, 1 Н); 7,20 (д, 1 Н); 7,30-7,40 (м, 2 Н); 11,45 (ш.с). МС m/z: 390(MH+), 271, 132. Аналогичным способом получают следующие соединения. 2b, оксалат 1-4-[4-(2,3-Дихлорфенил)пиперазин-1-ил]бутил-2,3-дигидро-1 Н-индола из 1b,4-[4-(2,3-дихлорфенил)пиперазин-1-ил]-1(2,3-дигидро-1 Н-индол-1-ил)бутан-1-она. Т. пл. 157-160 С. 1 Н ЯМР (ДМСО-d6): 1,55-1,65 (м, 2 Н); 1,65-1,75 (м, 2 Н); 2,90 (т, 2 Н); 2,95 (т, 2 Н); 3,05 19 Смесь гидрохлорида 1-(2,3-дихлорфенил) пиперазина (3,5 г) и диизопропилэтиламина в смеси метилизобутилкетона (50 мл) и диметилформамида (5 мл) нагревают до температуры 60 С с последующим добавлением 4-(индан-1 ил)бутилметансульфоната (3,5 г) в метилизобутилкетоне (10 мл). Полученную смесь кипятят с обратным холодильником в течение 5 ч и концентрируют в вакууме. Продукт очищают флэшхроматографией на силикагеле (элюент этилацетат) с получением неочищенного продукта,который далее осаждают в виде оксалата (0,7 г). Т. пл. 171-176 С. 1 Н ЯМР (ДМСО-d6): 1,35-1,45 (м, 3 Н); 1,55-1,75 (м, 3 Н); 1,80-1,90 (м, 1 Н); 2,20-2,30 (м,2 Н); 2,75-2,90 (м, 2 Н); 2,95 (т, 1 Н); 3,10 (т, 1 Н); 3,20 (ш.с, 8 Н); 7,10-7,15 (м, 2 Н); 7,15-7,25 (м,3 Н); 7,30-7,40 (м, 2 Н). МС m/z: 403 (МН+). Пример 4. 4, Оксалат 6-хлор-3-2-[4-(2,3 дихлорфенил)пиперазин-1-ил]этилсульфанил 1 Н-индола. К раствору (6-хлор-1 Н-индол-3-илсульфанил)уксусной кислоты (1,75 г) в тетрагидрофуране (30 мл) добавляют карбонилдиимидазол(1,2 г), перемешивают при комнатной температуре в течение 30 мин и охлаждают до температуры 5 С. К смеси добавляют 1-(2,3-дихлорфенил)пиперазин (1,8 г), растворенный в тетрагидрофуране (20 мл), и полученную смесь перемешивают при комнатной температуре в течение 2 ч. Смесь выливают в воду и водную фазу экстрагируют этилацетатом. Объединенные органические фазы сушат (MgSO4), фильтруют и выпаривают в вакууме с получением масла (3,6 г). Масло обрабатывают в тех же условиях реакции (восстановление аланом), как описано в примере 2, и продукт очищают флэшхроматографией на силикагеле(элюент:этилацетат/гептан 5:1) с получением масла. Указанное в заголовке соединение выделяют в виде оксалата (0,8 г). Т. пл. 137-141 С. 1 Н ЯМР (ДМСО-d6): 2,75-2,95 (м, 8 Н); 2,95-3,15 (м, 4 Н); 7,10-7,20 (м, 2 Н); 7,25-7,35 (м,2 Н); 7,50 (с, 1 Н); 7,60-7,70 (м, 2 Н); 11,60 (ш.с,1 Н). МС m/z: 422(MH+), 291, 182. Пример 5. 5 а, Гидрохлорид 3-3-[4-(2,3 дихлорфенил)пиперазин-1-ил]пропил-1 Ниндола. Смесь 3-(3-бромпропил)-1 Н-индола (1,19 г), карбоната калия (1,4 г) и 1-(2,3-дихлорфенил)пиперазина (1,27 г) в водном ацетонитриле (10 мл) кипятят с обратным холодильником в течение 5 ч и охлаждают до комнатной температуры. В смесь добавляют силикагель (7 г) и растворитель выпаривают в вакууме. Соединение очищают флэш-хроматографией на силикагеле (элюент:этилацетат/гептан/триэтиламин 49:49:2). Фракции, содержащие соединение, объединяют и выпаривают в вакууме. Перекристаллизация из ацетонитрила дает указан 005013(ш.с, 1 Н); 11,40 (ш.с, 1 Н). МС m/z: 388 (МН+). Аналогичным способом получают следующие соединения. 5b, Гидрохлорид 3-4-[4-(2,3-дихлорфенил)пиперазин-1-ил]бутил-1 Н-индола из 1(2,3-дихлорфенил)пиперазина и 3-(4-бромбутил)-1 Н-индола. Т. пл. 121-122 С. 1 Н ЯМР (ДMCO-d6): 1,45-1,55 (м, 2 Н); 1,65-1,75 (м, 2 Н); 2,35 (т, 2 Н); 2,50 (ш.с, 4 Н); 2,70 (т, 2 Н); 2,95 (ш.с, 4 Н); 6,95 (т, 1 Н); 7,05 (т,1 Н); 7,10-7,15 (м, 2 Н); 7,25-7,30 (м, 2 Н); 7,35 (д,1 Н); 7,50 (д, 1 Н); 10,75 (ш.с, 1 Н). МС m/z: 402(MH+). 5 с, 3-3-[4-(2,3-Дихлорфенил)пиперазин-1 ил]пропил-5-фтор-1H-индол из 1-(2,3-дихлорфенил)пиперазина и 3-(3-хлорпропил)-5-фтор 1 Н-индола. Т. пл. 147-148 С. 1(с, 1 Н); 7,55 (д, 4 Н); 7,95 (ш.с, 1 Н). МС m/z: 422(МН+), 424. Пример 6. 6, 1-4-[4-(2,3-Дихлорфенил)пиперазин-1-ил]бутил-3,4-дигидрохинолин 2(1 Н)-он. Свободное основание из гидрохлорида 1(2,3-дихлорфенил) пиперазина (6,0 г) высвобождают с использованием этилацетата и водного аммиака. Оставшееся масло растворяют в бутаноне (500 мл) с последующим добавлением карбоната калия (9,7 г) и смесь нагревают до температуры кипения с обратным холодильником. К этой смеси добавляют раствор 1-(4 бромбутил)-3,4-дигидрохинолин-2(1 Н)-она (7,9 21 г) в бутаноне (150 мл) и полученную смесь кипятят с обратным холодильником в течение 10 ч. Смесь фильтруют и очищают флэшхроматографией(д, 2 Н); 3,95 (т, 2 Н); 7,00 (т, 1 Н); 7,15 (д, 1 Н); 7,20-7,30 (м, 3 Н); 7,30-7,40 (м, 2 Н); 11,35 (ш.с,1 Н). МС m/z: 432 (МН+). Пример 7. 7 а,3-[4-(2,3-Дихлорфенил)пиперазин-1-ил]-1-(5-фтор-2,3-дигидро-1 Н-индол-1 ил)пропан-1-он. 3-Бромпропаноилхлорид (1 г в 10 мл безводного дихлорметана) добавляют при перемешивании при температуре 0 С к суспензии 1 г смолы Ванга (полимер Раппа, загрузка 0,95 ммоль/г) в 10 мл безводного дихлорметана, содержащего 5 эквивалентов диизопропилэтиламина. Смесь перемешивают в течение ночи при комнатной температуре, фильтруют и промывают безводным дихлорметаном (6 х 100 мл). Раствор 1-(2,3-дихлорфенил) пиперазина (2,5 эквивалента) в безводном ацетонитриле, содержащем диизопропилэтиламин (5 эквивалентов),добавляют к высушенной смоле и смесь нагревают до температуры 70 С в течение 3 ч. Смесь охлаждают до комнатной температуры и смолу промывают безводным ацетонитрилом и дихлорметаном и сушат. Раствор АlСl3 (1,1 эквивалент) в безводном ацетонитриле (5 мл) добавляют к смоле с последующим добавлением 5 фтор-2,3-дигидро-1 Н-индола (3 эквивалента) в безводном ацетонитриле (5 мл) и смесь перемешивают в течение 3 ч. Реакцию гасят добавлением 2N NaOH (1,2 эквивалента), фильтруют и продукт очищают твердофазной ионообменной хроматографией (колонка Varian SCX), используя Gilson ASPEC 232 XL. Дальнейшую очистку проводят на приборе РЕ Sciex API 150EX, оборудованном источником IonSpray и ЖХ системеShimadzu LC-8A/SLC-10A. Условия ЖХ (50 х 20 мм YMC ODS-A с частицами размером 5 мкм) представляют собой элюирование с линейным градиентом от вода/ацетонитрил/трифторуксусная кислота (80:20:0,05) до вода/ацетонитрил/ трифторуксусная кислота (10:90:0,03) за 7 мин при 22,7 мл/мин. Отбор фракций проводят по данным детектирования МС в разделенном потоке. Чистоту определяют интеграцией УФ следов (254 нм). Время удержания RT выражают в минутах. ЖХ/МС (m/z) 422 (МН+), RT = 2,49, чистота: 70,57%. Аналогичным способом получают следующие соединения: 7b,4-[4-(2,3-дихлорфенил)пиперазин-1-ил]-1(5-фтор-2,3-дигидро-1 Н-индол-1-ил)бутан-1-он: 24 10 а,3-[4-(3,4-дихлорфенил)пиперазин-1 ил]-1-(2,3-дигидро-1 Н-индол-1-ил)пропан-1-он: ЖХ/МС (m/z) 404 (МН+), RT = 2,47, чистота: 76,03%; 10b,4-[4-(3,4-дихлорфенил)пиперазин-1 ил]-1-(2,3-дигидро-1 Н-индол-1-ил)бутан-1-он: ЖХ/МС (m/z) 418 (МН+), RT = 2,58, чистота: 99,32%; 10 с,3-[4-(3,4-дихлорфенил)пиперазин-1 ил]-1-(5-фтор-2,3-дигидро-1 Н-индол-1-ил)пропан-1-он: ЖХ/МС (m/z) 422 (МН+), RT = 2,52,чистота: 80,99%; 10d,3-[4-(3,4-дихлорфенил)пиперазин-1 ил]-1-(3,4-дигидро-1 Н-изохинолин-2-ил)пропан 1-он: ЖХ/МС (m/z) 418 (МН+), RT = 2,45, чистота: 83,31%; 10 е,5-[4-(3,4-дихлорфенил)пиперазин-1 ил]-1-(3,4-дигидро-1 Н-изохинолин-2-ил)пентан 1-он: ЖХ/МС (m/z) 446,1 (МН+), RT = 2,52, чистота: 98,79%. Фармакологическое тестирование Соединения в соответствии с данным изобретением тестируют с помощью хорошо известных и надежных способов. Проводят следующие тесты. Ингибирование связывания [3 Н]YМ-091512 с допаминовыми рецепторами D4 человека. Данным способом in vitro определяют ингибирование лекарственным средством связывания [3 Н]YM-09151-2 (0,06 нМ) с мембранами клонированных допаминовых рецепторов D4.2 человека в СНО-клетках. Данный способ представляет собой модифицированный метод фирмы NEN Life Science Products, Inc., сертификат технических данных РС 2533-10/96. Результаты представлены ниже в таблице как значения IC50. Ингибирование связывания [3 Н]Spiperone сD3 рецепторами человека. Данным способом in vitro определяют ингибирование лекарственным средством связывания [3 Н]Spiperone (0,3 нМ) с мембранами клонированных допаминовых рецепторов D3 человека в СНО-клетках. Данный способ представляет собой модифицированный методMacKenzie et al. Eur. J. Pharm. -Mol. Pharm. Sec. 1994, 266, 79-85. Результаты представлены ниже в таблице. Ингибирование связывания [3 Н]Prazosine с альфа-1 рецепторами крысы. Данным способом in vitro определяют ингибирование лекарственным средством связывания [3 Н]Prazosine (0,25 нМ) с рецепторами альфа-1 в мембранах мозга крысы. Данный способ представляет собой модифицированный метод Hyttel et al. J. Neurochem. 1985, 44, 16151622. Результаты представлены ниже в таблице.% ингибирования связывания при 100 нМ) Соединения также подвергают следующему тестированию: ингибированию связывания[3 Н]Spiroperidol с D2 рецепторами. Соединения тестируют на предмет сродства к допаминовому рецептору D2 определением их способности ингибировать связываниеHyttel et al. J. Neuroche. 1985, 44, 1615. В общем, было обнаружено, что соединения в соответствии с данным изобретением имеют высокую степень сродства к допаминовым рецепторам D4 и D3. Соединения имеют только слабое или совсем не имеют сродства к допаминовому рецептору D2. Одним из важных эффектов блокады адренергических альфа-1-рецепторов является ортостатическая гипотензия, возникающая при падении давления в центральной вене вследствие расширения сосудов с небольшой пропускной способностью. Этот эффект может далее сопровождаться снижением минутного сердечного выброса. Определенные соединения в соответствии с данным изобретением имеют дополнительное преимущество, заключающееся в том,что они имеют только слабое влияние на адренергические рецепторы альфа-1, что подразумевает практическое отсутствие предрасположенности к ортостатической гипотензии. Определенные соединения взаимодействуют с центральными серотонергическими рецепторами, такими как рецепторы 5-HT1A и/или 5-НТ 2A, и/или они действуют как ингибиторы повторного поглощения рецепторов 5-НТ. Следовательно, соединения в соответствии с данным изобретением считаются полезными при лечении психозов, включая положительные и отрицательные симптомы шизофрении, аффективные расстройства, такие как общее со 005013 26 стояние тревоги, паника и навязчивое компульсивное расстройство, депрессию, агрессию, расстройство познавательной способности и дискинезию, вызванную лечением с помощью Lдопа. Фармацевтические композиции данного изобретения или те, которые получены в соответствии с данным изобретением, могут вводиться любым подходящим путем, например перорально в виде таблеток, капсул, порошков,сиропов и т.д., или парентерально, в виде растворов для инъекций. Для получения таких композиций могут быть использованы методы,хорошо известные в данной области техники, и любые фармацевтически приемлемые носители,разбавители, эксципиенты или другие добавки,обычно используемые в данной области техники. Предпочтительно, соединения в соответствии с данным изобретением вводятся в единичной дозированной форме, содержащей такие соединения в количестве от около 0,01 до 100 мг. Общая суточная доза обычно составляет от около 0,05 до 500 мг и наиболее предпочтительно от около 0,1 до около 50 мг активного соединения в соответствии с данным изобретением. Примеры препаративных форм Фармацевтические препаративные формы в соответствии с данным изобретением могут быть приготовлены обычными методами, используемыми в данной области техники. Например, таблетки могут быть получены смешиванием активного ингредиента с обычными адъювантами и/или разбавителями и дальнейшим прессованием смеси на обычной машине для получения таблеток. Примеры адъювантов или разбавителей включают кукурузный крахмал, картофельный крахмал, тальк,стеарат магния, желатин, лактозу, камеди и подобные. Любые другие адъюванты или добавки,обычно используемые для данных целей, такие как красители, вкусовые добавки, консерванты и т.д., могут быть использованы при условии,что они совместимы с активным ингредиентом. Растворы для инъекций могут быть получены растворением активного ингредиента и возможных добавок в части растворителя для инъекций, предпочтительно стерильной воде,доведением раствора до желаемого объема, стерилизацией раствора и наполнением ампул или флаконов. Могут быть добавлены любые подходящие добавки, обычно используемые в данной области техники, такие как агенты для поддержания тоничности, консерванты, антиокислители и т.д. Обычные примеры рецептов для препаративных форм в соответствии с данным изобретением представлены ниже. 1) Таблетки, содержащие 5,0 мг активного соединения, в расчете на свободное основание,мг: 27 Соединение формулы I 5,0 Лактоза 60 Кукурузный крахмал 30 Гидроксипропилцеллюлоза 2,4 Микрокристаллическая целлюлоза 19,2 Кроскармеллоза натрия тип А 2,4 Стеарат магния 0,84 2) Таблетки, содержащие 0,5 мг активного соединения, в расчете на свободное основание,мг: Соединение формулы I 0,5 Лактоза 46,9 Кукурузный крахмал 23,5 Провидон 1,8 Микрокристаллическая целлюлоза 14,4 Кроскармеллоза натрия тип А 1,8 Стеарат магния 0,63 3) Сироп, содержащий на миллилитр, мг: Соединение формулы I 25 Сорбит 500 Гидроксипропилцеллюлоза 15 Глицерин 50 Метилпарабен 1 Пропилпарабен 0,1 Этанол, мл 0,005 Вкусовая добавка 0,05 Сахарин натрия 0,5 Вода доб., мл 1 4) Раствор для инъекций, содержащий на миллилитр, мг: Соединение формулы I 0,5 Сорбит 5,1 Уксусная кислота 0,05 Сахарин натрия 0,5 Вода доб., мл 1 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы IR1 и R2 независимо выбраны из водорода и галогена, при условии, что по крайней мере один из R1 и R2 является атомом галогена;Q является необязательно замещенной 1 индолинильной группой формулы где R4, R5, R6, R7, R8 и R9 независимо выбраны из водорода, галогена, трифторметила, нитро,циано, C1-6-алкила, С 2-6-алкенила, С 2-6-алкинила,C1-6-алкокси, C1-6-алкилтио, C1-6-алкилсульфонила, гидрокси, гидрокси-С 1-6-алкила, амино, C1-6 алкиламино, ди(С 1-6-алкил)амино, ацила, аминокарбонила, C1-6-алкиламинокарбонила и ди(C1-6 алкил)аминокарбонила,и любой из его энантиомеров, и их кислотно-аддитивные соли. 2. Соединение по п.1, в котором R1 и R2 оба являются галогеном. 3. Соединение по п.2, в котором R1 и R2 оба являются хлором. 4. Соединение по п.1, в котором один из R1 2 и R является галогеном, а другой является водородом. 5. Соединение по п.4, в котором R2 является галогеном. 6. Соединение по п.4, в котором R1 является галогеном. 7. Соединение по п.1, в котором R1 и R2 независимо выбраны из водорода или хлора. 8. Соединение по пп.1-7, в котором W является N. 9. Соединение по пп.1-8, в котором X является СО или CH2. 10. Соединение по п.9, в котором 1 индолинильная группа является незамещенной или замещена галогеном. 11. Соединение по п.1, в котором R3 является водородом или R3 присоединен в параположении фенильного кольца. 12. Соединение по п.11, в котором R3 является галогеном. 13. Фармацевтическая композиция, отличающаяся тем, что она содержит соединение по любому из пп.1-12 в терапевтически эффективном количестве вместе с одним или более фармацевтически приемлемым носителем или разбавителем. 14. Применение соединения по любому из пп.1-12 для получения лекарственного средства,полезного для лечения психоза, включая положительные и отрицательные симптомы шизофрении, аффективные расстройства, такие как общее состояние тревоги, паника и навязчивое компульсивное расстройство, депрессию, агрессию, расстройство познавательной способности и дискинезию, вызванную лечением с помощьюL-допы. 15. Способ лечения психоза, включая положительные и отрицательные симптомы шизофрении, аффективные расстройства, такие как общее состояние тревоги, паника и навязчивое компульсивное расстройство, депрессию, агрессию, расстройство познавательной способности и дискинезию, вызванную лечением с помощьюL-допы, включающий введение терапевтически приемлемого количества соединения по любому из пп.1-12.
МПК / Метки
МПК: A61K 31/495, C07D 403/02, A61P 25/00
Метки: 4-фенил-1-пиперазина, тетрагидропиридина, галогензамещённые, производные, пиперидина
Код ссылки
<a href="https://eas.patents.su/16-5013-galogenzameshhyonnye-proizvodnye-4-fenil-1-piperazina-piperidina-i-tetragidropiridina.html" rel="bookmark" title="База патентов Евразийского Союза">Галогензамещённые производные 4-фенил-1-пиперазина, -пиперидина и -тетрагидропиридина</a>
Предыдущий патент: Применение липополисахаридов для лечения кишечных воспалительных процессов
Следующий патент: Защищенная от коррозии железобетонная конструкция, способ ее изготовления и система для обеспечения коррозионной устойчивости стальной арматуры (варианты)
Случайный патент: Производные 6-циклоалкил-1,5-дигидропиразоло[3,4-d]пиримидин-4-она и их применение в качестве ингибиторов pde9a




















