Псевдомициновые природные продукты
Номер патента: 4308
Опубликовано: 26.02.2004
Авторы: Кулантхаивел Паланиаппан, Зекнер Дуглас Джозеф, Перан Томас Джон Мл., Мартин Джеймс Вилльям, Белво Мэттью Дэвид
Формула / Реферат
1. Выделенный псевдомицин общей формулы
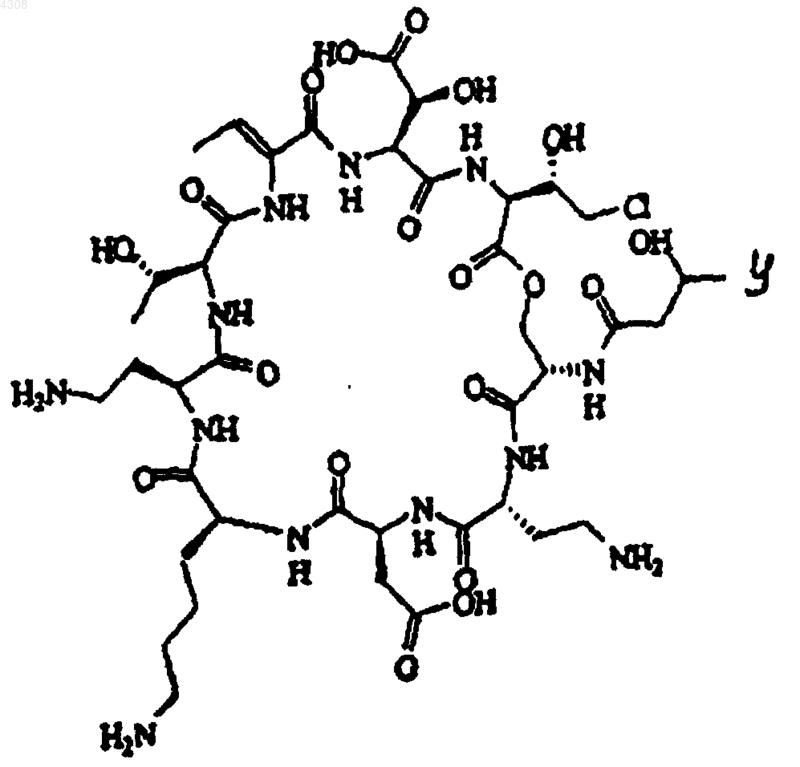
где Y представляет собой радикалы
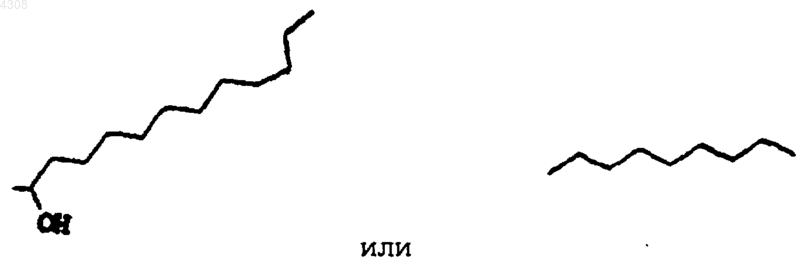
его фармацевтически приемлемую соль, гидрат, сложный эфир или их смесь.
2. Псевдомицин по п.1, отличающийся тем, что он является псевдомицином A' формулы
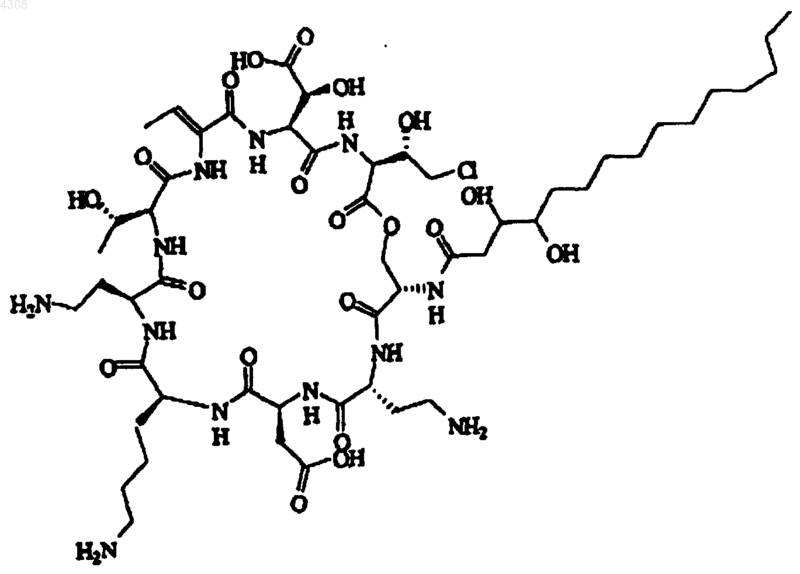
его фармацевтически приемлемой солью, гидратом, сложным эфиром.
3. Псевдомицин по п.1, отличающийся тем, что он является псевдомицином B' формулы
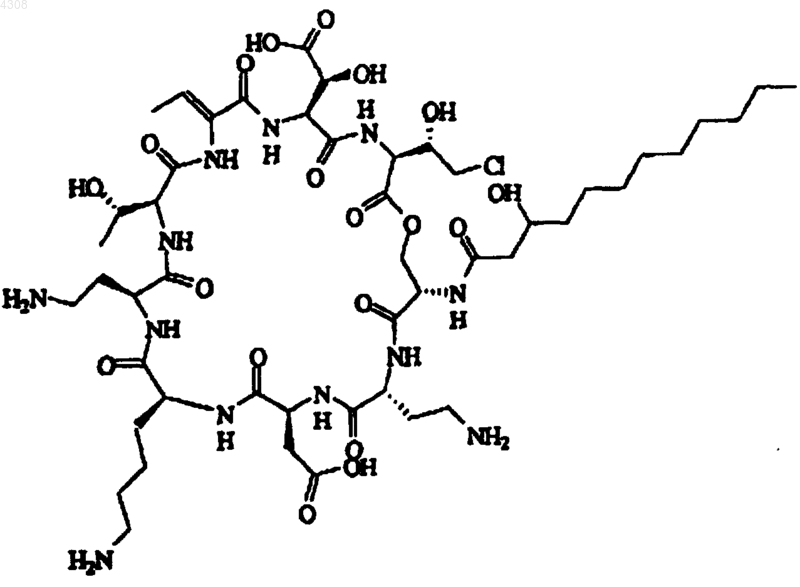
его фармацевтически приемлемой солью, гидратом, сложным эфиром.
4. Способ ингибирования грибковой активности, включающий взаимодействие грибка с выделенным псевдомицином, включающим псевдомицин A', фармацевтически приемлемую соль псевдомицина A', гидрат псевдомицина A', сложный эфир псевдомицина A', псевдомицин B', фармацевтически приемлемую соль псевдомицина B', гидрат псевдомицина B', сложный эфир псевдомицина B' или их смесь по п.1.
5. Способ облегчения симптомов грибковой инфекции у нуждающегося в этом пациента, включающий введение пациенту эффективного количества композиции, содержащей выделенный псевдомицин, включающий псевдомицин A', фармацевтически приемлемую соль псевдомицина A', гидрат псевдомицина A', сложный эфир псевдомицина A', псевдомицин B', фармацевтически приемлемую соль псевдомицина B', гидрат псевдомицина B', сложный эфир псевдомицина B' или их смесь по п.1.
6. Применение соединений по п.1 в производстве фармацевтической композиции для ингибирования грибковой активности.
7. Применение соединений по п.1 в производстве фармацевтической композиции для ингибирования грибковой активности или облегчения симптомов грибковой активности у пациента.
8. Способ ингибирования грибка в или на растении, включающий контакт указанного растения с выделенным псевдомицином по п.1, выбранным из псевдомицина A' формулы
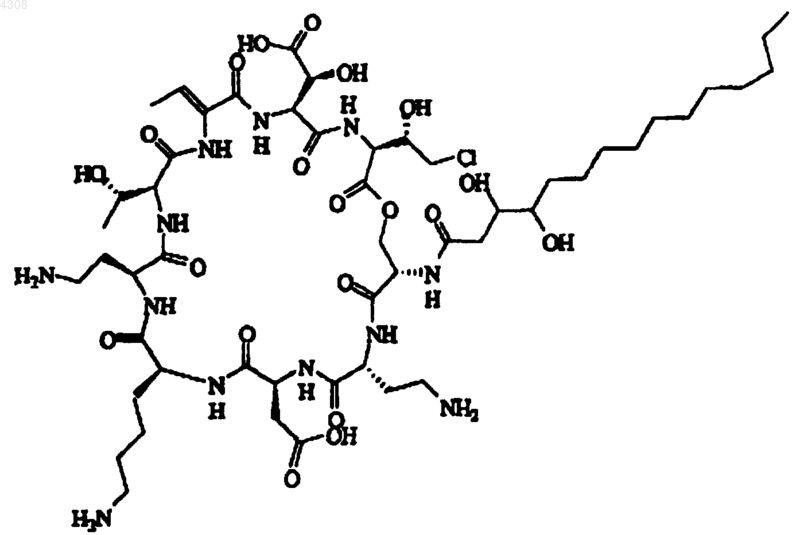
или псевдомицина B' формулы
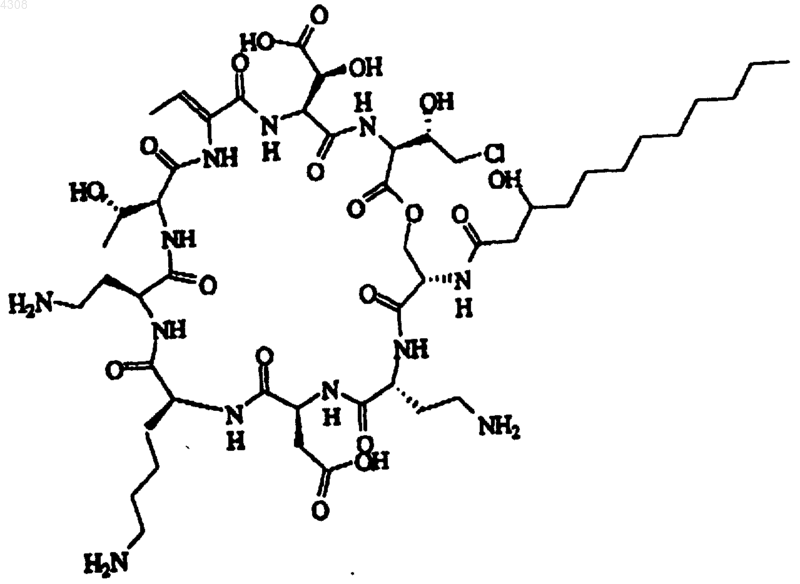
или его фармацевтически приемлемой солью, гидратом или сложным эфиром.
Текст
1 Настоящее изобретение относится к псевдомициновым природным продуктам, включая псевдомицины А' и В', способам получения таких псевдомицинов и способам использования противогрибковой активности таких псевдомицинов. Грибковые инфекции являются существенной причиной заболевания, ухудшения качества жизни и смертности людей, в особенности для пациентов, подверженных риску иммунологических заболеваний. За последние 20 лет значительно возросло количество случаев грибковых инфекций у людей. Это происходит частично вследствие увеличения количества людей с ослабленной иммунной системой или нарушенной трансплантацией органов, химиотерапией рака, СПИДом, возрастом и другими аналогичными нарушениями или состояниями. Такие пациенты предрасположены к действию грибковых патогенов, которые широко распространены повсюду среди населения, но сдерживаются действующей иммунной системой. Данные патогены трудно регулировать, так как некоторые существующие противогрибковые агенты либо высоко токсичны, либо только сдерживают грибковую активность. Например, полиены являются фунгицидами, но токсичны; тогда как азолы гораздо менее токсичны, но оказывают только фунгистатическое действие. Более важно, что есть новые сообщения об устойчивых к азолам и полиенам штаммах Candida, которые строго ограничивают выбор терапии против таких штаммов.Pseudomonas syringae продуцирует несколько классов противогрибковых агентов или антибиотиков, таких как псевдомицины, сирингомицины, сиринготоксины и сирингостатины,которые являются липодепсинонапептидами. Природные штаммы и транспозон-генерированные мутанты Р. syringae продуцируют такие липодепсинонапептиды. Некоторые из псевдомицинов, сирингомицинов и других липодепсипептидных противогрибковых агентов выделены, охарактеризованы химически и, как показано, обладают широким спектром противогрибкового действия, включая активность против важных грибковых патогенов человека и растений. Например, каждый из псевдомицинов А, В, С и С' выделен и очищен, их структуры охарактеризованы различными способами,включая секвенирование аминокислот, ЯМР и масс-спектрометрию. Смотри, например, BallioLett. 355, 96-100 (1994) и патент США 5576298. Псевдомицины, сирингомицины, сиринготоксины и сирингостатины представляют структурно различные семейства противогрибковых соединений. Ни одного из псевдомицинов, сирингомицинов, сиринготоксинов и сирингостатинов нет на рынке в качестве противогрибковой терапии. 2 Таким образом, открытие нежелательных побочных эффектов, создающих проблемы приготовления препаратов, повышения производительности и другие проблемы развития, препятствует широкой эксплуатации псевдомицинов,сирингомицинов, сиринготоксинов или сирингостатинов против всего диапазона грибковых инфекций, у животных, людей и растений. Остается потребность в противогрибковом агенте,который можно применять против инфекций, не поддающихся лечению существующими противогрибковыми агентами, и в применении против инфекций у животных, людей и растений. Настоящее изобретение относится к псевдомициновому природному продукту, производимому Р. syringae. Данный псевдомициновый природный продукт включает депсинонапептидное кольцо с последовательностью Ser-DabAsp-Lys-Dab-aThr-Dhb-HOAsp-ClThr,более конкретно L-Ser-D-Dab-L-Asp-L-Lys-L-Dab-LaThr-Z-Dhb-L-Asp(3-OH)-L-Thr(4-Cl), притом,что карбоксильная группа от ClThr и гидроксильная группа серина замыкают кольцо лактонной связью. Псевдомицин A' (IA) включает в качестве фрагмента 3,4-дигидроксипентадекановую кислоту, карбоксильная группа которой образует амидную связь с аминогруппой Nтерминального серина. Псевдомицин В' (IB) включает в качестве фрагмента 3-гидроксидодекановую кислоту,карбоксильная группа которой образует амидную связь с аминогруппой N-терминального серина. Данное изобретение относится также к способам, использующим псевдомициновый природный продукт, такой как псевдомицин А',псевдомицин В' или их смесь, для ингибирования грибковой активности или ослабления симптомов грибковой инфекции у нуждающегося в этом пациента. Такие способы могут убивать 3 грибок, облегчать симптомы грибковой инфекции, понижать жар и/или улучшать общее самочувствие пациента. Способы согласно данного изобретения эффективны против таких грибков как Candida parapsilosis, Candida albicans, Cryptococcus neoformans и/или Histoplasma capsulatum. Подробное описание изобретения Псевдомицины Используемые здесь термины псевдомицин и псевдомициновый природный продукт относятся к одному или более членам семейства противогрибковых агентов, которые выделены из бактерии Pseudomonas syringae. Псевдомицин является липодепсипептидом, циклическим пептидом, который включает одну или более необычных аминокислот и имеет одну или более присоединенных гидрофобных или жирнокислотных боковых цепей. Конкретно, псевдомицины являются липодепсинонапептидами с циклической пептидной частью, замкнутой лактонной связью и включающей необычные аминокислоты 4-хлортреонин, 3-гидроксиаспарагиновую кислоту, дегидро-2-аминомасляную кислоту и 2,4-диаминомасляную кислоту. Считают, что такие необычные аминокислоты вовлечены в биологические свойства псевдомицинов, такие как стабильность в сыворотке и их киллерное действие. Все псевдомицины имеют одинаковое пептидное ядро, но различаются гидрофобными боковыми частями, присоединенными к данному ядру. Каждый псевдомицин имеет нонапептидный цикл с последовательностью Ser-DabAsp-Lys-Dab-aThr-Dhb-HOAsp-ClThr (a именно,серин; 2,4-диаминомасляная кислота; аспарагиновая кислота; лизин; 2,4-диаминомасляная кислота; аллотреонин; дегидро-2-аминомасляная кислота; 3-гидроксиаспарагиновая кислота; 4 хлортреонин) притом, карбоксильная группа отClThr и гидроксильная группа серина замыкают кольцо лактонной связью. Липофильная часть присоединена к аминогруппе N-терминального серина. Аминогруппа серина образует амидную связь с карбоксилом 3,4-дигидрокситетрадекановой части в псевдомицине А, 3-моногидрокситетрадекановой части в псевдомицине В, 3,4-дигидроксигексадекановой части в псевдомицине С и 3-моногидроксигексадекановой части в псевдомицине С'. Карбоксильная группа серина образует амидную связь с Dab кольца. Псевдомицины А' и B' Используемые здесь термины псевдомицин А' и псевдомицин В' относятся к противогрибковым агентам, которые выделены из бактерии Pseudomonas syringae. Псевдомицины А' и В' являются псевдомицинами, имеющими характеристическое депсинонапептидное кольцо с последовательностью Ser-Dab-Asp-LysDab-aThr-Dhb-HOAsp-ClThr, притом, что карбоксильная группа от ClThr и гидроксильная группа серина замыкают кольцо лактонной свя 004308 4 зью. Псевдомицин А' включает в качестве фрагмента 3,4-дигидроксипентадекановую кислоту, карбоксильная группа которой образует амидную связь с аминогруппой N-терминального серина. Псевдомицин В' включает в качестве фрагмента 3-гидроксидодекановую кислоту, карбоксильная группа которой образует амидную связь с аминогруппой N-терминального серина. Биологические действия псевдомицинов Псевдомицин оказывает несколько биологических воздействий, включая уничтожение различных грибков, таких как грибковые патогены растений и животных. В частности, псевдомицин представляет собой активный противогрибковый агент против грибков, которые являются причиной условно-патогенных инфекций у пациентов, подверженных риску иммунологических заболеваний. Такие грибки включают различные виды Candida, в том числе С.parapsilosis, С. albicans, С. glabrata, С. Tropicalis и Histoplasma capsulatum. Желательным и предпочтительным биологическим действием противогрибкового агента, такого как псевдомицин А' и/или В', является уничтожение, а не ингибирование роста грибков, в особенности грибковых патогенов. Показано, что псевдомицины токсичны для широкого ряда патогенных относительно растений грибков, включая Rinchosporium secalis, Ceratocystis ulmi, Rizoctonic solani, Sclerotiniaantifugal activity, J. Of General Microbiology,137, 2857-2865 (1991. Кроме того, показано,что Р. Syringae MSU 16H обеспечивает большую, чем штамм дикого типа, защиту у вязов,инфицированных Ceratocystis ulmi, причинным агентом заболевания голландского вяза (смотри,например, Lam et. Al, Proc. Natl. Sci. USA, 84,6447-6451 (1987.Pseudomonas syringae включают широкий диапазон бактерий, которые обычно связаны с растениями. Некоторые из Р. syringae являются патогенами растений, тогда как другие только слабопатогенны или являются сапрофитами. Многие различные изоляты Р. syringae продуцируют один или более цитотоксических агентов,которые могут помочь данной бактерии выжить в дикой природе, где она должна конкурировать с грибком и другими бактериями. Цитотоксические агенты, продуцированные Р. Syringae,включают противогрибковые агенты, такие как псевдомицины, сирингомицины, сиринготоксины и сирингостатины. Штаммы Р. syringae, которые продуцируют один или более псевдомицинов, описаны. Например, штамм дикого типа MSU 174 (выделен 5 с ячменного поля, Монтана) и мутант данного штамма, генерированный путем мутагенеза транспозонов с использованием TN905 (MSU 16H), описаны в патенте США 5576298 от 19 ноября 1996, G. Strobel et al.; Harrison et al. J.Dutch elm disease", Proc. Natl. Acad. Sci. USA 84,6447-6451 (1987). Способы культивирования различных штаммов Р.syringae и их применение в производстве противогрибковых агентов, таких как псевдомицины, раскрыты также в патентной заявке США, Matthew D. Hilton et al."Pseudomycin Production by Pseudomonas syringae", представленной от того же числа, что и данная, и описанной ниже. Культуры MSU 174 и MSU 16H депонированы в Montana State University (Bozeman, Montana, USA) и доступны отDrive, Rockville, MD, USA). Описания работ,цитированных в данном параграфе, включены здесь в виде ссылок. Настоящее изобретение включает штамм,изолят и биологически очищенную культуру Р.syringae, которая продуцирует псевдомицин А' и/или В' в количестве, по меньшей мере, около 10 мкг/мл. Предпочтительной биологически очищенной культурой микроорганизма является штамм Pseudomonas syringae MSU 16 Н, 25-B1,67H1 или 7H9-1, или мутант, вариант, изолят,или рекомбинант этих штаммов, который продуцирует псевдомицин А' и/или В'. КультурыMSU 174 и MSU 16H получают, как описано в цитированных выше ссылках. Штамм Р.syringae, который подходит для производства псевдомицина А' и/или В', можно выделить из окружающих источников, включая растения, такие как ячмень, цитрусовые растения и сирень, а также из таких источников, как почва, вода, воздух и пыль. Предпочтительный штамм выделяют из растений. Штамм Р. syringae, который выделяют из окружающих источников, можно отнести к дикому типу. Используемый здесь термин дикий тип касается доминантного генотипа, который встречается в природе в нормальной популяции Р.syringae (то есть штаммы или изоляты Р. syringae, которые обнаружены в природе, а не получены путем лабораторных манипуляций). Как и в случае с другими организмами, характеристики псевдомицин А' - и/или В'-продуцирующих культур,применяемых в данном изобретении, штаммы Р.syringae, такие как MSU 174, MSU 16H, MSU 206, 25-B1, 7H9-1 и 67H1, подвержены изменению. Таким образом, потомство данных штаммов, например, рекомбинанты, мутанты и варианты можно получить способами, хорошо известными специалистам в данной области. 6 Мутантные штаммы Р.syringae также подходят для производства псевдомицина A' и/или В'. Используемый здесь термин мутант относится к внезапному наследуемому изменению в фенотипе штамма, которое может быть спонтанным или индуцированным известными мутагенными агентами, включая облучение и различные химикаты. Мутант Р.syringae согласно настоящего изобретения можно получить, применяя разнообразные мутагенные агенты, включая облучение, например, ультрафиолетовый свет, рентгеновское облучение; химические мутагены, сайт-специфический мутагенез и транспозон-опосредованный мутагенез. Примерами химических мутагенов являются этилметансульфонат (EMS), диэпоксиоктан, N-метил-Nнитро-N'-нитрозогуанин (NTG) и азотистая кислота. Псевдомицин А'- и/или В'-продуцирующие мутанты Р. syringae настоящего изобретения можно получить, обрабатывая бактерии некоторым количеством мутагенного агента, эффективным для получения мутантов, которые перепроизводят псевдомицин А' и/или В', которые производят псевдомицин А' и/или В' в большем количестве, чем другие псевдомицины, или которые производят псевдомицин А' и/или В' в благоприятных условиях культивирования. Притом, что тип и количество используемого мутагенного агента можно варьировать, предпочтительным способом является серийное разведение NTG до уровней в диапазоне от 1 до 100 мкг/мл. Предпочтительными мутантами согласно данного изобретения являются те, которые перепроизводят псевдомицин А' и/или В' в определенной минимальной среде. Данные мутанты перепроизводят псевдомицин А' и/или В' предпочтительно, по меньшей мере, до 10 мкг/мл. Средовые изоляты, мутантные штаммы и другие желательные штаммы Р. syringae можно подвергать отбору для получения желательных штрихов характера культуры, питательной среды, источника питательных веществ, источника углерода, условий культивирования и необходимых аминокислот. Предпочтительно выбирают псевдомицин А'- и/или В'-продуцирующий штамм Р. syringae, чтобы проводить культивирование в определенной минимальной среде,такой как среда N21 и/или чтобы производство псевдомицина А' и/или В' составляло более примерно 10 мкг/мл. Предпочтительные штаммы демонстрируют свойство продуцирования псевдомицина А' и/или В' при культивировании на среде, включающей глицин и необязательно липид, либо картофельный продукт, либо их комбинацию. Рекомбинантные штаммы можно разработать, трансформируя штаммы P.syringae с использованием установленных лабораторных методик, хорошо известных специалистам в данной области. Применяя рекомбинантную 7 технологию, штаммы Р.syringae можно трансформировать с целью экспрессии разнообразных генных продуктов в дополнение к антибиотикам, которые продуцируют данные штаммы. Например, можно трансформировать штаммы при помощи рекомбинантного вектора, который придает устойчивость к антибиотикам, к которым данные штаммы обычно чувствительны. Полученные таким образом трансформанты будут производить не только псевдомицины, такие как псевдомицины А' и/или В', но также придающий устойчивость фермент, который допускает отбор трансформированных из дикого типа клеток. Кроме того, применяя аналогичные методики, можно модифицировать данные штаммы с целью введения многочисленных копий эндогенных генов биосинтеза псевдомицина для достижения большего количества псевдомицина, такого как псевдомицины А' и/или В'. Потомство, то есть природные и индуцированные варианты, мутанты и рекомбинанты штаммовP.syringae 25-B1, 67 Н 1 и 7 Н 9-1, которые сохраняют свойство псевдомицина, такое как перепроизводство псевдомицина А' и/или В', являются частью данного изобретения. Культивирование Pseudomonas syringae Используемое здесь выражение водная питательная среда относится к композиции на водной основе, включающей минеральные и органические соединения и их соли, необходимые для культивирования бактерии, используемой в настоящем изобретении. Предпочтительная питательная среда содержит эффективное количество трех или менее аминокислот, предпочтительно глутаминовой кислоты, глицина,гистидина или их комбинации. В одном варианте среда содержит эффективное количество глицина и необязательно один или более картофельных продуктов и липидов. Глицин можно использовать в виде индивидуальной аминокислоты или как часть смеси аминокислот, такой как гидролизованный белок. Подходящие липиды включают соевое масло или жирную кислоту. Подходящие картофельные продукты включают бульон картофельной декстрозы, картофельный декстрин, картофельный белок и коммерческий пищевой продукт смесь картофельного пюре. Предпочтительные минеральные вещества в питательной среде включают смеси солей, обычно применяемые в клеточной культуре и при ферментации, такие как раствор минеральных солей Чапека (например, КСl, MgSO4 и FeSO4). Органическое соединение в питательной среде предпочтительно включает глюкозу и может необязательно включать растворимый крахмал; можно включить и другие органические вещества. рН среды предпочтительно составляет примерно от 4 до 6,5, более предпочтительно примерно от 4,5 до 5,7, наиболее предпочтительно примерно 5,2. Хотя количество каждого ингредиента в питательном бульоне обычно не является кри 004308 8 тическим для роста бактерий или производства псевдомицина А' и/или В', благоприятны определенные уровни питательных веществ. Предпочтительное количество глицина составляет примерно от 0,1 до 10 г/л, более предпочтительно примерно от 0,3 до 3 г/л, наиболее предпочтительно примерно 1 г/л. Предпочтительное количество липида составляет примерно от 1 до 10 г/л масляного продукта, такого как соевое масло, более предпочтительно примерно от 0,5 до 2 г/л соевого масла. Предпочтительное количество жирной кислоты или эфира жирной кислоты составляет примерно от 0,5 до 5 г/л. Предпочтительное количество картофельных продуктов включает примерно от 12 до 36 г/л,предпочтительно примерно 24 г/л бульона картофельной декстрозы; примерно от 5 до 50 г/л,предпочтительно примерно 30 г/л коммерческой смеси картофельного пюре; примерно от 1 до 30 г/л, предпочтительно примерно 20 г/л картофельного декстрина или примерно от 1 до 10 г/л, предпочтительно примерно 4 г/л картофельного белка. Предпочтительная питательная среда включает минеральные вещества, предпочтительно КСl примерно от 0,02 до 2 г/л, более предпочтительно примерно 0,2 г/л; MgSO4,предпочтительно MgSO47 Н 2 О, примерно от 0,02 до 2 г/л, более предпочтительно примерно 0,2 г/л; и FeSO4, предпочтительно FeSO47 Н 2 О,примерно от 0,4 до 40 мг/л, более предпочтительно примерно 4 мг/л. Р.syringae обычно культивируют в описанной среде в условиях контроля и регулирования рН и температуры. Р. syringae развивается и продуцирует псевдомицин А' и/или В' при температурах примерно от 15 до 35 С, предпочтительно примерно от 20 до 30 С, более предпочтительно примерно от 22 до 27 С, наиболее предпочтительно примерно при 25 С. Р.syringae развивается и продуцирует псевдомицин А' и/или В' при рН примерно от 4 до 9, предпочтительно примерно от 4 до 6, более предпочтительно примерно от 4,5 до 5,5. Обычно развитие Р. syringae не происходит, если температура выше 37 С или ниже 10 С, или если рН выше 9 или ниже 4. Способ производства псевдомицина A' и/или В' Для производства псевдомицина А' и/или В' из дикого типа или мутантного штамма Р.syringae микроорганизм культивируют при перемешивании в водной питательной среде,включающей эффективное количество трех или менее аминокислот. Три или менее аминокислот предпочтительно являются глутаминовой кислотой, глицином, гистидином или их комбинацией. В одном предпочтительном варианте аминокислоты включают глицин и необязательно один или более картофельных продуктов и липидов. Культивацию проводят в условиях, эффективных для развития Р.syringae и производства псевдомицина А' и/или В'. Эффективные 9 условия включают температуру примерно от 22 до 27 С и продолжительность примерно от 36 до 96 ч. При культивации на такой среде как описанная здесь Р. syringae может развиться до плотности клеток примерно 10-15 г/л сухого веса и продуцировать псевдомицины А' и/или В' с общим количеством, поменьшей мере, примерно 10 мкг/мл. Для производства псевдомицина А' и/или В' полезно регулировать концентрацию кислорода в среде во время культивации Р. syringae. Предпочтительно поддерживать уровень кислорода примерно от 5 до 50% насыщения, предпочтительно примерно 30% насыщение. Барботируя воздух с чистым кислородом или с газовыми смесями, включающими кислород, можно регулировать концентрацию кислорода в питательной среде. Кроме того, для регулировки скорости переноса кислорода можно регулировать скорость перемешивания. Для производства псевдомицина А' и/или В' полезно регулировать рН среды во время культивации Р.syringae. Псевдомицины, такие как псевдомицины А' и/или В', лабильны при основном рН, а если в течение периода более 12 ч рН выше 6, то может происходить существенное разрушение. Предпочтительно поддерживать рН питательной среды ниже 6, предпочтительно ниже 5,5 и выше 4,0. Предпочтительно поддерживать рН примерно от 5 до 5,4, более предпочтительно примерно от 5,0 до 5,2. Не ограничивая настоящего изобретения, полагают,что при основном рН происходит разрушение псевдомицина вследствие раскрытия лактонного кольца и конверсии ClThr в Thr. Р. syringae может продуцировать псевдомицины А' и/или В' при культивировании в периодической культуре. Однако культура с подпиткой или полунепрерывная подача глюкозы и необязательно кислоты или основания, такого как гидроксид аммония, для регулировки рН повышает производство псевдомицина. Производство Р. syringae псевдомицина можно дополнительно увеличить, используя способы непрерывного культивирования, в которых глюкоза и необязательно кислота или основание, такое как гидроксид аммония, для регулировки рН подаются автоматически. Псевдомицины А' и/или В' можно детектировать, определять, выделять и/или очищать любым из разнообразных способов, известных специалистам в данной области. Например, уровень активности псевдомицина в бульоне или в выделенной или очищенной композиции можно определить по противогрибковому действию против грибка, такого как Candida. Известны многочисленные способы получения и анализа псевдомицинов. Например, один или более псевдомицинов можно выделить и очистить хроматографически, например посредством ВЭЖХ. 10 Фармацевтические применения Препараты и противогрибковое действие псевдомицина А' или В' Каждый из псевдомицинов А' и В' демонстрирует in vitro и in vivo активность и, следовательно, может быть полезен в борьбе с общей грибковой инфекцией или грибковыми инфекциями кожи. Таким образом, настоящее изобретение относится к способу ингибирования грибковой активности, включающем взаимодействие псевдомицина А' и/или В' или их фармацевтически приемлемых солей с грибком. Предпочтительный способ включает ингибирование роста или активности различных грибков, включая С.parapsilosis, С. albicans, Cryptococcus neoformans и Histoplasma capsulatum. Используемое здесь выражение взаимодействие соединения данного изобретения с паразитом или грибком касается объединения, или соединения, или явного соприкосновения, или взаимного касания соединения данного изобретения с паразитом или грибком. Однако термин взаимодействие не подразумевает механизма ингибирования. Кроме того, данное изобретение относится к способу лечения грибковой инфекции, который включает введение эффективного количества псевдомицина А' и/или В', или его фармацевтически приемлемой соли, гидрата или сложного эфира нуждающемуся в таком лечении носителю. Предпочтительный способ включает лечение заражения различными грибками,включая С. parapsilosis, С. albicans, Cryptococcusneoformans и Histoplasma capsulatum. Введенный в эффективном и подходящем количестве препарат псевдомицина А' и/или В' облегчает переносимость грибковой инфекции, ослабляет симптомы, связанные с грибковой инфекцией и в результате может уничтожить грибковую инфекцию. Некоторые пациенты, нуждающиеся в противогрибковой терапии, имеют тяжелые симптомы инфицирования, такие как сильный жар,и, вероятно, требуют интенсивного или крайне необходимого ухода. Причиной таких серьезных заражений могут быть различные грибки.Candida spp., например, может вызывать заражение слизистой оболочки или общее заражение. Все чаще сообщается о штаммах Candida,устойчивых к азолам и полиенам. Aspergillus является причиной угрожающих жизни общих заражений. Cryptococcus ответственен за менингит. Такие серьезные грибковые заражения могут происходить у пациентов, подверженных риску иммунологических заболеваний, таких как пациенты с трансплантатами органов или костного мозга, проходящие химиотерапию рака, восстанавливающиеся после обширного оперативного вмешательства или страдающие от ВИЧ-инфицирования. Противогрибковая терапия для таких пациентов обычно включает внутривенное введение препарата, содержащего 11 псевдомицин А' и/или В', в течение нескольких дней или дольше, чтобы остановить инфекцию. Что касается противогрибковой активности, выражение эффективное количество обозначает количество соединения настоящего изобретения, которое способно ингибировать рост или активность грибков или ослабить симптомы грибковой инфекции. Для большинства грибковых инфекций ослабление симптомов инфицирования включает снижение жара, возвращение в сознание и улучшение самочувствия пациента. Предпочтительно ослаблять симптомы, убивая грибок для уничтожения инфекции или сведения ее до уровня, переносимого пациентом или контролируемого иммунной системой пациента. Используемый здесь термин ингибирование относится к ингибированию грибковой активности, включая остановку, торможение или профилактическое препятствование или предупреждение роста или любых присущих признаков и результатов существования грибка. Вводимая доза меняется в зависимости от таких факторов как природа и тяжесть инфекции, возраст, общее состояние здоровья носителя и его толерантность к противогрибковому агенту. Обычно композиции вводят нуждающемуся пациенту (человеку или другому животному, включая млекопитающих, таких как кошки,лошади и крупный рогатый скот, и птиц) в количестве, эффективном для ингибирования грибковой инфекции. Конкретную схему приема также можно варьировать в соответствии с указанными факторами, можно вводить лекарство единой дозой один раз в день или несколькими дозами в течение дня. Прием можно продолжать примерно от 2-3 дней до 2-3 недель или дольше. Обычная дневная доза (вводимая за один раз или поделенная на несколько доз) будет содержать примерно от 0,01 до 100 мг активного соединения данного изобретения на кг веса тела. Предпочтительные дневные дозы обычно будут составлять примерно от 0,1 до 60 мг/кг и идеально примерно от 2,5 до 40 мг/кг. Для серьезных инфекций соединение можно вводить путем внутривенного вливания, используя, например, от 0,01 до 10 мг/кг/ч активного ингредиента. Настоящее изобретение относится также к фармацевтическим препаратам, полезным для введения противогрибковых соединений согласно данного изобретения. Таким образом,настоящее изобретение относится также к фармацевтическому препарату, включающему один или более фармацевтически приемлемых носителей, разбавителей, растворителей, наполнителей или других добавок и псевдомицин А' и/или В'. Активный ингредиент в таких препаратах составляет от 0,1 до 99,9 мас.% препарата,обычно примерно от 10 до 30 мас.%. Под фармацевтически приемлемым понимают такой носитель, разбавитель, наполнитель, который 12 совместим с другими ингредиентами препарата и не вреден для реципиента. Препарат может включать добавки, такие как разнообразные масла, включая масла, полученные из нефти, животные, растительные и синтетические, например, арахисовое, соевое,минеральное и кунжутное масло. Подходящие фармацевтические наполнители включают крахмал, целлюлозу, глюкозу, лактозу, сахарозу,желатин, солод, стеарат магния, стеарат натрия,глицеринмоностеарат, хлорид натрия, сухое снятое молоко, глицерин, пропиленгликоль,воду и этанол. Композиции можно подвергать обычным фармацевтическим приемам, таким как стерилизация, и они могут содержать обычные фармацевтические добавки, такие как консерванты, стабилизаторы, увлажняющие агенты или эмульгаторы, соли для регулировки осмотического давления и буферы. Подходящие фармацевтические носители и их составы описаны в Matin "Remongton's Pharmaceutical Sciences", 15th Ed.; Mack Publishing Co., Easton(1975); смотри, например, стр. 1405-1412 и 1461-1487. Используемый здесь термин фармацевтически приемлемая соль относится к солям описанных здесь выше соединений, которые по существу нетоксичны для живых организмов. Типичные фармацевтически приемлемые соли включают соли, полученные путем взаимодействия соединений настоящего изобретения с минеральными или органическими кислотами или неорганическими основаниями. Такие соли известны как аддитивные соли кислот и оснований. Кислоты, обычно используемые для получения аддитивных солей кислот, являются минеральными кислотами, такими как соляная,бромистоводородная, йодистоводородная, серная и фосфорная кислоты, и органическими кислотами, такими как паратолуолсульфоновая,метансульфоновая, щавелевая, парабромфенилсульфоновая, карбоновая, янтарная, лимонная,бензойная и уксусная кислота. Примерами таких фармацевтически приемлемых солей являются сульфат, пиросульфат, бисульфат, сульфит, бисульфит, фосфат, моногидрофосфат, дигидрофосфат, метафосфат, пирофосфат, хлорид, бромид, йодид, ацетат, пропионат, оксалат, малонат, сукцинат, суберат, себакат, фумарат, малеат, бутин-1,4-диоат, гексин-1,6-диоат, бензоат,хлорбензоат, метилбензоат, динитробензоат,гидроксибензоат, метоксибензоат, фталат, сульфонат, ксиленсульфонат, фенилацетат, фенилпропионат, фенилбутират, цитрат, лактат, гамма-гидроксибутират, гликолят, тартрат, метансульфонат,пропансульфонат,нафтил-1 сульфонат, нафтил-2-сульфонат и манделат. Предпочтительными фармацевтически приемлемыми аддитивными солями кислот являются соли, образованные с минеральными кислотами,такими как соляная и бромисто-водородная ки 13 слоты, и соли, образованные с органическими кислотами, такими как малеиновая и метансульфоновая кислоты. Аддитивные соли оснований включают соли, производные неорганических оснований,таких как гидроксиды, карбонаты и бикарбонаты аммония, щелочных или щелочно-земельных металлов. Таким образом, основания, полезные для получения солей данного изобретения,включают гидроксид натрия, гидроксид калия,гидроксид аммония, карбонат калия, карбонат натрия, бикарбонат натрия, бикарбонат калия,гидроксид кальция и карбонат кальция. Особо предпочтительны соли калия и натрия. Следует различать, что конкретный противоион, образующий часть любой соли данного изобретения, не критичен по природе до тех пор, пока соль в целом является фармакологически приемлемой, и пока противоион не привносит в соль в целом нежелательных качеств. Псевдомицин А' и/или В' можно вводить парентерально, например, путем внутримышечной, подкожной или внутривенной инъекции,назальным или пероральным способом. В дополнение к данным способам введения псевдомицин А' и/или В' можно применять локально при поверхностных кожных инфекциях или для уничтожения или ингибирования грибков в слизистой оболочке. Препараты для парентерального введения включают псевдомицин А' и/или В' и физиологически приемлемый разбавитель, такой как деионизированная вода, физиологический раствор, 5% декстроза и обычно используемые другие разбавители. Препарат может содержать циклодекстрин и/или агент повышения растворимости, такой как полиэтиленгликоль, полипропиленгликоль или другой известный агент повышения растворимости. Такие препараты можно приготовить в стерильных пробирках,содержащих противогрибковый агент и наполнитель в виде сухого порошка или лиофилизованного порошка. Перед использованием добавляют физиологически приемлемый разбавитель и отбирают раствор шприцем для введения пациенту. Настоящие фармацевтические препараты готовят известными способами, используя известные и легкодоступные ингредиенты. В приготовлении композиций настоящего изобретения активный ингредиент обычно смешивают с носителем, или разбавляют носителем, или заключают внутрь носителя, который может представлять собой капсулу, саше, бумажный или другой контейнер. Если носитель служит в качестве разбавителя, он может быть твердым,полутвердым или жидким материалом, который служит носителем, наполнителем или средой для активного ингредиента. Таким образом,композиции могут быть в виде таблеток, пилюль, порошков, лепешек, саше, крахмальных облаток, эликсиров, суспензий, эмульсий, рас 004308 14 творов, сиропов, аэрозолей (как в твердой, так и в жидкой среде), мазей, содержащих, например,до 10 мас.% активного соединения, мягких или твердых капсул, суппозиториев, стерильных растворов для инъекций и стерильно упакованных порошков. Для орального применения противогрибковым соединением заполняют желатиновые капсулы или формуют из них таблетки. Такие таблетки могут также содержать связующее,диспергирующий агент или другие наполнители, подходящие для получения таблеток надлежащего размера для дозировки псевдомицина А' и/или В'. Для педиатрического или гериатрического применения противогрибковое соединение можно приготовить в виде ароматизированных жидких суспензий, растворов или эмульсий. Предпочтительным составом для перорального применения является линолевая кислота,кремофор RH-60 и вода предпочтительно в количестве (по объему) 8% линолевой кислоты,5% кремофора RH-60, 87% стерильной воды и псевдомицин А' и/или В' в количестве примерно от 2,5 до 40 мг/мл. Для локального применения противогрибковое соединение можно приготовить с сухим порошком для нанесения на поверхность кожи или приготовить в виде жидкого препарата,включающего водную или неводную жидкость,повышающую растворимость, например, спирт или гликоль. Применения препаратов псевдомицина А' и/или В' Настоящее изобретение охватывает также набор, включающий данные фармацевтические композиции и предназначенный для использования в способах настоящего изобретения. Данный набор может включать пробирку, которая содержит препарат настоящего изобретения и подходящие носители в сухом или жидком виде. Кроме того, данный набор включает инструкции по применению и введению данных соединений в виде этикетки на пробирке и/или вкладыша,вложенного в коробку, в которую упакована указанная ампула. Инструкции содержат такую информацию как подходящая дозировка и информация по применению, которая позволяет специалисту данной области вводить лекарство. Подразумевается, что специалистом данной области является лечащий врач, медицинская сестра или специалист, который может вводить лекарственный препарат. Настоящее изобретение относится также к фармацевтической композиции, которая включает препарат псевдомицина А' и/или В' и подходит для введения путем инъекции. Согласно данному изобретению препарат псевдомицина А' и/или В' можно применять для производства композиции или лекарственного средства, подходящего для введения путем инъекции. Данное изобретение относится также к способам получения композиций, включающих препарат псев 15 домицина А' и/или В' в виде, подходящем для введения путем инъекции. Например, жидкий или твердый препарат можно получать несколькими способами, применяя общеизвестные методики. Жидкий препарат можно получать, растворяя псевдомицин А' и/или В' в подходящем растворителе, таком как вода при подходящем рН, включающем буферы или другие наполнители. Сельскохозяйственные применения Показано, что антибиотики, продуцируемые Р. syringae NRRL В-12050, эффективно лечат болезнь голландского вяза (смотри, например, патенты США 4342746 и 4277462). В частности, показано, что Р. syringae MSU 16H обеспечивает большую защиту, чем штамм дикого типа, вязам, инфицированным Ceratocystisulmi, причинным агентом болезни голландского вяза (смотри, например, Lam et al. Proc.Natl. Sci.USA, 84, 6447-6451 (1987. Более обширные исследования выращенных на участке вязов подтверждают феномен биоконтроля на профилактическом уровне. Следовательно, псевдомицины настоящего изобретения могут быть полезны для профилактики болезни голландского вяза. Показано, что псевдомицины токсичны относительно широкого диапазона патогенных для растений грибков, включая RinchosporiumGeneral Microbiology, 137, 2857-2865 (1991. Следовательно, выделенный псевдомицин А' и/или В' (включая их гидраты, сольваты и эфиры) может быть полезен при лечении грибков у растений (в частности, V. alboatrum, Rizoctonicsolani и F. oxysporum), как для непосредственного лечения, так и для профилактики. Обычно зараженные растения обрабатывают путем инъекции в растение или распыления на растение водной суспензии псевдомициновых соединений. Средства для инъекции хорошо известны специалистам в данной области (например, пистолет для выдалбливания). Можно использовать любые средства распыления суспензии, которые распределяют на поверхности растений эффективное количество активного материала. Суспензия может включать другие добавки, обычно используемые специалистами в данной области,такие как агенты повышения растворимости,стабилизаторы, смачивающие агенты и их комбинации. Обработку растений можно также выполнять, используя сухую композицию, содержащую выделенные соединения псевдомицина А' и/или В'. Сухой препарат можно наносить на поверхность растений любыми способами, хорошо известными специалистам в данной об 004308 16 ласти, например, путем распыления или вытряхивая из контейнера. Настоящее изобретение можно лучше понять, обращаясь к следующим примерам. Данные примеры представлены как типичные конкретные варианты данного изобретения и не предназначены для ограничения области данного изобретения. Примеры Депонированные биологические материалы Р. syringae MSU 16H открыто доступен из: 25-B1 AccessionРТА-1622,7H9-1 AccessionРТА-1623,67 Н 1 AccessionРТА-1621. Пример 1. Производство псевдомицинов А' и В'. Разработаны ферментационные способы производства псевдомицина A' и/или В' в ферментационном бульоне штамма Pseudomonassyringae. Материалы и методы Получение инокулята: аликвоту клеток,хранящихся в парах жидкого азота, оттаивают и используют для засева двух 900 мл порций питательной среды CSM. Питательная среда CSM состоит из (г/л): декстрозы (5), мальтозы (4),соевого бульона Difco Tryptic Soy Broth (30),дрожжевого экстракта Difco (3) и MgSO47H2O(2). Используют примерно 0,5 мл клеток для засева каждой из двух 900 мл частей среды, содержащихся в двухлитровых колбах. Колбы инкубируют при встряхивании при 25 С в течение 24 ч. Содержание двух колб объединяют для засева 150 литрового бродильного чана, содержащего 115 л стерильного ферментационного бульона. Стадия ферментации: ферментационный бульон состоит из (г/л): декстрозы (20), растворимого крахмала (5), картофельного пюре быстрого приготовления от Basic American Foods(0,004) в водопроводной воде. Перед стерилизацией рН доводят до 5,2. Ферментацию проводят при 25 С в течение 68 ч. Содержание растворенного кислорода поддерживают при 30% насыщении воздухом или выше, постоянно регулируя поток воздуха и скорость вращения роторной мешалки. рН поддерживают в диапазоне от 4,0 до 5,4, добавляя H2SO4 или NaOH. Вариации периодических способов: найдено несколько вариаций простого периодического способа производства псевдомицинов А' и/или В' . Декстрозу можно подавать в бродильные чаны через 24 ч после начальной инокуля 17 ции со скоростью 60 мл в час. Подачу можно продолжать в течение ферментации. Иначе,применяют способ, когда содержание растворенного кислорода поддерживают при 5% насыщении воздухом через 24 ч после инокуляции и постоянно до конца периода ферментации. Сохранение уровня растворенного кислорода при 5% достигают путем добавления инертного газа азота (N2) к подаваемому в бродильный чан воздуху. Во всех случаях газ подают через одну трубку погруженного разбрызгивателя с отверстием, расположенным в бродильном чане прямо под дном турбины мешалки. Результаты и выводы Несколько способов ферментации обеспечивают производство псевдомицина А' и/или В' из Р. syringae. Пример 2. Выделение и очистка псевдомицинов А' и/или В'. Разработаны способы выделения и очистки псевдомицинов А' и/или В' из ферментационного бульона штамма Р. syringae. Материалы и методы Весь ферментационный бульон (4 х 100 л) после сбора урожая фильтруют через керамический фильтр Membralox (0,45 мкм), получая фильтрат (фракция А) и твердую пасту (фракция В). Фракцию В (135 л) экстрагируют равным объемом ацетона, содержащего 0,1% TFA, в течение 120 мин и оставляют отстояться. Прозрачный ацетоновый экстракт отделяют фильтрованием и затем выпаривают в вакууме до водного раствора, получая фракцию С (88 л). Сначала загружают в колонку со смолой HP20ss(10 л), набухшей в воде, фракцию А и промывают колонку 15% раствором ацетонитрила,содержащим 0,1% TFA (20 л). Затем загружают в ту же колонку фракцию С и промывают 20 л 15% раствора ацетонитрила, содержащего 0,1%TFA как и ранее. Затем колонку элюируют с линейным градиентом 15-20% ацетонитрилом, содержащим 0,1% TFA, в течение 30 мин и 20-35% ацетонитрилом, содержащим 0,1% TFA, в течение 60 мин со скоростью потока 1 л/мин. Собирают фракции по одному литру. Фракции 6-9 объединяютD (1 г) хроматографируют на колонке с обращенной фазой (Dynamax C18 41,4 х 250 мм), используя в качестве подвижной фазы смесь триэтиламмонийфосфатный буфер(рН 3)ацетонитрилметанол (градиентное элюирование от 65:17:18 до 30:35:35 за 45 мин при скорости потока 40 мл/мин). Подходящие фракции объединяют, уменьшают объем до 75 мл и повторно хроматографируют на C18-колонке, как ранее,применяя градиент от 80:10:10 до 46:27:27 и получая фракцию Е (113 мг) и фракцию F (116 мг). Дальнейшая хроматография фракций Е и F на колонке C18 (Dynamax 21,4 х 250 мм) дает 45 мг псевдомицина А' и 62 мг псевдомицина В',соответственно. 18 Результаты и выводы Методы ВЭЖХ, аналогичные применяемым для очистки других псевдомицинов, обеспечивают очистку псевдомицинов А' и В', выделенных из ферментационного бульона. Пример 3. Определение структуры псевдомицинов А' и В'. Структуры псевдомицинов А' и В' определяют методами масс-спектрометрии и ЯМР. Определение структуры псевдомицина А' Методы и результаты Молекулярную формулу псевдомицина А' определяют способом FAB MS высокого разрешения как C52H89ClN12O20 [m/z 1237,6112 дляC52H90ClN12O20 (M+H)+, -2,4 м.д.]. По сравнению с псевдомицином А молекулярная формула псевдомицина А' показывает одну дополнительную СН 2-группу. Это наблюдение предполагает,что в псевдомицине А' N-терминальный серин может быть ацилирован 3,4-дигидроксипентадекановой кислотой вместо 3,4 дигидрокситетрадекановой кислоты как в псевдомицине А. Данный аргумент подкреплен тем фактом, что во всех ранее охарактеризованных псевдомицинах ядро обладает характерным и идентичным нонадепсипептидным кольцом, и единственное различие между ними обусловлено природой гидрофобной боковой цепи. Согласно ЯМР-спектральным данным псевдомицин А' фактически идентичен всем известным псевдомицинам, таким как псевдомицины А, В, С и С'. Исчерпывающий анализ 1HMQC, псевдомицина А' устанавливает 3,4 диол-функциональность в гидрофобной боковой цепи псевдомицина А' и делает возможным отнесение в данной молекуле всех протонов и углеродов, несущих эти протоны (табл. 1). Структура, определенная для псевдомицина А' на основании данных масс-спектрометрии и ЯМР,приведена ниже. Структура псевдомицина А' по масс- и ЯМР-спектральным данным Таблица 1. Данные 1H и 13 С ЯМР для псевдомицина А' в 72.6 75.1 33.3 32.4. 30.2 х 4. 29.9. 27.2. 26.4. 23.2 15 0.81 14.3 Отнесения для Dab-1 и Dab-2 могут быть взаимно обменены Определение структуры псевдомицина В' Методы и результаты Определение структуры псевдомицина В' также выполнено посредством интерпретации масс- и ЯМР-спектральных данных. Молекулярная формула C49H83ClN12O19 [m/z 1179,5685 для C49H84ClN12O19 (М+Н)+, -1,8 м.д.] установлена по данным FAB MS высокого разрешения. Данная формула показывает на две СН 2-группы меньше, чем наблюдают для псевдомицина В. Подробный анализ 1H, 13 С и 2D ЯМР-спектров,включая TOCSY и HMQC, и сравнение со спектральными данными для известных псевдомицинов также выявляет идентичный аминокислотный состав. Кроме того, ЯМР-данные указывают присутствие 3-гидроксидодекановой кислоты (табл. 2). Таким образом, из указанных спектральных данных получают структуру псевдомицина В', приведенную ниже. Структура псевдомицина В' по масс- и ЯМР-спектральным данным Таблица 2. Данные 1H и 13 С ЯМР для псевдомицина В' в Н 2 О+СD3 СN Аминокислота Позиция н Боковая цепь 2a 2.33 43.8 2b 2.24 3 3.85 69.6 4 1.37 37.6 5-11 1.20 32.4 30.1 30.1 29.8 23.2 12 0.81 14.4 Отнесения для Dab-1 и Dab-2 могут быть взаимно обменены 21 Выводы Псевдомицины А' и В' представляют собой новые члены уникального класса нонадепсипептидов. Хотя данные молекулы очень близки известным псевдомицинам, отличаясь только природой гидрофобной боковой цепи, они должны играть ключевую роль в разъяснении соотношения структура-активность в качестве противогрибковых агентов среди соединений данного класса. Пример 4. Выделение, характеристика и мутагенез Pseudomonas syringae. Получены и применяются в производстве противогрибковых агентов средовые изоляты и мутанты Р. syringae. Материалы и методы Штаммы MSU 174 и MSU 16-Н выделены и охарактеризованы, как описано в патенте США 5576298 от 19 ноября 1996, Strobel etof fluorescent pseudomonas: Antimycotic production is necessary for control of Dutch elm disease",Proc. Natl. Acad. Sci. USA 84, 6447-6451 (1987). Описания указанных работ, цитированных в данном параграфе, включены здесь в виде ссылок. Дополнительные штаммы получены из таких диких типов и транспозон-генерированных мутантов путем химического мутагенеза. Штаммы, подверженные мутагенезу, включаютCSM, затем делят между средами, включающими 0, 1, 2, 4, 16 или 32 мкг/мл химического мутагена 1-метил-3-нитро-1-нитрозогуанидина(NTG или MNNG). Затем клетки замораживают для дальнейшего отбора и селекции. Клетки, подверженные мутагенезу, отбирают по желательным условиям культивирования и/или по производству одного или более псевдомицинов, таких как псевдомицин А' и/или В'. Подвергшиеся химическому мутагенезу клетки Р. syringae, такие как штамм 25-В 1,оттаивают и разводят до 6 клеток/мл в средеN21SM (табл. 5). Указанная среда иногда содержит один или более компонентов для отбора,таких как различные концентрации фосфата. 50 мкл подвергшихся мутагенезу клеток распределяют по лункам 96-луночного планшета для микротитрования с круглым дном, доставляя в среднем 0,3 клетки/ячейку. Для уменьшения испарения к каждой лунке обычно добавляют силиконовое масло. Планшеты инкубируют при встряхивании и 25 С в течение 6-12 дней. 22 Таблица 5. Состав среды N21SM Ингредиент Грамм на литр Глюкоза 20 Сульфат аммония 0,5 Мононатрийглутамат или L-глутаминовая 2 кислотаL-Гистидин 2 Глицин 0,5 Растворимый крахмал 5 КН 2 РO4 0,2 Раствор минеральных солей Чапека 2 млMES буфер 9,8 рН доводят до 5,0 После инкубации проводят серийное разведение аликвоты, обычно 5 мкл, из каждой ячейки (например, 1:56, 1:196, 1:320, 1:686 и/или 1:1715) и оценивают активность относительно Candida albicans в жидкостном биологическом исследовании на микротитровальном планшете. Планшеты инкубируют при 37 С в течение ночи и лунки метят по ингибированию роста С. albicans. Подходящие штаммы отбирают, инокулируют в CSM среду (табл. 6) и культивируют в течение 1-3 дней при 25 С. Таблица 6. Полная Streptomyces-среда (CSM) Компонент Концентрация (г/л) Глюкоза 5 Мальтоза 4 Соевый бульон Difco Tryptic 30 Дрожжевой экстракт Difco 3 2 Выбранные штаммы сохраняют, инокулируют в ферментационные бутыли, содержащие 13 мл среды N21SM и культивируют примерно 66 ч при 25 С. Из бутылей отбирают аликвоты,экстрагируют в течение 1 ч объемом ацетонитрила, равным объему аликвоты, центрифугируют и декантируют для ВЭЖХ-анализа одного или более псевдомицинов, таких как псевдомицин А' или В', как описано в примерах 1-3. Штаммы, продуцирующие один или более псевдомицинов, таких как псевдомицин А' или В',повторно выделяют, повторно ферментируют и готовят для культивирования в большем масштабе. Результаты Применяя описанные выше способы, получают штаммы, демонстрирующие производство одного или более псевдомицинов, таких как псевдомицин А' или В'. Выводы Раскрытые здесь способы и критерии отбора эффективны для производства штаммовP.syringae, которые развиваются на минимальной среде и продуцируют один или более псевдомицинов, таких как псевдомицин А' или В'. Пример 5. Культивирование P.syringae и производство псевдомицинов. Ферментация P.syringae в среде N21, которая не включает никаких картофельных продуктов, используемых в открытой среде для куль 23 тивации P.syringae, дает псевдомицины на уровне, подходящем для выделения. Производство псевдомицинов в качающихся колбах и среде N21 Материалы и методыP.syringae культивируют в колбе на 250 мл в 50 мл питательной среды N21 (табл. 7). Культивацию начинаю с аликвоты инокулятаP.syringae MSU 16H и выдерживают при 25 С и 70% влажности в течение 7 дней при перемешивании в инкубаторе при 250 об./мин. В конце инкубационного периода из колбы отбирают 4 мл бульона и смешивают с 6 мл метанола, содержащего 0,1% фосфорной кислоты. Считают,что низкий рН стабилизирует псевдомицины. Частицы удаляют фильтрованием или центрифугированием и определяют псевдомицины методом ВЭЖХ, как здесь описано. Таблица 7. Состав среды N21 Ингредиент Грамм на литр Сахароза 35 Сульфат аммония 0,5 Мононатрийглутамат 2L-Гистидин 2 Глицин 0,5 Растворимый крахмал 5 КН 2 РO4 0,2 Раствор минеральных солей Чапека 2 мл Дрожжевой экстракт 1MES буфер 9,8 РН доводят до 5,2 Производство псевдомицина некоторыми штаммами Р. syringae оценивают, используя питательную среду N21 с добавкой метилмиристата или без него. Исследованные штаммы Р.syringae включают MSU 16 Н, 25-В 1, 67 Н 1 и 7 Н 9-1. Результаты Различные штаммы Р. syringae при культивировании с метилмиристатом или без него продуцируют существенные уровни одного или более псевдомицинов, например, более 10 мкг/мл одного или более из псевдомицина А,псевдомицина В и/или псевдомицина С. Метилмиристат стимулирует производство псевдомицина для некоторых штаммов. Выводы Различные штаммы Р. syringae продуцируют коммерчески существенные уровни псевдомицинов в питательной среде без картофельных продуктов, и производство можно стимулировать метилмиристатом. Производство псевдомицинов в масштабе 5000 л с использованием среды N21 Способы производства псевдомицинов,применяющие питательную среду без добавления картофельных продуктов, сведены к масштабу 5000 л. Материалы и методы Колбы на вегетативной стадии, содержащие полную streptomyces-среду (CSM, табл. 5),засевают замороженной культурой Р. syringae, 004308 24 обычно штаммом 67 Н 1, и вращают при 250 об./мин и 25 С в течение 24 ч. Через 24 ч инкубации колб на вегетативной стадии используют их содержание для инокуляции колб на bumpстадии. Колбы на bump-стадии включают CSMсреду и вращаются при 250 об./мин. и 25 С. Колбы на bump-стадии засевают примерно 0,45 мл объединенной культуры из трех или четырех колб с вегетативной стадией. Колбы на bumpстадии обычно включают примерно 900 мл CSM в колбе Tunair на 2,5 л без дефлектора. Две культуры на bump-стадии в колбах Tunair помещают в бродильный чан. Колбы с bumpстадией инкубируют 16 ч. Затем две из культур на bump-стадии объединяют, соединяя в инокуляционной базуке. Объединенные культуры используют для инокуляции чана, содержащего питательную среду,описанную в табл. 15, которую дополняют еще 3 г/л (всего 4 г/л) глицина, 1 г/л соевого масла и 1 г/л дрожжевого экстракта. Данные крупномасштабные культуры культивируют при 25 С в течение трех-четырех дней. Во время периода культивации регулируют растворенный кислород на уровне 30% насыщения воздухом при перемешивании и токе воздуха. рН регулируют при 5,20,2, добавляя серную кислоту или гидроксид натрия, что требуется. Через восемнадцать часов после начала культивации в большом масштабе начинают подачу глюкозы со скоростью 200 мл/ч. Через двадцать часов после начала культивирования в большом масштабе начинают подачу гидроксида аммония со скоростью 20 мл/ч. Во время культивирования сдерживаемое давление составляет 5 фунт/ кв.дюйм(0,352 кг/см 2). Начальная скорость перемешивания составляет 150 об./мин и поток воздуха 0,5 куб.фут/мин. Если требуется, добавляют также противопенный агент. Исследованы также некоторые варианты данных условий. Через тричетыре дня крупномасштабной культивации собирают урожай P.syringae. Противогрибковую активность определяют, как описано в примере 6. Результаты и выводы Используя питательную среду без картофельных продуктов, получают псевдомицины в коммерчески существенных количествах порядка 5000 л. Пример 6. Определение и очистка псевдомицинов. Детектирование и количественное определение псевдомицинов по противогрибковой активности. Присутствие и количество псевдомицина или смеси псевдомицинов можно определить,измеряя противогрибковую активность препарата. Противогрибковую активность определяют in vitro посредством получения минимальной концентрации ингибирования (MIC) препарата,используя стандартный тест разведения агара или диск-диффузионный тест. Препарат одного 25 или более псевдомицинов может быть экстрактом клеточной культуры или более очищенной смесью. Типичным грибком, применяемым при проверке противогрибковой активности, является С. albicans. Противогрибковую активность считают значительной, если исследуемый препарат вызывает зоны ингибирования диаметром 10-12 мм на планшетах агара, засеянного Candida albicans х 657. Противогрибковые исследования проводят, применяя микротитровальный способ разведения бульона согласно методике NationalCommittee for Clinical Laboratory Standards на 96-луночном планшете для микротитрования. Среда Сабура и декстрозный бульон доводят до содержания 2,5 х 104 конидий/мл. Исследуемое соединение растворяют в воде и тестируют при двукратных разведениях, начиная с наибольшей концентрации 20 мкг/мл. Планшеты инкубируют при 35 С в течение 48 ч. Результаты в табл. 3 и 4 показывают минимальную концентрацию ингибирования (MIC) соединения, которая полностью ингибирует рост, по сравнению с необработанными контролями роста. Таблица 3. Противогрибковая активность псевдомицина А' МикроорганизмHistoplasma capsulatum 5,0 Таблица 4. Противогрибковая активность псевдомицина В' Микроорганизм ВЭЖХ-детектирование и количественное определение псевдомицинов Образец, который, как считают, содержит один или более псевдомицинов осветляют путем фильтрования или центрифугирования. Осветленную смесь хроматографируют на колонкеZobrax RxC8 (3,5 Т частицы 25 х 0,46 см) при скорости потока 1 мл/мин. Колонку элюируют с линейным градиентом 20-55% ацетонитрилом с 0,2% TFA в течение 15 мин и держат при 55% ацетонитрила с 0,2% TFA в течение 5 мин. Обычно псевдомицин А' элюируют примерно в течение 13,7 мин (822 с), а псевдомицин В' элюируют примерно в течение 12,4 мин (822 с). Псевдомицины детектируют по поглощению при 215 нм и определяют количественно путем интегрирования УФ-пиков. С целью идентификации и количественного определения для каждого псевдомицина используют стандарт. Пример 7. Препараты, включающие псевдомицин А' и/или B'. Следующие примеры препаратов являются только иллюстративными и никоим образом не 26 предназначены для ограничения области изобретения. Термин активный ингредиент обозначает псевдомицин А' и/или В' или их фармацевтически приемлемые соли. Препарат 1. Твердые желатиновые капсулы получают,используя следующие ингредиенты: Ингредиент Активный ингредиент Крахмал высушенный Стеарат магния Всего Препарат 2. Таблетки получают, используя указанные ниже ингредиенты. Компоненты смешивают и прессуют с получением таблеток, каждая весом 665 мг. Ингредиент Активный ингредиент Целлюлоза микрокристаллическая Диоксид кремния, белая сажа Стеариновая кислота Всего Препарат 3. Аэрозольный раствор получают, используя следующие компоненты. Активное соединение смешивают с этанолом, смесь добавляют к части пропелланта 22, охлажденного до -30 С, и переносят ее в заполняющее устройство. Необходимое количество подают в контейнер из нержавеющей стали и разбавляют оставшимся пропеллантом. Затем монтируют на контейнер блок с клапаном. Компонент Активный ингредиент Метанол Пропеллант 22 (хлордифторметан) Всего Препарат 4. Таблетки, каждая из которых содержит 60 мг активного ингредиента, получают следующим образом: Активный ингредиент Микрокристаллическая целлюлоза Поливинилпирролидон (10% раствор в воде) Натрийкарбоксиметилкрахмал Стеарат магния Тальк Всего Активный ингредиент, крахмал и целлюлозу пропускают через сито 45 меш США и тщательно перемешивают. С полученным порошком смешивают водный раствор, содержащий поливинилпирролидон, и пропускают смесь через сито 14 меш США. Полученные таким образом гранулы сушат при 50 С и пропускают через сито 18 меш США. Затем добавляют к гранулам натрийкарбоксиметилкрахмал, стеарат магния и тальк, заранее пропущенные через сито 60 меш США, после смешива 27 ния прессуют на устройстве для изготовления таблеток, получая таблетки, каждая весом 150 мг. Препарат 5. Капсулы, каждая из которых содержит 80 мг активного ингредиента, получают следующим образом: Активный ингредиент Крахмал Микрокристаллическая целлюлоза Стеарат магния Всего Активный ингредиент пропускают через сито 60 меш США, суспендируют в глицеридах насыщенных жирных кислот, а затем расплавляют, применяя минимально необходимое нагревание. Далее смесь заливают в форму для суппозиториев с номинальной вместимостью 2 г и оставляют охлаждаться. Препарат 7. Суспензии, каждая из которых содержит 50 мг активного ингредиента на дозу в 5 мл,получают следующим образом: Активный ингредиент Натрийкарбоксиметилцеллюлоза Сироп Раствор бензойной кислоты Ароматизатор Краситель Очищенная вода до общего количества 50 мг 50 мг 1,25 мл 0,10 мл По усмотрению По усмотрению 5 мл Активный ингредиент пропускают через сито 45 меш США и смешивают с натрийкарбоксиметилцеллюлозой и сиропом с получением пасты. Раствор бензойной кислоты, ароматизатор и краситель разбавляют частью воды и добавляют при перемешивании. Затем добавляют воду до необходимого объема. Препарат 8. Препарат для внутривенных инъекций можно приготовить следующим образом. Раствор данных ингредиентов обычно вводят пациенту внутривенно со скоростью 1 мл в минуту. Активный ингредиент Изотонический физиологический раствор дификации, оставаясь в рамках духа и области данного изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Выделенный псевдомицин общей формулы Активный ингредиент, целлюлозу, крахмал и стеарат магния смешивают, пропускают через сито 45 меш США и заполняют смесью твердые желатиновые капсулы по 200 мг в каждую. Препарат 6. Суппозитории, каждый из которых содержит 225 мг активного ингредиента, получают следующим образом: Активный ингредиент Глицериды насыщенных жирных кислот Всего Данное изобретение описано со ссылкой на различные конкретные и предпочтительные варианты и методики. Однако, следует понимать, что можно делать многие вариации и мо где Y представляет собой радикалы его фармацевтически приемлемую соль, гидрат,сложный эфир или их смесь. 2. Псевдомицин по п.1, отличающийся тем,что он является псевдомицином А' формулы его фармацевтически приемлемой солью, гидратом, сложным эфиром. 3. Псевдомицин по п.1, отличающийся тем,что он является псевдомицином В' формулы его фармацевтически приемлемой солью, гидратом, сложным эфиром. 4. Способ ингибирования грибковой активности, включающий взаимодействие грибка с выделенным псевдомицином, включающим псевдомицин А', фармацевтически приемлемую соль псевдомицина А', гидрат псевдомицина А',сложный эфир псевдомицина А', псевдомицин В', фармацевтически приемлемую соль псевдомицина В', гидрат псевдомицина В', сложный эфир псевдомицина В' или их смесь по п.1. 5. Способ облегчения симптомов грибковой инфекции у нуждающегося в этом пациента,включающий введение пациенту эффективного количества композиции, содержащей выделенный псевдомицин, включающий псевдомицин А', фармацевтически приемлемую соль псевдомицина А', гидрат псевдомицина А', сложный эфир псевдомицина А', псевдомицин В', фармацевтически приемлемую соль псевдомицина В',гидрат псевдомицина В', сложный эфир псевдомицина В' или их смесь по п.1. 6. Применение соединений по п.1 в производстве фармацевтической композиции для ингибирования грибковой активности. 7. Применение соединений по п.1 в производстве фармацевтической композиции для ингибирования грибковой активности или облегчения симптомов грибковой активности у пациента. 8. Способ ингибирования грибка в или на растении, включающий контакт указанного растения с выделенным псевдомицином по п.1,выбранным из псевдомицина А' формулы или его фармацевтически приемлемой солью,гидратом или сложным эфиром.
МПК / Метки
МПК: A61K 38/08, A61P 31/10, C07K 7/06
Метки: продукты, природные, псевдомициновые
Код ссылки
<a href="https://eas.patents.su/16-4308-psevdomicinovye-prirodnye-produkty.html" rel="bookmark" title="База патентов Евразийского Союза">Псевдомициновые природные продукты</a>
Предыдущий патент: Высокоэффективные композиции, содержащие дигидроэрготамин
Следующий патент: Модуляторы связанного с рецептором tnf фактора (traf), их получение и применение.
Случайный патент: Способ получения нитробифенилов












