Производные 1-трифторметил-4-гидрокси-7- пиперидиниламинометилхромана в качестве антагонистов вещества р
Формула / Реферат
1. Соединение формулы (I)
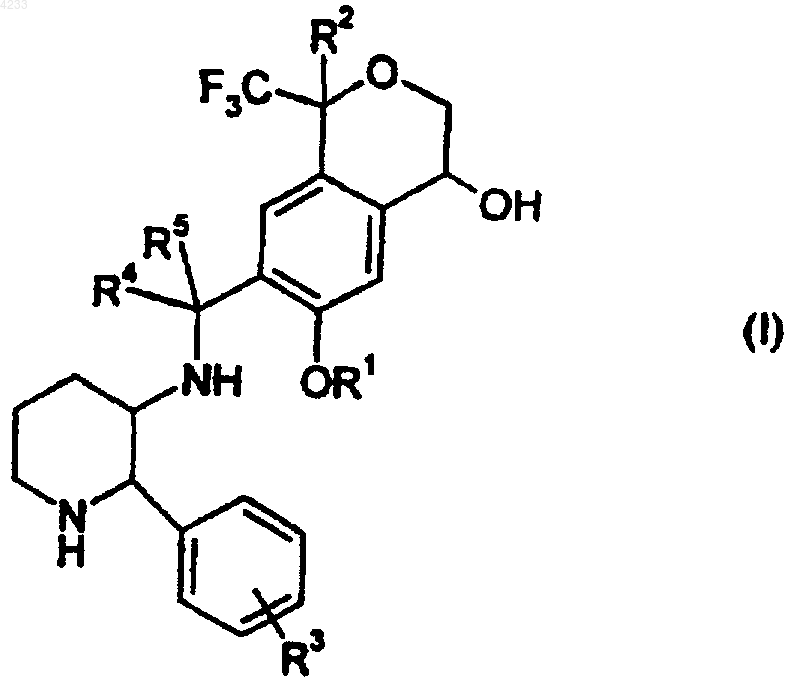
и его фармацевтически приемлемые соли, где R1 представляет C1-C6алкил;
R2 представляет водород, C1-C6алкил, галоген C1-C6алкил или фенил;
R3 представляет водород или галоген и
R4 и R5 независимо представляют водород, C1-C6алкил или галоген C1-C6алкил.
2. Соединение по п.1,
где R1 представляет C1-C3алкил;
R2 представляет водород, C1-C3алкил, галоген C1-C3алкил или фенил;
R3 представляет водород или фтор и
R4 и R5 независимо представляют водород, C1-C3алкил или галоген C1-C3алкил.
3. Соединение по п.2,
где R1 представляет метил;
R2 представляет водород, метил, трифторметил или фенил;
R3 представляет водород и
R4 и R5 независимо представляют водород.
4. Соединение по п.1, которое представляет собой (2S,3S)-3-(6-метокси-4-гидрокси-1-метил-1-трифторметилизохроман-7-ил)метиламино-2-фенилпиперидин или его фармацевтически приемлемую соль.
5. Фармацевтическая композиция для лечения заболеваний или состояний у млекопитающих, при которых необходима антагонистическая активность в отношении вещества P, которая включает количество соединения по п.1 или его фармацевтически приемлемой соли, эффективное для лечения указанных заболеваний или состояний, и фармацевтически приемлемый носитель.
7. Способ лечения заболеваний или состояний, при которых необходима антагонистическая активность в отношении вещества P у млекопитающих, который включает введение нуждающемуся в такой профилактике или лечении млекопитающему количества соединения по п.1 или его фармацевтически приемлемой соли, эффективного для лечения такого заболевания или состояния.
Текст
1 Настоящее изобретение относится к новым производным 1-трифторметил-4-гидрокси-7 пиперидиниламинометилхромана и их фармацевтически приемлемым солям, к фармацевтическим композициям, содержащим такие соединения, и к использованию таких соединений в качестве антагонистов вещества Р. Предпосылки изобретения Вещество Р является встречающимся в природе ундекапептидом, принадлежащим к тахикининовому семейству пептидов, причем последние были так названы благодаря их немедленному стимулирующему действию на ткани гладкой мускулатуры. Более конкретно,вещество Р является фармацевтически активным нейропептидом, который вырабатывается у млекопитающих (и который первый раз был выделен из кишечника) и который обладает характеристической аминокислотной последовательностью, что проиллюстрировано D.F. Veberet al. в патенте США 4680283. Широкое участие вещества Р и других тахикининов в патофизиологии множества заболеваний было подробно продемонстрировано в этой области. Например,недавно было показано, что вещество Р участвует в передаче боли или мигрени, а также в таких заболеваниях центральной нервной системы, как состояние беспокойства и шизофрения, в респираторных и воспалительных заболеваниях, таких как астма и ревматоидный артрит,соответственно, и в желудочно-кишечных заболеваниях и в заболеваниях желудочнокишечного тракта, подобных язвенному колиту,синдрому воспаленного кишечника, болезни Крона и т.д. Сообщалось также, что антагонисты тахикининов можно использовать для лечения сердечно-сосудистых заболеваний, аллергических состояний, иммунорегуляции, вазодилатации, бронхоспазма, рефлексов или нейронального контроля внутренних органов, старческого слабоумия типа Альцгеймера, рвоты, солнечных ожогов и инфекций Helicobacter pylori. В Европейской патентной заявке 840732,опубликованной 13 мая 1998 г. в международной патентной заявке PCT/IB 97/01466, поданной 19 ноября 1997 г. раскрыты различные соединения пиперидина, включая соединения пиперидина, содержащие заместитель, включающий кольцевой фрагмент, содержащий атом кислорода, в качестве антагонистов вещества Р. Существует потребность в антагонистах вещества Р, обладающих повышенной активностью и меньшим числом побочных эффектов. Краткое описание изобретения В настоящем изобретении предложены производные пиперидиниламинометилтрифторметилхромана следующей химической формулы (I): и их фармацевтически приемлемые соли,где R1 представляет C1-C6 алкил;R3 представляет водород или галоген; иR4 и R5 независимо представляют водород,C1-C6 алкил или галоген C1-C6 алкил. Соединения формулы (I) содержат по крайней мере два хиральных центра и поэтому существуют в виде по крайней мере двух диастереомерных пар оптических изомеров, включая эпимеры. Настоящее изобретение включает как индивидуальные изомеры соединений формулы (I), так и смеси двух или более таких изомеров. Соединения формулы (I) настоящего изобретения предпочтительно имеют (2S,3S) конфигурацию по отношению к пиперидиновому кольцу. Конкретными вариантами настоящего изобретения являются соединения формулы (I), гдеR1 представляет C1-С 3 алкил; R2 представляет водород, C1-С 3 алкил, галоген C1-С 3 алкил или фенил; R3 представляет водород или фтор; и R4 и R5 независимо представляют водород, C1-С 3 алкил или галоген C1-С 3 алкил. Другими вариантами настоящего изобретения являются соединения формулы (I), где R1 представляет метил; R2 представляет водород,метил, трифторметил или фенил; R3 представляет водород; и R4 и R5 представляют водород. Особенно предпочтительными соединениями формулы (I) являются (2S,3S)-3-(6 метокси-1-метил-1-трифторметилизохроман-7 ил)метиламино-2-фенилпиперидин или его фармацевтически приемлемые соли. Соединения настоящего изобретения полезны в качестве антагонистов вещества Р и поэтому их можно использовать для лечения заболеваний или состояний, выбранных из дистимии, тяжелого депрессивного расстройства,педиатрической депрессии, общего беспокойства, обсессивно-компульсивного расстройства,панического состояния, фобий, таких как социальная фобия и агорафобия; посттравматических стрессовых состояний, пограничного личностного расстройства, острой боли, хронической боли, мигрени, ангиогенеза, солнечных ожогов, недержания, воспалительных заболеваний, таких как ревматоидный артрит, остеоартрит, псориаз, астма и аллергические заболевания; рвоты, включая острую, длительную и преждевременную рвоту, где вызывающими рвоту агентами или условиями являются химио 3 терапия, облучение, хирургическое вмешательство, движение, мигрень или любой другой вызывающий рвоту агент или условие; заболеваний, вызванных Helicobacter pylori, сердечнососудистых заболеваний, глазных болезней,воспаления мочевой системы, психозов, шизофрении, кондуктивного расстройства, разрушительного поведения, биполярного расстройства,двигательных расстройств, таких как синдром Туретта, акинетический синдром, двигательные расстройства, связанные с болезнью Паркинсона, поздней дискинезией и дискинезией других типов; нарушений познавательной способности,таких как слабоумие (включая возрастное слабоумие и старческое слабоумие типа Альцгеймера) и нарушения памяти (например, амнезия),расстройств питания, таких как нервнопсихическая анорексия и нервно-психическая булемия, дефицита внимания, гиперактивности,синдрома хронической усталости, преждевременной эякуляции, предменструального синдрома, предменструальной дисфории, зависимости и привыкания к химическим средствам, соматических заболеваний, связанных со стрессами, невралгии, периферической невропатии,гастроэзофагиального рефлюкса, рефлекторно симпатической дистрофии, такой как синдром плечо/кисть; гиперчувствительности, такой как к сумаху укореняющемуся; фибромиалгии, ангины, болезни Рейно, ревматоидных заболеваний, таких как фиброз; экзем, ринитов, аллергий, пост-герпетической невралгии, цистита,воспалительных заболеваний кишечника, синдрома раздраженного кишечника, колита, фиброзных и коллагеновых заболеваний, таких как склеродерма и эозинофильный фасциолиаз; нарушений тока крови вследствие вазодилатации,и заболеваний, связанных с усилением или подавлением иммунной системы, таких как системная красная волчанка у млекопитающих,особенно у людей. Эти соединения особенно полезны в качестве противовоспалительных или противорвотных агентов, или агентов для лечения заболеваний центральной нервной системы(ЦНС). Соединения настоящего изобретения особенно полезны для лечения рвоты, включая острую, длительную или преждевременную рвоту,такую как рвота или тошнота, вызванная химиотерапией, облучением, хирургическим вмешательством, беременностью, движением, нарушениями вестибулярного аппарата, токсинами,мигренью и изменениями внутричерепного давления. Более конкретно, эти соединения можно использовать для лечения рвоты, вызванной антинеопластическими агентами, включая агенты, которые используют при лечении раковых заболеваний, и рвоты, вызванной другими фармакологическими агентами, такими как ролипрам или морфин. Эти соединения можно также использовать для лечения хронической и острой боли, включая гиперанальгетическую боль, нев 004233 4 ропатическую боль, послеоперационную боль и боль, связанную с поражениями нервов. Настоящее изобретение относится также к фармацевтической композиции для лечения у млекопитающих заболевания или состояния,при которых необходима антагонистическая активность в отношении вещества Р, которая включает количество соединения формулы (I) или его фармацевтически приемлемой соли,эффективное при лечении такого заболевания или состояния, и фармацевтически приемлемый носитель. Настоящее изобретение относится также к способу лечения болезни или состояния у млекопитающих, при которых необходима антагонистическая активность в отношении вещества Р, который включает введение нуждающемуся в таком лечении млекопитающему количества соединения формулы (I) или его фармацевтически приемлемой соли, эффективного при лечении такого заболевания или состояния. Настоящее изобретение относится также к фармацевтической композиции для лечения заболевания или состояния, выбранного из дистимии, тяжелого депрессивного расстройства, педиатрической депрессии, общего беспокойства,обсессивно-компульсивного расстройства, панического состояния, фобий, таких как социальная фобия и агорафобия; посттравматических стрессовых состояний, пограничного личностного расстройства, острой боли, хронической боли, мигрени, ангиогенеза, солнечных ожогов, недержания, воспалительных заболеваний, таких как ревматоидный артрит, остеоартрит, псориаз, астма и аллергические заболевания; рвоты, включая острую, длительную и преждевременную рвоту, где вызывающими рвоту агентами являются химиотерапия, облучение, хирургическое вмешательство, движение,мигрень или любой другой вызывающий рвоту агент или состояние; заболеваний, вызванныхHelicobacter pylori, сердечно-сосудистых заболеваний, глазных болезней, воспалений мочевой системы, психозов, шизофрении, кондуктивного расстройства, разрушительного поведения, биполярного расстройства, двигательных расстройств, таких как синдром Туретта, акинетический синдром, двигательные расстройства,связанные с болезнью Паркинсона, поздней дискинезией и дискинезией других типов; нарушений познавательной способности, таких как слабоумие (включая возрастное слабоумие или старческое слабоумие типа Альцгеймера) и нарушения памяти (например, амнезия), расстройств питания,таких как нервнопсихическая анорексия и нервно-психическая булемия, дефицита внимания, гиперактивности,синдрома хронической усталости, преждевременной эякуляции, предменструального синдрома, предменструальной дисфории, зависимости и привыкания к химическим средствам, соматических заболеваний, связанных со стресса 5 ми, невралгии, периферической невропатии,гастроэзофагиального рефлюкса, рефлекторносимпатической дистрофии, такой как синдром плечо/кисть; гиперчувствительности, такой как к сумаху укореняющемуся; фибромиалгии, ангины, болезни Рейно, ревматоидных заболеваний, таких как фиброз; экзем, ринитов, аллергии, пост-герпетической невралгии, цистита,воспалительных заболеваний кишечника, синдрома раздраженного кишечника, колита, фиброзных и коллагеновых заболеваний, таких как склеродерма и эозинофильный фасциолиаз; нарушений тока крови вследствие вазодилатации и заболеваний, связанных с усилением или подавлением иммунной системы, таких как системная красная волчанка у млекопитающих,особенно у человека, включающей количество соединения формулы (I) или его фармацевтически приемлемой соли, эффективное при лечении такого заболевания или состояния, и фармацевтически приемлемый носитель. Настоящее изобретение относится также к способу лечения заболевания или состояния,выбранных из дистимии, тяжелого депрессивного расстройства, педиатрической депрессии,общего беспокойства, обсессивно-компульсивного расстройства, панического состояния, фобий, таких как социальная фобия и агорафобия; посттравматических стрессовых состояний, пограничного личностного расстройства, острой боли, хронической боли, мигрени, ангиогенеза,солнечных ожогов, недержания, воспалительных заболеваний, таких как ревматоидный артрит, остеоартрит, псориаз, астма и аллергические заболевания; рвоты, включая острую, длительную и преждевременную рвоту, где вызывающими рвоту агентами или условиями являются химиотерапия, облучение, хирургическое вмешательство, движение, мигрень или любой другой вызывающий рвоту агент или условие; заболеваний, вызванных Helicobacter pylori,сердечно-сосудистых заболеваний, глазных болезней, воспалений мочевой системы, психозов,шизофрении, кондуктивного расстройства, разрушительного поведения, биполярного расстройства, двигательных расстройств, таких как синдром Туретта, акинетический синдром, двигательные расстройства, связанные с болезнью Паркинсона, поздней дискинезией и дискинезией других типов; нарушений познавательной способности, таких как слабоумие (включая возрастное слабоумие или старческое слабоумие типа Альцгеймера) и нарушения памяти (например, амнезия), расстройств питания, таких как нервно-психическая анорексия и нервнопсихическая булемия, дефицита внимания, гиперактивности, синдрома хронической усталости, преждевременной эякуляции, предменструального синдрома, предменструальной дисфории, зависимости и привыкания к химическим средствам, соматических заболеваний, связанных со стрессами, невралгии, периферической 6 невропатии, гастроэзофагиального рефлюкса,рефлекторно симпатической дистрофии, такой как синдром плечо/кисть; гиперчувствительности, такой как к сумаху укореняющемуся; фибромиалгии, ангины, болезни Рейно, ревматоидных заболеваний, таких как фиброз; экзем, ринитов, аллергии, пост-герпетической невралгии,цистита, воспалительных заболеваний кишечника, синдрома раздраженного кишечника, колита, фиброзных и коллагеновых заболеваний,таких как склеродерма и эозинофильный фасциолиаз; нарушений тока крови вследствие вазодилатации, и заболеваний, связанных с усилением или подавлением иммунной системы, таких как системная красная волчанка у млекопитающих, особенно у человека, включающий введение нуждающемуся в такой профилактике или лечении млекопитающему количества соединения формулы (I) или его фармацевтически приемлемой соли, эффективного для профилактики или лечения такого заболевания или состояния. Термин "процесс лечения", использованный здесь, относится к обращению, облегчению,ингибированию развития или профилактике заболевания или состояния, к которому этот термин применен, или одного или более симптомов такого заболевания или состояния. Термин "лечение", использованный здесь, относится к процессу лечения, "процесс лечения" определен выше. Термин "галоген" или (гало) означает F, Cl,Вr и I, предпочтительно Cl или F. Термин "алкил", используемый здесь, относится к радикалам с неразветвленной или разветвленной цепью, включая (но не ограничиваясь ими) метил, этил, н-пропил, изопропил и трет-бутил. Термин "галоген C1-C6 алкил" означает неразветвленный или разветвленный или циклический C1-С 6 алкил, замещенный одним или более(предпочтительно одним-семью) галогенами. Эти соединения включают (но не ограничиваются ими) трифторметил, дифторэтил, трифторэтил, пентафторэтил, трифторизопропил, тетрафторизопропил, пентафторизопропил, гексафторизопропил и т.п. Подробное описание изобретения Пиперидиниламинометилтрифторметилсодержащие циклические простые эфиры формулы (I) настоящего изобретения можно получить способами, раскрытыми в следующих схемах реакций и в описании. Если нет других указаний, в последующих схемах реакций и в описании R1, R2, R3, R4 и R5 имеют указанные выше значения и Z представляет водород или аминозащитную группу. Схема 1 иллюстрирует способ получения соединения формулы (VI), которое затем можно превратить в соответствующие метаболиты формулы (I) с помощью раскрытых далее способов биотрансформации. Соединения формулы(VI) можно получить восстановительным алкилированием соединения (II) соединением (III). Схема 1 Соединение формулы (VI), где Z представляет водород или аминозащитную группу и Q представляет R4 или R5, как указано выше, можно синтезировать с помощью восстановительного алкилирования амина формулы (II) соединением формулы (III) в соответствии с известными способами, раскрытыми в международной патентной публикации WO 97/03066. Реакцию можно проводить в присутствии подходящего восстанавливающего реагента в реакционно инертном растворителе. Подходящими восстанавливающими реагентами являются, например,боргидриды, такие как, например, триацетоксиборгидрид натрия (NaB(ОАс)3 Н), боргидрид натрия (NaBH4), цианоборгидрид натрия(LiAlH2) и триалкилсиланы. Подходящие растворители включают полярные растворители,такие как метанол, этанол, метиленхлорид, тетрагидрофуран (ТГФ), диоксан и этилацетат. Реакцию можно проводить при температуре от около -78 С до температуры кипения растворителя, предпочтительно от 0 до 25 С, в течение от 5 мин до 48 ч, предпочтительно от 0,5 до 12 ч. Предпочтительно соединения (VI), где Q отличен от водорода, получают, осуществляя взаимодействие соединения (II) с соединением(III), где W представляет соответствующую ацильную группу. Эту реакцию можно проводить в присутствии восстанавливающего агента,такого как NaBH3CN и кислоты Льюиса, такой как хлорид олова (IV) (TiCl4) в реакционноинертном растворителе, таком как дихлорметанZ представляет аминозащитную группу, аминозащитную группу можно удалить после восстановительного алкилирования, используя способы, известные специалистам (см., например,Protective Groups in Organic Synthesis, T.W.Greene et al., John WileySons, Inc., 1991), для получения соединения формулы (VI). Более конкретно, если Z представляет третбутоксикарбонил (сокращенно "Вос"), Вос можно удалить в присутствии кислоты, такой как НСl, в реакционно-инертном растворителе, таком как метанол, в инертной атмосфере (например, в атмосфере азота). Исходное соединение формулы (II) можно получить, защищая азот (2S,3S)-3-амино-2 фенилпиперидинового соединения, которое можно получить известными способами, как 8 раскрыто, например, в международной патентной публикации WO 92/17449. Защиту азота пиперидинового кольца соединения формулы(II) можно осуществить известными способами,как раскрыто, например, в международной патентной публикации WO 97/03066. Подходящими защитными группами являются, например,Воc (трет-бутоксикарбонил), бензилоксикарбонил (Cbz) или трифторацетил. Например защиту азота с помощью Воc можно осуществить, обрабатывая (2S,3S)-3-амино-2-фенилпиперидиновое соединение (трет-ВuОСО)2O в присутствии основания, такого как гидроксид натрия,бикарбонат натрия или триэтиламин. Соединения формулы (III) можно получить, формилируя или ацилируя соединения формулы (IV), как представлено на схеме 2. Схема 2 Можно использовать известные способы формилирования или ацилирования. Например,прямое формилирование можно проводить,осуществляя контактирование соединения (IV) с подходящим агентом формилирования в присутствии подходящего катализатора. Подходящие системы формилирующий агент/катализатор включают дихлорметиловый эфир/хлорид титана (IV) (СН 2 СНОСН 3/TiСl4), трифторуксусная кислота (СF3 СO2 Н)/гексаметилентетрамин(модифицированные условия Duff's) и фосфорилтрихлорид (РОСl3)/ДМФ (условия Вилсмейера). Более конкретно, формилирование соединения (IV) CH2CHOCH3/TiCl4 можно осуществить в реакционно-инертном растворителе в атмосфере азота. Подходящие растворители включают дихлорметан и 1,2-дихлорэтан при температуре от около -120 С до комнатной температуры в течение от около 1 мин до 10 ч,предпочтительно при -78 С в течение от 5 мин до 4 ч. Для формилирования можно также использовать реакцию Duff в соответствии с условиями реакции, раскрытыми с международной патентной публикации WO 94/24081. Кроме того, подходящий способ косвенного формилирования включает (i) галогенирование соединения (IV), (ii) замену атома галогена цианогруппой и затем (iii) восстановление полученного цианозамещенного соединения. (i). Реакцию галогенирования можно осуществить в соответствии с известными способами, раскрытымиG.A. Olah et al. (J.Org.Chem., Vol. 58, pp. 3194-,1983). (ii). Замену атома галогена цианогруппой можно осуществить в соответствии с известными способами, раскрытыми D.M. Tschaem et al., 9K.Takagi et al., (Bull.Chem.Soc.Jpn., Vol. 64, pp. 1118-, 1991). (iii). Используемую здесь реакцию восстановления можно осуществить в присутствии диизопропилалюминийгидрида (DIBAL-H) в дихлорметане или в присутствии никеля Ренея в муравьиной кислоте. Ацилирование можно осуществить с помощью хорошо известного способа ФриделяКрафтса, раскрытого, например, в AdvancedSons, forth edition, 1992, p. 539, и в приведенных там ссылках. Более конкретно, соединение (IV) можно подвергнуть взаимодействию с ацилирующим агентом в присутствии кислотного катализатора для получения соединения (III). Подходящие ацилирующие агенты включают ацилхлорид, ацилфторид и ангидриды, предпочтительно ацилхлорид. Подходящие кислотные катализаторы включают серную кислоту и кислоту Льюиса, такую как алюминийхлорид,предпочтительно алюминийхлорид. Эту реакцию обычно можно проводить при температуре от около -10 С до комнатной температуры, в течение от около 5 мин до 2 ч, предпочтительно при 0 С в течение 1 ч. Простой циклический эфир формулы (IV) можно получить из соединения формулы (Va) или (Vb) в соответствии с известным способом,раскрытым W.E. Parham et al., (J.Org.Chem., Vol. 39, pp. 2048, 1974), или способом, представленным на схеме 3. Схема 3(IV) можно синтезировать из соединения формулы (Va), где Y1 представляет Вr, I или Сl(предпочтительно Вr), a Y2 представляет водород или гидроксизащитную группу (предпочтительно тетрагидропиранил, сокращенно "ТГП"). Соединение формулы (Va) можно металлизировать, обрабатывая металлоорганическим соединением. Затем реакционную смесь можно обработать карбонильным соединением, представленным СF3 С(=O)R2, получая диол (Vc). При необходимости гидроксизащитную группу Y2 диола (Vc) можно удалить. Затем диол (Vc) можно подвергнуть реакции циклизации, получая соединение простого циклического эфира 10 бутиллитий,втор-бутиллитий или третбутиллитий. Реакцию металлизирования и последующую реакцию с СF3 С(=O)R2 можно осуществить в реакционно-инертном растворителе,таком как ТГФ, эфир и гексан в атмосфере инертного газа, например в атмосфере азота,при температуре от около -150 С до комнатной,в течение от 15 мин до 12 ч, предпочтительно от-120 С до -30 С, от 10 мин до 6 ч. Защиту гидроксигрупп и удаление защитной группы Y2 можно осуществить в зависимости от выбранной защитной группы в соответствии с известными способами (см., например, ProtectingD. Seebach et al., (Chem.Ber., Vol. 116, pp. 8354-,1994). Подходящими кислотами являются, например, НСl, H2SO4 или п-толуолсульфоновая кислота, трифторуксусная кислота (сокращенно ТФА). Реакцию можно проводить при температуре от комнатной до около 200 С в течение от 10 мин до 12 ч, предпочтительно при температуре от 60 до 150 С в течение от 30 мин до 6 ч. В другом варианте циклизацию можно осуществить в соответствии со способом, известным как реакция Mitsunobu, или в реакции,раскрытой J.R. Faick et al., (J.Am.Chem.Soc., Vol. 116, pp. 8354-, 1994). Например, реакцию Mitsunobu можно осуществить в присутствии трифенилфосфин/диэтилазодикарбоксилата в подходящем растворителе, таком как дихлорметан, в атмосфере азота при температуре около 0 С в течение от около 5 мин до 6 ч. В способе В схемы 3 соединение простого циклического эфира формулы (IV) можно получить, подвергая соединение формулы (Vb), гдеY3 представляет уходящую группу, одностадийной циклизации с помощью СF3 С(=O)R2 в присутствии подходящего основания (см., например, J.Org.Chem., Vol. 41, pp. 1184-, 1976). Подходящие уходящие группы включают Сl, Вr,тозилат, мезилат и трифлат. Подходящие основания включают алкиллитий, такой как н-BuLi,втор-BuLi или трет-BuLi. Например, реакцию можно осуществить, вначале обрабатывая соединение формулы (Vb) н-BuLi в подходящем реакционно-инертном растворителе, таком как ТГФ/гексан, в атмосфере азота при температуре от около -120 до 0 С в течение от около 5 мин до 12 ч, предпочтительно от -100 до -60 С в течение от 10 мин до 6 ч. Затем к реакционной смеси можно добавить карбонильное соединение СF3 С(=O)R2, и температуру можно повысить до от около -50 С до комнатной температуры. С другой стороны, например, исходные материалы формулы (Va) и (Vb), где R1 представляет метил, можно получить бромировани 11 ем в пара-положение известного коммерчески доступного соединения анизола в соответствии с известными способами (см. J.Org.Chem.,Vol.58, pp.7507-, 1993 и J.Org.Chem., Vol.46,pp.118-, 1981). В качестве альтернативы, другие способы получения соединений формулы VI можно найти в находящейся на одновременном рассмотрении заявке США 60/160226, поданной 18 октября 1999 г., включенной сюда в качестве ссылки. Если нет других указаний, давление в каждой из вышеуказанных реакций не является критическим. Обычно реакции ведут при давлении от одной до около трех атмосфер, предпочтительно при давлении окружающей среды(около одной атмосферы). Соединения формулы (VI) и промежуточные соединения, представленные на вышеуказанных схемах реакций, можно выделить и очистить обычными способами, такими как перекристаллизация или хроматографическая обработка. Как указано выше, соединения формулы(I) можно получить с помощью биотрансформации полученных биотрансформацией соединений (VI), метаболитами которых они являются. Биотрансформацию могут выполнить специалисты в данной области, осуществляя контактирование подлежащего трансформации вещества и других необходимых реагентов с ферментами, полученными из различных живых организмов в условиях, подходящих для осуществления химического взаимодействия. Затем продукты реакции выделяют и те, которые представляют интерес, выделяют для определения их химического строения и физических и биологических свойств. Ферменты могут присутствовать в виде очищенных реагентов, могут быть в виде неочищенных экстрактов или лизатов, или могут быть интактными клетками и могут быть в растворе, в суспензии (например,интактных клеток), могут быть ковалентно связаны с поверхностью носителя, или могут быть заключены в проницаемую матрицу (например,агарозные или альгинатные шарики). Субстрат и другие необходимые реагенты (например, вода,воздух) подаются в соответствии с химической необходимостью. Обычно реакцию проводят в присутствии одной или более жидкой фазы,водной и/или органической, для промотирования массового переноса реагентов и продуктов. Реакцию можно вести в асептических условиях или нет. Условия для контроля за ходом реакции и для выделения продуктов реакции могут меняться в зависимости от физических свойств реакционной системы и химических свойств реагентов и продуктов. Далее приводится один пример осуществления в лабораторном масштабе способа проведения аэробной биотрансформации, который может быть выполнен специалистом в данной 12 области для получения представляющего интерес соединения. Питательную среду (например,IOWA среду: декстроза, дрожжевой экстракт,вторичный кислый фосфат калия, хлорид натрия, соевая мука, вода), доведенную до нейтральных значений рН, помещают в один или более культуральный сосуд (например, пробирки или колбы для ферментации), который затем стерилизуют паром. Каждый сосуд затем инокулируют в асептических условиях материалом из культуры на агаре, суспензией промытых клеток или спор, или бульоном из жидкой питательной среды культуры биотрансформирующего микроорганизма. Сосуды устанавливают на шейкер, сконструированный для проведения ферментации, и встряхивают (например, вращают со скоростью 100-300 об./мин) при соответствующей температуре (например, при 2040 С) в течение времени, достаточного для промотирования роста микроорганизма до подходящего размера популяции (например, в течение 1-3 дней). Подлежащее трансформации исходное соединение (например, субстрат) растворяют в воде или в подходящем смешивающемся с водой растворителе (например, в диметилсульфоксиде, диметилформамиде, этиловом спирте,метиловом спирте). В каждый из сосудов для биотрансформации добавляют в асептических условиях полученный раствор до достижения нужной концентрации субстрата (например,100-200 мкг/мл). Сосуды с конкретными дозами помещают на шейкер и встряхивают, как указано выше, до тех пор, пока субстрат не превращается в продукт (продукты) за счет микробного метаболизма (например, 1-10 дней). Содержимое сосудов для биотрансформации обрабатывают механически (например, фильтруют или центрифугируют) для отделения не растворившегося твердого материала от водной фазы. Выделенный твердый материал экстрагируют подходящим смешивающимся с водой органическим растворителем (например, метанолом). Растворитель, содержащий экстракт твердого материала, и содержимое водной фазы из сосуда извлекают, объединяют и концентрируют, используя подходящие способы, например,экстракцию твердой фазы и сушку при пониженном давлении. Высушенный сырой материал снова растворяют в растворителе, который совместим со способом очистки (например, в ацетонитриле, метаноле, воде или в подвижной фазе для ВЭЖХ). Выделение и очистку продукта (продуктов) биотрансформации осуществляют с помощью твердофазной экстракции (ТФЭ) с последующей обработкой с помощью высокоэффективной жидкостной хроматографии с обращенной фазой (ВЭЖХ). Продукт (продукты) биотрансформации контролируют в процессе хроматографического разделения по УФпоглощению и спектральным характеристикам фотодиодной матрицы. Содержащие представ 13 ляющий интерес продукт (продукты) фракции подвижной фазы сохраняют и продукт (продукты) экстрагируют из подвижной фазы, используя подходящие способы, например вакуумную сушку с последующей ТФЭ. Элюат растворителя после ТФЭ выделяют, фильтруют для удаления твердого материала и концентрируют при пониженном давлении, получая высушенный очищенный продукт (продукты) биотрансформации. Химическое строение выделенного продукта (продуктов) определяют по результатам,полученным с помощью масс-спектроскопии и 1 Н ЯМР. Так как соединения настоящего изобретения пиперидиниламинометилтрифторметил циклические простые эфиры имеют по крайней мере два асимметрических центра, они могут существовать в различных стереоизомерных формах или конфигурациях (например, в формах диастереомеров, включая эпимеры). Следовательно, соединения могут существовать в виде отдельных (+)- и (-)-оптически активных форм, а также в виде их смесей. В объем настоящего изобретения включены все такие формы. В объем настоящего изобретения включены также все оптические изомеры и стереоизомеры соединений формулы (I) и их смеси. Что касается соединений формул (I), (VI) и (II), то настоящее изобретение включает использование рацемата, одной или более энантиомерных форм,одной или более диастереомерных форм или их смесей. Соединения формул (I), (VI) и (II) могут также существовать в виде таутомеров. Настоящее изобретение относится также к использованию всех таких таутомеров и их смесей. Индивидуальные изомеры можно получить известными способами, такими как оптическое разделение, фракционная кристаллизация, хроматографическая обработка или ВЭЖХ диастереомерной смеси, или промежуточного соединения,или соединения формулы (I), или его подходящей соли. Кроме того, индивидуальные стереоизомеры можно синтезировать из соответствующих оптически активных исходных материалов или промежуточных соединений, используя описанные здесь общие способы. Дополнительно, способы получения обогащенных диастереомерных смесей или определенных энантиомерных форм можно найти в находящейся на одновременном рассмотрении заявке США 60/160226, поданной 18 октября 1999 г. и включенной сюда в качестве ссылки. Поскольку соединения настоящего изобретения пиперидиниламинометилтрифторметилциклические простые эфиры являются основными соединениями, все они способны образовывать широкий ряд разнообразных солей с различными неорганическими и органическими кислотами. Хотя такие соли должны быть фармацевтически приемлемыми для введения животным, на практике часто бывает желательным 14 вначале выделить из реакционной смеси основное соединение настоящего изобретения в виде фармацевтически неприемлемой соли, а затем просто превратить ее в свободное основание в результате обработки щелочным реагентом и после этого превратить свободное основание в фармацевтически приемлемую соль присоединения кислоты. Соли присоединения кислот к основным соединениям настоящего изобретения легко получить, обрабатывая основное соединение практически эквивалентным количеством выбранной минеральной или органической кислоты в водном растворителе или в подходящем органическом растворителе, таком как метанол или этанол. После тщательного выпаривания растворителя легко получить нужную соль. Кислоты, которые используют для получения фармацевтически приемлемых солей присоединения кислот к вышеуказанным основным соединениям настоящего изобретения, являются кислотами, которые образуют нетоксичные соли присоединения кислот, т.е. соли, содержащие фармацевтически приемлемые анионы, такие как гидрохлорид, гидробромид, гидроиодид,нитрат, сульфат или бисульфат, фосфат или кислый фосфат, ацетат, лактат, цитрат или кислый цитрат, тартрат или битартрат, сукцинат,малеат, фумарат, глюконат, сахарат, бензоат,метансульфонат, этансульфонат, бензолсульфонат, р-толуолсульфонат и памоат (т.е. 1,1'метилен-бис-(2-гидрокси-3-нафтоат). Производные 1-трифторметил-4-гидрокси 7-пиперидиниламинометиленхромана настоящего изобретения и их фармацевтически приемлемые соли демонстрируют значительную активность связывания рецептора вещества Р и поэтому представляют ценность при лечении широкого круга клинических состояний, которые характеризуются наличием избыточной активности указанного вещества Р. Такие состояния включают дистимию, тяжелое депрессивное расстройство, педиатрическую депрессию,общее беспокойство,обсессивнокомпульсивное расстройство, паническое состояние, фобии, такие как социальная фобия и агорафобия; посттравматические стрессовые состояния, пограничное личностное расстройство, острую боль, хроническую боль, мигрени,ангиогенез, солнечный ожог, недержание, воспалительные заболевания, такие как ревматоидный артрит, остеоартрит, псориаз, астма и аллергические заболевания; рвоту, включая острую, длительную и преждевременную рвоту, где вызывающими рвоту агентами или условиями являются химиотерапия, облучение, хирургическое вмешательство, движение, мигрень или любой другой вызывающий рвоту агент или условие; заболевания, вызванные Helicobacterpylori, сердечно-сосудистые заболевания, глазные болезни, воспаления мочевой системы, психозы, шизофрению, кондуктивное расстройство,разрушительное поведение, биполярное рас 15 стройство, двигательные расстройства, такие как синдром Туретта, акинетический синдром,двигательные расстройства, связанные с болезнью Паркинсона, поздней дискинезией и дискинезией других типов; нарушения познавательной способности, такие как слабоумие (включая возрастное слабоумие и старческое слабоумие типа Альцгеймера) и нарушения памяти (например, амнезия), расстройства питания, такие как нервно-психическая анорексия и нервнопсихическая булемия, дефицит внимания, гиперактивность, синдром хронической усталости,преждевременную эякуляцию, предменструальный синдром, предменструальную дисфорию,зависимость и привыкание к химическим средствам, соматические заболевания, связанные со стрессами, невралгию, периферическую невропатию, гастроэзофагиальный рефлюкс, рефлекторно симпатическую дистрофию, такую как синдром плечо/кисть; гиперчувствительность,такую как к сумаху укореняющемуся; фибромиалгию, ангину, болезнь Рейно, ревматоидные заболевания, такие как фиброз; экземы, риниты,аллергии, пост-герпетическую невралгию, цистит, воспалительные заболевания кишечника,синдром раздраженного кишечника, колит,фиброзные и коллагеновые заболевания, такие как склеродерма и эозинофильный фасциолиаз; нарушение тока крови вследствие вазодилатации и заболевания, связанные с усилением или подавлением иммунной системы, такие как системная красная волчанка у млекопитающих,особенно у людей. Для лечения рвоты эти соединения можно предпочтительно использовать в комбинации с антагонистами 5 НТ 3 рецептора,такими как ондансетрон, гранисетрон или тропизетрон (ondansetron, granisetron или tropisetron). Производные 1-трифторметил-4-гидрокси 7-пиперидиниламинометилхромана по настоящему изобретению и их фармацевтически приемлемые соли можно вводить млекопитающим перорально, парентерально (например, внутривенно, внутримышечно или подкожно) или использовать для наружного применения. Обычно эти соединения наиболее желательно вводить людям в дозах в интервале от около 0,3 мг вплоть до 750 мг в день, хотя возможны изменения в зависимости от веса и состояния подлежащего лечению субъекта и конкретного выбранного способа введения. Однако наиболее желательно использовать уровень доз в интервале от около 0,06 до около 6 мг на кг массы тела в день. Тем не менее, возможны варианты в зависимости от конкретного вида подлежащего лечению животного и от его индивидуальной реакции на указанное лекарство, а также от выбранного типа фармацевтической композиции и от промежутка времени и интервалов, с которыми осуществляют введение. В некоторых случаях могут оказаться подходящими уровни доз ниже нижнего предела вышеуказанного ин 004233 16 тервала, тогда как в других случаях можно использовать еще большие дозы, не вызывая при этом каких-либо побочных эффектов, при условии, что такие более высокие дозы вначале делят на несколько мелких доз для введения в течение дня. Производные 1-трифторметил-4-гидрокси 7-пиперидиниламинометилхромана по настоящему изобретению и их фармацевтически приемлемые соли можно вводить отдельно или в сочетании с фармацевтически приемлемыми носителями или разбавителями любым из вышеуказанных способов и такое введение можно осуществлять в виде единичной дозы или множества доз. Более конкретно, новые терапевтические агенты настоящего изобретения можно вводить в виде множества различных дозовых форм, т.е. их можно комбинировать с различными фармацевтически приемлемыми инертными носителями в форме таблеток, капсул,облаток, лепешек, леденцов, порошков, спреев,кремов, бальзамов, суппозиториев, желе, гелей,паст, лосьонов, мазей, водных суспензий, растворов для инъекций, эликсиров, сиропов и т.п. Такие носители включают твердые разбавители или наполнители, стерильные водные среды и различные нетоксичные органические растворители и т.д. Более того, фармацевтические композиции для перорального введения могут включать подходящие подслащивающие агенты и/или вкусовые агенты. Обычно, терапевтически эффективные соединения настоящего изобретения присутствуют в таких дозовых формах в концентрациях в интервале от около 5,0 до около 70 мас.%. Для перорального введения можно использовать таблетки, содержащие различные эксципиенты, такие как микрокристаллическая целлюлоза, цитрат натрия, карбонат кальция, дикальцийфосфат и глицин, наряду с различными разрыхлителями, такими как крахмал (и предпочтительно кукурузный, картофельный крахмал или тапиоку), альгиновая кислота и некоторые комплексные силикаты, вместе с гранулирующими связующими, подобными поливинилпирролидону, сахарозе, желатину и гуммиарабику. Дополнительно для целей таблетирования очень часто бывают полезны смазывающие агенты, такие как стеарат магния, натрийлаурилсульфат и тальк. Твердые композиции аналогичного типа также можно использовать для наполнения желатиновых капсул; предпочтительные материалы в этой связи включают также лактозу или молочный сахар, и также высокомолекулярные полиэтиленгликоли. Если для перорального введения необходимы водные суспензии и/или эликсиры, активный ингредиент можно объединить с различными подслащивающими и вкусовыми агентами, цветным веществом или красителями и, при необходимости, эмульгирующими и/или суспендирующими агентами, также вместе с такими разбавителями, 17 как вода, этанол, пропиленгликоль, глицерин, и с их различными сочетаниями. Для парентерального введения можно использовать растворы соединений настоящего изобретения либо в кунжутном или арахисовом масле, либо в водном пропиленгликоле. Водные растворы должны быть при необходимости соответствующим образом буферированы (предпочтительно при рН 8), и жидкий растворитель необходимо сделать изотоничным. Такие водные растворы пригодны для внутривенных инъекций. Масляные растворы предназначены для внутрисуставных, внутримышечных и подкожных инъекций. Приготовление всех этих растворов в стерильных условиях можно легко осуществить стандартными фармацевтическими способами, которые хорошо известны специалистам в этой области. Кроме того, можно также вводить соединения настоящего изобретения поверхностно,при лечении, например, кожных воспалений, и это можно предпочтительно осуществить, используя кремы, желе, пасты, мази и т.п., в соответствии со стандартной фармацевтической практикой. Активность соединений настоящего изобретения в качестве антагонистов вещества Р можно определить по их способности ингибировать связывание вещества Р по его рецепторным сайтам в СНО-клетках, которые экспрессируют NK1 рецептор или в IM-9 клетках, используя радиоактивные реагенты. Антагонистическую активность в отношении вещества Р описанных здесь соединений пиперидиниламинометилтрифторметилциклических простых эфиров можно оценить, используя стандартную аналитическую процедуру, описанную D.G.Payan et al., (J.Immunology, Vol. 133, p. 3260,1984). Этот способ, по существу, включает определение концентрации индивидуального соединения, которая необходима для уменьшения на 50% количества реагентов радиомеченного вещества Р (SP) по их рецепторным сайтам, в указанных выделенных тканях коровы или в IM9 клетках, тем самым давая характеристическую величину IC50 для каждого из тестированных соединений. Более конкретно, ингибирование соединениями [3H]SP связывания с человеческими IM-9 клетками определяют в аналитическом буфере (50 мМ Tris-HCl (рН 7,4), 1 мМMnCl2, 0,02% альбумина телячьей сыворотки,бацитрацин (40 мкг/мл), лейпептин (4 мкг/мл),химостатин (2 мкг/мл) и фосфорамидон (30 мкг/мл. Реакцию инициируют, добавляя клетки к аналитическому буферу, содержащему 0,56 нМ [3H]SP и различные концентрации соединений (полный объем 0,5 мл), и инкубируя в течение 120 мин при 4 С. Инкубирование останавливают, фильтруя через GF/B фильтры (предварительно вымоченные в 0,1% полиэтиленимине в течение 2 ч). Неспецифическое связывание определяют как радиоактивность, сохранив 004233 18 шуюся в присутствии 1 мМ SP. Фильтры помещают в ампулы и количественно определяют радиоактивность, используя сцинтилляционный счетчик. В другом варианте противовоспалительную активность соединений настоящего изобретения на периферических участках млекопитающего демонстрируют с помощью теста экстравазации плазмы, вызванной капсаицином,используя процедуру, описанную A.Nagahisa etal., (European Journal of Pharmacology, Vol. 217,pp. 191-195, 1992). В этом тесте противовоспалительную активность определяют как процент ингибирования экстравазации белка плазмы в мочеточнике анестезированных фенобарбиталом (25 мг/кг внутрибрюшинно) самцов морских свинок Hartley (весом 300-350 г). Экстравазацию плазмы вызывают внутрибрюшинной инъекцией капсаицина (30 мМ в буфере, содержащем 0,1 BSA, 10 мл/животное) животным, которым не давали еды в течение ночи. Соединения настоящего изобретения растворяют в 0,1% растворе метилцеллюлозы в воде и вводят перорально за 1 ч перед введением капсаицина. За 5 мин перед введением капсаицина внутривенно вводят синий краситель Эванса (30 мг/кг). Животных умерщвляют через 10 мин после инъекции капсаицина и удаляют как правый, так и левый мочеточники. Содержание красителя в тканях количественно определяют, измеряя поглощение на длине волны 600 нм после экстрагирования формамидом в течение ночи. Соединение, полученное в примере 3 настоящего изобретения, демонстрирует 98% ингибирование при дозе 0,03 мг/кг, тогда как ближайшее по строению соединение примера 18WO 97/08114 демонстрирует 72% в той же самой дозе. Вредное воздействие на сродство связывания Са 2+ канальцев определяют, исследуя связывание верапамила в препаратах сердечной мембраны крыс. Более конкретно связывание верапамила осуществляют, как раскрыто ранееReynolds et al. (J.Pharmacol. Exp.Ther., Vol. 237,p. 731, 1986). Коротко, инкубирование инициируют, добавляя ткань в пробирки, содержащие 0,25 нМ [3H]дезметоксиверапамила и различные концентрации соединений (общий объем 1 мл). Неспецифическое связывание определяют как связывание радиолиганда, сохранившегося в присутствии 3-10 мкМ метоксиверапамила. Активность соединений настоящего изобретения против заболеваний ЦНС определяют в тесте перехвата,вызванногоMet(O2) ]веществом Р у монгольских песчанок,используя модифицикацию способа N.M.J. Rupniak (European Journal of Pharmacology, Vol. 265,pp. 179-183, 1994) и L.J. Bristow (European Journal of Pharmacology, Vol. 253, pp. 245-252, 1994). Более конкретно, во-первых, соединение настоящего изобретения вводят песчанкам под 19 кожно. Во-вторых, песчанок слегка анестезируют эфиром и обнажают поверхность черепа. Втретьих, [Sar9, Met(O2)11]вещество Р (5 мкл) вводят непосредственно в боковой желудочек с помощью иглы 25 размера, вводимой на 3,5 мм ниже лямбды. Затем песчанок помещают индивидуально в 1 л стаканы и регистрируют повторяющиеся удары задних лапок. Противорвотную активность соединений настоящего изобретения можно продемонстрировать в тесте рвоты, вызванной цисплатином у хорьков. Соединения настоящего изобретения подкожно вводят хорькам (самцы, с массой тела 1,3-1,6 кг) за 30 мин до инъекции цисплатина. Цисплатин вводят хорькам внутрибрюшинной инъекцией, и количество случаев рвоты (т.е. травление, срыгивание и рвоту) фиксируют с помощью видеокамеры в течение 4 ч. Частоту случаев подсчитывают. Подверженность метаболизму соединений настоящего изобретения можно оценить в invitro анализе, который включает (а) контактирование образца соединения с композицией реагента, приготовленной добавлением определенного цитохромного Р-450 (например, CYP2D6) изозима к слабому метаболизатору (сокращенно РМ) микросом печени (т.е. микросом печени человека, которые не содержат указанного определенного цитохромного Р-450 изозима) в материале носителя, и (b) анализ субстрата с помощью масс-спектрометра, связанного с прибором ВЭЖХ (высокоэффективная жидкостная хроматография). Более конкретно, субстрат (1 мкМ) инкубируют с РМ человеческими микросомами печени (изготовлены Keystone SkinCYP2D6-экспрессирующими микросомами (00,1 мг/мл) или контрольными векторными микросомами в присутствии 1,3 мМ NADP (никотинамидоадениндинуклеотидфосфат), 0,9 мM(глюкозо-6-фосфатдегидрогеназа) соответственно, в полном объеме 1,2 мл 100 мМ калийфосфатного буфера. рН раствора составляет 7,4 и температура инкубирования равна 37 С. В определенные моменты процесса инкубирования (0, 5, 10, 30 и 60 мин) из реакционной смеси отбирают аликвоты по 100 мкл и смешивают с 1 мл ацетонитрила (ACN), содержащим 5 нг/мл(2S,3S)-3-(2-метоксибензиламино)-2-дифенилметил-1-азабицикло-[2.2.2]октана в качестве внутреннего стандарта (полученного по способу, раскрытому в WO 90/05729). Затем белок осаждают центрифугированием (1800 х g в течение 10 мин) и собирают полученную надосадочную жидкость. Концентрации субстратов и продуктов в растворах образцов анализируют с помощью Sciex API-III масс-спектрометра, связанного с ВЭЖХ системой Hewlett-Packard НР 1090. Строят графики зависимости концентрации оставшихся субстратов в каждом из рас 004233 20 творов образцов (% остатка) от соответствующего времени инкубирования. На каждом графике получают величину T1/2. Рассчитывают отношения величин T1/2 для тестированных соединений (т.е. отношение T1/2 = (T1/2 для контрольных векторных микросом)/(T1/2 для РМ микросом человеческой печени, дополненных СYР 2D6-экспрессирующими микросомами). Примеры Далее настоящее изобретение иллюстрируется следующими примерами. Однако следует понимать, что настоящее изобретение не ограничено конкретными деталями этих примеров. Температуры плавления (т.пл.) получены на приборе Buchi micro melting point и не коррелировались. Инфракрасные спектры (ИК) получены на инфракрасном спектрометре Shimadzu(IR-470). Спектры 1H ядерного магнитного резонанса (1 Н-ЯМР) получены в СDСl3 на спектрометре ЯМР фирмы JEOL JNM-GX270, 270 МГц для 1H, если нет других указаний, положения сигналов выражены в частях на миллион(мд) от тетраметилсилана. Формы сигналов обозначают следующее: s(c), синглет; d(д), дублет;(0,75 мл, 9,3 ммоль) в сухом дихлорметане (10 мл) добавляют по каплям бром (0,47 мл, 18,0 ммоль) в атмосфере азота при 0 С. Раствор оранжевого цвета перемешивают при комнатной температуре в течение 4 ч. Реакционную смесь гасят, добавляя водный раствор 10% бисульфита натрия, и экстрагируют дихлорметаном. Органические экстракты промывают солевым раствором, сушат над сульфатом магния и концентрируют, получая сырые продукты, которые затем очищают на хроматографической колонке с силикагелем, осуществляя градиентное элюирование гексаном и этилацетатом(10:1, 8:1, 5:1), получая указанное в заголовке соединение в виде бесцветного масла (1,5 г,83,2%). 1(0,3 ммоль) в атмосфере азота при температуре 0 С в течение 1 ч. Реакционную смесь гасят насыщенным раствором бикарбоната натрия и экстрагируют дихлорметаном. Органические 21 экстракты промывают солевым раствором, сушат над сульфатом магния и концентрируют,получая сырой продукт. Его очищают на хроматографической колонке с силикагелем, элюируя смешанным растворителем из гексана и этилацетата (20:1) и получая указанное в заголовке соединение (2,05 г, количественно). 1(20 мл) по каплям добавляют н-бутиллитий (2,5 мл, 4,12 ммоль) в атмосфере азота при -78 С. Реакционную смесь перемешивают при -40 С в течение 1 ч. К реакционной смеси добавляют по каплям суспензию безводного хлорида церия(15 мл) при -78 С и перемешивают в течение 1 ч. К реакционной смеси добавляют трифторацетон (0,5 мл, 5,59 ммоль) и полученную смесь перемешивают при -78 С в течение 1 ч. Ее гасят насыщенным раствором аммонийхлорида, экстрагируют дихлорметаном. Объединенные органические экстракты сушат над сульфатом магния и концентрируют, получая сырые продукты,которые очищают на хроматографической колонке с силикагелем, осуществляя градиентное элюирование гексаном и этилацетатом (20:1,15:1, 12:1, 10:1), получая указанное в заголовке соединение (555 мг, 50,3%). 1(iv). 6-Метокси-1-метил-1-трифторметилизохроман. Смесь 1,1,1-трифтор-2-(4-метокси-2-(2(тетрагидропиран-2-илокси)этил)фенил)пропан 2-ола (470 мг, 1,35 ммоль) и концентрированной хлористо-водородной кислоты (4 мл) перемешивают при 120 С в течение 3 ч. После охлаждения реакционную смесь разбавляют водой и водный слой экстрагируют дихлорметаном. Органические экстракты сушат над сульфатом магния и концентрируют, получая указанное в заголовке соединение в виде масла коричневого цвета (460 мг). Его используют без дополнительной очистки. 22 сухом дихлорметане (5 мл) добавляют хлорид титана(IV) в атмосфере азота при -78 С. Спустя 15 мин, к желтому раствору добавляют раствор дихлорметилметилового эфира в сухом дихлорметане при той же температуре. Реакционную смесь перемешивают при -78 С в течение одного часа, выливают в ледяную воду и перемешивают при комнатной температуре в течение 30 мин. Водный слой экстрагируют метиленхлоридом. Экстракты промывают солевым раствором,сушат над сульфатом магния и концентрируют,получая сырой продукт. Его очищают на хроматографической колонке с силикагелем, осуществляя градиентное элюирование гексаном и этилацетатом (10:1, 8:1, 6:1), получая указанное в заголовке соединение (179 мг, 48,3% из 1,1,1 трифтор-2-(4-метокси-2-(2-(тетрагидропиран-2 илокси)этил)фенил)пропан-2-ола). 1(vi). 1-Трет-бутоксикарбонил-(2S,3S)-3-(6 метокси-1-метил-1-трифторметилизохроман-7 ил)метиламино-2-фенилпиперидин. К перемешиваемому раствору 1-третбутоксикарбонил-(2S,3S)-3-амино-2-фенилпиперидина (0,67 ммоль), который получают по способу, раскрытому в WO 97/03066, и 6-метокси 1-метил-1-трифторметилизохроман-7-карбальдегида (184 мг, 0,67 ммоль) в сухом дихлорметане (3 мл) порциями добавляют молярный избыток триацетоксиборгидрида натрия в атмосфере азота при комнатной температуре. Реакционную смесь перемешивают при комнатной температуре в течение 5 ч. Затем смесь подщелачивают, добавляя насыщенный раствор бикарбоната натрия, экстрагируют дихлорметаном, сушат над сульфатом магния и концентрируют, получая сырой продукт. Его очищают на хроматографической колонке с силикагелем,осуществляя градиентное элюирование дихлорметаном и метанолом (50:1, 25:1, 20:1), получая указанное в заголовке соединение (330 мг,91,8%). 1(2S,3S)-3-(6-метокси-1-метил-1 трифторметилизохроман-7-ил)метиламино-2 фенилпиперидин дигидрохлорид. К перемешиваемому раствору 1-третбутоксикарбонил-(2S,3S)-3-(6-метокси-1-метил 1-трифторметилизохроман-7-ил)метиламино-2 фенилпиперидина (325 мг, 0,61 ммоль) в этилацетате (5 мл) по каплям добавляют метанольный раствор НСl в атмосфере азота при комнатной температуре в течение 8 ч. Растворитель 23 удаляют и в результате перекристаллизации из этанола получают указанное в заголовке соединение (88 мг, 28,4%). Т.пл.: 193-201 С. 1(д, J=13,9 Гц, 1 Н), 3,51 (с, 3H), 3,33 (д, J=13,9 Гц, 1 Н), 3,31-3,24 (м, 1 Н), 2,84-2,74 (м, 4 Н),2,12-2,07 (м, 1 Н), 1,94-1,82 (м, 1 Н), 1,67-1,62 (м,1 Н), 1,59 (с, 3H), 1,43-1,38 (м, 1 Н). Диастереомерное отношение эпимеров по 1-положению в изохромановом кольце определяют по данным 1H-ЯМР как 5:1. Эти изомеры являются (2S,3S)-3-[(1R)-6-метокси-1-метил-1 трифторметилизохроман-7-ил]метиламино-2 фенилпиперидином и (2S,3S)-3-[(1S)-6-метокси 1-метил-1-трифторметилизохроман-7-ил]метиламино-2-фенилпиперидином. Более растворимый эпимер выделяют из маточного раствора. Диастереомерное отношение эпимеров по 1 положению в изохромановом кольце определяют по данным 1H-ЯМР как 1:3 (1R:1S). Абсолютную стереохимию указанных в заголовке соединений определяют кристаллографически с помощью рентгеновских лучей (3R) изомера после дополнительной очистки с помощью перекристаллизации. 1(i). 6-Гидрокси-1-метил-1-трифторметилизохроман. К перемешиваемому раствору 6-метокси-1 метил-1-трифторметилизохромана (71 г, 0,29 моль) в уксусной кислоте (600 мл) добавляют водный 48% НВr (300 мл) и смесь перемешивают при 130 С в течение 13 ч. После удаления уксусной кислоты в вакууме реакционную смесь обрабатывают водным NaOH (8M) до достижения величины рН=5-6. Полученный раствор экстрагируют этилацетатом (400 мл 2) и объединенные этилацетатные экстракты промывают солевым раствором (100 мл), сушат над MgSO4 и концентрируют в вакууме. В результате обработки с помощью флеш-хроматографии (силикагель, 1520 см, 17% этилацетат/гексан) получают 6-гидрокси-1-метил-1-трифторметилизохроман (67 г, 100%) в виде бесцветного масла. 1(680 мл) добавляют ацетилхлорид (31 мл, 0,44 моль) при 0 С и полученную смесь перемешивают при комнатной температуре в течение 1 ч. Реакционную смесь гасят, добавляя водную 1 н. НСl (400 мл) и экстрагируют этилацетатом (500 мл). Экстракты промывают водным насыщенным NаНСО 3 (100 мл) и солевым раствором(iii). (1R)-6-ацетокси-1-метил-1-трифторметилизохроман и (1S)-6-гидрокси-1-метил-1 трифторметилизохроман. Рацемическую смесь 6-ацетокси-1-метил 1-трифторметилизохромана (38,4 г, 0,140 моль),10% раствора втор-бутанола в гексане (1,3 л) и липазы PS (35 г) интенсивно перемешивают при комнатной температуре в течение 23 ч. После фильтрования фильтрат концентрируют при пониженном давлении, получая смесь. Ее очищают на хроматографической колонке с силикагелем, осуществляя градиентное элюирование гексаном и этилацетатом (15:1, 5:1, 2:1), получая сначала(1R)-6-ацетокси-1-метил-1-трифторметилизохроман в виде бесцветного масла (17,3 г, 45%, 94% ее). 1 Н ЯМР спектр этого соединения идентичен спектру рацемата. Вторая фракция дает (1S)-6-гидрокси-1-метил-1-трифторметилизохроман в виде кристаллов (16,9 г, 52%,83% ее). 1H ЯМР спектр этого материала идентичен спектру рацемата.(340 мл) добавляют карбонат калия (35,7 г, 0,258 моль) при 0 С, затем смесь перемешивают при комнатной температуре в течение 1 ч. Полученную смесь подкисляют 2 н. хлористоводородной кислотой (рН 3) и выпаривают в вакууме для удаления метанола. Остаток экстрагируют этилацетатом. Органический слой промывают водой и солевым раствором и сушат над сульфатом магния. После фильтрования полученный фильтрат концентрируют при пониженном давлении, получая указанное в заголовке соединение в виде бесцветного масла(28,0 г, 93%). Его используют без дополнитель 25 ной очистки. 1H ЯМР спектр этого соединения идентичен спектру рацемата.(1R)-6-Метокси-1-метил-1-трифторметилизохроман. К перемешиваемой смеси гидрида натрия(370 мл) при 0 С, затем смесь перемешивают при комнатной температуре в течение 1 ч. Реакционную смесь гасят водой и разбавляют насыщенным водным раствором аммонийхлорида. Ее экстрагируют смесью этилацетат-толуол(4:1). Органическую фракцию промывают водой и солевым раствором и сушат над сульфатом магния. Растворитель удаляют в вакууме, остаток очищают на хроматографической колонке с силикагелем, осуществляя элюирование гексаном и этилацетатом (40:1), получая указанное в заголовке соединение в виде бесцветного масла(29,1 г, 98%). 1 Н ЯМР спектр этого материала идентичен спектру рацемата.(1R)-6-метокси-1 метил-1-трифторметилизохроман далее превращают в указанное в заголовке соединение по изложенному далее способу получения в примере 3, получая указанное в заголовке соединение в форме отдельного диастереомера. Оптическое вращение: []27D = +75,44; (с = 0,424,МеОН). Пример 3. Микробная биотрансформация. 6-Метокси-1-метил-7-[(2-фенилпиперидин 3-иламино)метил-1-трифторметилизохроман-4 ол. 25 мл среды IOWA (безводная декстроза 20 г; дрожжевой экстракт 5 г; вторичный кислый фосфат калия 5 г; хлорид натрия 5 г; соевая мука 5 г; дистиллированная вода 1 л; рН доведено до 7,2 1 н. серной кислотой) помещают в каждую из восемнадцати 125-мл колб Делонга с крышками Мортона и полученные смеси стерилизуют паром в течение 30 мин при давлении 15 пси и температуре 121 С. Две колбы (стадия инокулюма) в асептических условиях инокулируют 0,25 мл хранящегося в криогенных условиях (-80 С) аксенического мицелия Streptomyces punipalus (NRRL 3529). Колбы с инокулированной смесью устанавливают вертикально на роторном шейкере (амплитуда 2 дюйма) и встряхивают с частотой 210 об./мин при 29 С в течение 2 дней. Затем 2,5 мл бульона со стадии инокулюма переносят в асептических условиях в остальные 15 колб(стадия биотрансформации). Колбы с инокулированной смесью на стадии биотрансформации устанавливают вертикально на роторном шейкере (амплитуда 2 дюйма) и встряхивают с частотой 210 об./мин при 29 С в течение 1 дня. Дигидрохлоридную соль (6-метокси-1-метил-1-трифтор 004233 26 метилизохроман-7-илметил)-(2-фенилпиперидин-3-ил)амина (т.е. субстрат) растворяют в дистиллированной воде (6,5 мг/мл). В каждую из 15 колб для биотрансформации добавляют в асептических условиях 0,75 мл полученного раствора, получая исходную концентрацию субстрата 173 мкг/мл (всего 73,1 мг в 15 колбах). Дозированные колбы устанавливают вертикально на роторном шейкере и встряхивают с частотой 210 об./мин при 29 С еще 4 дня. Процесс образования продукта биотрансформации контролируется ежедневно с помощью ВЭЖХ с обращенной фазой, отбирая 1 мл образцы. В конце четырехдневного периода биотрансформации в каждую колбу добавляют по 25 мл метанола и смешивают с содержимым (т.е. с бульоном). Полученную смесь бульон/метанол из всех 15 колб объединяют. Затем колбы промывают последовательно дважды, один раз 50 мл метанола и снова 25 мл метанола. Промывки объединяют с полученным ранее экстрактом,получая общий объем около 775 мл. Эту смесь бульон/метанол центрифугируют (центрифугаRC5B, 6000 об./мин, 8 мин) для удаления твердого материала. Надосадочную жидкость (А) сохраняют. Твердый материал снова суспендируют в 100 мл метанола, перемешивают и центрифугируют, как и раньше. Надосадочную жидкость (В) объединяют с оставшейся ранее надосадочной жидкостью (А) и фильтруют в вакууме через стекловолоконный фильтр(Whatman GF/B). Затем фильтрат перегоняют при пониженном давлении при 45 С для удаления метанола. Оставшиеся около 300 мл водной суспензии вводят при давлении газообразного азота (30 пси) в подготовленный картридж С 18 смолы (Biotage KP-C18-WP, 20-40 мкм) для экстрагирования твердой фазы (SPE). [Картридж подготавливают для ввода соединения, промывая его вначале 1250 мл метанола и второй раз промывая 2250 мл дистиллированной воды]. После загрузки колонку промывают 2050 мл дистиллированной воды для удаления несвязанного материала. Загруженную колонку промывают 975 мл 50% метанольного раствора (1:1 МеОН/Н 2O) для удаления нежелательного материала. Представляющее интерес соединение элюируют 975 мл метанола. Элюат перегоняют при пониженном давлении при 45 С для удаления метанола. Оставшийся после удаления метанола материал растворяют в 20% растворе метанола в воде и в вакууме вводят в картридж со смолой С 18 (Waters SepPak 6 см 3 (1 г) С 18) для SPE. [Картридж подготавливают, промывая вначале 15 мл метанола и второй раз промывая 15 мл дистиллированной воды]. SPE картридж с материалом освобождают от несвязанных соединений 20 мл 20% раствора метанола в воде. Связанные со смолой соединения элюируют 10 мл объемами раствора метанола в воде с возрастающей концентрацией (50, 55, 60, 65, 70, 75,80, 85, 90, 95, 100%). Почти все представляющее 27 интерес соединение элюируется из SPE картриджа в 60-70% метанольных элюатах (следовые количества в 55% элюате). Элюаты, содержащие указанное в заголовке соединение, объединяют и высушивают досуха при 45 С в потоке газообразного азота. Во время сушки добавляют при необходимости безводный этанол для удаления воды. Получают 59 мг высушенного остатка. Его растворяют в 75% растворе метанола в воде и обрабатывают с помощью высокоэффективной жидкостной хроматографии с обращенной фазой (ВЭЖХ способ 1) для выделения указанного в заголовке соединения. ВЭЖХ способ 1 Колонка: Подвижная фаза:Luna 5 мкм С 18(2), 21,2 х 250 мм Линейный градиент от 2-30 мин; (2080)% ацетонитрил: (80-20)% водный буфер [95% 20 мМ ацетат аммония, рН без доведения 6,8/5% МеОН] 9 мл/мин УФ поглощение на 281 нм; фотодиодная матрица на 200-400 нм (щель 4,8 нм) 30 мин Время удерживания указанного в заголовке соединения примерно 17,3. Элюирующиеся фракции подвижной фазы ВЭЖХ, содержащие указанное в заголовке соединение, объединяют,освобождают от растворителя (ацетонитрил) в вакууме при 45 С и вводят в свежий SPE картридж (Waters 6 см 3 С 18; подготовлен, как указано выше), промывают дистиллированной водой для удаления соли и элюируют 10 мл метанола. Элюат концентрируют досуха в потоке газообразного N2. Высушенный материал растворяют в 50% растворе метанола в воде и обрабатывают с помощью высокоэффективной жидкостной хроматографии с обращенной фазой (ВЭЖХ способ 2), для выделения указанного в заголовке соединения. ВЭЖХ способ 2 Колонка: Подвижная фаза:Luna 5 мкм С 18(2), 21,2 х 250 мм Линейный градиент от 2-30 мин; (575)% ацетонитрил: (95-25)% водный буфер [20 мМ уксусная кислота в дистиллированной воде, рН, доведенный до 4,0 1 н. H2SO4] 9 мл/мин УФ поглощение на 281 нм; фотодиодная матрица на 200-400 нм (щель 4,8 нм) 30 мин Время удерживания указанного в заголовке соединения примерно 21,8 мин. Элюирующиеся фракции подвижной фазы ВЭЖХ, содержащие указанное в заголовке соединение, собирают в сосуд, содержащий 20 мл буфера ацетата аммония (ВЭЖХ способ 1 подвижная водная фаза). Объединенные собранные фракции ВЭЖХ, содержащие указанное в заголовке соединение, освобождают от растворителя (ацетонитрила) в вакууме при 45 С, вводят в свежийSPE картридж (Waters 6 см 3 С 18; подготовлен,как указано выше), промывают 20 мл дистиллированной воды для удаления соли и элюируют 10 мл метанола. Метанольный элюат освобождают от растворителя в потоке газообразного азота при 45 С. Высушенный материал растворяют в безводном этаноле и высушивают досуха при пониженном давлении. Получают всего 19,3 мг указанного в заголовке соединения. Средний молярный выход процесса составляет 29,7%. Время удерживания указанного в заголовке соединения составляет 13,9 мин в способе 3 ВЭЖХ. В этом способе время удерживания исходного соединения составляет 17,5 мин. ВЭЖХ способ 3 Колонка: Подвижная фаза: Симметричная С 18, 3,9 х 150 мм Линейный градиент от 2-30 мин; (1590)% ацетонитрил: (85-10)% водный буфер [20 мМ уксусная кислота в дистиллированной воде, рН, доведенный до 4,0 1 н. H2SO4] 1 мл/мин УФ поглощение на 281 нм; фотодиодная матрица на 200-400 нм (щель 4,8 нм) 30 мин Соединение имеет максимальное поглощение УФ при 205 нм, 229 нм (только плечо) и 280 нм. Масс-спектр (APCI+): 451,3 (М+Н). Пример 4. Микросомальная биотрансформация. 6-Метокси-1-метил-7-[(2-фенилпиперидин 3-иламино)метил]-1-трифторметилизохроман-4 ол. Альтернативой синтезу с помощью микробной биотрансформации (пример 3) является способ с использованием микросомальной реакционной смеси рекомбинантных клеток. Реакционная смесь содержит следующие компоненты: 700 мкл 100 мМ калийфосфатного буфера(рН 7,4) 200 мкл раствора кофактора 20 мкл раствора исходного соединения в дистиллированной воде 80 мкл инфицированных бакуловирусом клеточных микросом насекомых, коэкспрессирующих человеческий Р 450P450-NADPH редуктазу. 100 мМ калийфосфатный буфер 8,1 мл 100 мМ K2 НРO4 в дистиллированной воде 1,9 мл 100 мМ KH2PO4 в дистиллированной воде Раствор кофактора 4 мг NADP+ (например, Sigma N-0505) 75 мг изолимонной кислоты (например, Sigma I1252) 198 мл изолимонной дегидрогеназы (например,Sigma 1-2002) 802 мл 125 мМ MgCl2 в дистиллированной воде. Компоненты реакции помещают в 16 х 125 мм стеклянные тестовые пробирки с крышками Мортона из нержавеющей стали. Пробирки инкубируют на роторном шейкере (с шагом 1 дюйм) при 240 об./мин при 37 С. За ходом реакции наблюдают в моменты 0,5 и 24 ч после инициирования, используя для анализа ВЭЖХ с обращенной фазой (способ 3, раскрыт в примере 3). Для остановки реакции и подготовки образцов для анализа 250 мл образец добавляют к 250 мл метанола, перемешивают, охлаждают на льду в течение 15 мин и центрифугируют (микроцентрифуга Эппендорфа, 14000 об./мин, 5 мин) для удаления выпавшего в осадок белка. Реакция завершается через 5 ч после инициирования. Молярное превращение по расчетам составляет 9,9%. Характеристики ВЭЖХ и APCI+ этого продукта такие же, что и для соединения,указанного в заголовке в примере 3. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I) и его фармацевтически приемлемые соли,где R1 представляет C1-С 6 алкил;R3 представляет водород или галоген иR4 и R5 независимо представляют водород,C1-С 6 алкил или галоген C1-С 6 алкил.R3 представляет водород или фтор иR4 и R5 независимо представляют водород,C1-С 3 алкил или галоген C1-С 3 алкил. 3. Соединение по п.2,где R1 представляет метил;R4 и R5 независимо представляют водород. 4. Соединение по п.1, которое представляет собой (2S,3S)-3-(6-метокси-4-гидрокси-1 метил-1-трифторметилизохроман-7-ил)метиламино-2-фенилпиперидин или его фармацевтически приемлемую соль. 5. Фармацевтическая композиция для лечения заболеваний или состояний у млекопитающих, при которых необходима антагонистическая активность в отношении вещества Р, которая включает количество соединения по п.1 или его фармацевтически приемлемой соли,эффективное для лечения указанных заболеваний или состояний, и фармацевтически приемлемый носитель. 7. Способ лечения заболеваний или состояний, при которых необходима антагонистическая активность в отношении вещества Р у млекопитающих, который включает введение нуждающемуся в такой профилактике или лечении млекопитающему количества соединения по п.1 или его фармацевтически приемлемой соли, эффективного для лечения такого заболевания или состояния.
МПК / Метки
МПК: C07D 405/12, A61P 25/28, A61K 31/453
Метки: антагонистов, производные, качестве, пиперидиниламинометилхромана, 1-трифторметил-4-гидрокси-7, вещества
Код ссылки
<a href="https://eas.patents.su/16-4233-proizvodnye-1-triftormetil-4-gidroksi-7-piperidinilaminometilhromana-v-kachestve-antagonistov-veshhestva-r.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 1-трифторметил-4-гидрокси-7- пиперидиниламинометилхромана в качестве антагонистов вещества р</a>
Предыдущий патент: Новый фармацевтический препарат
Следующий патент: Способ очистки жидких сред
Случайный патент: Получение сверхчистого висмута-213 для использования в терапевтической ядерной медицине












