Новые производные морфолинила, подходящие для применения в качестве ингибиторов mogat-2
Номер патента: 24182
Опубликовано: 31.08.2016
Авторы: Гонсалес-Гарсиа Мария Росарио, Фернандес Мария Кармен
Формула / Реферат
1. Соединение формулы
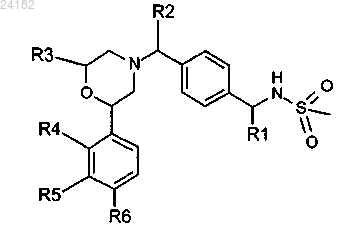
где R1 выбран из -СН3 и -CF3;
R2 выбран из Н и -СН3;
R3 выбран из Н и -СН3;
R4 выбран из Н, -ОС1-3алкила и галогена;
R5 выбран из Н, -CF3, -ОСН3 и галогена;
R6 выбран из Н и галогена;
при условии, что по меньшей мере один из R4, R5 и R6 представляет собой Н;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, отличающееся тем, что R1 представляет собой -СН3.
3. Соединение по п.1, отличающееся тем, что R1 представляет собой -CF3.
4. Соединение по любому из пп.1-3, отличающееся тем, что R2 представляет собой Н.
5. Соединение по любому из пп.1-4, отличающееся тем, что R3 представляет собой Н.
6. Соединение по любому из пп.1-5, отличающееся тем, что R4 выбран из Н и галогена.
7. Соединение по любому из пп.1-6, отличающееся тем, что R5 выбран из Н, -CF3, F и Cl.
8. Соединение по любому из пп.1-6, отличающееся тем, что R5 представляет собой Н.
9. Соединение по любому из пп.1-8, отличающееся тем, что R6 представляет собой F.
10. Соединение формулы
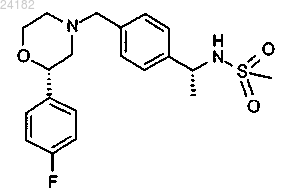
или его фармацевтически приемлемая соль.
11. Соединение по любому из пп.1-10, отличающееся тем, что фармацевтически приемлемая соль выбрана из хлоридной соли и малеатной соли.
12. Соединение по п.11, отличающееся тем, что фармацевтически приемлемая соль представляет собой малеатную соль.
13. Соединение, представляющее собой N-[(1R)-1-(4-{[(2S)-2-(4-фторфенил)морфолин-4-ил]метил}фенил)этил]метансульфонамида гидрохлорид.
14. Соединение, представляющее собой N-[(1R)-1-(4-{[(2S)-2-(4-фторфенил)морфолин-4-ил]метил}фенил)этил]метансульфонамида малеиновую кислоту.
15. Фармацевтическая композиция для лечения гипертриглицеридемии, содержащая соединение по любому из пп.1-14 и по меньшей мере один из фармацевтически приемлемых носителя, разбавителя или наполнителя.
Текст
НОВЫЕ ПРОИЗВОДНЫЕ МОРФОЛИНИЛА, ПОДХОДЯЩИЕ ДЛЯ ПРИМЕНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ MOGAT-2 В изобретении предложены соединения формулы I или их фармацевтически приемлемые соли, способы лечения гипертриглицеридемии с применением соединений и способы получения соединений.(71)(73) Заявитель и патентовладелец: ЭЛИ ЛИЛЛИ ЭНД КОМПАНИ (US) Избыточное потребление жира является основной причиной алиментарного ожирения и может иметь значительный отрицательный эффект на здоровье человека. Более 90% жира, потребляемого человеком, составляет триацилглицерин (или триглицерид), который почти полностью всасывается в тонком кишечнике. Полагают, что фермент ацил-КоА:моноацилглицерол-ацилтрансфераза 2 (MOGAT-2) играет важную роль в процессе всасывания потребляемого жира в тонком кишечнике. Было показано, что мыши, дефицитные по MOGAT-2, получавшие рацион с высоким содержанием жира, устойчивы к развитию ожирения, непереносимости глюкозы, гиперхолестеринемии и развитию жировой дистрофии печени. Кроме того, также было показано, что дефицитные по MOGAT-2 мыши демонстрируют более низкое содержание триацилглицерина в плазме после введения в рацион оливкового масла (Yen, et al., Nat. Med. 2009, 15(4), 442-446.). Существует потребность в дополнительных лекарственных средствах для лечения гипертриглицеридемии. Также существует потребность в новых ингибиторах рецептора MOGAT-2. Настоящее изобретение направлено на удовлетворение одной или более из указанных потребностей путем обеспечения альтернативных соединений и способов лечения, которые могут подходить для лечения гипертриглицеридемии. В настоящем изобретении предложено соединение формулы I где R1 выбран из -СН 3 и -CF3; R2 выбран из Н и -СН 3; R3 выбран из Н и -СН 3; R4 выбран из Н, OC1-3 алкила и галогена; R5 выбран из Н, -CF3, -ОСН 3 и галогена; R6 выбран из Н и галогена; при условии, что по меньшей мере один из R4, R5 и R6 представляет собой Н; или его фармацевтически приемлемая соль. Соединения согласно настоящему изобретению могут иметь один или более хиральных центров. Ниже в соединениях формулы II один из хиральных центров помечен звездочкой . Если R1 представляет собой -СН 3, предпочтительные соединения характеризуются (R)-конфигурацией указанного хирального центра. Если R1 представляет собой -CF3, предпочтительные соединения характеризуются (S)конфигурацией. В одном из вариантов реализации R1 представляет собой -СН 3. В другом варианте реализации R1 представляет собой -CF3. Предпочтительно R2 представляет собой Н. Предпочтительно R3 представляет собой Н. Предпочтительно R4 выбран из Н, -ОСН(СН 3)2 и галогена. Более предпочтительно R4 выбран из Н и галогена. Более предпочтительно R4 выбран из Н и С 1. Предпочтительно R5 выбран из Н, -CF3, -ОСН 3, F и С 1. Более предпочтительно R5 выбран из Н, -CF3, F и С 1. Более предпочтительно R5 представляет собой Н. Предпочтительно R6 выбран из Н и F. Предпочтительно R6 представляет собой F. Ниже в настоящем изобретении предложено соединение формулы III или его фармацевтически приемлемая соль. В настоящем изобретении предложено соединение в соответствии с формулами I или II, где R1 представляет собой -СН 3; R2 выбран из Н и -СН 3; R3 выбран из Н и -СН 3; R4 выбран из Н, -ОСН(СН 3)2 и галогена; R5 выбран из Н, -CF3, -OCH3, C1 и F; и R6 выбран из Н и F; или его фармацевтически приемлемая соль. В настоящем изобретении предложено соединение в соответствии с формулами I или II, где R1 представляет собой -СН 3; R2 выбран из Н и -СН 3; R3 выбран из Н и -СН 3; R4 выбран из Н и галогена; R5 выбран из Н, -CF3, F и С 1; и R6 выбран из Н и F; или его фармацевтически приемлемая соль. В настоящем изобретении предложено соединение в соответствии с формулами I или II, где R1 представляет собой -СН 3; R2 выбран из Н и -СН 3; R3 выбран из Н и -СН 3; R4 выбран из Н и галогена; R5 выбран из Н, F и С 1; и R6 выбран из Н и F; или его фармацевтически приемлемая соль. В настоящем изобретении предложено соединение в соответствии с формулами I или II, где R1 представляет собой -СН 3; R2 представляет собой Н; R3 представляет собой Н; R4 выбран из Н и Cl; R5 представляет собой Н, Cl или F; и R6 выбран из Н и F; или его фармацевтически приемлемая соль. В настоящем изобретении предложено соединение в соответствии с формулами I или II, где R1 представляет собой -СН 3; R2 представляет собой Н; R3 представляет собой Н; R4 выбран из Н и Cl; R5 представляет собой Н; и R6 выбран из Н и F; или его фармацевтически приемлемая соль. В настоящем изобретении предложено соединение в соответствии с формулами I или II, где R1 представляет собой -СН 3; каждый из R2, R3, R4 и R5 представляет собой Н; и R6 представляет собой F. В настоящем изобретении предложено соединение в соответствии с формулами I или II, где R1 представляет собой -CF3; R2 выбран из Н и -СН 3; R3 выбран из Н и -СН 3; R4 выбран из Н, -ОСН(СН 3)2 и галогена; R5 выбран из Н, -CF3, -OCH3, Cl и F; и R6 выбран из Н и F; или его фармацевтически приемлемая соль. В настоящем изобретении предложено соединение в соответствии с формулами I или II, где R1 представляет собой -CF3; R2 выбран из Н и -СН 3; R3 выбран из Н и -СН 3; R4 выбран из Н и галогена; R5 выбран из Н, -CF3, F и Cl; и R6 выбран из Н и F; или его фармацевтически приемлемая соль. В настоящем изобретении предложено соединение в соответствии с формулами I или II, где R1 представляет собой -CF3; R2 выбран из Н и -CF3; R3 выбран из Н и -CF3; R4 выбран из Н и галогена; R5 выбран из Н, F и С 1; и R6 выбран из Н и F; или его фармацевтически приемлемая соль. В настоящем изобретении предложено соединение в соответствии с формулами I или II, где R1 представляет собой -CF3; R2 представляет собой Н; R3 представляет собой Н; R4 выбран из Н и Cl; R5 представляет собой Н, Cl или F; и R6 выбран из Н и F; или его фармацевтически приемлемая соль. В настоящем изобретении предложено соединение в соответствии с формулами I или II, где R1 представляет собой -CF3; R2 представляет собой Н; R3 представляет собой Н; R4 выбран из Н и Cl; R5 представляет собой Н; и R6 выбран из Н и F; или его фармацевтически приемлемая соль. В настоящем изобретении предложено соединение в соответствии с формулами I или II, где R1 представляет собой -CF3; каждый из R2, R3, R4 и R5 представляет собой Н; и R6 представляет собой F. Предпочтительно фармацевтически приемлемая соль выбрана из: хлоридной соли или малеатной соли. Более предпочтительно фармацевтически приемлемая соль представляет собой малеатную соль. Предпочтительные соединения представляют собой N-[(lR)-l-(4-[(2S)-2-(4-фторфенил)морфолин 4-ил]метилфенил)этил]метансульфонамид;N-[(1R)-1-(4-[(2S)-2-(4-фторфенил)морфолин-4-ил]метилфенил)этил]метансульфонамида малеиновая кислота. В настоящем изобретении предложена фармацевтическая композиция, содержащая соединение формул I, II или III, как описано выше, или его фармацевтически приемлемую соль и по меньшей мере один из фармацевтически приемлемых носителя, разбавителя или наполнителя. В настоящем изобретении также предложен способ лечения пациентов, нуждающихся в лечении гипертриглицеридемии, включающий введение пациенту эффективного количества соединения в соответствии с формулами I, II или III, приведенными выше. В настоящем изобретении предложено соединение в соответствии с формулами I, II или III, приведенными выше, для применения для лечения гипертриглицеридемии. В настоящем изобретении предложено применение соединения в соответствии с формулами I, II или III, приведенными выше, для получения лекарственного средства для лечения гипертриглицеридемии. Термин "фармацевтически приемлемая соль" относится к соли соединения согласно настоящему изобретению, считающейся подходящей для клинического и/или ветеринарного применения. Фармацевтически приемлемые соли и распространенные способы получения указанных солей хорошо известны в данной области техники. См., например, P. Stahl, et al., Handbook of Pharmaceutical Salts: Properties, Selection and Use, (VCHA/Wiley-VCH, 2002); S.M. Berge, et al., "Pharmaceutical Salts," Journal of PharmaceuticalSciences, Vol. 66, No. 1, January 1977. Фармацевтические составы согласно настоящему изобретению могут быть получены при помощи способов, известных в данной области, с применением известных или легкодоступных добавок. Термин"фармацевтически приемлемые носитель, разбавитель или наполнитель", применяемый в настоящей заявке, относится к одному или более носителям, разбавителям и наполнителям, совместимым с другими ингредиентами состава и безвредным для пациента. Фармацевтические композиции и способы их получения известны в данной области техники, и примеры можно найти в Remington, "The Science and Practice of Pharmacy" (A. Gennaro, et al. eds. 19th ed. Mack Publishing Co.). Неограничивающие примеры фармацевтически приемлемых носителей, наполнителей и разбавителей, подходящих для указанных составов, включают следующие соединения: крахмал, сахара, маннит и производные кремния; связующие агенты, такие как карбоксиметилцеллюлоза и другие производные целлюлозы, альгинаты, желатин и поливинилпирролидон; увлажняющие агенты, такие как глицерин; разрыхлители, такие как карбонат кальция и бикарбонат натрия. Термин "пациент", применяемый в настоящей заявке, относится к животному, нуждающемуся в ле-2 024182 чении, предпочтительно, но не исключительно, к млекопитающему, предпочтительно человеку; или, альтернативно, к домашнему животному, такому как собака или кошка; или к птицам. Если не указано иное, названия соединениям, представленным в настоящей заявке, присваивали с применением ACDLABS или Symyx Draw 3.2. Общая химия. Следующие термины, применяемые в настоящей заявке, имеют указанные значения: "АЦН" относится к ацетонитрилу; "ДХМ" относится к дихлорметану; "ДЭА" относится к диэтиламину; "ДМЭА" относится к диметилэтиламину; "ДМФ" относится к диметилформамиду; "э.и." относится к энантиомерному избытку; "EtOAc" относится к этилацетату; "EtOH" относится к этанолу; "ч" относится к часу(ам);"ВЭЖХ" относится к высокоэффективной жидкостной хроматографии; "IPA" относится к изопропиловому спирту; "изомер 1" относится к первому элюируемому изомеру; "изомер 2" относится ко второму элюируемому изомеру; "ЖХ/МС" относится к жидкостной хроматографии с последующей массспектроскопией; "МеОН" относится к метанолу; "мин" относится к минуте(ам); "МС" относится к массспектроскопии; "ЯМР" масс-спектроскопией ядерно-магнитному резонансу; "СФХ" относится к сверхкритической флюидной хроматографии; "ТГФ" относится к тетрагидрофурану. Схема 1 На схеме 1 представлен общий синтез соединения формулы I. Замещенный морфолин 1, приобретенный из коммерческих источников или полученный при помощи способов, описанных в литературе, взаимодействует с альдегидом или кетоном 2 в условиях восстановительного аминирования с получением соединения формулы I (см.: Richard С. Larock, Comprehensive Organic Transformations: a guide to functional group preparations. 2nd edition, Page 835-846, Wiley-VCH,(1999. Предпочтительно морфолин 1 взаимодействует с соединением 2 в присутствии восстанавливающего агента, такого как триацетоксиборогидрид, и кислоты, такой как уксусная кислота, в дихлорметане с получением соединения формулы I, которое может быть превращено в подходящую соль при помощи соответствующей кислоты, например HCl, с получением гидрохлорида. Пример получения 1. (N-Z)-N-[(4-Бромфенил)метилен]-(R)-2-метилпропан-2-сульфинамид К раствору 4-бромбензальдегида (65,57 г, 0,35 моль) в толуоле (283 мл) порциями добавляли (R)-2 метилпропан-2-сульфинамид (40,5 г, 0,33 моль). Смесь перемешивали при температуре окружающей среды в течение 15 мин, а затем добавляли гидроксид натрия (1,34 г, 0,33 моль). Суспензию перемешивали при температуре окружающей среды в течение 12 ч. Добавляли сульфат натрия (16 г) и Celite (16 г),и суспензию перемешивали в течение 15 мин. Смесь фильтровали, и фильтрат концентрировали при пониженном давлении. Остаток очищали при помощи хроматографии на силикагеле, элюируя смесями гексан/EtOAc (от 100% до 70% гексана), с получением титульного соединения в виде белого твердого вещества (85,5 г, 88% выход). МС (m/z): 288 (М+1). Пример получения 2. N-[(1S)-l-(4-Бромфенил)-2,2,2-трифторэтил]-(R)-2-метилпропан-2-сульфинамид К раствору ацетата тетрабутиламмония (88 г, 0,29 моль) и (N-Z)-N-[(4-бромфенил)метилен]-(R)-2 метилпропан-2-сульфинамида (85 г, 0,29 моль) в ДМФ (1,2 л) при 0 С при перемешивании добавляли чистый (трифторметил)триметилсилан (109 мл, 0,74 моль). Смесь перемешивали при 0-5 С в течение 90 мин. Добавляли насыщенный водный раствор хлорида аммония (1,2 л) и экстрагировали EtOAc (4400 мл). Экстракты объединяли и последовательно промывали водой и солевым раствором (21 л), сушили над сульфатом магния, фильтровали, и фильтрат концентрировали при пониженном давлении. Остаток растирали с гексаном (200 мл) в течение 10 мин и фильтровали, и фильтрат сушили при пониженном давлении с получением титульного соединения в виде желтого твердого вещества (81 г, 76% выход, 98 э.и.). МС (m/z): 358 (М+1). Пример получения 3. (1S)-1-(4-Бромфенил)-2,2,2-трифторэтанамин 0,23 моль) в МеОН (670 мл) добавляли HCl (4 М раствор в диоксане, 226 мл, 0,9 моль). Смесь перемешивали при температуре окружающей среды в течение одного часа. Растворитель удаляли при пониженном давлении, и остаток растирали с метил-трет-бутиловым эфиром (200 мл) в течение 10 мин с получениемHCl соли в виде коричневого твердого вещества. Соль растворяли в воде (1,2) и добавляли 2 н. растворNaOH в количестве, достаточном для увеличения рН водного раствора до 10. Смесь экстрагировали метил-трет-бутиловым эфиром (3500 мл). Органическую фазу промывали водой и солевым раствором (по 500 мл), сушили над сульфатом магния, фильтровали и фильтрат концентрировали при пониженном давлении с получением титульного соединения в виде желтого твердого вещества (46 г, 80% выход, 98% э.и.). МС (m/z): 358 (М+1). Пример получения 4. N-[(1S)-1-(4-Бромфенил)-2,2,2-трифторэтил]метансульфонамид(1,18 г, 9,0 ммоль), 2,6-лутидина (67 мл, 0,57 моль) в ДХМ (250 мл) при 0 С по каплям добавляли метансульфонилхлорид (16,42 мл, 0,21 моль). Смесь нагревали до температуры окружающей среды и перемешивали при данной температуре в течение 20 ч. Реакционную смесь разбавляли ДХМ (300 мл) и последовательно промывали 2 М раствором HCl (2200 мл), водой (250 мл) и солевым раствором (250 мл). Органическую фазу собирали, сушили над сульфатом магния, фильтровали и фильтрат концентрировали при пониженном давлении. Остаток растирали с гексаном (200 мл) в течение 10 мин, фильтровали, и твердое вещество сушили при пониженном давлении с получением титульного соединения в виде светло-коричневого твердого вещества (60 г, 93% выход, 98% э.и.). МС (m/z): 332 (М+1). Пример получения 5. N-[(1S)-2,2,2-Трифтор-1-(4-формилфенил)этил]метансульфонамид В 2 л реактор PARR вносили N-[(1S)-1-(4-бромфенил)-2,2,2-трифторэтил]метансульфонамид (30 г,90 ммоль), ацетат палладия(II) (0,81 г, 3,6 ммоль), бутилди-1-адамантилфосфин (3,89 г, 10,84 ммоль) и тетраметилэтилендиамин (10,50 г, 90 ммоль) в толуоле (1,5 мл). Реактор герметизировали и заполняли синтез-газом (1:1 СО/Н 2 при 75 фунт/кв. дюйм). Реакционную смесь перемешивали в течение 16 ч при температуре 95 С. Смесь охлаждали, отводили синтез-газ и открывали реактор. Смесь фильтровали через Celite, и фильтрат концентрировали при пониженном давлении. Неочищенный остаток очищали при помощи хроматографии на силикагеле, элюируя смесями гексан/EtOAc (от 8:2 до 1:1), с получением титульного соединения (22,8 г, 90%, 80% э.и.). Хиральную чистоту соединения увеличивали путем элюирования через хиральную колонку: Chiralpak AS-H (2,1x25 см, 5 мкМ) СО 2/EtOH (9:1) с получением титульного соединения (19 г, 75% выход, 98% э.и.). МС (m/z): 282 (М+1). Пример получения 6. N-[(1R)-1-(4-Бромфенил)этил]метансульфонамид(250 мл) при 0 С добавляли метансульфонилхлорид (13,44 мл, 0,17 ммоль). Нагревали до температуры окружающей среды и перемешивали в течение 2,5 ч. Реакционную смесь промывали 2 М водным раствором HCl (100 мл). Затем органическую фазу последовательно промывали водой и солевым раствором(2100 мл). Органическую фазу сушили над безводным сульфатом натрия, фильтровали, и фильтрат концентрировали при пониженном давлении с получением остатка. Остаток растирали с гексаном (150 мл),фильтровали и сушили при пониженном давлении с получением титульного соединения в виде желтого твердого вещества (33,24 г, 96%, э.и.98%). МС (m/z): 278 (М+1). Пример получения 7. N-[(1R)-1-(4-Формилфенил)этил]метансульфонамид(1,1'бис(дифенилфосфино)ферроцен)палладия(II) (733 мг, 0,9 ммоль), карбонат натрия (3,81 г, 35 ммоль) и ДМФ (50 мл) объединяли в 300 мл реакторе PARR. Добавляли триэтилсилан (11,6 мл, 0,72 ммоль), и реактор три раза продували монооксидом углерода. Реактор заполняли монооксидом углерода (50 фунт/кв. дюйм), и смесь перемешивали при 90 С в течение 15 ч. Реактор охлаждали до температуры окружающей среды и открывали, смесь фильтровали через слой Celite, и слой промывали ДХМ (150 мл). Фильтрат последовательно промывали водой и солевым раствором (280 мл). Органическую фазу концентрировали при пониженном давлении с получением остатка в виде оранжевой маслянистой жидкости. Оранжевую маслянистую жидкость очищали при помощи флэш-хроматографии на силикагеле, элюируя смесями гексан/EtOAc (от 0 до 30% EtOAc), с получением титульного соединения (5,6 г, 70%, э.и.98%). МС В 30 л круглодонную колбу в атмосфере азота при 22 С вносили раствор (S)-l-метил-3,3-дифенил 3 а,4,5,6-тетрагидропирроло[1,2-с][1,3,2]оксазаборола (1 М раствор в толуоле; 44 мл; 44 ммоль). Добавляли раствор комплекса боран-N,N-диэтиланилина (1230 г; 7540 ммоль) в метил-трет-бутиловом эфире (4,5 л). Смесь нагревали и выдерживали при 40 С в течение 30 мин. По каплям в течение 30 мин добавляли раствор бром-4-фторацетофенона (1640 г; 7530 ммоль) в метил-трет-бутиловом эфире (4,5 л). Смесь перемешивали при 40 С в течение 2 ч. Охлаждали до 10 С на водяной бане со льдом, а затем для гашения реакции медленно добавляли МеОН (590 мл). Смесь перемешивали при 10-20 С в течение 30 мин. При 10 С к смеси добавляли соляную кислоту (3,0 М, 7,5 л). Перемешивали в течение одного часа и фильтровали. Фильтрат собирали. Слои фильтрата разделяли, водную фазу экстрагировали метил-третбутиловым эфиром (13 л), органические фазы объединяли, промывали солевым раствором, сушили надNa2SO4 и фильтровали, летучие вещества при пониженном давлении удаляли из фильтрата с получением титульного соединения в виде светло-желтой маслянистой жидкости (1650 г, 99%). МС (m/z): 201 (МОН); значение э.и.: 97,5% (на AD-H 250 мм 4,6 мм 5 мкм колонке с применением смеси 99:1 гексан:EtOH при 25 С при скорости потока 1,0 мл/мин). Пример получения 9. (S)-2-(4-Фторфенил)оксиран(1S)-2-Бром-1-(4-фторфенил)этанол (1650 г, 7,53 моль) растворяли в 6,8 л метил-трет-бутилового эфира. К смеси при 20 С добавляли NaOH (2 М раствор в Н 2 О; 4,93 л). Смесь перемешивали при 20-22 С в течение 3 ч. Слои разделяли, и водный слой экстрагировали метил-трет-бутиловым эфиром (12 л). Органические фазы объединяли, промывали солевым раствором (12 л), сушили над Na2SO4 и фильтровали, фильтрат концентрировали с получением остатка. Очищали при помощи колоночной флэшхроматографии на силикагеле с применением смеси 50:1 петролейный эфир:EtOAc для элюирования продукта. Фракции продукта концентрировали с получением титульного соединения в виде светложелтой маслянистой жидкости (880 г, 84%). 1 Н-ЯМР (300 МГц, CDCl3): 7,27-7,21 (m, 2 Н), 7,06-7,01 (m,2H), 3,86 (dd, J=2,6, 4,0 Гц, 1H), 3,16 (dd, J=4,1, 5,5 Гц, 1H), 2,79 (dd, J=2,6, 5,4 Гц, 1 Н); значение э.и.: 97,5% (на AD-H 250 мм 4,6 мм 5 мкм колонке с применением смеси 99:5 гексан:этиловый спирт при 25 С при скорости потока 1,0 мл/мин). Пример получения 10. (1S)-2-(Бензиламино)-1-(4-фторфенил)этанол В 10 л круглодонную колбу в атмосфере азота вносили (S)-2-(4-фторфенил)оксиран (880 г, 6,38 моль). К смеси при 20 С добавляли бензиламин (2047 г, 19,13 моль). Смесь нагревали до 80 С и перемешивали при указанной температуре в течение 5 ч. Охлаждали до 22 С и перемешивали в течение 16 ч. Для гашения реакции добавляли Н 2 О (3 л). Фильтровали и слой фильтрата промывали водой (21 л). Полученное твердое вещество суспендировали в гептане (2 л) и фильтровали с получением титульного соединения (1216 г, 77%). МС (m/z): 246 (М+1); значение э.и.: 99,0% (на AD-H 250 мм 4,6 мм 5 мкм колонке с применением смеси 90:10 гексан (с 0,02% диэтиламина):EtOH при 25 С при скорости потока 1,0 мл/мин). Пример получения 11. N-Бензил-2-хлор-N-[(2S)-2-(4-фторфенил)-2-гидроксиэтил]ацетамид(1S)-2-(Бензиламино)-1-(4-фторфенил)этанол (1215 г, 4,96 моль) растворяли в 12,15 л ДХМ, и смесь охлаждали до 0 С. По каплям в течение 30 мин добавляли NaOH (1M раствор в Н 2 О, 5,46 л, 5,46 моль) Смесь энергично перемешивали при 0-3 С в течение 10 мин, а затем, поддерживая температуру ниже 6 С, по каплям в течение 1 ч добавляли раствор хлорацетилхлорида (616,5 г, 5,46 моль) в 4,86 л ДХМ. Смесь перемешивали при 0 С в течение 1 ч, слои разделяли, и водную фазу экстрагировали ДХМ (12 л). Органический слой и экстракты объединяли и промывали 10%-ным раствором соляной кислоты (1,5 л),водой (1,5 л) и 1 М раствором NaOH (1 л). Сушили над Na2SO4 и фильтровали. Фильтрат собирали и растворитель удаляли при пониженном давлении с получением титульного соединения в виде бесцветной К трет-бутиловому спирту (14,5 л) добавляли N-бензил-2-хлор-N-[(2S)-2-(4-фторфенил)-2 гидроксиэтил]ацетамид (1440 г, 4,48 моль) и порциями при температуре 22 С добавляли трет-бутоксид,калия (753 г, 6,73 моль). Смесь перемешивали при 22 С в течение 1,5 ч. Для гашения реакции добавляли насыщенный водный раствор хлорида аммония (1306 г). Дополнительно перемешивали в течение 1 ч, а затем добавляли Н 2 О (2 л). Экстрагировали EtOAc (210 л), экстракты объединяли и концентрировали при пониженном давлении с получением остатка. Остаток повторно растворяли в EtOAc (20 л) и промывали Н 2 О (10 л). Раствор в EtOAc сушили над Na2SO4 и фильтровали. Фильтрат собирали и растворитель удаляли при пониженном давлении с получением титульного соединения в виде бесцветной маслянистой жидкости (1250 г, 98%). МС (m/z): 286 (М+1). Пример получения 13. (2S)-4-Бензил-2-(4-фторфенил)морфолин К литийалюминийгидриду в ТГФ (1 М раствор в ТГФ, 5,0 л, 5 моль) при 20 С в атмосфере азота по каплям добавляли раствор (6S)-4-бензил-6-(4-фторфенил)морфолин-3-она (625 г, 2,19 моль) в ТГФ (22 л). Смесь нагревали до 70 С и перемешивали в течение 1,5 ч. Смесь охлаждали до 0 С и для гашения реакции добавляли Н 2 О (200 мл), а затем водный раствор NaOH (4 М, 1,25 л) и еще Н 2 О (600 мл). Полученную смесь перемешивали в течение 30 мин и фильтровали, твердое вещество промывали EtOAc (10 л). Фильтрат собирали и концентрировали при пониженном давлении с получением титульного соединения(2S)-4-Бензил-2-(4-фторфенил)морфолин (948 г, 3,5 моль) растворяли в 1,2-дихлорэтане (17 л). Смесь нагревали до 70 С и в процессе нагревания по каплям добавляли 1-хлорэтилхлорформиат (1500 г,10,5 моль). Смесь перемешивали при 70 С в течение 3 ч, а затем концентрировали с получением остатка. Остаток растворяли в МеОН (10 л) и при перемешивании нагревали до 70 С в течение 1 ч. Раствор концентрировали при пониженном давлении с получением остатка. Остаток суспендировали в EtOAc (5 л) и фильтровали, твердое вещество промывали EtOAc (1 л) с получением серовато-белого твердого вещества. Твердое вещество суспендировали в смеси 10:1 EtOAc/MeOH (10:1, 3 л) и фильтровали, твердое вещество собирали с получением титульного соединения в виде белого твердого вещества (300 г). Остаточный раствор концентрировали с получением дополнительного материала. Указанный материал суспендировали в смеси EtOAc/MeOH (2:1; 1 л) и фильтровали с получением дополнительных 105 г титульного соединения в виде белого твердого вещества. Порции продукта смешивали с получением титульного соединения (405 г, 53%). МС (m/z): 182 (М-С 1). Значение э.и.: 100% (на AD-H 250 мм 4,6 мм 5 мкм колонке с применением смеси 90:10 гексан (с 0,02% ДЭА):этиловый спирт при 25 С при скорости потока 1,0 мл/мин). Пример получения 15. 2-Бром-1-(2-изопропоксифенил)этанон 1-(2-Изопропоксифенил)этанон (1,0 г, 6 ммоль) растворяли в Et2O (25 мл), по каплям при перемешивании добавляли бром (0,3 мл, 6 ммоль), и смесь перемешивали в темноте при температуре окружающей среды. Реакционную смесь промывали насыщенным водным раствором Na2CO3. Сушили над MgSO4 и фильтровали, фильтрат собирали, и летучие вещества удаляли при пониженном давлении с получением титульного соединения (1,5 г, 83%). МС (m/z): 258 (М+1). Пример получения 16. 4-Бензил-2-(2-хлор-4-фторфенил)морфолин Объединяли муравьиную кислоту (98-100%; 0,30 мл, 8 ммоль) и 2-бензиламиноэтанол (1,21 г, 8 ммоль) и полученную смесь охлаждали на ледяной бане. Добавляли 2-бром-1-(2-хлор-4 фторфенил)этанон (1,0 г, 4 ммоль), смесь перемешивали при температуре обратной конденсации в течение 20 ч. Смесь разбавляли ДХМ и промывали насыщенным водным раствором Na2CO3. Органическую фазу сушили над MgSO4 и фильтровали, фильтрат собирали и концентрировали при пониженном давлении. Очищали при помощи колоночной флэш-хроматографии, элюируя с градиентом смесями 0-20% метил-трет-бутилового эфира в гексане. Фракции продукта объединяли и растворители удаляли при пониженном давлении с получением титульного соединения в виде желтой маслянистой жидкости (1,22 г,43%). МС (m/z): 306 (М+1). Пример получения 17. 4-Бензил-2-(2-изопропоксифенил)морфолин 4-Бензил-2-(2-изопропоксифенил)морфолин получали, по существу, при помощи способа из примера получения 16. МС m/z 312 (М+1). Пример получения 18. 2-(6-Хлор-4-фторциклогекса-2,4-диен-1-ил)морфолин 4-Бензил-2-(2-хлор-4-фторфенил)морфолин (529 мг, 1,73 ммоль) растворяли в ДХМ (2,5 мл). Добавляли 1-хлорэтилхлорформиат (1,25 г, 8,65 ммоль), нагревали до 80 С и перемешивали в течение ночи. Добавляли МеОН (2,5 мл) и перемешивали при 65 С в течение 3 ч. Концентрировали при пониженном давлении и очищали при помощи хроматографии на сильной катионообменной смоле, элюируя с градиентом смесями 0-100% (2 н. раствор NH3/MeOH) в МеОН. Фракции продукта объединяли и растворители удаляли при пониженном давлении с получением титульного соединения в виде белого твердого вещества (345 мг, 92%). МС (m/z): 216(М+1). Пример получения 19. 2-(2-Изопропоксифенил)морфолин 4-Бензил-2-(2-изопропоксифенил)морфолин (0,51 г, 2 ммоль), 10% PdOH/углерод (0,51 г, 10 мол.%) и безводный формиат аммония (0,53 г, 10 ммоль) объединяли в атмосфере азота. Полученную смесь нагревали до температуры обратной конденсации и перемешивали. Протекание реакции отслеживали при помощи тонкослойной хроматографии. После завершения реакции реакционную смесь фильтровали через слой Celite, фильтрат собирали и растворитель удаляли при пониженном давлении с получением титульного соединения в виде маслянистой жидкости (0,25 г, 63%). МС (m/z): 433 (М+1). Пример получения 20. N-[2-[2-Бром-1-(3-метоксифенил)этокси]этил]-4-нитробензолсульфонамид Этиленоксид (11 мл, 220 ммоль) одной порцией добавляли к ДХМ, охлажденному до 0 С, а затем при помощи шприца добавляли 1-метокси-3-винилбензол (7,09 г, 52,82 ммоль). Смесь перемешивали при 0 С. Добавляли N-бромсукцинимид (9,4 г, 52,82 ммоль) и 4-нитробензолсульфонамид (8,9 г, 44,02 ммоль). Колбу оборачивали фольгой, и реакционную смесь перемешивали при температуре окружающей среды в течение 20 ч. Концентрировали при пониженном давлении и фильтровали, фильтрат концентрировали при пониженном давлении с получением остатка. Остаток очищали при помощи колоночной флэш-хроматографии, элюируя с градиентом смесями 5-40% EtOAc в гексане. Фракции продукта объединяли и растворители удаляли при пониженном давлении с получением титульного соединения в виде темно-желтой маслянистой жидкости (14,22 г, 70,3%). МС (m/z): 459 (М+1). Пример получения 21. 2-(3-Метоксифенил)-4-(4-нитрофенил)сульфонилморфолинN-[2-[2-Бром-1-(3-метоксифенил)этокси]этил]-4-нитробензолсульфонамид (14,22 г, 30,96 моль) растворяли в АЦН (200 мл), добавляли карбонат калия (6,42 г, 46,44 ммоль), и смесь нагревали до температуры обратной конденсации. Смесь перемешивали при температуре обратной конденсации в течение 3 ч. Полученную смесь охлаждали до температуры окружающей среды и разбавляли EtOAc. Фильтровали через Celite, фильтрат концентрировали при пониженном давлении с получением остатка. Остаток очищали при помощи колоночной флэш-хроматографии, элюируя с градиентом смесями 50-80% EtOAc в гексане. Фракции продукта объединяли, и растворители удаляли при пониженном давлении с получением титульного соединения в виде оранжевого твердого вещества (11,2 г, 95,6%). МС (m/z): 379(M+1). Пример получения 22. 2-(3-Метоксифенил)морфолин(150 мл) и воде (2,67 мл). При перемешивании к смеси добавляли LiOH (6,21 г, 147,99 ммоль), а затем 1 пропантиол (13,42 мл, 147,99 ммоль). Смесь перемешивали при температуре окружающей среды в течение 25 ч. Смесь разбавляли EtOAc и добавляли солевой раствор. Дважды экстрагировали EtOAc. Экстракты собирали и концентрировали при пониженном давлении до 200 мл, а затем три раза промывали 1 н. раствором НС 1. Водно-кислотные экстракты объединяли и добавляли Na2CO3 до получения основной смеси. Основный раствор три раза экстрагировали EtOAc, экстракты объединяли, промывали солевым раствором и сушили над Na2SO4. Фильтровали, фильтрат собирали, и растворители удаляли при пониженном давлении с получением остатка. Остаток очищали при помощи колоночной флэшхроматографии, элюируя EtOAc, а затем с градиентом смесями 5-100% (10% 2 М раствора NH3 в МеОН)/ДХМ. Фракции продукта объединяли, и растворители удаляли при пониженном давлении с получением титульного соединения в виде желтой маслянистой жидкости (3,09 г, 15,99 ммоль). МС (m/z): 194 В пробирку вносили N-[(1R)-1-(4-бромфенил)этил]метансульфонамид (29 г, 104 ммоль), бутилвиниловый эфир (34,23 мл, 261 ммоль), ацетат палладия(II) (14,04 г, 63 ммоль), бис(1,3 дифенилфосфино)пропан (52,7 г, 125 ммоль) и карбонат калия (17,3 г, 125 ммоль). Пробирку продували азотом в течение 2 мин, а затем добавляли Н 2 О (69,5 мл) и ДМФ (69,5 мл). Пробирку герметизировали и перемешивали при 110 С в течение 20 ч. Реакционную смесь охлаждали до температуры окружающей среды и добавляли HCl (2 н., 60 мл). Реакционную смесь перемешивали при температуре окружающей среды в течение 10 мин. рН смеси доводили до 7 при помощи гранул NaOH, смесь разбавляли ДХМ (220 мл) и фильтровали через слой Celite, фильтрат последовательно промывали водным раствором К 2 СО 3(2120 мл), солевым раствором (2100 мл) и Н 2 О (100 мл). Смесь сушили над MgSO4 и фильтровали,фильтрат концентрировали при пониженном давлении с получением остатка. Остаток очищали при помощи колоночной флэш-хроматографии, элюируя смесями EtOAc в гексане (с градиентом 0, 5, 10, 20, 30 и 40% EtOAc). Фракции продукта объединяли, и растворители удаляли при пониженном давлении с получением титульного соединения (17,6 г, 70,0%) в виде желтой маслянистой жидкости. МС (m/z): 242N-[(1R)-1-(4-Ацетилфенил)этил]метансульфонамид (15 г, 62 ммоль) растворяли в EtOH (155,4 мл) и охлаждали на ледяной бане. Добавляли борогидрид натрия (1,2 г, 31,1 ммоль), и полученную смесь перемешивали на ледяной бане в течение 2 ч. Реакцию гасили добавлением Н 2 О (20 мл), и смесь концентрировали при пониженном давлении. Остаток разбавляли EtOAc (90 мл) и Н 2 О (50 мл). Слои разделяли,и водный слой промывали солевым раствором (250 мл), сушили над MgSO4 и фильтровали, фильтрат концентрировали при пониженном давлении с получением остатка. Изомеры очищали и разделяли с применением условий проведения хроматографии К (см., ниже), отбирая второй элюируемый изомер в качестве титульного соединения (2,01 г, 13%). МС (m/z): 261 (М+18). Пример 1. N-[(1R)-1-(4-[(2S)-2-(4-Фторфенил)морфолин-4-ил]метилфенил)этил] метансульфонамид(2S)-2-(4-Фторфенил)морфолина гидрохлорид (29,5 г, 128,8 ммоль) суспендировали в ДХМ (17 л) в атмосфере азота при 22 С и добавляли триэтиламин (35,89 мл, 257,5 ммоль). Добавляли N-[(1R)-1-(4 формилфенил)этил]метансульфонамид (29,26 г, 128,8 ммоль) и полученный раствор перемешивали в течение 30 мин. Добавляли уксусную кислоту (8,85 мл, 154,5 ммоль), а затем триацетоксиборогидрид натрия (86,17 г, 386,3 ммоль) 3 порциями. Перемешивали в течение 3 ч, протекание реакции до завершения отслеживали при помощи ЖХМС. Реакцию гасили путем медленного добавления насыщенного водного раствора бикарбоната натрия (259,31 мл) с получением раствора с рН 8. Слои разделяли, и водный слой экстрагировали 200 мл ДХМ. Органические слои объединяли, промывали насыщенным раствором бикарбоната натрия, водой и солевым раствором, а затем сушили над MgSO4. Фильтровали, фильтрат собирали и концентрировали с получением остатка. Остаток очищали при помощи колоночной флэшхроматографии на силикагеле, элюируя с градиентом от 100% ДХМ до ДХМ:МеОН (95:5). Фракции продукта объединяли и концентрировали с получением титульного продукта в виде желтой вязкой маслянистой жидкости (41 г, 81,13%). МС (m/z): 393 (М+1). Пример 2. N-[(1R)-1-(4-[(2S)-2-(4-Фторфенил)морфолин-4-ил]метилфенил)этил]метансульфонамида малеатN-[(1R)-1-(4-[(2S)-2-(4-Фторфенил)морфолин-4-ил]метилфенил)этил]метансульфонамид (250,47 мг) растворяли в EtOAc (10 мл). При 60 С добавляли малеиновую кислоту (85 мг), растворенную вEtOAc (2 мл). Охлаждали до температуры окружающей среды, и смесь перемешивали в течение 30 мин. Суспензию фильтровали и промывали EtOAc (5 мл). Слой фильтрата собирали и сушили при пониженном давлении с получением титульного соединения в виде твердого вещества (280 мг, 97,7%). МС (m/z): 393 (М-малеиновая кислота+1). Способ 2.N-[(1R)-1-(4-[(2S)-2-(4-Фторфенил)морфолин-4-ил]метилфенил)этил]метансульфонамид (270 г) растворяли в EtOAc (10 л). Смесь нагревали до 60 С и добавляли малеиновую кислоту (96 г, 1,1 экв.) вEtOAc (2,8 л). Смесь охлаждали до температуры окружающей среды и полученную смесь перемешивали в течение 14 ч. Суспензию фильтровали, твердое вещество промывали EtOAc (5 л), и слой фильтрата сушили при пониженном давлении. Твердое вещество растворяли в 5 объемах EtOH (1,4 л), нагревали до 90 С и добавляли воду (280 мл). Смесь грели при 90 С в течение 1 ч, а затем в течение ночи охлаждали до температуры окружающей среды. Осадок отфильтровывали и сушили в вакуумном сушильном шкафу при 40 С с получением титульного соединения в виде белого твердого вещества (256 г, 70%). МС (m/z): 393 (М-малеиновая кислота+1). Пример 3. N-[(1R)-1-(4-[(2S)-2-(4-Фторфенил)морфолин-4-ил]метилфенил)этил]метансульфонамида гидрохлоридN-[(1R)-1-(4-[(2S)-2-(4-Фторфенил)морфолин-4-ил]метилфенил)этил]метансульфонамид (50 г,127,39 ммоль) растворяли в изопропиловом спирте (200 мл). К раствору по каплям добавляли HCl (4 М раствор в диоксане; 63,70 мл, 254,78 ммоль) и перемешивали при температуре окружающей среды в течение 50 мин. Летучие вещества удаляли при пониженном давлении и добавляли Н 2 О (200 мл), а затем воду выпаривали Добавляли Н 2 О (200 мл) и изопропиловый спирт (100 мл) и концентрировали до общего объема 80 мл. Полученную вязкую суспензию фильтровали, твердое вещество промывали Н 2 О и фильтровали, слой фильтрата сушили при пониженном давлении при 55 С с получением титульного соединения в виде белого твердого вещества (40,6 г, 75%). МС (m/z): 393 (М-С 1). Пример 4. N-[(1R)-1-(4-1-[(2S)2-(4-Фторфенил)морфолин-4-ил]этилфенил)этил]метансульфонамида гидрохлорид, изомер 1 Изомер 1 N-[(1R)-1-(4-1-[2-(4-Фторфенил)морфолин-4-ил]этилфенил)этил]метансульфонамида гидрохлорида получали, по существу, при помощи способа из примера 3. МС (m/z) 407 (М-С 1) Объединяли соль щавелевой кислоты 2-(2-хлорфенил)морфолина (200 мг, 0,696 ммоль), триэтиламин (193 мкл, 1,39 ммоль), N-[(1S)-2,2,2-трифтор-1-(4-формилфенил)этил]метансульфонамид (205,3 мг,0,73 ммоль) и ДХМ (15 мл). Добавляли уксусную кислоту (47,8 мкл, 0,83 ммоль) и триацетоксиборогидрид натрия (465 мг, 2,09 ммоль) и перемешивали при температуре окружающей среды в течение 5 ч. рН смеси доводили до 10 при помощи насыщенного водного раствора NaHCO3. Перемешивали до прекращения выделения газа, слои разделяли, и водный слой дважды экстрагировали ДХМ. Органические экстракты объединяли, промывали солевым раствором и сушили над MgSO4. Смесь фильтровали, фильтрат собирали и концентрировали при пониженном давлении с получением остатка. Остаток очищали при помощи 10 г SCX картриджа, картридж промывали ДХМ, 50% смесью МеОН/ДХМ и 100% МеОН, а затем элюировали NH3 в МеОН (2 н. ). Фракции продукта концентрировали при пониженном давлении с получением неочищенного продукта в виде маслянистой жидкости. Маслянистую жидкость очищали при помощи хиральной ВЭЖХ с применением условий Е (см., ниже) с получением свободного основания (104 мг, 32,3%) в качестве второго элюируемого изомера. Свободное основание (104 мг, 0,224 ммоль) растворяли в 1 мл ДХМ и по каплям добавляли HCl в Et2O (2 М, 561,6 мкл, 1,12 ммоль). Перемешивали при температуре окружающей среды в течение 5 мин, а затем растворители удаляли при пониженном давлении с получением титульного соединения (99 мг, 88,2%). МС (m/z): 463 (М-С 1). Следующие соединения получали, по существу, при помощи способа из примера 5. Все следующие примеры в табл. 1 выделяли в виде отдельных изомеров из хиральных исходных веществ и/или с применением хроматографических колонок и условий, указанных ниже. Можно выделять в виде свободного основания или соли. Таблица 1N-[(1R)-1-[4-[1-[(2S)2-(4-Фторфенил)морфолин-4-ил]этил]фенил]этил]метансульфо Объединяли изомер 2 N-[(lR)-l-[4-(l-гидроксиэтил)фенил]этил]метансульфонамида (420 мг, 1,73 ммоль) и ДХМ (5 мл). Смесь охлаждали до 0 С и продували аргоном. Добавляли ацетилбромид (295,8 мкл, 3,45 ммоль), и реакционную смесь перемешивали при 0 С в течение 10 мин. Добавляли дополнительное количество ацетилбромида (519,5 мкл, 6,90 ммоль) и перемешивали в течение дополнительных 10 мин. Реакционную смесь разбавляли ДХМ, и растворители выпаривали при пониженном давлении с получением остатка. Остаток растворяли в ДМФ (2 мл), добавляли (2S)-2-(4-фторфенил)морфолина гидрохлорид (71,1 мг, 0,327 ммоль) и К 2 СО 3 (135,4 мг, 0,980 ммоль) и перемешивали при температуре окружающей среды в течение ночи. Реакционную смесь фильтровали, и фильтрат очищали при помощи хроматографии на сильной катионообменной смоле, элюируя ДХМ, смесью ДХМ/МеОН (1:1), МеОН и смесью 2 М раствор NH3/MeOH. Фракции продукта объединяли, и растворители удаляли при пониженном давлении с получением остатка. Остаток очищали при помощи обращенно-фазовой ВЭЖХ (XTerra MSC18 колонка, рН 8), отбирая первый элюируемый изомер (изомер 1) в качестве титульного соединения Исследование ингибирования MOGAT-2. В данном исследовании оценивали ингибирующую активность соединений in vitro против MOGAT2 человека. MOGAT-2 участвует в переносе олеоильной группы олеоил-КоА к моноолеоилглицерину("MAG") с образованием диолеоилглицерина ("DAG") в пути повторного синтеза триглицерида в кишечнике. В исследовании применяли экстракцию при помощи Microscint E, которая позволяет селективно экстрагировать гидрофобные молекулы по сравнению с гидрофильными, для разделения 14 С-олеоил-КоА и 14C-DAG. Клетки насекомого генно-инженерной линии SF9 экспрессировали M0GAT-2 человека. Клеточный лизат готовили в 20 мМ растворе NaCl с ингибитором протеазы (Roche Cat 11873580001). Клетки SF9,экспрессирующие MOGAT-2 человека, гомогенизировали при 15000 об/мин в течение 202 с (РТ-3100Polytrone). Гомогенат центрифугировали при 1000 g при 4 С в течение 10 мин. Надосадочную жидкость собирали в отдельную пробирку для количественного анализа и исследования активности белков. Субстрат моноолеата глицерина очищали при помощи хроматографии (Spectrum Chemical, CAS25496-72-4). Субстрат моноацилглицерина (MAG) готовили в виде фосфолипидных везикул (диолеоилфосфатидилхолин "ДОФХ"). Везикулы MAG/ДОФХ готовили при общей концентрации липидов (MAG и ДОФХ) 20 мМ. Готовили различные мольные отношения MAG к общему содержанию липидов для исследования соединения (8,9%) и проведения кинетических исследований (2,6-40%). Соответствующее количество очищенного MAG смешивали с ДОФХ (Avanti Polar Lipids850375 С) в хлороформе в стеклянной пробирке. Хлороформ удаляли в токе N2, а затем смесь сушили при пониженном давлении в течение 30 мин. К высушенной смеси MAG/ДОФХ добавляли соответствующее количество буфера (Tris-Cl pH 7,4, 250 мМ сахарозы, 1 мМ ЭДТА) для достижения целевой общей концентрации липидов. Раствор MAG/ДОФХ обрабатывали ультразвуком до прояснения раствора. Размер везикул измеряли при помощи динамического рассеяния света для подтверждения однородности. Буфер для исследования состоял из 100 мМ Tris, pH 7,5 (Invitrogen 15567-022), 11% ДМСО, 250 мМ сахарозы (Sigma S-0389), 1 мМ ЭДТА и полной смеси ингибиторов протеаз (Roche Diagnostic 12454800). К буферу совместно с субстратами и ферментами добавляли исследуемые соединения. Конечная концентрация для реакции составляла 0,016 мг/мл экстракта клеток SF9, 20 мкМ олеоил-КоА (3,5 мкМ 14 Солеоил-КоА), 1,26 мМ липидов в виде обработанных ультразвуком везикул, состоящих из 8,9:91,1 (мольное отношение) MAG: ДОФХ. Реакцию гасили через 90 мин инкубации при комнатной температуре путем добавления AESSM (12,5% 100% денатурированного EtOH; 11% ДИ Н 2 О; 2.5% 1,0 н. раствора NaOH; 59% изопропанола (Mallinckrodt 3031-08); 15 об.% гептана (Omni Solv HX0078). Добавляли Microscint E,а затем герметизировали планшеты и после по меньшей мере 4 ч выдерживания при комнатной температуре проводили подсчет при помощи сцинцилляционного счетчика IC50 (концентрацию полу максимального ингибирования) рассчитывали с применением программного обеспечения Excel Fit (версии 4; данные анализировали с применением нелинейного логистического уравнения с 4 параметрами (ABaseEquation 205 путем построения графика зависимости концентрации от относительной активностиMOGAT-2. Все соединения, представленные в настоящей заявке, имеют IC50 меньше 100 нМ, а соединение из примера 2 продемонстрировало IC50 12 нМ в описанном исследовании MOGAT-2 in vitro. Ингибирующая активность в клеточном исследовании MOGAT-2. В данном исследовании оценивали ингибирующую активность соединений против MOGAT-2 человека в клетке. Сасо-2 представляет собой линию клеток рака толстой кишки человека и часто применяется в качестве модели эпителиальных клеток кишечника. Сасо-2 не экспрессирует MOGAT-2, и поэтомуMOGAT-2 человека вводили в клеточную линию путем устойчивой трансфекции. Для определения клеточной активности MOGAT-2 применяли аналог MAG, 2-О-гексадецилглицерин (HDG), поскольку HDG не гидролизуется и полученный продукт легко исследовать при помощи масс-спектрометрии. Субстрат доставляли в клетки с применением смеси с ДОФХ в виде обработанных ультразвуком везикул. Клетки Сасо-2 высеивали в 100 мм планшетах в количестве, достаточном для достижения 80% конфлюэнтности после выдерживания в течение 24 ч в полной среде (3/1 DMEM: F12+10% ФБС+20 мМ ГЭПЭС+гентамицин). Клетки трансфицировали плазмидом hMOGAT-2 (MOGAT-2-pCDNA3.1-Hygro) с применением Липофектамина 2000 (Invitrogen). После 6 ч взаимодействия с трансфекционной смесью клетки три раза промывали ФБС, а затем добавляли среду. Клетки дополнительно инкубировали в течение 18 ч, трипсинизировали и серийно разбавляли в 100 мм планшетах. Добавляли полную среду+400 мкг/мл гигромицина и инкубировали до образования клонов. Клоны выделяли и переносили в 24 луночные планшеты и выращивали до слияния. РНК готовили из указанных клонов с применением набора Qiagen RNAeasy. Исследование Taqman проводили с применением набора реагентов ABI(HS00228262) на Sequence Detection System 7900 (ABI). Лизаты на основе указанных клонов исследовали при помощи метода вестерн-блоттинга с применением козьего поликлонального антитела (Santa Cruz.SC-32392) для подтверждения экспрессии MOGAT-2 человека белком с молекулярной массой 38 кДа,соответствующего MOGAT-2. 2-О-Гексадецилглицерин ("HDG", Biosynth ChemistryBiology,Н-1806, 562,7 мкл с концентра- 12024182 цией 20 мг/мл) и ДОФХ (14,3 мл с концентрацией 20 мг/мл) смешивали в хлороформе в стеклянной пробирке и сушили сперва с N2, а затем при пониженном давлении в течение дополнительных 30 мин. К высушенной смеси HDG/ДОФХ добавляли 20 мл буфера (150 мМ Tris-Cl рН 7,4, 250 мМ сахарозы, 1 мМ ЭДТА) и обрабатывали ультразвуком до прояснения раствора. Клетки Сасо-2 при 37 С высеивали в 96 луночный планшет, покрытый поли-D-лизином ("клеточный планшет"), и выдерживали при 5% СО 2 в течение ночи. Питательную среду удаляли и клетки в течение 30 мин предварительно обрабатывали исследуемым соединением в DMEM:F12 (3:1) среде (GIBCO 93-0152DK), содержащей 2% БСА (Sigma). Клетки в течение 4 ч обрабатывали одним исследуемым соединением в 2% БСА DMEM:F12 (3:1) среде,содержащей 40 мкМ олеиновой кислоты и 800 мкМ 8,9:91,9 (мольное отношение) HDG/ДОФХ. Клетки трипсинизировали 50 мкл раствора трипсина и добавляли 50 мкл ФБС. Клетки немедленно замораживали при помощи сухого льда и хранили при -20 С до проведения ЖХ-МС. Клетки экстрагировали смесью хлороформ/метанол следующим образом: клетки переносили в 2 мл планшет, клеточный планшет промывали 200 мкл метанола, а затем метанольный смыв переносили в 2 мл планшет, клеточный планшет промывали 200 мкл ФБС, и ФБС смыв переносили в 2 мл планшет. В 2 мл планшет добавляли хлороформ (400 мкл) с внутренним стандартом (19,52 нг/мл) DAG (15:0,15:0 (Sigma, D5-TAG (39,03 нг/мл)CDN (16,16,16). Герметизированный 2 мл планшет переворачивали (10), а затем перемешивали на вортексе. Из 2 мл планшета удаляли 400 мкл нижнего слоя и переносили в лунки другого планшета, "конечного планшета". В 2 мл планшет добавляли CHCl3:МеОН (400 мкл 2:1). Герметизированный 2 мл планшет повторно переворачивали (10), а затем перемешивали на вортексе. Из 2 мл планшета удаляли 220 мкл нижнего слоя и переносили в конечный планшет. Конечный планшет сушили и содержимое повторно растворяли в 500 мл IPA. Конечный планшет герметизировали и встряхивали в течение 5 мин. 10 мкл образца из конечного планшета вводили в колонку Halo C8 (2,150, 2,7 мкл размер частиц) при 60 С при помощи петлевого автодозатора с объемом петли 10 мкл, подключенного к системе доставки растворителя Shimadzu. Отслеживали каналы для сбора данных для D5 С 16 внутреннего стандарта TAG, а также простого эфира TAG, и С 52 и С 54 природных TAG. Растворитель А представлял собой смесь 80/20 Н 2 О/метанол с 20 мкМ ацетата аммония. Растворитель В представлял собой смесь 50/50 IPA/ТГФ с 20 мкМ ацетата аммония. Скорость потока равнялась 0,4 мл/мин. Промывочные растворители представляли собой смесь Н 2 О/МеОН и ДХМ. При помощи программного обеспечения Xcalibur извлекали площади интересующих пиков и экспортировали данные в Excel, в котором применяли следующую формулу:(площадь для простого эфира TAG/площадь для С 54 природного TAG)/ площадь для ВС. Указанное отношение позволяет эффективно рассчитывать флуктуации количества клеток в каждой лунке. Результаты указанного исследования MOGAT-2 на основе клеток приведены ниже в табл. 3. Результаты исследования MOGAT-2 на основе клеток показывают, что примеры, перечисленные в табл. 6, ингибируют Фармакологическое действие в модели введения масляного болюса собакам. Ингибирование MOGAT-2 в тонкой кишке может подходить для лечения гипертриглицеридемии,вызванной избыточным потреблением жира. Для оценки способности соединений, приведенных в примерах, ингибировать всасывание TAG для каждого исследования отбирали 21 самца гончей (n=7 на группу лечения), причем каждая из выбранных собак имела массу тела 9-13 кг. Собак содержали в клетках при стандартном световом режиме (12 ч света и 12 ч темноты) при комнатной температуре, 728F, и при относительно влажности 30-70%. Собак прекращали кормить за 16 ч до начала исследования, а затем голодным собакам с носителем (1% ГЭЦ, 0,25% Tween 80, противовспениватель) вводили одно или более исследуемые соединения. Через один час после дозирования у собак отбирали образец крови (0,5 мл из яремной вены) для 0 времени. Сразу после отбора образца 0 времени собакам вводили оливковое масло (Sigma Catalog: О-1514, 5 мл/кг). Образцы отбирали в пробирку с ЭДТА во льду через 1,5, 2, 3, 5, 7 и 9 ч после введения смеси соединение/носитель. Образцы центрифугировали при 9000 ц/мин в течение 15 мин и анализировали (Roche Cat no. 1877771) на общее плазменное содержание триглицерида с применением Roche Hitachi 917. Для измерения TAG18.118.118.1 образцы экстрагировали и проводили ЖХ/МС/МС аналогично процедуре, описанной выше в клеточном исследовании MOGAT-2, с применением 10 мкл плазмы. Аналит представлял собой [M+NH4]+ ион TAG 18:1 18:1 18:1 с массой 902,8 m/z; внутренний стандарт представлял собой D5 TAG 16:0 16:0 16:0 с массой 829,8 m/z. Отмечали изменение отношения 603.5m/z дочернего иона для 902,8 m/z (TAG 18:1 18:1 18:1) и 556,5 m/z дочернего иона для 829,8 m/z (D5TAG 16:0 16:0 16:0 внутренний стандарт) в относительных количествах TAG 18:1 18:1 18:1. Рассчитывали фактическую AUC уровня TAG в плазме, вычитая из общей AUC TAG AUC TAG на исходном уровне, с применением Graphpad Prism4: (фактическая AUCTAG=AUCTAG после введения масляного болюса AUCTAG в 0 ч). Процент ингибирования триглицерида в плазме рассчитывали следующим образом: (средняя фактическая AUC TAG для группы, получающей масляный болюс, - средняя фактическая AUC TAG для группы, получающей масляный болюс и лечение с применением соединения, средняя фактическаяAUC TAG для группы, получающей масляный болюс) 100. В конечном статистическом анализе применяли метод Даннета однофакторного дисперсионного анализа для сравнения с контролем. Все значения фактической AUC TAG преобразовывали в упорядоченные усредненные значения AUC для сравнения с пределом изменчивости для серии исследований. В соответствии с указанным исследованием может быть дополнительно оценена способность соединений согласно настоящему изобретению, представленных в примерах, ингибировать активность MOGAT-2 и снижать всасывание TAG in vivo. Пример 2 оценивали по данной модели в трех исследованиях при дозе 30 мг/кг и двух исследованиях при дозе 75 мг/кг. Результаты указанных исследований показали статистически значимое (р 0,05) снижение содержания триглицеридов после приема пищи. Результаты имели следующий вид: 43% ингибирование всасывания TAG (45% для 18,1 TAG) при ПО дозе 30 мг/кг и 64% ингибирование всасыванияTAG (63% для 18.1 TAG) при ПО дозе 75 мг/кг. Соединения согласно настоящему изобретению, представленные в примерах, могут быть легко получены в виде фармацевтических композиций в соответствии с принятыми способами, такими как приведенные в Remington's Pharmaceutical Sciences, Gennaro, Ed., Mack Publishing Co. Easton Pa. 1990. Лечащий врач или другой медицинский работник способен определить эффективное количество соединения для лечения пациента, нуждающегося в лечении, в частности для лечения гипертриглицеридемии. Предпочтительные фармацевтические композиции могут быть получены в форме таблетки или капсулы для перорального введения. Таблетка или капсула может содержать соединение согласно настоящему изобретению в количестве, эффективном для лечения пациента, нуждающегося в лечении. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулыR6 выбран из Н и галогена; при условии, что по меньшей мере один из R4, R5 и R6 представляет собой Н; или его фармацевтически приемлемая соль. 2. Соединение по п.1, отличающееся тем, что R1 представляет собой -СН 3. 3. Соединение по п.1, отличающееся тем, что R1 представляет собой -CF3. 4. Соединение по любому из пп.1-3, отличающееся тем, что R2 представляет собой Н. 5. Соединение по любому из пп.1-4, отличающееся тем, что R3 представляет собой Н. 6. Соединение по любому из пп.1-5, отличающееся тем, что R4 выбран из Н и галогена. 7. Соединение по любому из пп.1-6, отличающееся тем, что R5 выбран из Н, -CF3, F и Cl. 8. Соединение по любому из пп.1-6, отличающееся тем, что R5 представляет собой Н. 9. Соединение по любому из пп.1-8, отличающееся тем, что R6 представляет собой F. 10. Соединение формулы или его фармацевтически приемлемая соль. 11. Соединение по любому из пп.1-10, отличающееся тем, что фармацевтически приемлемая соль выбрана из хлоридной соли и малеатной соли. 12. Соединение по п.11, отличающееся тем, что фармацевтически приемлемая соль представляет собой малеатную соль. 13. Соединение, представляющее собой N-[(1R)-1-(4-[(2S)-2-(4-фторфенил)морфолин-4- 14024182 ил]метилфенил)этил]метансульфонамида гидрохлорид. 14. Соединение, представляющее собой N-[(1R)-1-(4-[(2S)-2-(4-фторфенил)морфолин-4 ил]метилфенил)этил]метансульфонамида малеиновую кислоту. 15. Фармацевтическая композиция для лечения гипертриглицеридемии, содержащая соединение по любому из пп.1-14 и по меньшей мере один из фармацевтически приемлемых носителя, разбавителя или наполнителя.
МПК / Метки
МПК: C07D 265/30, C07D 295/03, C07D 295/04, A61K 31/5375, A61P 3/00
Метки: подходящие, морфолинила, качестве, производные, mogat-2, новые, ингибиторов, применения
Код ссылки
<a href="https://eas.patents.su/16-24182-novye-proizvodnye-morfolinila-podhodyashhie-dlya-primeneniya-v-kachestve-ingibitorov-mogat-2.html" rel="bookmark" title="База патентов Евразийского Союза">Новые производные морфолинила, подходящие для применения в качестве ингибиторов mogat-2</a>
Предыдущий патент: Экстракция молочной кислоты
Следующий патент: Устройство для затягивания или ослабления резьбовых креплений
Случайный патент: Барабанная стиральная машина с торцевой загрузкой белья












