Карбоксиэтилированные полисульфаты циклодекстрина, подходящие для применения в качестве лекарственных средств
Формула / Реферат
1. Соединение β-циклодекстрин полисульфата, представленное структурной формулой
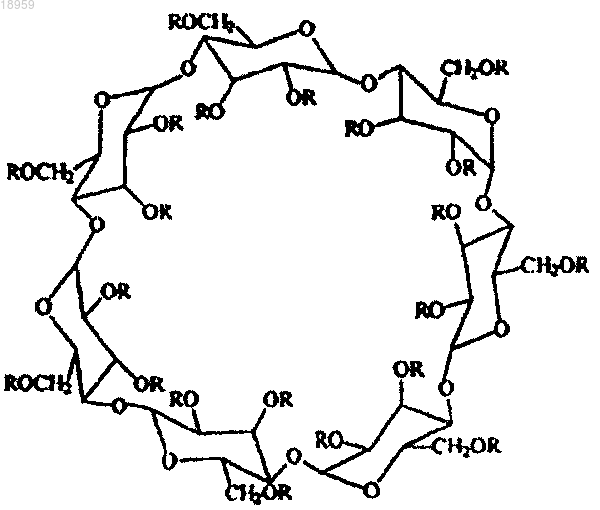
где каждый R независимо от другого представляет собой -CH2-CH2-СООН, или -SO3H, или Н при условии, что от одного до трех R представляют собой -CH2-CH2-СООН и по меньшей мере два R в глюкопиранозном звене представляют собой -SO3H,
и фармацевтически приемлемые соли и/или сольваты указанного соединения.
2. Соединение β-циклодекстрин полисульфата по п.1, отличающееся тем, что все замещающие группы R представляют собой три группы -CH2-CH2-СООН, семнадцать групп -SO3H и один атом водорода.
3. Соединение β-циклодекстрин полисульфата по п.1, отличающееся тем, что все замещающие группы R представляют собой три группы -CH2-CH2-СООН и восемнадцать групп -SO3H.
4. Соединение β-циклодекстрин полисульфата по любому из пп.1-3, в котором в среднем от 2,00 до 2,57 групп R в глюкопиранозном звене представляют собой -SO3H.
5. Соединение β-циклодекстрин полисульфата по любому из пп.1-4, в котором в среднем от 2,2 до 3,0 групп R представляют собой -CH2-CH2-СООН.
6. Способ получения соединения β-циклодекстрин полисульфата по любому из пп.1-5, отличающийся тем, что соединение β-циклодекстрина, представленное структурной формулой
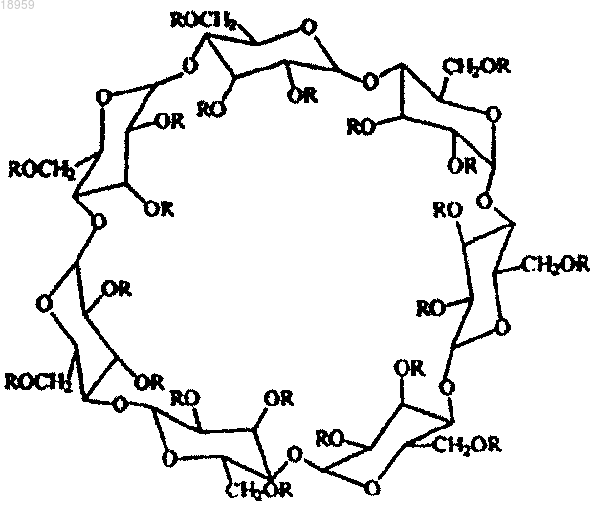
где каждый R независимо от остальных представляет собой -CH2-CH2-СООН или Н при условии, что от одного до трех R представляют собой -CH2-CH2-СООН,
реагирует с сульфирующим агентом, при этом количество указанного сульфирующего агента таково, что в результате данной реакции по меньшей мере два атома Н в глюкопиранозном звене превращаются в группы -SO3H.
7. Способ по п.6, отличающийся тем, что указанную реакцию проводят при температуре в диапазоне от 40 до 100°С.
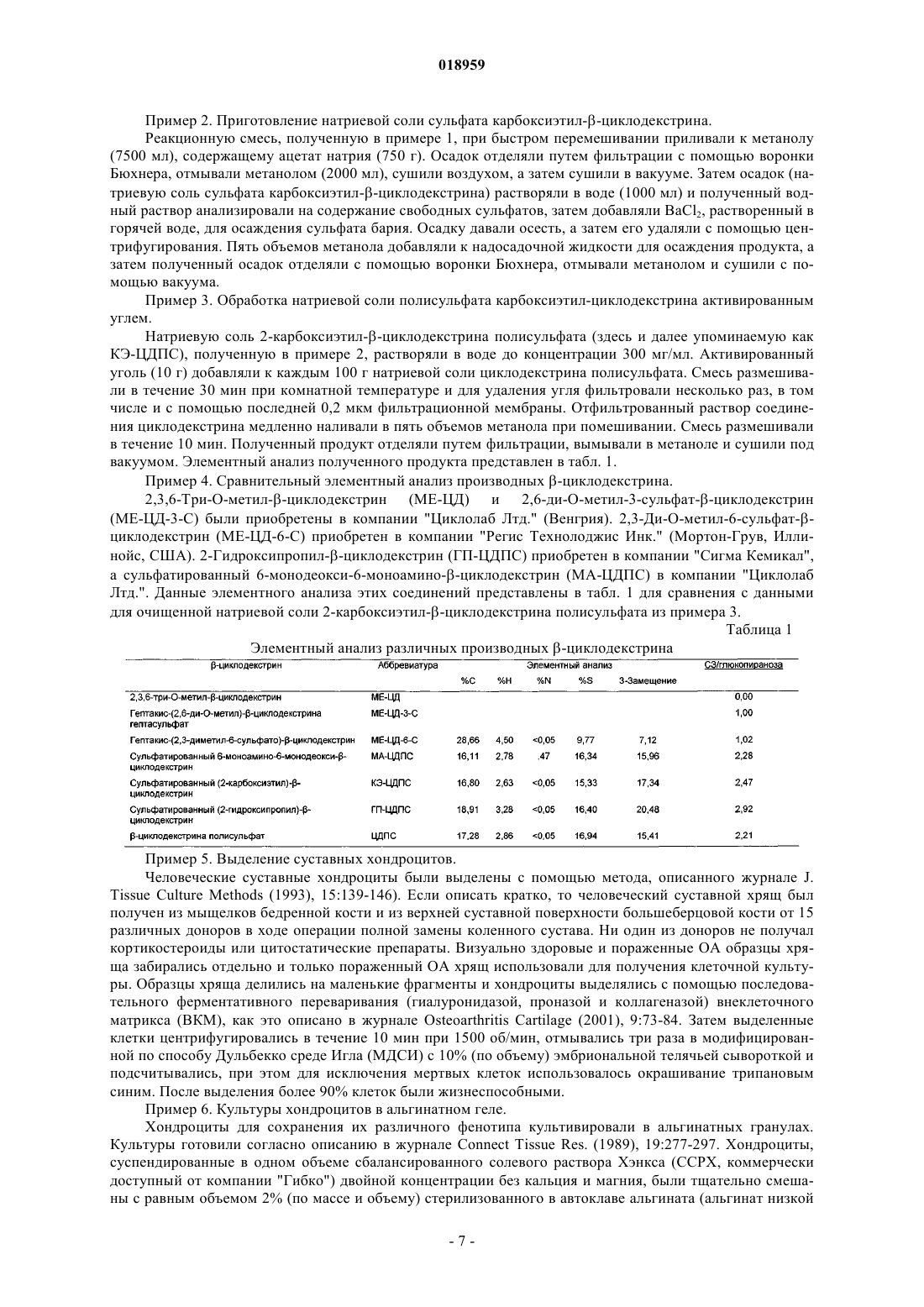
8. Способ по п.6 или 7, отличающийся тем, что указанное соединение β-циклодекстрина, представленное структурной формулой
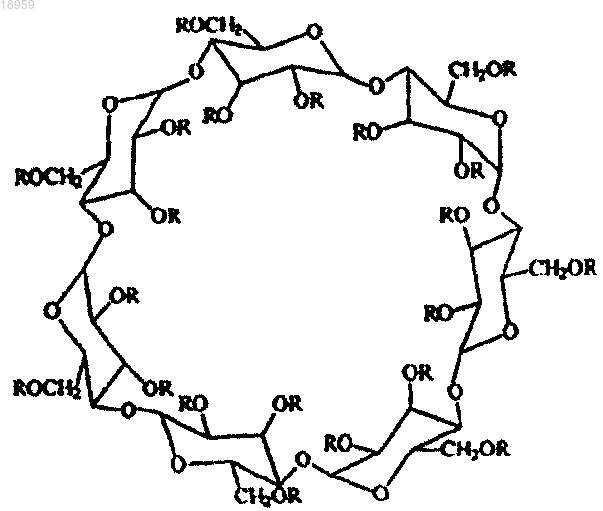
где каждый R независимо от остальных представляет собой -CH2-CH2-СООН или Н при условии, что от одного до трех R представляют собой -CH2-CH2-СООН,
получают путем реакции β-циклодекстрина с акриламидом в таком количестве, что в результате указанной реакции от одной до трех гидроксильных групп β-циклодекстрина превращаются в группы -CH2-CH2-СООН.
9. Способ по п.8, отличающийся тем, что указанную реакцию проводят при температуре в диапазоне от 40 до 95°С.
10. Способ по п.8 или 9, отличающийся тем, что молярное отношение акриламида к β-циклодекстрину находится в диапазоне от 1 до 100.
11. Фармацевтическая композиция для лечения и/или профилактики дегенеративных заболеваний суставов, остеоартрита, суставного ревматизма, артроза или дегенеративного артрита, или лечения гепарин-индуцированной тромбоцитопении, или восстановления хряща или соединительной ткани, содержащая по меньшей мере одно соединение β-циклодекстрина полисульфата по любому из пп.1-5 в комбинации с одним или более нетоксичными фармацевтически приемлемыми вспомогательными веществами.
12. Применение соединения β-циклодекстрин полисульфата по любому из пп.1-5 для лечения и/или профилактики дегенеративных заболеваний суставов, остеоартрита, суставного ревматизма, артроза или дегенеративного артрита, или для лечения гепарин-индуцированной тромбоцитопении, или для восстановления хряща, или для восстановления соединительной ткани.
Текст
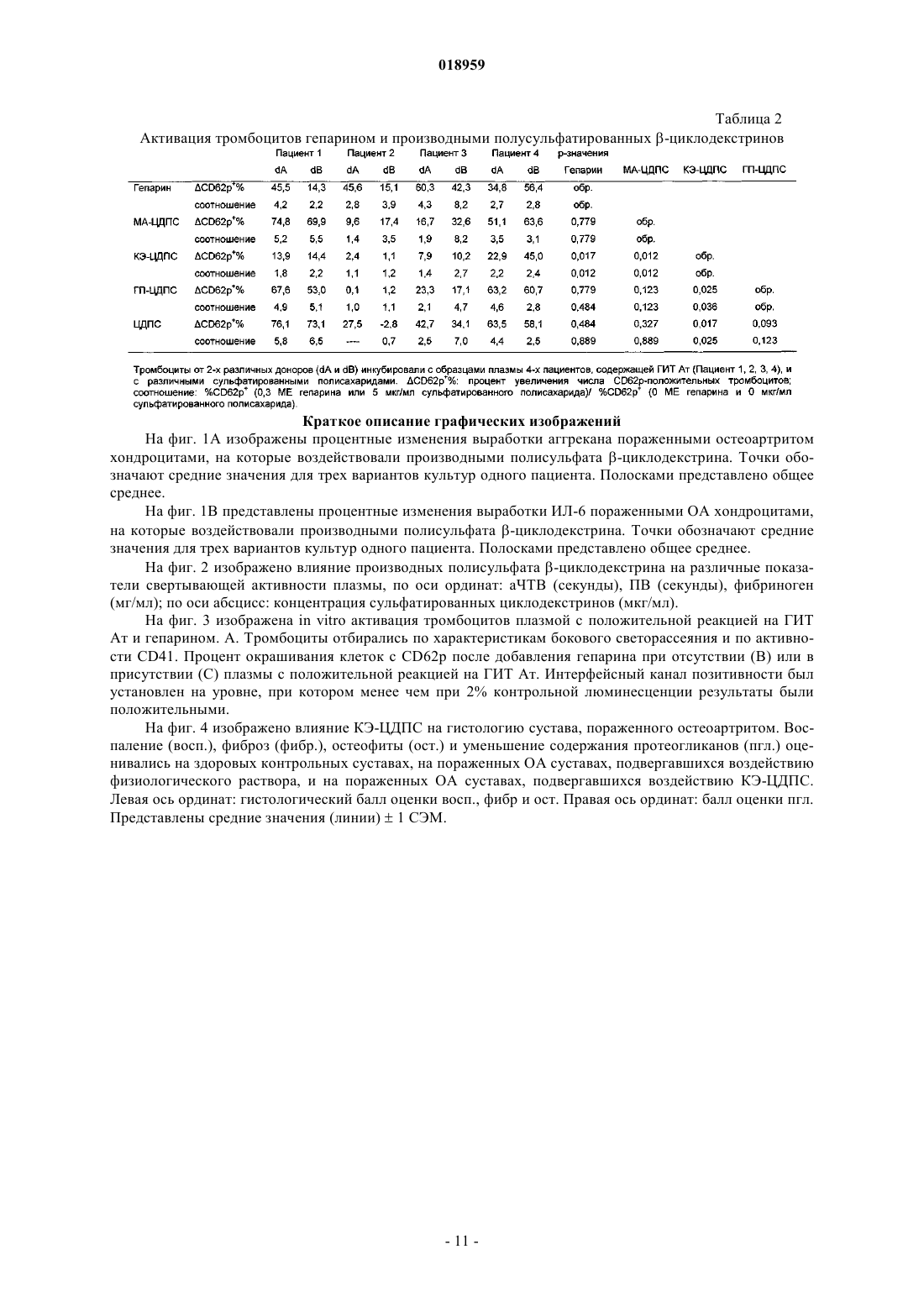
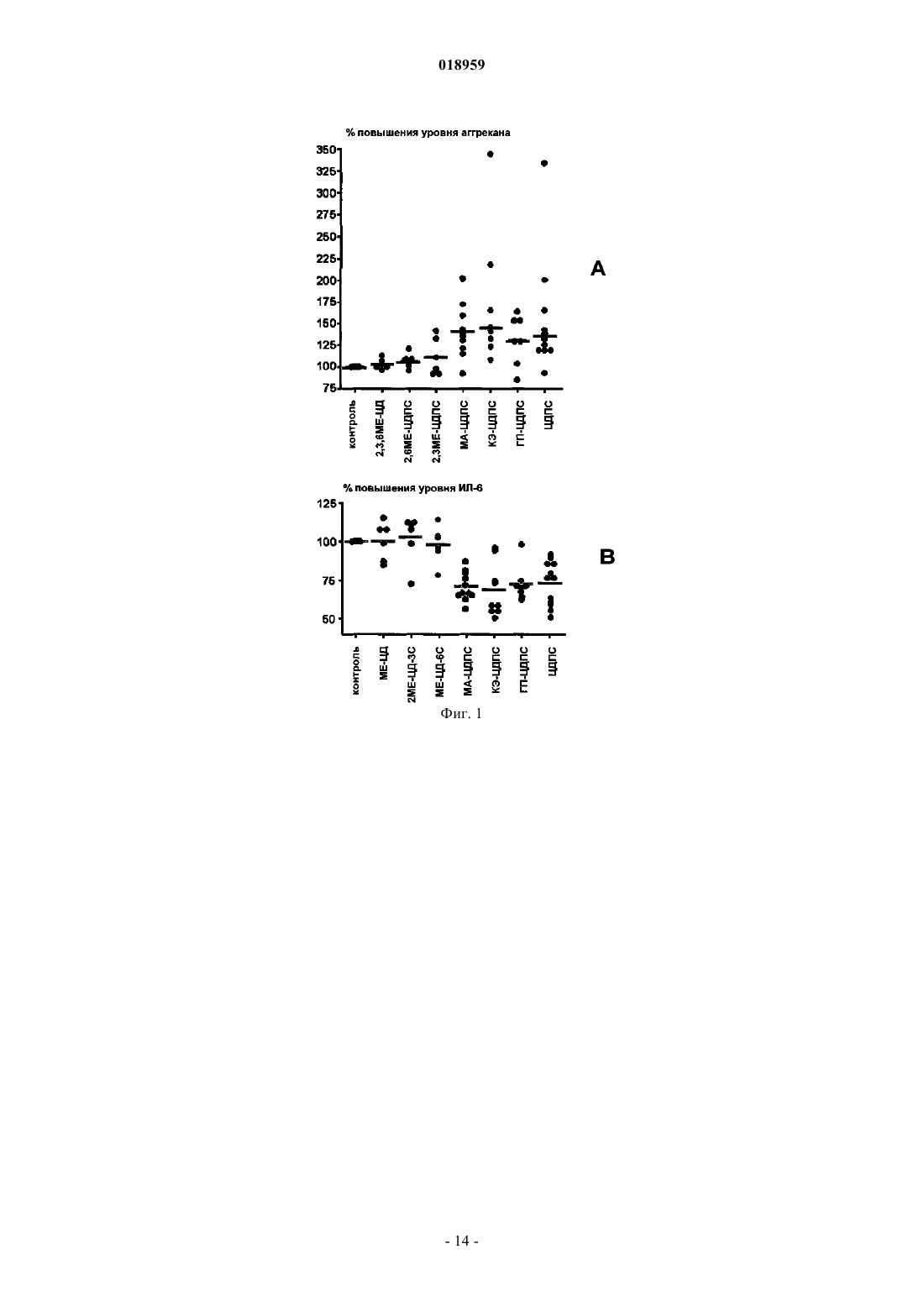
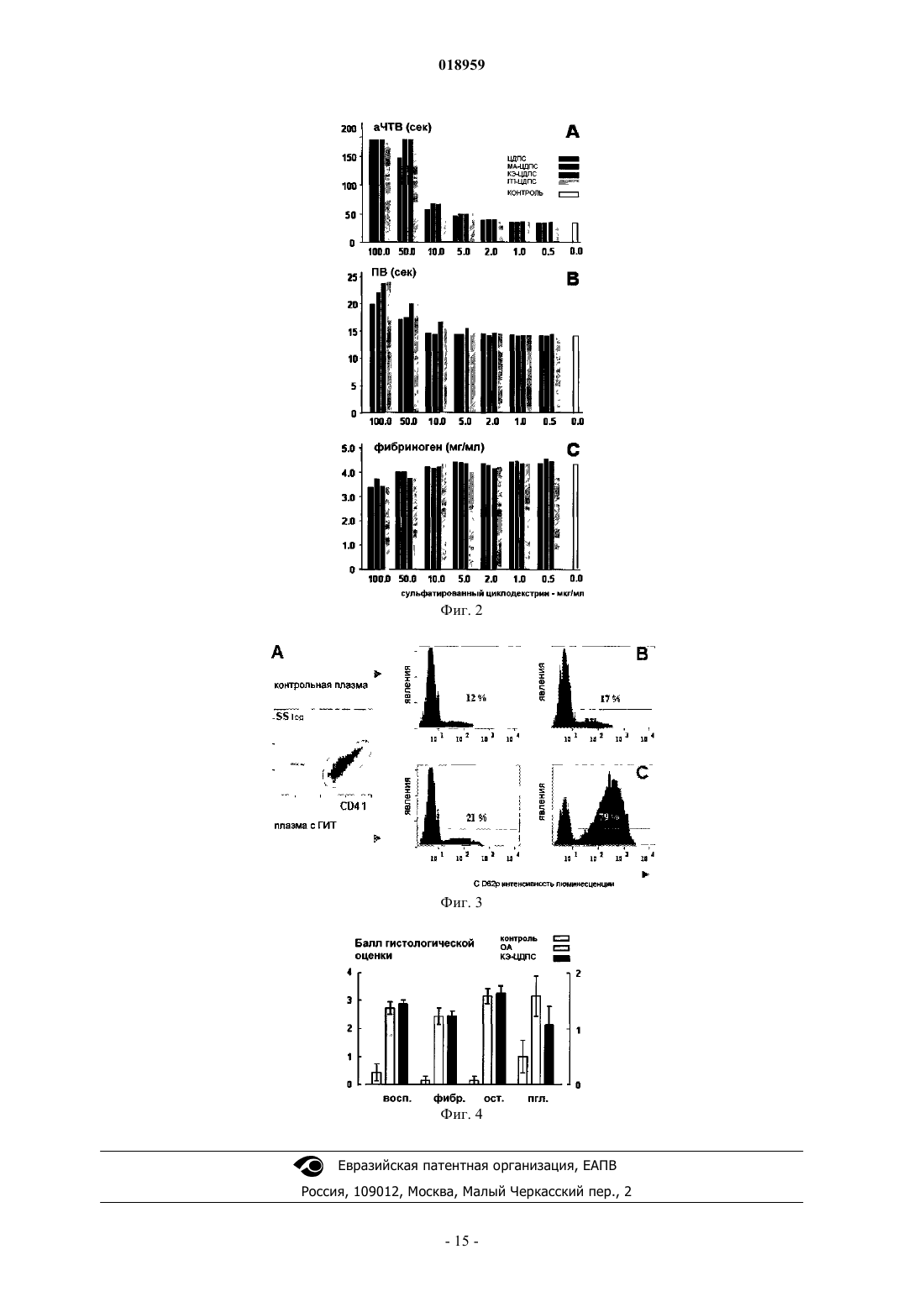
Изобретение относится к новым соединениям -циклодекстрина полисульфата, содержащим в глюкопиранозном звене от одного до трех 2-карбоксиэтильных заместителей и по меньшей мере две сульфатные группы; при этом данные соединения применимы в качестве активных ингредиентов для лечения и/или профилактики дегенеративных заболеваний суставов, остеоартрита, суставного ревматизма, артроза или дегенеративного артрита или для лечения гепарин-индуцированной тромбоцитопении либо для восстановления хряща или для восстановления соединительной ткани. Элеваут Дирк, Вербругген Август Людовик (BE) Нилова М.И. (RU) Область техники, к которой относится изобретение Настоящее изобретение относится к карбоксиалкилированным полисульфатам -циклодекстрина и их солям, способу их получения, фармацевтической композиции, содержащей терапевтически эффективное количество указанных соединений, и к применению подобных соединений карбоксиалкилированного -циклодекстрина в качестве активных ингредиентов, отдельно или в комбинации с другими терапевтическими средствами, в способе лечения и/или профилактики дегенеративных заболеваний суставов,особенно остеоартрита, или для лечения гепарин-индуцированной тромбоцитопении, а также для восстановления хрящевой или соединительной ткани. Уровень техники Циклодекстрины образуют семейство циклических олиго- и полисахаридов, содержащих 5 или более D-глюкопиранозидных звеньев, связанных посредством 1-4 гликозидных связей. Наиболее типичные циклодекстрины содержат от 6 до 8 глюкопиранозидных звеньев, соединенных в кольцо и образующих по форме усеченный конус. В данном семействе -циклодекстрин содержит 7 глюкопиранозидных звеньев в кольце. Классические процедуры сульфатирования приводят к сульфатированию одной, двух или трех гидроксильных групп глюкопиранозидных звеньев. Из уровня техники известны некоторые варианты медицинского применения полисульфатированных циклодекстринов. Например, в патенте США 6930098 представлены сведения о лечении людей, страдающих артрозом, путем введения композиции,состоящей в основном из полисульфатированного циклодекстрина или его аддитивных солей, в комбинации с одним или более нетоксичными фармацевтически приемлемыми наполнителями; предпочтительная дозировка для подобного лечения составляет от 50 до 1500 мг/день. Согласно данным журналаOsteoarthritis and Cartilage (2008), 16:986-993 -циклодекстрина полисульфат (ЦДПС), введенный подкожно на модели кроликов с экспериментально вызванным остеоартритом (ОА), уменьшал поражение хряща и образование остеоцитов в пораженных суставах. Эти данные говорят о том, что ЦДПС положительно влияет на тканевые патологические процессы, лежащие в основе ОА, и поэтому данное вещество может быть классифицировано как средство для лечения ОА, модифицирующее течение заболевания или структуру ткани. В литературе описаны все свойства ЦДПС, за исключением хондропротекторной активности. Было доказано, что полисульфатированные циклодекстрины обладают важной биологической активностью,аналогичной таковой у гепарина, что может объясняться схожестью их молекулярного строения. Кроме склонности к прочному связыванию фактора роста фибробластов, антиангиогенной активности и способности ингибировать внедрение в клетку ретровируса ВИЧ, данные полисахариды также обладают антикоагуляционными свойствами, а ЦДПС может вызывать гепарин-индуцированную тромбоцитопению. Исследования in vitro, касающиеся ЦДПС и коагуляции, продемонстрировали увеличение продолжительности времени коагуляции тромбина и уменьшение тромбообразования. Было точно определено,что подобная биологическая активность связана со структурой молекулы полисахарида и изменяется при различных модификациях структуры. Например, при введении в молекулу различных алкильных групп активированное частичное тромбопластиновое время (аЧТВ) in vitro не увеличивалось, что говорит о более низкой антикоагуляционной активности по сравнению с ЦДПС. Кроме того, способность вызывать гепарин-индуцированную тромбоцитопению (здесь и далее называемую ГИТ) и тромбоэмболические состояния путем взаимодействия с антителами к гепарину/тромбоцитарному фактору IV является предметом изучения. Эти антитела иногда могут образовываться, когда в ходе лечения гепарином активированные тромбоциты выделяют тромбоцитарный факторIV (ТФ 4). Затем гепарин образует комплекс с ПФ 4, который функционирует как антиген, стимулирующий выработку аутоантител. Эти антитела связываются с комплексом с помощью их фрагмента F(ab)', а также связываются с FcRII (IgG CD32) других тромбоцитов с помощью фрагмента Fc, тем самым вызывая активацию тромбоцитов, агрегацию и образование микрочастиц тромбоцитов. Возможно, что эти частицы, обладающие прокоагуляционной активностью, вызывают тромботические осложнения ГИТ. Было выявлено, что некоторые низкомолекулярные гепарины, а также другие сульфатированные полисахариды, например хондроитинполисульфаты, также могут связываться с ГИТ-антителами в присутствии ТФ 4 и что их реакционная способность зависит от молекулярной массы и степени сульфатирования. Антитела, обладающие способностью активировать тромбоциты после применения гепарина, вырабатываются только у части пациентов. У некоторых из данных пациентов позднее может развиться тромбоцитопения, а ещ у меньшей части из них - тромбоз. Таким образом, одной проблемой, на решение которой направлено данное изобретение, является разработка новых терапевтических средств с установленными хондропротекторными свойствами,уменьшенным влиянием на коагуляцию и сниженным риском развития гепарин-индуцированной тромбоцитопении. Другой проблемой, на решение которой направлено данное изобретение, является разработка новых терапевтических средств, подходящих для предотвращения агрегации тромбоцитов и профилактики сосудистого тромбоза у лиц, страдающих синдромом ГИТ. Следующей проблемой, на решение которой направлено данное изобретение, является разработка новых терапевтических средств, которые могут быть использованы для лечения синдрома ГИТ без стимуляции антикоагуляционной активности. Кроме того, проблемой, на решение которой направлено данное изобретение, является разработка новых терапевтических средств, которые могут быть использованы для лечения синдрома ГИТ без стимулирования активации тромбоцитов и индуцирования тромбоза при наличии реактивных антител к комплексу гепарина с тромбоцитарным фактором IV. Ещ одной проблемой, на решение которой направлено данное изобретение, является разработка новых терапевтических средств, которые могут быть использованы для лечения и/или профилактики дегенеративных заболеваний суставов, таких как остеоартрит, суставной ревматизм, артроз и дегенеративный артрит, или для восстановления хряща или соединительной ткани. Краткое описание изобретения Неожиданно было обнаружено, что производные 2-карбоксиэтилциклодекстрина полисульфата(КЭ-ЦДПС), а также его соли и аналоги (особенно карбоксиметил, карбоксипропил и аналоги карбоксибутила) не вызывают значимой активации тромбоцитов и, таким образом, обладают минимальным потенциалом к индуцированию гепарин-ассоциированных тромбоэмболических нарушений in vivo. При исследовании КЭ-ЦДПС на мышах, у которых с помощью коллагеназы вызывался остеоартрит коленных суставов, соединение предотвращало снижение уровня протеогликанов хряща в пораженных остеоартритом суставах мышей, при этом не проявляя негативных побочных эффектов, таких как гепарининдуцированная тромбоцитопения. Подробное описание изобретения Таким образом, в первую очередь настоящее изобретение связано с новыми соединениями на основе -циклодекстрина, представленными структурной формулой (I) где каждый R независимо от другого может представлять собой -CH2-CH2-СООН, или -CH2-СООН,или -CH2-CH(CH3)-СООН, или -CH2-CH(С 2 Н 5)-СООН, или -SO3H, или Н,при условии, что один из трех R представляет собой -CH2-CH2-СООН либо один из четырех R представляет собой -CH2-СООН, или -CH2-CH(CH3)-СООН, или -CH2-CH(С 2 Н 5)-СООН, а также при условии, что по меньшей мере по два R на каждое глюкопиранозное звено представлены -SO3H и соответствующими фармацевтически приемлемыми солями и/или сольватами. Особенно предпочтительны соли этих кислотных соединений, представленные солями калия, натрия и кальция. Вышеперечисленные группы могут находиться в любой из указанных выше позиций R, представленных в молекуле -циклодекстрина. Согласно одному варианту данного изобретения карбоксиметильный фрагмент -CH2-CH2-СООН может быть представлен в D-глюкопиранозном звене молекулы-циклодекстрина либо в позиции углерода 2, либо в позиции углерода 6. Согласно следующему варианту данного изобретения три из семи D-глюкопиранозных звеньев молекулы -циклодекстрина замещены карбоксиметильным фрагментом -CH2-CH2-СООН. Согласно следующему варианту данного изобретения 3 или 4 из 7 D-глюкопиранозных звеньев молекулы -циклодекстрина замещены карбоксиметильным фрагментом -CH2-COOH, или карбоксипропильным фрагментом -CH2-CH(CH3)-COOH, или карбоксибутильным фрагментом -CH2-CH(С 2 Н 5)-COOH. Согласно следующему варианту данного изобретения каждый R независимо от другого представляет собой -CH2-CH2-СООН, или -SO3H, или Н при условии, что от двух до трех R представляют собой-CH2-CH2-СООН и по меньшей мере семь, а предпочтительно по меньшей мере десять, ещ более предпочтительно по меньшей мере четырнадцать и наиболее предпочтительно по меньшей мере шестнадцатьR представлены -SO3H. Согласно следующему варианту данного изобретения каждый R независимо от другого представляет собой -CH2-CH2-СООН, или -SO3H, или Н при условии, что все R (т.е. всего 21 группа) представлены тремя группами -CH2-CH2-СООН, либо шестнадцатью группами -SO3H и двумя атомами водорода, либо семнадцатью группами -SO3H и одним атомом водорода, либо восемнадцатью группами -SO3H (в последнем случае четыре из семи D-глюкопиранозных звеньев молекулы-циклодекстрина замещены тремя группами -SO3H, а три из семи D-глюкопиранозных звеньев молеку-2 018959 лы -циклодекстрина замещены двумя группами -SO3H). Изобретение касается соединений -циклодекстрина, представленных структурной формулой (I), в их кислотной форме или в форме любых фармацевтически приемлемых солей. В кислотной форме радикалы -COO- и -SO3- представлены в форме -СООН и -SO3H соответственно. Выражение "фармацевтически приемлемая соль" относится к соединениям, представленным структурной формулой (I), в которой один или более радикалы (анионы) -СОО- и -SO3- связаны за счет ионной связи с фармацевтически приемлемым противоположно заряженным ионом, например (но не ограничиваясь только ими) с катионом металла. Предпочтительными солями, предусмотренными настоящим изобретением, являются соли, в которых катион выбран из катионов щелочных металлов, а ещ предпочтительнее, если катион представлен Na+ или K+. Также подходящим вариантом фармацевтически приемлемой соли является соль кальция. Под термином "сольват" согласно настоящему изобретению следует понимать любую форму соединений, представленных структурной формулой (I), или фармацевтически приемлемыми солями, в которых фрагменты нековалентно связаны с молекулой растворителя (предпочтительнее полярного растворителя). К таким растворителям относятся главным образом гидраты и алкоголяты, например метанолаты или этанолаты. Сольваты (преимущественно гидраты) соединений, представленные структурной формулой (I), могут быть получены путем стандартных процедур сольватации, хорошо известных тем,кто работает в данной области. С другой стороны, настоящее изобретение относится к способу получения карбоксиалкилированных соединений -циклодекстрина, представленных структурной формулой (I). Согласно одному из вариантов способ характеризуется тем, что соединение -циклодекстрина,представленное структурной формулой где каждый R независимо от остальных представляет собой или -CH2-CH2-СООН, или -CH2-СООН,или -CH2-CH(CH3)-СООН, или -CH2-CH(С 2 Н 5)-СООН, или Н при условии, что от одного до трех R представляют собой -CH2-CH2-СООН или от одного до четырех R представляют собой или -CH2-СООН, или-CH2-CH(CH3)-СООН, или -CH2-CH(С 2 Н 5)-СООН,реагирует с сульфонирующим веществом, где количество сульфонирующего вещества таково, что при соответствующей реакции оно обеспечивает преобразование по меньшей мере двух атомов Н в глюкопиранозном звене группы -SO3H. При вышеупомянутом варианте реализации изобретения исходное сырье является коммерчески доступным или может производиться с помощью методик, хорошо известных специалистам в данной области. Коммерчески доступен карбоксиметилированный -циклодекстрин компании "Циклолаб Лтд."(Венгрия) со степенью замещения 3,5. Карбоксиметилированный -циклодекстрин со степенью замещения 3,6 описан Jin и Li в журнале J. Chromatogr. В (1998), 708:265. Компетентные лица понимают, что показатель степени замещения, который не является целым числом, представляет собой среднее значение, которое отражает состав смеси молекул. Например, карбоксиметилированный -циклодекстрин со степенью замещения 3,5 может представлять собой 50/50 смесь карбоксиметилированного-циклодекстрина с 4-мя карбоксиметильными заместителями. Коммерчески доступен карбоксиэтилированный -циклодекстрин компании "Циклолаб Лтд."(Венгрия) со степенью замещения 3. Карбоксиэтилированные -циклодекстрины с различными степенями замещения могут быть произведены путем взаимодействия -циклодекстрина с акриламидом по реакции присоединения Михаэля, например, согласно процедуре (но не ограничиваясь только ею), описанной на стр. 513-516 Доклада 9-го Международного симпозиума, посвященного циклодекстринам (1998). Карбоксиэтилированные -циклодекстрины со степенью замещения от 2,2 до 3,0 (т.е. те, в которых в среднем от 2,2 до 3,0 R-групп в структурной формуле представлены -CH2-CH2-СООН) также могут быть получены с помощью обычной оптимизации вышеупомянутых реакций присоединения Михаэля. Аналогичным образом, карбоксипропилированные (R=-CH2-CH(CH3)-СООН) и карбоксибутилированные (R=-CH2-CH(С 2 Н 5)-СООН) -циклодекстрины с различными степенями замещения могут производиться путем реакции -циклодекстрина с метакриламидом или этакриламидом соответственно в условиях реакции присоединения Михаэля. Количество используемого акриламида, метакриламида или этакриламида может быть в молярном избытке (например, молярное соотношение в диапазоне от 1 до 100) по отношению к количеству-циклодекстрина. Реакцию можно проводить в состоянии охлаждения или нагревания, например, при температуре в диапазоне от 40 до 95 С, а также возможно е проведение в присутствии соответствующего растворителя. Реакция карбоксиэтилциклодекстрина с сульфонирующими агентами может быть проведена в подходящем растворителе. В качестве сульфонирующего агента может быть использовано подходящее соединение, например комплексы трхокиси серы, такие как комплекс сульфотриоксид-пиридин-, комплекс сульфотриоксид-триалкиламин, комплекс сульфотриоксид-диоксан, комплекс сульфотриоксиддиметилформамид и т.п., а также безводная серная кислота, концентрированная серная кислота, хлорсульфоновая кислота и другие соединения. Количество использующегося сульфонирующего средства может превышать количество карбоксиалкилированного -циклодекстрина, например карбоксиэтилциклодекстрина. К примеру, если в качестве сульфонирующего средства используется комплекс пиридин-сульфотриоксида или комплекс триалкиламин-сульфотриоксида, то желательно, чтобы их количество составляло от 1 до 10 мол.экв. (а предпочтительнее от 2 до 5 мол.экв.) по отношению к количеству карбоксиалкилированного-циклодекстрина, например карбоксиэтилциклодекстрина. В качестве растворителя для реакции сульфонилирования предпочтительно использовать третичный амин, например пиридин, пиколин, лутидин, N,N-диметилформамид, формамид, гексаметиленфосфорилтриамид, хлороформ, бензол, толуол, ксилол, воду, спирты или смесь этих растворителей в любых подходящих пропорциях, жидкий диоксид серы и другие вещества. Реакцию сульфонилирования можно проводить как при охлаждении, так и при нагревании, но предпочтительнее проводить е при нагревании, желательно при температуре в диапазоне от 40 до 100 С. Если говорить более точно, то в зависимости от условий проведения реакции сульфонилирования(таких как температура, время реакции и т.д., но не ограничиваясь ими), соединения полисульфатов карбоксиалкилированных -циклодекстринов, представленные структурной формулой (I), могут быть получены в виде смеси соединений, в которой, например, будут представлены соединения или с шестнадцатью группами SO3H, или с семнадцатью группами SO3H, или с восемнадцатью группами SO3H. После завершения реакции сульфонилирования продукт реакции, которым является соединение-циклодекстрина, представленное структурной формулой (I) в кислотной форме, может быть выделен и очищен либо он может использоваться в неизменном виде для дальнейшего перевода его в фармацевтически приемлемую соль. Например, неочищенный продукт, полученный в результате реакции сульфонилирования, может быть подвергнут воздействию соединения щелочного металла, такого как соль натрия. Если необходимо достигнуть фармацевтической категории с высокой степенью очистки, то затем продукт можно подвергнуть дальнейшей очистке с помощью вымывания в метаноле и/или обработки активированным углем. При другом варианте использования данного изобретения было обнаружено, что соединения полисульфатов карбоксиалкилированных -циклодекстринов, включая их фармацевтически приемлемые соли и/или сольваты (например, таковые, представленные структурной формулой (I), включая отдельные варианты, описанные выше), особенно соединения в среднем с тремя 2-карбоксиэтильными цепями (т.е. те,в которых три R представлены -CH2-CH2-СООН), значительно в меньшей степени активируют тромбоциты по сравнению с гепарином и другими полисульфатированными производными -циклодекстрина,это было продемонстрировано на in vitro модели ГИТ и говорит о том, что соединения, описываемые в данном изобретении, а особенно КЭ-ЦДПС, не проявляют перекрестной активности с реактивными антителами к комплексу гепарина с тромбоцитарным фактором IV. Таким образом, с другой стороны, настоящее изобретение касается лекарственного средства, содержащего соединение полисульфата карбоксиалкилированного -циклодекстрина, представленного структурной формулой (I) или же содержащего его фармацевтически приемлемые соли и/или сольваты(включая отдельные варианты, описанные выше), в сочетании с одним или несколькими нетоксичными фармацевтически приемлемыми вспомогательными веществами. В силу своей биохимической и фармакологической активности новые соединения на основе полисульфатов карбоксиалкилированного -циклодекстрина, описанные в данном изобретении, являются очень полезными лекарственными средствами. Их низкая токсичность полностью сочетается с их подобным применением. Также они являются очень стабильными и поэтому особенно подходят для использования в качестве активного компонента (ингредиента) в фармацевтических композициях. Предпочтительно фармацевтическая композиция согласно данному изобретению содержит соединения полисульфатов карбоксиалкилированного -циклодекстрина, представленных структурной формулой (I), в которой степень сульфатирования глюкопиранозного звена в среднем находится в диапазоне от 1,00 до 2,57, предпочтительно в диапазоне от 1,43 до 2,57, ещ более предпочтительно в диапазоне от 2,28 до 2,57 и наиболее предпочтительна степень сульфатирования, равная 2,57. Как известно специалистам, степень сульфатирования, или степень замещения (С 3), глюкопиранозного звена -циклодекстрина может быть рассчитана следующим образом: где ma - атомная масса. В каждой единице дозирования фармацевтической композиции согласно данному изобретению активный компонент (т.е. соединение полисульфата карбоксиалкилированного -циклодекстрина, представленного структурной формулой (I), включая фармацевтически приемлемые соли и/или сольваты, а также включая любой из вышеописанных вариантов) преимущественно представлен в терапевтически эффективном количестве, т.е. в количестве, подобранном соответствующим образом согласно предусмотренным частоте и способу введения, например композиция может выпускаться в таблетках, желатиновых капсулах и т.п., в саше, ампулах, в виде сиропа и т.п., в каплях, а также в виде систем для введения через кожу или через слизистые оболочки. Обычно такая единица дозирования содержит от 10 до 5000 мг, предпочтительно от 20 до 500 мг и ещ более предпочтительно от 25 до 250 мг активного компонента. Согласно данному изобретению соединения также могут использоваться (например, в фармацевтической композиции) в комбинации с одним или несколькими другими активными компонентами (ингредиентами), что будет полезно при осуществлении одного из необходимых видов лечения, описанных ниже. Подходящими примерами таких активных компонентов (ингредиентов) являются (но не ограничиваются ими) антитромботические средства, антикоагулянты, противовоспалительные средства, клеточные продукты и антиагрегантные средства, например дипиридамол, аспирин, тиклопидин, клопидогрел или антагонисты комплекса гликопротеинов IIb/IIIa. Другим примером подходящего активного компонента является хемокин, способный вызывать образование хряща in vivo, например CXCL6 или CXCL6 вырабатывающие клетки, такие как описаны в WO 2005/014026. Термин "клеточные продукты", использованный в данном изобретении в отношении активного ингредиента, комбинированного с новым соединением полисульфата карбоксиалкилированного-циклодекстрина, включает хондрогенные клетки, т.е. клетки, способные продуцировать прочный гиалиновый хрящ; и клетки-предшественники хондрогенных клеток, т.е. клетки-предшественники, способные подвергаться дифференцировке в хондрогенные клетки, определенные выше; к ним относятся стволовые клетки, которые могут быть получены из различных тканей, в том числе из костного мозга или из пуповины; самым подходящим вариантом являются скелетные клетки-предшественники (например, таковые, полученные из синовиальной мембраны), которые способны дифференцироваться в клетки, продуцирующие хрящ, например, как это описано в WO 01/25402. Фармацевтические композиции, описанные в данном изобретении, могут разрабатываться для применения у млекопитающих, в том числе у человека, для лечения любого из заболеваний, описанных ниже. Предпочтительно фармацевтическая композиция согласно данному изобретению, содержащая новый полисульфат карбоксиалкилированного -циклодекстрина либо отдельно, либо в комбинации с другим активным ингредиентом (как это описано выше), может быть использована для лечения и/или профилактики дегенеративных заболеваний суставов, предпочтительно остеоартрита, а также суставного ревматизма, артроза, дегенеративного артрита, для лечения гепарин-индуцированной тромбоцитопении,для восстановления хряща или соединительной ткани. Фармацевтические композиции согласно данному изобретению особенно подходят для лечения синдрома гепарин-индуцированной тромбоцитопении, при этом они не вызывают активации тромбоцитов и тромбоза при наличии реактивных антител к комплексу гепарина с тромбоцитарным фактором IV. Фармацевтические композиции согласно данному изобретению могут с успехом быть получены в различных лекарственных формах, таких как, например, растворы для инъекций или для приема внутрь,таблетки, покрытые сахарной оболочкой, простые таблетки или желатиновые капсулы. Предпочтительной формой выпуска являются растворы для инъекций. Подходящая дозировка может варьировать в широких пределах в зависимости от исходного возраста пациента, массы тела, состояния здоровья, этиологии и тяжести заболевания, а также от способа применения препарата. Один из соответствующих режимов лечения предусматривает введение одной или более дозировок от 20 до 500 мг/день, внутримышечно или подкожно, постоянно или периодически, с более или менее регулярными интервалами времени между введением. Другой вариант настоящего изобретения относится к композициям, содержащим полисульфат карбоксиалкилированного -циклодекстрина (представленный структурной формулой (I), включая фарма-5 018959 цевтически приемлемые соли и/или сольваты, а также включая любой из вышеописанных вариантов соединения) в сочетании с другим активным компонентом или ингредиентом, которые используются для приема внутрь или для парентерального введения. В описанной в данном изобретении фармацевтической композиции для перорального, сублингвального, подкожного, внутримышечного, внутривенного, чрескожного, через слизистые оболочки, местного или ректального введения активный компонент может применяться у животных и человека в стандартных лекарственных формах, в сочетании со стандартными фармацевтическими носителями или вспомогательными веществами. Соответствующие лекарственные формы включают пероральные формы, например желатиновые капсулы, порошки, гранулы, суспензии и растворы для приема внутрь; сублингвальные и трансбуккальные формы введения; подкожные, внутримышечные, внутривенные, интраназальные или внутриглазные формы введения; ректальные формы введения. Когда готовится твердая композиция в форме таблетки, основной активный ингредиент может быть смешан с одним или более фармацевтически приемлемыми носителями или вспомогательными веществами, такими как (но не ограничиваясь ими) желатин, крахмал, лактоза, стеарат магния, тальк, аравийская камедь и т.п. Таблетки могут быть покрыты оболочкой из сахарозы или из другого подходящего материала или в качестве альтернативного варианта они могут быть обработаны таким образом, что они будут сохранять устойчивость или обладать замедленным действием или будут в течение продолжительного времени постепенно выделять заданное количество активного компонента. Препарат в желатиновых капсулах получается путем смешения активного ингредиента с разбавителем и заливки полученной смеси в мягкие или твердые желатиновые капсулы. Диспергируемые в воде порошки или гранулы могут содержать активный компонент, смешанный с диспергирующими или увлажняющими веществами, с суспендирующими веществами, такими как поливинилпирролидон, а также с подсластителями или с усилителями вкуса. Для ректального введения используют суппозитории, которые готовят с применением связующих веществ, таящих при ректальной температуре; например, применяется масло какао или полиэтиленгликоли. Для парентерального, интраназального или внутриглазного введения используются водные суспензии, изотонические растворы или стерильные растворы для инъекций, которые содержат фармакологически совместимые диспергирующие и/или увлажняющие вещества, например пропиленгликоль или полибутиленгликоль. Для введения через слизистые оболочки активный компонент может быть использован в комбинации со стимулятором; такими стимуляторами могут являться соли желчных кислот, гидрофильный полимер, например гидроксипропилцеллюлоза, гидроксипропилметилцеллюлоза, гидроксиэтилцеллюлоза,этилцеллюлоза, карбоксиметилцеллюлоза, декстран, поливинилпирролидинон, пектины, крахмал, желатин, казеин, акриловые кислоты, акриловые эфиры и их сополимеры, виниловые полимеры или сополимеры, виниловые спирты, алкоксиполимеры, полимеры полиэтиленоксида, полиэфиры и смеси данных веществ. Активный компонент также может производиться в форме микрокапсул, возможно с одним или несколькими носителями или добавками. Мелкодисперсный порошок или гранулы для перорального введения могут содержать растворяющие, диспергирующие и/или поверхностно-активные вещества или вещества могут находиться в воде или в сиропе, в капсулах или в саше в сухом состоянии либо в неводном растворе или в суспензиях, в которые могут включаться суспендирующие вещества, в таблетках, в которые могут быть включены связующие и смазывающие вещества, или в виде суспензии в воде или сиропе. По желанию или при необходимости, могут быть добавлены ароматизирующие, консервирующие, суспендирующие, загущающие или эмульгирующие вещества. Таблетки и гранулы являются предпочтительными лекарственными формами для приема внутрь, также они могут быть покрыты оболочкой. Для улучшения проникающей способности в ротовой полости и всасывания в желудочно-кишечном тракте полисульфаты карбоксиалкилированного -циклодекстрина, представленные структурной формулой (I), могут выпускаться в форме смесей с оливковым маслом, солями желчных кислот или натрия N-[8-(2-гидроксибензилбензоил)амино]каприлатом. Пример 1. Сульфатирование карбоксиэтилциклодекстрина. Сульфонат пиридина (комплекс пиридин-сульфотриоксида) нагревали на водяной бане до 70-80 С. Сульфонат пиридина (1000 мл) помещали в резервуар с механическим перемешиванием с односторонним рычагом и выдерживали на водяной бане при температуре 80 С. При быстром перемешивании медленно добавляли карбоксиэтилциклодекстрин со степенью замещения 3 (100 г) от компании "Циклолаб Лтд." (Венгрия). Полученную смесь выдерживали при постоянном перемешивании при температуре 80 С в течение 2,5 ч, затем добавляли воду (500 мл). Пример 2. Приготовление натриевой соли сульфата карбоксиэтилциклодекстрина. Реакционную смесь, полученную в примере 1, при быстром перемешивании приливали к метанолу(7500 мл), содержащему ацетат натрия (750 г). Осадок отделяли путем фильтрации с помощью воронки Бюхнера, отмывали метанолом (2000 мл), сушили воздухом, а затем сушили в вакууме. Затем осадок (натриевую соль сульфата карбоксиэтилциклодекстрина) растворяли в воде (1000 мл) и полученный водный раствор анализировали на содержание свободных сульфатов, затем добавляли BaCl2, растворенный в горячей воде, для осаждения сульфата бария. Осадку давали осесть, а затем его удаляли с помощью центрифугирования. Пять объемов метанола добавляли к надосадочной жидкости для осаждения продукта, а затем полученный осадок отделяли с помощью воронки Бюхнера, отмывали метанолом и сушили с помощью вакуума. Пример 3. Обработка натриевой соли полисульфата карбоксиэтил-циклодекстрина активированным углем. Натриевую соль 2-карбоксиэтилциклодекстрина полисульфата (здесь и далее упоминаемую как КЭ-ЦДПС), полученную в примере 2, растворяли в воде до концентрации 300 мг/мл. Активированный уголь (10 г) добавляли к каждым 100 г натриевой соли циклодекстрина полисульфата. Смесь размешивали в течение 30 мин при комнатной температуре и для удаления угля фильтровали несколько раз, в том числе и с помощью последней 0,2 мкм фильтрационной мембраны. Отфильтрованный раствор соединения циклодекстрина медленно наливали в пять объемов метанола при помешивании. Смесь размешивали в течение 10 мин. Полученный продукт отделяли путем фильтрации, вымывали в метаноле и сушили под вакуумом. Элементный анализ полученного продукта представлен в табл. 1. Пример 4. Сравнительный элементный анализ производных -циклодекстрина. 2,3,6-Три-О-метилциклодекстрин (МЕ-ЦД) и 2,6-ди-О-метил-3-сульфатциклодекстрин(МЕ-ЦД-3-С) были приобретены в компании "Циклолаб Лтд." (Венгрия). 2,3-Ди-О-метил-6-сульфат-циклодекстрин (МЕ-ЦД-6-С) приобретен в компании "Регис Технолоджис Инк." (Мортон-Грув, Иллинойс, США). 2-Гидроксипропилциклодекстрин (ГП-ЦДПС) приобретен в компании "Сигма Кемикал",а сульфатированный 6-монодеокси-6-моноаминоциклодекстрин (МА-ЦДПС) в компании "Циклолаб Лтд.". Данные элементного анализа этих соединений представлены в табл. 1 для сравнения с данными для очищенной натриевой соли 2-карбоксиэтилциклодекстрина полисульфата из примера 3. Таблица 1 Элементный анализ различных производных -циклодекстрина Пример 5. Выделение суставных хондроцитов. Человеческие суставные хондроциты были выделены с помощью метода, описанного журнале J.Tissue Culture Methods (1993), 15:139-146). Если описать кратко, то человеческий суставной хрящ был получен из мыщелков бедренной кости и из верхней суставной поверхности большеберцовой кости от 15 различных доноров в ходе операции полной замены коленного сустава. Ни один из доноров не получал кортикостероиды или цитостатические препараты. Визуально здоровые и пораженные ОА образцы хряща забирались отдельно и только пораженный ОА хрящ использовали для получения клеточной культуры. Образцы хряща делились на маленькие фрагменты и хондроциты выделялись с помощью последовательного ферментативного переваривания (гиалуронидазой, проназой и коллагеназой) внеклеточного матрикса (ВКМ), как это описано в журнале Osteoarthritis Cartilage (2001), 9:73-84. Затем выделенные клетки центрифугировались в течение 10 мин при 1500 об/мин, отмывались три раза в модифицированной по способу Дульбекко среде Игла (МДСИ) с 10% (по объему) эмбриональной телячьей сывороткой и подсчитывались, при этом для исключения мертвых клеток использовалось окрашивание трипановым синим. После выделения более 90% клеток были жизнеспособными. Пример 6. Культуры хондроцитов в альгинатном геле. Хондроциты для сохранения их различного фенотипа культивировали в альгинатных гранулах. Культуры готовили согласно описанию в журнале Connect Tissue Res. (1989), 19:277-297. Хондроциты,суспендированные в одном объеме сбалансированного солевого раствора Хэнкса (ССРХ, коммерчески доступный от компании "Гибко") двойной концентрации без кальция и магния, были тщательно смешаны с равным объемом 2% (по массе и объему) стерилизованного в автоклаве альгината (альгинат низкой вязкости из Macrocystis pyrifera, коммерчески доступный от компании "Сигма") в ССРХ. Заключительная клеточная концентрация составила 5106 хондроцитов на 1 мл 1%-ного альгината. Затем суспензию хондроцитов/альгината медленно по каплям с помощью иглы 23-го калибра добавляли в 102 мМ раствор кальция хлорида. Гранулам дали полимеризироваться в течение 10 мин при комнатной температуре. После удаления кальция хлорида гранулы три раза отмывали с помощью 0,15 М натрия хлорида. Альгинатные гранулы культивировали на 12-луночных планшетах с 106 клеток в одной культуре (каждая лунка содержала 20 альгинатных гранул;50000 хондроцитов на гранулу) в 3 мл МДСИ с добавлением 10% ЭТС (эмбриональной телячьей сыворотки) и 50 мг/мл аскорбината при температуре 37 С в атмосфере с 5%-ным содержанием СО 2. Питательную среду заменяли два раза в неделю. Известно, что метаболизм ВКМ хондроцитами в данной альгинатной системе культивирования достигает стабильного состояния через 1 неделю. Пример 7. Обработка хондроцитов сульфатированными -циклодекстринами in vitro. Хрящевые клетки, полученные из пораженного остеоартритом (ОА) хряща от 15 доноров, использовали для оценки влияния различных полисульфатов -циклодекстринов на синтез и накопление аггрекана ЭТС. На 5-й день культивирования пораженные ОА хондроциты каждого донора подвергались воздействию 5 мкг/мл МЕ-ЦД, МЕ-ЦД-3-С, МЕ-ЦД-6-С, МА-ЦДПС, ГП-ЦДПС, КЭ-ЦДПС и ЦДПС (как определено в примерах 3, 4 и описано в табл.1). После 5 дополнительных дней культивирования среду собирали и хранили при температуре 20 С для дальнейшего анализа на концентрацию ИЛ-6. Клетки отделялись от их алыинатной оболочки с помощью растворения альгината путем воздействия 3 мл 55 мМ дегидратированного тринатриевого цитрата с рН 6,8 и 0,15 М NaCl при температуре 25 С в течение 10 мин. Полученную суспензию центрифугировали при 1500 об/мин в течение 10 мин для отделения надосадочной жидкости, содержащей компоненты межтерриториального матрикса клеток и компоненты клеточного матрикса (КМ). Содержание аггрекана в межтерриториальном матриксе оценивали с помощью набора ELISA (компания "Биосоурс", Бельгия) согласно инструкциям производителя. Все эксперименты проводились с тремя повторениями. Пример 8. Полисульфаты -циклодекстрина и показатели свертывания крови. МА-ЦДПС, ГП-ЦДПС, КЭ-ЦДПС и ЦДПС (как определено в примерах 3, 4 и описано в табл.1) готовили в виде буферных растворов с различными концентрациями. Полисахариды инкубировались с нормальной смешанной плазмой, взятой у 40 здоровых добровольцев, а затем анализировалось влияние полисахаридов на активированное частичное тромбопластиновое время (аЧТВ), на протромбиновое время (ПВ) и на уровень фибриногена; анализ осуществляли на анализаторе коагуляции STA Compact (от компании "Диагностика Стаго", Асниерес, Франция) в соответствии с инструкциями производителя. Пример 9. Полисульфаты -циклодекстрина и гепарин-индуцированная тромбоцитопения. Анализировали активацию здоровых донорских тромбоцитов с помощью антител к гепарину/ТФ 4,полученных от пациентов с ГИТ, в присутствии гепарина и различных сульфатированных форм-циклодекстрина. Для этих анализов использовали плазму пациентов, которые перенесли эпизод гепарин-индуцированной тромбоэмболии (ГИТ) после введения им гепарина и у которых в ходе иммунологических и проточно-цитометрических тестов были выявлены антитела к гепарину/ТФ 4 (ГИТ Ат). Степень экспрессии CD62p активированными тромбоцитами оценивали с помощью проточной цитометрии,проводившейся на анализаторе FC500 (от компании "Бекмен Культер", Бельгия). Раствор обогащенной тромбоцитами плазмы (ОТП) готовили путем медленного центрифугирования (в течение 10 мин при 180 g) обработанной противосвертывающим цитратом свежей крови (1:9 по объему, 0,129 моль/л или 3,8% тринатриевый цитратный буфер), полученной от здоровых доноров. Образцы плазмы пациентов с положительной реакцией на ГИТ Ат и образцы плазмы здоровых доноров с отрицательной реакцией на ГИТ Ат готовили путем двойного центрифугирования (в течение 15 мин при 2230 об/мин) свежезаготовленной крови, обработанной противосвертывающим цитратом. 70 мкл ОТП инкубировали с 20 мкл плазмы, содержащей ГИТ Ат, и при необходимости в присутствии гепарина (0,3 МЕ/мл) или соответствующего производного -циклодекстрина (5 мкг/мл). Эксперименты с каждым образцом плазмы с положительной реакцией на ГИТ Ат повторяли независимо друг от друга с использованием тромбоцитов от двух доноров (А и В), это делалось для исключения инертности тромбоцитов. После первого этапа инкубации в течение 40 мин 5 мкл раствора тромбоцитов помещали в чистую пробирку с 85 мкл физиологического раствора с фосфатным буфером (ФРФБ), содержащего 1%-ный альбумин бычьей сыворотки (АБС) и 0,1% натрия азид, 5 мкл (0,25 мкг) моноклональных анти-CD41 антител (Ат) (конъюгированный фикоэритрин - Техасский красный с двойным энергетическим окрашиванием [Energy coupled dye - ECD], от компании "Бекмен Культер") и 5 мкл (0,125 мкг) анти-CD62 р Ат(конъюгированный фикоэритрин [ФЭ], от компании "Бекмен Культер"). CD41 (гликопротеин IIb) - это селективный маркер тромбоцитов и предшественников тромбоцитов. CD62p - это компонент альфагранул, который выделяется на поверхность тромбоцитов при их активации. После 20 мин инкубации при комнатной температуре общий объем суспензии тромбоцитов доводили до 600 мкл с помощью буферного раствора и сразу же была проведена оценка путем проточной цитометрии. Анализировали 20000 сигналов в образце и популяции тромбоцитов отбирали с помощью харак-8 018959 теристик бокового светорассеяния и по уровню маркера тромбоцитов CD41. Активированные тромбоциты (CD62p+) были выделены из всех остальных тромбоцитов с помощью экспрессии CD62p-ФЭ (как это показано на фиг. 3). С целью внутреннего контроля среди всей популяции тромбоцитов была определена фракция активированных тромбоцитов и было подсчитано относительное соотношение CD62p [соотношение: %CD62p+ (0,3 ME гепарина или 5 мкг/мл производного -циклодекстрина)/%CD62 р+ (0 ME гепарина или 0 мкг/мл производного -циклодекстрина)]. Результаты исследования тромбоцитов, подвергшихся воздействию гепарина, оценивали с помощью системы баллов, описанной в журнале Thromb.Haemost. (1999), 82:1255-1259. На основании результатов, ранее полученных от здоровых лиц, результаты контрольных тестов считались положительными, если рассчитанные соотношения по меньшей мере для двух доноров были более 2. Для оценки способности различных производных -циклодекстрина индуцировать активацию тромбоцитов процентные показатели и соотношения CD62p+ тромбоцитов после инкубации с соответствующим -циклодекстрином статистически сравнивали с процентными показателями и соотношениями CD62p+ тромбоцитов после инкубации с гепарином. Пример 10. Индукция экспериментального остеоартрита. Остеоартрит коленного сустава вызывали с помощью введения в правый коленный сустав взрослых(10 недель) самцов мышей линии C57BI/6 10 мкл раствора 2 Е/мкл коллагеназы VII типа (Sigma C-9572,от компании "Сигма-Алдрич", Бельгия). В левый коленный сустав этих животных вводили 10 мкл ФРФБ и данный сустав использовали в качестве контроля. Мыши были случайным образом разделены по массе на две группы по 8 мышей в каждой, в первой группе животным вводили КЭ-ЦДПС из примера 3, животным из второй группы вводили физиологический раствор. Лечение начиналось через три дня после проведения мышам внутрисуставной инъекции. Животных содержали на стандартном рационе с употреблением водопроводной воды ad libitum, а их вес фиксировали дважды в неделю. Мышей умерщвляли через три недели после индуцирования остеоартрита коленного сустава и их печень, почки и коленные суставы сразу же фиксировали в 2%-ном параформальдегиде с нейтральным буфером (Fluka 76240, от компании "Сигма-Алдрич", Бельгия). Пример 11. Гистопатология. После фиксации коленные суставы декальцифицировали с помощью 0,5 М ЭДТА в ФРФБ и помещали в парафин. Делались срезы ткани толщиной 5 мкм, а затем они окрашивались гематоксилином и эозином для анализа общего строения или сафранином-O для оценки содержания протеогликанов. Через каждые 100 мкм оценивалось по 3 среза сустава. Окрашенные препараты подвергали оценке. Оценивали следующие параметры: воспаление синовиальных оболочек, фиброз, остеофиты и эрозия хряща. Воспаление синовиальных оболочек оценивалось от 0 до +3 следующим образом: 0 - нет отклонений от нормы;+3 - тяжелые изменения. Фиброз оценивали следующим образом: 0 - нет отклонений от нормы;+3 - фиброз, сопровождающийся метаплазией кости. Остеофиты оценивали от 0 до +4 с учетом количества наблюдаемых остеофитов с максимальным баллом 1 за наблюдаемую область. Эрозия хряща оценивали от 0 до +3 следующим образом: 0 - нет отклонений от нормы;+2 - уменьшение содержания протеогликанов в одной области;+3 - уменьшение содержания протеогликанов в различных областях. Согласно данной системе баллов в целом соединение бедренной и большеберцовой костей оценивалось двумя независимыми исследователями. Пример 12. Статистический анализ. Для исследования изменений культур хондроцитов после лечения полисульфатом циклодекстрина рассчитывались средние концентрации ИЛ-6 и аггрекана в трех культурах хондроцитов от каждого донора. Критерий знаковых рангов Уилкоксона использовали для оценки значимости различий между контрольными культурами, не подвергавшимися воздействию, и культурами, на которые воздействовали различными полисульфатами циклодекстрина. Перекрестная реактивность гепарина с полисахаридами при индуцированной in vitro активации тромбоцитов анализировали с помощью критерия знаковых рангов Уилкоксона. Оценку веса мышей в течение времени анализировали с помощью методов анализа данных длительных наблюдений, а точнее - с помощью анализа площади под кривой и анализа смешанной модели. Баллы, полученные при гистологическом исследовании, сравнивались с помощью тестов Манна-9 018959 Уитни. Уровень значимости для всех анализов был установлен на уровне р 0,05. Пример 13. Эффекты от вызываемой сульфатированными -циклодекстринами выработки аггрекана и ингибирования выделения ИЛ-6. Несульфатированные МЕ-ЦД не активируют синтез аггрекана и не влияют на выделение ИЛ-6, и поэтому они используются в качестве контроля в экспериментах на изолированных хондроцитах. Кроме того, моносульфатированные циклодекстрины МЕ-ЦД-3-С и МЕ-ЦД-6-С также не влияют на синтез хондроцитами аггрекана и на секрецию ИЛ-6. Однако бисульфатированные (ЦДПС, МА-ЦДПС) и трисульфатированные -циклодекстрины (ГП-ЦДПС, КЭ-ЦДПС) значительно усиливают синтез хондроцитами аггрекана, в среднем на 50-70% (как это показано на фиг. 1 А). Эти высокосульфатированные-циклодекстрины также значимо подавляют секрецию хондроцитами ИЛ-6 (как это показано на фиг. 1 В). Пример 14. Влияние -циклодекстрина на свертываемость крови. При повышении концентрации показатели аЧТВ (с) сохраняются на одном уровне до достижения концентрации всех изученных производных ЦДПС в 5 мкг/мл. При концентрации исследовавшихся производных свыше 50 мкг/мл в течение экспериментального периода наблюдения тромб не образовывался(как это показано на фиг. 2A). Такую же тенденцию наблюдали и для показателей ПВ (фиг. 2C), за исключением не настолько выраженного увеличения протромбинового времени при использовании концентраций свыше 50 мкг/мл (как показано на фиг. 2B). После инкубации с 50 или 100 мкг/мл МА-ЦДПС,ГП-ЦДПС, КЭ-ЦДПС или ЦДПС соответственно наблюдалось небольшое снижение концентрации фибриногена (как показано на фиг. 2C). Таким образом, влияния на процесс свертывания крови при концентрациях, которые in vitro проявляют хондропротекторный эффект, выявлено не было. Пример 15. Индукция активации тромбоцитов. Считалось, что активация тромбоцитов антителами к гепарину/ТФ 4 имеет место, если во всех образцах плазмы с положительной реакцией на ГИТ Ат от двух доноров отмечалось соотношение активации тромбоцитов гепарином %CD62p+ (0,3 ME гепарина)/%CD62 р+ (0 ME гепарина) свыше 2. При отсутствии у пациентов ГИТ Ат тромбоциты не активировались ни гепарином, ни производными полисульфатов -циклодекстрина. Иммунологическая перекрестная реактивность между гепарином и некоторыми полисульфатированными -циклодекстринами проявляется в виде индуцированной ГП-ЦДПС, МА-ЦДПС и ЦДПС активации тромбоцитов в присутствии образцов плазмы лиц, у которых при предыдущем использовании гепарина появились ГИТ Ат (как это показано на фиг. 3). Парный анализ как соотношений, так и процентного содержания CD62p-положительных клеток подтвердил значимое различие (р=0,017 для процентов и р=0,012 для соотношений) между тромбоцитами, инкубировавшимися с гепарином и с КЭ-ЦДПС, и это говорит о том, что КЭ-ЦДПС не проявляет перекрестной реактивности с антителами к гепарину/ТФ 4(табл. 2). Более того, р-значения, рассчитанные по данным парного анализа соотношений и процентов активированных тромбоцитов (при сравнении применения КЭ-ЦДПС и каждого из других проанализированных циклодекстринов), были ниже 0,05. Пример 16. Влияние КЭ-ЦДПС на экспериментальный остеоартрит коленного сустава. Поскольку в ходе исследований ГИТ in vitro для КЭ-ЦДПС был выявлен наилучший профиль безопасности, данное соединение применялось на экспериментальной модели остеоартрита на мышах. Лечение с помощью КЭ-ЦДПС не оказывало влияния на вес животных. На протяжении всего исследования разницы в массе тела между животными из группы лечения и из контрольной группы не было. Внутрисуставное введение коллагеназы в коленный сустав мышей вызывало ослабевание связок и приводило к слабости сустава. Следствием механической нестабильности и предполагаемого сопутствующего выделения ряда новых антигенных детерминант явилось развитие у этих мышей ОА поражений и тяжелой воспалительной реакции со стороны синовиальных оболочек. По сравнению с контрольными здоровыми коленными суставами у мышей в суставах, пораженных ОА и подвергавшихся воздействию КЭ-ЦДПС и ФРФБ, отмечалась тяжелая инвазия воспалительных клеток в синовиальную оболочку с образованием выраженного синовиального паннуса. Также в данных суставах, пораженных ОА, наблюдалось формирование остеофитов. Воспаление синовиальных оболочек, формирование паннуса и рост остеофитов не уменьшались при лечении. В отличие от этого, все повреждения хряща восстанавливались у мышей, получавших КЭ-ЦДПС, поскольку окрашивание Сафранином-O верхней суставной поверхности большеберцовой кости и мыщелков бедренной кости у получавших лечение мышей было более выраженным по сравнению с таковым у мышей, получавших ФРФБ (как это показано на фиг. 4). Таблица 2 Активация тромбоцитов гепарином и производными полусульфатированных -циклодекстринов Краткое описание графических изображений На фиг. 1 А изображены процентные изменения выработки аггрекана пораженными остеоартритом хондроцитами, на которые воздействовали производными полисульфата -циклодекстрина. Точки обозначают средние значения для трех вариантов культур одного пациента. Полосками представлено общее среднее. На фиг. 1 В представлены процентные изменения выработки ИЛ-6 пораженными ОА хондроцитами,на которые воздействовали производными полисульфата -циклодекстрина. Точки обозначают средние значения для трех вариантов культур одного пациента. Полосками представлено общее среднее. На фиг. 2 изображено влияние производных полисульфата -циклодекстрина на различные показатели свертывающей активности плазмы, по оси ординат: аЧТВ (секунды), ПВ (секунды), фибриноген(мг/мл); по оси абсцисс: концентрация сульфатированных циклодекстринов (мкг/мл). На фиг. 3 изображена in vitro активация тромбоцитов плазмой с положительной реакцией на ГИТ Ат и гепарином. А. Тромбоциты отбирались по характеристикам бокового светорассеяния и по активности CD41. Процент окрашивания клеток с CD62p после добавления гепарина при отсутствии (В) или в присутствии (С) плазмы с положительной реакцией на ГИТ Ат. Интерфейсный канал позитивности был установлен на уровне, при котором менее чем при 2% контрольной люминесценции результаты были положительными. На фиг. 4 изображено влияние КЭ-ЦДПС на гистологию сустава, пораженного остеоартритом. Воспаление (восп.), фиброз (фибр.), остеофиты (ост.) и уменьшение содержания протеогликанов (пгл.) оценивались на здоровых контрольных суставах, на пораженных ОА суставах, подвергавшихся воздействию физиологического раствора, и на пораженных ОА суставах, подвергавшихся воздействию КЭ-ЦДПС. Левая ось ординат: гистологический балл оценки восп., фибр и ост. Правая ось ординат: балл оценки пгл. Представлены средние значения (линии)1 СЭМ. где каждый R независимо от другого представляет собой -CH2-CH2-СООН, или -SO3H, или Н при условии, что от одного до трех R представляют собой -CH2-CH2-СООН и по меньшей мере два R в глюкопиранозном звене представляют собой -SO3H,и фармацевтически приемлемые соли и/или сольваты указанного соединения. 2. Соединение -циклодекстрин полисульфата по п.1, отличающееся тем, что все замещающие группы R представляют собой три группы -CH2-CH2-СООН, семнадцать групп -SO3H и один атом водорода. 3. Соединение -циклодекстрин полисульфата по п.1, отличающееся тем, что все замещающие группы R представляют собой три группы -CH2-CH2-СООН и восемнадцать групп -SO3H. 4. Соединение -циклодекстрин полисульфата по любому из пп.1-3, в котором в среднем от 2,00 до 2,57 групп R в глюкопиранозном звене представляют собой -SO3H. 5. Соединение -циклодекстрин полисульфата по любому из пп.1-4, в котором в среднем от 2,2 до 3,0 групп R представляют собой -CH2-CH2-СООН. 6. Способ получения соединения -циклодекстрин полисульфата по любому из пп.1-5, отличающийся тем, что соединение -циклодекстрина, представленное структурной формулой где каждый R независимо от остальных представляет собой -CH2-CH2-СООН или Н при условии,что от одного до трех R представляют собой -CH2-CH2-СООН,реагирует с сульфирующим агентом, при этом количество указанного сульфирующего агента таково, что в результате данной реакции по меньшей мере два атома Н в глюкопиранозном звене превращаются в группы -SO3H. 7. Способ по п.6, отличающийся тем, что указанную реакцию проводят при температуре в диапазоне от 40 до 100 С. 8. Способ по п.6 или 7, отличающийся тем, что указанное соединение -циклодекстрина, представленное структурной формулой где каждый R независимо от остальных представляет собой -CH2-CH2-СООН или Н при условии,что от одного до трех R представляют собой -CH2-CH2-СООН,получают путем реакции -циклодекстрина с акриламидом в таком количестве, что в результате указанной реакции от одной до трех гидроксильных групп -циклодекстрина превращаются в группы-CH2-CH2-СООН. 9. Способ по п.8, отличающийся тем, что указанную реакцию проводят при температуре в диапазоне от 40 до 95 С. 10. Способ по п.8 или 9, отличающийся тем, что молярное отношение акриламида к-циклодекстрину находится в диапазоне от 1 до 100. 11. Фармацевтическая композиция для лечения и/или профилактики дегенеративных заболеваний суставов, остеоартрита, суставного ревматизма, артроза или дегенеративного артрита, или лечения гепарин-индуцированной тромбоцитопении, или восстановления хряща или соединительной ткани, содержащая по меньшей мере одно соединение -циклодекстрина полисульфата по любому из пп.1-5 в комбинации с одним или более нетоксичными фармацевтически приемлемыми вспомогательными веществами. 12. Применение соединения -циклодекстрин полисульфата по любому из пп.1-5 для лечения и/или профилактики дегенеративных заболеваний суставов, остеоартрита, суставного ревматизма, артроза или дегенеративного артрита, или для лечения гепарин-индуцированной тромбоцитопении, или для восстановления хряща, или для восстановления соединительной ткани.
МПК / Метки
МПК: A61K 31/724, A61P 31/12, C08B 37/16, A61P 31/18, A61P 19/02, A61P 7/02
Метки: карбоксиэтилированные, применения, циклодекстрина, лекарственных, подходящие, полисульфаты, средств, качестве
Код ссылки
<a href="https://eas.patents.su/16-18959-karboksietilirovannye-polisulfaty-ciklodekstrina-podhodyashhie-dlya-primeneniya-v-kachestve-lekarstvennyh-sredstv.html" rel="bookmark" title="База патентов Евразийского Союза">Карбоксиэтилированные полисульфаты циклодекстрина, подходящие для применения в качестве лекарственных средств</a>
Предыдущий патент: Способ извлечения высокочистого диоксида углерода
Следующий патент: Смесь собирателей для флотации глинистых минералов из калийных руд
Случайный патент: Способ получения олефинов и ароматических веществ из органических веществ