Пептиды, модулирующие активацию каспазы
Номер патента: 10058
Опубликовано: 30.06.2008
Авторы: Семенкова Лидия Николаевна, Корпела Тимо Калеви, Татулов Эдуард Борисович, Зубов Дмитрий Львович, Дудич Елена Ивановна, Дудич Игорь Вячеславович
Формула / Реферат
1. Пептид, представляющий собой фрагмент белка, который распознается антиидиотипическим антителом против апоптотически активного участка a-фетопротеина человека, соответствующего аминокислотной последовательности 251-259 данного белка, или антиидиотипическим антителом против альбумина человека к последовательности 246-254 альбумина человека.
2. Пептид, соответствующий активному центру a-фетопротеина или альбумина человека, имеющий аминокислотную последовательность CCRGDVLDCnXmY, или CCHGDLLECnXmY, в которой X обозначает любую гидрофобную аминокислоту и Y обозначает любую гидрофильную аминокислоту, индекс n равен 0, 1, 2 или 3 и индекс m равен 0, 1, 2 или 3.
3. Пептид по п.2, где пептид дополнительно содержит на N-конце 0, 1, 2 или 3 фланкирующих остатка цистеина и 0, 1, 2 или 3 фланкирующих остатка цистеина на C-конце.
4. Пептид по п.2, имеющий полимеризованную или цикличную структуру, где циклизование или полимеризация осуществляется посредством химического взаимодействия аминокислотных остатков цистеина или других аминокислотных остатков, способных образовывать межмолекулярные сшивки.
5. Пептид по любому из пп.2-4, отличающийся одновременным наличием последовательностей RGD и DXXD в одной и той же молекуле, в которой X обозначает любой гидрофобный аминокислотный остаток и R, G и D обозначают Arg, Gly и Asp соответственно.
6. Пептид по п.5, в котором D в последовательности RGD является общим с последовательностью DXXD.
7. Пептид по любому из пп.2-6, где любой из X обозначает независимо V, L или W и Y обозначает D, E или G.
8. Пептид по п.2, включающий последовательность C*C*RGDVLDC*, представленный в линейной, полимеризованной или цикличной форме, где аминокислотные остатки, отмеченные звездочкой, обозначают места образования возможных дисульфидных связей.
9. Пептид по п.2, включающий последовательность C*C*HGDLLEC*, представленный в линейной, полимеризованной или цикличной форме, где аминокислотные остатки, отмеченные звездочкой, обозначают места образования возможных дисульфидных связей.
10. Применение пептида по любому из пп.1-9 для подавления апоптотических регуляторных метаболических путей в клетках животных и человека.
11. Применение пептида по любому из пп.1-9 для увеличения сохранности органов или клеток при их трансплантации.
12. Применение пептида по любому из пп.1-9 для предотвращения возникновения аутоиммунных нарушений и синдрома иммунодефицита, вызванного вирусной инфекцией.
13. Применение пептида по любому из пп.1-9 для снижения цитотоксических эффектов после химио- и лучевой терапии.
14. Применение пептида по любому из пп.1-9 для ингибирования апоптоза нейронных клеток, неспецифичного вызванного лекарственными средствами апоптоза или опосредованного окислительным стрессом апоптоза.
15. Применение пептида по любому из пп.1-9 для предотвращения апоптоза культивируемых клеток, в том числе стволовых клеток костного мозга, мезинхимальных стволовых клеток, эмбриональных стволовых клеток, получаемых для научных, медицинских или технических целей.
16. Косметическая композиция для омоложения кожи и профилактики старения кожи, содержащая пептид по любому из пп.1-9, приемлемые в косметологии носители и наполнители и, необязательно, производные витаминов A, E, Д, антиоксиданты, стероидные гормоны, изофлавиноиды растительного происхождения.
17. Применение косметической композиции по п.16 для омоложения кожи и профилактики старения кожи, в том числе вызванного ультрафиолетовым облучением и профилактики солнечной радиации, путем нанесения указанной композиции на кожу индивидуума.
18. Антиидиотипическое антитело или фрагмент антиидиотипического антитела, имеющий паратоп с молекулярной структурой, обеспечивающей распознавание апоптотически активного участка
a-фетопротеина человека или альбумина сыворотки человека, состоящего из аминокислотных остатков 251-259 последовательности a-фетопротеина или аминокислотных остатков 246-254 альбумина.
19. Пептид, имеющий эпитоп или участок связывания с антителами или их фрагментами, определенными в п.18.
20. Белок, содержащий в своей структуре аминокислотную последовательность пептида, определенного в п.19.
Текст
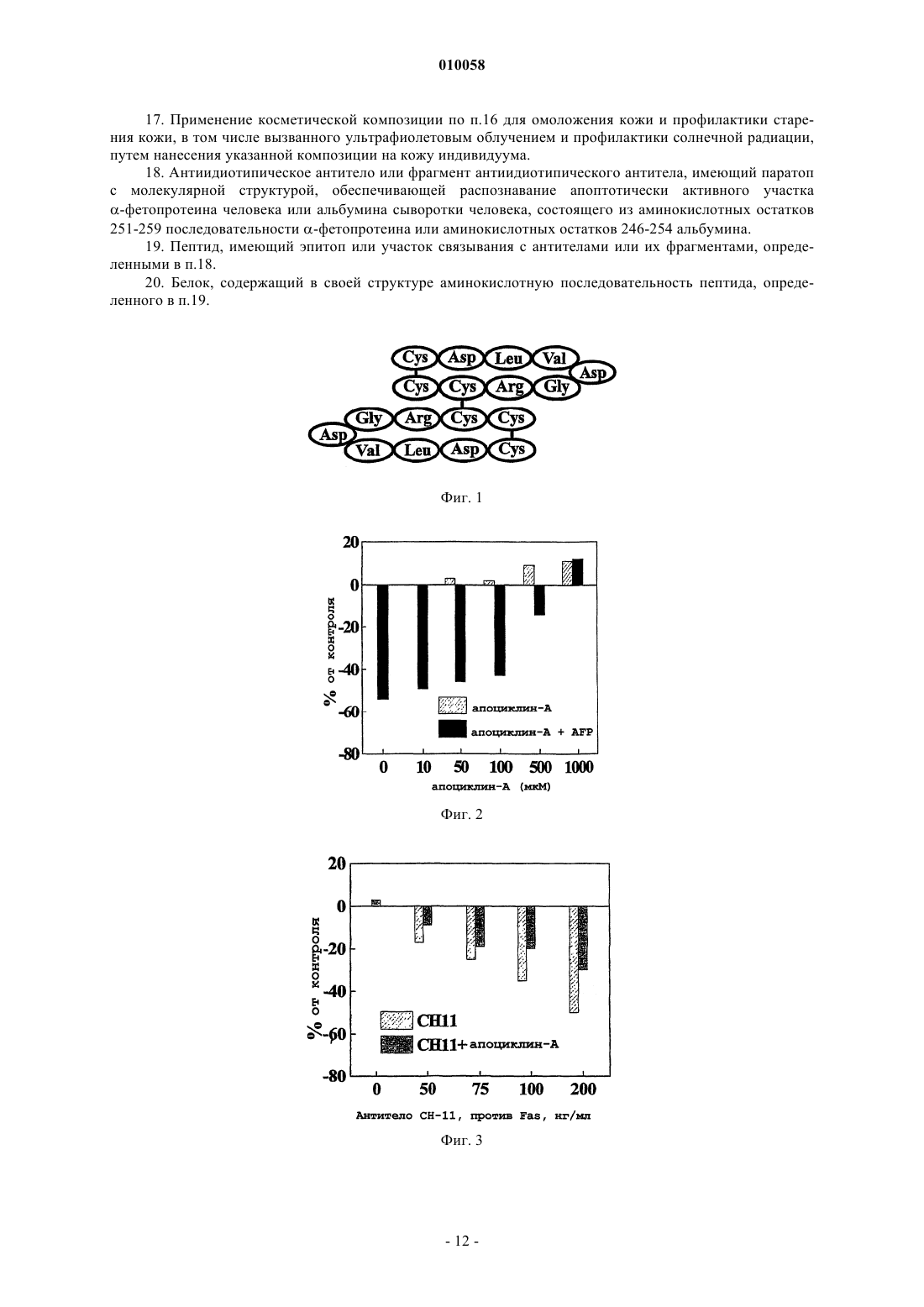
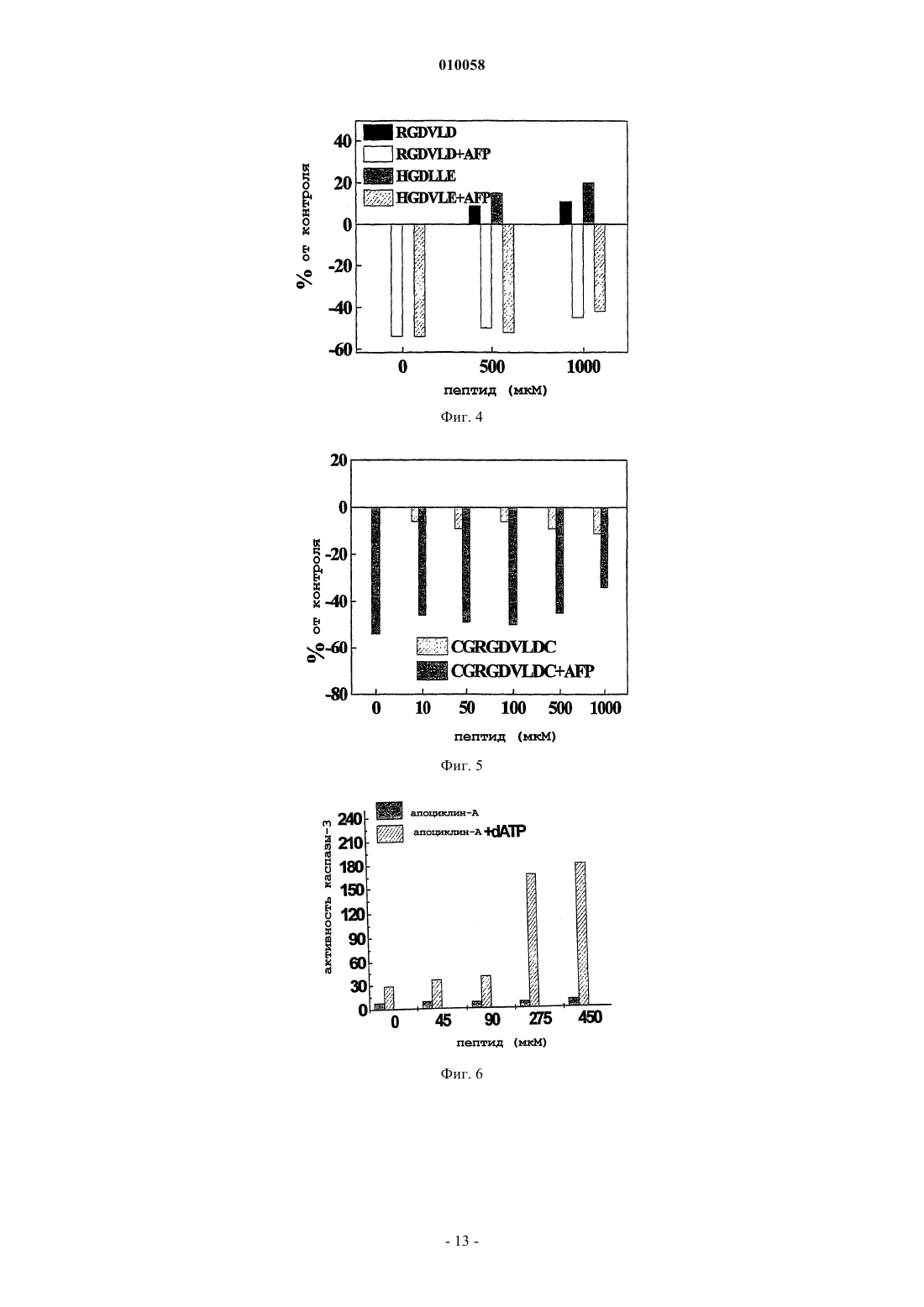
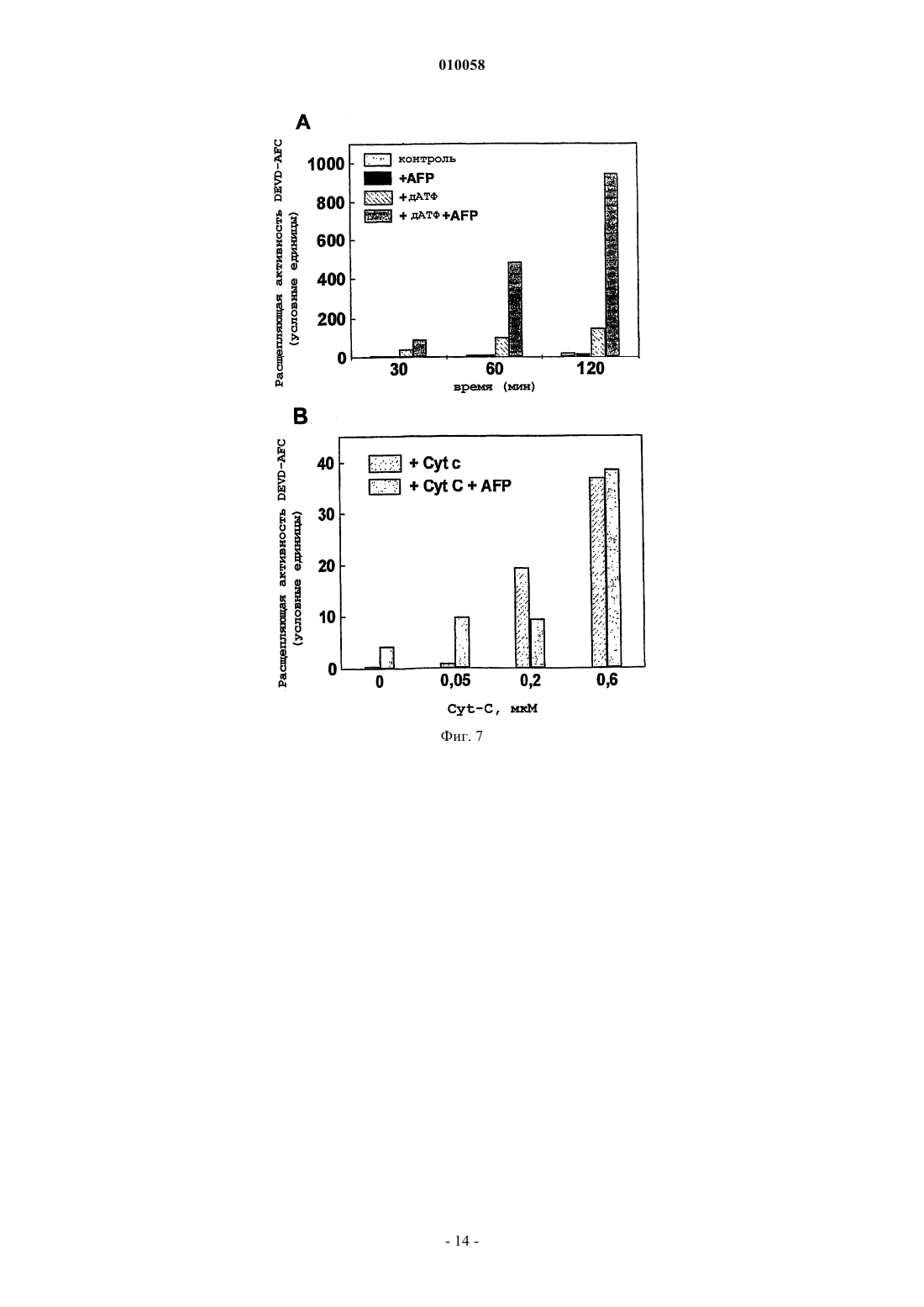
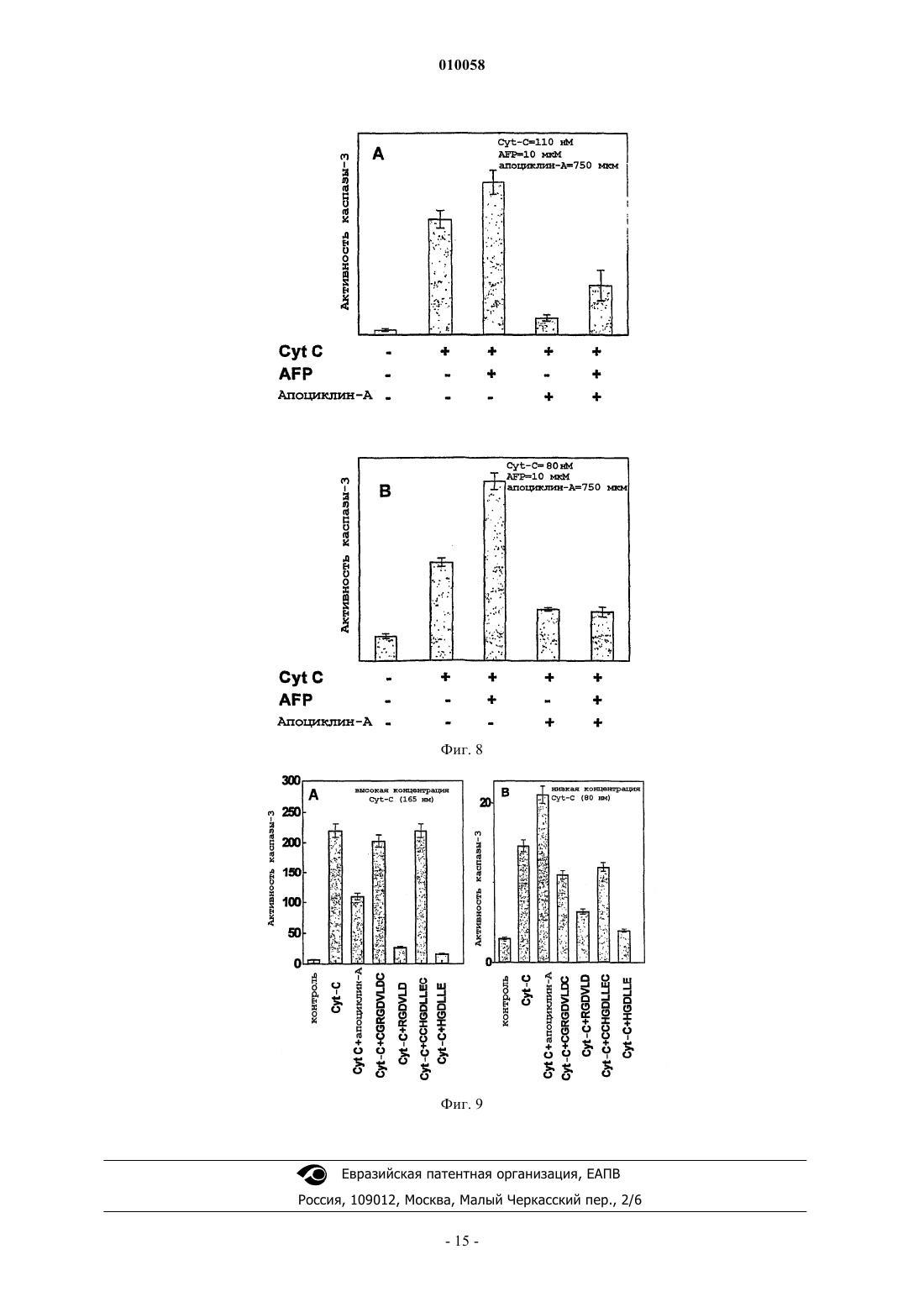
010058 Область техники Настоящее изобретение относится к медицине и механизмам гибели клеток человека и животных. В частности, изобретение относится к пептидам, способным останавливать апоптотическую гибель клетки,вызванную различными факторами. Изобретение описывает пептиды с такими активностями, способы получения и применение указанных пептидов. Уровень техники изобретения Апоптоз представляет собой активную форму гибели клеток и принимает участие во множестве процессов нормального развития клетки, а также при злокачественном перерождении клеток. Механизм апоптоза вовлечен в биологические процессы, вызванные действием различных типов лекарственных средств, цитокинов и факторов роста, окислительным стрессом, радиацией, старением, аутоиммунными заболеваниями и иммунным отторжением при трансплантации органов. Недавние исследования апоптоза демонстрируют, что при различных типах апоптоза, обусловленных действием гормонов, цитокинов,отсутствием факторов роста, химиотерапевтическими агентами, ионизирующей радиацией, иммунологическими нарушениями, СПИД, раком и старением, используются общие молекулярные механизмы(Nagata (1997), Cell 88, 355-365). Активация каспазных протеаз по каскадному принципу представляет собой фундаментальный момент в индукции апоптоза. Описаны два различных типа передачи сигналов апоптоза. Начальная фаза зависимого от рецепторов инициирования апоптоза включает в себя активацию соответствующих рецепторов гибели определенными лигандами, такими как TNF или FasL, которые в настоящее время являются наиболее изученными индукторами апоптоза. После активации рецепторы гибели на поверхности клеток, Fas (CD95) или TNFR1, присоединяются к цитозольным белкам-адаптерам(FADD, MORT, RIP, TRADD), которые в свою очередь вводят каспазу-8 для активации каскада интерлейкин-1 превращающего фермента ICE и протеазы (каспазы) семейства CED-3, сопровождающегося активацией CPP32/каспазы-3-подсемейства цистеиновых протеаз, представители которого находятся в цитоплазме клетки в форме латентных предшественников, прокаспаз (Enari, et al. (1996), Nature 380: 723-726). Рецепторнезависимые типы апоптоза обычно включают критически важный вызываемый цитохромом C механизм, для которого необходимо формирование мультимолекулярного комплекса цитохрома C, дАТФ, Apaf-1 и прокаспазы-9, который приводит к активации последней посредством аутопротеолиза и гомодимеризации и последующей активации каспазного каскада (Cohen, et al. (1997),Biochem. J., 326: 1-16). Агенты, которые влияют на биологический контроль апоптоза таким образом, имеют потенциальное терапевтическое применение в многочисленных клинических приложениях. Большое количество полученных из растений ингибиторов апоптоза используется для скрининга патологических нарушений,которые часто сопровождают химиотерапию, радиационные воздействия, иммунные нарушения или СПИД. Данные добавки обычно содержат углеводы, жир и гидролизаты растительных белков, лектины и фосфолипиды (US 6004579, Barr et al.). Эффективные регуляторы апоптоза можно было бы применять при лечении больных раком, чтобы контролировать терапию цитокинами, химиотерапию или лучевую терапию. Апоптотические механизмы действуют при различных типах иммунологических нарушений,таких как аутоиммунные заболевания, иммунное отторжение при трансплантации органа или анафилаксия, или при вирусных инфекциях, вызванных вирусом иммунодефицита человека. Альфа-фетопротеин (AFP) представляет собой ассоциированный с опухолью эмбриональный гликопротеин, демонстрирующий широкий диапазон биологических активностей, охватывающих регуляцию роста клетки, дифференцировку незрелых клеток, иммуносупрессию активированных иммунных клеток, специфичную для опухоли индукцию апоптоза и регуляцию апоптотических сигналов, опосредуемых другими факторами, а также регуляцию экспрессии различных генов (Mizejewsky (2001), Exp.Biol. Med., v. 226: 377-408). Многочисленные доказательства регуляции активности роста клеток, включая подавляющую рост опухоли активность, были описаны для различных видов полноразмерной молекулы AFP, ее протеолитических фрагментов или рекомбинантных доменов и синтетических пептидов(Dudich et al. (1999), Biochemistry, 38: 10406-10414; Jacobson et al., Proc. Natl. Acad. Sci. USA (2002), 99: 2211-2215; MacColl et al. (2001), Biochem. Biophys. Acta, 1528: 127-134). Поиск расположения функциональных активных участков молекулы AFP, которые ответственны за множество ее активностей, был предпринят различными исследователями. Определение расположения участков связывания арахидоновой кислоты и эстрадиола было успешным (рассмотрено в обзоре Mizejewsky, (2001) Exp. Biol. Med.,v. 226: 377-408). Недавно было продемонстрировано, что AFP реализует свою онкосуппрессивную активность, инициируя апоптоз посредством активации каспазы-3 и независимо от передачи сигнала Fas/FasL иTNF/TNFR (Dudich et al., (1999) Eur. J. Biochem. 282). За последнее десятилетие описаны многочисленные доказательства супрессии роста опухолевых клеток, опосредованной AFP, но активный участок молекулы AFP, который ответственен за передачу сигнала апоптоза, не был до сих пор идентифицирован. ДНК и аминокислотные последовательности AFP человека были опубликованы (Morinaga, et.(1983. Синтетические пептиды, соответствующие участку связывания E2, как было показано, обладают-1 010058 подавляющей рост опухоли активностью (патенты США US 5674842; 10/1997 Mizejewsky; US 5707963,07/1998 Mizejewsky). Множество биологически активных белков имеет гомологичную с AFP последовательность (Mizejewsky (2001), Exp. Biol. Med., v. 226(5): 377-408). Была идентифицирована достоверная гомология AFP с различными белками, вовлеченными в передачу сигнала апоптоза, такими как Вс 12,TNFR1, Fas и др. (Mizejewsky (2001), Exp. Biol. Med., v. 226(5): 377-408). B WO 9835981 A1 (Economou, J.et al., 1998) описано использование 66 пептидных последовательностей AFP, которые используют для иммунизации против рака. Один из пептидов, А 20, имел последовательность CRGDVLDCL, которая, как случайно оказалось, содержала часть активного участка AFP, обнаруженного в настоящем изобретении. Тем не менее, не было обнаружено никакой специфической активности для пептида CRGDVLDCL, и настоящее изобретение остается первым изобретением, способным определить один из предполагаемых биологически активных участков AFP. Более того, пептиды по настоящему изобретению содержат остаток цистеина, который способен к образованию межцепочечных дисульфидных связей, что приводит к появлению более высокой биологической активности, чем для пептида с последовательностьюCRGDVLDCL. Важный участок связывания интегрина представляет собой трипептид Arg-Gly-Asp, который присутствует у множества лигандов интегрина. Интегрины являются гетеродимерными гликопротеинами,опосредующими взаимодействия цитоплазматического матрикса с клеткой и клетки с клеткой, они играют активную роль в процессах дифференцировки клетки, иммунного распознавания, развития опухоли и метастатического роста. В субъединицах интегрина были идентифицированы области контакта для последовательности Arg-Gly-Asp (Pasqualini, et al. J. Cell Biol. (1995), 130: 1189-1196). Синтетические пептиды, содержащие мотив Arg-Gly-Asp, используются в качестве ингибиторов взаимодействия лигандов с интегрином. Было показано, что синтетические пептиды, содержащие мотив Arg-Gly-Asp, способны к непосредственной активации каспазы-3 (Bukley, et al. (1999), Nature, 397: 534-539). AFP содержит в своей последовательности последовательность Arg-Gly-Asp (RGD), которая расположена в домене II в положении 253-255. По настоящему изобретению последовательность RGD является частью функционально активного участка AFP, вовлеченного в передачу сигнала апоптоза. В настоящем изобретении описана минимальная часть молекулы AFP, которая ответственна за передачу сигнала апоптоза. Небольшие пептиды или другие небольшие гаптены являются важными регуляторами, используемыми в качестве лекарственных средств, поскольку их можно синтезировать in vitro и они не вызывают образование нейтрализующих антител. Пептиды, содержащие от 6 до 10 остатков,были получены при помощи твердофазной химии F-MOC. Также были синтезированы подобные пептиды, соответствующие гомологичным последовательностям альбумина сыворотки человека (HSA). Для всех пептидов оценивали их регулирующую активность роста в целых клетках в культуре, и также проверяли их способность непосредственно индуцировать активацию каспазы в бесклеточных цитозольных экстрактах. Дополнительно оценивали способность пептидов модулировать апоптоз, вызванный AFP и цитотоксическими Mab CH-11 против Fas в целых клетках, и влиять на индуцированную цитохромом C активацию каспазы в бесклеточных системах. Краткое описание чертежей На фиг. 1 показано схематическое представление биологически активного димерного пептида (мономер обозначен здесь как апоциклин-A; Cys-Cys-Arg-Gly-Asp-Val-Leu-Asp-Cys). На фиг. 2 показано ингибирование мультимерным циклическим 9-членным пептидом апоциклиномA (Cys-Cys-Arg-Gly-Asp-Val-Leu-Asp-Cys) вызванного AFP апоптоза. Клетки U-937 обрабатывали в лунках планшета для микротитрования в течение 15 мин различными дозами апоциклина-A, и после этого 3 мкм очищенного AFP человека добавляли к каждой лунке. Пролиферацию клеток оценивали при помощи анализа с введением [3H]-тимидина через 24 ч инкубации. На фиг. 3 показано влияние цикличного 9-членного пептида апоциклина-A (Cys-Cys-Arg-Gly-AspVal-Leu-Asp-Cys) на апоптоз, вызванный в клетках U-937 цитотоксическими моноклональными антителами CH-11 против Fas. Клетки в течение 15 мин обрабатывали апоциклином-A в концентрации 500 мкМ и после этого в каждую лунку добавляли различные дозы цитотоксических Mab CH-11 против Fas(Immunotech Ltd). Пролиферацию клеток оценивали при помощи анализа с введением [3H]-тимидина через 16 ч инкубации. На фиг. 4 показано влияние линейных 6-членных пептидов Arg-Gly-Asp-Val-Leu-Asp (RGDVLD) иHis-Gly-Asp-Leu-Leu-Glu (HGDLLE) на опосредованное AFP подавление роста клеток U-937. Клетки в течение 15 мин обрабатывали различными дозами пептидов и после этого в каждую лунку добавляли 3 мкМ очищенного AFP человека. Пролиферацию клеток оценивали при помощи анализа с введением[3H]-тимидина через 24 ч инкубации. На фиг. 5 показано влияние цикличного мономерного 9-членного пептида Cys-Gly-Arg-Gly-AspVal-Leu-Asp-Cys (CGRGDVLDC) на опосредованное AFP подавление роста клеточной линии миелобластомы человека U-937. Клетки в течение 15 мин обрабатывали различными дозами пептида и после этого в каждую лунку добавляли 3 мкМ очищенного AFP-человека. Пролиферацию клеток оценивали при помощи анализа с введением [3H]-тимидина через 24 ч инкубации.-2 010058 На фиг. 6 показано, что цикличный 9-членный пептид апоциклин-A (CCRGDVLDC) увеличивает в бесклеточных цитозольных экстрактах дАТФ-зависимую активацию прокаспазы-3, вызванную низкими дозами эндогенного Cyt-C. Клеточные экстракты из клеток U937 инкубировали в течение 40 мин с различными дозами апоциклина-A и 1 мМ дАТФ. Экстракты, инкубированные без добавок, были взяты в качестве контроля. Активацию каспазы-3 анализировали по расщеплению флуорогенного субстратаDEVD-AFC. На фиг. 7 показано синергическое усиление с помощью AFP человека опосредованной цитохромом(A) AFP вызывает активацию каспазы-3 в бесклеточных цитозольных экстрактах в присутствии дАТФ. Аликвоты полученного из HepG2 цитозольного экстракта (25 мкг белка) обрабатывали AFP(7 мкМ) в течение различных временных интервалов или в качестве контроля с такой же дозой HSA в присутствии дАТФ (1 мМ) и затем оценивали активность по протеолизу субстрата DEVD;(B) Синергическое повышение опосредованной AFP активации каспазы-3 в присутствии субоптимальной дозы экзогенного цитохрома C в цитозольном экстракте клеток HepG2. Аликвоты полученного из HepG2 цитозольного экстракта (25 мкг белка) в течение различных временных интервалов обрабатывали AFP (10 мкМ), цитохромом C (0,2 мкМ) или комбинацией таких же доз обоих соединений в присутствии дАТФ (1 мМ) и затем оценивали активность по протеолизу субстрата DEVD;(C) AFP по-разному воздействует на активацию каспазы-3 в бесклеточных цитозольных экстрактах,вызываемую различными дозами цитохрома C. Аликвоты цитозольного экстракта из S100 (25 мкг белка) в течение 30 мин обрабатывали AFP (10 мкМ) и различными дозами цитохрома C в присутствии дАТФ(1 мМ) и затем оценивали активность по протеолизу субстрата DEVD. Показано среднее значениестандартное отклонение для четырех групп данных. На фиг. 8 показаны эффекты пептидов апоциклина-A CCRGDVLDC, CGRGDVLDC,CCHGDLLEC, RGDVLD и HGDLLE на дАТФ-зависимую активацию каспазы, вызванную Cyt-C, в бесклеточных цитозольных экстрактах клеток HepG2 при высокой дозе (165 нМ) эндогенного цитохромаC (A) и низкой дозе (110 нМ) эндогенного цитохрома C (В). Пептиды в высокой концентрации 750 мкМ добавляли к клеточному экстракту за 15 мин до добавления цитохрома C. За активацией каспазы следили по расщеплению специфичного для каспазы-3 флуорогенного субстрата DEVD-AMC. На фиг. 9 показано, что мультимерный 9-членный пептид апоциклин-A (CCRGDVLDC) отменяет опосредованную цитохромом C/AFP активацию каспазы-3 в бесклеточной системе. Аликвоты полученных из HepG2 цитозольных экстрактов предварительно обрабатывали в течение 15 мин апоциклином-A в концентрации 750 мкМ и затем обрабатывали в течение 40 мин 10 мкМ AFP и/или 110 нМ (А) или 80 нМ(B) цитохрома C в присутствии 1 мМ дАТФ. За активацией каспазы следили по расщеплению специфичного для каспазы-3 флуорогенного субстрата DEVD-AMC. Подробное описание изобретения Предмет изобретения относится к пептидам, и в частности к искусственным синтетическим мультимерным циклическим пептидам, способным к регуляции апоптотической гибели клетки. Более конкретно, оно относится к оригинальной аминокислотной последовательности молекулы -фетопротеина человека (AFP) или альбумина человека, ответственной за регуляцию апоптоза в клетках опухоли.AFP представляет собой ассоциированный с опухолью эмбриональный гликопротеин, демонстрирующий широкий диапазон биологических активностей, охватывающих регуляцию роста клетки, дифференцировку незрелых клеток, иммуносупрессию активированных иммунных клеток, специфичную индукцию апоптоза в опухоли и регуляцию апоптотических сигналов, опосредуемых другими факторами, регуляцию экспрессии генов. Недавно было показано, что AFP может вызывать избирательный апоптоз опухолей посредством прямой или непрямой активации каспазы-3 в клетках и в бесклеточной системе (Dudich et al., 1999, J. Eur. Biochem. 266, 750-761; Semenkova et al. (2003), J. Eur. Biochem. 270: 276282). По настоящему изобретению активный участок таких эффектов обнаружили в AFP, а также в альбумине. Были смоделированы пептиды, формирующие активный центр, и проведен скрининг биологической активности большого количества синтетических природных и неприродных пептидов. Пептиды по настоящему изобретению можно использовать для ингибирования различных типов клеточной гибели, которая зависит от активации опосредованного цитохромом C каспазного каскада,например апоптоза, вызываемого окислительным стрессом, лекарственными средствами, цитокинами,лигандом Fas, -фетопротеином. Пептиды можно использовать для предотвращения апоптоза в культурах клеток, для увеличения сохранности органов для трансплантации, для предотвращения иммунологических аутоиммунных нарушений и синдрома иммунодефицита, вызванного вирусной инфекцией, побочных цитотоксических эффектов после химиотерапии и лучевой терапии. Также представлены аминокислотные последовательности пептидов и способы создания и использования пептидов. Самыми активными структурами пептидов являются искусственные синтетические пептиды, имеющие жесткую молекулярную структуру, подобную В настоящем изобретении предпринята попытка определить активный участок молекулы AFP, ответственный за инициацию апоптоза в раковых клетках, используя теоретические и экспериментальные подходы. Была предложена гипотеза, что активный пептид, моделирующий активный участок, мог бы непосредственно вызывать апоптоз в целых клетках и инициировать активацию каспазы-3 в бесклеточной системе или мог бы модулировать апоптотические сигналы, вызванные AFP и/или другими апоптотическими факторами, такими как антитела против Fas или цитохром C. Удивительно, что синтетический цикличный пептид Cys-Cys-Arg-Gly-Asp-Val-Leu-Asp-Cys (обозначаемый здесь как апоциклин-A), созданный по образцу части молекулы AFP, имеющий достоверную гомологию с некоторыми каспазами,как оказалось, был биологически активным. Ряд замен в последовательности аминокислот апоциклина-A был предпринят для идентификации функционально важных аминокислот. Также синтезировали большое количество пептидов, родственных с апоциклином-A. Все пептиды проверяли на их способность влиять на выживание опухолевых клеток в культуре и влиять на активацию каспазы в бесклеточных цитозольных лизатах. Следующая стадия проверки пептидов была предпринята для исследования способности пептидов влиять на апоптоз, вызванный AFP, антителами против Fas в целых клетках и модулировать активацию каспазы, опосредованную Cyt-C, в бесклеточной системе. Продемонстрировали, что 9-членный пептид апоциклин-A, соответствующий последовательностиAFP 251-259, полностью останавливал опосредованный AFP апоптоз в клетках опухоли in vitro и значительно модулировал опосредованную Cyt-C и AFP активацию каспазы в бесклеточных цитозольных экстрактах. Более определенно, в бесклеточной системе, апоциклин-A значительно увеличивал активацию каспазы, опосредованную низкой дозой цитохрома C и уменьшал эффекты, вызванные высокой дозой цитохрома C. Более короткий 6-членный пептид р 25 частично сохранил данную активность в бесклеточной системе, но не в целых клетках. Также продемонстрировано, что полученные из AFP пептиды проявили взаимный антагонизм в регулировании опосредованной Cyt-C активации каспазы в клеточных экстрактах. Было показано, что 9-членный пептид апоциклин-A умеренно усиливал опосредованные низкой дозойCyt-C эффекты и значительно ингибировал активацию каспазы, инициированную высокими дозами экзогенного или эндогенного цитохрома C. Такие данные показывают, что полученный из AFP 9-членный пептид апоциклин-A является минимальной частью AFP, которая ответственна за специфическое связывание с неизвестными цитозольными молекулами, вовлеченными в передачу сигналов апоптоза. Описанная структура данного пептида и его искусственная природа подразумевает, что он может быть активным компонентом нового лекарственного средства, которое препятствует действию различных апоптотических факторов in vitro и in vivo. Применение данного пептида охватывает предотвращение апоптоза в культивируемых клетках, способы предотвращения иммунологического отторжения аллогенных трансплантатов и аутоиммунных реакций, способы, позволяющие избежать гепатологического септического шока, и апоптоз, вызванный терапией цитокинами и т.д. Сокращения для аминокислот, используемые здесь, приведены в следующей таблице. Для того чтобы обнаружить минимальную часть молекулы AFP, которая ответственна за апоптоз,сигнальные пептиды, содержащие от 6 до 10 остатков, были получены посредством твердофазной химииF-MOC. Также синтезировали подобные пептиды, соответствующие гомологичной последовательности альбумина сыворотки человека (HSA). Для всех пептидов оценивали их регулирующую рост активность в целых клетках в культуре и также проверяли их способность непосредственно влиять на активацию каспазы в бесклеточных цитозольных экстрактах. Дополнительно пептиды оценивали на их способность-4 010058 модулировать апоптоз, вызванный AFP и цитотоксическими Mab CH-11 против Fas в целых клетках, и также влиять на вызванную Cyt-C активацию каспазы в бесклеточной системе. Искусственный цикличный пептид CCRGDVLDC (звездочки обозначают возможную дисульфидную связь), содержащий мотив Arg-Gly-Asp (RGD), соответствующий последовательности 251-259 -фетопротеина человека (AFP),гомологичный цикличный пептид с заменой Cys252 на Gly CGRGDVLDC и линейный пептидRGDVLD, соответствующий остаткам 253-258, были получены посредством твердофазной химииF-MOC. Гомологичные цикличные пептиды из последовательности альбумина сыворотки человекаCCHGDLLEC, CGHGDLLEC и линейный пептид HGDLLE также синтезировали и использовали в качестве функциональных контролей. Необходимо признать, что пептиды, содержащие только последовательность RCD, значительно отличаются от пептидов по настоящему изобретению. Мультимерный цикличный пептид, содержащий RGD, из AFP CCRGDVLDC (здесь апоциклинA) способен остановить апоптоз в клетках опухоли in vitro. Было продемонстрировано, что апоциклин-A полностью останавливал вызванный AFP апоптоз в клетках миелобластомы человека U937 и значительно ингибировал опосредованную антителами против Fas гибель клетки. Кроме того, была оценена способность полученных из AFP пептидов апоциклина-A и линейного 6-членного пептида RGDVLD влиять на активацию каспазы, вызванную Cyt-C и AFP в бесклеточной системе. Было обнаружено, что апоциклин-A заметно увеличивал дАТФ-зависимую активацию каспазы, вызванную низкими дозами эндогенного или экзогенного Cyt-C, и фактически полностью останавливал активацию каспазы, вызванную высокими апоптотически активными дозами Cyt-C. Также продемонстрировали, что апоциклин-A останавливал вызванную AFP активацию каспазы-3, зависимую от Cyt-C/дАТФ, в бесклеточных цитозольных экстрактах клеток HepG2. Линейный, полученный из AFP 6-членный пептид RGDVLD не показал никакой регулирующей апоптоз активности в целых клетках, но был способен останавливать опосредованную Cyt-C/AFP активацию каспазы в бесклеточной системе. Хорошо известным и обычно используемым подходом для того, чтобы заблокировать определенные функциональные участки биологически активных белков, таких как рецепторы, является использование соответствующих блокирующих антител против них. Такие антитела создают на своихFab-фрагментах структуры, которые точно соответствуют рецепторному участку. С другой стороны,можно создать антиидиотипические антитела, чтобы они соответствовали первичным Fab-фрагментам. Следовательно, антиидиотипическое антитело имеет сходство с активным центром рецептора. Согласно настоящему изобретению AFP и альбумин содержат специальный активный участок, который соответствует рецепторам, инициирующим цикл гибели клетки, и блокирует их. Следовательно, определенная часть AFP/альбумина, обнаруженного в настоящем изобретении, имеет структуру, блокирующую участок инициации. Следовательно, антиидиотипическое антитело против активного участка AFP и/или альбумина содержит значительную структурную информацию о молекуле, способной заблокировать рецептор гибели клетки. Такую 3-D структуру можно выявить обычной рентгеновской кристаллографией и/или молекулярным компьютерным моделированием по данным о последовательности. Основная суть настоящего изобретения заключается в том, что был обнаружен апоптотически активный участок в двух важных и присутствующих в большом количестве белках млекопитающих, т.е. вAFP и альбумине. На основе данных результатов был разработан ряд молекулярных структур для блокирования инициирующего гибель клеток рецептора в клетках млекопитающих. Исследуемые молекулы представляли собой пептиды для облегчения их синтеза, но понятно, что можно создать другие молекулы, основанные на синтетических или природных соединениях. Одинаково хорошо можно конструировать молекулярные структуры на основе других, особенно на неиммунногенных, молекулах-носителях. Главным практическим результатом настоящего изобретения является цикличный пептид из AFP,CCRGDVLDC (апоциклин-A), который содержит два функциональных активных участка: RGD иDVLD. Обе последовательности непосредственно вовлечены в регуляцию активности каспазы и апоптоз. Содержащие RGD белки или пептиды, как известно, вовлечены во взаимодействие с молекулами интегринов и могут использоваться для ингибирования внутриклеточных контактов, влияя таким образом на пролиферацию клеток и апоптоз. Апоциклин-A отличается от других содержащих RGD пептидов мультимерным представлением данного участка в циклической форме. Это позволяет увеличить общий эффект при мультимерном представлении последовательности RGD. Последовательность DVLD расположена в апоциклине-A сразу же после RGD и представляет собой хорошо известный участок расщепления для каспазы-3, -7 и -2. Следовательно, она имеет структуру, типичную для субстратов каспаз, DXXD (Garcia-Calvo M., et al. (1998), J. Biol. Chem. 32608-13). В апоциклине-A данный участок может связываться с активным центром каспазы-3 в качестве пептидного субстрата. Похожую активность можно также приписать полной молекуле AFP, но для этого будут необходимы конформационные изменения, позволяющие открыть для контакта соответствующий участок для проявления модулирующей апоптоз активности (Semenkova et al. (2003), Eur. J. Biochem. 270, 276-282). Способность апоциклина-A ингибировать активность каспазы-3 в бесклеточной системе можно объяснить наличием подобной субстрату аминокислотной последовательности, которая способна связаться и заблокировать активные центры соответствующих каспаз. Кроме того, участок DVLD апоциклина-A мог бы избирательно способствовать высвобождению каспазы-3 из апоптосомного комплекса,-5 010058 нарушая взаимодействие между XIAP и процессированной каспазой-3 на подобие типичного тетрапептидного ингибитора каспазы-3 DEVD-cho (Bratton, S.В., et al. (2001), EMBO J. 5, 998). Уникальная природа апоциклина-A заключается в его цикличной структуре, которая позволяет осуществить мультимерное представление последовательности субстрата и увеличивает общий эффект посредством одновременного взаимодействия с различными молекулами, вовлеченными в передачу сигнала апоптоза. Далее изобретение проиллюстрировано ниже неограничивающими примерами. Пример 1. Синтез пептидов. Пептиды синтезировали на синтезаторе Model 430A; Applied Biosystems, Foster City, CA, USA согласно обычным способам пептидного синтеза. Цикличные пептиды сначала получали самопроизвольным образом из линейных пептидов в водных растворах, подвергаемых воздействию атмосферного кислорода, и очищали из раствора при помощи ВЭЖХ по общепринятой процедуре, используемой для пептидов. 1. Цикличный мультимерный 9-членный пептид, соответствующий аминокислотной последовательности 251-259 AFP человека Cys-Cys-Arg-Gly-Asp-Val-Leu-Asp-Cys, CCRGDVLDC (звездочки обозначают возможную дисульфидную связь), который будет обозначаться здесь как апоциклин-A. Второй цистеин Cys252 способен к образованию S-S связи между двумя соседними цикличными мономерными пептидами. Молекулярная масса мономерного цикличного пептида составляла 983 Да. Пептид апоциклин-A состоит из двух или более (менее чем 5) кольцеподобных 9-членных пептидных структур,соответствующих последовательности Cys-Cys-Arg-Gly-Asp-Val-Leu-Asp-Cys 2. Цикличный мономерный пептид Cys-Gly-Arg-Gly-Asp-Val-Leu-Asp-Cys (звездочки обозначают возможную дисульфидную связь), соответствующий аминокислотной последовательности 251-259 AFP человека с одной аминокислотной заменой Cys252 на Gly для того, чтобы избежать мультимеризации пептидов при образовании S-S связей между мономерами. Молекулярная масса мономерного цикличного 9-членного пептида составляла 937 Да. 3. Линейный пептид из AFP, соответствующий последовательности 253-259, Arg-Gly-Asp-Val-LeuAsp (253-259). Молекулярная масса мономерного пептида составляла 674 Да. 4. Цикличный пептид из HSA (альбумина сыворотки человека) Cys-Cys-His-Gly-Asp-Leu-Leu-GluCys, CCHGDLLEC (M. м.: 992); 5. Цикличный пептид из HSA Cys-Gly-His-Gly-Asp-Leu-Leu-Glu-Cys, CGHGDLLEC (M. м.: 946). В данном пептиде Cys252 заменен на Gly. 6. Линейный пептид р 26 из HSA: His-Gly-Asp-Leu-Leu-Glu, HGDLLE (M. м.: 683). Реагенты. Флуорогенные пептидные субстраты DEVD-AMC и LEHD-AFC получали из Alexis Biochemicals(San Diego, USA). Цитохром C сердца быка (Cyt-C), аденилнуклеотидтрифосфат (дАТФ) и другие реактивы получали из Sigma Chemical Co. AFP человека выделяли из пуповинной сыворотки, используя ионообменную, аффинную хроматографию и хроматографию гель-фильтрацией, как описано у Dudich et al.(1999), Biochemistry, 38: 10406-10414. Чистоту AFP устанавливали посредством PAGE и Rocketэлектрофореза с использованием моноспецифичных антител против AFP человека и зрелых белков сыворотки и было показано, что она составляла не менее 99,8%. Приготовление бесклеточного экстракта. Клетки гепатокарциномы человека HepG2 и клеточную линию монобластомы человека U937 получали из американской коллекции типовых культур. Клеточные экстракты готовили, лизируя клетки в гипотоническом буфере для экстракции. Для того чтобы получить цитозольную фракцию S-100, клеточный лизат центрифугировали в течение 1 ч при 100000g. Экстракты либо использовали сразу же, либо замораживали при -70C для использования позднее. Бесклеточные реакции. Бесклеточные реакции, как правило, проводили в реакционных объемах 13 мкл. Апоптоз вызывали введением различных доз цитохрома C из сердца быка и/или очищенного AFP человека в присутствии 1 мМ дАТФ. Для реакций емкостью 13 мкл, 10 мкл экстракта клеток (2-4 мг/мл, как определили анализом по Брэдфорду) дополняли 1 мкл дАТФ, 1 мкл Cyt-C и/или раствором AFP в реакционном буфере для того, чтобы получить необходимую конечную концентрацию реагентов. Для оценки активности пептидов различные дозы пептидов, растворенных в реакционном буфере вместе с 1 мМ дАТФ, добавляли к клеточному экстракту. Для того чтобы определить способность пептидов модулировать апоптотические эффекты Cyt-C и AFP, пептиды добавляли к экстракту за 10 мин до добавления цитохрома C или AFP. Контрольные образцы инкубировали с равным объемом буфера (3 мкл) без добавления реагентов. Для-6 010058 того чтобы инициировать апоптоз, экстракты инкубировали при 37C в течение 40 мин. Определение активности каспазы. В конце реакции активации каспазы аликвоты экстракта (5 мкл) дополняли флуорогенным субстратом DEVD-AMC (3 мМ) и затем инкубировали в течение определенных интервалов времени (0,5-1 ч) при 37C. Реакции прекращали разбавлением, добавляя 2,0 мл охлажденного на льду 0,2 мМ натрийфосфатного буфера, pH 7,5, за которым следовало измерение флуоресценции на флуориметре PerkinElmer MPF-44A (exc=365 нм и em=440 нм). Интенсивность флуоресценции для каждого образца нормализовали по отношению к концентрации цитозольных белков. Активацию каспазы представляли как отношение нормализованной интенсивности флуоресценции образца к соответствующему значению, измеренному с контрольным образцом. Индукция апоптоза. Клетки U937, 4103 клеток/лунку, помещали в плоскодонный 96-луночный планшет (Costar) в полной среде и инкубировали в течение 2 ч перед добавлением реагентов. Затем клетки обрабатывали в течение 24 ч различными дозами AFP, растворенного в PBS, и затем оценивали пролиферацию. Обработку клеток цитотоксическими антителами IgM CH-11 против Fas проводили, как описано ранее. Клетки U937 обрабатывали антителами CH-11 в концентрации 50 нг/мл в течение 18 ч. Клетки оставляли без обработки или обрабатывали реагентами в течение соответствующих интервалов времени и в течение последних 4 ч культивирования подвергали их воздействию [3H]-тимидина (1 Ки/ммоль/лунку). Экспериментальные данные выражали как процент включения [3H]-тимидина в культурах клеток в трех повторах относительно контроля среды. В качестве контроля были взяты клетки, культивированные без дополнений. Анализ активности пептидов. Для анализа регулирующей рост активности пептидов, различные дозы пептидов добавляли к клеткам в течение 24 ч, и затем анализировали пролиферацию клеток, жизнеспособность клеток и фрагментацию ДНК. Для того чтобы определить способность пептидов модулировать апоптоз, вызванный другими факторами, клетки Jurkat обрабатывали антителами CH-11 в концентрации 20 нг/мл без ActD, клетки Raji обрабатывали CH-11 в присутствии 0,5 мкг/мл ActD в течение 18 ч. Для индукции апоптозаTNF- клетки (Jurkat, MCF7 или U937) обрабатывали в течение 24 ч цитокинами в концентрации 25 нг/мл и затем анализировали пролиферацию или жизнеспособность, как описано выше. Клетки HepG2 предварительно отмывали перед добавлением TNF свежеприготовленной средой для того, чтобы удалить эндогенные факторы роста. Пример 2. Идентификация специфичного для каспазы-3 содержащего RGD активного участка AFP человека, ответственного за передачу сигнала апоптоза. Для того чтобы определить функционально важные аминокислоты в молекуле AFP, авторы изобретения определили аминокислотную гомологию последовательности AFP человека и каспазы-3 и -1 и сконструировали структуру пептидного аналога предполагаемого активного участка. Изучали наложение следующих последовательностей: Из сравнения наложения последовательностей видно, что AFP имеет определенную гомологию с ферментативным активным центром каспазы 1 и 3. Ферментативно активные участки каспазы 1 и 2 содержат мотив RGD, который расположен перед каталитически активным остатком Cys. Эффекторные каспазы 3 и 7 имеют в данном месте мотив RGT, но положение остатков Cys полностью совпадает в молекуле AFP и в casp-3 и casp-7. Принимая во внимание, что AFP имеет межцепочечную дисульфидную связь между Cys252 и Cys259 (Morinaga, et. al. (1983), Proc. Natl. Acad. Sci. USA, 80: 4604-4608), авторы изобретения предложили гипотезу о расположении подобного каспазе активного участка молекулы AFP где-то между остатками Cys251-Cys259. Необходимо отметить, что casp-3, -7 и -8 также имеют мотивыRGD, но они расположены в других каталитически активных положениях (Bukley, et al. (1999), Nature,397: 534-539). Свободный цистеин Cyы 258 в составе структуры пептида несомненно мог бы образовать межцепочечные дисульфидные связи между двумя соседними пептидами (фиг. 1). Для того чтобы доказать наличие функционально важных аминокислот в петле Cys251-Cys259 в молекуле AFP, авторы изобретения сконструировали структуру пептидного аналога предполагаемого активного участка. В качестве контроля также синтезировали гомологичные пептиды из HSA.-7 010058 Пример 3. Цикличный пептид из AFP апоциклин-A останавливает вызванный AFP апоптоз в клетках U937. Ранее опубликованные данные демонстрируют, что AFP различного происхождения (эмбриональный или полученный из среды культивирования клеточной линии гепатомы HepG2) может вызывать зависимое от дозы подавление роста и программируемую гибель клеток в различных опухолевых клеточных линиях, характеризующуюся классическими признаками апоптоза, такими как значительное подавление роста, цитотоксичность и фрагментация ДНК (Dudich et al. (1999), J. Eur. Biochem. 266, 750-761). Для того чтобы определить возможное расположение активного участка в молекуле AFP, который ответственнен за передачу сигнала апоптоза, авторы изобретения проверили способность различных пептидов,полученных из AFP, блокировать данный эффект. На фиг. 2 демонстрируется, что полученный из AFP пептид апоциклин-A полностью останавливает вызванный AFP апоптоз в клетках U-937. Более того,предварительная обработка в течение 15 мин клеток U-937 апоциклином-A (1 мМ) вызывала 15% стимуляцию пролиферации относительно контроля среды. Это означает, что апоциклин-A также останавливает самопроизвольный апоптоз клеток во время 24-часового культивирования. Пример 4. Апоциклин-A значительно ингибирует апоптоз, вызванный антителами против Fas в клетках U-937. Для проверки специфичности к AFP, авторы изобретения проверили, может ли апоциклин-A влиять на апоптоз, вызванный другими факторами. Апоптоз в клетках U-937 вызывали различными дозами цитотоксических моноклональных антител IgM CH-11 против Fas. Ha фиг. 3 продемонстрировано, что 0,5 мМ апоциклин-A значительно ингибирует опосредованный антителами против Fas апоптоз, отменяя приблизительно 50% общего эффекта. Увеличение концентрации апоциклина-A до 1 мМ вызывало более значительное ингибирование вызванного антителами против Fas апоптоза. Известно, что внутриклеточные пути метаболизма, вовлеченные в различные типы апоптоза, являются общими для большинства апоптотических факторов. Данные авторов изобретения указывают на то, что апоциклин-A нейтрализует действие зависимых от AFP и Fas метаболических путей передачи сигнала апоптоза, взаимодействуя с определенным рецептором, который вовлечен двумя факторами в передачу сигнала апоптоза. Пример 5. Определение функционально важных аминокислот в активном участке молекулы AFP.a) Полученные из AFP пептиды. Цикличный пептид CGRGDVLDC с заменой Cys252 на Gly и 6-членный пептид RGDVLD сконструировали для того, чтобы определить функционально важные аминокислоты в последовательности функционально важного активного участка, который ответственен за передачу сигнала апоптоза. На фиг. 4 продемонстрировано влияние CGRGDVLDC на апоптоз, опосредованный AFP в клетках U-937. Данный пептид не отменяет опосредованную AFP цитотоксичность. Точно такие же результаты получили для RGDVLD (фиг. 4). Эти данные указывают на то, что Cys252 является функционально важной аминокислотой, и его замена на Gly полностью аннулирует способность пептида взаимодействовать с апоптотической активностью полной молекулы AFP. Более короткий пептид RGDVLD также не способен регулировать опосредованный AFP апоптоз, показывая необходимость цикличной структуры для образования апоптотического активного участка.b) Полученные из HSA пептиды. Альбумин, как известно, имеет достоверную гомологию с AFP (Morinaga, et al. Proc. Natl. Acad. Sci.USA, 80: 4604-4608). Также была обнаружена гомология в области предполагаемого активного участка,который моделировали пептидом апоциклином-A. Авторы изобретения сконструировали следующие пептиды из последовательности HSA: цикличные пептиды CCHGDLLEC, CGHGDLLEC (с единичной заменой Cys на Gly) и линейный 6-членный пептид HGDLLE. Авторы изобретения также проверили способность данных пептидов влиять на вызванный AFP апоптоз в целых клетках подобно тому, как описано выше (табл. 1). На фиг. 5 продемонстрировано, что CCHGDLLEC имеет схожую с апоциклином-A активность останавливать опосредованный AFP апоптоз в клетках U-937. HGDLLE иCGHGDLLEC не влияли на ответ клеток на AFP.-8 010058 Таблица 1 Влияние полученных из AFP и HSA пептидов на рост клеток и вызванный Цикличные пептиды. 1) Непосредственное влияние петпида при дозе 1 мМ на пролиферацию клеток U-937 (в %) от контроля без добавок. Пример 6. Апоциклин-A действует совместно с низкими субоптимальными дозами эндогенного цитохрома C для того, чтобы вызвать активацию каспазы в бесклеточной системе. Для того чтобы определить может ли апоциклин-A действовать подобно целой молекуле AFP для обеспечения активации каспазы в бесклеточной системе, авторы изобретения создали такую же бесклеточную систему, как описано выше, но вместо AFP использовали цикличный пептид апоциклин-A. На фиг. 8 продемонстрировано, что апоциклин-A синергично увеличивает общую активность каспазы-3 в бесклеточной системе в присутствии низких субоптимальных доз эндогенного цитохрома C и дАТФ. Без добавления дАТФ апоциклин-A был не способен вызывать протеолитическую активность в отношенииDEVD в тех же самых экспериментальных условиях. Такой же эффект наблюдали для полной молекулыAFP в "молчащих" бесклеточных экстрактах. Эти данные показывают, что авторам изобретения удалось идентифицировать активные участки AFP и альбумина, ответственные за их стимулирующую апоптоз активность. Пример 7. AFP действует синергично с низкими субоптимальными дозами цитохрома C и дАТФ при активации каспазы-3 в цитозольных клеточных экстрактах. Авторы изобретения далее проверяли способность AFP вызывать активацию каспазы в бесклеточной системе. Добавление AFP в цитозольный экстракт S-100 инициировало зависимую от дАТФ индукцию специфичной для каспазы-3 протеолитической активности в отношении DEVD, которая постепенно увеличивалась в течение по крайней мере 2 ч (фиг. 7A). В качестве контроля равное количество альбумина сыворотки человека (HSA) добавляли в такую же бесклеточную систему и показали отсутствие его влияния на уровень DEVD-протеолизной активности. Низкая степень DEVD-протеолизной активности также была вызвана одним дАТФ и происходила, очевидно, вследствие наличия небольшого количества эндогенного Cyt-C в препаратах. При отсутствии дАТФ AFP совсем не вызывает никакой активации каспазы. Для того чтобы определить, может ли AFP непосредственно вызывать активацию каспазы в цитозольных экстрактах клеток или для этого необходимо присутствие низкого уровня Cyt-C, авторы изобретения исследовали DEVD-протеолизную активность после добавления экзогенного Cyt-C в "молчащий" цитозольный экстракт с неподдающимся определению уровнем эндогенного цитохрома C. На фиг. 7 В показано, что никакой DEVD-протеолизной активности не выявлено в данном типе цитозольного лизата после 2 ч обработки в присутствии дАТФ и низкой субоптимальной дозы Cyt-C. Тем не менее, добавление AFP (7 мкМ) в эту же самую реакционную систему инициировало процесс активации каспазы, которая постепенно увеличивалась зависимым от времени образом (фиг. 7 В). Пример 8. Отмена апоциклином-A опосредованной Cyt-C/AFP активации каспазы в бесклеточной системе. На фиг. 8 показано, что эффекты апоциклина-A на активацию каспазы-3 опосредованы различными дозами цитохрома C и AFP. Высокая доза пептида (750 мкМ) значительно (50-70%) ингибировала активацию каспазы, вызванной высокими дозами эндогенного цитохрома C (фиг. 8A). Комбинированная обработка цитозольной фракции цитохромом C/AFP приводила к значительному повышению общейDEVD-протеолизной активности (фиг. 8 А и В). Добавление апоциклина-A ингибировало опосредованную Cyt-C/AFP активацию каспазы на 60-80%. Эти данные указывают на то, что апоциклин-A действует в бесклеточной системе обратным образом по сравнению с целой молекулой AFP, отменяя общий эффект активации каспазы, вызванный одним только Cyt-C или в комбинации с AFP. Следовательно, апоциклин-A представляет собой последовательность молекулы AFP, которая ответственна за его апоптотическую активность и за взаимодействие с членами апоптосомного комплекса.-9 010058 Пример 9. Влияние полученных из AFP и полученных из HSA пептидов на от дАТФ-зависимую опосредованную Cyt-C активацию каспазы в бесклеточных цитозольных экстрактах. Для того чтобы проверить способность различных пептидов влиять на активацию каспазы, вызванную экзогенным цитохромом-C в бесклеточной системе, авторы изобретения использовали цитозольные клеточные экстракты клеток HepG2. Аликвоты клеточных экстрактов предварительно обрабатывали пептидами в концентрации 750 мкМ в течение 15 мин и после этого вводили в реакционную смесь различные дозы цитохрома-C, чтобы вызвать активацию каспазы. Экстракты для контроля инкубировали с дАТФ без пептидов и цитохрома-C, но они не проявляли никакой каспазной активности. На фиг. 9 А видно, что пептиды из AFP, 9-членный пептид апоциклин-A и 6-членный пептид RGDVLD, а также и 6-членный пептид из HSA, HGDLLE, вызывали значительное ингибирование опосредованной высокими дозами цитохрома-C активации каспазы. С другой стороны, цикличный мономерный 9-членный пептид с единичной аминокислотной заменой CGRGDVLDC, а также и цикличный мультимерный пептид изHSA CCHGDLLEC, не показали никакой ингибирующей апоптоз активности ни в целых клетках, ни в бесклеточной системе. Следовательно, самый эффективный пептид апоциклин-A действительно воспроизводит активный участок AFP, который ответственен за передачу сигналов апоптоза. Определенно отличающийся эффект получили для активации каспазы, вызванной низкой дозой цитохрома C. На фиг. 9 В показано, что апоциклин-A приводит к такой же стимуляции, как и полноразмерная молекула AFP, при вызванной низкой дозой цитохрома C активации каспазы. Пептиды CGRGDVLDC и CCHGDLLEC не влияли на активность при низкой дозе цитохрома C, но пептиды RGDVLD и HGDLLE демонстрировали значительную отмену вызванной цитохромом C активации каспазы. В табл. 2 просуммированы экспериментальные данные, характеризующие активность пептидов в бесклеточных цитозольных экстрактах. Таблица 2 Модуляция различными пептидами опосредованной Cyt-C активности Пример 10. Получение антиидиотипических антител против биологически активного участка AFP. Для иммунизации, объединения клеток и получения асцитной жидкости использовали мышейBALB/C. Двадцать мышей иммунизировали эмульсией высоко очищенного AFP человека (40 мкг) в полном адъюванте Фрейнда. Мышей стимулировали с интервалом в 2 недели тем же самым количествомAFP, эмульгированного в неполном адъюванте Фрейнда. Мышей с самым высоким ответом против AFP человека отбирали и внутривенно вводили им в хвосты 80 мкг AFP в 100 мкл раствора AFP, содержащего 50 мкл неполного адъюванта Фрейнда. Через три дня готовили клетки селезенки и смешивали с клетками миеломы мыши NS-1, после чего следовала обработка PEG в среде КС, содержащей FCS. Объединенные клетки выращивали в среде HAT, содержащей FCS, после чего следовало культивирование в среде HT. Гибридомы проверяли на их способность производить антитела при помощи анализа TR-FIA,вовлекая поликлональное антитело кролика в качестве иммобилизированного захватывающего антитела- 10010058 и меченное европием антитело против человека в качестве антитела для мониторинга (для технических деталей и реактивов, см. публикацию Peuravuori, H. and Korpela, T. et al. Clin.Chem. 1993, 39, p. 847-848). Среди клонов, продуцирующих антитела, клоны, которые не были чувствительны к введению пептидаCCRGDVLDC и его циклических форм, отбрасывали. Клоны, показывающие хороший ответ, выращивали до достаточного количества для того, чтобы можно было ввести их мышам для получения асцитной жидкости. Подготавливали асцитную жидкость и выделяли из нее моноклональные антитела противAFP. Очищенные антитела подвергали протеолизу для того, чтобы получить Fab-фрагменты из выбранных клонов общеизвестными способами (для знакомства с методиками см. статью Muronetz and Korpela,J. Chromatogr. 2003, 790, pp. 53-66). C Fab-фрагментами производили ту же процедуру, что и для AFP, как описанно выше, для того чтобы получить моноспецифичные антитела против Fab-фрагментов. С данными антиидиотипическими антителами против активного участка AFP проводили скрининг клонов на их чувствительность к пептидам активного участка AFP. Антиидиотипическое антитело против активного участка альбумина человека в положении по последовательности 246-254 можно было бы сделать, по существу, теми же самыми методиками, что и против AFP, описанными выше. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Пептид, представляющий собой фрагмент белка, который распознается антиидиотипическим антителом против апоптотически активного участка -фетопротеина человека, соответствующего аминокислотной последовательности 251-259 данного белка, или антиидиотипическим антителом против альбумина человека к последовательности 246-254 альбумина человека. 2. Пептид, соответствующий активному центру -фетопротеина или альбумина человека, имеющий аминокислотную последовательность CCRGDVLDCnXmY, или CCHGDLLECnXmY, в которой X обозначает любую гидрофобную аминокислоту и Y обозначает любую гидрофильную аминокислоту, индекс n равен 0, 1, 2 или 3 и индекс m равен 0, 1, 2 или 3. 3. Пептид по п.2, где пептид дополнительно содержит на N-конце 0, 1, 2 или 3 фланкирующих остатка цистеина и 0, 1, 2 или 3 фланкирующих остатка цистеина на C-конце. 4. Пептид по п.2, имеющий полимеризованную или цикличную структуру, где циклизование или полимеризация осуществляется посредством химического взаимодействия аминокислотных остатков цистеина или других аминокислотных остатков, способных образовывать межмолекулярные сшивки. 5. Пептид по любому из пп.2-4, отличающийся одновременным наличием последовательностейRGD и DXXD в одной и той же молекуле, в которой X обозначает любой гидрофобный аминокислотный остаток и R, G и D обозначают Arg, Gly и Asp соответственно. 6. Пептид по п.5, в котором D в последовательности RGD является общим с последовательностьюDXXD. 7. Пептид по любому из пп.2-6, где любой из X обозначает независимо V, L или W и Y обозначаетD, E или G. 8. Пептид по п.2, включающий последовательность CCRGDVLDC, представленный в линейной,полимеризованной или цикличной форме, где аминокислотные остатки, отмеченные звездочкой, обозначают места образования возможных дисульфидных связей. 9. Пептид по п.2, включающий последовательность CCHGDLLEC, представленный в линейной,полимеризованной или цикличной форме, где аминокислотные остатки, отмеченные звездочкой, обозначают места образования возможных дисульфидных связей. 10. Применение пептида по любому из пп.1-9 для подавления апоптотических регуляторных метаболических путей в клетках животных и человека. 11. Применение пептида по любому из пп.1-9 для увеличения сохранности органов или клеток при их трансплантации. 12. Применение пептида по любому из пп.1-9 для предотвращения возникновения аутоиммунных нарушений и синдрома иммунодефицита, вызванного вирусной инфекцией. 13. Применение пептида по любому из пп.1-9 для снижения цитотоксических эффектов после химио- и лучевой терапии. 14. Применение пептида по любому из пп.1-9 для ингибирования апоптоза нейронных клеток, неспецифичного вызванного лекарственными средствами апоптоза или опосредованного окислительным стрессом апоптоза. 15. Применение пептида по любому из пп.1-9 для предотвращения апоптоза культивируемых клеток, в том числе стволовых клеток костного мозга, мезинхимальных стволовых клеток, эмбриональных стволовых клеток, получаемых для научных, медицинских или технических целей. 16. Косметическая композиция для омоложения кожи и профилактики старения кожи, содержащая пептид по любому из пп.1-9, приемлемые в косметологии носители и наполнители и, необязательно,производные витаминов A, E, Д, антиоксиданты, стероидные гормоны, изофлавиноиды растительного происхождения.- 11010058 17. Применение косметической композиции по п.16 для омоложения кожи и профилактики старения кожи, в том числе вызванного ультрафиолетовым облучением и профилактики солнечной радиации,путем нанесения указанной композиции на кожу индивидуума. 18. Антиидиотипическое антитело или фрагмент антиидиотипического антитела, имеющий паратоп с молекулярной структурой, обеспечивающей распознавание апоптотически активного участка-фетопротеина человека или альбумина сыворотки человека, состоящего из аминокислотных остатков 251-259 последовательности -фетопротеина или аминокислотных остатков 246-254 альбумина. 19. Пептид, имеющий эпитоп или участок связывания с антителами или их фрагментами, определенными в п.18. 20. Белок, содержащий в своей структуре аминокислотную последовательность пептида, определенного в п.19.
МПК / Метки
МПК: A61K 38/00, C07K 16/42, C07K 7/00, A61P 37/00
Метки: каспазы, модулирующие, пептиды, активацию
Код ссылки
<a href="https://eas.patents.su/16-10058-peptidy-moduliruyushhie-aktivaciyu-kaspazy.html" rel="bookmark" title="База патентов Евразийского Союза">Пептиды, модулирующие активацию каспазы</a>
Предыдущий патент: Инактивированная полиомиелитная вакцина, полученная из штамма сейбина вируса полиомиелита
Следующий патент: Flp-опосредованная рекомбинация
Случайный патент: Улучшение роста бифидобактерий в кисломолочных продуктах