Замещенные амидазо [1, 2а] азины как селективные сох-2 ингибиторы
Номер патента: 3399
Опубликовано: 24.04.2003
Авторы: Монсеррат Видаль Карлос, Лагунас Арналь Кармен, Хименес Гвасч Ферран, Фарреронс Гальеми Карлес, Микель Боно Игнасио-Хосе, Фернандес Серрат Ана Мария, Фернандес Гарсия Андрес
Формула / Реферат
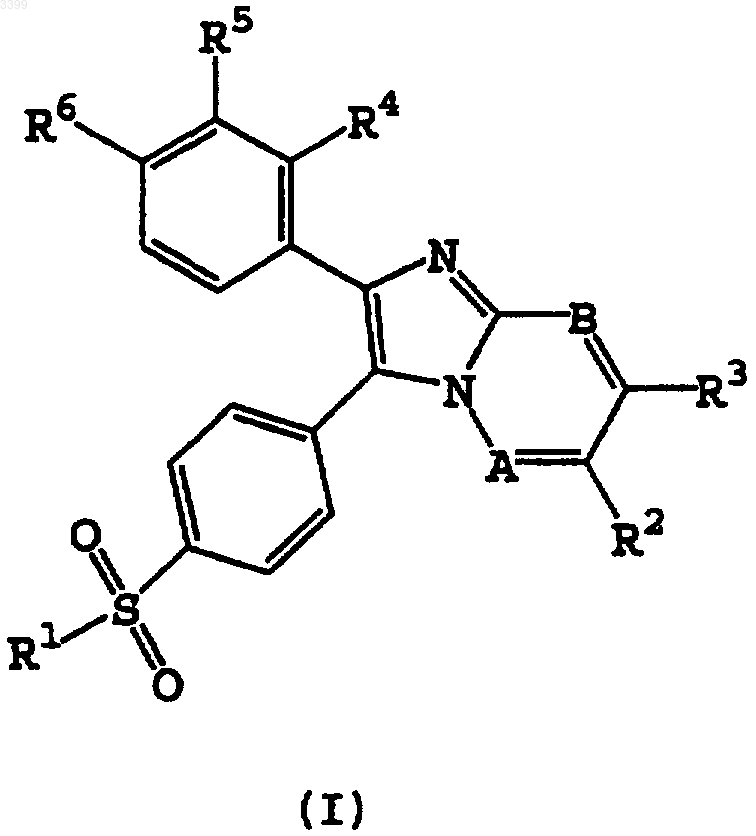
1. Замещенный имидазо[1,2a]азин формулы (I) или его фармацевтически приемлемый сольват и его соль присоединения кислоты, где A и B независимо выбирают из N и CH, при условии, что если A представляет N, тогда B также представляет N; R1 выбирают из группы, состоящей из CH3 и NH2; R2 и R3 выбирают из группы, состоящей из H, CH3, Cl, Br, COCH3 и OCH3; и R4, R5 и R6, каждый независимо, выбирают из группы, состоящей из H, F, Cl, Br, (C1-C3)алкила, трифторметила, (C1-C3)алкокси и трифторметокси.
2. Соединение по п.1, в котором A представляет CH и B представляет N.
3. Соединение по п.2, в котором R4, R5, и R6 выбирают из группы, состоящей из H, F, Cl, метила, изопропила, метокси и этокси.
4. Соединение по п.3, в котором указанное соединение выбирают из группы, состоящей из
(Ia) 2-фенил-3-(4-метилсульфонилфенил)имидазо[1,2a]пиримидина;
(Ib) 2-(4-метилфенил)-3-(4-метилсульфонилфенил)имидазо[1,2a]пиримидина;
(Ic) 2-(4-фторфенил)-3-(4-метилсульфонилфенил)имидазо[1,2a]пиримидина;
(Id) 2-(4-хлорфенил)-3-(4-метилсульфонилфенил)имидазо[1,2a]пиримидина;
(Ie) 2-(4-бромфенил)-3-(4-метилсульфонилфенил)имидазо[1,2a]пиримидина;
(If) 2-(4-метоксифенил)-3-(4-метилсульфонилфенил)имидазо[1,2a]пиримидина;
(Ig) 2-(4-этоксифенил)-3-(4-метилсульфонилфенил)имидазо[1,2a]пиримидина;
(Ih) 2-(3,4-диметилфенил)-3-(4-метилсульфонилфенил)имидазо[1,2a]пиримидина;
(Ii) 2-(3-метил-4-метоксифенил)-3-(4-метилсульфонилфенил)имидазо[1,2a]пиримидина;
(Ij) 2-(3-фтор-4-метоксифенил)-3-(4-метилсульфонилфенил)имидазо[1,2a]пиримидина;
(Ik) 2-(3-хлор-4-метоксифенил)-3-(4-метилсульфонилфенил)имидазо[1,2a]пиримидина;
(Il) 2-(3,4-диметоксифенил)-3-(4-метилсульфонилфенил)имидазо[1,2a]пиримидина;
(Im) 7-метил-2-(4-метилфенил)-3-(4-метилсульфонилфенил)имидазо[1,2a]пиримидина;
(In) 7-метил-2-(3,4-диметилфенил)-3-(4-метилсульфонилфенил)имидазо[1,2a]пиримидина;
(Io) 2-(4-метилфенил)-3-(4-аминосульфонилфенил)имидазо[1,2a]пиримидина;
(Ip) 2-(3-фтор-4-метоксифенил)-3-(4-аминосульфонилфенил)имидазо[1,2a]пиримидина;
(Iq) 2-(2-метилфенил)-3-(4-аминосульфонилфенил)имидазо[1,2a]пиримидина;
(Ir) 2-(4-фторфенил)-3-(4-аминосульфонилфенил)имидазо[1,2a]пиридина;
(Is) 2-(2-хлорфенил)-3-(4-аминосульфонилфенил)имидазо[1,2a]пиримидина;
(It) 2-(3-фторфенил)-3-(4-аминосульфонилфенил)имидазо[1,2a]пиримидина;
(Iu) 2-(3-хлорфенил)-3-(4-аминосульфонилфенил)имидазо[1,2a]пиримидина.
5. Соединение по п.4, в котором указанным соединением является 3-(4-метилсульфонилфенил)-2-(4-фторфенил)имидазо[1,2a]пиримидин (Ic).
6. Соединение по п.4, в котором указанным соединением является 3-(4-метилсульфонилфенил)-2-(4-метоксифенил)имидазо[1,2a] пиримидин (If).
7. Соединение по п.4, в котором указанным соединением является 3-(4-метилсульфонилфенил)-2-(4-этоксифенил)имидазо[1,2a]пиримидин (Ig).
8. Соединение по п.1, в котором A представляет N и B представляет N.
9. Соединение по п.8, в котором R4, R5 и R6 выбирают из группы, состоящей из H, F, Cl, метила, изопропила, метокси и этокси.
10. Соединение по п.9, в котором указанное соединение выбирают из группы, состоящей из
(Iаа) 2-фенил-3-(4-метилсульфонилфенил)имидазо[1,2a][1,2,4]триазина;
(Ibb) 2-(4-фторфенил)-3-(4-метилсульфонилфенил)имидазо[1,2a][1,2,4]триазина;
(Icc) 2-(3-фтор-4-метоксифенил)-3-(4-метилсульфонилфенил)имидазо[1,2a][1,2,4]триазина;
(Idd) 2-фенил-3-(4-аминосульфонилфенил) имидазо[1,2a][1,2,4]триазина;
(Iee) 2-(2-фторфенил)-3-(4-аминосульфонилфенил)имидазо[1,2a][1,2,4]триазина;
(Iff) 2-(2-хлорфенил)-3-(4-аминосульфонилфенил)имидазо[1,2a][1,2,4]триазина;
(Igg) 2-(3-метилфенил)-3-(4-аминосульфонилфенил)имидазо[1,2a][1,2,4]триазина;
(Ihh) 2-(3-фторфенил)-3-(4-аминосульфонилфенил)имидазо[1,2a][1,2,4]триазина.
11. Соединение по п.1, в котором A представляет CH и B представляет CH.
12. Соединение по п.11, в котором R4, R5 и R6 выбирают из группы, состоящей из H, F, Cl, метила, изопропила, метокси и этокси.
13. Соединение по п.12, в котором указанное соединение выбирают из группы, состоящей из
(Iaaa) 2-фенил-3-(4-метилсульфонилфенил)имидазо[1,2a]пиридина;
(Ibbb) 2-(4-фторфенил)-3-(4-метилсульфонилфенил)имидазо[1,2a]пиридина;
(Iccc) 2-(4-метоксифенил)-3-(4-метилсульфонилфенил)имидазо[1,2a]пиридина;
(Iddd) 2-(4-этоксифенил)-3-(4-метилсульфонилфенил)имидазо[1,2a]пиридина;
(Ieee) 2-(4-изопропоксифенил)-3-(4-метилсульфонилфенил)имидазо[1,2a]пиридина;
(Ifff) 2-(3-метил-4-метоксифенил)-3-(4-метилсульфонилфенил)имидазо[1,2a]пиридина;
(Iggg) 2-(3-фтор-4-метоксифенил)-3-(4-метилсульфонилфенил)имидазо[1,2a]пиридина;
(Ihhh) 2-(3-хлор-4-метоксифенил)-3-(4-метилсульфонилфенил)имидазо[1,2a]пиридина;
(Iiii) 2-(3,4-диметоксифенил)-3-(4-метилсульфонилфенил)имидазо[1,2a]пиридина;
(Ijjj) 7-метил-2-(4-метоксифенил)-3-(4-метилсульфонилфенил)имидазо[1,2a]пиридина;
(Ikkk) 6-метил-2-(4-этоксифенил)-3-(4-метилсульфонилфенил)имидазо[1,2a]пиридина;
(Illl) 6-хлор-2-(4-этоксифенил)-3-(4-метилсульфонилфенил)имидазо[1,2a]пиридина;
(Immm) 6-бром-2-(4-этоксифенил)-3-(4-метилсульфонилфенил)имидазо[1,2a]пиридина;
(Innn) 2-(2-метилфенил)-3-(4-аминосульфонилфенил)имидазо[1,2a]пиридина;
(Iooo) 2-(2-фторфенил)-3-(4-аминосульфонилфенил)имидазо[1,2a]пиридина;
(Ippp) 2-(3-метилфенил)-3-(4-аминосульфонилфенил)имидазо[1,2a]пиридина;
(Iqqq) 2-(3-фторфенил)-3-(4-аминосульфонилфенил)имидазо[1,2a]пиридина;
(Irrr) 2-фенил-3-(4-аминосульфонилфенил)имидазо[1,2a]пиридина;
(Isss) 2-(4-фторфенил)-3-(4-аминосульфонилфенил)имидазо[1,2a]пиридина;
(Ittt) 2-(4-метоксифенил)-3-(4-аминосульфонилфенил)имидазо[1,2a]пиридина;
(Iuuu) 2-(3-метил-4-метоксифенил)-3-(4-аминосульфонилфенил)имидазо[1,2a]пиридина;
(Ivvv) 2-(3-фтор-4-метоксифенил)-3-(4-аминосульфонилфенил)имидазо[1,2a]пиридина;
(Iwww) 2-(3-хлор-4-метоксифенил)-3-(4-аминосульфонилфенил)имидазо[1,2a]пиридина;
(Ixxx) 2-(3,4-дифторфенил)-3-(4-аминосульфонилфенил)имидазо[1,2a]пиридина.
14. Фармацевтическая композиция, включающая терапевтически эффективное количество соединения формулы (I) по любому из пп.1-13, и соответствующие количества фармацевтически приемлемых носителей.
15. Фармацевтическая композиция для лечения воспалительного заболевания, включающая терапевтически эффективное количество соединения формулы (I) по любому из пп.1-13, и соответствующие количества фармацевтически приемлемых носителей.
16. Фармацевтическая композиция для лечения опосредствованного циклооксигеназой заболевания, включающая терапевтически эффективное количество соединения формулы (I) по любому из пп.1-13, и соответствующие количества фармацевтически приемлемых носителей.
17. Фармацевтическая композиция для селективного ингибирования циклооксигеназы 2 (COX-2), включающая терапевтически эффективное количество соединения формулы (I) по любому из пп. 1-13, и соответствующие количества фармацевтически приемлемых носителей.
18. Применение соединения формулы (I) по любому из пп.1-13 для получения лекарственного средства для лечения воспаления.
19. Применение соединения формулы (I) по любому из пп.1-13 для получения лекарственного средства для лечения опосредствованного циклооксигеназой заболевания.
20. Применение соединения формулы (I) по любому из пп.1-13 для получения лекарственного средства для селективного ингибирования циклооксигеназы 2 (COX-2).
21. Применение соединения формулы (I) по любому из пп.1-13 для получения лекарства для лечения ракового заболевания.
22. Применение по п.21, в котором раковым заболеванием являетёя рак ободочной кишки.
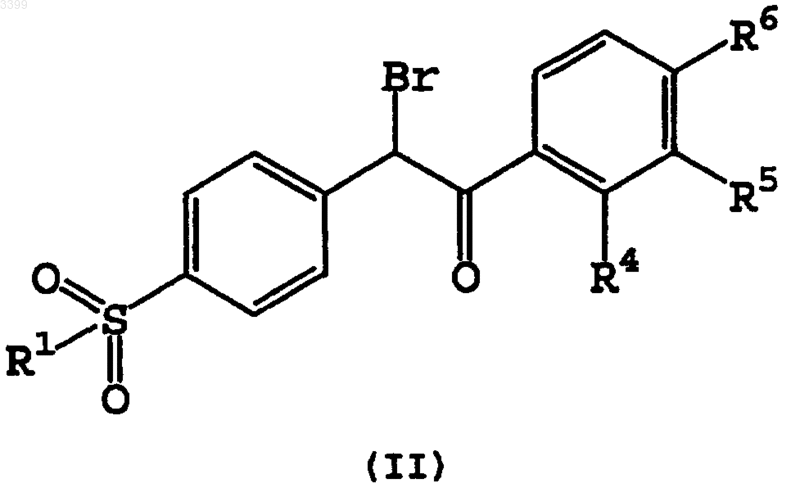
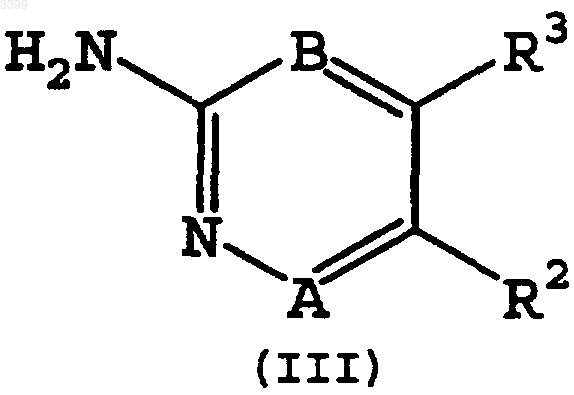
23. Способ получения замещенного имидазо[1,2a]азина формулы (I) по п.1, включающий реакцию конденсации замещенного 2-бром-2-(4-R1-сульфонилфенил)-1-фенилэтанона формулы (II) с замещенным аминоазином формулы (III), в полярном растворителе
Текст
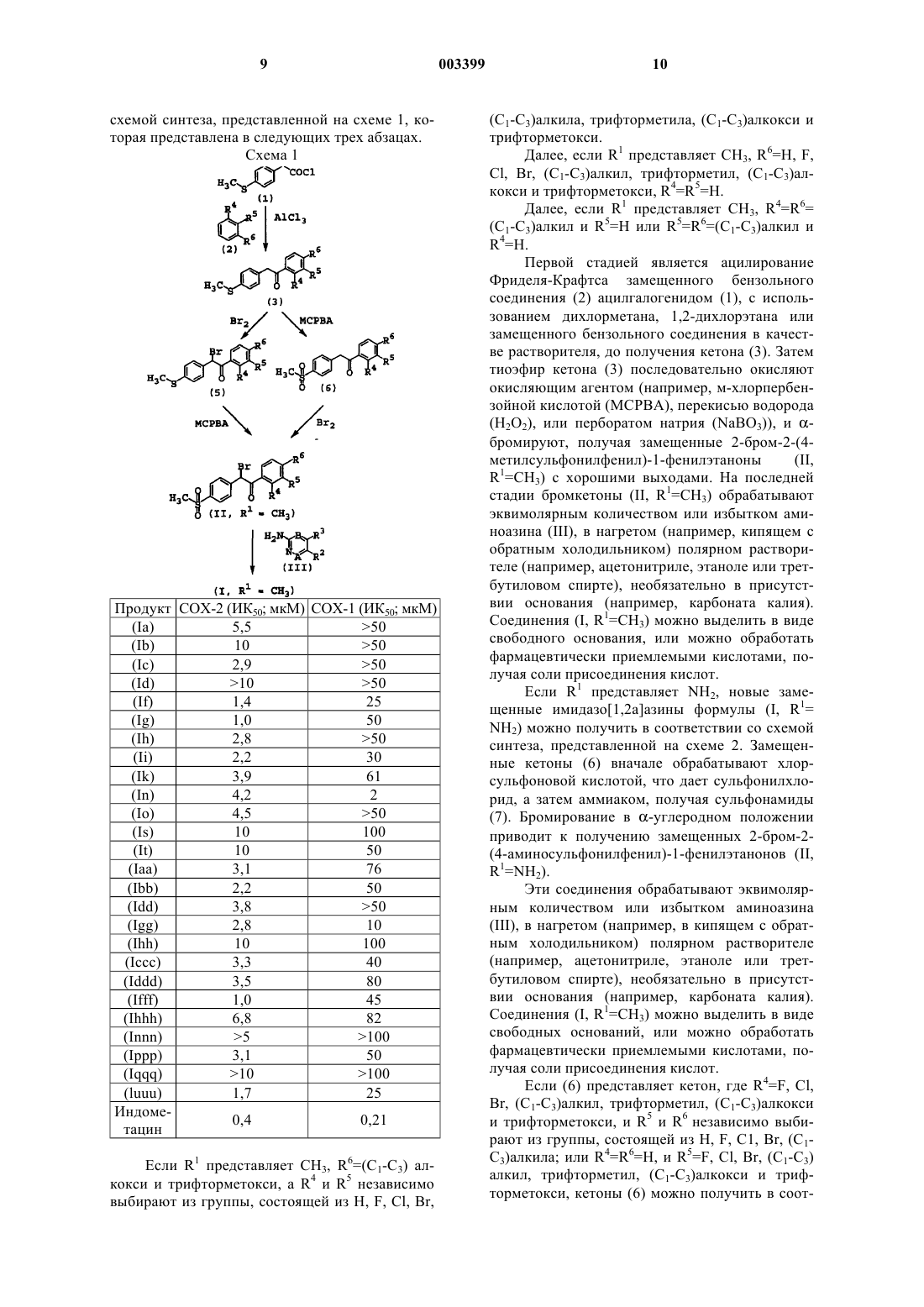
1 Настоящее изобретение относится к новым СОХ-2 ингибиторам, нестероидным противовоспалительным лекарственным средствам, к способам их получения и к их использованию для лечения и профилактики. Область изобретения Классически, основным механизмом действия нестероидных противовоспалительных лекарств было ингибирование циклооксигеназы. Этот фермент трансформирует арахидоновую кислоту в простагландине Н 2, который последовательно трансформируется в другие простагландины, простациклины или тромбоксаны. Недавно было доказано существование двух изоформ циклооксигеназы, а именно СОХ-1 и СОХ-2. Несмотря на то, что они эквивалентны в отношении 60% их строения, у них существуют важные функциональные различия. СОХ-1 представляет конструктивный фермент, встречающийся в большинстве тканей человека, и в настоящее время рассматривается как ответственный за несколько физиологических функций. Он синтезирует простаноиды в ответ на стимулы, продуцируемые циркулирующими гормонами, которые контролируют физиологические клеточные процессы (ТхА 2 в тромбоцитах, PGI2 в эндотелии, PGE2 в почках и слизистой оболочке кишечника и т.д). Эти гормоны необходимы для поддержания сосудистого гомеостаза и функций желудка и почек. Совсем недавно был секвенирован, охарактеризован и клонирован ген для второй индуцируемой формы циклооксигеназы (СОХ-2). СОХ-2 является индуцируемым ферментом,обычно не детектируемым в большинстве тканей, но его экспрессия существенно возрастает во время воспалительных процессов. Было показано, что индуцирование СОХ-2 происходит в фибробластах, макрофагах, эпителиальных клетках кишечника и бронхов, в результате экспонирования провоспалительным агентам, таким как эндотоксины, цитокины и факторы роста. СОХ-2 экспрессия наблюдалась на различных животных моделях острых или хронических воспалений. Обнаружение индуцируемого изофермента СОХ-2, отличающегося от структурного фермента СОХ-1, возобновило интерес к разработке новых нестероидных противовоспалительных лекарств для лечения воспалений, так как предполагается, что благоприятное действие этих лекарств будет связано с их активностью в отношении СОХ-2, тогда как связанные с ними побочные эффекты будут связаны с их активностью в отношении СОХ-1. Желательно иметь новые фармацевтические противовоспалительные лекарственные средства с предпочтительным селективным ингибированием СОХ-2 по сравнению с СОХ-1. Эти лекарственные средства с противовоспалительными, антипиретическими и анальгезирующими активностями, которые аналогичны обычным нестероидным про 003399 2 тивовоспалительным лекарственным средствам,могут обладать противораковым действием, но при значительном уменьшении нежелательных побочных эффектов. В частности, такие соединения должны иметь пониженную токсичность для желудочно-кишечного тракта, более слабое побочное действие на почки и значительно реже вызывать кровотечения. В патентной заявке WO 96/31509 раскрыты имидазо[1,2 а]пиридины с 4-сульфонилфенильными радикалами в 2-положении конденсированной гетероциклической системы в качестве селективных СОХ-2 ингибиторов общей формулы В патентных заявках WO 92/10190 и WO 96/03387 раскрыты структуры близких соединений для лечения воспалений. Однако имидазо[1,2 а]азины с 4-сульфонилфенильными радикалами в 3 положении(вместо 2 положения) конденсированной гетероциклической системы, которые являются объектом настоящего изобретения, никогда не были химически охарактеризованы ранее. Обнаружено, что они демонстрируют заметное и неожиданное селективное СОХ-2 ингибирование. Краткое содержание изобретения В настоящем изобретении предложены новые замещенные имидазо[1,2 а]азины формулы(I) или их фармацевтически приемлемые соли присоединения кислот и их сольваты, где А и В независимо выбирают из N и СН, при условии,что если А представляет N, тогда и В также представляет N; R1 выбирают из группы, состоящей из СН 3 и NH2, предпочтительно СН 3; R2 и R3 выбирают из группы, состоящей из Н, СН 3,Сl, Вr, СОСН 3 и ОСН 3, предпочтительно Н; R4,R5 и R6, каждый независимо, выбирают из группы, состоящей из Н, F, Cl, Вr, (C1-С 3)алкила,трифторметила, (C1-С 3)алкокси и трифторметокси. Предпочтительно R4, R5 и R6 выбирают из группы, состоящей из Н, метила, изопропила, F,Cl, метокси и этокси. Соединения формулы (I), в которых А представляет СН, а В представляет N, предпочтительны.N, тогда имидазо[1,2 а]азины формулы (I) называются имидазо[1,2 а]пиримидинами, а конкретные их примеры обозначены здесь буквами (Iа,Ib). Если А представляет N и В представляетN, тогда имидазо[1,2 а]азины формулы (I) называются имидазо[1,2 а]триазинами, и конкретные их примеры обозначают двумя буквами (Iаа,Ibb). Если А представляет СН и В представляет СН, тогда имидазо[1,2 а]азины формулы (I) называются имидазо[1,2 а]пиридинами, и конкретные их примеры обозначают тремя буквами(laaa, Ibbb). Для установления номенклатуры этих конденсированных кольцевых систем была использована нумерация, разъясняемая далее,которая эквивалентна нумерации, использованной в WO 96/31509 для соединений с аналогичной структурой. Перечисленные далее соединения формулы (I) являются особенно предпочтительными, и приведены соответствующие им химические сдвиги в спектрах ядерного магнитного резонанса. Химические сдвигив спектрах 1R ЯМР даны в миллионных долях (мд) по отношению к тетраметилсилану (ТМС); спектры записаны на спектрометре с рабочей частотой 300 МГц для соединений в соответствующих дейтерированных растворителях. Использованы следующие сокращения: с - синглет, д - дублет,т - триплет, кв - квартет, дд - дублет дублетов,тд - триплет дублетов, м -мультиплет. В настоящем изобретении раскрыт также синтез некоторых из следующих соединений.H ЯМР (ДМСО 300 МГц):6,94 (т, 1 Н),7,33-7,41 (м, 3 Н), 7,50 (с, 2 Н), 7,53-7,58 (м, 1 Н),7,67-7,74 (м, 3 Н), 8,02 (д, 2 Н), 8,10 (д, 1 Н). Еще более предпочтительны соединения 2(4-фторфенил)-3-(4-метилсульфонилфенил) имидазо[1,2 а]пиримидин (Iс), 2-(4-метоксифенил)-3-(4-метилсульфонилфенил)имидазо[1,2 а] пиримидин (If) и 2-(4-этоксифенил)-3-(4 метилсульфонилфенил)имидазо[1,2 а]пиримидин (Ig), которые обладают специфической селективной СОХ-2 ингибирующей активностью,как представлено в таблице. Объектом настоящего изобретения является подходящий способ получения замещенных имидазо[1,2 а]азинов формулы (I). Этот способ включает конденсацию аминоазина формулы Промежуточные (II) и (III) получают из известных соединений. Если R1 представляет СН 3, новые замещенные имидазо[1,2 а]азины формулы (I)(luuu) 1,7 25 Индоме 0,4 0,21 тацин Если R1 представляет СН 3, R6=(C1-С 3) алкокси и трифторметокси, а R4 и R5 независимо выбирают из группы, состоящей из Н, F, Cl, Вr, 003399R4=Н. Первой стадией является ацилирование Фриделя-Крафтса замещенного бензольного соединения (2) ацилгалогенидом (1), с использованием дихлорметана, 1,2-дихлорэтана или замещенного бензольного соединения в качестве растворителя, до получения кетона (3). Затем тиоэфир кетона (3) последовательно окисляют окисляющим агентом (например, м-хлорпербензойной кислотой (МСРВА), перекисью водорода(Н 2O2), или перборатом натрия (NaBO3, и бромируют, получая замещенные 2-бром-2-(4 метилсульфонилфенил)-1-фенилэтаноны(II,R1=СН 3) с хорошими выходами. На последней стадии бромкетоны (II, R1=СН 3) обрабатывают эквимолярным количеством или избытком аминоазина (III), в нагретом (например, кипящем с обратным холодильником) полярном растворителе (например, ацетонитриле, этаноле или третбутиловом спирте), необязательно в присутствии основания (например, карбоната калия). Соединения (I, R1=СН 3) можно выделить в виде свободного основания, или можно обработать фармацевтически приемлемыми кислотами, получая соли присоединения кислот. Если R1 представляет NH2, новые замещенные имидазо[1,2 а]азины формулы (I, R1=NH2) можно получить в соответствии со схемой синтеза, представленной на cхеме 2. Замещенные кетоны (6) вначале обрабатывают хлорсульфоновой кислотой, что дает сульфонилхлорид, а затем аммиаком, получая сульфонамиды(7). Бромирование в -углеродном положении приводит к получению замещенных 2-бром-2(4-аминосульфонилфенил)-1-фенилэтанонов (II,R1=NH2). Эти соединения обрабатывают эквимолярным количеством или избытком аминоазина(например, ацетонитриле, этаноле или третбутиловом спирте), необязательно в присутствии основания (например, карбоната калия). Соединения (I, R1=СН 3) можно выделить в виде свободных оснований, или можно обработать фармацевтически приемлемыми кислотами, получая соли присоединения кислот. Если (6) представляет кетон, где R4=F, Cl,Вr, (C1-С 3)алкил, трифторметил, (C1-С 3)алкокси и трифторметокси, и R5 и R6 независимо выбирают из группы, состоящей из Н, F, C1, Вr, (C1 С 3)алкила; или R4=R6=Н, и R5=F, Cl, Вr, (C1-С 3) алкил, трифторметил, (C1-С 3)алкокси и трифторметокси, кетоны (6) можно получить в соот 11 ветствии со способом, представленным на cхеме 3. Из альдегидов (7) получают замещенные спирты (9) в результате присоединения соответствующего магнийорганического реагента (8),полученного обработкой бензилхлорида или бензилбромида магнием в тетрагидрофуране или диэтиловом эфире в качестве растворителя. Последующее окисление замещенного спирта (9) до кетона (6) осуществляют, обрабатывая окисляющим агентом (таким как пиридинийхлорхромат или трет-бутоксид алюминия). Схема 2(I) ингибируют циклооксигеназу-1 и циклооксигеназу-2 (СОХ-1 и COX-2) in vitro, как представлено в таблице. Соединения (I) селективно ингибируют СОХ-2 предпочтительнее, чем СОХ-1. Благодаря их высокой селективности, описанные соединения можно использовать в качестве альтернативы обычным нестероидным про 003399 12 тивовоспалительным лекарствам, особенно в тех случаях, когда эти лекарства могут быть противопоказаны из-за их побочных эффектов стимулирования язвенных заболеваний. Соединения формулы (I) могут предотвращать поражения нейронов, ингибируя выработку нейронных свободных радикалов, и их можно использовать для лечения приступов эпилепсии. Определенные ранее соединения формулы(I) можно использовать для лечения боли, лихорадки и воспалений, сопутствующих различным состояниям, включая ревматическую лихорадку,симптомы, связанные с гриппом и другими вирусными инфекциями, обычную простуду, головную боль, дисменоррею, мигрень, зубную боль, растяжения суставов и сухожилий, миозиты, невралгию, синовиты, артрит, включая ревматоидный артрит, остеоартрит, подагру и анкилозные спондилиты, тендениты, кожные заболевания, такие как псориаз, экзема, дерматиты и ожоги, поражения, вызванные хирургическими и зубоврачебными процедурами. Эти соединения могут также ингибировать клеточные и неопластические трансформации и рост опухолевых метастазов, и, следовательно, их можно использовать для лечения раковых заболеваний,таких как рак ободочной кишки. Соединения формулы (I) можно использовать для лечения и/или профилактики опосредствованных циклооксигеназой заболеваний, таких как диабетическая ретинопатия и ангиогенез опухолей. Соединения формулы (I) могут также ингибировать спазмы гладкой мускулатуры, вызванные простаноидами, и могут также быть полезными для лечения дисменорреи и при преждевременных родах. Их можно также использовать для лечения нарушений познавательных функций, таких как деменция, старческое слабоумие, болезнь Альцгеймера, болезнь Пика, болезнь Паркинсона, болезнь Креутцфельд-Якоба, и для лечения остеопороза. Соединения формулы (I) ингибируют воспалительные процессы, и поэтому их можно использовать для лечения астмы, аллергических ринитов, синдрома респираторных нарушений,желудочно-кишечных нарушений, таких как болезнь Крона, гастрит, воспалительные заболевания кишечника и язвенный колит; и воспалений, сопровождающих другие заболевания, такие как мигрень, нодозный периартрит, тиреоидит, болезнь Ходкинса, склеродома, тяжелая миастения, рассеянный склероз, саркоидоз,нефротический синдром, синдром Бекета, полимиозит, гингивит и конъюктивит. Соединения формулы (I) можно использовать для лечения офтальмических заболеваний,таких как ретинит, ретинопатии, увеит и острые поражения тканей глаза. Кроме четких вышеприведенных указаний следует понимать, что ссылки на "лечение" 13 включают как лечение стабильных симптомов,так и их профилактику. Настоящее изобретение включает также фармацевтические композиции, включающие терапевтически эффективное количество любого соединения формулы (I) , как определено выше, вместе с соответствующими количествами фармацевтически приемлемых носителей. Среди них наиболее предпочтительны фармацевтические композиции для лечения воспалений, для лечения опосредствованных циклооксигеназой заболеваний, или для селективного ингибирования циклооксигеназы 2 (СОХ-2). Фармацевтические композиции настоящего изобретения можно получить в любой известной специалистам форме для перорального,ректального введения, поверхностного нанесения, или для введения с помощью инъекций. Благодаря их высокой СОХ-2 селективности, проиллюстрированной приведенными в таблице результатами, раскрытые соединения можно использовать как альтернативу обычным стероидным противовоспалительным лекарствам, особенно если эти лекарства могут иметь противопоказания из-за их способности способствовать образованию язвенных заболеваний. Следовательно, другим вариантом настоящего изобретения является использование любого из соединений формулы (I), как определено ранее,для получения терапевтического агента для лечения воспалений, для лечения опосредствованных циклооксигеназой заболеваний, для селективного ингибирования циклооксигеназы 2(СОХ-2), и для лечения раковых заболеваний,особенно рака ободочной кишки. Примеры Приведенные далее примеры иллюстрируют изобретение. Пример 1. Получение 1-(4-фторфенил)-2(4-метилтиофенил)этанона (промежуточное 3,R4=R5=Н, R6=F). Смесь фторбензола (181 мл) и алюминийхлорида (18,5 г, 139 ммоль) обрабатывают раствором хлорида 4-метилтиофенилуксусной кислоты (21,9 г, 120 ммоль) в 37 мл фторбензола. После завершения добавления смесь перемешивают при 50 С в течение 3 ч. Затем реакционную смесь выливают в ледяную воду и перемешивают в течение 1 ч. Ее экстрагируют хлороформом и промывают 5% водным раствором бикарбоната натрия и соляным раствором. Органический слой выделяют и сушат над безводным сульфатом натрия. Осушающий агент отфильтровывают, и фильтрат концентрируют в вакууме, получая 15,6 г (55%) целевого соединения в виде твердого вещества желтого цвета. Пример 2. Получение 1-(4-фторфенил)-2(4-метилсульфонилфенил)этанона(промежуточное 4, R4=R5=Н, R6=F). Приготавливают раствор 15,5 г (60 ммоль) 1-(4-фторфенил)-2-(4-метилтиофенил)этанона в 2 л хлороформа. Затем к раствору порциями до 003399(148 ммоль). Реакционную смесь перемешивают в течение 3 ч, и обрабатывают 5% водным раствором бикарбоната натрия. Органический слой выделяют и промывают 5% водным раствором бикарбоната натрия и соляным раствором. Его сушат над безводным сульфатом натрия. Осушающий агент отфильтровывают, и полученный фильтрат концентрируют в вакууме. Полученное твердое вещество промывают смесью гексан/этилацетат (6:1), получая 14,5 г (84%) целевого соединения в виде твердого вещества белого цвета. Пример 3. Получение 2-бром-2-(4 метилсульфонилфенил)-1-(4-фторфенил)этанона(промежуточное II, R1=СН 3, R4=R5=Н, R6=F). Получают смесь 1-(4-фторфенил)-2-(4 метилсульфонилфенил)этанона (14,6 г, 50 ммоль) в 210 мл хлороформа и 826 мл ССl4. К этой смеси по каплям добавляют раствор 8,0 г(50 ммоль) брома в ССl4. После завершения обесцвечивания брома органический слой промывают 5% водным раствором бикарбоната натрия и соляным раствором. Его сушат над безводным сульфатом натрия. Осушающий агент отфильтровывают, и полученный фильтрат концентрируют в вакууме, получая 14,0 г (70%) целевого соединения в виде твердого вещества. Пример 4. Получение 2-бром-2-(4-метилсульфонилфенил)-1-(4-метоксифенил)этанона(промежуточное II, R1=СН 3, R4=R5=Н, R6=МеО). Указанное в заголовке соединение получают из анизола и хлорида 4-метилтиофенилуксусной кислоты в хлороформе, используя способ примеров 1, 2 и 3. Пример 5. Получение 2-бром-2-(4-метилсульфонилфенил)-1-фенилэтанона(промежуточное II, R1=СН 3, R4=R5=R6=Н). Указанное в заголовке соединение получают из бензола и хлорида 4-метилтиофенилуксусной кислоты в хлороформе, используя способ примеров 1, 2 и 3. Пример 6. Получение 2-бром-1-(3-фтор-4 метоксифенил)-2-(4-метилсульфонилфенил) этанона (промежуточное II, R1=СН 3, R4=Н,R5=F, R6=МеО). Указанное в заголовке соединение получают из 2-фторанизола и хлорида 4 метилтиофенилуксусной кислоты в хлороформе,используя способ примеров 1, 2 и 3. Пример 7. Получение 2-бром-1-(3-хлор-4 метоксифенил)-2-(4-метилсульфонилфенил) этанона (промежуточное II, R1=СН 3, R4=Н,R5=Сl, R6=МеО). Указанное в заголовке соединение получают из 2-хлоранизола и хлорида 4-метилтиофенилуксусной кислоты в хлороформе, используя способ примеров 1, 2 и 3. Пример 8. Получение 3-(4-метилсульфонилфенил)-2-(4-фторфенил)имидазо[1,2 а]пиримидина (продукт Iс). 15 Раствор 3,0 г 2-бром-2-(4-метилсульфонилфенил)-1-(4-фторфенил)этанона (промежуточное II, R1=СН 3, R4=R5=Н, R6=F) в 300 мл третбутилового спирта обрабатывают 15,0 г 2 аминопиримидина. Реакционную смесь кипятят с обратным холодильником в течение 16 ч, а затем оставляют остывать. После концентрирования остаток обрабатывают дихлорметаном и 5% водным раствором бикарбоната натрия. Органический слой выделяют, и промывают 5% водным раствором бикарбоната натрия и водой. Органический слой сушат над безводным сульфатом натрия. Осушающий агент отфильтровывают, а фильтрат концентрируют в вакууме. Полученный остаток промывают ацетоном, получая 1,1 г (37%) целевого соединения в виде твердого вещества белого цвета. Пример 9. Получение 2-(4-фторфенил)-3(4-метилсульфонилфенил)имидазо[1,2 а][1,2,4] триазина (продукт Ibb). Раствор 3,0 г 2-бром-2-(4-метилсульфонилфенил)-1-(4-фторфенил)этанона (промежуточное II, R1=СН 3, R4=R5=Н, R6=F) в 200 мл ацетонитрила обрабатывают 10,0 г 3-амино[1,2,4]триазина. Реакционную смесь кипятят с обратным холодильником в течение 16 ч. После охлаждения и удаления растворителя, полученный остаток обрабатывают дихлорметаном и 5% водным раствором бикарбоната натрия. Органический слой выделяют и промывают 5% водным раствором бикарбоната натрия и водой. Органический слой сушат над безводным сульфатом натрия. Осушающий агент отфильтровывают, и фильтрат концентрируют в вакууме. Полученный остаток промывают ацетоном, получая 1,4 г (47%) целевого соединения в виде твердого вещества желтого цвета. Пример 10. Получение 2-(4-фторфенил)-3(4-метилсульфонилфенил)имидазо[1,2 а]пиридина (продукт Ibbb). Раствор 3,0 г 2-бром-2-(4-метилсульфонилфенил)-1-(4-фторфенил) этанона (промежуточное II, R1=СН 3, R4=R5=Н, R6=F) в 200 мл ацетонитрила обрабатывают 6,0 г 2-аминопиридина. Эту смесь кипятят с обратным холодильником в течение 12 ч, и оставляют остывать. После концентрирования остаток обрабатывают дихлорметаном и 5% водным раствором бикарбоната натрия. Органический слой выделяют и промывают 5% водным раствором бикарбоната натрия и водой. Органический слой сушат над безводным сульфатом натрия. Осушающий агент отфильтровывают, и фильтрат концентрируют в вакууме. Полученный остаток промывают изопропанолом, получая 0,94 г (32%) целевого соединения в виде твердого вещества серого цвета. Пример 11. Получение 2-(4-метоксифенил)-3-(4-метилсульфонилфенил)имидазо[1,2 а] пиримидина (продукт If). Указанное в заголовке соединение получают из 2-бром-2-(4-метилсульфонилфенил)-1 003399(4-метоксифенил)этанона (промежуточное II,R1=СН 3, R4=R5=Н, R6=МеО) и 2-аминопиримидина, используя способ примера 8. Пример 12. Получение 2-(4-метоксифенил)-3-(4-метилсульфонилфенил)имидазо[1,2 а][1,2,4]триазина. Указанное в заголовке соединение получают из 2-бром-2-(4-метилсульфонилфенил)-1(4-метоксифенил)этанона (промежуточное II,R1=СН 3, R4=R5=H, R6=MeO) и 3-амино[1,2,4] триазина, используя способ примера 9. Пример 13. Получение 2-(4-метоксифенил)-3-(4-метилсульфонилфенил)имидазо[1,2 а] пиридина (продукт Iccc). Указанное в заголовке соединение получают из 2-бром-2-(4-метилсульфонилфенил)-1(4-метоксифенил)этанона (промежуточное II,R1=СН 3, R4=R5=Н, R6=MeO) и 2-аминопиридина, используя способ примера 10. Пример 14. Получение 2-фенил-3-(4 метилсульфонилфенил)имидазо[1,2 а]пиримидина (продукт Iа). Указанное в заголовке соединение получают из 2-бром-2-(4-метилсульфонилфенил)-1 фенилэтанона (промежуточное II, R1=СН 3,R4=R5=R6=Н) и 2-аминопиримидина, используя способ примера 8. Пример 15. Получение 2-фенил-3-(4 метилсульфонилфенил)имидазо[1,2 а][1,2,4] триазина (продукт Iaa). Указанное в заголовке соединение получают из 2-бром-2-(4-метилсульфонилфенил)-1 фенилэтанона (промежуточное II, R1=СН 3, R4=R5=R6=Н) и 3-амино[1,2,4]триазина, используя способ примера 9. Пример 16. Получение 2-фенил-3-(4 метилсульфонилфенил)имидазо[1,2 а]пиридина(продукт Iaaa). Указанное в заголовке соединение получают из 2-бром-2-(4-метилсульфонилфенил)-1 фенилэтанона (промежуточное II, R1=СН 3,R4=R5=R6=H) и 2-аминопиридина, используя способ примера 10. Пример 17. Получение 2-(3-фтор-4-метоксифенил)-3-(4-метилсульфонилфенил)имидазо[1,2 а]пиримидина (продукт Ij). Указанное в заголовке соединение получают из 2-бром-1-(3-фтор-4-метоксифенил)-2(4-метилсульфонилфенил)этанона(промежуточное II, R1=СН 3, R4=Н, R5=F, R6=MeO) и 2 аминопиримидина, используя способ примера 8. Пример 18. Получение 2-(3-фтор-4-метоксифенил)-3-(4-метилсульфонилфенил)имидазо[1,2 а][1,2,4]триазина (продукт Icc). Указанное в заголовке соединение получают из 2-бром-1-(3-фтор-4-метоксифенил)-2(4-метилсульфонилфенил)этанона(промежуточное II, R1=СН 3, R4=Н, R5=F, R6=MeO) и 3 амино[1,2,4]триазина, используя способ примера 9. 17 Пример 19. Получение 2-(3-фтор-4 метоксифенил)-3-(4-метилсульфонилфенил) имидазо[1,2 а]пиридина (продукт Iggg). Указанное в заголовке соединение получают из 2-бром-1-(3-фтор-4-метоксифенил)-2(4-метилсульфонилфенил)этанона(промежуточное II, R1=СН 3, R4=Н, R5=F, R6=МеО) и 2 аминопиридина, используя способ примера 10. Пример 20. Получение 2-(3-хлор-4 метоксифенил)-3-(4-метилсульфонилфенил) имидазо[1,2]пиримидина (продукт Ik). Указанное в заголовке соединение получают из 2-бром-1-(3-хлор-4-метоксифенил)-2-(4 метилсульфонилфенил)этанона (промежуточноеII, R1=СН 3, R4=Н, R5=Сl, R6=МеО) и 2-аминопиримидина, используя способ примера 8. Пример 21. Получение 2-(3-хлор-4-метоксифенил)-3-(4-метилсульфонилфенил)имидазо[1,2 а][1,2,4]триазина (продукт Iee). Указанное в заголовке соединение получают из 2-бром-1-(3-хлор-4-метоксифенил)-2-(4 метилсульфонилфенил)этанона (промежуточноеII, R1=СН 3, R4=Н, R5=Сl, R6=МеО) и 3 амино[1,2,4]триазина, используя способ примера 9. Пример 22. Получение 2-(3-хлор-4 метоксифенил)-3-(4-метилсульфонилфенил) имидазо[1,2 а]пиридина (продукт Ihhh). Указанное в заголовке соединение получают из 2-бром-1-(3-хлор-4-метоксифенил)-2-(4 метилсульфонилфенил)этанона (промежуточноеII, R1=СН 3, R4=Н, R5=Сl, R6=МеО) и 2-аминопиридина, используя способ примера 10. Пример 23. Получение 2-(4-аминосульфонилфенил)-1-фенилэтанона (промежуточное 7,R4=R5=R6=Н). К 200 мл хлорсульфоновой кислоты, предварительно охлажденной до 0 С ледяным солевым раствором, добавляют порциями 45,0 г 1,2 дифенилэтанона. Реакционную смесь перемешивают в течение 14 ч при комнатной температуре, и выливают в 900 г льда, при интенсивном механическом перемешивании. Образующийся твердый осадок отфильтровывают и добавляют к охлажденной ранее смеси ацетона (67 мл) и раствора аммиака в воде (62 мл). Реакционную смесь перемешивают в течение 5 ч при комнатной температуре, фильтруют и промывают водой. Полученное твердое вещество промывают кипящим с обратным холодильником ацетоном в течение 30 мин. Его отфильтровывают и сушат в вакууме в присутствии пятиокиси фосфора, 22,5 г (36,0%), получая целевое соединение в виде порошка белого цвета. Пример 24. Получение 2-(4-аминосульфонилфенил)-2-бром-1-фенилэтанона (промежуточное II, R1=NH2, R4=R5=R6=Н). К смеси 14,4 г (52 ммоль) 2-(4 аминосульфонилфенил)-1-фенилэтанона в 240 мл ледяной уксусной кислоты, перемешиваемой в атмосфере азота, добавляют раствор 24 мл бромистоводородной кислоты в ледяной уксус 003399 18 ной кислоте (33%). К реакционной смеси медленно добавляют 8,4 г (52 ммоль) брома. Все это перемешивают при комнатной температуре до полного обесцвечивания. После концентрирования полученный остаток растворяют в этилацетате (500 мл) . Органический слой промывают дважды 5% водным раствором бикарбоната натрия (2 х 350 мл) и соляным раствором (350 мл). Органический слой сушат, фильтруют и концентрируют в вакууме. Остаток промывают гексаном, получая 14,9 г (80%) целевого соединения в виде порошка белого цвета. Пример 25. Получение 2-фенил-3-(4 аминосульфонилфенил)имидазо[1,2 а]пиридина(продукт Irrr). Смесь 2,0 г 2-(4-аминосульфонилфенил)-2 бром-1-фенилэтанона в 120 мл ацетонитрила обрабатывают 6,0 г 2-аминопиридина. Ее кипятят с обратным холодильником до завершения реакции, оставляют охлаждаться до комнатной температуры и концентрируют в вакууме. Полученный остаток растворяют в этилацетате и промывают 5% водным раствором бикарбоната натрия. Органический слой сушат, осушающий агент отфильтровывают, и полученный фильтрат выпаривают в вакууме. Оставшееся твердое вещество промывают диэтиловым эфиром, получая 640 мг (32%) целевого соединения в виде порошка бледно коричневого цвета. Пример 26. Получение 2-фенил-3-(4 аминосульфонилфенил)имидазо[1,2 а]пиримидина. Смесь 2,0 г 2-бром-2-(4-аминосульфонилфенил)-1-фенилэтанона в 120 мл ацетонитрила обрабатывают 6,0 г 2-аминопиримидина. Эту смесь кипятят с обратным холодильником до завершения реакции. Реакционную смесь оставляют остывать до комнатной температуры, и выпаривают в вакууме. Полученный остаток растворяют в этилацетате и промывают 5% водным раствором бикарбоната натрия. Органический слой сушат, фильтруют и концентрируют в вакууме. Полученное твердое вещество обрабатывают диэтиловым эфиром и фильтруют, получая 820 мг (42%) целевого соединения в виде порошка желтого цвета. Пример 27. Получение 2-фенил-3-(4 аминосульфонилфенил)имидазо[1,2 а][1,2,4]триазина (продукт Idd). Смесь 4,0 г 2-бром-2-(4-аминосульфонилфенил)-1-фенилэтанона в 200 мл ацетонитрила обрабатывают 10,0 г 3-амино[1,2,4]-триазина. Смесь кипятят с обратным холодильником до окончания реакции, что контролируют с помощью ТСХ. После концентрирования в вакууме полученное твердое вещество обрабатывают этилацетатом и 5% водным раствором бикарбоната натрия. Органический слой выделяют и промывают 5% водным раствором бикарбоната натрия и один раз соляным раствором. Органический слой сушат, осушающий агент отфильтровывают, и полученный фильтрат концентри 19 руют в вакууме. Полученный остаток промывают диэтиловым эфиром и горячим этанолом, и фильтруют, получая 1,9 г (48%) целевого соединения в виде порошка бледно коричневого цвета. Пример 28. Получение 2-(4-аминосульфонилфенил)-1-(4-метоксифенил)этанона (промежуточное 7, R4=R5=Н, R6=ОСН 3). Указанное в заголовке соединение получают из 2-фенил-1-(4-метоксифенил)этанона в виде бледно желтого порошка, используя способ примера 23. Пример 29. Получение 2-(4-аминосульфонилфенил)-2-бром-1-(4-метоксифенил)этанона (промежуточное II, R1=NH2, R4=R5=Н,R6=ОСН 3). Указанное в заголовке соединение получают из 2-(4-аминосульфонилфенил)-1-(4-метоксифенил)этанона в виде желтого порошка, используя способ примера 24. Пример 30. Получение 2-(4-метоксифенил)-3-(4-аминосульфонилфенил)имидазо[1,2 а] пиридина (продукт Ittt). Указанное в заголовке соединение получают из 2-(4-аминосульфонилфенил)-2-бром-1(4-метоксифенил)этанона в виде порошка желтого цвета, используя способ примера 25. Пример 31. Получение 2-(4-метоксифенил)-3-(4-аминосульфонилфенил)имидазо[1,2 а] пиримидина. Указанное соединение получают из 2-(4 аминосульфонилфенил)-2-бром-1-(4-метоксифенил)этанона в виде порошка желтого цвета,используя способ примера 26. Пример 32. Получение 2-(4-метоксифенил)-3-(4-аминосульфонилфенил)имидазо[1,2 а][1,2,4]триазина. Указанное в заголовке соединение получают из 2-(4-аминосульфонилфенил)-2-бром-1(4-метоксифенил)этанона в виде порошка желтого цвета, используя способ примера 27. Пример 33. Получение 2-(4-аминосульфонилфенил)-1-(4-метилфенил) этанона (промежуточное 7, R4=R5=Н, R6=СН 3). Указанное в заголовке соединение получают из 2-фенил-1-(4-метилфенил)этанона в виде порошка бледно желтого цвета, используя способ примера 23. Пример 34. Получение 2-(4-аминосульфонилфенил)-2-бром-1-(4-метилфенил)этанона(промежуточное II, R1=NH2, R4=R5=Н, R6=СН 3). Указанное в заголовке соединение получают из 2-(4-аминосульфонилфенил)-1-(4-метилфенил)этанона в виде порошка белого цвета,используя способ примера 24. Пример 35. Получение 2-(4-метилфенил)3-(4-аминосульфонилфенил)имидазо[1,2 а]пиримидина (продукт Iо). Указанное в заголовке соединение получают из 2-(4-аминосульфонилфенил)-2-бром-1(4-метилфенил)этанона в виде порошка бледно 20 коричневого цвета, используя способ примера 26. Пример 36. Получение 2-(4-аминосульфонилфенил)-1-(4-фторфенил)этанона (промежуточное 7, R4=R5=H, R6=F). Указанное в заголовке соединение получают из 2-фенил-1-(3-фторфенил)этанона в виде порошка белого цвета, используя способ примера 23. Пример 37. Получение 2-(4-аминосульфонилфенил)-2-бром-1-(4-фторфенил)этанона(промежуточное II, R1=NH2, R4=R5=Н, R6=F). Указанное в заголовке соединение получают из 2-(4-аминосульфонилфенил)-1-(4-фторфенил)этанона в виде гигроскопического порошка бледно коричневого цвета, используя способ примера 24. Пример 38. Получение 2-(4-фторфенил)-3(4-аминосульфонилфенил)имидазо[1,2 а]пиридина (продукт Isss). Указанное в заголовке соединение получают из 2-(4-аминосульфонилфенил)-2-бром-1(4-фторфенил)этанона в виде порошка бледно желтого цвета, используя способ примера 25. Пример 39. Получение 2-(4-фторфенил)-3(4-аминосульфонилфенил)имидазо[1,2 а]пиримидина. Указанное в заголовке соединение получают из 2-(4-аминосульфонилфенил)-2-бром-1(4-фторфенил)этанона в виде порошка бледно желтого цвета, используя способ примера 26. Пример 40. Получение 2-(4-фторфенил)-3(4-аминосульфонилфенил)имидазо[1,2 а][1,2,4] триазина. Указанное в заголовке соединение получают из 2-(4-аминосульфонилфенил)-2-бром-1(4-фторфенил)этанона в виде порошка бледного коричнево-зеленого цвета, используя способ примера 27. Пример 41. Получение 2-(4-аминосульфонилфенил)-1-(3-хлор-4-метоксифенил)этанона(промежуточное 7, R4=Н, R5=Cl, R6=ОСН 3). Указанное в заголовке соединение получают из 2-фенил-1-(3-хлор-4-метоксифенил) этанона в виде порошка бледно желтого цвета,используя способ примера 23. Пример 42. Получение 2-(4-аминосульфонилфенил)-2-бром-1-(3-хлор-4-метоксифенил)этанона (промежуточное II, R1=NH2,R4=Н, R5=Cl, R6=ОСН 3). Указанное в заголовке соединение получают из 2-(4-аминосульфонилфенил)-1-(3-хлор 4-метоксифенил)этанона в виде порошка бледно коричневого цвета, используя способ примера 24. Пример 43. Получение 2-(3-хлор-4 метоксифенил)-3-(4-аминосульфонилфенил) имидазо[1,2 а]пиридина (продукт Iwww). Указанное в заголовке соединение получают из 2-(4-аминосульфонилфенил)-2-бром-1(3-хлор-4-метоксифенил)этанона в виде порош 21 ка бледно желтого цвета, используя способ примера 25. Пример 44. Получение 2-(4-аминосульфонилфенил)-1-(3-фтор-4-метоксифенил)этанона(промежуточное 7, R4=Н, R5=F, R6=ОСН 3). Указанное в заголовке соединение получают из 2-фенил-1-(3-фтор-4-метоксифенил) этанона в виде порошка бледно коричневого цвета, используя способ примера 23. Пример 45. Получение 2-(4-аминосульфонилфенил)-2-бром-1-(3-фтор-4-метоксифенил) этанона (промежуточное II, R1=NH2, R4=Н,R5=F, R6=ОСН 3). Указанное в заголовке соединение получают из 2-(4-аминосульфонилфенил)-1-(3-фтор 4-метоксифенил)этанона в виде порошка бледно коричневого цвета, используя способ примера 24. Пример 46. Получение 2-(3-фтор-4 метоксифенил)-3-(4-аминосульфонилфенил) имидазо[1,2 а]пиримидина (продукт Iр). Указанное в заголовке соединение получают из 2-(4-аминосульфонилфенил)-2-бром-1(3-фтор-4-метоксифенил)этанона в виде порошка бледно желтого цвета, используя способ примера 26. Пример 47. Получение 2-фенил-1-(3 фторфенил)этанола(промежуточное 9,R4=R6=Н, R5=F). Порошок магния (12,8 г, 527 ммоль) покрывают 30 мл предварительно полученного раствора 82,6 г (483 ммоль) бензилбромида в 500 мл диэтилового эфира. После того, как начинается реакция, остальной раствор добавляют с такой скоростью, чтобы кипение с обратным холодильником не прекращалось во время добавления. После завершения добавления реакционную смесь перемешивают при кипячении с обратным холодильником в течение 30 мин, и охлаждают до 0 С. К реакционной смеси добавляют 50,0 г (403 ммоль) 3-фторбензальдегида в 250 мл диэтилового эфира. Смесь перемешивают при комнатной температуре до завершения реакции. Затем смесь обрабатывают 300 мл насыщенного водного раствора аммонийхлорида. Органический слой выделяют, промывают последовательно 500 мл 40% водного раствора бисульфида натрия (дважды), 500 мл 5% водного раствора бикарбоната натрия и 300 мл воды. Органический слой сушат, осушающий агент отфильтровывают, и фильтрат выпаривают в вакууме, получая 80,4 г (93%) указанного в заголовке соединение в виде масла желтого цвета,которое можно использовать без дальнейшей очистки. Пример 48. Получение 2-фенил-1-(3 фторфенил)этанона(350 ммоль) 2-фенил-1-(3-фторфенил)этанола в 1,5 л дихлорметана. Эту смесь перемешивают в 22 течение 3 ч при комнатной температуре, и затем реакционную смесь очищают, фильтруя через силикагель (силикагель/реакционная смесь,10:1), используя в качестве элюента смесь этилацетата и гексана (1:10), и получая 26,1 г (35%) указанного в заголовке соединения в виде твердого вещества белого цвета. Пример 49. Получение 2-(4-аминосульфонилфенил)-1-(3-фторфенил)этанона (промежуточное 7, R4=R6=Н, R5=F). К 85,1 мл хлорсульфоновой кислоты,предварительно охлажденной до -5 С, порциями добавляют 20,4 г 2-фенил-1-(3-фторфенил)этанона. Реакционную смесь перемешивают в течение 20 ч при комнатной температуре, и выливают на 2,2 кг льда. Эту смесь перемешивают в течение 2 ч, и дважды экстрагируют этилацетатом (2 х 850 мл). Органический слой трижды промывают 950 мл соляного раствора и обрабатывают 215 мл аммиака. Полученную смесь перемешивают в течение 1 ч. Органический слой выделяют и четыре раза промывают 300 мл 2 н. раствора водной соляной кислоты и дважды 300 мл соляного раствора. Органический слой сушат, осушающий агент отфильтровывают, и фильтрат выпаривают в вакууме. Полученный остаток промывают диэтиловым эфиром, получая 8,3 г (30%) указанного в заголовке соединения. Пример 50. Получение 2-бром-2-(4-аминосульфонилфенил)-1-(3-фторфенил)этанона(промежуточное II, R1=NН 2, R4=R6=Н, R5=F). Смесь 39 мл бромисто-водородной кислоты 33% в ледяной уксусной кислоте добавляют к раствору 8,2 г (22 ммоль) 2-(4-аминосульфонилфенил)-1-(3-фторфенил)этанона в 157 мл ледяной уксусной кислоты в атмосфере азота. После окончания добавления к смеси по каплям добавляют 3,5 г (22 ммоль) брома. Реакционную смесь перемешивают в течение 3 ч при комнатной температуре и выливают в 600 мл воды. Эту смесь перемешивают в течение 45 мин, фильтруют и осторожно промывают водой. Полученное твердое вещество растворяют в этилацетате и промывают 5 раз 100 мл 5% водного раствора бикарбоната натрия и 3 раза 150 мл соляного раствора. Органический слой сушат над сульфатом натрия, фильтруют, и фильтрат концентрируют в вакууме. Полученный остаток промывают 50 мл гексана, получая 5,7 г (54%) указанного в заголовке соединения. Пример 51. Получение 2-(3-фторфенил)-3(4-аминосульфонилфенил)имидазо[1,2 а][1,2,4] триазина (продукт Ihh). Смесь 2,0 г 2-бром-2-(4-аминосульфонилфенил)-1-(3-фторфенил)этанона, 8,0 г 3 амино-1,2,4-триазина и 300 мл этанола кипятят с обратным холодильником в атмосфере азота до завершения реакции. Реакционную смесь охлаждают и очищают, фильтруя через силикагель. Ее концентрируют, и полученное твердое вещество растворяют в 200 мл дихлорметана. Орга 23 нический слой промывают 150 мл 5% водного раствора бикарбоната натрия, и 150 мл воды. Полученный остаток промывают вначале гексаном, затем изопропанолом, получая 270 мг(13%) указанного в заголовке соединения. Пример 52. Получение 2-(3-фторфенил)-3(4-аминосульфонилфенил)имидазо[1,2 а]пиримидина (продукт It). Смесь 2,0 г 2-бром-2-(4-аминосульфонилфенил)-1-(3-фторфенил)этанона, 8,0 г 2 аминопиримидина и 300 мл этанола кипятят с обратным холодильником в атмосфере азота до завершения реакции. Реакционную смесь охлаждают и очищают, фильтруя через силикагель. Ее концентрируют, и полученное твердое вещество растворяют в 200 мл этилацетата. Органический слой промывают 150 мл 5% водного раствора бикарбоната натрия и 150 мл воды. Полученный твердый остаток промывают вначале гексаном, а затем изопропанолом, получая 1,1 г(55%) указанного в заголовке соединения. Пример 53. Получение 2-(3-фторфенил)-3(4-аминосульфонилфенил)имидазо[1,2 а]пиридина (продукт Iqqq). Смесь 1,4 г 2-бром-2-(4-аминосульфонилфенил)-1-(3-фторфенил)этанона, 7,5 г 2 аминопиридина и 300 мл этанола кипятят с обратным холодильником в атмосфере азота до завершения реакции. Реакционную смесь охлаждают и очищают, фильтруя через силикагель. Смесь концентрируют, и полученное твердое вещество растворяют в 200 мл этилацетата. Органический слой промывают 150 мл 5% водного раствора бикарбоната натрия и 150 мл воды. Полученный остаток промывают вначале гексаном, а затем изопропанолом, получая 940 мгin vitro. Цельную кровь, полученную от добровольцев без видимых соответствующих воспалительных состояний и не принимавших какихлибо NSAIDs в течение, по крайней мере, 15 дней до взятия крови, используют для оценки эффекта ингибирования СОХ-2 синтезированными соединениями. Аликвоты крови по 500 мкл инкубируют либо с ДМСО (носитель), либо с тестовыми соединениями в конечных концентрациях, варьирующихся от 0,1 до 25 мкМ, в течение 15 мин при 37 С. Затем добавляют 5 мкл LPS (липополисахариды из E.Choli, серотип: 0111:В 4, SIGMA) с конечными концентрациями 100 мкг/мл, и инкубирование продолжают в течение 24 ч при 37 С для индуцирования СОХ-2. В конце процесса инкубирования кровь центрифугируют при 10000 об/мин для получения плазмы, и полученные образцы хранят при-80 С. Уровни PGE2 в плазме устанавливают,используя EIA (Cayman Chemical). Результаты представлены как ИK50 в таблице. Пример 55. Анализ ингибирования COX-1 24 Свежую кровь отбирают в стерильные контейнеры с антикоагулянтами или без них. Аликвоты по 500 мкл немедленно переносят в ампулы Эппендорфа, в которые предварительно помещены каждое из тестовых соединений при конечных концентрациях, варьирующихся от 0,1 до 100 мкМ. Ампулы Эппендорфа вращают и инкубируют при 37 С в течение 1 ч. В конце инкубирования плазму получают путем центрифугирования, и хранят ее при -80 С. Уровни ТХВ 2 в плазме устанавливают, используя EIA(Cayman Chemical). Полученные результаты представлены как ИК 50 в таблице. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Замещенный имидазо[1,2 а]азин формулы (I) или его фармацевтически приемлемый сольват и его соль присоединения кислоты, где А и В независимо выбирают из N и СН, при условии, что если А представляет N, тогда В также представляет N; R1 выбирают из группы,состоящей из СН 3 и NH2; R2 и R3 выбирают из группы, состоящей из Н, СН 3, Сl, Вr, СОСН 3 и ОСН 3; и R4, R5 и R6, каждый независимо, выбирают из группы, состоящей из Н, F, Cl, Br, (C1 С 3)алкила, трифторметила, (C1-С 3)алкокси и трифторметокси.R выбирают из группы, состоящей из Н, F, Cl,метила, изопропила, метокси и этокси. 4. Соединение по п.3, в котором указанное соединение выбирают из группы, состоящей из(Iu) 2-(3-хлорфенил)-3-(4-аминосульфонилфенил)имидазо[1,2 а]пиримидина. 5. Соединение по п.4, в котором указанным соединением является 3-(4-метилсульфонилфенил)-2-(4-фторфенил)имидазо[1,2 а]пиримидин (Iс). 6. Соединение по п.4, в котором указанным соединением является 3-(4-метилсульфонилфенил)-2-(4-метоксифенил)имидазо[1,2 а] пиримидин (If). 7. Соединение по п.4, в котором указанным соединением является 3-(4-метилсульфонилфенил)-2-(4-этоксифенил)имидазо[1,2 а]пиримидин (Ig). 8. Соединение по п.1, в котором А представляет N и В представляет N. 9. Соединение по п.8, в котором R4, R5 и R6 выбирают из группы, состоящей из Н, F, Cl, метила, изопропила, метокси и этокси. 10. Соединение по п.9, в котором указанное соединение выбирают из группы, состоящей изR выбирают из группы, состоящей из Н, F, Cl,метила, изопропила, метокси и этокси. 13. Соединение по п.12, в котором указанное соединение выбирают из группы, состоящей из(Ixxx) 2-(3,4-дифторфенил)-3-(4-аминосульфонилфенил)имидазо[1,2 а]пиридина. 14. Фармацевтическая композиция, включающая терапевтически эффективное количество соединения формулы (I) по любому из пп.113, и соответствующие количества фармацевтически приемлемых носителей. 15. Фармацевтическая композиция для лечения воспалительного заболевания, включающая терапевтически эффективное количество соединения формулы (I) по любому из пп.1-13,и соответствующие количества фармацевтически приемлемых носителей. 16. Фармацевтическая композиция для лечения опосредствованного циклооксигеназой заболевания, включающая терапевтически эффективное количество соединения формулы (I) по любому из пп.1-13, и соответствующие количества фармацевтически приемлемых носителей. 17. Фармацевтическая композиция для селективного ингибирования циклооксигеназы 2(СОХ-2), включающая терапевтически эффективное количество соединения формулы (I) по любому из пп. 1-13, и соответствующие количества фармацевтически приемлемых носителей. 18. Применение соединения формулы (I) по любому из пп.1-13 для получения лекарственного средства для лечения воспаления. 19. Применение соединения формулы (I) по любому из пп.1-13 для получения лекарственного средства для лечения опосредствованного циклооксигеназой заболевания. 28 20. Применение соединения формулы (I) по любому из пп.1-13 для получения лекарственного средства для селективного ингибирования циклооксигеназы 2 (COX-2). 21. Применение соединения формулы (I) по любому из пп.1-13 для получения лекарства для лечения ракового заболевания. 22. Применение по п.21, в котором раковым заболеванием является рак ободочной кишки. 23. Способ получения замещенного имидазо[1,2 а]азина формулы (I) по п.1, включающий реакцию конденсации замещенного 2-бром-2-(4R1-cyльфoнилфeнил)-1-фенилэтанона формулы(II) с замещенным аминоазином формулы (III), в полярном растворителе
МПК / Метки
МПК: C07D 487/04, A61K 31/53, C07D 471/04, A61P 35/00
Метки: азины, селективные, амидазо, замещенные, ингибиторы, сох-2
Код ссылки
<a href="https://eas.patents.su/15-3399-zameshhennye-amidazo-1-2a-aziny-kak-selektivnye-soh-2-ingibitory.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные амидазо [1, 2а] азины как селективные сох-2 ингибиторы</a>
Предыдущий патент: Лекарственный комплекс c полимерным носителем
Следующий патент: Азабициклические лиганды рецепторов 5нт1
Случайный патент: Коробка и её крышка