Новое производное фенилимидазола в качестве ингибитора фермента pde10a, фармацевтическая композиция на его основе и его применение для лечения нейродегенеративных и психиатрических расстройств
Номер патента: 21410
Опубликовано: 30.06.2015
Авторы: Фарах Мохамед М., Нильсен Якоб, Ритзен Андреас, Келер Ян, Ланггор Мортен, Килберн Джон Пол
Формула / Реферат
1. Соединение - 5,8-диметил-2-[2-(1-метил-4-фенил-1Н-имидазол-2-ил)этил][1,2,4]триазоло[1,5-а]пиразин
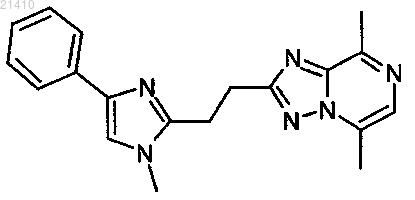
и/или его фармацевтически приемлемые кислотно-аддитивные соли.
2. Применение соединения по п.1 в качестве лекарственного средства для лечения нейродегенеративного или психиатрического расстройства.
3. Применение соединения по п.1 для лечения нейродегенеративного или психиатрического расстройства в комбинации с одним или несколькими нейролептическими лекарственными средствами, выбранными из группы, включающей сертиндол, оланзапин, рисперидон, кветиапин, арипипразол, галоперидол, клозапин, зипрасидон и осанетант, где нейродегенеративное расстройство выбрано из группы, включающей болезнь Альцгеймера, мультиинфарктную деменцию, алкогольную деменцию или деменцию, связанную с другими наркотическими средствами, деменцию, связанную с внутричерепными опухолями или травмой мозга, деменцию, связанную с болезнью Хантингтона или болезнью Паркинсона, или деменцию, связанную со СПИД; делирию; расстройство памяти; посттравматическое стрессовое расстройство; врожденное слабоумие; расстройство обучения, представляющее собой расстройство обучения чтению, расстройство обучения математике или расстройство обучения письменному выражению мыслей; синдром дефицита внимания/гиперактивности; возрастное снижение умственной деятельности; и психиатрическое расстройство выбрано из группы, включающей шизофрению, представляющую собой шизофрению параноидного типа, тяжелую форму шизофрении с преобладанием бессвязности, притупленными, парадоксальными эмоциями и отсутствием систематизированного бреда, шизофрению кататонического, недифференцированного или резидуального типа; шизофрениформное заболевание; шизоаффективное расстройство, представляющее собой расстройство бредового типа или депрессивного типа; бредовое расстройство; биполярное расстройство, представляющее собой биполярное расстройство I типа, биполярное расстройство II типа и циклотимическое расстройство; психотическое расстройство, вызванное веществом, представляющее собой психоз, вызванный алкоголем, амфетамином, марихуаной, кокаином, галлюциногенами, летучими соединениями, опиоидами или фенциклидином; расстройство личности параноидного типа и расстройство личности шизоидного типа.
4. Применение соединения по п.1 для получения лекарственного средства для лечения нейродегенеративного или психиатрического расстройства, где нейродегенеративное расстройство выбрано из группы, включающей болезнь Альцгеймера, мультиинфарктную деменцию, алкогольную деменцию или деменцию, связанную с другими наркотическими средствами, деменцию, связанную с внутричерепными опухолями или травмой мозга, деменцию, связанную с болезнью Хантингтона или болезнью Паркинсона, или деменцию, связанную со СПИД; делирию; расстройство памяти; посттравматическое стрессовое расстройство; врожденное слабоумие; расстройство обучения, представляющее собой расстройство обучения чтению, расстройство обучения математике или расстройство обучения письменному выражению мыслей; синдром дефицита внимания/гиперактивности; возрастное снижение умственной деятельности; и психиатрическое расстройство выбрано из группы, включающей шизофрению, представляющую собой шизофрению параноидного типа, тяжелую форму шизофрении с преобладанием бессвязности, притупленными, парадоксальными эмоциями и отсутствием систематизированного бреда, шизофрению кататонического, недифференцированного или резидуального типа; шизофрениформное заболевание; шизоаффективное расстройство, представляющее собой расстройство бредового типа или депрессивного типа; бредовое расстройство; биполярное расстройство, представляющее собой биполярное расстройство I типа, биполярное расстройство II типа и циклотимическое расстройство; психотическое расстройство, вызванное веществом, представляющее собой психоз, вызванный алкоголем, амфетамином, марихуаной, кокаином, галлюциногенами, летучими соединениями, опиоидами или фенциклидином; расстройство личности параноидного типа и расстройство личности шизоидного типа.
5. Способ лечения пациента, страдающего нейродегенеративным или психиатрическим расстройством, где нейродегенеративное расстройство выбрано из группы, включающей болезнь Альцгеймера, мультиинфарктную деменцию, алкогольную деменцию или деменцию, связанную с другими наркотическими средствами, деменцию, связанную с внутричерепными опухолями или травмой мозга, деменцию, связанную с болезнью Хантингтона или болезнью Паркинсона, или деменцию, связанную со СПИД; делирию; расстройство памяти; посттравматическое стрессовое расстройство; врожденное слабоумие; расстройство обучения, представляющее собой расстройство обучения чтению, расстройство обучения математике или расстройство обучения письменному выражению мыслей; синдром дефицита внимания/гиперактивности; возрастное снижение умственной деятельности; и психиатрическое расстройство выбрано из группы, включающей шизофрению, представляющую собой шизофрению параноидного типа, тяжелую форму шизофрении с преобладанием бессвязности, притупленными, парадоксальными эмоциями и отсутствием систематизированного бреда, шизофрению кататонического, недифференцированного или резидуального типа; шизофрениформное заболевание; шизоаффективное расстройство, представляющее собой расстройство бредового типа или депрессивного типа; бредовое расстройство; биполярное расстройство, представляющее собой биполярное расстройство I типа, биполярное расстройство II типа и циклотимическое расстройство; психотическое расстройство, вызванное веществом, представляющее собой психоз, вызванный алкоголем, амфетамином, марихуаной, кокаином, галлюциногенами, летучими соединениями, опиоидами или фенциклидином; расстройство личности параноидного типа и расстройство личности шизоидного типа, где указанный способ включает введение эффективного количества соединения по п.1 пациенту, одного или в комбинации с одним или несколькими нейролептическими средствами, выбранными из сертиндола, оланзапина, рисперидона, кветиапина, арипипразола, галоперидола, клозапина, зипрасидона и осанетанта.
6. Фармацевтическая композиция для лечения нейродегенеративных или психиатрических расстройств, содержащая соединение по п.1 и одно или несколько фармацевтически приемлемых носителей, разбавителей и эксципиентов.
7. Применение соединения по п.1 для лечения нейродегенеративного или психиатрического расстройства, где нейродегенеративное расстройство выбрано из группы, включающей болезнь Альцгеймера, мультиинфарктную деменцию, алкогольную деменцию или деменцию, связанную с другими наркотическими средствами, деменцию, связанную с внутричерепными опухолями или травмой мозга, деменцию, связанную с болезнью Хантингтона или болезнью Паркинсона, или деменцию, связанную со СПИД; делирию; расстройство памяти; посттравматическое стрессовое расстройство; врожденное слабоумие; расстройство обучения, представляющее собой расстройство обучения чтению, расстройство обучения математике или расстройство обучения письменному выражению мыслей; синдром дефицита внимания/гиперактивности; возрастное снижение умственной деятельности; и психиатрическое расстройство выбрано из группы, включающей шизофрению, представляющую собой шизофрению параноидного типа, тяжелую форму шизофрении с преобладанием бессвязности, притупленными, парадоксальными эмоциями и отсутствием систематизированного бреда, шизофрению кататонического, недифференцированного или резидуального типа; шизофрениформное заболевание; шизоаффективное расстройство, представляющее собой расстройство бредового типа или депрессивного типа; бредовое расстройство; биполярное расстройство, представляющее собой биполярное расстройство I типа, биполярное расстройство II типа и циклотимическое расстройство; психотическое расстройство, вызванное веществом, представляющее собой психоз, вызванный алкоголем, амфетамином, марихуаной, кокаином, галлюциногенами, летучими соединениями, опиоидами или фенциклидином; расстройство личности параноидного типа и расстройство личности шизоидного типа.
Текст
НОВОЕ ПРОИЗВОДНОЕ ФЕНИЛИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРА ФЕРМЕНТА PDE10A, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ЕГО ОСНОВЕ И ЕГО ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ НЕЙРОДЕГЕНЕРАТИВНЫХ И ПСИХИАТРИЧЕСКИХ РАССТРОЙСТВ Ритзен Андреас, Келер Ян, Ланггор Мортен, Нильсен Якоб, Килберн Джон Пол (DK), Фарах Мохамед М. (GB) и его фармацевтически приемлемым кислотно-аддитивным солям, пригодным для лечения нейродегенеративного или психиатрического расстройства. Область техники, к которой относится изобретение Настоящее изобретение предоставляет соединение, которое является ингибитором ферментаPDE10A и полезно при лечении нейродегенеративных и психиатрических расстройств. Настоящее изобретение предоставляет также фармацевтические композиции, содержащие соединение согласно настоящему изобретению, и способы лечения расстройств с использованием соединения настоящего изобретения. Предпосылки создания изобретения В данном описании приводятся ссылки на различные публикации во всей их полноте. Таким образом, содержание указанных публикаций включено в данное описание посредством ссылки для более полного описания уровня области техники, к которой относится настоящее изобретение. Циклические нуклеотиды - циклический аденозинмонофосфат (сАМР) и циклический гуанозинмонофосфат (cGMP) - функционируют в качестве вторичных внутриклеточных мессенджеров, регулирующих широкий спектр процессов в нейронах. Внутриклеточные сАМР и cGMP генерируются аденил- и гуанилциклазами и разлагаются циклическими нуклеотидными фосфодиэстеразами (phosphodiesterases PDE). Внутриклеточные уровни сАМР и cGMP контролируются внутриклеточной передачей сигнала, и стимуляция/репрессия аденил- и гуанилциклаз в ответ на активацию GPCR является конкретно описанным способом контроля концентраций циклических нуклеотидов (Antoni, F.A. Front. Neuroendocrinol. 2000, 21, 103-132). Уровни сАМР и cGMP, в свою очередь, контролируют активность сАМР- и cGMPзависимых киназ, а также других белков с элементами циклических нуклеотидных ответов, которые через последующее фосфорилирование белков и другие процессы регулируют ключевые нейронные функции, такие как синаптическая передача, нейронная дифференциация и выживаемость. Выявлен 21 фосфодиэстеразный ген, которые можно подразделить на 11 генных семейств. PDE представляют собой класс внутриклеточных ферментов, которые регулируют уровни сАМР и cGMP посредством гидролиза циклических нуклеотидов в соответствующие нуклеотидмонофосфаты. НекоторыеPDE разлагают сАМР, некоторые разлагают cGMP, а некоторые разлагают те и другие. БольшинствоPDE широко экспрессировано и функционирует во многих тканях, в то время как некоторые являются более тканеспецифичными. Фосфодиэстераза 10 А (phosphodieasterase 10A - PDE10A) является фосфодиэстеразой двойной специфичности, которая может преобразовывать как сАМР в AMP, так и cGMP в GMP (Loughney, K. et al.Res. Comm. 1999, 261, 551-557; Seeger, T.F. et al. Brain Research, 2003, 985, 113-126). Мышиная PDE10A является первым идентифицированным представителем PDE10 семейства фосфодиэстераз (Fujishige, K. et al. J. Biol. Chem. 1999, 274, 18438-18445; Loughney, K. et al. Gene, 1999, 234,109-117), и были идентифицированы N-концевые сплайсированные варианты генов крысы и человека(Kotera, J. et al. Biochem. Biophys. Res. Comm. 1999, 261, 551-557; Fujishige, K. et al. Eur. J. Biochem. 1999,266, 1118-1127). Существует высокая степень гомологии между видами. Но в отличие от других PDE семейств, PDE10 локализована только у млекопитающих. мРНК для PDE10 высокоэкспрессирована в мужской половой железе и в мозге (Fujishige, K. et al. Eur J. Biochem. 1999, 266, 1118-1127; Soderling, S. etal. Proc. Natl. Acad. Sci. 1999, 96, 7071-7076; Loughney, K. et al. Gene, 1999, 234, 109-117). Указанные исследования показывают, что экспрессия PDE10 в мозге является наивысшей в стриатруме (хвост и скорлупа чечевидного ядра), прилежащем ядре и обонятельном бугорке. Позднее был проведен анализ конфигурации экспрессии PDE10A мРНК (Seeger, T.F. et al. Abst. Soc. Neurosci. 2000, 26, 345.10) и PDE10A белка (Menniti, F.S. et al. William Harvey Research Conference "Phosphodiesterase in Health and Disease",Porto, Portugal, Dec. 5-7, 2001) в мозге крысы.PDE10A экспрессируется с высокими уровнями средними шипиковыми нейронами (medium spinyneurons - MSN) хвостовых ядер, прилежащим ядром и соответствующими нейронами обонятельного бугорка. Они образуют ядро базальной системы нервных узлов. MSN играют ключевую роль в кортикобазальной ганглиально-таламо-кортикальной петле, интегрируя конвергентный кортикально/таламный вход и посылая эту интегрированную информацию назад в кортикальный слой. MSN экспрессируют два функциональных класса нейронов: класс D1, экспрессирующий D1 дофаминовые рецепторы, и класс D2,экспрессирующий D2 дофаминовые рецепторы. D1 класс нейронов является частью "прямого" стриарного метаболического пути выхода, который свободно функционирует для усиления поведенческих ответов.D2 класс нейронов является частью "непрямого" стриарного пути выхода, который функционирует для подавления поведенческих ответов, конкурирующих с ответами, которым способствует "прямой" путь. Такие конкурирующие проводящие пути действуют подобно тормозу и акселератору в автомобиле. В самом простом представлении ограниченное движение при болезни Паркинсона является результатом сверхактивности "непрямого" пути, в то время как избыточное движение при таких расстройствах, как болезнь Хантингтона, отражает повышенную активность прямого пути метаболизма. PDE10A регуляция проведения сигналов сАМР и/или cGMP в дендритном компартменте этих нейронов может быть вовлечена в фильтрацию кортико/таламного входа в MSN. Кроме того, PDE10A может быть вовлечена в регу-1 021410(Seeger, T.F. et al. Brain Research, 2003, 985, 113-126). Антагонизм дофаминового D2 рецептора четко установлен при лечении шизофрении. Начиная с 1950-х годов, антагонизм дофаминового D2 рецептора был главной основой лечения психоза, и все эффективные нейролептические лекарственные средства противодействуют D2 рецепторам. Действие D2,вероятно, проводится, главным образом, через нейроны в полосатом теле, прилежащем ядре и обонятельном бугорке, поскольку эти области воспринимают наиболее плотные дофаминергические проекции и имеют наиболее сильную экспрессию D2 рецепторов (Konradi, С. and Heckers, S. Society of BiologicalPsychiatry, 2001, 50, 729-742). Антагонизм дофаминовых D2 рецепторов приводит к снижению уровней сАМР в клетках, где они экспрессируются через ингибирование аденилатциклазы, и это является компонентом процесса проведения D2 сигнала (Stoof, J.C.; Kebabian J.W. Nature, 1981, 294, 366-368; Neve, K.A.et al. Journal of Receptors and Signal Transduction, 2004, 24, 165-205). И наоборот, антагонизм D2 рецептора эффективно повышает уровни сАМР, и этот результат мог бы быть имитирован ингибированием сАМР разлагающих фосфодиэстераз. Большинство из 21 фосфодиэстеразного гена широко экспрессировано; следовательно, ингибирование, вероятно, имеет побочные эффекты. Поскольку PDE10 в данном контексте обладает желаемым профилем экспрессии с высокой и относительно специфической экспрессией в нейронах в полосатом теле,прилежащем ядре и обонятельном бугорке, ингибирование PDE10A, вероятно, обладает эффектами, аналогичными антагонизму D2 рецептора, и, следовательно, обладает нейролептическим действием. Хотя ингибирование PDE10, как ожидается, частично имитирует антагонизм D2 рецептора, можно ожидать, что оно имеет иной профиль. D2 рецептор имеет, помимо сАМР, и другие компоненты проведения сигнала (Neve, K.A. et al. Journal of Receptors and Signal Transduction, 2004, 24, 165-205), и поэтому подавление сАМР через ингибирование PDE10A может негативно модулировать, а не напрямую подавлять проведение дофаминового сигнала через D2 рецепторы. Это может снижать риск экстрапирамидальных побочных эффектов, которые наблюдались при сильном D2 антагонизме. И напротив, PDE10A ингибирование может обладать некоторыми эффектами, не наблюдаемыми при антагонизме D2 рецептора.PDE10A также экспрессирована в D1 рецепторах, экспрессирующих стриарные нейроны (Seeger, T.F. etal. Brain Research, 2003, 985, 113-126). Поскольку антагонизм D1 рецептора приводит к стимулированию аденилатциклазы и, как результат, к повышению уровней сАМР, ингибирование PDE10A, вероятно, также обладает эффектами, которые имитируют антагонизм В 1 рецептора. И наконец, PDE10A ингибирование будет не только повышать уровни сАМР в клетках, но, как может ожидаться, также повышать уровни cGMP, поскольку PDE10A является фосфодиэстеразой с двойной специфичностью. cGMP активирует ряд целевых белков в клетках, подобных сАМР, а также взаимодействует с путями проведения сАМР сигнала. В заключение, PDE10A ингибирование, вероятно, частично имитирует антагонизм D2 рецептора и, следовательно, обладает нейролептическим действием, но его профиль может отличаться от профиля,который наблюдается у классических антагонистов D2 рецептора. Было показано, что папаверин, ингибитор PDE10A, является активным в отношении некоторых антипсихотических моделей. Папаверин усиливал каталептическое действие антагониста D2 рецептора галоперидола у крыс, но сам по себе не вызывал каталепсии (WO 03/093499). Папаверин снижал повышенную активность крыс, вызванную РСР, в то время снижение амфетамин-индуцированной гиперактивности было незначительным (WO 03/093499). Эти модели показывают, что PDE10A ингибирование обладает классическим нейролептическим потенциалом, который является ожидаемым из теоретических соображений. В WO 03/093499 дополнительно описано применение селективных PDE10A ингибиторов для лечения ассоциированных неврологических и психиатрических расстройств. Кроме того, ингибированиеPDE10A может ослаблять когнитивные расстройства, связанные с шизофренией. Распределение PDE10A в тканях показывает, что ингибиторы PDE10A могут применяться для повышения уровней сАМР и/или cGMP внутри клеток, которые экспрессируют PDE10A фермент, в частности нейронов, которые включают базальные ганглии, и, следовательно, ингибиторы PDE10A настоящего изобретения могут применяться при лечении различных ассоциированных нейропсихиатрических состояний, в которых задействованы базальные ганглии, таких как неврологические и психиатрические расстройства, шизофрения, биполярное расстройство, обсессивно-компульсивное расстройство и т.п., и могут обладать преимуществом отсутствия побочных эффектов, которые ассоциируются с терапевтическими лекарственными средствами, применяющимися в настоящее время. Кроме того, данные последних публикаций (WO 2005/120514, WO 2005/012485, Cantin et al., BioorganicMedicinal Chemistry Letters, 17 (2007), 2869-2873) свидетельствуют о том, что ингибиторыPDE10A могут применяться при лечении ожирения и инсулиннезависимого сахарного диабета. Что касается ингибиторов PDE10A, в ЕР 1250923 описано применение селективных PDE10A ингибиторов, в целом, и папаверина, в частности, для лечения некоторых неврологических и психиатрических расстройств. В WO 05/113517 описаны стереоспецифичные бензодиазепиновые соединения в качестве ингибиторов фосфодиэстеразы, в частности 2 и 4 типов, и предупреждение и лечение патологий, в которые вовлечены расстройства центральной и периферической нервной системы. В WO 02/88096 описаны производные бензодиазепина и их применения в качестве ингибиторов фосфодиэстеразы, в частности 4 типа, в области терапии. В WO 04/41258 описаны производные бензодиазепинона и их применения в качестве ингибиторов фосфодиэстеразы, в частности 2 типа, в области терапии. Пирролодигидроизохинолины и их производные описаны в качестве ингибиторов PDE10 вWO 05/03129 и WO 05/02579. Пиперидинилзамещенные хиназолины и изохинолины, которые служат в качестве ингибиторов PDE10A, описаны в WO 05/82883. В WO 06/11040 описаны замещенные производные хиназолина и изохинолина, которые служат в качестве ингибиторов PDE10. В US 29950182079 описаны замещенные тетрагидроизохинолинильные производные хиназолина и изохинолина, которые служат в качестве эффективных ингибиторов фосфодиэстеразы (PDE). В частности, в US 29950182079 описаны указанные соединения, которые являются селективными ингибиторами PDE10. Аналогично, вUS 20060019975 описаны пиперидин-производные хиназолина и изохинолина, которые служат в качестве эффективных ингибиторов фосфодиэстеразы (PDE). US 29950182079 также относится к соединениям,которые являются селективными ингибиторами PDE10. В WO 06/028957 описаны производные циннолина в качестве ингибиторов фосфодиэстеразы 10 типа для лечения психиатрических и неврологических синдромов. Однако в приведенных выше публикациях не описывается соединение настоящего изобретения, которое по своей структуре не относится ни к одному из известных ингибиторов PDE10 (Kehler, J. etal. Expert Opin. Ther. Patents, 2007, 17, 147-158). Соединение настоящего изобретения впервые описано в заявке WO 09/152825, приоритет которой заявлен. Доказано, что соединение настоящего изобретения является эффективным ингибитором фермента PDE10A и в условиях in vivo активным соединением, которое обращает РСР-индуцированную повышенную активность на 99%; таким образом, данное соединение может стать альтернативным соединением лекарственным средствам, продаваемым в настоящее время для лечения нейродегенеративных и/или психиатрических расстройств, которые неодинаково эффективны для всех пациентов. Поэтому все еще существует потребность в альтернативных способах лечения. Сущность изобретения Задачей настоящего изобретения является предоставление соединения, которое является селективным ингибитором PDE10A фермента. Дополнительной задачей настоящего изобретения является предоставление соединения, которое обладает такой активностью и которое обладает хорошей, предпочтительно повышенной, растворимостью, метаболической стабильностью и/или биологической доступностью по сравнению с соединениями предшествующего уровня. Еще одной задачей настоящего изобретения является предоставление эффективного лечения, в частности длительного лечения пациента, которым является человек, без побочных эффектов, обычно наблюдаемых у применяемых в настоящее время терапевтических средств для лечения неврологических и психиатрических расстройств. Другие предметы настоящего изобретения станут понятными из настоящего описания. Соответственно, изобретение относится к соединению, которое представляет собой 5,8-диметил-2[2-(1-метил-4-фенил-1 Н-имидазол-2-ил)этил][1,2,4]триазоло[1,5-а]пиразин формулы I В контексте настоящего описания термин "соединение настоящего изобретения" включает 5,8-диметил-2-[2-(1-метил-4-фенил-1 Н-имидазол-2-ил)этил][1,2,4]триазоло[1,5-а]пиразин формулы I и его фармацевтически приемлемые соли. Изобретение также относится к соединению настоящего изобретения или его фармацевтически приемлемой кислотно-аддитивной соли для применения в качестве лекарственного средства. В еще одном аспекте настоящее изобретение относится к фармацевтической композиции, включающей соединение настоящего изобретения и фармацевтически приемлемый носитель, разбавитель или эксципиент. Изобретение также относится к применению соединения настоящего изобретения для получения лекарственного средства для лечения нейродегенеративного или психиатрического расстройства. Изобретение также относится к соединению настоящего изобретения для применения в качестве лекарственного средства. Изобретение также относится к соединению настоящего изобретения для лечения психиатрического расстройства, выбранного из группы, включающей шизофрению, шизофрению параноидного типа,тяжелую форму шизофрении с преобладанием бессвязности, притупленными, парадоксальными эмоциями и отсутствием систематизированного бреда, шизофрению кататонического, недифференцированного или резидуального типа; шизофрениформное заболевание; шизоаффективное расстройство, бредового типа или депрессивного типа; бредовое расстройство; биполярное расстройство, биполярное расстройство I типа, биполярное расстройство II типа и циклотимическое расстройство; психотическое расстройство, вызванное веществом, психоз, вызванный алкоголем, амфетамином, марихуаной, кокаином, галлюциногенами, летучими соединениями, опиоидами или фенциклидином; расстройство личности параноидного типа и расстройство личности шизоидного типа. Кроме того, в еще одном аспекте настоящее изобретение относится к способу лечения субъекта,страдающего нейродегенеративным расстройством, включающему введение пациенту соединения настоящего изобретения. В еще одном аспекте настоящее изобретение относится к способу лечения субъекта, страдающего психиатрическим расстройством, включающему введение субъекту соединения настоящего изобретения. В еще одном варианте осуществления настоящее изобретение относится к способу лечения пациента, страдающего наркотической зависимостью, такой как хронический алкоголизм,амфетаминовая, кокаиновая или опиатная наркомания, включающему введение пациенту соединения настоящего изобретения. Подробное описание изобретения В описании термины "PDE 10", "PDE10A" и "PDE 10A фермент" используются взаимозаменяемо. Соединение настоящего изобретения при испытании, которое описано в разделе "Биологическое испытание ингибирования PDE 10 А фермента", проявляет значение IC50 примерно 2,2 нМ, что делает его применимым для ингибирования активности PDE 10A фермента. Кроме того, соединение было тестировано на способность к обратному изменению индуцированной фенилциклидином (РСР) гиперактивности. Обращение РСР эффекта было количественно определено как описано в разделе "Индуцированная фенилциклидином (РСР) гиперактивность". Результаты эксперимента показывают, что соединение настоящего изобретения, тестированное в опытах in vivo, является активным соединением, которое обращает РСР индуцированную гиперактивность на 99%. Фармацевтически приемлемые соли. Настоящее изобретение включает также соли соединения настоящего изобретения, как правило фармацевтически приемлемые соли. Такие соли включают фармацевтически приемлемые кислотноаддитивные соли. Кислотно-аддитивные соли включают соли неорганических кислот, а также соли органических кислот. Конкретные примеры подходящих неорганических кислот включают соляную, бромистоводородную, йодисто-водородную, фосфорную, серную, сульфаминовую, азотную и т.п. кислоты. Конкретные примеры подходящих органических кислот включают муравьиную, уксусную, трихлоруксусную, трифторуксусную, пропионовую, бензойную, коричную, лимонную, фумаровую, гликолевую, итаконовую, молочную, метансульфоновую, малеиновую, яблочную, малоновую, миндальную, щавелевую,пикриновую, пирувиновую, салициловую, янтарную, метансульфоновую, этансульфоновую, винную,аскорбиновую, памоиновую, бис-метиленсалициловую, этандисульфоновую, глюконовую, цитраконовую, аспаргиновую, стеариновую, пальмитиновую, EDTA, гликолевую, п-аминобензойную, глютаминовую,бензолсульфоновую,п-толуолсульфоновую,теофиллинуксусные кислоты,а также 8-галогентеофиллин, например 8-бромтеофиллин, и т.п. Дополнительные примеры фармацевтически приемлемых неорганических или органических кислотно-аддитивных солей включают фармацевтически приемлемые соли, приведенные в публикацииBerge, S.M. et al., J. Pharm. Sci. 1977, 66, 2, содержание которой включено в данное описание посредством ссылки. Кроме того, соединения настоящего изобретения могут существовать в несольватированных, а также в сольватированных формах с фармацевтически приемлемыми растворителями, такими как вода, этанол и т.п. Обычно сольватированные формы рассматриваются как эквивалент несольватированным формам для целей настоящего изобретения. Фармацевтические композиции. Настоящее изобретение дополнительно относится к фармацевтической композиции, включающей соединение настоящего изобретения и фармацевтически приемлемый носитель или разбавитель. Настоящее изобретение относится также к фармацевтической композиции, включающей соединение настоящего изобретения и фармацевтически приемлемый носитель или разбавитель. Соединение настоящего изобретения может вводиться само по себе или в сочетании с фармацевтически приемлемыми носителями, разбавителями или эксципиентами в разовой дозе или множественных дозах. Фармацевтические композиции настоящего изобретения могут вводиться в препарат с фармацевтически приемлемыми носителями или разбавителями, а также с любыми другими известными адъювантами и эксципиентами в соответствии со стандартными методиками, такими как описано, например, вRemington: The Science and Practice of Pharmacy, 19th Edition, Gennaro, Ed., Mack Publishing Co., Easton,PA, 1995. Фармацевтические композиции могут быть специфически разработаны для введения любым подходящим способом введения, таким как пероральный, ректальный, назальный, легочный, местный (включая трансбуккальный и подъязычный), чрескожный, интрацистернальный, интраперитонеальный, ваги-4 021410 нальный и парентеральный (включая подкожный, внутримышечный, интратекальный, внутривенный и внутрикожный) способы введения. Очевидно, что способ введения будет зависеть от общего состояния и возраста пациента, подлежащего лечению, природы состояния, подлежащего лечению, и активного ингредиента. Фармацевтические композиции для перорального введения включают твердые дозированные формы, такие как капсулы, таблетки, драже, пилюли, пастилки, порошки и гранулы. Когда это приемлемо,композиции могут быть получены с покрытиями, такими как энтеросолюбильные покрытия, или они могут быть получены для обеспечения контролируемого высвобождения активного ингредиента, такого как постепенное или длительное высвобождение, в соответствии со способами, известными в данной области техники. Жидкие дозированные формы для перорального введения включают растворы, эмульсии, суспензии, сиропы и эликсиры. Фармацевтические композиции для парентерального введения включают стерильные водные и неводные растворы, дисперсии, суспензии или эмульсии для инъекции, а также стерильные порошки,предназначенные для получения стерильных растворов или дисперсий для инъекции перед применением. Другие подходящие формы для введения включают, но не ограничиваясь ими, суппозитории, спреи, мази, кремы, гели, формы, вводимые при вдыхании, дермальные пластыри и импланты. Обычно дозировки для перорального введения находятся в интервале примерно от 0,001 до примерно 100 мг/кг массы тела в день. Обычно дозировки для перорального введения также находятся в интервале примерно от 0,01 до примерно 50 мг/кг массы тела в день. Конкретные дозировки для перорального введения также находятся в интервале примерно от 0,05 до примерно 10 мг/кг массы тела в день. Дозировки для перорального введения обычно вводятся в одной или нескольких дозах, обычно от одного до трех доз в день. Конкретная доза будет зависеть от частоты и способа введения, пола, возраста, массы тела и общего состояния пациента, подлежащего лечению, природы и тяжести состояния, подлежащего лечению, и любых сопутствующих заболеваний, подлежащих лечению, а также других факторов, очевидных для специалиста данной области техники. Композиции также могут быть представлены в единичной дозированной форме методами, известными специалисту данной области техники. Например, конкретная единичная дозированная форма для перорального введения может содержать примерно от 0,01 до примерно 1000 мг, примерно от 0,05 до примерно 500 мг или примерно от 0,5 г до примерно 200 мг. Для парентеральных способов введения, таких как внутривенное, интратекальное, внутримышечное и аналогичные способы введения, типичные дозы составляют порядка половины дозы, применяемой для перорального введения. Настоящее изобретение также относится к способу получения фармацевтической композиции,включающему смешивание соединения настоящего изобретения и по меньшей мере одного фармацевтически приемлемого носителя или разбавителя. Соединение настоящего изобретения обычно используется в виде свободного основания или в виде его соли. Для парентерального введения могут использоваться растворы соединения настоящего изобретения в стерильном водном растворе, водном пропиленгликоле, водном витамине Е или кунжутном или арахисовом масле. Такие водные растворы должны быть подходящим образом забуферены, если это необходимо, и жидкому разбавителю сначала придается изотоничность с помощью достаточного количества раствора соли или глюкозы. Водные растворы особенно подходят для внутривенного, внутримышечного,подкожного и интраперитонеального введения. Соединение настоящего изобретения может легко вводиться в известную стерильную водную среду с использованием стандартных методик, известных специалисту данной области. Подходящие фармацевтические носители включают твердые инертные разбавители или эксципиенты, стерильные водные растворы и различные органические растворители. Примеры твердых носителей включают лактозу, каолин, сахарозу, циклодекстрин, тальк, желатин, агар, пектин, гуммиарабик, стеарат магния, стеариновую кислоту и простые низшие алкиловые эфиры целлюлозы. Примеры жидких носителей включают, но не ограничиваясь ими, сироп, арахисовое масло, оливковое масло, фосфолипиды, жирные кислоты, амины жирных кислот, полиоксиэтилен и воду. Аналогично, носитель или разбавитель может включать любой материал для замедленного высвобождения действующего вещества, известный в данной области, такой как глицерилмоностеарат или глицерилдистеарат, сам по себе или в смеси с воском. Фармацевтические композиции, полученные объединением соединения настоящего изобретения и фармацевтически приемлемого носителя, затем легко вводятся в различные дозированные формы, подходящие для указанных способов введения. Композиции могут быть легко получены в единичной дозированной форме способами, известными в области фармации. Композиции настоящего изобретения, подходящие для перорального введения, могут быть представлены в виде дискретных единиц, таких как капсулы или таблетки, каждая из которых содержит предопределенное количество активного ингредиента и, необязательно, подходящий эксципиент. Кроме того, перорально доступные композиции могут быть представлены в форме порошка или гранул, раствора или суспензии в водной или неводной жидкости или эмульсии типа "масло в воде" или "вода в масле". Если для перорального введения используется твердый носитель, препарат может быть представлен в виде таблетки, введен в твердую желатиновую капсулу в форме порошка или в форме пеллета или он может быть представлен в форме лепешки или пастилки. Количество твердого носителя будет изменяться в широких пределах, но будет находиться в интервале примерно от 25 мг до примерно 1 г на единицу дозы. Если используется жидкий носитель, препарат может быть представлен в форме сиропа, эмульсии,мягкой желатиновой капсулы или стерильной жидкости для инъекции, такой как водная или неводная жидкая суспензия или раствор. Фармацевтические композиции настоящего изобретения могут быть получены способами, традиционными для данной области техники. Например, таблетки могут быть получены смешиванием активного ингредиента с обычными адъювантами и/или разбавителями и последующим прессованием смеси в стандартном аппарате для таблетирования с получением таблеток. Примеры адъювантов или разбавителей включают кукурузный крахмал, картофельный крахмал, тальк, стеарат магния, желатин, лактозу,смолы и т.п. Могут использоваться любые другие адъюванты или добавки, обычно используемые для таких целей, такие как красители, вкусовые добавки, консерванты и т.д., при условии, что они совместимы с активными ингредиентами. Лечение расстройств. Как указано выше, соединение настоящего изобретения является ингибитором фермента PDE10A и как таковое может применяться для лечения связанных с ним неврологических и психиатрических расстройств. Таким образом, изобретение относится к соединению формулы I, соединению настоящего изобретения, а также фармацевтической композиции, содержащей такое соединение, для применения при лечении нейродегенеративного расстройства, психического расстройства или наркомании у пациентов; где нейродегенеративное расстройство выбрано из группы, включающей болезнь Альцгеймера, мультиинфарктную деменцию, алкогольную деменцию или деменцию, связанную с другими наркотическими веществами, деменцию, связанную с внутричерепными опухолями или травмой мозга, деменцию, связанную с болезнью Хантингтона или болезнью Паркинсона, или деменцию, связанную со СПИД; делирию; расстройство памяти; посттравматическое стрессовое расстройство; врожденное слабоумие; расстройство обучения, например расстройство обучения чтению, расстройство обучения математике или расстройство обучения письменному выражению мыслей; синдром дефицита внимания/гиперактивности и возрастное снижение умственной деятельности; и где психиатрическое расстройство выбрано из группы,включающей шизофрению, например, параноидального типа, тяжелую форму шизофрении с преобладанием бессвязности, притупленными, парадоксальными эмоциями и отсутствием систематизированного бреда, шизофрению кататонического, недифференцированного или резидуального типа; шизофрениформное расстройство; шизоаффективное расстройство, например бредового типа или депрессивного типа; бредовое расстройство; психотическое расстройство, вызванное веществом, например психоз, вызванный алкоголем, амфетамином, марихуаной, кокаином, галлюциногенами, летучими соединениями,опиоидами или фенциклидином; расстройство личности параноидного типа и расстройство личности шизоидного типа; и где наркотическая зависимость представляет собой хронический алкоголизм, амфитаминовую, кокаиновую или опиатную зависимость. Настоящее изобретение предоставляет способ лечения пациента, страдающего нейродегенеративным расстройством, выбранным из расстройства познавательной способности или расстройства двигательной способности, где способ включает введение пациенту терапевтически эффективного количества соединения настоящего изобретения. Настоящее изобретение предоставляет также способ лечения пациента, страдающего психиатрическим расстройством, где указанный способ включает введение пациенту терапевтически эффективного количества соединения настоящего изобретения. Примеры психиатрических расстройств, которые могут лечиться в соответствии с настоящим изобретением, включают, но не ограничиваясь ими, шизофрению,например, параноидального типа, тяжелую форму шизофрении с преобладанием бессвязности, притупленными, парадоксальными эмоциями и отсутствием систематизированного бреда, шизофрению кататонического, недифференцированного или резидуального типа; шизофрениформное расстройство; шизоаффективное расстройство, например, бредового типа или депрессивного типа; бредовое расстройство; психотическое расстройство, вызванное веществом, например психоз, вызванный алкоголем, амфетамином, марихуаной, кокаином, галлюциногенами, летучими соединениями, опиоидами или фенциклидином; расстройство личности параноидного типа; расстройство личности шизоидного типа и невроз страха выбран из невроза страха панического типа; агорафобии; специфической фобии; социальной фобии; обсессивно-компульсивного расстройства; посттравматического стрессового расстройства; острого стрессового расстройства и генерализированного тревожного расстройства. Таким образом, настоящее изобретение относится к способу лечения пациента, страдающего психиатрическим расстройством, таким как шизофрения, где указанный способ включает введение пациенту соединения настоящего изобретения, как такового. Настоящее изобретение предоставляет также способ лечения пациента, страдающего расстройством познавательной способности, указанный способ включает введение пациенту соединения настоящего изобретения. Примеры расстройств познавательной способности, которые могут лечиться согласно настоящему изобретению, включают, но не ограничиваясь ими, болезнь Альцгеймера, мультиинфарктную деменцию, алкогольную деменцию или деменцию, связанную с другими наркотическими веществами,деменцию, связанную с внутричерепными опухолями или травмой мозга, деменцию, связанную с болезнью Хантингтона или болезнью Паркинсона, или деменцию, связанную со СПИД; делирию; расстройство памяти; посттравматическое стрессовое расстройство; врожденное слабоумие; расстройство обучения, например расстройство обучения чтению, расстройство обучения математике или расстройство обучения письменному выражению мыслей; синдром дефицита внимания/повышенной активности; возрастное снижение умственной деятельности. Настоящее изобретение предоставляет также способ лечения расстройства двигательной функции,включающий введение пациенту соединения настоящего изобретения. Примеры расстройств двигательной функции, которые могут лечиться согласно настоящему изобретению, включают, но не ограничиваясь ими, болезнь Хантингтона и дискинезию, связанную с терапевтическим лечением агонистами дофамина. Настоящее изобретение предоставляет также способ лечения расстройства двигательной функции,выбранного из болезни Паркинсона и синдрома усталых ног, включающий введение пациенту соединения настоящего изобретения. Настоящее изобретение предоставляет также способ лечения расстройства настроения, включающий введение пациенту соединения настоящего изобретения. Примеры расстройств настроения и эпизодов аномального настроения, которые могут лечиться согласно настоящему изобретению, включают, но не ограничиваясь ими, обширный эпизод депрессии слабого, среднего и тяжелого типа, эпизод маниакального или смешанного настроения, эпизод гипоманиакального настроения; эпизод депрессивного настроения с типичными отличительными признаками; эпизод депрессивного настроения с меланхолическими отличительными признаками; эпизод депрессивного настроения с кататоническими отличительными признаками; эпизод послеродового расстройства настроения; постинсультную депрессию; обширное депрессивное расстройство; дистимическое расстройство; незначительное депрессивное расстройство; предменструальное дисфоническое расстройство; постпсихотическое депрессивное расстройство при шизофрении; обширное депрессивное расстройство, наложенное на психическое расстройство, такое как бредовое расстройство или шизофрения; биполярное расстройство, например биполярное расстройство I типа, биполярное расстройство II типа и циклотимическое расстройство. Следует представлять,что расстройство настроения является психиатрическим расстройством. Настоящее изобретение относится также к способу лечения наркотической зависимости, например хронического алкоголизма, амфетаминовой, кокаиновой или опиатной наркомании, у пациента, где указанный способ включает введение указанному пациенту количества соединения настоящего изобретения,эффективного в лечении наркотической зависимости. Термин "наркотическая зависимость", когда используется в данном описании, означает патологическую потребность в наркотическом средстве и обычно характеризуется мотивационными нарушениями психического равновесия, такими как компульсивные побуждения принимать желаемое наркотическое средство и эпизодами страстного желания потребления наркотического средства. Наркотическая зависимость является достаточно широко изучаемым патологическим состоянием. Расстройство зависимости включает прогрессирование расстройства от острого употребления наркотических средств до развития поведения изыскания наркотических средств, восприимчивости к рецидиву их приема и сниженной, замедленной способности реагировать на природно-полезные стимулы. Например, в монографии Diagnostic and Statistical Manual of Mental Disorders, Fouth Edition (DSM-IV) определены три стадии зависимости: увлечение/антиципация, пьянство/интоксикация и абстиненция/негативная эмоциональная реакция. Эти стадии характеризуются, соответственно, повсеместной постоянной сильной потребностью употребления и озабоченностью в получении вещества; использованием большего количества вещества, чем это необходимо для ощущения эффектов интоксикации; и ощущение симптомов толерантности и абстиненции, а также снижение мотивации к нормальной жизнедеятельности. Настоящее изобретение дополнительно предоставляет способ лечения расстройства, включающего в качестве симптома дефицит внимания и/или познавательной способности, у пациента, где указанный способ включает введение указанному пациенту количества соединения настоящего изобретения, эффективного в лечении указанного расстройства. Другими расстройствами, которые могут быть подвергнуты лечению согласно настоящему изобретению, являются обсессивно-компульсивные расстройства, синдром Тауретта и другие тиковые расстройства. Термин "нейродегенеративное расстройство или состояние", когда используется в данном описании и если не указано иное, относится к расстройству или состоянию, которое вызвано дисфункцией и/или гибелью нейронов центральной нервной системы. Лечению указанных расстройств и состояний может способствовать введение средства, которое предупреждает дисфункцию или гибель нейронов при риске таких расстройств или состояний и/или повышает функцию поврежденных или здоровых нейронов таким образом, что компенсирует потерю функции, вызванную дисфункцией или гибелью нейронов повышенного риска. Термин "нейротрофическое средство", когда используется в данном описании, отно-7 021410 сится к веществу или средству, которое обладает некоторыми из указанных свойств или всеми указанными свойствами. Примеры нейродегенеративных расстройств и состояний, которые могут лечиться согласно настоящему изобретению, включают, но не ограничиваясь ими, болезнь Паркинсона, болезнь Хантингтона; деменцию, например деменцию при болезни Альцгеймера, мультиинфарктную деменцию, деменцию,связанную со СПИД, лобно-височную деменцию; нейродегенерацию, связанную с травмой мозга; нейродегенерацию, связанную с инсультом; нейродегенерацию, связанную с церебральным инфарктом; нейродегенерацию, вызванную гипогликемией; нейродегенерацию, связанную с эпилептическим припадком; нейродегенерацию, связанную с отравлением нейротоксинами; и мультисистемную атрофию. В одном варианте осуществления настоящего изобретения в нейродегенеративное расстройство или состояние вовлечена нейродегенерация стриарных средних шипиковых нейронов у пациента. В дополнительном варианте осуществления настоящего изобретения нейродегенеративное расстройство или состояние представляет собой болезнь Хантингтона. В еще одном варианте осуществления изобретение относится к способу лечения пациента для снижения содержания жира в организме, для снижения массы тела или для лечения инсулиннезависимого сахарного диабета (NIDDM), метаболического синдрома или толерантности к глюкозе, включающему введение пациенту, нуждающемуся в таком лечении, соединения настоящего изобретения. В некоторых вариантах осуществления изобретения пациент имеет избыточный вес или страдает ожирением, и соединение настоящего изобретения вводится перорально. В другом предпочтительном варианте осуществления изобретения способ дополнительно включает введение пациенту второго терапевтического средства,предпочтительно лекарственного средства для лечения ожирения, например римонабанта, орлистата,сибутрамина, бромокриптина, эфедрина, лептина, псевдоэфедрина, пептида YY3-36 или их аналогов. Термин "метаболический синдром", когда используется в данном описании, относится к констелляции состояний, которые приводят к высокому риску возникновения у людей заболевания коронарной артерии. Эти состояния включают диабет 2 типа, ожирение, высокое кровяное давление и плохой липидный профиль с повышенным содержанием LDL ("плохого") холестерина, низким содержание HDL ("хорошего") холестерина и повышенным содержанием триглицеридов. Все такие состояния связаны с высокими уровнями содержания инсулина в крови. Основным нарушением при метаболическом синдроме является инсулинорезистентность в жировой ткани и мышце. Все ссылки, включая публикации, заявки на патенты и патенты, цитированные в данном описании,введены в данное описание посредством ссылки во всей их полноте и в той же степени, как если бы каждая публикация была отдельно указана как введенная в описание посредством ссылки и внесена в описание во всей полноте (в максимальной степени, разрешенной законом). Заголовки и подзаголовки используются в данном описании только для удобства и не должны рассматриваться как ограничивающие данное изобретение каким-либо образом. Применение любого примера или всех примеров или выражений, указывающих на примеры (включая "например" и "такой как"), в настоящем описании предназначено только для более полного освещения настоящего изобретения, но не для ограничения области изобретения, если не указано иное. Цитирование и введение патентных документов выполнены только для удобства и не отражают какой бы то ни было оценки обоснованности, патентоспособности и/или обладанию исковой силой указанных патентных документов. Настоящее изобретение включает все модификации и эквиваленты предметов, указанных в прилагаемой формуле изобретения, насколько это разрешено законом. Экспериментальная часть Получение соединения настоящего изобретения. Соединение настоящего изобретения может быть получено, как показано на представленной далее схеме синтеза. Схема 1 В частности, соединения настоящего изобретения могут быть получены восстановлением алкена формулы V гидрированием с использованием катализатора переходного металла, такого как металлический палладий, и источника водорода, такого как газообразный водород, гидрокарбонат аммония или циклогексадиен. Указанные алкены формулы V могут быть получены в соответствии с реакцией Виттига (Wittig) взаимодействием соли фосфония формулы III и альдегида формулы IV в подходящем растворителе, таком как тетрагидрофуран,в присутствии подходящего основания,такого как 1,8-диазабицикло[5.4.0]ундец-7-ен. Соль фосфония формулы III может быть легко получена взаимодействием соединений формулы II с трифенилфосфином способами, известными специалистам данной области техники. Альдегиды формулы IV являются легкодоступными соединениями и известны в данной области, как описано, например, в Journal of Medicinal Chemistry (2009), 52(21), 6535-6538 или вWO 2004/024705 и в патенте США 4826833. Электрофил II (схема 2) может быть получен из диметилхлорпиразина формулы VI, известного в данной области, как описано, например, в Journal of the Chemical Society, Perkin Transactions 1: Organicand Bio-Organic Chemistry, 1996, (19), 2345-2350 и Journal of Heterocyclic Chemistry (1981), 18(3), 555-8. Соединение VI может быть превращено в аминопиразин формулы VII, как описано в литературе, например в Science of Synthesis (2004), 16, 751-844 и Synthesis, 1994, (9), 931-4. Аминирование 6-членных гетероциклов, таких как пиразины формулы VIII, с использованием реагента электрофильного аминирования, такого как, например, о-мезитиленсульфонилгидроксиламин, хорошо известно в данной области,как описано, например, в Organic Process ResearchDevelopment, 2009, 13, 263-267. Взаимодействие соединения формулы VIII с метилхлорацетатом приводит к получению злектрофила II. Схема 2 Изобретение, раскрытое в данном описании, дополнительно проиллюстрировано приведенными ниже примерами, которые, тем не менее, не являются примерами, ограничивающими область данного изобретения. Общие способы Данные анализа ЖХ-МС получают с использованием одного из следующих способов. Способ А. Используют аппарат РЕ Sciex API 150EX, снабженный фотоионизацией атмосферного давления, и ЖХ-систему Shimadzu LC-8A/SLC-10A. Колонка: 4,630 мм Waters Symmetry C18 с размером частиц 3,5 мкм; температура колонки: 60C; система растворителей: А=вода/трифторуксусная кислота(100:0,05), В=вода/ацетонитрил/трифторуксусная кислота (5:95:0,035); способ: элюирование с линейным градиентом: А:В = от 90:10 до 0:100 в течение 2,4 мин при объемной скорости истечения 3,3 мл/мин. Очистку с использованием препаративной ЖХ-МС проводят на аппарате РЕ Sciex API 150EX с химической ионизацией при атмосферном давлении. Колонка: 5020 мм YMC ODS-A с размером частиц 5 мкм; способ: элюирование с линейным градиентом: А:В= от 80:20 до 0:100 в течение 7 мин при объемной скорости истечения 22,7 мл/мин. Сбор фракций проводят с помощью МС детектора разделенного потока. 1H ЯМР спектры записывают при 500,13 МГц на аппарате Bruker Avance AV500 или при 250,13 МГц на аппарате Bruker Avance DPX250. В качестве внутреннего стандарта используют ТМС. Значения химического сдвига выражают в м.д. Для обозначения мультиплетности ЯМР сигналов используют следующие аббревиатуры: с означает синглет, д означает дуплет, т означает триплет, кв означает квартет, кви означает квинтет, г означает гептет, дд означает дуплет дуплетов, дт означает дуплетный триплет, дкв означает квартет дуплетов, тт означает триплет триплетов, м означает мультиплет, уш. с означает уширенный синглет, уш. означает уширенный сигнал. Аббревиатуры соответствуют ACS Styl Guide: "The ACS Styleguide - A manual for authors и editors" К раствору 4,6-диметилпиримидин-2-иламина (25 г, 200 ммоль) в 400 мл CH2Cl2 по каплям добавляют раствор гидроксиламин-2,4,6-триметилбензолсульфоната (105 г, 488 ммоль) в 300 мл CH2Cl2 при 0 С, полученную смесь перемешивают при 0 С в течение 1 ч и фильтруют. Выделенный твердый продукт промывают CH2Cl2 (100 мл) с получением 2,4,6-триметилбензолсульфоната 1-амино-4,6-диметил 1 Н-пиримидин-2-илиденаммония (40 г, выход: 62%). Смесь 2,4,6-триметилбензолсульфоната 1-амино-4,6-диметил-1 Н-пиримидин-2-илиденаммония(40 г, 0,1 моль) и NaOH (10 г, 0,2 моль) в 500 мл EtOH перемешивают при 50-60 С в течение 1 ч. К смеси добавляют метиловый эфир хлоруксусной кислоты (16,6 г, 0,15 моль) и полученную смесь кипятят с обратным холодильником при перемешивании в течение 4 ч. Смесь концентрируют при пониженном давлении, к остатку добавляют воду (1000 мл) и смесь экстрагируют CH2Cl2 (3300 мл). Объединенные органические слои промывают насыщенным раствором соли (200 мл), сушат над Na2SO4, фильтруют и концентрируют в вакууме. Остаток очищают хроматографией (колонка, силикагель; элюирование: петролейный эфир/EtOAc=2/1) с получением 2 г 2-хлорметил-5,7-диметил[1,2,4]триазоло[1,5-а]пиримидина с выходом 9%. 1 Н ЯМР (300 МГц, ДМСО-d6):8,55 (с, 1 Н), 6,25 (с, 2 Н), 4,05 (с, 3H), 3,95 (с, 3H); ЖХ-МС (МН+): m/z = 196,9, tR = 0,52 мин (способ А). Аналогично получают промежуточный продукт: 2-хлорметил-5,8-диметил[1,2,4]триазоло[1,5-а]пиразин получают из 2-амино-3,6-диметилпиразина; выход 60%; 1 Н ЯМР (500 МГц, CDCl3):7,91 (с, 1 Н), 4,87 (с, 2 Н), 2,91 (с, 3H), 2,74 (с, 3H); ЖХ-МС: m/z = 196,9 (МН+), tR = 0,64 мин (способ А).(5,8-диметил[1,2,4]триазоло[1,5-а]пиразин-2-илметил)трифенилфосфонийхлорида в виде не совсем белого твердого вещества (2,412 г, 74,9%). ЖХ-МС: m/z = 423,2 ([M-Cl+), tR = 0,86 мин (способ A). Раствор 1-метил-4-фенил-1 Н-имидазол-2-карбальдегида (220 мг, 1,18 ммоль) в сухом ТГФ добавляют к хлориду (5,8-диметил[1,2,4]триазоло[1,5-а]пиразин-2-илметил)трифенилфосфония (500 мг,1,18 ммоль) в атмосфере аргона и к полученной смеси добавляют 1,8-диазабицикло[5.4.0]ундец-7-ен(176 мкл, 1,18 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 2 ч, после чего смесь выпаривают в силикагель (2 г). Остаток очищают хроматографией (силикагель, элюирование с градиентом: A:B 50:50 100:0, где A представляет этилацетат, В представляет гептан) с получением указанного в заголовке соединения (334 мг, 79%) в виде твердого не совсем белого вещества. ЖХ-МС: m/z = 331,4 (MH+), tR = 0,65 мин (способ А). Получение соединения настоящего изобретения. Пример 1. 5, 8-Диметил-2-[2-(1-метил-4-фенил-1 Н-имидазол-2-ил)этил][1,2,4]триазоло[1,5-а]пиразинH-Cube Continuous-flow Hydrogenation Reactor (ThalesNano) со скоростью потока 1 мл/мин, через небольшой картридж 10% Pd/C (THS01111) при температуре внутри реактора 25C и давлении водорода 1 бар (100 кПа). Летучие компоненты выпаривают с получением указанного в заголовке соединения(178 мг, 51%). ЖХ-МС: m/z = 333,2 (MH+), tR = 0,57 мин (способ А). Аналогично получают следующие соединения. Фармакологическое тестирование.PDE10A фермент. Активный PDE10A фермент получают рядом способов для применения в PDE биологических испытаниях (Loughney, K. et al. Gene, 1999, 234, 109-117; Fujishige, K. et al. Eur. J. Biochem. 1999, 266, 11181127; Soderling, S. et al. Proc. Natl. Acad. Sci. 1999, 96, 7071-7076). PDE10A может экспрессироваться в виде первичных продуктов трансляции или виде процессированных белков, поскольку они экспрессируют каталитический домен. PDE10A может быть получен в клетках различных типов, например в клетках насекомых или Е.coli. Примером способа получения каталитически активного PDE10A является следующий способ. Каталитический домен PDE10A человека (аминокислоты 440-779 из последовательности с инвентарным номером NP 006652) амплифицируют из общей РНК мозга человека с помощью стандартной RTPCR и клонируют в BamH1 и Xho1 сайты рЕТ 28 а вектора (Novagen). Экспрессию в coli выполняют в соответствии со стандартными методиками. В частности, плазмиды экспрессии трансформируют в BL21(DE3) Е.coli линию и 50 мл культур, инокулированных клетками, которым предоставлена возможность расти до OD600 0,4-0,6 перед экспрессией белка, которую индуцируют 0,5 мМ IPTG. После индукции клетки инкубируют в течение ночи при комнатной температуре и затем собирают центрифугированием. Клетки, экспрессирующие PDE10A, снова суспендируют в 12 мл (50 мМ TRIS-HCl, рН 8,0, 1 мМ MgCl2 и ингибиторы протеазы). Клетки подвергают лизису обработкой ультразвуком и после лизирования всех клеток согласно методикам Novahen добавляют Triton X100. PDE10A частично очищают на Q сефарозе и большинство активных фракций объединяют. Биологическое испытание ингибирования PDE10A. Определение ингибирования PDE10A можно проводить в соответствии со следующей методикой. Опыт проводят в образцах объемом 60 мкл, содержащих фиксированное количество подходящего PDEHEPES 7,6; 10 мМ MgCl2; 0,02% Tween 20), 0,1 мг/мл BSA, 225 pCi 3 Н-меченого циклического нуклеотидного субстрата, меченного тритием сАМР, до конечной концентрации 5 нМ с изменением количеств ингибиторов. Реакции инициируют добавлением субстрата циклического нуклеотида, давая возможность протекать в течение 1 ч при комнатной температуре до завершения смешением с SPA гранулами (15 мкл,8 мг/мл) силиката иттрия (Amersham). Гранулам дают возможность осаждаться в течение 1 ч в темноте перед считыванием планшетов с помощью счетчика Wallac 1450 Microbeta. Величину измеренного сигнала преобразуют в активность относительно неингибированного контроля (100%), после чего вычисляют значения IC50 с использованием Xlfit в EXCEL. В контексте настоящего изобретения биологическое испытание проводят в 60 мкл опытного буфера(50 мМ HEPES рН 7,6; 10 мМ MgCl2; 0,02% Tween 20), содержащего достаточное количество PDE10A для превращения 20-25% 10 нМ 3 Н-сАМР и изменяющиеся количества ингибиторов. После ингибирования в течение 1 ч реакции завершают добавлением SPA гранул (15 мкл, 8 мг/мл) силиката иттрия(Amersham). Гранулам дают возможность осаждаться в течение 1 ч в темноте перед считыванием планшетов с помощью счетчика Wallac 1450 Microbeta. Значения IC50 вычисляют посредством нелинейной регрессии с использованием XLfit (IDBS). Результаты испытаний показывают, что тестируемое соединение настоящего изобретения ингибирует PDE10A фермент со значением IC50 примерно 2,2 нМ. Гиперактивность, индуцированная фенциклидином (РСР). В опыте используют самцов мышей (NMRI, Charles River) с массой тела 20-25 г. Каждая группа мышей, получающих испытываемое соединение (5 мг/кг) плюс РСР (2,3 мг/кг), а также группы, получающие инъекцией разбавитель испытываемого соединения плюс РСР или только разбавитель, включает восемь мышей. Объем инъекции составляет 10 мл/кг. Тест проводят в условиях нормального освещения в комнате с невозмущенным воздухом. Испытываемое соединение вводят в ротовые полости oss за 60 мин до инъекции РСР, который вводят подкожно. Сразу после РСР инъекции мышей помещают в специальные опытные клетки (2032 см). Активность количественно определяют с помощью 5X8 источников инфракрасного света и фотоэлементов,расположенных на расстоянии 4 см. Лучи света проходят на 1,8 см выше дна клетки. Для регистрации единичного передвижения необходимо пересечение соседних световых лучей, что предупреждает регистрацию движения мышей в стационарном состоянии. Передвижение записывают с интервалами 5 мин в течение 1 ч. Действие лекарственного средства рассчитывают исходя из общего количества передвижений, зарегистрированных в течение периода оценки поведения 1 ч, в соответствии со следующей методикой. В качестве исходного значения используют среднее количество передвижений, вызванных носителем в отсутствие РСР. 100%-ный эффект РСР, соответственно, вычисляется как общее количество самопроизвольных передвижений за вычетом исходного значения. Таким образом, реакцию в группах, принимающих испытываемое соединение, определяют как вычисленное количество общих передвижений за вычетом исходного значения и выражают в процентах от аналогичного результата, зафиксированного в параллельной контрольной группе животных, получающих РСР. Процент ответных реакций преобразуют в процент ингибирования. Результаты экспериментов показывают, что соединение настоящего изобретения, тестированное в условиях in vivo, является активным соединением, которое обращает гиперактивность, индуцированную РСР, на 99%. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение - 5,8-диметил-2-[2-(1-метил-4-фенил-1 Н-имидазол-2-ил)этил][1,2,4]триазоло[1,5 а]пиразин и/или его фармацевтически приемлемые кислотно-аддитивные соли. 2. Применение соединения по п.1 в качестве лекарственного средства для лечения нейродегенеративного или психиатрического расстройства. 3. Применение соединения по п.1 для лечения нейродегенеративного или психиатрического расстройства в комбинации с одним или несколькими нейролептическими лекарственными средствами, выбранными из группы, включающей сертиндол, оланзапин, рисперидон, кветиапин, арипипразол, галоперидол, клозапин, зипрасидон и осанетант, где нейродегенеративное расстройство выбрано из группы,включающей болезнь Альцгеймера, мультиинфарктную деменцию, алкогольную деменцию или деменцию, связанную с другими наркотическими средствами, деменцию, связанную с внутричерепными опухолями или травмой мозга, деменцию, связанную с болезнью Хантингтона или болезнью Паркинсона,- 12021410 или деменцию, связанную со СПИД; делирию; расстройство памяти; посттравматическое стрессовое расстройство; врожденное слабоумие; расстройство обучения, представляющее собой расстройство обучения чтению, расстройство обучения математике или расстройство обучения письменному выражению мыслей; синдром дефицита внимания/гиперактивности; возрастное снижение умственной деятельности; и психиатрическое расстройство выбрано из группы, включающей шизофрению, представляющую собой шизофрению параноидного типа, тяжелую форму шизофрении с преобладанием бессвязности, притупленными, парадоксальными эмоциями и отсутствием систематизированного бреда, шизофрению кататонического, недифференцированного или резидуального типа; шизофрениформное заболевание; шизоаффективное расстройство, представляющее собой расстройство бредового типа или депрессивного типа; бредовое расстройство; биполярное расстройство, представляющее собой биполярное расстройствоI типа, биполярное расстройство II типа и циклотимическое расстройство; психотическое расстройство,вызванное веществом, представляющее собой психоз, вызванный алкоголем, амфетамином, марихуаной,кокаином, галлюциногенами, летучими соединениями, опиоидами или фенциклидином; расстройство личности параноидного типа и расстройство личности шизоидного типа. 4. Применение соединения по п.1 для получения лекарственного средства для лечения нейродегенеративного или психиатрического расстройства, где нейродегенеративное расстройство выбрано из группы, включающей болезнь Альцгеймера, мультиинфарктную деменцию, алкогольную деменцию или деменцию, связанную с другими наркотическими средствами, деменцию, связанную с внутричерепными опухолями или травмой мозга, деменцию, связанную с болезнью Хантингтона или болезнью Паркинсона, или деменцию, связанную со СПИД; делирию; расстройство памяти; посттравматическое стрессовое расстройство; врожденное слабоумие; расстройство обучения, представляющее собой расстройство обучения чтению, расстройство обучения математике или расстройство обучения письменному выражению мыслей; синдром дефицита внимания/гиперактивности; возрастное снижение умственной деятельности; и психиатрическое расстройство выбрано из группы, включающей шизофрению, представляющую собой шизофрению параноидного типа, тяжелую форму шизофрении с преобладанием бессвязности, притупленными, парадоксальными эмоциями и отсутствием систематизированного бреда, шизофрению кататонического, недифференцированного или резидуального типа; шизофрениформное заболевание; шизоаффективное расстройство, представляющее собой расстройство бредового типа или депрессивного типа; бредовое расстройство; биполярное расстройство, представляющее собой биполярное расстройствоI типа, биполярное расстройство II типа и циклотимическое расстройство; психотическое расстройство,вызванное веществом, представляющее собой психоз, вызванный алкоголем, амфетамином, марихуаной,кокаином, галлюциногенами, летучими соединениями, опиоидами или фенциклидином; расстройство личности параноидного типа и расстройство личности шизоидного типа. 5. Способ лечения пациента, страдающего нейродегенеративным или психиатрическим расстройством, где нейродегенеративное расстройство выбрано из группы, включающей болезнь Альцгеймера,мультиинфарктную деменцию, алкогольную деменцию или деменцию, связанную с другими наркотическими средствами, деменцию, связанную с внутричерепными опухолями или травмой мозга, деменцию,связанную с болезнью Хантингтона или болезнью Паркинсона, или деменцию, связанную со СПИД; делирию; расстройство памяти; посттравматическое стрессовое расстройство; врожденное слабоумие; расстройство обучения, представляющее собой расстройство обучения чтению, расстройство обучения математике или расстройство обучения письменному выражению мыслей; синдром дефицита внимания/гиперактивности; возрастное снижение умственной деятельности; и психиатрическое расстройство выбрано из группы, включающей шизофрению, представляющую собой шизофрению параноидного типа, тяжелую форму шизофрении с преобладанием бессвязности, притупленными, парадоксальными эмоциями и отсутствием систематизированного бреда, шизофрению кататонического, недифференцированного или резидуального типа; шизофрениформное заболевание; шизоаффективное расстройство, представляющее собой расстройство бредового типа или депрессивного типа; бредовое расстройство; биполярное расстройство, представляющее собой биполярное расстройство I типа, биполярное расстройствоII типа и циклотимическое расстройство; психотическое расстройство, вызванное веществом, представляющее собой психоз, вызванный алкоголем, амфетамином, марихуаной, кокаином, галлюциногенами,летучими соединениями, опиоидами или фенциклидином; расстройство личности параноидного типа и расстройство личности шизоидного типа, где указанный способ включает введение эффективного количества соединения по п.1 пациенту, одного или в комбинации с одним или несколькими нейролептическими средствами, выбранными из сертиндола, оланзапина, рисперидона, кветиапина, арипипразола,галоперидола, клозапина, зипрасидона и осанетанта. 6. Фармацевтическая композиция для лечения нейродегенеративных или психиатрических расстройств, содержащая соединение по п.1 и одно или несколько фармацевтически приемлемых носителей,разбавителей и эксципиентов. 7. Применение соединения по п.1 для лечения нейродегенеративного или психиатрического расстройства, где нейродегенеративное расстройство выбрано из группы, включающей болезнь Альцгеймера, мультиинфарктную деменцию, алкогольную деменцию или деменцию, связанную с другими наркотическими средствами, деменцию, связанную с внутричерепными опухолями или травмой мозга, демен- 13021410 цию, связанную с болезнью Хантингтона или болезнью Паркинсона, или деменцию, связанную со СПИД; делирию; расстройство памяти; посттравматическое стрессовое расстройство; врожденное слабоумие; расстройство обучения, представляющее собой расстройство обучения чтению, расстройство обучения математике или расстройство обучения письменному выражению мыслей; синдром дефицита внимания/гиперактивности; возрастное снижение умственной деятельности; и психиатрическое расстройство выбрано из группы, включающей шизофрению, представляющую собой шизофрению параноидного типа, тяжелую форму шизофрении с преобладанием бессвязности, притупленными, парадоксальными эмоциями и отсутствием систематизированного бреда, шизофрению кататонического, недифференцированного или резидуального типа; шизофрениформное заболевание; шизоаффективное расстройство,представляющее собой расстройство бредового типа или депрессивного типа; бредовое расстройство; биполярное расстройство, представляющее собой биполярное расстройство I типа, биполярное расстройство II типа и циклотимическое расстройство; психотическое расстройство, вызванное веществом, представляющее собой психоз, вызванный алкоголем, амфетамином, марихуаной, кокаином, галлюциногенами, летучими соединениями, опиоидами или фенциклидином; расстройство личности параноидного типа и расстройство личности шизоидного типа.
МПК / Метки
МПК: C07D 403/12, A61K 31/4353, C07D 487/04, A61K 31/519, A61P 25/00, A61K 31/4184
Метки: фенилимидазола, нейродегенеративных, лечения, производное, фармацевтическая, качестве, композиция, фермента, применение, основе, новое, pde10a, психиатрических, расстройств, ингибитора
Код ссылки
<a href="https://eas.patents.su/15-21410-novoe-proizvodnoe-fenilimidazola-v-kachestve-ingibitora-fermenta-pde10a-farmacevticheskaya-kompoziciya-na-ego-osnove-i-ego-primenenie-dlya-lecheniya-nejjrodegenerativnyh-i-psihiatr.html" rel="bookmark" title="База патентов Евразийского Союза">Новое производное фенилимидазола в качестве ингибитора фермента pde10a, фармацевтическая композиция на его основе и его применение для лечения нейродегенеративных и психиатрических расстройств</a>
Предыдущий патент: Способ полимеризации с улучшенной однородностью полимера
Следующий патент: Безводная форма производного пиридина
Случайный патент: Применение сложных эфиров гидроксибензойной кислоты для получения лекарственного средства для предупреждения и лечения папилломавирусной инфекции человека



















