Дизамещенные фталазиновые антагонисты пути hedgehog
Формула / Реферат
1. Соединение формулы
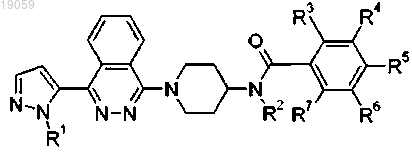
где R1 представляет собой водород или метил;
R2 представляет собой водород или метил;
R3, R4, R5, R6 или R7 независимо представляют собой водород, фтор, хлор, циано, трифторметил, трифторметокси, дифторметокси, метилсульфонил или трифторметилсульфонил при условии, что по меньшей мере три из R3, R4, R5, R6 и R7 представляют собой водород,
или фармацевтически приемлемая соль указанного соединения.
2. Соединение по п.1, отличающееся тем, что R1 представляет собой метил, или его фармацевтически приемлемая соль.
3. Соединение по п.1 или 2, отличающееся тем, что R2 представляет собой метил, или его фармацевтически приемлемая соль.
4. Соединение по любому из пп.1-3, отличающееся тем, что R3, R4, R5, R6 и R7 независимо представляют собой водород, фтор, хлор, трифторметил или метилсульфонил, или его фармацевтически приемлемая соль.
5. Соединение по любому из пп.1-4, отличающееся тем, что R3, R4, R5, R6 и R7 независимо представляют собой водород, фтор или трифторметил, или его фармацевтически приемлемая соль.
6. Соединение по любому из пп.1-5, отличающееся тем, что R4, R6 и R7 представляют собой водород, или его фармацевтически приемлемая соль.
7. Соединение по любому из пп.1-6, которое представляет собой 4-фтор-N-метил-N-(1-(4-(1-метил-1H-пиразол-5-ил)фталазин-1-ил)пиперидин-4-ил)-2-(трифторметил)бензамид, или его фармацевтически приемлемая соль.
8. Соединение по любому из пп.1-7, которое представляет собой гидрохлорид 4-фтор-N-метил-N-(1-(4-(1-метил-1H-пиразол-5-ил)фталазин-1-ил)пиперидин-4-ил)-2-(трифторметил)бензамида.
9. Фармацевтическая композиция, содержащая соединение по любому из пп.1-8 или его фармацевтически приемлемую соль в комбинации с фармацевтически приемлемым носителем, разбавителем или наполнителем.
10. Антагонист пути Hedgehog, представляющий собой соединение по любому из пп.1-8 или его фармацевтически приемлемую соль.
11. Применение соединения по любому из пп.1-8 или его фармацевтически приемлемой соли для лечения рака.
Текст
ДИЗАМЕЩЕННЫЕ ФТАЛАЗИНОВЫЕ АНТАГОНИСТЫ ПУТИ HEDGEHOG(71)(73) Заявитель и патентовладелец: ЭЛИ ЛИЛЛИ ЭНД КОМПАНИ (US) В настоящем изобретении предложены новые 1,4-дизамещенные фталазиновые антагонисты путиhedgehog, подходящие для лечения рака. Настоящее изобретение относится к антагонистам пути Hedgehog и более конкретно к новым 1,4 дизамещенным фталазинам и их терапевтическому применению. Сигнальный путь Hedgehog (Hh) играет важную роль в формировании эмбриональных структур и поддержании жизнедеятельности тканей у взрослых за счет определения направления дифференцировки и пролиферации клеток. Семейство белковHedgehog (Hh), включающее Sonic Hedgehog (Shh), Indian Hedgehog (Ihh) и Desert Hedgehog (Dhh), представляет собой секретируемые гликопротеины, которые подвергаются посттрансляционным модификациям, включая автокаталитическое расщепление и присоединение холестерина к пептиду с концевой аминогруппой с образованием фрагмента, обладающего сигнальной активностью. Hh связывается с включающим двенадцать трансмембранных доменов трансмембранным белком Ptch (Ptch1 и Ptch2), тем самым уменьшая Ptch-опосредованную супрессию белка Smoothened (Smo). Активация Smo запускает ряд внутриклеточных явлений, завершающийся стабилизацией факторов транскрипции Gli (Gli1, Gli2 иGli3) и экспрессией Gli-зависимых генов, которые ответственны за пролиферацию клеток, выживаемость клеток, ангиогенез и инвазию. Сигнальный путь Hh в последнее время привлекает значительный интерес, основанный на обнаружении того факта, что нарушенная активация передачи сигнала Shh приводит к образованию различных опухолей, например рака поджелудочной железы, медуллобластомы, базально-клеточной карциномы,мелкоклеточного рака легких и рака простаты. В WO 2005033288 предложены конкретные 1,4 дизамещенные фталазиновые соединения, которые, как утверждается, являются антагонистамиWO 2009002469 предложены конкретные 1,4-дизамещенные фталазиновые соединения, которые, как утверждается, являются возможным способом лечения всех опухолей, возникающих в результате нарушений сигнального пути Hedgehog. В настоящее время по-прежнему существует необходимость в высокоактивных ингибиторах путиHedgehog, в частности ингибиторах, обладающих желаемыми токсикологическими характеристиками. В настоящем изобретении предложены новые 1,4-дизамещенные фталазины, которые являются высокоактивными антагонистами указанного пути. Конкретные соединения согласно настоящему изобретению обеспечивают желаемое взаимодействие "лекарство-лекарство" и связанные с этим показатели безопасности в отношении способности обратимого и/или необратимого механизм-зависимого ингибированияCYP3A4. В настоящем изобретении предложено соединение формулы I где R1 представляет собой водород или метил;R2 представляет собой водород или метил;R3, R4, R5, R6 или R7 независимо представляют собой водород, фтор, хлор, циано, трифторметил,трифторметокси, дифторметокси, метилсульфонил или трифторметилсульфонил при условии, что по меньшей мере три из R3, R4, R5, R6 и R7 представляют собой водород,или его фармацевтически приемлемая соль. В настоящем изобретении также предложена фармацевтическая композиция, содержащая соединение формулы I или его фармацевтически приемлемую соль в комбинации с фармацевтически приемлемым наполнителем, носителем или разбавителем. В настоящем изобретении также предложен способ лечения рака, выбранного из группы, состоящей из рака мозга, базально-клеточной карциномы, рака пищевода, рака желудка, рака ЖКТ, рака поджелудочной железы, рака желчевыводящих путей, рака простаты, рака груди, мелкоклеточного рака легких,немелкоклеточного рака легких, В-клеточной лимфомы, множественной миеломы, рака яичников, колоректального рака, рака печени, рака почки, меланомы, рака головы и шеи, мезотелиомы, саркомы мягких тканей, саркомы кости, лейкемии и рака яичек, у млекопитающего, включающий введение млекопитающему эффективного количества соединения формулы I или его фармацевтически приемлемой соли. Дополнительно, в настоящем изобретении предложено соединение формулы I или его фармацевтически приемлемая соль для применения в терапии. Также в настоящем изобретении предложено соединение формулы I или его фармацевтически приемлемая соль для применения при лечении рака. В частности, рак выбран из группы, состоящей из рака мозга, базально-клеточной карциномы, рака пищевода,рака желудка, рака ЖКТ, рака поджелудочной железы, рака желчевыводящих путей, рака простаты, рака груди, мелкоклеточного рака легких, немелкоклеточного рака легких, В-клеточной лимфомы, множественной миеломы, рака яичников, колоректального рака, рака печени, рака почки, меланомы, рака головы и шеи, мезотелиомы, саркомы мягких тканей, саркомы кости, лейкемии и рака яичек. В настоящем изобретении также предложено применение соединения формулы I или его фармацевтически приемлемой соли в терапии. Дополнительно, в настоящем изобретении предложено применение соединения формулы I или его фармацевтически приемлемой соли для производства лекарственного средства для лечения рака. В частности, рак выбран из группы, состоящей из рака мозга, базальноклеточной карциномы, рака пищевода, рака желудка, рака ЖКТ, рака поджелудочной железы, рака желчевыводящих путей, рака простаты, рака груди, мелкоклеточного рака легких, немелкоклеточного рака легких, В-клеточной лимфомы, множественной миеломы, рака яичников, колоректального рака, рака печени, рака почки, меланомы, рака головы и шеи, мезотелиомы, саркомы мягких тканей, саркомы кости, лейкемии и рака яичек. Кроме того, в настоящем изобретении предложена фармацевтическая композиция, содержащая соединение формулы I или его фармацевтически приемлемую соль в качестве активного ингредиента для лечения рака, выбранного из группы, состоящей из рака мозга, базально-клеточной карциномы, рака пищевода, рака желудка, рака ЖКТ, рака поджелудочной железы, рака желчевыводящих путей, рака простаты, рака груди, мелкоклеточного рака легких, немелкоклеточного рака легких, В-клеточной лимфомы,множественной миеломы, рака яичников, колоректального рака, рака печени, рака почки, меланомы, рака головы и шеи, мезотелиомы, саркомы мягких тканей, саркомы кости, лейкемии и рака яичек. Конкретные соединения формулы I или их фармацевтически приемлемые соли представляют собой соединения, в которых:(c) R3, R4, R5, R6 или R7 независимо представляют собой водород, фтор, хлор, трифторметил или метилсульфонил;(d) R3, R4, R5, R6 или R7 независимо представляют собой водород, фтор или трифторметил;(e) по меньшей мере два из R3, R4, R5, R6 и R7 независимо представляют собой фтор, хлор, трифторметил или метилсульфонил при условии, что R3 и R7 одновременно не являются водородом;(f) по меньшей мере два из R3, R4, R5, R6 и R7 независимо представляют собой фтор или трифторметил при условии, что R3 и R7 одновременно не являются водородом;(h) R3 и R5 независимо представляют собой фтор, хлор, трифторметил или метилсульфонил; R4, R6 и 7(i) R3 и R5 независимо представляют собой фтор или трифторметил; R4, R6 и R7 представляют собой водород;(j) R1 представляет собой метил и R2 представляет собой метил;(k) R1 представляет собой метил; R2 представляет собой метил и R3, R4, R5, R6 или R7 независимо представляют собой водород, фтор, хлор, трифторметил или метилсульфонил;(l) R1 представляет собой метил; R2 представляет собой метил и R3, R4, R5, R6 или R7 независимо представляют собой водород, фтор или трифторметил;(m) R1 представляет собой метил; R2 представляет собой метил и по меньшей мере два из R3, R4, R5,6R и R7 независимо представляют собой фтор, хлор, трифторметил или метилсульфонил при условии, чтоR3 и R7 одновременно не являются водородом;(n) R1 представляет собой метил; R2 представляет собой метил и по меньшей мере два из R3, R4, R5,6R и R7 независимо представляют собой фтор или трифторметил при условии, что R3 и R7 одновременно не являются водородом;(о) R1 представляет собой метил; R2 представляет собой метил и R4, R6 и R7 представляют собой водород;(р) R1 представляет собой метил; R2 представляет собой метил; R3 и R5 независимо представляют собой фтор, хлор, трифторметил или метилсульфонил и R4, R6 и R7 представляют собой водород;(q) R1 представляет собой метил; R2 представляет собой метил; R3 и R5 независимо представляют собой фтор или трифторметил и R4, R6 и R7 представляют собой водород. Следует понимать, что используемые выше и далее в описании настоящего изобретения следующие термины, если не указано иное, имеют следующие значения."Фармацевтически приемлемый носитель, разбавитель или наполнитель" представляет собой среду,общепринятую в области доставки биологически активных агентов млекопитающим, например людям."Фармацевтически приемлемые соли" относится к сравнительно нетоксичным неорганическим и органическим солям соединений согласно настоящему изобретению."Терапевтически эффективное количество" или "эффективное количество" означает количество соединения формулы I или его фармацевтически приемлемой соли согласно настоящему изобретению или фармацевтической композиции, содержащей соединение формулы I или его фармацевтически приемлемую соль согласно настоящему изобретению, которое приводит к биологическому или медицинскому ответу или желаемому терапевтическому воздействию на ткань, организм, животное, млекопитающее или человека, ожидаемому исследователем, ветеринаром, лечащим врачом или другим практикующим врачом. Предполагается, что термины "лечение", "лечить", "лечащий" и т.д. включают замедление или обращение прогрессирования нарушения. Указанные термины также включают уменьшение, облегчение,ослабление, устранение или снижение одного или более симптомов нарушения или состояния, даже если нарушение или состояние фактически не устраняется и даже если прогрессирование нарушения или состояния как таковое не замедляется или не обращается. В рамках стандартной номенклатуры, используемой в настоящем описании, первой описывают терминальную часть указанной боковой цепи, затем соседние функциональные группы в направлении места присоединения. Например, заместитель метилсульфонил эквивалентен CH3-SO2-. Соединения согласно настоящему изобретению способны взаимодействовать, например, с рядом неорганических и органических кислот, с образованием фармацевтически приемлемых солей присоединения кислот. Указанные фармацевтически приемлемые соли и общепринятые способы их получения хорошо известны в данной области техники. См., например, П. Шталь с соавторами (P. Stahl, et al.),HANDBOOK OF PHARMACEUTICAL SALTS: PROPERTIES, SELECTION AND USE (VCHA/WileyVCH, 2002); C.M. Бердж с соавторами (S.M. Berge, et al.), "Pharmaceutical Salts, "Journal of PharmaceuticalSciences, Vol. 66, No. 1, January 1977. Соединения согласно настоящему изобретению предпочтительно входят в состав фармацевтических композиций с применением фармацевтически приемлемого носителя, разбавителя или наполнителя и вводятся с помощью различных способов. Предпочтительно такие композиции предназначены для перорального или внутривенного введения. Указанные фармацевтические композиции и способы их получения хорошо известны в данной области техники. См., например, REMINGTON: THE SCIENCE ANDCo., 1995). Фактически вводимое соединение определяет лечащий врач с учетом имеющих значение обстоятельств, включающих состояние, подвергаемое лечению, выбранный способ введения, фактическое вводимое соединение или соединения, возраст, вес и ответ индивидуального пациента и степень тяжести симптомов у пациента. Суточные дозировки, как правило, находятся в диапазоне от примерно 0,1 до примерно 10 мг/кг массы тела. В некоторых случаях дозировки ниже нижнего предела указанного диапазона могут быть более чем достаточными, при этом в других случаях возможно применение даже больших дозировок. Соединения формулы I или их соли можно получить с помощью различных методик, известных в данной области техники, а также способов, описанных далее на схеме, в примерах получения и примерах. Конкретные стадии синтеза каждого из описанных способов можно объединять различным образом для получения соединений формулы I или их фармацевтически приемлемых солей. Заместители, если не указано иное, являются такими, как определено ранее. Реагенты и исходные вещества, как правило, легкодоступны среднему специалисту в данной области техники. Другие реагенты и исходные вещества можно получить с помощью стандартных способов органической и гетероциклической химии, способов, аналогичных синтезу известных соединений со сходной структурой, и способов, описанных в примерах получения и примерах, которые представлены далее, включая любые новые способы. Названия соединений в примерах получения и примерах были получены при помощи инструмента Struct=Name в ChemDraw Ultra 10.0. Используемые в настоящем описании следующие термины имеют указанные значения: "Et2O" относится к диэтиловому эфиру; "ДМФ" относится к диметилформамиду; "ДМСО" относится к диметилсульфоксиду; "DMAC" относится к N,N-диметилацетамиду; "NMP" относятся к N-метилпирролидину;"МеОН" относится к метанолу; "boc" или "t-boc" относится к трет-бутоксикарбонилу; "IC50" относится к концентрации агента, которая приводит к 50% от максимального ингибиторного ответа, возможного для данного агента. Соединение формулы I может быть получено согласно реакциям, приведенным на схеме. На стадии 1 дигалогензамещенный фталазин (1) (Х=Cl или Br) взаимодействует с 4-амино-bocзащищенным пиперидином (2) в ходе реакции нуклеофильного ароматического замещения (SNAr) с получением галогенпиперидилфталазина формулы (3). Реакцию проводят в биполярном апротонном растворителе, таком как ДМФ, DMAC или NMP, в присутствии органического или неорганического основания. Предпочтительно реакцию проводят в NMP в присутствии карбоната калия при температуре, равной 50-140 С. На стадии 2 галогенпиперидилфталазин формулы (3) подвергают реакции кросс-сочетания по Сузуки с пиразолбороновым эфиром или кислотой (4). Например, галогенпиперидилфталазин (3) объединяют с пинаколиновым эфиром 1-метил-1H-пиразол-5-бороновой кислоты в присутствии палладиевого катализатора, такого как тетракис-(трифенилфосфин)палладий, и неорганического основания, такого как бикарбонат натрия. Реакция протекает в смеси растворителей толуол/этанол/вода с образованием пиразолилфталазина формулы (5). Стадия 3 представляет собой простое удаление защитной boc-группы, проводимое в кислой среде,например, HCl в диэтиловом эфире или диоксане, с получением аминопиперидинилфталазина формулы(6). Способы введения и удаления азот- и кислородзащитных групп хорошо известны в данной области техники (см., например, Грин и Вутс (Greene and Wuts), Protective Groups in Organic Synthesis, 3rd Ed.,John Wiley and Sons, New York, (1999. На стадии 4 аминопиперидинилфталазин формулы (6) ацилируют с получением пиперидиниламида формулы I. Согласно одному из способов амин подвергают взаимодействию с соответствующим образом замещенным бензоилхлоридом в инертном растворителе, таком как дихлорметан, в присутствии органического основания, такого как триэтиламин или диизопропилэтиламин. В качестве альтернативы, амид получают с применением соответствующим образом замещенной бензойной кислоты. Активный сложный эфир получают с применением пентафторфенилдифенилфосфината с последующим взаимодействием с амином. Реакцию проводят в смеси растворителей ДМФ/ДМСО при температуре, равной примерно от -10 до 100 С, в присутствии органического основания, такого как триэтиламин или диизопропиламин. Пример получения 1. трет-Бутил 1-(4-хлорфталазин-1-ил)пиперидин-4-ил(метил)карбамат Нагревали смесь карбоната калия (21,23 г, 153,6 ммоль), 1,4-дихлорфталазина (26 г, 128 ммоль) и трет-бутилового эфира метилпиперидин-4-илкарбаминовой кислоты (30,01 г, 134,4 ммоль) в Nметилпирролидине (200 мл) при 80 С в течение ночи. Выливали реакционную смесь в воду, экстрагировали дихлорметаном, сушили над Na2SO4 и концентрировали при пониженном давлении. Добавляли диэтиловый эфир и отфильтровывали полученное твердое вещество (примесь 4-хлорфталазин-1-ола из исходного вещества). Концентрировали фильтрат. Очищали полученный остаток путем флэшхроматографии на силикагеле (гексан:этилацетат=2:1) с получением титульного соединения в виде белого твердого вещества (17,66 г, 37%). Получали титульное соединение по существу согласно способу, описанному в примере получения 1, применяя трет-бутиловый эфир пиперидин-4-илкарбаминовой кислоты. Охлаждали реакционную смесь и выливали в воду (500 мл). Экстрагировали в этилацетате, промывали водой, сушили над Na2SO4 и удаляли растворители при пониженном давлении с получением титульного соединения в виде желтого твердого вещества (36 г, 97%). Помещали карбонат натрия (3,82 г, 36,09 ммоль), трет-бутил 1-(4-хлорфталазин-1-ил)пиперидин-4 ил(метил)карбамат (6,8 г, 18,04 ммоль) и пинаколиновый эфир 1-метил-1H-пиразол-5-бороновой кислоты(5,63 г, 27,1 ммоль) в колбу со смесью толуола (50 мл), этанола (17 мл) и воды (17 мл). Дегазировали смесь в течение 10 мин газообразным азотом. Добавляли тетракис-(трифенилфосфин)палладий (0,4 г,0,35 ммоль) и нагревали смесь при 74 С в течение ночи. Охлаждали смесь до температуры окружающей среды и разбавляли дихлорметаном. Промывали органическую часть солевым раствором, сушили надNa2SO4 и концентрировали при пониженном давлении. Очищали полученный остаток путем флэшхроматографии на силикагеле (гексан:этилацетат:2 М NH3 в МеОН=20:5:1) с получением титульного соединения в виде желтой пены (5,33 г, 70%).ES/MC m/z 423,2 (М+1). Альтернативный способ получения трет-бутил метил(1-(4-(1-метил-1 Н-пиразол-5-ил)фталазин-1 ил)пиперидин-4-ил)карбамата. Примеры получения 4-6. Пример получения 4. 1,4-Дибромфталазин В пробирку, стойкую к давлению, помещали пентабромид фосфора (24,5 г, 54,1 ммоль) и 2,3 дигидрофталазин-1,4-дион (5,00 г, 30,8 ммоль). Герметизировали пробирку и нагревали при 140 С в течение 6-7 ч. Оставляли охлаждаться на ночь. Осторожно открывали пробирку из-за избыточного давления. Отделяли твердое вещество и выливали в ледяную воду. Оставляли перемешиваться в ледяной воде и собирали полученное твердое вещество путем вакуумного фильтрования. Сушили в вакуумируемом сушильном шкафу с получением конечного продукта (8,31 г, 93%).(395 мг, 2,86 ммоль) и трет-бутиловый эфир метилпиперидин-4-илкарбаминовой кислоты (532 мг,2,38 ммоль). Нагревали при 80 С в течение ночи. Охлаждали и выливали в воду. Собирали твердое вещество и сушили в вакуум-сушильном шкафу при температуре окружающей среды в течение ночи с получением конечного продукта (0,96 г, 95%).(1,25 мл). Дегазировали реакционную смесь азотом в течение 10 мин. Добавляли тетракис(трифенилфосфин)палладий (137,1 мг, 118,7 мкмоль). Дополнительно продували азот через реакционную смесь в течение 10 мин. Закрывали реакционную емкость и нагревали при 90 С в течение ночи. Охлаждали реакционную смесь и фильтровали через подложку силикагеля, элюируя 5% MeOH:CH2Cl2. Концентрировали фракции при пониженном давлении. Очищали полученный остаток с помощью хроматографии на силикагеле (2% 2 Н NH3 в МеОН:CH2Cl2) с получением конечного продукта (345,6 мг,69%). Получали титульное соединение по существу согласно способу, описанному в примере получения 3, применяя трет-бутил 1-(4-хлорфталазин-1-ил)пиперидин-4-ил(метил)карбамат и пинаколиновый эфир 1H-пиразол-3-бороновой кислоты с получением 580 мг (67%). Получали титульное соединение по существу согласно способу, описанному в примере получения 3, применяя трет-бутил-1-(4-хлорфталазин-1-ил)пиперидин-4-илкарбамат с получением 5,92 г (94%). Растворяли трет-бутил-метил(1-(4-(1-метил-1H-пиразол-5-ил)фталазин-1-ил)пиперидин-4 ил)карбамат (7,77 г, 18,39 ммоль) в дихлорметане (100 мл). К раствору добавляли избыток 1 М хлороводорода в диэтиловом эфире (20 мл, 80 ммоль) и перемешивали при температуре окружающей среды в течение 2 ч. Концентрировали при пониженном давлении. Очищали полученный остаток путем флэшхроматографии на силикагеле (дихлорметан:2 М NH3 в МеОН=10:1) с получением титульного соединения в виде желтой пены (5,83 г, 98%).ES/MC m/z 323,2 (М+1). Промежуточные соединения, представленные далее в таблице, получали по существу согласно способу, описанному в примере получения 9, с тем исключением, что с соответствующего т-bocзамещенного амина снимают защиту с применением 4 М HCl в диоксане.(2,8 г, 8,68 ммоль) и триэтиламина (3,36 мл, 26,1 ммоль) в CH2Cl2 (30 мл) 4-фтор-2(трифторметил)бензоилхлоридом (2,14 мл, 10,42 ммоль). Перемешивали в течение 3 ч при температуре окружающей среды. Концентрировали реакционную смесь при пониженном давлении. Очищали полученный остаток путем флэш-хроматографии на силикагеле (гексан:этилацетат:2 М NH3 в МеОН=20:5:1) с получением свободного основания в виде желтой пены (3,83 г, 86%).ES/MC m/z 513,0 (М+1). Пример 1 а. Гидрохлорид 4-фтор-N-метил-N-(1-(4-(1-метил-1H-пиразол-5-ил)фталазин-1-ил)пиперидин-4-ил)-2(трифторметил)бензамида. Растворяли 4-фтор-N-метил-N-(1-(4-(1-метил-1H-пиразол-5-ил)фталазин-1-ил)пиперидин-4-ил)-2(трифторметил)бензамид (7,13 г, 13,91 ммоль) в дихлорметане (100 мл) и добавляли избыток 1 н. HCl в диэтиловом эфире (30 мл, 30 ммоль). Удаляли растворители при пониженном давлении с получением титульного соединения (7,05 г, 92%).ES/MC m/z 513,0 (М+1). Данные ЯМР показали наличие смеси амидных ротамеров в соотношении 2:1. Основной ротамер: 1 Н ЯМР (400 МГц, ДМСО-d6):8,34 (м, 1 Н), 8,26 (м, 2 Н), 7,95 (м, 1 Н), 7,75 (м, 1 Н), 7,64 (м, 2 Н),7,55 (м, 1 Н), 6,72 (д, 1 Н, J=2 Гц), 5,15 (уш., 1 Н), 4,71 (м, 1 Н), 4,22 (м, 2 Н), 3,84 (с, 3H), 3,48 (м, 2 Н), 2,65(м, 2 Н), 1,62 (м, 2 Н). Амиды, представленные далее в таблице, получали по существу согласно способам, описанным в примере 1 и 1 а, с применением соответствующего пиперидинилфталазина и замещенного бензоилхлорида.(0,26 мл, 1,5 ммоль) в ДМФ:ДМСО=4:1 (2 мл) при 60 С. Охлаждали до 0 С и к раствору добавляли дифенилфосфинат пентафторфенила (250 мг, 0,65 ммоль) в ДМФ:ДМСО=1:1 (1 мл). Перемешивали смесь при 60 С в течение ночи. Охлаждали реакционную смесь до температуры окружающей среды и разбавляли CH2Cl2, промывали солевым раствором, сушили над Na2SO4 и концентрировали при пониженном давлении. Очищали полученный остаток путем флэш-хроматографии на силикагеле (гексан:этилацетат: 2 М NH3 в МеОН=20:5:1) с получением продукта. Добавляли избыток 1 н. HCl в диэтиловом эфире (1 мл,10 ммоль) к выделенному продукту и удаляли растворитель с получением титульного соединенияES/MC m/z 539,0 (М+1). Амиды, представленные далее в таблице, получали по существу согласно способу, описанному в примере 14, с применением соответствующего пиперидинилфталазина и замещенной бензойной кислоты. Полагают, что Hedgehog является фактором выживаемости следующих раковых заболеваний: базально-клеточной карциномы; раковых заболеваний верхних отделов ЖКТ (пищевода, желудка, поджелудочной железы и желчевыводящих путей); рака простаты, рака груди; мелкоклеточного рака легких; немелкоклеточного рака легких; В-клеточной лимфомы; множественной миеломы; рака ЖКТ; рака яичников; колоректального рака; рака печени; меланомы; рака головы и шеи; мезотелиомы; саркомы мягких тканей; саркомы кости; лейкемии; рака яичек; рака почки и рака мозга. Полагают, что элементы пути Hedgehog являются потенциальными мишенями для лекарственных средств для лечения раковых заболеваний. Клеточная линия Daoy, выделенная из опухоли медуллобластомы (АТСС, НТВ-186), проявляет ответ на лиганды Hh. Когда указанные клетки обрабатывают экзогенно добавляемой Shh-кондиционированной средой, путь передачи сигнала Hh активируется и приводит к повышенной экспрессии Gli1. Циклопамин, алкалоид, выделенный из кукурузной лилии Veratrumcalifornicum (черемица калифорнийская), является слабым антагонистом Hedgehog и, как было показано,подавляет экспрессию Gli1 в ответ на стимуляцию Shh. Последние наблюдения позволяют предположить, что циклопамин подавляет рост культивируемых клеток медуллобластомы и аллотрансплантантов. С применением указанной модельной системы клеток Daoy можно идентифицировать высокоактивные ингибиторы сигнальных путей Hedgehog. Так как соединения согласно настоящему изобретению являются антагонистами Hedgehog, они подходят для лечения вышеуказанных типов опухолей. Определение биологической активности IC50: функциональное исследование для измерения ингибирования Gli1 в клетках Daoy. Представленное далее исследование и его результаты дополнительно показывают применимость и эффективность соединений и способов согласно настоящему изобретению. Функциональные исследования подтверждают, что соединения согласно настоящему изобретению проявляют способность ингибировать сигнальный путь Shh. Все лиганды, растворители и реагенты, применяемые в следующем исследовании, легкодоступны из коммерческих источников или могут быть легко получены специалистами в данной области техники. Биологическую активность определяют с помощью функционального исследования раковых клеток нервной системы Daoy и измерения содержания рибонуклеиновой кислоты Gli1 с применением системы для исследования рДНК (разветвленной деоксирибонуклеиновой кислоты) (Panomics, Inc., Fremont, CA). Первоначально Gli был открыт в клеточной линии глиобластомы; он кодирует белок "цинковый палец",который активируется посредством сигнального пути Shh. Максимальный ответ получают путем индуцирования транскрипции Gli1 в клетках Daoy с применением кондиционированной среды (почка эмбриона человека, клетки HEK-293, устойчиво экспрессирующие рекомбинантный Shh) в течение 24 ч, а затем измерения количества стимулированных транскриптов Gli1. Минимальным ответом является количество транскриптов Gli1, ингибируемых контрольным соединением в клетках Daoy, которые стимулировали кондиционированной средой (почка эмбриона человека, клетки HEK-293, устойчиво экспрессирующие рекомбинантный Shh) в течение 24 ч. В системе для исследования рДНК применяют технологию ДНК с разветвленной цепью для обеспечения амплификации рибонуклеиновой кислоты (транскрипта)-мишени. Технология предполагает применение трех типов синтетических гибридных коротких Gli1-специфичных кДНК-зондов, которые определяют специфичность транскрипта-мишени (модификаторы захвата (МЗ), модификаторы-метки(ММ) и блокаторы (БЛ, которые гибридизуются в виде комплекса с транскриптами-мишенями для амплификации сигнала гибридизации. Добавление хемилюмигенного субстрата в течение стадии амплификации обеспечивает возможность детектирования с применением люминесценции. Клетки Daoy выращивали до достижения конфлюэнтности в колбе для тканевых культур Т 225 в среде роста Daoy, содержащей минимальную поддерживающую среду (MEM) и 10% эмбриональную бычью сыворотку (ЭБС) с 0,1 нМ заменимых аминокислот и 1 мМ пирувата натрия. Клетки удаляли из колб Т 225 с применением трипсина-этилендиаминтетрауксусной кислоты (ЭДТА), центрифугировали,повторно суспендировали в среде, затем подсчитывали. Клетки Daoy затем помещали в количестве 50000 клеток на лунку в среду для роста в 96-луночные прозрачные планшеты для тканевых культур Costar и оставляли инкубироваться на ночь при 37 С в 5% диоксида углерода (СО 2). Клетки промывали один раз фосфатно-солевым буфером (PBS), затем добавляли 100 мкл Shh кондиционированной среды (Shh-CM) для стимуляции уровня экспрессии Gli1. Shh-CM разбавляли контрольной средой для роста - 0,1% ЭБС/DMEM (модифицированная по способу Дульбекко среда Игла) - для достижения максимальной стимуляции. Клетки Daoy, обработанные Shh-CM, затем обрабатывали ингибиторами Hedgehog в различных концентрациях в диапазоне от 1 мкМ до 0,1 нМ. Исследуемые соединения оставляли инкубироваться в течение 24 ч при 37 С в 5% СО 2. Измерение транскрипта Gli1 проводили с применением исследования Gli1 Quantigene 2.0 согласно описанию от производителя (Panomics, Inc.). Получали буфер для разбавленной лизисной смеси (DLM),который содержал протеиназу К. После 24-часового инкубирования с соединением клетки промывали один раз PBS и 180 мкл DLM добавляли в клетки. Планшет для клеточных культур, содержащий лизисный буфер, герметизировали и помещали в 55 С в течение от 30 до 45 мин. Полученные клеточные лизаты затем растирали 5 раз. Набор рабочих зондов, содержащий зонды Gli1, получали путем разбавления зондов в DLM согласно руководству производителя, затем 20 мкл набора рабочих зондов добавляли в планшеты для исследования рДНК вместе с 80 мкл лизатов Daoy. Планшеты герметизировали и инкубировали в течение ночи при 55 С. Планшеты рДНК затем обрабатывали согласно руководству производителя. Сигнал количественно оценивали путем считывания планшетов на планшет-ридере Perkin ElmerEnvision с люминесцентным детектированием. Люминесцентный сигнал прямо пропорционален количеству транскрипта-мишени, присутствующего в образце. Данные сигнала люминесценции, полученные в функциональном исследовании, применяли для вычисления IC50 в исследовании in vitro. Данные рассчитывали на основании максимальных контрольных значений (для клеток Daoy, обработанных Shh-CM) и минимального контрольного значения (для клетокDaoy, обработанных Shh-CM и контрольным соединением в ингибирующей концентрации, 1 мкМ N-(3(1 Н-бензо[d]имидазол-2-ил)-4-хлорфенил)-3,5-диметоксибензамида). Четырехпараметровую логистическую кривую применяли для получения значений IC50 с использованием программного обеспечения ActivityBase версии 5.3, уравнение 205 (Assay Guidance Manual Version 5.0, 2008, Eli Lilly and Company andNIH Chemical Genomics Center). Согласно описанному способу соединения, примеры которых приведены в настоящем патенте, обладают IC50, составляющей 40 нМ. Например, в описанном выше исследовании соединение согласно примеру 1 а обладает IC50, составляющей примерно 2,4 нМ при стандартной ошибке, равной 0,5 (n=7,вычислена как среднее геометрическое и геометрическая среднеквадратичная ошибка). Указанные результаты подтверждают, что соединения согласно настоящему изобретению являются высокоактивными антагонистами Hedgehog и как таковые подходят для применения в качестве противораковых агентов. Исследование ингибирования CYP3A4. Образцы для инкубирования получали путем добавления микросомного препарата печени человека к исследуемому ингибитору (конечные концентрации 0,05 мг/мл белка, 10 мкМ ингибитора в 100 мМ буфере NaPO4, pH 7,4) и перемешивали. Образцы предварительно инкубировали в течение примерно 5 мин при 37 С. После предварительного инкубирования инициировали реакцию путем добавления раствора, содержащего НАДФН и мидазолам, в качестве ферментного субстрата (конечная концентрация 1 мМ НАДФН, 5 мкМ мидазолама). После добавления раствора НАДФН образцы инкубировали в течение 3 мин при примерно 37 С. После инкубирования реакцию гасили путем добавления 50 мкл метанола (и внутреннего стандарта для хроматографии), образцы тщательно перемешивали. После гашения реакции смесь центрифугировали при примерно 4000 об/мин в течение 15 мин при примерно 5 С и анализировали путем ЖХ/МС-анализа. Образцы анализировали путем ВЭЖХ/МС с градиентным элюированием на коротких традицион- 12019059 ных колонках С 18 (загружаемая подвижная фаза при загрузке - 95/5 Milli-Q H2O/метанол (об./об.) с 1% уксусной кислоты). Подвижная фаза В - 80/20 Milli-Q H2O/метанол (об./об.) с 1% уксусной кислоты. Подвижная фаза С - 5/95 Milli-Q H2O/метанол (об./об.) с 1% уксусной кислоты. Подвижная фаза для промывки - 75/25 Milli-Q H2O/ацетонитрил (об./об.). Образцы впрыскивали в спектральный масс-анализатор для мониторинга заданных ионов (SIM) с массой, равной 342,1 (1-ОН-мидазолам) и 346,1 (внутренний стандарт -гидроксимидазолам-d4) с применением TurboIon Spray с детектированием положительных ионов. Данные представлены в виде % ингибирования образования 1-ОН-мидазолама в присутствии ингибитора в концентрации 10 мкМ. Согласно описанному способу пример 1 а показывает 13,5% ингибирование CYP3A4. Соединения,например, согласно примеру 1 а, которые демонстрируют низкую способность обратимо ингибироватьCYP3A4, обладают сниженной вероятностью негативных взаимодействий с другими лекарственными средствами, которые могут приводить к изменениям дозировки лекарственных средств или необходимости прекращения введения лекарственного средства пациенту. Таким образом, указанные соединения являются желательными и обладают улучшенными характеристиками безопасности. Механизм-зависимое ингибирование CYP3A in vitro. Соединение согласно примеру 1 а оценивали в качестве механизм-зависимого ингибитора CYP3A с целью получения кинетических констант k инакт и KI для указанного взаимодействия (k инакт является максимальной константой скорости образования неактивного комплекса с ферментом. KI представляет собой концентрацию при половине максимальной инактивации). Соединение инкубировали с микросомами печени человека (пул микросом печени человека с высокой экспрессией активности CYP3A4) в процессе двухстадийного инкубирования in vitro: реакции инактивации, которая позволяет ингибитору инактивировать фермент, и анализ активности, в котором определяют остаточную активность микросомного белка с применением 1'-гидроксилирования мидазолама в качестве зонда. Реакционные смеси для инактивации (конечный объем 100 мкл), содержащие 100 мМ буфер фосфата натрия (рН 7,4), 1 мМ ЭДТА (этилендиаминтетрауксусная кислота) в отсутствие или в присутствии 1 мМ НАДФН (никотинамид аденин динуклеотид фосфат, восстановленный) и исследуемое соединение с концентрацией в диапазоне 0,75-24 мкМ, предварительно инкубировали в течение 3 мин при 37 С в трех повторах. Реакции инактивации инициировали путем добавления пула микросом с высокой активностью CYP3A (CellzDirect, Austin TX, 0,5 мг/мл). В различные временные интервалы (0, 2,5, 5, 10 и 30 мин) отбирали 5-мкл аликвоты реакционных смесей для подавления активности и разбавляли 1/20 в предварительно нагретой (37 С) инкубационной системе для анализа активности CYP3A4 (95 мкл), содержащей 1 мМ НАДФН и мидазолам (100 мкМ). Указанную смесь для исследования активности с конечной концентрацией белка, равной 0,025 мг/мл, и концентрацией ингибитора 1/20 дополнительно инкубировали (37 С) в течение 1 мин перед остановкой реакции путем добавления 50 мкл МеОН. Образцы перемешивали и денатурированный белок удаляли путем центрифугирования при 4000 об/мин в течение 10 мин. Образование 1'-ОН мидазолама анализировали путем ЖХ/МС/МС с градиентным элюированием на колонке Phenomenex Synergi 4 Hydro-RP (подвижная фаза А - 95/5 Milli-Q H2O/метанол (об./об.) с 5 мМ ацетата аммония, подвижная фаза В - 5/95 Milli-Q H2O/метанол (об./об.) с 5 мМ ацетата аммония,растворитель для промывания иглы А - 0,4% трифторуксусной кислоты в 90/10 ацетонитрил/Milli-QH2O (об./об.), растворитель для промывания иглы В - 50/50 Milli-Q H2O/метанол (об./об Образцы впрыскивали в Sciex API 4000 для мониторинга селективных реакций при массе, равной 342,0 (1-OHмидазолам) и 347,0 (внутренний стандарт -гидроксимидазолам-d3), с применением TurboIon Spray с детектированием положительных ионов. Снижение образования 1'-ОН мидазолама (активности CYP3A4) в инкубированных микросомах наносили на график в виде логарифма процента остаточной активности CYP3A4 как функции времени предварительного инкубирования для каждой концентрации исследуемого соединения. Кинетические параметры подавления активности определяли с применением WinNonlin Professional с построением следующих уравнений по полученным данным: Уравнение 1: ингибирование в процентах (t)=100(t=0)е(-t),гдеопределена как Уравнение 2: =(k инактI)/(KI+I). Снижение активности в случае соединения согласно примеру 1 а находится в диапазоне 11-22% и не зависит от концентрации. Следовательно, значения k инакт и KI в уравнении 2 невозможно определить. Основываясь на полученных данных, соединение согласно примеру 1 а не является механизм-зависимым ингибитором CYP3A4. Соединения, такие как пример 1 а, которые демонстрируют низкую или отсутствующую способность механизм-зависимого необратимого ингибирования CYP3A4, обладают сниженной вероятностью негативных взаимодействий с другими лекарственными средствами, которые могли бы приводить к изменениям дозировки лекарственных средств или необходимости прекращения введения лекарственного средства пациенту. Таким образом, такие соединения являются желательными и обладают улучшенными характеристиками безопасности. где R1 представляет собой водород или метил;R2 представляет собой водород или метил;R3, R4, R5, R6 или R7 независимо представляют собой водород, фтор, хлор, циано, трифторметил,трифторметокси, дифторметокси, метилсульфонил или трифторметилсульфонил при условии, что по меньшей мере три из R3, R4, R5, R6 и R7 представляют собой водород,или фармацевтически приемлемая соль указанного соединения. 2. Соединение по п.1, отличающееся тем, что R1 представляет собой метил, или его фармацевтически приемлемая соль. 3. Соединение по п.1 или 2, отличающееся тем, что R2 представляет собой метил, или его фармацевтически приемлемая соль. 4. Соединение по любому из пп.1-3, отличающееся тем, что R3, R4, R5, R6 и R7 независимо представляют собой водород, фтор, хлор, трифторметил или метилсульфонил, или его фармацевтически приемлемая соль. 5. Соединение по любому из пп.1-4, отличающееся тем, что R3, R4, R5, R6 и R7 независимо представляют собой водород, фтор или трифторметил, или его фармацевтически приемлемая соль. 6. Соединение по любому из пп.1-5, отличающееся тем, что R4, R6 и R7 представляют собой водород, или его фармацевтически приемлемая соль. 7. Соединение по любому из пп.1-6, которое представляет собой 4-фтор-N-метил-N-(1-(4-(1-метил 1H-пиразол-5-ил)фталазин-1-ил)пиперидин-4-ил)-2-(трифторметил)бензамид, или его фармацевтически приемлемая соль. 8. Соединение по любому из пп.1-7, которое представляет собой гидрохлорид 4-фтор-N-метил-N-(1(4-(1-метил-1H-пиразол-5-ил)фталазин-1-ил)пиперидин-4-ил)-2-(трифторметил)бензамида. 9. Фармацевтическая композиция, содержащая соединение по любому из пп.1-8 или его фармацевтически приемлемую соль в комбинации с фармацевтически приемлемым носителем, разбавителем или наполнителем. 10. Антагонист пути Hedgehog, представляющий собой соединение по любому из пп.1-8 или его фармацевтически приемлемую соль. 11. Применение соединения по любому из пп.1-8 или его фармацевтически приемлемой соли для лечения рака.
МПК / Метки
МПК: C07D 401/14, A61K 31/502, A61P 35/00
Метки: hedgehog, фталазиновые, пути, дизамещенные, антагонисты
Код ссылки
<a href="https://eas.patents.su/15-19059-dizameshhennye-ftalazinovye-antagonisty-puti-hedgehog.html" rel="bookmark" title="База патентов Евразийского Союза">Дизамещенные фталазиновые антагонисты пути hedgehog</a>
Предыдущий патент: Способ получения кристаллических форм а и в илапразола и способ превращения указанных кристаллических форм
Следующий патент: Способ получения 1-бензил-3-гидроксиметил-1н-индазола и его производных и необходимые промежуточные соединения с магнием
Случайный патент: Способ обследования и оценки стабильности деревянных столбов












