Фармацевтические промежуточные соединения в синтезе ингибиторов ацетилхолинэстеразы (асе) и их применение
Номер патента: 15450
Опубликовано: 31.08.2011
Авторы: Мезеи Тибор, Верешшне Пандур Ангела, Порч-Маккаи Марта, Шимиг Дьюла, Луцакш Дьюла
Формула / Реферат
1. Соединения общей формулы (I)
где R1представляет собой ароматическую углеводородную группу, содержащую одно или более ароматическое кольцо, которое может быть замещено одним или более одинаковыми или различными заместителями, выбранными из галогена, C1-C6-алкила, гидрокси, амино, или R1представляет собой прямую или разветвленную, насыщенную, алифатическую углеводородную группу, содержащую от 1 до 6 атомов углерода;
R2 представляет собой прямую или разветвленную, насыщенную, алифатическую углеводородную группу, содержащую от 1 до 6 атомов углерода;
R3 представляет собой прямую или разветвленную, насыщенную, алифатическую углеводородную группу, содержащую от 1 до 6 атомов углерода, или R3 представляет собой C1-C6-алкил, замещенный одной или более фенильной группой.
2. Соединение по п.1, где прямая или разветвленная, насыщенная, алифатическая углеводородная группа представляет собой метил, этил, 1-пропил, 2-пропил, 1-бутил или третичный бутил.
3. Соединения общей формулы (I) по п.1, где R1 представляет собой фенил; R2 представляет собой этил и R3 представляет собой этил.
4. Соединения общей формулы (I) по п.1, где R1 представляет собой метил; R2 представляет собой этил и R3 представляет собой этил.
5. Способ получения соединений общей формулы (I) по п.1, где значения R1, R2 и R3являются такими, как указано в п.1, включающий взаимодействие соединения общей формулы (IV)
где значения R1 и R2являются такими, как определено выше,
в органическом растворителе в присутствии связывающего кислоту агента по меньшей мере с 2 мол.экв. соединения общей формулы (VI)
XCOOR3, (VI)
где X представляет собой галоген или третичную бутилоксикарбонилоксигруппу и R3является таким, как определено выше.
6. Способ по п.5, включающий взаимодействие 1 мол.экв. соединения общей формулы (IV) с 2-3 мол.экв. соединения общей формулы (VI).
7. Способ по п.5, включающий применение тетрагидрофурана, этилацетата, дихлорметана или ацетона в качестве органического растворителя.
8. Способ по п.7, включающий применение ацетона в качестве органического растворителя.
9. Способ по п.5, включающий применение органического амина или неорганической соли в качестве связывающего кислоту агента.
10. Способ по п.9, включающий применение в качестве органического амина триэтиламина, пиридина или морфолина, в качестве неорганической соли - карбоната натрия или карбоната калия.
11. Способ по п.10, включающий применение триэтиламина в качестве связывающего кислоту агента.
12. Способ по п.5, включающий применение соединения общей формулы (VI), где X представляет собой хлор и R3 представляет собой этил.
13. Способ получения соединений общей формулы (II)
где R1и R2 являются такими, как определено в п.1,
включающий взаимодействие соединения общей формулы (I), где R1, R2 и R3являются такими, как в п.1, с тионилхлоридом в органическом растворителе.
14. Способ по п.13, включающий применение соединения общей формулы (I), где R1представляет собой фенил; R2представляет собой этил; R3представляет собой этил.
15. Способ по п.13, включающий применение соединения общей формулы (I), где R1представляет собой метил; R2представляет собой этил; R3представляет собой этил.
16. Способ по любому из пп.13-15, включающий применение апротонного растворителя в качестве органического растворителя.
17. Способ по п.16, включающий применение дихлорметана в качестве органического растворителя.
18. Способ получения соединений общей формулы (II), где R1 и R2 определены, как в п.1, включающий взаимодействие соединения общей формулы (IV), где R1и R2 являются такими, как определено выше, в органическом растворителе в присутствии связывающего кислоту агента по меньшей мере с 2 мол.экв. соединения общей формулы (VI), где X и R3являются такими же, как определено в п.12, после этого взаимодействие полученного таким образом соединения общей формулы (I) с тионилхлоридом в органическом растворителе.
19. Способ по п.18, включающий применение в качестве исходных веществ соединения общей формулы (IV), где R1 представляет собой фенил; R2 представляет собой этил, и соединения общей формулы (VI), где R3 представляет собой этил и X представляет собой хлор.
20. Способ по п.18, включающий применение в качестве исходных веществ соединения общей формулы (IV), где R1 представляет собой метил; R2 представляет собой этил, и соединения общей формулы (VI), где R3 представляет собой этил и X представляет собой хлор.
21. Способ по любому из пп.18-20, включающий взаимодействие 1 мол.экв. соединения общей формулы (IV) с 2-3 мол.экв. соединения общей формулы (VI).
22. Способ по любому из пп.18-21, включающий применение органического амина или неорганической соли в качестве связывающего кислоту агента.
23. Способ по п.22, включающий применение триэтиламина, пиридина или морфолина в качестве органического амина.
24. Способ по п.23, включающий применение триэтиламина в качестве связывающего кислоту агента.
25. Способ получения соединений общей формулы (III)
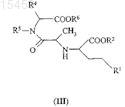
и их солей,
где R1представляет собой ароматическую углеводородную группу, содержащую одно или более ароматическое кольцо, которое может быть замещено одним или более одинаковыми или различными заместителями, выбранными из галогена, C1-C6-алкила, гидрокси, амино, или R1представляет собой прямую или разветвленную, насыщенную, алифатическую углеводородную группу, содержащую от 1 до 6 атомов углерода;
R2 представляет собой прямую или разветвленную, насыщенную, алифатическую углеводородную группу, содержащую от 1 до 6 атомов углерода;
R4 представляет собой прямую или разветвленную, насыщенную, алифатическую углеводородную группу, содержащую от 1 до 6 атомов углерода;
R5 представляет собой водород или R5 представляет собой прямую или разветвленную, насыщенную, алифатическую углеводородную группу, содержащую от 1 до 6 атомов углерода, или
радикал формулы (VII), образованный R4, R5и атомами углерода и азота, присоединенными к нему, в формуле (III)

представляет собой часть любой из кольцевых систем (В) и (С), перечисленных ниже
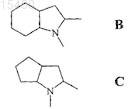
R6 представляет собой водород, прямую или разветвленную, насыщенную, алифатическую углеводородную группу, содержащую от 1 до 6 атомов углерода, или C1-C6-алкил, замещенный одной или более фенильной группой,
включающий
взаимодействие соединения общей формулы (II), полученного в соответствии со способом по п.13 или 18, где R1 и R2являются такими, как определено выше, с соединением общей формулы (VIII)
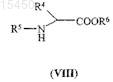
или его солью,
где R4, R5 и R6являются такими, как определено выше;
и, если желательно, превращение полученного таким образом сложного эфира общей формулы (III), где R6 представляет собой прямую или разветвленную, насыщенную, алифатическую углеводородную группу, содержащую от 1 до 6 атомов углерода, или R6 представляет собой C1-C6-алкил, замещенный одной или более фенильной группой, в соответствующую карбоновую кислоту общей формулы (III), где R6представляет собой водород;
и, если желательно, превращение полученного соединения общей формулы (III) в его соль.
26. Способ по п.25, где прямая или разветвленная, насыщенная, алифатическая углеводородная группа представляет собой метил, этил, 1-пропил, 2-пропил, 1-бутил или третичный бутил.
27. Способ получения соединения общей формулы (III), где R1 представляет собой фенил; R2 представляет собой этил; R6представляет собой водород и радикал формулы (VII) в общей формуле (III) представляет собой группу формулы (С) (рамиприл), включающий взаимодействие соединения общей формулы (II), полученного в соответствии с любым из способов по п.13 или 18, где R1и R2 определены в преамбуле п.27, с (S,S,S)-2-азабицикло[3.3.0]октан-3-карбоновой кислоты бензиловым эфиром или его солью и удаление бензильной группы путем каталитического гидрирования.
28. Способ по п.27, где соль бензилового эфира (S,S,S)-2-азабицикло[3.3.0]октан-3-карбоновой кислоты представляет собой гидрохлорид.
29. Способ получения соединения общей формулы (III), где R1 представляет собой метил; R2 представляет собой этил; R6представляет собой водород и радикал формулы (VII) в общей формуле (III) представляет собой группу формулы (В) (периндоприл), включающий взаимодействие соединения общей формулы (II), полученного в соответствии с любым из способов по п.13 или 18, где R1и R2 определены в преамбуле п.29, с (S,S,S)-пергидроиндол-2-карбоновой кислоты бензиловым эфиром или его солью и удаление бензильной группы путем каталитического гидрирования.
30. Способ по п.29, где соль бензилового эфира (S,S,S)-пергидроиндол-2-карбоновой кислоты представляет собой гидрохлорид.
31. Способ получения периндоприла, включающий взаимодействие соединения общей формулы (II), полученного в соответствии с любым из способов по п.13 или 18, где R1представляет собой метил; R2представляет собой этил, с (S,S,S)-пергидроиндол-2-карбоновой кислотой.
32. Способ получения рамиприла, включающий взаимодействие соединения общей формулы (II), полученного в соответствии с любым из способов по п.13 или п.18, где R1 представляет собой фенил; R2 представляет собой этил, с (S,S,S)-2-азабицикло[3.3.0]октан-3-карбоновой кислотой.
Текст
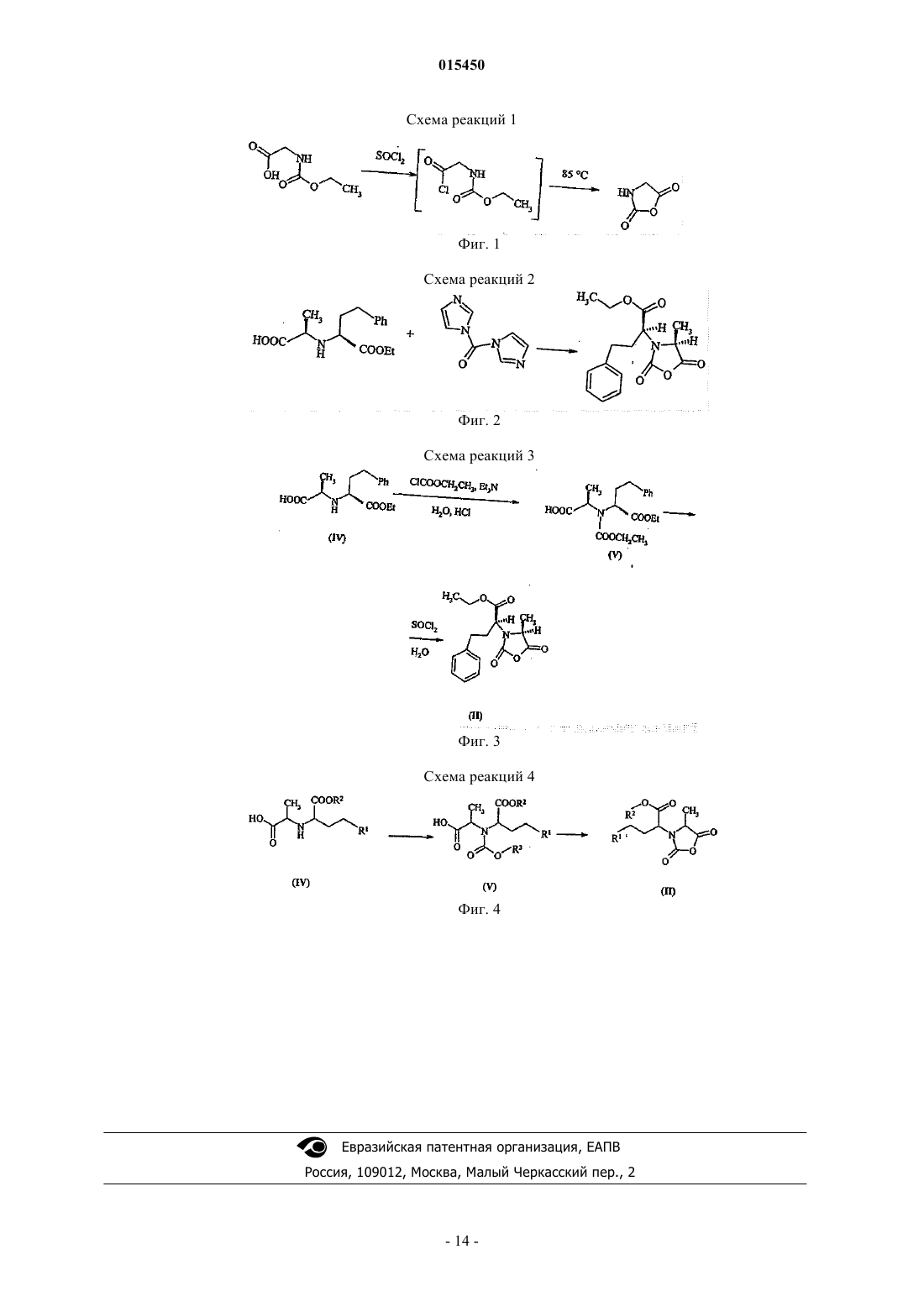
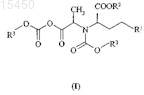
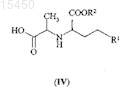
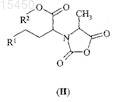
ФАРМАЦЕВТИЧЕСКИЕ ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ В СИНТЕЗЕ ИНГИБИТОРОВ АЦЕТИЛХОЛИНЭСТЕРАЗЫ (АСЕ) И ИХ ПРИМЕНЕНИЕ Соединения общей формулы (I), где R1 представляет собой ароматическую углеводородную группу,содержащую одно или более ароматическое кольцо, которое может быть замещено одним или более одинаковыми или различными заместителями, выбранными из галогена, C1-С 6-алкила, гидрокси, амино, илиR1 представляет собой прямую или разветвленную, насыщенную, алифатическую углеводородную группу,содержащую от 1 до 6 атомов углерода; R2 представляет собой прямую или разветвленную, насыщенную,алифатическую углеводородную группу, содержащую от 1 до 6 атомов углерода; R3 представляет собой прямую или разветвленную, насыщенную, алифатическую углеводородную группу, содержащую от 1 до 6 атомов углерода; или R3 представляет собой C1-С 6-алкил, замещенный одной или более фенильной группой,представляют собой ценные фармацевтические промежуточные соединения, которые могут быть получены путем взаимодействия соединения общей формулы (IV), где значения R1 и R2 являются такими, как определено выше, по меньшей мере с 2 мол.экв. соединения общей формулы (VI), где X представляет собой галоген или трет-бутилоксикарбонилоксигруппу и R3 является таким, как определено выше. Известные соединения общей формулы (II), где R1 и R2 являются такими, как определено выше, получают путем взаимодействия соединений общей формулы (I) с тионилхлоридом. Соединения общей формулы (I) представляют собой новые промежуточные соединения, полезные в синтезе фармацевтически активных ингредиентов, в частности, при получении ингибиторов ацетилхолинэстеразы (АСЕ), например эналаприла,периндоприла или рамиприла.(71)(73) Заявитель и патентовладелец: ЭГИШ ДЬДЬСЕРДЬЯР НЬИЛЬВАНОШАН МЮКД РЕСВЕНЬТАРШАШАГ (HU) 015450 Область изобретения Настоящее изобретение относится к новым фармацевтическим промежуточным соединениям и к их применению. Конкретнее, настоящее изобретение относится к новым промежуточным соединениям,применимым при приготовлении фармацевтических продуктов, в частности в синтезе ингибиторов АСЕ,к способу их получения и способу превращения указанных промежуточных соединений в фармацевтически активные ингредиенты, в особенности в ингибиторы АСЕ. В соответствии с аспектом настоящего изобретения предложены соединения общей формулы (I) где R1 представляет собой ароматическую углеводородную группу, содержащую одно или более ароматическое кольцо, которое может быть замещено одним или более одинаковыми или различными заместителями, выбранными из галогена, C1-C6-алкила, гидрокси, амино, или R1 представляет собой прямую или разветвленную, насыщенную, алифатическую углеводородную группу, содержащую от 1 до 6 атомов углерода, предпочтительно от 1 до 4 атомов углерода, например метил, этил, 1-пропил, 2-пропил,1-бутил, третичный бутил;R2 представляет собой прямую или разветвленную, насыщенную, алифатическую углеводородную группу, содержащую от 1 до 6 атомов углерода, предпочтительно от 1 до 4 атомов углерода, например метил, этил, 1-пропил, 2-пропил, 1-бутил, третичный бутил;R3 представляет собой прямую или разветвленную, насыщенную, алифатическую углеводородную группу, содержащую от 1 до 6 атомов углерода, предпочтительно от 1 до 4 атомов углерода, например метил, этил, 1-пропил, 2-пропил, 1-бутил, третичный бутил, или R3 представляет собой C1-C6-алкил, замещенный одной или более фенильной группой. В соответствии с еще одним аспектом настоящего изобретения предложен способ получения соединений общей формулы (I), где R1, R2 и R3 являются такими, как указано выше, включающий взаимодействие соединения общей формулы (IV) где R1 и R2 являются такими, как определено выше,по меньшей мере с 2 мол.экв. соединения общей формулы (VI)XCOOR3,(VI) в которой X представляет собой атом галогена или третичную бутоксикарбонилоксигруппировку; иR3 является таким, как определено выше,в органическом растворителе в качестве реакционной среды и в присутствии связывающего кислоту агента. В соответствии с еще одним аспектом настоящего изобретения предложен способ получения соединений общей формулы (II) где R1 и R2 являются такими, как определено выше,включающий взаимодействие соединения общей формулы (I), где R1, R2 и R3 являются такими, как определено выше, в органическом растворителе с тионилхлоридом. В соответствии с еще одним аспектом настоящего изобретения предложен способ получения соединений общей формулы (II), где R1 и R2 являются такими, как определено в п.1, включающий взаимодействие соединения общей формулы (IV), где R1 и R2 являются такими, как определено выше, в органическом растворителе в присутствии связывающего кислоту агента, по меньшей мере с 2 мол.экв. соединения общей формулы (VI), где R3 и X являются такими, как указано выше, после этого реакцией полученного таким образом соединения общей формулы (I) в органическом растворителе с тионилхлоридом.-1 015450 В соответствии с еще одним воплощением предложен способ, включающий применение в качестве исходных веществ соединения общей формулы (IV), где R1 представляет собой метил; R2 представляет собой этил, и соединения общей формулы (VI), где R3 представляет собой этил и X представляет собой хлор. В соответствии с еще одним аспектом настоящего изобретения предложен способ получения соединений общей формулы (III) и их солей,где R1 представляет собой ароматическую углеводородную группу, содержащую одно или более ароматическое кольцо, которое может быть замещено одним или более одинаковыми или различными заместителями, выбранными из галогена, C1-C6-алкила, гидрокси, амино, или R1 представляет собой прямую или разветвленную, насыщенную, алифатическую углеводородную группу, содержащую от 1 до 6 атомов углерода, предпочтительно от 1 до 4 атомов углерода, например метил, этил, 1-пропил, 2-пропил,1-бутил, третичный бутил;R2 представляет собой прямую или разветвленную, насыщенную, алифатическую углеводородную группу, содержащую от 1 до 6 атомов углерода, предпочтительно от 1 до 4 атомов углерода, например метил, этил, 1-пропил, 2-пропил, 1-бутил, третичный бутил;R4 представляет собой прямую или разветвленную, насыщенную, алифатическую углеводородную группу, содержащую от 1 до 6 атомов углерода;R5 представляет собой водород или R5 представляет собой прямую или разветвленную, насыщенную, алифатическую углеводородную группу, содержащую от 1 до 6 атомов углерода, предпочтительно от 1 до 4 атомов углерода, например метил, этил, 1-пропил, 2-пропил, 1-бутил, третичный бутил, или радикал формулы (VII), образованный R4, R5 и атомами углерода и азота, присоединенными к нему,в формуле (III) представляет собой часть любой из кольцевых систем (В) и (С), перечисленных нижеR6 представляет собой водород, прямую или разветвленную, насыщенную, алифатическую углеводородную группу, содержащую от 1 до 6 атомов углерода, предпочтительно от 1 до 4 атомов углерода,например метил, этил, 1-пропил, 2-пропил, 1-бутил, третичный бутил, или C1-C6-алкил, замещенный одной или более фенильной группой,включающий взаимодействие соединения общей формулы (II), полученного, как описано выше, где R1 и R2 являются такими, как определено выше, с соединением общей формулы (VIII) или его солью,где R4, R5 и R6 являются такими, как определено выше; и, если желательно, превращение полученного таким образом сложного эфира общей формулы (III),где R6 представляет собой прямую или разветвленную, насыщенную, алифатическую углеводородную группу, содержащую от 1 до 6 атомов углерода, предпочтительно от 1 до 4 атомов углерода, например-2 015450 метил, этил, 1-пропил, 2-пропил, 1-бутил, третичный бутил, или R6 представляет собой C1-C6-алкил, замещенный одной или более фенильной группой, в соответствующую карбоновую кислоту общей формулы (III), где R6 представляет собой водород; и, если желательно, превращение полученного соединения общей формулы (III) в его соль. В соответствии с еще одним аспектом настоящего изобретения предложен способ получения соединения общей формулы (III), где R1 представляет собой фенил; R2 представляет собой этил; R6 представляет собой водород и радикал формулы (VII) в общей формуле (III) представляет собой группу формулы (С) (рамиприл), включающий взаимодействие соединения общей формулы (II), полученного, как описано выше, где R1 и R2 являются такими, как определено выше, с (S,S,S)-2-азабицикло[3.3.0]октанкарбоновой кислоты бензиловым эфиром или его солью, предпочтительно его гидрохлоридом, и после этого удаление бензильной группы путем каталитического гидрирования. В соответствии с еще одним аспектом настоящего изобретения предложен способ получения рамиприла, включающий взаимодействие соединения общей формулы (II), полученного в соответствии с вышеописанным способом, где R1 представляет собой фенил и R2 представляет собой этил, с (S,S,S)-2 азабицикло[3.3.0]октанкарбоновой кислотой. В соответствии с еще одним аспектом изобретения предложен способ получения соединения общей формулы (III), где R1 представляет собой метил; R2 представляет собой этил; R6 представляет собой водород и значение радикала формулы (VII) в общей формуле (III) представляет собой группу формулы (В)(периндоприл), и его соли, образованной с третичным бутиламином, включающий взаимодействие соединения общей формулы (II), полученного в соответствии с вышеописанным способом, где R1 представляет собой метил; R2 представляет собой этил, с (S,S,S)-пергидроиндол-2-карбоновой кислоты бензиловым эфиром или его солью, предпочтительно его тозилатом, после этого удаление бензильной группы путем каталитического гидрирования и последующего превращения продукта периндоприла, полученного таким образом, в его соль, образованную с третичным бутиламином. В соответствии с еще одним аспектом настоящего изобретения предложен способ получения периндоприла и его соли третичного бутиламмония, включающий взаимодействие соединения общей формулы (II), полученного при помощи вышеописанного способа, где R1 представляет собой метил и R2 представляет собой этил, с (S,S,S)-пергидроиндол-2-карбоновой кислотой и превращение продукта периндоприла в его соль третичного бутиламина. Предшествующий уровень техники Соединения оксазолидиндионового типа получали вначале путем реакции N-этоксикарбонилглицина с тионилхлоридом и нагревания ацилхлоридного промежуточного соединения при 85 С с получением соответствующего циклического ангидрида (Leuchs, Chem. Ber., 39, 1906, 858). Эта реакция продемонстрирована на фиг. 1 в схеме реакций 1. Существует несколько способов, известных в соответствии с уровнем техники, получения соединений общей формулы (II). Обычно аминокислоты общей формулы (IV) используют в качестве исходных соединений. Оксазолидиндионы общей формулы (II) получают путем реакции аминокислот общей формулы(IV) и фосгеновых производных. Продукты реакции часто не выделяли, даже их образование не отмечалось, но указанные промежуточные соединения немедленно вступали во взаимодействиеN-[1-(S)-этоксикарбонил-3-фенилпропил]-4-(S)-метил-оксазолидин-2,5-диона (соединение общей формулы (II), где R1 представляет собой фенил; R2 представляет собой этил), смесь N-[1-(S)-этоксикарбонил-3 фенилпропил]-L-аланина (соединение формулы (IV), где R1 представляет собой фенил; R2 представляет собой этил) и N,N'-карбонилдиимидазола кипятили с обратным холодильником в атмосфере азота в течение 15 мин и полученный таким образом раствор непосредственно использовали на следующих стадиях реакции (Jerry W. Skiles, Raymond D. Youssefyeh, John T. Suh, Howard Jones, EP 61768, 29.03.1982). Этот способ продемонстрирован на фиг. 2 в схеме реакций 2. Оксазолидиндионы общей формулы (II) получены, выделены и охарактеризованы другими авторами похожим путем с использованием N,N'-карбонилдиимидазола (Oudenes, Jan у Schleicher, RichardHenry, ES 2004804, 01.02.1989; Marjo Mrslavic, Janja Crinski US 5359086, 16.09.1993). В соответствии с часто используемым способом, также известным в области техники, оксазолидиндионы общей формулы (II) получают путем реакции аминокислоты общей формулы (IV) и фосгена(Fu-Chih Huang, Howard Jones, Clara J. Lin, Bernard Love, EP 114067, 12.01.1983; Raymond D. Youssefyeh,Jerry W. Skiles, John T. Suh, Howard Jones, US 4686295. 07.03.1983; Satomi Takahashi, Kenji Inoue,Yoshifumi Yanagida, Takehisa Ohashi, Kiyoshi Watanabe, EP 215335, 23.08.1986). В еще одном известном способе используется трихлорметила хлорформиат в качестве другого производного фосгена для получения оксазолидиндионов общей формулы (II) (Satomi Takahashi, Kenji Inoue,Takehisa Ohashi, Kiyoshi Watanabe, US 4716235, 29.12.1987). В соответствии с еще одним известным способом вместо фосгена использовали менее токсичный трифосген (Pau Cid EP 1279665, 23.07.2002).-3 015450 В соответствии с еще одним известным способом соединения общей формулы (IV) превращали в ихN-алкокси(аралкокси)карбонильные производные общей формулы (V) и указанные производные использовали для получения соединений общей формулы (II). В Европейском патенте 1197490 (авторы изобретения Chong-Ming Chen, Yu-Liang Liu, Ya-ChiehChai, Chien-Huang Wu, дата подачи заявки 15.05.2001) раскрыто взаимодействие аминокислот общей формулы (IV), где R1 представляет собой фенил и R2 представляет собой этил, с 1,2 мол.экв. этилхлорформиата в дихлорэтане, при котором таким образом образующееся соединение общей формулы (V), гдеR1 представляет собой фенил и каждый из R2 и R3 представляет собой этил, взаимодействовало с реагентом, активирующим карбоксильную группу, например тионилхлоридом, ацетилхлоридом или ацетангидридом с получением соответствующего оксазолидиндиона общей формулы (II). Этот способ продемонстрирован на фиг. 3 в схеме реакций 3. Краткое описание изобретения В процессе исследований авторы изобретения предполагали получить циклические ангидриды общей формулы (II). Схема реакций 4 проиллюстрирована на фиг. 4, начиная с соединений общей формулы(IV) через промежуточные соединения общей формулы (V). При осуществлении способа Европейского патента 1197490 и контроля взаимодействия путем хроматографии обнаружено, что при применении соединения общей формулы (VI) лишь в небольшом мольном избытке исходное вещество общей формулы (IV) потребляется чрезвычайно медленно, желаемый продукт, соответствующий общей формуле (V), аналогично образуется медленно, и в соответствии с хроматографическим анализом побочный продукт присутствует помимо желаемого продукта общей формулы (V) после того, как исходное соединение используется во взаимодействии. Настоящее изобретение основано на неожиданном обнаружении того, что при применении соединения общей формулы (VI) по меньшей мере в количестве 2 мол.экв. относительно количества соединения общей формулы (IV) реакция протекает быстро и приводит в результате к гомогенному продукту,который выделен и идентифицирован как соединение общей формулы (I), где R1 представляет собой ароматическую углеводородную группу, содержащую одно или более ароматическое кольцо, которое может быть замещено одним или более одинаковыми или различными заместителями, выбранными из галогена, C1-C6-алкила, гидрокси, амино, или R1 представляет собой прямую или разветвленную, насыщенную, алифатическую углеводородную группу, содержащую от 1 до 6 атомов углерода, предпочтительно от 1 до 4 атомов углерода, например метил, этил, 1-пропил, 2-пропил, 1-бутил, третичный бутил;R2 представляет собой прямую или разветвленную, насыщенную, алифатическую углеводородную группу, содержащую от 1 до 6 атомов углерода, предпочтительно от 1 до 4 атомов углерода, например метил,этил, 1-пропил, 2-пропил, 1-бутил, третичный бутил; и R3 представляет собой прямую или разветвленную, насыщенную, алифатическую углеводородную группу, содержащую от 1 до 6 атомов углерода,предпочтительно от 1 до 4 атомов углерода, например метил, этил, 1-пропил, 2-пропил, 1-бутил, третичный бутил, или R3 представляет собой C1-C6-алкил, замещенный одной или более фенильной группой. Соединения общей формулы (I) являются новыми. Подробное описание изобретения Смешанные ангидриды аминокислот, аналогичные соединениям общей формулы (I), известны из предшествующего уровня техники. Указанные соединения обычно получают, начиная сN-алкокси(аралкокси)карбонил аминокислот (общий способ получения см. в Org Synth. Vol. 63, 160-168,Ed Wiley, 1985), в органическом растворителе (обычно N,N-диметилформамиде или тетрагидрофуране) и в присутствии N-метилморфолина путем добавления 1 мол.экв. C1-C6-алкила или фенилалкилхлорформиата общей формулы (VI) при -20 С. Такие смешанные ангидриды могут содержать две идентичные алкокси(аралкокси)карбонильные группы, но в большинстве случаев две группы отличаются. В соответствии с предшествующим уровнем техники задача получения такого смешанного ангидрида заключается в увеличении реакционноспособности карбоксильных групп в последующей реакции,которая может представлять собой реакцию сочетания с получением пептидов (D. Jukic et al., Eur. J. Med.Chem. 1991, 921), удлинения цепи (J. Cooper et al., J. Chem. Soc. Perkin Trans. 1, 1991, 705), синтеза ацильных производных, таких как эфир тиоловой кислоты или амид (R.A. Breitenmoser et al., Helvetica.Chim. Acta 2001, 786; B. Garrigues et al., Tetr. Lett. 1986, 1685), и восстановление карбоксильной группы до гидроксиметильной группы с получением спиртов (V. Constantinou-Kokotou, Org. Prep. Proced. Int. 1999, 237; V. Caplar et al., Croatica Chim. Acta 2003, 23).-4 015450 Предшествующий уровень техники умалчивает о сущности способа превращения соединений, аналогичных соединениям общей формулы (I), в оксазолидиндионы. Еще одно неожиданное обнаружение, лежащее в основе настоящего изобретения, заключается в том, что оксазолидиндионы общей формулы (II) образуются в результате взаимодействия соединения общей формулы (I) и тионилхлорида. В указанном способе предложена нереализованная возможность синтеза соединений общей формулы (II) в промышленном масштабе. А именно, новые промежуточные соединения общей формулы (I) получают в быстрой реакции и получают в форме высокочистого и гомогенного продукта, который может быть выделен с чрезвычайно высокой чистотой. Превращение соединений общей формулы (I) в соответствующие оксазолидиндионы общей формулы (II) может быть легко и просто осуществлено в промышленном масштабе. Оксазолидиндионы общей формулы (II) представляют собой важные промежуточные соединения,применимые при получении соединений общей формулы (III). В общей формуле (III):R1 представляет собой ароматическую углеводородную группу, содержащую одно или более ароматическое кольцо, которое может быть замещено одним или более одинаковыми или различными заместителями, выбранными из галогена, C1-C6-алкила, гидрокси, амино, или R1 представляет собой прямую или разветвленную, насыщенную, алифатическую углеводородную группу, содержащую от 1 до 6 атомов углерода, предпочтительно от 1 до 4 атомов углерода, например метил, этил, 1-пропил, 2-пропил,1-бутил, третичный бутил;R2 представляет собой прямую или разветвленную, насыщенную, алифатическую углеводородную группу, содержащую от 1 до 6 атомов углерода, предпочтительно от 1 до 4 атомов углерода, например метил, этил, 1-пропил, 2-пропил, 1-бутил, третичный бутил;R4 представляет собой прямую или разветвленную, насыщенную, алифатическую углеводородную группу, содержащую от 1 до 6 атомов углерода, предпочтительно от 1 до 4 атомов углерода, например метил, этил, 1-пропил, 2-пропил, 1-бутил, третичный бутил;R5 представляет собой водород или прямую или разветвленную, насыщенную, алифатическую углеводородную группу, содержащую от 1 до 6 атомов углерода, предпочтительно от 1 до 4 атомов углерода, например метил, этил, 1-пропил, 2-пропил, 1-бутил, третичный бутил; или радикал формулы (VII), образованный R4, R5 и атомами углерода и азота, присоединенными к нему в общей формуле (III), представляет собой часть кольцевой системы формулы (В) или (С) иR6 представляет собой водород, прямую или разветвленную, насыщенную, алифатическую углеводородную группу, содержащую от 1 до 6 атомов углерода, предпочтительно от 1 до 4 атомов углерода,например метил, этил, 1-пропил, 2-пропил, 1-бутил, третичный бутил или C1-C6-алкил, замещенный одной или более фенильной группой. Среди соединений общей формулы (III) существует несколько важных антигипертензивных фармацевтически активных агентов, таких как рамиприл, периндоприл и эналаприл. Определения терминов, использованных в настоящем описании, являются следующими. Термин "алкил" представляет собой прямую или разветвленную, насыщенную, алифатическую углеводородную группу, содержащую от 1 до 6, предпочтительно от 1 до 4 атомов углерода, например метил, этил, 1-пропил, 2-пропил, 1-бутил, третичный бутил и т.д. Предпочтительное типичное соединение общей формулы (I) является соединением, где R1 представляет собой фенил; каждый из R2 и R3 представляет собой этил, который представляет собой ценное промежуточное соединение, полезное в синтезе антигипертензивного средства, известного под Международным непатентованным названием (INN) рамиприл. Второй предпочтительный представитель соединений общей формулы (I) является соединением,где R1 представляет собой метил; каждый из R2 и R3 представляет собой этил, который представляет собой ценное промежуточное соединение, полезное в синтезе антигипертензивного средства, известного под Международным непатентованным названием (INN) периндоприл. Соединения общей формулы (I) могут быть получены путем взаимодействия соединения общей формулы (IV) в органическом растворителе по меньшей мере с 2 мол.экв. соединения общей формулы(VI) в присутствии связывающего кислоту агента. В реакции соединение общей формулы (VI) успешно используют в количестве 2-3 мол.экв., предпочтительно в количестве 2,2 мол.экв. относительно исходного соединения общей формулы (IV). В качестве органического растворителя предпочтительно может быть использован тетрагидрофуран, этилацетат, дихлорметан или ацетон, в особенности благоприятно ацетон. В качестве связывающего кислоту агента могут быть использованы органические амины (например,триэтиламин, пиридин, морфолин) или неорганические соли (например, карбонат натрия, карбонат калия). Особенно благоприятно может быть использован триэтиламин. В соединениях общей формулы (VI) X предпочтительно обозначает хлор. В соединениях общей формулы (VI) R3 предпочтительно представляет собой этил. Взаимодействие легко протекает приблизительно при комнатной температуре. Время реакции короткое, обычно приблизительно 1 ч.-5 015450 В соответствии с настоящим изобретением соединение общей формулы (I) может быть превращено в соответствующее соединение общей формулы (II) путем обработки тионилхлоридом в органическом растворителе. Тионилхлорид может быть использован в эквимолярном количестве с соединением общей формулы(I) или указанный реагент может быть использован в 1,5-2,5 молярном избытке относительно мольного количества реагента общей формулы (I). В соответствии с предпочтительным воплощением способа может быть использовано соединение общей формулы (I), где R1 представляет собой фенил и R2 и R3, оба, представляют собой этил. В этом случае получают соединение общей формулы (II), полезное в синтезе рамиприла. В еще одном предпочтительном воплощении способа может быть использовано соединение общей формулы (I), где R1 представляет собой метил и каждый из R2 и R3 представляет собой этил. В этом случае получают соединение общей формулы (II), полезное в синтезе периндоприла. В способе могут быть использованы органические растворители, выбранные из группы апротонных растворителей, предпочтительно дихлорметан. Взаимодействие легко протекает даже при низкой температуре. Указанное взаимодействие может быть осуществлено при температуре от приблизительно 5 С до приблизительно комнатной температуры. Время взаимодействия составляет несколько часов. Преимущество вышеупомянутого способа заключается в том, что промежуточные соединения общей формулы (I) получают в форме гомогенных имеющих высокую чистоту продуктов и превращение указанных соединений общей формулы (I) в соединения общей формулы (II) может быть осуществлено легко реализуемым путем в промышленном масштабе при помощи простого способа. Соединения общей формулы (II), полученные в соответствии с вышеописанным способом, могут быть превращены в конечные продукты общей формулы (III) при помощи способов, известных из предшествующего уровня техники. В соответствии с еще одним аспектом настоящего изобретения предложен способ получения соединений общей формулы (III) и их солей,где R1 представляет собой ароматическую углеводородную группу, содержащую одно или более ароматическое кольцо, которое может быть замещено одним или более одинаковыми или различными заместителями, выбранными из галогена, C1-C6-алкила, гидрокси, амино, или R1 представляет собой прямую или разветвленную, насыщенную, алифатическую углеводородную группу, содержащую от 1 до 6 атомов углерода, предпочтительно от 1 до 4 атомов углерода, например метил, этил, 1-пропил, 2 пропил, 1-бутил, третичный бутил;R2 представляет собой прямую или разветвленную, насыщенную, алифатическую углеводородную группу, содержащую от 1 до 6 атомов углерода, предпочтительно от 1 до 4 атомов углерода, например метил, этил, 1-пропил, 2-пропил, 1-бутил, третичный бутил;R4 представляет собой прямую или разветвленную, насыщенную, алифатическую углеводородную группу, содержащую от 1 до 6 атомов углерода, предпочтительно от 1 до 4 атомов углерода, например метил, этил, 1-пропил, 2-пропил, 1-бутил, третичный бутил;R5 представляет собой водород или R5 представляет собой прямую или разветвленную, насыщенную, алифатическую углеводородную группу, содержащую от 1 до 6 атомов углерода, предпочтительно от 1 до 4 атомов углерода, например метил, этил, 1-пропил, 2-пропил, 1-бутил, третичный бутил, или радикал формулы (VII), образованный R4, R5 и атомами углерода и азота, присоединенными к нему,в формуле (III) представляет собой часть любой из кольцевых систем (В) и (С), перечисленных ниже, иR6 представляет собой водород, прямую или разветвленную, насыщенную, алифатическую углеводородную группу, содержащую от 1 до 6 атомов углерода, предпочтительно от 1 до 4 атомов углерода,например метил, этил, 1-пропил, 2-пропил, 1-бутил, третичный бутил, или C1-C6-алкил, замещенный одной или более фенильной группой,включающий взаимодействие соединения общей формулы (II), полученного в соответствии со способом, описанным выше, где R1 и R2 являются такими, как определено выше, с соединением общей формулы (VIII)R4, R5 и R6 являются такими, как определено выше,и, если желательно, превращение полученного таким образом сложного эфира общей формулы (III),где R6 представляет собой прямую или разветвленную, насыщенную, алифатическую углеводородную группу, содержащую от 1 до 6 атомов углерода, предпочтительно от 1 до 4 атомов углерода, например метил, этил, 1-пропил, 2-пропил, 1-бутил, третичный бутил, или R6 представляет собой C1-C6-алкил, замещенный одной или более фенильной группой, в соответствующую карбоновую кислоту общей формулы (III), где R6 представляет собой водород; и, если желательно, превращение полученного соединения общей формулы (III) в его соль. Соединения общей формулы (VIII) могут быть использованы в виде их соли, такой как галогениды водорода (например, гидрохлорид), или в виде алкил- или арилсульфонатов (например, тозилат). Реакция соединений общих формул (II) и (VIII) может быть осуществлена в соответствии со способами, известными из предшествующего уровня техники. Превращение сложных эфиров, где R6 представляет собой C1-C6-алкил или фенилалкил, в соответствующие карбоновые кислоты, где значение R6 представляет собой водород, а также образование соли указанных карбоновых кислот могут быть осуществлены в соответствии со способами, известными из предшествующего уровня техники. Вышеописанный аспект настоящего изобретения может быть особенно предпочтительно использован для получения соединений общей формулы (III), где R1 представляет собой фенил; R2 представляет собой этил; R6 представляет собой водород и радикал формулы (VII) представляет собой часть кольцевой системы (В) (трандолаприл) или (С) (рамиприл), указанных выше. Аналогичное предпочтительное использование вышеприведенного способа представляет собой его применение для получения соединений общей формулы (III), где R1 представляет собой метил; R2 представляет собой этил; R6 представляет собой водород и радикал формулы (VII) представляет собой часть кольцевой системы (В) (периндоприл). В соответствии с еще одним аспектом настоящего изобретения предложен способ получения рамиприла, включающий взаимодействие соединения общей формулы (II), полученного, как описано выше,где R1 представляет собой фенил и R2 представляет собой этил, с (S,S,S)-2-азабицикло[3.3.0]октан-3 карбоновой кислоты бензиловым эфиром или его солью, предпочтительно его гидрохлоридом, и последующее удаление бензильной группы путем каталитического гидрирования. В соответствии с еще одним аспектом настоящего изобретения предложен способ получения периндоприла, включающий взаимодействие соединения общей формулы (II), полученного, как описано выше, где R1 представляет собой метил и R2 представляет собой этил, с (S,S,S)-пергидроиндол-2 карбоновой кислоты бензиловым эфиром или его солью, предпочтительно его гидрохлоридом, и последующее удаление бензильной группы путем каталитического гидрирования. Взаимодействие осуществляют в соответствии со способом, известным в области техники, с использованием органического растворителя и связывающего кислоту агента. В качестве органического растворителя успешно может быть использован этилацетат. Подходящие связывающие кислоту агенты включают органические основания, например триэтиламин, или неорганические соли, например карбонат натрия или карбонат калия. Реакция может быть осуществлена при температуре от приблизительно 5 до приблизительно 10 С. Время реакции обычно составляет несколько часов.-7 015450 Бензильная группа может быть удалена из продукта путем каталитического гидрирования. Подходящие катализаторы включают инертные металлы. Предпочтительно может быть использован палладий или платина, особенно предпочтителен палладий. В качестве реакционной среды могут быть использованы полярные органические растворители,предпочтительно этанол. В соответствии с настоящим изобретением альтернативный способ предложен для получения рамиприла, включающий взаимодействие соединения общей формулы (II), где R1 представляет собой фенил и R2 представляет собой этил, с (S,S,S)-2-азабицикло[3.3.0]-октан-3-карбоновой кислотой. Аналогично, периндоприл может быть получен путем реакции соединения общей формулы (II), гдеR1 представляет собой метил и R2 представляет собой этил, с (S,S,S)-пергидроиндол-2-карбоновой кислотой. Реакция сочетания предпочтительно может быть осуществлена с использованием тетрагидрофурана в качестве растворителя путем кипячения реакционной смеси с обратным холодильником в течение нескольких часов. Преимущество вышеприведенного способа заключается в том, что промежуточные соединения общей формулы (I) получают в виде гомогенного продукта, имеющего высокую чистоту, и превращение указанных соединений общей формулы (I) в соединения общей формулы (II) может быть осуществлено легко реализуемым путем в промышленном масштабе в простом способе. Дополнительные признаки настоящего изобретения могут быть обнаружены в следующих примерах, не ограничивая объем изобретения указанных примеров. Пример 1. Этил-2-(S)-N-этоксикарбонил-N-[1-(S)-(этоксикарбонилоксикарбонил)-этил]-амино-4 фенилбутират. 2,79 г (0,01 моль) N-[1-(S)-этоксикарбонил-3-фенилпропил]-L-аланина суспендируют в 25 мл ацетона, после чего добавляют 2,02 г (2,8 мл; 0,02 моль) триэтиламина. Реакционную смесь перемешивают до полного растворения всех исходных веществ; 2,39 г (2,1 мл; 0,022 моль) этилхлорформиата добавляют по каплям к реакционной смеси с поддержанием температуры от 10 до 20 С. Затем реакционную смесь перемешивают при комнатной температуре в течение 1 ч. После перемешивания реакционную смесь охлаждают и перемешивают при температуре от -2 до 2 С в течение 30 мин. Кристаллический осадок отфильтровывают и фильтрат концентрируют путем упаривания. Продукт получают в виде вязкого масла. Выход 4,20 г, приблизит. 100%. Инфракрасная спектрометрия (ИК) (см-1) 3063, 1827, 1742, 1710. 1 Н-ЯМР (CDCl3)7,25 (5 Н, m, ArH2-6); 4,55 (1H, t, PhCH2CH2CH), 4,34 (2 Н, q, J=7,0 Гц, ОСН 2 СН 3),4,30-4,05 (5 Н, m, Ala -Н, 2 ОСН 2 СН 3); 2,85-2,75 (2 Н, m, PhCH2); 2,35-2,20 (1 Н, m, PhCH2CH2); 2,20-1,95N-[1-(S)-Этоксикарбонил-3-фенилпропил]-4-(S)-метил-оксазолидин-2,5-дион. а) 4,23 г (0,01 моль) этил-2-(S)-N-этоксикарбонил-N-[1(S)-(этоксикарбонилоксикарбонил)этил]амино-4-фенилбутирата растворяют в 10 мл дихлорметана и к этому раствору добавляют по каплям 1,93 г (1,18 мл; 0,0165 моль) тионилхлорида, поддерживая температуру реакционной смеси от 5 до 10 С. Затем реакционную смесь перемешивают при комнатной температуре в течение 4,5-5 ч. Растворитель упаривают из реакционной смеси. Получающееся в результате коричневое вязкое масло растворяют в 3,5 мл метил-трет-бутилового эфира, перемешивают при температуре от -10 до -5 С и осажденные кристаллы выделяют путем фильтрования. Выход 1,95 г (64%), бесцветные кристаллы. Температура плавления 67-68 С. б) 2,79 г (0,01 моль) N-[1-(S)-этоксикарбонил-3-фенилпропил]-L-аланина суспендируют в 25 мл ацетона и к суспензии добавляют 2,02 г (2,8 мл; 0,02 моль) триэтиламина. Реакционную смесь перемешивают до растворения всех твердых веществ и по каплям добавляют 2,17 г (1,9 мл; 0,02 моль) этилхлорформиата, поддерживая температуру реакционной смеси от 10 до 20 С. Реакционную смесь перемешивают при комнатной температуре в течение 1 ч. Затем реакционную смесь охлаждают и перемешивают в течение 30 мин при температуре от -2 до 2 С. Кристаллический осадок отфильтровывают и фильтрат выпаривают досуха. Маслянистый остаток растворяют в 10 мл дихлорметана, охлаждают до 5 С и по каплям добавляют 1,93 г (1,18 мл; 0,0165 моль) тионилхлорида, поддерживая температуру реакционной смеси от 5 до 10 С.-8 015450 Затем реакционную смесь перемешивают при комнатной температуре в течение 4,5-5 ч. Растворитель упаривают и получающееся в результате коричневое вязкое масло смешивают с 3,5 мл метил-третбутилового эфира. Раствор перемешивают при температуре от -10 до -5 С и кристаллический продукт выделяют путем фильтрования. Выход 1,95 г, (64%), бесцветные кристаллы. Температура плавления 67-68 С. ИК (см-1) 2980, 2930, 1845, 1770, 1725. 1 Н-ЯМР (CDCl3)7,25 (5 Н, m, ArH2-6); 4,40 (1 Н, q, J=7,0 Гц, Ala -H); 4,36 (1 Н, dd, J=5,0 Гц,PhCH2CH2CH); 4,23 (2 Н, q, J=7,1 Гц, OCH2CH3); 2,80 (2 Н, m, PhCH2); 2,50-2,40 (1 Н, m, PhCH2CH2); 2,352,25 (1 Н, m, PhCH2CH2); 1,54 (3 Н, d, J=7,0 Гц, Ala-СН 3); 1,28 (3 Н, t, J=7,1 Гц, ОСН 2 СН 3) млн-1. Элементарный анализ:(2S,3aS,6aS)-1-[(2S)-2-(1S)-1-(Этоксикарбонил)-3-фенилпропил]амино]-1-оксопропил]октагидроциклопента[b]пиррол-2-карбоновая кислота (рамиприл). 25,0 г (0,0887 моль) (S,S,S)-2-азабицикло[3.3.0]октан-3-карбоновой кислоты бензилового эфира гидрохлорида и 9,9 г (13,5 мл; 0,0975 моль) триэтиламина смешивают с 125 мл этилацетата. К получающейся в результате суспензии по каплям добавляют раствор 32,5 г (0,1065 моль) N-[1-(S)-этоксикарбонил-3 фенилпропил]-4-(S)-метилоксазолидин-2,5-диона в 125 мл этилацетата, поддерживая температуру реакционной смеси при 5-10 С. Затем реакционную смесь перемешивают при комнатной температуре в течение 4 ч. После перемешивания реакционную смесь охлаждают до температуры от 0 до 5 С и соль отфильтровывают. Фильтрат промывают водой (2200 мл), сушат над сульфатом магния и растворитель упаривают досуха. Получающийся неочищенный рамиприла бензиловый эфир гидрируют в 96% (об./об.) этанола (440 мл) с использованием катализатора палладий/древесный уголь. Реакционную смесь упаривают досуха, остаток после упаривания перемешивают в диизопропиловом эфире (260 мл) при 0-5 С в течение 1 ч и продукт отфильтровывают. Таким образом, получают 32,2 г (87%) неочищенного продукта. Продукт перекристаллизовывают из смеси диэтилового эфира/диизопропилового эфира с получением 27,3 г (74%) очищенного продукта. Температура плавления 107-108 С. ИК и 1 Н-ЯМР спектры продукта идентичны спектрам, приведенным в сертифицированном референсном стандарте фармакопеи США. Элементарный анализ:C23H32N2O5 (416,53) Рассчитанный: С 66,32; Н 7,74; N 6,73% Измеренный: С 66,37; Н 7,75; N 6,64% Пример 4. Этил-2-(S)-N-этоксикарбонил-N-[1-(S)-(этоксикарбонилоксикарбонил)этил]аминопентаноат. 2,17 г (0,01 моль) N-[1-(S)-этоксикарбонилбутил]-L-аланина суспендируют в 25 мл ацетона и добавляют 2,02 г (2,8 мл; 0,02 моль) триэтиламина. Реакционную смесь перемешивают до растворения всех твердых веществ и по каплям добавляют 2,39 г (2,1 мл, 0,022 моль) этилхлорформиата, поддерживая температуру реакционной смеси от -5 до 0 С. Реакционную смесь перемешивают при комнатной температуре в течение 1 ч. После этого реакционную смесь охлаждают и перемешивают в течение 30 мин при температуре от -2 до 2 С. Кристаллическое твердое вещество отфильтровывают и фильтрат выпаривают досуха в вакууме. Продукт получают в виде вязкого масла (3,40 г, 94%) ИК (см-1) 2981, 1827, 1742, 1712 1 Н-ЯМР (CDCl3)4,70 (1 Н, t, СН 3 СН 2 СН 2 СН); 4,31 (2 Н, q, J=7,0 Гц, ОСН 2 СН 3); 4,30 (1 Н, q,J=7,0 Гц, Ala -Н); 4,24-4,10 (4 Н, m, 2 ОСН 2 СН 3); 1,98-1,70 (1 Н, m, СН 3 СН 2 СН 2); 1,70-1,60 (1 Н, m,СН 3 СН 2 СН 2); 1,55 (3 Н, d, J=7,0 Гц, Ala-СН 3); 1,47-1,33 (2 Н, т, СН 3 СН 2 СН 2); 1,37 (3 Н, t, J=7,0 Гц,ОСН 2 СН 3); 1,27 (3 Н, t, J=7,3 Гц, ОСН 2 СН 3); 1,26 (3 Н, t, J=7,3 Гц, ОСН 2 СН 3); 0,97 (3 Н, t, J=7,3 Гц,СН 3 СН 2 СН 2) млн-1. Элементарный анализ:N-[1-(S)-Этоксикарбонилбутил]-4-(S)-метилоксазолидин-2,5-дион. а) 3,61 г (0,01 моль) этил-2(S)-N-этоксикарбонил-N-[1(S)-(этоксикарбонилоксикарбонил)этил]аминопентаноата растворяют в 10 мл дихлорметана и по каплям добавляют 1,93 г (1,18 мл; 0,0165 моль) тионилхлорида, поддерживая температуру реакционной смеси от 5 до 10 С. Затем реакционную смесь перемешивают при комнатной температуре в течение 2-3 ч. После перемешивания растворитель упаривают из реакционной смеси. Продукт получают в маслянистой форме в виде остатка после-9 015450 упаривания (выход 2,31 г, 95%). б) 2,17 г (0,01 моль) N-[1-(S)-Этоксикарбонилбутил]-L-аланина суспендируют в 25 мл ацетона и к этой суспензии добавляют 2,02 г (2,8 мл; 0,02 моль) триэтиламина. Суспензию перемешивают до растворения всех твердых веществ и к реакционной смеси по каплям добавляют 2,17 г (1,9 мл; 0,02 моль) этилхлорформиата, поддерживая температуру реакционной смеси от 10 до 20 С. Реакционную смесь затем перемешивают при комнатной температуре в течение 1 ч, охлаждают и перемешивают в течение 30 мин при температуре от -2 до 2 С. Кристаллическое твердое вещество отфильтровывают и фильтрат упаривают досуха. Получающийся в результате маслянистый остаток растворяют в 10 мл дихлорметана, охлаждают до 5 С и при поддержании температуры реакционной смеси от 5 до 10 С по каплям добавляют 1,93 г(1,18 мл; 0,0165 моль) тионилхлорида. Затем реакционную смесь перемешивают при комнатной температуре в течение 2-3 ч. После перемешивания растворитель упаривают из реакционной смеси. Продукт получают в виде масла (выход 2,31 г, 95%). ИК (см-1): 2980, 2966, 1852, 1780, 1739; 1 Н-ЯМР (CDCl3)4,59 (1 Н, q, J=7,0 Гц, Ala -H); 4,48 (1 Н, dd, J=5,7 Гц, СН 3 СН 2 СН 2 СН); 4,23 (2 Н,q, J=7,1 Гц, ОСН 2 СН 3); 2,07-1,98 (1 Н, m, СН 3 СН 2 СН 2 СН); 1,94-1,84 (1 Н, m, CH3CH2CH2CH); 1,59 (3 Н, d,J=7,0 Гц, Ala-CH3); 1,56-1,41 (2 Н, m, CH3CH2CH2CH); 1,30 (3 Н, t, J=7,1 Гц, OCH2CH3); 0,99 (3 Н, t,J=7,4 Гц, СН 3 СН 2 СН 2 СН) млн-1. Элементарный анализ:(2S,3aS,7aS)-1-[(2S)-2-(1S)-1-(Этоксикарбонил)бутил]амино]-1-оксопропил]октагидро-1H-индол 2-карбоновой кислоты трет-бутиламмониевая соль (периндоприла эрбумин). а) 4,72 г (28 ммоль) (S,S,S)-1H-пергидроиндол-2-карбоновой кислоты суспендируют в 37,5 мл тетрагидрофурана и суспензию охлаждают до 0-5 С. К суспензии по каплям добавляют раствор 8,15 г(33,5 ммоль) N-[1-(S)-этоксикарбонилбутил]-4-(S)-метилоксазолидин-2,5-диона в 37,5 мл тетрагидрофурана, поддерживая температуру реакционной смеси от 0 до 5 С. Затем реакционную смесь перемешивают и кипятят с обратным холодильником в течение 4 ч. Реакционную смесь упаривают в вакууме и остаток после упаривания растворяют в 120 мл этилацетата. По каплям к этилацетатному раствору остатка после упаривания при перемешивании добавляют раствор 1,95 г (2,8 мл; 27 ммоль) трет-бутиламина в 60 мл этилацетата. Получающуюся в результате суспензию нагревают до растворения, обрабатывают активированным углем, фильтруют и фильтрату дают возможность охлаждаться до комнатной температуры при непрерывном перемешивании. Кристаллический продукт отфильтровывают. Выход 6,76 г (55%). Температура плавления 149,0-149,5 С. ИК и 1 Н-ЯМР спектры продукта идентичны спектрам источника. б) К раствору 12,95 г (0,03 моль) (S,S,S)-1H-пергидроиндол-2-карбоновой кислоты бензилового эфира тозилата и 9,10 г (12,5 мл; 0,09 моль) триэтиламина в 90 мл этилацетата по каплям при комнатной температуре добавляют раствор 8,76 г (0,036 моль) N-[1-(S)-этоксикарбонилбутил]-4-(S)метилоксазолидин-2,5-диона в 90 мл этилацетата. Реакционную смесь перемешивают при комнатной температуре в течение 2 ч. После перемешивания реакционную смесь смешивают с 150 мл 5% (мас./об.) водного раствора гидрокарбоната натрия, органический слой отделяют, промывают водой (2150 мл),сушат над сульфатом магния, обрабатывают активированным углем, фильтруют и выпаривают досуха. Полученный таким образом неочищенный периндоприла бензиловый эфир растворяют в 150 мл этанола и гидрируют в присутствии катализатора палладий/древесный уголь. Катализатор отфильтровывают, растворитель упаривают и остаток после упаривания растворяют в 120 мл этилацетата. К получающемуся в результате раствору по каплям при перемешивании добавляют раствор 2,19 г (3,15 мл; 0,03 моль) трет-бутиламина в 45 мл этилацетата. Кристаллы отфильтровывают и очищают путем перекристаллизации из этилацетата. Таким образом, получают 9,65 г (73%) кристаллического продукта. Температура плавления 149,0-149,5 С. ИК и 1 Н-ЯМР спектры продукта идентичны спектрам источника. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения общей формулы (I) где R1 представляет собой ароматическую углеводородную группу, содержащую одно или более ароматическое кольцо, которое может быть замещено одним или более одинаковыми или различными заместителями, выбранными из галогена, C1-C6-алкила, гидрокси, амино, или R1 представляет собой прямую или разветвленную, насыщенную, алифатическую углеводородную группу, содержащую от 1 до 6 атомов углерода;R2 представляет собой прямую или разветвленную, насыщенную, алифатическую углеводородную группу, содержащую от 1 до 6 атомов углерода;R3 представляет собой прямую или разветвленную, насыщенную, алифатическую углеводородную группу, содержащую от 1 до 6 атомов углерода, или R3 представляет собой C1-C6-алкил, замещенный одной или более фенильной группой. 2. Соединение по п.1, где прямая или разветвленная, насыщенная, алифатическая углеводородная группа представляет собой метил, этил, 1-пропил, 2-пропил, 1-бутил или третичный бутил. 3. Соединения общей формулы (I) по п.1, где R1 представляет собой фенил; R2 представляет собой этил и R3 представляет собой этил. 4. Соединения общей формулы (I) по п.1, где R1 представляет собой метил; R2 представляет собой этил и R3 представляет собой этил. 5. Способ получения соединений общей формулы (I) по п.1, где значения R1, R2 и R3 являются такими, как указано в п.1, включающий взаимодействие соединения общей формулы (IV) где значения R1 и R2 являются такими, как определено выше,в органическом растворителе в присутствии связывающего кислоту агента по меньшей мере с 2 мол.экв. соединения общей формулы (VI)XCOOR3,(VI) где X представляет собой галоген или третичную бутилоксикарбонилоксигруппу и R3 является таким, как определено выше. 6. Способ по п.5, включающий взаимодействие 1 мол.экв. соединения общей формулы (IV) с 2-3 мол.экв. соединения общей формулы (VI). 7. Способ по п.5, включающий применение тетрагидрофурана, этилацетата, дихлорметана или ацетона в качестве органического растворителя. 8. Способ по п.7, включающий применение ацетона в качестве органического растворителя. 9. Способ по п.5, включающий применение органического амина или неорганической соли в качестве связывающего кислоту агента. 10. Способ по п.9, включающий применение в качестве органического амина триэтиламина, пиридина или морфолина, в качестве неорганической соли - карбоната натрия или карбоната калия. 11. Способ по п.10, включающий применение триэтиламина в качестве связывающего кислоту агента. 12. Способ по п.5, включающий применение соединения общей формулы (VI), где X представляет собой хлор и R3 представляет собой этил. 13. Способ получения соединений общей формулы (II) где R1 и R2 являются такими, как определено в п.1,- 11015450 включающий взаимодействие соединения общей формулы (I), где R1, R2 и R3 являются такими, как в п.1, с тионилхлоридом в органическом растворителе. 14. Способ по п.13, включающий применение соединения общей формулы (I), где R1 представляет собой фенил; R2 представляет собой этил; R3 представляет собой этил. 15. Способ по п.13, включающий применение соединения общей формулы (I), где R1 представляет собой метил; R2 представляет собой этил; R3 представляет собой этил. 16. Способ по любому из пп.13-15, включающий применение апротонного растворителя в качестве органического растворителя. 17. Способ по п.16, включающий применение дихлорметана в качестве органического растворителя. 18. Способ получения соединений общей формулы (II), где R1 и R2 определены, как в п.1, включающий взаимодействие соединения общей формулы (IV), где R1 и R2 являются такими, как определено выше, в органическом растворителе в присутствии связывающего кислоту агента по меньшей мере с 2 мол.экв. соединения общей формулы (VI), где X и R3 являются такими же, как определено в п.12, после этого взаимодействие полученного таким образом соединения общей формулы (I) с тионилхлоридом в органическом растворителе. 19. Способ по п.18, включающий применение в качестве исходных веществ соединения общей формулы (IV), где R1 представляет собой фенил; R2 представляет собой этил, и соединения общей формулы (VI), где R3 представляет собой этил и X представляет собой хлор. 20. Способ по п.18, включающий применение в качестве исходных веществ соединения общей формулы (IV), где R1 представляет собой метил; R2 представляет собой этил, и соединения общей формулы (VI), где R3 представляет собой этил и X представляет собой хлор. 21. Способ по любому из пп.18-20, включающий взаимодействие 1 мол.экв. соединения общей формулы (IV) с 2-3 мол.экв. соединения общей формулы (VI). 22. Способ по любому из пп.18-21, включающий применение органического амина или неорганической соли в качестве связывающего кислоту агента. 23. Способ по п.22, включающий применение триэтиламина, пиридина или морфолина в качестве органического амина. 24. Способ по п.23, включающий применение триэтиламина в качестве связывающего кислоту агента. 25. Способ получения соединений общей формулы (III) и их солей,где R1 представляет собой ароматическую углеводородную группу, содержащую одно или более ароматическое кольцо, которое может быть замещено одним или более одинаковыми или различными заместителями, выбранными из галогена, C1-C6-алкила, гидрокси, амино, или R1 представляет собой прямую или разветвленную, насыщенную, алифатическую углеводородную группу, содержащую от 1 до 6 атомов углерода;R2 представляет собой прямую или разветвленную, насыщенную, алифатическую углеводородную группу, содержащую от 1 до 6 атомов углерода;R4 представляет собой прямую или разветвленную, насыщенную, алифатическую углеводородную группу, содержащую от 1 до 6 атомов углерода;R5 представляет собой водород или R5 представляет собой прямую или разветвленную, насыщенную, алифатическую углеводородную группу, содержащую от 1 до 6 атомов углерода, или представляет собой часть любой из кольцевых систем (В) и (С), перечисленных нижеR6 представляет собой водород, прямую или разветвленную, насыщенную, алифатическую углеводородную группу, содержащую от 1 до 6 атомов углерода, или C1-C6-алкил, замещенный одной или более фенильной группой,включающий взаимодействие соединения общей формулы (II), полученного в соответствии со способом по п.13 или 18, где R1 и R2 являются такими, как определено выше, с соединением общей формулы (VIII) или его солью,где R4, R5 и R6 являются такими, как определено выше; и, если желательно, превращение полученного таким образом сложного эфира общей формулы (III),где R6 представляет собой прямую или разветвленную, насыщенную, алифатическую углеводородную группу, содержащую от 1 до 6 атомов углерода, или R6 представляет собой C1-C6-алкил, замещенный одной или более фенильной группой, в соответствующую карбоновую кислоту общей формулы (III), гдеR6 представляет собой водород; и, если желательно, превращение полученного соединения общей формулы (III) в его соль. 26. Способ по п.25, где прямая или разветвленная, насыщенная, алифатическая углеводородная группа представляет собой метил, этил, 1-пропил, 2-пропил, 1-бутил или третичный бутил. 27. Способ получения соединения общей формулы (III), где R1 представляет собой фенил; R2 представляет собой этил; R6 представляет собой водород и радикал формулы (VII) в общей формуле (III) представляет собой группу формулы (С) (рамиприл), включающий взаимодействие соединения общей формулы (II), полученного в соответствии с любым из способов по п.13 или 18, где R1 и R2 определены в преамбуле п.27, с (S,S,S)-2-азабицикло[3.3.0]октан-3-карбоновой кислоты бензиловым эфиром или его солью и удаление бензильной группы путем каталитического гидрирования. 28. Способ по п.27, где соль бензилового эфира (S,S,S)-2-азабицикло[3.3.0]октан-3-карбоновой кислоты представляет собой гидрохлорид. 29. Способ получения соединения общей формулы (III), где R1 представляет собой метил; R2 представляет собой этил; R6 представляет собой водород и радикал формулы (VII) в общей формуле (III) представляет собой группу формулы (В) (периндоприл), включающий взаимодействие соединения общей формулы (II), полученного в соответствии с любым из способов по п.13 или 18, где R1 и R2 определены в преамбуле п.29, с (S,S,S)-пергидроиндол-2-карбоновой кислоты бензиловым эфиром или его солью и удаление бензильной группы путем каталитического гидрирования. 30. Способ по п.29, где соль бензилового эфира (S,S,S)-пергидроиндол-2-карбоновой кислоты представляет собой гидрохлорид. 31. Способ получения периндоприла, включающий взаимодействие соединения общей формулы(II), полученного в соответствии с любым из способов по п.13 или 18, где R1 представляет собой метил;R2 представляет собой этил, с (S,S,S)-пергидроиндол-2-карбоновой кислотой. 32. Способ получения рамиприла, включающий взаимодействие соединения общей формулы (II),полученного в соответствии с любым из способов по п.13 или п.18, где R1 представляет собой фенил; R2 представляет собой этил, с (S,S,S)-2-азабицикло[3.3.0]октан-3-карбоновой кислотой.
МПК / Метки
МПК: C07C 271/22, C07D 263/44, C07K 5/06, C07D 209/52, C07D 209/42, C07C 269/04
Метки: ацетилхолинэстеразы, соединения, синтезе, асе, фармацевтические, применение, ингибиторов, промежуточные
Код ссылки
<a href="https://eas.patents.su/15-15450-farmacevticheskie-promezhutochnye-soedineniya-v-sinteze-ingibitorov-acetilholinesterazy-ase-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Фармацевтические промежуточные соединения в синтезе ингибиторов ацетилхолинэстеразы (асе) и их применение</a>
Предыдущий патент: Способ борьбы с фитопатогенными грибами
Следующий патент: Штепсельный разъем для установки перед стенкой или за стенкой
Случайный патент: Способ экстракции