Противобактериальные индолоноксазолидиноны, промежуточные соединения для их получения и содержащие их фармацевтические композиции
Формула / Реферат
1. Соединения формулы I
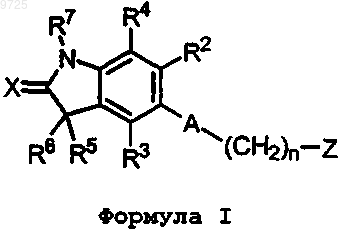
или их фармацевтически приемлемые соли, где А представляет собой фрагмент i
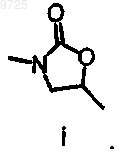
где
n равно 0 или 1;
X представляет собой О или S;
Z представляет собой NHC(=O)R1, NHC(=S)R1 или C(=O)NHR1;
R1 представляет собой Н, NH2, NH-C1-4-алкил, C1-4-алкил;
R2, R3 и R4 независимо друг от друга представляют собой Н или F;
R5 и R6 независимо друг от друга представляют собой С1-4алкил или галоген;
R7 представляет собой Н или С1-4алкил.
2. Соединение по п.1, где R7 представляет собой С1-4алкил.
3. Соединение по п.1, где R5 представляет собой фтор.
4. Соединение по п.3, где R6 представляет собой фтор.
5. Соединение по п.1, выбранное из группы:
a) (5R)-(-)-3-(3,3-дифтор-2,3-дигидро-1-метил-2-оксо-1H-индол-5-ил)-N-метил-2-оксо-5-оксазолидинкарбоксамид;
b) (5R)-(-)-3-(3,3-дифтор-2,3-дигидро-1-метил-2-оксо-1H-индол-5-ил)-2-оксо-5-оксазолидинкарбоксамид;
c) (5R)-(-)-3-(3,3-дифтор-2,3-дигидро-1-этил-2-оксо-1H-индол-5-ил)-2-оксо-5-оксазолидинкарбоксамид;
d) (5R)-(-)-3-(3,3-дифтор-2,3-дигидро-1-этил-2-оксо-1H-индол-5-ил)-N-метил-2-оксо-5-оксазолидинкарбоксамид;
e) N-[[(5S)-(-)-3-(3,3-дифтор-2,3-дигидро-1-метил-2-оксо-1H-индол-5-ил)-2-оксо-5-оксазолидинил]метил]ацетамид и
f) N-[[(5S)-(-)-3-(3,3-дифтор-2,3-дигидро-1-этил-2-оксо-1H-индол-5-ил)-2-оксо-5-оксазолидинил]метил]ацетамид.
6. Применение соединения по п.1 для получения лекарственного препарата, обладающего противомикробным действием.
7. Применение по п.6, в котором лекарственный препарат приготовлен для орального, парентерального, трансдермального или местного введения.
8. Применение по п.6, в котором лекарственный препарат содержит от примерно 0,1 до примерно 1000 мг соединения по п.1.
9. Применение по п.6, в котором лекарственный препарат содержит от примерно 0,1 до примерно 500 мг соединения по п.1.
10. Фармацевтическая композиция, содержащая соединение по п.1 и фармацевтически приемлемый носитель.
11. Соединение формулы II

где
R7 представляет собой С1-4алкил;
М выбран из группы, состоящей из NO2, NH2, NHC(O)OR8 или остатка i
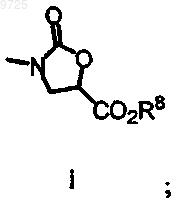
где R8 представляет собой С1-4алкил или бензил.
12. Соединение по п.11, где R7 представляет собой С1-4алкил или замещенный С1-4алкил.
13. Соединение по п.11, выбранное из группы:
a) бутил (5R)-3-(3,3-дифтор-1-метил-2-оксо-2,3-дигидро-1Н-индол-5-ил)-2-оксо-5-оксазолидинкарбоксилат;
b) бензил 1-этил-3,3-дифтор-2-оксо-2,3-дигидро-1Н-индол-5-илкарбамат;
c) 5-амино-1-этил-3,3-дифтор-1,3-дигидро-2Н-индол-2-он;
d) 1-этил-3,3-дифтор-5-нитро-1,3-дигидро-2Н-индол-2-он;
e) бензил 3,3-дифтор-1-метил-2-оксо-2,3-дигидро-1Н-индол-5-илкарбамат;
f) 5-амино-3,3-дифтор-1-метил-1,3-дигидро-2Н-индол-2-он;
g) 3,3-дифтор-1-метил-5-нитро-1,3-дигидро-2Н-индол-2-он и
h) бутил (5R)-3-(3,3-дифтор-1-этил-2-оксо-2,3-дигидро-1Н-индол-5-ил)-2-оксо-5-оксазолидинкарбоксилат.
Текст
009725 Данное изобретение относится к новым 2-оксииндолил (или индол-2-он)оксазолидинонам, их производным, промежуточным соединениям и их получению. Оксазолидиноновые противобактериальные агенты являются новым синтетическим классом противомикробных средств с сильной активностью против ряда патогенных микроорганизмов человека и животных (ветеринария), включая грам-положительные аэробные бактерии, такие как многорезистентные стафиллококки и стептококки, анаэробные организмы, такие как бактероиды и виды клостридий, и устойчивые к кислотам организмы, такие как Mycobacterium tuberculosis и Mycobacterium avium. В одном аспекте изобретение касается соединений формулы I или их фармацевтически приемлемые соли, где А представляет собой фрагмент iR2, R3 и R4 независимо друг от друга представляют собой Н или F;R5 и R6 независимо друг от друга представляют собой C1-4 алкил или галоген;R7 представляет собой Н или C1-4 алкил. В другом аспекте изобретение представляет соединение формулы II где R8 представляет собой С 1-4 алкил или бензил. В еще другом аспекте изобретение касается применения соединения формулы I для изготовления лекарственного препарата для лечения микробных инфекций у млекопитающих. Лекарственный препарат готовят для перорального, парентерального, трансдермального или местного введения. Лекарственный препарат может содержать соединение формулы I в количестве от примерно 0,1 до примерно 100 мг/кг массы тела/день, более предпочтительно в количестве от примерно 1 до примерно 50 мг/кг массы тела/день. Например, лекарственный препарат может содержать от примерно 0,1 до примерно 1000 мг,например от примерно 0,1 до примерно 500 мг соединения формулы I. Еще в другом аспекте в изобретении предложена фармацевтическая композиция, содержащая соединение формулы I и фармацевтически приемлемый носитель. Преимущественно соединения данного изобретения проявляют сильную противобактериальную активность. Подробное описание изобретения Использованы следующие определения, если не указано иначе. Содержание атомов углерода в различных углеводородсодержащих группах указано приставкой,определяющей минимальное и максимальное число атомов углерода в группе, то есть приставка Ci-j означает группу с числом атомов углерода от "i" до "j", включительно. Так, например, C1-7-алкил относится к алкилу, содержащему от одного до семи атомов углерода включительно.-1 009725 Термин "галоген" относится к атому галогена, выбранному из Cl, Br, I и F. Термин "алкил" относится к группам как с линейной, так и с разветвленной цепью. Если не указано специально, алкильные группы содержат от 1 до 6 атомов углерода. Термин "алкенил" относится к группам как с линейной, так и с разветвленной цепью, содержащим по меньшей мере одну группу -С=С-. Если не указано специально, алкенильные группы содержат от 1 до 6 атомов углерода. Термин "алкинил" относится к группам как с линейной, так и с разветвленной цепью, содержащим по меньшей мере одну группу -ОС-. Если не указано специально, алкинильные группы содержат от 1 до 6 атомов углерода. Термин "алкокси" относится к -О-алкильным группам. Термин "циклоалкил" относится к циклической алкильной группе. Если не указано специально,циклоалкильные группы могут содержать от 3 до 7 атомов углерода. Термин "циклоалкенил" относится к циклической алкенильной группе. Если не указано специально,циклоалкенильные группы могут содержать от 3 до 7 атомов углерода и по меньшей мере одну группу С=С- внутри кольца. Термин "аминогруппа" относится к -NH2. Термин "арил" относится к фенилу или нафтилу. Термин "het" относится к моно- или бициклической кольцевой системе, содержащей по меньшей мере один гетероатом, выбранный из О, S и N. Каждое моноциклическое кольцо может быть ароматическим, насыщенным или частично ненасыщенным. Бициклическая кольцевая система может содержать моноциклическое кольцо, содержащее по меньшей мере один гетероатом, сконденсированный с циклоалкильной или арильной группой. Бициклическая кольцевая система может также содержать моноциклическую кольцевую систему, содержащую по меньшей мере один гетероатом, сконденсированную с другой het, моноциклической кольцевой системой. Термин het охватывает термины het1, het2 и гетероциклоалкил, определенный в данном описании. Примерами "het" являются, но этим не ограничиваются, пиридин, тиофен, фуран, пиразолин, пиримидин, 2-пиридил, 3-пиридил, 4-пиридил, 2-пиримидинил, 4-пиримидинил, 5-пиримидинил, 3 пиридазинил, 4-пиридазинил, 3-пиразинил, 4-оксо-2-имидазолил, 2-имидазолил, 4-имидазолил, 3 изоксазолил, 4-изоксазолил, 5-изоксазолил, 3-пиразолил, 4-пиразолил, 5-пиразолил, 2-оксазолил, 4 оксазолил, 4-оксо-2-оксазолил, 5-оксазолил, 1,2,3-оксатиазол, 1,2,3-оксадиазол, 1,2,4-оксадиазол, 1,2,5 оксадиазол, 1,3,4-оксадиазол, 2-тиазолил, 4-тиазолил, 5-тиазолил, 3-изотиазол, 4-изотиазол, 5-изотиазол,2-фуранил, 3-фуранил, 2-тиенил, 3-тиенил, 2-пирролил, 3-пирролил, 3-изопирролил, 4-изопирролил, 5 изопирролил, 1,2,3-оксатиазол-1-оксид, 1,2,4-оксадиазол-3-ил, 1,2,4-оксадиазол-5-ил, 5-оксо-1,2,4 оксадиазол-3-ил, 1,2,4-тиадиазол-3-ил, 1,2,4-тиадиазол-5-ил, 1,2,5-тиадиазол-3-ил, 3-оксо-1,2,4 тиадиазол-5-ил, 1,3,4-тиадиазол-5-ил, 2-оксо-1,3,4-тиадиазол-5-ил, 1,2,3-триазол-1-ил, 1,2,4-триазол-3-ил,1,2,4-триазол-5-ил, 1,2,3,4-тетразол-5-ил, 5-оксазолил, 3-изотиазолил, 4-изотиазолил, 5-изотиазолил,1,3,4-оксадиазол, 4-оксо-2-тиазолинил, 5-метил-1, 3, 4-тиадиазол-2-ил, тиазолдион, 1,2,3,4-тиатриазол,1,2,4-дитиазолон, фталимид, хинолинил, морфолинил, бензоксазоил, диазинил, триазинил, хинолинил,хиноксалинил, нафтиридинил, азетидинил, пирролидинил, гидантоинил, оксатиоланил, диоксоланил,имидазолинил и азабицикло[2.2.1]гептил. Термин "гетероарил" относится к ароматическому het, примерами которых являются, но этим не ограничиваются, пиридин и тиофен. Термин "замещенный алкил" относится к алкильной группе, содержащий от 1 до 4 заместителей, выбранных из галогена, het, циклоалкила, циклоалкенила, арила, -OQ10, -SQ10, -S(O)2Q10, -S(O)Q10, -OS(O)2Q10,-C(=NQ10)Q10, -C(=NOQ10)Q10, -SC(O)Q10, -NQ10Q10, -C(O)Q10, -C(S)Q10, -C(O)OQ10, -OC(O)Q10, -C(O)NQ10Q10,C(O)C(Q16)2OC(O)Q10, -CN, =O, =S, -NQ10C(O)Q10, -NQ10C(O)NQ10Q10, -S(O)2NQ10Q10, -NQ10S(0)2Q10,-NQ10S(O)Q10, -NQ10SQ10, NO2 и -SNQ10Q10. Каждый het, циклоалкил, циклоалкенил и арил могут быть замещены 1-4 заместителями, независимо друг от друга выбранными из галогена и Q15. Термин "замещенный арил" относится к арильной группе, содержащей от 1 до 3 заместителей, выбранных из -OQ10, -SQ10, -S(O)2Q10, -S(O)Q10, -OS(O)2Q10, -C(=NQ10)Q10, -SC(O)Q10, -NQ10Q10, -C(O)Q10,-C(S)Q10, -C(O)OQ10, -OC(O)Q10, -C (O)NQ10Q10, -C(O)C(Q16)2OC(O)Q10, -CN, -NQ10C(O)Q10,-NQ10C(O)NQ10Q10, -S(O)2NQ10Q10, -NQ10S(O)2Q10, -NQ10S(O)Q10, -NQ10SQ10, -NO2, SNQ10Q10, алкила, замещенного алкила, het, галогена, циклоалкила, циклоалкенила и арила. Het, циклоалкил, циклоалкенил и арил могут быть замещены 1-3 заместителями, выбранными из галогена и Q15. Термин "замещенный het" относится к гетероциклической группе, содержащей от 1 до 4 заместителей, выбранных из -OQ10, -SQ10, -S(O)2Q10, S(O)Q10, -OS(O)2Q10, -C(=NQ10)Q10, -C(=NOQ10)Q10,-SC(O)Q10, -NQ10Q10, -C(O)Q10, -C(S)Q10, -C(O)OQ10, -OC(O)Q10, -C(O)NQ10Q10, -C(O)C(Q16)2OC(O)Q10,-CN, -NQ10C(O)Q10, -NQ10C(O)NQ10Q10, -S(O)2NQ10Q10, "NQ10S(O)2Q10, "NQ10S(O)Q10, -NQ10SQ10, -NO2,-SNQ10Q10, алкила, замещенного алкила, het, галогена, циклоалкила, циклоалкенила и арила. Заместительhet также может быть замещен одним или более заместителями =O или =S, причем О или S присоединены к атому цикла, способному содержать двойную связь между атомом цикла и О или S. Het, циклоалкил, циклоалкенил и арил могут быть замещены 1-3 заместителями, выбранными из галогена и Q15.-2 009725 Термин "замещенный алкенил" относится к алкенильной группе, содержащей от 1 до 3 заместителей -OQ10, -SQ10, -S(O)2Q10, -S(O)Q10, -OS(O)2Q10, -C(=NQ10)Q10, -C(=NOQ10)Q10, -SC(O)Q10, -NQ10Q10,-C(O)Q10, -C(S)Q10, -C(O)OQ10, -ОС(O)Q10, -C(O)NQ10Q10, -С(О)С(Q16)2OC(O)Q10, -CN, =O, =S,-NQ10C(O)Q10, -NQ10C(O)NQ10Q10, -S(O)2NQ10Q10, -NQ10S(O)2Q10, -NQ10S(O)Q10, -NQ10SQ10, -NO2,-SNQ10Q10, алкила, замещенного алкила, het, галогена, циклоалкила, циклоалкенила и арила. Het, циклоалкил, циклоалкенил и арил могут быть замещены 1-3 заместителями, выбранными из галогена и Q15. Термин "замещенная алкоксигруппа" относится к алкоксильной группе, содержащей от 1 до 3 заместителей -OQ10, -SQ10, -S(O)2Q10, -S(O)Q10, -OS(O)2Q10, -C(=NQ10)Q10, -SC(O)Q10, -NQ10Q10, -C(O)Q10,-C(S)Q10, -C(O)OQ10, -OC(O)Q10, -C(O)NQ10Q10, -С(О)С(Q16)2OC(O)Q10, -CN, =O, =S, -NQ10C(O)Q10,-NQ10C(O)NQ10Q10, -S(O)2NQ10Q10, -NQ10S(O)2Q10, -NQ10S(O)Q10, -NQ10SQ10, -NO2, SNQ10Q10, алкила, замещенного алкила, het, галогена, циклоалкила, циклоалкенила и арила. Het, циклоалкил, циклоалкенил и арил могут быть замещены 1-3 заместителями, выбранными из галогена и Q15. Термин "замещенный циклоалкенил" относится к циклоалкенильной группе, содержащей от 1 до 3 заместителей -OQ10, -SQ10, -S(O)2Q10, -S(O)Q10, -OS(O)2Q10, -C(=NQ10)Q10, -SC(O)Q10, -NQ10Q10, -C(O)Q10,-C(S)Q10, -C(O)OQ10, -ОС(O)Q10, -C(O)NQ10Q10, -C(O)C(Q16)2OC(O)Q10, -CN, =O, =S, -NQ10C(O)Q10,-NQ10C(O)NQ10Q10, -S(O)2NQ10Q10, -NQ10S(O)2Q10, -NQ10S(O)Q10, -NQ10SQ10, -NO2, -SNQ10Q10, алкила, замещенного алкила, het, галогена, циклоалкила, циклоалкенила и арила. Het, циклоалкил, циклоалкенил и арил могут быть замещены 1-3 заместителями, выбранными из галогена и Ql5. Термин "замещенная аминогруппа" означает аминогруппу, в которой один или оба водорода аминогруппы заменены группой, выбранной из -OQ10, -SQ10, -S(O)2Q10, -S(O)Q10, -OS(O)2Q10, -C(O)Q10,-C(S)Q10, -C(O)OQ10, -OC(O)Q10, -C(O)NQ10Q10, -С(O)С(Q16)2OC(O)Q10, -CN, алкила, замещенного алкила,het, галогена, циклоалкила, циклоалкенила и арила. Het, циклоалкил, циклоалкенил и арил могут быть замещены 1-3 заместителями, выбранными из галогена и Q15. Каждый из Q10 независимо друг от друга выбран из -Н, алкила, циклоалкила, het, циклоалкенила и арила. Het, циклоалкил, циклоалкенил и арил могут быть замещены 1-3 заместителями, выбранными из галогена и Q13. Каждый из Q11 независимо друг от друга выбран из -Н, галогена, алкила, арила, циклоалкила и het. Алкил, циклоалкил и het могут быть замещены 1-3 заместителями, независимо друг от друга выбранными из галогена, -NO2, -CN, =S, =O и Q14. Арил может быть замещен 1-3 заместителями, независимо друг от друга выбранными из галогена, -NO2, -CN и Q14. Каждый из Q13 независимо друг от друга выбран из Q 11, -OQ 11, -SQ 11, -S(O) 2Q 11, -S(O)Q 11,-OS(O) 2Q 11, -C(=NQ 11)Q 11, -SC(O)Q 11, -NQ 11Q 11, -C(O)Q 11, -C(S)Q 11, -C(O)OQ 11, -OC(O)Q 11,-C(O)NQ11Q11, -C(O)C(Q16)2OC(O)Q10, -CN, =O, =S, NQ11C(O)Q11, -NQ11C(O)NQ11Q11, -S(O)2NQ11Q11,-NQ11S(O)2Q11, -NQ11S(O)Q11, -NQ11SQ11, -NO2 и -SNQ11Q11, причем Q13 не означает =O или =S, если Q10 означает арил или het не содержащие атома, способного образовывать двойную связь с O или S. Каждый из Q14 означает -Н или заместитель, выбранный из алкила, циклоалкила, циклоалкенила,фенила или нафтила, каждый из которых может быть замещен 1-4 заместителями, независимо друг от друга выбранными из -F, -Cl, -Br, -I, -OQ16, -SQ16, -S(O)2Q16, -S(O)Q16, -OS(O)2Q16, -NQ16Q16, -C(O)Q16,-C(S)Q16, -C(O)OQ16, -NO2, -C(O)NQ16Q16, -CN, -NQ16C(O)Q16, -NQ16C(O)NQ16Q16, -S(O)2NQ16Q16 и-NQ16S(O)2Q16. Алкил, циклоалкил и циклоалкенил могут быть дополнительно замещены =O или =S. Каждый из Q15 означает алкил, циклоалкил, циклоалкенил, het, фенил или нафтил, каждый возможно замещенный 1-4 заместителями, независимо друг от друга выбранными из -F, -Cl, Br, -I, -OQ16, -SQ16,-S(O)2Q16, -S(O)Q16, -OS(O)2Q16, -C(=NQ16) Q16, -SC(O)Q16, -NQ16Q16, -C(O)Q16, -C(S)Q16, -C(O)OQ16,-OC(O)Q16, -C(O)NQ16Q16, -C(O)C(Q16)2OC(O)Q16, -CN, -NQ16C(O)Q16, -NQ16C(O)NQ16Q16, -S(O)2NQ16Q16,-NQ16S(O)2Q16, -NQ16S(O)Q16, -NQ16SQ16, -NO2 и -SNQ16Q16. Алкил, циклоалкил и циклоалкенил могут быть дополнительно замещены =O или =S. Каждый из Q16 независимо друг от друга выбран из -Н, алкила и циклоалкила. Алкил и циклоалкил могут дополнительно содержать от 1 до 3 (атомов) галогена. Термин "млекопитающее" относится к человеку или животным. Соединения данного изобретения обычно называют в соответствии с системой номенклатуры IUPAC или CAS. Могут быть использованы сокращения, хорошо известные обычному специалисту в данной области (например, "Ph" для фенила, "Me" для метила, "Et" для этила, "О" для атома кислорода, "S" для атома серы, "N" для атома азота, "ч" для часа или часов и "КТ" для комнатной температуры). Соединения данного изобретения могут быть превращены в их соли, где это целесообразно, обычными способами. Термин "фармацевтически приемлемые соли" относится к кислотно-аддитивным солям, применимым для введения соединений данного изобретения, и включают гидрохлориды, гидробромиды, гидроиодиды, сульфаты, фосфаты, ацетаты, пропионаты, лактаты, мезилаты, малеаты, малаты, сукцинаты, тартраты, цитраты, 2-гидроксиэтилсульфонаты, фумараты и подобные. Указанные соли могут быть в гидратированной форме. Соединения формулы I данного изобретения содержат хиральный центр, а именно у С-5 оксазолидинонового цикла, и как таковые они находятся как в форме двух энантиомеров, так и их рацемической-3 009725 смеси. Изобретение относится как к обоим энантиомерам, которые обладают описанными здесь свойствами, так и к смесям, содержащим оба изомера. Дополнительно, в зависимости от заместителей, в соединениях формулы I могут присутствовать дополнительные хиральные центры и другие изомерные формы,и данное изобретение включает все возможные стереоизомеры и геометрические формы. Соединения данного изобретения применимы для лечения микробных инфекций у человека и других теплокровных животных, путем как парентерального, так и орального введения. Фармацевтические композиции данного изобретения могут быть изготовлены путем комбинирования соединений данного изобретения с твердым или жидким фармацевтически приемлемым носителем и, возможно, с фармацевтически приемлемыми вспомогательными веществами и наполнителями с применением стандартных и общепринятых методик. Композициями в твердой форме являются порошки,таблетки, диспергируемые гранулы, капсулы, крахмальные капсулы и суппозитории. Твердым носителем может быть по меньшей мере одно вещество, которое также может выполнять функцию разбавителя,отдушки, солюбилизатора, лубриканта, суспендирующего агента, связующего, дезинтегрирующего агента, и энкапсулирующего агента. Инертными твердыми носителями являются карбонат магния, стеарат магния, тальк, сахар, лактоза, пектин, декстрин, крахмал, желатина, целлюлозные материалы, низкоплавкий воск, масло какао и подобные. Композициями в жидкой форме являются растворы, суспензии и эмульсии. Например, могут быть приготовлены растворы соединений данного изобретения, растворенные в воде и в системах вода-пропиленгликоль, возможно содержащие подходящие общепринятые красители, отдушки, стабилизаторы и загустители. Предпочтительно фармацевтическую композицию готовят с использованием общепринятой методики в единичной дозированной форме, содержащей эффективные или целесообразные количества активного компонента, то есть соединения согласно данному изобретению. Количество активного компонента, который является соединением согласно данному изобретению,в фармацевтической композиции и его единичной дозированной форме может варьироваться или приспосабливаться в зависимости от конкретного применения, силы действия конкретного соединения и желаемой концентрации. Обычно количество активного компонента находится в интервале от 0,5 до 90 мас.% композиции. При терапевтическом применении для лечения или борьбы с бактериальными инфекциями у теплокровных животных соединения или их фармацевтические композиции могут вводиться перорально, парентерально и/или местно в дозах для получения и поддержания концентрации, то есть противобактериально эффективного количества или уровня активного компонента в крови у животного, подвергающегося лечению. Обычно такое противобактериально эффективное количество дозы активного компонента находится в интервале от примерно 0,1 до примерно 100, более предпочтительно от примерно 3,0 до примерно 50 мг/кг массы тела/в день. Следует понимать, что дозы могут сильно зависеть от потребностей пациента, тяжести излечиваемой бактериальной инфекции и конкретного используемого соединения. Кроме того, следует понимать, что начальная вводимая доза может быть увеличена за пределы вышеуказанного уровня для быстрого достижения желаемого уровня в крови или начальная доза может быть меньше оптимальной и ежедневная доза может быть прогрессивно увеличена во время курса лечения в зависимости от конкретной ситуации. При желании дневная доза может также быть разбита на множество доз для введения, например, от 2 до 4 раз в день. Соединения согласно данному изобретению могут быть введены парентерально, например, путем внутривенного вливания или другого парентерального пути введения. Фармацевтические композиции для парентерального введения обычно содержат фармацевтически приемлемое количество растворимой соли (кислотно-аддитивной соли или соли основания), растворенной в фармацевтически приемлемом жидком носителе, таком как, например, вода для инъекций и буферный раствор, для получения подходящего буферного изотонического раствора, например, имеющего рН примерно от 3,5 до 6. Подходящими буферными агентами являются, например, тринатрийортофосфат, бикарбонат натрия, цитрат натрия,N-метилглюкамин, L(+) -лизин и L(+)-аргинин, представляющих собой только несколько буферных агентов. Соединения данного изобретения обычно растворяют в носителе в количестве, достаточном для обеспечения фармацевтически приемлемой для инъекций концентрации в интервале от примерно 1 до примерно 400 мг/мл раствора. Полученную жидкую фармацевтическую композицию следует вводить таким образом, чтобы получить вышеуказанное противобактериально эффективное количество дозы. Соединения согласно данному изобретению преимущественно вводят перорально в виде твердых или жидких дозированных форм. При местном лечении эффективное количество соединения формулы I смешивают с фармацевтически приемлемым наполнителем в виде геля или крема, которые могут быть нанесены на кожу пациентов в области лечения. Приготовление указанных кремов и гелей хорошо известно из уровня техники и может предусматривать включение средств, улучшающих пенетрацию. Оксазолидиноновые противобактериальные средства данного изобретения обладают применимой активностью против различных организмов. Активность in vitro соединений данного изобретения может быть оценена стандартными тестовыми процедурами, такими как определение минимальной ингибирующей концентрации (MIC) путем разбавления агаром, как описано в "Approved Standard Methods forNational Committee for Clinical Laboratory Standards, Villanova, Pennsylvania, США. Соединения формулы I могут быть получены способами, известными специалистам в данной области. Например, соединения формулы I могут быть синтезированы по схеме I, как показано ниже. Схема I Согласно схеме I, функционализированный нитрооксиндол А (X = О) алкилируют алкилгалогенидом или сложным эфиром сульфонатом в присутствии основания, такого как 1,8 диазобицикло[5.4.0]ундец-7-ен (DBU) или карбоната калия с образованием оксиндола В. Путем восстановления нитрогруппы В, используя, например, каталитическое гидрирование над палладиевым или платиновым катализатором, получают аминооксиндол С. Превращение аминооксиндола С в соединения данного изобретения может быть достигнуто известными способами или как описано в схемах ниже. Например, как описано в схеме II, аминооксиндол С может быть обработан алкилхлорформиатом в присутствии соответствующего основания, такого как бикарбонат натрия, с образованием промежуточного карбамата D. Последующая обработка 2(S)-ацетиламино-1-(хлорметил)этилацетатом (Tet. Lett. 1996, 37(44), 7937-7940) в присутствии основания, такого как трет-бутилат лития, в растворителе, таком как диметилфорамид, при температуре от примерно 0 до 25 С дает 5-(ацетиламинометил)оксазолидиноноксиндол Е (W = О, R1 = метил). Более общий синтез указанных 5-(ациламинометил)оксазолидинон-оксиндолов, исходя из карбамата D, показан также на схеме II. Обработка литиевым основанием, таким как н.-бутиллитий или гексаметилдисилазид лития, в растворителе, таком как тетрагидрофуран, при температуре обычно в интервале от-78 до -40 С дает литиированное производное, которое сразу обрабатывают (R)-глицидилбутиратом и нагревают до комнатной температуры, получая 5-(гидроксиметил)оксазолидинон-оксиндол F. Гидроксигруппу затем превращают в подходящую уходящую группу (Lg), такую как алкил- или арилсульфонат,используя реагенты алкил- или арилсульфонилхлорид, в присутствии связующего кислоту амина, такого как триэтиламин, в растворителе, таком как дихлорметан или тетрагидрофуран. Уходящую группу затем вытесняют солью азида (например, азидом натрия) в растворителе, таком как ацетон или диметилсульфоксид, при температуре обычно в интервале примерно от 25 до 75 С и полученный алкилазид затем восстанавливают, получая промежуточный 5-(аминометил)оксазолидинон Н. Последний может быть подвергнут, например, каталитическому гидрированию или путем реакции азида с трифенилфосфином в растворителе, таком как тетрагидрофуран, превращен в иминофосфоран, который затем гидролизуют до амина при температурах примерно от 20 до 60 С при прибавлении воды. Амин затем ацилируют (W = О) или тиоацилируют (W = S), используя способы, известные специалисту в данной области, получая целевую структуру Е. На схеме III ниже приведены общие способы получения соединений формулы I, в которых А = оксазолидинону, n = 1 и Z = NHhet1, Ohet1 или Shet1. Исходными веществами для указанной процедуры являются гидроксиметилпроизводные F (описанные в предыдущей схеме), а превращение указанных промежуточных продуктов в конечные соединения I известны в технике (см. Gravestock, M.B., International Publications WO 99/64417 и WO 00/21960. Сначала гидроксигруппу превращают в вытесняемую группу (Lg), такую как алкил- или арисульфонат, бромид или иодид. Указанное активирование может быть произведено согласно способам, известным специалистам в данной области и как описано на схемеII. Затем активированное гидроксипроизводное вводят в реакцию с соединением формулы HN(Pg)het1,HOhet1, HShet1 или с соответствующими солями алкоголятов металлов M-N(Pg)het1, M-Ohet1, M-Shet1,где М представляет собой щелочной металл или другой металл, известный как промотор Оалкилирования (например, серебро) и "Pg" представляет собой подходящую защитную группу. В виде альтернативы исходное вещество может быть введено в реакцию с соединениями формулы HN(Pg)het1,HOhet1, HShet1 при активировании типа Мицунобу в присутствии, например, свободного или связанного с полимером трифенилфосфина и диэтил- (или диизопропил)азодикарбоксилата. В качестве конечной стадии производят удаление защитной группы, используя известные способы. Схема III Схема IV ниже описывает избранные способы получения соединений формулы I, в которых А = оксазолидинону, n = 1 и Z = het2. Получение указанных аналогов из активированных гидроксиметилоксазолидинонов G известно в технике (см. Gravestock, M.B., Betts, M.J., и Griffin, D.A., International Publications WO 01/81350). Структура G может просто реагировать с het2-H в форме свободного основания или в форме аниона het2-, образованного из свободного основания, и образовывать целевую структуру J. Альтернативный способ для 1,2,3-триазолов (например, структуры L) предусматривает превращение структуры G в азид К (как описано в схеме II) с последующим циклоприсоединением норборнадиена. См. также International Publications WO 99/64417 и WO 00/21960, WO 01/81350 для дополнительных путей синтеза структуры J. Схема V иллюстрирует общий способ получения соединений формулы I, где А = оксазолидинону, n = 1 и Z =C(=O)NHR1. Анилины С (см. схему I) могут быть превращены в алкиловые эфиры оксазолидинон-5 карбоновой кислоты М двухстадийным способом. Сначала обработка алкил-(2R)-эпоксипропаноатом (или глицидатом) и трифлатом лития в подходящем растворителе, таком как ацетонитрил, при подходящей температуре, обычно в интервале от 20 до 110 С в зависимости от растворителя, дает промежуточный аминоспирт в результате присоединения азота анилина к концевому углероду эпоксидного цикла. Последующая обработка 1,1'-карбонилдиимидазолом в растворителе, таком как ацетонитрил или ТГФ, при соответствующей температуре, обычно в интервале от 20 до 60 С, или фосгеном в растворителе, таком как толуол или метиленхлорид или их смеси, в присутствии основания, такого как триэтиламин, при соответствующей температуре, обычно в интервале от -10 до 25 С, приводит затем к получению промежуточного оксазолидинона М (R8 = C1-4 алкил). Указанная структура может быть превращена в целевую структуру N, используя способы, хорошо известные специалисту в данной области, например, взаимодействием с аминами или производными аминов Подходящие промежуточные продукты, применимые при получении соединений формулы I, и дополнительные способы синтеза для использования в получении соединений формулы I могут быть найдены, например, в следующих публикациях, каждая из которых приведена здесь в качестве ссылки. Патент США 5164510; заявка РСТ и публикации WO 95/07271, WO 00/21960, WO 99/40094, WO 99/64417, WO 99/64416, WO 00/21960 и WO 01/81350; Европейский патентЕР 738726 и патент ГерманииDE 19802239. Примерами соединений изобретения являются, но этим не ограничиваются,(5R)-(-)-3-(3,3-Дифтор-2,3-дигидро-1-метил-2-оксо-1H-индол-5-ил)-N-метил-2-оксо-5-оксазолидинкарбоксамид;N-(5S)-(-)-3-(3,3-дифтор-2,3-дигидро-1-этил-2-оксо-1H-индол-5-ил)-2-оксо-5-оксазолидинил]метил]ацетамид. В некоторых вариантах выполнения противобактериальные соединения являются пролекарствами соединений формулы I. Выражение "пролекарство" означает производное известного непосредственно действующего лекарственного средства, которое превращается в активное лекарственное средство в результате ферментативного или химического процесса. Пролекарства соединений формулы I получают модифицированием функциональных групп, присутствующих в соединении, таким образом, чтобы модификации расщеплялись либо при обычной манипуляции, или in vivo до исходного соединения. Проле-7 009725 карствами являются, но не этим ограничиваются, соединения строения (I), в которых гидроксильная,амино- или сульфгидрильная группы связаны с любой группой таким образом, чтобы при введении животному оно расщеплялось с образованием свободного гидроксила, амино- или сульфгидрильной группы, соответственно. Представительными примерами пролекарств являются, но не этим ограничиваются,ацетатные, формиатные и бензоатные производные спиртовых или аминных функциональных групп. См.Prodrugs: Bioreversible-Derivaties for Various Functional Groups and Chemical Entities," in Designes of Prodrugs (H. Bundgaard, изд.), Eisevier, N.Y. (1985). Примеры Считают, что без дополнительных исследований специалист в данной области, используя предшествующие описания, может в полной степени осуществить данное изобретение. Следующие подробные примеры описывают, каким образом получают различные соединения и/или осуществляют различные способы изобретения, и являются только иллюстративными и никаким образом не ограничивают изобретение. Специалист в данной области сможет распознать соответствующие варианты как в отношении реагентов, так и в отношении условий реакций и оборудования. Пример 1. (5R)-(-)-3-(3,3-дифтор-2,3-дигидро-1-метил-2-оксо-1H-индол-5-ил)-N-метил-2-оксо-5 оксазолидинкарбоксамид Раствор 3,3-дифтор-5-нитро-1,3-дигидро-2H-индол-2-она 2 (Tetrahedron, 1999, 55, 1881-92, 7,05 г,32,9 ммоль) в безводном N,N-диметилформамиде (66 мл) в атмосфере N2 по каплям обрабатывают 1,8 диазабицикло[5.4.0]ундец-2-еном (6,40 мл, 42,8 ммоль) и затем иодометаном (2,46 мл, 39,5 ммоль). Реагирующую слабо экзотермически реакционную смесь перемешивают при обычной температуре в течение 18 ч, разбавляют водой со льдом (100 мл) и фильтруют, получая указанное в заголовке соединение 3,т.пл. 131,5-134,5 С. Стадия 2. Получение 5-амино-3,3-дифтор-1-метил-1,3-дигидро-2H-индол-2-онаParr под давлением водорода 20 фунт/кв. дюйм в течение 1,5 ч. Катализатор затем удаляют фильтрованием через подушку целита и фильтрат концентрируют при пониженном давлении, получая указанное в заголовке соединение 4, MS (ESI+) для C9H8N2OF2 m/z 199 (М+Н)+, которое может быть использовано без дополнительной очистки. Очисткой хроматографией на силикагеле (элюент 40%-ная смесьEtOAc/гептан) получают образец для анализа, т.пл. 186-189 С. Стадия 3. Получение бутил (5R)-3-(3,3-дифтор-2,3-дигидро-1-метил-2-оксо-1H-индол-5-ил)-2-оксо 5-оксазолидинкарбоксилата Смесь 5-амино-3,3-дифтор-1-метил-1,3-дигидро-2H-индол-2-она 4 (стадия 2, 4,50 г, 22,7 ммоль) и бутил(2R)-глицидата (3,60 г, 25,0 ммоль) в сухом ацетонитриле (11,4 мл) в атмосфере N2 нагревают до 70 С при энергичном перемешивании и сразу обрабатывают трифторметансульфонатом лития (3,89 г,-8 009725 25,0 ммоль). Полученную смесь нагревают до слабого кипения, кипятят с обратным холодильником в течение 1,5 ч и затем концентрируют при пониженном давлении. Смесь продуктов выливают в 10%-ную смесь MeOH/CH2Cl2 (150 мл), промывают водой (100 мл) и рассолом (50 мл), сушат над безводным сульфатом натрия и концентрируют при пониженном давлении, получая сырой промежуточный аминоспирт[MS (ESI+) для C16H20N2O4F2 m/z 343 (М+Н)+], который используют без дополнительной очистки. Раствор указанного промежуточного соединения в сухом ацетонитриле (113 мл) в атмосфере N2 обрабатывают 1,1'-карбонилдиимидазолом (5,52 г, 34,1 ммоль) и реакционную смесь перемешивают при обычной температуре в течение 24 ч. Растворитель удаляют при пониженном давлении и остаток вносят в CH2Cl2(125 мл), промывают водной хлористоводородной кислотой (0,22 М, 350 мл) и рассолом (50 мл), сушат над безводным сульфатом натрия, концентрируют при пониженном давлении и хроматографируют на двух патронах с силикагелем массой 90 г Biotage Flash 40M, элюируя смесью EtOAc/CH2Cl2 (3/97). Объединением и концентрированием фракций с Ff=0,40 путем ТСХ (смесь EtOAc/гексан, 50/50) получают указанное в заголовке соединение 5 MS (ESI+) для C17H18N2O5F2 m/z 369 (М+Н)+; 1 Н ЯМР (400 МГц, ДМСО-d6)7,96(м, 1 Н), 7,76 (дд, 1 Н), 7,28 (д, 1 Н), 5,34 (дд, 1 Н), 4,41 (т, 1 Н),4,18 (м, 3 Н), 3,19 (с, 3 Н), 1,62 (квинт, 2 Н), 1,35 (секст, 2 Н), 0,90 (т, 3 Н). Стадия 4. Получение (5R)-(-)-3-(3,3-дифтор-2,3-дигидро-1-метил-2-оксо-1H-индол-5-ил)-N-метил-2 оксо-5-оксаэолидинкарбоксамида(5R)-3-(3,3-дифтор-2,3-дигидро-1-метил-2-оксо-1H-индол-5-ил)-2-оксо-5-оксазолидинкарбоксилат 5 (стадия 3, 5,55 г, 15,1 ммоль) обрабатывают 2 М MeNH2 в МеОН (151 мл) при энергичном перемешивании. Полученную суспензию перемешивают при обычной температуре в течение 1 ч и осажденный продукт отделяют фильтрованием, получая указанное в заголовке соединение 1, т.пл. 242,5245 С; MS (ESI+) для C14H13N3O4F2m/z 326 (М+Н)+; [n]25D -39 (с 0,95, ДМСО). Пример 2.(5R)-3-(3,3-дифтор-2,3-дигидро-1-метил-2-оксо-1H-индол-5-ил)-2-оксо-5-оксазолидинкарбоксилат 5 (пример 1, стадия 4, 340 мг, 0,923 ммоль) при энергичном перемешивании обрабатывают 7 н.NH3 в МеОН (9,2 мл). Полученную суспензию перемешивают при обычной температуре в течение 1 ч,разбавляют простым диэтиловым эфиром (5 мл) и осажденный продукт выделяют фильтрованием, получая указанное в заголовке соединение 6, т.пл. 274-277 С (разл.); MS (ESI-) для C13H11N3O4F2 m/z 310 (МН)-; [n]25D -22 (с 0,95, ДМСО). Пример 3. Следуя примеру 1, стадии 1, и производя несущественные изменения, только заменяя иодметан на иодэтан, получают указанное в заголовке соединение 8, т.пл. 111-112 С. Смесь 5-амино-3,3-дифтор-1-этил-1,3-дигидро-2H-индол-2-она (стадия 2, 2,715 мг, 3,37 ммоль) и бутил-(2R)-глицидата (729 мг, 5,05 ммоль) в сухом ацетонитриле (13,5 мл) в атмосфере N2 обрабатывают трифторметансульфонатом лития (788 мг, 5,05 ммоль). Полученную смесь нагревают до 75 С, перемешивают при указанной температуре в течение 20 ч и затем концентрируют при пониженном давлении. Смесь продуктов помещают в 10%-ную смесь МеОН/CH2Cl2 (40 мл), промывают водой (20 мл) и рассолом (20 мл), сушат над безводным сульфатом натрия и концентрируют при пониженном давлении, получая сырой промежуточный аминоспирт [MS (ESI+) для C17H22N2O4F2 m/z 357 (М+Н)+], который используют без дополнительной очистки. Раствор указанного промежуточного соединения в сухом ацетонитриле (34 мл) в атмосфере N2 обрабатывают 1,1'-карбонилдиимидазолом (820 мг, 5,05 ммоль) и реакционную смесь перемешивают при обычной температуре в течение 4 дней. Растворитель удаляют при пониженном давлении, и остаток помещают в CH2Cl2 (50 мл), промывают водной хлористо-водородной кислотой(0,1 М, 225 мл) и рассолом (25 мл), сушат над безводным сульфатом натрия, концентрируют при пониженном давлении и хроматографируют на патроне с силикагелем массой 90 г Biotage Flash 40M, элюируя смесью EtOAc/CH2Cl2 (5/95). Объединением и концентрированием фракций с Rf=0,48 путем ТСХ (смесь(11,5 мл) и смесь перемешивают при обычной температуре в течение 1 ч. Растворитель удаляют при пониженном давлении и смесь продуктов хроматографируют на патроне с силикагелем массой 40 г BiotageFlash 40S, элюируя смесью MeOH/CH2Cl2 (2/98). Объединением и концентрированием фракций с Rf=0,35 путем ТСХ (смесь МеОН/CHCl3, 10/90),растиранием в порошок и фильтрованием из смеси CH2Cl2/Et2O выделяют указанное в заголовке соединение 7, т.пл. 201-203 С; MS (ESI + ) для C14H13N3O4F2 m/z 326 (М+Н)+; [n]25D -20 (с 0,94, ДМСО). Пример 4. (5R)-(-)-3-(3,3-дифтор-2,3-дигидро-1-этил-2-оксо-1H-индол-5-ил)-N-метил-2-оксо-5 оксазолидинкарбоксамид Следуя примеру 1, стадии 4, и производя несущественные изменения, только заменяя бутил (5R)-3(3,3-дифтор-2,3-дигидро-1-метил-2-оксо-1H-индол-5-ил)-2-оксо-5-оксазолидинкарбоксилат 5 на бутил Смесь 5-амино-3,3-дифтор-1-метил-1,3-дигидро-2H-индол-2-она 4 (пример 1, стадия 2, 300 мг, 1,51 ммоль) в смеси ТГФ/Н 2 О (2:1, 7,5 мл) обрабатывают бикарбонатом натрия (254 мг, 3,02 ммоль) и далее бензиловым эфиром хлормуравьиной кислоты (22 6 мкл, 1,59 ммоль); двухфазную смесь перемешивают при обычной температуре в течение 18 ч. Реакционную смесь разбавляют Н 2 О (10 мл) и экстрагируютEtOAc (20 мл); органическую фазу промывают Н 2 О (10 мл) и рассолом (10 мл), сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток перекристаллизовывают из смеси EtOAc/гексан, получая указанное в заголовке соединение 13, т.пл. 174-175,5 С; MS (ESI+) для Смесь бензил 3,3-дифтор-1-метил-2-оксо-2,3-дигидро-1H-индол-5-илкарбамата 13 (стадия 1, 300 мг,0,903 ммоль), (1S)-2-(ацетамино)-1-(хлорметил)этилацетата (350 мг, 1,81 ммоль) и МеОН (73 мкл, 1,81 ммоль) в сухом ДМФА (0,6 мл) в атмосфере N2 охлаждают на ледяной бане и по каплям обрабатываютLiOtBu (1M в гексане, 2,71 мл, 2,71 ммоль) в течение 5 мин. Полученную двухфазную смесь перемешивают при 0 С в течение 30 мин и при обычной температуре в течение 21 ч, затем гасят ледяной уксусной кислотой (104 мкл, 2 эквив.), разбавляют МеОН (5 мл) и слои разделяют. Слой смеси МеОН/ДМФА затем разбавляют Н 2 О (15 мл) и экстрагируют EtOAc (325 мл) и объединенный EtOAc-слой промывают Н 2 О (220 мл) и рассолом (20 мл), сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток хроматографируют с силикагелем массой 40 г Flash 40S, элюируя смесью Следуя примеру 5, стадии 2, и производя несущественные изменения, только заменяя бензил 3,3 дифтор-1-метил-2-оксо-2,3-дигидро-1H-индол-5-илкарбамат 13 на бензил 3,3-дифтор-1-этил-2-оксо-2,3 дигидро-1H-индол-5-илкарбамат 15 (стадия 1), и перекристаллизовывая продукт из смеси CH2Cl2/Et2O с последующим хроматографированием, получают указанное в заголовке соединение 14, т.пл. 139-141 С;MS (ESI + ) для C16H17N3O4F2 m/z 354 (М+Н)+; [n]25D -22 (с 0,98, ДМСО). Противобактериальная активность Способ определения минимальной ингибирующей активности MICMIC in vitro испытуемых соединений определяли стандартным методом разбавления в агаровом геле. Готовили раствор исходного лекарственного вещества каждого аналога в предпочтительном растворителе, обычно в смеси ДМСО:Н 2 О (1:3). Серийные 2-кратные разбавления каждого образца производили, используя 1,0 мл аликвоты стерильной дистиллированной воды. К каждой 1,0 мл аликвоте лекарственного вещества прибавляли 9 мл жидкой агаровой среды Mueller Hinton. Загруженный лекарственным веществом агар перемешивали, выливали в 15100 мм чашку Петри и оставляли для отверждения и высыхания перед инокуляцией. Пробирки каждого из испытуемых организмов выдерживали замороженными в паровой фазе морозильника с жидким азотом. Испытуемые культуры оставляли на ночь при 35 С на среде соответствующего организма. Колонии собирали стерильным тампоном и клеточную суспензию готовили в бульоне соевой триптиказы (TSB) до мутности 0,5 стандарта McFarland. Разбавление каждой суспензии 1:20 производили в TSB. Чашки Петри, содержащие загруженный лекарственным веществом агар, инокулировали 0,001 мл каплей клеточной суспензии, используя репликатор Steers, давая приблизительно от 104 до 105 клеток на пятно. Чашки Петри инкубировали в течение ночи при 35 С. В процессе инкубации были зарегистрированы и отмечены следующие минимальные ингибирующие концентрации (MIC мкг/мл), наименьшие концентрации лекарственного вещества, которые ингибируют видимый рост организма. Данные приведены в таблице. или их фармацевтически приемлемые соли, где А представляет собой фрагмент iR2, R3 и R4 независимо друг от друга представляют собой Н или F;R5 и R6 независимо друг от друга представляют собой С 1-4 алкил или галоген;N-(5S)-(-)-3-(3,3-дифтор-2,3-дигидро-1-этил-2-оксо-1H-индол-5-ил)-2-оксо-5-оксазолидинил]метил]ацетамид. 6. Применение соединения по п.1 для получения лекарственного препарата, обладающего противомикробным действием. 7. Применение по п.6, в котором лекарственный препарат приготовлен для орального, парентерального, трансдермального или местного введения. 8. Применение по п.6, в котором лекарственный препарат содержит от примерно 0,1 до примерно 1000 мг соединения по п.1. 9. Применение по п.6, в котором лекарственный препарат содержит от примерно 0,1 до примерно 500 мг соединения по п.1. 10. Фармацевтическая композиция, содержащая соединение по п.1 и фармацевтически приемлемый носитель. 11. Соединение формулы II где R8 представляет собой С 1-4 алкил или бензил. 12. Соединение по п.11, где R7 представляет собой С 1-4 алкил или замещенный С 1-4 алкил. 13. Соединение по п.11, выбранное из группы:
МПК / Метки
МПК: C07D 413/04, A61K 31/42, C07D 413/14, C07D 407/04, A61P 31/04
Метки: промежуточные, противобактериальные, соединения, композиции, содержащие, получения, фармацевтические, индолоноксазолидиноны
Код ссылки
<a href="https://eas.patents.su/15-9725-protivobakterialnye-indolonoksazolidinony-promezhutochnye-soedineniya-dlya-ih-polucheniya-i-soderzhashhie-ih-farmacevticheskie-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Противобактериальные индолоноксазолидиноны, промежуточные соединения для их получения и содержащие их фармацевтические композиции</a>
Предыдущий патент: Ацилированные аминопропандиолы и аналоги и их применения в терапии
Следующий патент: Способ извлечения золота
Случайный патент: Баллистически стойкий лист и баллистически стойкое изделие












